Изобретение относится к медицине, а именно к реконструктивной хирургии врожденных пороков сердца, и может быть использовано при изготовлении биопротезов для замещения выводного отдела правого желудочка, клапана и ствола легочной артерии у детей.
Кондуиты на основе яремной вены крупного рогатого скота (ЯВ КРС), а именно ее сегменты, содержащие трехстворчатый клапан, консервированные полиглицидиловым эфиром глицерола (Denacol-313), впервые предложил в 1992 г. Yukio Ichikawa (Ichikawa Y. A New RV-PA Conduit with a Natural Valve Made of Bovine Jugular Vein. // ASAIO Journal. - 1992. - v. 38. - p. M266-M270.). В дальнейшем он с соавторами обосновал в эксперименте целесообразность ее применения для замещения выводного отдела правого желудочка, клапана и ствола легочной артерии (Ichikawa Y., Noishiki Y., Soma Т., Ishii M., Yamamoto К., Takahashi К., Mo M., Kosuge Т., Kondo J., Matsumoto A. A new antithrombogenic RV-PA valved conduit. // ASAIO Journal. - 1994. - v. 40(3). - p. M714-M718; Ichikawa Y., Noishiki Y., Kosuge Т., Yamamoto K., Kondo J., Matsumoto A. Use of a bovine jugular vein graft with natural valve for right ventricular outflow tract reconstruction: a one-year animal study. // J. Thorac. Cardiovasc. Surg. - 1997. - v. 114. - p. 224-233.).
Y. Ichikawa с соавторами предложили использовать Denacol-313 в качестве консерванта для биоматериала, так как основной компонент данного препарата - полиглицидиловый эфир глицерола, по сравнению с альдегидными консервантами, придает биоткани улучшенные упругоэластические свойства и низкую кальцийсвязывающую активность. Кроме того, с целью повышения тромборезистентности авторы предложили иммобилизовать на биоматериале гепарин - либо ковалентно, за счет прямого связывания эпоксигруппами полиглицидилового эфира глицерола, оставшимися свободными после поперечной сшивки, либо через образование комплексов с протамин-сульфатом (с последующим высвобождением гепарина в кровоток).
Недостатками способа, предложенного Y.Ichikawa с соавторами, являются:
1) Использование технического (используемого в производстве клеев, бумаги и резины) эпоксидного препарата Denacol-313, содержащего в больших количествах, помимо полиглицидилового эфира глицерола, три примеси, две из которых являются хлорсодержащими и, следовательно, потенциально токсичными;
2) Дополнительная антитромботическая модификация гепарином нецелесообразна для данного вида биопротезов, т.к. тромботические осложнения в интракардиальной позиции клапана легочной артерии практически не встречаются. В то же время высокая частота кальцификации биоматериалов у детей, для которых предназначено данное медицинское изделие, является главным лимитирующим фактором применения биопротезов в данной возрастной группе. Поэтому целесообразным было бы включение в технологию антикальциевой обработки.
С 2001 г. компания Medtronic Inc. выпускает беспатентный коммерческий продукт - кондуит Contegra® - изготовляемый из клапансодержащих сегментов КРС, консервированных глутаровым альдегидом и хранящихся до использования в смеси 1% глутарового альдегида и 20% изопропилового спирта. Кондуит Contegra® представляет собой трубчатый сегмент ЯВ КРС длиной до 15 см, содержащий внутри, на уровне приблизительно середины длины трубчатой части, трехстворчатый естественный клапан.
К настоящему времени экспериментальными и клиническими работами было доказано, что ЯВ КРС является адекватным материалом для кондуита «правый желудочек - легочная артерия» в силу ряда причин:
- вариабельность диаметра ЯВ КРС - от 12 до 24 мм - анатомически позволяет использовать ее у детей в широком возрастном диапазоне - от периода новорожденности (12 мм) до 18 лет (24 мм);
- толщина стенки ЯВ КРС сопоставима по толщине со стенкой легочной артерии у детей;
- венозный клапан предназначен для функционирования в условиях правых отделов и компетентен при низких давлениях крови; при этом створки его очень тонкие и эластичные, что не создает градиента на клапане (Carrel Т. Bovine valved jugular vein (Contegra™) to reconstruct the right ventricular outflow tract. // Expert Rev. Medical Devices. - 2004. - v. 1(1). - p. 11-19).
Недостатками кондуита Contegra®, широко используемого в клинической практике, являются:
1) большое количество отдаленных осложнений, обусловленных стенозом дистального анастомоза (40-60% в структуре дисфункций);
2) высокая частота кальцификации стенки (трубчатой части) кондуита (17-25% удаленных кондуитов кальцинированы) (Yuan S. - M. The Contegra Valved Bovine Conduit: A Biomaterial for the Surgical Treatment of Congenital Heart Defects. // Arq. Bras. Cardiol. - 2012. - v. 99(6). - p. l159-1165.; Urso S., Rega F., Meuris В., Gewillig M., Eyskens В., Daenen W., Heying R., Meyns B. The Contegra conduit in the right ventricular outflow tract is an independent risk factor for graft replacement. // Eur. J. Cardio-thorac. Surg. - 2011. - v. 40. - p. 603- 609.).
Эти недостатки обусловлены использованием глутарового альдегида в качестве основного консерванта биоматериала. При подготовке биопротеза к имплантации глутаровый альдегид плохо отмывается из ткани протеза, что ведет к цитотоксическим эффектам на границе «ткань реципиента / биопротез», сопровождающимся образованием гиперпластической неоинтимы с выраженной клеточной инфильтрацией. Кроме того, хорошо известно, что химические связи, образуемые глутаровым альдегидом в биоматериале, являются центрами нуклеации фосфатов кальция из плазмы крови, с последующим ростом кристаллов гидроксиапатита, то есть служат причиной кальцификации биопротеза.
Из существующего уровня техники известен способ изготовления клапансодержащего кондуита из ЯВ КРС (CN №104095692 (А), МПК A61F 2/06), включающий в себя следующие стадии:
1. Отбор животных-доноров: в возрасте 2-5 лет, здоровых, не контактировавших с больными животными;
2. Выделение и иссечение с помощью ножа яремной вены по всей длине в течение 1 минуты;
3. Повторные промывания водой до полного обесцвечивания промывочной жидкости, затем временное (не более 3 ч) хранение в солевом растворе при температуре 4-10°С;
4. Первичная обработка - срезание жировой и соединительной ткани с наружной поверхности вены, тщательно избегая травмы стенки сосуда;
5. Промывание в сбалансированном солевом растворе при бережном перемешивании в течение 6 ч со сменой раствора через каждый час;
6. Консервация 0,6% глутаровым альдегидом в течение 2 суток при температуре 4-12°С, затем - 0,3% амиловым диальдегидом в течение недели;
7. Формирование наружной оболочки из полиэфирной ткани.
Недостатками способа по патенту CN №104095692 (А) являются вышеперечисленные недостатки, относящиеся к кондуиту Contegra®, так как в качестве основного консерванта использованы глутаровый и амиловый диальдегиды. Кроме того, длительное (3 ч) промывание в воде ведет к отеку тканей, а общий длительный срок отмывки до начала консервации - 9 ч (3 ч в воде и 6 ч в солевом растворе) - может явиться причиной начала аутолитических процессов с нарушением структурной целостности биоматериала в доконсервационном периоде.
Недостатком способов изготовления кондуита Contegra® и кондуита по патенту CN №104095692 (А) является также отсутствие этапа контроля состояния клапанного аппарата как на этапе отбора сырья, так и на этапе выходного контроля изделия. Учитывая небольшой диаметр и значительную длину проксимальной (доклапанной) и дистальной (надклапанной) трубчатых частей - 6-8 см, адекватная оценка клапана невооруженным глазом невозможна. Оценка функции клапана с использованием гидродинамического стента для данного вида биопротезов является методом разрушающего контроля и, соответственно, также невыполнима.
Кроме того, недостатком известных способов (предложенные Y. Ichikawa, Contegra®, патент CN №104095692) является отсутствие антикальциевой обработки биоматериала в технологии изготовления кондуита. Известно, что ткани, содержащие в большом количестве эластин, к каковым относится стенка ЯВ КРС, накапливают кальций в значительно большем количестве нежели коллагенсодержащие - перикард и створки клапанов. При этом если кальцификация коллагена может быть в значительной мере угнетена за счет замены альдегидных сшивающих агентов на эпоксидные, то кальцификация эластина не зависит от выбора сшивающего агента. Риск кальцификации ксеновенозного кондуита в послеоперационном периоде тем выше, что возрастной контингент, для которого он предназначен (дети, в т.ч. первых лет жизни), наиболее подвержен данному осложнению. Соответственно, для профилактики кальцификации биоматериала необходима дополнительная антикальциевая обработка.
Известен способ антикальциевой обработки биоматериалов, предварительно консервированных эпоксидными консервантами, путем помещения биопротезов в 0,05-1,0%-ный раствор дифосфоната, содержащего в структуре аминогруппу, на 3-5 ч при температуре 18-25°С с последующей отмывкой и помещением для хранения в стерилизующий раствор (RU 2374843, МПК A01N 1/02).
Недостатком данного способа является ряд моментов, затрудняющих ковалентное взаимодействие аминогруппы дифосфоната (бисфосфоната) и остаточной свободной эпоксигруппой, не связавшейся с биоматериалом в процессе консервации (именно на таком механизме основана технология по соответствующему патенту):
1) Реакции ковалентного связывания быстрее протекают при повышении температуры. При обработке биоматериала очень высокие температуры невозможны, но 37-40°С вполне допустимы. В связи с этим температура 18-25°С, заявленная в патенте №2374843, не является оптимальной.
2) Увеличение концентрации иммобилизуемого вещества при остальных неизменных параметрах также увеличивает скорость реакции, в связи с чем 0,05-1,0% концентрация раствора дифосфоната по патенту №2374843 не является оптимальной.
Техническим результатом изобретения является создание ксеновенозного кондуита для замещения выводного отдела правого желудочка, клапана и ствола легочной артерии у детей, обладающего высокой надежностью функционирования клапанного аппарата биопротеза, а также сниженным риском дисфункций, обусловленных цитотоксическими реакциями и кальцификацией.
Данный результат достигается за счет усовершенствования методики изготовления кондуита из ЯВ КРС, включающей многоступенчатый контроль качества биоматериала, а также его многоступенчатую химическую обработку. Для входного контроля сырья используют эндоскопическое исследование морфологических особенностей стенки ЯВ КРС в под- и надклапанной части, а также качества створчатого аппарата. На этом этапе выбраковываются сегменты ЯВ КРС, имеющие дефекты поверхности стенки ксеновены, двух- или четырехстворчатый клапан, неравномерную площадь, недостаточную коаптацию, неравномерную по толщине структуру створок или иные внутренние дефекты, которые могут быть выявлены при эндоскопии. При этом проводят гидравлическую функциональную пробу: трубчатую часть пережимают любым «мягким» инструментом в самом проксимальном отделе, сегмент заполняют стерильным физиологическим раствором, после чего зажим снимают. В этот момент клапан должен закрыться и удерживать жидкость, заполняющую дистальный отдел. Такой клапан считается компетентным. В противном случае (при некомпетентности клапана) сегмент также подлежит выбраковке. Сегменты ЯВ КРС, прошедшие этап контроля, подлежат окончательному препарированию с последующей консервацией 5% буферным раствором эпоксидного сшивающего агента в течение 14 суток, с заменой раствора на свежий после 24 часов от момента консервации. Длительность периода от момента забора ЯВ КРС до начала консервации не должна превышать 6 ч. Через 14 суток ЯВ КРС подвергают гистологическому контролю, для чего отрезают по 0,5-1 см стенки вены с дистального и проксимального краев, выполняют стандартную проводку и окраску с последующей оценкой препаратов методом световой микроскопии. Критериями отбраковки ксеновенозных кондуитов на данном этапе являются: отек ткани, разрыхление и фрагментация коллагеновых и эластиновых элементов, присутствие нежелательных тканевых элементов (чрезмерная васкуляризация, гладкомышечные пучки, воспалительно-клеточная инфильтрация и т.д.), патологические включения (например, мелкодисперсный кальций). Кондуиты, прошедшие гистологический контроль, подвергаются антикальциевой обработке путем ковалентной иммобилизации бисфосфонового соединения, содержащего в структуре свободную аминогруппу. В качестве бисфосфонового соединения используют памидроновую, или неридроновую, или 2,2-карбоксиэтил-аминоэтидроновую кислоту или их соли. Обработку проводят путем погружения сегментов ЯВ КРС в 1,2-5% раствор бисфосфоната на 5-8 ч при 37°С. При этом следует учитывать, что чем ниже концентрация раствора бисфосфоната, тем длительнее должна быть экспозиция в нем, и наоборот. После обработки выполняют заключительный эндоскопический контроль ксеновенозного кондуита с функциональной пробой на замыкательную функцию, повторно оценивая морфологию внутренней поверхности стенки ксеновены и створчатого аппарата. Особое внимание уделяют гидравлической функциональной пробе, т.к. известно, что под действием сшивающего агента тонкие створки венозного клапана могут сморщиваться, деформироваться, в результате чего клапан теряет свою компетентность. Такие кондуиты выбраковываются. Кондуиты, прошедшие выходной эндоскопический контроль, герметично упаковывают в раствор для хранения (биоцидный консервант, не содержащий сшивающих агентов).
Изобретение поясняется чертежами:
Фиг. 1A, 1Б. Верификация данных визуального осмотра сегментов невооруженным глазом. Разрезанный параллельно продольной оси клапансодержащий сегмент яремной вены крупного рогатого скота. А - трехстворчатый клапан; Б - двустворчатый клапан с редуцированными створками.
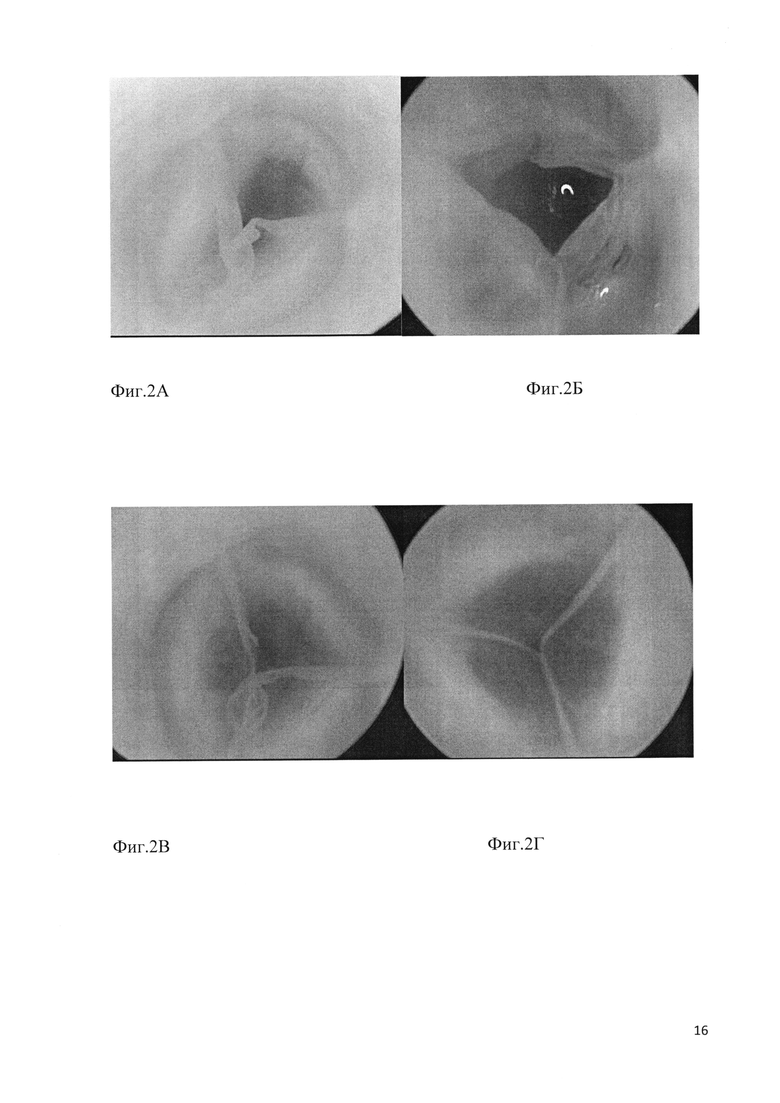
Фиг. 2. Эндоскопическая картина замкнутого ксеновенозного клапана. А-В - варианты дефектов венозного клапана: А - атрезия одной из створок; Б - недостаток площади одной из створок; В - избыточная длина свободного края двух створок венозного клапана. Г - компетентный 3-створчатый клапан с однородной структурой и анатомически правильным расположением створок.
Фиг. 3. Микроскопическое строение ксеновенозной стенки: А - нормальная структура, плотная упаковка коллагеновых и эластиновых волокон (окраска гематоксилин-эозином); Б - выраженный отек биоматериала, нарушение восприятия красителя (окраска гематоксилин-эозином). Исх. ув. × 400.
Ниже приведены примеры осуществления заявляемого способа.
Пример 1
Клапансодержащие сегменты яремной вены крупного рогатого скота, отобранные на мясокомбинате и очищенные по существующим методикам, оценивают визуально невооруженным глазом на наличие 3-створчатого клапана. На данном этапе ксеновенозных сегментов потенциально пригодными для создания кондуита оказались лишь 30% ксеновенозных сегментов, содержащих 3-створчатый клапан (фиг. 1А). Остальные сегменты содержали 2- или 4-створчатый клапан; створки располагались на разном уровне либо существенно различались по площади (фиг. 1Б). Первично отобранные сегменты просматривают с использованием эндоскопа (Hopkins Telescope 45°, Karl Storz, Германия). При визуализации обращают внимание на количество створок, их анатомическое строение и структуру, осесимметричность и качество смыкания (проведение гидравлической пробы).
Для проведения эндоскопии ксеновенозный клапансодержащий сегмент заполняют стерильным 0,9% раствором натрия хлорида и пережимают мягким зажимом с защищенными браншами в наиболее проксимальной (подклапанной) части. После введения эндоскопа продвигают его в направлении клапана так, чтобы обеспечить наилучшую визуализацию стенки и створчатого аппарата. После получения и документирования изображения клапана (либо обнаруженного дефекта стенки) снимают зажим с подклапанной части и оценивают запирательную функцию клапана. Клапан считают компетентным, если он остается в замкнутом состоянии и удерживает столб жидкости над клапаном.
Результаты эндоскопической оценки трехстворчатых клапанов, пропущенных на этапе визуального контроля, позволили выявить различные дефекты почти у 50% клапанов: недостаточную для полноценного смыкания площадь одной или нескольких створок (фиг. 2А), анатомические отверстия (фиг. 2Б) либо дефекты свободного края створок (фиг. 2В). Таким образом, для создания кондуитов может быть использовано не более 15% исходного сырья. Это сегменты, имеющие достаточную длину под- и надклапанной частей, компетентный 3-створчатый клапан с однородной структурой и анатомически правильным расположением створок (фиг. 2Г).
Сегменты, успешно прошедшие входной контроль, подвергают консервации эпоксидным сшивающим агентом по существующим методикам, а именно - 5% раствором диглицидилового эфира этиленгликоля, приготовленным на фосфатном буфере (рН 7,4).
После окончания срока консервации (14 суток) выполняют гистологический контроль кондуитов. Для этого срезают по 0,5 см наиболее дистальной и наиболее проксимальной частей ксеновенозной стенки, выполняют стандартную гистологическую проводку и заливку в блоки, с помощью микротома получают стандартные серийные срезы толщиной 4 мкм, которые окрашивают гематоксилин-эозином и пикрофуксином по Ван-Гизон. При просмотре препаратов выявляют состояние волокнистых структур и наличие/отсутствие инородных тканевых и/или неорганических включений. Нормальная структура ксеновенозной стенки не содержит инородных неорганических включений, мышечных элементов; коллагеновые и эластиновые волокна плотно упакованы, без признаков отека и разрыхления (фиг. 3А). Наиболее частым критерием выбраковки (5-10%) является отек ткани (фиг. 3Б).
Кондуиты, получившие положительное заключение по результатам гистологического контроля, подвергают антикальциевой модификации памидроновой кислотой. Обработку производят в 1,2% водном растворе памидроновой кислоты при температуре 37°С в течение 8 ч. После этого кондуиты отмывают от несвязанных бисфосфонатов в 0,9%-ном растворе NaCl в течение 20 мин с двукратной сменой раствора и выполняют заключительный эндоскопический контроль с функциональной гидравлической пробой по описанной выше методике.
Кондуиты, имеющие положительное заключение по результатам эндоскопического контроля, помещают для хранения в раствор биоцидной композиции, сохраняющей стерильность изделия в течение длительного времени.
Пример 2
Все стадии изготовления кондуитов выполнены аналогично примеру 1, но для антикальциевой модификации в качестве бисфосфонового соединения выбрана неридроновая кислота. Обработку производят в 2,5% водном растворе неридроновой кислоты при температуре 37°С в течение 6 ч.
Пример 3
Все стадии изготовления кондуитов выполнены аналогично примеру 1, но для антикальциевой модификации применяют 2,2-карбоксиэтил-аминоэтидроновая кислоту. Обработку проводят в 5% водном растворе 2,2-карбоксиэтил-аминоэтидроновой кислоты при температуре 37°С в течение 5 ч.
Количество иммобилизованных бисфосфонатов при использовании вышеперечисленных кислот для антикальциевой модификации представлено в табл. 1.
Для сравнительной оценки эффективности антикальциевой модификации изготавливали образцы кондуитов в соответствии со способом по патенту RU 2374843. Для этого консервировали ЯВ КРС 5% раствором диглицидилового эфира этиленгликоля. Через 14 суток консервации биоматериал отмывали в 0,9%-ном растворе NaCl в течение 1 ч с трехкратной сменой раствора и помещали на 4 ч при комнатной температуре в 0,9% растворы памидроновой или 2,2-карбоксиэтил-аминоэтидроновой кислот, приготовленные на фосфатном буфере при рН 7,4. По истечении данного времени биопротезы отмывали в 0,9%-ном растворе NaCl в течение 40 мин с двукратной сменой раствора и помещали для хранения в 1% раствор, например, в 2-бром-2-нитропропан-1,3 диола.
Количество иммобилизованных бисфосфонатов для антикальциевой модификации (примеры по заявленному способу и по патенту RU 2374843) представлено в табл. 1.

Оценку биологической эффективности антикальциевой обработки осуществляли с помощью стандартной модели ускоренной кальцификации путем подкожной имплантации исследуемого материала крысам линии Vistar на 60 суток с последующим количественным анализом содержания кальция в ткани. В качестве контрольных использовали образцы биоматериала, консервированные глутаровым альдегидом (ГА) и диглицидиловым эфиром этиленгликоля (ДЭЭ) без антикальциевой обработки. Наименьшее накопление кальция в образцах ксеновенозной стенки было достигнуто при консервации его эпоксидным соединением (диглицидиловым эфиром этиленгликоля, ДЭЭ) с иммобилизацией 2,2-карбоксиэтил-аминоэтидроновой, памидроновой и неридроновой кислот по предложенному способу (табл. 2).

| название | год | авторы | номер документа |
|---|---|---|---|
| БИОПРОТЕЗ ДЛЯ ТРАНСКАТЕТЕРНОЙ ЗАМЕНЫ МИТРАЛЬНОГО КЛАПАНА | 2020 |
|
RU2738306C1 |
| Транскатетерный самораскрывающийся клапансодержащий протез для имплантации в позицию легочной артерии | 2024 |
|
RU2831895C1 |
| СПОСОБ АНТИКАЛЬЦИЕВОЙ ОБРАБОТКИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА | 2008 |
|
RU2374843C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОЛОГИЧЕСКОГО ПРОТЕЗА ВЕНОЗНОГО КЛАПАНА | 2010 |
|
RU2429023C1 |
| ЭКСТРАКАРДИАЛЬНЫЙ КЛАПАНОСОДЕРЖАЩИЙ КОНДУИТ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2202991C2 |
| СПОСОБ ОБРАБОТКИ БИОЛОГИЧЕСКОЙ ТКАНИ ДЛЯ ИМПЛАНТИРУЕМОГО БИОПРОТЕЗА | 2019 |
|
RU2741224C1 |
| Способ торакоскопического транскатетерного репротезирования митрального клапана самораскрывающимся биологическим протезом (варианты) | 2016 |
|
RU2632540C1 |
| Биопротез аортального клапана (варианты) для открытой бесшовной и транскатетерной имплантации | 2020 |
|
RU2749118C1 |
| Способ предимплантационной обработки биологических протезов для сердечно-сосудистой хирургии | 2023 |
|
RU2827028C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПРОТЕЗА ДЛЯ РЕКОНСТРУКЦИИ ВЫВОДНЫХ ОТДЕЛОВ ЖЕЛУДОЧКОВ И КЛАПАНОВ СЕРДЦА | 2008 |
|
RU2363425C1 |


Изобретение относится к медицине, а именно к реконструктивной хирургии врожденных пороков сердца, и может быть использовано при изготовлении биопротезов для замещения выводного отдела правого желудочка, клапана и ствола легочной артерии у детей. Способ изготовления клапансодержащего кондуита из яремной вены крупного рогатого скота включает отбор, механическую очистку и отмывку биоматериала с последующей его консервацией эпоксидным сшивающим агентом. На этапе отбора биоматериала и при выходном контроле готового изделия проводят эндоскопическое исследование внутренних структур кондуита с функциональной гидравлической пробой на замыкательную функцию клапана. После этапа консервации проводят гистологический контроль структуры биоматериала каждого изделия, а затем подвергают антикальциевой обработке 1,2-5% раствором бисфосфонового соединения, содержащего свободную аминогруппу, при температуре 35-40°С в течение 4-8 часов. Предлагаемый способ изготовления клапансодержащего кондуита обеспечивает создание ксеновенозного кондуита для замещения выводного отдела правого желудочка, клапана и ствола легочной артерии у детей, обладающего высокой надежностью функционирования клапанного аппарата биопротеза, а также сниженным риском дисфункций, обусловленных цитотоксическими реакциями и кальцификацией. 2 з.п. ф-лы, 8 ил., 2 табл., 3 пр.
1. Способ изготовления клапансодержащего кондуита из яремной вены крупного рогатого скота, включающий отбор, механическую очистку и отмывку биоматериала с последующей его консервацией эпоксидным сшивающим агентом и антикальциевой обработкой, отличающийся тем, что на этапе отбора биоматериала и при выходном контроле готового изделия проводят эндоскопическое исследование внутренних структур кондуита с функциональной гидравлической пробой на замыкательную функцию клапана, после этапа консервации проводят гистологический контроль структуры биоматериала каждого изделия, а затем подвергают антикальциевой обработке 1,2-5% раствором бисфосфонового соединения, содержащего свободную аминогруппу, при температуре 35-40°C в течение 5-8 часов.
2. Способ по п. 1, отличающийся тем, что функциональную пробу на замыкательную функцию клапана проводят под эндоскопическим контролем путем заполнения жидкостью ксеновенозного клапансодержащего сегмента, пережатого в наиболее проксимальной части с последующим снятием зажима и визуальным контролем замыкания клапана.
3. Способ по п. 1, отличающийся тем, что бисфосфоновое соединение выбрано из ряда памидроновой, неридроновой, 2,2-карбоксиэтил-аминоэтидроновой кислот или их солей.
| СПОСОБ ИЗГОТОВЛЕНИЯ ПУСТОТЕЛЫХ КАМНЕЙ | 1935 |
|
SU47220A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОЛОГИЧЕСКОГО ПРОТЕЗА ВЕНОЗНОГО КЛАПАНА | 2010 |
|
RU2429023C1 |
| СПОСОБ АНТИКАЛЬЦИЕВОЙ ОБРАБОТКИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА | 2008 |
|
RU2374843C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ АЛЛОГЕННЫХ ТРАНСПЛАНТАТОВ ПРИСЕРДЕЧНЫХ СОСУДОВ С КЛАПАНАМИ | 2010 |
|
RU2445940C1 |
| CN 104095692 A, 15.10.2014 | |||
| WO 2000048531 A1, 24.08.2000. | |||
Авторы
Даты
2017-10-13—Публикация
2016-06-06—Подача