ОБЛАСТЬ ТЕХНИКИ
Изобретение в целом относится к способу синтеза химического соединения, такому как способ синтеза 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она или 6-(5-метоксигепт-1-ил)бицикло[3.3.0]октан-3-она.
УРОВЕНЬ ТЕХНИКИ
Химическое соединение 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он (также известное под названием этоксигептилбициклооктанон или ETHOCYN®) является нестероидным соединением, проникающим в дерму. Аналогичным соединением является CYOCTOL™, или 6-(5-метоксигепт-1-ил)бицикло[3.3.0]октан-3-он. Эти соединения конкурентно ингибируют рецептор межклеточного дигидротестостерона (ДГТ), связываясь в фибробластах из кожной ткани, и исследовались на предмет возможности применения для лечения опосредованных ДГТ медицинских расстройств, таких как угри обыкновенные, гирсутизм, андрогенная алопеция и келоидные рубцы.
Синтез 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она является сложным вследствие, например, бициклической структуры указанного соединения, которая включает четыре хиральных центра. Синтез включает многочисленные реакции, некоторые из которых дороги или опасны. Одна из реакций включает расширение цикла с использованием эфирного раствора диазометана, который получают из DIAZALD® (N-метил-N-нитрозо-n-толуолсульфамид) и спиртового раствора гидроксида калия. Реакция с участием диазометана высокотоксична и опасна вследствие своего взрывного потенциала. Способы синтеза 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она и производных описаны в патенте США №4689349, Kasha et al. Способы синтеза производных 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она (6-(5-метоксигепт-1-ил)бицикло[3.3.0]октан-3-она, или CYOCTOL™) также предположительно описаны в Mulzer et al., "Stereocontrolled synthesis of all eight stereoisomers of the putative anti-androgen cyoctol", Tetrahedron 60:9599-9614 (2004).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предложен способ синтеза соединения, такого как 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он или метоксигептилбициклооктанон, из 3-(5-этоксигепт-1-ил)циклопентена или другого исходного вещества. Такой способ включает реакцию 3-(5-этоксигепт-1-ил)циклопентена с дихлоркетеном с образованием первой смеси, содержащей 7,7-дихлор-4-(5-этоксигепт-1-ил)бицикло[3,2.0]гептан-6-он и 6,6-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он. Первую смесь подвергают взаимодействию с уксусной кислотой и цинком с образованием второй смеси, содержащей 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-он и 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он. Вторую смесь подвергают взаимодействию с йодидом триметилсульфония с образованием третьей смеси, содержащей 2-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксиран]. Третью смесь подвергают взаимодействию с йодидом лития с образованием 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
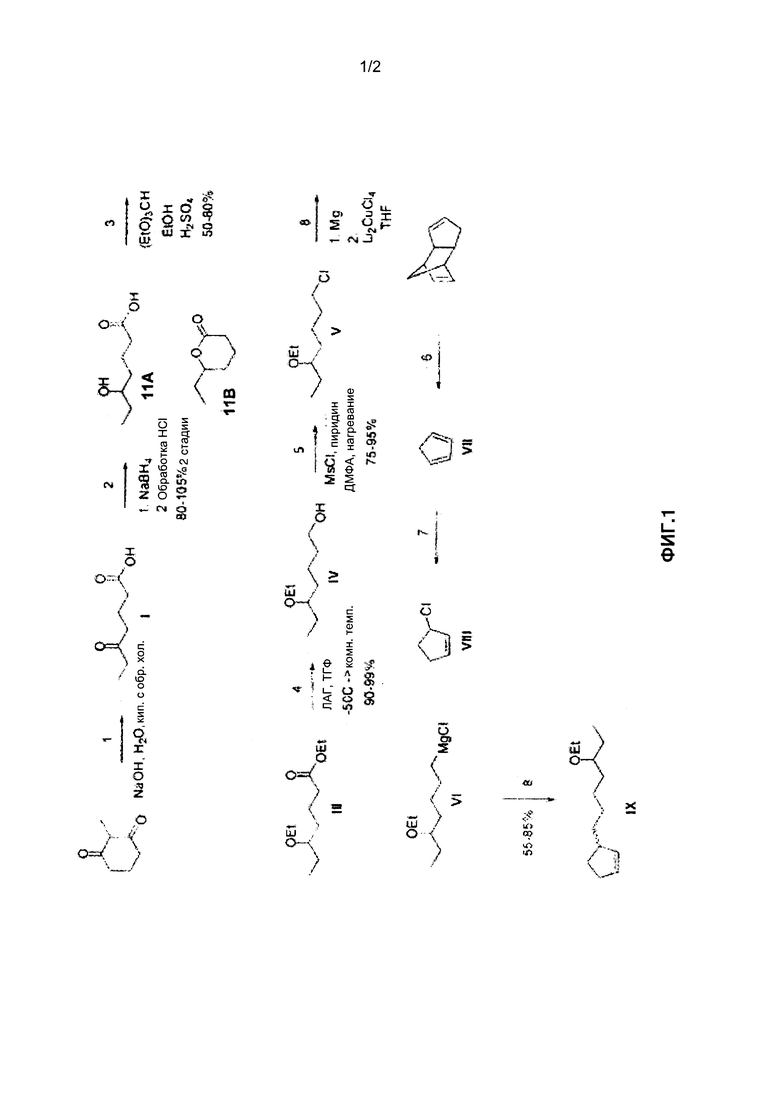
На ФИГ. 1 представлен синтез 3-(5-этоксигепт-1-ил)циклопентена из 2-метилциклогексан-1,3-диона; и
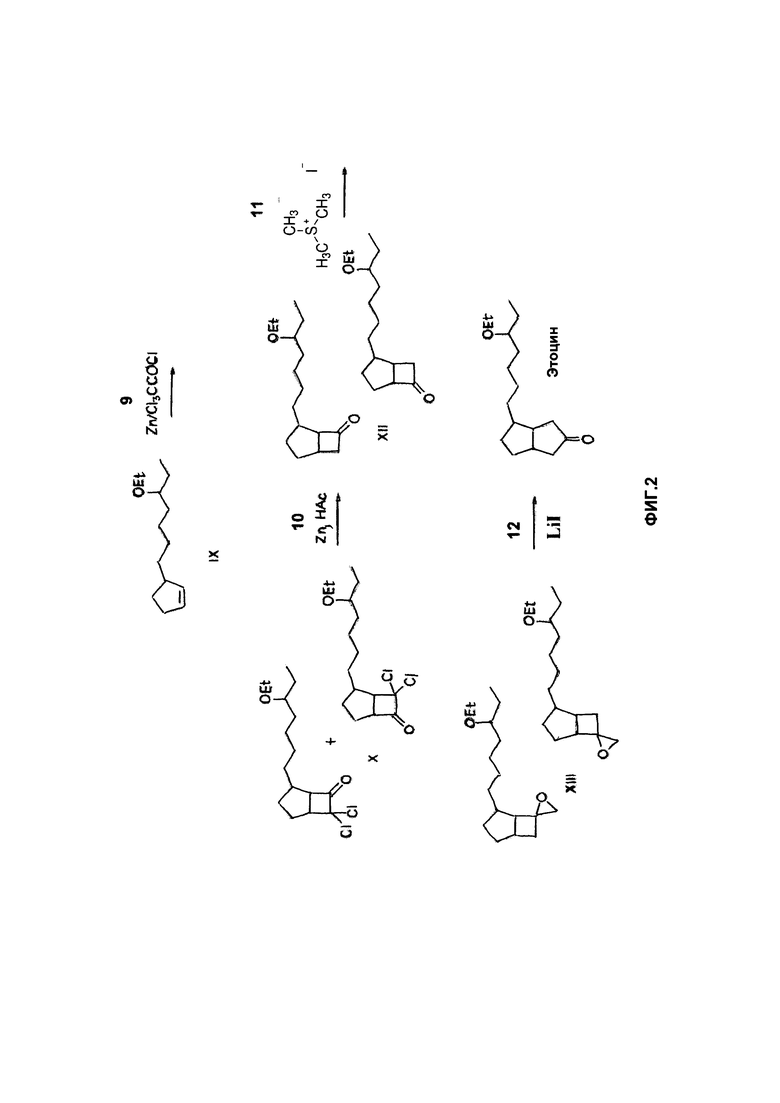
на ФИГ. 2 представлен синтез 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она из 3-(5-этоксигепт-1-ил)циклопентена в соответствии с вариантом реализации изобретения.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Предложен способ синтеза 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она. Способ согласно настоящему изобретению обеспечивает более безопасный и менее дорогой путь получения 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она. 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он, синтезированный по способу согласно изобретению, может быть получен с хорошим выходом и иметь чистоту, подходящую для применения в композиции, такой как лекарственная или косметическая композиция.
Употребляемые в настоящем документе термины "содержащий", "включающий", "имеющий в составе", "характеризующийся" и их грамматические эквиваленты являются включающими или неограничивающими терминами, которые не исключают дополнительных, не указанных элементов или этапов способа, но также включают более узкие термины "состоящий из" и "по существу состоящий из" и грамматические их эквиваленты. Употребляемый в настоящем документе по отношению к материалу, структуре, характеристике или действию согласно способу термин "может" указывает, что они предполагаются для применения при осуществлении варианта реализации изобретения, и употребляется предпочтительно по сравнению с более узким термином "является" с тем, чтобы избежать любого намека, что другие совместимые материалы, структуры, характеристики и способы, применимые в сочетании с данным, следует или необходимо исключить.
Соединение 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может быть синтезировано, как описано на фигурах 1 и 2. На ФИГ. 1 описан синтез 3-(5-этоксигепт-1-ил)циклопентена (Соединение IX) из 2-метилциклогексан-1,3-диона. На ФИГ. 2 показан синтез 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она из Соединения IX.
Как показано в Реакциях 1 и 2 на ФИГ. 1, 2-метилциклогексан-1,3-дион может вступать в реакцию с гидроксидом натрия и боргидридом натрия в воде с образованием 5-гидроксигептановой кислоты (Соединение IIA) и дельта-лактона (Соединение IIB) с выходом от приблизительно 85% до приблизительно 105%. Все процентные содержания и соотношения, использованные здесь, приведены по массе от общей массы композиции, если не указано или из контекста не следует иное. 2-метилциклогексан-1,3-дион может быть приобретен в компании, поставляющей химические реактивы, например в Sigma-Aldrich Со. (Сент-Луис, Миссури, США). В результате гидролиза в Реакции 1 с высоким выходом образуется Соединение I, кетокислота. Восстановление Соединения I боргидридом натрия с последующим гашением кислотой дает смесь Соединения IIA и Соединения IIB, в которой преобладает Соединение IIB. Карбонильные группы Соединения I могут быть восстановлены боргидридом натрия с образованием в результате рацемической смеси R- и S-энантиомеров в С5 положении Соединения IIA и в С6 положении Соединения IIB.
Соединения IIA и IIB могут вступить в реакцию с триэтилортоформатом (ТЭОФ), этанолом и серной кислотой в качестве катализатора с образованием этил-5-этоксигептаната (Соединение III), как показано в Реакции 3. Оба Соединения IIA и IIB реагируют с указанными реагентами с образованием одного продукта, Соединения III. Соединение III может быть получено с выходом от приблизительно 50% до приблизительно 80%. Перед проведением дальнейших реакций Соединение III может быть очищено, например, перегонкой.
Как показано в Реакции 4, Соединение III может реагировать с алюмогидридом лития (ЛАГ) в тетрагидрофуране (ТГФ) с образованием 5-этоксигептанола (Соединение IV).
Соединение IV может быть получено с выходом от приблизительно 90% до приблизительно 99%. Реакция может быть проведена при температуре от приблизительно -50°C до приблизительно комнатной температуры (от приблизительно 20°C до приблизительно 25°C). В некоторых вариантах реализации с целью контроля за реакцией реакция проводится при комнатной температуре. Как показано в Реакции 5, Соединение IV может вступать в реакцию с метансульфонилхлоридом (MsCl) и пиридином в диметилформамиде (ДМФА) с образованием 1-хлор-5-этоксигептана (Соединение V) с выходом от приблизительно 75% до приблизительно 95%.
Как показано в Реакциях 6-8, Соединение V может вступать в реакцию с металлическим магнием с образованием реактива Гриньяра, 5-этоксигептилмагнийхлорида (Соединение VI), который реагирует с дилития тетрахлорокупратом с образованием дилитиевого купратного комплекса. Дилитиевый купратный комплекс может связываться с 3-хлорциклопентеном (Соединение VIII) с образованием 3-(5-этоксигепт-1-ил)циклопентена (Соединение IX) с выходом от приблизительно 55% до приблизительно 85%. Соединение VIII может быть синтезировано из циклопентена (Соединение VII), который синтезируют из дициклопентадиена, что показано в Реакциях 6 и 7. Дициклопентадиен может быть приобретен в компании, поставляющей химические реактивы, например в Sigma-Aldrich Co. В результате термического крекинга и перегонки дициклопентадиена образуется мономерный циклопентадиен, который обрабатывают соляной кислотой для получения Соединения VIII.
Каждое из Соединений I-IX в Реакциях 1-8 может быть обработано, очищено и выделено перед переходом к следующей реакции. Соединения I-IX могут быть обработаны, очищены и выделены обычными методами, которые не описаны здесь подробно. В некоторых вариантах реализации Соединения I-IX могут быть синтезированы способом, описанным в патенте США 4689349, Kasha et al.
Согласно ФИГ. 2, Соединение IX может подвергаться взаимодействию с дихлоркетеном, как показано в Реакции 9. Дихлоркетен образуется in situ из трихлорацетилхлорида и цинка. В результате циклоприсоединения дихлоркетена к Соединению IX образуется смесь экзо- и эндо-7,7-дихлор-4-(5-этоксигепт-1-ил)бицикло[3,2.0]гептан-6-она и экзо- и эндо-6,6-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-она, которые вместе обозначены здесь как Соединение X. В Реакции 9 образуются оба изомера Соединения X в практически равных количествах. Для получения Соединения X Соединение IX может быть растворено в органическом растворителе, таком как диэтиловый эфир. Тем не менее, другие органические растворители могут быть использованы, например диметилсульфоксид (ДМСО), диметилформамид (ДМФА), ацетонитрил, тетрагидрофуран и любые аналогичные. К раствору Соединения IX может быть добавлен порошок цинка. На каждый моль эквивалента Соединения IX в Реакции 9 может быть использовано от приблизительно 1,0 моль эквивалента до приблизительно 3,0 моль эквивалентов порошка цинка, например, от приблизительно 1,4 моль эквивалентов до приблизительно 1,8 моль эквивалентов. В определенных вариантах реализации на моль эквивалента Соединения IX применяют приблизительно 1,6 моль эквивалентов порошка цинка. Смесь порошка цинка и раствора Соединения IX может быть нагрета до температуры чуть ниже температуры кипения органического растворителя. Трихлорацетилхлорид может быть разбавлен органическим растворителем, таким как диэтиловый эфир, и раствор трихлорацетилхлорида медленно добавлен к смеси порошка цинка и раствора Соединения IX. Тем не менее, могут быть применены другие органические растворители. На каждый моль эквивалента Соединения IX в Реакции 9 может применяться от приблизительно 1,0 моль эквивалента до приблизительно 3,0 моль эквивалентов трихлорацетилхлорида, например от приблизительно 1,2 моль эквивалентов до приблизительно 1,6 моль эквивалентов. В определенных вариантах реализации приблизительно 1,4 моль эквивалентов трихлорацетилхлорида применяют на моль эквивалента Соединения IX. В процессе присоединения реакционная смесь может начать энергично кипеть. Раствор трихлорацетилхлорида может быть добавлен к смеси порошка цинка и раствора Соединения IX в течение периода времени от приблизительно одного часа до приблизительно двух часов. После добавления раствора трихлорацетилхлорида реакционная смесь может подвергаться кипячению при перемешивании в течение периода времени, достаточного, чтобы реакция прошла до конца, например от приблизительно десяти минут до приблизительно шестидесяти минут. Реакционная смесь затем может быть охлаждена, отфильтрована, подвержена по меньшей мере одной жидкость-жидкостной экстракции, осушена, отфильтрована, упарена и очищена с получением Соединения X в виде бесцветного масла. В качестве примера, реакционная смесь может быть охлаждена до комнатной температуры и отфильтрована через кизельгур, например кизельгур, доступный под торговым наименованием CELITE®. Осадок на фильтре может быть промыт органическим растворителем, например, таким как диэтиловый эфир. Тем не менее, могут быть применены другие органические растворители. Слои органических растворителей могут быть соединены и промыты, например, водой. Органический слой может подвергаться перемешиванию с насыщенным водным раствором бикарбоната натрия (NaHCO3), например, в течение приблизительно одного часа. После разделения органического и водного слоев органический слой может быть промыт раствором соли, осушен над сульфатом натрия (Na2SO4), отфильтрован через диоксид кремния и упарен под вакуумом. Полученный остаток может быть очищен, например, путем перегонки из колбы в колбу для получения Соединения X в виде бесцветного масла.
Как показано в Реакции 10, Соединение X может вступать в реакцию с уксусной кислотой и цинком с образованием смеси экзо- и эндо- 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-она и 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-она, которые вместе обозначены здесь как Соединение XII. В Реакции 10 образуются оба изомера Соединения XII в практически равных количествах. Соединение X может быть использовано в Реакции 10 в необработанном виде, то есть без перегонки, что позволяет снизить разложение Соединения X. Считается, что нагрев Соединения X для перегонки (до температуры выше 200°C) может вызвать его разложение в связи с присутствием цинка или хлорангидрида, оставшихся после Реакции 9. В Реакции 10 цинк может быть добавлен порциями к раствору Соединения X в уксусной кислоте. Может быть применен избыток цинка по отношению к Соединению X. В качестве примера, от приблизительно 2,0 моль эквивалентов до приблизительно 12 моль эквивалентов цинка может быть применено на моль эквивалента Соединения X, например от приблизительно 5 моль эквивалентов до приблизительно 10 моль эквивалентов. В определенных вариантах реализации применяют приблизительно 9,8 моль эквивалентов цинка на моль эквивалента Соединения X. Цинк может быть добавлен к раствору Соединения X при температуре от приблизительно 10°C до приблизительно 20°C. После добавления цинка, что вызывает возрастание температуры реакции, реакционная смесь может подвергаться перемешиванию, например, в течение приблизительно одного часа. Реакционная смесь может быть отфильтрована, упарена, подвержена по меньшей мере одной жидкость-жидкостной экстракции, осушена, отфильтрована, упарена и очищена с получением Соединения XII в виде бесцветного масла. В качестве примера, реакционная смесь может быть отфильтрована через кизельгур, например кизельгур, доступный под торговым наименованием CELITE®, и фильтрат упарен под вакуумом с образованием остатка. Полученный остаток может быть распределен между гептаном и водой. Органический и водный слои могут быть разделены и органический слой промыт водным раствором NaHCO3. Органический слой может быть осушен над Na2SO4 и к нему добавлен органический растворитель, например, такой как диэтиловый эфир. Тем не менее, могут быть применены другие органические растворители. Реакционная смесь может быть отфильтрована, например, с помощью диоксида кремния, а фильтрат упарен. Полученный остаток может быть очищен, например, путем перегонки из колбы в колбу для получения Соединения XII в виде бесцветного масла. Соединение XII может быть получено с выходом, большим чем приблизительно 55%. Соединение XII стабильно и может подвергаться перегонке.
Как показано в Реакции 11, Соединение XII может вступить в реакцию с йодидом триметилсульфония с образованием 2-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксирана] и 4-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксирана], которые вместе обозначены здесь как Соединение XIII. В Реакции 11 образуются оба изомера Соединения XIII в практически равных количествах. Соединение XIII стабильно и может быть выделено. Гидрид натрия может быть добавлен к органическому растворителю, например к диметилсульфоксиду (ДМСО), нагретому до температуры от приблизительно 50°C до приблизительно 60°C и охлажденному до комнатной температуры. Тем не менее, могут быть применены другие органические растворители. Гидрид натрия может быть применен в Реакции 11 в количестве от приблизительно 1 моль эквивалента до приблизительно 3 моль эквивалентов на моль эквивалента Соединения XII, например в количестве приблизительно 1,2 моль эквивалентов. ТГФ или другой органический растворитель после охлаждения может быть добавлен к раствору гидрида натрия, охлажденному до -5°C. Йодид триметилсульфония может быть добавлен к охлажденному раствору раствору гидрида натрия одной порцией. Йодид триметилсульфония может быть применен в Реакции 11 в количестве от приблизительно 1 моль эквивалента до приблизительно 3 моль эквивалентов на моль эквивалента Соединения XII, например в количестве приблизительно 1,2 моль эквивалентов. После удаления источника охлаждения ТГФ или другой органический растворитель может быть объединен с Соединением XII. Соединение XII и ТГФ могут быть добавлены к раствору, содержащему гидрид натрия и йодид триметилсульфония, в результате чего температура реакционной смеси возрастает. Реакционная смесь может подвергаться взаимодействию при перемешивании в течение периода времени, достаточного, чтобы реакция прошла до конца, в течение которого температура реакционной смеси может возрастать приблизительно до комнатной температуры. К реакционной смеси может быть добавлена вода, после чего производится по меньшей мере одна жидкость-жидкостная экстракция, осушение, фильтрование и концентрирование с получением Соединения XIII в виде бесцветного масла. В качестве примера, реакционная смесь может быть влита в воду и экстрагирована органическим растворителем, таким как гептан. Органические слои могут быть промыты водой и соляным водным раствором. Может быть добавлен органический растворитель, такой как этилацетат, и раствор осушен над Na2SO4. Раствор может быть отфильтрован, например, при помощи диоксида кремния, а фильтрат упарен с образованием Соединения XIII в виде бесцветного масла. Соединение XIII может быть получено с выходом, большим чем приблизительно 90%.
Как показано в Реакции 12, йодид лития может подвергаться взаимодействию с Соединением XIII с получением 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она в качестве основного продукта. Вследствие симметрии конечного продукта оба изомера Соединения XIII могут взаимодействовать с йодидом лития с образованием 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она. Йодид лития может быть применен в Реакции 12 в количестве от приблизительно 1 моль эквивалента до приблизительно 3 моль эквивалентов на моль эквивалента Соединения XIII, например в количестве приблизительно 1,2 моль эквивалентов. Согласно способу по изобретению может быть получена рацемическая смесь 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она с хорошими выходом и чистотой. Раствор йодида лития в ТГФ может быть добавлен порциями к раствору Соединения XIII в ТГФ. Также в Реакции 12 могут быть применены иные, чем йодид лития, кислоты Льюиса. Также в Реакции 12 может быть применен другой органический растворитель, такой как ДМСО или дихлорметан. Поскольку реакция является экзотермической, реакционная смесь может быть охлаждена до комнатной температуры на ледяной бане. Температура реакции может варьироваться от приблизительно 10°C до приблизительно 25°C. Реакционная смесь может подвергаться перемешиванию в течение периода времени, достаточного для протекания реакции до конца, например от приблизительно одного часа до приблизительно трех часов. После того как реакция прошла до конца, может быть добавлена вода и реакционная смесь подвергнута по меньшей мере одной жидкость-жидкостной экстракции органическим растворителем, таким как гептан. Органические слои могут быть промыты водой, осушены, отфильтрованы и очищены с получением 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она в виде масла. В качестве примера, к реакционной смеси может быть добавлена вода и реакционная смесь экстрагирована гептаном. Органические слои могут быть промыты водой и водным соляным раствором, осушены над Na2SO4 и отфильтрованы через диоксид кремния. Диоксид кремния может быть промыт 20%-ным этилацетатом в гептане, который концентрируют с получением 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она в виде масла. Масло может быть дополнительно очищено с помощью хроматографии для получения чистого 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она с выходом более чем приблизительно 20%, например более чем приблизительно 40%. 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может иметь чистоту более чем приблизительно 99% по данным хромато-масс-спектрометрического (ГХ/МС) анализа. 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может иметь чистоту более чем приблизительно 95% по данным анализа при помощи ядерного магнитного резонанса (ЯМР) и более чем 85% по данным анализа при помощи хиральной газовой хроматографии (ГХ).
Аналогичный способ также может быть применен для синтеза 6-(5-метоксигепт-1-ил)бицикло[3.3.0]октан-3-она, или CYOCTOL™. CYOCTOL™ представляет собой производное ETHOCYN®, имеющее в положении С5 метоксигруппу вместо этоксигруппы. CYOCTOL™ может быть синтезирован способом, аналогичным тому, который описан выше.
Если требуется дополнительная очистка 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она, она может быть осуществлена обычными методами, например при помощи хроматографии.
Поскольку 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он имеет четыре хиральных центра, 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он, синтезированный согласно способу по изобретению, теоретически может включать до шестнадцати различных изомеров. Тем не менее, два пятичленных кольца 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она являются цис-конденсированными, поскольку два хиральных центра С-3а и С-6а связаны друг с другом. Таким образом, согласно способу по изобретению может быть получена рацемическая смесь восьми различных изомеров 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она.
В некоторых вариантах реализации химическое соединение 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он, полученное, как описано выше, может быть приготовлено в виде композиции, пригодной для местного применения, например в виде фармацевтической или косметической композиции. В качестве примера, 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может быть приготовлен в виде бальзама, крема, мази, лосьона, геля, пены, дисперсии, мусса, раствора, аэрозоля, суспензии или эмульсии. 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он также может быть включен в различные косметические продукты, включая, но не ограничиваясь ими, твердую, полутвердую, жидкую косметику (например, основу под макияж, косметику для глаз, уход за губами), средства для снятия макияжа, дезодоранты и антиперспиранты, мыло, продукты для ванны и душа (например, масла или соли), продукты по уходу за волосами, солнцезащитный крем, лосьоны для бритья и продукты для детей. 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может также быть приготовлен в виде композиции, подходящей для перорального применения, например в виде таблетки или капсулы.
6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может быть представлен в композиции в терапевтически эффективном количестве, которое является таким количеством соединения, которое, если его вводят пациенту для лечения или профилактики медицинского расстройства или состояния, является достаточным для осуществления таких лечения или профилактики. В определенных вариантах реализации 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может присутствовать в композиции в концентрации от приблизительно 0,01% по массе до приблизительно 5% по массе. 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он может быть использован для лечения или профилактики опосредованных ДГТ медицинских расстройств, таких как угри обыкновенные, гирсутизм, андрогенная алопеция или келоидные рубцы.
Композиция может также включать фармацевтически приемлемое связующее вещество, которое может функционировать в качестве разбавителя, диспергатора или растворителя. Фармацевтически приемлемым является нетоксичное, биологически допустимое, совместимое с 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-оном и иным образом биологически пригодное для введения человеку связующее вещество. Фармацевтически приемлемое связующее вещество добавляют к композиции или иным образом применяют в качестве связующего вещества, носителя или разбавителя для облегчения введения 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она. Фармацевтически приемлемое связующее вещество может включать, но не ограничивается ими, воду, физиологический раствор, фосфатный буфер, раствор Хенкса, раствор Рингера, раствор декстрозы в физиологическом растворе или растворы глюкозы, лактозы или сахарозы. Композиция может также включать фармацевтически приемлемые наполнители, такие как крахмал, глюкоза, лактоза, сахароза, желатин, экстракт солода, рисовая мука, мука, мел, силикагель, стеарат магния, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, вода или этанол.
Композиция необязательно может включать небольшие количества других ингредиентов, таких как абсорбенты, абразивы, добавки против слеживаемости, противовспенивающие средства, антимикробные средства, вяжущие вещества, биологические добавки, буферизующие вещества, наполнители, химические добавки, косметические биоциды, денатураты, косметические вяжущие средства, лекарственные вяжущие средства, наружные анальгетики, пленкообразователи, матирующие добавки, эфирные масла, раздражающие средства, смягчающие средства, средства, успокаивающие кожу, средства, заживляющие кожу, пластификаторы, консерванты, усилители консервантов, пропелленты, восстанавливающие агенты, средства для ухода за кожей, средства, усиливающие проникновение через кожу, защитные средства для кожи, растворители, суспендирующие средства, загустители, солюбилизаторы, солнцезащитные средства, средства против загара, средства, поглощающие или рассеивающие ультрафиолет, средства для искусственного загара, хелатирующие агенты, отшелущивающие вещества, средства для депиляции, отшелушивающие средства/эксфолианты, органические гидроксикислоты или натуральные экстракты.
Следующие примеры служат для более подробного разъяснения вариантов реализации настоящего изобретения. Эти примеры не должны рассматриваться как исчерпывающие или ограничивающие объем настоящего изобретения.
Примеры
Растворители и реагенты, которые были использованы при синтезе 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она, были приобретены у коммерческих поставщиков, например в Sigma-Aldrich Со. (Сент-Луис, Миссури, США) или других поставляющих химические реактивы компаниях. Растворители и реагенты были использованы чистоты ч.д.а. или более высокой.
Пример I
Синтез Соединения X из Соединения IX
К раствору Соединения IX (35,2 г, 0,168 моль) в диэтиловом эфире (250 мл) добавили порошок цинка (17,5 г, 0,268 моль). Смесь нагрели чуть ниже температуры кипения. Трихлорацетилхлорид (26,3 мл, 0,234 моль) разбавили диэтиловым эфиром до 100 мл и этот раствор по каплям добавили к смеси, включающей Соединение IX. Приблизительно через одну минуту реакционная смесь начала энергично кипеть с обратным холодильником. Добавление раствора трихлорацетилхлорида заняло около девяноста минут. После того как добавление было завершено, было продолжено перемешивание при кипении с обратным холодильником в течение приблизительно тридцати минут. Реакционную смесь охладили до комнатной температуры и отфильтровали через кизельгур CELITE®. Осадок на фильтре промыли диэтиловым эфиром. Объединенные органические слои дважды промыли водой и перемешивали органический слой с насыщенным водным раствором NaHCO3 приблизительно в течение часа. После разделения слоев органический слой промыли раствором соли, осушили над сульфатом натрия (Na2SO4), отфильтровали через небольшой слой диоксида кремния и концентрировали в вакууме. Полученный остаток очистили путем перегонки из колбы в колбу (0,03 мм рт. ст., 180-200°C) с выходом приблизительно 45 г бесцветного масла.
Пример II
Синтез Соединения XII из Соединения X
К раствору Соединения X (30 г, 0,093 моль) в уксусной кислоте (250 мл) при температуре приблизительно 15°C небольшими порциями в течение приблизительно сорока пяти минут прибавляли цинк (60 г, 0,91 моль). Температура возросла приблизительно до 25°C. После того как прибавление было завершено, смесь перемешивали приблизительно один час. Реакционную смесь отфильтровали через кизельгур CELITE® и фильтрат концентрировали под вакуумом. Полученный остаток распределили между гептаном и водой. Органический и водный слои разделили и органический слой дважды промыли насыщенным водным раствором NaHCO3, осушили над Na2SO4 и добавили к нему 50 мл этилацетата. Смесь отфильтровали через диоксид кремния и фильтрат концентрировали. Полученный остаток очистили путем перегонки из колбы в колбу (0,02 мм рт. ст., 140°C) с выходом приблизительно 14,5 г бесцветного масла (0,0575 моль, выход 62%).
Пример III
Синтез Соединения XIII из Соединения XII
К ДМСО (100 мл) добавили NaH (2,7 г, 60% в масле, 67,4 ммоль). Смесь нагрели до 55°C и перемешивали в течение приблизительно 1,5 часов. После охлаждения смеси до комнатной температуры добавили ТГФ (100 мл) и охладили смесь до -5°C. Добавили йодид триметилсульфония (13,7 г, 67,4 ммоль) одной порцией и перемешивали смесь приблизительно две минуты, в течение которых йодид триметилсульфония растворился не полностью. Лед-метанольную баню удалили и добавили раствор Соединения XII (14,15 г, 56,15 ммоль) в ТГФ (20 мл) одной порцией. Температура выросла приблизительно до 8°C. Перемешивание продолжали приблизительно два часа и температуре позволили вырасти до комнатной. Смесь вылили в воду (500 мл) и дважды экстрагировали гептаном (2×300 мл). Объединенные органические слои четыре раза промыли водой и один раз соляным раствором. Добавили этилацетат (200 мл) и осушили раствор над Na2SO4. Смесь отфильтровали через небольшой слой диоксида кремния и концентрировали с образованием 14,8 г (0,0556 моль, выход 99%) Соединения XIII в виде бесцветного масла.
Пример IV
Синтез 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она из Соединения XIII
К раствору Соединения XII (47,2 г, 0,177 моль) в ТГФ (200 мл) порциями прибавили раствор йодида лития (28,5 г, 0,212 моль) в ТГФ (100 мл). Прибавление было очень экзотермическим, реакционную смесь охладили до комнатной температуры на ледяной бане. Температура реакции варьировалась в пределах от приблизительно 10°C до приблизительно 25°C. Смесь перемешивали приблизительно два часа и влили в воду (200 мл). Смесь дважды экстрагировали гептаном. Объединенные органические слои дважды промыли соляным раствором, осушили над сульфатом натрия (Na2SO4) и отфильтровали через диоксид кремния. Слой диоксида кремния промыли 20%-ным раствором этилацетата в гептане. Органические слои концентрировали с получением приблизительно 45 г сырого продукта в виде масла. Неочищенный продукт очистили при помощи хроматографии (градиент 0-25% этилацетата в гептане, картридж silicycle 800 г Si) c получением приблизительно 22 г (0,082 моль, выход 46%) чистого 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она. Другая фракция 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она, приблизительно 11 г, была получена более низкой чистоты (выход 23%).
Хотя изобретение может допускать различные модификации и альтернативные формы, конкретные варианты реализации были показаны в качестве примера на чертежах и были описаны здесь подробно. Тем не менее, следует понимать, что изобретение не должно быть ограничено конкретными раскрытыми формами. Напротив, изобретение должно охватывать все модификации, эквиваленты и альтернативы, попадающие в рамки изобретения, как определено следующими пунктами формулы изобретения и их правовыми эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 9-дезокси-9 @ -метиленизостеров @ или их лактонов или их солей | 1979 |
|
SU1053745A3 |
| КОНДЕНСИРОВАННОЕ ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ АМИНОПИРРОЛИДИНА | 2007 |
|
RU2443698C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2531588C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2006 |
|
RU2446171C2 |
| Способ получения производных простациклина или их солей | 1979 |
|
SU1003754A3 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРИДОНОВЫХ КАРБОНОВЫХ КИСЛОТ, СПОСОБ И ПРОМЕЖУТОЧНЫЕ ДЛЯ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 1993 |
|
RU2161154C2 |
| ПРОИЗВОДНЫЕ N-ЗАМЕЩЕННОГО 3-АЗАБИЦИКЛО[3.2.0]ГЕПТАНА | 1994 |
|
RU2136678C1 |
| СОЕДИНЕНИЯ АЗЕТИДИНА, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РАСТВОРИМОЙ ЭПОКСИДГИДРОЛАЗЫ | 2012 |
|
RU2615995C2 |
| Способ получения гликлазида | 2021 |
|
RU2754708C1 |
| Способ получения 9-деокси-9а-метилен-изостеров ПГJ @ или их лактонов | 1980 |
|
SU1360582A3 |
Изобретение относится к способу синтеза 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она в виде рацемической смеси, который используют для лечения опосредованных дигидротестостероном расстройств. Способ включает реакцию первой смеси, содержащей 7,7-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-он и 6,6-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он, с уксусной кислотой и цинком с образованием второй смеси, содержащей 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-он и 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он, реакцию указанной второй смеси с йодидом триметилсульфония с образованием третьей смеси, содержащей 2-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксиран] и 4-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксиран], и реакцию указанной третьей смеси с кислотой Льюиса с образованием 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она. Также изобретение относится к фармацевтической композиции, содержащей полученный вышеописанным способом 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-он в виде рацемической смеси. Предлагаемый способ позволяет получить целевой продукт с хорошим выходом и чистотой, подходящей для применения в фармацевтической композиции. 2 н. и 8 з.п. ф-лы, 2 ил., 4 пр.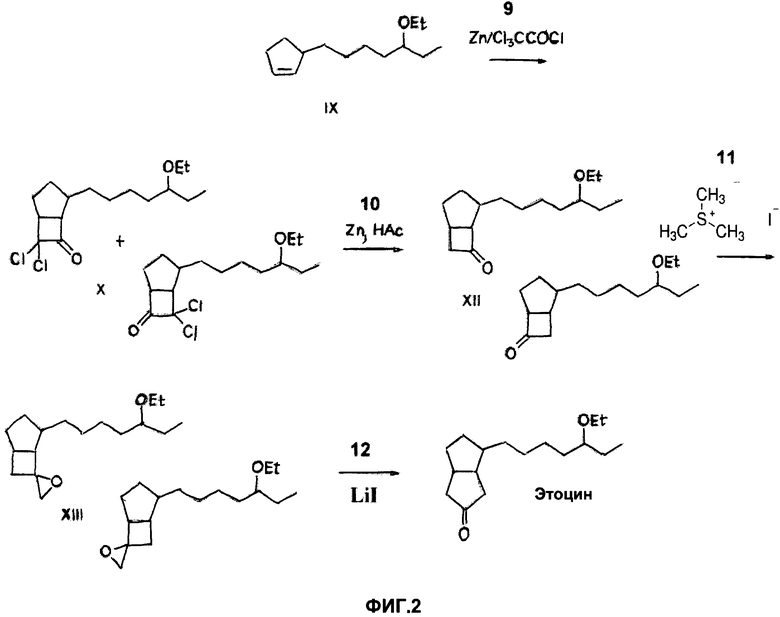
1. Способ синтеза 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она в виде рацемической смеси, включающий:
реакцию первой смеси, содержащей 7,7-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-он и 6,6-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он, с уксусной кислотой и цинком с образованием второй смеси, содержащей 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-он и 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он;
реакцию указанной второй смеси с йодидом триметилсульфония с образованием третьей смеси, содержащей 2-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксиран] и 4-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксиран]; и
реакцию указанной третьей смеси с кислотой Льюиса с образованием 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она.
2. Способ по п. 1, отличающийся тем, что реакция первой смеси с уксусной кислотой и цинком с образованием второй смеси включает реакцию указанной первой смеси с уксусной кислотой и цинком без перегонки первой смеси.
3. Способ по п. 1, отличающийся тем, что реакция указанной второй смеси с йодидом триметилсульфония с образованием третьей смеси включает добавление к указанной второй смеси йодида триметилсульфония, гидрида натрия и диметилсульфоксида.
4. Способ по п. 1, отличающийся тем, что реакция указанной третьей смеси с кислотой Льюиса с образованием 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она включает растворение указанных 2-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксирана] и 4-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксирана] в тетрагидрофуране и добавление раствора йодида лития в тетрагидрофуране.
5. Способ по п. 1, отличающийся тем, что реакция указанной третьей смеси с кислотой Льюиса с образованием 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она включает фильтрование и концентрирование указанного 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она.
6. Способ по п. 1, дополнительно включающий очистку указанного 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она.
7. Способ по п. 1, отличающийся тем, что реакция указанной третьей смеси с кислотой Льюиса включает реакцию указанной третьей смеси с йодидом лития.
8. Способ по п. 1, отличающийся тем, что реакция первой смеси с уксусной кислотой и цинком включает реакцию цинка с указанными 7,7-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-оном и 6,6-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-оном в растворе уксусной кислоты.
9. Способ по п. 1, отличающийся тем, что реакция указанной второй смеси с йодидом триметилсульфония включает реакцию указанной второй смеси с йодидом триметилсульфония и гидридом натрия.
10. Фармацевтическая композиция для лечения опосредованных дигидротестостероном расстройств, содержащая эффективное количество рацемической смеси 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она, при этом указанная рацемическая смесь 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она получена по способу, включающему:
реакцию первой смеси, содержащей 7,7-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-он и 6,6-дихлор-4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он с уксусной кислотой и цинком с образованием второй смеси, содержащей 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-6-он и 4-(5-этоксигепт-1-ил)бицикло[3.2.0]гептан-7-он;
реакцию указанной второй смеси с йодидом триметилсульфония с образованием третьей смеси, содержащей 2-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксиран] и 4-(5-этоксигепт-1-ил)спиро[бицикло[3.2.0]гептан-6,2'-оксиран]; и
реакцию указанной третьей смеси с кислотой Льюиса с образованием 6-(5-этоксигепт-1-ил)бицикло[3.3.0]октан-3-она.
| AU 2011100223 A4, 14.04.2011 | |||
| WO 1983004019 A1, 24.11.1983 | |||
| US 5264619 A1, 23.11.1993 | |||
| Способ получения оптически активных производных (+)-бицикло (3.3.0)-октанола | 1988 |
|
SU1788968A3 |
Авторы
Даты
2017-11-03—Публикация
2013-03-11—Подача