Аллерген, содержащий комбинацию последовательностей белков, кодируемых генами EsxA, EsxB, EspJ, EspK M. tuberculosis complex, и способ его применения для диагностики инфекции M. tuberculosis complex относится к области медицины, фармакологии и биотехнологии, конкретно к способу диагностики инфекции представителями группы М. Tuberculosis complex методом внутрикожной инъекции аллергена, способного вызывать аллергическую реакцию замедленного типа у сенсибилизированных M. Tuberculosis complex реципиентов. Изобретение описывает новую группу аллергенов, содержащих расширенный по сравнению с предыдущим уровнем техники спектр антигенных детерминант секретируемых белков M. Tuberculosis complex, кодируемых генами EsxA, EsxB, EspJ и EspK, которые присутствуют у патогенных форм микобактерий, входящих в группу Mycobacterium tuberculosis complex, но отсутствуют у вакцинного штамма М. bovis BCG и M. microti. Изобретение также описывает способ применения новых аллергенов в диагностикумах в виде дозированной лекарственной формы для внутрикожного введения, позволяющей осуществить диагностику инфекции туберкулеза по развитию аллергической реакции замедленного типа по месту инъекции.
Туберкулез является одной из 10 ведущих причин смертности человека в мире. Около одной трети населения мира имеют латентный туберкулез. Возбудителем туберкулеза является бактерия (Mycobacterium tuberculosis), чаще всего поражающая легкие. Туберкулез излечим и предотвратим. По данным ВОЗ в 2015 году туберкулезом заболели 10,4 миллиона человек, и 1,8 миллиона человек (в том числе 0,4 миллиона человек с ВИЧ) умерли от этой болезни. Более 95% случаев смерти от туберкулеза происходит в странах с низким и средним уровнем дохода. По оценкам ВОЗ, в 2015 году 1 миллион детей заболели туберкулезом, и 170000 детей умерли от него (не считая детей с ВИЧ).
С 2000 года было спасено более 49 миллионов человеческих жизней благодаря эффективной диагностике и лечению. С 2000 года заболеваемость туберкулезом снижалась в среднем на 1,5% в год. Для достижения контрольных показателей на 2020 год, предусмотренных Стратегией по ликвидации туберкулеза, эти темпы снижения необходимо ускорить до 4-5% в год. В Российской Федерации проблема заболеваемости туберкулезом стоит остро. По данным ФБУ «ЦНИИ ОИЗ» Минздрава России, заболеваемость в РФ в 2014 году составила в среднем 59,5 на 100000 населения, а по некоторым регионам заболеваемость достигает 130-169,5 на 100000 населения. Средние показатели распространенности туберкулеза составляют от 75,7 до 594,7 на 100000 населения по результатам 2014 года. Смертность от туберкулеза в РФ по данным за 2014 год составила в среднем 11,5 случаев на 100000 населения. Абсолютное число смертей от туберкулеза в РФ (не включены случаи коинфекции ВИЧ) составило 14054 в 2014 году. Туберкулез, как причина смерти, в большинстве случаев устанавливается патологоанатомами и остается не диагностированным до момента смерти (2005 год - 58,5%; 2013 год - 78,1%), что указывает на недостаточный уровень диагностики туберкулеза в РФ.
Регистрация более ранних форм туберкулеза и качественное лечение детей в Российской Федерации привели к существенному сокращению смертности от туберкулеза детей в возрасте 0-14 лет (2005 год - умерло 37 детей; 2013 год - 20) и 15-17 лет (соответственно 27 и 2 детей). При этом среди детей в возрасте 0-14 лет значительное большинство имеет возраст до 5 лет (2005 год - 59,5%; 2013 год - 85,0%).
Таким образом, разработка доступных и качественных средств ранней диагностики туберкулеза остается актуальной задачей здравоохранения не только в РФ, но и в мире.
Основным способом диагностики инфекции M. tuberculosis является кожная проба или реакция Манту. При этой процедуре осуществляется внутрикожное введение аллергенов, содержащих те или иные формы антигенов M. tuberculosis, что приводит к развитию аллергической реакции замедленного типа. Наблюдая результаты развития местной аллергической реакции в ответ на введение аллергена, можно судить о сенсибилизации к M.tuberculosis, которая может быть связана либо с инфекцией M. tuberculosis, либо с инфекцией других патогенных форм микобактерий группы M. tuberculosis complex, либо, в случае первого поколения аллергенов на основе туберкулинов, с перекрестной реакцией поствакцинального иммунитета. Туберкулиновая проба Манту не дает сведений о распространении, стадии или локализации инфекции. Положительная реакция показывает, что исследуемый пациент по меньшей мере имел контакт с возбудителями туберкулеза.
Реакция Манту является общепринятым, не дорогим и стандартным методом, диагностическая значимость которого зависит от качества и типа используемого аллергена - препарата, содержащего белки, специфичные М. tuberculosis complex. Первое поколение препаратов аллергенов для постановки реакции Манту, содержали препараты туберкулина, полученного путем грубой экстракции содержимого культуральной среды специальных штаммов микобактерий М. tuberculosis, М. bovis или М. avium после их инактивации. Применялось несколько различных типов туберкулина, например, до недавнего времени применяли различные разведения ATK (Alt Tuberculin Koch, старый туберкулин Коха), содержащего лишь продукты жизнедеятельности туберкулезных бактерий, элементы из клеточных стенок и часть питательной среды. АТК является частью фильтрата из убитой нагреванием культуры микобактерий М. tuberculosis complex. Проблемы специфичности, наличие неспецифических аллергических реакций в отношении компонентов АТК привело к его замещению PPD (purified protein derivative). PPD также представляет собой сложную смесь антигенов. Открытый F. Seibert в 1934 г. PPD-S был утвержден в 1952 г. ВОЗ как международный стандарт сухого очищенного туберкулина. В СССР использовали PPD-L (М. Линниковой) со стабилизатором - 0,005% твин-80 и консервантом - 0,01% хинозол.
Основными недостатками препаратов PPD являются: 1) Сложность и длительность производственного цикла в связи с необходимостью культивирования микобактерий; 2) Проблемы с межсерийной воспроизводимостью; 3) Риск изменения антигенных свойств препарата в процессе непрерывного пассирования в связи с генетическим дрейфом штаммов микобактерий, используемых в производстве туберкулина; 4) Сложность процедуры инактивации и экстракции компонентов туберкулина из культуральной среды микобактерий; 5) Повреждение антигенных структур в процессе инактивации и экстракции компонентов клеток микобактерий, приводящее к снижению специфических антигенных свойств препарата; 6) Перекрестные ложноположительные реакции пробы Манту у лиц, вакцинированных против туберкулеза.
Для преодоления указанных недостатков были разработаны и запатентованы аллергены следующего поколения, производство которых не связано с культивированием живых микобактерий - рекомбинантные белковые аллергены и препараты туберкулина на их основе. В основе нового поколения препаратов туберкулина лежит технология получения рекомбинантных белков в системе E. coli, и высокоэффективные методы очистки методом металл-хелатной хроматографии. Получение аллергена для проведения реакции Манту с использованием системы экспрессии E. coli снимает проблемы: 1) Опасного производства, связанного с культивированием живых микобактерий; 2) Сокращения длительности производственного цикла, так как культура E. coli растет в десятки раз быстрее микобактерий; 3) Экономической эффективности производства в связи с высоким выходом целевого белка; 4) Стандартизации процедуры производства и аффинной очистки целевого белка из биомассы с чистотой более 95%; 5) Стандартизации антигенных характеристик аллергена в связи с таргетным использованием только основных выбранных антигенных структур и строгого контроля за их изменениями при производстве; 6) Ложноположительных реакций на пробу Манту у вакцинированных пациентов в связи с использованием белковых структур аллергена, отсутствующих в геноме у вакцинного штамма BCG.
Наиболее близкими аналогами предлагаемого изобретения является способ диагностики туберкулеза, который осуществляют путем внутрикожного введения рекомбинантного химерного аллергена, вызывающего аллергическую реакцию замедленного типа, описанный в патентах РФ №2277540 и №2360926. Решение, раскрытое в указанных патентах, описывает аллерген для проведения реакции Манту, представляющий собой химерный белок, содержащий полноразмерные последовательности белков ESAT-6 (ген EsxA) и CFP-10 (ген EsxB), произведенный в системе экспрессии Е. coli и очищенный методом металл-хелатной хроматографии. Гены EsxA и EsxB, кодирующих белки ESAT-6 и CFP-10, отсутствуют в геноме у вакцинного штамма М. bovis BCG, в связи с чем вакцинированные BCG но не болеющие туберкулезом лица не имеют ложноположительной реакции на пробу Манту, в которой используется данный аллерген. Известно, что у другого известного в мире вакцинного штамма М. microti гены EsxA и EsxB так же отсутствуют в составе генома.
Общеизвестно, что белки ESAT-6 и CFP-10 обнаруживаются в культуральной среде при культивировании микобактерий. Эти белки кодируются генами группы Esx-1. Гены группы Esx обеспечивают работу системы транспорта и секреции некоторых белков включая ESAT-6 и CFP-10 к поверхности клеточной стенки микобактерий и в окружающую клетку биологическую среду [Matthew М. Champion et al. J. Proteome Res. 2014, 13, 5151-5164]. Геномы патогенных микобактерий могут содержать несколько гомологичных трансмембранных транспортерных систем, обозначаемых как Esx1-5. Гены системы Esx консервативны и их филогенетические ортологи прослеживаются как у патогенных, так и у не патогенных видов микобактерий. Тем не менее, установлен факт связи между патогенностью микобактерий и наличием у этих патогенных форм как минимум системы Esx-1. Так, при сравнительном анализе полноразмерных последовательностей вакцинных штаммов М. bovis BCG и М. microti с дикими штаммами группы М. tuberculosis complex, была установлена связь между аттенуацией и делетированием некоторых районов хромосомной ДНК, включая район RD1, содержащих группу генов Esx-1 (локус ESAT-6). Несмотря на малое понимание функций и механизма связи белков локуса ESAT-6 с патогенным процессом, в ряде исследований было показано, что искусственное восстановление утраченного района RD1 в вакцинном штамме BCG приводит к значительному повышению его патогенности на модельных животных [Pym et al., Molecular Microbiology, 2002, 46 (3), 709-717].
Методами иммуноблота и масс-спектрометрии хорошо продемонстрировано, что белки ESAT-6 и CFP-10, являясь факторами патогенности при инфекции М. tuberculosis, одновременно обнаруживаются как на поверхности клеточной стенки, так и в окружающих инфекционный очаг тканях. Установлено, что белки ESAT-6 и CFP-10 являются индукторами иммунного ответа: у инфицированных М. tuberculosis лиц обнаруживаются антитела против ESAT-6 и CFP-10, а периферические мононуклеары крови отвечают продукцией гамма-интерферона в ответ на стимуляцию этими антигенами. Таким образом, белки ESAT-6 и CFP-10 обнаруживают свойство индуцировать как гуморальный, так и клеточный иммунный ответ у контактировавших с М. tuberculosis лиц [Arend et al., Clin. Diagn. Lab. Immunol. 8: 1089-1096].
Авторы наиболее близкого аналога настоящего изобретения (в патентах РФ №2277540 и №2360926) использовали последовательности белков ESAT-6 и CFP-10 для создания рекомбинантного аллергена, описали способ его клонирования, культивирования биомассы и очистки стандартными способами, а также описали способ применения полученного аллергена в форме диагностикума для определения аллергической реакции замедленного типа (реакции Манту) у лиц, контактировавших с М. tuberculosis.
Новое решение, предложенное авторами настоящего патента, состоит в дальнейшем развитии уже описанного подхода создания рекомбинантных аллергенов. Раскрывается группа новых аллергенов, содержащих последовательности белков ESAT-6 и CFP-10 и, дополнительно к ним, белков, кодируемых генами EspJ и EspK, которые также расположены в делетированном у вакцинных штаммов районе RD1.
Гены EspJ и EspK кодируют одноименные белки, которые находятся в одном локусе ESAT-6, вместе с генами EsxA и EsxB, которые кодируют описанные ранее белки ESAT-6 и CFP-10. Анализ полногеномных последовательностей хромосомной ДНК вакцинных штаммов М. bovis BCG и M. Microti, подтверждает что гены EspJ и EspK находятся в делетированном районе RD1, а соответствующие им белки не обнаруживаются в культуральной среде и клеточных экстрактах вакцинных штаммов наиболее чувствительным методом масс-спектрометрии. Ранее было показано, что белки EspJ и EspK являются субстратом для системы трансмембранного транспорта Esx-1, они транспортируются на поверхность клеточной стенки и секретируются в окружающее клетку пространство, при этом механизм транспорта этих белков идентичен с ранее описанными ESAT-6 и CFP-10, поскольку все они являются субстратом для одной транспортной системы esx-1.
Последние протеомные исследования с применением масс-спектрометрии показали наличие белков EspJ и EspK как в клеточном лизате, так и в культуральной среде патогенного штамма М. marinum, который является моделью для изучения работы системы генов Esx-1 [Matthew М. Champion et al. J. Proteome Res. 2014, 13, 5151-5164].
С другой стороны, в научных работах описаны иммуногенные свойства EspJ и EspK, которые могут быть индукторами как клеточного, так и гуморального иммунитета у лиц, инфицированных или контактировавших с М. tuberculosis complex. Показано, что, как и в случае ESAT-6 и CFP-10, у инфицированных М. tuberculosis complex лиц обнаруживаются антитела против EspJ и EspK, а периферические мононуклеары крови таких пациентов отвечают продукцией гамма-интерферона в ответ на стимуляцию указанными антигенами [Else Marie Agger et al., Immunology 2003 110 507-512], [Xiao-Qing Liu et al., INFECTION AND IMMUNITY, May 2004, p. 2574-2581], [Tuberculosis Seghrouchni et al. May 2009, Volume 89, Issue 3, Pages 210-217].
Авторы настоящего изобретения предлагают новое семейство аллергенов для осуществления реакции Манту, содержащих комбинацию аминокислотных последовательностей белков ESAT-6 и CFP-10 и белков EspJ и EspK для расширения спектра антигенных детерминант аллергена. Применение нового аллергена в диагностикумах для кожной реакции Манту, включающего в себя последовательности ESAT-6 (EsxA), CFP-10 (EsxB), EspJ и EspK ранее не описано и впервые раскрывается авторами настоящего патента.
Применение новых аллергенов, включающих в себя последовательности ESAT-6, CFP-10, EspJ и EspK, решает задачи дальнейшего развития и улучшения качества кожных диагностикумов на основе реакции Манту для диагностики туберкулеза путем: 1) Повышения положительного и отрицательного прогностического значения диагностикумов; 2) Снижения дозы аллергена за счет расширения перечня специфических антигенных детерминант в составе препарата; 3) Снижения неспецифических ложноположительных реакций, приводящих к гипердиагностике; 4) Снижению риска появления неспецифических аллергических реакций на введение препарата за счет снижения вводимой дозы аллергена.
Для получения препарата аллергена осуществляется клонирование гена мозаичного (химерного) полиэпитопного белка в системе экспрессии E. coli. Аминокислотные последовательности для создания аллергена выбираются из советующих последовательностей белков М. tuberculosis, приведенных в Таблице №1. Указанные последовательности в Таблице №1 могут выбираться полностью либо фрагментарно. Целесообразно, чтобы в мозаичном белке были представлены по меньшей мере полноразмерные последовательности белков ESAT-6, CFP-10, в сочетании с С-концевым доменом белка EspJ (аминокислоты в интервале 194-273), и с С-концевым доменом белка EspK (аминокислоты в интервале 650-700). Домены, содержащие эпитопы или фрагменты последовательностей, относящихся к разным белкам из ряда EsxA-EsxB-EspJ-EspK, могут быть разделены линкерами для обеспечения стерической свободы вращения и кручения между разделяемыми доменами.
Указанные в Таблице №1 последовательности могут быть заменены на гомологичные, в рамках группы микобактерий М. tuberculosis complex или других микобактерий, если степень гомологии между заменяемой и указанной в таблице №1 последовательностями не ниже 50%.
Предпочтительно разместить повтор из, по меньшей мере, 6 гистидинов на С-конце полиэпитопного белка, поскольку это обеспечит избавление от не до конца транслированных форм белка при его выделении и очистке.
После осуществления дизайна аминокислотной последовательности мозаичного полиэпитопного белка-аллергена, осуществляется ее обратная трансляция, что, с учетом вырожденности генетического кода, дает много вариантов последовательности ДНК, каждая из которых кодирует целевой ген. Полученная последовательность ДНК предпочтительно получается методом синтеза соответствующих комплементарных антипараллельных перекрывающихся одноцепочечных ДНК-олигонуклеотидов длинной от 50 до 80 оснований и их последующей сборке в целевую двуцепочечную ДНК в полимеразной цепной реакции, с использованием синтезированных олигонуклеотидов в качестве матрицы.
Полученные варианты гена полиэпитопного белка-аллергена клонируются в стандартный плазмидный вектор, предпочтительно реплицирующийся в E. coli, несущий ген антибиотикорезистентности предпочтительно к ампицилину или канамицину. Целесообразно клонировать последовательность гена полиэпитопного белка-аллергена под контроль промотора фага Т7 и лактозного оператора. Могут быть использованы и другие типы промоторов и операторов, обеспечивающие высокий уровень экспрессии клонированного гена.
Компетентные клетки E. coli трансформируются плазмидой, несущей клонированный целевой ген, кодирующий полиэпитопный белок-аллерген. Штамм для трансформации целесообразно выбирать из тех, которые содержат ген полимеразы фага Т7 в хромосомной ДНК под контролем лактозного оператора. Могут быть использованы и другие штаммы, подходящие к выбранной системе экспрессии и промотору, обеспечивающие необходимый уровень продукции клонированного гена.
Селекция клеток, успешно трансформированных плазмидной ДНК, содержащей целевой ген, осуществляется по признаку антибиотикорезистентности, предпочтительно к ампициллину или канамицину. Отбираются клоны, обладающие антибиотикорезистентностью. Дальнейшая селекция ведется по признаку наличия индукции синтеза целевого полиэпитопного белка аллергена. Структура гена подтверждается секвенированием плазмидной ДНК, выделенной из отобранного клона, а также сверкой расчетной массы белка с данными оценки массы по электрофорезу в полиакриламидном геле в денатурирующий.
Целевой белок экстрагируется предпочтительно из телец включения штамма-продуцента после индукции экспрессии целевого гена. Экстракция целевого белка может также осуществляться из водорастворимой фракции клеточного лизата, или из культуральной среды штамма-продуцента.
Очистка препарата белка-аллергена осуществляется предпочтительно методами металл-хелатной хроматографии благодаря наличию гистидинового повтора на C- или N- конце белка.
После этапа очитки, целевой полиэпитопный белок-аллерген переводится в форму водного изотонического раствора с концентрацией предпочтительно в диапазоне от 0,5 до 3 мкг на мл и pH в диапазоне предпочтительно от 6,8 до 7,5. В качестве буферной системы для задания необходимого pH предпочтительно использовать фосфатный буфер. В качестве стабилизатора водного раствора белка и для предотвращения агрегации, предпочтительно использовать не ионные детергенты типа твин-20 или твин-80 (полисорбат-80) или их аналоги в концентрации от 0,001% до 0,05%. В качестве консерванта предпочтительно использовать фенол в концентрации от 0,001% до 0,05%. Могут быть использованы иные стабилизаторы и консерванты, обеспечивающие стабильность препарата белка-аллергена в составе препарата для инъекции.
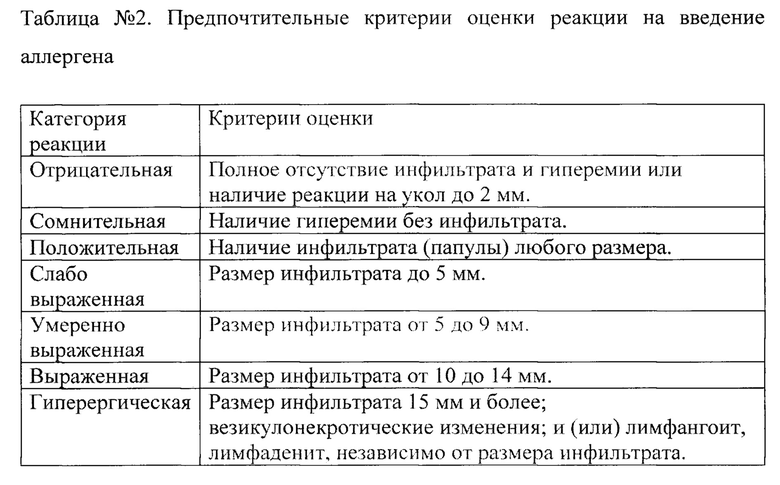
Для осуществления диагностики туберкулеза препарат белка-аллергена вводится исследуемым лицам внутрикожно в количестве, предпочтительно, 100 мкл. Результат пробы оценивают путем измерения гиперемии и инфильтрата по месту введения препарата аллергена предпочтительно через 72 часа после инъекции. Предпочтительные критерии оценки реакции на введение аллергена приведены в Таблице №2.
Пример 1
Диагностика инфекции туберкулеза методом внутрикожной инъекции мозаичного полиэпитопного белка-аллергена, содержащего фрагменты белков, кодируемых генами EsxA, EsxB, EspJ и EspK M. tuberculosis, способного вызывать специфическую аллергическую реакцию замедленного типа у сенсибилизированных M. tuberculosis complex реципиентов.
Фаза 1. Дизайн и получение гена мозаичного полиэпитопного белка-аллергена.
Из последовательности геномной ДНК М. tuberculosis H37Rv (genbank accession number NC_000962) выбираются гены EsxA, EsxB, EspJ и EspK. Аминокислотные последовательности белков, соответствующих этим генам приведена в Таблице №1.
На первом этапе в состав мозаичного белка включаются полноразмерные последовательности белков, соответствующих генам EsxA и EsxB. На втором этапе, в состав конструкции мозаичного белка включаются домены белка EspJ, содержащие: Т-клеточный эпитоп GQPSQATQLLSTPVSQVTTQ (аминокислоты №110-129) и С-концевой домен, содержащий множественные Т-клеточные эпитопы AEKPATEQAEPVHEVTNDDQGDQGDVQPAEVV AAARDEGAGASPGQQPGGGVPAQAMDTGAGARPAASPLAAPVDPSTPA (аминокислоты №194-273). На третьем этапе, в состав конструкции мозаичного белка включается домен белка EspK, содержащий два Т-клеточных эпитопа LWFELMKPMTSTATGREAAHLR AFRAYAAHSQEI (аминокислоты №657-690).
Для устранения стерических ограничений и подвижности доменов, принадлежащих разным белкам, в местах их соединения включают линкерную последовательность SGASSGSGGS. Для целей дальнейшей очистки целевого белка, на С-конце конструкции предусматривают гексамерный гистидин, новый повтор.
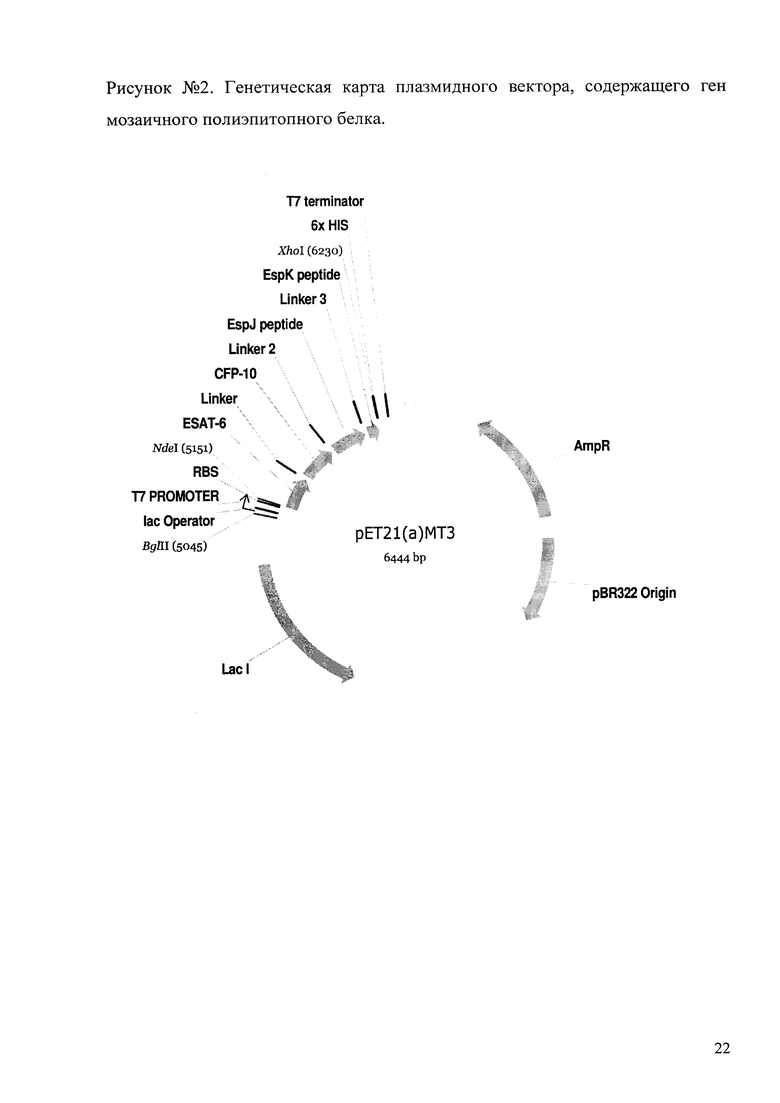
Окончательная структура мозаичного полиэпитопного белка представлена в элайнменте на рис 1. На рисунке №1 консолидированная последовательность конструкции полиэпитопного белка обозначена как МТ3.
Полученную последовательность аминокислот подвергают обратной трансляции. Вырожденность генетического кода используется для формирования массива расчетных взаимно перекрывающихся антипараллельных комплементарных олигонуклеотидов, способных к самосборке и достройке в двуцепочечную ДНК заданной последовательности в полимеразной цепной реакции при использовании олигонуклеотидов в качестве ДНК-матрицы. Сборка гена осуществляется тремя частями: 1) EsxA; 2) EsxB; 3) EspJ/EspK. Линкерные последовательности включаются в состав частей. Группы олигонуклеотидов, необходимые для амплификации и сборки каждой части, указаны в таблице №3. Часть 1 (EsxA) амплифицируется с праймерами, содержащими на 3'-конце сайт рестрикции Nde I, а на 5'-конце сайты рестрикции BamH I и Xho I. Часть 2 (EsxB) амплифицируются праймерами, содержащими на 1'-конце сайт рестрикции Bgl II, а на 5'-конце сайты рестрикции BamH I и Xho I. Часть 3 (EspJ/K) амплифицируются праймерами, содержащими на 1'-конце сайт рестрикции Bgl II, а на 5'-конце сайты рестрикции Xho I. Условия проведения полимеразной цепной реакции стандартные, применяются коммерческие наборы реагентов, содержащие Taq-полимеразу и стандартный буфер для проведения реакции. В качестве матрицы для проведения амплификации используют смесь заранее синтезированных соответствующих олигонуклеотидов в концентрации от 0,1 до 1 микромоль на литр каждого (согласно данным таблицы №3).
Для клонирования частей гена используют плазмидный вектор рЕТ21а. На первом этапе, плазмидная ДНК гидролизуется эндонуклеазами рестрикции Nde I и Xho I. Для клонирования первой части гена (EsxA), ПЦР-продукт гидролизуется эндонуклеазами рестрикции Nde I и Xho I и лигируется в плазмидный вектор по соответствующим липким концам сайтов рестрикции. Структура плазмиды подтверждается секвенированием, после чего вектор гидролизуют эндонуклеазами рестрикции BamH 1 и Xho I для следующего этапа работы. Для клонирования второй части гена (EsxB), соответствующий ПЦР-продукт гидролизуется эндонуклеазами рестрикции Bgl II и Xho I и лигируется в плазмидный вектор по соответствующим сайтам, при этом палиндромная последовательность сайтов BamH I и Bgl II взаимно уничтожается при лигировании комплементарных липких концов. Структура плазмиды подтверждается секвенированием, после чего вектор вновь гидролизуют эндонуклеазами рестрикции BamH I и Xho I для следующего этапа работы. Для клонирования третьей части гена (EspJ/K), соответствующий ПЦР-продукт гидролизуется эндонуклеазами рестрикции Bgl II и Xho I и лигируется в плазмидный вектор по соответствующим сайтам, при этом палиндромная последовательность сайтов BamH I и Bgl II взаимно уничтожается при лигировании комплементарных липких концов. Структура плазмиды подтверждается секвенированием.
Полученный плазмидный вектор рЕТ21 (а)-МТ3 имеет генетическую карту, показанную на рис 2. Вектор рЕТ21 (а)-МТ3 трансформируется в компетентные клетки E.coli, приготовленные стандартным способом. Для трансформации используется штамм BL21(DE3), содержащий копию гена ДНК-полимеразы фага Т7 в хромосомной ДНК. Отбор клонов после трансформации ведется рассеванием на твердую агаризованную среду, содержащую ампициллин в концентрации 100 мкг/мл, по признаку антибиотикорезистентности к ампициллину, ген резистентности к которому находится в составе плазмиды. Отобранные клоны пересевают, культивируют в жидкой среде LB до оптической плотности 0,6 ОЕ на длине волны 600 нм, после чего индуцируют экспрессию гена полиэпитопного мозаичного белка-аллергена добавлением в среду изопропил-β-D-тиогалактопиранозида (IPTG) до концентрации 1 mМ, что обеспечивает разблокировку лактозного оператора и активирует транскрипцию полимеразы Т7 и целевого мозаичного гена. Наличие индукции определяют по наличию специфических полос в электрофорезе суммарного клеточного лизата клонов в полиакриламидном геле в денатурирующих условиях. Клоны, показавшие индукцию и продукцию целевого белка с массой, совпадающей с расчетной, отбираются и пересеваются на агаризованную среду. Плазмидная ДНК клонов выделяется стандартными методами и подвергается секвенированию для проверки последовательности ДНК на предмет появления ошибок. Клоны, содержащие векторную плазмидную ДНК с целевым геном, обладающие индукцией и не содержащие ошибок в структуре целевого гена, пересеваются и депонируются в криохранилище при -80°С.
Фаза 2. Получение очищенного препарата белка-аллергена.
10 мл ночной культура штамма Е. соli BL21 (DE3) трансформированного плазмидой рЕТ21(а)-МТ3 пересевается к 50 мл среды LB, содержащей ампициллин 100 мкг/мл, и инкубируется при +37 °С с шейкированием 300 оборотов в минуту до получения оптической плотности культуральной среды 0,5-0,7 ОЕ на длине волны 600 нм. Транскрипция целевого гена мозаичного белка и полимеразы фага Т7 индуцируется путем внесения в культуральную в среду изопропил-β-D-тиогалактопиранозида (IPTG) до концентрации 1 mM. Индукция осуществляется в течение 4-5 часов, после чего клетки отделяются от культуральной среды центрифугированием. Биомасса клеток после индукции весом 1 грамм ресуспендируется в 5 мл лизирующего буфера, содержащего 50 мМ NaH2PO4 и 300 мМ NaCl рН8.0. К смеси добавляют лизоцим до концентрации 1 мг/мл и инкубируют при +0 °С в течение 30 минут. На следующем этапе биомасса подвергается ультразвуковой дезинтеграции импульсами 200-300 Ватт длительностью 10 секунд, повторяемых шесть раз с интервалами 10 секунд. Полученный таким образом клеточный лизат центрифугируют 30 минут при +4 °С с ускорением 10-20 тысяч g. Супернатант после центрифугирования отделяют от осадка. Осадок содержит целвой белок-аллерген в виде водонерастворимых телец включения. Осадок телец включения ресуспендируют в 2-5 мл буфера, содержащего 100 мМ NaH2PО4, 10 mM Tris и 8М мочевину, рН8.0. Полученный раствор осветляют центрифугированием в течение 20-30 минут при ускорении 10-15000 g. Супернатант после центрифугирования загружают на хроматографическую колонку, содержащую хроматографическую металл-хелатированную среду Ni-NTA Agarose CL4B, уравновешенную буфером, содержащим 100 мМ NaH2PO4, 10 mM Tris и 8М мочевину, рН8.0. Осуществляют промывку колонки тем же буфером до выхода оптической плотности элюата на уровень 0,01-0,05 оптических единиц на длине волны 280 нм. Осуществляют градиентную промывку хроматографической колонки буфером, содержащим 100 мМ NaH2P04, 300 мМ NaCl, 0,01% Twin80, 20 мМ имидазол, 8 M мочевину pH 8.0, с понижением концентрации мочевины с 8 М до 0М. Элюируют целевой белок, пропуская через колонку буфер, содержащий 10 мМ NaH2PO4, 150 мМ NaCl, 0,01% Twin80, 250 мМ имидазол, pH 7.4. Сбор фракции белка контролируют по оптическому поглощению при длине волны 280 нм.
Фаза 3. Получение готового препарата аллергена для инъекций.
Препарат белка после хроматографической очистки подвергают гель-фильтрации на колонке с носителем Superdex G25 (Millipor). Используют буфер для гель-фильтрации содержащий 10 мМ NaH2PО4, 1,8 мМ KН2РO4, 137 мМ NaCl, 2.7 мМ KCl, 0,005%-0,01% Twin80 (полисорбат 80), 0,01%-0,005%) фенол, pH 7.4. Сбор фракции белка контролируют по оптическому поглощению элюата при длине волны 280 нм. Белок разбавляют тем же буфером до концентрации 1-3 мкг/мл, раствор стерилизуют фильтрацией на фильтре пористостью 0,22 мкм и используют в качестве препарата для инъекции.
Фаза 4. Диагностика инфекции туберкулеза при помощи полученного препарата белка-аллергена.
Диагностика туберкулеза с помощью полученного препарата аллергена может осуществляться как в ветеринарии, так и у человека. Препарат вводят строго внутрикожно. Для проведения пробы применяют туберкулиновые шприцы и тонкие короткие иглы с косым срезом. Шприцем набирают 0,2 мл (две дозы) препарата и выпускают раствор до метки 0,1 мл в стерильный ватный тампон. После обработки участка кожи 70% этиловым спиртом, в верхние слои натянутой кожи параллельно ее поверхности вводят 0,1 мл препарата. При постановке пробы, как правило, в коже образуется папула размером 7-10 мм в диаметре беловатого цвета. Лицам, у которых в анамнезе имелись проявления неспецифической аллергии, пробу рекомендуется проводить на фоне приема десенсибилизирующих препаратов в течение 7 дней (5 дней до постановки пробы и 2 дня после нее). Результат пробы оценивают через 72 ч от ее постановки, путем измерения прозрачной линейкой поперечного (по отношению к оси предплечья) размера гиперемии и инфильтрата (папулы), в мм. Гиперемию учитывают только в случае отсутствия инфильтрата. Критерии оценки результатов приведены в таблице №2.


Изобретение относится к медицине и касается способа диагностики инфекции M. tuberculosis complex путем внутрикожного введения препарата аллергена, способного вызывать специфическую аллергическую реакцию замедленного типа у сенсибилизированных M. tuberculosis complex реципиентов. В качестве аллергена используется препарат белка, содержащий комбинацию аминокислотных последовательностей, кодируемых генами M. tuberculosis complex из ряда EsxA, EsxB, EspK, EspJ. Изобретение обеспечивает возможность создания лекарственных средств фармакологической группы аллергенов, обладающих повышенной по сравнению с существующими аналогами специфической иммуногенностью к M.tuberculosis и близкородственным видам Mycobacterium tuberculosis complex и содержащих более широкий спектр специфических антигенных детерминант, которые отсутствуют в вакцинном штамме М. bovis BCG. 8 з.п. ф-лы, 1 пр., 2 ил., 3 табл.
1. Способ диагностики инфекции M. tuberculosis complex путем внутрикожного введения препарата аллергена, способного вызывать специфическую аллергическую реакцию замедленного типа у сенсибилизированных M. tuberculosis complex реципиентов, отличающийся тем, что в качестве аллергена используется препарат белка, содержащий комбинацию аминокислотных последовательностей, кодируемых генами M. tuberculosis complex из ряда EsxA, EsxB, EspK, EspJ.
2. Способ по п. 1, отличающийся тем, что в аминокислотных последовательностях аллергена, относящихся к генам M. tuberculosis complex EsxA, EsxB, EspK, EspJ, произведены замены и/или модификации аминокислотной последовательности, не приводящие к потере способности аллергена вызывать аллергическую реакцию замедленного типа у сенсибилизированных M. tuberculosis complex реципиентов.
3. Способ по п. 1, отличающийся тем, что компоненты аллергена представляют собой рекомбинантные белки и/или полиэпитопные рекомбинантные белки, полученные в бактериальной системе экспрессии.
4. Способ по п. 1, отличающийся тем, что компоненты аллергена представляют собой синтетические пептиды и/или смесь синтетических пептидов и рекомбинантных белков.
5. Способ по п. 1, отличающийся тем, что аллерген содержит белки, очищенные методом металл-хелатной хроматографии.
6. Способ по п. 1, отличающийся тем, что аллерген содержит белки, несущие полигистидиновые аминокислотные повторы на С- или на N-конце.
7. Способ по п. 1, отличающийся тем, что эпитопы и/или блоки последовательностей аллергена, относящиеся к генам M. tuberculosis complex из ряда EsxA, EsxB, EspK, EspJ, разделены между собой инертными линкерами, представляющими собой низко иммуногенные аминокислотные последовательности длиной от 1 до 10 аминокислот.
8. Способ по п. 1, отличающийся тем, что дозированная лекарственная форма для диагностики туберкулезной инфекции содержит препарат аллергена в количестве от 0,05 до 0,5 мкг на одну дозу.
9. Способ по п. 1, отличающийся тем, что дозированная лекарственная форма для диагностики туберкулезной инфекции содержит препарат аллергена в водном изотоническом растворе с рН 6.8-7.5.
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| PATIL N., et al., Initial experience with GeneXpert MTB/RIF assay in the Arkansas Tuberculosis Control Program.Australas Med J | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2017-11-23—Публикация
2017-01-24—Подача