РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США номер 61/289685, поданной 23 декабря 2009 года, и предварительной заявки на патент США номер 61/324481, поданной 15 апреля 2010 года.
УРОВЕНЬ ТЕХНИКИ
Казеинкиназы 1 (CK1) представляют собой семейство эволюционно консервативных серин/треониновых киназ, включающее семь известных представителей указанного семейства у позвоночных (CK1α, -β, -γ1, -γ2, -γ3, -δ и -ε). CK1 содержат типичный киназный домен, за которым следует С-концевой хвостовой участок, который связывают с регуляцией локализации CK1, субстратной селективностью и киназной активностью. Было обнаружено, что бесчисленное множество белков, вовлеченных во многие клеточные функции, включая везикулярный транспорт, репарацию поврежденной ДНК, протекание клеточного цикла, цитокинез и циркадные ритмы, фосфорилируются CK1 (обзор: Gross and Anderson (1998); Vielhaber and Virshup (2001); Knippschild et al. (2005)). Более того, представители семейства CK1 (-α, -δ/ε и -γ) модулируют активность основных сигнальных путей (например, Wnt и Shh) посредством различных механизмов (Peters et al., 1999; Liu et al., 2002; Price and Kalderon, 2002; Davidson et al., 2005; Zeng et al., 2005 и обзор; Price (2006)).
Было описано семь изоформ CK1 у млекопитающих, а именно CK1α, β, γ1-3, δ и ε, и несколько сплайс-вариантов. Все они содержат высококонсервативный киназный домен, короткий N-концевой домен, содержащий от 6 до 76 аминокислот, и высоковариабельный С-концевой домен, содержащий от 24 до более чем 200 аминокислот. Конститутивная фосфотрансферазная активность изоформ CK1 строго контролируется посредством нескольких механизмов. Например, близкородственные изоформы CK1δ и ε, обладающие 98% идентичностью на уровне аминокислот их каталитического домена, регулируются путем аутофосфорилирования, дефосфорилирования и протеолитического расщепления. Представители семейства CK1 были обнаружены в ядре, цитоплазме и плазматической мембране. Посредством фосфорилирования многочисленных различных субстратов, содержащих каноническую или не каноническую консенсусную последовательность, они модулируют активность ключевых регуляторных белков, вовлеченных во многие клеточные процессы, такие как клеточная дифференцировка, клеточная пролиферация, апоптоз, циркадные ритмы, сегрегация хромосом и везикулярный транспорт.
Семейство Pim-киназ, включающее три изоформы, Pim-1, Pim-2 и Pim-3, недавно вызвало интерес в области онкологии и иммунной регуляции. В ходе продолжающихся исследований была показана роль указанных белков (как функционально, так и механистически) в выживаемости и пролиферации клеток, при этом при ряде раковых заболеваний и воспалительных состояний у людей наблюдалась избыточная экспрессия указанных белков.
Pim-киназы подавляют апоптоз и регулируют протекание клеточного цикла. Сообщалось, что в солидных опухолях, таких как рак предстательной железы и рак поджелудочной железы, наблюдается повышенный уровень Pim-киназ. Pim-1 первоначально была обнаружена в клетках лейкоза у мышей, и в нескольких независимых исследованиях было показано повышение уровня указанных киназ в злокачественных опухолях предстательной железы человека. Pim-1, 2 и 3 образуют отдельное семейство высоко гомологичных серин/треониновых киназ, принадлежащих к семейству киназ, родственных кальмодулин-зависимым протеинкиназам (САМК). Помимо указанных трех кодируемых генами белков для Pim-1 и 2 также были описаны варианты трансляции, являющиеся результатом использования альтернативных инициирующих кодонов. Название Pim связано с первоначальной идентификацией гена pim-1 как сайта частого встраивания провируса в вызванных вирусом мышиного лейкоза Молони Т-клеточных лимфомах. Впоследствии было обнаружено, что ген, кодирующий Pim-2, также подвержен указанному встраиванию. Pim-3, первоначально определенная как зависимая от деполяризации киназа (KID)-l, позже была переименована вследствие высокого сходства ее последовательности с Pim-1 (71% идентичность на уровне аминокислот). Для всех трех изоформ наблюдается повсеместная экспрессия белков Pim на высоком уровне в кроветворной ткани и нарушенная экспрессия в различных злокачественных опухолях человека. Pim-киназы обеспечивают положительную регуляцию выживаемости и пролиферации клеток, открывая терапевтические возможности в области онкологии. Избыточная экспрессия протеинкиназы Pim часто наблюдается в злокачественных опухолях предстательной железы и клетках некоторых форм лейкемии и лимфомы.
Также было обнаружено участие Pim-киназ в иммунной регуляции. Сообщалось, что при различных воспалительных состояниях наблюдается повышенный уровень экспрессии Pim-2, и что Pim-2 может функционировать как положительный регулятор интерлейкина-6 (IL-6), в силу чего избыточная экспрессия указанной киназы приводит к повышению уровня индуцированного раздражителем IL-6. Pim-1 и 2 также вовлечены в вызываемый цитокинами рост и выживаемость Т-клеток. При сравнении чувствительности стимулированных Т-клеток у мышей Pim-1-/-Pim-2-/- и мышей дикого типа после лечения иммуносупрессором рапамицином было обнаружено, что отсутствие Pim-1/Pim-2 приводило к значительному нарушению активации Т-клеток, что указывает на то, что Pim-киназы способствуют росту и выживаемости лимфоцитов посредством PI3K/AK.T (РКВ, протеинкиназа В)/ (mTOR)-независимый путь мишени рапамицина в клетках млекопитающих. Также были описаны другие параллельные, но независимые функции и перекрывающаяся субстратная специфичность в отношении белков указанных путей, включая положительную регуляцию транскрипции генов, зависимых от ядерного фактора каппа-В (NF-κВ), которые вовлечены как в воспалительные, так и в онкологические процессы. Таким образом, Pim-киназы являются перспективными мишенями в обеих указанных областях терапевтического применения. Кроме того, сообщалось, что Pim-киназы участвуют в защите транспортера АТФ-связывающей кассеты (АВС-транспортера) P-гликопротеина (Pgp; АВСВ1) от протеолитического и протеасомного распада. Pgp, как известно, опосредует отток лекарственного средства из клеток. Таким образом, ингибиторы Pim-киназ могут обеспечить новый подход к устранению лекарственной устойчивости.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Один из аспектов настоящего изобретения относится к соединениям, которые ингибируют казеинкиназу 1 и/или казеинкиназу 2 и/или PIM-киназу. Например, один вариант реализации изобретения относится к соединению формулы 1:
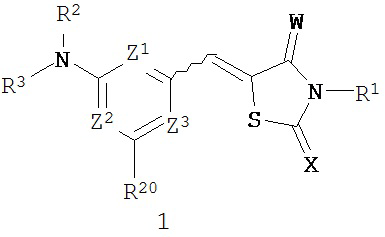
или его фармацевтически приемлемой соли, где независимо для каждого случая:
W и Х независимо представляют собой кислород или серу;
Z1, Z2 и Z3 независимо представляют собой C-R20 или N, при условии что по меньшей мере один из Z1 и Z2 представляет собой N;
R1 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -COR6, -C(O)OR6, -SO2(R6), -C(O)(R6)(R7), -SO2N(R6)(R7) и -[C(R4)2]p-R5;
каждый из R2 и R3 независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(CR6), -C(O)N(R6)(R7), -SO2N(R6)(R7), -P(O)(OR6)(OR7); или R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R5 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероциклоалкила, аралкила, гетероарила, гетероаралкила, галогена, гидрокси, алкокси,гидроксиалкила и алкоксиалкила;
-N(R8)(R9), -N(R8)COR9, -N(R8)C(O)OR9, -N(R8)SO2(R9), -CON(R8)(R9), -ОС(О)(R8)(R9), -SO2N(R8)(R9), -OC(O)OR8, -COOR9, -C(O)N(OH)(R8), -OS(O)2OR8, -S(O)2OR8, -S(O)2R8, -OR8, -COR8, -OP(O)(OR8)(OR8), -P(O)(OR8)(OR8) и -N(R8)P(O)(OR9)(OR9);
R6 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R7 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R8 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R9 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R8 и R9 соединены друг с другом с образованием гетероциклического кольца;
R20 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, галогена, галогеналкила, трифторметила, фторалкила, перфторалкила, тио, циано, гидрокси, метокси, алкокси, фенокси, арилокси, гетероарилокси, карбоксила, алкоксикарбонила, ацила, нитро, амино, алкиламино, ариламино, гетероариламино, амидо, ациламино, сульфата, сульфоната, сульфонила, сульфоксидо, сульфонамидо, сульфамоил, -[[C(R4)2]p-R5, NR14R5, OR16, O-[C(R4)2]p-R5, NR14-[C(R4)2]p-R5 и SR16;
R14 и R15 каждый из независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(R6), -С(O)N(R6)(R7), -SO2N(R6)(R7) и P(O)(OR6)(OR7); или R14 и R15 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R16 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6 и -C(O)N(R6)(R7); и
p равен 1, 2, 3, 4, 5 или 6;
где любой из вышеуказанных алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила может являться необязательно замещенным.
Вариант реализации изобретения относится к соединению формулы 2:

или его фармацевтически приемлемой соли, где независимо для каждого случая:
R1 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -COR6, -C(O)OR6, -SO2(R6), -C(O)N(R6)(R7), -SO2N(R6)(R7) и -[C(R4)2]p-R5;
каждый из R и R независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(CR6), -C(O)N(R6)(R7), -SO2N(R6)(R7); или R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R4 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероциклоалкила, аралкила, гетероарила, гетероаралкила, галогена, гидрокси, алкокси,гидроксиалкила и алкоксиалкила;
R5 выбран из группы, состоящей из арила, гетероарила, гетероциклила, -N(R8)(R9), -N(R8)COR9, -N(R8)C(O)OR9, -N(R8)SO2(R9), -CON(R8)(R9), -ОС(О)(R8)(R9), -SO2N(R8)(R9), -OC(O)OR8, -COOR9, -C(O)N(OH)(R8), -OS(O)2OR8, -S(O)2OR8, -S(O)2R8, -OR8, -COR8, -OP(O)(OR8)(OR8), -P(O)(OR8)(OR8) и -N(R8)P(O)(OR9)(OR9);
R6 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R7 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R6 и R7 соединены друг с другом с образованием гетероциклического кольца;
R7 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R8 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R8 и R9 соединены друг с другом с образованием гетероциклического кольца;
R20 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, галогена, галогеналкила, трифторметила, фторалкила, перфторалкила, тио, циано, гидроксил, метокси, алкокси, фенокси, арилокси, гетероарилокси, карбоксила, алкоксикарбонила, ацила, нитро, амино, алкиламино, ариламино, гетероариламино, амидо, ациламино, сульфата, сульфоната, сульфонила, сульфоксидо, сульфонамидо, сульфамоила, -[C(R4)2]p-R5; NR14R15, OR16 и SR16;
каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(R6), -C(O)N(R6)(R7), -SO2N(R6)(R7) и -SO2N(R6)(R7); или R14 и R15 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R16 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6 и -C(O)N(R6)(R7); и
p равен 1, 2, 3, 4, 5 или 6;
где любой из вышеуказанных алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила может являться необязательно замещенным.
Аспект изобретения относится к соединению или его фармацевтически приемлемой соли, выбранному из группы, состоящей из:
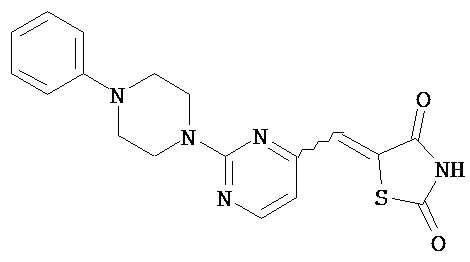 ,
, 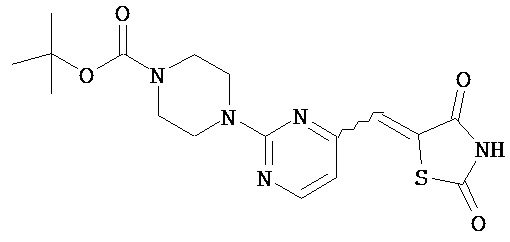 ,
,
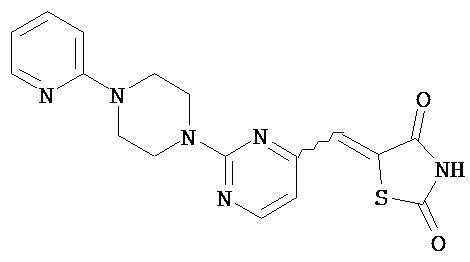 ,
, 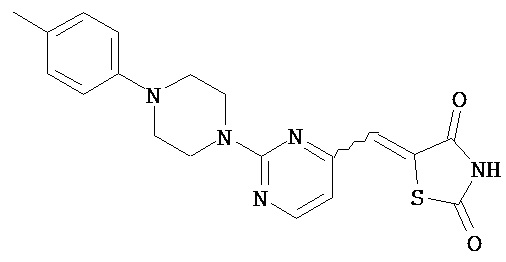 ,
,
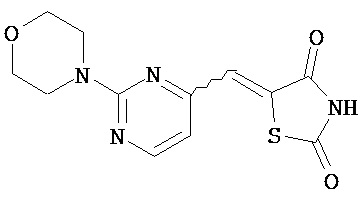 ,
, 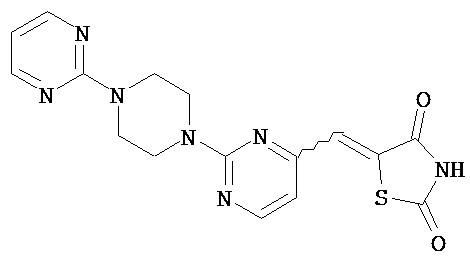 ,
,
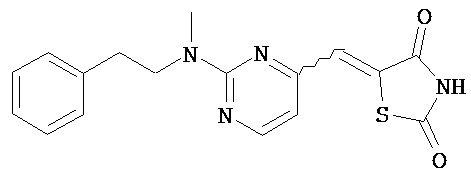 ,
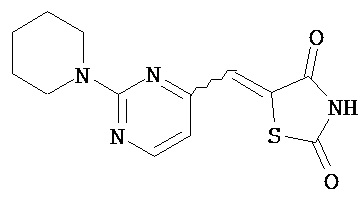
, 
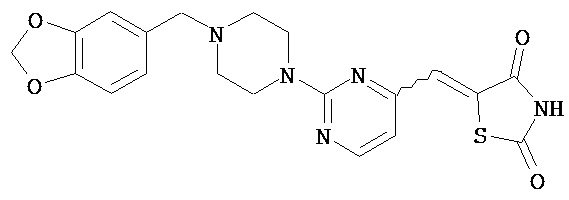 ,
, 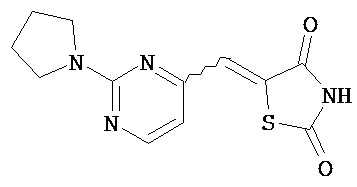 ,
,
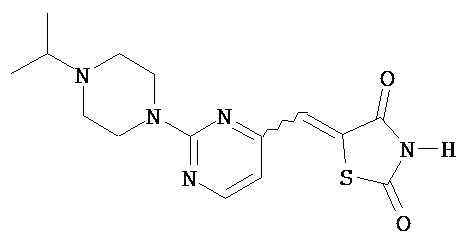 ,
, 
 ,
,  ,
,
 ,
,  ,
,
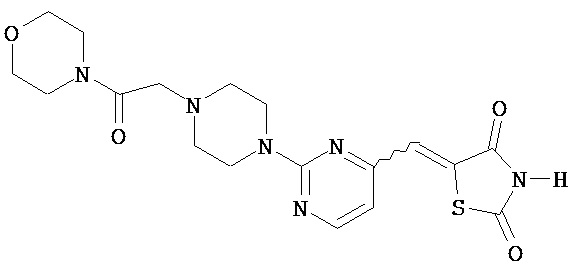 ,
, 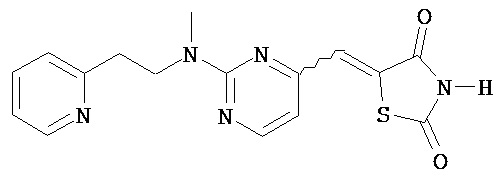 ,
,
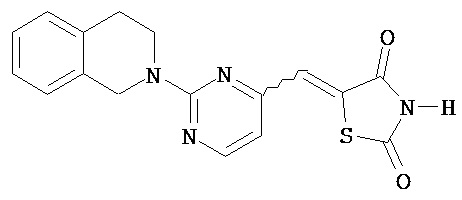 ,
, 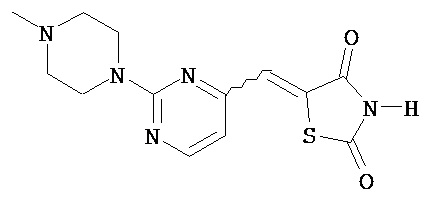 ,
,
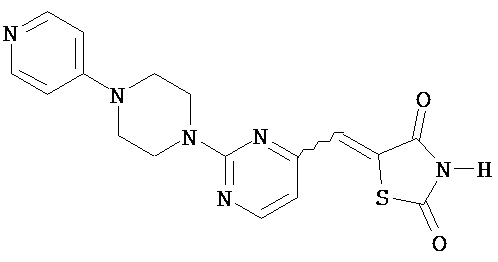 ,
,  ,
,
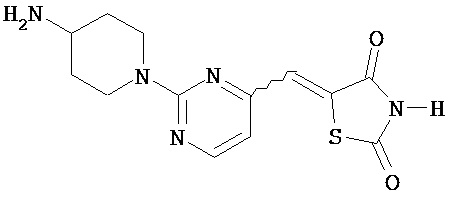 ,
, 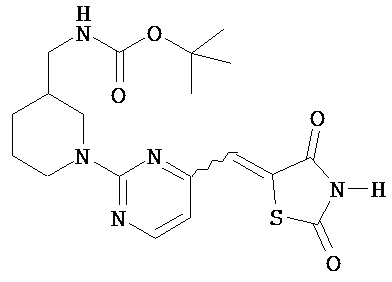 ,
,
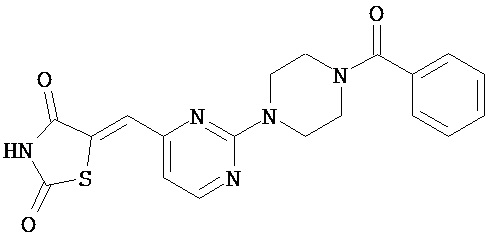 ,
, 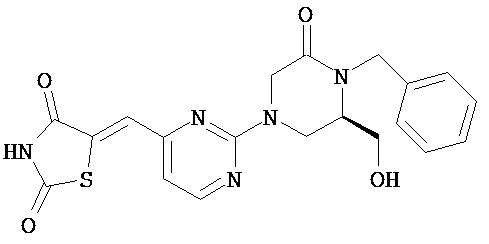 ,
,
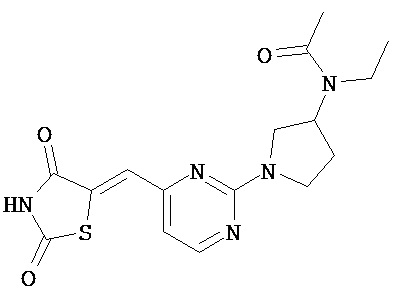 ,
, 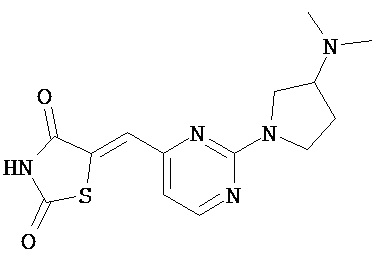 ,
, 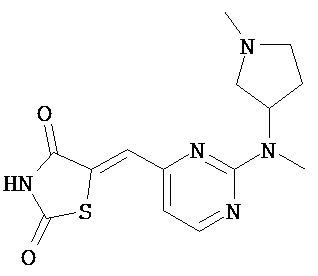 ,
,
 ,
, 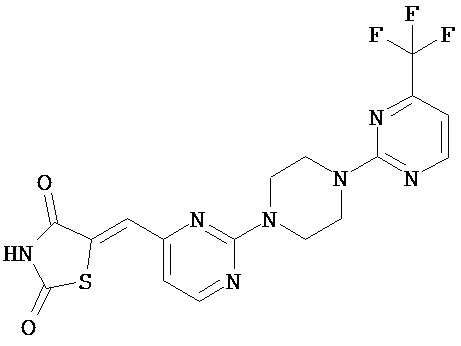 ,
,
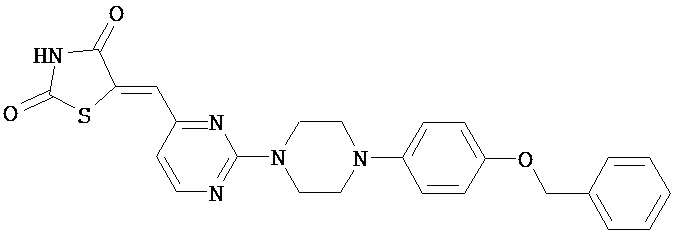 ,
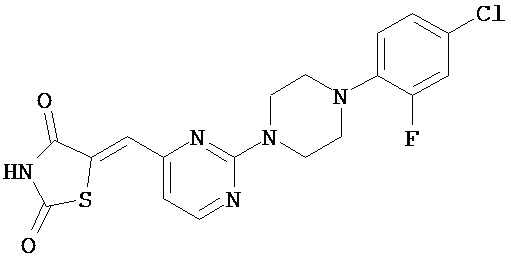
, 
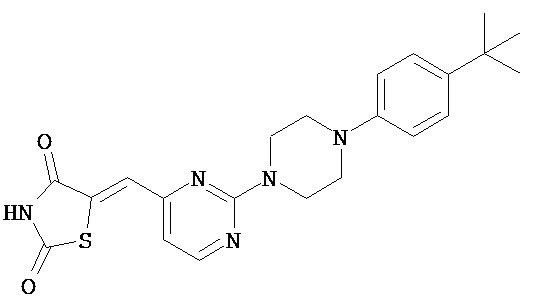 ,
,  ,
,
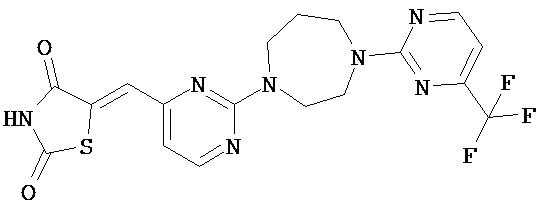 ,
, 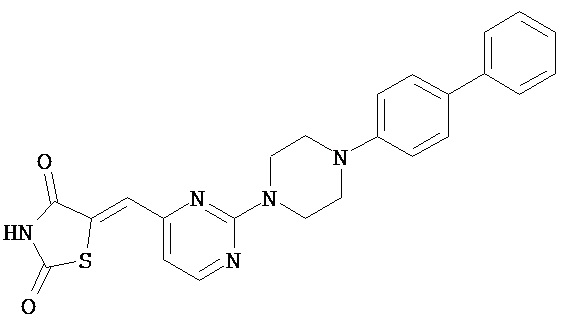 ,
,
 ,
, 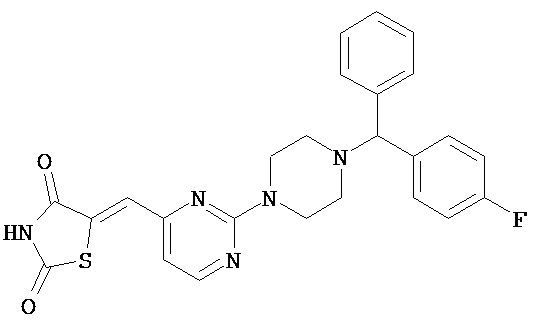 ,
,
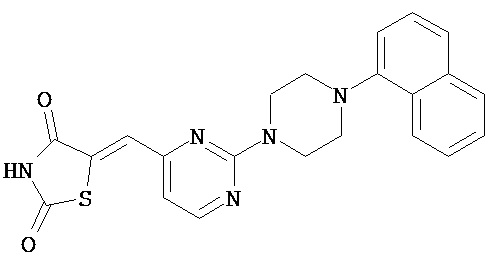 ,
, 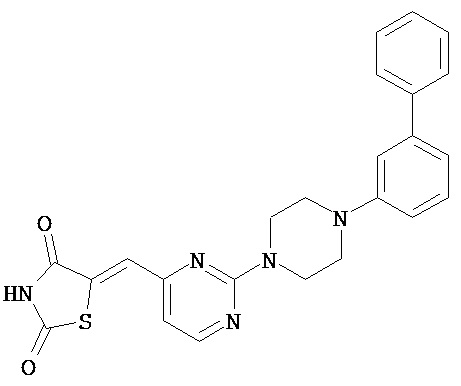 ,
,
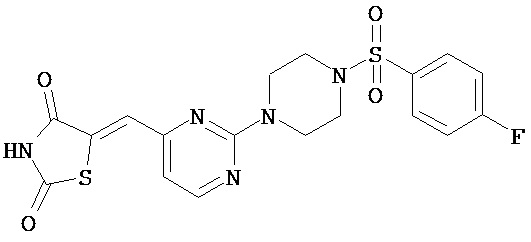 ,
, 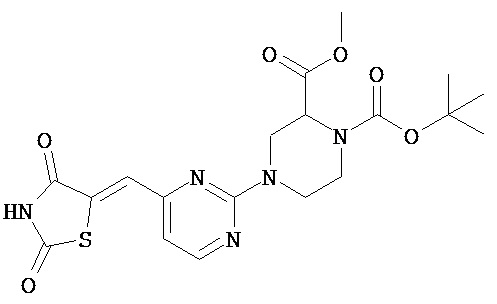 ,
,
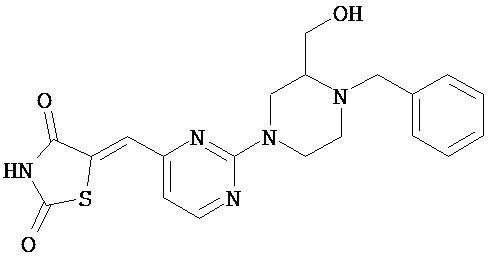 ,
,  ,
,
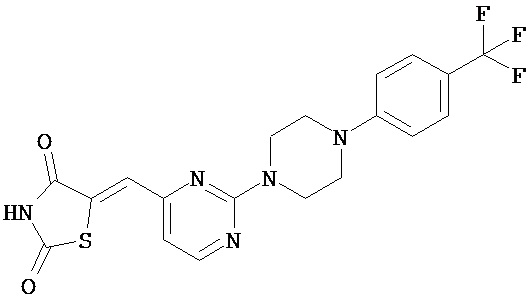 ,
,  ,
,
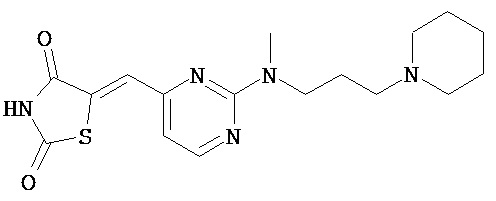 ,
, 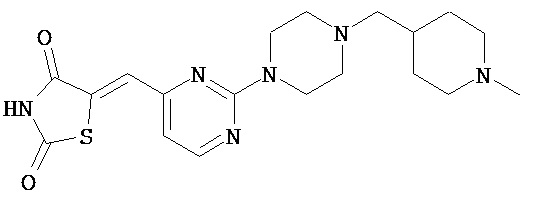 ,
,
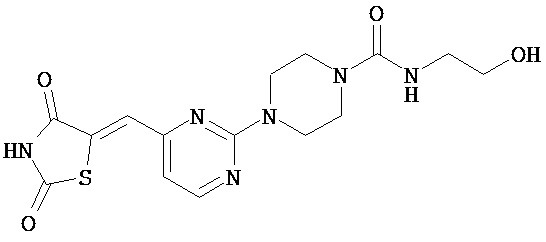 ,
, 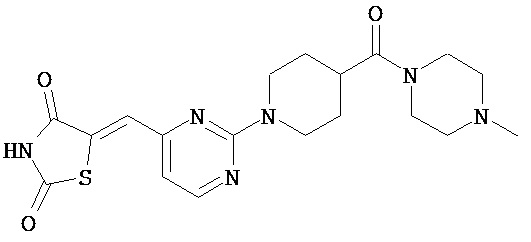 ,
,
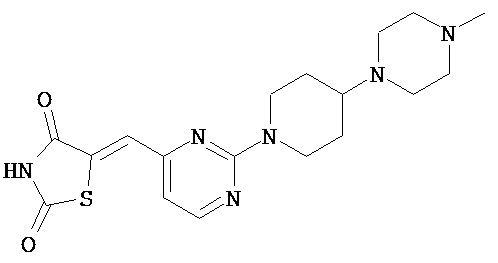 ,
, 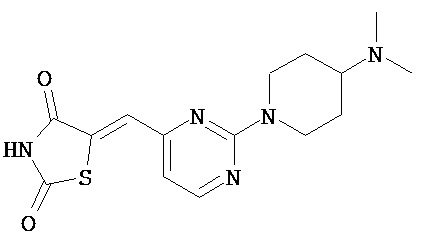 ,
,
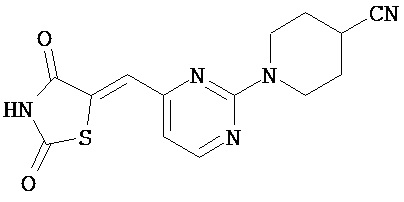 ,
,  ,
,
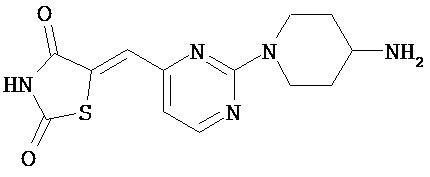 ,
,  ,
,
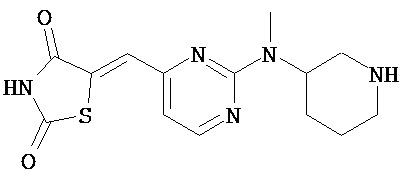 ,
,  ,
, 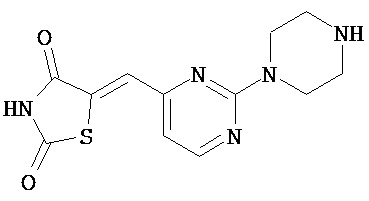 ,
,
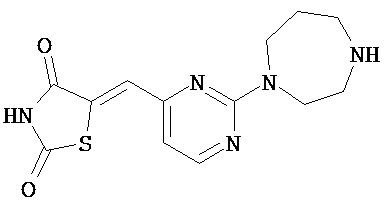 ,
, 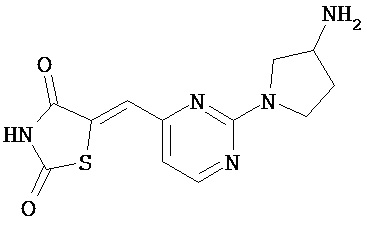 ,
, 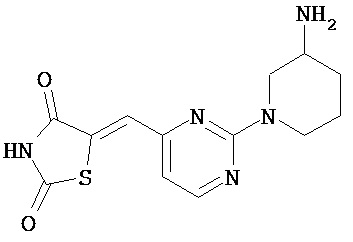 ,
,
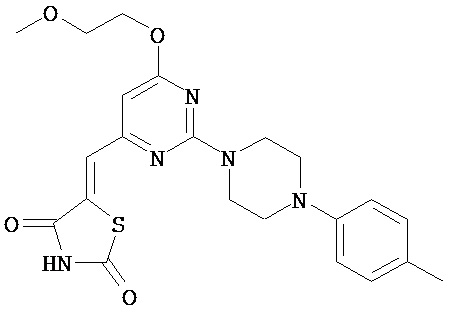 ,
, 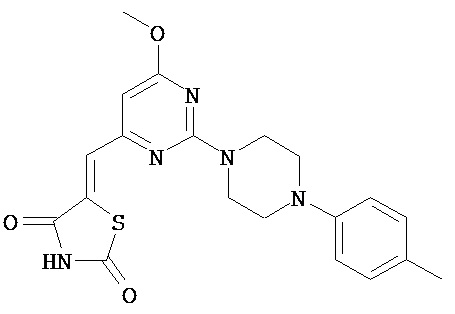 ,
,
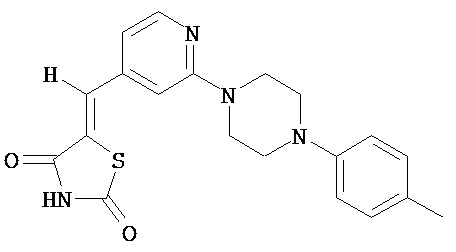 ,
, 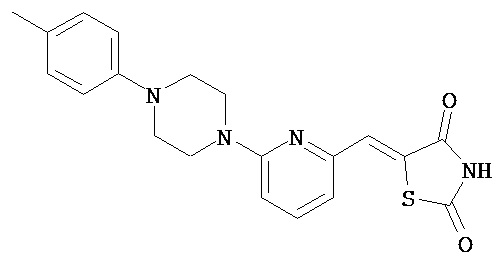 ,
,
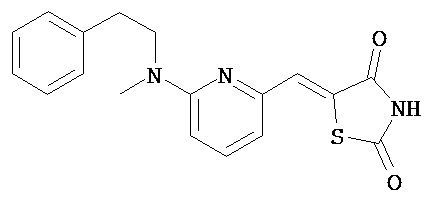 ,
, 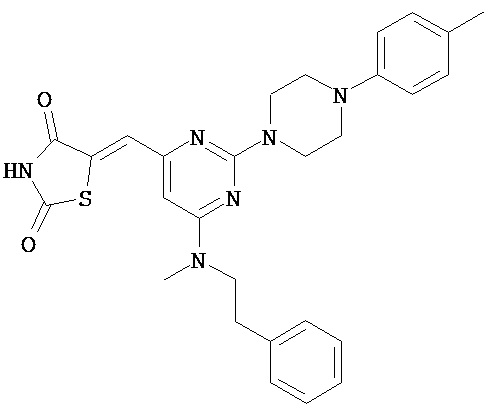 ,
,
 ,
, 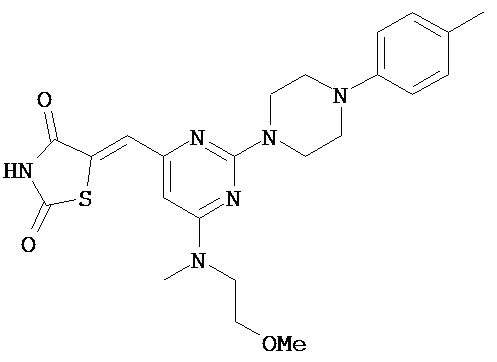 ,
,
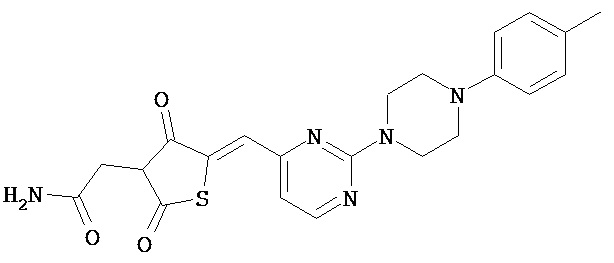 ,
, 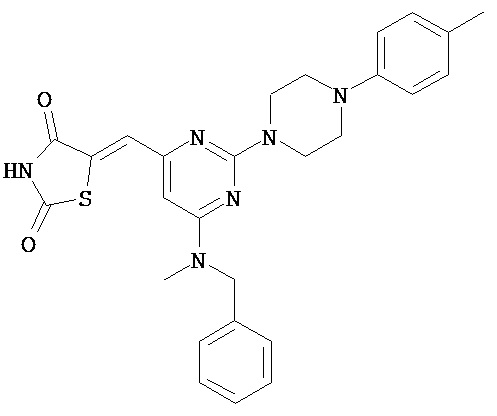 и
и
 .
.
Аспект изобретения относится к соединению, или его фармацевтически приемлемой соли, выбранному из группы, состоящей из:
 ,
,  ,
,
 ,
, 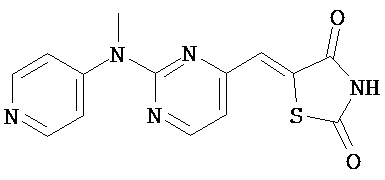 ,
,
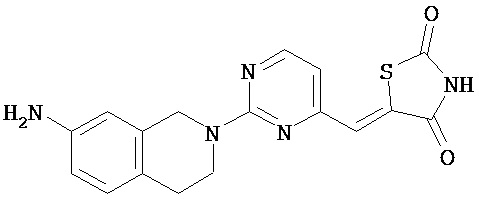 ,
, 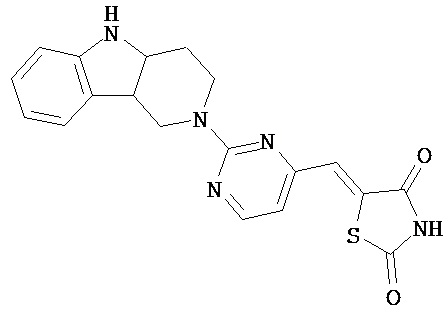 ,
,
 ,
,  ,
,
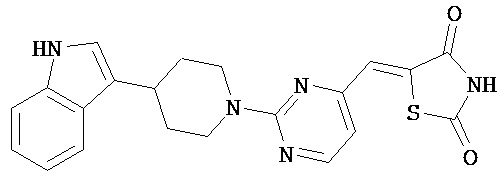 ,
, 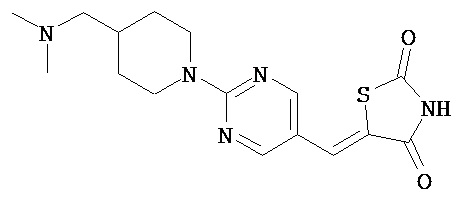 ,
,
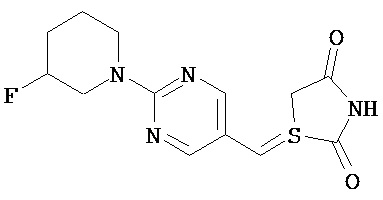 ,
, 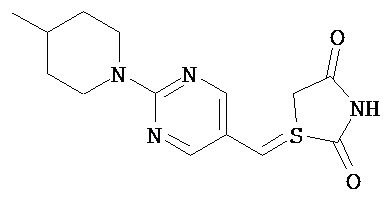 ,
,
 ,
, 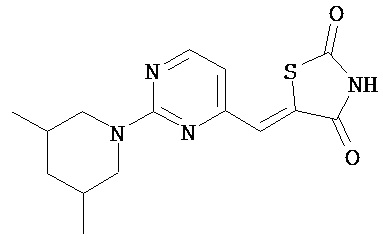 ,
,
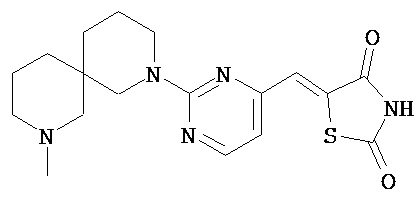 ,
,  ,
,
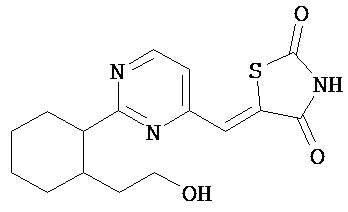 ,
, 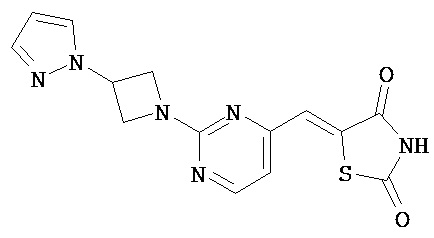 ,
,
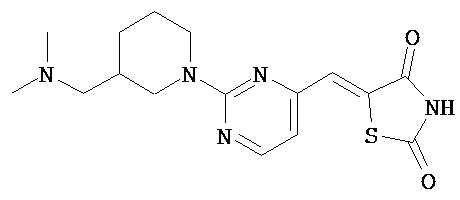 ,
, 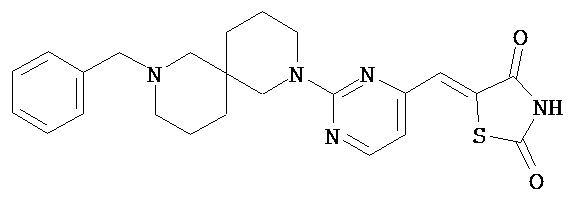 ,
,
 ,
,  ,
,
 ,
,  ,
, 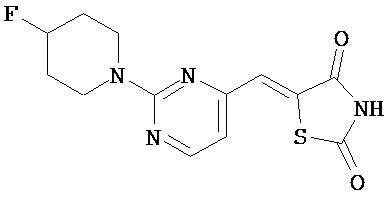 ,
,
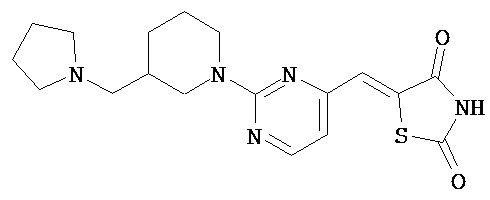 ,
,  ,
,
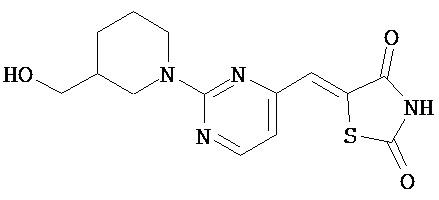
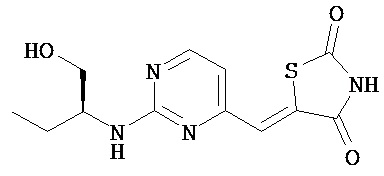 ,
, 
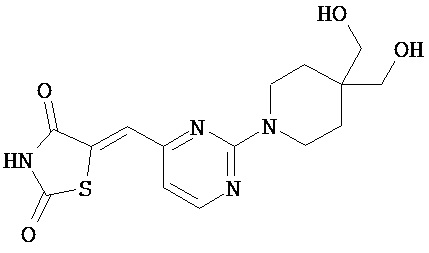 ,
,  ,
,
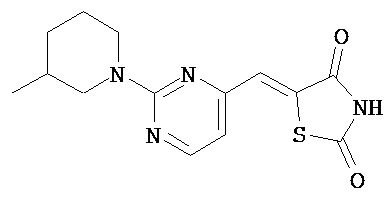 ,
, 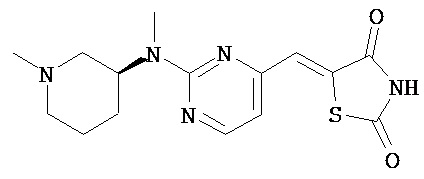 ,
, 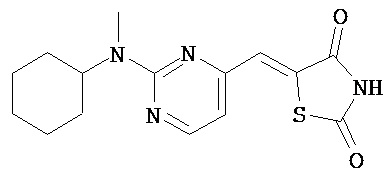 ,
,
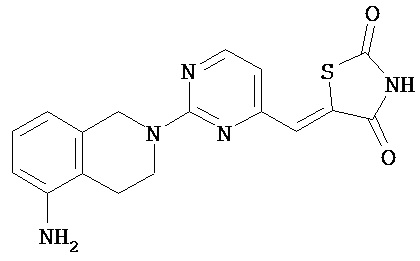 ,
, 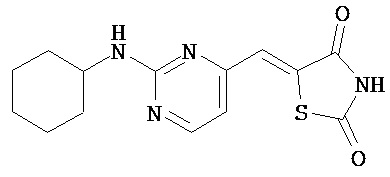 ,
,
 ,
, 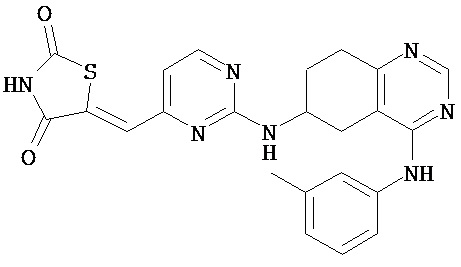 ,
,
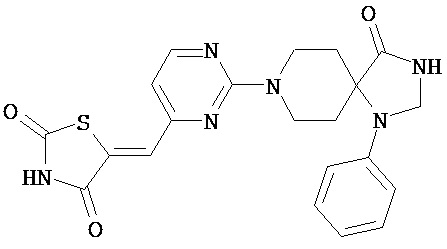 ,
,  ,
,
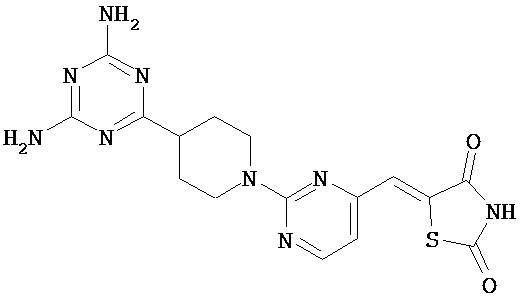 ,
,  ,
,
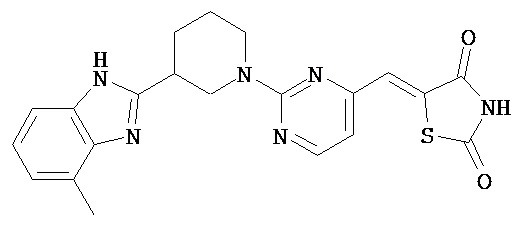 ,
,  ,
,
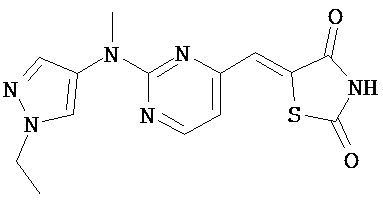 ,
, 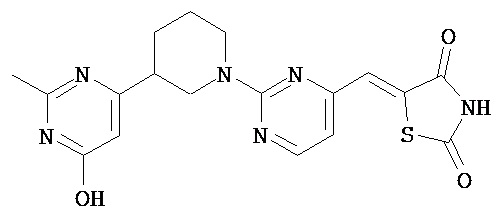 ,
,
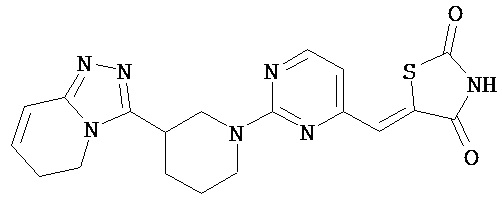 ,
, 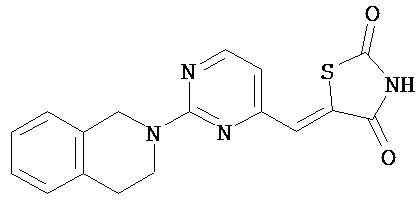 ,
,
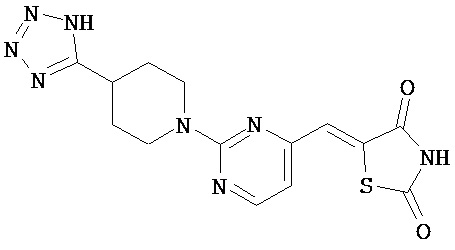 ,
, 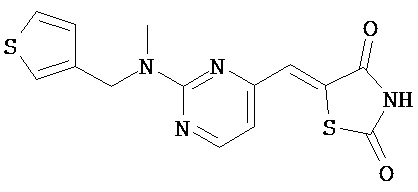 ,
,
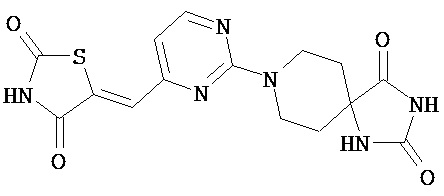 ,
,  ,
,
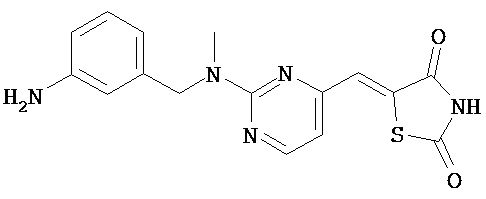 ,
,  ,
,
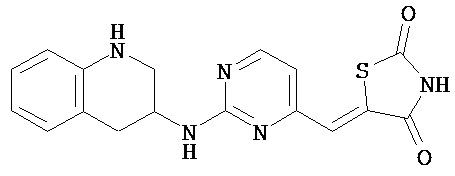 ,
,  ,
,
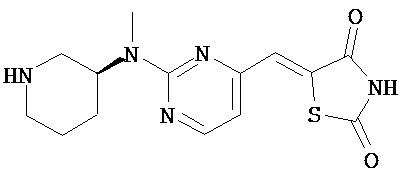 ,
, 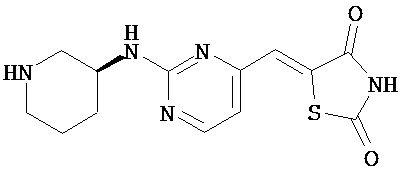 ,
,
 ,
, 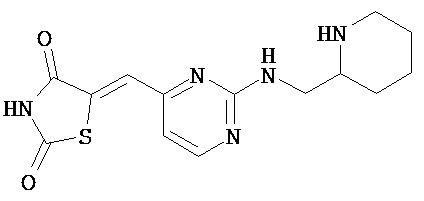 ,
,
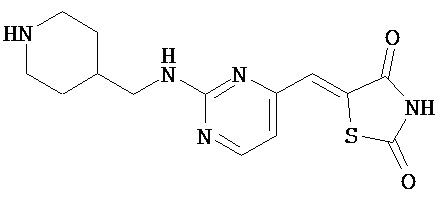 ,
, 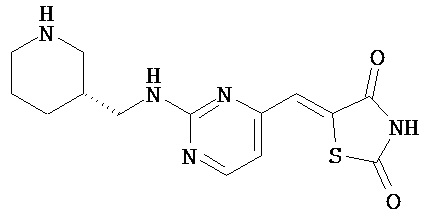 ,
,
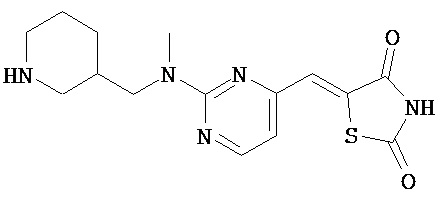 ,
, 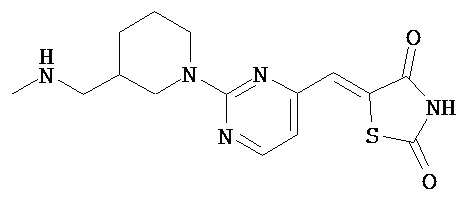 ,
,
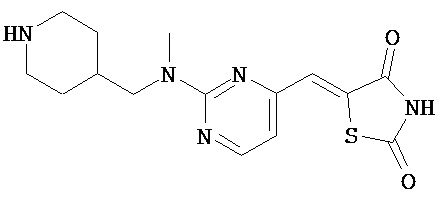 ,
, 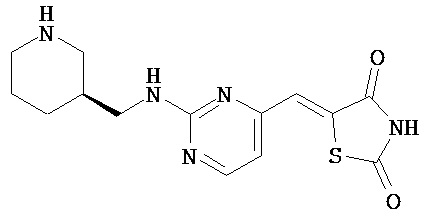 ,
,
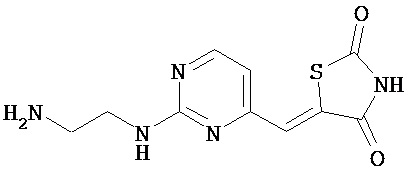 ,
,  ,
,  ,
,
 ,
, 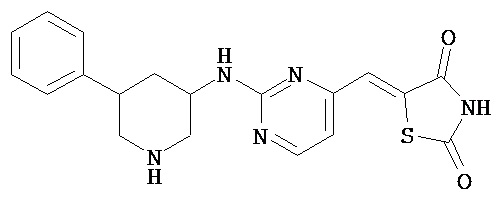 ,
,
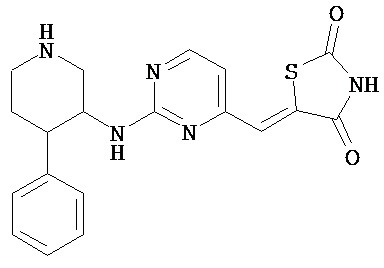 ,
, 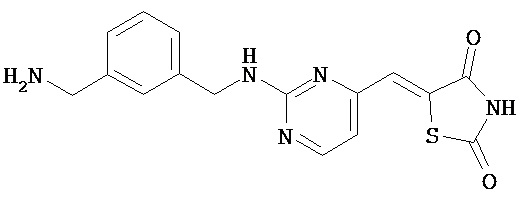 ,
,
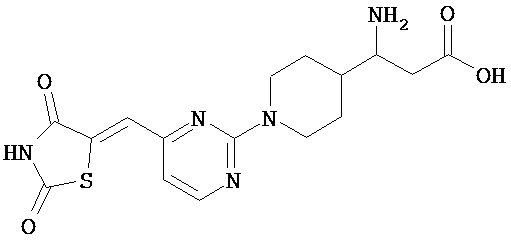 ,
, 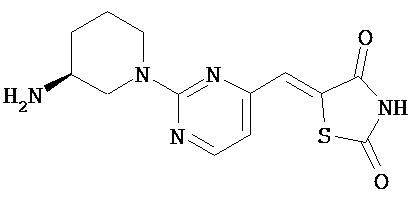 ,
,
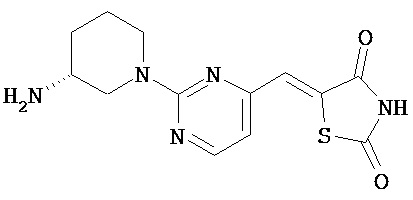 ,
, 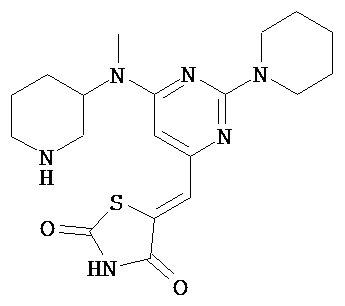 ,
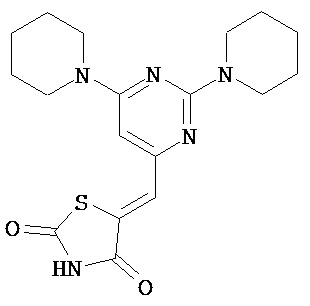
,  ,
,
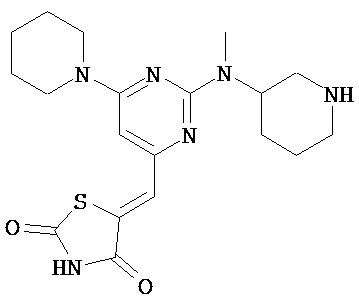
 ,
, 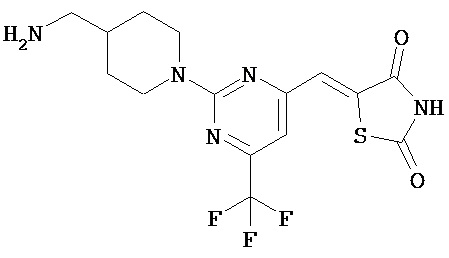 ,
,
 ,
, 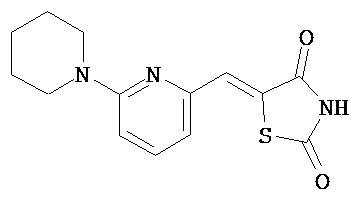 ,
,
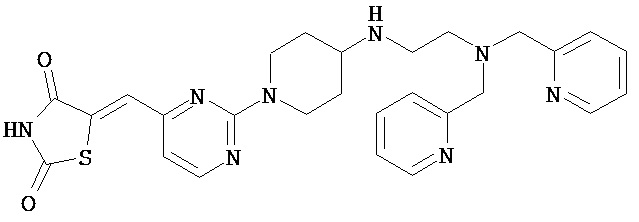 ,
, 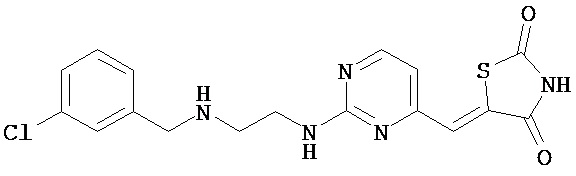 ,
,
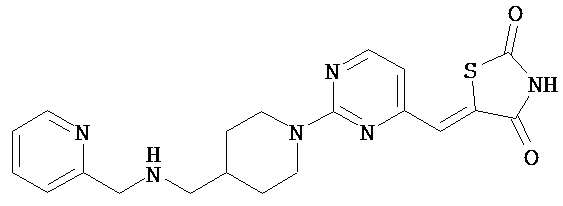 ,
,  ,
,
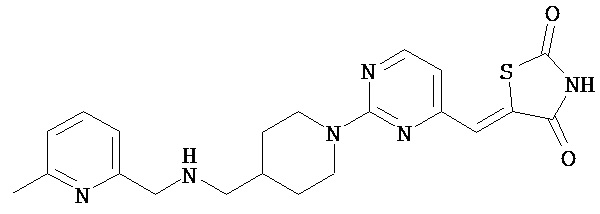 ,
, 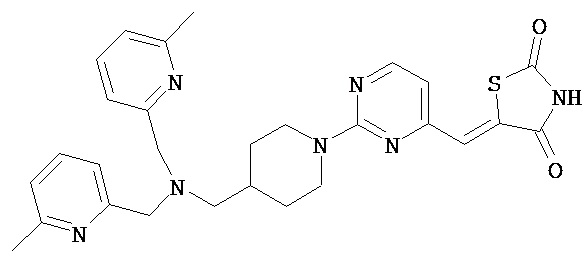 ,
,
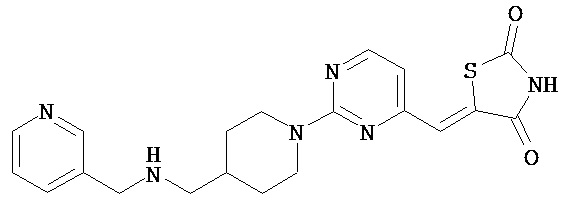 ,
,  ,
,
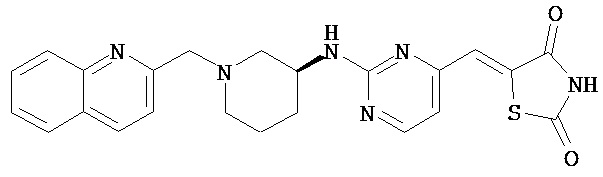 ,
, 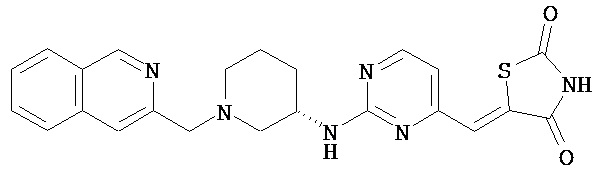 ,
,
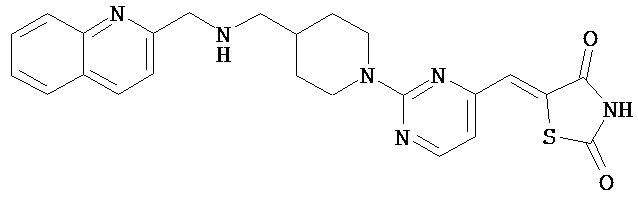 ,
,
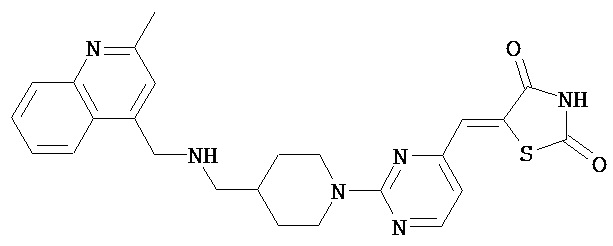 ,
, 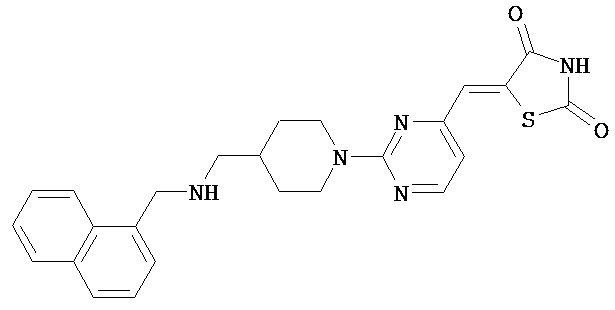 ,
,
 ,
,
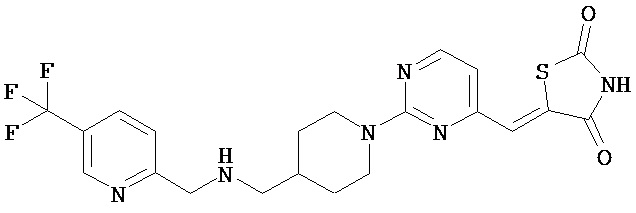 ,
,
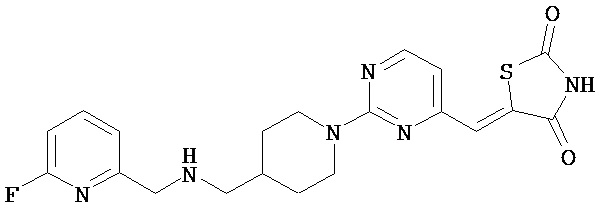 ,
,
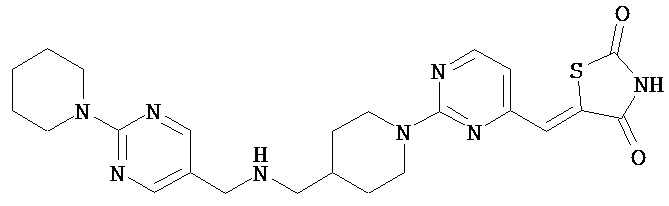 ,
,
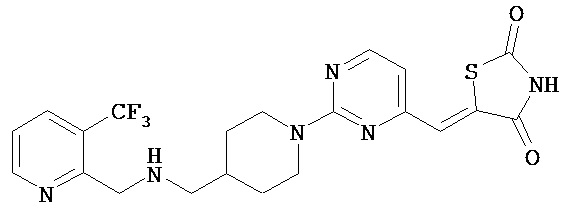 ,
,  ,
,
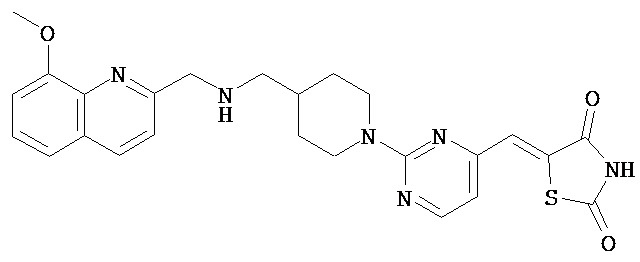 ,
,
 ,
,
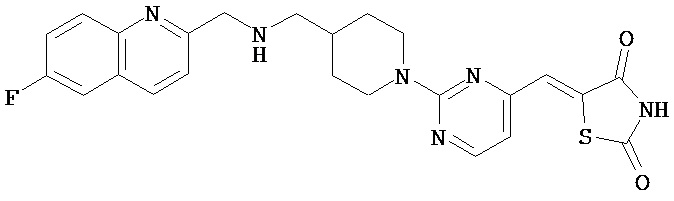 ,
,
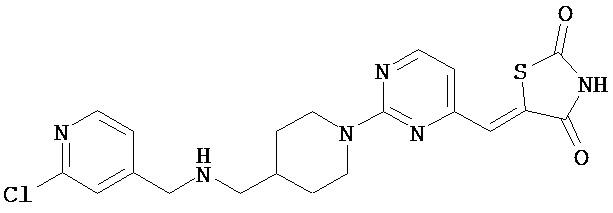 ,
,
 ,
,  ,
,
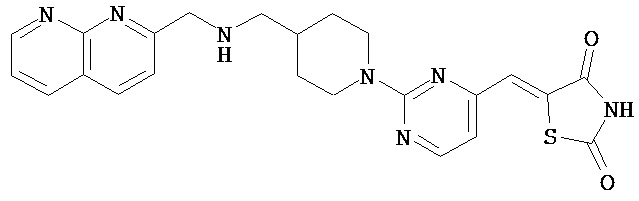 ,
,
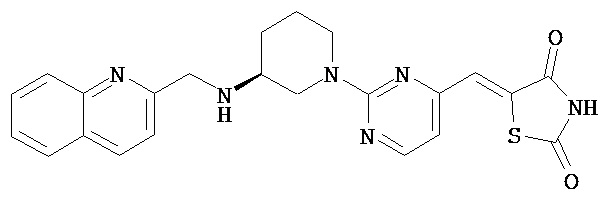 ,
,
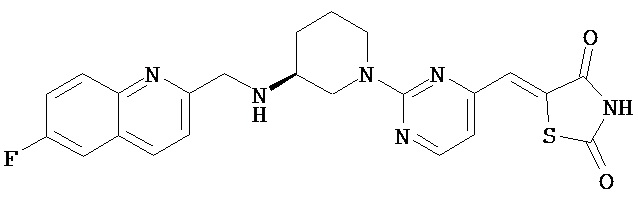 ,
,
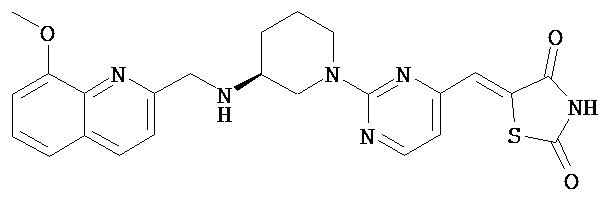 ,
,  ,
,
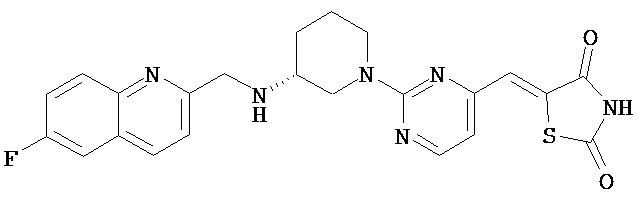 ,
,
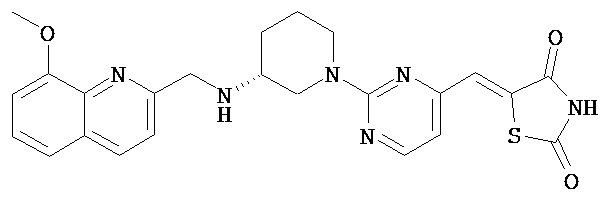 ,
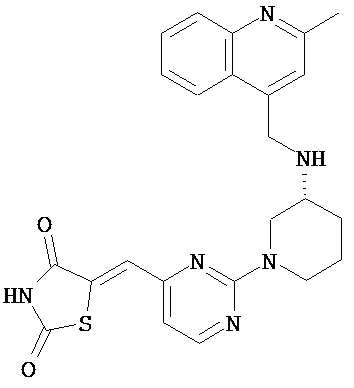
, 
 ,
, 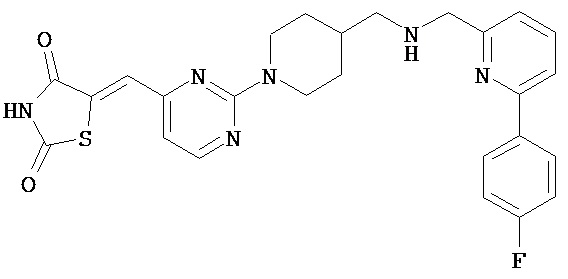 ,
,
 ,
, 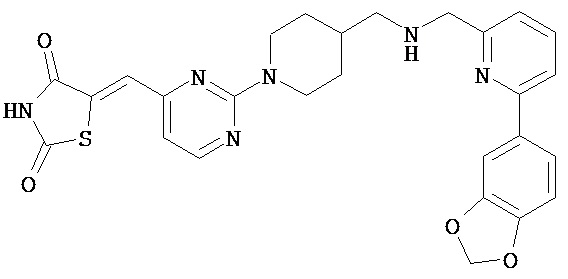 ,
,
 ,
,  ,
,
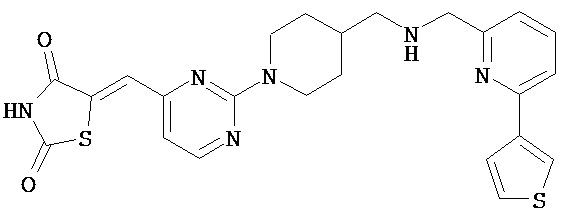 ,
, 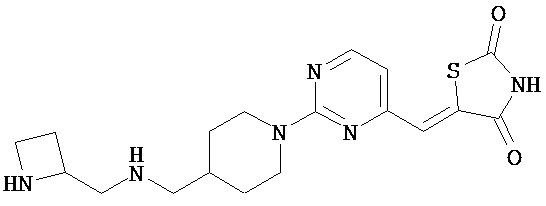 ,
,
 ,
,  ,
,
 ,
,  ,
,
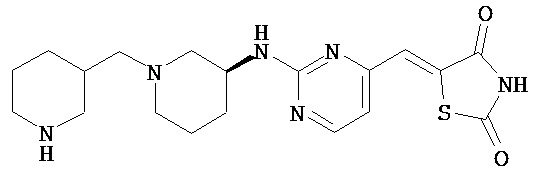 ,
,  ,
,
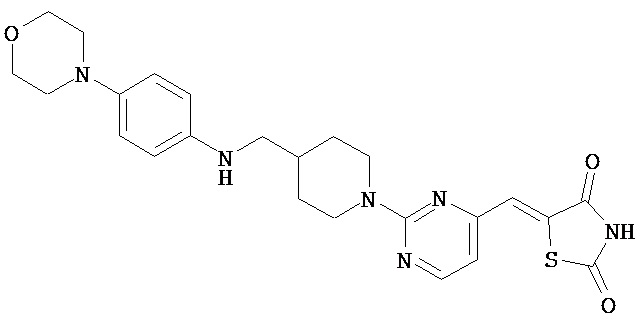 ,
,  ,
,
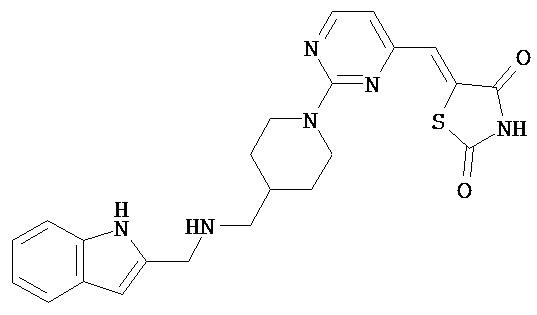 ,
, 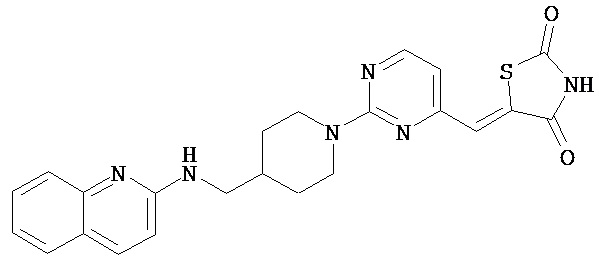 ,
,
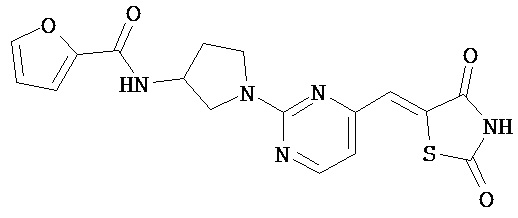 ,
, 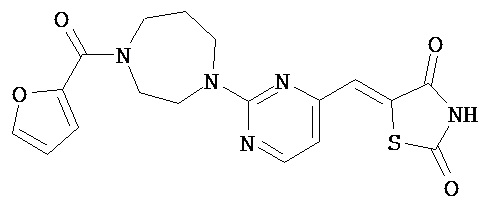 ,
,
 ,
, 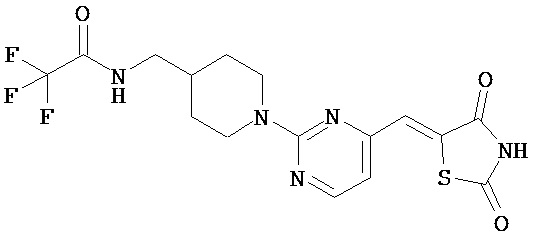 ,
,
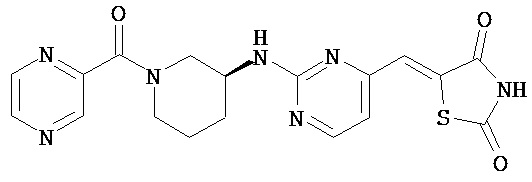 ,
,
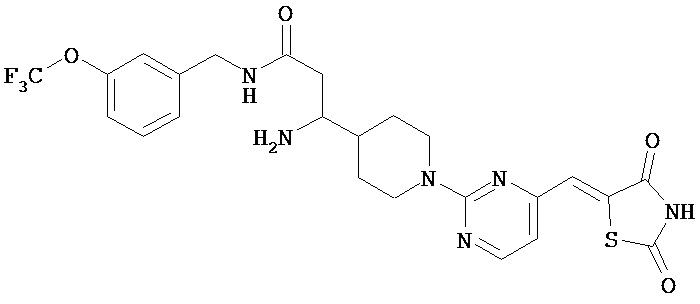 ,
,
 ,
,
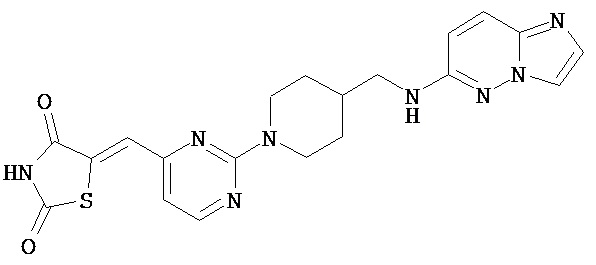 ,
, 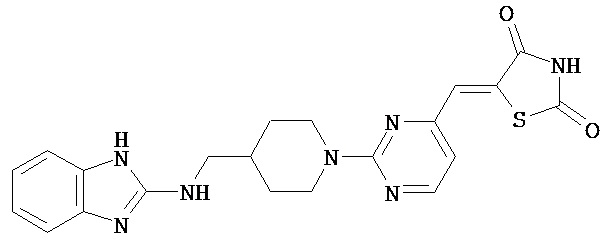 ,
,
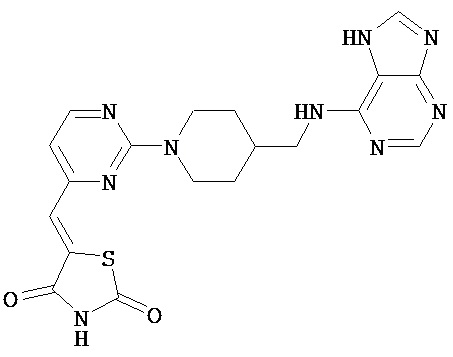 ,
, 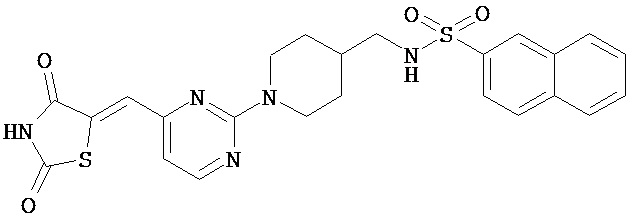 ,
,
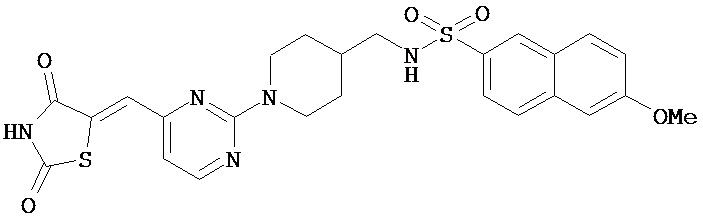 ,
,
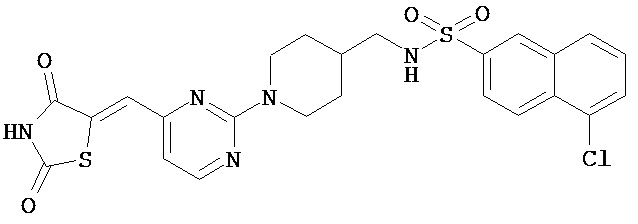 и
и
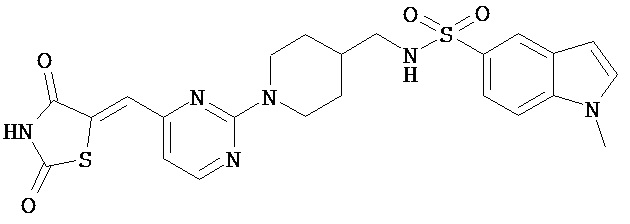 .
.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой ингибитор CK1, CK1γ1, CK1γ2 или CK1γ3. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 5000 нМ для CK1, CK1γ1, CK1γ2 или CK1γ3. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 1000 нМ для CK1, CK1γ1, CK1γ2, или CK1γ3. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 500 нМ для CK1, CK1γ1, CK1γ2 или CK1γ3.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой ингибитор CK2. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 5000 нМ для CK2. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 1000 нМ для CK2. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 500 нМ для CK2.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой ингибитор PIM1, PIM2 или PIM3. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 5000 нМ для PIM1, PIM2 или PIM3, Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 1000 нМ для PIM1, PIM2 или PIM3. Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 500 нМ для PIM1, PIM2 или PIM3.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой ингибитор пути Wnt.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой ингибитор пути TGFβ.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой ингибитор пути JAK/STAT.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой ингибитор пути mTOR.
Вариант реализации изобретения относится к любому из вышеуказанных соединений, где соединение представляет собой модулятор деградации Pgp, оттока лекарственного средства из клеток или лекарственной устойчивости.
Вариант реализации изобретения относится к фармацевтической композиции, содержащей любое из вышеуказанных соединений или их комбинацию и фармацевтически приемлемый носитель.
Согласно другому варианту реализации, изобретение относится к способу подавления активности CK1, включающему приведение во взаимодействие CK1, CK1γ1, CK1γ2, или CK1γ3 с любым из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу подавления активности CK2 включающему приведение во взаимодействие CK2 с любым из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения или предотвращения состояния, связанного с нарушенной активностью CK1, CK1γ1, CK1γ2 или CK1γ3, включающему введение млекопитающему, нуждающемуся в указанном введении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения или предотвращения состояния, связанного с нарушенной активностью CK2, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения рака, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций. Согласно одному варианту реализации изобретения, рак представляет собой рак системы, выбранной из группы, состоящей из кроветворной системы, иммунной системы, эндокринной системы, дыхательной системы, желудочно-кишечного тракта, скелетно-мышечной системы, репродуктивной системы, центральной нервной системы и мочевой системы. Согласно одному варианту реализации изобретения, рак расположен в миелоидной ткани, лимфоидной ткани, ткани поджелудочной железы, ткани щитовидной железы, легочной ткани, ткани толстой кишки, ткани прямой кишки, ткани анального канала, ткани печени, в коже, в костях, ткани яичника, ткани матки, ткани шейки матки, молочной железы, предстательной железы, ткани яичек, ткани мозга, ствола мозга, ткани мозговых оболочек, почке или мочевой пузыре млекопитающего. Согласно одному варианту реализации изобретения рак выбран из группы, состоящей из рака молочной железы, рака толстой кишки, множественной миеломы, рака предстательной железы, ходжкинской лимфомы, неходжкинской лимфомы, лейкемии, гематологической злокачественной опухоли, почечно-клеточной карциномы, рака почек, злокачественной меланомы, рака поджелудочной железы, рака легких, рака толстой и прямой кишки, рака мозга, рака головы и шеи, рака мочевого пузыря, рака щитовидной железы, рака яичника, рака шейки матки и миелодиспластического синдрома.
Согласно другому варианту реализации, изобретение относится к способу лечения лейкемии или других гематологических злокачественных опухолей, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения болезни Альцгеймера, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения Wnt-зависимого заболевания, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения TGFβ-зависимого заболевания, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения JAK/STAT-зависимого заболевания, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения mTOR-зависимого заболевания, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения или предотвращения воспаления, воспалительных заболеваний (например, остеоартрита и ревматоидного артрита), неврологических состояний (например, болезни Альцгеймера) и нейродегенерации, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения или предотвращения связанных с костной тканью заболеваний и состояний, включая остеопороз и костеобразование, или ускорение восстановлении костной ткани, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения или предотвращения гипогликемии, метаболического синдром и диабета, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу регуляции апоптоза (например, повышения скорости апоптоза раковых клеток), включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения или предотвращения нарушенной эмбрионального развития, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу подавления активности PIM, включающему приведение во взаимодействие PIM1, PIM2 или PIM3 с любым из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения или предотвращения состояния, связанного с нарушенной активностью PIM, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу модулирования деградации Pgp и/или оттока лекарственного средства из клеток, включающему приведение во взаимодействие клеток с любым из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации изобретение относится к способу лечения злокачественной опухоли, основанному на модуляции Pgp, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций.
Согласно другому варианту реализации, изобретение относится к способу лечения злокачественной опухоли, основанному на модуляции Pgp, включающему введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества любого из вышеуказанных соединений или фармацевтических композиций, в сочетании с другим лекарственным средством, соединением или материалом, для устранения устойчивости к указанному лекарственному средству, соединению или материалу.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 4981.
На Фигуре 2 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 4981.
На Фигуре 3 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 4981.
На Фигуре 4 показана относительная активность CK1δ(h) в виде функции концентрации соединения 4981.
На Фигуре 5 показана относительная активность CK1(y) в виде функции концентрации соединения 4981.
На Фигуре 6 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 4993.
На Фигуре 7 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 4993.
На Фигуре 8 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 4993.
На Фигуре 9 показана относительная активность CK1δ(h) в виде функции концентрации соединения 4993.
На Фигуре 10 показана относительная активность CK1(y) в виде функции концентрации соединения 4993.
На Фигуре 11 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 4991.
На Фигуре 12 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 4991.
На Фигуре 13 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 4991.
На Фигуре 14 показана относительная активность CK1δ(h) в виде функции концентрации соединения 4991.
На Фигуре 15 показана относительная активность CK1(y) в виде функции концентрации соединения 4991.
На Фигуре 16 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 4999.
На Фигуре 17 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 4999.
На Фигуре 18 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 4999.
На Фигуре 19 показана относительная активность CK1δ(h) в виде функции концентрации соединения 4999.
На Фигуре 20 показана относительная активность CK1(y) в виде функции концентрации соединения 4999.
На Фигуре 21 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 4985.
На Фигуре 22 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 4985.
На Фигуре 23 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 4985.
На Фигуре 24 показана относительная активность CK1δ(h) в виде функции концентрации соединения 4985.
На Фигуре 25 показана относительная активность CK1(y) в виде функции концентрации соединения 4985.
На Фигуре 26 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 4992.
На Фигуре 27 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 4992.
На Фигуре 28 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 4992.
На Фигуре 29 показана относительная активность CK1δ(h) в виде функции концентрации соединения 4992.
На Фигуре 30 показана относительная активность CK1(y) в виде функции концентрации соединения 4992.
На Фигуре 31 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 4996.
На Фигуре 32 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 4996.
На Фигуре 33 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 4996.
На Фигуре 34 показана относительная активность CK1δ(h) в виде функции концентрации соединения 4996.
На Фигуре 35 показана относительная активность CK1(y) в виде функции концентрации соединения 4996.
На Фигуре 36 показана относительная активность CK1γ1(h) в виде функции концентрации соединения 5000.
На Фигуре 37 показана относительная активность CK1γ2(h) в виде функции концентрации соединения 5000.
На Фигуре 38 показана относительная активность CK1γ3(h) в виде функции концентрации соединения 5000.
На Фигуре 39 показана относительная активность CK1δ(h) в виде функции концентрации соединения 5000.
На Фигуре 40 показана относительная активность CK1(y) в виде функции концентрации соединения 5000.
На Фигуре 41 показана кривая зависимости эффекта от дозы и EC50 гемцитабина для клеток РС-3 (данные использовали в качестве контроля эксперимента).
На Фигуре 42 показана кривая зависимости эффекта от дозы и EC50 гемцитабина для клеток OVCAR-3 (данные использовали в качестве контроля эксперимента).
На Фигуре 43 показана кривая зависимости эффекта от дозы и EC50 гемцитабина для клеток LNCaP (данные использовали в качестве контроля эксперимента).
На Фигуре 44 показана кривая зависимости эффекта от дозы и EC50 гемцитабина для клеток Jurkat (данные использовали в качестве контроля эксперимента).
На Фигуре 45 показана кривая зависимости эффекта от дозы и EC50 гемцитабина для клеток MDA-MB-468 клетки (данные использовали в качестве контроля эксперимента).
На Фигуре 46 показана кривая зависимости эффекта от дозы и IC50 гемцитабина для клеток НСТ116 (данные использовали в качестве контроля эксперимента).
На Фигуре 47 показана кривая зависимости эффекта от дозы и IC50 гемцитабина для клеток А549 (данные использовали в качестве контроля эксперимента).
На Фигуре 48 показана кривая зависимости эффекта от дозы и IC50 гемцитабина для клеток DU145 (данные использовали в качестве контроля эксперимента).
На Фигуре 49 показана кривая зависимости эффекта от дозы и IC50 сорафениба для клеток НС 1954 (данные использовали в качестве контроля эксперимента).
На Фигуре 50 показана кривая зависимости эффекта от дозы и EC50 сорафениба для клеток Сасо-2 (данные использовали в качестве контроля эксперимента).
На Фигуре 51 показана кривая зависимости эффекта от дозы и IC50 соединения 4991 для клеток OVCAR- по сравнению с цисплатином.
На Фигуре 52 показана кривая зависимости эффекта от дозы и IC50 соединения 4991 для клеток OVCAR-8 по сравнению с цисплатином.
На Фигуре 53 показана кривая зависимости эффекта от дозы и IC50 соединения 4991 для клеток SK-OV-3 по сравнению с цисплатином.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Определения терминов, используемых в настоящей заявке, включают признанные определения для каждого термина согласно существующему уровню техники в области химии и фармацевтики. В подходящих случаях представлены иллюстрации. Определения относятся к терминам при их использовании на всем протяжении настоящей заявки либо отдельно, либо в качестве части большей группы, если иное не указано в конкретных примерах.
Если стереохимичекие данные специально не указаны, все стереооизомеры соединений согласно изобретению включены в объем изобретения как в виде чистых соединений, так и в виде их смесей. Если иное не указано, отдельные энантиомеры, диастереомеры, геометрические изомеры, их комбинации и их смеси также включены в настоящее изобретение. Полиморфные кристаллические формы и сольваты также включены в объем настоящего изобретения.
При использовании в настоящей заявке, термин «выделенный» в сочетании с соединением согласно настоящему изобретению означает, что указанное соединение находится вне клетки или вне организма, и что указанное соединение отделено от нескольких или всех компонентов, окружающих его в естественных условиях.
При использовании в настоящей заявке, термин «чистый» в сочетании с выделенным образцом соединения согласно настоящему изобретению означает, что выделенный образец содержит по меньшей мере 60 масс. % соединения. Предпочтительно, выделенный образец содержит по меньшей мере 70 масс. % соединения. Более предпочтительно, выделенный образец содержит по меньшей мере 80 масс. % соединения. Более предпочтительно, выделенный образец содержит по меньшей мере 90 масс. % соединения. Наиболее предпочтительно, выделенный образец содержит по меньшей мере 95 масс. % соединения. Чистоту выделенного образца соединения согласно настоящему изобретению можно оценить с помощью нескольких способов или их комбинаций; например, с помощью тонкослойной, препаративной или флэш-хроматографии, масс-спектрометрии, ВЭЖХ, ЯМР-анализа и т.д.
Термин «гетероатом» является принятым в данной области техники и относится к атому любого элемента, отличному от атома углерода или водорода. Примеры гетероатомов включают атом бора, азота, кислорода, фосфора, серы и селена.
Термин «алкил» является принятым в данной области техники и включает насыщенные алифатические группы, включая алькильные группы с прямой цепью, алькильные группы с разветвленной цепью, циклоалкильные (алициклические) группы, циклоалькильные группы, содержащие в качестве заместителя алкил, и алькильные группы, содержащие в качестве заместителя циклоалкил. Согласно конкретным вариантам реализации изобретения, алкил с прямой или разветвленной цепью содержит примерно 30, или меньше, атомов углерода в скелете (например, C1-C30 для алкила с прямой цепью и C3-C30 для алкила с разветвленной цепью), альтернативно, примерно 20, или меньше, атомов углерода Подобным образом, циклоалкилы содержат от примерно 3 до примерно 10 атомов углерода в своей кольцевой структуре, альтернативно, содержат примерно 5, 6 или 7 атомов углерода в своей кольцевой структуре.
Если количество атомов углерода специально не указано, "низший алкил" относится к алькильной группе, определенной выше, содержащей от одного до примерно десяти атомов углерода, альтернативно, от одного до примерно шести атомов углерода в структуре скелета. Подобным образом, «низший алкенил» и "низший алкинил" имеют такую же длину цепи.
Термин «аралкил» является принятым в данной области техники и относится к алкильной группе, содержащей в качестве заместителя арильную группу (например, ароматическую или гетероароматическую группу).
Термины «алкенил» и «алкинил» являются принятыми в данной области техники и относятся к ненасыщенным алифатическим группам, аналогичным по длине цепи и возможным заместителям алкилам, описанным выше, содержащим по меньшей мере одну двойную или тройную связь, соответственно.
Термин «арил» является принятым в данной области техники и относится к 5-, 6- и 7-членным однокольцевым ароматическим группам, которые могут содержать от нуля до четырех гетероатомов, таким как бензол, нафталин, антрацен, пирен, пиррол, фуран, тиофен, имидазол, оксазол, тиазол, триазол, пиразол, пиридин, пиразин, пиридазин и пиримидин и т.д. Указанные арильный группы, содержащие гетероатомы в кольцевой структуре, могут также называться «арильными гетероциклами» или «гетероароматическими группами». Ароматическое кольцо может содержать в одном или более положениях кольца такие заместители, как описанные выше заместители, например, галоген, азид, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, алкоксил, амино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, эфир, алкилатио, сульфонил, сульфонамидо, кетон, альдегид, сложный эфир, гетероцикл, ароматические или гетероароматические фрагменты, -CF3, -CN или т.д. Термин "арил" также включает полициклические системы колец, содержащие два или более циклических колец, в которых два или более атомов углерода являются общими для двух соединенных колец (кольца представляют собой "конденсированные кольца"), где по меньшей мере одно из колец является ароматическим, например, разные циклические кольца могут представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы, арилы и/или гетероциклы.
Термины «орто», «мета» и «пара» являются принятыми в данной области техники и относятся к 1,2-, 1,3- и 1,4-дизамещенным бензолам, соответственно. Например, названия 1,2-диметилбензол и орто-диметилбензол являются синонимами.
Термины «гетероциклил», «гетероарил» или «гетероциклическая группа» являются принятыми в данной области техники и относятся к от 3- до примерно 10-членным кольцевым структурам, альтернативно, от 3- до примерно 7-членным кольцам, структуры которых включают от одного до четырех гетероатомов. Гетероциклы также могут представлять собой полициклы. Гетероциклические группы включают, например, тиофен, тиантрен, фуран, пиран, изобензофуран, хромен, ксантен, феноксантен, пиррол, имидазол, пиразол, изотиазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, пиримидин, фенантролин, феназин, фенарсазин, фенотиазин, пиперонил, фуразан, феноксазин, пирролидин, оксолан, тиолан, оксазол, пиперидин, пиперазин, морфолин, лактоны, лактамы, такие как азетидиноны и пирролидиноны, сультамы, сультоны и т.д. Гетероциклическое кольцо может содержать в одноме или более положениях такие заместители, как описанные выше заместители, например, такие как галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, эфир, алкилатио, сульфонила, кетон, альдегид, сложный эфир, гетероцикл, ароматический или гетероароматический фрагмент, -CF3, -CN и т.д.
Термин «необязательно замещенный» относится к химической группе, такой как алкил, циклоалкил, арил и т.д., где один или более атомов водорода могут быть замещены заместителем, описанным в настоящей заявке, включая, но не ограничиваясь указанными, галоген, азид, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, алкоксил, амино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, эфир, алкилатио, сульфонил, сульфонамидо, кетон, альдегид, сложный эфир, гетероцикл, ароматические или гетероароматические фрагменты, -CF3, -CN и т.д.
Термины «полициклил» или «полициклическая группа» являются принятыми в данной области техники и относятся к двум или более кольцам (например, циклоалкилам, циклоалкенилам, циклоалкинилам, арилам и/или гетероциклилам), в которых два или более атомов углерода являются общими для двух соединенных колец, например, кольца представляют собой «конденсированные кольца». Кольца, которые соединяются через не смежные атомы, называются кольцами «с мостиком». Каждое из колец полицикла может содержать такие заместители, как описанные выше заместители, например, галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонила, карбоксила, силил, эфир, алкилатио, сульфонила, кетон, альдегид, сложный эфир, гетероцикл, ароматический или гетероароматический фрагмент, -CF3, -CN и т.д.
Термин «карбоцикл» является принятым в данной области техники и относится к ароматическому или не ароматическому кольцу, в котором каждый атом кольца представляет собой углерод.
Термин «нитро» является принятым в данной области техники и относится к -NO2; термин «галоген» является принятым в данной области техники и относится к -F, -Cl, -Br или -I; термин «сульфгидрил» является принятым в данной области техники и относится к -SH; термин «гидроксил» означает -ОН; и термин «сульфонил» является принятым в данной области техники и относится к -SO2-. «Галид» означает соответствующий анион галогенов и «псевдогалид» имеет определение, представленное в источнике Advanced Inorganic Chemistry, Cotton and Wilkinson, 560.
Термины «амин» и «амино» являются принятыми в данной области техники и относятся как к незамещенным, так и к замещенным аминам, например, фрагменту, который может быть представлен общими формулами:

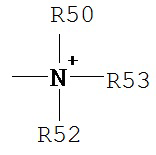
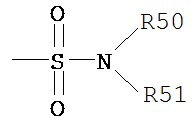
где каждый из R50, R51 и R52 независимо представляет собой водород, алкил, алкенил, -(CH2)m-R61, или R50 и R51 вместе с атомом, к которому они присоединены, образуют гетероцикл, содержащий от 4 до 8 атомов в структуре кольца; R61 представляет собой арил, циклоалкил, циклоалкенил, гетероцикл или полицикл; и m равен нулю или целому числу от 1 до 8. Согласно другим вариантам реализации изобретения, каждый из R50 и R51 (и необязательно R52) независимо представляет собой водород, алкил, алкенил или -(CH2)m-R61. Таким образом, термин «алкиламин» включает аминную группу, определенную выше, содержащую присоединенный к ней замещенный или незамещенный алкил, т.е., по меньшей мере один из R50 и R51 представляет собой алькильную группу.
Термин «ациламино» является принятым в данной области техники и относится к фрагменту, который может быть представлен общей формулой:
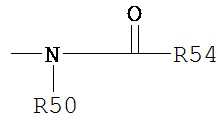
где R50 является таким, как определено выше, и R54 представляет собой водород, алкил, алкенил или -(CH2)m-R61, где т и R61 определены выше.
Термин «амидо» является принятыми в данной области техники для карбонила, содержащего в качестве заместителя амино, и включает фрагмент, который может быть представлен общей формулой:
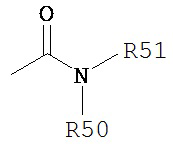
где R50 и R51 определены выше. Конкретные варианты реализации амида согласно настоящему изобретению не включают имиды, которые могут являться не подходящими.
Термин «алкилтио» относится к алкильной группе, определенной выше, содержащей присоединенный к ней серный радикал. Согласно конкретным вариантам реализации изобретения, фрагмент «алкилатио» представлен одним из -S-алкила, -S-алкенила, -S-алкинила и -S-(CH2)m-R61, где m и R61 определены выше. Типичные алкилтиогруппы включают метилтио, этилтио и т.д.
Термин «карбоксил» является принятым в данной области техники и включает такие фрагменты, которые могут быть представлены общими формулами:
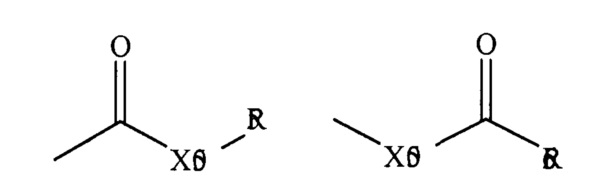
где Х50 представляет собой связь или кислород или серу, и R55 и R56 представляют собой водород, алкил, алкенил, -(CH2)m-R61 или фармацевтически приемлемую соль, R56 представляет собой водород, алкил, алкенил или -(CH2)m-R61, где m и R61 определены выше. Если Х50 представляет собой кислород, и R55 или R56 не представляют собой водород, формула относится к «сложному эфиру». Если Х50 представляет собой кислород, и R55 определен выше, в настоящей заявке фрагмент называется карбоксильной группой, и, в частности, если R55 представляет собой водород, формула относится к «карбоновой кислоте». Если Х50 представляет собой кислород, и R56 представляет собой водород, формула относится к «формату». В целом, если атом кислорода представленной выше формулы замещен атомом серы, формула относится к «тиолкарбонильной» группе. Если Х50 представляет собой серу, и R55 или R56 представляют собой не водород, формула относится к «сложному тиолэфиру». Если Х50 представляет собой серу, и R55 представляет собой водород, формула относится к «тиолкарбоновой кислоте». Если Х50 представляет собой серу, и R56 представляет собой водород, формула относится к «тиолформату». С другой стороны, если Х50 представляет собой связь, и R55 представляет собой не водород, приведенная выше формула относится к «кетоновой» группе. Если Х50 представляет собой связь, и R55 представляет собой водород, приведенная выше формула относится к «альдегидной» группе.
Термин «карбамоил» относится к -O(C=O)NRR’, где R и R’ независимо представляют собой Н, алифатическую группу, арильную группу или гетероарильную группу.
Термин «оксо» относится к кислороду карбонила (=O).
Термины «оксим» и «оксимэфир» являются принятыми в данной области техники и относятся к фрагментам, которые могут быть представлены общей формулой:
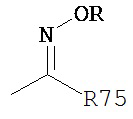
где R75 представляет собой водород, алкил, циклоалкил, алкенил, алкинил, арил, аралкил или -(CH2)m-R61. Фрагмент представляет собой «оксим», когда R представляет собой Н; и указанный фрагмент представляет собой «оксимэфир», когда R представляет собой алкил, циклоалкил, алкенил, алкинил, арил, аралкил или -(CH2)m-R61.
Термины «алкоксил» или «алкокси» являются принятыми в данной области техники и относятся к алькильной группе, определенной выше, содержащей присоединенный к ней кислородный радикал. Примеры алкоксильных групп включают метокси, этокси, пропилокси, трет-бутокси и т.д. «Эфир» представляет собой два атома углерода, ковалентно связанных кислородом. Соответственно, заместитель алкила, который предоставляет указанному алкилу эфирную группу, представляет собой или напоминает алкоксил, который может быть представлен оним из -O-алкила, -O-алкенила, -O-алкинила, -O-(CH2)m-R61, где m и R61 описаны выше.
Термин «сульфонат» является принятым в данной области техники и относится к фрагменту, который может быть представлен общей формулой:

в котором R57 представляет собой электронную пару, водород, алкил, циклоалкил или арил.
Термин «сульфат» является принятым в данной области техники и включает фрагмент, который может быть представлен общей формулой:
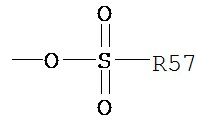
в котором R57 является таким, как определено выше.
Термин «сульфонамидо» является принятым в данной области техники и включает фрагмент, который может быть представлен общей формулой:
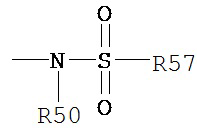 ,
,
в котором R50 и R56 определены выше.
Термин «сульфамоил» является принятым в данной области техники и относится к фрагменту, который может быть представлен общей формулой:
 ,
,
в котором R50 и R51 определены выше.
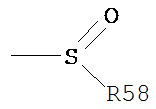
Термин «сульфонил» является принятым в данной области техники и относится к фрагменту, который может быть представлен общей формулой:

в котором R58 представляет собой один из следующих: водорода, алкила, алкенила, алкинила, циклоалкила, гетероциклила, арила или гетероарила.
Термин "сульфоксидо" является принятым в данной области техники и относится к фрагменту, который может быть представлен общей формулой:
в котором R58 определен выше.
Термин «фосфорил» является принятым в данной области техники и в целом может быть представлен формулой:
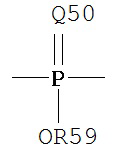
где Q50 представляет собой S или О, и R59 представляет собой водород, низший алкил или арил. При использовании в качестве заместителя, например, алкила, фосфорильная группа фосфорилалкила может быть представлена общими формулами:
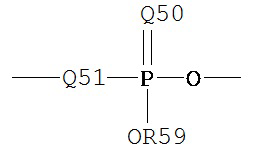
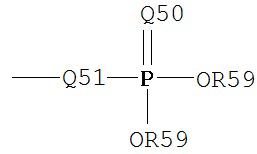
где каждый из Q50 и R59 независимо определены выше, и Q51 представляет собой О, S или N. Когда Q50 представляет собой S, фосфорильный фрагмент представляет собой «фосфоротиоат».
Термин «фосфорамидит» является принятым в данной области техники и может быть представлен общими формулами:
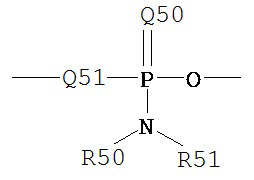
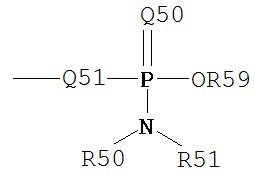 ,
,
где Q51, R50, R51 и R59 определены выше.
Термин «фосфонамидит» является принятым в данной области техники и может быть представлен общими формулами:

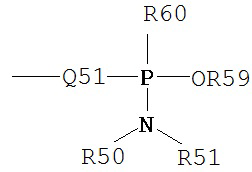
где Q51, R50, R51 и R59 определены выше, и R60 представляет собой низший алкил или арил.
Аналогичные замещения могут осуществляться в алкенильных и алкинильных группах для получения, например, аминоалкенилов, аминоалкинилов, амидоалкенилов, амидоалкинилов, иминоалкенилов, иминоалкинилов, тиоалкенилов, тиоалкинилов, карбонил-замещенных алкенилов или алкинилов.
Когда определение обозначения, например, алкила, m, n и т.д., встречается более одного раза в какой-либо структуре, каждое из указанных определений является независимым от определений указанного обозначения в любом другом месте той же структуры.
Термины трифлил, тозил, мезил и нонафлил являются принятыми в данной области техники и относятся к трифторметансульфонильным, n-толуолсульфонильным, метансульфонильным и нонафторбутансульфонильным группам, соответственно. Термины «трифлат», «тозтлат», «мезилат» и «нонафлат» являются принятыми в данной области техники и относятся к функциональным группам сложного эфира трифторметансульфоната, сложного эфира n-толуолсульфоната, сложного эфира метансульфоната и сложного эфира нонафторбутансульфоната и молекулам, которые содержат указанные группы, соответственно.
Аббревиатуры Me, Et, Ph, Tf, Nf, Ts и Ms обозначают метил, этил, фенил, трифторметансульфонил, нонафторбутансульфонил, n-толуолсульфонил и метансульфонил, соответственно. Более полный список аббревиатур, используемых специалистами в области органической химии, представлен в первом номере каждого тома журнала Journal of Organic Chemistry; указанный список, как правило, представлен в таблице под названием «Основной список аббревиатур».
Конкретные соединения, содержащиеся в композициях согласно настоящему изобретению, могут существовать в конкретных геометрических или стереоизомерных формах. Кроме того, полимеры согласно настоящему изобретению могут также являться оптически активными. Согласно настоящему изобретению предполагается, что все такие соединения, включая цис- и транс-изомеры, Е- и Z-изомеры, R- и S-энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, их рацемические и другие смеси, включены в объем изобретения. Дополнительные асимметрические атомы углерода могут присутствовать в заместителе, таком как алкильная группа. Все указанные изомеры, а также их смеси, включены в настоящее изобретение,
Если конкретный энанатиомер соединения согласно настоящему изобретению, например, является желаемым, он может быть получен с помощью асимметрического синтеза или с помощью взаимодействия с хиральным вспомогательным элементом, при котором полученную диастереомерную смесь разделяют и вспомогательную группу расщепляют с получением чистых желаемых энантиомеров. Альтернативно, если молекула содержит основную функциональную группу, такую как аминогруппа, или кислотную функциональную группу, такую как карбоксил, могут образовываться диастереомерные соли с соответствующей оптически активной кислотой или основанием с последующим разделением полученных таким образом диастереомеров с помощью методов фракционной кристаллизации или хроматографии, хорошо известных в данной области техники, и последующим восстановлением чистых энантиомеров.
Необходимо понимать, что термин «замещение» или «замещенный» подразумевает, что указанное замещение происходит в соответствии с разрешенными валентностями замещаемого атома и заместителя, и что результатом замещения является стабильно соединение, например, которое спонтанно не подвергается трансформации, например, перестройке, циклизации, элиминации или другим реакциям.
Термин «замещенный» включает все возможные заместители органических соединений. В широком смысле, возможные заместители включают ациклические и циклические, разветвленные и не разветвленные, карбоциклические и гетероциклические, ароматические и не ароматические заместители органических соединений. Типичные заместители включают, например, заместители, описанные выше в настоящей заявке. Может быть один или более возможных заместителей, которые могут быть одинаковыми или разными для соответствующих органических соединений. В целях настоящего изобретения, гетероатомы, такие как азот, могут иметь водородные заместители и/или любые возможные заместители органических соединений, описанных в настоящей заявке, которые удовлетворяют валентностям указанных гетероатомов. Предполагается, что настоящее изобретение не ограничивается возможными заместителями органических соединений.
Фраза «защитная группа» при использовании в настоящей заявке относится к временным заместителям, которые защищают потенциально реактивную функциональную группу от нежелательных химических превращений. Примеры указанных защитных групп включают сложные эфиры карбоновых кислот, силилэфиры спиртов и ацетали и кетали альдегидов и кетонов, соответственно. Примеры защитных групп для азота включают амид (-NRC(=O)R) или уретан (-NRC(=O)OR), такой как: метиламид (-NHC(=O)OCH3); бензилоксиамид (-NHC(=O)OCH2C6H5NCbz); ткой как, m-бутоксиамид (-NHC(=O)OC(CH3)3,-NHBoc); 2-бифенил-2-пропоксиамид (-NHC(-O)OC(CH3)2C6H4C6H5NHBoc), такой как, 9-флуоренилметоксиамид (-NHFmoc), такой как, 6-нитровератрилоксиамид (-NHNvoc), такой как, 2-триметилсилилэтилоксиамид (-NHTeoc), например, 2,2,2-трихлорэтилоксиамид (-NHTroc), такой как, аллилоксиамид (-NHAlloc), такой как, 2-(фенилсульфонил)этилоксиамид (-NHPsec); или в подходящих случаях (например, в случае циклических аминов), такой как нитроксидный радикал. Обзор в области химии защитных групп представлен в источнике Greene, T.W.; Wuts, P.G.M. Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991. Формы соединений согласно изобретению, содержащие защитные группы, включены в объем настоящего изобретения.
Термин «фармацевтически приемлемая соль» или «соль» относится к соли одного или более соединений. Подходящие фармацевтически приемлемые соли соединений включают соли присоединения кислоты, такие как соли, образованные с неорганическими кислотами, такими как соляная кислота и бромистоводородная кислота, а также соли, образованные с органическими кислотами, такими как малеиновая кислота. Например, кислоты, обычно используемые для получения фармацевтически приемлемых солей, включают неорганические кислоты, такие как бисульфид водорода, соляная, бромистоводородная, йодистоводородная, серная и фосфорная кислота, а также органические кислоты, такие как пара-толуолсульфоновая, салициловая, винная, бивинная, аскорбиновая, малеиновая, бензолсульфоновая, фумаровая, глюконовая, глюкуроновая, муравьиная, глутаминовая, метансульфоновая, этансульфоновая, бензолсульфоновая, молочная, щавелевая, иора-бромфенилсульфоновая, карбоновая, сукциновая, лимонная, бензойная и уксусная кислота, и родственные неорганические и органические кислоты. Указанные фармацевтически приемлемые соли, таким образом, включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моноводородафосфат, диводородафосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формат, изобутират, капрат, гептаноат, припиолат, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, бутан-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, β-гидроксибутират, гликолят, малеат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.д.
Если соединения содержат один или более кислотных фрагментов, фармацевтически приемлемые соли могут быть образованы посредством обработки раствора соединения раствором фармацевтически приемлемого основания. Подходящие основания для образования фармацевтически приемлемых солей с кислотными функциональными группами включают, но неограничиваются указанными, гидроксиды и карбонаты щелочных металлов, таких как натрий, калий и литий; щелочно-земельных металлов, таких как кальций и магний; и других металлов, таких как алюминий и цинк. Подходящие основания также включают аммоний и органические амины, такие как незамещенные амины или моно-, ди- или триалкиламины, содержащие в качестве заместителя гидрокси; дициклогексиламин; трибутиламин; пиридин; N-метил, N-этиламин; диэтиламин; триэтиламин; моно-, бис- или трис-(2-гидрокси-низшие алкиламины), такие как моно-, бис- или трис-(2-гидроксиэтил)амин, 2-гидрокси-трет-бутиламин или трис-(гидроксиметил)метиламин, N,N-диалкил-N-(гидроксиалкил)амины, такие как N,N-диметил-N-(2-гидроксиэтил)амин или три-(2-гидроксиэтил)амин; N-метил-D-глюкамин; и аминокислоты, такие как аргинин, лизин и т.д.
Конкретные соединения согласно изобретению и их соли могут существовать в более чем одной кристаллической форме (т.е. являться полиморфными); настоящее изобретние включает каждую из кристаллических форм и их смеси.
Конкретные соединения согласно изобретению и их соли могут также существовать в форме сольватов, например, гидратов, и настоящее изобретение включает каждый сольват и их смеси.
Конкретные соединения согласно изобретению могут иметь один или более хиральных центров и существовать в различных оптически активных формах. Когда соединения согласно изобретению содержат один хиральный центр, соединения могут существовать в двух энантиомерных формах, и настоящее изобретение включает как энантиомеры, так и смеси энантиомеров, например, рацемические смеси. Энантиомеры могут быть разделены с помощью способов, известных специалистам в данной области техники; например, энантиомеры могут быть разделены путем образования диастереоизомерных солей, которые могут быть разделены, например, путем кристаллизации; образования диастереоизомерных производных или комплексов, которые могут быть разделены, например, путем кристаллизации, газово-жидкостной или жидкостной хроматографии; селективной реакции одного энантиомера с энантиомер-специфичным реагентом, например, посредством ферментативной сложной этерификации; или газово-жидкостной или жидкостной хроматографии в хиральных условиях, например, на хиральной системе; подходящие условия включают хиральные системы (например, силикагель со связанным хиральным лигандом) или присутствие хирального растворителя. Если желаемый энантиомер превращается в другие химические соединения с помощью одного из способов разделения, описанных выше, то может использоваться дополнительный этап выделения очищенного желаемого энантиомера. Альтернативно, специфические энантиомеры можно синтезировать с помощью асимметрического синтеза с использованием оптически активных реагентов, веществ, катализаторов или растворителей или путем превращения одного энантиомера в другой путем асимметрической трансформации.
Когда соединение согласно изобретению имеет более одного хирального центра, оно может существовать в диастереомерных формах. Диастереомерные соединения могут быть разделены с помощью способов, известных специалистам в данной области техники (например, хроматографии или кристаллизации) и отдельные энантиомеры могут быть разделены, как описано выше. Настоящее изобретение включает различные диастереоизомеры соединений согласно изобретению и их смеси. Соединения согласно изобретению могут существовать в различных таутомерных формах или в виде различных геометрических изомеров, и настоящее изобретение включает каждый таутомер и/или геометрический изомер соединений согласно изобретению и их смеси. Например, любые олефины, присутствующие в соединениях, могут существовать в виде геометрических E-, Z-изомеров или их смеси, если иное не указано. Соединения согласно изобретению могут существовать в форме цвиттерионов. Настоящее изобретение включает каждую цвиттерионную форму соединений согласно изобретению и их смеси.
При использовании в настоящей заявке термин «пролекарство» относится к агенту, который превращается в исходное лекарственное средство in vivo в результате какого-либо физиологического химического процесса (например, пролекарство при помещении в физиологический pH превращается в желаемую форму лекарственного средства). Пролекарства часто являются применимыми, так как в некоторых случаях их введение может быть легче по сравнению с исходным лекарственным средством. Пролекарства могут, например, являться биодоступными при пероральном введении в отличие от исходного лекарственного средства. Пролекарство также может обладать лучшей растворимостью в фармакологической композиции по сравнению с исходным лекарственным средством. Неограничивающим примером пролекарств является соединение согласно настоящему изобретению, где указанное соединение вводится в виде сложного эфира («Пролекарства») для облегчения его прохождения через клеточную мембрану, когда растворимость в воде не желательна, который затем метаболическим путем гидролизуется с образованием карбоновой кислоты во внеклеточном пространстве, когда растворимость является желательной. Пролекарства обладают многими полезными свойствами. Например, пролекарство может обладать большей растворимостью в воде по сравнению с исходным лекарственным средством, что облегчает, таким образом, введение лекарственного средства. Пролекарство может также обладать более высокой биодоступностью при пероральном введении по сравнению с исходным лекарственным средством. После введения происходит ферментативное или химическое расщепление Пролекарства для доставки исходного лекарственного средства в кровь или ткани.
Примеры пролекарств высвобождают аминные соединения согласно изобретению, где свободный водород амина или спирта замещается (C1-C6)алканоилоксиметилом, 1-((C1-C6)алканоилокси)этилом, 1-метил-1-((C1-C6)алканоилокси)этилом, (C1-C6)алкоксикарбонилоксиметилом, N-(C1-C6)алкоксикарбониламинометилом, сукциноилом, (C1-C6)алканоилом, α-амино(C1-C4)алканоилом, арилактилом и α-аминоацилом или α-аминоацил-α-аминоацилом, где указанные α-аминоацильные фрагменты независимо представляют собой любые из природных L-аминокислот, присутствующих в белках, -P(O)(OH)2, -P(O)(O(C1-C6)алкил)2 или гликозил (радикал, образующийся в результате отсоединения гидроксила гемиацеталя карбогидрата).
Другие примеры пролекарств при их расщеплении высвобождают соответствующую свободную кислоту, и такие гидролизуемые образующие сложный эфир остатки соединений согласно настоящему изобретению включают, но не ограничиваются указанными, заместители типа карбоновых кислот (например, -(CH2)C(O)OH или фрагмент, который содержит карбоновую кислоту), где свободный водород замещается (C1-C4)алкилом, (C2-C12алканоилоксиметилом, (C4-C9)1-(алканоилокси)этилом, 1-метил-1-(алканоилокси)-этилом, содержащим от 5 до 10 атомов углерода, алкоксикарбонилаоксиметилом, содержащим от 3 до 6 атомов углерода, 1-(алкоксикарбонилаокси)этилом, содержащим от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилаокси)этилом, содержащим от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометилом, содержащим от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонила)амино)этилом, содержащим от 4 до 10 атомов углерода, 3-фталидилом, 4-кротонолактонилом, гамма-бутиролактон-4-илом, ди-N,N-(C1-C2)алкиламино(C2-C3)алкилом (таким как β-диметиламиноэтил), карбамоил-(C1-C2)алкилом, N,N-ди(C1-C2)-алкилкарбамоил-(C1-C2)алкилом и пиперидине-, пирролидино- или морфолино(C2-C3)алкилом.
Термин «субъект» при использовании в настоящей заявке, относится к животному, как правило, млекопитающему или человеку, которое предполагается или является объектом лечения, наблюдения, и/или исследования. Когда термин используется в сочетании с введением соединения или лекарственного средства, тогда субъект является объектом лечения, наблюдения, и/или введения соединения или лекарственного средства.
Термины «совместно вводить» и «совместное введение» относятся к одновременному введению (введению двух или более терапевтических агентов в одно и то же время), введению в разное время (введению одного или более терапевтических агентов в другое время по отношению к введению дополнительного терапевтического агента или агентов), при условии что терапевтические агенты в некоторой степени одновременно присутствуют в теле пациента.
Термин «терапевтически эффективное количество» при использовании в настоящей заявке означает количество активного соединения или фармацевтического агента, которое вызывает биологический или медицинский ответ в культуре клеток, системе тканей, у животного или человека, ожидаемый исследователем, ветеринаром, клиницистом или врачом, включая облегчение симптомов заболевания, состояния или нарушения, подвергаемого лечению.
Термин «композиция» включает продукт, который содержит определенные ингредиенты в определенном количестве, а также любой продукт, являющийся прямым или не прямым результатом комбинации определенных ингредиентов в определенных количествах.
Термин «фармацевтически приемлемый носитель» относится к среде, которая используется для получения желаемых форм дозирования соединений. Фармацевтически приемлемый носитель может включать один или более растворителей, разбавителей или других жидких основ; диспергирующих или суспендирующих агентов; поверхностно-активных веществ; изотонических агентов; загустителей или эмульгаторов; консервантов; твердых связующих веществ; скользящих веществ и т.д. В источниках Remington’s Pharmaceutical Sciences, Fifteenth Edition, E.W.Martin (Mack Publishing Co., Easton, Pa., 1975) и Handbook of Pharmaceutical Excipients, Third Edition, A.H.Kibbe ed. (American Pharmaceutical Assoc. 2000), описаны различные носители и известные методы, используемые для получения фармацевтических композиций.
СОЕДИНЕНИЯ
Аспект изобретения относится к соединению формулы 1:

или его фармацевтически приемлемой соли, где независимо для каждого случая:
W и Х независимо представляют собой кислород или серу;
Z1, Z2 и Z3 независимо представляют собой C-R20 или N, при условии что по меньшей мере один из Z1 и Z2 представляет собой N;
R1 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -COR6, -C(O)OR6, -SO2(R6), -C(O)N(R6)(R7), -SO2N(R6)(R7) и -[C(R4)2]p-R5;
каждый из R2 и R3 независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(CR6), -C(O)N(R6)(R7), -SO2N(R6)(R7), -P(O)(OR6)(OR7); или R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R4 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероциклоалкила, аралкила, гетероарила, гетероаралкила, галогена, гидрокси, алкокси, гидроксиалкила и алкоксиалкила;
R5 выбран из группы, состоящей из арила, гетероарила, гетероциклила, N(R8)(R9), -N(R8)COR9, -N(R8)C(O)OR9, -N(R8)SO2(R9), -CON(R8)(R9), -ОС(О)(R8)(R9), -SO2N(R8)(R9), -OC(O)OR8, -COOR9, -C(O)N(OH)(R8), -OS(O)2OR8, -S(O)2OR8, -S(O)2R8, -OR8, -COR8, -OP(O)(OR8)(OR8), -P(O)(OR8)(OR8) и -N(R8)P(O)(OR9)(OR9);
R6 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R7 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R8 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R9 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R8 и R9 соединены друг с другом с образованием гетероциклического кольца;
R20 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, галогена, галогеналкила, трифторметила, фторалкила, перфторалкила, тио, циано, гидрокси, метокси, алкокси, фенокси, арилокси, гетероарилокси, карбоксила, алкоксикарбонила, ацила, нитро, амино, алкиламино, ариламино, гетероариламино, амидо, ациламино, сульфата, сульфоната, сульфонила, сульфоксидо, сульфонамидо, сульфамоил, -[C(R4)2]p-R5, NR14R5, OR16, O-[C(R4)2]p-R5, NR14-[C(R4)2]p-R5 и SR16;
каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(R6), -С(O)N(R6)(R7), -SO2N(R6)(R7) и -P(O)(OR6)(OR7); или R14 и R15 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R16 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6 и -C(O)N(R6)(R7); и
p равен 1, 2, 3, 4, 5 или 6;
где любой из вышеуказанных алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила может являться необязательно замещенным.
Согласно одному варианту реализации изобретения, W и Х представляют собой кислород.
Согласно одному варианту реализации изобретения, Z1 и Z2 представляют собой азот; и Z3 представляет собой C-R20.
Согласно одному варианту реализации изобретения, Z1, Z2 и Z3 представляют собой азот.
Согласно одному варианту реализации изобретения, Z1 представляет собой азот; и каждый из Z2 и Z3 представляет собой C-R20.
Согласно одному варианту реализации изобретения, Z2 представляет собой азот; и каждый из Z1 и Z3 представляет собой C-R20.
Согласно одному варианту реализации изобретения, R1 представляет собой водород.
Согласно одному варианту реализации изобретения, R1 выбран из группы, состоящей из алкила, алкенила, алкинила, арила, гетероарила, гетероциклила и -[C(R4)2]p-R5.
Согласно одному варианту реализации изобретения, W и Х представляют собой кислород, каждый из Z1 и Z2 представляет собой азот, Z3 представляет собой C-R20 и R1 представляет собой водород.
Согласно одному варианту реализации изобретения, R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца.
Согласно одному варианту реализации изобретения, необязательно замещенное гетероциклическое кольцо выбрано из группы, состоящей из пиперазинила, гомопиперизинила, пирролидинила, пиперидинила, гомопиперидинила, морфолинила, 1,4-диазепан-5-онила и хинолинила.
Согласно одному варианту реализации изобретения, R2 и R3 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(R6), -C(O)(R6)(R7) и -SO2N(R6)(R7), где алкил, алкенил, алкинил, арил, гетероарил и гетероцикло могут являться необязательно замещенными.
Согласно одному варианту реализации изобретения, R2 представляет собой -[C(R4)2]p-R5, и R3 выбран из группы, состоящей из алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, COR6, -C(O)OR6, -SO2(CR6), -C(O)N(R6)(R7) и -SO2N(R6)(R7), где алкил, алкенил, алкинил, арил, гетероарил и гетероцикло могут являться необязательно замещенными.
Согласно одному варианту реализации изобретения, R5 представляет собой арил или гетероарил, каждый из которых может являться необязательно замещенным.
Согласно одному варианту реализации изобретения, R5 представляет собой -N(R8)(R9).
Согласно одному варианту реализации изобретения, R4 представляет собой водород.
Согласно одному варианту реализации изобретения, R20 выбран из группы, состоящей из алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, галогена, галогеналкила, трифторметила, карбоксила, алкоксикарбонила, ацила, нитро, амидо, ациламино, сульфонамидо, -[C(R4)2]p-R5; NR14R15, OR16 и SR16.
Согласно одному варианту реализации изобретения, R20 представляет собой водород.
Аспект изобретения относится к соединению формулы 2:

или его фармацевтически приемлемой соли, где независимо для каждого случая:
R1 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -COR6, -C(O)OR6, -SO2(R6), -C(O)N(R6)(R7), -SO2N(R6)(R7) и -[C(R4)2]p-R5;
R2 и R3 каждый из независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(CR6), -C(O)N(R6)(R7), -SO2N(R6)(R7), -P(O)(OR6)(OR7); или R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R4 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероциклоалкила, аралкила, гетероарила, гетероаралкила, галогена, гидрокси, алкокси, гидроксиалкила и алкоксиалкила;
R5 выбран из группы, состоящей из арила, гетероарила, гетероциклила, - N(R8)(R9), -N(R8)COR9, -N(R8)C(O)OR9, -N(R8)SO2(R9), -CON(R8)(R9), -ОС(О)(R8)(R9), -SO2N(R8)(R9), -OC(O)OR8, -COOR9, -C(O)N(OH)(R8), -OS(O)2OR8, -S(O)2OR8, -S(O)2R8, -OR8, -COR8, -OP(O)(OR8)(OR8), -P(O)(OR8)(OR8) и -N(R8)P(O)(OR9)(OR9);
R6 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R7 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R6 и R7 соединены друг с другом с образованием гетероциклического кольца;
R8 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила;
R9 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R8 и R9 соединены друг с другом с образованием гетероциклического кольца;
R20 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, галогена, галогеналкила, трифторметила, фторалкила, перфторалкила, тио, циано, гидрокси, метокси, алкокси, фенокси, арилокси, гетероарилокси, карбоксила, алкоксикарбонила, ацила, нитро, амино, алкиламино, ариламино, гетероариламино, амидо, ациламино, сульфата, сульфоната, сульфонила, сульфоксидо, сульфонамидо, сульфамоила, -[C(R4)2]p-R5; NR14R5, OR16 и SR16;
каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(R6), -С(O)N(R6)(R7), -SO2N(R6)(R7) и -P(O)(OR6)(OR7); или R14 и R15 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца;
R16 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR6 и -С(O)N(R6)(R7); и
p равен 1, 2, 3, 4, 5 или 6;
где любой из вышеуказанных алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила может являться необязательно замещенным.
Согласно одному варианту реализации изобретения, R20 представляет собой водород.
Согласно одному варианту реализации изобретения, R20 выбран из группы, состоящей из водорода, алкила, трифторметила, алкенила, алкинила, арила, гетероарила, гетероциклила, -[C(R4)2]p-R5; NR14R5, OR16 и SR16.
Согласно одному варианту реализации изобретения, R20 представляет собой водород.
Согласно одному варианту реализации изобретения, R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца.
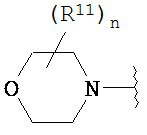
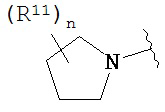
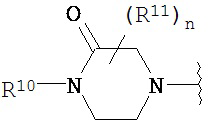
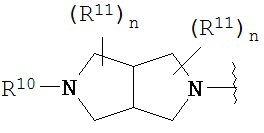
Согласно одному варианту реализации изобретения, R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
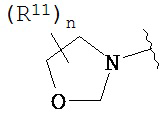 ,
, 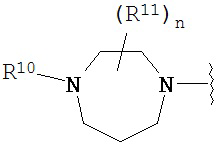 ,
,  ,
, 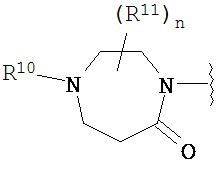 и
и 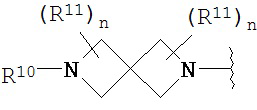
где, независимо для каждого случая:
R10 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила, гетероциклоалкила, -[C(R4)2]p-R5, -COR12, -C(O)OR12, -SO2(R12), -C(O)N(R12)(R13), -SO2(R12)(R13) и -P(O)(OR12)(OR13);
R12 и R13 выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R12 и R13 соединены друг с другом с образованием гетероциклического кольца;
R11 выбран из группы, состоящей из алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, галогена, галогеналкила, тио, циано, гидроксиалкила, алкокси, алкилаалкокси, алкилатио, нитро, циано, -N(R17)(R18), -N(R17)COR18, -N(R17)C(O)OR18, -N(R17)SO2(R18), -CON(R17)(R18), -OC(O)N(R17)(R18), SO2N(R17)(R18), -OC(O)OR17, -COOR17, -C(O)N(OH)(R17), -OS(O)2OR17, -S(O)2OR17, -S(O)2R17, -OR17, -COR17, -OP(O)(OR17)(OR18), -P(O)(OR17)OR18), -N(R17)P(O)(OR18)(OR18) и -[C(R4)2]p-R5;
R17 и R18 выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила; или R17 и R18 соединены друг с другом с образованием гетероциклического кольца; и
n равен 0, 1, 2 или 3;
где любой из вышеуказанных алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, аралкила, гетероаралкила и гетероциклоалкила может являться необязательно замещенным.
Согласно одному варианту реализации изобретения, R10 выбран из группы, состоящей из водорода, алкила, арила, гетероарила, гетероциклила, -[C(R4)2]p-R5, -COR12, -C(O)OR12 и -SO2(R12);
где любой из вышеуказанных алкила, арила, гетероарила и гетероцикло может являться необязательно замещенным.
Согласно одному варианту реализации изобретения, n равен 0.
Согласно одному варианту реализации изобретения, n равен 1.
Согласно одному варианту реализации изобретения, R11 выбран из группы, остоящей из алкила, гетероциклила, циано, гидроксиалкила, - N(R17)(R18), -CON(R17)(R18) и -[C(R4)2]p-R5;
где любой из вышеуказанных алкила и гетероцикло может являться необязательно замещенным.
Согласно одному варианту реализации изобретения, R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца формулы:

Согласно одному варианту реализации изобретения, n равен 0 или 1.
Согласно одному варианту реализации изобретения, R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца формулы:
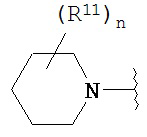 или
или 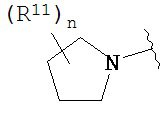
Согласно одному варианту реализации изобретения, R2 и R3 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, гетероциклила, -[C(R4)2]p-R5, -COR6, -C(O)OR6, -SO2(R6), -C(O)N(R6)(R7) и -SO2N(R6)(R7), где указанные алкил, алкенил, алкинил, арил, гетероарил и гетероцикло могут являться необязательно замещенными.
Согласно одному варианту реализации изобретения, R3 представляет собой -[C(R4)2]p-R5.
Согласно одному варианту реализации изобретения, R2 представляет собой необязательно замещенный алкил.
Согласно одному варианту реализации изобретения, R4 представляет собой водород.
Согласно одному варианту реализации изобретения, R4 представляет собой гидрокси.
Согласно одному варианту реализации изобретения, R5 представляет собой арил, гетероарил, гетероцикл, каждый из которых может являться необязательно замещенным.
Согласно одному варианту реализации изобретения, p равен 1, 2 или 3.
Согласно одному варианту реализации изобретения, R5 выбран из группы, состоящей из -N(R8)(R9), -N(R8)COR9, -N(R8)C(O)OR9, -N(R8)SO2(R9), -CON(R8)(R9), -ОС(О)(R8)(R9), -SO2N(R8)(R9), -OC(O)OR8, -COOR9, -C(O)N(OH)(R8), -OS(O)2OR8, -S(O)2OR8, -S(O)2R8, -OR8, -COR8, -OP(O)(OR8)(OR8), -P(O)(OR8)(OR8) и -N(R8)P(O)(OR9)(OR9).
Согласно одному варианту реализации изобретения, R5 представляет собой -N(R8)(R9).
Аспект изобретения относится к соединению, или его фармацевтически приемлемой соли, выбранному из группы, состоящей из:
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
, 
 ,
,  ,
,
 ,
, 
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  и
и
 .
.
Аспект изобретения относится к соединению, или его фармацевтически приемлемой соли, выбранному из группы, состоящей из:
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,
 ,
, 
 ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,
 ,
,  ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,  ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,  ,
,
 ,
,
 ,
,
 ,
,
 ,
,  ,
,
 ,
,
 ,
, 
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,
 ,
,
 ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,
 и
и
 .
.
Любое из вышеуказанных соединений может существовать в виде геометрического изомера Е, геометрического изомера Z или их смеси. Например, согласно одному варианту реализации изобретения, " " в вышеуказанных структурах представляет собой. E-изомер конкретного соединения. Согласно другому варианту реализации изобретения, представляет собой Z-изомер конкретного соединения. Согласно другому варианту реализации изобретения, "
" в вышеуказанных структурах представляет собой. E-изомер конкретного соединения. Согласно другому варианту реализации изобретения, представляет собой Z-изомер конкретного соединения. Согласно другому варианту реализации изобретения, " " представляет собой смесь Е- и Z- изомеров конкретного соединения.
" представляет собой смесь Е- и Z- изомеров конкретного соединения.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор CK1γ1, CK1γ2 или CK1γ3.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор CK2.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор пути Wnt.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор пути JAK/STAT.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор пути mTOR.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой посредник деградации Pgp и/или оттока лекарственного средства из клеток.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор пути TGFβ.
Согласно некоторым вариантам реализации изобретения, IC50 указанного соединения составляет менее 5000 нМ для CK1γ1, CK1γ2 или CK1γ3.
Согласно некоторым вариантам реализации изобретения, IC50 указанного соединения составляет менее 1000 нМ для CK1γ1, CK1γ2 или CK1γ3.
Согласно некоторым вариантам реализации изобретения, IC50 указанного соединения составляет менее 500 нМ для CK1γ1, CK1γ2 или CK1γ3.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор CK2.
Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 5000 нМ для CK2.
Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 1000 нМ для CK2.
Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 500 нМ для CK2.
Согласно одному варианту реализации изобретения, любое из вышеуказанных соединений представляет собой ингибитор PIM1, PIM2 или PIM3.
Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 5000 нМ для PIM1, PIM2 или PIM3.
Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 1000 нМ для PIM1, PIM2 или PIM3.
Согласно одному варианту реализации изобретения, IC50 указанного соединения составляет менее 500 нМ для PIM1, PIM2 или PIM3.
ОБЩИЕ СХЕМЫ СИНТЕЗА
Общие Схемы синтеза, которые использовали для получения соединений, описанных в настоящей заявке, представлены ниже. Например, соединения согласие изобретению могут быть получены, как показано на Схеме I:
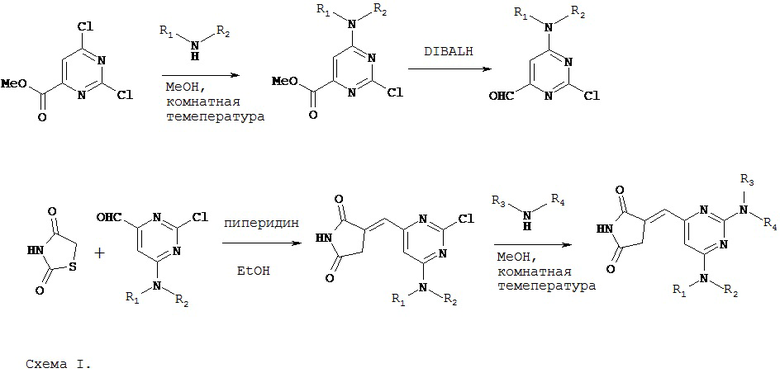
Альтернативно, соединения согласно изобретению могут быть получены, как показано на Схеме II:
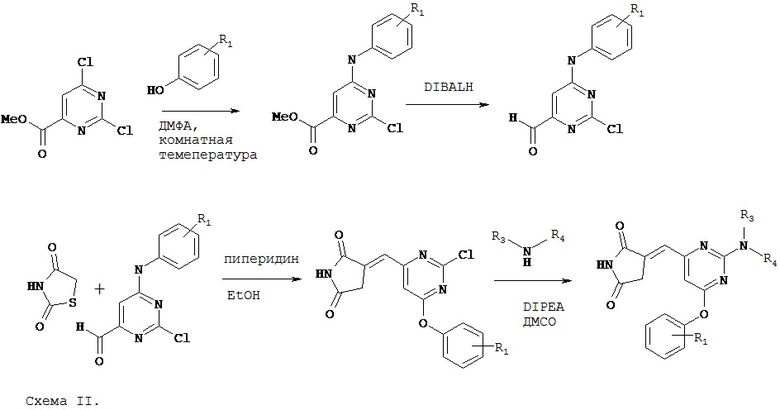
Другой способ получения соединений, описанных в настоящей заявке, изображен на Схеме III;

ВОЗМОЖНЫЕ ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Конкретные соединения согласно изобретению могут быть получены в соответствии с вышеуказанными Схемами путем проведения реакции между амином (Реагентом А) и гидантоиновым ядром (Реагентом В). Неограничивающие возможные примеры Реагента А и Реагента В показаны в Таблице 1 и Таблице 2, соответственно.
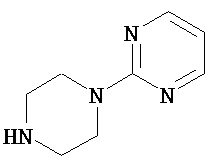
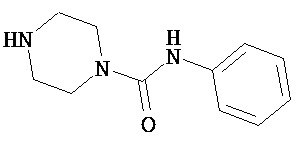
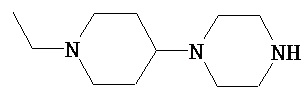

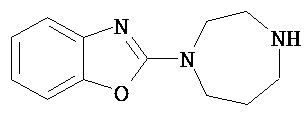


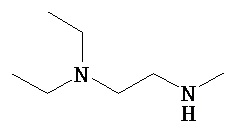
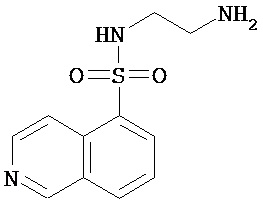
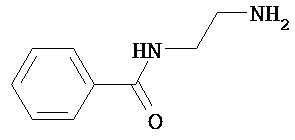

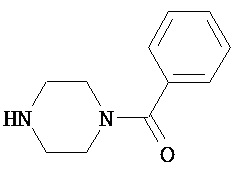

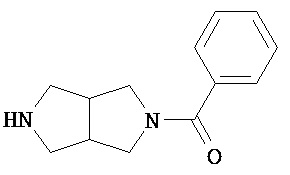

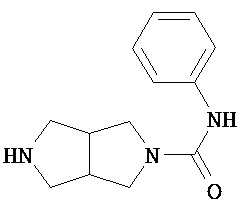

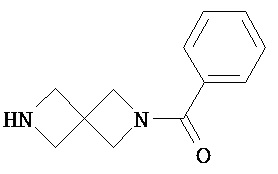
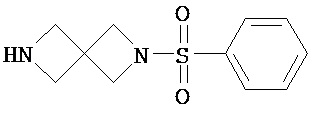
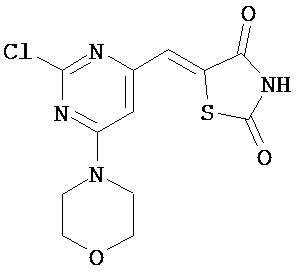

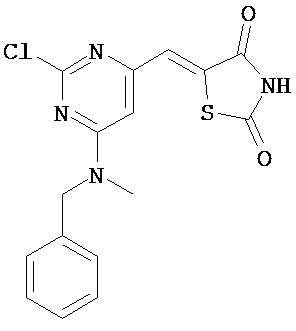


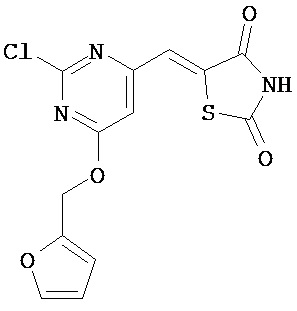
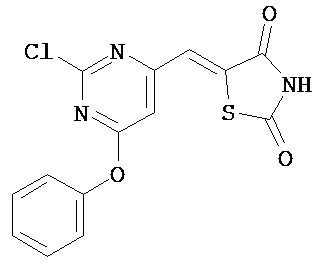
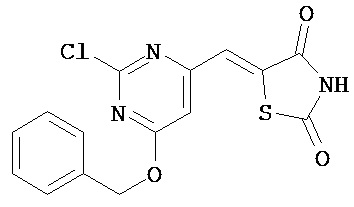

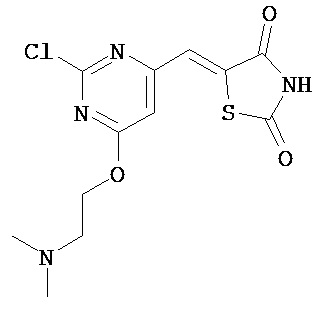
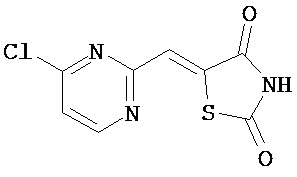

Дополнительные возможные варианты реализации изобретения, которые могут быть получены в соответствии с вышеуказанными Схемами реакций с использованием Реагентов А и В, перечислены в Таблице 3. Предполагается, что геометрические изомеры, перечисленные в Таблице 3, отражают фактическую геометрию возможных соединений в том случае, если их предполагается получить; однако окончательное определение структуры может быть сделано только в том случае, если указанные соединения синтезировали и подвергали соответствующим анализам с помощью 2D ЯМР. Кроме того, несмотря на то, что соединения представлены в виде геометрического "Z"-изомера, подразумеваются как Е-, так и Z-геометрические изомеры и их смеси.
Кроме того, может являться удобным или желательным получать, очищать и/или обрабатывать активное соединение в химически защищенной форме. Термин «химически защищенная форма», при использовании в настоящей заявке, относится к соединению, в котором одна или более реактивных функциональных групп являются защищенными от нежелательных химических реакций (т.е. модифицированы с помощью защитной группы).
При введении защитной группы для реактивной функциональной группы могут осуществляться реакции, включающие другие не защищенные реактивные функциональные группы, не затрагивающие защищенную группу; защитная группа может быть удалена, обычно в ходе последующего этапа, без существенного влияния на остальную часть молекулы. См., например, Protective Groups in Organic Synthesis (Т.Green and P.Wuts, Wiley, 1991) и Protective Groups in Organic Synthesis (T.Green and P.Wuts; 3rd Edition; John Wiley and Sons, 1999).
Например, гидроксигруппа может быть защищена с помощью эфира (-OR) или сложного эфира (-OC(=O)R), например: m-бутилового эфира; бензилового, бензгидрилового (дифенилметилового) или тритилового (трифенилметилового) эфира; триметилсилилового или m-бутилдиметилсилилового эфир; или сложного ацетилэфира (-OC(=O)CH3,-OAc).
Например, альдегидная или кетоновая группа может быть защищена с помощью ацеталя или кеталя, соответственно, в котором карбонильная группа (C(=O)) превращена в диэфир (C(OR)2), путем реагирования, например, с первичным спиртом. Альдегидная или кетоновая группа просто восстанавливается путем гидролиза с использованием воды в сильном избытке в присутствии кислоты.
Например, аминная группа может быть защищена с помощью амида (-NRC(=O)R) или уретана (-NRC(=O)OR), такого как: метиламид (-МНС(=O)CH3); бензилоксиамид (-NHC(=O)OCH2C6H5NHCbz); такого как m-бутоксиамид (-NHC(=O)-OC(CH3)-NHBoc); 2-бифенил-2-пропоксиамид (-NHC(=O)OC(CH3)2C6H4C6H5-NHBoc), такого как 9-флуоренилметоксиамид (-NHFmoc), такого как 6-нитровератрилоксиамид (-NHNvoc), такого как 2-триметилсилилэтилоксиамид (-NHTeoc), такого как 2,2,2-трихлорэтилоксиамид (-NHTroc), такого как аллилоксиамид (-NHAlloc), такого как 2-(фенилсульфонил)этилоксиамид (-NHPsec); или, в подходящих случаях (например, в случае циклических аминов), такого как нитроксидный радикал.
Например, группа карбоновой кислоты может быть защищена с помощью сложного эфира или амида, например: сложного бензилового эфира; сложного m-бутилового эфира; сложного метилового эфира или метиламида.
Например, тиоловая группа может быть защищена с помощью тиоэфира (-SR), например: бензилового тиоэфира или ацетамидометилового эфира (-SCH2NHC(=O)CH3).
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Одно или более соединений согласно настоящему изобретению можно вводить млекопитающему, отдельно или в составе фармацевтических композиций, в которых их смешивают с подходящими носителями или наполнителем (наполнителями), в дозах, достаточных для лечения или облегчения заболевания или состояния, описанного в настоящей заявке. Смеси указанных соединений также можно вводить пациенту в виде простой смеси или в составе подходящих фармацевтических композиций. Например, один аспект изобретения относится к фармацевтической композиции, содержащей терапевтически эффективную дозу соединения формулы I или его фармацевтически приемлемой соли, сольвата, энантиомера или стереоизомера; и фармацевтически приемлемый разбавитель или носитель.
Методы получения лекарственных форм и введения соединений согласно настоящему изобретению могут быть найдены в источниках, хорошо известным специалистам в данной области техники, например, в источнике Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, последнее издание.
Подходящие способы введения могут, например, включать пероральное введение, введение в виде глазных капель, ректальное введение, трансмукозальное, местное или интестинальное введение; парентеральную доставку, включая внутримышечные, подкожные, интрамедуллярные инъекции, а также интратекальные, непосредственно внутрижелудочковые, внутривенные, внутрибрюшинные, интраназальные или внутриглазные инъекции.
Альтернативно, можно осуществлять местное, а не системное введение соединения, например, путем инъекции соединения непосредственно в место отека, часто в виде депо или состава с замедленным высвобождением.
Более того, можно вводить соединение с помощью системы направленной доставки лекарственного средства, например, в липосоме, покрытой специфичными к эндотелиальным клеткам антителами.
Фармацевтические композиции согласно настоящему изобретению могут быть получены, например, с помощью традиционного смешения, растворения, грануляции, получения драже, отмучивания, эмульгирования, инкапсулирования, включения или лиофилизирования.
Фармацевтические композиции для применения в соответствии с настоящим изобретением, таким образом, могут быть получены традиционным способом с использованием одного или более физиологически приемлемых носителей, включая наполнители и вспомогательные вещества, которые ускоряют включение активного соединения в композиции, которые могут иметь фармацевтическое применение, Подходящая лекарственная форма зависит от выбранного способа введения.
Для инъекций агенты согласно изобретению могут быть включены в состав водных растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или физиологический солевой буфер. В лекарственной форме для трансмукозального введения используются пенетранты, соответствующие для преодолеваемого барьера. Указанные пенетранты в целом известны в данной области техники.
Лекарственные формы для перорального введения соединений могут быть с легкостью получены путем комбинирования активного соединения с фармацевтически приемлемыми носителями, хорошо известными в данной области техники. Такие носители позволяют включать соединения согласно изобретению в состав таблеток, пилюлей, драже, капсул, жидкостей, гелей, сиропов, суспензий, эмульсий и т.д. для перорального приема внутрь пациентом, подвергаемым лечению. Фармацевтические композиции для перорального введения могут быть получены путем комбинирования активного соединения с твердым наполнителем, необязательного измельчения полученной смеси и обработки смеси гранул после добавления, при желании, подходящих вспомогательных веществ с получением сердцевин таблеток или драже. Подходящие наполнители включают такие наполнители, как сахара, включая лактозу, сахарозу, манит или сорбитол; целлюлозные композиции, такие как, например, маисовый крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза натрия и/или поливинилпирролидон (ПВП). При желании могут быть добавлены дезинтегрирующие агенты, такие как поперечно сшитый поливинилпирролидон, агар или альгиновые кислоты, или их соли, такие как альгинат натрия.
Сердцевины драже представлены с подходящими покрытиями. Для указанных целей могут использоваться концентрированные растворы сахара, которые могут необязательно содержать гуммиарабик, тальк, поливинилпирролидон, карбопол-гель, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органически растворители или смеси растворителей. Могут добавляться красители или пигменты в покрытия для таблеток или драже для идентификации или для обозначения различных комбинаций доз активного соединения.
Фармацевтические композиции, которые могут использоваться для перорального введения, включают твердые капсулы, сделанные из желатина, а также мягкие, запечатанные капсулы, сделанные из желатина и пластификатора, такого как глицерин или сорбитол. Твердые капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими веществами, такими как крахмалы, и/или скользящими веществами, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таки как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут добавляться стабилизаторы.
Для трансбуккального введения композиции могут быть представлены в форме таблеток или пастилок, полученных с помощью стандартных способов.
В случае введения с помощью ингаляции соединения для применения в соответствии с настоящим изобретением удобно доставлять в форме композиций спрея-аэрозоля из баллонов, находящихся под давлением, или небулайзеров, в которых используется подходящий пропеллент, например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газа. В случае сжатого аэрозоля единица дозирования может быть определена с помощью клапана для доставки отмеренного количества. Могут быть изготовлены капсулы и картриджи, например, из желатина, для применения в ингаляторе или инсуффляторе, содержащие порошкообразную смесь соединения и подходящего порошкообразного основания, такого как лактоза или крахмал.
Соединения могут быть представлены в виде лекарственных форм для парентерального введения путем инъекции, например, болюсной инъекции или длительной инфузии. Лекарственные формы для инъекций могут быть представлены в виде единичных лекарственных форм, например, в ампулах или многодозовых контейнерах, с добавлением консервантов. Композиции могут быть представлены в таких формах, как суспензии, растворы или эмульсии в масляных или водных основах, и могут содержать формообразующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты.
Фармацевтические лекарственные формы для парентерального введения включают водные растворы активного соединения в водорастворимой форме. Кроме того, могут быть получены суспензии активного соединения в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды или липосомы. Водные суспензии для инъекций могут содержать вещества, которые повышают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбитол или декстран. Необязательно суспензия может также содержать подходящие стабилизаторы или агенты, которые повышают растворимость соединений для возможности получения сильно концентрированных растворов.
Альтернативно, активный ингредиент может быть представлен в форме порошка для восстановления перед применением с помощью подходящего носителя, например, стерильной апирогенной воды.
Соединения могут также быть представлены в виде композиций для ректального введения, таких как суппозитории или удерживающие клизмы, например, содержащие стандартные основы для суппозиториев, такие как масло какао или другие глицериды.
Кроме лекарственных форм, описанных ранее, соединения могут также быть представлены в виде систем депо. Такие лекарственные формы длительного действия могут вводиться путем имплантации (например, подкожно или внутримышечно или путем внутримышечной инъекции). Таким образом, например, соединения могут быть представлены в виде лекарственной формы с подходящими полимерными или гидрофобными материалами (например, таких как эмульсия в приемлемом масле) или ионообменными смолами или в виде труднорастворимых производных (например, в виде труднорастворимой соли).
Альтернативно, могут использоваться другие системы доставки для гидрофобных фармацевтических соединений. Липосомы и эмульсии являются примерами средств доставки или носителей для гидрофобных лекарственных средств. Также могут использоваться конкретные органические растворители, такие как диметилсульфоксид. Соединения также могут доставляться с использованием систем замедленного высвобождения, таких как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие терапевтический агент. Различные материалы для замедленного высвобождения описаны и хорошо известны специалистам в данной области техники. Капсулы с замедленным высвобождением в зависимости от их химической природы могут высвобождать соединения в течение периода времени от нескольких недель до более чем 100 дней. В зависимости от химической природы и биологической стабильности терапевтического реагента могут использоваться дополнительные стратегии стабилизации белков.
Фармацевтические композиции могут также включать подходящие твердофазные или гелеобразные носители или наполнители. Примеры указанных носителей или наполнителей включают, но не ограничиваются указанными, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
СПОСОБЫ ЛЕЧЕНИЯ
Согласно настоящему изобретению предложены способы модулирования активности CK1 и ее подтипов, CK2, пути Wnt, и/или пути TGFβ.Также согласно настоящему изобретению предложены способы лечения или предотвращения состояний и заболеваний, на причину которых можно влиять путем модулирования активности CK1 (например, CK1γ), CK2, пути Wnt и/или пути TGFβ. Указанные способы, как правило, включают введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения или композиции согласно изобретению.
Также согласно настоящему изобретению предложены способы модулирования активности PIM, таких как PIM1, PIM2 или PIM3, пути JAK/STAT и/или пути mTOR и/или Pgp. Также согласно настоящему изобретению предложены способы лечения или предотвращения состояний и заболеваний, на причину которых можно влиять путем модулирования активности PIM, пути JAK/STAT и/или пути mTOR и/или Pgp. Указанные способы, как правило, включают введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения или композиции согласно изобретению.
Различные заболевания, такие как рак, воспаление и воспалительные заболевания (например, остеоартрит и ревматоидный артрит) и неврологические состояния (например, болезнь Альцгеймера) и нейродегенерация, можно лечить путем введения модуляторов CK1 (например, CK1γ), CK2, пути Wnt и/или пути TGFβ. Связанные с костной тканью заболевания и состояния, включая остеопороз и костеобразование, также можно лечить путем введения модуляторов CK1 (например, CK1γ), CK2, пути Wnt и/или пути TGFβ. Восстановление кости может быть ускорено путем введения модуляторов CK1 (например, CK1γ), CK2, пути Wnt и/или пути TGFβ. Дополнительные состояния, которые можно лечить путем введения модуляторов CK1 (например, CK1γ), CK2, пути Wnt и/или пути TGFβ, включают гипогликемию, метаболический синдром и диабет. Модуляторы CK1 (например, CK1γ), CK2, пути Wnt и/или пути TGFβ также применимы для регуляции апоптоза (например, повышения скорости апоптоза в раковых клетках). Модуляторы CK1 (например, CK1γ), CK2, пути Wnt и/или пути TGFβ также применимы для лечения или предотвращения нарушения эмбрионального развития.
По меньшей мере в связи с тем, что повышенное содержание CK1γ, как было обнаружено, связано с конкретными раковыми заболеваниями, способ лечения рака у субъекта включает введение указанному субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения, которое ингибирует CK1γ. Также было обнаружено, что PIM1, PIM2, PIM3, путь JAK/STAT и/или путь mTOR связаны с конкретными раковыми заболеваниями. Таким образом, согласно настоящему изобретению предложен способ лечения рака, включающий введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения, которое ингибирует PIM1 и/или PIM2 и/или PIM3.
PIM1, PIM2 и Р1МЗ также связывают с защитой Pgp от деградации, которая может регулировать отток лекарственного средства из клеток и лекарственную устойчивость. Таким образом, согласно настоящему изобретению, предложен способ лечения злокачественных опухолей, включающий введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения, которое ингибирует PIM1 и/или PIM2 и/или PIM3, в сочетании с другим лекарственным средством, соединением или материалом для устранения устойчивости к указанному лекарственному средству, соединению или материалу.
Соединения, описанные в настоящей заявке, в целом могут применяться для модулирования клеточной пролиферации. Соответственно, заболевания, которые можно лечить, включают гиперпролиферативные заболевания, такие как доброкачественный рост клеток и злокачественный рост клеток.
Примеры раковых заболеваний, которые можно лечить, включают лейкозы, например, острый лимфоидный лейкоз и миелоидный лейкоз, и карциномы, такие как рак толстой и прямой кишки и гепатокарцинома. Другие раковые заболевания включают острый лимфобластный лейкоз; острый миелоидный лейкоз; карциному коры надпочечников, карциному коры надпочечников; связанный со СПИДом рак; связанную со СПИДом лимфому; рак анального канала; детскую астроцитому мозжечка; базальноклеточную карциному, см. рак кожи (не меланому); внепеченочный рак желчных протоков; рак мочевого пузыря; рак мочевого пузыря; рак костей, остеосаркому/злокачественную фиброзную гистоцитому; глиому ствола мозга; опухоль мозга, астроцитому мозжечка; опухоль мозга, астроцитому мозжечка/злокачественную глиому; опухоль мозга, эпендимому; опухоль мозга, медуллобластому; опухоль мозга, супратенториальные примитивные нейроэктодермальные опухоли; опухоль мозга, глиому зрительного пути и гипоталамуса; опухоль мозга; рак молочной железы; рак молочной железы и ботриомикому; рак молочной железы; рак молочной железы у мужчин; бронхиальные аденомы/карциноиды; лимфому Беркитта; карциноидную опухоль; желудочно-кишечную карциноидную опухоль; карциному неизвестной первичной локализации; первичную лимфому центральной нервной системы; астроцитому мозжечка; астроцитому мозжечка/злокачественную глиому; рак шейки матки; детские раковые заболевания; хронический лимфолейкоз; хронический миелолейкоз; хронические миелопролиферативные нарушения; рак толстой кишки; рак толстой и прямой кишки; кожную Т-клеточную лимфому, см. фунгоидный микоз и синдром Сезари; рак эндометрия; эпендимому; рак пищевода; рак пищевода; семейство опухолей Юинга; экстракраниальную герминогенную опухоль; экстрагонадную герминогенную опухоль; внепеченочный рак желчных протоков; рак глаза, внутригазную меланому; рак глаза, ретинобластому; рак желчного пузыря; рак желудка; рак желудка; желудочно-кишечную карциноидную опухоль; экстракраниальную герминогенную опухоль; экстрагонадную герминогенную опухоль; герминогенную опухоль яичника; гестационную трофобластическую опухоль; глиому; детскую глиому ствола мозга; глиому, детскую астроцитому мозжечка; детскую глиому зрительного пути и гипоталамуса; волосистоклеточные лейкозы; рак головы и шеи; гематологические раковые заболевания (рак крови), гепатоклеточный рак (рак печени) у взрослых (первичный); гепатоклеточный рак (рак печени) у детей (первичный); ходжкинскую лимфому; ходжкинскую лимфому; ходжкинскую лимфому во время беременности; гипофарингиальный рак; глиому гипоталамуса и зрительного пути; внутригазную меланому; карциному островковых клеток (эндокринных клеток поджелудочной железы); саркому Капоши; рак почек (почечно-клеточный рак); рак почек; рак гортани; рак гортани; острый лимфобластный лейкоз; острый лимфобластный лейкоз; острый миелоидный лейкоз; острый миелоидный лейкоз; хронические лимфоцитарные лейкозы; хронические миелогенные лейкозы; волосистоклеточные лейкозы; рак губы и ротовой полости; рак печени у взрослых (первичный); рак печени у детей (первичный); немелкоклеточный рак легких; мелкоклеточный рак легких; лимфому, связанную со СПИДом, лимфому Беркитта, кожную Т-клеточную лимфому, см. фунгоидный микоз и синдром Сезари; ходжкинскую лимфому; ходжкинскую лимфому; ходжкинскую лимфому во время беременности; неходжкинскую лимфому; неходжкинскую лимфому; неходжкинскую лимфому во время беременности; первичную лимфому центральной нервной системы; макроглобулинемию Вальденстрема; злокачественную фиброзную гистиоцитому кости/остеосаркому; медуллобластому; меланому; меланому, внутриглазную (глазную); карциному клеток Меркеля; злокачественную мезотелиому у взрослых; мезотелиому; метастатический плоскоклеточный рак шеи с первичной оккультной саркомой; синдром множественной эндокринной неоплазии; множественную миелому/неоплазму плазматических клеток, фунгоидный микоз; миелодиспластические синдромы; миелодиспластические/миелопролиферативные заболевания; миелогенные лейкозы, хронические; острые миелоидные лейкозы у взрослых; острые миелоидные лейкозы у детей; множественную миелому; хронические миелопролиферативные заболевания; рак носовой полости и параназального синуса; назофарингеальный рак; назофарингеальный рак; нейробластому; неходжкинскую лимфому; неходжкинскую лимфому; неходжкинскую лимфому во время беременности; немелкоклеточный рак легких; рак рта; рак ротовой полости и губ; орофарингеальный рак; остеосаркому/злокачественную фиброзную гистиоцитому кости; рак яичника; рак эпителия яичника; герминогенную опухоль яичника; опухоль яичника с низким потенциалом к злокачественности; рак островковых клеток поджелудочной железы; рак параназального синуса и носовой полости; рак паращитовидной железы; пениальный рак; феохромоцитому; пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли; опухоль гипофиза; неоплазму плазматических клеток/множественную миелому; псевдореспираторную бластому; ботриомикому и рак молочной железы; ботриомикому и ходжкинскую лимфому; ботриомикому и неходжкинскую лимфому; первичную лимфому центральной нервной системы; рак предстательной железы; рак прямой кишки; почечно-клеточный рак (рак почек); почечно-клеточный рак (рак почек); переходно-клеточный рак почечной лоханки и мочеточника; ретинобластому; рабдомиосаркому; рак слюнных желез; рак слюнных желез; саркому, опухоли семейства Юинга; саркому, саркому Капоши мягких тканей; саркому, саркому мягких тканей; саркому матки; синдром Сезари; рак кожи (не меланому); рак кожи; рак кожи (меланому); кожную карциному клеток Меркеля; мелкоклеточный рак легких; рак тонкой кишки; саркому мягких тканей; саркому мягких тканей; чешуйчато-клеточную карциному, см. рак кожи (не меланому); плоскоклеточный метастатический рак шеи с оккультной первичной карциномой; рак желудка; рак желудка; супратенториальные примитивные нейроэктодермальные опухоли; Т-клеточную лимфому, кожную, см. фунгоидный микоз и синдром Сезари; рак яичка; тимому; тимому и тимическую карциному; рак щитовидной железы; рак щитовидной железы; переходно-клеточный рак почечной лоханки и мочеточника; гестационную трофобластическую опухоль; карциному неизвестной первичной локализации; рак неизвестной первичной локализации; нетипичный рак у детей; переходно-клеточный рак почечной лоханки и мочеточника; уретральный рак; рак матки, эндометрия; саркому матки; рак влагалища; глиому зрительного пути и гипоталамуса; вульварный рак; макроглобулинемию Вальденстрема; опухоль Вильмса и женский рак.
Неврологические заболевания, которые можно лечить, включают эпилепсию, шизофрению, биполярное расстройство или другие физиологические и/или психические нарушения, нейропатию, скелетно-мышечную атрофию и нейродегенеративные заболевания, например, нейродегенеративное заболевание. Примеры нейродегенеративных заболеваний включают: болезнь Альцгеймера, амиотрофический латеральный склероз (АЛС) и болезнь Паркинсона. Другой класс нейродегенеративных заболеваний включает заболевания, вызванные по меньшей мере отчасти агрегацией полиглутамина. Заболевания указанного класса включают; болезнь Хантингтона, спинально-бульбулярную мышечную атрофию (SBMA или болезнь Кеннеди), дентаторубро-паллидолюисову атрофию (DRPLA), спинально-церебеллярную атаксию 1 (SCA1), спинально-церебеллярную атаксию 2 (SCA2), болезнь Мачадо-Джозефа (MJD; SCA3), спинально-церебеллярную атаксию 6 (SCA6), спинально-церебеллярную атаксию 7 (SCA7) и спинально-церебеллярную атаксию 12 (SCA12).
Любое другое заболевание, в котором принимает участие путь Wnt, путь TGFβ, путь JAK/STAT, путь mTOR, модуляция Pgp, CK1, CK1γ, CK2 или PIM, можно лечить или предотвращать с использованием соединений и способов, описанных в настоящей заявке.
ДОЗИРОВКА
В настоящей заявке, «терапевтически эффективное количество» или «терапевтически эффективная доза» представляет собой количество соединения согласно изобретению или комбинации двух или более указанных соединений, которое приводит к подавлению, полному или частичному, прогрессирования состояния или облегчению, по меньшей мере частично, одного или более симптомов указанного состояния. Терапевтически эффективное количество может также представлять собой количество, которое является профилактически эффективным. Количество, которое является терапевтически эффективным, зависит от массы тела и пола пациента, состояния, подвергаемого лечению, тяжести указанного состояния и желаемого результата. Для конкретного пациента терапевтически эффективное количество может быть определено с помощью способов, известных специалистам в данной области техники.
Терапевтически эффективная доза относится к такому количеству соединения, которое приводит к смягчению симптомов пациента. Токсичность и терапевтическая эффективность такого соединения могут быть определены с помощью стандартных фармацевтических способов на клеточных культурах или экспериментальных животных, например, для определения максимальной переносимой дозы (MTD) и ED50 (эффективной дозы для 50% максимального эффекта). Отношение между дозой, вызывающей токсический эффект, и дозой, вызывающей, терапевтический эффект, представляет собой терапевтический индекс, который может быть выражен как отношение между MTD и ED50. Данные, полученные в результате указанных анализов на клеточных культурах и исследований на животных, могут использоваться для определения диапазона доз для применения у человека. Доза указанных соединений предпочтительно находится в диапазоне концентраций в циркуляторном русле, которые включают ED50, не проявляющие или проявляющие малую токсичность. Доза может различаться в указанном диапазоне в зависимости от используемой формы дозирования и используемого способа введения. Конкретная лекарственная форма, способ введения и доза могут быть выбраны конкретным врачом с учетом состояния пациента. При лечении кризов для достижения быстрого ответа может являться необходимьм введение болюсной дозы или инфузии высокой дозы, приближенной к MTD.
Величина дозы и интервалы между введением доз могут устанавливаться в индивидуальном порядке с достижением плазматического уровня активного агента, который является достаточным для поддержания эффекта, модулирующего CK1, CK1γ, CK2, Piml-3, путь Wnt, путь TGFβ, путь JAK/STAT, путь mTOR или Pgp, или минимальной эффективной концентрации (МЕС). МЕС различается для каждого соединения, но может быть определена из данных in vitro. Дозы, необходимые для достижения МЕС, зависят от индивидуальных характеристик и путей введения. Анализ ВЭЖХ или биоанализы могут использоваться для определения плазматических концентраций.
Интервалы между введением доз могут также определяться с использованием значения МЕС. Соединения следует вводить с использованием схемы, согласно которой плазматический уровень поддерживается выше МЕС в течение 10-90% времени, предпочтительно между 30 и 90% и наиболее предпочтительно между 50 и 90% до достижения желаемого облегчения симптомов. В случаях локального введения или селективного захвата эффективная локальная концентрация лекарственного средства может не зависеть от плазматической концентрации.
Вводимое количество композиции безусловно будет зависеть от субъекта, подвергаемого лечению, от массы тела субъекта, тяжести заболевания, способа введения и заключения лечащего врача.
НАБОРЫ
Соединения и композиции согласно изобретению (например, соединения и композиции формулы I) могут, при желании, быть представлены в упаковке или дозирующем устройстве, которое может содержать одну или более единичных лекарственных форм, содержащих активный ингредиент. Упаковка может, например, включать металлическую или полимерную форму, такую как блистерная упаковка. К упаковке или дозирующему устройству могут прилагаться инструкции по введению. Также могут быть получены композиции, содержащие соединение согласно изобретению в совместимом фармацевтическом носителе, находящиеся в подходящей емкости и предписанные для лечения указанного состояния. Также могут быть предложены инструкции по применению.
ПРИМЕРЫ
Для лучшего понимания изобретения, описанного в общих чертах, приведены следующие примеры, которые представлены исключительно для иллюстрации конкретных аспектов и вариантов реализации настоящего изобретения и не ограничивают изобретение. Предполагается, что геометрические изомеры, представленные ниже, являются точными формами, но конечная структура может быть определена с помощью 2-D ЯМР-анализа. Несмотря на то, что предполагается, что примеры соединений, описанные ниже, являются геометрическими Z-изомерами, геометрические Е-изомеры и смеси Е- и Z-изомеров также рассматриваются согласно настоящему изобретению.
ПРИМЕР 1

(Е)-4-(диметиламино)-1,1-диметоксибут-3-ен-2-он (1): 1,1-диметокси-N,N-диметилметанамин (100 г, 839 ммоль, 1,02 экв.) и 1,1-диметоксипропан-2-он (97 г, 821 ммоль) добавляли и перемешивали при 110°С в течение 3 часов. Образовавшийся метанол удаляли с помощью устройства Дина-Старка. После охлаждения раствора до комнатной температуры оставшиеся летучие вещества удаляли в вакууме с получением 130 г неочищенного продукта, (Е)-4-(диметиламино)-1,1-диметоксибут-3-ен-2-она (1) (130 г, 143 г теор., 91%). ЖХ/МС m/z 283 (М+1). Ссылка: международная публикация WO 2006/0097341А1, стр. 67.
ПРИМЕР 2
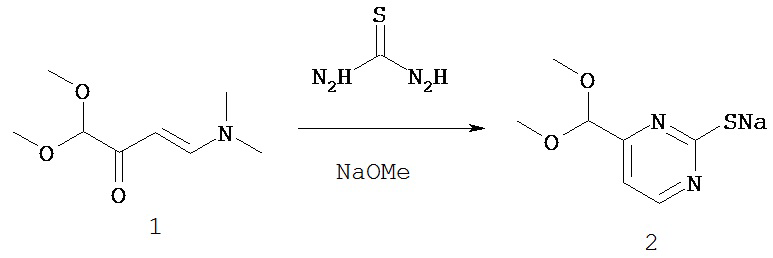
4-(Диметоксиметил)пиримидин-2-тиолат натрия (2): Раствор тиомочевины (64,7 г, 850 ммоль, 1,13 экв.) и метанолата натрия (95%, 40,5 г, 751 ммоль, 1,0 экв.) в метаноле (500 мл, 1,5 М) перемешивали при комнатной температуре в течение 30 минут. Добавляли раствор (Е)-4-(диметиламино)-1,1-диметоксибут-3-ен-2-она (1) (130 г, 751 ммоль) в метаноле (200 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Неочищенный 4-(диметоксиметил)пиримидин-2-тиолат натрия (2) использовали непосредственно в следующем этапе без дополнительной очистки. ЖХ/МС m/z 209 (М+1). Ссылка: международная публикация WO 2006/0097341А1, стр. 67.
ПРИМЕР 3
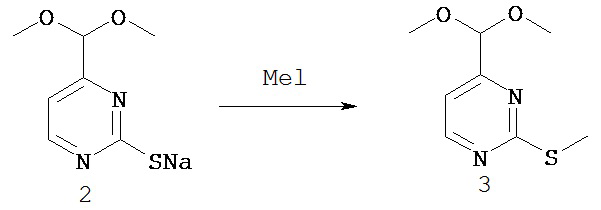
4-(диметоксиметил)-2-(метилтио)пиримидин (3): К неочищенному раствору 4-(диметоксиметил)пиримидин-2-тиолата натрия (2) (156 г, 751 ммоль) в метаноле (700 мл, 1,1 М) осторожно добавляли йодметан (128 г, 902 ммоль, 1,20 экв.) при поддержании температуры реакции ниже 28°C с использованием ледяной/водяной бани для охлаждения. Полученную смесь перемешивали при комнатной температуры в течение 16 часов. После удаления растворителя при пониженном давлении осадок разбавляли водой (300 мл) и экстрагировали этилацетатом (2×150 мл). Комбинированный органический слой концентрировали при пониженном давлении и неочищенный осадок очищали посредством пропускания через короткую пластину с силикагелем и промывки диэтиловым эфиром (200 мл) с получением 4-(диметоксиметил)-2-(метилтио)пиримидина (3) в виде масла коричневого цвета (53,7 г, 150 г теор., 35,7%). ЖХ/МС m/z 201 (М+1). Ссылка: международная публикация WO 2006/0097341А1, стр. 67.
ПРИМЕР 4
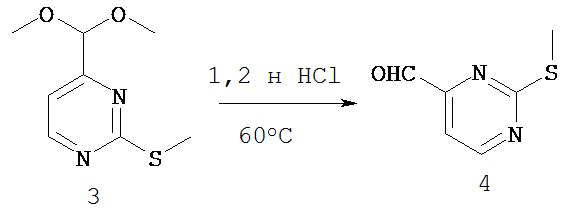
2-(метилтио)пиримидин-4-карбальдегид (4): К 1,2 н водному раствору HCl (300 мл, 268 ммоль, 1,0 экв.) осторожно добавляли 4-(диметоксиметил)-2-(метилтио)пиримидин (3) (53,7 г, 268 ммоль) и перемешивали при 60°С в течение 3 часов. Реакционную смесь затем охлаждали до комнатной температуры и нейтрализовали путем медленного добавления твердого бикарбоната натрия. Неочищенную смесь экстрагировали диэтиловым эфиром (3×150 мл) и комбинированный органический слой концентрировали при пониженном давлении с получением 2-(метилтио)пиримидин-4-карбальдегида (4) в виде твердого вещества желтого цвета (14,2 г, 41,5 г теор., 34%). ЖХ/МС m/z 155 (М+1). Ссылка: международная публикация WO 2006/009734 А1, стр. 67.
ПРИМЕР 5
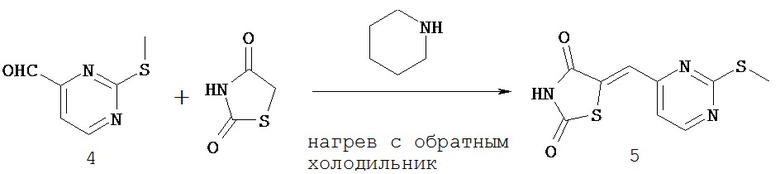
(Z)-5-((2-(Метилтио)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (5): Круглодонную колбу на 40 мл наполняли 2-(метилтио)пиримидин-4-карбальдегидом (4) (771 мг, 5 ммоль), тиазолидин-2,4-дионом (586 мг, 5 ммоль, 1,0 экв.) и пиперидином (400 мкл, 4 ммоль, 0,8 экв.) в этаноле (20 мл, 0,25 М). Реакционную смесь нагревали до 80°С и перемешивали в течение 20 часов. Полученный осадок желтого цвета выделяли посредством фильтрования, промывали этанолом (1×20 мл) и сушили в вакууме с получением (Z)-5-((2-(метилтио)пиримидин-4-ил)метилен)тиазолидин-2,4-диона (5) в виде твердого вещества желтого цвета (550 мг, 898 мг теор., 61%). ЖХ/МС m/z 254 (М+1).
ПРИМЕР 6

(Z)-5-((2-(Метилсульфонил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (6): Смесь (Z)-5-((2-(метилтио)пиримидин-4-ил)метилен)тиазолидин-2,4-диона (5) (3,5 г, 13,82 ммоль) в ТГФ(100 мл, 0,13 М) обрабатывали раствором оксона (25,8 г, 41,5 ммоль, 3,0 экв.) в воде (175 мл). Полученную смесь перемешивали при комнатной температуре в течение 48 часов. Полученный осадок фильтровали и промывали водой (20 мл) и диэтиловым эфиром (20 мл) с получением (Z)-5-((2-(метилсульфонила)пиримидин-4-ил)метилен)тиазолидин-2,4-диона (6) в виде твердого вещества (2,48 г, 3,94 г теор., 63%). ЖХ/МС m/z 286 (М+1).
ПРИМЕР 7

Общий способ замещения 1: Круглодонную колбу на 2 драма наполняли (Z)-5-((2-(метилсульфонил)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом (6) (25 мг, 0,0877 ммоль), ДМСО (1 мл, 0,08 М), диизопропилэтиламином (50 мкл, 0,288 ммоль, 3,2 экв.) и соответствующим амином (0,0877 ммоль, 1,0 экв.). Реакционную смесь нагревали до 120°С и перемешивали в течение 16 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4).
ПРИМЕР 8
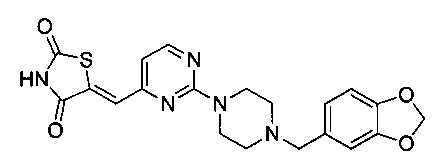
(Z)-5-((2-(4-(Бензо[d][1,3]диоксол-5-илметил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4980) получали с использованием общего способа замещения и 1-(бензо[d][1,3]диоксол-5-илметил)пиперазина (16,6 мг, 37,4 мг теор., 44,3%). ЖХ/МС m/z 426,5 (М+1).
ПРИМЕР 9
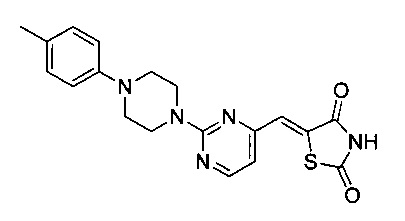
(Z)-5-((2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4981) получали с использованием общего способа замещения и 1-(п-толил)пиперазина (12,5 мг, 33,6 мг теор., 37,2%). ЖХ/МС m/z 382,5 (М+1).
ПРИМЕР 10
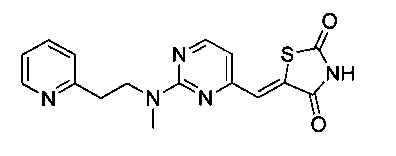
(Z)-5-((2-(метил(2-(пиридин-2-ил)этил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4982) получали с использованием общего способа замещения и N-метил-2-(пиридин-2-ил)этанамина (13,7 мг, 30 мг теор., 45,6%). ЖХ/МС m/z 342,4 (М+1).
ПРИМЕР 11
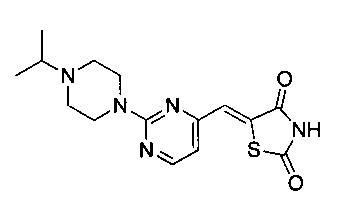
(Z)-5-((2-(4-Изопропилпиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4983) получали с использованием общего способа замещения и 1-изопропилпиперазина (15,3 мг, 29,3 мг теор., 52,1%). ЖХ/МС m/z 334,4 (М+1).
ПРИМЕР 12
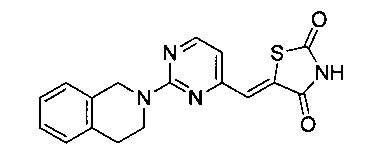
(Z)-5-((2-(3,4-Дигидроизохинолин-2(1Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4984) получали с использованием общего способа замещения и 1,2,3,4-тетрагидроизохинолина (0,1 мг, 29,8 мг теор., 0,3%). ЖХ/МС m/z 339,4 (М+1).
ПРИМЕР 13
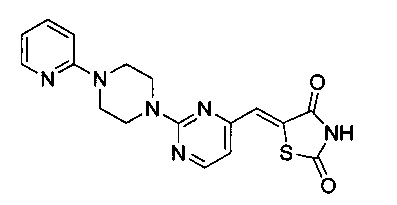
(Z)-5-((2-(4-(Пиридин-2-ил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4985) получали с использованием общего способа замещения и 1-(пиридин-2-ил)пиперазина (25,7 мг, 32,4 мг теор., 79,3%). ЖХ/МС m/z 369,4 (М+1).
ПРИМЕР 14
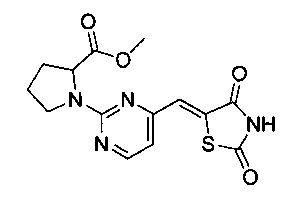
(Z)-метил-1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пирролидин-2-карбоксилат (Соединение 4987) получали с использованием общего способа замещения и метилпирролидин-2-карбоксилата (3,1 мг, 29,4 мг теор., 10,5%). ЖХ/МС m/z 335,4 (М+1).
ПРИМЕР 15
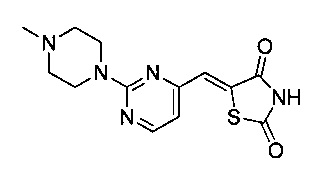
(Z)-5-((2-(4-метилпиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4988) получали с использованием общего способа замещения и 1-метилпиперазина (0,1 мг, 26,9 мг теор., 0,4%). ЖХ/МС m/z 306,4 (М+1).
ПРИМЕР 16

(Z)-5-((2-(4-морфолинопиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4989) получали с использованием общего способа замещения и 4-(пиперидин-4-ил)морфолина (14,7 мг, 33 мг теор., 44,5%). ЖХ/МС m/z 376,4 (М+1).
ПРИМЕР 17
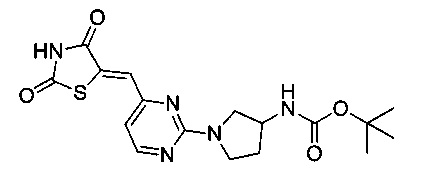
(Z)-трет-бутил (1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пирролидин-3-ил)карбамат (Соединение 4990) получали с использованием общего способа замещения и трет-бутилпирролидин-3-илкарбамата (0,1 мг, 34,4 мг теор., 0,3%). ЖХ/МС m/z 392,4 (М+1).
ПРИМЕР 18
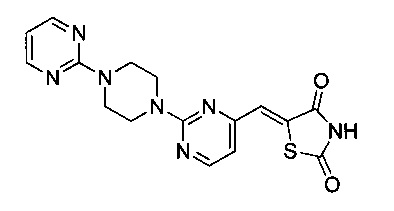
(Z)-5-((2-(4-(пиримидин-2-ил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4991) получали с использованием общего способа замещения и 2-(пиперазин-1-ил)пиримидина (3,1 мг, 32,5 мг теор., 9,5%). ЖХ/МС m/z 370,4 (М+1).
ПРИМЕР 19

(Z)-5-((2-морфолинопиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4992) получали с использованием общего способа замещения и морфолина (7,8 мг, 25,7 мг теор., 30,3%). ЖХ/МС m/z 293,3 (М+1).
ПРИМЕР 20

(Z)-5-((2-(пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4993) получали с использованием общего способа замещения и пиперидина (8,9 мг, 25,5 мг теор., 34,8%). ЖХ/МС m/z 291,3 (М+1).
ПРИМЕР 21

(Z)-5-((2-(пирролидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4994) получали с использованием общего способа замещения и пирролидина (8,3 мг, 24,3 мг теор., 34,1%). ЖХ/МС m/z 277,3 (М+1).
ПРИМЕР 22
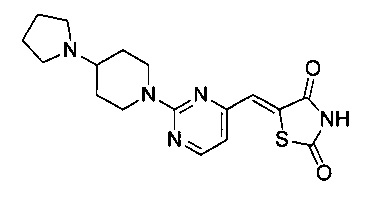
(Z)-5-((2-(4-(пирролидин-1-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4995) получали с использованием общего способа замещения и 4-(пирролидин-1-ил)пиперидина (9,3 мг, 31,6 мг теор., 29,4%). ЖХ/МС m/z 360,4 (М+1).
ПРИМЕР 23

(Z)-трет-бутил-4-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперазин-1-карбоксилат (Соединение 4996) получали с использованием общего способа замещения и трет-бутилпиперазин-1-карбоксилата (6,7 мг, 34,4 мг теор., 19,5%). ЖХ/МС m/z 392,4 (М+1).
ПРИМЕР 24
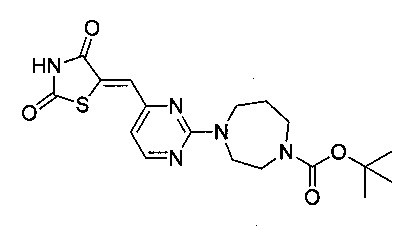
(Z)-трет-бутил 4-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)-1,4-диазепан-1-карбоксилат (Соединение 4997) получали с использованием общего способа замещения и трет-бутил-1,4-диазепан-1-карбоксилата (5,1 мг, 35,7 мг теор., 14,3%). ЖХ/МС m/z 406,5 (М+1).
ПРИМЕР 25
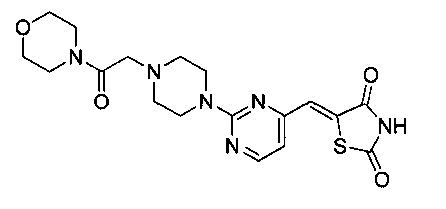
(Z)-5-((2-(4-(2-морфолино-2-оксоэтил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4998) получали с использованием общего способа замещения и 1-морфолино-2-(пиперазин-1-ил)этанона (11,4 мг, 36,8 мг теор., 31%). ЖХ/МС m/z 419,5 (М+1).
ПРИМЕР 26
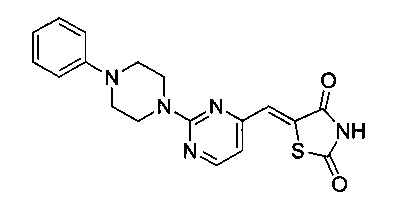
(Z)-5-((2-(4-фенилпиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 4999) получали с использованием общего способа замещения и 1-фенилпиперазина (11,3 мг, 32,3 мг теор., 35%). ЖХ/МС m/z 368,4 (М+1).
ПРИМЕР 27
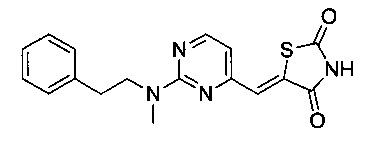
(Z)-5-((2-(метил(фенэтил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 5000) получали с использованием общего способа замещения и N-метил-2-фенилэтанамина (8,3 мг, 30 мг теор., 27,7%). ЖХ/МС m/z 341,4 (М+1).
ПРИМЕР 28
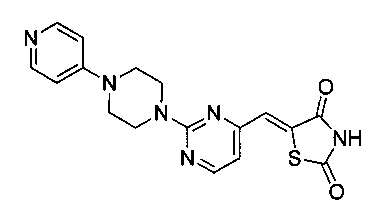
(Z)-5-((2-(4-(пиридин-4-ил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 5001) получали с использованием общего способа замещения и 1-(пиридин-4-ил)пиперазина (7 мг, 32,4 мг теор., 21,6%). ЖХ/МС m/z 369,4 (М+1).
ПРИМЕР 29
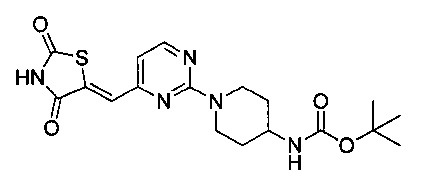
(Z)-трет-бутил(1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)карбамат (Соединение 5002) получали с использованием общего способа замещения и трет-бутилпиперидин-4-илкарбамата (5,9 мг, 35,7 мг теор., 16,5%). ЖХ/МС m/z 406,5 (М+1).
ПРИМЕР 30

(Z)-трет-бутил((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-3-ил)метил)карбамат (Соединение 5003) получали с использованием общего способа замещения и трет-бутил(пиперидин-3-илметил)карбамата (0,1 мг, 36,9 мг теор., 0,3%). ЖХ/МС m/z 420,5 (М+1).
ПРИМЕР 31

(Z)-5-((2-(4-аминопиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10183) получали с использованием общего способа замещения и трет-бутилпиперидин-4-илкарбамата. Очищенный boc-защищенный продукт затем обрабатывали дихлорметаном (1,0 мл), соляной кислотой в метаноле (500 мкл, 1,25 М)) и 50°С в течение 16 часов. Реакционную смесь затем концентрировали при пониженном давлении (Genevac НТ-4) с получением (1,7 мг, 26,9 мг теор., 6,3%). ЖХ/МС m/z 306,4 (М+1).
ПРИМЕР 32
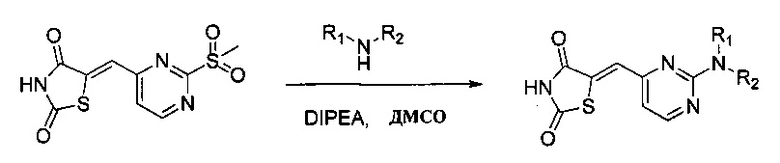
Общий способ замещения 2: Круглодонную колбу на 2 драхмы наполняли (Z)-5-((2-(метилсульфонила)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом (25 мг, 0,0877 ммоль), ДМСО (1 мл, 0,08 М), диизопропилэтиламином (50 мкл, 0,288 ммоль, 3,2 экв.) и соответствующим амином (0,0877 ммоль, 1,0 экв.). Реакционную смесь нагревали до 110°С и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4).
ПРИМЕР 33
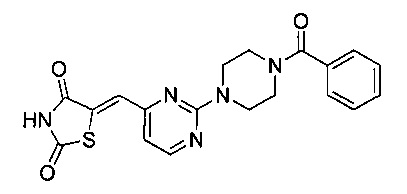
(Z)-5-((2-(4-бензоилпиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10189) получали с использованием общего способа замещения и фенил(пиперазин-1-ил)метанона (4,1 мг, 34,7 мг теор., 11,8%). ЖХ/МС m/z 396 (М+1).
ПРИМЕР 34
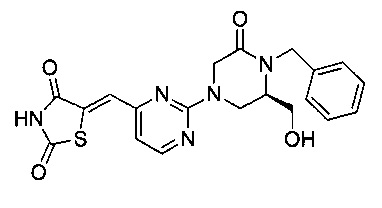
(R,Z)-5-((2-(4-бензил-3-(гидроксиметил)-5-оксопиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10190) получали с использованием общего способа замещения и (R)-1-бензил-6-(гидроксиметил)пиперазин-2-она (5,1 мг, 37,4 мг теор., 13,6%). ЖХ/МС m/z 426 (М+1).
ПРИМЕР 35
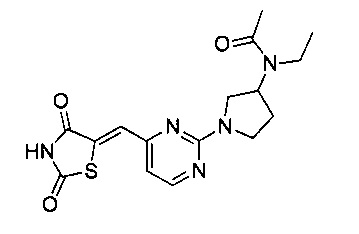
(Z)-N-(1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пирролидин-3-ил)-N-этилацетамид (Соединение 10191) получали с использованием общего способа замещения и N-этил-N-(пирролидин-3-ил)ацетамида (12,1 мг, 31,8 мг теор., 38%). ЖХ/МС m/z 362 (М+1).
ПРИМЕР 36
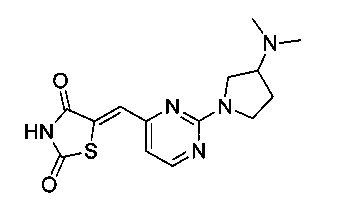
(Z)-5-((2-(3-(диметиламино)пирролидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10192) получали с использованием общего способа замещения и N,N-диметилпирролидин-3-амина (12,2 мг, 28,1 мг теор., 43,4%). ЖХ/МС m/z 320 (М+1).
ПРИМЕР 37
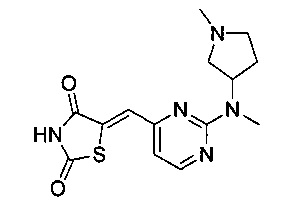
(Z)-5-((2-(метил(1-метилпирролидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10193) получали с использованием общего способа замещения и N,1-диметилпирролидин-3-амина (1,1 мг, 28,1 мг теор., 3,9%). ЖХ/МС m/z 320 (М+1).
ПРИМЕР 38

(Z)-5-((2-(4-(2-гидроксиэтил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10194) получали с использованием общего способа замещения и 2-(пиперазин-1-ил)этанола (4,4 мг, 29,5 мг теор., 14,9%). ЖХ/МС m/z 336 (М+1).
ПРИМЕР 39
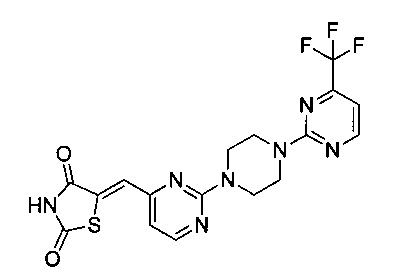
(Z)-5-((2-(4-(4-(трифторметил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10195) получали с использованием общего способа замещения и 2-(пиперазин-1-ил)-4-(трифторметил)пиримидина (5,8 мг, 38,5 мг теор., 15,1%). ЖХ/МС m/z 438 (М+1).
ПРИМЕР 40
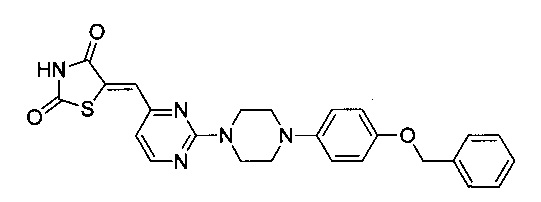
(Z)-5-((2-(4-(4-(бензилокси)фенил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10196) получали с использованием общего способа замещения и 1-(4-(бензилокси)фенил)пиперазина (4 мг, 41,7 мг теор., 9,6%). ЖХ/МС m/z 474 (М+1).
ПРИМЕР 41
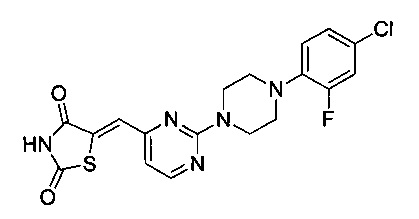
(Z)-5-((2-(4-(4-хлор-2-фторфенил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10197) получали с использованием общего способа замещения и 1-(4-хлор-2-фторфенил)пиперазина (4,8 мг, 36,9 мг теор., 13%). ЖХ/МС m/z 420 (М+1).
ПРИМЕР 42
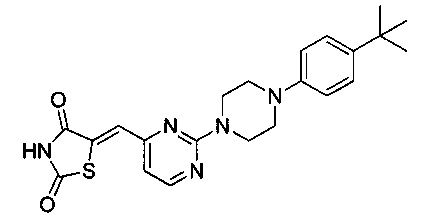
(Z)-5-((2-(4-(4-(трет-бутил)фенил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10198) получали с использованием общего способа замещения и 1-(4-(трет-бутил)фенил)пиперазина (3,7 мг, 37,2 мг теор., 10%). ЖХ/МС m/z 424 (М+1).
ПРИМЕР 43

(Z)-5-((2-(4-(3,5-бис(трифторметил)фенил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10199) получали с использованием общего способа замещения и 1-(3,5-бис(трифторметил)фенил)пиперазина (3,8 мг, 44,3 мг теор., 8,6%). ЖХ/МС m/z 504 (М+1).
ПРИМЕР 44
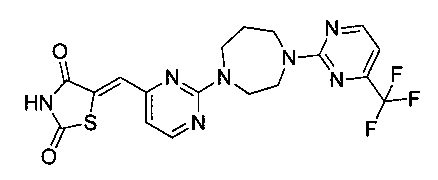
(Z)-5-((2-(4-(4-(трифторметил)пиримидин-2-ил)-1,4-диазепан-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10200) получали с использованием общего способа замещения и 1-(4-(трифторметил)пиримидин-2-ил)-1,4-диазепана (4,9 мг, 39,7 мг теор., 12,3%). ЖХ/МС m/z 452 (М+1).
ПРИМЕР 45
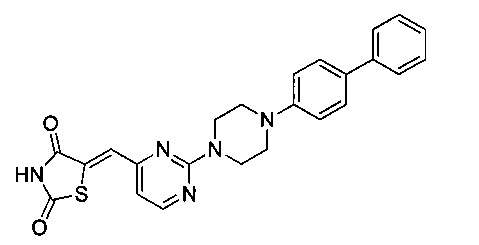
(Z)-5-((2-(4-([1,1'-бифенил]-4-ил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10201) получали с использованием общего способа замещения и 1-([1,1'-бифенил]-4-ил)пиперазина (1,2 мг, 39 мг теор., 3,1%). ЖХ/МС m/z 444 (М+1).
ПРИМЕР 46
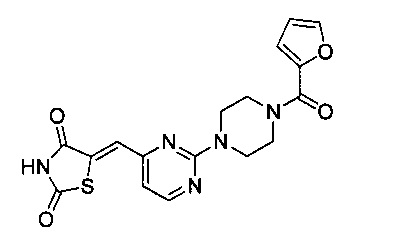
(Z)-5-((2-(4-(фуран-2-карбонил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10202) получали с использованием общего способа замещения и фуран-2-ил(пиперазин-1-ил)метанона (6 мг, 33,9 мг теор., 17,7%). ЖХ/МС m/z 386 (М+1).
ПРИМЕР 47

(Z)-5-((2-(4-((4-фторфенил)(фенил)метил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10203) получали с использованием общего способа замещения и 1-((4-фторфенил)(фенил)метил)пиперазина (14,4 мг, 41,8 мг теор., 34,4%). ЖХ/МС m/z 476 (М+1).
ПРИМЕР 48
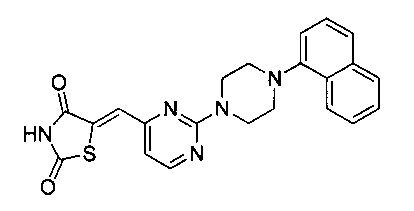
(Z)-5-((2-(4-(нафталин-1-ил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10204) получали с использованием общего способа замещения и 1-(нафталин-1-ил)пиперазина (6,2 мг, 36,7 мг теор., 16,9%). ЖХ/МС m/z 418 (М+1).
ПРИМЕР 49
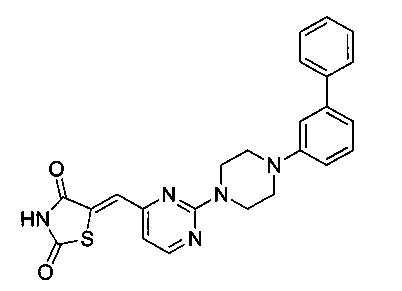
(Z)-5-((2-(4-([1,1'-бифенил]-3-ил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10205) получали с использованием общего способа замещения и 1-([1,1'-бифенил]-3-ил)пиперазина (10,4 мг, 39 мг теор., 26,7%). ЖХ/МС m/z 444 (М+1).
ПРИМЕР 50
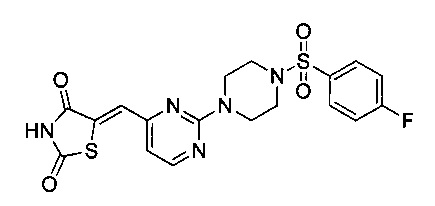
(Z)-5-((2-(4-((4-фторфенил)сульфонил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10206) получали с использованием общего способа замещения и 1-((4-фторфенил)сульфонила)пиперазина (5,2 мг, 39,6 мг теор., 13,1%). ЖХ/МС m/z 450 (М+1).
ПРИМЕР 51
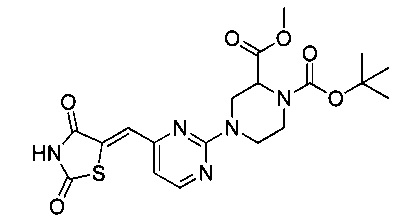
(Z)-1-трет-бутил-2-метил-4-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперазин-1,2-дикарбоксилат (Соединение 10207) получали с использованием общего способа замещения и 1-трет-бутил-2-метил пиперазин-1,2-дикарбоксилата (2,8 мг, 39,6 мг теор., 7%). ЖХ/МС m/z 450 (М+1).
ПРИМЕР 52
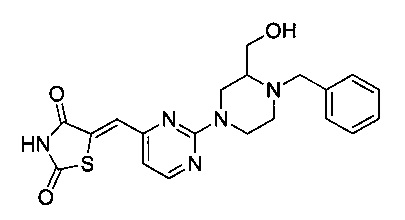
(Z)-5-((2-(4-бензил-3-(гидроксиметил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10208) получали с использованием общего способа замещения и (1-бензилпиперазин-2-ил)метанола (1,7 мг, 36,2 мг теор., 4,7%). ЖХ/МС m/z 413 (М+1).
ПРИМЕР 53
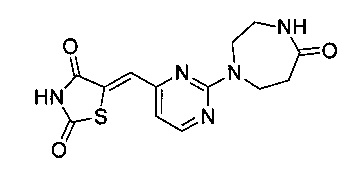
(Z)-5-((2-(5-оксо-1,4-диазепан-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10209) получали с использованием общего способа замещения и 1,4-диазепан-5-она (1,1 мг, 28,1 мг теор., 3,9%). ЖХ/МС m/z 320 (М+1).
ПРИМЕР 54
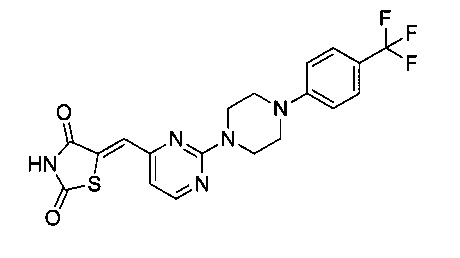
(Z)-5-((2-(4-(4-(трифторметила)фенил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10210) получали с использованием общего способа замещения и 1-(4-(трифторметила)фенил)пиперазина (3,3 мг, 38,3 мг теор., 8,6%). ЖХ/МС m/z 436 (М+1).
ПРИМЕР 55
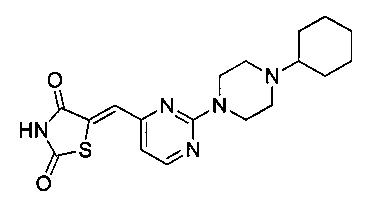
(Z)-5-((2-(4-циклогексилпиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10211) получали с использованием общего способа замещения и 1-циклогексилпиперазина (10,7 мг, 32,9 мг теор., 32,5%). ЖХ/МС m/z 374 (М+1).
ПРИМЕР 56
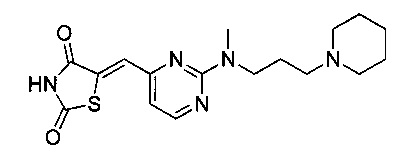
(Z)-5-((2-(метил(3-(пиперидин-1-ил)пропил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10212) получали с использованием общего способа замещения и N-метил-3-(пиперидин-1-ил)пропан-1-амина (10,2 мг, 31,8 мг теор., 32,1%). ЖХ/МС m/z 362 (М+1).
ПРИМЕР 57

(Z)-5-((2-(4-((1-метилпиперидин-4-ил)метил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10250) получали с использованием общего способа замещения и 1-((1-метилпиперидин-4-ил)метил)пиперазина (7,3 мг, 42,3 мг теор., 17,2%). ЖХ/МС m/z 403 (М+1).
ПРИМЕР 58
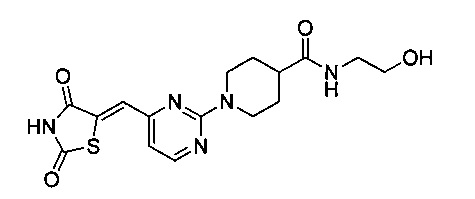
(Z)-1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)-N-(2-гидроксиэтил)пиперидин-4-карбоксамид (Соединение 10251) получали с использованием общего способа замещения и N-(2-гидроксиэтил)пиперидин-4-карбоксамида (10,8 мг, 39,7 мг теор., 27,2%). ЖХ/МС m/z 378 (М+1).
ПРИМЕР 59
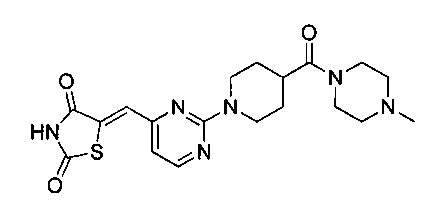
(Z)-5-((2-(4-(4-метилпиперазин-1-карбонил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10252) получали с использованием общего способа замещения и (4-метилпиперазин-1-ил)(пиперидин-4-ил)метанона (5,5 мг, 43,8 мг теор., 12,6%). ЖХ/МС m/z 417 (М+1).
ПРИМЕР 60
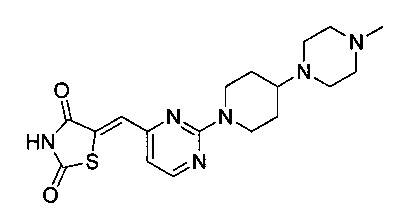
(Z)-5-((2-(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10253) получали с использованием общего способа замещения и 1-метил-4-(пиперидин-4-ил)пиперазина (12,4 мг, 40,9 мг теор., 30,4%). ЖХ/МС m/z 389 (М+1).
ПРИМЕР 61
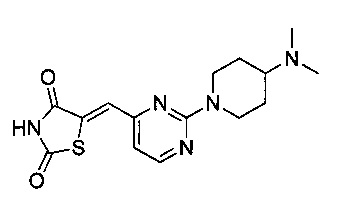
(Z)-5-((2-(4-(диметиламино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10254) получали с использованием общего способа замещения и N,N-диметилпиперидин-4-амина (5 мг, 35,1 мг теор., 14,3%). ЖХ/МС m/z 334 (М+1).
ПРИМЕР 62
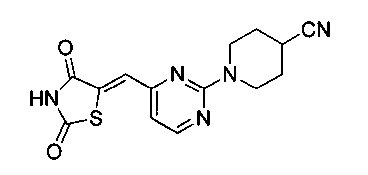
(Z)-1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-карбонитрил (Соединение 10255) получали с использованием общего способа замещения и пиперидин-4-карбонитрила (7,5 мг, 33,2 мг теор., 22,6%). ЖХ/МС m/z 316 (М+1).
ПРИМЕР 63

(Z)-5-((2-((2-гидрокси-2-фенилэтил)(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10264) получали с использованием общего способа замещения и 2-(метиламино)-1-фенилэтанола (10,8 мг, 37,5 мг теор., 28,8%). ЖХ/МС m/z 357 (М+1).
ПРИМЕР 64
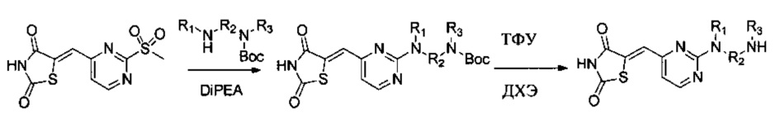
Общий способ замещения 3: Круглодонную колбу на 2 драхма наполняли (Z)-5-((2-(метилсульфонила)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом (50 мг, 0,175 ммоль), ДМСО (2 мл, 0,08 М), диизопропилэтиламином (34 мкл, 0,193 ммоль, 1,1 экв.) и соответствующим амином (0,175 ммоль, 1,0 экв.). Реакционную смесь нагревали до 100°С и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4). К неочищенному продукту затем добавляли 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4).
ПРИМЕР 65
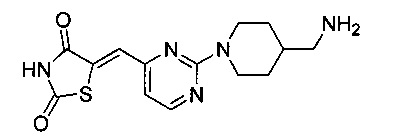
(Z)-5-((2-(4-(аминометил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион получали с использованием общего способа замещения и трет-бутил(пиперидин-4-илметил)карбамата (49 мг, 55,9 мг теор., 88%). ЖХ/МС m/z 320 (М+1).
ПРИМЕР 66
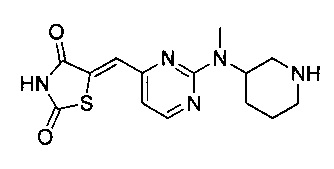
(Z)-5-((2-(метил(пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10257) получали с использованием общего способа замещения и трет-бутил-3-(метиламино)пиперидин-1-карбоксилата (2,3 мг, 55,9 мг теор., 4,1%). ЖХ/МС m/z 320 (М+1).
ПРИМЕР 67

(Z)-5-((2-(3-метилпиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10258) получали с использованием общего способа замещения и трет-бутил-2-метилпиперазин-1-карбоксилата (1,5 мг, 53,4 мг теор., 2,8%). ЖХ/МС m/z 306 (М+1).
ПРИМЕР 68
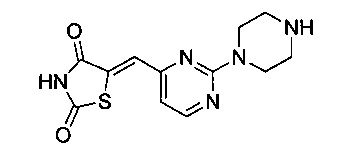
(Z)-5-((2-(пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10259) получали с использованием общего способа замещения и трет-бутилпиперазин-1-карбоксилата (17,7 мг, 51 мг теор., 34,7%). ЖХ/МС m/z 292 (М+1).
ПРИМЕР 69
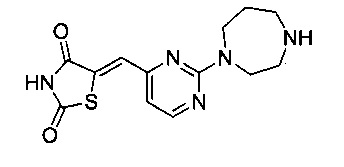
(Z)-5-((2-(1,4-диазепан-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10260) получали с использованием общего способа замещения и трет-бутил-1,4-диазепан-1-карбоксилата (15,2 мг, 53,4 мг теор., 28,4%). ЖХ/МС m/z 306 (М+1).
ПРИМЕР 70
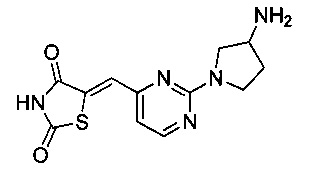
(Z)-5-((2-(3-аминопирролидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10261) получали с использованием общего способа замещения и трет-бутилпирролидин-3-илкарбамата (16,5 мг, 51 мг теор., 32,4%). ЖХ/МС m/z 292 (М+1).
ПРИМЕР 71

(Z)-5-((2-(3-аминопиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10262) получали с использованием общего способа замещения и трет-бутилпиперидин-3-илкарбамата (16,9 мг, 29,8 мг теор., 53,4%). ЖХ/МС m/z 306 (М+1).
ПРИМЕР 72
Синтез (Z)-5-((6-(2-метоксиэтокси)-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-диона (Соединение 10214)
Круглодонную колбу на 25 мл наполняли 2-метоксиэтанолом (57 мкл, 1 экв.) и ТГФ (2,5 мл). 60% NaH в масле (21 мг, 1,1 экв.) добавляли при 0°С в атмосфере аргона. Реакционную смесь перемешивали в течение 5 мин при -5°С и в течение 1 часа 15 мин. при комнатной температуре. Метил-2,6-дихлорпиримидин-4-карбоксилат (150 мг, 1 экв.), растворенный в ТГФ (1 мл), добавляли в течение 5 мин. при -78°С. Реакционную смесь перемешивали в течение 4 часов при нагревании от -78°С до 0°С. По результатам ЖХ/МС через 3 часа (-15°С) наблюдали 2 пика (отношение 2:1) с желаемой массой на 1,57 мин. и 1,67 мин. (М+1 = 247 и 249). Реакцию гасили 10% NH4Cl (5 мл) при 0°С. Водный слой экстрагировали EtOAc (3×10 мл). Комбинированный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением 161 мг неочищенной смеси метил-2-хлор-6-(2-метоксиэтокси)пиримидин-4-карбоксилата и метил-6-хлор-2-(2-метоксиэтокси)пиримидин-4-карбоксилата, которую частично разделяли с помощью флэш-хроматографии на силикагеле (10 г, гексаны/EtOAc, от 9:1 до 7:3).
F1: 47 мг чистого желаемого изомера 6-алкокси (26%, 179 мг теор.)
F2: 19,3 мг смеси изомеров (11%)
F3: 28,8 мг чистого нежелательного изомера 2-алкокси (16%)
Круглодонную колбу на 25 мл наполняли метил-2-хлор-6-(2-метоксиэтокси)пиримидин-4-карбоксилатом [SAD105-047F1] (45 мг, 1 экв.) и CH2Cl2 (1 мл). 1 М DIBAL-H (0,2 мл, 1,1 экв.) добавляли при -78°С в течение 2 мин в атмосфере аргона. Реакционную смесь перемешивали в течение 3 часов при -78°С, при этом по результатам ЖХ/МС все еще наблюдали большое количество исходного материала. Дополнительную порцию 1 М DIBAL-H (0,27 мл, 1,4 экв.) добавляли при -78°С в течение 2 мин в атмосфере аргона, и через 0,5 часа по результатам ЖХ/МС больше не наблюдали исходный материал, при этом наблюдали 1 основной пик на 1,20 мин. (М+1=217, М+1+МеОН=249). Реакцию гасили МеОН (0,5 мл) и затем 10% NH4Cl (1 мл). Реакционную смесь нагревали до комнатной температуры и затем растворитель концентрировали при пониженном давлении. Осадок разбавляли 10% NH4Cl (4 мл). Водный слой экстрагировали EtOAc (3×10 мл). Комбинированный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением 41,9 мг неочищенного 2-хлор-6-(2-метоксиэтокси)пиримидин-4-карбальдегида в виде масла желтого цвета, которое использовали в следующем этапе без дополнительной очистки, (Н ЯМР δ: 9,91 (s, 1Н); 7,23 (s, 1Н); 4,59-4,64 (m, 2Н), 3,7-3,8 (m, 2Н); 3,44 (s, 3Н).
Неочищенный 2-хлор-6-(2-метоксиэтокси)пиримидин-4-карбальдегид (sad105-052, 41,9 мг) растворяли в этаноле (1,5 мл) и добавляли в пробирку на 10 мл, содержащую тиазолидиндион (21,3 мг, 0,18 ммоль) и 1-(п-толил)пиперазин (39,3 мг, 0,18 ммоль). Реакционную смесь перемешивали при 80°С в течение 15,5 часов. По результатам ЖХ/МС наблюдали пик с желаемой массой на 2,18 мин. (М+1=456). Растворитель концентрировали при пониженном давлении и осадок растворяли в EtOAc (20 мл) и промывали насыщенным раствором NaHCO3 (10 мл). Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением 85,7 мг масла коричневого цвета. В результате очистки с помощью флэш-хроматографии (SiO2, 10 г, гексаны/EtOAc, от 9:1 до 6:4 до 1:1) получали 11,5 мг (13,9%, 2 этапа, 83 мг теор.) чистого (Z)-5-((6-(2-метоксиэтокси)-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-диона в виде твердого вещества желтого цвета.
ПРИМЕР 73
Синтез (Z)-5-((6-метокси-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-диона (Соединение 10227)

Круглодонную колбу на 40 мл наполняли метанолом (120 мкл из 200 мкл МеОН в 1 мл ацетонитрила, 1 экв.), K2СО3 (67 мг, 1 экв.), метил-2,6-дихлорпиримидин-4-карбоксилатом (100 мг, 1 экв.) и ацетонитрилом (2 мл). Реакционную смесь перемешивали в течение 2,5 часов при комнатной температуре, по результатам ЖХ/МС наблюдали только исходный материал. Реакционную смесь затем перемешивали в течение 1 часа при 85°С. По результатам ЖХ/МС наблюдали образование небольшого количества желаемого продукта (1,51 мин., М+1=203). Добавляли метанол (0,200 мл, 10 экв.) и реакционную смесь перемешивали в течение 15 часов при 85°С. По результатам ЖХ/МС наблюдали в основном 1 пик с помощью УФ-детекции и МС на 1,53 мин. и небольшое количество бис-метоксипиримидина. Твердый осадок отфильтровывали и фильтрат выпаривали с получением 89 мг (91% выход неочищенного продукта, теор. 98 мг) неочищенного желаемого продукта. По результатам Н-ЯМР наблюдали смесь (11:1) желаемого продукта и побочного продукта бис-метоксипиримидина (М+1=199). Материал использовали в следующем этапе без дополнительной очистки.
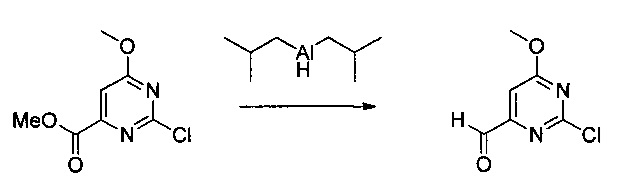
Круглодонную колбу на 25 мл наполняли метил-2-хлор-6-метоксипиримидин-4-карбоксилатом [sad105-055, неочищенный] (74 мг, 1 экв.) в атмосфере аргона. Добавляли 1 М DIBAL-H в дихлорметане (0,73 мл, 2 экв.) в течение 5 мин. и реакционную смесь перемешивали при -78°С в течение 45 мин. Через 0,5 часов по результатам ЖХ/МС наблюдали завершение реакции. Реакцию гасили при -78°С метанолом (0,5 мл) и затем 10% NH4Cl (2 мл). Растворители концентрировали при пониженном давлении и осадок разбавляли 10% NH4Cl (3 мл). Водный слой экстрагировали EtOAc (3×10 мл). Комбинированный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением неочищенного продукта 2-хлор-6-метоксипиримидин-4-карбальдегида в виде масла оранжевого цвета (76 мг, 63 мг теор., 121%). ЖХ/МС m/z: 205,0: (М+1+МеОН, гемиацетат с метанолом). Некоторое количество восстановленного спирта также наблюдали в неочищенном продукте (2,17 мин, М+1=175). Неочищенный альдегид использовали непосредственно в следующем этапе без дополнительной очистки.
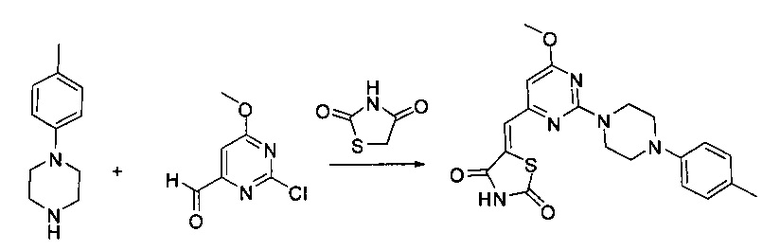
Неочищенный 2-хлор-6-метоксипиримидин-4-карбальдегид (sad105-058, 76 мг) растворяли в этаноле (2 мл) и добавляли во флакон на 10 мл, содержащий тиазолидиндион (42,8 мг, 0,37 ммоль, 1 экв.) и 1-(п-толил)пиперазин (70,8 мг, 0,40 ммоль, 1,1 экв.). Смесь перемешивали в течение 45 часов при 80°С и в течение 15 часов при 90°С с получением осадка. По результатам ЖХ/МС раствора наблюдали некоторое количество продукта на (М+1=412) и некоторое количество промежуточного соединения на (М+1=430). Желаемый продукт отбирали из раствора и по результатам ЖХ/МС раствора не наблюдали превращения реакции. Твердое вещество желтого цвета фильтровали с использованием пастеровской пипетки через пластину из стекловаты и твердое вещество промывали EtOH (4×0,5 мл). Фильтрат этанола содержал некоторое количество желаемого продукта. Твердое вещество заново растворяли в CH2Cl2 и нерастворимое твердое вещество отфильтровывали. Фильтрат концентрировали при пониженном давлении с получением 20 мг желаемого продукта (Z)-5-((6-метокси-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-диона (97,3% чистота). Нерастворимое твердое вещество распределяли между насыщенным раствором NaHCO3 (3 мл) и CH2Cl2 (2×5 мл). Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением дополнительных 13,4 мг желаемого продукта (в общем 33,4 мг, 150 мг теор., 22%). ЖХ/МС m/z: 412 (М+1).
ПРИМЕР 74
Синтез (Z)-5-((2-(4-(п-толил)пиперазин-1-ил)пиридин-4-ил)метилен)тиазолидин-2,4-диона (Соединение 10263)
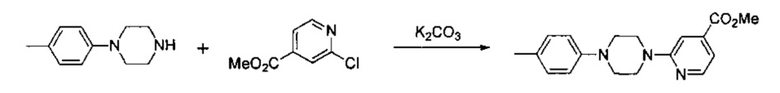
Круглодонную колбу на 40 мл наполняли метил-2-хлоризоникотинатом (200 мг, 1,17 ммоль, 1 экв.) и 1-(п-толил)пиперазином (205 мг, 1,17 ммоль, 1 экв.). Добавляли толуол (3 мл) и ДМСО (3 мл) с последующим добавлением карбоната калия (403 мг, 2,9 ммоль, 2,5 экв.). Смесь перемешивали в течение 18 часов при 100°С. По результатам ЖХ/МС через 18 часов наблюдали пик на 1,68 мин. с желаемой массой (М+1=312) с параллельным вымыванием хлорпиридинового исходного материала (М+1=172). Реакционную смесь разбавляли водой (5 мл) и водный слой экстрагировали CH2Cl2 (3×10 мл). Комбинированный органический слой сушили над Na2SO4 и затем концентрировали при пониженном давлении. Неочищенную смесь очищали на силикагеле (10 г, гексаны/EtOAc 9:1 to 1:1) с получением желаемого продукта в виде белых кристаллов (27 мг, 67 мг теор., 40%).
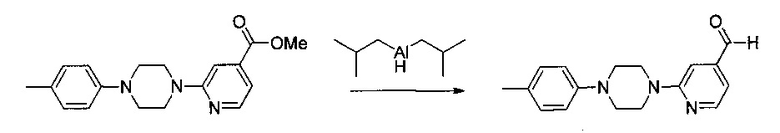
Круглодонную колбу на 25 мл наполняли метил-2-(4-(п-толил)пиперазин-1-ил)изоникотинатом (27 мг, 0,087 ммоль, 1 экв.) и CH2Cl2 (1 мл). Добавляли 1 М DIBAL-H в CH2Cl2 (130 мкл, 0,13 ммоль, 1,5 экв.) в атмосфере аргона при -78°С в течение 2 мин. Реакционную смесь гасили МеОН (0,5 мл) при -78°С. По результатам ЖХ/МС неочищенной смеси наблюдали смесь (1:1) спирта (1,21 мин, М+1=284) и альдегида в виде гемиацеталя с метанолом (1,38 мин, M+1+MeOH=314,3). Неочищенный альдегид использовали непосредственно в следующем этапе без какой-либо дополнительной очистки.
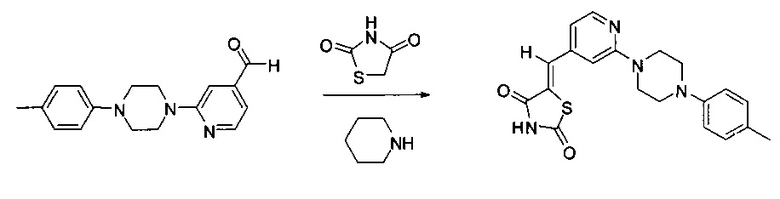
Неочищенный 2-(4-(п-толил)пиперазин-1-ил)изоникотинальдегид [sad105-080] растворяли в этаноле (1 мл) и добавляли во флакон на 10 мл, содержащий тиазолидиндион (10,2 мг, 0,087 ммоль) и 1-(п-толил)пиперазин (5,9 мг, 0,087 ммоль). Реакционную смесь перемешивали при 90°С в течение 19,5 часов. По результатам ЖХ/МС наблюдали новый пик с желаемой массой на 1,78 мин. (М+1=381). Реакционную смесь концентрировали при пониженном давлении и осадок очищали с помощью флэш-хроматографии (SiO2, 10 г, гексаны/EtOAc, от 9:1 до 4:6) с получением 10,1 мг (30%, 2 этапа, 33,1 мг теор.) (Z)-5-((2-(4-(п-толил)пиперазин-1-ил)пиридин-4-ил)метилен)тиазолидин-2,4-диона в виде твердого вещества желтого цвета. Указанное твердое вещество желтого цвета растворяли в горячем EtOH (0,5 мл). При охлаждении выпадало в осадок твердое вещество желтого цвета, которое фильтровали через пластину из стекловаты и промывали 0,25 мл этанола. Указанное твердое вещество заново растворяли в CH2Cl2 и концентрировали при пониженном давлении с получением 1,7 мг указанного в заголовке продукта. ЖХ/МС m/z: (М+1=381).
ПРИМЕР 75
Синтез (Z)-5-((6-(4-(п-толил)пиперазин-1-ил)пиридин-2-ил)метилен)тиазолидин-2,4-диона (Соединение 10216)
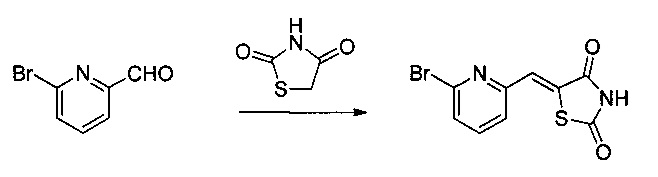
Круглодонную колбу на 40 мл наполняли тиазолидин-2,4-дионом (300 мг, 2,56 ммоль, 1 экв.) и 6-бромпиколинальдегидом (477 мг, 2,56 ммоль, 1 экв.). Добавляли толуол (5 мл, 0,5 М), ледяную уксусную кислоту (22 мкл, 0,38 ммоль, 0,15 экв.) и пиперидин (25 мкл, 0,25 ммоль, 0,1 экв.) и через содержимое колбы пропускали аргон. Смесь перемешивали в течение 16 часов при 125°С. Полученное твердое вещество собирали посредством фильтрования и затем промывали ацетоном (3×5 мл). Твердое вещество сушили при пониженном давлении с получением (Z)-5-((6-бромпиридин-2-ил)метилен)тиазолидин-2,4-диона (439 мг, 731 мг теор., 60%). ЖХ/МС m/z: 286 (М+1).
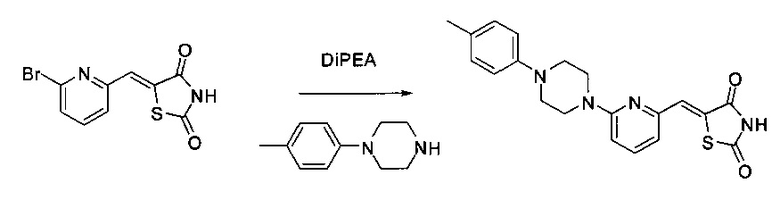
Круглодонную колбу на 8 мл наполняли 1-(п-толил)пиперазином (56 мг, 0,318 ммоль, 1 экв.) и ДМСО (1 мл, 0,3 М), DIPEA (105 мкл, 0,636 ммоль, 2 экв.), (Z)-5-((6-бромпиридин-2-ил)метилен)тиазолидин-2,4-дионом (91 мг, 0,318 ммоль, 1 экв.) и через содержимое колбы пропускали аргон. Смесь перемешивали в течение 48 часов при 110°С. Реакционную смесь затем распределяли между CH2Cl2 (10 мл) и насыщенным раствором NaCl (20 мл). Водный слой снова экстрагировали CH2Cl2 (2×15 мл) и комбинированный органический слой сушили над ххх и концентрировали при пониженном давлении с получением осадка оранжевого цвета. Указанный осадок оранжевого цвета растирали с эфиром (3×15 мл) с получением (Z)-5-((6-(4-(п-толил)пиперазин-1-ил)пиридин-2-ил)метилен)тиазолидин-2,4-диона в виде твердого вещества оранжевого цвета (65 мг, 122 мг теор., 53%). ЖХ/МС m/z: 382 (М+1).
ПРИМЕР 76
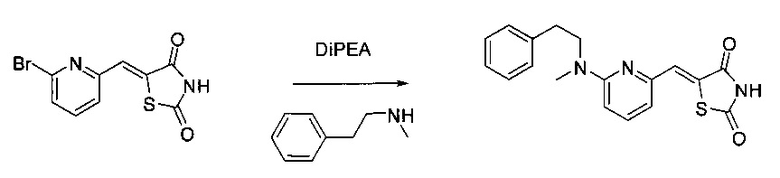
(Z)-5-((6-(метил(фенэтил)амино)пиридин-2-ил)метилен)тиазолидин-2,4-дион:
Круглодонную колбу на 8 мл наполняли N-метил-2-фенилэтанамином (43 мг, 0,318 ммоль, 1 экв.) и ДМСО (1 мл, 0,3 М), DIPEA (105 мкл, 0,636 ммоль, 2 экв.), (Z)-5-((6-бромпиридин-2-ил)метилен)тиазолидин-2,4-дионом (91 мг, 0,318 ммоль, 1 экв.) и через содержимое колбы пропускали аргон. Смесь перемешивали в течение 48 часов при 110°С. Реакционную смесь затем распределяли между CH2Cl2 (10 мл) и насыщенным раствором NaCl (20 мл). Водный слой снова экстрагировали CH2Cl2 (2×15 мл) и комбинированный органический слой сушили над ххх и концентрировали при пониженном давлении с получением осадка оранжевого цвета. Указанный осадок оранжевого цвета осадок растирали с эфиром (3×15 мл) с получением (Z)-5-((6-(метил(фенэтил)амино)пиридин-2-ил)метилен)тиазолидин-2,4-диона в виде пленки оранжевого цвета (2,6 мг, 175 мг теор., 5%). ЖХ/МС m/z: 340 (М+1).
ПРИМЕР 77
Общий способ 1 получения амино-аналогов
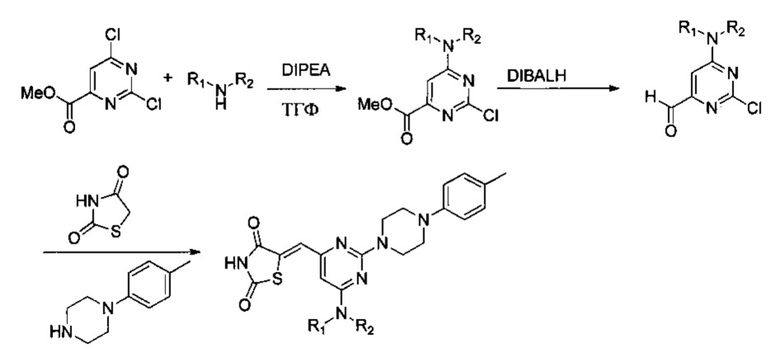
Метил-2,6-дихлорпиримидин-4-карбоксилат (200 мг, 0,966 ммоль) в 2 мл ТГФ обрабатывали DIPEA (185 мкл, 1,06 ммоль) и реакционную смесь затем охлаждали до 0°С. Затем к реакционной смеси медленно добавляли раствор соответствующего амина (1 экв., 0,966 ммоль) в 2 мл ТГФ. Реакционную смесь перемешивали в течение 2 часов и затем концентрировали при пониженном давлении с получением неочищенного продукта светло-желтого цвета, который использовали без какой-либо дополнительной очистки.
Неочищенный продукт светло-желтого цвета (1 экв.) обрабатывали ДХМ (2 мл). Реакционную смесь затем охлаждали до -70°С и добавляли по каплям 1 М DIBALH (180 мкл, 1,1 экв.) и перемешивали в течение 2 часов. Дополнительные 100 мкл DIBALH добавляли по каплям и перемешивали в течение дополнительных 3 часов. Затем добавляли МеОН (1 мл) для гашения реакции. Реакционной смеси затем позволяли нагреваться до комнатной температуры и распределяли между водой (5 мл) и ДХМ (5 мл). Слой ДХМ собирали и концентрировали при пониженном давлении. С помощью флэш-хроматографии с использованием смеси 50%-80% EtOAc/гексаны получали желаемый альдегид.
Альдегид обрабатывали тиазолидин-2,4-дионом (1 экв.) и 1-(п-толил)пиперазином (1,1 экв.) в 2 мл EtOH. Реакционную смесь затем нагревали до 85°С в течение 16 часов и затем дополнительно нагревали до 95°С в течение 24 часов. Реакционную смесь затем концентрировали и очищали с помощью хроматографической системы Biotage с использованием смеси гексаны/EtOA (1:1) с получением конечных амино-аналогов.
ПРИМЕР 78

(Z)-5-((6-(метил(фенэтил)амино)-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10217) получали с использованием общего способа 1 получения амино-аналогов и N-метил-2-фенилэтанамина (4,2 мг, 90 мг теор., 5%, 3 этапов). ЖХ/МС m/z: 515 (М+1).
ПРИМЕР 79
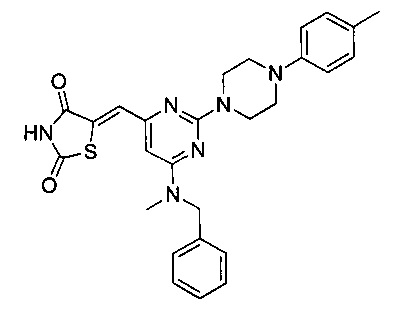
(Z)-5-((6-(бензил(метил)амино)-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10238) получали с использованием общего способа 1 получения амино-аналогов и N-метилбензиламина (5,1 мг, 85 мг теор., 6%, 3 этапов). ЖХ/МС m/z: 501 (М+1).
ПРИМЕР 80
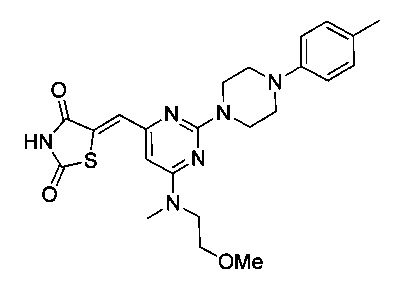
(Z)-5-((6-((2-метоксиэтил)(метил)амино)-2-(4-(-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10243) получали с использованием общего способа замещения и N-метил-1-фенилметанамина (34 мг, 142 мг теор., 23,9%, 3 этапа). ЖХ/МС m/z 501: (М+1).
ПРИМЕР 81
Общий способ 2 получения амино-аналогов
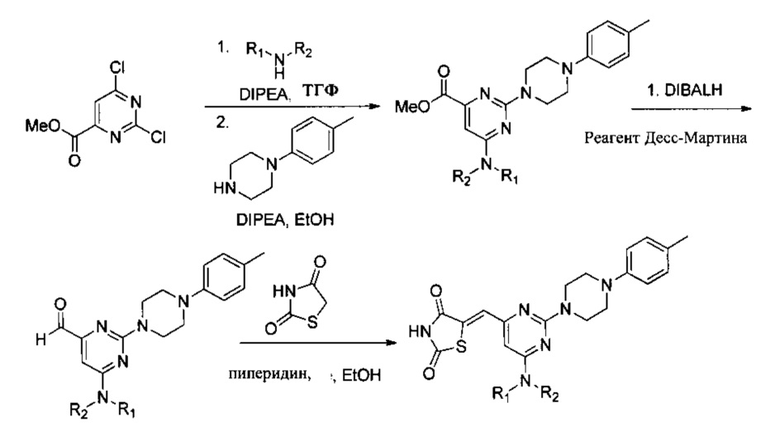
Метил-2,6-дихлорпиримидин-4-карбоксилат (200 мг, 0,966 ммоль) в 2 мл ТГФ обрабатывали DIPEA (185 мкл, 1,06 ммоль) и затем охлаждали до 0°С. Затем медленно добавляли раствор соответствующего амина (1 экв., 0,966 ммоль) в 2 мл ТГФ. Реакционную смесь перемешивали в течение 2 часов и концентрировали при пониженном давлении с получением неочищенного продукта светло-желтого цвета, который использовали без какой-либо дополнительной очистки.
Неочищенный материал обрабатывали 2 мл EtOH, DIPEA (1,1 экв.) и 1-(п-толил)пиперазином (1 экв.). Реакционную смесь затем нагревали до 90°С в течение 2 дней. По результатам ЖХ/МС наблюдали желаемый продукт вместе с вариантом EtO сложного эфира. Реакционную смесь затем концентрировали при пониженном давлении и очищали с помощью системы Biotage с использованием смеси 10-100% EtOAc/гексаны с получением желаемого промежуточного сложного диаминоэфирного соединения.
Промежуточное сложное диаминоэфирное соединение обрабатывали ДХМ (2 мл) и охлаждали до -10°С. Добавляли по каплям DIBALH (3 экв.) и реакционной смеси позволяли нагреваться до комнатной температуры и перемешивали в течение 1 часа. Добавляли метанол (1 мл) для гашения реакции и затем реакционной смеси позволяли перемешиваться в течение 30 мин. Реакционную смесь затем распределяли между ДХМ (10 мл) и Н2О (10 мл). Водный слой снова экстрагировали ДХМ (2×10 мл) и комбинированный органический слой концентрировали при пониженном давлении. Неочищенный осадок очищали на силикагеле с использованием смеси 5-10% МеОН/ДХМ с получением желаемого спирта.
Спирт (1 экв.) обрабатывали 2 мл ДХМ и реакционную смесь охлаждали до 0°С и обрабатывали 1,4 мл 15% реагента Десс-Мартина в ДХМ. Реакционную смесь перемешивали в течение 1 часа и обрабатывали дополнительной порцией реагента Десс-Мартина (1,1 экв.) при 0°С и реакционной смеси позволяли нагреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь затем концентрировали при пониженном давлении и неочищенный осадок очищали с помощью флэш-хроматография с использованием 5-10% МеОН/ДХМ с получением желаемого альдегида.
Альдегид обрабатывали тиазолидин-2,4-дионом (1 экв.), пиперидином (0,8 экв.) и 2 мл EtOH. Реакционную смесь затем нагревали до 85°С в течение 16 часов и затем концентрировали при пониженном давлении. Осадок затем растирали с ДХМ (2 мл), МеОН (2 мл) и EtOAc (2 мл) с получением конечных амино-аналогов.
ПРИМЕР 82
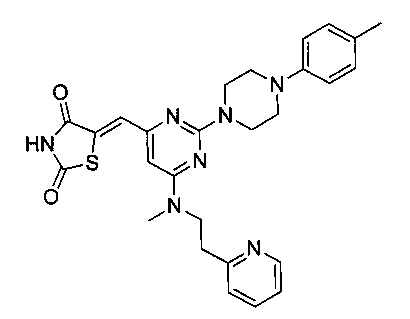
(Z)-5-((6-(метил(2-(пиридин-2-ил)этил)амино)-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10240) получали с использованием общего способа замещения и N-метил-2-(пиридин-2-ил)этанамина (12,7 мг, 160 мг теор., 1,7%, 5 этапов). ЖХ/МС m/z: 516 (М+1).
ПРИМЕР 83
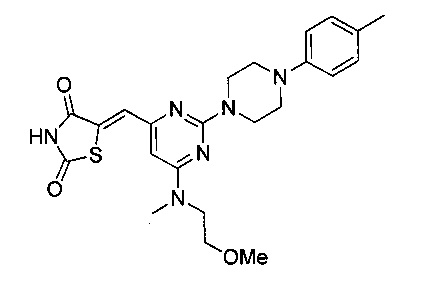
(Z)-5-((6-((2-метоксиэтил)(метил)амино)-2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10243) получали с использованием общего способа замещения и 2-метокси-N-метилэтанамина (34 мг, 680 мг теор., 5%, 5 этапов). ЖХ/МС m/z: 469 (М+1).
ПРИМЕР 84
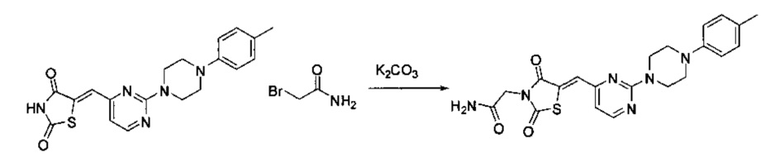
(Z)-2-(2,4-диоксо-5-((2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-3-ил)ацетамид (Соединение 10244)
К 10 мг (Z)-5-((2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-диона добавляли 4 мг 2-бромацетамида, 4 мг карбоната калия и 0,5 мл ДМФА. Реакционную смесь нагревали до 55°С в течение 4 часов, концентрировали при пониженном давлении и очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с градиентом ацетонитрил/вода с использованием трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением (Z)-2-(2,4-диоксо-5-((2-(4-(п-толил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-3-ил)ацетамида (4 мг, 11,5 мг теор., 35%). ЖХ/МС m/z: 439 (М+1).
ПРИМЕР 85
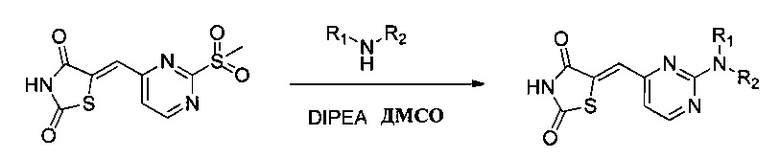
Общий способ замещения: Круглодонную колбу на 2 драхма наполняли (Z)-5-((2-(метилсульфонила)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом (25 мг, 0,0877 ммоль), полученным согласно общему способу, ДМСО (1 мл, 0,08 М), диизопропилэтиламином (50 мкл, 0,288 ммоль, 3,2 экв.) и соответствующим амином (0,0877 ммоль, 1,0 экв.). Реакционную смесь нагревали до 110°С и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4).
ПРИМЕР 86
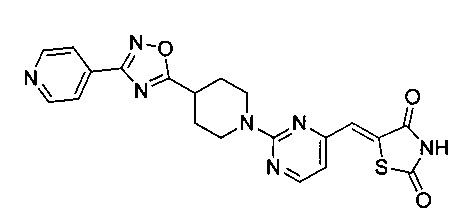
(Z)-5-((2-(4-(3-(пиридин-4-ил)-1,2,4-оксадиазол-5-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10291) получали с использованием общего способа замещения и 5-(пиперидин-4-ил)-3-(пиридин-4-ил)-1,2,4-оксадиазола (6 мг, 45,8 мг теор., 13%). ЖХ/МС m/z 436,4 (М+1).
ПРИМЕР 87
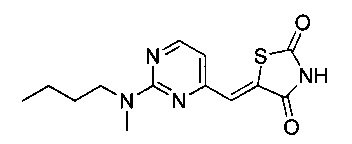
(Z)-5-((2-(бутил(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10292) получали с использованием общего способа замещения и N-метилбутан-1-амина (12,5 мг, 30,7 мг теор., 40,7%). ЖХ/МС m/z 293,3 (М+1).
ПРИМЕР 88
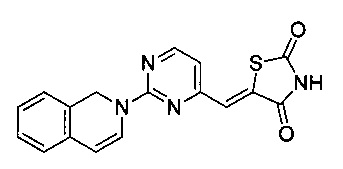
(Z)-5-((2-(изохинолин-2(1Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10313) получали с использованием общего способа замещения 1,2,3,4-тетрагидроизохинолина (2 мг, 35 мг теор., 5,7%). ЖХ/МС m/z 337,1 (М+1).
ПРИМЕР 89
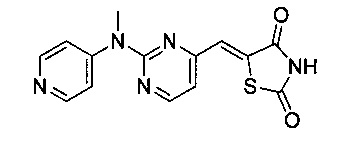
(Z)-5-((2-(метил(пиридин-4-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10318) получали с использованием общего способа замещения и N-метилпиридин-4-амина (11,7 мг, 32,9 мг теор., 35,5%). ЖХ/МС m/z 314,3 (М+1).
ПРИМЕР 90
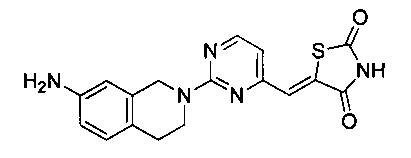
(Z)-5-((2-(7-амино-3,4-дигидроизохинолин-2(1Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10319) получали с использованием общего способа замещения и 1,2,3,4-тетрагидроизохинолин-7-амина (12,8 мг, 37,2 мг теор., 34,4%). ЖХ/МС m/z 354,3 (М+1).
ПРИМЕР 91
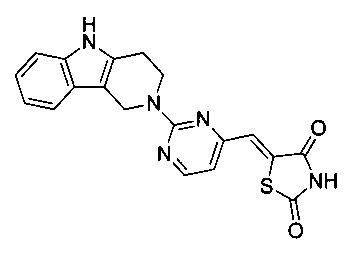
(Z)-5-((2-(3,4-дигидро-1Н-пиридо[4,3-b]индол-2(5Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10321) получали с использованием общего способа замещения и 2,3,4,5-тетрагидро-1Н-пиридо[4,3-b]индола (4,2 мг, 39,7 мг теор., 10,6%). ЖХ/МС m/z 378,4 (М+1).
ПРИМЕР 92
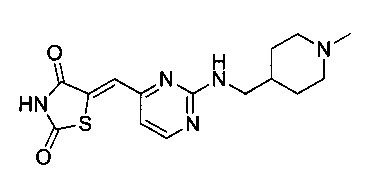
(Z)-5-((2-(((1-метилпиперидин-4-ил)метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10404) получали с использованием общего способа замещения и 1-(метилпиперидин-4-ил)метанамина (7,4 мг, 29,2 мг теор., 25,3%). ЖХ/МС m/z 334,1 (М+1).
ПРИМЕР 93

(Z)-5-((2-(4-(2-(диметиламино)этил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10406) получали с использованием общего способа замещения и N,N-диметил-2-(пиперидин-4-ил)этанамина (20,6 мг, 38,0 мг теор., 54,2%). ЖХ/МС m/z 362,2 (М+1).
ПРИМЕР 94

(Z)-5-((2-(4-(1Н-индол-3-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10407) получали с использованием общего способа замещения и 3-(пиперидин-4-ил)-1Н-индола (7,2 мг, 42,6 мг теор., 16,8%). ЖХ/МС m/z 406,1 (М+1).
ПРИМЕР 95
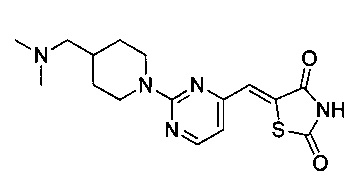
(Z)-5-((2-(4-(1Н-индол-3-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10408) получали с использованием общего способа замещения и N,N-диметил-1-(пиперидин-4-ил)метанамина (23,1 мг, 36,5 мг теор., 63,2%). ЖХ/МС m/z 348,1 (М+1).
ПРИМЕР 96
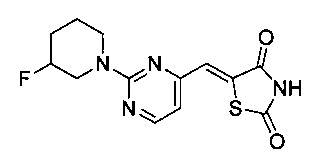
(Z)-5-((2-(3-фторпиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10410) получали с использованием общего способа замещения и 3-фторпиперидина (7,7 мг, 32,4 мг теор., 23,7%). ЖХ/МС m/z 309,1 (М+1).
ПРИМЕР 97

(Z)-5-((2-(4-метилпиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10411) получали с использованием общего способа замещения и 4-метилпиперидина (16,4 мг, 32 мг теор., 51,2%). ЖХ/МС m/z 305,1 (М+1).
ПРИМЕР 98
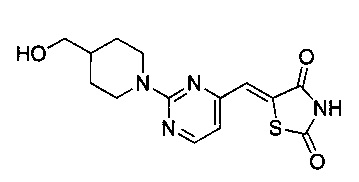
(Z)-5-((2-(4-(гидроксиметил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10412) получали с использованием общего способа замещения и пиперидин-4-илметанола (17,8 мг, 33,7 мг теор., 52,8%). ЖХ/МС m/z 321,1 (М+1).
ПРИМЕР 99
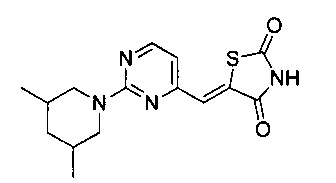
(Z)-5-((2-(3,5-диметилпиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10413) получали с использованием общего способа замещения и 3,5-диметилпиперидина (1,3 мг, 33,5 мг теор., 3,9%). ЖХ/МС m/z 319,1 (М+1).
ПРИМЕР 100
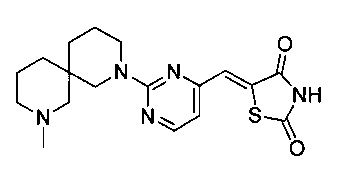
(Z)-5-((2-(8-метил-2,8-диазаспиро[5,5]ундекан-2-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10415) получали с использованием общего способа замещения и 2-метил-2,8-диазаспиро[5,5]ундекана (23,5 мг, 39,3 мг теор., 59,8%). ЖХ/МС m/z 374,2 (М+1).
ПРИМЕР 101
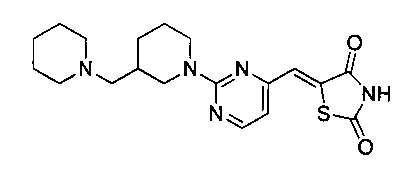
(Z)-5-((2-(3-(пиперидин-1-илметил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10416) получали с использованием общего способа замещения и 1-(пиперидин-3-илметил)пиперидина (21,8 мг, 40,7 мг теор., 53,5%). ЖХ/МС m/z 388,5 (М+1).
ПРИМЕР 102
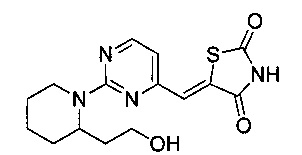
(Z)-5-((2-(2-(2-гидроксиэтил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10417) получали с использованием общего способа замещения и 2-(пиперидин-2-ил)этанола (10,1 мг, 35,2 мг теор., 28,7%). ЖХ/МС m/z 335,1 (М+1).
ПРИМЕР 103
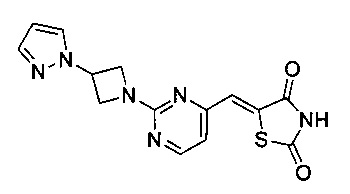
(Z)-5-((2-(3-(1Н-пиразол-1-ил)азетидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10418) получали с использованием общего способа замещения и 1-(азетидин-3-ил)-1Н-пиразола (24,3 мг, 34,5 мг теор., 70,4%). ЖХ/МС m/z 329,1 (М+1).
ПРИМЕР 104
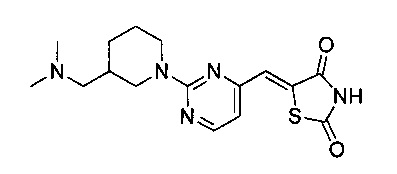
(Z)-5-((2-(3-((диметиламино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10419) получали с использованием общего способа замещения и N,N-диметил-1-(пиперидин-3-ил)метанамина (23,4 мг, 36,5 мг теор., 64,1%). ЖХ/МС m/z 348,4 (М+1).
ПРИМЕР 105
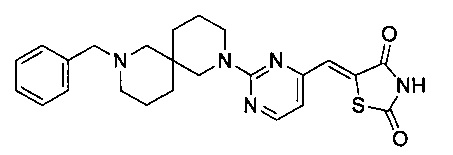
(Z)-5-((2-(8-бензил-2,8-диазаспиро[5,5]ундекан-2-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10420) получали с использованием общего способа замещения и 2-бензил-2,8-диазаспиро[5,5]ундекана (15,3 мг, 47,3 мг теор., 32,4%). ЖХ/МС m/z 450,5 (М+1).
ПРИМЕР 106
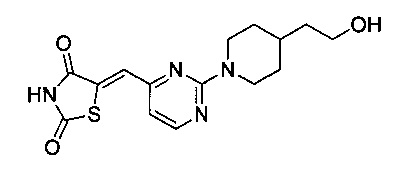
(Z)-5-((2-(4-(2-гидроксиэтил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10423) получали с использованием общего способа замещения и 2-(пиперидин-4-ил)этанола (18,1 мг, 47,2 мг теор., 38,4%). ЖХ/МС m/z 335,1 (М+1).
ПРИМЕР 107
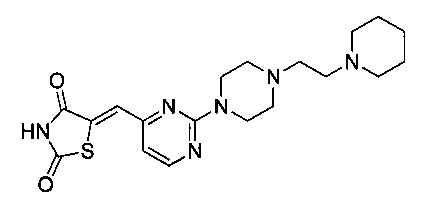
(Z)-5-((2-(4-(2-(пиперидин-1-ил)этил)пиперазин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10425) получали с использованием общего способа замещения и 1-(2-(пиперидин-1-ил)этил)пиперазина (36,6 мг, 66,3 мг теор., 55,2%). ЖХ/МС m/z 403,2 (М+1).
ПРИМЕР 108
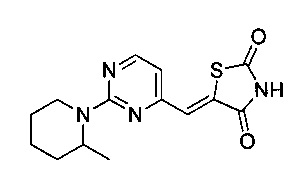
(Z)-5-((2-(2-метилпиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10426) получали с использованием общего способа замещения и 2-метилпиперидина (2,5 мг, 32 мг теор., 7,8%). ЖХ/МС m/z 305,1 (М+1).
ПРИМЕР 109
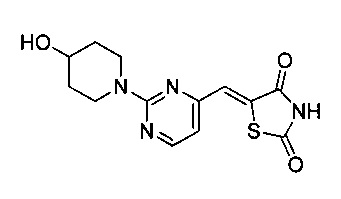
(Z)-5-((2-(4-гидроксипиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10427) получали с использованием общего способа замещения и пиперидин-4-ола (19,9 мг, 33,7 мг теор., 52,8%). ЖХ/МС m/z 321,1 (М+1).
ПРИМЕР 110
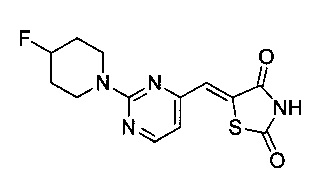
(Z)-5-((2-(4-фторпиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10429) получали с использованием общего способа замещения и 4-фторпиперидина (12 мг, 32,4 мг теор., 37%). ЖХ/МС m/z 309,1 (М+1).
ПРИМЕР 111
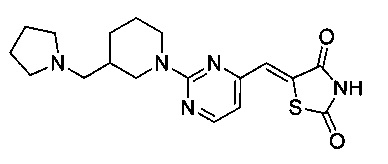
(Z)-5-((2-(3-(пирролидин-1-илметил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10446) получали с использованием общего способа замещения и 3-(пирролидин-1-илметил)пиперидина (4,3 мг, 39,3 мг теор., 11%). ЖХ/МС m/z 374,5 (М+1).
ПРИМЕР 112
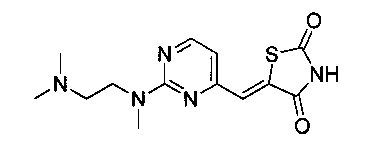
(Z)-5-((2-((2-(диметиламино)этил)(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10450) получали с использованием общего способа замещения и N1,N1,N2-триметилэтан-1,2-диамина (5,6 мг, 32,3 мг теор., 17,3%). ЖХ/МС m/z 308,4 (М+1).
ПРИМЕР 113

(S,Z)-5-((2-((1-гидроксибутан-2-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10454) получали с использованием общего способа замещения и амина (6,6 мг, 30,9 мг теор., 21,3%). ЖХ/МС m/z 295,1 (М+1).
ПРИМЕР 114
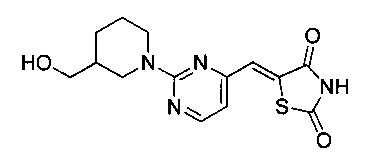
(Z)-5-((2-(3-(гидроксиметил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10455) получали с использованием общего способа замещения и (S)-2-аминобутан-1-ола (13,5 мг, 33,7 мг теор., 40,1%). ЖХ/МС m/z 321,1 (М+1).
ПРИМЕР 115
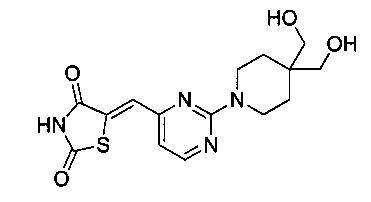
(Z)-5-((2-(4,4-бис(гидроксиметил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10456) получали с использованием общего способа замещения и пиперидин-4,4-диилдиметанола (10 мг, 36,8 мг теор., 27,1%). ЖХ/МС m/z 351,1 (М+1).
ПРИМЕР 116

(Z)-5-((2-(3-гидроксипиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10457) получали с использованием общего способа замещения и пиперидин-3-ола (6,3 мг, 32,2 мг теор., 19,6%). ЖХ/МС m/z 307,1 (М+1).
ПРИМЕР 117
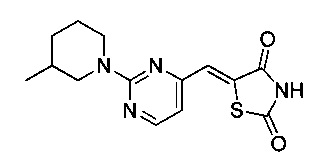
(Z)-5-((2-(3-метилпиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10495) получали с использованием общего способа замещения и 3-метилпиперидина (10,3 мг, 32 мг теор., 32,2%). ЖХ/МС m/z 305,1 (М+1).
ПРИМЕР 118
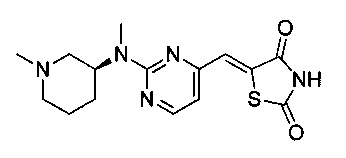
(S,Z)-5-((2-(метил(1-метилпиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10497) получали с использованием общего способа замещения и (S)-N,1-диметилпиперидин-3-амина (11,2 мг, 58,4 мг теор., 19,2%). ЖХ/МС m/z 334,1 (М+1).
ПРИМЕР 119
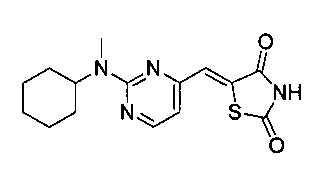
(Z)-5-((2-(циклогексил(метил)амино)пиримвдин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10512) получали с использованием общего способа замещения и N-метилциклогексанамина (3,4 мг, 33,5 мг теор., 10,2%). ЖХ/МС m/z 319,1 (М+1).
ПРИМЕР 120
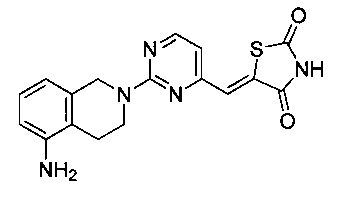
(Z)-5-((2-(5-амино-3,4-дигидроизохинолин-2(1Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10521) получали с использованием общего способа замещения и 1,2,3,4-тетрагидроизохинолин-5-амина (8,2 мг, 37,2 мг теор., 22%). ЖХ/МС m/z 354,1 (М+1).
ПРИМЕР 121
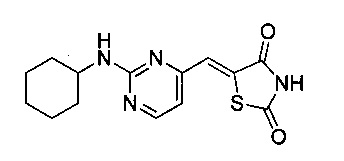
(Z)-5-((2-(циклогексиламино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10522) получали с использованием общего способа замещения и циклогексанамина (3,6 мг, 32 мг теор., 11,2%). ЖХ/МС m/z 305,1 (М+1).
ПРИМЕР 122

(Z)-1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-карбоксамид (Соединение 10532) получали с использованием общего способа замещения и пиперидин-4-карбоксамида (16,7 мг, 35,1 мг теор., 47,6%). ЖХ/МС m/z 334,1 (М+1).
ПРИМЕР 123
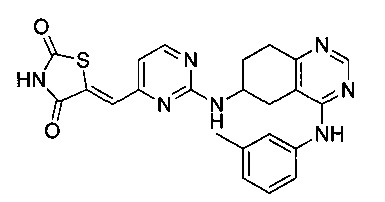
(Z)-5-((2-((4-(m-толиламино)-5,6,7,8-тетрагидрохиназолин-6-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10561) получали с использованием общего способа замещения и N4-(м-толил)-5,6,7,8-тетрагидрохиназолин-4,6-диамина (5,2 мг, 48,3 мг теор., 10,8%). ЖХ/МС m/z 460,5 (М+1).
ПРИМЕР 124
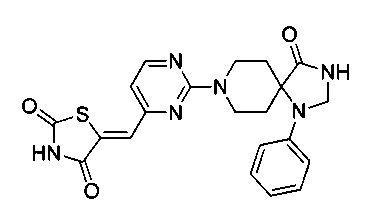
(Z)-5-((2-(4-оксо-1-фенил-1,3,8-триазаспиро[4,5]декан-8-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10562) получали с использованием общего способа замещения и 1-фенил-1,3,8-триазаспиро[4,5]декан-4-она (12,4 мг, 38,2 мг теор., 32,4%). ЖХ/МС m/z 437,1 (М+1).
ПРИМЕР 125
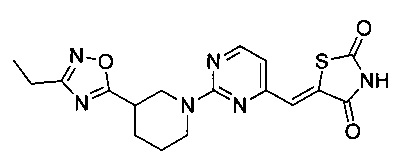
(Z)-5-((2-(3-(3-этил-1,2,4-оксадиазол-5-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10563) получали с использованием общего способа замещения и 3-этил-5-(пиперидин-3-ил)-1,2,4-оксадиазол (11,9 мг, 33,9 мг теор., 35,1%). ЖХ/МС m/z 387,1 (М+1).
ПРИМЕР 126
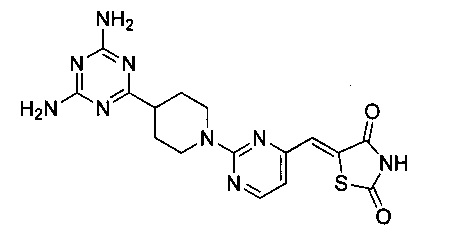
(Z)-5-((2-(4-(4,6-диамино-1,3,5-триазин-2-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10564) получали с использованием общего способа замещения и 6-(пиперидин-4-ил)-1,3,5-триазин-2,4-диамина (13,0 мг, 35,0 мг теор., 37,1%). ЖХ/МС m/z 400,1 (М+1).
ПРИМЕР 127
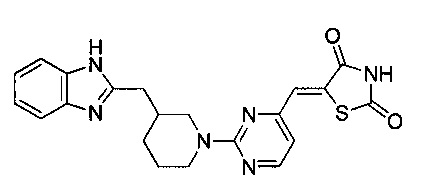
(Z)-5-((2-(3-((1H-бензо[d]имидазол-2-ил)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10568) получали с использованием общего способа замещения и 2-(пиперидин-3-илметил)-1Н-бензо[d]имидазола (29,3 мг, 44,2 мг теор., 66,3%). ЖХ/МС m/z 421,5 (М+1).
ПРИМЕР 128

(Z)-5-((2-(3-(4-метил-1H-бензо[d]имидазол-2-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10569) получали с использованием общего способа замещения и 4-метил-2-(пиперидин-3-ил)-1Н-бензо[d]имидазола (18,9 мг, 44,2 мг теор., 42,7%). ЖХ/МС m/z 421,5 (М+1).
ПРИМЕР 129

(Z)-5-((2-(4-(6,7,8,9-тетрагидро-5Н-[1,2,4]триазоло[4,3-а]азепин-3-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10570) получали с использованием общего способа замещения и 3-(пиперидин-4-ил)-6,7,8,9-тетрагидро-5Н-[1,2,4]триазоло[4,3-а]азепина (16,2 мг, 44,7 мг теор., 36,2%). ЖХ/МС m/z 426,5 (М+1).
ПРИМЕР 130

(Z)-5-((2-(((1-этил-1Н-пиразол-5-ил)метил)(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10571) получали с использованием общего способа замещения и 1-(1-этил-1Н-пиразол-5-ил)-N-метилметанамина (7,2 мг, 36,2 мг теор., 20%). ЖХ/МС m/z 345,1 (М+1).
ПРИМЕР 131
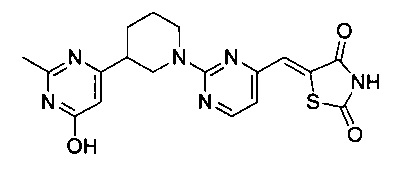
(Z)-5-((2-(3-(6-гидрокси-2-метилпиримидин-4-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10572) получали с использованием общего способа замещения и 2-метил-6-(пиперидин-3-ил)пиримидин-4-ола (16,8 мг, 41,9 мг теор., 40,1%). ЖХ/МС m/z 399,1 (М+1).
ПРИМЕР 132

(Z)-5-((2-(3-([1,2,4]триазоло[4,3-a]пиридин-3-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10573) получали с использованием общего способа замещения и 3-(пиперидин-3-ил)-[1,2,4]триазоло[4,3-а]пиридина (11 мг, 42,8 мг теор., 25,7%). ЖХ/МС m/z 408,5 (М+1).
ПРИМЕР 133
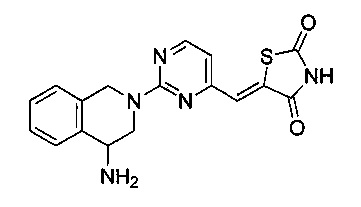
(Z)-5-((2-(4-амино-3,4-дигидроизохинолин-2(1Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10574) получали с использованием общего способа замещения и 1,2,3,4-тетрагидроизохинолин-4-амина (1,4 мг, 37,2 мг теор., 3,8%). ЖХ/МС m/z 354,1 (М+1).
ПРИМЕР 134
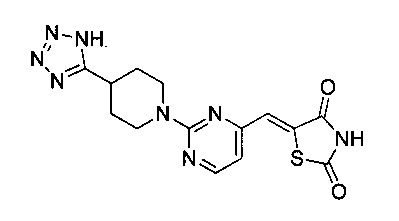
(Z)-5-((2-(4-(1Н-тетразол-5-ил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10575) получали с использованием общего способа замещения и 4-(1Н-тетразол-5-ил)пиперидина (4 мг, 37,7 мг теор., 10,6%). ЖХ/МС m/z 359,1 (М+1).
ПРИМЕР 135
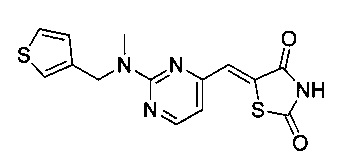
(Z)-5-((2-(метил(тиофен-3-илметил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10576) получали с использованием общего способа замещения и N-метил-1-(тиофен-3-ил)метанамина (7,5 мг, 35 мг теор., 21,5%). ЖХ/МС m/z 333,0 (М+1).
ПРИМЕР 136
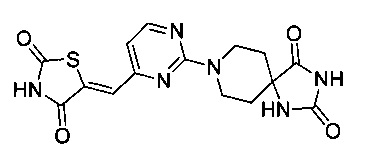
(Z)-5-((2-(2,4-диоксо-1,3,8-триазаспиро[4,5]декан-8-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10577) получали с использованием общего способа замещения и 1,3,8-триазаспиро[4,5]декан-2,4-диона (15,2 мг, 39,4 мг теор., 38,6%). ЖХ/МС m/z 375,1 (М+1).
ПРИМЕР 137

(Z)-5-((2-(((1Н-бензо[d]имидазол-2-ил)метил)(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10579) получали с использованием общего способа замещения и 1-(1Н-бензо[d]имидазол-2-ил)-N-метилметанамина (6,6 мг, 38,5 мг теор., 17%). ЖХ/МС m/z 367,1 (М+1).
ПРИМЕР 138

(Z)-5-((2-((3-аминобензил)(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10581) получали с использованием общего способа замещения и 3-((метиламино)метил)анилина (19,7 мг, 35,9 мг теор., 54,9%). ЖХ/МС m/z 342,1 (М+1).
ПРИМЕР 139
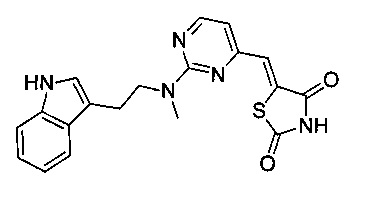
(Z)-5-((2-((2-(1Н-индол-3-ил)этил)(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10615) получали с использованием общего способа замещения и 2-(1Н-индол-3-ил)-N-метилэтанамина (8,3 мг, 39,9 мг теор., 20,8%). ЖХ/МС m/z 380,4 (М+1).
ПРИМЕР 140
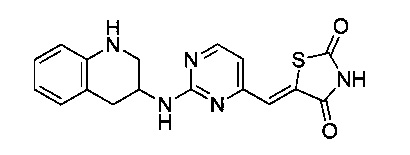
(Z)-5-((2-((1,2,3,4-тетрагидрохинолин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10639) получали с использованием общего способа замещения и 1,2,3,4-тетрагидрохинолин-3-амина (5 мг, 37,2 мг теор., 13,5%). ЖХ/МС m/z 354,1 (М+1).
ПРИМЕР 141
Замещение/удаление защитной группы из монозамещенных Вос-диаминов
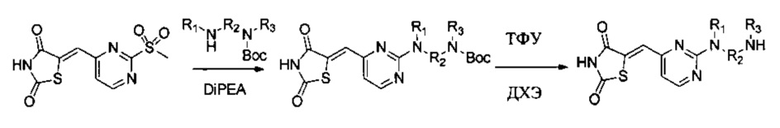
ПРИМЕР 142
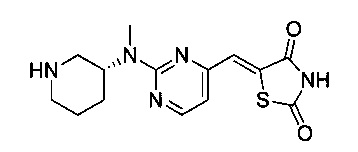
(R,Z)-5-((2-(метил(пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10322) получали с использованием общего способа замещения и (R)-трет-бутил-3-(метиламино)пиперидин-1-карбоксилата. Неочищенный содержащий защитную группу амин затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (3,1 мг, 55,9 мг теор., 5,5%). ЖХ/МС m/z 320,1 (М+1).
ПРИМЕР 143
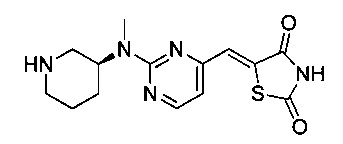
(S,Z)-5-((2-(метил(пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10323) получали с использованием общего способа замещения и (S)-трет-бутил-3-(метиламино)пиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (Сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (3,2 мг, 55,9 мг теор., 5,7%). ЖХ/МС m/z 320,1 (М+1).
ПРИМЕР 144
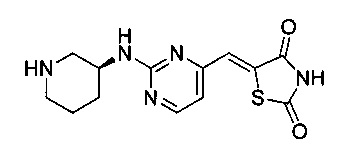
(S,Z)-5-((2-(пиперидин-3-иламино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10421) получали с использованием общего способа замещения и (R)-трет-бутил-3-аминопиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (6,9 мг, 32,1 мг теор., 21,5%). ЖХ/МС m/z 306,1 (М+1).
ПРИМЕР 145
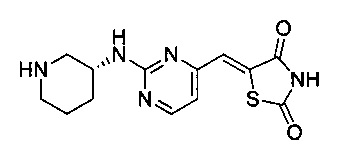
(R,Z)-5-((2-(пиперидин-3-иламино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10422) получали с использованием общего способа замещения и (S)-трет-бутил-3-аминопиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (3,8 мг, 32,1 мг теор., 11,8%). ЖХ/МС m/z 306,1 (М+1).
ПРИМЕР 146
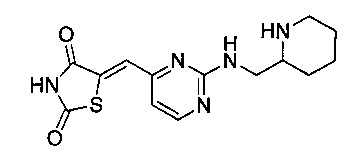
(Z)-5-((2-((пиперидин-2-илметил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10424) получали с использованием общего способа замещения и трет-бутил-2-(аминометил)пиперидин-1-карбоксилат. Неочищенный амин, содержащий защиную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (10,7 мг, 45,6 мг теор., 23,5%). ЖХ/МС m/z 320,1 (М+1).
ПРИМЕР 147
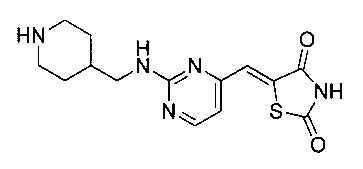
(Z)-5-((2-((пиперидин-4-илметил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10428) получали с использованием общего способа замещения и трет-бутил-4-(аминометил)пиперидин-1-карбоксилат. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (5,3 мг, 33,5 мг теор., 15,8%). ЖХ/МС m/z 320,1 (М+1).
ПРИМЕР 148

(R,Z)-5-((2-((пиперидин-3-илметил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10430) получали с использованием общего способа замещения и (S)-трет-бутил-3-(аминометил)пиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (7,3 мг, 33,5 мг теор., 21,8%). ЖХ/МС m/z 320,1 (М+1).
ПРИМЕР 149
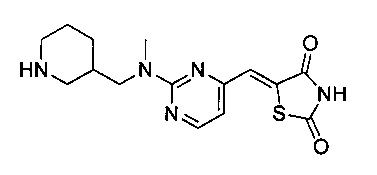
(Z)-5-((2-(метил(пиперидин-3-илметил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10445) получали с использованием общего способа замещения и трет-бутил-3-((метиламино)метил)пиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (21,6 мг, 35 мг теор., 61,7%). ЖХ/МС m/z 334,1 (М+1).
ПРИМЕР 150
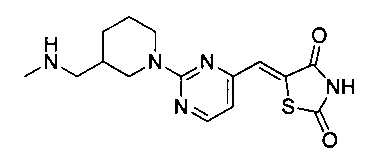
(Z)-5-((2-(3-((метиламино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10447) получали с использованием общего способа замещения и трет-бутил метил(пиперидин-3-илметил)карбамата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (17,9 мг, 35 мг теор., 51,1%). ЖХ/МС m/z 334,1 (М+1).
ПРИМЕР 151

(Z)-5-((2-(метил(пиперидин-4-илметил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10448) получали с использованием общего способа замещения и трет-бутил 4-((метиламино)метил)пиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (6,5 мг, 35 мг теор., 18,6%). ЖХ/МС m/z 334,1 (М+1).
ПРИМЕР 152
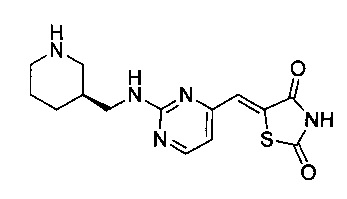
(S,Z)-5-((2-((пиперидин-3-илметил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10449) получали с использованием общего способа замещения и (R)-трет-бутил-3-((метиламино)метил)пиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (11,2 мг, 33,5 мг теор., 33,4%). ЖХ/МС m/z 320,1 (М+1).
ПРИМЕР 153
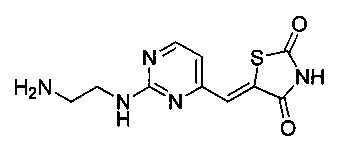
(Z)-5-((2-((2-аминоэтил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10451) получали с использованием общего способа замещения и трет-бутил (2-аминоэтил)карбамата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (10,7 мг, 27,9 мг теор., 38,4%). ЖХ/МС m/z 266,1 (М+1).
ПРИМЕР 154
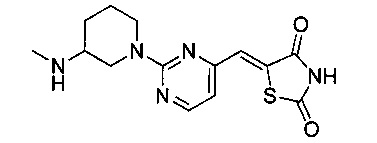
(Z)-5-((2-(3-(метиламино)пиперидин-4-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10496) получали с использованием общего способа замещения и трет-бутил метил(пиперидин-3-ил)карбамат. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (26,9 мг, 33,5 мг теор., 80%). ЖХ/МС m/z 320,1 (М+1).
ПРИМЕР 155

(Z)-5-((2-(октагидро-1,5-нафтиридин-1(2Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10504) получали с использованием общего способа замещения и трет-бутилоктагидро-1,5-нафтиридин-1(2Н)-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (7,2 мг, 36,3 мг теор., 19,8%). ЖХ/МС m/z 346,1 (М+1).
ПРИМЕР 156
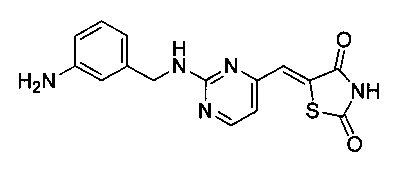
(Z)-5-((2-((3-аминобензил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10565) получали с использованием общего способа замещения и трет-бутил(3-(аминометил)фенил)карбамата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (6,5 мг, 28,7 мг теор., 22,7%). ЖХ/МС m/z 328,1 (М+1).
ПРИМЕР 157

(Z)-5-((2-((5-фенилпиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10566) получали с использованием общего способа замещения и трет-бутил-3-амино-5-фенилпиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (5,6 мг, 33,4 мг теор., 16,8%). ЖХ/МС m/z 382,1 (М+1).
ПРИМЕР 158
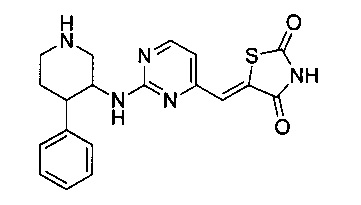
(Z)-5-((2-((4-фенилпиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10567) получали с использованием общего способа замещения и трет-бутил-3-амино-4-фенилпиперидин-1-карбоксилата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (5,7 мг, 33,4 мг теор., 17,1%). ЖХ/МС m/z 382,1 (М+1).
ПРИМЕР 159

(Z)-5-((2-((3-(аминометил)бензил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10580) получали с использованием общего способа замещения и трет-бутил-3-(аминометил)бензилкарбамата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (16,6 мг, 35,8 мг теор., 46,3%). ЖХ/МС m/z 342,1 (М+1).
ПРИМЕР 160
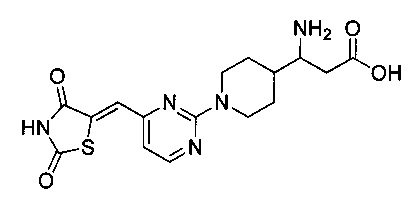
(Z)-5-((2-(октагидро-1,5-нафтиридин-1(2Н)-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10640) получали с использованием общего способа замещения и 3-((трет-бутоксикарбонила)амино)-3-(пиперидин-4-ил)прпановой кислоты. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (24,6 мг, 11,8 мг теор., 208%). ЖХ/МС m/z 378,4 (М+1).
ПРИМЕР 161
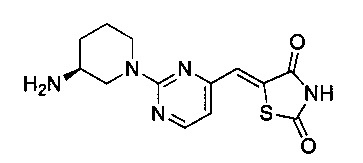
(S,Z)-5-((2-(3-аминопиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10676) получали с использованием общего способа замещения и (S)-трет-бутил пиперидин-3-илкарбамата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (46,8 мг, 30,2 мг теор., 155%). ЖХ/МС m/z 306,1 (М+1).
ПРИМЕР 162

(R,Z)-5-((2-(3-аминопиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10677) получали с использованием общего способа замещения и (R)-трет-бутилпиперидин-3-илкарбамата. Неочищенный амин, содержащий защитную группу, затем обрабатывали 2 мл ДХЭ и 500 мкл ТФУ и перемешивали в течение 24 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенные осадки очищали с помощью обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) (44,2 мг, 30,2 мг теор., 146%). ЖХ/МС m/z 306,1 (М+1).
ПРИМЕР 163
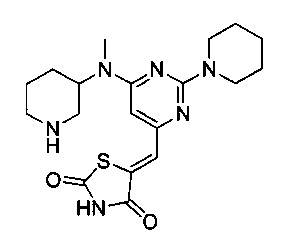
(Z)-5-((6-(метил(пиперидин-3-ил)амино)-2-(пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10498) получали с использованием общего способа 2 получения амино-аналогов (Пример 81) с использованием трет-бутил-3-(метиламино)пиперидин-1-карбоксилата и пиперидина (11,4 мг, 54,0 мг теор., 21,1%). ЖХ/МС m/z 403,2 (М+1).
ПРИМЕР 164
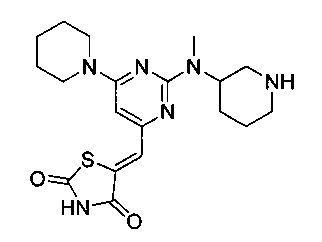
(Z)-5-((2-(метил(пиперидин-3-ил)амино)-6-(пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10505) получали с использованием общего способа 2 получения амино-аналогов (Пример 81) с использованием пиперидина и трет-бутил-3-(метиламино)пиперидин-1-карбоксилата (10,5 мг, 26,3 мг теор., 41,9%). ЖХ/МС m/z 403,2 (М+1).
ПРИМЕР 165
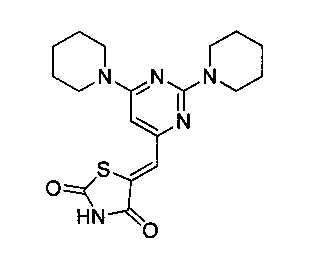
(Z)-5-((2,6-ди(пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10511) получали с использованием общего способа 2 получения амино-аналогов (Пример 81) с использованием пиперидина (14,0 мг, 233 мг теор., 6%). ЖХ/МС m/z 374,2 (М+1).
ПРИМЕР 166
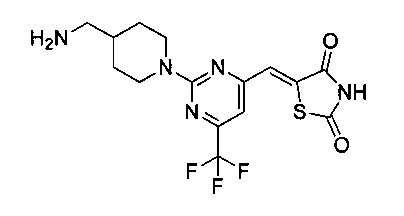
(Z)-5-((2-(4-(аминометил)пиперидин-1-ил)-6-(трифторметила)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10700) получали следующим образом.


4-Метил-2-(метилтио)-6-(трифторметил)пиримидин
Круглодонную колбу на 30 мл наполняли 1,1,1-трифторпентан-2,4-дионом (2,00 г, 13,0 ммоль, 1 экв.), этанолом (15 мл, 0,8 М), солью гемисерной кислоты тиометилизомочевины (1,807 г, 6,5 ммоль, 1 экв.) и реакционную смесь перемешивали при 80°С в течение 3 часов. Растворитель концентрировали при пониженном давлении и осадок распределяли между CH2Cl2 (25 мл) и насыщенным раствором NaHCO3 (25 мл). Водный слой экстрагировали EtOAc (2×10 мл) и комбинированный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением неочищенный желаемого пиримидина в виде твердого вещества оранжеватого цвета. В результате очистки с использованием системы Biotage (картридж, заполненный 25 г SiO2, гексаны/EtOAc от 95:5 до 75:25) получали 1,66 г чистого желаемого продукта (2,70 г теор., 61,4%). ЖХ/МС m/z 209 (М+1).
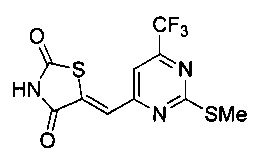
(Z)-5-((2-(Метилтио)-6-(трифторметил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион
Круглодонную колбу на 30 мл наполняли 4-метил-2-(метилтио)-6-(трифторметил)пиримидином (0,500 г, 2,4 ммоль, 1 экв.), этанолом (5 мл, 0,48 М), диоксидом селена (0,293 мг, 2,6 ммоль, 1,1 экв.) и реакционную смесь перемешивали при 90°С в течение 40 часов и затем при комнатной температуре в течение 14 дней. Неочищенную реакционную смесь затем обрабатывали тиазолидин-2,4-дионом (0,281 г, 2,4 ммоль, 1 экв.), триэтиламином (1,0 мл, 7,20 ммоль, 3 экв.) и реакционную смесь перемешивали в течение 16 часов при 80°С. Растворитель концентрировали при пониженном давлении и осадок распределяли между EtOAc (30 мл) и насыщенным раствором NaHCO3 (25 мл). Водный слой экстрагировали EtOAc (2×10 мл) и комбинированный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенного продукт очищали с использованием системы Biotage (картридж, заполненный 10 г SiO2, CH2Cl2/МеОН от 99:1 до 9:1) с получением 270 мг частично очищенного продукта, который заново очищали с помощью системы Biotage (картридж, заполненный 10 г SiO2, гексаны/EtOAc от 90:10 до 0:1, затем CH2Cl2/МеОН от 99:1 до 9:1) с получением 212 мг твердого вещества желтого цвета, которое являлось все еще не полностью очищенным, но которое использовали непосредственно в следующем этапе без дополнительной очистки.
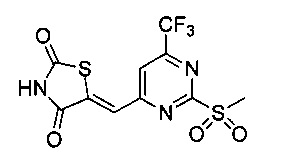
(Z)-5-((2-(Метилсульфонил)-6-(трифторметила)пиримидин-4-ил)метилен)тиазолидин-2,4-дион
Круглодонную колбу на 8 мл наполняли пиримидинсульфидом (212 мг, 0,66 ммоль, 1 экв.), CH2Cl2 (3 мл, 0,22 М), добавляли 50 масс. % m-СРВА (0,683 г, 1,98 ммоль, 3 экв.) в течение 1 мин. при комнатной температуре. Через 3,5 часа добавляли дополнительные 3 эквивалента m-СРВА, 50 масс. % (0,683 г, 1,98 ммоль, 3 экв.) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученное твердое вещество белого цвета фильтровали и промывали CH2Cl2 и затем Et2O с получением 67 мг твердого вещества не совсем белого цвета (233 мг теор., 28,7%), которое использовали в следующем этапе без дополнительной очистки. ЖХ/МС m/z 354 (М+1).
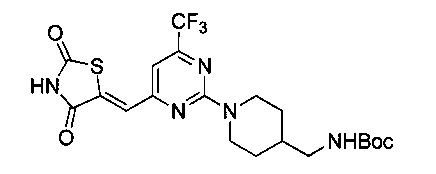
(Z)-трет-Бутил((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)-6-(трифторметил)пиримидин-2-ил)пиперидин-4-ил)метил)карбамат
Круглодонную колбу на 8 мл наполняли 2-сульфонпиримидином (67 мг, 0,19 ммоль, 1 экв.), ДМСО (1 мл, 0,19 М), трет-бутил(пиперидин-4-илметил)карбаматом (40,6 мг, 0,19 ммоль, 1 экв.), DIPEA (66 мкл, 0,38 ммоль, 2 экв.) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре и затем при 50°С в течение 3 часов. Реакционную смесь непосредственно очищали с помощью обращенно-фазовой ВЭЖХ (2 ввода проб по 500 мкл, способ 12 мин, градиент метанол/вода с 0,4% ТФУ) с получением желаемого продукта (15,3 мг, 92,7 мг теор., 16,5%).
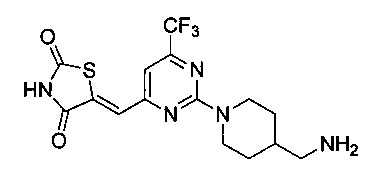
(Z)-5-((2-(4-(аминометил)пиперидин-1-ил)-6-(трифторметил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10700)
Круглодонную колбу на 8 мл наполняли CF3-пиримидином (15,3 мг, 0,031 ммоль, 1 экв.), CH2Cl2 (1 мл, 0,03 М), ТФУ (0,5 мл, 6,5 ммоль, 208 экв.) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Растворитель концентрировали при пониженном давлении и осадок сушили в высоком вакууме. Осадок промывали эфиром (2×2 мл) и твердое вещество желтого цвета сушили в высоком вакууме в течение ночи с получением (13,4 мг, 15,8 мг теор., 85%). ЖХ/МС m/z 388,1 (М+1).
ПРИМЕР 167

(Z)-5-((2-(4-(аминометил)пиперидин-1-ил)-6-метоксипиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10701) получали следующим образом.

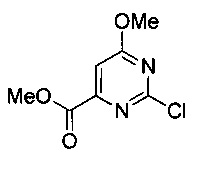
Метил-2-хлор-6-метоксипиримидин-4-карбоксилат
Круглодонную колбу на 30 мл наполняли метил-2,6-дихлорпиримидин-4-карбоксилатом (0,6 г, 2,9 ммоль, 1 экв.), метанолом (6 мл, 0,97 М), K2CO3 (0,401 г, 2,9 ммоль, 1 экв.) и реакционную смесь перемешивали при 65°С в течение 1,5 часов. Растворитель концентрировали при пониженном давлении и осадок распределяли между EtOAc (25 мл) и H2O (25 мл) и водный слой экстрагировали EtOAc (2×20 мл). Комбинированный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением неочищенный хлорпиримидин (441 мг, 588 мг теор., 75%), который использовали в следующем этапе без дополнительной очистки.
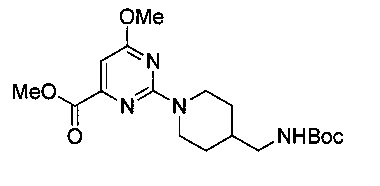
Метил-2-(4-(((трет-бутоксикарбонила)амино)метил)пиперидин-1-ил)-6-метоксипиримидин-4-карбоксилат
Круглодонную колбу на 8 мл наполняли 2-хлорпиримидином (150 мг, 0,74 ммоль, 1,5 экв.), метанолом (1,5 мл, 0,49 М), трет-бутил(пиперидин-4-илметил)карбаматом (159 мг, 0,49 ммоль, 1 экв.), DIPEA (258 мкл, 0,99 ммоль, 2 экв.) и реакционную смесь перемешивали при 65°С в течение 3 часов. Растворитель концентрировали при пониженном давлении и осадок распределяли между EtOAc (25 мл) и насыщенным раствором NaHCO3 (10 мл). Органический слой сушили над Na2SO4 и сушили при пониженном давлении с получением неочищенного продукта. В результате очистки с использованием системы Biotage (картридж, заполненный 10 г SiO2, гексаны/EtOAc от 95:5 до 40:60) получали желаемое промежуточного пиримидинового соединения в виде твердого вещества белого цвета (219 мг, 281 мг теор., 78%).
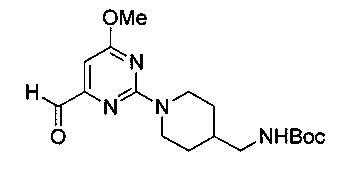
трет-Бутил ((1-(4-формил-6-метоксипиримидин-2-ил)пиперидин-4-ил)метил)карбамат
2-хгорлую круглодонную колбу на 50 мл наполняли сложным метиловым эфиром промежуточного соединения (150 мг, 0,39 ммоль, 1 экв.), CH2Cl2 (2 мл, 0,195 М) и затем добавляли DIBAL-H 1 M в CH2Cl2 (0,59 мл, 0,59 ммоль, 1,5 экв.) в течение 4 минут при -78°С. Реакционную смесь затем перемешивали в течение 1,5 часов при -78°С и в течение 1,5 часов между -78°С и комнатной температурой. По результатам ЖХ/МС наблюдали в основном исходный материал, следовательно, реакционную смесь заново охлаждали до -78°С и добавляли DIBAL-H (0,8 мл, 0,8 ммоль, 2 экв.). По результатам ЖХ/МС наблюдали в основном исходный материал. Реакционную смесь хранили при -20°С в течение 3 дней. Реакционную смесь охлаждали до -78°С и обрабатывали 1 М DIBAL-H в гексанах (0,59 мл, 0,59 ммоль, 1 экв.) в течение 5 мин., что приводило к образованию белого осадка. Через 2,5 часа добавляли другой эквивалент DIBAL-H (1 M в гексанах, 0,59 мл) в течение 15 мин при -78°С. Реакцию гасили метанолом (1 мл) при -78°С через 35 мин. Растворитель концентрировали при пониженном давлении и осадок распределяли между CH2Cl2 (20 мл) и насыщенным раствором NaHCO3 (20 мл). Органический слой сушили над Na2SO4 и растворитель концентрировали при пониженном давлении с получением неочищенного продукта, который использовали в следующем этапе без дополнительной очистки.

(Z)-трет-Бутил ((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)-6-метоксипиримидин-2-ил)пиперидин-4-ил)метил)карбамат
Круглодонную колбу на 8 мл наполняли неочищенным альдегидом (0,2 ммоль, определено), этанолом (2 мл), тиазолидин-2,4-дионом (23 мг, 0,2 ммоль, 1 экв.), триэтиламином (56 мкл, 0,4 ммоль, 2 экв.), пропускали Ar и реакционную смесь перемешивали при 80°С в течение 24 часов. Неочищенную смесь очищали с использованием системы Biotage (картридж, заполненный 10 г SiO2, CH2Cl2/МеОН от 99:1 до 94:6) с получением 113 мг частично очищенного продукта. Образец заново очищали с помощью обращенно-фазовой ВЭЖХ (метанол/вода 10-90%, 0,4% ТФУ, 3 одинаковых ввода пробы) с получением чистого продукта в виде соли ТФУ (47,3 мг, 225 мг теор., 21%). ЖХ/МС m/z 450 (М+1).
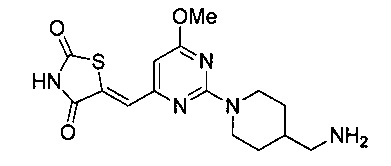
(Z)-5-((2-(4-(аминометил)пипервдин-1-ил)-6-метоксипиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10701)
Круглодонную колбу на 8 мл наполняли МеО-пиримидинамином, содержащим защитную группу boc, (47,3 мг, 105 мкмоль, 1 экв.), CH2Cl2 (1,3 мл, 0,08 М), ТФУ (0,5 мл, 6,5 ммоль, 62 экв.) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Растворители концентрировали при пониженном давлении и осадок заново растворяли в ДМСО (0,9 мл) и очищали с помощью обращенно-фазовой ВЭЖХ (метанол/вода с 0,4% ТФУ, 10-90%, 2 ввода по 500 мкл) с получением соединения в виде соли ТФУ (43,9 мг, 48,8 мг теор., 90%). ЖХ/МС m/z 350,1 (М+1).
ПРИМЕР 168
Синтезированные пиридиновые аналоги
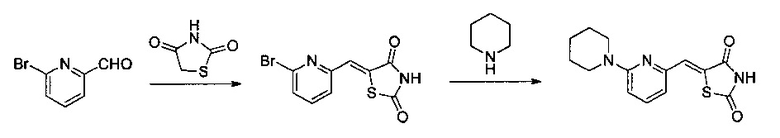
(Z)-5-((6-(пиперидин-1-ил)пиридин-2-ил)метилен)тиазолидин-2,4-дион (Соединение 10317) получали следующим образом.
Круглодонную колбу на 30 мл наполняли тиазолидин-2,4-дионом (300 мг, 2,56 ммоль, 1 экв.), толуолом (5 мл, 0,5 М), 6-бромпиколинальдегидом (477 мг, 2,56 ммоль, 1 экв.), ледяной уксусной кислотой (22 мкл, 0,256 ммоль, 0,1 экв.), пиперидином (25 мкл, 0,256 ммоль, 0,1 экв.), пропускали Ar и нагревали при встряхивании при 125°С. После нагревания в течение 16 часов реакционный раствор желтого цвета отбирали пипеткой от твердого осадка. Осадок промывали ацетоном (3×5 мл) и сушили в высоком вакууме с получением желаемого продукта в виде твердого вещества (439 мг, 731 мг теор., 60%), которое использовали в следующем этапе без дополнительной очистки.
Круглодонную колбу на 2 драма наполняли (Z)-5-((6-бромпиридин-2-ил)метилен)тиазолидин-2,4-дионом (60 мг, 0,210 ммоль, 1 экв.), ДМСО (1 мл, 0,08 М), диизопропилэтиламином (34 мкл, 0,2 ммоль, 1 экв.) и пиперидином (21 мкл, 0,21 ммоль, 1 экв.) и реакционную смесь нагревали при перемешивании при 110°С в течение 24 часов. Растворитель удаляли при пониженном давлении (Genvac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением (Z)-5-((6-(пиперидин-1-ил)пиридин-2-ил)метилен)тиазолидин-2,4-диона (7,9 мг, 60,9 мг теор., 12,9%). ЖХ/МС m/z 290,1 (М+1).
ПРИМЕР 169
Аналоги, синтезированные с помощью восстановительного аминирования
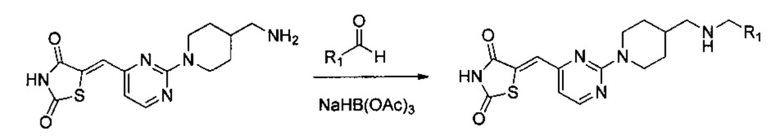
Общий способ восстановительного аминирования: Круглодонную колбу на 2 драма наполняли смесью неочищенный амин/соль ТФУ, полученной с использованием общего способа замещения с последующим использованием общего способа удаления защитной группы из ТФУ (0,115 ммоль), ДХЭ (2 мл), DIPEA (6 экв. 0,690 ммоль), ДМФА (1 мл), альдегидом (1 экв., 0,115 ммоль) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь затем обрабатывали NaBH(OAc)3 (2,5 экв., 0,230 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь затем разбавляли ДХЭ (2 мл) и NaHCO3 (2 мл). Водный слой снова экстрагировали ДХЭ (2×2 мл) и комбинированный органический слой концентрировали при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением чистых продуктов в виде соли ТФУ.
ПРИМЕР 170
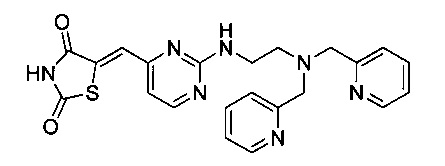
(Z)-5-((2-((2-(диметиламино)этил)(метил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10452) получали с использованием общего способа восстановительного аминирования (Пример 169) и пиколинальдегида (16,1 мг, 47 мг теор., 34,3%). ЖХ/МС m/z 448,5 (М+1).
ПРИМЕР 171

(Z)-5-((2-((2-((3-хлорбензил)амино)этил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10453) получали с использованием общего способа восстановительного аминирования (Пример 169) и 3-хлорбензальдегида (5,6 мг, 40,9 мг теор., 13,7%). ЖХ/МС m/z 390,8 (М+1).
ПРИМЕР 172
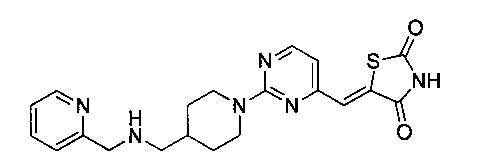
(Z)-5-((2-(4-(((пиридин-2-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10502) получали с использованием общего способа восстановительного аминирования (Пример 169) и пиколинальдегида (8,5 мг, 71,8 мг теор., 11,8%). ЖХ/МС m/z 411,5 (М+1).
ПРИМЕР 173

(S,Z)-5-((2-((1-(пиридин-2-илметил)пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10526) получали с использованием общего способа восстановительного аминирования (Пример 169) и пиколинальдегида (2,6 мг, 34,7 мг теор., 7,1%). ЖХ/МС m/z 397,1 (М+1).
ПРИМЕР 174
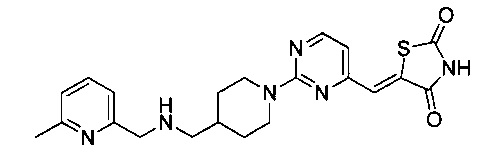
(Z)-5-((2-(4-((((6-метилпиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10530) получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-метилпиколинальдегида (10,4 мг, 74,3 мг теор., 14%). ЖХ/МС m/z 425,5 (М+1).
ПРИМЕР 175
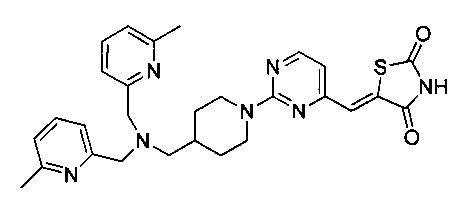
(Z)-5-((2-(4-((бис((6-метилпиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10531) получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-метилпиколинальдегида (2,5 мг, 92,6 мг теор., 2,7%). ЖХ/МС m/z 530,6 (М+1).
ПРИМЕР 176
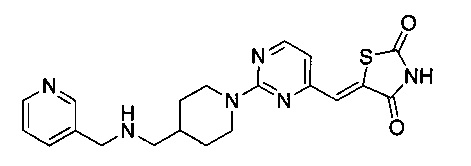
(Z)-5-((2-(4-(((пиридин-3-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10533) получали с использованием общего способа восстановительного аминирования (Пример 169) и никотинальдегида (5,3 мг, 71,8 мг теор., 7,4%). ЖХ/МС m/z 411,5 (М+1).
ПРИМЕР 177

(Z)-5-((2-(4-(((пиридин-4-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10534) получали с использованием общего способа восстановительного аминирования (Пример 169) и изоникотинальдегида (4,1 мг, 71,8 мг теор., 5,7%). ЖХ/МС m/z 411,5 (М+1).
ПРИМЕР 178

(S,Z)-5-((2-((1-(хинолин-2-илметил)пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10535) получали с использованием общего способа восстановительного аминирования (Пример 169) и хинолин-2-карбальдегида (2,2 мг, 78 мг теор., 2,8%). ЖХ/МС m/z 447,5 (М+1).
ПРИМЕР 179

(S,Z)-5-((2-((1-(изохинолин-3-илметил)пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10543) получали с использованием общего способа восстановительного аминирования (Пример 169) и изохинолин-3-карбальдегида (1,5 мг, 78 мг теор., 1,9%). ЖХ/МС m/z 447,5 (М+1).
ПРИМЕР 180

(Z)-5-((2-(4-(((хинолин-2-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10547) получали с использованием общего способа восстановительного аминирования (Пример 169) и хинолин-2-карбальдегида (3,8 мг, 81 мг теор., 4,7%). ЖХ/МС m/z 461,5 (М+1).
ПРИМЕР 181
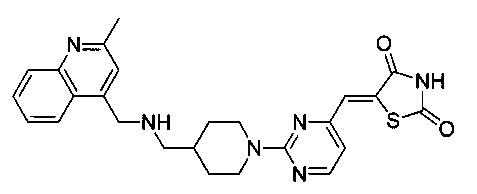
(Z)-5-((2-(4-((((2-метилхинолин-4-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10618) получали с использованием общего способа восстановительного аминирования (Пример 169) и 2-метилхинолин-4-карбальдегида (35,1 мг, 56,5 мг теор., 62,2%). ЖХ/МС m/z 475,5 (М+1).
ПРИМЕР 182
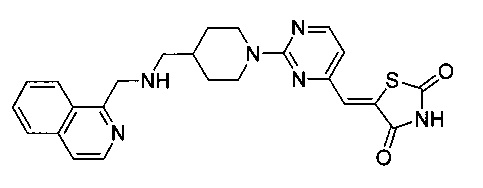
(Z)-5-((2-(4-(((изохинолин-1-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10619) получали с использованием общего способа восстановительного аминирования (Пример 169) и изохинолин-1-карбальдегида (35,1 мг, 43,8 мг теор., 80%). ЖХ/МС m/z 461,5 (М+1).
ПРИМЕР 183
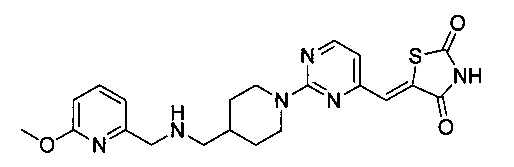
(Z)-5-((2-(4-((((6-метоксипиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10620) получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-метоксипиколинальдегида (37,5 мг, 52,4 мг теор., 71,5%). ЖХ/МС m/z 441,5 (М+1).
ПРИМЕР 184
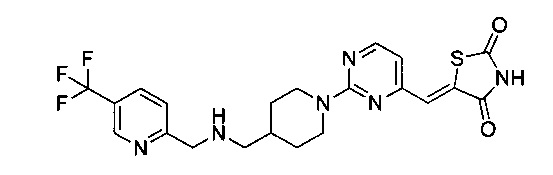
(Z)-5-((2-(4-((((5-(трифторметила)пиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10621) получали с использованием общего способа восстановительного аминирования (Пример 169) и 5-(трифторметила)пиколинальдегида (23 мг, 56,9 мг теор., 40,4%). ЖХ/МС m/z 479,5 (М+1).
ПРИМЕР 185
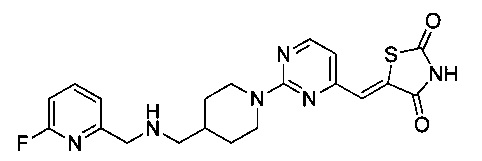
(Z)-5-((2-(4-((((6-фторпиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10622) получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-фторпиколинальдегида (29,3 мг, 51 мг теор., 57,5%). ЖХ/МС m/z 429,5 (М+1).
ПРИМЕР 186
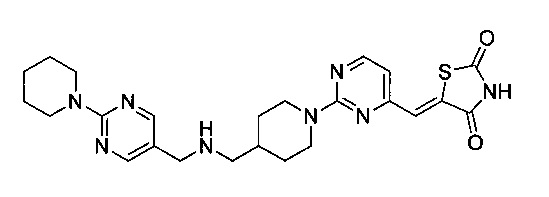
(Z)-5-((2-(4-((((2-(пиперидин-1-ил)пиримидин-5-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10623) получали с использованием общего способа восстановительного аминирования (Пример 169) и 2-(пиперидин-1-ил)пиримидин-5-карбальдегида (40,1 мг, 47 мг теор., 80%). ЖХ/МС m/z 495,5 (М+1).
ПРИМЕР 187
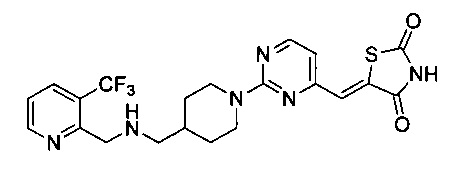
(Z)-5-((2-(4-((((3-(трифторметила)пиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10630) получали с использованием общего способа восстановительного аминирования (Пример 169) и 3-(трифторметила)пиколинальдегида (44 мг, 45,5 мг теор., 97%). ЖХ/МС m/z 479,5 (М+1).
ПРИМЕР 188

(Z)-5-((2-(4-((((3-фторпирвдин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10631) получали с использованием общего способа восстановительного аминирования (Пример 169) и 3-фторпиколинальдегида (42,5 мг, 40,7 мг теор., 104%). ЖХ/МС m/z 429,5 (М+1).
ПРИМЕР 189
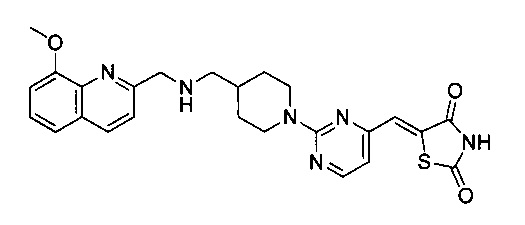
(Z)-5-((2-(4-((((8-метоксихинолин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10632) получали с использованием общего способа восстановительного аминирования (Пример 169) и 8-метоксихинолин-2-карбальдегида (35,5 мг, 46,6 мг теор., 76%). ЖХ/МС m/z 491,5 (М+1).
ПРИМЕР 190
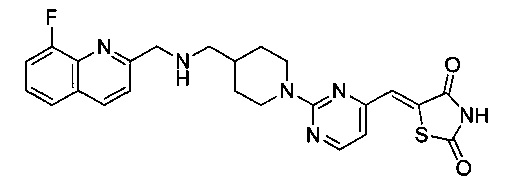
(Z)-5-((2-(4-((((8-фторхинолин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10633) получали с использованием общего способа восстановительного аминирования (Пример 169) и 8-фторхинолин-2-карбальдегида (28,5 мг, 45,5 мг теор., 62,7%). ЖХ/МС m/z 479,5 (М+1).
ПРИМЕР 191

(Z)-5-((2-(4-((((6-фторхинолин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10634) получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-фторхинолин-2-карбальдегида (32,7 мг, 45,5 мг теор., 71,9%). ЖХ/МС m/z 479,5 (М+1).
ПРИМЕР 192

(Z)-5-((2-(4-((пиридин-2-иламино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10636) получали с использованием общего способа восстановительного аминирования (Пример 169) и 2-хлоризоникотинальдегида (19,6 мг, 42,3 мг теор., 46,4%). ЖХ/МС m/z 445,5 (М+1).
ПРИМЕР 193
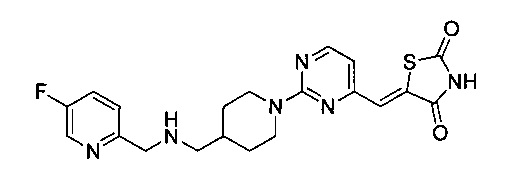
(Z)-5-((2-(4-((((5-фторпиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10637) получали с использованием общего способа восстановительного аминирования (Пример 169) и 5-фторпиколинальдегида (7,9 мг, 40,7 мг теор., 19,4%). ЖХ/МС m/z 429,5 (М+1).
ПРИМЕР 194
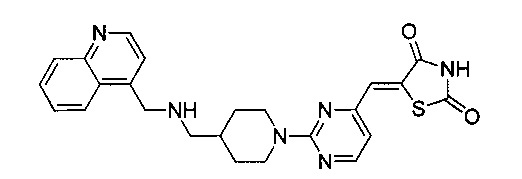
(Z)-5-((2-(4-(((хинолин-4-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10638) получали с использованием общего способа восстановительного аминирования (Пример 169) и хинолин-4-карбальдегида (24,6 мг, 43,8 мг теор., 56,2%). ЖХ/МС m/z 461,5 (М+1).
ПРИМЕР 195
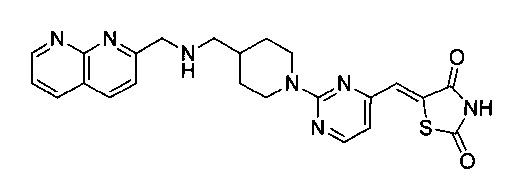
(Z)-5-((2-(4-((((1,8-нафтиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10674) получали с использованием общего способа восстановительного аминирования (Пример 169) и 1,8-нафтиридин-2-карбальдегида (6,9 мг, 43,8 мг теор., 15,7%). ЖХ/МС m/z 462,5 (М+1).
ПРИМЕР 196

(S,Z)-5-((2-(3-((хинолин-2-илметил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10689) получали с использованием общего способа восстановительного аминирования (Пример 169) и хинолин-2-карбальдегида (30,9 мг, 54,9 мг теор., 56,3%). ЖХ/МС m/z 447,2 (М+1).
ПРИМЕР 197
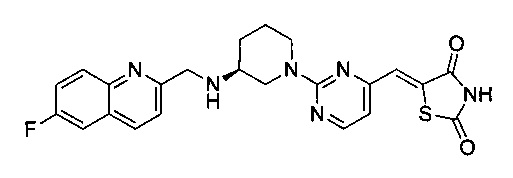
(S,Z)-5-((2-(3-(((6-фторхинолин-2-ил)метил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10690) получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-фторхинолин-2-карбальдегида (26,7 мг, 57,1 мг теор., 46,7%). ЖХ/МС m/z 465,5 (М+1).
ПРИМЕР 198

(S,Z)-5-((2-(3-(((8-метоксихинолин-2-ил)метил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10691) получали с использованием общего способа восстановительного аминирования (Пример 169) и 8-метоксихинолин-2-карбальдегида (16,4 мг, 58,6 мг теор., 28%). ЖХ/МС m/z 477,5 (М+1).
ПРИМЕР 199
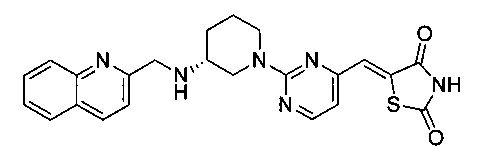
(R,Z)-5-((2-(3-((хинолин-2-илметил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10692) получали с использованием общего способа восстановительного аминирования (Пример 169) и хинолин-2-карбальдегида (24,9 мг, 54,9 мг теор., 45,3%). ЖХ/МС m/z 447,5 (М+1).
ПРИМЕР 200

(R,Z)-5-((2-(3-(((6-фторхинолин-2-ил)метил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10693) получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-фторхинолин-2-карбальдегида (24,1 мг, 57,1 мг теор., 42,2%). ЖХ/МС m/z 465,5 (М+1).
ПРИМЕР 201

(R,Z)-5-((2-(3-(((8-метоксихинолин-2-ил)метил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10694) получали с использованием общего способа восстановительного аминирования (Пример 169) и 8-метоксихинолин-2-карбальдегида (15,5 мг, 58,6 мг теор., 26,4%). ЖХ/МС m/z 477,5 (М+1).
ПРИМЕР 202

(R,Z)-5-((2-(3-(((2-метилхинолин-4-ил)метил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10696) получали с использованием общего способа восстановительного аминирования (Пример 169) и 2-метилхинолин-4-карбальдегида (25 мг, 56,6 мг теор., 44,1%). ЖХ/МС m/z 461,5 (М+1).
ПРИМЕР 203
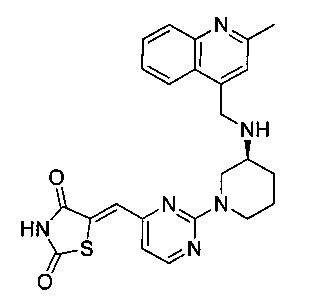
(S,Z)-5-((2-(3-(((2-метилхинолин-4-ил)метил)амино)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10698) получали с использованием общего способа восстановительного аминирования (Пример 169) и 2-метилхинолин-4-карбальдегида (30 мг, 56,6 мг теор., 53%). ЖХ/МС m/z 461,5 (М+1).
ПРИМЕР 204
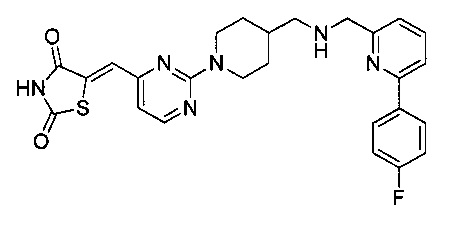
(Z)-5-((2-(4-((((6-(4-фторфенил)пиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-(4-фторфенил)пиколинальдегида (26,5 мг, 36,3 мг теор., 72,9%). ЖХ/МС m/z 505,5 (М+1).
ПРИМЕР 205
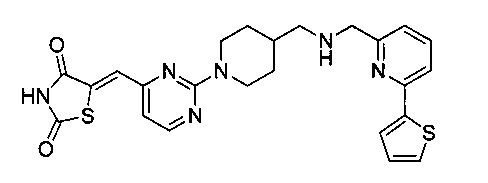
(Z)-5-((2-(4-((((6-(тиофен-2-ил)пиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-(тиофен-2-ил)пиколинальдегида (15,2 мг, 35,5 мг теор., 42,9%). ЖХ/МС m/z 493,5 (М+1).
ПРИМЕР 206

(Z)-5-((2-(4-((((6-(бензо[d][1,3]диоксол-5-ил)пиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-(бензо[d][1,3]диоксол-5-ил)пиколинальдегида (25,8 мг, 38,2 мг теор., 67,5%). ЖХ/МС m/z 531,5 (М+1).
ПРИМЕР 207

(Z)-5-((2-(4-((((6-(тиофен-3-ил)пиридин-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион получали с использованием общего способа восстановительного аминирования (Пример 169) и 6-(тиофен-3-ил)пиколинальдегида (32,5 мг, 35,5 мг теор., 92%). ЖХ/МС m/z 493,5 (М+1).
ПРИМЕР 208
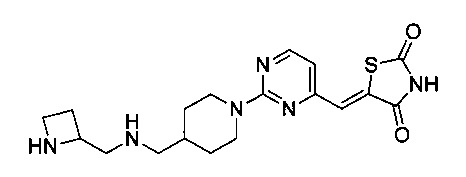
(Z)-5-((2-(4-(((азетидин-2-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10402) получали с использованием общего способа восстановительного аминирования (Пример 169) и трет-бутил-2-формилазетидин-1-карбоксилата с последующим использованием общего способа удаления защитной группы из ТФУ (15,2 мг, 68 мг теор., 22,4%). ЖХ/МС m/z 389,5 (М+1).
ПРИМЕР 209
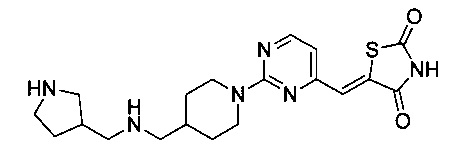
(Z)-5-((2-(4-(((пирролидин-3-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10403) получали с использованием общего способа восстановительного аминирования (Пример 169) и трет-бутил-3-формилпирролидин-1-карбоксилата с последующим использованием общего способа удаления защитной группы из ТФУ (17,1 мг, 70,4 мг теор., 24%). ЖХ/МС m/z 403,5 (М+1).
ПРИМЕР 210
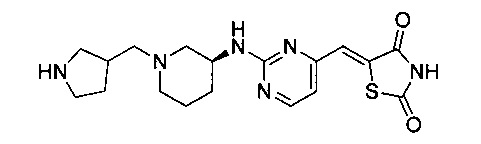
(Z)-5-((2-(((3S)-1-(пирролидин-3-илметил)пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10506) получали с использованием общего способа восстановительного аминирования (Пример 169) и трет-бутил-3-формилпирролидин-1-карбоксилата с последующим использованием общего способа удаления защитной группы из ТФУ (2,7 мг, 34,0 мг теор., 7,9%). ЖХ/МС m/z 389,2 (М+1).
ПРИМЕР 211
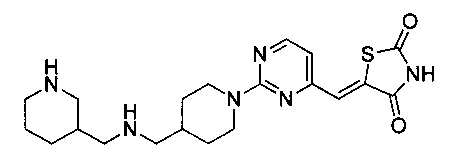
(Z)-5-((2-(4-(((пиперидин-3-илметил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10508) получали с использованием общего способа восстановительного аминирования (Пример 169) и трет-бутил-3-формилпиперидин-1-карбоксилата с последующим использованием общего способа удаления защитной группы из ТФУ (26,5 мг, 72,9 мг теор., 36,4%). ЖХ/МС m/z 417,2 (М+1).
ПРИМЕР 212
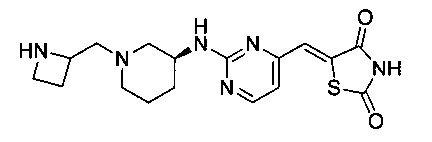
(Z)-5-((2-(((3S)-1-(азетидин-2-илметил)пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10527) получали с использованием общего способа восстановительного аминирования (Пример 169) и трет-бутил-2-формилазетидин-1-карбоксилата с последующим использованием общего способа удаления защитной группы из ТФУ (2,2 мг, 32,8 мг теор., 6,0%). ЖХ/МС m/z 375,2 (М+1).
ПРИМЕР 213
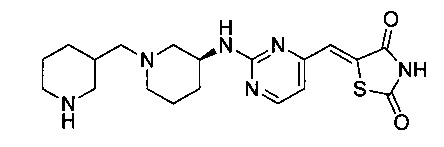
(Z)-5-((2-(((3S)-1-(пиперидин-3-илметил)пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10528) получали с использованием общего способа восстановительного аминирования (Пример 169) и трет-бутил-3-формилпиперидин-1-карбоксилата с последующим использованием общего способа удаления защитной группы из ТФУ (4,5 мг, 35,3 мг теор., 11,9%). ЖХ/МС m/z 403,2 (М+1).
ПРИМЕР 214
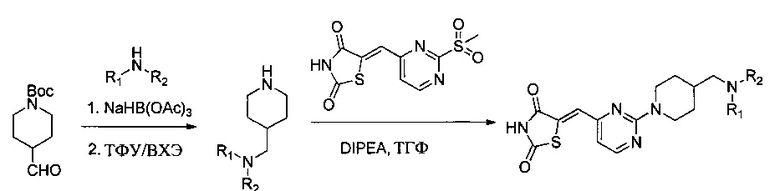
Общий способ обратного восстановительного аминирования: Круглодонную колбу на 2 драма наполняли трет-бутил 4-формилпиперидин-1-карбоксилатом (0,7 ммоль), амином (1 экв., 0,7 ммоль), ДХЭ (3 мл) и перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь затем обрабатывали NaBH(ОАс)3 (2 экв., 1,4 ммоль) и перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь затем промывали насыщенным раствором NaHCO3 (3 мл) и водный слой снова экстрагировали ДХЭ (2×2 мл). Комбинированный органический слой концентрировали при пониженном давлении (GeneVac НТ-4) и неочищенный осадок очищали с помощью ВЭЖХ с использованием градиента МеОН/Н2О и ТФУ в качестве модификатора. Полученный пиперидиновый аналог, содержащий защитную группу Boc, обрабатывали ДХЭ (3 мл), ТФУ (0,5 мл) и перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении (GeneVac НТ-4) и использовали в общем способе замещения без дополнительной очистки.
ПРИМЕР 215
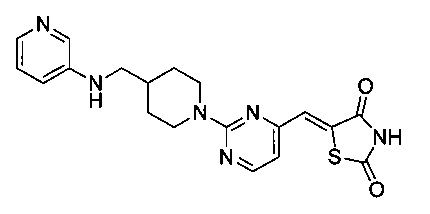
(Z)-5-((2-(4-((пиридин-3-иламино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10616) получали с использованием общего способа обратного восстановительного аминирования (Пример 214) и пиридин-3-амина (15,5 мг, 41,7 мг теор., 37,2%). ЖХ/МС m/z 397,5 (М+1).
ПРИМЕР 216
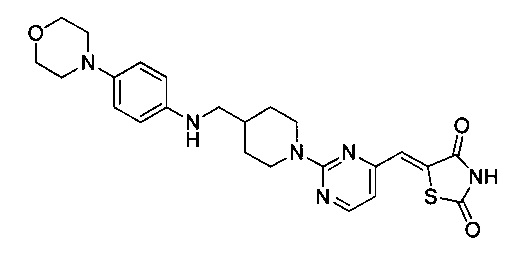
(Z)-5-((2-(4-(((4-морфолинофенил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10617) получали с использованием общего способа обратного восстановительного аминирования (Пример 214) и 4-морфолиноанилина (12,5 мг, 50,5 мг теор., 24,7%). ЖХ/МС m/z 481,5 (М+1).
ПРИМЕР 217
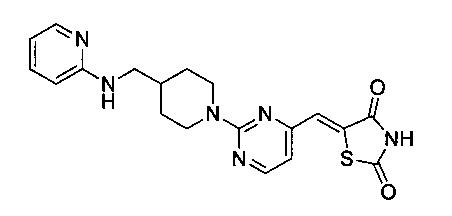
(Z)-5-((2-(4-((пиридин-2-иламино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10635) получали с использованием общего способа обратного восстановительного аминирования (Пример 214) и пиридин-2-амина (21,2 мг, 41,7 мг теор., 50,9%). ЖХ/МС m/z 397,5 (М+1).
ПРИМЕР 218
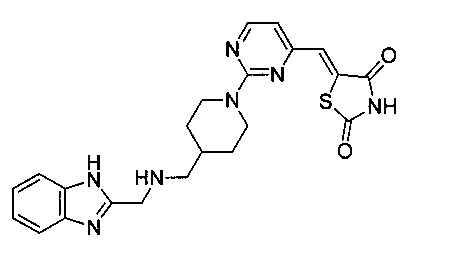
(Z)-5-((2-(4-((((1H-бензо[d]имидазол-2-ил)метил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10646) получали с использованием общего способа обратного восстановительного аминирования (Пример 214) и (1Н-бензо[d]имидазол-2-ил)метанамина (8 мг, 42,7 мг теор., 18,7%). ЖХ/МС m/z 450,5 (М+1).
ПРИМЕР 219
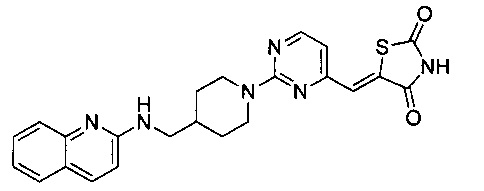
(Z)-5-((2-(4-((хинолин-2-иламино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10675) получали с использованием общего способа обратного восстановительного аминирования (Пример 214) и хинолин-2-амина (21,2 мг, 128 мг теор., 16,53%). ЖХ/МС m/z 447,5 (М+1).
ПРИМЕР 220
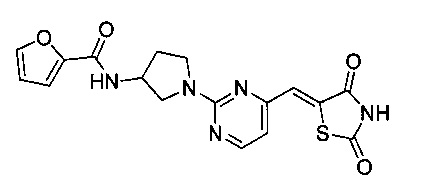
(Z)-N-(1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пирролидин-3-ил)фуран-2-карбоксамид (Соединение 10315) получали следующим образом.
Круглодонную колбу на 2 драхма наполняли (Z)-5-((2-(3-аминопирролидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом, полученным с использованием общего способа замещения с последующим использованием общего способа удаления защитной группы из ТФУ, (25 мг, 0,065 ммоль), ДХМ (1 мл), фуран-2-карбонилхлоридом (8 мкл, 0,082 ммоль, 1,3 экв.) и пиридином (0,040 мл, 0,491 ммоль, 7,5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (Сбор фракций с использованием МС) с градиентом ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением указанного в заголовке соединения (2,7 мг, 33,1 мг теор., 8,2%). ЖХ/МС m/z 386,1 (М+1).
ПРИМЕР 221
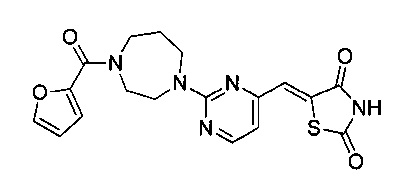
(Z)-5-((2-(4-(фуран-2-карбонил)-1,4-диазепан-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10316) получали следующим образом.
Круглодонную колбу на 2 драхма наполняли (Z)-5-((2-(1,4-диазепан-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом, полученным с использованием общего способа замещения, с последующим использованием общего способа удаления защитной группы из ТФУ, (25 мг, 0,062 ммоль), ДХМ (1 мл), фуран-2-карбонилхлоридом (8,07 мкл, 0,062 ммоль, 1 экв.) и пиридином (0,040 мл, 0,491 ммоль, 8 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (Сбор фракций с использованием МС) с градиентом ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением указанного в заголовке соединения (1,9 мг, 32,7 мг теор., 5,8%). ЖХ/МС m/z 400,1 (М+1).
ПРИМЕР 222

(Z)-N-((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)метил)пиразин-2-карбоксамид (Соединение 10500) получали следующим образом.
Круглодонную колбу на 2 драхма наполняли (Z)-5-((2-(4-(аминометил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом, полученным с использованием общего способа замещения, с последующим использованием общего способа удаления защитной группы из ТФУ, (56 мг, 0,175 ммоль), ДХМ (3 мл), пиразин-2-карбонилхлоридом (25 мг, 0,175 ммоль, 1 экв.) и пиридином (0,120 мл, 1,47 ммоль, 8,4 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (Сбор фракций с использованием МС) с градиентом ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением указанного в заголовке соединения (4,9 мг, 74,5 мг теор., 6,6%). ЖХ/МС m/z 426,5 (М+1).
ПРИМЕР 223
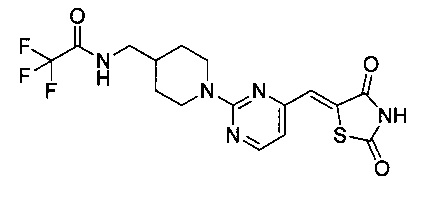
(Z)-N-((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)метил)-2,2,2-трифторацетамид (Соединение 10503) получали следующим образом.
Круглодонную колбу на 2 драхма наполняли (Z)-5-((2-(4-(аминометил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом, полученным с использованием общего способа замещения, с последующим использованием общего способа удаления защитной группы из ТФУ, (56 мг, 0,175 ммоль), ДХМ (3 мл), 2,2,2-трифторацетилхлоридом (23 мг, 0,175 ммоль, 1 экв.) и пиридином (0,120 мл, 1,47 ммоль, 8,4 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с градиентом ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением указанного в заголовке соединения (6,5 мг, 72,7 мг теор., 8,9%). ЖХ/МС m/z 416,1 (М+1).
ПРИМЕР 224
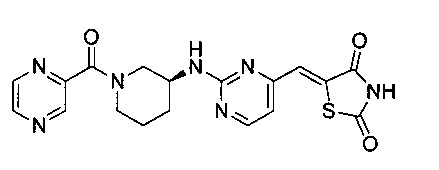
(S,Z)-5-((2-((1-(пиразин-2-карбонила)пиперидин-3-ил)амино)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10529) получали следующим образом.
Круглодонную колбу на 2 драхма наполняли (S,Z)-5-((2-(пиперидин-3-иламино)пиримидин-4-ил)метилен)тиазолидин-2,4-дионом, полученным с использованием общего способа замещения, с последующим использованием общего способа удаления защитной группы из ТФУ, (27 мг, 0,088 ммоль), ДХМ (2 мл), пиразин-2-карбонила хлоридом (12,5 мг, 0,088 ммоль, 1 экв.) и пиридином (0,080 мл, 0,982 ммоль, 11 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением указанного в заголовке соединения (2,6 мг, 36,1 мг теор., 6,4%). ЖХ/МС m/z 412,1 (М+1).
ПРИМЕР 225
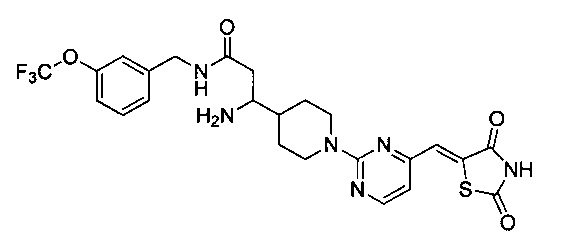
(Z)-3-амино-3-(1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)-N-(3-(трифторметокси)бензил)пропанамид (Соединение 10686) получали следующим образом.
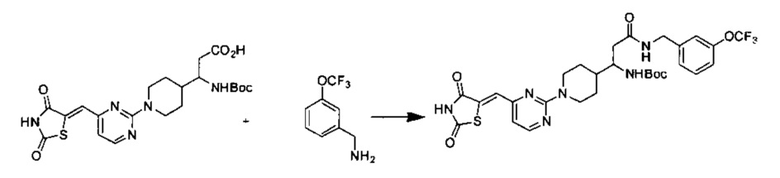
Круглодонную колбу на 2 драма наполняли (Z)-3-((трет-бутоксикарбонил)амино)-3-(1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)пропановой кислотой, полученной с использованием общего способа замещения, (25 мг, 0,052 ммоль), ДМФА (1 мл), DIPEA (34,9 мкл, 0,209 ммоль, 4 экв.) и (3-(трифторметокси)фенил)метанамином (7,85 мкл, 0,052 ммоль, 1 экв.). Реакционную смесь перемешивали в течение 20 минут, затем добавляли HBTU (29,8 мг, 0,079 ммоль, 1,5 экв.) и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и полученное твердое вещество промывали водой (2×1 мл) и сушили в высоком вакууме с получением 20 мг (Z)-трет-бутил(1-(1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)-3-оксо-3-((3-(трифторметокси)бензил)амино)пропил)карбамата (20 мг, 34,1 мг теор., 58,7%).
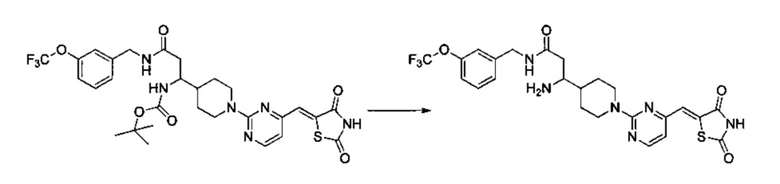
Круглодонную колбу на 2 драма наполняли (Z)-трет-бутил(1-(1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)-3-оксо-3-((3-(трифторметокси)бензил)амино)пропил)карбаматом (20 мг, 0,031 ммоль), ДХМ (0,5 мл) и ТФУ (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Растворитель удаляли при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (сбор фракций с использованием МС) с градиентом ацетонитрил/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением указанного в заголовке соединения (15,6 мг, 16,9 мг теор., 92%). ЖХ/МС m/z 551,2 (М+1)
ПРИМЕР 226
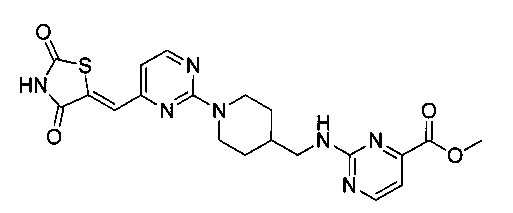
(Z)-метил 2-(((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)метил)амино)пиримидин-4-карбоксилат (Соединение 10578) получали следующим образом.
Метил-2-((пиперидин-4-илметил)амино)пиримидин-4-карбоксилат получали следующим образом: Круглодонную колбу на 40 мл наполняли трет-бутил-4-(аминометил)пиперидин-1-карбоксилатом (1,76 ммоль, 1,1 экв.), ацетонитрилом (4 мл), DIPEA (2,37 ммоль, 1,5 экв.), метил-2,6-дихлорпиримидин-4-карбоксилатом (1,58 ммоль, 1 экв.) и затем перемешивали при 85°С в течение 72 часов. Реакционную смесь концентрировали при пониженном давлении и очищали на SiO2 с использованием системы Biotage и градиента 10-50% EtOAc/гексаны с получением желаемого амина, содержащего защитную группу, (233 мг, 552 мг теор., 42%). Метил-2-((пиперидин-4-илметил)амино)пиримидин-4-карбоксилат получали с использованием общего способа удаления защитной группы из ТФУ и использовали непосредственно в общем способе замещения с получением указанного в заголовке соединения (4 мг, 73,4 мг теор., 5%). ЖХ/МС m/z 456,1 (М+1).
ПРИМЕР 227

(Z)-5-((2-(4-((имидазо[1,2-b]пиридазин-6-иламино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10597) получали с использованием такого же способа, как способ, используемый в синтезе Примера 226, с получением указанного в заголовке соединения (12,2 мг, 45,9 мг теор., 26,6%). ЖХ/МС m/z 437,5 (М+1).
ПРИМЕР 228

(Z)-5-((2-(4-(((1Н-бензо[d]имидазол-2-ил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10598) получали с использованием такого же способа, как способ, используемый в синтезе Примера 226, с получением указанного в заголовке соединения (21,4 мг, 45,8 мг теор., 46,7%). ЖХ/МС m/z 436,5 (М+1).
ПРИМЕР 229
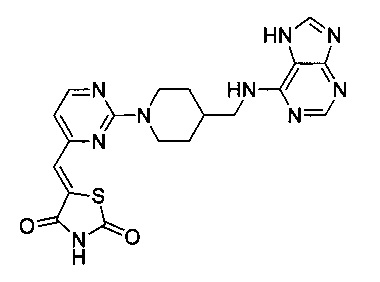
(Z)-5-((2-(4-(((7Н-пурин-6-ил)амино)метил)пиперидин-1-ил)пиримидин-4-ил)метилен)тиазолидин-2,4-дион (Соединение 10645) получали с использованием такого же способа, как способ, используемый в синтезе Примера 226 с получением указанного в заголовке соединения (12,7 мг, 41,6 мг теор., 30,6%). ЖХ/МС m/z 438,5 (М+1).
ПРИМЕР 230
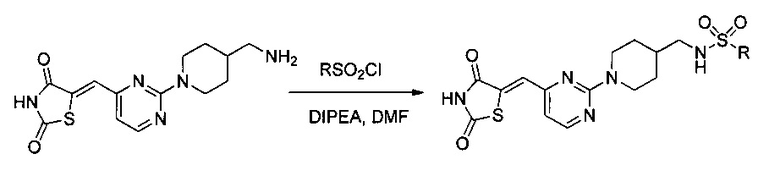
Общий способ получения сульфонамидов Круглодонную колбу на 2 драма наполняли соответствующим сульфонилхлоридом (0,072 ммоль, 1 экв.) в 0,5 мл ДМФА и затем осторожно обрабатывали раствором соответствующего аминного промежуточного соединения, полученного с использованием общего способа замещения с последующим использованием общего способа удаления защитной группы из ТФУ, (0,072 ммоль, 1 экв.), DIPEA (0,288 ммоль, 4 экв.) и 1 мл ДМФА. Реакционную смесь затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь распределяли между 2 мл ДХЭ и 1 мл насыщенным раствором NaHCO3 и водный слой экстрагировали ДХЭ (2×2 мл). Комбинированный органический слой концентрировали при пониженном давлении (Genevac НТ-4) и неочищенный осадок очищали с использованием обращенно-фазовой ВЭЖХ (Сбор фракций с использованием МС) с использованием градиента ацетонитрил/вода или метанол/вода и трифторуксусной кислоты в качестве модификатора. Очищенные фракции затем концентрировали при пониженном давлении (Genevac НТ-4) с получением сульфонамидных аналогов.
ПРИМЕР 231
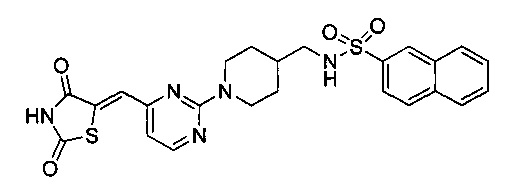
(Z)-N-((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)метил)нафталин-2-сульфонамид (Соединение 10616) получали с использованием такого же способа, как общий способ, описанный в Примере 230, с получением указанного в заголовке соединения (7,7 мг, 36,7 мг теор., 21%). ЖХ/МС m/z 510,5 (М+1).
ПРИМЕР 232

(Z)-N-((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)метил)-6-метоксинафталин-2-сульфонамид получали с использованием такого же способа, как общий способ, описанный в Примере 230, с получением указанного в заголовке соединения (15,2 мг, 38,9 мг теор., 39,1%). ЖХ/МС m/z 540,5 (М+1),
ПРИМЕР 233

(Z)-5-хлор-N-((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)метил)нафталин-2-сульфонамид получали с использованием такого же способа, как общий способ, описанный в Примере 230, с получением указанного в заголовке соединения (9,2 мг, 39,2 мг теор., 23,5%). ЖХ/МС m/z 545 (М+1).
ПРИМЕР 234

(Z)-N-((1-(4-((2,4-диоксотиазолидин-5-илиден)метил)пиримидин-2-ил)пиперидин-4-ил)метил)-1-метил-1Н-индол-5-сульфонамид получали с использованием такого же способа, как общий способ, описанный в Примере 230, с получением указанного в заголовке соединения (13,2 мг, 36,9 мг теор., 35,8%). ЖХ/МС m/z 513,5 (М+1).
ПРИМЕР 235
Протоколы скрининга CK1γ1(b), CK1γ2(h), CK1γ3(h), CK1δ(h) и CK1(y) на предмет киназной активности: Скрининг киназ был проведен компанией Millipore UK Ltd. Состав буфера для разведения киназ: 20 мМ MOPS, 1 мМ ЭДТА, 0,01% Brij - 35,5% глицерин, 0,1% b-меркаптоэтанол, 1 мг/мл БСА.
В конечном реакционном объеме 25 мкл интересующее соединение (в желаемой концентрации) и соответствующую киназу (5-10 мЕд) инкубировали с 8 мМ MOPS, рН 7,0, 0,2 мМ ЭДТА, 200 мкМ KRRRALS(p)VASLPGL (SEQ ID N0:1), 10 мМ ацетатом магния и [γ-33Р-АТФ] (специфичная активность приблизительно 500 импульсов в минуту/пкмоль, требуемая концентрация). Реакцию инициировали путем добавления комплекса Mg-АТФ. После инкубации в течение 40 минут при комнатной температуре реакцию останавливали путем добавления 5 мкл 3% раствора фосфорной кислоты. 10 мкл реакционной смеси затем наносили на фильтр РЗО Filtermat и промывали три раза в течение 5 минут 75 мМ фосфорной кислотой и один раз метанолом до высушивания и сцинтилляционного подсчета. Определенные значения IC50 для нескольких соединений предложены в Таблице 5.
Относительная активность киназы в виде функции концентрации соединения изображена на Фигурах 1-40.
Дополнительные значения IC50 для CK1 показаны в Таблице 6:
Дополнительные данные по % активности показаны в Таблице 7.
ПРИМЕР 236
Анализы PIM-киназ были проведены в компании Millipore UK Ltd. Данные IC50 суммированы в Таблице 8, и данные процентной активности суммированы в Таблице 9.
Дополнительные данные по процентной активности для соединений 4981 и 4991 при концентрации 10 микромоль (мкМ) показаны в Таблицах 10 и 11.
ПРИМЕР 237: Исследования клеточной пролиферации
Подавление клеток PC-3:
Клетки: PC-3, ATCC (Американская коллекция типовых культур), пассаж неизвестен, Mycoplasma не обнаружена.
Среда: Среда DMEM (GIBCO Cat#11995073) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 3,000 клеток на лунку (100 мкл) в 96-луночных планшетах инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 41. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли по 20 мкл раствора MTS (Promega Cat #05430) в каждую лунку и инкубировали в течение 4 часов.
Вычисление: % подавление + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 12:
ПРИМЕР 238: Исследования клеточной пролиферации
Подавление клеток OVCAR-3
Клетки: Клетки OVCAR-3, АТСС (Американская коллекция типовых культур), пассаж 4, Mycoplasma не обнаружена.
Среда: Среда RPMI-1640 (GIBCO Cat#22400121) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 2,000 клеток на лунку (100 мкл) в 96-луночных планшетах инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ, Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 42. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat #G5430) в каждую лунку и инкубировали в течение 4 часов.
Вычисление: % подавления + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 13:
ПРИМЕР 239: Исследования клеточной пролиферации
Подавление клеток LNCaP
Клетки: LNCaP, ATCC (Американская коллекция типовых культур). Пассаж неизвестен, Mycoplasma не обнаружена.
Среда: Среда RPMI-1640 (GIBCO Cat#22400121) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 3,000 клеток на лунку (100 мкл) в 96-луночных планшетах, инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 43. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat #G5430) в каждую лунку и инкубировали в течение 4 часов.
Вычисление: % подавления + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 14:
ПРИМЕР 240: Исследования клеточной пролиферации Подавление клеток Jurkat
Клетки: Клетки Jurkat, ATCC (Американская коллекция типовых культур), пассаж неизвестен, Mycoplasma не обнаружена.
Среда: Среда RPMI-1640 (GIBCO Cat#22400121) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 5,000 клеток на лунку (100 мкл) в 96-луночных планшетах, инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 44. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat #05430) в каждую лунку и инкубировали в течение 4 часов.
Вычисление: % подавления + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 15:
ПРИМЕР 241: Исследования клеточной пролиферации Подавление клеток MDA-MB-468
Клетки: Клетки MDA-MB-468, АТСС (Американская коллекция типовых культур), пассаж неизвестен, Mycoplasma не обнаружена.
Среда: Среда RPMI-1640 (GIBCO Cat#22400121) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 2,000 клеток на лунку (100 мкл) в 96-луночных планшетах, инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 45. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat #05430) в каждую лунку и инкубировали в течение 4 часов.
Вычисление: % подавления + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 16:
ПРИМЕР 242: Исследования клеточной пролиферации
Подавление клеток НСТ116
Клетки: Клетки НСТ116, АТСС (Американская коллекция типовых культур), пассаж неизвестен, Mycoplasma не обнаружена.
Среда: Среда DMEM (GIBCO Cat#11995073) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 750 клеток на лунку (100 мкл) в 96-луночных планшетах, инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 46. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat #05430) в каждую лунку и инкубировали в течение 4 часов.
Измерение: Абсорбция при 490 нм с использованием спектрофотометра MD Spectramax Plus 384.
Вычисление: % подавления + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 17:
ПРИМЕР 243: Исследования клеточной пролиферации Подавление клеток А549
Клетки: Клетки А549, АТСС (Американская коллекция типовых культур), пассаж неизвестен, без Mycoplasma.
Среда: Среда DMEM (GIBCO Cat#11995073) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 750 клеток на лунку (100 мкл) в 96-луночных планшетах, инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 47. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat#G5430) в каждую лунку и инкубировали в течение 4 часов.
Измерение: Абсорбция при 490 нм, использовали спектрофотометр MD Spectramax Plus 384.
5 Вычисление: % подавления + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 18:
ПРИМЕР 244: Исследования клеточной пролиферации Подавление клеток DU145
Клетки: Клетки DU145 клетки, АТСС (Американская коллекция типовых культур), пассаж неизвестен, Mycoplasma не обнаружена.
Среда: Среда DMEM (GIBCO Cat#11995073) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 750 клеток на лунку (100 мкл) в 96-луночных планшетах, инкубировали в течение ночи при 37°C во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (гемцитабин, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 48. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat#G5430) в каждую лунку и инкубировали в течение 4 часов.
Измерение: Абсорбция при 490 нм, использовали спектрофотометра MD Spectramax Plus 384.
Вычисление: % подавление + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 19:
ПРИМЕР 245: Исследования клеточной пролиферации
Подавление клеток НСС1954
Клетки: Клетки DU145, АТСС (Американская коллекция типовых культур), пассаж неизвестен, Mycoplasma не обнаружена.
Среда: RPMI-1640 (GIBCO Cat#22400121) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 2,000 клеток на лунку (100 мкл) в 96-луночных планшетах, инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разводили в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. дополнительное 3-кратное разведение). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (сорафениб, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 49. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat#G5430) в каждую лунку и инкубировали в течение 4 часов.
Измерение: Абсорбция при 490 нм, использовали спектрофотометр MD Spectramax Plus 384.
Вычисление: % подавление + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 20:
ПРИМЕР 246: Исследования пролиферации клеток
Подавление клеток Сасо-2
Клетки: Клетки Сасо-2, АТСС (Американская коллекция типовых культур), пассаж 109, Mycoplasma не обнаружена.
Среда: среда DMEM (GIBCO Cat#11995073) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone Cat#SH30396,03).
Посев: 3,000 клеток на лунку (100 мкл) в 96-луночные планшеты, инкубировали в течение ночи при 37°С во влажной атмосфере с 5% CO2.
Лечение: Тестируемые соединения сначала разбавляли в 333 раза в среде. Пятьдесят микролитров (50 мкл) разведенных соединений добавляли в каждую лунку (т.е. разводили еще в 3 раза). Конечная концентрация тестируемых соединений составляла 10 мкМ. Конечные концентрации положительного контроля (сорафениб, также добавляли по 50 мкл в каждую лунку) показаны на Фигуре 50. Клетки инкубировали в течение 72 часов после добавления тестируемых соединений.
MTS: Добавляли 20 мкл раствора MTS (Promega Cat #05430) в каждую лунку и инкубировали в течение 4 часов.
Измерение: Абсорбция при 490 нм, использовали спектрофотометр MD Spectramax Plus 384.
Вычисление: % подавление + (AVE нулевой контроль - AVE соединение) / AVE нулевой контроль * 100.
Результаты показаны в Таблице 21:
ПРИМЕР 247
Определение IC50 соединения 4991 для трех линий раковых клеток
Дополнительные исследования клеточного подавления были проведены в компании Crown Biosciences. Материалы представлены в Таблице 22.
Кривые зависимости эффекта от дозы для соединения 4991 по сравнению с цисплатином, а также рассчитанные значения IC50 значения показаны на Фигурах 51-53.
ПРИМЕР 248
Анализы РАМРА и стабильности человеческих и крысиных микросом печени in vitro для определения ADME (всасывания, распределения, метаболизма и выведения).
Типичный способ градиентной ВЭЖХ и МС, приведенный в Таблице 22, использовали для анализа соединений 4981, 4985, 4991 и 4999.
Проводили анализ проникающей способности через искусственные параллельные мембраны (РАМРА) для соединений 4981, 4985, 4991 и 4999. Рабочая концентрация для анализа, которую получали путем разведения (1000-кратного) 10 мМ исходных растворов в ДМСО в ФСБ, pH 7,4, составляла 10 мкМ. Конечная концентрация ДМСО составляла 0,1%. В донорный планшет добавляли по 300 мкл на лунку 10 мкМ растворов. Акцепторный планшет, содержащий по 200 мкл ФСБ на лунку, pH 7,4, помещали в донорный планшет и планшеты инкубировали в течение 5 часов при комнатной температуре. В конце периода инкубации планшеты разделяли и концентрации соединений в каждом растворе определяли с помощью ЖХ/МС/МС. Анализ проводили в трех повторностях. Дексаметазон и верапамил использовали в качестве контрольных соединений. Проникающая способность. Pe, и удержание массы, R, для каждого соединения рассчитывали с использованием следующих далее уравнений, Результаты суммированы в Таблице 17. Результаты для дексаметазона и верапамила согласуются с имеющимися данными.
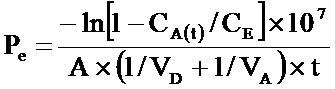
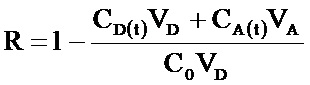
где:
C0 представляет собой исходную концентрацию в донорной лунке (мкМ)
CD(t) представляет собой концентрацию в донорной лунке после инкубации (мкМ)
CA(t) представляет собой концентрацию в акцепторной лунке после инкубации (мкМ)
VD представляет собой объем в донорной лунке (0,3 мл)
VD представляет собой объем в акцепторной лунке (0,2 мл)
CE равен (CD(t)VD+CA(t)VA)/(VD+VA)
А представляет собой площадь фильтрования (0,3 см2)
t представляет собой время инкубации (18,000 с).
Анализы стабильности человеческих и крысиных (Sprague-Dawley) микросом печени проводили для соединений 4981, 4985, 4991 и 4999. Используемые концентрации белка составляли 0,4 (человек) и 0,2 мг/мл (крыса) в системе восстановления кофактора НАДФН (2,6 мМ НАДФ +, 6,6 мМ глюкозо-6-фосфат, 0,8 Ед/мл глюкозо-6-фосфатдегидрогеназы и 6,6 мМ хлорид магния). 100 мкМ рабочий исходный раствор каждого соединения в 20% ДМСО/80% ацетонитрил разводили в 100 раз с получением 1 мкМ соединений/1% конечные концентрации для органических реакций. Контрольные точки снимали через 0 и 60 минут. При снятии каждой контрольной точки добавляли 100 мкл инкубационной суспензии к 200 мкл ацетонитрила, содержащего внутренний контроль (толбутамид), с последующим центрифугирвоанием при 3,220 rcf в течение 10 минут. Двести (200) мкл полученных супернатантов отбирали, сушили в атмосфере азота и восстанавливали с помощью 100 мкл 2 мМ ацетата аммония, 0,1% муравьиной кислоты в 50% метаноле перед проведением анализа с помощью ЖХ/МС/МС. Тестостерон и дексаметазон использовали в качестве контрольных соединений. В Таблице 25 приведены суммарные результаты. Результаты для тестостерона и дексаметазона согласуются с имеющимися данными.
Используемые материалы перечислены в Таблице 26.
Оборудование для ЖХ/МС:
Хроматограф: Shimadzu LC-20 AD
Автоматический дозатор: СТС HTS PAL
MC: API 4000
Программное обеспечение: программа Analyst, версия 1, 4, 2.
ПРИМЕР 249
Данные по подавлению пролиферации выбранных клеток
Клеточные линии:
Все клетки, если иное специально не указано, культивировали в среде с добавлением 10% ЭБС при температуре 37°С, 5% CO2 и 95% влажности. Все среды для культивирования были получены из GIBCO (США, IMDM Cat. 12200-036; RPMI 1640 Cat,31800-022; 2-меркаптоэтанол Cat. 21985-023).
Реагенты:
Порошок реагента MTS, CellTiter 96® AQueous (Cat. No.: G11 12, Promega. Порошок реагента MTS хранили в высушенном состоянии при 4°С в защищенном от света месте.)
Феназинметосульфат (ФМС) (продукт No.: P9625, SIGMA. Порошок ФМС хранили в высушенном состоянии при 4°С в защищенном от света месте.)
Приготовление раствора ФМС:
0,92 мг/мл ФМС в ФСБ, модифицированном Дульбекко, стерилизовали посредством фильтрования через фильтр (0,2 мкм) в стерильный защищенный от света контейнер. Хранили при -20°С.
Приготовление раствора MTS:
Следующий протокол рекомендован для получения 21 мл раствора MTS (достаточно для десяти 96-луночных планшетов).
а. Выбирали защищенный от света контейнер или закрывали контейнер фольгой.
b. Добавляли 21 мл ФСБ, модифицированный Дульбекко, в контейнер.
с. Взвешивали 42 мг порошка реагента MTS и добавляли к ФСБ, модифицированному Дульбекко.
d. Смешивали при средней скорости на столике с магнитной мешалкой в течение 15 минут или до полного растворения MTS.
е. Измеряли pH раствора MTS. Оптимальное значение pH составляло между 6,0 и 6,5. Если pH раствора был выше 6,5, доводили до pH 6,5 с помощью 1н НСl.
f. Стерилизовали посредством фильтрования раствор MTS через фильтр (0,2 мкм) в стерильный, защищенный от света контейнер.
g. Хранили раствор MTS при -20°С в защищенном от света месте.
Приготовление смеси MTS/ФМС:
а. Для получения реагентов, достаточных для одного 96-луночного планшета, содержащего клетки, культивируемые в объеме 100 мкл, размораживали раствор MTS и раствор ФМС. Для полной разморозки 20 мл раствора MTS требовалось примерно 90 минут при комнатной температуре или 10 минут на водяной бане при 37°С. (Примечание: Для удобства, при первой разморозке продукта общее содержимое пробирки на 1 мл с раствором ФМС можно переносить в бутылку на 20 мл с раствором MTS. Указанную смесь необходимо хранить при -20°С в период между использованиями. При хранении растворов ФМС и MTS при 4°С указанные растворы необходимо смешивать непосредственно перед добавлением в аналитический планшет).
b. Стерильно удаляли 2,0 мл раствора MTS из реакционной бутылки из темного стекла и переносили в аналитическую пробирку.
с. Добавляли 100 мкл раствора ФМС к 2,0 мл раствора MTS непосредственно перед добавлением в культуральный планшет, содержащий клетки.
d. Осторожно вращали пробирку для обеспечения полного смешения объединенных растворов MTS и ФМС.
Оборудование:
Спектрофотометр для микропланшетов SpectraMAX plus, модель 3011, Molecular Devices Corp.(Калифорния, США); CO2-инкубатор с водяной рубашкой, Therma (США). Инвертированный микроскоп, Chongguang XDS-1B, Chongqing Guangdian Corp. (Чунцин, КНР).
Определение цитотоксичности и IC50;
1. Клетки, соответственно находящиеся в фазе логарифмического роста, собирали и подсчитывали с помощью гемоцитометра. Выживаемость клеток составляла выше 98% по результатам анализа вытеснения трипанового синего.
2. Концентрации клеток доводили до 2,22×105 или 1,11×105 или 5,56×104 клеток/мл с помощью соответствующей среды.
3. 90 мкл клеточной суспензии добавляли в 96-луночные планшеты (по три повторности для каждой концентрации клеток), конечная плотность клеток составляли 2×104 или 1×104 или 5×103 клеток на лунку. Плотность 5×103 клеток на лунку использовали для первого теста. Определяли подходящую плотность клеток и изменяли плотность клеток в соответствии с результатами первого теста.
4. На следующий день тестируемые образцы или лекарственные средства, используемые в качестве положительного контроля, растворяли с ДМСО с получением исходного раствора в концентрации 20 мМ.
5. 10 мкл раствора лекарственного средства добавляли в каждую лунку (в трех повторностях для каждой концентрации лекарственного средства).
6. Планшеты инкубировали в течение дополнительных 72 часов, затем проводили измерение с помощью MTS-анализа.
7. Раствор MTS/ФМС готовили непосредственно перед использованием. 20 мкл смеси вводили в каждую лунку 96-луночного аналитического микропланшета, содержащего 100 мкл культуральной среды. (Конечный реакционный объем составлял 120 мкл).
8. Планшет инкубировали в течение 1-4 часов при 37°С во влажной атмосфере с 5% CO2.
9. Абсорбцию на 490 нм записывали с использованием спектрофотометра для микропланшетов SpectraMAX Plus.
Анализ данных:
Для расчета IC50 использовали программу GraphPad Prism, версию 5, Кривые наносили на график с использованием нелинейной модели регрессии с сигмоидальной функцией дозы.
Результаты
Результаты показаны в Таблицах 27 и 28.
ПРИМЕР 250
ПРИМЕР 251
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все патенты США и опубликованные заявки на патент США, цитированные в настоящей заявке, включены в настоящую заявку посредством ссылки.
ЭКВИВАЛЕНТЫ
Несмотря на то, что в настоящей заявке описаны и проиллюстрированы только несколько вариантов реализации настоящего изобретения, специалисты в данной области техники с легкостью определят различные другие способы и/или структуры для осуществления функций и/или получения результатов и/или одного или более преимуществ, описанных в настоящей заявке. Предполагается, что каждый из таких вариантов и/или модификаций включен в объем настоящего изобретения. В общем, специалисты в данной области техники с легкостью определят, что все параметры, показатели, материалы и конфигурации, описанные в настоящей заявке, приведены в качестве примеров, и что действительные параметры, показатели, материалы и/или конфигурации будут зависеть от конкретного применения или применений, для которых используется идея настоящего изобретения. Специалистам в данной области техники будут очевидны (или они смогут определить их с использованием стандартных экспериментов) многие эквиваленты конкретных вариантов реализации изобретения, описанных в настоящей заявке. Таким образом, необходимо понимать, что вышеизложенные варианты реализации изобретения представлены исключительно в качестве примера и что в пределах объема прилагаемой формулы изобретения и ее эквивалентов изобретение может иметь другие варианты осуществления помимо конкретно описанных и заявленных. Настоящее изобретение относится к каждому отдельному признаку, системе, образцу, материалу, набору и/или способу, описанному в настоящей заявке. Кроме того, любые комбинации двух или более указанных признаков, систем, образцов, материалов, наборов и/или способов, если указанные признаки, системы, образцы, материалы, наборы и/или способы не являются взаимно несовместимыми, включены в объем настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИНОПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2012 |
|
RU2674017C2 |
| Гибридные производные (1Н-1,2,4) триазола и серосодержащих гетероциклов: производных тиазолидин-2,4-диона, тиоморфолин-3-она и 1,4-тиазепан-3-она, обладающих антимикробной активностью | 2020 |
|
RU2771027C1 |
| ПИРАЗОЛОПИРИМИДИНЫ И РОДСТВЕННЫЕ ГЕТЕРОЦИКЛЫ КАК СК2 ИНГИБИТОРЫ | 2010 |
|
RU2607453C2 |
| Гибридные амиды на основе триазола и тиазолидина, обладающие антимикробной активностью | 2018 |
|
RU2703997C1 |
| 1-СУЛЬФОНИЛ-1,3-ДИГИДРОИНДОЛ-2-ОНЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2003 |
|
RU2259999C2 |
| ИНГИБИТОРЫ МЕТАЛЛОПРОТЕИНАЗ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2002 |
|
RU2288228C2 |
| ИМИДНЫЕ МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2738833C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СТИМУЛИРУЮЩЕЕ ИЛИ ВЫЗЫВАЮЩЕЕ РОСТ ВОЛОС ИЛИ РЕСНИЦ И/ИЛИ ПРЕПЯТСТВУЮЩЕЕ ИХ ВЫПАДЕНИЮ, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЕДИНЕНИЕ, ЕЕ ПРИМЕНЕНИЕ | 2003 |
|
RU2316325C2 |
| ГЕТЕРОАРОМАТИЧЕСКИЕ И АРОМАТИЧЕСКИЕ ПИПЕРАЗИНИЛАЗЕТИДИНИЛАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ | 2010 |
|
RU2558141C2 |
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |

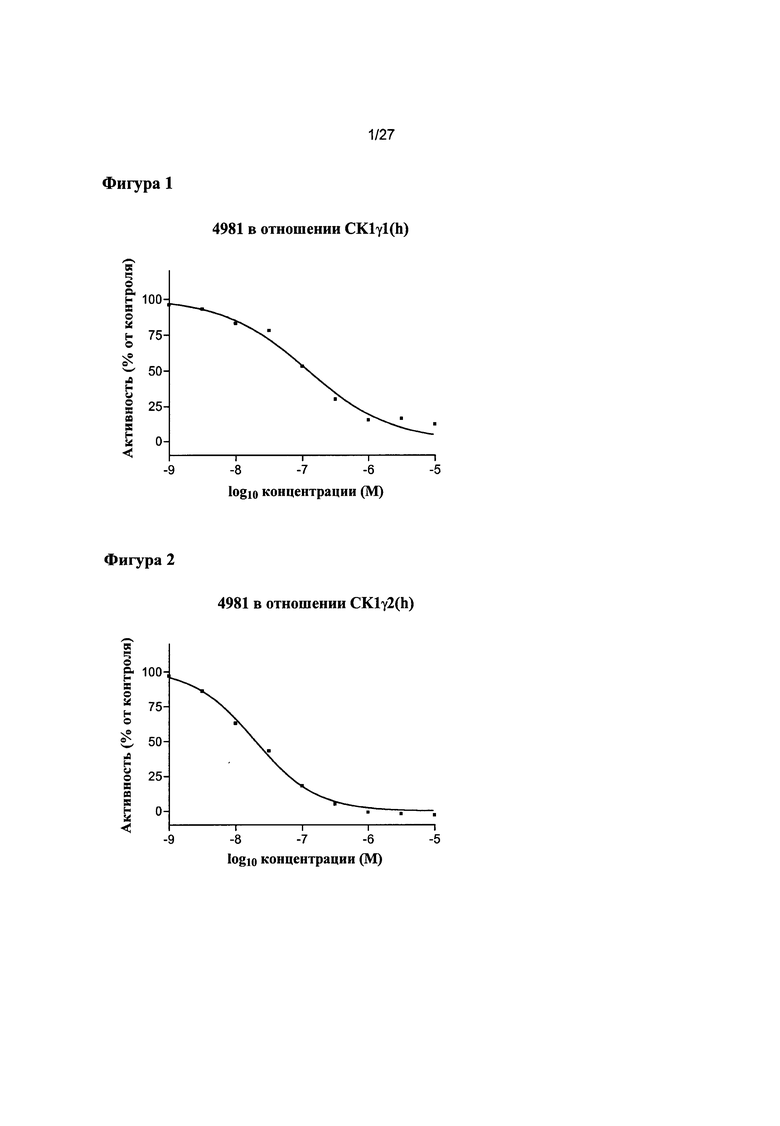
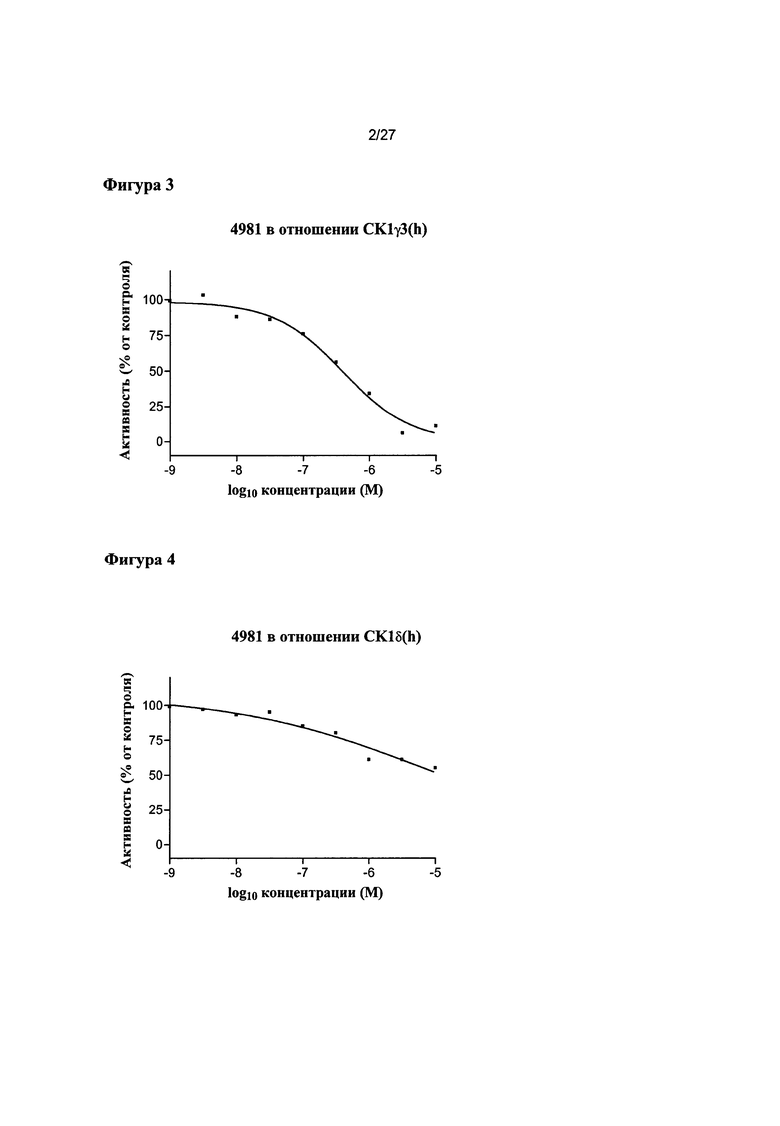
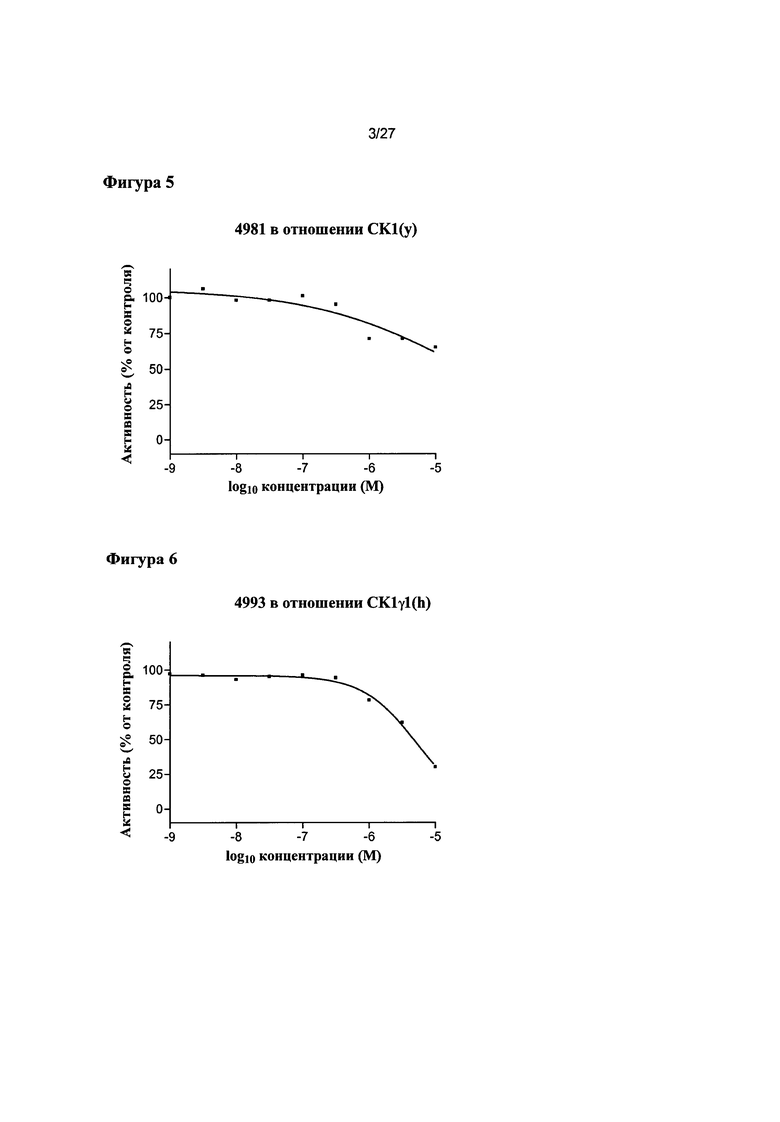
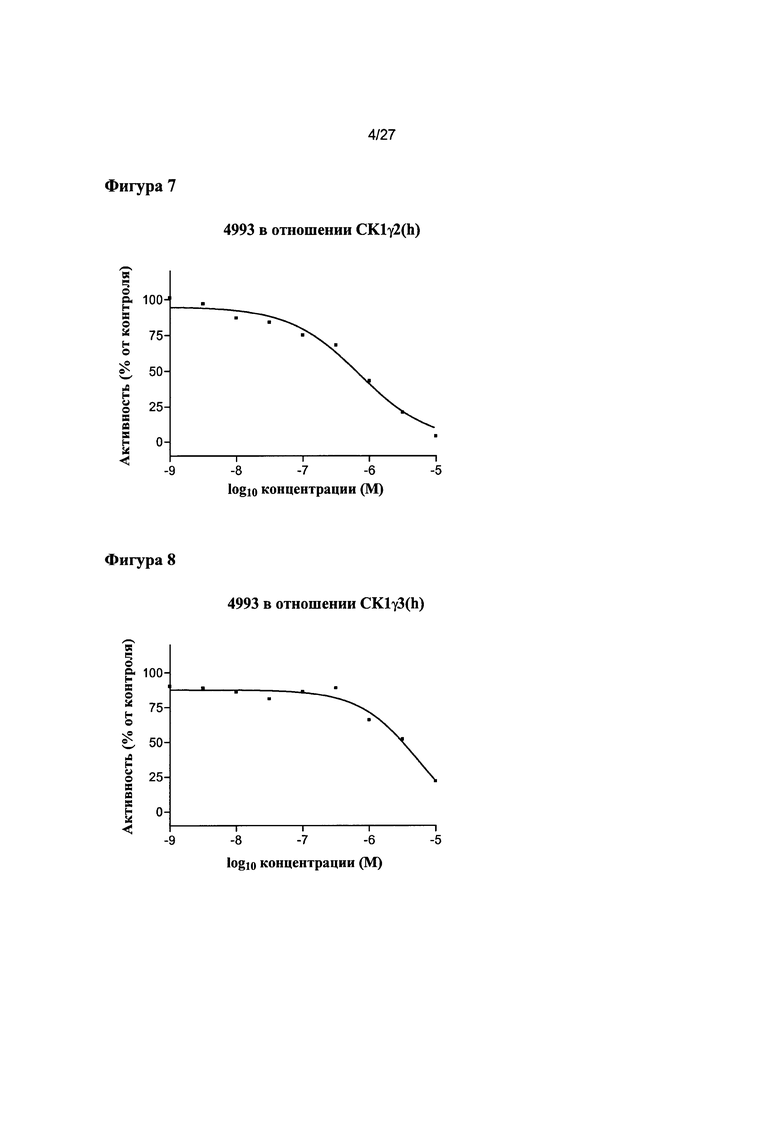
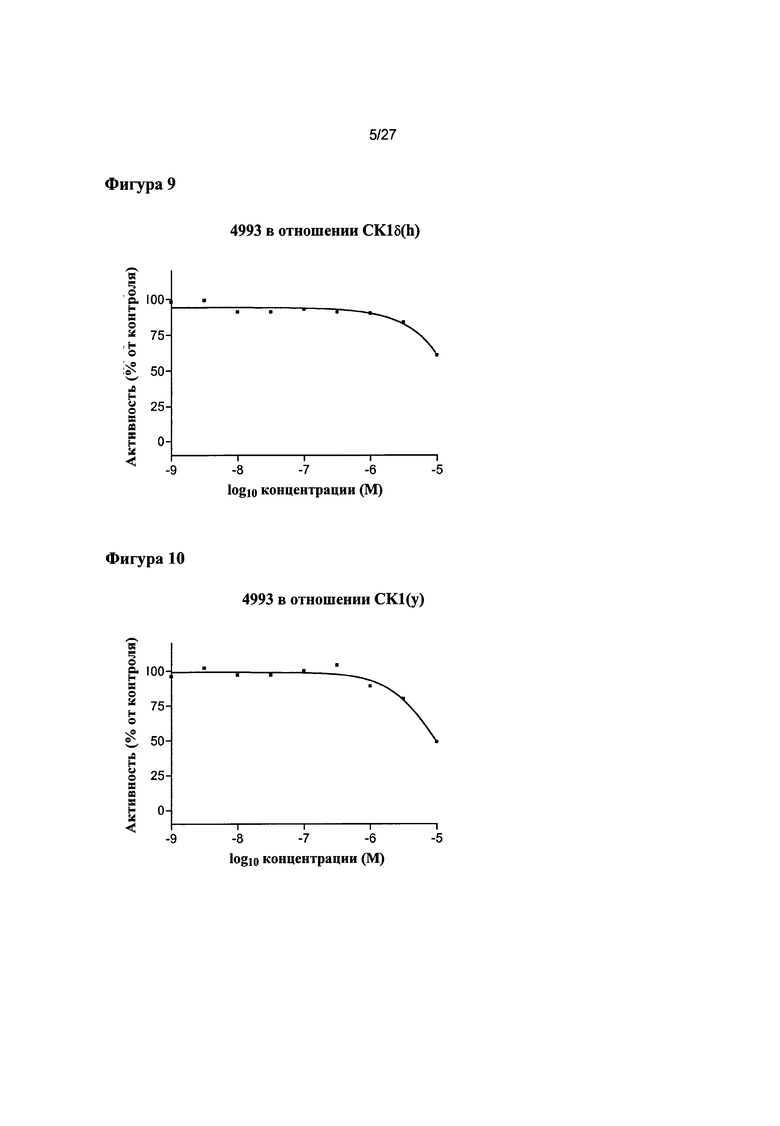
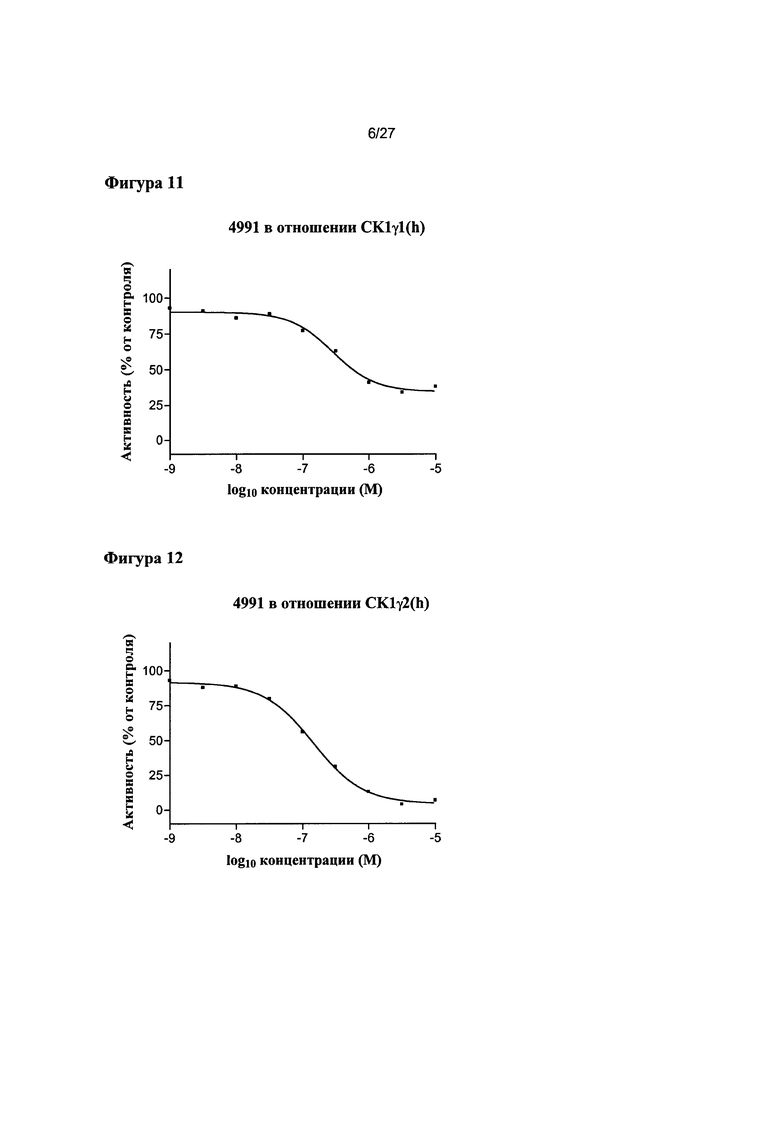
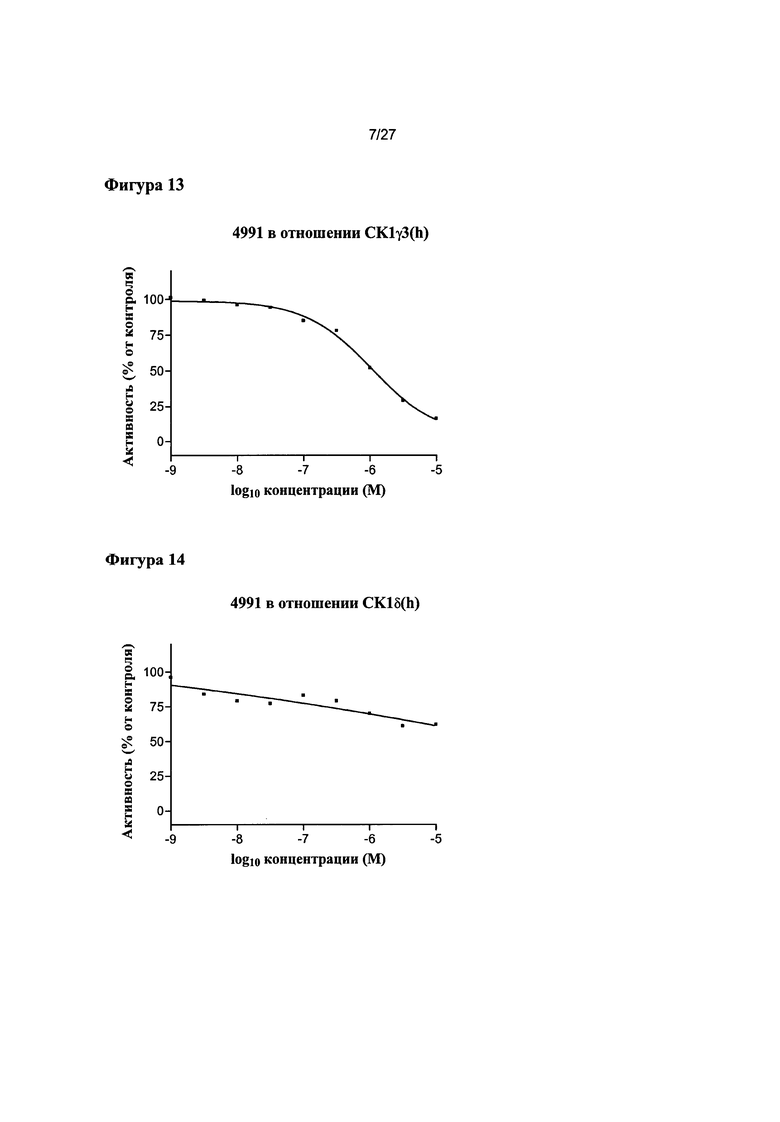
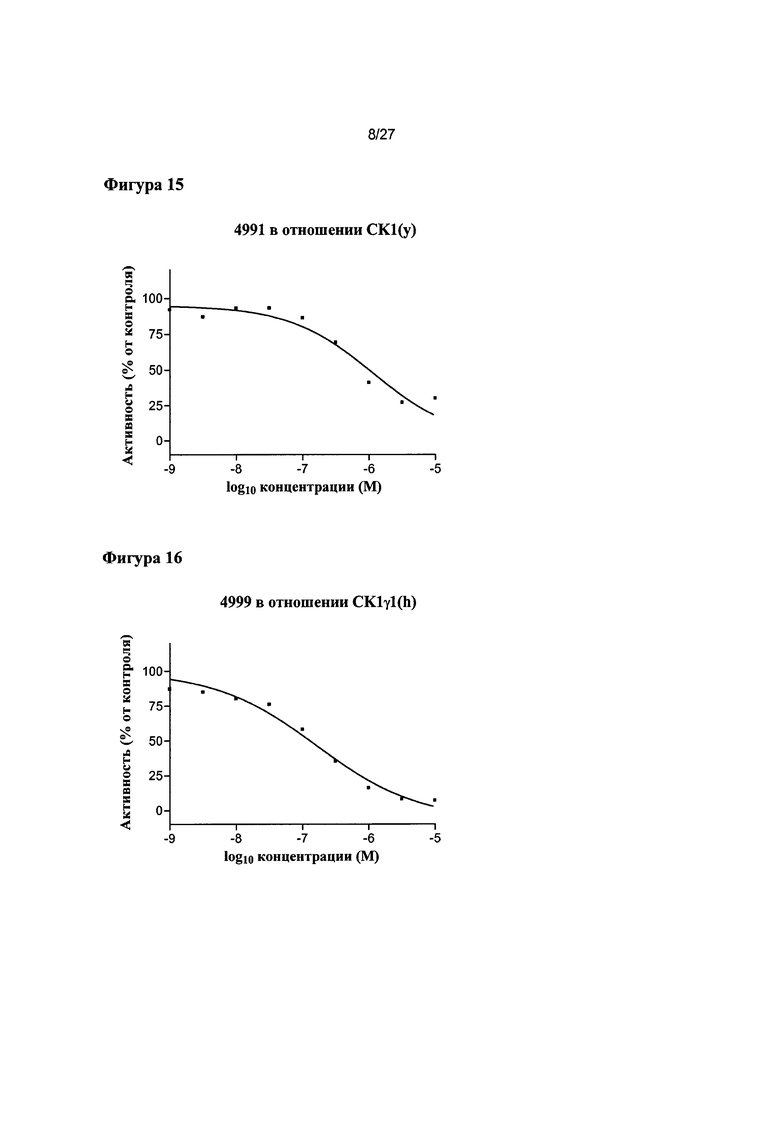
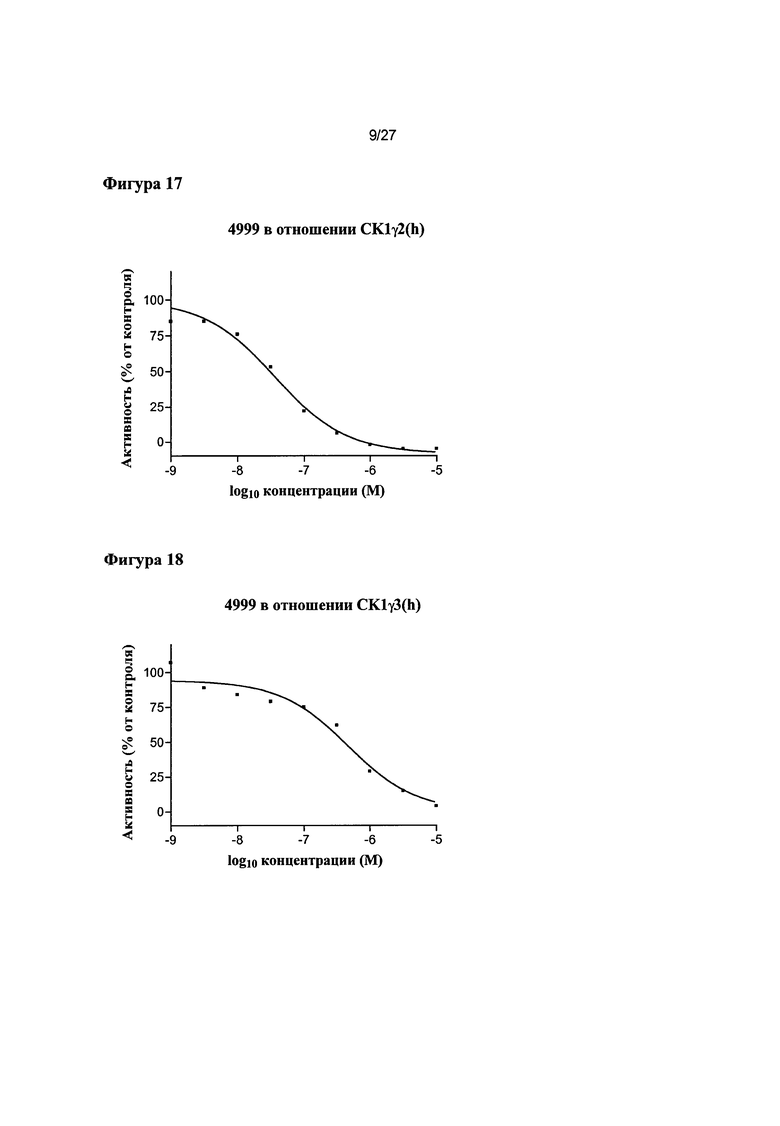

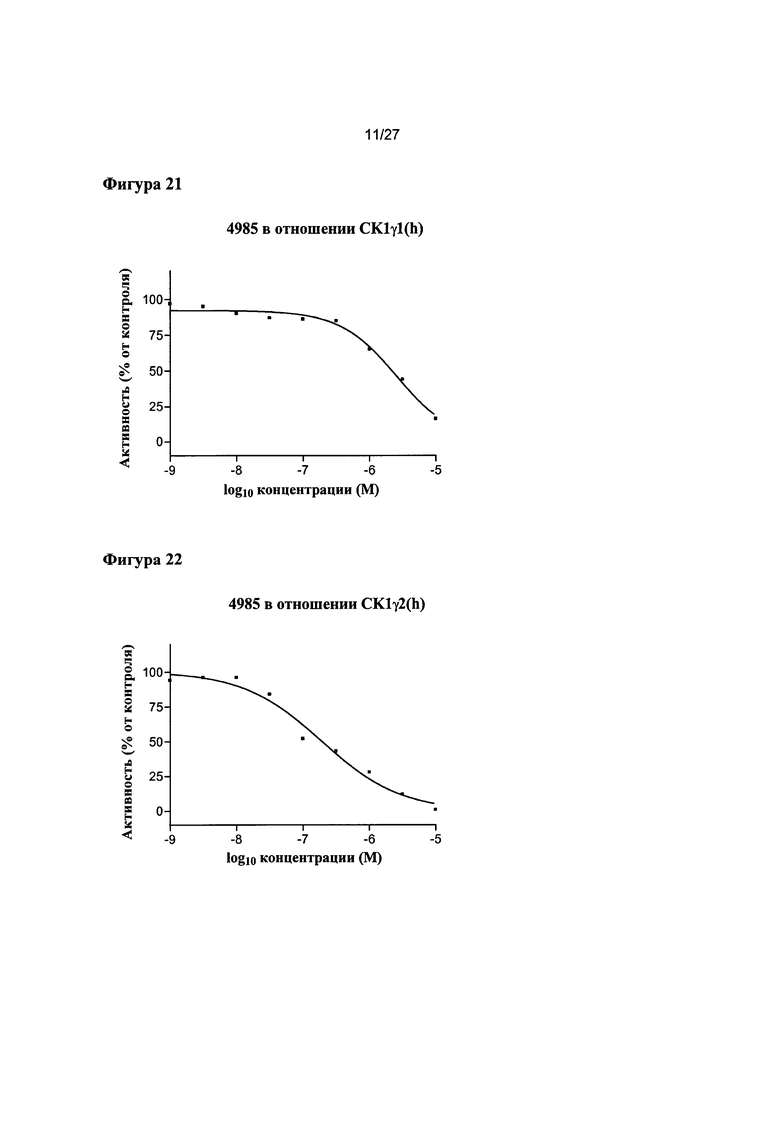
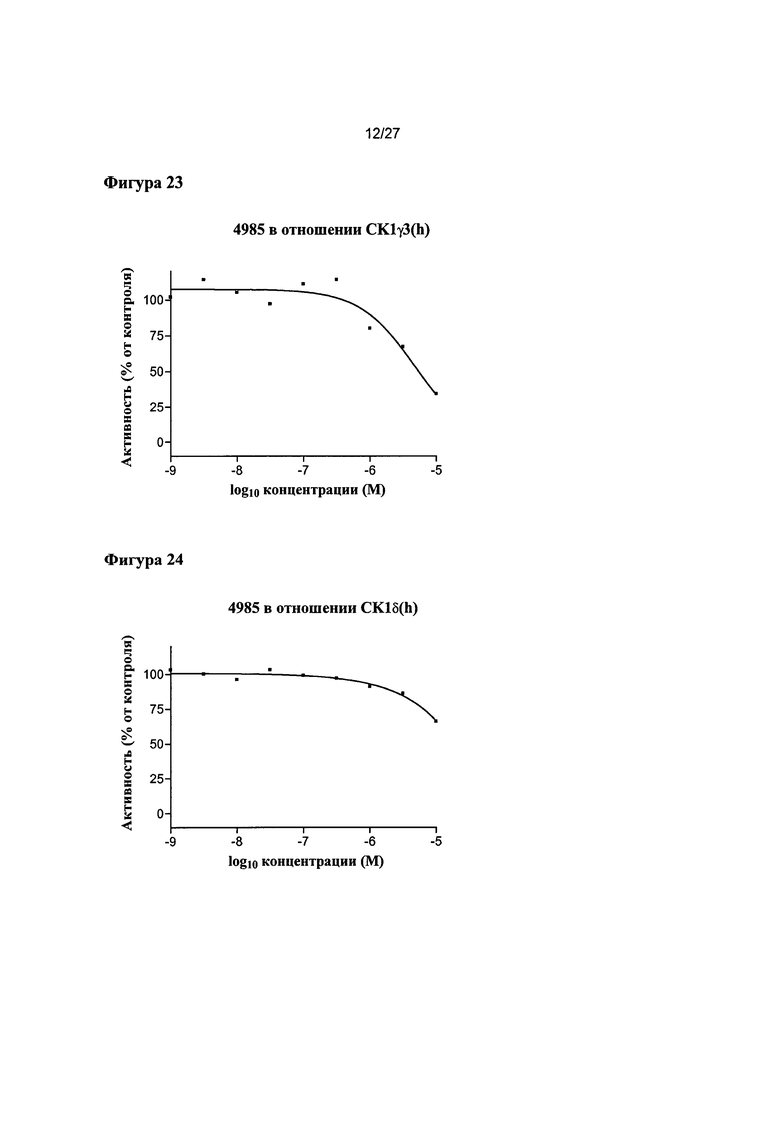
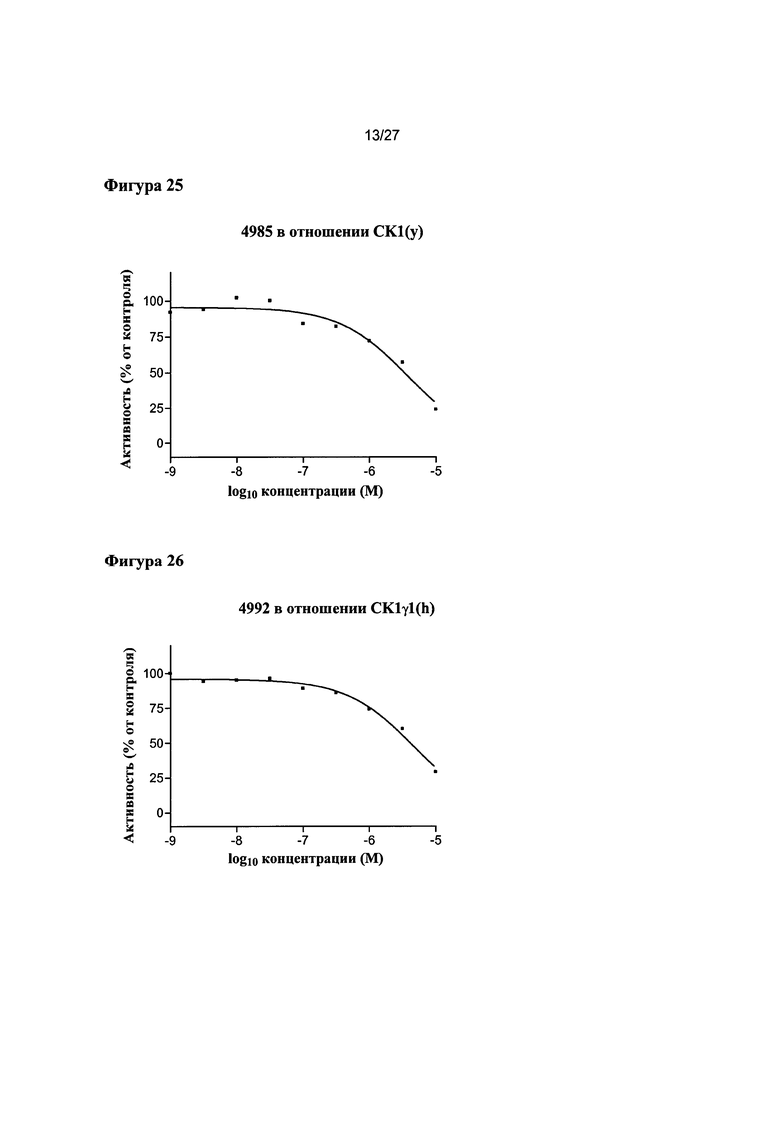

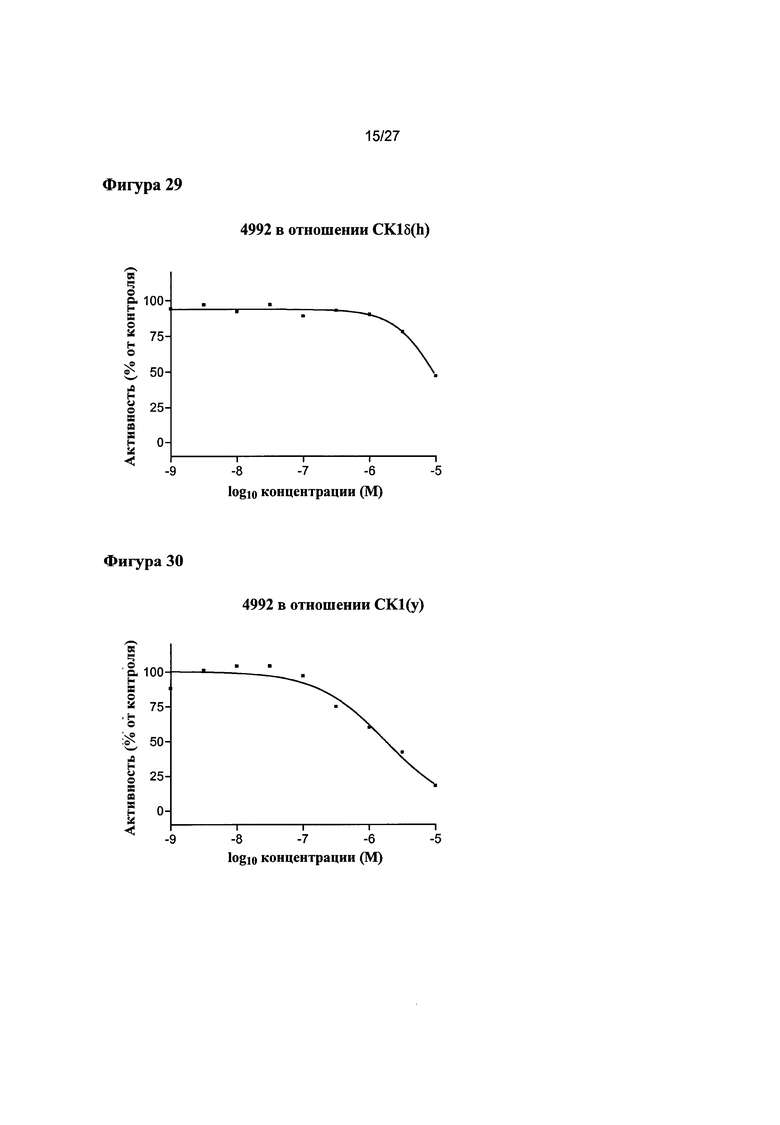
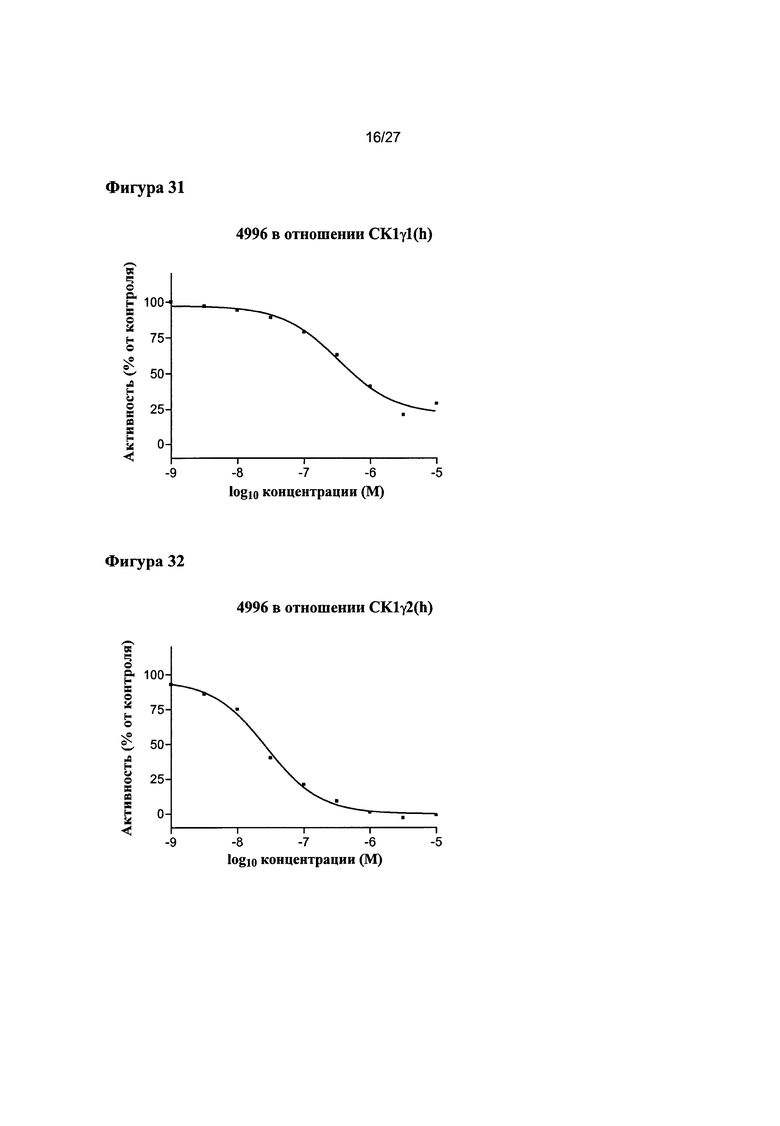


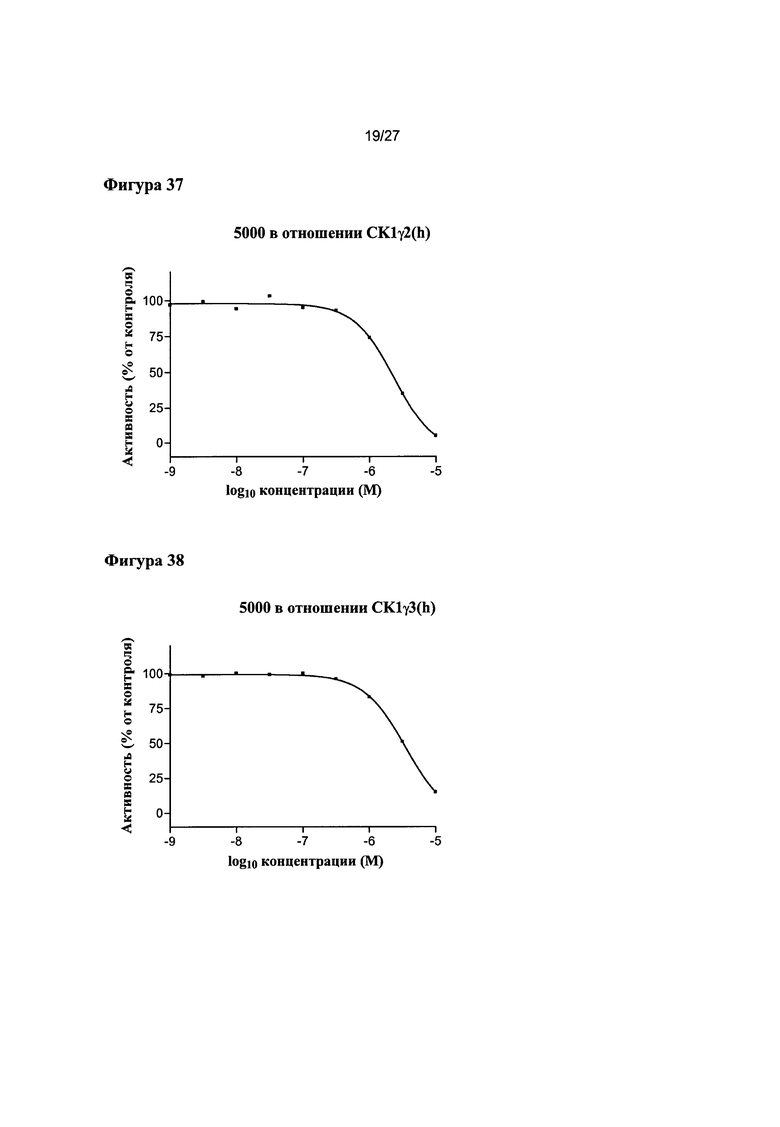
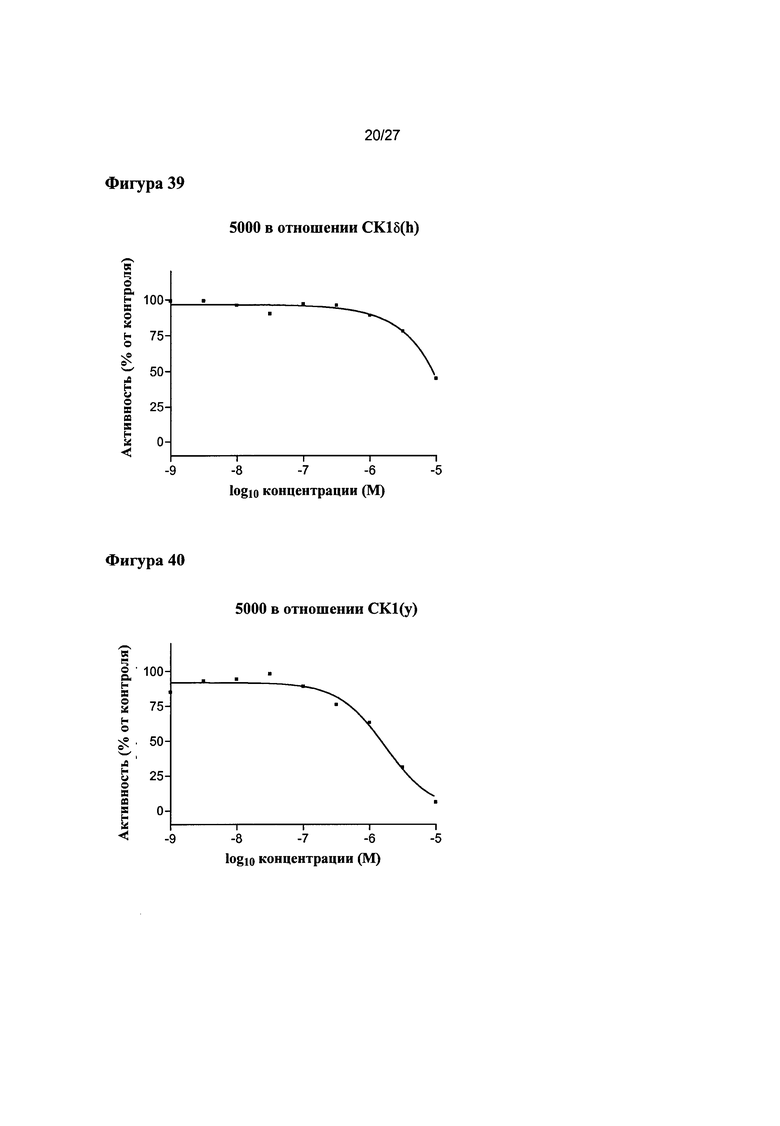
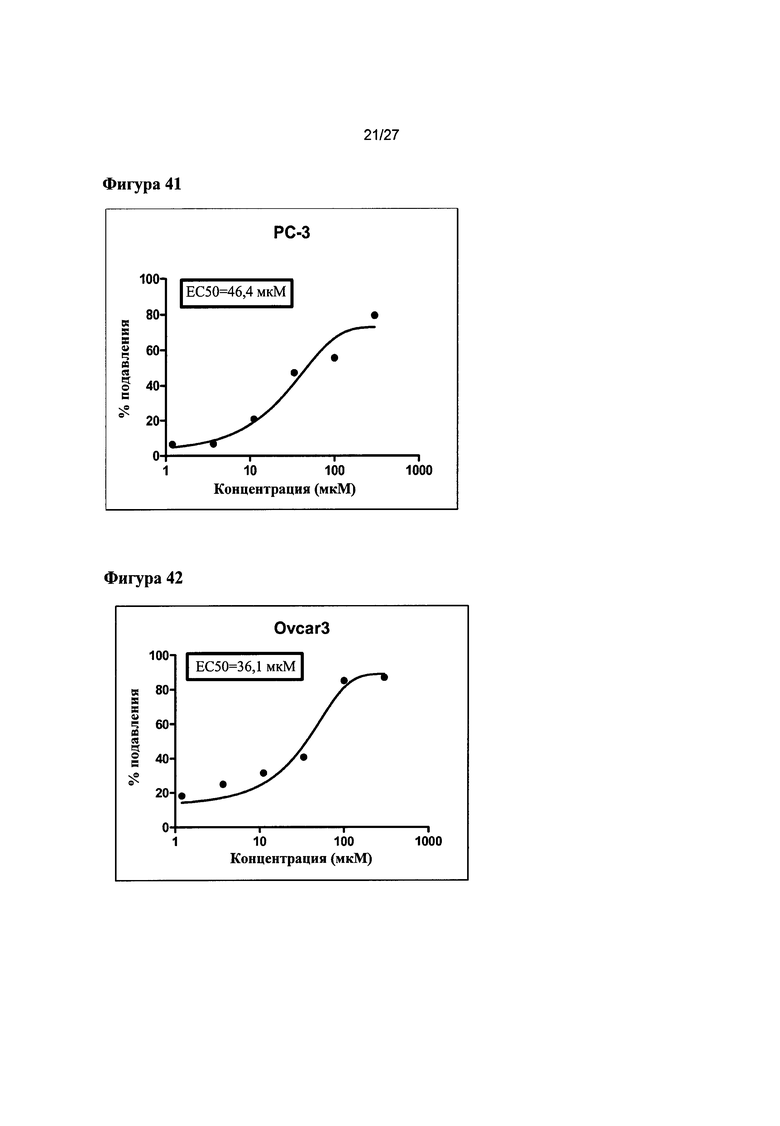
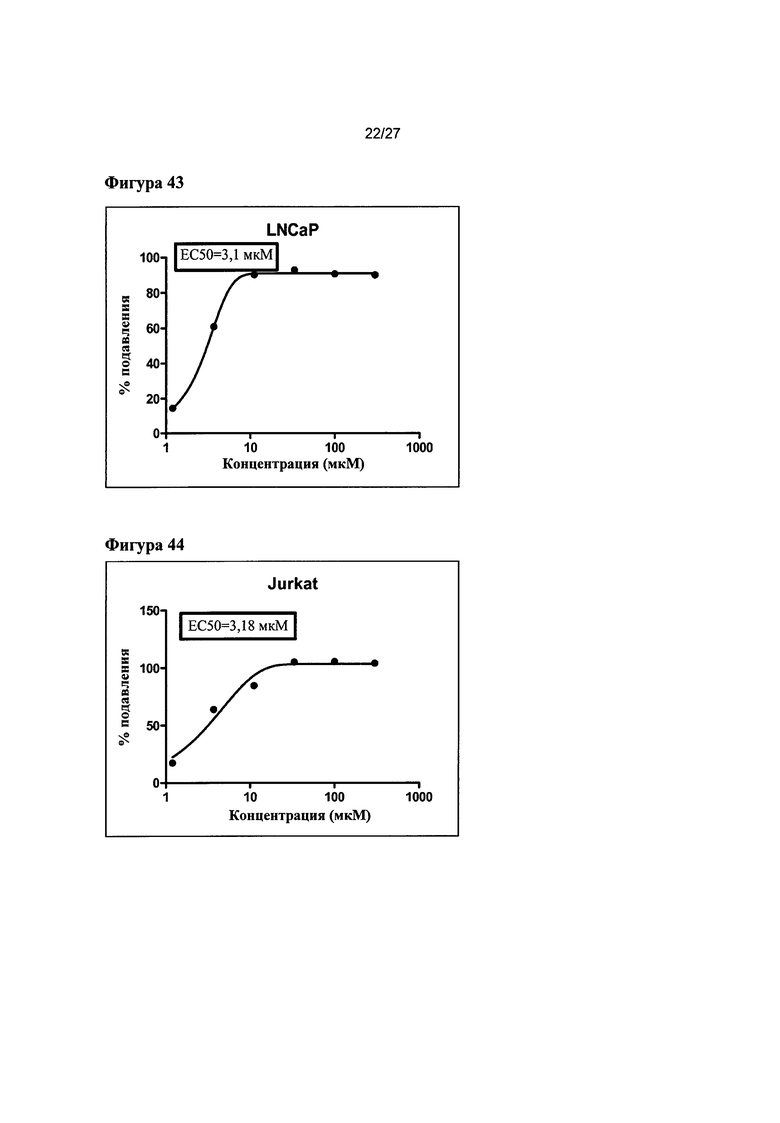

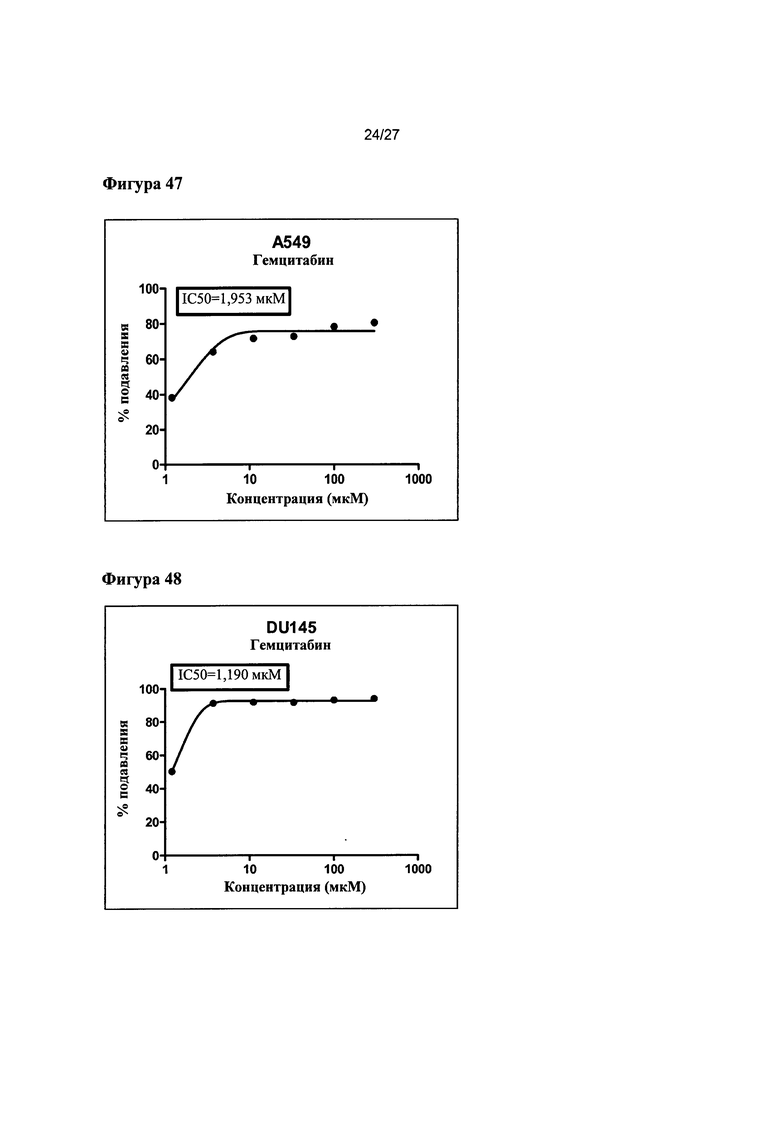
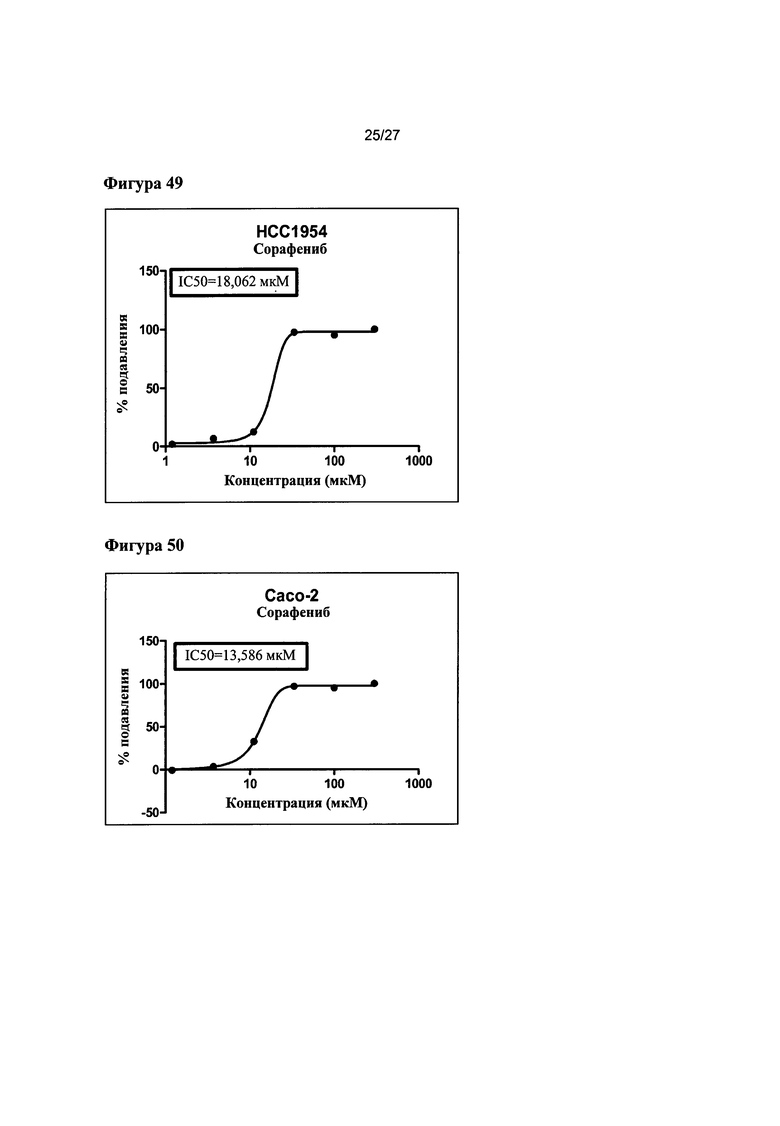
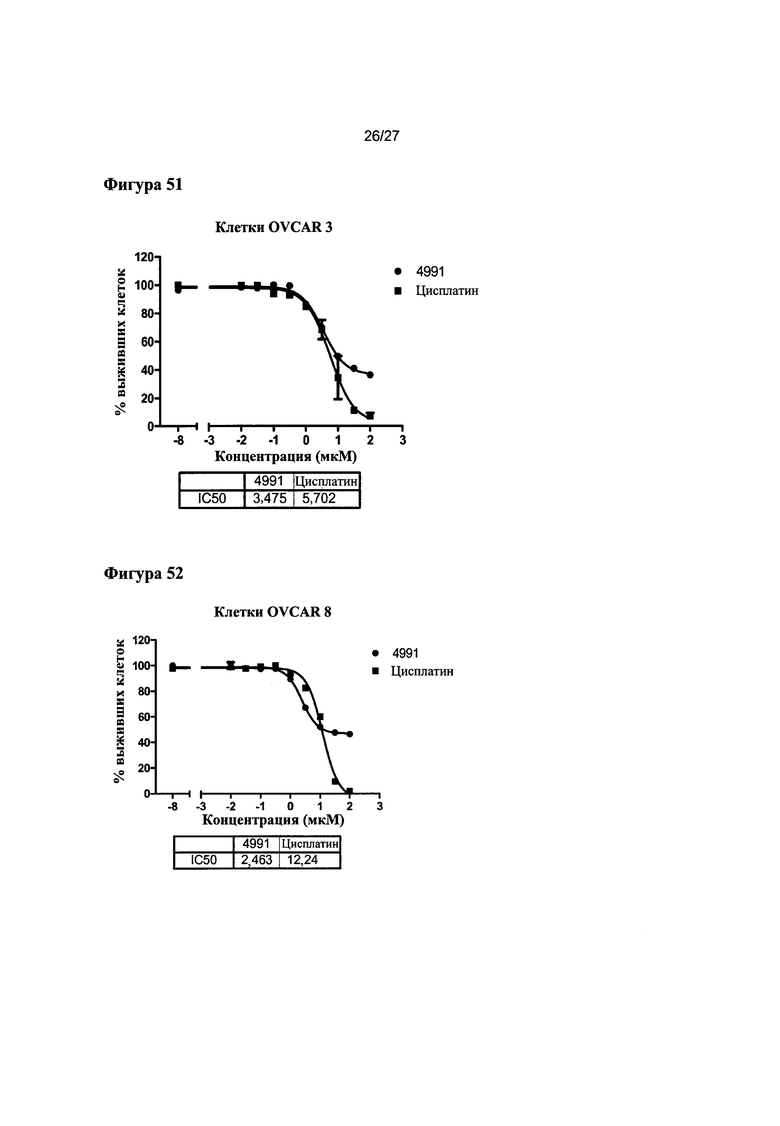
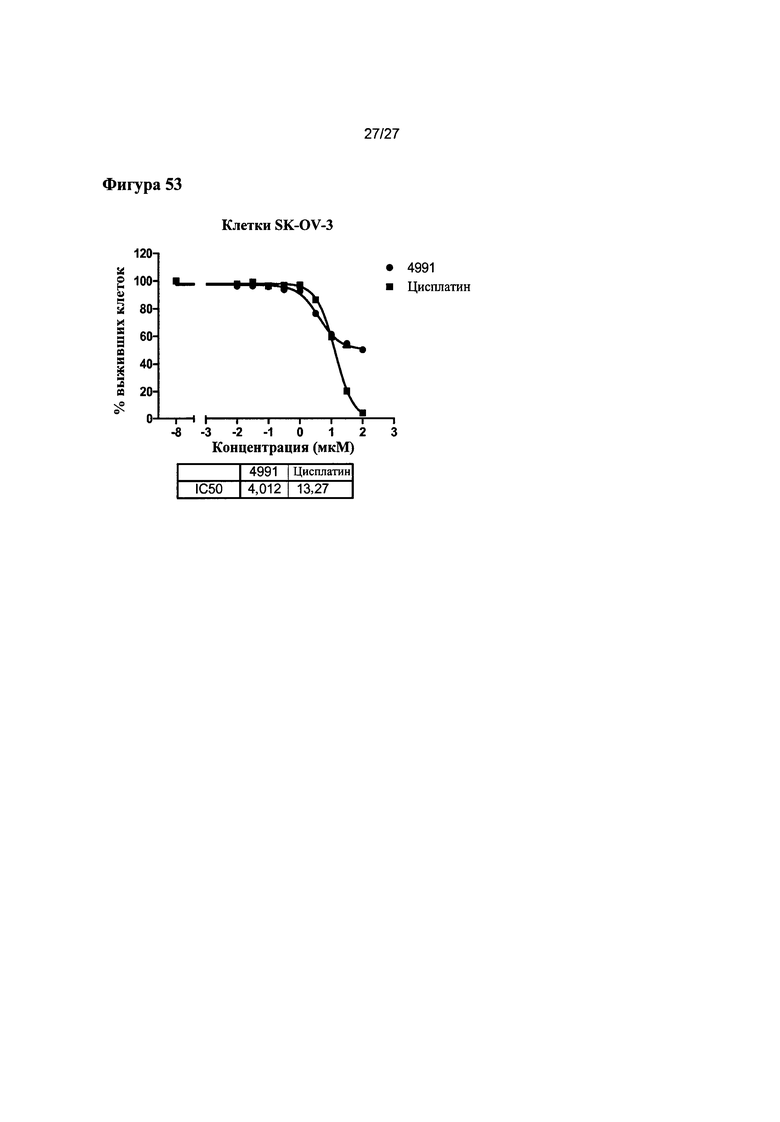
Изобретение относится к соединению формулы 2, или его фармацевтически приемлемой соли, где независимо для каждого случая R1 представляет собой водород; каждый из R2 и R3 независимо выбран из группы, состоящей из водорода; (C1-С6)алкила, необязательно замещенного ОН; гетероарила, содержащего 6 атомов в кольце, из которых 1 атом является N, а остальные представляют собой атомы С (пиридин); гетероциклила, содержащего 5 или 6 атомов в кольце, из которых 1 атом является N, а остальные представляют собой атомы С (пиперидин или пирролидин), необязательно замещенного группой, выбранной из метила, фенила, пиридинилметила, хинолинилметила, пирродинилметила, пиперидинилметила или азетидинилметила; арил(C1-С6)алкила, где арил содержит 6 атомов в кольце, необязательно замещенного амино или CH2NH2, где (С1-С6)алкил необязательно замещен ОН; гетероарил(C1-С6)алкила, где гетероарил содержит 5-9 атомов в кольце, из которых 1-2 атома являются гетероатомами, выбранными из N и S, а остальные атомы представляют собой атомы С (индол, пиридин, тиофен, бензимидазол, пиразол), где гетероарил необязательно замещен этилом; гетероцикло(C1-С6)алкила, где гетероцикл содержит 6 атомов в кольце, из которых 1 атом является N, а остальные представляют собой атомы С (пиперидин), необязательно замещенный метилом; и -[C(R4)2]p-R5, или R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца, содержащего 5-10 атомов, из которых 1-2 атома являются гетероатомами, выбранными из N и О, а остальные представляют собой атомы С; R20 выбран из группы, состоящей из водорода; гетероциклила, содержащего 6 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, а остальные атомы представляют собой атомы С (пиперидинил); галоген(C1-С6)алкила; трифторметила; фтор(C1-С6)алкила; -О-[C(R4)2]p-R5; -OR16, где R16 представляет собой метил; и амино, представляющего собой -N(R50)(R51), где каждый из R50 и R51 независимо представляет собой водород, (C1-С6)алкил, необязательно замещенный метокси, или -(CH2)m-R61, где R61 представляет собой арил, содержащий 6 атомов в кольце, и m равен целому числу от 1 до 8. Также изобретение относится к конкретным соединениям, приведенным в формуле изобретения. Соединения по изобретению предназначены для лечения рака или воздействия на апоптоз, путем введения млекопитающему, которое в этом нуждается, терапевтически эффективного количества соединения. Технический результат – аминопиримидиновые соединения для лечения рака. 5 н. и 19 з.п. ф-лы, 30 табл., 251 пр., 53 ил.
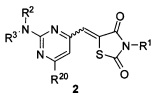
1. Соединение формулы 2:
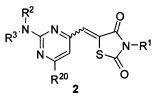 ,
,
или его фармацевтически приемлемая соль, где независимо для каждого случая:
R1 представляет собой водород,
каждый из R2 и R3 независимо выбран из группы, состоящей из водорода,
(C1-С6)алкила, необязательно замещенного ОН,
гетероарила, содержащего 6 атомов в кольце, из которых 1 атом является N, а остальные представляют собой атомы С (пиридин),
гетероциклила, содержащего 5 или 6 атомов в кольце, из которых 1 атом является N, а остальные представляют собой атомы С (пиперидин или пирролидин), необязательно замещенного группой, выбранной из метила, фенила, пиридинилметила, хинолинилметила, пирродинилметила, пиперидинилметила или азетидинилметила,
арил(C1-С6)алкила, где арил содержит 6 атомов в кольце, необязательно замещенного амино или CH2NH2, где (С1-С6)алкил необязательно замещен ОН,
гетероарил(C1-С6)алкила, где гетероарил содержит 5-9 атомов в кольце, из которых 1-2 атома являются гетероатомами, выбранными из N и S, а остальные атомы представляют собой атомы С (индол, пиридин, тиофен, бензимидазол, пиразол), где гетероарил необязательно замещен этилом,
гетероцикло(C1-С6)алкила, где гетероцикл содержит 6 атомов в кольце, из которых 1 атом является N, а остальные представляют собой атомы С (пиперидин), необязательно замещенный метилом,
где арил, гетероарил и гетероциклил обозначены выше, и
-[C(R4)2]p-R5,
или R2 и R3 соединены друг с другом с образованием
необязательно замещенного гетероциклического кольца, содержащего 5-10 атомов, из которых 1-2 атома являются гетероатомами, выбранными из N и О, а остальные представляют собой атомы С, а именно:
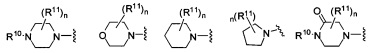
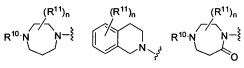 и
и
где независимо в каждом случае:
R10 выбран из группы, состоящей из:
водорода,
(C1-С6)алкила, необязательно замещенного ОН;
арила, содержащего 6 или 10 атомов в кольце, необязательно замещенного (C1-С6)алкилом, трифторметилом, гелогеном, фенилом или бензилокси;
гетероарила, содержащего 6 атомов в кольце, где 1-4 атома представляют собой гетероатомы, выбранные из N, а остальные атомы представляют собой атомы С (пиридин, пиримидин), необязательно замещенного трифторметилом;
арил(C1-С6)алкила, где арил содержит 6 атомов в кольце, где арил необязательно замещен галогеном, или где (С1-С6)алкил необязательно замещен фенилом;
гетероарил(C1-С6)алкила, где гетероарил содержит 9 атомов в кольце, где 2 атома представляют собой гетероатомы О, а остальные атомы представляют собой С (бензодиоксол);
гетероцикло(C1-С6)алкила, где гетероцикл содержит 6 атомов в кольце, где 1 атом представляет собой гетероатом N, а остальные атомы представляют собой атомы С (пиперидин), необязательно замещенного (C1-С6)алкилом;
-COR12,
-С(О)OR12,
-S(O)2R12 и
-[C(R4)2]p-R5;
R12 выбран из группы состоящей из
(C1-С6)алкила,
арила, содержащего 6 атомов С в кольце, необязательно замещенного галогеном;
гетероарила, содержащего 5 атомов в кольце, где 1 атом представляет собой гетероатом, выбранный из О, а остальные представляют собой атомы С, и
гетероциклила, содержащего 6 атомов в кольце, где 1 атом представляет собой гетероатом, выбранный из N, а остальные представляют собой атомы С (пиперидинил), необязательно замещенный C1-С6алкилом;
R11 выбран из группы, состоящей из
(C1-С6)алкила, необязательно замещенного ОН, амино или СООН;
гетероарила, содержащего 5-10 атомов в кольце, где от 1 до 4 атомов представляют собой гетероатомы, выбранные из N и О, а остальные атомы представляют собой атомы С (триазин, оксадиазол, индол, бензимидазол, пиримидин, тетразол, 6,7,8,9-тетрагидро-5H-[1,2,3]триазоло[1,3-а]азепин, [1,2,4]триазоло[4,3-а]пиримидин), необязательно замещенного пиридином, амино, (C1-С6)алкилом или ОН;
гетероциклила, содержащего 5 или 6 атомов в кольце, где 1 или 2 атома представляют собой гетероатомы, выбранные из N и О, а остальные представляют собой атомы С (пиперидин, пирролидин, морфолин), необязательно замещенного (C1-С6)алкилом;
галогена;
циано;
-N(R17)(R18),
-N(R17)COR18,
-N(R17)С(О)OR18,
-CON(R17)(R18),
-COR17,
-COOR17,
-OR17 и
-[C(R4)2]p-R5;
R17 и R18 выбраны из группы, состоящей из
водорода,
(C1-С6)алкила, необязательно замещенного ОН,
гетероарила, содержащего 5 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из О, а остальные атомы представляют собой атомы углерода;
гетероциклила, содержащего 6 атомов в кольце, из которых 2 атома являются гетероатомами, выбранными из N, а остальные атомы представляют собой атомы С (пиперазинил), необязательно замещенного метилом;
гетероарил (C1-С6) алкила, где гетероарил содержит 10 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, (хинолин), где гетероарил необязательно замещен галогеном, метокси или метилом;
n равен 0, 1, 2 или 3;
p равен 1, 2 или 3;
R4 представляет собой водород;
R5 выбран из группы, состоящей из
гетероарила, содержащего 5-9 атомов в кольце, из которых 2 атома являются гетероатомами, выбранными из N, а остальные представляют собой атомы С (пиразолил или бензимидазолил), необязательно замещенного этилом;
гетероциклила, содержащего 5-6 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, а остальные атомы представляют собой атомы С (пиперидин, пирролидин),
-N(R8)(R9),
-N(R8)С(О)OR9,
-C(O)R8,
-N(R8)С(О)R9,
-N(R8)SO2R9 и
-OR8;
R8 выбран из группы, состоящей из
водорода,
(C1-С6)алкила,
арил(C1-С6)алкила, где арил содержит 6 атомов в кольце и необязательно замещен галогеном,
арила, содержащего 6 атомов в кольце, необязательно замещенного морфолином,
гетероарила, содержащего 6-10 атомов в кольце, где 1-4 атома представляют собой гетероатомы N, а остальные атомы представляют собой атомы С (пиридин, пиразин, хинолин, бензимидазол, имидазо[1,2-b]пиридазин, 7-Н-пурин),
гетероарил(C1-С6) алкила, где гетероарил содержит 6-10 атомов в кольце, из которых 1-2 атома являются гетероатомами, выбранными из N, а остальные атомы представляют собой атомы С (пиридин, пиримидин, хинолин, нафтиридин, бензо[d]имидазол), необязательно замещенного метилом, галогеном, метокси, тиофенилом, трифторметилом, пиперидинилом, фторфенилом или метилендиоксифенилом,
гетероцикло(C1-С6) алкила, где гетероцикл содержит 4-6 атомов, из которых 1-4 атома являются гетероатомами, выбранными из N, а остальные атомы представляют собой атомы С (пирролидин, пиперидин, азетидин); и
гетероциклила, содержащего 6 атомов в кольце, где 2 атома представляют собой гетероатомы, выбранные из N и О, а остальные атомы представляют собой атомы С (морфолино);
R9 выбран из группы, состоящей из
водорода,
(C1-С6)алкила,
трифторметила,
арила, содержащего 10 атомов С в кольце (нафталинил), необязательно замещенного метокси или галогеном,
гетероарила, содержащего 6-9 атомов в кольце, где 2 атома представляют собой гетероатомы N, а остальные атомы представляют собой атомы С (пиразин, индол), и
гетероарил(C1-С6) алкила, где гетероарил содержит 6 атомов в кольце, где 1 атом представляет собой гетероатом N, а остальные атомы представляют собой атомы С (пиридин),
R20 выбран из группы, состоящей из
водорода,
гетероциклила, содержащего 6 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, а остальные атомы представляют собой атомы С (пиперидинил),
галоген(C1-С6)алкила,
трифторметила,
фтор(C1-С6)алкила,
-О-[C(R4)2]p-R5,
-OR16, где R16 представляет собой метил, и
амино, представляющего собой -N(R50)(R51), где каждый из R50 и R51 независимо представляет собой
водород,
(C1-С6)алкил, необязательно замещенный метокси, или
-(CH2)m-R61,
где R61 представляет собой
арил, содержащий 6 атомов в кольце,
и m равен целому числу от 1 до 8.
2. Соединение по п. 1, где R20 выбран из группы, состоящей из
гетероциклила, содержащего 6 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, а остальные атомы представляют собой атомы С (пиперидинил), и
OR16, где R16 представляет собой метил.
3. Соединение по п. 1, где R20 представляет собой водород.
4. Соединение по п. 1, отличающееся тем, что R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца, выбранного из группы, состоящей из:
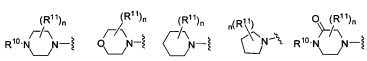
 и
и
где R10 и R11 такие, как определено в п. 1.
5. Соединение по п. 4, отличающееся тем, что R10 выбран из группы, состоящей из
водорода,
(C1-С6)алкила, необязательно замещенного ОН,
арила, содержащего 6 или 10 атомов в кольце, необязательно замещенного (C1-С6)алкилом, трифторметилом, галогеном, фенилом или бензилокси;
гетероарила, содержащего 6 атомов в кольце, из которых 1-4 атома являются гетероатомами, выбранными из N, а остальные атомы представляют собой атомы С (пиридин, пиримидин), необязательно замещенного трифторметилом,
-[C(R4)2]p-R5,
-COR12,
-С(О)OR12 и
-SO2(R12).
6. Соединение по п. 4, где n равен 0.
7. Соединение по п. 4, где n равен 1.
8. Соединение по п. 7, где R11 выбран из группы, состоящей из
(C1-С6)алкила,
гетероциклила, содержащего 5-6 атомов в кольце, из которых 1-2 атома являются гетероатомами, выбранными из N и О, а остальные атомы представляют собой атомы С (пиперидин, пирролидин, морфолин), необязательно замещенного (C1-С6)алкилом,
циано,
гидрокси(C1-С6)алкила,
-N(R17)(R18),
-CON(R17)(R18) и
-[C(R4)2]p-R5.
9. Соединение по п. 4, где R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца формулы:
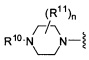
10. Соединение по п. 9, где n равен 0 или 1.
11. Соединение по п. 1, где R2 и R3 соединены друг с другом с образованием необязательно замещенного гетероциклического кольца формулы:
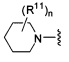 или
или 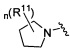 .
.
12. Соединение по п. 1 или 2, где R2 и R3 независимо выбраны из группы, состоящей из
водорода,
(C1-С6)алкила, необязательно замещенного ОН,
гетероарила, содержащего 6 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, а остальные атомы представляют собой атомы С (пиридин),
гетероциклила, содержащего 5-6 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, а остальные атомы представляют собой атомы С (пиперидин или пирролидин), необязательно замещенный метилом, фенилом, пиридинилметилом, хинолинметилом, пирролидинилметилом, пиперидинилметилом или азетидинилметилом, и
-[C(R4)2]p-R5.
13. Соединение по п. 12, где R3 представляет собой -[C(R4)2]p-R5.
14. Соединение по п. 13, где R2 представляет собой (C1-С6)алкил, необязательно замещенный ОН.
15. Соединение по п. 13, где R5 представляет собой
гетероарил, содержащий 5-9 атомов в кольце, из которых 2 атома являются гетероатомами, выбранными из N, а остальные атомы представляют собой атомы С (пиразолил или бензимидазолил),
гетероциклил, содержащий 5-6 атомов в кольце, из которых 1 атом является гетероатомом, выбранным из N, а остальные атомы представляют собой атомы С (пиперидин, пирролидин).
16. Соединение по п. 13, где R5 выбран из группы, состоящей из -N(R8)(R9), -N(R8)COR9, -N(R8)С(О)OR9, -N(R8)SO2(R9), -OR8 и -COR8.
17. Соединение по п. 16, где R5 представляет собой -N(R8)(R9).
18. Соединение, или его фармацевтически приемлемая соль, выбранное из группы, состоящей из:
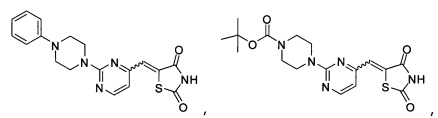
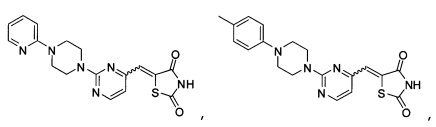
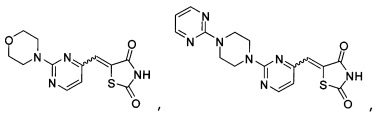

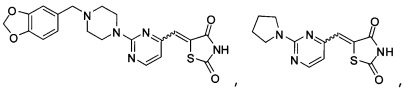
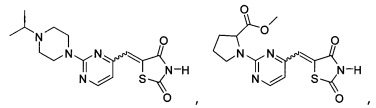
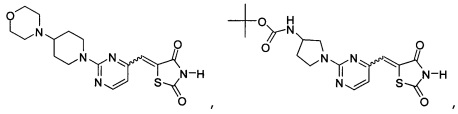
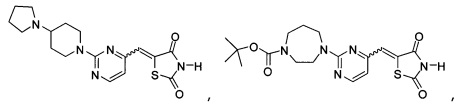
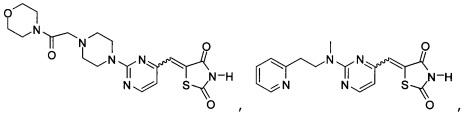
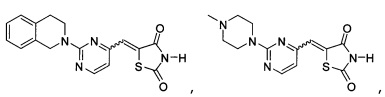
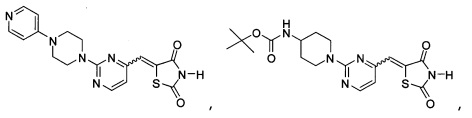


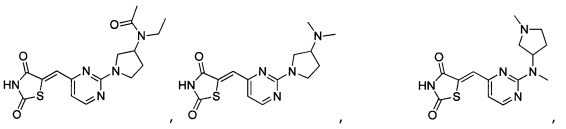


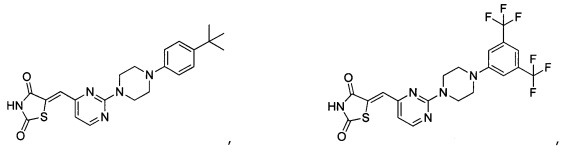
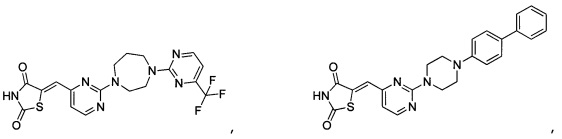
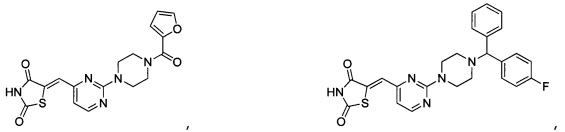

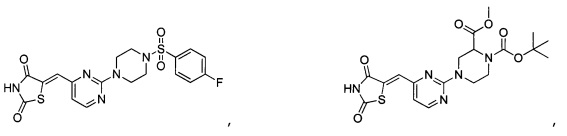



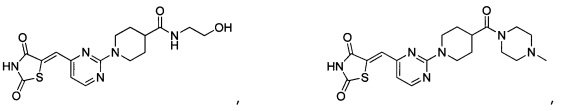



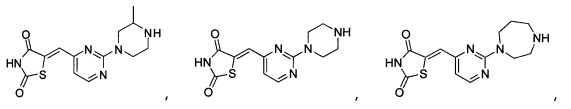
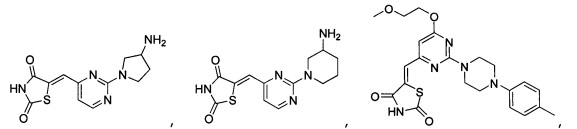

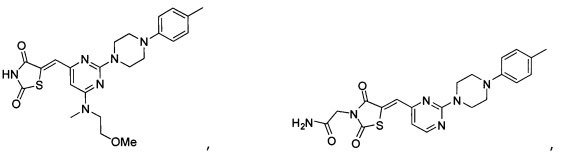
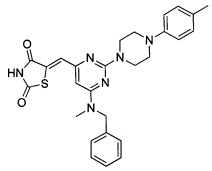 и
и 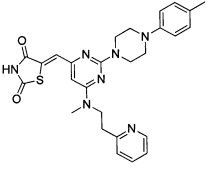
19. Соединение, или его фармацевтически приемлемая соль, выбранное из группы, состоящей из:
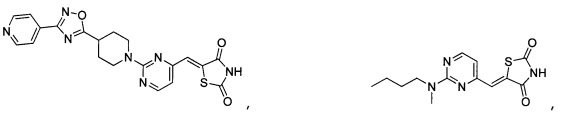








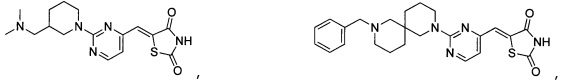





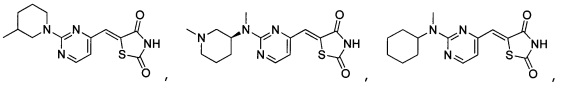


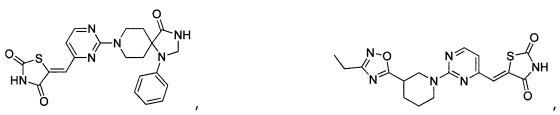
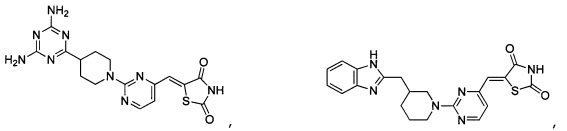












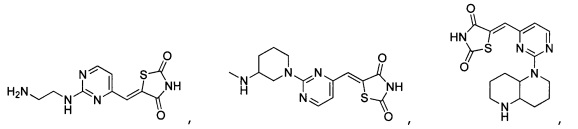



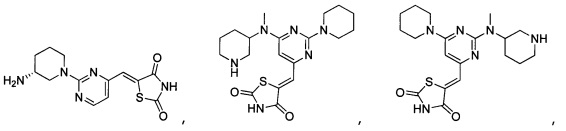


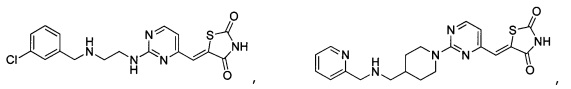
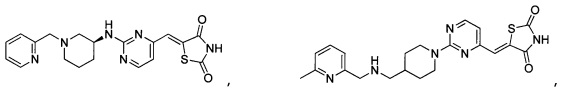

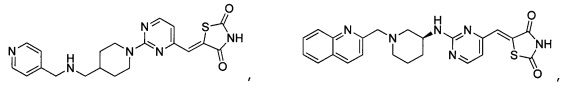

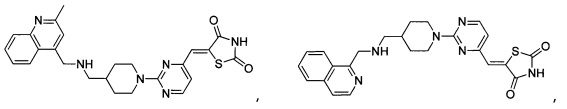
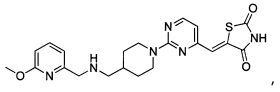
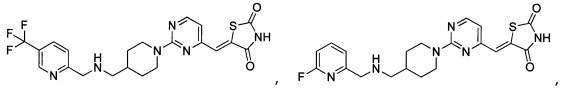

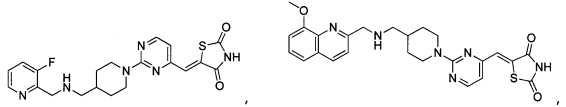
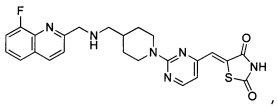
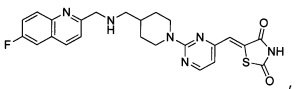
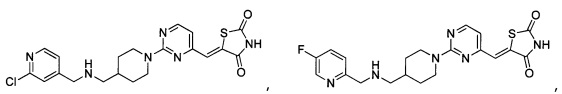
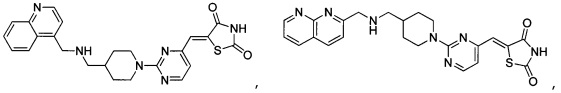
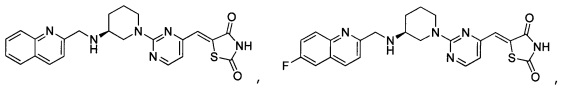
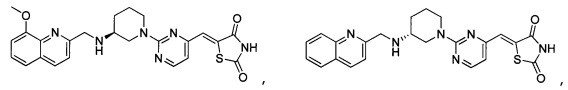
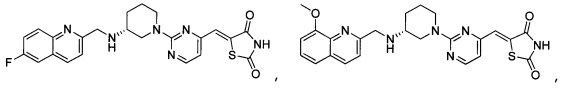

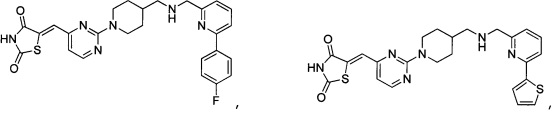
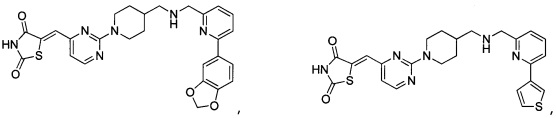
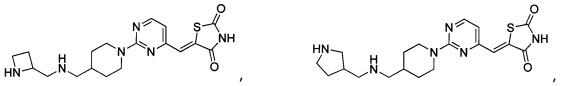
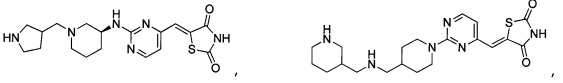

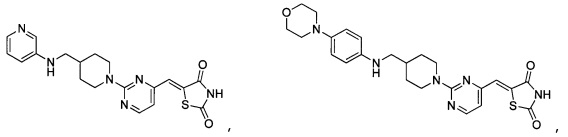
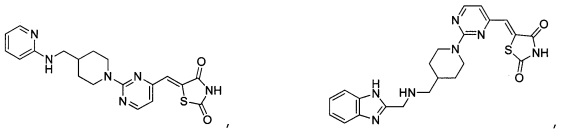
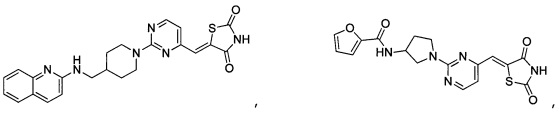
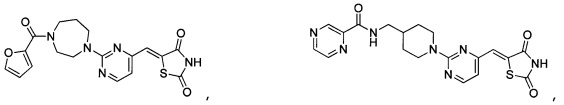




 и
и
 .
.
20. Способ лечения рака, включающий введение млекопитающему, которое в этом нуждается, терапевтически эффективного количества соединения по любому из пп. 1-19.
21. Способ по п. 20, где рак представляет собой рак кроветворной системы, иммунной системы, эндокринной системы, дыхательной системы, желудочно-кишечного тракта, скелетно-мышечной системы, репродуктивной системы, центральной нервной системы или мочевой системы.
22. Способ по п. 21, где рак локализован в миелоидной ткани, лимфоидной ткани, ткани поджелудочной железы, ткани щитовидной железы, легочной ткани, ткани толстой кишки, ткани прямой кишки, ткани анального канала, ткани печени, в коже, в костях, ткани яичников, ткани матки, ткани шейки матки, молочной железы, предстательной железы, ткани яичек, ткани мозга, ствола мозга, в ткани мозговых оболочек, почке или мочевом пузыре млекопитающего.
23. Способ по п. 22, где рак представляет собой рак молочной железы, рак толстой кишки, множественную миелому, рак предстательной железы, ходжкинскую лимфому, неходжкинскую лимфому, лейкемию, гематологические злокачественные опухоли, почечно-клеточную карциному, рак почек, злокачественную меланому, рак поджелудочной железы, рак легких, рак толстой и прямой кишки, рак мозга, рак головы и шеи, рак мочевого пузыря, рак щитовидной железы, рак яичника, рак шейки матки или миелодиспластический синдром.
24. Способ воздействия на апоптоз, включающий введение млекопитающему, которое в этом нуждается, терапевтически эффективного количества соединения по любому из пп. 1-19.
| Колосоуборка | 1923 |
|
SU2009A1 |
| ПРОИЗВОДНЫЕ ТИАЗОЛИДИНДИОНА, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2129553C1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 5955481 А, 21.09.1999. | |||
Авторы
Даты
2017-11-24—Публикация
2010-12-23—Подача