Ссылка на родственную заявку
Согласно настоящей заявке, поданной в соответствии с 37 CFR §1.53(b), испрашивается приоритет в соответствии с 35 USC §119(е) по предварительной заявке на выдачу патента США №61/485249, поданной 12 мая 2011 года, которая включена в виде ссылки в полном объеме.
Область техники
Настоящее изобретение относится к способам выявления и определения количества представляющего интерес человеческого или гуманизированного антитела из образца животного, такого как ткань, плазма или сыворотка крови. Способы предусматривают аффинное обогащение и протеазное расщепление образца с получением одного или нескольких пептидов, которые являются консервативными и характерными для каркасного участка человеческого или гуманизированного антитела, выявляемого или количественно оцениваемого при помощи масс-спектрометрии.
Уровень техники
Анализ полученных в результате исследований in vivo терапевтических белков образцов плазмы/сыворотки крови представляет интерес в биофармацевтической промышленности. На протяжении более 25 лет применялся традиционный ELISA-подход, и он характеризуется некоторыми недостатками. Для ELISA необходимы высококачественные специализированные реактивы, на создание которых может уходить несколько месяцев, а оптимизация анализа может занимать еще несколько дополнительных месяцев. Таким образом, ELISA характеризуется длительным временем разработки анализа, что является недостатком как на ранней стадии исследования, так и на стадии разработки белковых лекарственных средств (Murray et al (2001) J. Imm. Methods 255:41-56; Kirchner et al (2004) Clin. Pharmacokinetics 43(2):83-95). В некоторых случаях подходящие реактивы для ELISA и условия проведения анализа могут быть невозможны по причине сильно специфических требований для связывания для каждого белкового терапевтического средства. Другой недостаток ELISA заключается в том, что реактивы могут неспецифично связываться с белками плазмы/сыворотки крови, причем взаимодействие с матрицей является широко распространенным явлением. Количественное определение белка с помощью масс-спектрометрии, с другой стороны, является высокоспецифичным и, следовательно, взаимодействие с матрицей происходит редко по сравнению с ELISA. Разработка анализов ELISA может быть трудоемкой и нуждается в сложных, специфических реактивах. ELISA также чувствителен к случаям взаимодействия с матрицей и перекрестной реактивности антител. При помощи ELISA опосредованно измеряют концентрацию аналита с помощью свойств связывания. Это множество факторов делает ELISA способы количественной оценки белка затруднительными для разработки и переноса в другие лаборатории с устойчивыми эксплуатационными показателями. Исходя из этих отличий, масс-спектрометрия является ортогональным способом по отношению к ELISA. Масс-спектрометрические способы количественной оценки белка, и LC-MS/MS в частности, не нуждаются в специфических реактивах и обычно дают более быстрые результаты при разработке анализа. Кроме того, масс-спектрометрия менее подвержена влиянию взаимодействий с матрицей и предусматривает типичные условия проведения анализа, которые являются высокоспецифичными и могут быть уплотнены и автоматизированы. Благодаря высокой специфичности масс-спектрометрии измеряют концентрацию аналита по характерным физико-химическим свойствам аналита, т.е. массовому и фрагментационному паттерну. Устойчивый формат делает возможным легкий перенос из лаборатории в лабораторию, что является значительным преимуществом для одобренных терапевтических средств на основе антител. Общая методика количественной оценки белков при помощи масс-спектрометрии заключается в расщеплении при помощи трипсина интактного белка. Полученные пептиды анализируют с помощью масс-спектрометрии путем введения соответствующих меченных стабильным изотопом внутренних стандартов в фиксированной концентрации.
Последние достижения в области пептидного и белкового анализа с помощью масс-спектрометрии (MS) являются результатом разработок передовых методик ионизации и введения в газовой фазе, таких как электрораспылительная ионизация (ESI) и лазерная десорбция-ионизация в присутствии матрицы (MALDI, US 2003/0027216), а также усовершенствований чувствительности, разрешения, погрешности измерения приборов, биоинформатики и алгоритмов деконволюции данных в программном обеспечении ("Electrospray lonization Mass Spectrometry: Fundamentals, Instrumentation, and Applications", Cole, R.B., Ed. (1997) Wiley, New York; "Modem Protein Chemistry: Practical Aspects", Howard, G.C. and Brown, W.E., Eds. (2002) CRC Press, Boca Raton, FL, p.71-102; Martin et al (1997) Cancer Chemother. Pharmacol. 40:189-201; WO 03/046571; WO 03/046572).
Жидкостная хроматография в тандеме с масс-спектрометрией является мощным инструментом для анализа и количественной оценки белка в очень сложных матрицах, таких как образцы плазмы/сыворотки крови. Поскольку пептиды, полученные в результате расщепления представляющего интерес белка и других белкой плазмы/сыворотки крови, могут обладать одинаковой или сходной номинальной массой, то второй размер MS-фрагментации зачастую дает уникальный фрагмент представляющего интерес пептида. Сочетание конкретного исходного пептида и иона уникального фрагмента используется для избирательного мониторинга подвергаемой количественной оценке молекулы. Такой подход называется "мониторинг множественных реакций" (MRM), второе название которого "контроль селективных реакций" (SRM), который также является широко используемым способом количественной оценки белка.
Электрораспылительная ионизация (ESI) предусматривает ионизацию при атмосферном давлении (API) жидкого образца. В ходе процесса электрораспыления создаются высокозаряженные капли, которые при испарении создают ионы, характерные для содержащихся в растворе соединений. Для забора образца этих ионов в газовой фазе на анализ масс может быть использовано отверстие для забора образца ионов в масс-спектрометре. Измеряемый с помощью детектора масс-спектрометра ответ на аналит зависит от концентрации аналита в жидкости и не зависит от скорости потока жидкости.
Сущность изобретения
Настоящее изобретение относится к способу выявления человеческих или гуманизированных антител, включающему следующие стадии:
(a) обработка биологического образца расщепляющим ферментом с образованием образца расщепленного антитела, причем биологическим образцом является сыворотка, плазма крови, ткань или клетки от животного, которое было обработано человеческим или гуманизированным антителом; и
(b) анализ образца расщепленного антитела с помощью масс-спектрометрии с выявлением одного или нескольких человеческих каркасных пептидов.
В соответствии с иллюстративным вариантом осуществления человеческие каркасные пептиды содержат одну или несколько последовательностей, выбранных из SEQ ID NO 1-8.
В соответствии с иллюстративным вариантом осуществления расщепляющим ферментом является трипсин.
В соответствии с иллюстративным вариантом осуществления осуществляют контакт биологического образца со средой для аффинного захвата или хроматографическим адсорбентом. Элюируют обогащенный биологический образец, затем обрабатывают расщепляющим ферментом.
В соответствии с иллюстративным вариантом осуществления измеряют концентрацию образца расщепленного антитела.
В соответствии с одним аспектом настоящее изобретение относится к способам протеазного расщепления образца или иммунноаффинного захвата с последующим протеазным расщеплением с получением одного или нескольких пептидов, характерных исключительно для каркасного участка человеческого или гуманизированного антитела, т.е. не присутствующих в животных биологических образцах, выявляемых и количественно оцениваемых с помощью масс-спектрометрии (LC-MS/MS).
В соответствии с вариантом осуществления настоящее изобретение относится к человеческим или гуманизированным антителам, конъюгированным с лекарственными частями, причем конъюгаты антитело-лекарственное средство измеряются с помощью способов согласно настоящему изобретению.
Краткое описание чертежей
На фигуре 1 показано выравнивание аминокислотных последовательностей тяжелой цепи человеческого антитела 2Н7, окрелизумаба, Hu2H7 (SEQ ID NO:11), начиная от остатка 101, и пяти антител яванского макака к CD20: CynoHC 1a D3 1 (SEQ ID NO:12), CynoHC 1b E5 1 (SEQ ID NO:13), Cyno HC 2a (SEQ ID NO:14), CynoHC 2b E6 1 (SEQ ID NO:15), CynoHC 3 (SEQ ID NO:16). Подчеркнутыми показаны каркасные сигнатурные пептиды (FSP 1-8), которые характерны исключительно человеческому Mab 2H7 (hu 2H7) и отсутствуют в тяжелой цепи IgG яванского макака, причем каждый имеет по меньшей мере одно отличие по аминокислоте в последовательностях.
На фигуре 2 показана тяжелая цепь (SEQ ID NO:17) и легкая цепь (SEQ ID NO:18) трастузумаба (Herceptin®, Genentech Inc.; rhuMAbHER2, Anti p185HER2), полученного рекомбинатным способом гуманизированного моноклонального антитела, регистрационный номер CAS 180288-69-1.
На фигуре 3 показана тяжелая цепь (SEQ ID NO:11) и легкая цепь (SEQ ID NO:19) окрелизумаба, rhuMAb 2H7, PR070769, гуманизированного антитела к CD20, регистрационный номер CAS 637334-45-3.
На фигуре 4 показана тяжелая цепь (SEQ ID NO:20) и легкая цепь (SEQ ID NO:21) пертузумаба, rhuMAb 2C4, регистрационный номер CAS 380610-27-5. У FSP2, FSP3, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:20).
На фигуре 5 показана тяжелая цепь (SEQ ID NO:22) и легкая цепь (SEQ ID NO:23) антитела к PDL1, член расширенного семейства CD28/CTLA-4 Т-клеточных регуляторов. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:22).
На фигуре 6 показана тяжелая цепь (SEQ ID NO:24) и легкая цепь (SEQ ID NO:25) антитела к нейропилину-1, антитела к NRP1, MNRP1685A. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:24).
На фигуре 7 показана тяжелая цепь (SEQ ID NO:26) и легкая цепь (SEQ ID NO:27) антитела к MUC16, MMUC3333A/DMUC4064A. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:26).
На фигуре 8 показана (SEQ ID NO:28) и легкая цепь (SEQ ID NO:29) ритуксимаба, С2 В8, MabThera, (Rituxan®, Genentech Inc., Biogen/Idec), регистрационный номер CAS 174722-31-7. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:28).
На фигуре 9 показаны общие стадии LC-MS/MS способа количественной оценки терапевтического антитела в плазме/сыворотке крови животного с помощью одного или нескольких каркасных сигнатурных пептидов (FSP).
На фигуре 10 показан мониторинг множественных реакций расщепленного трипсином трастузумаба. Каркасные сигнатурные пептиды FSP3 (12,5 мин), FSP8 (15 мин) и FSP5 (17 мин) разделены и количественно оценены относительно исходного уровня.
На фигуре 11 показан MS/MS спектр FSP5 от аффинно-захваченного, а затем расщепленного конъюгата антитела к MUC16 и лекарственного средства, который был внесен в плазму крови.
На фигуре 12 показана калибровочная кривая FSP8, внесенного с различными концентрациями от 1 до 1000 мкг/мл в обработанную литиевой солью гепарина плазму крови яванского макака, которая была получена при помощи подхода расщепления/SPE цельной плазмы крови.
На фигуре 13 показаны LC-MS/MS хроматограммы, демонстрирующие выявление FSP8, внесенного в обработанную литиевой солью гепарина плазму крови яванского макака, при LLOQ=1 мкг/мл после подготовки образца посредством расщепления/SPE цельной плазмы крови.
На фигуре 14 показана блок-схема стадий LC-MS/MS способа с аффинным захватом белкового терапевтического средства и ферментативным расщеплением с образованием каркасных сигнатурных пептидов (FSP) mAb в плазме/сыворотке крови животного.
На фигуре 15 показан рисунок захвата mAb из плазмы/сыворотки животного на покрытых стрептавидином магнитных частицах, связанных с биотинилированным зондом захвата, или покрытой белками A, G магнитной частице с последующим выделением путем разделения в магнитном поле, расщеплением захваченного антитела и анализом с помощью LC-MS/MS.
На фигуре 16 изображены варианты осуществления покрытой белками A, G магнитной частице (сверху) для общего захвата антитела и покрытых стрептавидином магнитных частиц, связанных с биотинилированным зондом захвата (снизу), для специфического захвата антитела.
На фигуре 17а показано LC-MS/MS разделение и выявление FSP8 при концентрации 1 мкг/мл антитела трастузумаб в плазме крови крысы.
На фигуре 17b показано LC-MS/MS разделение и выявление внутреннего стандарта, представляющего собой меченный стабильным изотопом (SIL) FSP8.
На фигуре 18 показана линейность выявления в виде графика соотношения FSP8 к внутреннему стандарту, представляющему собой меченный стабильным изотопом FSP8, относительно концентрации трастузумаба (HERCEPTIN®) от 1 до 250 мкг/мл в плазме крови крысы.
На фигуре 19а показан рисунок моноклонального антитела (mAb-терапевтического средства), захваченного путем связывания с иммобилизированным внеклеточным доменом (ECD) или поликлональным антителом к IgG человека и выявляемого при помощи меченного пероксидазой хрена (HRP) поликлонального антитела к IgG человека в анализе ELISA при помощи электрохемилюминисцентного или колориметрического выявления.
На фигуре 19b показаны элементы LC-MS/MS анализа, начинающегося с захвата частицы с белком А mAb-терапевтического средства из биологического образца, расщепления трипсином захваченного mAb-терапевтического средства с образованием одного или нескольких каркасных сигнатурных пептидов (FSP), например FSP8, и LC/MS/MS выявления мониторинга множественных реакций (MRM) для выявления перехода от 938,0 (М, 2+) до 836,7 (у15, 2+).
На фигуре 20 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови крыс, которым были введены дозы трастазумаба, mAb к HER2.
На фигуре 21 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови крыс, которым были введены дозы 3А5, mAb к MUC 16.
На фигуре 22 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови крыс, которым были введены дозы mAb к мезотелину (Msln).
На фигуре 23 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе средних фармакокинетических параметров (ФК) образцов плазмы/сыворотки крови яванского макака, которому были введены дозы 3А5 (MMUC1206A), mAb к MUC 16, путем измерения антитела в плазме крови на протяжении 28 дней.
На фигуре 24 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе средних фармакокинетических параметров (ФК) образцов плазмы/сыворотки крови яванского макака, которому были введены дозы mAb к мезотелину (Msln), путем измерения антитела в плазме крови на протяжении 40 дней.
На фигуре 25 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови мышей (А, В, С), которым были введены дозы конъюгата антитела-лекарственного средства (ADC), anti-LY6E-MC-vc-PAB-MMAE, в исследованиях эффективности на мышах.
Подробное описание изобретения
Если не указано иное, то используемые в настоящем документе технические и научные термины имеют то же значение, которое обычно понимается рядовым специалистом в данной области техники, к которой относится настоящее изобретение, и согласуются с Singleton et al, (1994) "Dictionary of Microbiology and Molecular Biology", 2nd Ed., J. Wiley & Sons, New York, NY; и Janeway, et al (2001) "Immunobiology", 5th Ed., Garland Publishing, New York. При использовании в настоящем документе торговых названий также подразумевается состав продукта с торговым названием, генерик и активный фармацевтический ингредиент(ы) продукта с торговым названием.
ОПРЕДЕЛЕНИЯ
Термин "биологический образец" относится к любому полученному или выделенному от животного компоненту и включает кровь, плазму, сыворотку крови, клетки, мочу, спинномозговую жидкость (CSF), молоко, бронхиальный лаваж, костный мозг, амниотическую жидкость, слюну, желчь, образец стекловидного тела, слезы или ткань.
Термин "расщепляющий фермент" относится к ферменту, способному расщеплять или гидролизировать пептиды или белки на ферменты либо специфическим, либо общим, случайным образом. Расщепляющий фермент может сформировать из антитела образец расщепленного антитела, причем антитело представляет собой компонент биологического образца. Расщепляющие ферменты включают протеазы, такие как трипсин, папаин, эндопротеиназа LysC, эндопротеиназа ArgC, V8 золотистого стафилококка, химотрипсин, Asp-N, Asn-C, пепсин и эндопротеиназа GluC.
Термин "антитело" в настоящем документе используется в наиболее широком смысле и охватывает различные структуры по типу антител, в том числе без ограничения моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител при условии, что они проявляют необходимую антиген-связывающую активность.
"Фрагмент антитела" относится к отличной от интактного антитела молекуле, которая содержит часть интактного антитела, связывающегося с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают без ограничения Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и образованные из фрагментов антител мультиспецифические антитела.
В соответствии с определенными вариантами осуществления приведенное в настоящем документе антитело представляет собой фрагмент антитела. Фрагменты антител включают без ограничения Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv фрагменты и другие описываемые ниже фрагменты. Обзор некоторых фрагментов антител см. в работе Hudson et al. Nat. Med. 9:129-134 (2003). Обзор scFv фрагментов см., например, в работе Pluckthim, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp.269-315 (1994); патентных документах WO 93/16185; US 5571894; US 5587458. Рассмотрение Fab и F(ab')2 фрагментов, содержащих остатки связывающегося с рецептором спасения эпитопа и характеризующихся повышенным периодом полужизни in vivo, см. в патентном документе US 5869046.
Диатела представляют собой фрагменты антител с двумя антиген-связывающими сайтами, которые могут быть бивалентными или биспецифичными (ЕР 404097; WO 1993/01161; Hudson et al. (2003) Nat. Med. 9:129-134; Hollinger et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448). Триотела и тетратела также описаны в Hudson et al. (2003) Nat. Med. 9:129-134.
Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В соответствии с определенными вариантами осуществления однодоменное антитело представляет собой однодоменное человеческое антитело (US 6248516).
Фрагменты антител можно получить с помощью различных методик, в том числе без ограничения протеолитическое расщепление интактного антитела, а также продуцирование рекомбинантными клетками-хозяевами (например, Е. coli или фаг), как описывается в настоящем документе.
Термин "химерное" антитело относится к антителу, у которого часть тяжелой и/или легкой цепи происходит от конкретного источника или вида, в то время как другая тяжелая и/или легкая цепь происходит от другого источника или вида.
Термин "Fc участок" в настоящем документе используется для обозначения С-концевого участка иммуноглобулиновой тяжелой цепи, который содержит по меньшей мере часть константного участка. Термин включает Fc участки с нативной последовательностью и вариантные Fc участки. В соответствии с одним вариантом осуществления Fc участок тяжелой цепи IgG человека длится от Cys226, или от Pro230, до карбоксильного конца тяжелой цепи. Однако, С-концевой лизин (Lys447) Fc участка может присутствовать или может не присутствовать. Если в настоящем документе не указано иное, нумерация аминокислотных остатков в Fc участке или константном участке соответствует системе нумерации EU, также называемой EU-нумерация, которая описана в работе Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
"Каркас" или "FR" относится к остаткам константного домена, отличным от остатков гипервариабельного участка (HVR). FR константного домена обычно состоит из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно представлены в следующей последовательности в VH (или VL): FR1-Н1 (L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины "антитело полной длины", "интактное антитело" и "целое антитело" используются в настоящем документе взаимозаменяемо для обозначения антитела со структурой, по сути схожей со структурой естественного антитела, или с тяжелыми цепями, которые содержат указанный в настоящем документе Fc участок.
"Человеческое антитело" представляет собой антитело, обладающее аминокислотной последовательностью, которая соответствует последовательности антитела, продуцируемого человеком или клеткой человека или полученного из любого источника, за исключением человека, в котором используются репертуары человеческих антител или другие кодирующие человеческие антитела последовательности. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее отличные от человеческих антиген-связывающие остатки.
"Человеческий консенсусный каркас" является каркасным участком антитела, который представляет собой наиболее часто встречающиеся аминокислотные остатки при выборе каркасных VL или VH последовательностей иммуноглобулина человека. Обычно, выбор VL или VH последовательностей иммуноглобулина человека происходит из подгруппы последовательностей вариабельного домена. Обычно, подгруппа последовательностей представляет собой подгруппу согласно работе Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols.1-3. В соответствии с одним вариантом осуществления для VL подгруппой является подгруппа каппа I согласно приведенной выше работе Kabat et al. В соответствии с одним вариантом осуществления для VH подгруппой является подгруппа III согласно приведенной выше работе Kabat et al.
Термин "гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В соответствии с определенными вариантами осуществления гуманизированное антитело будет содержать практически все из по меньшей мере одного, и как правило двух, вариабельных доменов, в которых все или по сути все HVR (например, CDR) соответствуют таковым отличного от человеческого антитела и все или практически все FR соответствуют таковым человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константного участка антитела, происходящего от человеческого антитела. Термин "гуманизированная форма антитела, например отличного от человеческого антитела, относится к антителу, которое было подвергнуто гуманизации.
Термин "химерное" антитело включает отличный от человеческого вариабельный участок (например, вариабельный участок, полученный от мыши, крысы, хомяка, кролика или низшего примата, такого как мартышка) и человеческий константный участок (US 4816567; Morrison et al. (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). В следующем примере химерное антитело представляет собой антитело с "переключенным классом", у которого класс или подкласс был изменен по сравнению с таковым исходного антитела. Химерные антитела включают их антиген-связывающие фрагменты.
В соответствии с определенными вариантами осуществления химерным антителом является гуманизированное антитело. Как правило, отличное от человеческого антитело гуманизируют для снижения иммуногенности для людей, в то же время сохраняя специфичность и аффинность исходного отличного от человеческого антитела. В целом, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например CDR, (или их части) получены из последовательностей отличного от человеческого антитела. Гуманизированное антитело необязательно будет также содержать по меньшей мере часть человеческого константного участка. В соответствии с некоторыми вариантами осуществления некоторые FR остатки в гуманизированном антителе заменены соответствующими остатками из отличного от человеческого антитела (например, антитела, из которого получены остатки HVR), например, для восстановления или повышения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения рассматриваются, например, в работе Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в работе Riechmann et al., Nature 332:323-329 (1988); Queen et al, Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); US 5821337; US 7527791; US 6982321; US 7087409; Kashmiri et al. (2005) Methods 36:25-34 (описывающая прививку SDR (a-CDR)); Padlan, (1991) Mol. Immunol. 28:489-498 (описывающая "изменение поверхности"); Dall'Acqua et al. (2005) Methods 36:43-60 (описывающая "FR шаффлинг"); и Osboum et al, (2005) Methods 36:61-68; Klimka et al. (2000) Br. J. Cancer 83:252-260 (описывающая подход "управляемого отбора" для FR шаффлинга).
Человеческие каркасные участки, которые могут быть использованы для гуманизации, включают без ограничения: каркасные участки, отобранные с помощью способа "наибольшего соответствия" (см., например, Sims et al. J. Immunol. 151:2296 (1993)); каркасные участки, полученные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных участков легкой или тяжелой цепи (Carter et al. (1992) Proc. Natl. Acad. Sci. USA, 89:4285; Presta et al. (1993) J. Immunol., 151:2623); человеческие зрелые (с соматической мутацией) каркасные участки или человеческие каркасные участки эмбрионального типа (Almagro and Fransson, (2008) Front. Biosci. 13:1619-1633); и каркасные участки, полученные в результате скрининга FR библиотек (см, например, Васа et al. (1997) J. Biol. Chem. 272:10678-10684; и Rosok et al. (1996) J. Biol. Chem. 271:22611-22618).
Человеческие антитела могут быть получены с помощью различных известных в данной области техники методик. Человеческие антитела, в целом, описаны в работе van Dijk and van de Winkel, (2001) Curr. Opin. Pharmacol. 5: 368-74; Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Человеческие антитела могут быть получены путем введения иммуногена трансгенному животному, которые было модифицировано с тем, чтобы продуцировать интактные человеческие антитела или интактные антитела с человеческими вариабельными участками в ответ на стимуляцию антигеном. Такие животные, как правило, содержат весь или часть человеческого иммуноглобулинового локуса, который заменяет эндогенный иммуноглобулиновый локус или который присутствует внехромосомно или рандомно интегрируется в хромосомы животного. У таких трансгенных мышей эндогенный иммуноглобулиновый локус, в целом, был инактивирован. Обзор способов получения человеческих антител от трансгенных животных см. в работе Lonberg, Nat. Biotech. 23:1117-1125 (2005). См. также, например, патенты США №№6075181 и 6150584, описывающие технологию XENOMOUSE™; US 5770429, описывающий технологию HuMAB®; US 7041870, описывающий технологию K-М MOUSE®, и US 2007/0061900, описывающий технологию VELOCiMousE®). Человеческие вариабельные участки из интактных антител, выработанных такими животными, могут быть дополнительно модифицированы, например, путем комбинирования с другим человеческим константным участком.
Человеческие антитела также могут быть получены при помощи гибридомных способов. Были описаны линии миеломных клеток человека и гетеромиеломных клеток мыши-человека для получения человеческих моноклональных антител. (См., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987); и Boemer et al., (1991) J. Immunol,, 147: 86). Человеческие антитела, полученные с помощью технологии человеческих В-клеточных гибридом, также были описаны в работе Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительные способы включают способы, описанные, например, в патенте США №7189826 (в котором описано получение моноклональных человеческих антител IgM от линий гибридомных клеток); Ni, (2006) Xiandai Mianyixue, 26(4):265-268 (описывающей гибридомы человек-человек). Технология человеческой гибридомы (технология Trioma) также описана в работах Vollmers and Brandlein, (2005) Histology and Histopathology, 20(3):927-937 и Vollmers and Brandlein, (2005) Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91.
Человеческие антитела также могут быть получены путем выделения последовательностей клонированных Fv вариабельных доменов, отобранных из полученных от человека фаг-дисплейных библиотек. Такие последовательности вариабельных доменов затем могут быть скомбинированы с необходимым человеческим константным доменом. Техники отбора человеческих антител из библиотек антител описаны ниже.
Антитела согласно настоящему изобретению могут быть выделены путем скрининга комбинаторных библиотек в отношении антител с необходимой активностью или активностями. Например, в данной области техники известен ряд способов создания фаг-дисплейных библиотек и скрининга таких библиотек в отношении антител, обладающих необходимыми характеристиками связывания. Такие способы рассматриваются, например, в работе Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) и дополнительно описаны, например, в работе McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al. (1992) J. Mol. Biol. III: 581-597; Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al. (2004) J. Mol. Biol. 338(2): 299-310; Lee et al. (2004) J. Mol. Biol. 340(5): 1073-1093; ellouse, (2004) Proc. Natl. Acad. Sci. USA 101(34): 12467-12472; и Lee et al. (2004) J. Immunol. Methods 284(1-2): 119-132.
В некоторых способах фагового дисплея репертуары генов VH и VL раздельно клонируют при помощи полимеразной цепной реакции (ПЦР) и рандомно рекомбинируют в фаговых библиотеках, которые затем могут быть подвергнуты скринингу в отношении связывающегося с антигеном фага, как описано в работе Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Фаг, как правило, воспроизводит фрагменты антитела, либо в виде одноцепочечных Fv (scFv) фрагментов, либо в виде Fab фрагментов. Библиотеки из иммунизированных источников дают высокоаффинные антитела на иммуноген без необходимости построения гибридом. Альтернативно, может быть клонирован интактный репертуар (например, человека) с получением одного источника антител к широкому диапазону "чужих", а также "своих" антигенов без какой-либо иммунизации, как описано в работе Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, интактные библиотеки также можно получить синтетически путем клонирования сегментов неперестроенного V-гена из стволовых клеток, а также с применением ПЦР-праймеров, содержащих случайную последовательность, с тем, чтобы закодировать высоковариабельные CDR3 участки и осуществить перестройку in vitro, как описано в работе Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Фаговые библиотеки человеческих антител описаны в патентных документах US 5750373, US 2005/0079574, US 2005/0119455, US 2005/0266000, US 2007/0117126, US 2007/0160598, US 2007/0237764, US 2007/0292936, US 2009/0002360. Выделенные из библиотек человеческих антител антитела или фрагменты антител рассматривают в настоящем документе как человеческие антитела или фрагменты человеческих антител.
В соответствии с определенными вариантами осуществления антитело представляет собой мультиспецифичное антитело, например, биспецифичное антитело. Мультиспецифичные антитела представляют собой моноклональные антитела, которые характеризуются специфичностями связывания по меньшей мере для двух различных сайтов. В соответствии с определенными вариантами осуществления одна из специфичностей связывания предназначена для одного антигена, а другая предназначена для второго антигена. В соответствии с определенными вариантами осуществления биспецифичные антитела могут связываться с двумя различными эпитопами одного антигена. Биспецифичные антитела также могут быть использованы для связывания цитотоксических средств с экспрессирующими антиген клетками. Биспецифичные антитела могут быть получены в виде антител полной длины или в виде фрагментов антител.
Методики получения мультиспецифичных антител включают без ограничения рекомбинантную коэкспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина с различными специфичностями (см. работу Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829, и Traunecker et al., EMBO J. 10: 3655 (1991)), и конструирование "knob-in-hole" (US 5731168). Мультиспецифичные антитела также можно получить путем создания эффектов электростатического управления для создания Fc-гетеродимерных молекул антител (WO 2009/089004A1); сшивания двух или более антител или фрагментов (см., например, патент США №4676980 и работу Brennan et al„ Science, 229: 81 (1985)); применения лейциновых застежек с получением биспецифичных антител (см, например, работу Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)); применения технологии "диатела" для получения биспецифичных фрагментов антител (см., например, работу Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и применения одноцепочечных Fv (sFv) димеров (Gruber et al., J. Immunol., 152:5368 (1994)); и получения триспецифичных антител (Tutt et al. (1991) J. Immunol. 147: 60).
Также включены в настоящий документ сконструированные антитела с тремя или более функциональными антиген-связывающими сайтами, в том числе "осьминоговые антитела" (см., например, US 2006/0025576 A1).
Антитело или фрагмент в настоящем документе также включают "FAb двойного действия" или "DAF", содержащий антиген-связывающий сайт, который связывается с одним антигеном, а также с другим, отличным антигеном (см., например, US 2008/0069820).
Варианты антител
В соответствии с определенными вариантами осуществления предусматриваются приведенные в настоящем документе варианты аминокислотных последовательностей антител. Например, может быть необходимо увеличивать аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотных последовательностей антитела могут быть получены путем введения соответствующих модификаций в кодирующую антитело нуклеотидную последовательность или путем пептидного синтеза. Такие модификации включают, например, делеции из, и/или вставки в, и/или замены остатков в аминокислотной последовательности антитела. Для получения конечного конструкта может быть осуществлена любая комбинация делеции, вставки и замены при условии, что конечный конструкт обладает необходимыми характеристиками, например, антиген-связывающей характеристикой.
Антитела включают химерные белки, содержащие антитело, белок, лекарственную часть, метку или другую группу. Химерные белки могут быть получены с помощью рекомбинационных методик, конъюгации или пептидного синтеза с оптимизацией таких свойств, как фармакокинетика. Человеческое или гуманизированное антитело согласно настоящему изобретению также может представлять собой химерный белок, содержащий последовательность альбумин-связывающего пептида (АВР) (Dennis et al, (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" V Biol Chem. 277:35035-35043; WO 01/45746). Антитела согласно настоящему изобретению включают химерные белки с последовательностями АВР, которые изложены в следующих источниках: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 в таблицах III и IV, страница 35038; (ii) US 2004/0001827 в параграфе [0076]; и (iii) WO 01/45746 на страницах 12-13, и причем все они включены в настоящий документ при помощи ссылки.
Варианты замен, вставок и делеции
В соответствии с определенными вариантами осуществления настоящее изобретение относится к вариантам антител с одной или несколькими аминокислотными заменами. Представляющие интерес сайты для приводящего к замене мутагенеза включают HVR и FR. Консервативные замены показаны в таблице 1 под заголовком "консервативные замены". Более заметные замены приведены в таблице 1 под заголовком "иллюстративные замены" и дополнительно описаны ниже на основании классов боковых цепей аминокислот. Аминокислотные замены могут быть введены в представляющее интерес антитело, а продукты подвергнуты скринингу на необходимую активность, например, сохраненное/улучшенное связывание с антигеном, пониженная иммуногенность или повышенная ADCC или CDC.
Аминокислоты могут быть сгруппированы в соответствии с общими свойствами боковых цепей:
(1) гидрофобные: норлейцин. Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Tip, Tyr, Phe.
Неконсервативные замены повлекут обмен члена одного из таких классов на член другого класса.
Один тип варианта замены предусматривает замену одного или нескольких остатков гипервариабельного участка исходного антитела (например, гуманизированного или человеческого антитела). Обычно, выбранный для последующего исследования полученный вариант(ы) будет характеризоваться модификациями (например, улучшениями) определенных биологических свойств (например, повышенная аффинность, сниженная иммуногенность) относительно исходного антитела и/или будет характеризоваться практически сохраненными определенными биологическими свойствами исходного антитела. Иллюстративный вариант замены представляет собой антитело с созревшей аффинностью, которое традиционно может быть получено, например, с помощью методик созревания аффинности с использованием фагового дисплея, таких как те, что описываются в настоящем документе. Схематически, подвергают мутации один или несколько остатков HVR и представленные на фаге вариантные антитела подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания).
В HVR могут быть осуществлены изменения (например, замены), например, для повышения аффинности антитела. Такие изменения могут быть осуществлены в "горячих точках" HVR, т.е. остатках, кодируемых кодонами, которые с высокой частотой подвергаются мутации в ходе процесса соматического созревания (см., например, работу Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или SDR (a-CDR), с тестированием полученной вариантной VH или VL на аффинность связывания. Созревание аффинности путем построения вторичных библиотек или повторного отбора из вторичных библиотек был описан, например, у Hoogenboom et al. в работе Methods in Molecular Biology 178:1-37 (O'Brien et al., ed. Human Press, Totowa, NJ, (2001)) В соответствии с некоторыми вариантами осуществления созревания аффинности в выбранные для созревания изменчивые гены вариабельность вносят с помощью любого из многочисленных способов (например, ПЦР с ошибающейся полимеразой, шаффлинг цепи или олигонуклеотид-направленный мутагенез). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для идентификации любых вариантов антител с необходимой аффинностью. Другой способ введения вариабельности предусматривает ориентированные на HVR подходы, при которых производят рандомизацию остатков HVR (например, 4-6 остатков за раз). Участвующие в связывании с антигеном остатки HVR могут быть точно идентифицированы, например, с помощью сканирующего аланином мутагенеза или моделирования. В частности, зачастую объектом являются CDR-H3 и CDR-L3.
В соответствии с определенными вариантами осуществления замены, вставки или делеции могут иметь место в одном или нескольких HVR при условии, что изменения практически не снижают способность антитела связывать антиген. Например, в HVR могут быть выполнены консервативные изменения (например, приведенные в настоящем документе консервативные замены), которые практически не снижают аффинность связывания. Такие изменения могут быть за пределами "горячих точек" HVR или SDR. В соответствии с некоторыми вариантами осуществления приведенных выше вариантных последовательностей VH и VL каждый HVR либо не изменен, либо содержит не более одной, двух или трех аминокислотных замен.
Пригодный способ идентификации остатков или участков антитела, которые могут служить объектом для мутагенеза, называется "сканирующий аланином мутагенез", описываемый в работе Cunningham and Wells (1989) Science, 244:1081-1085. Этот способ включает идентификацию и замену остатка или группы целевых остатков (например, заряженных остатков, таких как arg, asp, his, lys и glu) на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для выявления того, затрагивается ли взаимодействие антитела с антигеном. В аминокислотные положения могут быть введены дополнительные замены, демонстрирующие функциональную чувствительность изначальных замен. Альтернативно, или дополнительно, определяют кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта антитела и антигена. Такие контактирующие остатки и соседние остатки могут быть выбраны или исключены в качестве кандидатов на замену. Варианты могут быть подвергнуты скринингу для определения того, имеют ли они необходимые свойства.
Вставки в аминокислотных последовательностях включают слияния с амино- и/или карбоксильным концом, варьирующие по длине от одного остатка до полипептидов, содержащих сотни или более остатков, а также вставки внутри последовательности из одного или множества аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метиониловым остатком. Другие варианты вставок у молекулы антитела включают слияние N- или С-конца антитела с ферментом (например, для ADEPT) или полипептидом, который повышает период полужизни антитела в сыворотке крови.
Варианты с гликозилированием
В соответствии с определенными вариантами осуществления предлагаемое в настоящем документе антитело изменено с целью повышения или понижения степени, до которой гликозилируется антитело. Добавление или удаление сайтов гликозилирования у антитела может быть легко осуществлено путем изменения аминокислотной последовательности так, чтобы создать или удалить один или несколько сайтов гликозилирования.
Если антитело содержит Fc участок, то может быть изменен присоединенный к нему углевод. Производимые клетками млекопитающего естественные антитела, как правило, содержат разветвленный, двухантенарный олигосахарид, который обычно присоединен с помощью N-связи к Asn297 CH2 домена Fc участка (Wright et al. (1997) TIBTECH 15:26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в "стволе" двухантенарной олигосахаридной структуре. В соответствии с некоторыми вариантами осуществления для создания вариантов антител с определенными улучшенными свойствами в антителе по настоящему изобретению могут быть выполнены модификации олигосахарида.
В соответствии с одним вариантом осуществления настоящее изобретение относится к вариантам антитела с углеводной структурой, которые не содержат (прямо или опосредованно) присоединенную к Fc участку углеводную структуру. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Определяют количество фукозы путем расчета среднего количества фукозы в сахарной цепи в Asn297 по отношению к сумме всех присоединенных к Asn 297 гликоструктур (например, сложные, гибридные структуры и структуры с высоким содержанием маннозы) по результатам измерения MALDI-TO масс-спектрометрии, как, например, описано в WO 2008/077546. Asn297 относится к аспарагиновому остатку, расположенному приблизительно в 297 положении Fc участка (нумерация остатков Fc участков по Eu); тем не менее, Asn297 также может быть расположен приблизительно ±3 аминокислоты выше или ниже 297 положения, т.е. между положениями 294 и 300, по причине незначительных вариаций последовательностей у антител. Такие варианты с фукозилированием могут характеризоваться повышенной ADCC функцией (US 2003/0157108; US 2004/0093621). Примеры публикаций, относящихся к "дефукозилированным" вариантам антител или вариантам антител "с дефицитом по фукозе", включают: US 2003/0157108, WO 2000/61739, WO 2001/29246, US 2003/0115614, US 2002/0164328, US 2004/0093621, US 2004/0132140, US 2004/0110704, US 2004/0110282, US 2004/0109865, WO 2003/085119, WO 2003/084570, WO 2005/035586, WO 2005/035778, WO 2005/053742, WO 2002/031140;
Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. (2004) Biotech. Bioeng. 87:614. Примеры способных продуцировать дефукозилированные антитела клеточных линий включают клетки СНО Lee 13, дефектные по фукозилированию белка (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); US 2003/0157108, Presta, L; и WO 2004/056312, Adams et al. (особенно в примере 11), и нокаутные клеточные линии, такие как клетки СНО с нокаутным геном альфа-1,6-фукозилтрансферазы, FUT8 (Yamane-Ohnuki et al (2004) Biotech. Bioeng. 87:614; Kanda, Y. et al. (2006) Biotechnol. Bioeng., 94(4):680-688; WO 2003/085107).
Варианты антител дополнительно снабжают разделенными пополам олигосахаридами, у которых, например, присоединенный к Fc участку антитела двухантенарный олигосахарид разделен пополам посредством GlcNAc. Такие варианты антитела могут характеризоваться пониженным фукозилированием и/или повышенной ADCC функцией. Примеры таких вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США №6602684 (Umana et al.); и US 2005/0123546 (Umana et al.). Также настоящее изобретение относится к вариантам антител по меньшей мере с одним остатком галактозы в присоединенном к Fc участку олигосахариде. Такие варианты антител могут характеризоваться улучшенной CDC функцией. Описаны такие варианты антител (WO 1997/30087; WO 1998/58964; WO 1999/22764).
Варианты Fc участка
В соответствии с определенными вариантами осуществления в Fc участок приведенного в настоящем документе антитела могут быть введены одна или несколько аминокислотных модификаций с получением, таким образом, варианта Fc участка. Вариант Fc участка может содержать последовательность Fc участка человека (например, Fc участок IgG1, IgG2, IgG3 или IgG4 человека), содержащий аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
В соответствии с определенными вариантами осуществления настоящее изобретение относится к варианту антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его желаемым кандидатом для применений, в которых важен период полужизни антитела т vivo, но определенные эффекторные функции (например, комплемента и ADCC) не являются необходимыми или являются вредными. Для подтверждения снижения/уменьшения CDC и/или ADCC активностей могут быть проведены анализы цитотоксичности in vitro и/или in vivo. Например, анализы связывания с Fc рецептором (FcR) могут быть проведены для того, чтобы убедиться, что антитело не может связываться с FcyR (следовательно, вероятно не обладает ADCC активностью), но сохраняет способность связываться с FcRn. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только Fc(RIII, в то время как моноциты экспрессируют Fc(RI, Fc(RII и Fc(RIII. Экспрессия FcR на гематопоэтических клетках обобщена в таблице 3 на странице 464 в работе Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Неограничивающие примеры анализов in vitro для оценки ADCC активности представляющей интерес молекулы описаны в US 5500362; Hellstrom, I. et al. (1986) Proc. Nat'l Acad. Sci. USA 83:7059-7063); Hellstrom, I et al. (1985) Proc. Nat'l Acad. Sci. USA 82:1499-1502; US 5821337; Bruggemann, M. et al. (1987) J. Exp. Med. 166:1351-1361). Альтернативно, могут быть использованы нерадиоактивные анализы (см., например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Маунтин-Вью, Калифорния) и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Мэдисон, Висконсин). Пригодные эффекторные клетки для таких анализов включают мононуклеары периферической крови (РВМС) и натуральные клетки-киллеры (NK). Альтернативно, или дополнительно, ADCC активность представляющей интерес молекулы может быть оценена in vivo, например, на животной модели, как, например, раскрыто в работе Clynes et al. (1998) Proc. Nat'l Acad. Sci. USA 95:652-656. Анализы связывания Clq также могут быть осуществлены для подтверждения того, что антитело не способно связываться с Clq и, следовательно, не обладает CDC активностью. См., например, результаты ELISA по связыванию с Clq и СЗс в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента может быть проведен анализ CDC (Gazzano-Santoro et al. (1996), J. Immunol. Methods 202:163; Cragg, M.S. et al. (2003) Blood 101:1045-1052; Cragg, M.S. and M.J. Glennie, (2004) Blood 103:2738-2743). Определения связывания FcRn и выведения/периода полужизни in vivo могут быть осуществлены с помощью известных в данной области техники способов (Petkova, S.B. etal. (2006) Int'l. Immunol. 18(12):1759-1769).
Антитела со сниженной эффекторной функцией включают антитела с заменой одного или нескольких остатков 238, 265, 269, 270, 297, 327 и 329 в Fc участке (US 6737056). Такие Fc-мутанты включают Fc-мутанты с заменами по двум или более аминокислотным положениям 265, 269, 270, 297 и 327, в том числе так называемый Fc-мутант "DANA" с заменой остатков 265 и 297 на аланин (US 7332581).
Описаны некоторые варианты антител с повышенным или пониженным связыванием с FcR. (US 6737056; WO 2004/056312; Shields et al. (2001) J. Biol. Chem. 9(2): 6591-6604).
В соответствии с определенными вариантами осуществления варианты антител содержат Fc участок с одной или несколькими аминокислотными заменами, которые увеличивают ADCC, например, замены по положениям 298, 333 и/или 334 в Fc участке (нумерация остатков по EU).
В соответствии с некоторыми вариантами осуществления в Fc участке осуществляют изменения, которые в результате дают измененное (т.е. либо повышенное, либо пониженное) связывание Clq и/или измененную комплементзависимую цитотоксичность (CDC), например, как описано в патенте США №6194551, WO 99/51642 и работе Idusogie et al. (2000) J. Immunol. 164: 4178-4184.
Антитела с повышенными периодами полужизни и повышенным связыванием с неонатальным Fc-рецептором (FcRn), который ответственен за передачу материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US 2005/0014934A1 (Hinton et al.). Такие антитела содержат Fc участок с одной или несколькими заменами в нем, которые повышают связывание Fc участка с FcRn. Такие Fc-варианты включают варианты с заменами по одному или нескольким остаткам Fc участка: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замена 434 остатка Fc участка (патент США №7371826). Касательно других примеров вариантов Fc участка см. также работу Duncan & Winter, Nature 322:738-40 (1988); US 5648260; US 5624821; и WO 94/293 51.
Варианты сконструированного антитела с цистеиновыми заменами В соответствии с определенными вариантами осуществления может быть необходимо создание сконструированных антител с цистеиновыми заменами, например, "thioMAb", у которых один или несколько остатков антитела заменены цистеиновыми остатками. В соответствии с конкретными вариантами осуществления заменяемые остатки находятся в доступных сайтах антитела. В результате замены таких остатков цистеином реакционно-способные тиоловые группы располагаются в доступных сайтах антитела и могут быть использованы для конъюгации антитела с другими частями, такими как лекарственные части или лекарственные части с линкером, с образованием конъюгата антитело-лекарственное средство (ADC), также называемого иммуноконъюгатом, который описан в настоящем документе далее. В соответствии с определенными вариантами осуществления цистеином может быть замещен любой один или несколько из следующих остатков: V205 (нумерация по Kabat) легкой цепи; А118 (нумерация по EU) тяжелой цепи; и S400 (нумерация по EU) Fc участка тяжелой цепи. Сконструированные антитела с цистеиновыми заменами могут быть получены, как описано, например, в US 7521541.
Производные антител
В соответствии с определенными вариантами осуществления приведенное в настоящем документе антитело может быть дополнительно модифицировано как содержащее дополнительные небелковые части, которые известны из уровня техники и легко доступны. Подходящие для дериватизации антитела части включают без ограничения водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают без ограничения полиэтиленгликоль (PEG), сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена и малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, пропиленгликолевые гомополимеры, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные многоатомные спирты (например, глицерин), поливиниловый спирт и их смеси. При производстве преимуществами может обладать полиэтиленгликолевый пропиональдегид по причине его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество присоединенных к антителу полимеров может варьировать, и если присоединено более одного полимера, то они могут представлять собой одинаковые или различные молекулы. В целом, количество и/или тип используемых для дериватизации полимеров можно определить исходя из обстоятельств, в том числе без ограничений конкретных свойств или функций нуждающегося в улучшении антитела, будет ли применяться производное антитела в терапии при определенных условиях и т.д.
В соответствии с другим вариантом осуществления настоящее изобретение относится к конъюгатам антитела и небелковой части, которые могут избирательно нагреваться под воздействием излучения. В соответствии с одним вариантом осуществления небелковой частью является углеродная нанотрубка (Kam et al. (2005) Proc. Natl. Acad. Sci. USA 102:11600-11605). Излучение может иметь любую длину волны и включает без ограничения длины волн, которые не вредят обычным клетка, но которые нагревают небелковую часть до температуры, при которой погибают клетки, находящиеся рядом с антителом-небелковой частью.
Используемый в настоящем документе термин "гипервариабельный участок" или "HVR" относится к каждому участку вариабельного домена антитела, который является гипервариабельный по последовательности и/или образует структурно определяемые петли ("гипервариабельные петли"). Обычно, естественные четырехцепочечные антитела содержат шесть HVR, три в VH (H1, H2, Н3) и три в VL (L1, L2, L3). HVR обычно содержит аминокислотные остатки из гипервариабельных петель и/или из "определяющих комплементарность участков" (CDR), причем последние обладают наиболее высокой вариабельностью и/или вовлечены в распознавание антигена. Иллюстративные гипервариабельные петли присутствуют в аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (Н3) (Chothia and Lesk, (1987) J. Mol. Biol. 196:901-917). Иллюстративные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) присутствуют в аминокислотных остатках 24-34 у L1, 50-56 у L2, 89-97 у L3, 31-35 В у HI, 50-65 у H2 и 95-102 у Н3 (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). За исключением CDR1 в VH, обычно CDR содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также содержат "определяющие специфичность остатки" или "SDR", которые являются остатками, вступающими в контакт с антигеном. SDR содержатся в участках CDR, называемых укороченные-CDR или а-CDR. Иллюстративные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-Н3) находится в аминокислотных остатках 31-34 у L1, 50-55 у L2, 89-96 у L3, 31-35 В у H1, 50-58 у H2 и 95-102 у Н3 (Almagro and Fransson, (2008) Front. Biosci. 13:1619-1633). Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) в настоящем документе имеют нумерацию в соответствии с упомянутой ранее работой Kabat et al.
"Выделенное" антитело представляет собой антитело, которое было отделено от компонента его естественного окружения. В соответствии с некоторыми вариантами осуществления антитело очищено до степени чистоты более 95% или 99% с помощью, например, электрофореза (например, SDS-PAGE, изоэлектрическое фокусирование (IEF), капиллярный электрофорез) или хроматографии (например, ионообменная или обращенно-фазовая HPLC). Обзор способов оценки степени чистоты антитела см., например, в работ Flatman et al. (2007) J. Chromatogr. В 848:79-87.
Используемый в настоящем документе термин "моноклональное антитело" относится к антителу, получаемому из популяции практически однородных антител, т.е. формирующие популяцию отдельные антитела являются идентичными и/или связываются с одним эпитопом, за исключением возможных вариантных антител, например, содержащих природные мутации или образовавшиеся в ходе получения препарата моноклональных антител, причем такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело из препарата моноклональных антител направлено на одну детерминанту на антигене. Таким образом, определение "моноклональный" указывает на признак антитела как получаемого из практически однородной популяции антител, и оно не должно рассматриваться как нуждающееся в получении каким-либо конкретным способом антитело. Например, моноклональные антитела, подлежащие применению в соответствии с настоящим изобретением, могут быть получены с помощью ряда методик, включая без ограничения гибридомный способ, способы с использованием рекомбинантной ДНК, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все или часть иммуноглобулиновых локусов человека, причем в настоящем документе описываются такие способы и другие иллюстративные способы получения моноклональных антител.
Термин "голое антитело" относится к антителу, которое не конъюгировано с гетерологичной частью (например, цитотоксичной частью) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтическом составе.
Термин "естественные антитела" относится к встречающимся в природе молекулам иммуноглобулина с различными структурами. Например, естественные IgG-антитела представляют собой гетеротетрамерные гликопротеины массой приблизительно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными мостиками. От N- до С-конца каждая тяжелая цепь имеет вариабельный участок (VH), также называемый вариабельный тяжелый домен или вариабельный домен тяжелой цепи, за которым следует три константных домена (СН1, СН2 и СН3). Аналогично, от N- до С-конца каждая легкая цепь имеет вариабельный участок (VL), также называемый вариабельный легкий домен или вариабельный домен легкой цепи, за которым следует константный домен (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности ее константного домена.
"Процент (%) идентичности аминокислотной последовательности" относительно эталонной полипептидной последовательности определяют как долю аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в эталонной полипептидной последовательности после выравнивания последовательностей и введения при необходимости гэпов с получением максимального процента идентичности последовательностей и без учета каких-либо консервативных замен как части идентичности последовательности. Выравнивание с целью определения процента идентичности аминокислотной последовательности может быть осуществлено различными способами, которые известны из уровня техники, например, с помощью общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники смогут определить подходящие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для осуществления максимального выравнивания по всей длине сравниваемых последовательностей. В контексте настоящего документе, тем не менее, % величины идентичности аминокислотной последовательности получен с помощью компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была создана компанией Genentech, Inc., а исходный код был подан с документацией пользователя в Ведомство по охране авторского права США, Вашингтон, 20559, где он зарегистрирован под регистрационным номером авторского права США TXU510087. Программа ALIGN-2 общедоступна от компании Genentech, Inc., Южный Сан-Франциско, Калифорния, или ее можно скомпилировать из исходного кода. Программу ALIGN-2 необходимо компилировать для пользования на операционной системе UNIX, в том числе Digital UNIX V4.0D. Все параметры сравнения последовательностей выставляются программой ALIGN-2 и не изменяются.
В случаях использования ALIGN-2 для сравнений аминокислотных последовательностей, % идентичности аминокислотной последовательности у заданной аминокислотной последовательности А к, с или против заданной аминокислотной последовательности В (которую альтернативно можно перефразировать как заданная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности к, с или против заданной аминокислотной последовательности В) рассчитывают следующим образом: 100-кратная дробь X/Y, где Х представляет собой количество аминокислотных остатков, подсчитанных как идентичные совпадения с помощью программы для выравнивания последовательностей ALIGN-2 при выравнивании А и В такой программой, и где Y представляет собой общее количество аминокислотных остатков в В. Понятно, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А к В не будет равен % идентичности аминокислотной последовательности В к А. Если специально не указано иное, все используемые в настоящем документе значения % идентичности аминокислотной последовательности получены, как описано в непосредственно предшествующем параграфе с помощью компьютерной программы ALIGN-2.
Термин "вариабельный участок" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) естественного антитела обычно имеют подобные структуры, причем каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). См., например, работу Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007). Одного домена VH или VL может быть достаточно для придания антиген-связывающей специфичности. Кроме того, связывающиеся с конкретным антигеном антитела могут быть выделены с помощью домена VH или VL из связывающегося с антигеном антитела для скрининга библиотеки, соответственно, комплементарных доменов VL или VH (Portolano et al. (1993) J. Immunol. 150:880-887; Clarkson et al. (1991) Nature 352:624-628).
"Опухоль-ассоциированные антигены" (ТАА) известны из уровня техники и могут быть получены для применения при создании человеческих или гуманизированных антител с помощью способов и информации, которые хорошо известны в данной области техники. В попытках найти эффективные клеточные мишени для диагностики и терапии злокачественной опухоли исследователи прилагали усилия для выявления трансмембранных или иных опухоль-ассоциированных полипептидов, которые специфично экспрессируются на поверхности одного или нескольких конкретных типов злокачественных клеток по сравнению с поверхностью одной или нескольких нормальных нераковых клеток. Обычно, такие опухоль-ассоциированные полипептиды обильнее экспрессируются на поверхности злокачественных клеток по сравнению с поверхностью нераковых клеток. Идентификация таких полипептидов поверхностных антигенов опухоль-ассоциированных клеток в результате дала возможность специфично воздействовать на злокачественные клетки для разрушения их с помощью терапевтических средств на основе антител.
Примеры ТАА включают без ограничения перечисленные ниже ТАА (1)-(36). Для удобства, информация касательно этих антигенов, все из которых известны из уровня техники, приведена ниже и включает названия, альтернативные названия, номера доступа в Genbank и основную ссылку(ссылки), в соответствии с условными идентификационными обозначения последовательностей нуклеиновых кислот и белков Национального центра биотехнологической информации (NCBI). Соответствующие ТАА (1)-(36) последовательности нуклеиновых кислот и белков доступны в общедоступных базах данных, таких как GenBank. Опухоль-ассоциированные антигены, на которые нацелены антитела, включают варианты и изоформы аминокислотных последовательностей, которые обладают по меньшей мере приблизительно 70%, 80%, 85%, 90% или 95% идентичностью последовательности по отношению к последовательностям, указанным в приведенных ссылках, или которые проявляют практически такие же биологические свойства или характеристики, что и ТАА с последовательностью, указанной в приведенных ссылках. Например, ТАА с вариантной последовательностью обычно может специфично связываться с антителом, которое специфично связывается с ТАА с соответствующей приведенной последовательностью. Последовательности и раскрытия специально приведенных в настоящем документе ссылок однозначно включены при помощи ссылки.
ОПУХОЛЬ-АССОЦИИРОВАННЫЕ АНТИГЕНЫ (1)-(36);
(1) BMPR1B (рецептор костного морфогенетического белка типа IB, номер доступа в Genebank NM_001203) ten Dijke, P., et al Science 264 (5155):101-104 (1994), Oncogene 14 (11):1377-1382 (1997)); WO 2004/063362 (пункт 2); WO 2003/042661 (пункт 12); US 2003/134790-A1 (страница 38-39); WO 2002/102235 (пункт 13; страница 296); WO 2003/055443 (страница 91-92); WO 2002/99122 (пример 2; страница 528-530); WO 2003/029421 (пункт 6); WO 2003/024392 (пункт 2; фиг.112); WO 2002/98358 (пункт 1; страница 183); WO 2002/54940 (страница 100-101); WO 2002/59377 (страница 349-350); WO 2002/30268 (пункт 27; страница 376); WO 2001/48204 (пример; фиг.4); NP_001194 рецептор костного морфогенетического белка, тип IB, /pid=NP_001194.1. Перекрестные ссылки: MIM:603248; NP_001194.1; AY065994.
(2) El 6 (LAT1, SLC7A5, номер доступа в Genebank NM_003486) Biochem. Biophys. Res. Commun. 255 (2), 283-288 (1999), Nature 395 (6699):288-291 (1998), Gaugitsch, H.W., et al (1992) J. Biol. Chem. 267 (16):11267-11273); WO 2004/048938 (пример 2); WO 2004/032842 (пример IV); WO 2003/042661 (пункт 12); WO 2003/016475 (пункт 1); WO 2002/78524 (пример 2); WO 2002/99074 (пункт 19; страница 127-129); WO 2002/86443 (пункт 27; страницы 222, 393); WO 2003/003906 (пункт 10; страница 293); WO 2002/64798 (пункт 33; страница 93-95); WO 2000/14228 (пункт 5; страница 133-136); US 2003/224454 (фиг.3); WO 2003/025138 (пункт 12; страница 150); NP_003477 семейство переносчиков растворенных веществ 7 (транспортер катионных аминокислот, у+система), член 5 /pid=NP_003477.3 - Homo sapiens; перекрестные ссылки: MIM:600182; NP_003477.3; NM_015923; NM_003486_1.
(3) STEAP1 (шестой трансмембранный эпителиальный антиген предстательной железы, номер доступа в Genebank NM_012449); Cancer Res. 61 (15), 5857-5860 (2001), Hubert, R.S., et al (1999) Proc. Natl. Acad. Sci. U.S.A. 96 (25):14523-14528); WO 2004/065577 (пункт 6); WO 2004/027049 (фиг.1L); ЕР1394274 (пример 11); WO 2004/016225 (пункт 2); WO 2003/042661 (пункт 12); US 2003/157089 (пример 5); US 2003/185830 (пример 5); US 2003/064397 (фиг.2); WO 2002/89747 (пример 5; страница 618-619); WO 2003/022995 (пример 9; фиг.13А, пример 53; страница 173, пример 2; фиг.2А); NP_036581 шестой трансмембранный эпителиальный антиген предстательной железы; перекрестные ссылки: MIM:604415; NP_036581.1; NM_012449_1.
(4) 0772Р (СА125, MUC16, номер доступа в Genebank AF361486); J. Biol. Chem. 276 (29):27371-27375 (2001)); WO 2004/045553 (пункт 14); WO 2002/92836 (пункт 6; фиг.12); WO 2002/83866 (пункт 15; страница 116-121); US 2003/124140 (пример 16); перекрестные ссылки: 01:34501467; ААК74120.3; AF361486_1.
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин, номер доступа в Genebank NM_005823) Yamaguchi, N., et al Biol. Chem. 269 (2), 805-808 (1994), Proc. Natl. Acad. Sci. U.S.A. 96 (20):11531-11536 (1999), Proc. Natl. Acad. Sci. U.S.A. 93 (I): 136-140 (1996), J. Biol. Chem. 270 (37):21984-21990 (1995)); WO 2003/101283 (пункт 14); (WO 2002/102235 (пункт 13; страница 287-288); WO 2002/101075 (пункт 4; страница 308-309); WO 2002/71928 (страница 320-321); W094/10312 (страница 52-57); перекрестные ссылки: MIM:601051; NP_005814.2; NM_005823_1.
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, семейство переносчиков растворенных веществ 34 (фосфат натрия), член 2, тип II натрий-зависимый транспортер фосфата ЗЬ, номер доступа в Genebank NM_006424) J. Biol. Chem. 277 (22): 19665-19672 (2002), Genomics 62 (2):281-284 (1999), Feild, J.A., et al (1999) Biochem. Biophys. Res. Commun. 258 (3):578-582); WO 2004/022778 (пункт 2); ЕР1394274 (пример 11); WO 2002/102235 (пункт 13; страница 326); ЕР0875569 (пункт 1; страница 17-19); WO 2001/57188 (пункт 20; страница 329); WO 2004/032842 (пример IV); WO 2001/75177 (пункт 24; страница 139-140); перекрестные ссылки: MIM:604217; NP_006415.1; NM_006424_1.
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, sema-домен, семь тромоспондиновых повторов (тип 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен, (семафорин) 5B, номер доступа в Genebank АВ040878); Nagase Т., et al (2000) DNA Res. 1 (2): 143-150); WO 2004/000997 (пункт 1); WO 2003/003984 (пункт 1); WO 2002/06339 (пункт 1; страница 50); WO 2001/88133 (пункт 1; страница 41-43, 48-58); WO 2003/054152 (пункт 20); WO 2003/101400 (пункт 11); номер доступа: Q9P283; EMBL; АВ040878; BAA95969.1. Genew; HGNC:10737.
(8) PSCA hig (2700050C12Rik, C530008016Rik, RIKEN cDNA 2700050C12, ген RIKEN cDNA 2700050C12, номер доступа в Genebank AY358628); Ross et al (2002) Cancer Res. 62:2546-2553; US 2003/129192 (пункт 2); US 2004/044180 (пункт 12); US 2004/044179 (пункт 11); US 2003/096961 (пункт 11); US 2003/232056 (пример 5); WO 2003/105758 (пункт 12); US 2003/206918 (пример 5); ЕР1347046 (пункт 1); WO 2003/025148 (пункт 20); перекрестные ссылки: 01:37182378; AAQ88991.1; AY358628_1.
(9) ETBR (рецептор эндотелина типа В, номер доступа в Genebank AY275463); Nakamuta M., et al Biochem. Biophys. Res. Commun. 177, 34-39, 1991; Ogawa Y., et al Biochem. Biophys. Res. Commun. 178, 248-255, 1991; Arai H., et al Jpn. Circ. J. 56, 1303-1307, 1992; Arai H., et al J. Biol. Chem. 268, 3463-3470, 1993; Sakamoto A., Yanagisawa M., et al Biochem. Biophys. Res. Commun. 178, 656-663, 1991; Elshourbagy N.A., et al J. Biol. Chem. 268, 3873-3879, 1993; Haendler В., et al J. Cardiovasc. Pharmacol. 20, s1-S4, 1992; Tsutsumi M., et al Gene 228, 43-49, 1999; Strausberg R.L., et al Proc, Natl. Acad. Sci. U.S.A. 99. 16899-16903, 2002; Bourgeois С., et al J. Clin. Endocrinol. Metab. 82, 3116-3123, 1997; Okamoto Y., et al Biol. Chem. 272, 21589-21596, 1997; Verheij J.B., et al Am. J. Med. Genet. 108, 223-225, 2002; Hofstra R.M.W., et al Eur. J. Hum. Genet. 5, 180-185, 1997; Puffenberger E.G., et al Cell 79, 1257-1266, 1994; Attie Т., et al, Hum. Mol. Genet. 4, 2407-2409, 1995; Auricchio A., et al Hum. Mol. Genet. 5:351-354, 1996; Amiel J., et al Hum. Mol. Genet. 5, 355-357, 1996; Hofstra R.M.W., et al Nat. Genet. 12, 445-447, 1996; Svensson P.J., et al Hum. Genet. 103, 145-148, 1998; Fuchs S., et al Mol. Med. 7, 115-124, 2001; Pingault V., et al (2002) Hum. Genet. Ill, 198-206; WO 2004/045516 (пункт 1); WO 2004/048938 (пример 2); WO 2004/040000 (пункт 151); WO 2003/087768 (пункт 1); WO 2003/016475 (пункт 1); WO 2003/016475 (пункт 1); WO 2002/61087 (фиг.1); WO 2003/016494 (фиг.6); WO 2003/025138 (пункт 12; страница 144); WO 2001/983 51 (пункт 1; страница 124-125); ЕР 0522868 (пункт 8; фиг.2); WO 2001/77172 (пункт 1; страница 297-299); US 2003/109676; US6518404 (фиг.3); US5773223 (пункт 1а; столбец 31-34); WO 2004/001004.
(10) MSG783 (RNF124, гипотетический белок FLJ20315, номер доступа в Genebank NM_017763); WO 2003/104275 (пункт 1); WO 2004/046342 (пример 2); WO 2003/042661 (пункт 12); WO 2003/083074 (пункт 14; страница 61); WO 2003/018621 (пункт 1); WO 2003/024392 (пункт 2; фиг.93); WO 2001/66689 (пример 6); перекрестные ссылки: LocusID: 54894; NP_060233.2; NM_017763_1.
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ассоциированный со злокачественной опухолью предстательной железы ген 1, ассоциированный со злокачественной опухолью предстательной железы белок 1, шестой трансмембранный эпителиальный антиген предстательной железы 2, шестой трансмембранный эпителиальный белок предстательной железы, номер доступа в Genebank AF455138); Lab. Invest. 82 (11):1573-1582 (2002)); WO 2003/087306; US 2003/064397 (пункт 1; фиг.1); WO 2002/72596 (пункт 13; страница 54-55); WO 2001/72962 (пункт 1; фиг.4 В); WO 2003/104270 (пункт 11); WO 2003/104270 (пункт 16); US 2004/005598 (пункт 22); WO 2003/042661 (пункт 12); US 2003/060612 (пункт 12; фиг.10); WO 2002/26822 (пункт 23; фиг.2); WO 2002/16429 (пункт 12; фиг.10); перекрестные ссылки: 01:22655488; AAN04080.1; AF455138_1.
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, катионный канал для транзиторного рецепторного потенциала, подсемейство М, член 4, номер доступа в Genebank NM_017636); Xu, X.Z., et al Proc. Natl. Acad. Sci. U.S.A. 98 (19): 10692-10697 (2001), Cell 109 (3):397-407 (2002), J. Biol. Chem. 278 (33):30813-30820 (2003)); US 2003/143557 (пункт 4); WO 2000/40614 (пункт 14; страница 100-103); WO 2002/10382 (пункт 1; фиг.9А); WO 2003/042661 (пункт 12); WO 2002/30268 (пункт 27; страница 391); US 2003/219806 (пункт 4); WO 2001/62794 (пункт 14; фиг.1A-D); перекрестные ссылки: MIM:606936; NP_060106.2; NM_017636_1.
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, полученный из клеток тератокарциномы ростовой фактор, номер доступа в Genebank NP_003203 или NM_003212); Ciccodicola, A., etalEMBOJ. 8 (7):1987-1991 (1989), Am. J. Hum. Genet. 49 (3):555-565 (1991)); US 2003/224411 (пункт 1); WO 2003/083041 (пример 1); WO 2003/034984 (пункт 12); WO 2002/88170 (пункт 2; страница 52-53); WO 2003/024392 (пункт 2; фиг.58); WO 2002/16413 (пункт 1; страница 94-95, 105); WO 2002/22808 (пункт 2; фиг.1); US5854399 (пример 2; столбец 17-18); US5792616 (фиг.2); перекрестные ссылки: М1М:187395; NP_003203.1; NM_003212_1.
(14) CD21 (CR2 (рецептор комплемента 2), или C3DR (С3(1/рецептор вируса Эпштейна-Барр), или Hs.73792, номер доступа в Genebank M26004); Fujisaku et al (1989) J. Biol. Chem. 264 (4):2118-2125); Weis J.J., et al J. Exp. Med. 167, 1047-1066, 1988; Moore М., et al Proc. Natl. Acad. Sci. U.S.A. 84, 9194-9198, 1987; Barel М., et al Mol. Immunol. 35, 1025-1031, 1998; Weis J.J., et al Proc. Natl. Acad. Sci. U.S.A. 83, 5639-5643, 1986; Sinha S.K., et al (1993) J. Immunol. 150, 5311-5320; WO 2004/045520 (пример 4); US 2004/005538 (пример 1); WO 2003/062401 (пункт 9); WO 2004/045520 (пример 4); WO 91/02536 (фиг.9.1-9.9); WO 2004/020595 (пункт 1); номер доступа: Р20023; 013866; Q14212; EMBL; M26004; AAA35786.1.
(15) CD79b (CD79B, CD79p, IGb (иммуноглобулин-ассоциированный бета), В29, номер доступа в Genebank NM_000626 или 11038674); Proc. Natl. Acad. Sci. U.S.A. (2003) 100 (7):4126-4131, Blood (2002) 100 (9):3068-3076, Muller et al (1992) Eur. J. Immunol. 22 (6): 1621-1625); WO 2004/016225 (пункт 2, фиг.140); WO 2003/087768, US 2004/101874 (пункт 1, страница 102); WO 2003/062401 (пункт 9); WO 2002/78524 (пример 2); US 2002/150573 (пункт 5, страница 15); US5644033; WO 2003/048202 (пункт 1, страницы 306 и 309); WO 99/58658, US6534482 (пункт 13, фиг.17А/В); WO 2000/55351 (пункт 11, страницы 1145-1146); перекрестные ссылки: М1М:147245; NP_000617.1; NM_000626_1.
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (содержащий домен SH2 фосфатазный якорный белок 1a), SPAP1B, SPAP1C, номер доступа в Genebank NM_030764, AY358130); Genome Res. 13 (10):22б5-2270 (2003), Immunogenetics 54 (2):87-95 (2002), Blood 99 (8):2662-26б9 (2002), Proc. Natl. Acad. Sci. U.S.A. 98 (17):9772-9777 (2001), Xu, M.J., et al (2001) Biochem. Biophys. Res. Commun. 280 (3):768-775; WO 2004/016225 (пункт 2); WO 2003/077836; WO 2001/38490 (пункт 5; фиг.18D-1-18D-2); WO 2003/097803 (пункт 12); WO 2003/089624 (пункт 25); перекрестные ссылки: MIM:606509; NP_110391.2; NM_030764_1.
(17) HER2 (ErbB2, номер доступа в Genebank Ml 1730); Coussens L., et al Science (1985) 230(4730):1132-1139); Yamamoto Т., et al Nature 319, 230-234, 1986; Semba K„ et al Proc. Natl. Acad. Sci. U.S.A. 82, 6497-6501, 1985; Swiercz J.M., et al J. Cell Biol. 165, 869-880. 2004; Kuhns J.J., et al J. Biol. Chem. 274, 36422-36427, 1999; Cho H.-S., et al Nature 421, 756-760, 2003; Ehsani A., et al (1993) Genomics 15, 426-429; WO 2004/048938 (пример 2); WO 2004/027049 (фиг.II); WO 2004/009622; WO 2003/081210; WO 2003/089904 (пункт 9); WO 2003/016475 (пункт 1); US 2003/118592; WO 2003/008537 (пункт 1); WO 2003/055439 (пункт 29; фиг.1А-В); WO 2003/025228 (пункт 37; фиг.5С); WO 2002/22636 (пример 13; страница 95-107); WO 2002/12341 (пункт 68; фиг.7); WO 2002/13847 (страница 71-74); WO 2002/14503 (страница 114-117); WO 2001/53463 (пункт 2; страница 41-46); WO 2001/41787 (страница 15); WO 2000/44899 (пункт 52; фиг.7); WO 2000/20579 (пункт 3; фиг.2); US5869445 (пункт 3; столбец 31-38); W09630514 (пункт 2; страница 56-61); ЕР1439393 (пункт 7); WO 2004/043361 (пункт 7); WO 2004/022709; WO 2001/00244 (пример 3; фиг.4); номер доступа: Р04626; EMBL; M11767; AAA35808.1. EMBL; M11761; AAA35808.1.
(18) NCA (CEACAM6, номер доступа в Genebank Ml 8728); Bamett Т., et al Genomics 3, 59-66, 1988; Tawaragi Y., et al Biochem. Biophys. Res. Commun. 150, 89-96, 1988; Strausberg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99:16899-16903, 2002; WO 2004/063709; ЕР1439393 (пункт 7); WO 2004/044178 (пример 4); WO 2004/031238; WO 2003/042661 (пункт 12); WO 2002/78524 (пример 2); WO 2002/86443 (пункт 27; страница 427); WO 2002/60317 (пункт 2); номер доступа: Р40199; Q 14920; EMBL; M29541; AAA59915.1. EMBL; M18728.
(19) MDP (DPEP1, номер доступа в Genebank BC017023); Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899-16903 (2002)); WO 2003/016475 (пункт 1); WO 2002/64798 (пункт 33; страница 85-87); JP05003790 (фиг.6-8); W099/46284 (фиг.9); перекрестные ссылки: MIM:179780; AAH17023.1; BC017023J.
(20) IL20Ra (IL20Ra, ZCYTOR7, номер доступа в Genebank AF 184971); dark H.F., et al Genome Res. 13, 2265-2270, 2003; Mungall A.J., et al Nature 425, 805-811, 2003; Blumberg H., et al Cell 104, 9-19, 2001; Dumoutier L., et al J. Immunol. 167, 3545-3549, 2001; Parrish-Novak J., et al J. Biol. Chem. 277, 47517-47523, 2002; Pletnev S., et al (2003) Biochemistry 42:12617-12624; Sheikh F., et al (2004) J. Immunol. 172, 2006-2010; EP 1394274 (пример 11); US 2004/005320 (пример 5); WO 2003/029262 (страница 74-75); WO 2003/002717 (пункт 2; страница 63); WO 2002/22153 (страница 45-47); US 2002/042366 (страница 20-21); WO 2001/46261 (страница 57-59); WO 2001/46232 (страница 63-65); W098/37193 (пункт 1; страница 55-59); номер доступа: Q9UHF4; Q6UWA9; Q96SH8; EMBL; AF 184971; AAFO 1320.1.
(21) Бревикан (BCAN, BEHAB, номер доступа в Genbank AF229053); Gary S.C., et al Gene 256, 139-147, 2000; dark H.F., et al Genome Res. 13, 2265-2270, 2003; Strausberg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002; US 2003/186372 (пункт 11); US 2003/186373 (пункт 11); US 2003/119131 (пункт 1; фиг.52); US 2003/119122 (пункт 1; фиг.52); US 2003/119126 (пункт 1); US 2003/119121 (пункт 1; фиг.52); US 2003/119129 (пункт 1); US 2003/119130 (пункт 1); US 2003/119128 (пункт 1; фиг.52); US 2003/119125 (пункт 1); WO 2003/016475 (пункт 1); WO 2002/02634 (пункт 1).
(22) EphB2R (DRT, ERK, Hek5, EPHT3, Туго5, номер доступа в Genbank NM_004442); Chan, J. and Watt, V.M, Oncogene 6 (6), 1057-1061 (1991) Oncogene 10 (5):897-905 (1995), Annu. Rev. Neurosci. 21:309-345 (1998), Int. Rev. Cytol. 196:177-244 (2000)); WO 2003042661 (пункт 12); WO 200053216 (пункт 1; страница 41); WO 2004065576 (пункт 1); WO 2004020583 (пункт 9); WO 2003004529 (страница 128-132); WO 200053216 (пункт 1; страница 42); перекрестные ссылки: М1М:600997; NP_004433.2; NM_004442_1.
(23) ASLG659 (B7h, номер доступа в Genbank AX092328); US 2004/0101899 (пункт 2); WO 2003104399 (пункт 11); WO 2004000221 (фиг.3); US 2003/165504 (пункт 1); US 2003/124140 (пример 2); US 2003/065143 (фиг.60); WO 2002/102235 (пункт 13; страница 299); US 2003/091580 (пример 2); WO 2002/10187 (пункт 6; фиг.10); WO 2001/94641 (пункт 12; фиг.7b); WO 2002/02624 (пункт 13; фиг.1А-1В); US 2002/034749 (пункт 54; страница 45-46); WO 2002/06317 (пример 2; страница 320-321, пункт 34; страница 321-322); WO 2002/71928 (страница 468-469); WO 2002/02587 (пример 1; фиг.1); WO 2001/40269 (пример З; страницы 190-192); WO 2000/36107 (пример 2; страница 205-207); WO 2004/053079 (пункт 12); WO 2003/004989 (пункт 1); WO 2002/71928 (страница 233-234,452-453); WO 01/16318.
(24) PSCA (предшественник антигена стволовых клеток предстательной железы, номер доступа в Genbank AJ297436); Reiter R.E., et al Proc. Natl. Acad. Sci. U.S.A. 95, 1735-1740, 1998; Gu Z., et al Oncogene 19, 1288-1296, 2000; Biochem. Biophys. Res. Commun. (2000) 275(3):783-788; WO 2004/022709; EP1394274 (пример 11); US 2004/018553 (пункт 17); WO 2003/008537 (пункт 1); WO 2002/81646 (пункт 1; страница 164); WO 2003/003906 (пункт 10; страница 288); WO 2001/40309 (пример 1; фиг.17); US 2001/055751 (пример 1; фиг.lb); WO 2000/32752 (пункт 18; фиг.1); WO 98/51805 (пункт 17; страница 97); W098/51824 (пункт 10; страница 94); WO 98/40403 (пункт 2; фиг.1В); номер доступа: 043653; EMBL; AF 043498; ААС39607.1.
(25) GEDA (номер доступа в Genbank AY260763); ААР 14954 липомный белок по типу партнера слияния HMGIC/pid=AAP 14954.1 - Homo sapiens (человек); WO 2003/054152 (пункт 20); WO 2003/000842 (пункт 1); WO 2003/023013 (пример 3, пункт 20); US 2003/194704 (пункт 45); перекрестные ссылки: GL30102449; ААР14954.1; AY260763_1.
(26) BAFF-R (рецептор факт ора активации В-клеток, BLyS-рецептор 3, BR3, номер доступа в Genbank AF 116456); BAFF-рецептор/pid=NP_443177.1 - Homo sapiens: Thompson, J.S., et al Science 293 (5537), 2108-2111 (2001); WO 2004/058309; WO 2004/011611; WO 2003/045422 (пример; страница 32-33); WO 2003/014294 (пункт 35; фиг.6В); WO 2003/035846 (пункт 70; страница 615-616); WO 2002/94852 (столбец 136-137); WO 2002/38766 (пункт 3; страница 133); WO 2002/24909 (пример 3; фиг.3); перекрестные ссылки: MIM:606269; NP_443177.1; NM_052945_1; AF 132600.
(27) CD22 (изоформа В-клеточного рецептора CD22-B, BL-CAM, Lyb-8, Lyb8, SIGLEC-2, FLJ22814, номер доступа в Genbank AK026467); Wilson et al (1991) J. Exp. Med. 173:137-146; WO 2003/072036 (пункт 1; фиг.1); перекрестные ссылки: MIM:107266; NP_001762.1; NM_001771_1.
(28) CD79a (CD79A, CD79a, иммуноглобулин-ассоциированный альфа, специфичный для В-клеток белок, который ковалентно взаимодействует с Ig бета (CD79B) и формирует комплекс на поверхности с молекулами Ig M, передает сигнал, вовлеченный в дифференцировку В-клеток), pI: 4.84, MW: 25028 ТМ: 2 [Р] гено-хромосомный номер: 19q13.2, номер доступа в Genbank NP_001774.10); WO 2003/088808, US 2003/0228319; WO 2003/062401 (пункт 9); US 2002/150573 (пункт 4, страницы 13-14); W099/58658 (пункт 13, фиг.16); W092/07574 (фиг.1); US5644033; На et al (1992) J. Immunol. 148(5):1526-1531; Muller et al (1992) Eur. J. Immunol., 22:1621-1625; Hashimoto et al (1994) Immunogenetics 40(4):287-295; Preud'homme et al (1992) dm. Exp. Immunol. 90(1):141-146; Yu et al (1992) J. Immunol. 148(2) 633-637; Sakaguchi et al (1988) EMBO J. 7(11):3457-3464.
(29) CXCR5 (рецептор лимфомы Беркитта 1, G-белок сопряженный рецептор, который активируется хемокином CXCL13, участвует в миграции лимфоцитов и гуморальной защите, играет роль в инфицировании ВИЧ-2 и, возможно, развитии СПИДа, лимфомы, миеломы и лейкоза); 372 аа, pI: 8.54 MW: 41959 ТМ: 1 [Р] гено-хромосомный номер: 11q23.3, номер доступа в Genbank NP_001707.1); WO 2004/040000; WO 2004/015426; US 2003/105292 (пример 2); US6555339 (пример 2); WO 2002/61087 (фиг.1); WO 2001/57188 (пункт 20, страница 269); WO 2001/72830 (страницы 12-13); WO 2000/22129 (пример 1, страницы 152-153, пример 2, страницы 254-256); WO 99/28468 (пункт 1, страница 38); US 5440021 (пример 2, столбец 49-52); WO 94/28931 (страницы 56-58); WO 92/17497 (пункт 7, фиг.5); Dobner et al (1992) Eur. J. Immunol. 22:2795-2799; Barella et al (1995) Biochem. J. 309:773-779.
(30) HLA-DOB (бета-субъединица молекулы МНС II класса (антиген 1а), которая связывает пептиды и презентирует их CD4+ Т-лимфоцитам); 273 аа, pI: 6.56, MW: 30820.ТМ: 1 [Р] гено-хромосомный номер: бр21.3, номер доступа в Genbank NP_002111.1); Tonnelle et al (1985) EMBO J. 4(11):2839-2847; Jonsson et al (1989) Immunogenetics 29(6):411-413; Beck et al (1992) J. Mol. Biol. 228:433-441; Strausberg et al (2002) Proc. Natl. Acad. Sci USA 99:16899-16903; Servenius et al (1987) J. Biol. Chem. 262:8759-8766; Beck et al (1996) J. Mol. Biol. 255:1-13; Naruse et al (2002) Tissue Antigens 59:512-519; W099/58658 (пункт 13, фиг.15); US6153408 (столбец 35-38); US5976551 (столбец 168-170); US6011146 (столбец 145-146); Kasahara et al (1989) Immunogenetics 30(1):66-68; Larhammar et al/(1985)J: Biol. Chem. 260(26):14111-14119.
(31) P2X5 (управляемый лигандами пуринергического рецептора Р2Х ионный канал 5, ионный канал, управляемый внеклеточной АТФ, может быть вовлечен в синаптическую передачу и нейрогенез, недостаток может способствовать развитию патофизиологии идио патической нестабильности детрузора); 422 аа), р1: 7.63, MW: 47206 ТМ: 1 [Р] гено-хромосомный номер: 17р13.3, номер доступа в Genbank NP_002552.2); Le et al (1997) FEBS Lett. 418(1-2):195-199; WO 2004/047749; WO 2003/072035 (пункт 10); Touchman et al (2000) Genome Res. 10:165-173; WO 2002/22660 (пункт 20); WO 2003/093444 (пункт 1); WO 2003/087768 (пункт 1); WO 2003/029277 (страница 82).
(32) CD72 (антиген дифференцировки В-клеток CD72, Lyb-2); 359 аа, pi: 8.66, MW: 40225, TM: 1 [Р] гено-хромосомный номер: 9р13.3, номер доступа в Genbank NP_001773.1); WO 2004042346 (пункт 65); WO 2003/026493 (страницы 51-52, 57-58); WO 2000/75655 (страницы 105-106); Von Hoegen et al (1990) J. Immunol. 144(12):4870-4877; Strausberg et al (2002) Proc. Natl. Acad. Sci USA 99:16899-16903.
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок I типа семейства богатых лейциновыми повторами (LRR) белков, регулирует активацию и апоптоз В-клеток, потеря функции связана с повышенной активностью заболевания у больных системной красной волчанкой); 661 аа, pI: 6.20, MW: 74147 TM: 1 [Р] гено-хромосомный номер: 5ql2, номер доступа в Genbank NP_005573.1); US 2002/193567; WO 97/07198 (пункт 11, страницы 39-42); Miura et al (1996) Genomics 38(3):299-304; Miura et al (1998) Blood 92:2815-2822; WO 2003/083047; WO 97/44452 (пункт 8, страницы 57-61); WO 2000/12130 (страницы 24-26).
(34) FcRH1 (Fc-рецептор-подобный белок 1, предполагаемый рецептор для иммуноглобулинового Fc-домена, который со держит Ig-подобный домен С 2 типа и ITAM домены, может играть роль в дифференцировке В-лимфоцитов); 429 аа, pI: 5.28, MW: 46925 TM: 1 [Р] гено-хромосомный номер: lq21-lq22, номер доступа в Genbank NP_443170.1); WO 2003/077836; WO 2001/38490 (пункт 6, фиг.18Е-1-18-Е-2); Davis et al (2001) Proc. Natl. Acad. Sci USA 98(17):9772-9777; WO 2003/089624 (пункт 8); EP1347046 (пункт 1); WO 2003/089624 (пункт 7).
(35) IRTA2 (FcRH5, ассоциированный с транслокациями рецепторный белок иммуноглобулинового суперсемейства 2, предполагаемый иммунорецептор с возможной ролью в В-клеточном развитии и лимфомагенезе; дерегуляция гена в результате транслокации имеет место при некоторых В-клеточных злокачественных новообразованиях); 977 аа, р1: 6.88, MW: 106468, TM: 1 [Р] гено-хромосомный номер: Iq21, номер доступа в Genbank Human:AF343662, AF343663, AF343664, AF343665, AF369794, AF397453, АК090423, АК090475, AL834187, AY358085; мышиный; АК08975б, AY158090, AY506558; NP_112571.1; WO 2003/024392 (пункт 2, фиг.97); Nakayama et al (2000) Biochem. Biophys. Res. Commun. 277(1):124-127; WO 2003/077836; WO 2001/38490 (пункт З, фиг.18В-1-18В-2).
(36) TENB2 (TMEFF2, томорегулин, TPEF, HPP1, TR, предполагаемый трансмембранный протеогликан, относящийся к EGF/херегулиновому семейству ростовых факторов и фоллистатину); 374 аа, номер доступа в NCBI: AAD55776, AAF91397, AAG49451, эталонная последовательность по NCBI: NP_057276; ген по NCBI: 23671; OMIM: 605734; SwissProt Q9UIK5; номер доступа в Genbank AF179274; AY358907, CAF85723, CQ782436; WO 2004/074320; JP2004113151; WO 2003/042661; WO 2003/009814; ЕР 1295944 (страницы 69-70); WO 2002/30268 (страница 329); WO 2001/90304; US 2004/249130; US 2004/022727; WO 2004/063355; US 2004/197325; US 2003/232350; US 2004/005563; US 2003/124579; Horie et al (2000) Genomics 67:146-152; Uchida et al (1999) Biochem. Biophys. Res. Commun. 266:593-602; Liang et al (2000) Cancer Res. 60:4907-12; Glynne-Jones et al (2001) Int JCancer. Oct 15; 94(2):178-84.
Рекомбинантные способы и композиции
Антитела можно получить с помощью рекомбинантных способов и композиций, которые, например, описаны в US 4816567. В соответствии с одним вариантом осуществления настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей описываемое в настоящем документе антитело. Такая нуклеиновая кислота может кодировать содержащую VL аминокислотную последовательность и/или содержащую VH аминокислотную последовательность антитела (например, легкую и/или тяжелую цепи антитела). В соответствии со следующим вариантом осуществления настоящее изобретение относится к одному или нескольким содержащим такую нуклеиновую кислоту векторам (например, векторам экспрессии). В соответствии со следующим вариантом осуществления настоящее изобретение относится к содержащей такую нуклеиновую кислоту клетке-хозяину. В соответствии с одним таким вариантом осуществления клетка-хозяин содержит (например, была им трансформирована): (1) вектор, содержащий нуклеиновую кислоту, который кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую последовательность, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В соответствии с одним вариантом осуществления клетка-хозяин является эукариотической, например, клеткой яичника китайского хомячка (СНО) или лимфоидной клеткой (например, клеткой YO, NSO, Sp20). В соответствии с одним вариантом осуществления настоящее изобретение относится к способу получения антитела, причем способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую приведенное выше антитело, в подходящих для экспрессии антитела условиях и, необязательно, выделение антитела из клетки-хозяина (или культуральной среды клеток-хозяев).
Для рекомбинантного получения антитела нуклеиновую кислоту, кодирующую антитело, например описываемое выше, выделяют и вставляют в один или несколько векторов для последующего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована с помощью традиционных процедур (например, путем применения олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии кодирующих антител векторов включают описываемые в настоящем документе прокариотические или эукариотические клетки. Например, антитела могут продуцироваться у бактерий, особенно если нет необходимости в гликозилировании и Fc-эффекторной функции. По поводу экспрессии фрагментов и полипептидов антител у бактерий см., например, US 5648237; US 5789199; US 5840523; Charlton, Methods in Molecular Biology, Vol.248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, (2003), pp.245-254, в которой описана экспрессия фрагментов антител у Е. coli.) После экспрессии антитело может быть выделено из бактериальной клеточной массы в растворимой фракции и может быть дополнительно очищено.
Помимо прокариот, эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии кодирующих антитело векторов, в том числе штаммы грибов и дрожжей, чьи пути гликозилирования были "гуманизированы", что приводит в результате к продуцированию антитела с частично или полностью человеческим профилем гликозилирования (Gemgross, (2004) Nat. Biotech. 22:1409-1414; Li et al. (2006) Nat, Biotech. 24:210-215).
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают от многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Было обнаружено множество бакуловирусных штаммов, которые могут быть использованы в сочетании с клетками насекомых, в частности для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также могут быть использованы культуры клеток растений (US 5959177; US 6040498; US 6420548; US 7125978; US 6417429, в котором описана технология PLANTIBODIES™ для получения антител у трансгенных растений).
В качестве хозяев также могут быть использованы клетки позвоночных. Например, могут быть пригодны линии клеток млекопитающих, которые адаптированы для роста в суспензии. Другими примерами пригодных линий клеток-хозяев млекопитающих являются линия С VI клеток почки мартышки, трансформированная посредством SV40 (COS-7); линия клеток первичной почки человека (293 или клетки 293, которая описана, например, в работе Graham et al. (1977, J. Gen Virol. 36:59); клетки почки новорожденного хомяка (ВНК); клетки Сертоли мыши (клетки ТМ4, которые описаны, например, в работе Mather, (1980) Biol. Reprod. 23:243-251); клетки почки мартышки (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки цервикальной карциномы человека (HELA); клетки почки собаки (MDCK; клетки печени крысы линии buffalo (BRL 3А); клетки легкого человека (W138); клетки печени человека (Нер G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, которые описаны, например, в работе Mather et al. (1982) Annals N.Y. Acad. Sci. 383:44-68; клетки MRC 5; и клетки FS4. Другие пригодные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомячка (СНО), в том числе DHFR" клетки СНО (Uriaub et al. (1980) Proc. Natl. Acad. Sci. USA 77:4216); и линии миеломных клеток, такие как YO, NSO и Sp2/0. Обзор некоторых подходящих для продуцирования антитела линий клеток-хозяев млекопитающих см., например, в работе Yazaki and Wu, Methods in Molecular Biology, Vol.248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp.255-268 (2003).
Анализы
Антитела могут быть идентифицированы, подвергнуты скринингу или охарактеризованы по их физическим/химическим свойствам и/или биологическим активностям при помощи различных известных из уровня техники анализов. В соответствии с одним аспектом антитело по настоящему изобретению тестируют на его антиген-связывающую активность, например, при помощи известных способов, таких как ELISA, вестерн-блоттинг и т.д. В соответствии с другим аспектом могут быть использованы анализы по конкурентному связыванию для идентификации антитела, которое конкурирует с другим известным антителом в отношении связывания с антигеном. В соответствии с определенными вариантами осуществления такое конкурентное антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается известное антитело. Подробные иллюстративные способы картирования эпитопа, с которым связывается антитело, приведены в работе Morris (1996) "Epitope Mapping Protocols," in Methods in Molecular Biology, Vol.66 (Humana Press, Totowa, NJ).
В типичном анализе по конкурентному связыванию иммобилизированный антиген инкубируют в растворе, содержащем первое меченое антитело, которое связывается с антигеном (например, HER2 или CD20), и второе немеченое антитело, которое тестируют на его способность конкурировать с первым антителом за связывание с антигеном. Второе антитело может присутствовать в гибридомном супернатанте. В качестве контроля иммобилизированный антиген инкубируют в растворе, содержащем первое меченое антитело, но без второго немеченого антитела. После инкубации в условиях, позволяющих проходить связыванию первого антитела с антигеном, избыток несвязавшегося антитела удаляют и измеряют количество ассоциированной с иммобилизированным антигеном метки. Если количество ассоциированной с иммобилизированным антигеном метки существенно уменьшено в тестовом образце по сравнению с контрольным образцом, то это указывает на то, что второе антитело конкурирует с первым антителом за связывание с антигеном. См. работу Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
В соответствии с одним аспектом анализы включают идентификацию их антител с биологической активностью. Биологическая активность может включать, например, ингибирование развитие опухоли.
В соответствии с определенными вариантами осуществления антитела из способов по настоящему изобретению пригодны для выявления наличия антигена в биологическом образце. Используемый в настоящем документе термин "выявление" касается количественного или качественного выявления. В соответствии с определенными вариантами осуществления понятие биологический образец включает кровь, плазму, сыворотку крови, клетки, мочу, образец стекловидного тела, слезы или ткань. В соответствии с определенными вариантами осуществления способ включает приведение в контакт биологического образца с описываемым в настоящем документе антителом в условиях, позволяющих проходить связыванию антитела с антигеном, и выявление того, формируется ли комплекс антитела и антигена. Таким способом может быть способ in vitro или in vivo. В соответствии с одним вариантом осуществления антитело применяют для отбора пригодных для терапии антителом субъектов, например, в случае, если экспрессируемым белком-антигеном является биомаркер для отбора пациентов. Иллюстративные нарушения, которые могут быть диагностированы с помощью антитела согласно настоящему изобретению, включают злокачественную опухоль и иммунные нарушения.
В соответствии с определенными вариантами осуществления способа по настоящему изобретению используют меченные и конъюгированные антитела. Метки включают без ограничения метки или части, которые выявляются непосредственно (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминесцентные и радиоактивные метки), а также части, такие как ферменты или лиганды, которые выявляются опосредованно, например, в результате ферментативной реакции или молекулярного взаимодействия. Иллюстративные метки включают без ограничения радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза светлячка и бактериальная люцифераза (US 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизозим, сахаридоксидазы, например, глюкозоксидазу, галактозоксидазу и глюкозо-6-фосфатдегидрогеназу, оксидазы гетероциклических соединений, такие как уриказа и ксантиноксидаза, связанные с ферментом, который использует перекись водорода для окисления предшественника красителя, таким как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спин-метки, бактериофаговые метки, стабильные свободные радикалы и т.п.
Лекарственные части, которые влияют на уничтожение клеток, могут быть ковалентно присоединены к антителам с помощью линкерного элемента с образованием конъюгатов антитело-лекарственное средство для направленных терапевтических эффектов по уничтожению клеток. Иллюстративный вариант осуществления соединения-конъюгата антитело-лекарственное средство (ADC) включает антитело (Ab), которое целенаправленно воздействует на опухолевую клетку, и цитотоксическую или цитостатическую лекарственную часть (D), и линкерную часть (L), которая присоединяет Ab к D. Антитело присоединяется через один или несколько аминокислотных остатков, таких как лизин и цистеин, с помощью линкерной части (L) к D; причем композиция характеризуется формулой I:
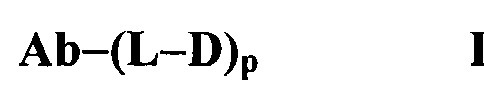 ,
,
где р равно от 1 до приблизительно 20 или от приблизительно 2 до приблизительно 5. Количество лекарственных частей, которые могут быть конъюгированы через реакционно-способную линкерную часть с молекулой антитела, может быть ограничено количеством свободных цистеиновых остатков, которые вводят с помощью описанных в настоящем документе способов.
Лекарственная часть (D) конъюгата антитело-лекарственное средство (ADC) включает любое соединение, часть или группу, которая обладает цитотоксическим или цитостатическим эффектом. Лекарственные части могут оказывать собственные цитотоксические и цитостатические эффекты при помощи механизмов, включающих без ограничения связывание тубулина, связывание или интеркаляция ДНК и ингибирование РНК-полимеразы, синтеза белка и топоизомеразы. Некоторые цитотоксические лекарственные средства склонны быть неактивными или менее активными при конъюгации с большими антителами или белковыми рецепторными лигандами. Иллюстративные лекарственные части включают без ограничения майтанзиноид, доластатин, ауристатин, калихеамицин, пирролобензодиазепин (PBD), PNU-159682, антрациклин, дуокармицин, алкалоид барвинка, таксан, трихотецен, СС1065, дуокармицин, кампотецин, элинафид и их стереоизомеры, изостеры, аналоги или производные, и включая производные этих лекарственных средств, которые обладают цитотоксической активностью.
Конъюгаты антитело-лекарственное средство (ADC) представляют собой противораковые терапевтические средства направленного действия, которые разработаны для уменьшения неспецифических токсических эффектов и повышения эффективности по сравнению с традиционной противораковой химиотерапией на основе малых молекул и антител. Они используют мощную нацеливающую способность моноклональных антител для специфичной доставки весьма сильных конъюгированных терапевтических средств на основе малых молекул к злокачественной клетке. Для оценки свойств, таких как фармакокинетика и токсичность, этих конъюгатов антитело-лекарственное средство полезно было бы, чтобы была возможность характеризовать и количественно оценивать их из плазмы крови, мочи и других биологических образцов. Были раскрыты способы выявления и скрининга конъюгатов антитело-лекарственное средство с помощью захвата на иммуноаффинной мембране (IAM) и масс-спектрометрии (US 2005/0232929), в том числе способы аффинного захвата с использованием микроносителей (US 2009/0286258).
СПОСОБЫ ИЗМЕРЕНИЯ ЧЕЛОВЕЧЕСКИХ И ГУМАНИЗИРОВАННЫХ АНТИТЕЛ В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ
Один аспект настоящего изобретения относится к воспроизводимому, эффективному и экономичному, основному, основанному на LC-MS/MS способу количественной оценки различных терапевтических средств на основе человеческих и гуманизированных моноклональных антител (МАb) с общей каркасной структурой антитела в образцах ткани и плазмы крови крысы и мартышки, и потенциально других видов животных, за исключением человека, по результатам доклинических исследований. Расщепление антител дает пептиды из консервативного каркасного участка, которые характерны для вводимых человеческих или гуманизированных терапевтических антител и не встречаются среди эндогенных белков мартышки и крысы.
На фигуре 9 показан общий LC-MS/MS способ количественной оценки терапевтического антитела в плазме/сыворотке крови животного с помощью одного или нескольких каркасных сигнатурных пептидов (FSP).
Способы по настоящему изобретению включают общий подход количественной оценки человеческих или гуманизированных антител, включающему следующие стадии:
(a) обработка биологического образца расщепляющим ферментом с образованием образца расщепленного антитела, причем образец сыворотки или плазмы крови взят от животного, которое было обработано человеческим или гуманизированным антителом; и
(b) анализ образца расщепленного антитела с помощью масс-спектрометрии с выявлением и измерением концентрации одного или нескольких общих человеческих каркасных пептидов, причем человеческие каркасные пептиды содержат одну или несколько последовательностей, выбранных из SEQ ID NO 1-8.
В соответствии с одним иллюстративным вариантом осуществления расщепляющим ферментом является трипсин. Альтернативные протеазы могут образовывать дополнительные каркасные пептиды помимо пептидов с SEQ ID NO 1-8. Может быть использован любой специфичный фермент, такой как эндопротеиназа LysC, эндопротеиназа ArgC, V8 от Staphylococcus aureus и эндопротеиназа GluC. Могут быть использованы неспецифичные протеазы, такие как папаин. Полученные для количественной оценки пептиды могут иметь иные последовательности, чем полученные при помощи трипсина, но идея применения общих каркасных пептидов, присутствующих в человеческих и не присутствующих в животных антителах, остается той же.
В соответствии с другим вариантом осуществления способ дополнительно включает приведение в контакт образца расщепленного антитела со средой для аффинного захвата или очистку образца при помощи твердофазной экстракции (SPE) и элюирование обогащенного образца расщепленного антитела.
В соответствии с другим вариантом осуществления способ включает аффинный захват антитела, содержащего один или несколько человеческих каркасных пептидов с последовательностями, выбранными из SEQ ID NO 1-8, с последующим расщеплением. Способ аффинного захвата может быть осуществлен с помощью ECD (связывание антигена по внеклеточному домену), захвата с помощью антител к ID или белка А или G.
В соответствии с другим вариантом осуществления биологический образец представляет собой сыворотку, плазму крови, ткань или линию клеток, полученную от любого млекопитающего, за исключением человека.
При иллюстративной демонстрации способа антитело представляет собой антитело трастузумаб к HER2 (HERCEPTIN®, Genentech, Inc.). Способы согласно настоящему изобретению были осуществлены на других антителах. Антитела, которые были расщеплены трипсином из неклинического образца плазмы крови и проанализированы, включают антитела к MUC16, антитела к MSLN (мезотелин), антитела к Steapl, антитела к CD20 (2Н7 и ритуксимаб), антитела к HER3 (2С4, пертузумаб), антитела к NRP1, антитела к PDL1, антитела к LRP6, антитела к В7-Н4, антитела к GFRA1 7С9, антитела к NRG1 и антитела к LY6E.
В соответствии с другим вариантом осуществления образец антитела был проанализирован посредством аффинного захвата на основе иммунопреципитации (IP) посредством белка A/G на носителе в виде частиц с последующим расщеплением и анализом на носителе в виде частиц.
КАРКАСНЫЕ СИГНАТУРНЫЕ ПЕПТИДЫ
Каркасные участки человеческих антител преимущественно консервативны. На фигуре 1 показано выравнивания последовательностей для аминокислотных последовательностей тяжелой цепи человеческого антитела 2Н7, окрелизумаб (SEQ ID NO: 11), и пяти антител к CD20 яванского макака: CynoHC 1a D3 1 (SEQ ID NO:12), CynoHC 1b E5 1 (SEQ ID NO: 13), Cyno HC 2a (SEQ ID NO: 14), CynoHC 2b E6 1 (SEQ ID NO: 15), CynoHC 3 (SEQ ID NO: 16). Указаны каркасные сигнатурные пептиды (FSP 1-8), которые характерны исключительно человеческим Mab 2Н7 (hu 2Н7) и отсутствуют в тяжелой цепи IgG яванского макака, причем каждый имеет по меньшей мере одно отличие по аминокислоте в последовательностях. Исходя из доступной информации о последовательностях, каркасные сигнатурные пептиды (FSP1-8) характерны только для человеческого антитела и не для вариантов IgG яванского макака. Каркасные сигнатурные пептиды (FSP 1-8) из таблицы 2 также присутствуют в эндогенном IgG1 и в некоторых случаях в IgG2, IgG3 и IgG4. Эти пептиды также широко распространены среди других человеческих или гуманизированных терапевтических антител и человеческих IgG.
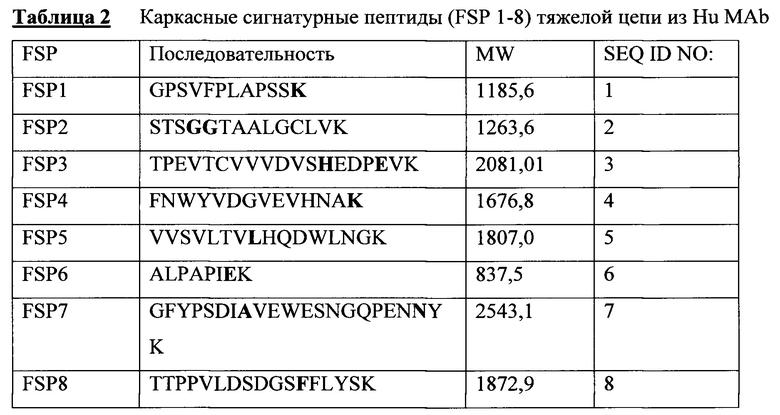
8 каркасных сигнатурных пептидов (FSP) с остатками, характерными (жирным) для человеческого IgG
Трастузумаб (HERCEPTIN®, Genentech), использовали в качестве модельного эталонного стандарта и вносили в плазму крови яванского макака и крысы с последующим непосредственным расщеплением цельной плазмы крови с или без предварительного концентрирования с помощью SPE или иммунопреципитации с помощью магнитных частиц с белком A/G и последующим расщеплением на частице перед LC-MS/MS анализом, используемый при проверке рабочий диапазон значений устанавливали на 1-1000 мкг/мл в обеих матрицах плазмы крови. Также тестировали и подтверждали специфичность при помощи как отрицательного контрольного холостого образца плазмы крови, так и образцов плазмы крови с внесенным антителом.
Трастузумаб (HERCEPTIN®, huMAb4D5-8, rhuMAb HER2, Genentech) представляет собой полученное от рекомбинантной ДНК гуманизированное моноклональное антитело с каппа цепью IgG1, представляющее собой версию мышиного антитела к HER2, которое избирательно с высокой аффинностью связывается в клеточном анализе (Kd=5 нМ) с внеклеточным доменом белка рецептора эпидермального фактора роста человека 2, HER2 (ErbB2) (US 5821337; US 6054297; US 6407213; US 6639055; Coussens L, et al (1985) Science 230:1132-9; Slamon DJ, et al (1989) Science 244:707-12). Трастузумаб содержит человеческие каркасные участки с определяющими комплементарность участками мышиного антитела (4D5), которое связывается с HER2. Трастузумаб связывается с антигеном HER2 и, таким образом, ингибирует рост злокачественных клеток. Как в анализах in vitro, так и у животных было показано, что трастузумаб ингибирует пролиферацию опухолевых клеток человека, которые сверхэкспрессируют HER2 (Hudziak RM, et al (1989) Mol Cell Biol 9:1165-72; Lewis GD, et al (1993) Cancer Immunol Immunother; 37: 255-63; Baselga J, et al (1998) Cancer Res. 58:2825-2831). Трастузумаб является медиатором антитело-зависимой клеточной цитотоксичности ADCC (Hotaling ТЕ, et al (1996) [abstract]. Proc. Annual Meeting Am Assoc Cancer Res; 37: 471; Pegram MD, et al (1997) [abstract]. Proc Am Assoc Cancer Res; 38: 602; Sliwkowski et al (1999) Seminars in Oncology 26(4), Suppl 12: 60-70; Yarden Y. и Sliwkowski, M. (2001) Nature Reviews: Molecular Cell Biology, Macmillan Magazines, Ltd., Vol.2: 127-137). HERCEPTIN® 1998 был одобрен для лечения больных с метастазирующими злокачественными опухолями молочной железы, которые сверхэкспрессируют ErbB2 (Baselga et al, (1996) J. Clin. Oncol. 14: 737-744).
Меченные стабильным изотопом (SIL) аналоги FSP1-8 (SEQ ID NO: 1-8) могут быть использованы в качестве ("внесенных") внутренних стандартов in situ. Стабильные изотопные метки, как правило, включают 13С, 15N и 2Н. Внутренние стандарты могут быть включены в один или несколько аминокислотных остатков пептидной последовательности. Внутренние стандарты могут быть введены в образец до или после расщепления и функционируют как компенсирующие отклонения, которые встречаются в ходе LC-MS/MS анализа (например, изменения в работе автоматического дозатора, разделениях при LC и MS-ответах). Например, получалимеченную стабильным изотопом версию FSP8, в которой лизин между фенилаланином (F) и тирозином (Y) помечали посредством 13С и 15N.
Исходя из их MS-характеристик, в качестве основного пептида для количественной оценки эмпирически выбирали FSP8 в связи с его наиболее интенсивным ответным сигналом. В дополнение к этому, для количественного подтверждения отслеживали три других пептида, FSP4, FSP5 и FSP3. Каждый из этих четырех пептидов мог быть использован в качестве суррогата для количественной оценки mAb в животных биологических матрицах. В анализе использовали их соответствующие SIL IS (таблица 3). FSP6 может быть использован только в животных матрицах, отличных от яванского макака, поскольку в плазме яванского макака выявляли фоновые помехи при совместном элюировании. Наблюдали относительно более слабую ионизацию у FSP1, FSP5 и FSP2.
с означает цистеиновый остаток, который был алкилирован при помощи йодоацетамида.
ЧЕЛОВЕЧЕСКИЕ И ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА
На фигуре 2 показана тяжелая цепь (SEQ ID NO:17) и легкая цепь (SEQ ID NO:18) трастузумаба (Herceptin®, Genentech Inc.; rhuMAbHER2, Anti p185HER2), полученного рекомбинантным способом гуманизированного моноклонального антитела, регистрационный номер CAS 180288-69-1.
На фигуре 3 показана тяжелая цепь (SEQ ID NO:11) и легкая цепь (SEQ ID NO:19) окрелизумаба, rhuMAb 2H7, PR070769, гуманизированного антитела к CD20, регистрационный номер CAS 637334-45-3.
На фигуре 4 показана тяжелая цепь (SEQ ID NO:20) и легкая цепь (SEQ ID NO:21) пертузумаба, rhuMAb 2C4, регистрационный номер CAS 380610-27-5. У FSP2, FSP3, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:20).
На фигуре 5 показана тяжелая цепь (SEQ ID NO:22) и легкая цепь (SEQ ID NO:23) антитела к PDL1, член расширенного семейства CD28/CTLA-4 Т-клеточных регуляторов. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:22).
На фигуре 6 показана тяжелая цепь (SEQ ID NO:24) и легкая цепь (SEQ ID NO:антитела к нейропилину-1, антитела к NRP1, MNRP1685A. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:24). Антитело к NRP1 представляет собой рекомбинантное, полученное при помощи фага человеческое моноклональное антитело, которое специфично взаимодействует с нейропилином-1 (NRP1), мультидоменным рецептором, который известен как связывающийся с рядом лигандов, в том числе членами семейства VEGF. Антитело к NRP1 продемонстрировало эффективность в комбинации с антителом к VEGF в мышиных моделях ксенотрансплантата и устойчивую нелинейную фармакокинетику в широком диапазоне доз в доклинических испытаниях. В настоящее время в исследованиях I фазы его оценивают в качестве отдельного средства и в комбинации с бевацизумабом с или без паклитакселя.
На фигуре 7 показана тяжелая цепь (SEQ ID NO:26) и легкая цепь (SEQ ID NO:27) антитела к MUC16, DMUC4064A. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:26).
На фигуре 8 показана тяжелая цепь (SEQ ID NO:28) и легкая цепь (SEQ ID NO:19) ритуксимаба, С2 В8, MabThera, (Rituxan®, Genentech Inc., Biogen/Idec). У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:28). Ритуксимаб (RITUXAN®, Genentech/Biogen Idee; MABTHERA®, Roche, REDITUX®, регистрационный номер CAS 174722-31-7) представляет собой генетически сконструированное химерное мышиное/человеческое моноклональное антитело, направленное против антигена CD20. Ритуксимаб представляет собой антитело, называемое в патентном документе US 5736137 "С2В8". Ритуксимаб предназначен для лечения больных с рецидивирующей или резистентной слабо выраженной или фолликулярной CD20-положительной, В-клеточной NHL. Ритуксимаб связывается с CD-20 на клеточной поверхности и приводит к В-клеточному истощению (Cartron et al (2002) Blood 99: 754-758; Idusogie et al (2000) J. Immunol. 164: 4178-4184;  AJ, et al (1999) Semin Oncol; 26: 66-73; US 5736137). РИТУКСАН (US 5677180; US 5736137) представляет собой наиболее широко используемое моноклональное антитело при гематопоэтических злокачественных новообразованиях и признано в повсеместно клинической практике. РИТУКСАН впервые получил одобрение FDA в 1997 году для лечения рецидивирующей или резистентной слабо выраженной или фолликулярной CD20-положительной, В-клеточной не-ходжкинской лимфомы (NHL). В июне 1998 года он также был одобрен в Европейском Союзе под торговым названием MabThera®. В феврале 2006 года РИТУКСАН также получил одобрение FDA в комбинации с метотрексатом для уменьшения признаков и симптомов у взрослых больных с умеренно-тяжело активным ревматоидным артритом, которые давали неадекватный ответ на одно или несколько терапевтических средств-антагонистов TNF. Аминокислотная последовательность антитела ритуксимаб (также обозначаемого С2В8) и иллюстративные способы его получения с помощью рекомбинантной экспрессии в клетках яичника китайского хомячка (СНО) раскрыты в патенте США №5736137.
AJ, et al (1999) Semin Oncol; 26: 66-73; US 5736137). РИТУКСАН (US 5677180; US 5736137) представляет собой наиболее широко используемое моноклональное антитело при гематопоэтических злокачественных новообразованиях и признано в повсеместно клинической практике. РИТУКСАН впервые получил одобрение FDA в 1997 году для лечения рецидивирующей или резистентной слабо выраженной или фолликулярной CD20-положительной, В-клеточной не-ходжкинской лимфомы (NHL). В июне 1998 года он также был одобрен в Европейском Союзе под торговым названием MabThera®. В феврале 2006 года РИТУКСАН также получил одобрение FDA в комбинации с метотрексатом для уменьшения признаков и симптомов у взрослых больных с умеренно-тяжело активным ревматоидным артритом, которые давали неадекватный ответ на одно или несколько терапевтических средств-антагонистов TNF. Аминокислотная последовательность антитела ритуксимаб (также обозначаемого С2В8) и иллюстративные способы его получения с помощью рекомбинантной экспрессии в клетках яичника китайского хомячка (СНО) раскрыты в патенте США №5736137.
ПОДГОТОВКА ОБРАЗЦА
На фигуре 15 показан рисунок захвата mAb из плазмы/сыворотки животного на покрытых стрептавидином магнитных частицах, связанных с биотинилированным зондом захвата, или покрытой белками A, G магнитной частице с последующим выделением путем разделения в магнитном поле, расщеплением захваченного антитела и анализом с помощью LC-MS/MS.
На фигуре 16 изображены варианты осуществления покрытой белками A, G магнитной частицы (сверху) для общего захвата антитела и покрытых стрептавидином магнитных частиц, связанных с биотинилированным зондом захвата (снизу), для специфичного захвата антитела.
Потенциал иммунопреципитации для эффективного и воспроизводимого выделения целевого моноклонального антитела (MAb) с помощью белка А оценивали в двух форматах: (а) связанный с магнитными частицами белок А и (b) нанесенный на 96-луночный микротитровальный планшет белок А. В предварительном тесте микротитровальный планшет с белком А был слишком ограничен по емкости по сравнению с магнитными частицами с белком А при захвате общей наносимой загрузки эндогенных IgG вместе с целевым Mab, в частности из плазмы крови мартышки. Для оценки выделения FSP как из обработанной литиевой солью/гепарином плазмы крови яванского макака, так и из обработанной литиевой солью/гепарином плазмы крови крысы Спрага-Доули было выбрано расщепление на частицах с помощью магнитных частиц с белком А. Также тестировали расщепление цельной плазмы крови с последующей твердофазной экстракцией, и было обнаружено, что оно менее эффективно при устранении помех от фонового шума.
РАЗДЕЛЕНИЕ И АНАЛИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ
Для оценки специфичности FSP, чувствительности выявления и воспроизводимости исследовали два подхода: (1) расщепление/SPE (твердофазная экстракция) цельной плазмы и (2) иммунопреципитация (IP).
Образцы плазмы крови мартышки (яванского макака) и крысы (n=10 лотов каждого вида) оценивали для определения специфичности от лота к лоту, возможных влияний помех и воспроизводимости. Помимо холостого контроля с плазмой крови, холостые образцы плазмы крови обогащали, т.е. в них "вносили", 20 мкг/мл трастузумаба. Набор калибровочных образцов трастузумаба, варьирующий от 1 до 1000 мкг/мл трастузумаба, готовили в матрице объединенной плазмы крови и прогоняли параллельно с отдельными образцами плазмы крови мартышки и крысы.
На фигуре 12 показана калибровочная кривая трастузумаба (с применение FSP8 в качестве суррогата), внесенного с различными концентрациями от 1 до 1000 мкг/мл в обработанную литиевой солью гепарина плазму крови яванского макака, которая была получена при помощи методики расщепления/SPE цельной плазмы крови. Меченные стабильным изотопом внутренние стандарты (IS) пептидов готовили в 20% ацетонитриле с получением рабочего раствора внутреннего стандарта, содержащего соответствующие концентрации.
На фигуре 14 показаны стадии иммунопреципитации (IP) моноклональных антител и образование соответствующих каркасных сигнатурных пептидов (FSP) в плазме или сыворотке крови животного. Протоколы приведены в примерах 1-4.
Образцы животных готовили с помощью иммунопреципитации (IP) с помощью парамагнитных частиц с белком А с последующим расщеплением трипсином. В 96-луночный микротитровальный планшет с коническим дном (VWR Scientific) помещали аликвоту из 25 мкл разбавленной плазмы или сыворотки крови [разведение 1:2 объем/объем буфером для внесения (SN1) 0,1:5,0:3,0:0,2:91,7:0,1 твина 20 / тризмы гидрохлорида (1 М) / хлорида натрия (5 М) / ЭДТА (0,5 М) / воды / BSA, объем/объем/объем/объем/объем/масса] вместе с 125 мкл буфера для внесения. Аликвоту из 25 мкл предварительно промытых и ресуспендированных в буфере для внесения магнитных частиц с белком А добавляли в каждую лунку. Затем смесь инкубировали при комнатной температуре (RT) в течение 120 минут при постоянном помешивании для осуществления захвата mAb. Отбрасывали супернатант и частицы тщательно промывали в промывочном буфере (SN2) из 5,0:3,0:0,2:91,8 тризмы гидрохлорида (1 М) / хлорида натрия (5 М) / ЭДТА (0,5 М) / воды, объем/объем/объем/объем. Промывание и разделение в магнитном поле осуществляли с помощью, соответственно, устройства для промывания микротитровальных планшетов (BioTek, Вермонт, США) и плоского магнита для 96-луночного планшета (Biotek). Процесс промывания/разделения также можно было осуществить с помощью процессора магнитных частиц серии KingFisher для 96 образцов (Thermo Scientific).
После иммунопреципитации (IP) 25 мкл аликвоту рабочего раствора IS вносили в каждую лунку за исключением лунок для холостых проб, в которые вместо этого добавляли 25 мкл 25% ацетонитрила. Добавляли аликвоты 75 мкл раствора RapiGest (0,05:37,5:10 порошка RapiGest /50 мМ бикарбоната аммония/ацетонитрила, масса/объем/объем) и 10 мкл 0,1 М ДДТ. Планшет накрывали клейкой герметизирующей пленкой (VWR Scientific) и аккуратно покачивали в течение примерно 1 минут с последующей инкубацией при 60°С в течение 60 минут. Добавляли объем 25 мкл йодуксусной кислоты (0,1 М), а планшет накрывали алюминиевой фольгой и инкубировали при комнатной температуре в течение примерно 30 минут в защищенном от света месте. В каждую лунку добавляли 10 мкл раствора трипсина (0,250 мг/мл) и планшет затем инкубировали при 37°С в течение примерно 90 минут. Расщепление останавливали путем добавления 15 мкл 2 М HCl в каждую лунку и инкубированием планшета при 37°С в течение 30 минут. Образцы затем переносили с помощью устройства от компании Tomtec (Коннектикут, США) на плоский фильтр для высокопроизводительного скрининга HTS (0,45 мкм, Millipore), помещенный поверх 96-луночного планшета для сбора с коническим дном, и центрифугировали в течение 5 минут при 3000 об./мин. для сбора фильтрата. Планшет для сбора запечатывали и 20 мкл объем фильтрата вводили непосредственно на LC-MS/MS.
ELISA и LC-MS/MS
ELISA (фигура 19а) и LC-MS/MS (фигура 19b) сравнивали при измерении общего антитела в плазме крови крысы после введения однократной дозы антитела. На фигуре 19а показан рисунок моноклонального антитела (mAb-терапевтического средства), захваченного путем связывания с иммобилизированным внеклеточным доменом (ECD) или поликлональным антителом к IgG человека и выявляемого при помощи меченного пероксидазой хрена (HRP) поликлонального антитела к IgG человека в анализе ELISA при помощи электрохемилюминисцентного, колориметрического выявления или выявления с применением хромофорного субстрата.
Жидкостное хроматографическое разделение осуществляли с помощью либо двойной системы HP Agilent 1100 Series LC, либо двойной системы Shimadzu LC-10ADvp с колонкой для обращенно-фазовой хроматографии BioSuite С 18 РА-А (2,1×50 мм, 3 мкм, Waters), используемой со скоростью потока 200 мкл/мин. Температуру колонки поддерживали на уровне 50°С с помощью нагревателя колонки (Analytical Sales and Products, Нью-Джерси, США). Подвижная фаза состояла из А: 0,1% муравьиная кислота в воде, и В: 0,1% муравьиная кислота в ацетонитриле/метаноле (75:25, объем/объем). Градиентное состояние поддерживали с 5% В в течение 0,4 мин линейно меняли до 40% за 3,4 мин, затем повышали до 95% В за 1 мин, удерживали на уровне 95% В в течение 0,5 мин перед возвращением назад до 5% В за 0,1 мин и поддерживали на этом уровне в течение 0,5 мин для снижения возможных примесей. Наконец, градиент возвращали до 5% В за 1 мин и повторно уравновешивали на уровне 5% В в течение 0,9 мин Общее время LC-хроматографирования составляло 7,5 мин Образцы вводили с помощью автоматического дозатора СТС HTS PAL (LEAP Technologies, Северная Каролина, США) с петлей-дозатором объемом 20 мкл. Промывочный раствор 1 автоматического дозатора представлял собой ацетонитрил/изопропанол/трифторэтанол/метанол/вода/муравьиная кислота (60:15:15:5:5:0,2 по объему), а промывочный раствор 2 представлял собой вода/ацетонитрил/муравьиная кислота (95:5:0,2 по объему).
Для количественной оценки использовали тройной квадрупольный масс-спектрометр Sciex API 4000® (АВ Sciex, Калифорния, США), оснащенный турбоэлектрическим ионизатором. MS-прибор запускали в режиме определения положительных ионов с исходной температурой, выставленной на 500°С, и напряжением ионораспыления 5000 В. Параметры газа выставляли следующие: газовая завеса - 25, газ для распыления - 45 и вспомогательный газ - 40. Использовали параметр газ для соударений - 10. Подробности переходов в мониторинге множественных реакций (MRM) для сигнатурных пептидов и их соответствующих внутренних стандартов приведены в таблице. Время выдержки выставляли на 50 мс для каждого MRM-перехода и применяли одинаковое напряжение на входе, величиной 10 В. Разрешения как на Q1, так и на Q3 выставляли на единицу. Количественную оценку осуществляли с помощью алгоритма Intelliquan по площади пика.
* означает аминокислоту, содержащую стабильную изотопную метку 13С5 и 15N1.
Способ количественной оценки выполняли с применением трастузумаба в качестве модели. Калибровочные стандарты готовили путем внесения трастузумаба в плазму крови яванского макака или плазмы крови крысы Спрага-Доули в количестве 1,00, 1,75, 3,00, 10,0, 25,0, 75,0, 200 и 250 мкг/мл. Кош-роли качества (QC) готовили в количестве 1,00 (LLOQ), 2,50 (LQC), 15,0 (MQC) и 190 мкг/мл (UQC) трастузумаба в плазме крови. Кроме того, включали 10-кратное разведение QC от начальной концентрации 1000 мкг/мл. Внутренние QC результатов анализа готовили в 6 повторах, QC правильности разведения готовили в 3 повторах. Данные количественной оценки способа приводятся в таблице 5. Данные показывают, что LC-MS/MS анализ характеризуется хорошей точностью и достоверностью со значениями в пределах ранее установленных критериев приемлемости.
На фигуре 17а показано выявление 1 мкг/мл (LLOQ) антитела трастузумаба в плазме крови крысы с применением FSP8 в качестве суррогата, с внутренним стандартом, представляющим собой меченный стабильным изотопом FSP8 (фигура 17b), выявляемым с таким же временем удержания. Образцы готовили согласно протоколу из примера 4. На фигуре 18 продемонстрирована хорошая линейность от 1 до 250 мкг/мл трастузумаба в плазме крови крысы.
На фигуре 20 показаны отдельные графики зависимости концентрации от времени у крыс (1А, 1В, 1C), которым ввели болюсную дозу 2 мг/кг трастузумаба, mAb к HER2. Образцы плазмы крови через 28 часов после введения дозы анализировали с помощью LC-MS/MS (фигура 19b) и ELISA (фигура 19а) анализов. Наблюдали хорошую согласованность между двумя способами анализа. На фигуре 20 приведены следующие ФК параметры:
На фигуре 21 показаны отдельные графики зависимости концентрации от времени у крыс (2D, 2Е, 2F), которым ввели болюсную дозу 2 мг/кг 3А5, mAb к MUC 16. Образцы плазмы крови через 28 часов после введения дозы анализировали с помощью LC-MS/MS (фигура 19b) и ELISA (фигура 19а) анализов. Наблюдали хорошую согласованность между двумя способами. На фигуре 21 приведены следующие ФК параметры:
На фигуре 22 показаны результаты, полученные от крыс (3G, 3Н, 3I), которым ввели болюсную дозу 2 мг/кг mAb к мезотелину (Msln). Образцы плазмы крови анализировали через 28 часов после введения дозы с помощью LC-MS/MS (фигура 19b) и ELISA (фигура 19а) анализов. Наблюдали хорошую согласованность между двумя способами. На фигуре 22 приведены следующие ФК параметры:
На фигуре 23 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе средних фармакокинетических параметров (ФК) образцов плазмы/сыворотки крови яванского макака, которому были введены дозы 3А5, mAb к MUC 16, путем измерения антитела в крови на протяжении 28 дней. На фигуре 23 приведены следующие ФК параметры:
Все значения представляют собой среднее±среднее квадратичное отклонение (SD)
На фигуре 24 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе средних фармакокинетических параметров (ФК) образцов плазмы/сыворотки крови яванского макака, которому были введены дозы mAb к мезотелину (Msin), путем измерения антитела в крови на протяжении 42 дней. На фигуре 24 приведены следующие ФК параметры:
Все значения представляют собой среднее±среднее квадратичное отклонение (SD)
На фигуре 25 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови мышей (А, В, С), которым были введены дозы конъюгата антитела-лекарственного средства (ADC), anti-LY6E-MC-vc-PAB-MMAE, который характеризуется следующей структурой:
 ,
,
где АЬ представляет собой антитело к LY6E, соединенное через аминокислоту цистеин с малеимидокапроильной (МС) группой линкера, а р означает количество лекарственных частей (ММАЕ) на антитело в молекуле ADC. Диапазон р в типичной смеси ADC составляет от приблизительно 0 до приблизительно 20 или от приблизительно 0 до приблизительно 8. Если р равно 0, то может присутствовать некоторое количество голого, неконъюгированного антитела. Средний груз лекарственного средства может составлять от приблизительно 2 до приблизительно 5 или от приблизительно 3 до приблизительно 4. Таким образом, типичный препарат конъюгата антитело-лекарственное средство (ADC) представляет собой гетерогенную смесь соединений с антителами, конъюгированными с некоторым количеством лекарственных частей, таких как ММАЕ. Линкер также включает чувствительное к распознаванию катепсином валин-цитруллиновое (Val-Cit) дипептидное звено и пара-аминобензилоксиметильное (РАВ) звено (US 7659241; US 7498298; Doronina et al. (2006) Bioconjugate Chem. 17:114-124; и Doronina et al. (2003) Nat. Biotech. 21:778-784).
Лекарственная часть ММАЕ (ведотин, (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((1S,2R)-1-гидрокси-1-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-N,3-диметил-2-((S)-3-метил-2-(метиламино)бутанамидо)бутанамид, регистрационный номер CAS 474645-27-7) представляет собой монометилауристатиновый аналог доластатина (US 5635483; US 5780588), соединенный при помощи его N-конца с антителом. ММАЕ имеет структуру:
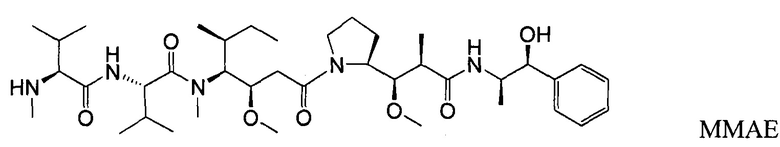 .
.
ФК-профили и параметры по результатам двух способов анализов (LC-MS/MS и ELISA) из эксперимента с дозировкой антитела на фигурах 23-28 демонстрируют высокую согласованность, что указывает на то, что количественная оценка mAb у животных, в том числе яванских макаков, крыс и мышей, посредством однократного общего LC-MS/MS анализа с применением общих каркасных сигнатурных пептидов в качестве суррогатов является реальной и дает робастные результаты. Подход на основе однократной MS может дать надежные ФК данные, для получения которых в ином случае необходимо множество анализов ELISA. Кроме того, MS-подход не нуждается в каких-либо специфических реактивах, что может помочь ускорить процесс разработки способа и сделать возможной оценку ФК на ранних стадиях разработки лекарственного средства.
АНАЛИЗ ДАННЫХ
Калибровочные кривые строили в иммунопреципитационном подходе для: DWYIHWVR (SEQ ID NO:9), FSP3, FSP4, FSP5, FSP8 (все как для мартышки, так и для крысы) и NQVSLTCLVK (SEQ ID NO:10) (только для крысы), и в подходе расщепления/SPE цельной плазмы для: FSP4, FSP5, FSP8 (все как для мартышки, так и для крысы). Получали данные по специфичности для холостых и с внесенной пробой образцов плазмы крови. В качестве критерия воспроизводимости расщепления были взяты отношения площадей и соответствующие CV (коэффициент вариации) для различных пептидов в отношении FSP8 (кандидат на основную количественную оценку). Квадратичную (1/конц.2 взвешенная) регрессию использовали для аппроксимации данных,
В подходе расщепления/SPE цельной плазмы крови для обработки образцов плазмы крови мартышки (пример 3b) FSP8 является наиболее чувствительным пептидом. На фигуре 13 показаны LC-MS/MS хроматограммы, демонстрирующие выявление FSP8, внесенного в обработанную литиевой солью гепарина плазму крови яванского макака, при LLOQ (нижний предел количественной оценки) = 1 мкг/мл после получения образца расщепления/SPE цельной плазмы крови. В холостой пробе присутствуют пики на 4,47 и 5,20 минутах. FSP8 имеет время удержания, составляющее 4,66 минуты. Единственными отличными пептидами, поддающимися количественной оценке при низких концентрациях, являются FSP4 и FSP5. Однако, их соотношение сигнал/шум (s/n) при уровне LLOQ 1 мкг/мл составляет менее (<) 5. Как и ожидалось, пептид NQVSLTCLVK (SEQ ID NO: 10) демонстрировал высокие эндогенные фоновые уровни во всех образцах плазмы крови мартышки. Девять из десяти отдельных протестированных лотов имели похожую и приемлемую специфичность. Лот №5 имел нетипичный фоновый уровень для всех поддающихся количественной оценке пептидов. Картина наводит на мысль, что он может быть загрязнен некоторым количеством плазмы крови человека. В общем, образцы с (т.е. внесенным) FSP демонстрировали хорошую точность и достоверность для всех лотов FSP8, потенциального сигнатурного пептида для основной количественной оценки (исключение: FSP7 с 27% CV). Соотношения площади пиков у FSP4 и FSP5 при сравнении с FSP8 демонстрировали CV менее 20% среди различных образцов и типов образцов.
В подходе расщепления/SPE цельной плазмы крови для обработки образцов плазмы крови крысы (пример 3b) FSP8 является наиболее восприимчивым пептидом. Отличными пептидами, поддающимися количественной оценке при низких уровнях концентрациях, являются FSP4 и FSP5. Однако, s/n для этих пептидов на уровне LLOQ составляет менее 5. Калибровочные кривые демонстрировали расщепленную природу, возможно вследствие подавления сигнала у образцов, которые были введены позднее. Ни один из отдельных протестированных лотов не имел поддающихся количественной оценке фоновых пиков для всех пептидов. Вследствие расщепленной кривой образцы FSP демонстрировали крайне изменчивые значения точности и достоверности. Соотношения площади пиков у FSP4 и FSP5 в отношении FSP8 в большинстве случаев демонстрировали CV более 20%, вновь указывая на вариабельность результатов анализа.
В иммунопреципитационном подходе для обработки образцов плазмы крови мартышки (пример 4) FSP8 является наиболее чувствительным, т.е. восприимчивым пептидом. Все другие пептиды также поддаются количественной оценке на низких уровнях концентраций. Для всех пептидов s/n на уровне LLOQ составляет более 5 (за исключением FSP2). Как и ожидалось, пептид NQVSLTCLVK (SEQ ID NO: 10) демонстрировал фоновые уровни для всех образцов плазмы крови мартышки. Взаимосвязь концентрации и ответа демонстрировала некоторую нелинейность при высоких концентрациях, возможно вследствие насыщения магнитными частицами с белком А и/или в результате конкуренции с эндогенными IgG яванского макака. Из 10 отдельных протестированных лотов образцы из лота №5 имели фоновые пики для всех поддающихся количественной оценке пептидов со сходным уровнем, за исключением пептида вариабельного участка DTYIHWVR (SEQ ID NO: 9). В целом, образцы FSP демонстрировали хорошую точность и достоверность для всех лотов FSP8 (включая лот №5, если брать в учет фоновую концентрацию холостой пробы). Соотношения площадей пиков у почти всех пептидов демонстрировали CV менее 15% среди различных образцов и типов образцов (за исключением FSP5 с CV для CALS приблизительно 23%).
В иммунопреципитационном (IP) подходе для обработки образцов плазмы крови крысы (пример 4) FSP8 является наиболее восприимчивым пептидом. Все остальные пептиды также поддаются количественной оценки при низких уровнях концентрации. Для всех остальных пептидов s/n на уровне LLOQ составляет более 5 (за исключением FSP2). Взаимосвязь концентрации и ответа демонстрировала более хорошую линейность, чем данные по иммунопреципитации (IP) мартышки, возможно вследствие меньшей конкуренции со стороны менее аффинных эндогенных IgG в плазме крови крысы. Ни один из отдельных протестированных лотов не имел поддающихся количественной оценке фоновых пиков для всех пептидов. В целом, образцы FSP демонстрировали хорошую точность и достоверность для всех лотов FSP8. Соотношения площадей пиков у почти всех пептидов демонстрировали CV менее 20% среди различных образцов и типов образцов (за исключением FSP5 и FSP2 с CV для CALS более (>) 24%).
Выделение с помощью иммунопреципитации (IP) с применением магнитных частиц с белком А демонстрировало более хорошую чувствительность и воспроизводимость, чем выделение с помощью расщепления/SPE цельной плазмы крови. IP подход был быстрее и "чище", чем подход с расщепление/SPE цельной матрицы.
Примеры
Пример 1 Простая процедура расщепления цельной плазмы крови и экстракции
1. Аликвоту 10 мкл (цитрата натрия) плазмы крови поместить в планшет Lo-bind.
2. Добавить 95 мкл 10 мМ раствора ДДТ в 50 мМ бикарбонате аммония.
3. Перемешать и инкубировать при 60°С в течение 60 минут.
4. Добавить 20 мкл 100 мМ йодоацетамида (IAA) в 50 мМ бикарбонате аммония.
5. Инкубировать в темноте при комнатной температуре в течение 30 минут.
6. Оставить на свету на 20 минут.
7. Добавить 15 мкл 500 мкг/мл раствора трипсина в 50 мМ бикарбонате аммония.
8. Инкубировать в течение ночи при 37°С
9. Добавить 15 мкл 1% раствора муравьиной кислоты. Перемешать и центрифугировать.
10. Анализировать с помощью LC-MS/MS (20 мкл инъекция, при 0,7 мл/мин UPLC).
Пример 2. Протокол твердофазной экстракции для планшета MAX/WCX microElution® (Waters Corp.).
1. Смешать 600 мкл расщепленной сыворотки/плазмы крови со 100 мкл 8% H3PO4.
2. Кондиционировать планшет для SPE MAX/WCX μElution (Waters Corp., Милфорд Массачусетс) посредством 200 мкл МеОН.
3. Уравновесить планшет для SPE MAX/WCX μElution при помощи 200 мкл H2O.
4. Загрузить разбавленную расщепленную сыворотку/плазму крови на планшет для SPE MAX/WCX μElution (2×350 мкл аликвоты). Воздействовать достаточным вакуумом перед каждым добавлением для того, чтобы сделать возможным покапельное прохождение образца через слой.
5. Промыть при помощи 200 мкл 5% NH4OH.
6. Промыть при помощи 200 мкл 20% ACN (ацетонитрила).
7. Элюировать под умеренным вакуумом при помощи (2×25 мкл) 5:25:1 ацетонитрил/вода/TFA, объем/объем/объем в полипропиленовый планшет с 96-позициями, 2,0 мл, прямоугольными лунками с коническим дном.
8. Добавить 200 мкл воды и запечатать планшет пурпурным матом для запечатывания и встряхивать на вортексе примерно 30 с.
9. Ввести 25 мкл на LC/MS/MS систему 4000 QTRAP® (AB Sciex, Фостер Сити, Калифорния, США).
Пример 3а. Процедура расщепления цельной плазмы №1
1. Аликвоту 10 мкл плазмы крови поместить в планшет Lo-bind.
2. Добавить 95 мкл 10 мМ раствора ДДТ в 50 мМ бикарбонате аммония.
3. Перемешать и инкубировать при 60°С в течение 60 минут.
4. Добавить 20 мкл 100 мМ йодоацетамида в 50 мМ бикарбонате аммония.
5. Инкубировать в темноте при комнатной температуре в течение 30 минут.
6. Оставить на свету на 20 минут.
7. Добавить 15 мкл 500 мкг/мл трипсина в 50 мМ бикарбонате аммония.
8. Инкубировать в течение ночи при 37°С.
9. Добавить 15 мкл 1% раствора муравьиной кислоты. Перемешать и центрифугировать.
10. Анализировать с помощью LC-MS/MS.
Пример 3b. Расщепление/SPE (твердофазная экстракция) цельной плазмы крови - протокол №2
1. Смешать 25 мкл образца плазмы крови со 100 мкл раствором поверхностно-активного вещества SF RapiGest™ (Waters Corp., Милфорд, Массачусетс МА) (0,05:40:10 КарЮе51™/ацетат аммония, 50 мМ / ACN, масса/объем/объем). Добавить дополнительные 400 мкл разбавителя RapiGest™ (80:20 ацетат аммония, 50 мМ / ACN, объем/объем).
2. Добавить 10 мкл ДДТ (1 М). Инкубировать при 60°С в течение приблизительно 1 часа.
3. Добавить 25 мкл IAA (1 М). Инкубировать при RT в течение приблизительно 0,5 часа в защищенном от света месте.
4. Добавить 20 мкг трипсина. Инкубировать при 37°С в течение приблизительно 16 часов.
5. Добавить другую 20 мкг дозу трипсина. Инкубировать при 37°С в течение приблизительно 4 часов.
6. Добавить 50 мкл 6 М HCl. Инкубировать при 37°С в течение приблизительно 0,5 часов.
7. Подвергнуть 500 мкл расщепленной цельной плазмы крови SPE с применением планшета MAX μElution Oasis® ((Waters Corp., Милфорд, Массачусетс)).
8. Смешать 500 мкл расщепленной плазмы крови со 100 мкл 8% H3PO4.
9. Кондиционировать планшет для SPE MAX μElution Oasis® при помощи 200 мкл МеОН.
10. Уравновесить планшет для SPE MAX μElution Oasis® при помощи 200 мкл H2O.
11. Загрузить разбавленную расщепленную плазму крови на планшет для SPE MAX μElution Oasis® (2×300 мкл аликвоты). Воздействовать достаточным вакуумом для того, чтобы сделать возможным покапельное прохождение образца через слой.
12. Промыть при помощи 200 мкл 5% NH4OH.
13. Промыть при помощи 200 мкл 20% ацетонитрила.
14. Элюировать под умеренным вакуумом при помощи (2×25 мкл) 75:25:1 ацетонитрил/вода/TFA, объем/объем/объем.
15. Добавить 200 мкл воды и запечатать планшет. Встряхивать на вортексе примерно 30 с.
16. Конечный объем SPE-элюата составляет примерно 250 мкл. Непосредственно ввести 25 мкл этого экстракта.
Пример 4 Протокол иммунопреципитации
1. Аккуратно перемешать суспензию частиц с белком А так, чтобы все частицы были равномерно суспендированы.
2. Отобрать пипеткой необходимый объем суспендированных частиц в полипропиленовую пробирку. С помощью внешнего магнита отделить частицы от буфера для хранения и аккуратно удалить с помощью пипетки буфер для хранения, не затрагивая частицы, (примечание: рассчитать необходимый объем частиц из расчета 25 мкл объема частиц, необходимого на лунку).
3. Добавить объем буфера SN1 в полипропиленовую пробирку, равный начальному объему частиц. Быстро встряхнуть на вортексе так, чтобы частицы ресуспендировались в буфере SN1.
4. Еще раз с помощью внешнего магнита отделить частицы от буфера SN1 и аккуратно удалить буфер для хранения, не затрагивая микроносители.
5. Повторить стадии 3-4 еще два раза.
6. После промывания частиц снова добавить объем буфера SN1, равный начальному объему частиц. Быстро встряхнуть на вортексе так, чтобы частицы ресуспендировались в буфере SN1. Раствор промытых частиц необходимо готовить свежим в день применения. Его следует хранить при 2-4° в случае, если не использован в течение часа от промывки.
7. Встряхнуть на вортексе образец плазмы крови и отобрать 25 мкл аликвоту в микроцентрифужную пробирку.
8. Разбавить образец плазмы крови посредством 50 мкл буфера SN1. Быстро встряхнуть на вортексе.
9. Отобрать 25 мкл аликвоту образца разбавленной плазмы крови в 96-луночный микротитровальный планшет.
10. В каждую лунку добавить 125 мкл буфера SN1.
11. В каждую лунку добавить 25 мкл промытых частиц с белком А (из стадии 6). Убедиться, чтобы частицы хорошо суспендированы в растворе перед добавлением.
12. Закрыть планшет клейкой герметизирующей пленкой и аккуратно покачивать на шейкере для титровального планшета в течение примерно двух часов при комнатной температуре.
13. С помощью внешнего магнита и устройство отмывки иммунологических планшетов отделить магнитные частицы и удалить несвязавшиеся белки в супернатанте. Три раза промыть частицы с помощью буфера SN2 с применением устройства отмывки иммунологических планшетов. Убедиться, чтобы частицы были хорошо суспендированы в растворе перед каждой стадией промывки путем покачивания на шейкере для титровального планшета.
14. Добавить 25 мкл рабочего раствора внутреннего стандарта в каждую лунку за исключением холостых проб без внутреннего стандарта. Добавить 25 мкл разбавителя для рабочего раствора внутреннего стандарта в лунки, содержащие холостые пробы без внутреннего стандарта.
15. В каждую лунку добавить 75 мкл раствора RapiGest.
16. В каждую лунку добавить 10 мкл 0,1 М ДДТ. Закрыть планшет клейкой герметизирующей пленкой и аккуратно покачивать на шейкере для титровального планшета в течение примерно 1 минуты.
17. Инкубировать планшет при 60°С в предварительно прогретом термостате в течение примерно одного часа.
18. В каждую лунку добавить 25 мкл 0,1 М IAA. Закрыть планшет клейкой герметизирующей пленкой и аккуратно покачивать на шейкере для титровального планшета в течение примерно 1 минуты. Эти стадии необходимо проводить в защищенном от света месте. Закрыть планшет алюминиевой фольгой и инкубировать при комнатной температуре в течение примерно 30 минут.
19. В каждую лунку добавить 10 мкл раствора трипсина. Закрыть планшет клейкой герметизирующей пленкой и аккуратно покачивать на шейкере для титровального планшета в течение примерно 1 минуты.
20. Инкубировать планшет при 37°С в предварительно прогретом инкубаторе в течение примерно 90 минут.
21. В каждую лунку добавить 15 мкл 2 М HCl. Закрыть планшет клейкой герметизирующей пленкой и аккуратно покачивать на шейкере для титровального планшета в течение примерно 1 минуты.
22. Инкубировать планшет при 37°С в предварительно прогретом инкубаторе в течение 30 минут.
23. Аккуратно покачивать планшет на шейкере для титровального планшета в течение примерно 1 минуты. С помощью системы Tomtec перенести раствор из каждой лунку на плоский фильтр для высокопроизводительного скрининга HTS, помещенный поверх 96-луночного планшета для сбора с коническим дном.
24. Центрифугировать комбинацию плоский фильтр для высокопроизводительного скрининга HTS/96-луночный планшет для сбора с коническим дном в течение 5 минут при 3000 об./мин для сбора фильтрата в 96-луночный планшет для сбора с коническим дном.
25. Запечатать 96-луночный планшет для сбора с коническим дном желтым матом для инъекций и непосредственно вводить инъекцией.
Буфер SN1: 0,1:5,0:3,0:0,2:91,7:0,1 твин 20/тризмы гидрохлорид (1 М)/хлорид натрия (5 М)/ЭДТА (0,5 М)/вода/бычий сывороточный альбумин, объем/объем/объем/объем/масса. Раствор готовили путем объединения 1 мл твин 20, 50,0 мл 1 М тризмы гидрохлорида, 30 мл 5 М раствора хлорида натрия, 2 мл 0,5 М ЭДТА и 1,00 г бычьего сывороточного альбумина в 1 л мерной колбе. Объем затем доводили водой и хорошо перемешивали для растворения бычьего сывороточного альбумина. Его хранили в закрытой емкости при 2-8°С в течение до одного месяца.
Буфер SN2: 5,0:3,0:0,2:91,8 тризмы гидрохлорид (1 М)/хлорид натрия (5 М)/ЭДТА (0,5 М)/вода, объем/объем/объем/объем. Раствор готовили путем объединения 50,0 мл 1 М тризмы гидрохлорида, 30 мл 5 М раствора хлорида натрия и 2 мл 0,5 М ЭДТА в 1 л мерной колбе. Объем затем доводили при помощи воды хорошо перемешивали. Его хранили в закрытой емкости при 2-8°С в течение до одного месяца.
Иллюстративный HPLC способ №2:
Колонка: Waters BioSuite С 18 РА-А, 3 мкм, 2,1×50 мм (деталь №188002425).
Подвижная фаза А: 0,1:100 муравьиная кислота/вода, объем/объем.
Подвижная фаза В: 0,1:75:25 муравьиная кислота/ацетонитрил/метанол, объем/объем/объем.
Скорость потока: 0,20 мл/мин. Градиент:
Условия MS/MS
Несмотря на то, что приведенное выше изобретение было довольно подробно описано посредством иллюстрации и примера для ясности понимания, описание и примеры не следует толковать как ограничивающие объем настоящего изобретения.
Описание всей процитированной в настоящем документе патентной и научной литературы безоговорочно включено в его полном объеме при помощи ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2626537C2 |
| ВЕЩЕСТВА И СПОСОБЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРЕДУПРЕЖДЕНИИ И/ИЛИ ЛЕЧЕНИИ БОЛЕЗНИ ГЕНТИНГТОНА | 2015 |
|
RU2742493C2 |
| ПИРРОЛОБЕНЗОДИАЗЕПИНОВЫЕ КОНЪЮГАТЫ | 2017 |
|
RU2744200C2 |
| КОНЪЮГАТЫ МЕЧЕННЫХ РАДИОАКТИВНЫМ ЦИРКОНИЕМ СКОНСТРУИРОВАННЫХ АНТИТЕЛ С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ | 2010 |
|
RU2562862C2 |
| АНТИТЕЛА ПРОТИВ CD20 И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2573994C2 |
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2755066C2 |
| СПОСОБ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ ПУТЕМ ИНГИБИРОВАНИЯ MASP-2 ЗАВИСИМОЙ АКТИВАЦИИ КОМПЛЕМЕНТА | 2010 |
|
RU2600876C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| ИММУНОТЕРАПЕВТИЧЕСКОЕ ЛЕЧЕНИЕ | 2006 |
|
RU2454428C2 |

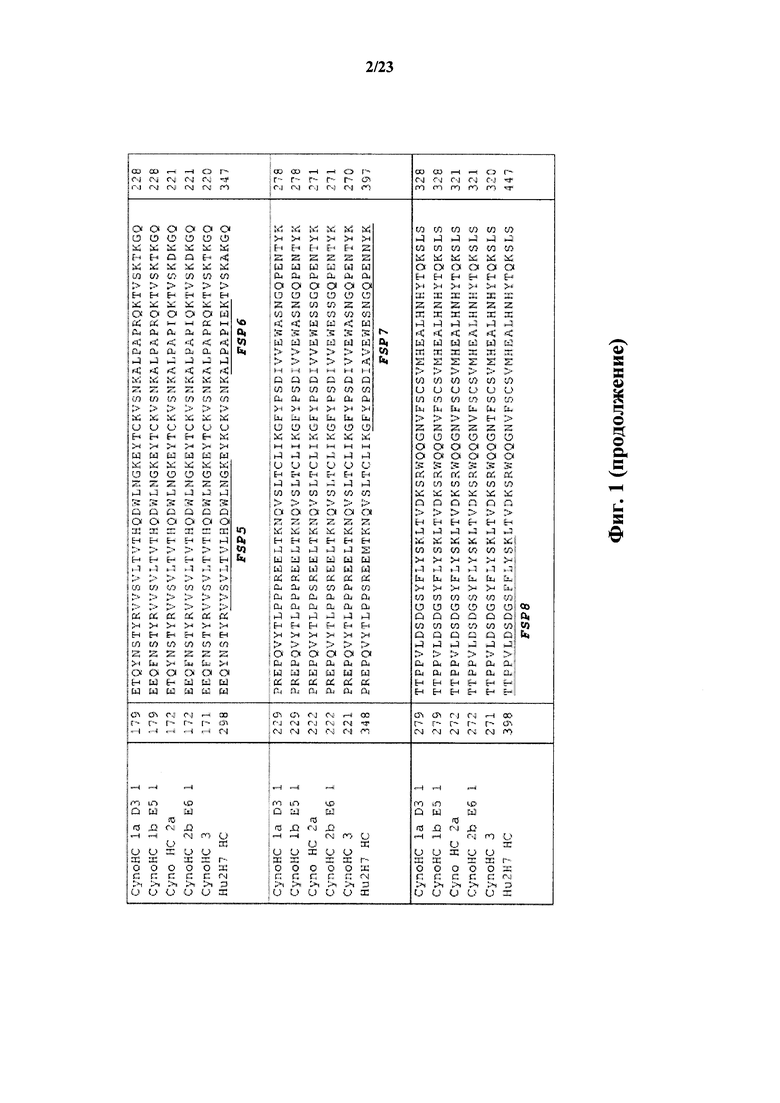





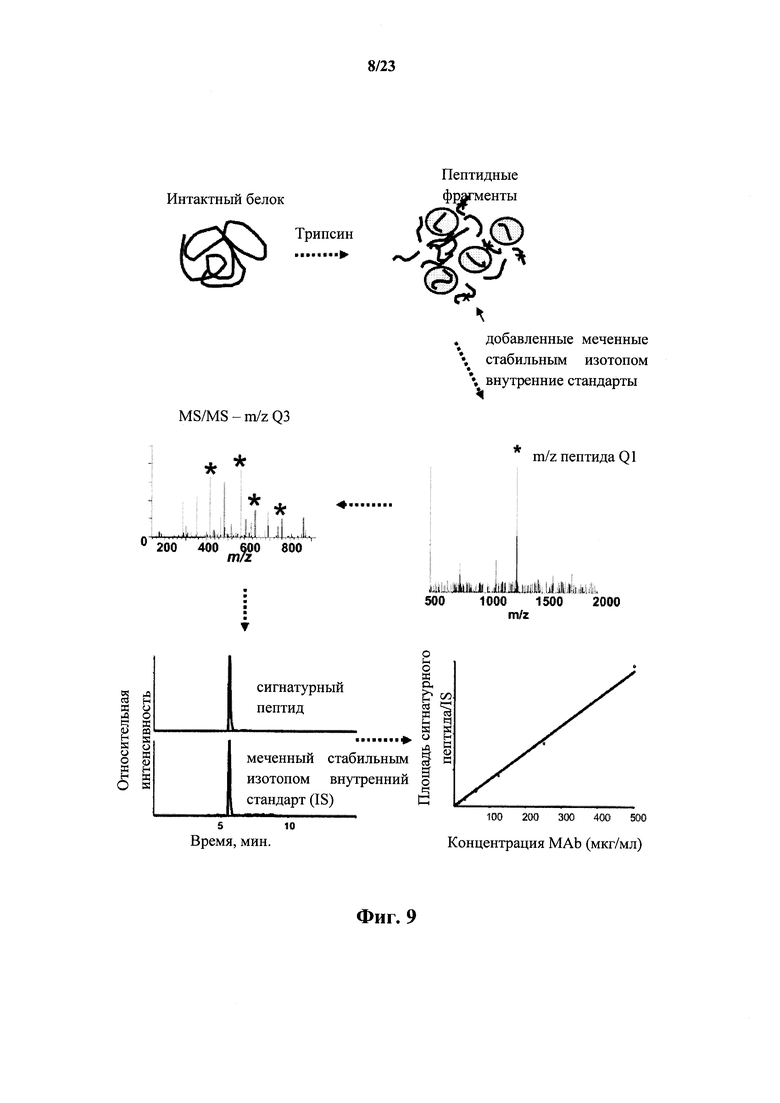
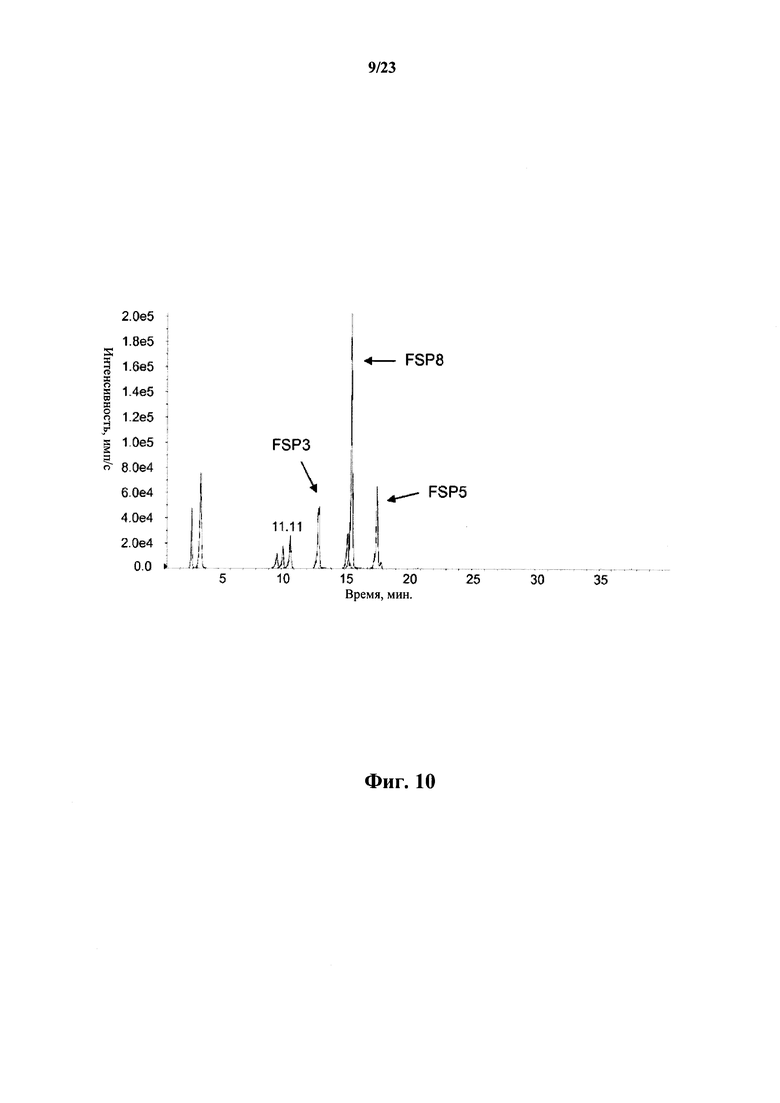
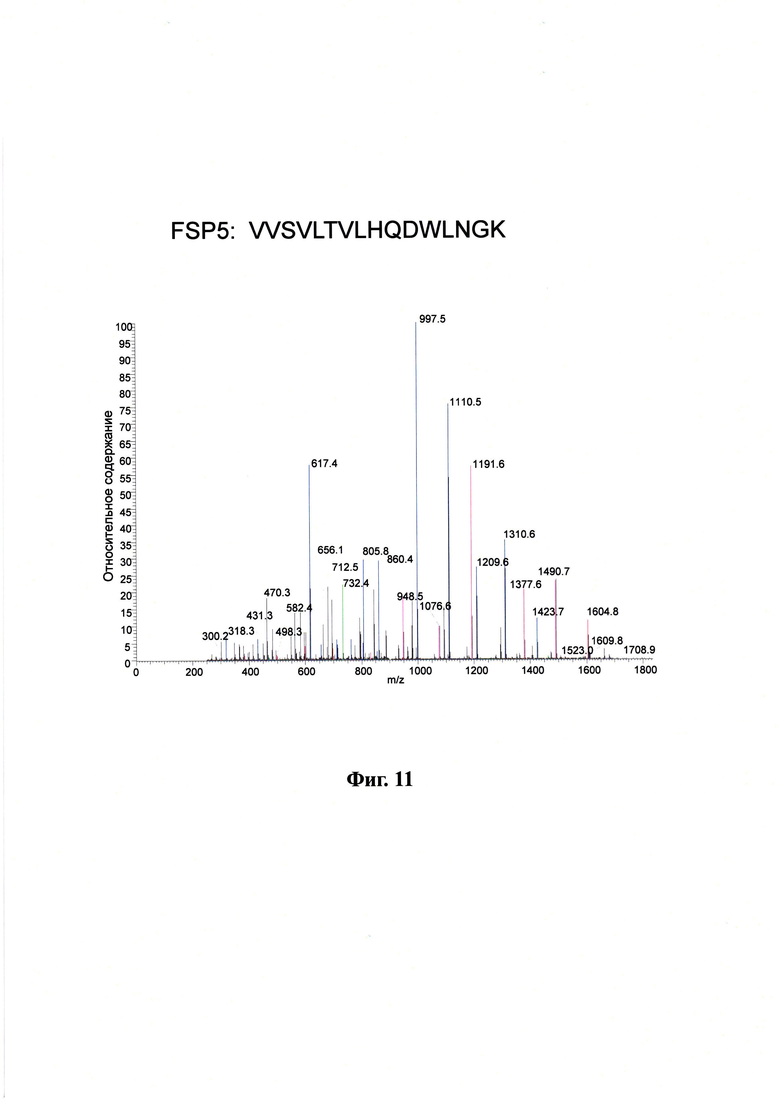
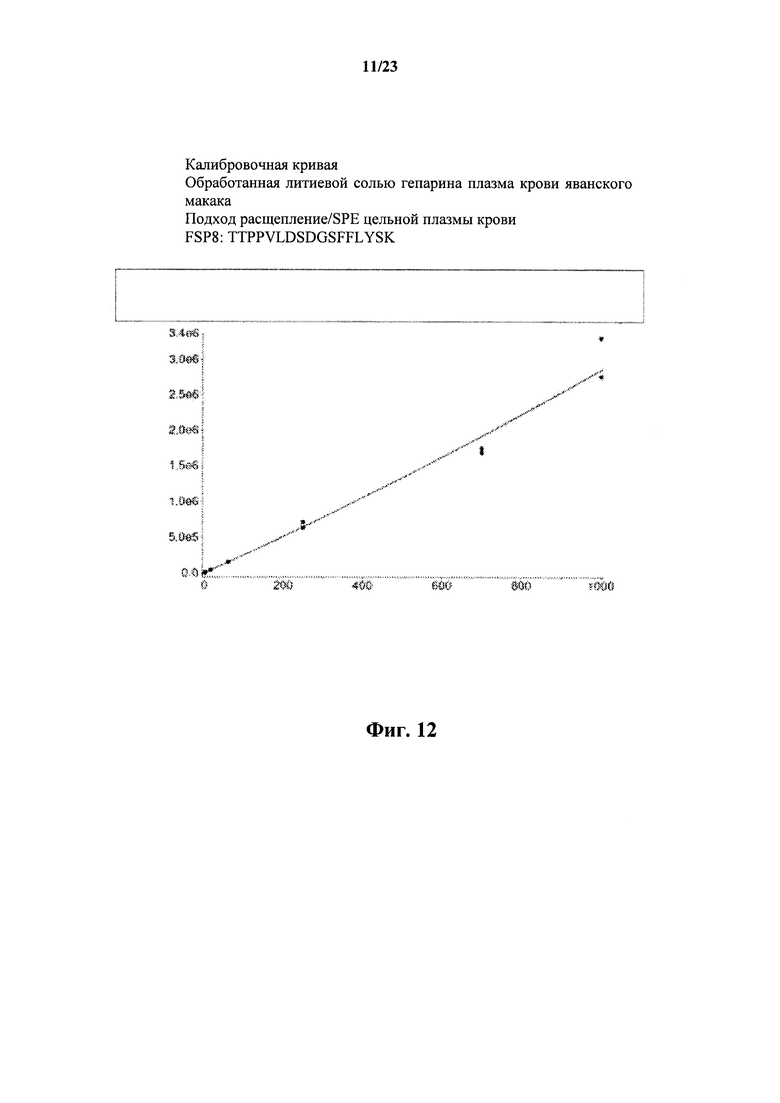
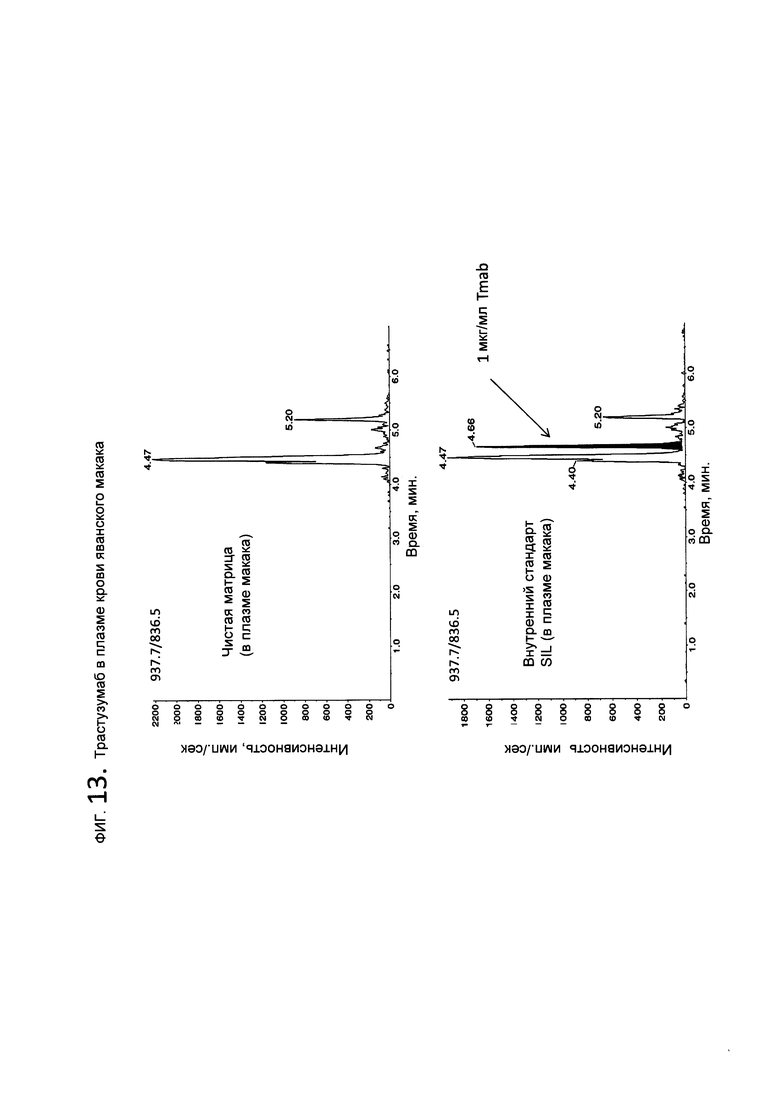
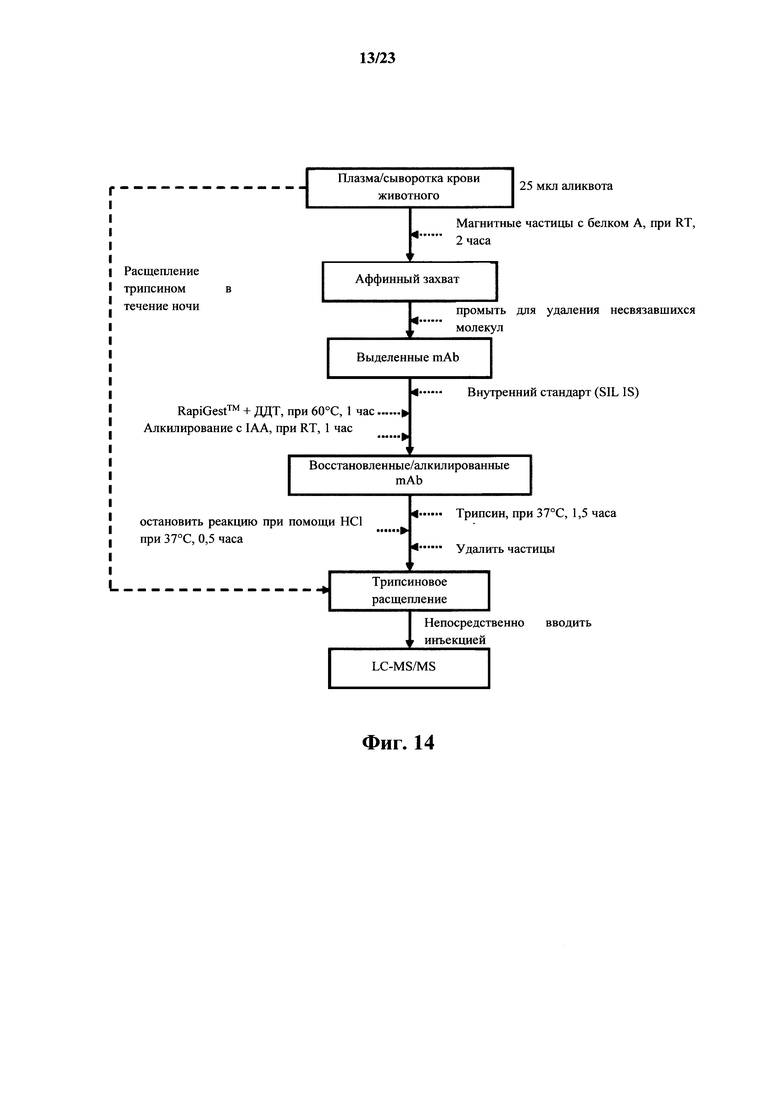
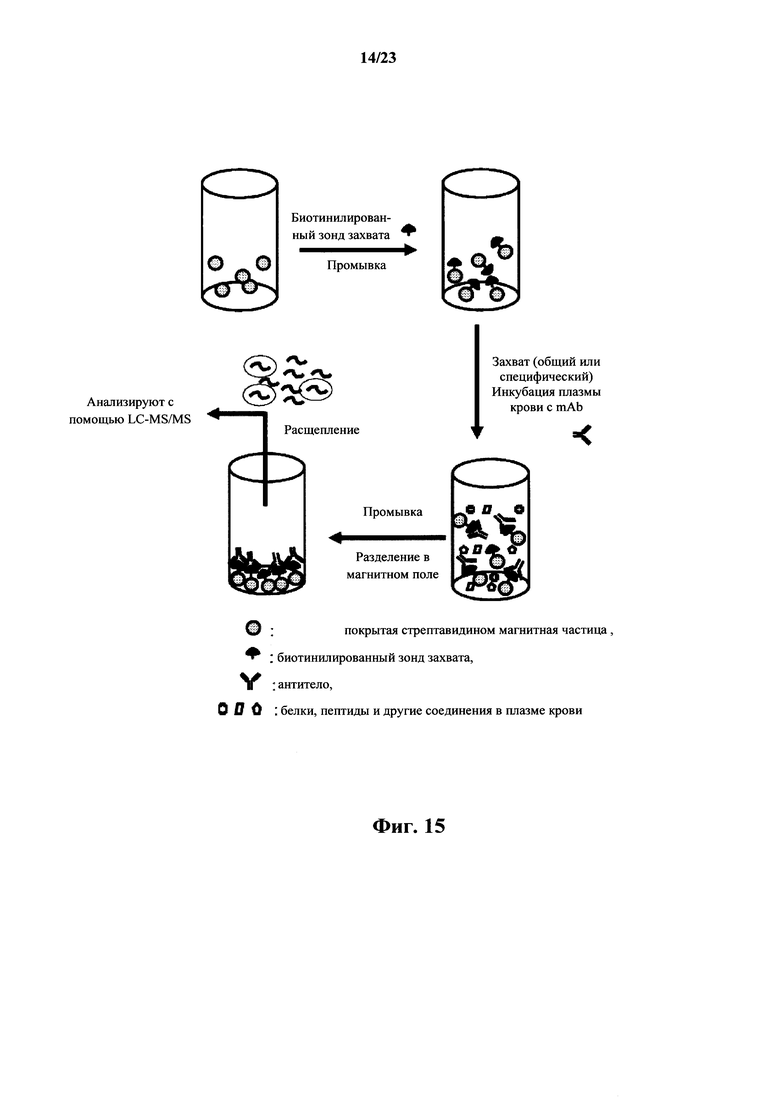
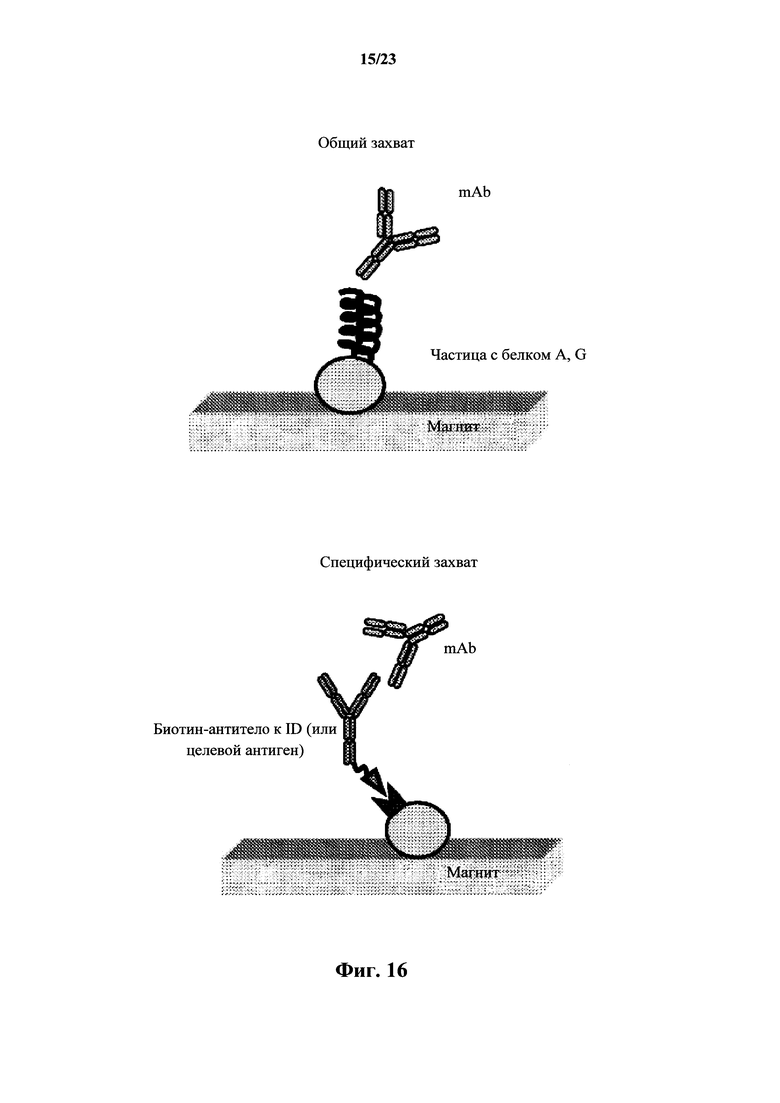
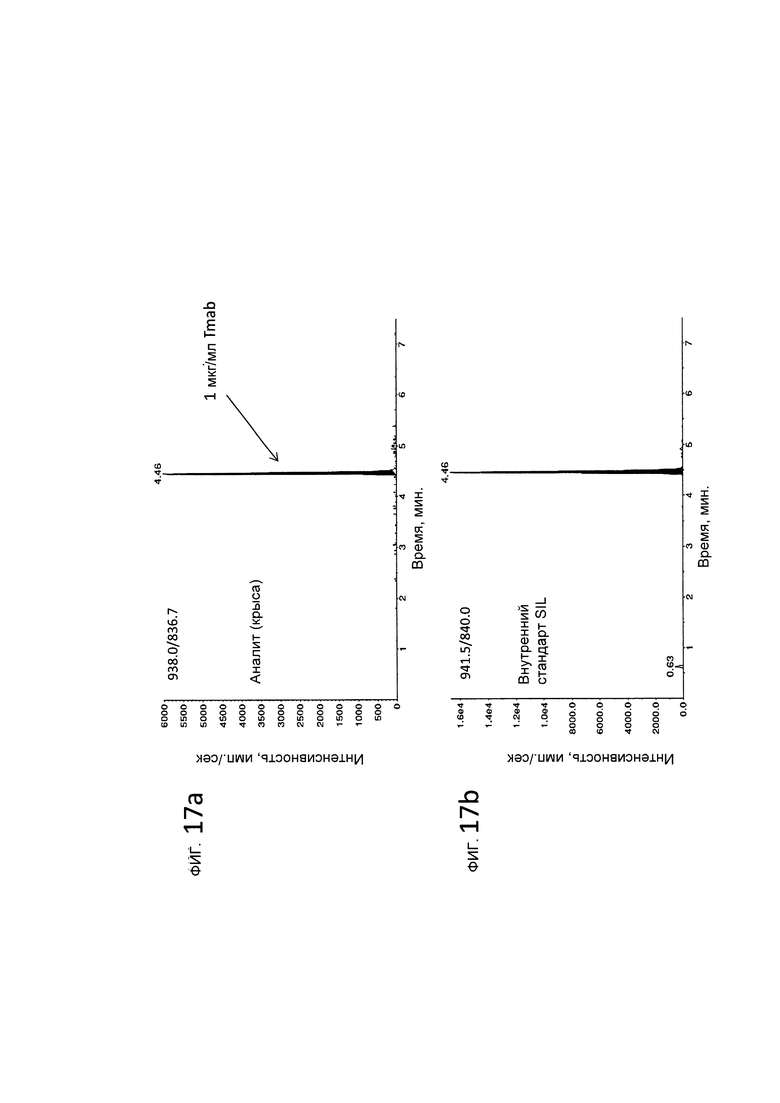
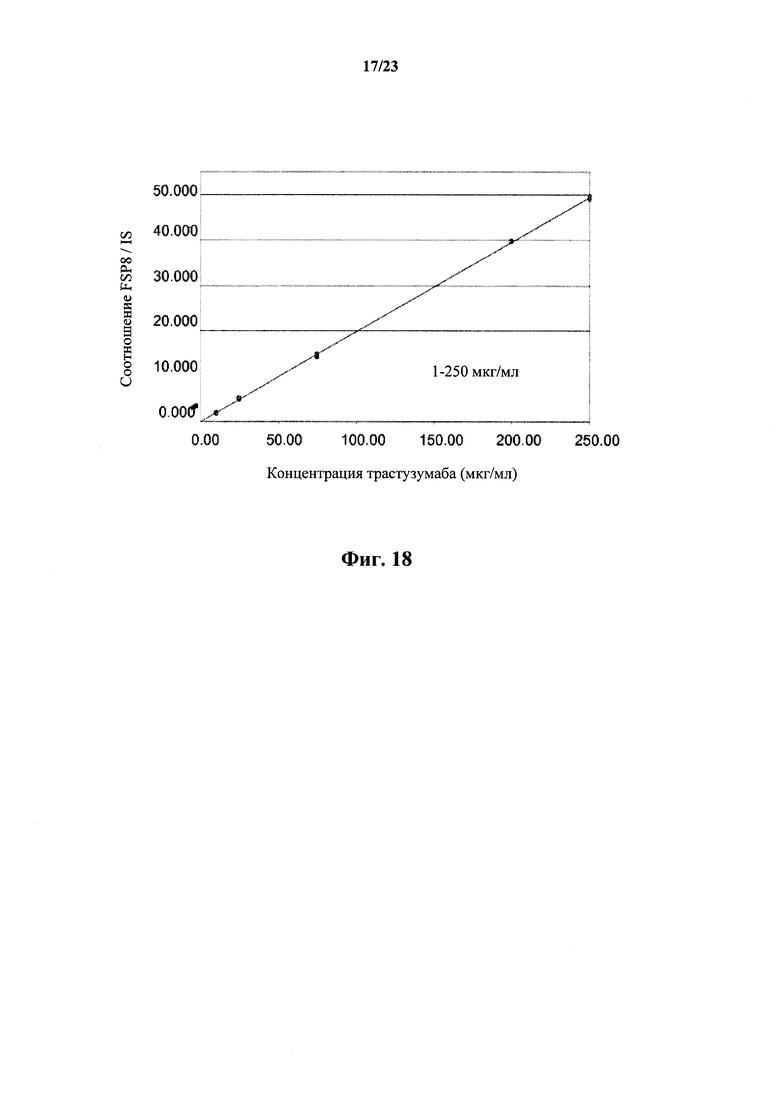

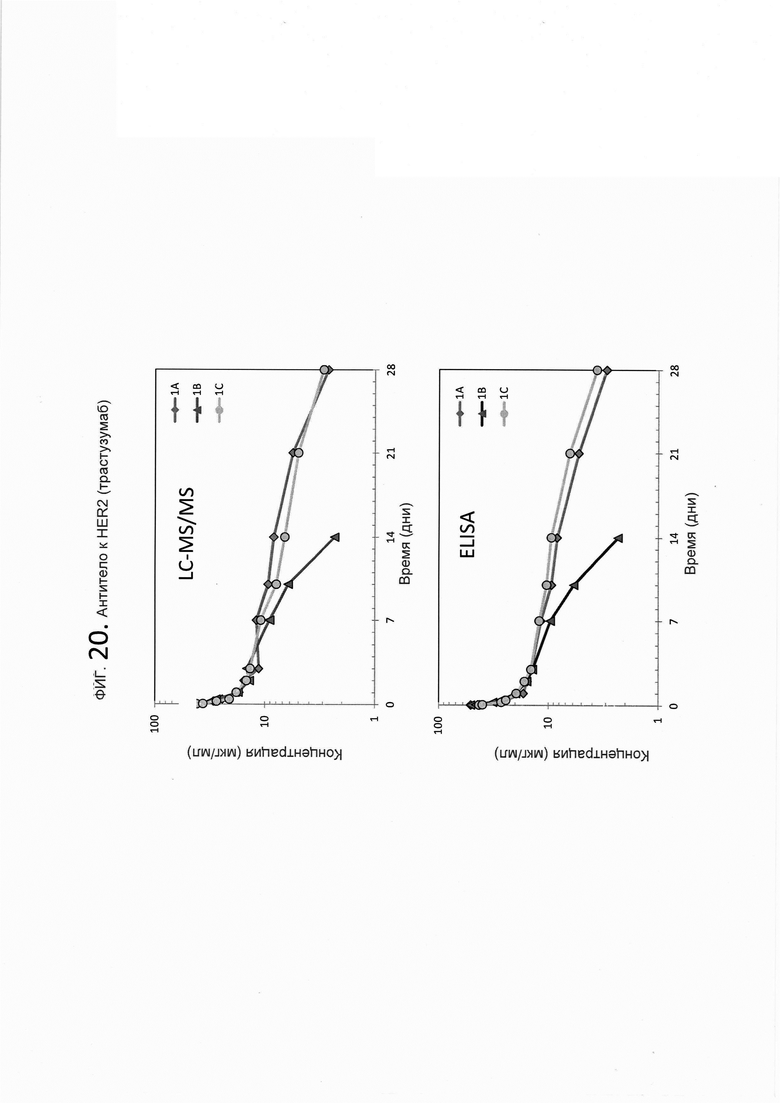
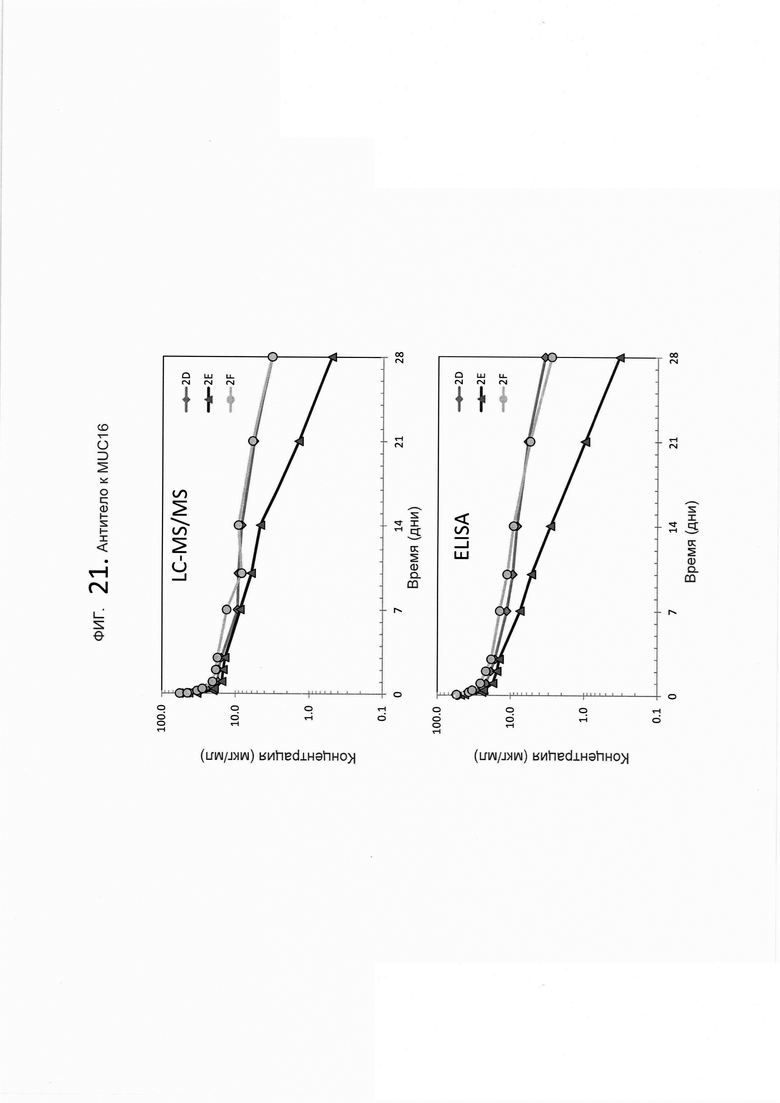
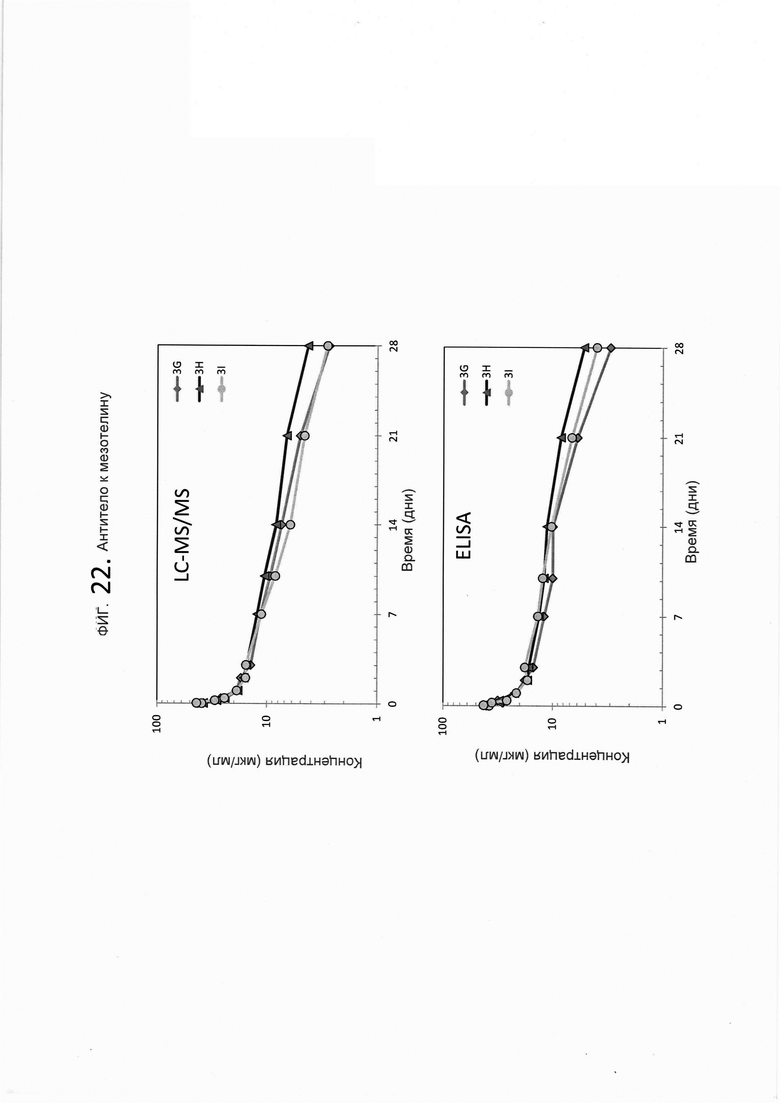


Изобретение относится к медицине и касается способа выявления человеческих или гуманизированных антител, включающего стадии обработки содержащего человеческое или гуманизированное антитело биологического образца расщепляющим ферментом с образованием образца расщепленного антитела, причем биологическим образцом является сыворотка, плазма крови, ткань или клетки от животного, которое было обработано человеческим или гуманизированным антителом; и анализа образца расщепленного антитела с помощью масс-спектрометрии с выявлением одного или нескольких человеческих каркасных пептидов. Изобретение обеспечивает обнаружение терапевтических антител в образцах от животного, обработанного с помощью терапевтического антитела; при этом обнаружения других антител, присутствующих в образце, таких как нативные антитела животных, не происходит. 11 з.п. ф-лы, 4 пр., 25 ил., 13 табл.
1. Способ выявления человеческих или гуманизированных антител, включающий следующие стадии:
(a) обработка содержащего человеческое или гуманизированное антитело биологического образца расщепляющим ферментом с образованием образца расщепленного антитела, причем биологическим образцом является сыворотка, плазма крови, ткань или клетки от животного, которое было обработано человеческим или гуманизированным антителом; и
(b) анализ образца расщепленного антитела с помощью масс-спектрометрии с выявлением одного или нескольких человеческих каркасных пептидов, причем человеческие каркасные пептиды содержат одну или несколько последовательностей, выбранных из SEQ ID NO 1-8:
2. Способ по п. 1, в котором расщепляющим ферментом является трипсин.
3. Способ по п. 1, дополнительно включающий приведение в контакт образца расщепленного антитела со средой для аффинного захвата или хроматографическим адсорбентом и элюирование обогащенного образца расщепленного антитела.
4. Способ по п. 1, дополнительно включающий приведение в контакт биологического образца со средой для аффинного захвата или хроматографическим адсорбентом и элюирование обогащенного биологического образца, затем обработку обогащенного биологического образца расщепляющим ферментом.
5. Способ по п. 3 или п. 4, в котором среда для аффинного захвата представляет собой белок A/G на носители в виде частиц.
6. Способ по п. 3 или п. 4, в котором хроматографический адсорбент представляет собой адсорбент для твердофазной экстракции (SPE).
7. Способ по п. 1, в котором биологический образец представляет собой сыворотку или плазму крови.
8. Способ по п. 1, в котором измеряют концентрацию образца расщепленного антитела.
9. Способ по п. 1, в котором человеческое или гуманизированное антитело связывается с одним или несколькими опухоль-ассоциированными антигенами или рецепторами клеточной поверхности, выбранными из (1)-(36):
(1) BMPR1B (рецептор костного морфогенетического белка типа IB);
(2) E16 (LAT1, SLC7A5);
(3) STEAP1 (шестой трансмембранный эпителиальный антиген предстательной железы);
(4) 0772Р (СА125, MUC16);
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин);
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, семейство переносчиков растворенных веществ 34 (фосфат натрия), член 2, тип II натрийзависимый транспортер фосфата 3b);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, sema-домен, семь тромоспондиновых повторов (тип 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен, (семафорин) 5В);
(8) PSCA blg;
(9) ETBR (рецептор эндотелина типа В);
(10) MSG783 (RNF124, гипотетический белок FLJ20315);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ассоциированный со злокачественной опухолью предстательной железы ген 1, ассоциированный со злокачественной опухолью предстательной железы белок 1, шестой трансмембранный эпителиальный антиген предстательной железы 2, шестой трансмембранный эпителиальный белок предстательной железы);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, катионный канал для транзиторного рецепторного потенциала, подсемейство М, член 4);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, полученный из клеток тератокарциномы ростовой фактор);
(14) CD21 (CR2 (рецептор комплемента 2) или G3DR (C3d/рецептор вируса Эпштейна-Барр) или Hs.73792);
(15) CD79b (CD79B, CD79β, IGb (иммуноглобулин-ассоциированный бета), В29);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (содержащий домен SH2 фосфатазный якорный белок 1a), SPAP1B, SPAP1C);
(17) HER2 (ErbB2);
(18) NCA;
(19) MDP;
(20) IL20Rα;
(21) бревикан;
(22) EphB2R;
(23) ASLG659;
(24) PSCA;
(25) GEDA;
(26) BAFF-R (рецептор фактора активации В-клеток, BLyS-рецептор 3, BR3);
(27) CD22 (изоформа В-клеточного рецептора CD22-B);
(28) CD79a (CD79A, CD79α, иммуноглобулин-ассоциированный альфа);
(29) CXCR5 (рецептор лимфомы Беркитта 1);
(30) HLA-DOB (бета-субъединица молекулы МНС II класса (антиген 1a));
(31) Р2Х5 (управляемый лигандами пуринергического рецептора Р2Х ионный канал 5);
(32) CD72 (антиген дифференцировки В-клеток CD72, Lyb-2);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок I типа семейства богатых лейциновыми повторами (LRR) белков);
(34) FcRH1 (Fc-рецептор-подобный белок 1);
(35) IRTA2 (FcRH5, ассоциированный с транслокациями рецепторный белок иммуноглобулинового суперсемейства 2) и
(36) TENB2 (предполагаемый трансмембранный протеогликан).
10. Способ по п. 1, в котором человеческое или гуманизированное антитело выбирают из трастузумаба, окрелизумаба, пертузумаба, антитела к PDL1, антитела к нейропилину-1, антитела к MUC16, ритуксимаба, антитела к мезотелину и антитела к LY6E.
11. Способ по п. 1, в котором человеческое или гуманизированное антитело конъюгируют с лекарственной частью.
12. Способ по п. 1, в котором лекарственную часть выбирают из майтанзиноида, доластатина, ауристатина, калихеамицина, пирролобензодиазепина (PBD), PNU-159682, антрациклина, дуокармицина, алкалоида барвинка, таксана, трихотецена, СС1065, кампотецина, элинафида и их стереоизомеров, изостеров, аналогов или производных.
Авторы
Даты
2017-12-15—Публикация
2012-05-11—Подача