Изобретение относится к области фармации и касается способа получения средства из растительного сырья, обладающего иммуностимулирующим действием.
Известен способ получения суммарного экстракта из корней горечавки желтой («Гентин»), обладающего иммуностимулирующим действием [1], заключающийся в экстракции сырья 40% этанолом с последующим концентрированием спиртового извлечения и сушкой. Недостатками известного метода является низкий выход конечного продукта (17-18% от массы растительного сырья) и невысокое содержание действующих веществ (содержание фенольных соединений - не более 1%). Более того, для производства препарата используется сырье горечавки желтой, имеющей ограниченные сырьевые запасы на территории России. В качестве альтернативного источника получения подобного средства предлагается трава горечавки холодной, широко распространенная на территории Сибири и Дальнего Востока и хорошо произрастающая в условиях искусственной культуры в Забайкалье.
Задачей изобретения является создание суммарного растительного препарата, содержащего флавоноиды и полисахариды, повышение иммуностимулирующего действия средства за счет более высокого содержания действующих веществ.
Техническим результатом изобретения является повышенное иммуностимулирующее действие средства из надземной части горечавки холодной, полученного заявленным способом.
Для достижения указанного технического результата измельченный растительный материал (траву горечавки холодной) заливают 70% этанолом в соотношении сырье : экстрагент 1:(12-15) и подвергают смесь ультразвуковой обработке частотой 50 кГц при 50°C в течение 60-80 мин. Извлечение фильтруют в сборник, промывая остаток растительного сырья на фильтре дополнительным объемом 70% этанола (20-25%) от взятого на этанольную экстракцию). Спиртовые извлечения объединяют и концентрируют в вакууме до 1/6 от первоначального объема. Остаток растительного сырья заливают водой в соотношении сырье : экстрагент 1:(12-14) и подвергают смесь ультразвуковой обработке частотой 50 кГц при 60°C в течение 90-100 мин. Извлечение фильтруют в сборник, промывая остаток растительного сырья на фильтре дополнительным объемом воды (14-15% от взятого на водную экстракцию). Водные извлечения объединяют и концентрируют в вакууме до 1/(7-10) от первоначального объема. Сгущенные экстракты, полученные от этанольной и водной экстракций, объединяют, высушивают в вакуум-сушильном шкафу и измельчают на мельнице пропеллерного типа. Выход готового продукта (сухого экстракта) составляет 26-39% от массы растительного сырья.
Выявленные отличительные признаки позволяют сделать вывод о соответствии предлагаемого технологического решения критерию "новизна".
Предложенный способ позволяет получить сухой экстракт (далее - средство) в виде рассыпчатого негигроскопичного порошка светло-коричневого цвета с горьким вкусом и специфическим запахом. Потеря массы при высушивании - 4-6%.
Способ иллюстрируется нижеследующими примерами.
Пример 1. 51.25 кг цветков горечавки холодной с влажностью 5.4% измельчают на мельнице до размера частиц диаметром 2-3 мм. 50 кг измельченного сырья загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 750 л 70% этанола. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме при температуре 50°C в течение 60 мин. После этого ультразвуковой процессор удаляют и смесь фильтруют через сукно в сборник, промывая остаток растительного сырья на фильтре 180 л 70% этанола. В результате получено 890 л этанольного экстракта с плотностью 0.892 г/см3, который концентрируют в вакууме до объема 150 л (плотность концентрата 1.025 г/см3). Объем полученного отгона этанола - 725 л (плотность 0.852 г/см3). Остаток растительного сырья после этанольной экстракции загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 700 л воды. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме при температуре 60°C в течение 90 мин. После этого ультразвуковой процессор удаляют и смесь фильтруют через сукно в сборник, промывая остаток растительного сырья на фильтре 100 л воды. В результате получено 700 л водного экстракта с плотностью 0.985 г/см3, который концентрируют в вакууме до объема 100 л (плотность концентрата 1.012 г/см3). Объем полученного отгона воды - 540 л. Полученные концентраты после этанольной и водной экстракций объединяют (объем объединенного концентрата 240 л, плотность 1.017 г/см3), сушат в вакуум-сушильном шкафу при температуре 55°C и давлении 0.1 атм в течение 8 часов и измельчают на мельнице пропеллерного типа. Получают 19.30 кг готового продукта (средства), что составляет 38.60% от массы растительного сырья. Средство представляет собой рассыпчатый негигроскопичный порошок, светло-коричневого цвета, с горьким вкусом и специфическим запахом. Потеря массы при высушивании составляет 4.2%. Шрот растительного сырья массой 129 кг и влажностью 79.8% далее не используют и направляют в отвал.
Пример 2. 52.97 кг стеблей горечавки холодной с влажностью 4.7% измельчают на мельнице до размера частиц диаметром 2-3 мм. 50 кг измельченного сырья загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 600 л 70% этанола. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме при температуре 50°C в течение 80 мин. После этого ультразвуковой процессор удаляют и смесь фильтруют через сукно в сборник, промывая остаток растительного сырья на фильтре 150 л 70% этанола. В результате получено 710 л этанольного экстракта с плотностью 0.875 г/см3, который концентрируют в вакууме до объема 85 л (плотность концентрата 1.018 г/см3). Объем полученного отгона этанола - 640 л (плотность 0.864 г/см3). Остаток растительного сырья после этанольной экстракции загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 600 л воды. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме при температуре 60°C в течение 100 мин. После этого ультразвуковой процессор удаляют и смесь фильтруют через сукно в сборник, промывая остаток растительного сырья на фильтре 85 л воды. В результате получено 605 л водного экстракта с плотностью 0.985 г/см3, который концентрируют в вакууме до объема 60 л (плотность концентрата 1.006 г/см3). Объем полученного отгона воды - 502 л. Полученные концентраты после этанольной и водной экстракций объединяют (объем объединенного концентрата 145 л, плотность 1.024 г/см3), сушат в вакуум-сушильном шкафу при температуре 55°C и давлении 0.1 атм в течение 8 часов и измельчают на мельнице пропеллерного типа. Получают 13.38 кг готового продукта (средства), что составляет 26.78% от массы растительного сырья. Средство представляет собой рассыпчатый негигроскопичный порошок, светло-коричневого цвета, с горьким вкусом и специфическим запахом. Потеря массы при высушивании составляет 5.7%. Шрот растительного сырья массой 121 кг и влажностью 72.7% далее не используют и направляют в отвал.
Пример 3. 51.86 кг травы горечавки холодной (смесь цветков и стеблей в соотношении 60:40) с влажностью 5.0% измельчают на мельнице до размера частиц диаметром 2-3 мм. 50 кг измельченного сырья загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 750 л 70% этанола. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме при температуре 50°C в течение 60 мин. После этого ультразвуковой процессор удаляют и смесь фильтруют через сукно в сборник, промывая остаток растительного сырья на фильтре 180 л 70% этанола. В результате получено 890 л этанольного экстракта с плотностью 0.892 г/см3, который концентрируют в вакууме до объема 150 л (плотность концентрата 1.025 г/см3). Объем полученного отгона этанола - 725 л (плотность 0.852 г/см3). Остаток растительного сырья после этанольной экстракции загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 700 л воды. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме при температуре 60°C в течение 90 мин. После этого ультразвуковой процессор удаляют и смесь фильтруют через сукно в сборник, промывая остаток растительного сырья на фильтре 100 л воды. В результате получено 700 л водного экстракта с плотностью 0.985 г/см3, который концентрируют в вакууме до объема 100 л (плотность концентрата 1.012 г/см3). Объем полученного отгона воды - 540 л. Полученные концентраты после этанольной и водной экстракций объединяют (объем объединенного концентрата 240 л, плотность 1.017 г/см3), сушат в вакуум-сушильном шкафу при температуре 55°C и давлении 0.1 атм в течение 8 часов и измельчают на мельнице пропеллерного типа. Получают 17.86 кг готового продукта (средства), что составляет 35.72% от массы растительного сырья. Средство представляет собой рассыпчатый негигроскопичный порошок, светло-коричневого цвета, с горьким вкусом и специфическим запахом. Потеря массы при высушивании составляет 4.8%. Шрот растительного сырья массой 125 кг и влажностью 76.8% далее не используют и направляют в отвал
Химический состав средства
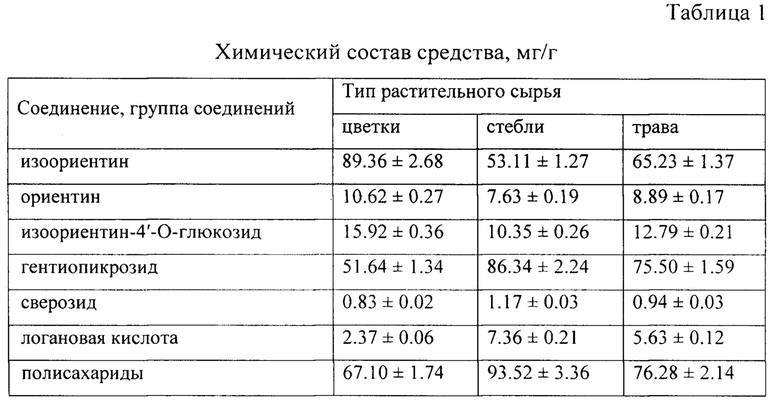
На предварительно этапе исследования нами был изучен химический состав средства с применением метода ВЭЖХ-УФ [2]. Идентификацию соединений проводили по данным хроматографической подвижности, спектров поглощения, спектральных отношений и метода добавок. В результате в трех образцах средства, полученных из цветков, стеблей и травы горечавки холодной, было установлено присутствие трех флавоноидов - изоориентина (лютеолин-6-С-глюкозида), ориентина (лютеолин-8-С-глюкозида) и изоориентин-4'-O-глюкозида, а также трех иридоидов - гентиопикрозида, сверозида и логановой кислоты. Все упомянутые соединения являются типичными для растений рода Горечавка и были ранее обнаружены в надземной части горечавки холодной [3]. Согласно данным ВЭЖХ содержание доминирующего флавоноида - изоориентина, в образцах средств, полученных из цветков, стеблей и травы горечавки холодной, составило 53.11-89.36 мг/г (таблица 1).
Присутствие полисахаридов было доказано на основании реакции осаждения ацетоном водного раствора средства. Выпавший белый аморфный осадок давал положительные цветные реакции с фенолом, антроном и карбазолом в среде концентрированной серной кислоты, что указывало на присутствие полисахаридов в средстве [4]. С применением антрон-серного метода [5] было установлено, что содержание полисахаридов в средстве составило 67.10-93.52 мг/г.
Количественный анализ и показатели качества средства
Для осуществления химической характеристики средства разработаны методика количественного анализа изоориентина в средстве методом ВЭЖХ и методика количественного анализа полисахаридов в средстве спектрофотометрическим методом.
Методика количественного анализа изоориентина в средстве методом ВЭЖХ Испытуемый раствор. 10 мг средства помещают в пластиковую пробирку типа Эппендорф вместимостью 2 мл, прибавляют 1 мл 70% этанола и растворяют в ультразвуковой ванне при 30°C в течение 15 мин. Охлаждают и центрифугируют при 3000 об/мин 10 мин. Надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0.45 мкм.
Раствор сравнения. 1 мг изоориентина и 1 мг ориентина растворяют в метаноле и доводят до объема 5 мл этим же растворителем.
Условия хроматографирования:
- колонка длиной 75 мм и внутренним диаметром 2 мм, заполненная силикагелем октадецилсилильным для хроматографии с размером частиц 5 мкм;
- температура: 35°C;
- подвижная фаза:
- подвижная фаза А: 21 г/л лития перхлората раствор в 1 г/л кислоте перхлорной;
- подвижная фаза В: ацетонитрил;
- спектрофотометрический детектор, длина волны 254 нм;
- время уравновешивания системы: 3 мин перед каждым вводом (5% В);
- объем вводимой пробы: 1 мкл;
- программа градиентного режима элюирования представлена в таблице 2.

Результаты: на хроматограмме должен быть доминирующий пик, совпадающий по подвижности с РСО изоориентина.
Порядок выхода пиков раствора сравнения: ориентин → изоориентин.
Пригодность хроматографической системы. Хроматографическая система считается пригодной, если выполняются следующие условия: разрешение между пиками ориентина и изоориентина не менее 2.
Расчет: содержание изоориентина в средстве в процентах (X) вычисляют по формуле: 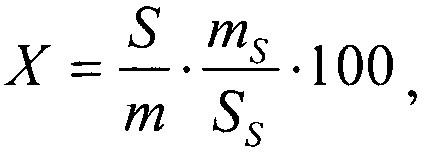 где S - площадь пика изоориентина в исследуемом растворе; m - масса навески субстанции, г; SS - площадь пика изоориентина в растворе сравнения; mS - масса навески изоориентина, г.
где S - площадь пика изоориентина в исследуемом растворе; m - масса навески субстанции, г; SS - площадь пика изоориентина в растворе сравнения; mS - масса навески изоориентина, г.
Методика количественного анализа полисахаридов в средстве спектрофотометрическим методом
Испытуемый раствор. 10 мг средства помещают в пластиковую пробирку типа Эппендорф вместимостью 2 мл, прибавляют 1 мл воды и растворяют в ультразвуковой ванне при 60°C в течение 20 мин. Охлаждают и центрифугируют при 3000 об/мин 10 мин. Надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0.45 мкм (раствор А). 0.5 мл раствора А переносят в центрифужную пробирку, приливают 3 мл 95% этанола, перемешивают и нагревают на водяной бане в течение 10 мин. После охлаждения содержимое пробирки центрифугируют в течение 10 мин со скоростью вращения 3000 об/мин. Надосадочную жидкость сливают, а осадок суспендируют с 5 мл 95% этанола и повторно центрифугируют в тех же условиях. Надосадочную жидкость сливают, осадок продувают в пробирке горячим воздухом до удаления следов этанола. К осадку приливают 4 мл 0.1% раствора антрона в 80% серной кислоте, нагревают на водяной бане при 70°C в течение 10 мин. Содержимое пробирки после охлаждения переносят 95% этанолом в мерную колбу вместимостью 25 мл и доводят до метки тем же растворителем (раствор Б).
Стандартный раствор. 1 мг глюкозы растворяют в воде и доводят до объема 25 мл этим же растворителем. К 0.5 мл полученного раствора А приливают 4 мл 0.1% раствора антрона в 80% серной кислоте, нагревают на водяной бане при 70°C в течение 10 мин. Содержимое пробирки после охлаждения переносят 95% этанолом в мерную колбу вместимостью 25 мл и доводят до метки тем же растворителем.
Раствор сравнения. К 0.5 мл воды приливают 4 мл 0.1% раствора антрона в 80% серной кислоте, нагревают на водяной бане при 70°C в течение 10 мин. Содержимое пробирки после охлаждения переносят 95% этанолом в мерную колбу вместимостью 25 мл и доводят до метки тем же растворителем.
Условия спектрофотометрирования:
- кварцевая кювета с длиной оптического пути 1 дм;
- длина волны: 430 нм.
Расчет: содержание полисахаридов в средстве в процентах (X) вычисляют по формуле: 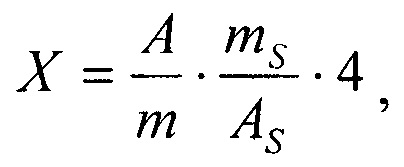 где A - оптическая плотность исследуемого раствора; m - масса навески субстанции, г; AS - оптическая плотность раствора сравнения глюкозы; mS - масса навески глюкозы, г.
где A - оптическая плотность исследуемого раствора; m - масса навески субстанции, г; AS - оптическая плотность раствора сравнения глюкозы; mS - масса навески глюкозы, г.
Метрологический анализ разработанных методик показал, что относительная ошибка определения изоориентина методом ВЭЖХ не превышает 3%, полисахаридов спектрофотометрическим методом - не превышает 4% (таблица 3). Полученные результаты свидетельствуют об удовлетворительных валидационных параметрах методик, что указывает на возможность их использования в практике фармакопейного анализа для определения показателей качества разработанного средства.

По данным проведенных исследований определены общие показатели качества средства, обобщенные в таблице 4. Для стандартизации средства было предложено определение внешнего вида, подлинности (присутствие олеаноловой кислоты методом ВЭТСХ и гентиопикрозида методом ВЭЖХ), потери в массе при высушивании, золы сульфатной, тяжелых металлов, количественное определение суммарного содержания изоориентина (ВЭЖХ), полисахаридов (спектрофотометрия) и микробиологической чистоты.

Предлагаемый способ, по сравнению с известным, позволяет получить препарат постоянного состава с более выраженной активностью за счет более высокого содержания действующих веществ (флавоноидов и полисахаридов).
Рассчитать экономическую целесообразность предлагаемого способа в настоящее время не представляется возможным, однако вышеуказанные преимущества в сочетании с простой схемой получения способствуют рациональному использованию лекарственного растительного сырья и определяют перспективность внедрения данного способа в фармацевтическую промышленность.
Фармакотерапевтические свойства средства
Острая токсичность средства. Опыты проведены на крысах самцах линии Wistar массой 180-190 г. Острую токсичность средства оценивали с использованием метода Кербера [6] при однократном внутрибрюшинном введении в дозах 500-5000 мг/кг и внутрижелудочном введении в дозах 1000-6000 мг/кг. Все испытанные дозы растворяли в ДМСО и доводили дистиллированной водой до конечного объема, составляющего 1.0 мл/100 г массы животного. Наблюдение за общим состоянием подопытных крыс и их поведением осуществляли в течение 14 дней. При этом в первый день после введения указанных средств животные находились под постоянным наблюдением. Регистрировали наблюдаемые признаки интоксикации: общее состояние животных, поведение, двигательную активность, характер дыхательных движений, состояние волосяного и кожного покрова, окраску слизистых оболочек, потребление корма и воды, количество и консистенцию фекальных масс, частоту мочеиспускания и окраску мочи. Также регистрировали сроки развития интоксикации и гибели животных. На 14 сутки эксперимента осуществляли эвтаназию под эфирным наркозом и проводили макроскопический осмотр внутренних органов с помощью бинокулярной лупы, а также осуществляли патоморфологическое исследование жизненно важных органов.
Установлено, что при внутрижелудочном и внутрибрюшинном введении средства во всех использованных дозах гибели животных в течение всего периода наблюдения не отмечалось. При внутрибрюшинном введении наиболее высоких доз испытуемого средства (2000-5800 мг/кг) в течение 1-2 суток видимые признаки интоксикации животных не наблюдались. Вскрытие животных, осуществленное через 14 суток, показало, что визуально внутренние органы не отличались от таковых у интактных крыс; патоморфологические изменения у животных, получавших средство в высоких дозах, также не были отмечены. Таким образом, полученные данные позволяют отнести испытуемое средство к группе малотоксичных веществ по классификации К.К. Сидорова [7].
Влияние средства на иммунную систему. Эксперименты проведены на мышах самцах линии СВА массой 18-20 г. Действие средства было изучено на животных, находящихся в состоянии иммунодепрессии, вызванной цитостатиком азатиоприном, который вводили контрольной группе животных в дозе 50 мг/кг перорально 1 раз в сутки в течение 5 дней [8]. Исследуемое средство вводили на фоне азатиоприна перорально ежедневно в течение 14 дней. Интактная группа животных получала очищенную воду по аналогичной схеме. Состояние гуморального иммунитета оценивали по количеству антителообразующих клеток (АОК), определяемых методом локального гемолиза по методу A.J. Cunningham [9]. Мышей иммунизировали внутрибрюшинно эритроцитами барана в дозе 2×108 клеток/мышь. Величину иммунного ответа оценивали по числу АОК на селезенку и на 106 клеток с ядрами на 5 сутки после иммунизации. Действие средства на состояние клеточного звена иммунного ответа оценивали в реакции гиперчувствительности замедленного типа (ГЗТ) [7]. Состояние макрофагального звена иммунного ответа определяли в реакции фагоцитоза перитонеальных макрофагов в отношении частиц коллоидной туши, при этом оптическую плотность лизата клеток перитонеального экссудата, отражающего количество туши, поглощенной перитонеальными макрофагами, определяли при длине волны 620 нм [7]. При статистической обработке экспериментальных данных вычислялась средняя арифметическая, ошибка средней арифметической, критерий Стьюдента и достоверность различий (Р). Различие считали достоверным при вероятности 95% (P≤0.05) [10]. В качестве препарата сравнения использовали коммерческий препарат Иммунал.
При исследовании влияния средства на процессы антителообразования установлено, что оно восстанавливает показатели гуморального иммунного ответа в условиях азатиоприновой иммуносупрессии. Введение азатиоприна приводило к снижению как абсолютного числа АОК, так и числа АОК на 106 спленоцитов на 39% и 40% соответственно по сравнению с теми же показателями в контрольной группе (таблица 5).
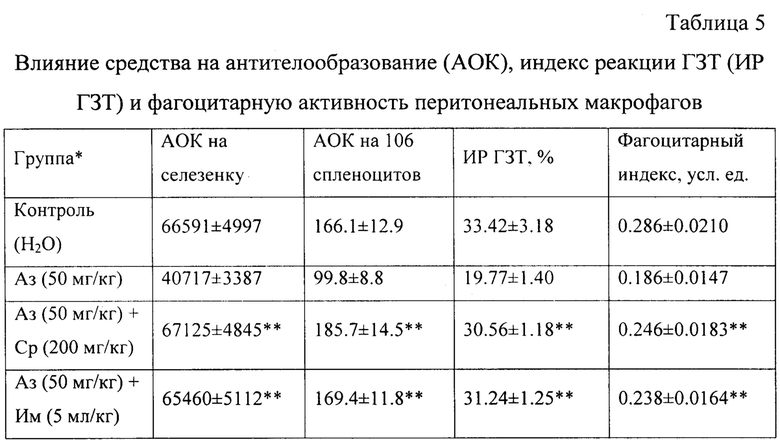
Примечания: * Аз - азатиоприн (иммунодепрессант), Им - Иммунал (препарат сравнения), Ср - средство; ** разница существенна (P≤0.05) по сравнению с контролем.
При введении средства на фоне иммуносупрессии наблюдали достоверное увеличение количества АОК как в абсолютных значениях, так и при расчете на 106 спленоцитов; при этом первый показатель превышал уровень азатиоприновой супрессии в 1.7 раза, а второй - в 1.9 раза соответственно.
При исследовании влияния средства на клеточно-опосредованную реакцию ГЗТ установлено, что оно восстанавливает индекс данной реакции (ИР ГЗТ) в условиях азатиоприновой иммуносупрессии. Введение азатиоприна приводило к снижению ИР ГЗТ на 41% по сравнению с тем же показателем в контрольной группе. При введении средства наблюдали увеличение ИР ГЗТ в 1.6 раза на фоне иммуносупрессии.
При исследовании влияния средства на фагоцитарную активность перитонеальных макрофагов в отношении частиц коллоидной туши установлено, что данное средство увеличивает фагоцитарный индекс в 1.3 раза по сравнению с данными у животных, получавших азатиоприн.
Активность средства была сопоставима с таковой препарата сравнения. Таким образом, полученные данные позволяют заключить, что исследуемое средство является эффективным иммунокорригирующим средством, способным ослаблять супрессивное действие азатиоприна на состояние клеточного и гуморального звеньев иммунного ответа.
Источники информации
1. Бакуридзе А.Д. Химическое изучение растений рода Горечавка и создание фитопрепарата. Дисс. … канд. фарм. н. Москва, 1987. 241 с. - прототип.
2. Olennikov D.N., Chirikova N.K. Algidisides I and II, new iridoids glycosides from Gentiana algida // Chemistry of Natural Compounds. 2016. Vol. 52. No. 4. P. 637-641.
3. Olennikov D.N., Kashchenko N.I., Chirikova N.K., Tankhaeva L.M. Iridoids and flavonoids of four Siberian gentians: Chemical profile and gastric stimulatory effect // Molecules. 2015. Vol. 20. No. 10. P. 19172-19188.
4. Olennikov D.N., Tankhaeva L.M. Absorption spectra of carbohydrates and related compounds in H2SO4 // Chemistry of Natural Compounds. 2006. Vol. 42. №3. P. 262-264/
5. Olennikov D.N., Tankhaeva L.M., Samuelsen A.B. Quantitative analysis of polysaccharides from Plantago major leaves using the Dreywood method // Chemistry of Natural Compounds. 2006. Vol. 42. №3. P. 265-268.
6. Требования по доклиническому изучению общетоксического действия новых фармакологических веществ. М., 1984. 49 с.
7. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. МЗ РФ. Департамент контроля качества, эффективности и безопасности фармакологических средств. Фармакологический комитет МЗ РФ. 2 изд., перераб. и доп. М., 2005. С. 138-145.
8. Лазарева Д.Н., Алехин Е.К. Стимуляторы иммунитета. М., 1985. 256 с.
9. Cunningham A.J. A method of increased sensitivity for detecting single antibody forming cells // Nature. 1965. Vol. 207. №5001. P. 1106-1107.
10. Лакин Г.Ф. Биометрия. M., 1990. 352 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения иммуностимулирующего средства из шрота ягод брусники обыкновенной | 2021 |
|
RU2775065C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТИТЕЛЬНОГО СРЕДСТВА, ОБЛАДАЮЩЕГО АНКСИОЛИТИЧЕСКИМ И АНТИДЕПРЕССИВНЫМ ДЕЙСТВИЕМ | 2018 |
|
RU2678586C1 |
| Способ получения растительного средства, обладающего гастропротекторным действием | 2023 |
|
RU2812531C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУММЫ ФЛАВОНОИДОВ, ОБЛАДАЮЩЕЙ АНТИЛИПАЗНЫМ ДЕЙСТВИЕМ, ИЗ ВЕГЕТАТИВНОЙ ЗЕЛЕНИ ОГУРЦА ПОСЕВНОГО | 2024 |
|
RU2837472C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТИТЕЛЬНОГО СРЕДСТВА, ОБЛАДАЮЩЕГО НЕЙРОПРОТЕКТИВНЫМ ДЕЙСТВИЕМ | 2022 |
|
RU2805653C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ИММУНОСТИМУЛИРУЮЩИМ ДЕЙСТВИЕМ | 2012 |
|
RU2564906C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО АДАПТОГЕННЫМ ДЕЙСТВИЕМ | 2012 |
|
RU2582952C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-ГИДРОКСИАЦЕТОФЕНОН-4-О-БЕТА-D-ГЛЮКОПИРАНОЗИДА (ПИЦЕИНА) ИЗ РАСТИТЕЛЬНОГО СЫРЬЯ | 2012 |
|
RU2532167C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ГИПОЛИПИДЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2000 |
|
RU2173161C1 |
| СПОСОБ ПОЛУЧЕНИЯ α(1,2)-L-рамно-α(1,4)-D-ГАЛАКТОПИРАНОЗИЛУРОНАНА ИЗ КОРНЕВИЩ Acorus calamus L. | 2014 |
|
RU2548768C1 |
Изобретение относится к фармацевтической промышленности, а именно к способу получения средства, обладающего иммуностимулирующим действием. Способ получения средства, обладающего иммуностимулирующим действием, из надземной части горечавки холодной путем экстрагирования растительного материала, при этом измельченный растительный материал смешивают с 70% этанолом, подвергают смесь ультразвуковой обработке, смесь фильтруют и промывают на фильтре дополнительным объемом 70% этанола, далее остаток растительного материала после этанольной экстракции смешивают с водой, подвергают смесь ультразвуковой обработке, смесь фильтруют и промывают на фильтре дополнительным объемом воды, этанольное извлечение концентрируют, водное извлечение концентрируют, сконцентрированные этанольное и водное извлечения объединяют, высушивают и измельчают при определенных условиях. Средство, полученное вышеописанным способом, обладает выраженным иммуностимулирующим действием. 5 табл., 3 пр.
Способ получения средства, обладающего иммуностимулирующим действием, из надземной части горечавки холодной путем экстрагирования растительного материала, отличающийся тем, что измельченный растительный материал смешивают с 70% этанолом в соотношении сырье : экстрагент 1:(12-15), подвергают смесь ультразвуковой обработке частотой 50 кГц при 50°C в течение 60-80 мин, смесь фильтруют и промывают на фильтре дополнительным объемом 70% этанола, составляющим 20-25% от взятого на этанольную экстракцию, далее остаток растительного материала после этанольной экстракции смешивают с водой в соотношении сырье : экстрагент 1:(12-14), подвергают смесь ультразвуковой обработке частотой 50 кГц при 60°C в течение 90-100 мин, смесь фильтруют и промывают на фильтре дополнительным объемом воды, составляющим 14-15% от взятого на водную экстракцию, этанольное извлечение концентрируют до 1/6 от первоначального объема, водное извлечение концентрируют до 1/(7-10) от первоначального объема, сконцентрированные этанольное и водное извлечения объединяют, высушивают и измельчают.
| Бакуридзе А.Д | |||
| Химическое изучение растений рода Горечавка и создание фитопрепарата // Дисс | |||
| канд | |||
| фарм | |||
| наук., Москва, 1987, 241 стр | |||
| SINGH S et all | |||
| Immunomodulatory activity of butanol fraction of Gentiana oliveri Griseb | |||
| On Balb/C mice // Asian Pac J Trop Biomed., 2012 Jun, 2(6): 433-7 | |||
| CN 106165794 A, 30.11.2016 | |||
| CN 106177834 A, 07.12.2016. |
Авторы
Даты
2017-12-19—Публикация
2016-12-15—Подача