ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет по временной патентной заявке США с серийным номером № 61/594245, поданной 2 февраля 2012 года, под названием "Plant Transactivation Interaction Motifs and Uses Thereof."
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к биотехнологии растений. Варианты осуществления относятся к полипептидам (например, слитый белок), содержащим новый или синтетический мотив взаимодействия факторов транскрипции из трансактиватора растений. Некоторые варианты осуществления относятся к применению такого белка для экспрессии представляющей интерес нуклеиновой кислоты или для повышения экспрессии представляющей интерес нуклеиновой кислоты. Некоторые варианты осуществления относятся к полинуклеотидам, кодирующим белок, содержащий новый или синтетический мотив взаимодействия факторов транскрипции из трансактиватора растений. Конкретные примеры относятся к клеткам-хозяевам, тканям и/или организмам, содержащим полипептид или полинуклеотид по изобретению.
УРОВЕНЬ ТЕХНИКИ
Введение клонированных и выделенных генов в клетки растений (генетическая трансформация) и последующую регенерацию трансгенных растений широко используют для осуществления генетической модификации растений или растительных материалов. Генетическую трансформацию растений для введения желаемого признака (например, улучшенное питательное качество; увеличенный выход; устойчивость к паразитам или резистентность к заболеванию; устойчивость к стрессовым воздействиям; и устойчивость к гербицидам) в настоящее время широко используют для получения новых и улучшенных трансгенных растений, которые экспрессируют желаемый признак. ДНК, как правило, случайным образом встраивают в ядерную или пластидную ДНК эукариотической клетки-хозяина, а затем клетки, содержащие ДНК, встроенную в ДНК клеток, выделяют и используют для получения стабильно трансформированных клеток растений. Часто является желательной модификация способами генетической инженерии одного сорта растения для экспрессии более чем одного введенного признака путем введения множества кодирующих последовательностей, которые могут содержать сходные (или идентичные) регуляторные элементы.
Экспрессия трансгенов (а также эндогенных генов) контролируется посредством механизмов, вовлекающих множество взаимодействий белок-ДНК и белок-белок. Путем таких взаимодействий регуляторные элементы нуклеиновых кислот (например, промоторы и энхансеры), могут обеспечивать профили экспрессии кодирующей последовательности, которые являются либо конститутивными, либо специфическими. Например, промотор может обеспечивать увеличенную транскрипцию кодирующей последовательности в конкретных тканях во время конкретных периодов развития или в ответ на стимулы окружающей среды. К сожалению, присущие общепринятым промотором признаки экспрессии трансгенов ограничивают диапазон контроля экспрессии, который можно использовать для действия в клетке-хозяине. Одним практическим ограничением общепринятых промоторов является то, что трудно тонко отрегулировать уровень экспрессии введенного гена вследствие ограниченной силы промотора и подавления экспрессии трансгеном, в частности, сильными промоторами или одновременным применением в одной и той же клетке множества копий одного и того же промотора. Также является желательной инициация или увеличение экспрессии эндогенных или нативных генов.
Трансактиваторы представляют собой белки, которые функционируют, привлекая посредством белок-белковых взаимодействий ряд различных белков, вовлеченных в транскрипцию ДНК (например, комплексы ремоделирования нуклеосом; комплексы медиаторов и основные факторы транскрипции, такие как TFIIB, TBP и TFIIH) для инициации или увеличения скорости транскрипции путем влияния на сборку/разборку нуклеосом, образование прединициирующего комплекса, освобождение промотора и/или скорость удлинения. Белок-белковые взаимодействия трансактиваторов и их партнеров по связыванию вовлекают отдельные внутренние структурные элементы в трансактиваторах, известные как "домены трансактивации (TAD)". Полагают, что TAD обладают небольшой гомологией первичных последовательностей и принимают определенную структуру при связывании с мишенью. Sigler (1988) Nature 333:210-2. Хотя полагают, что кислые и гидрофобные остатки в TAD являются важными (см., например, Cress and Triezenberg (1991) Science 251(4989):87-90), вклад индивидуальных остатков в активность является небольшим. Hall and Struhl (2002) J. Biol. Chem. 277:46043-50.
Белок вириона вируса простого герпеса 16 (VP16) представляет собой трансактиватор, который функционирует, стимулируя транскрипцию вирусных генов в инфицированных HSV клетках. Как в случае других трансактиваторов, VP16 активирует транскрипцию посредством серии белок-белковых взаимодействий, вовлекающих их TAD, которые являются высококислотными. Было показано, что кислотные TAD VP16 взаимодействуют с несколькими белками-партнерами как in vitro, так и in vivo. Например, TAD VP16 содержит мотив взаимодействия, который взаимодействует прямо с субъединицей Tfb1 TFIIH (Langlois et al. (2008) J. Am. Chem. Soc. 130:10596-604), и это взаимодействие коррелирует со способностью VP16 активировать как фазу инициации, так и фазу элонгации транскрипции для предранних генов вирусов.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании описаны новые мотивы белок-белковых взаимодействий TAD, выделенные из белков трансактиваторов растений, и нуклеиновые кислоты, кодирующие их. Эти новые мотивы взаимодействия можно использовать в синтетических TAD для сообщения свойств регуляции генов полипептиду, содержащему TAD. Например, некоторые варианты осуществления включают слитый белок активаторов транскрипции, который содержит полипептид ДНК-связывающего домена и такой полипептид TAD. В зависимости от конкретного ДНК-связывающего домена, который слит с TAD в слитом белке активатора транскрипции, трансактивацию можно использовать для увеличения экспрессии представляющего интерес гена. Например, гетерологичный полинуклеотид, с которым связывается связывающий ДНК домен, может быть функционально связанным с представляющим интерес геном, тем самым осуществляя нацеливание слитого белка (и его функционального TAD), связывание которого увеличит экспрессию представляющего интерес гена. Альтернативно ДНК-связывающий домен можно модифицировать способами инженерии так, чтобы он связывал эндогенный полинуклеотид, который функционально связан с представляющим интерес геном или является проксимальным относительно него. При связывании слитого белка активатора транскрипции с участком связывания ДНК-мишени можно стимулировать транскрипцию гена, функционально связанного с участком связывания ДНК-мишени.
Также в настоящем описании описаны синтетические варианты мотивов белок-белкового взаимодействия TAD и нуклеиновые кислоты, кодирующие их. В некоторых примерах синтетический вариант мотива белок-белкового взаимодействия TAD модифицируют способами инженерии путем внесения одной или нескольких мутаций (например, консервативная мутация или мутация, идентифицированная в ортологе мотива взаимодействия) в TAD трансактиватора (например, трансактиватор растений). Неожиданно синтетический вариант TAD, полученный таким образом, который содержит вариант мотива взаимодействия, может сообщать свойства регулирования генов, отличающиеся от немодифицированного TAD, когда он связан с ДНК-связывающим доменом в слитом белке активатора транскрипции. Например, конкретные синтетические варианты TAD, которые содержат мотив взаимодействия варианта, могут повышать уровень активации транскрипции, сообщаемый встречающимся в природе мотивом взаимодействия TAD, при экспрессии в том же положении в слитом белке, содержащем ДНК-связывающий домен.
Некоторые варианты осуществления включают синтетический слитый белок активатора транскрипции. В конкретных вариантах осуществления слитый белок может увеличивать транскрипцию представляющего интерес гена, где слитый белок содержит первый полипептид, содержащий ДНК-связывающий домен, функционально связанный со вторым полипептидом, содержащим мотив взаимодействия TAD. В некоторых примерах мотив взаимодействия TAD может быть выбран из группы мотивов взаимодействия TAD, состоящей из SEQ ID NO:10-16. Например, но не ограничиваясь ими, мотив взаимодействия TAD может находиться в TAD, содержащем аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2-8 и SEQ ID NO:100-106. В некоторых примерах мотив взаимодействия TAD может представлять собой вариант мотива взаимодействия TAD, имеющий, например, но не ограничиваясь ими, аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:17-58. Например, но не ограничиваясь этим, такой вариант мотива взаимодействия TAD может находиться в TAD, содержащем аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:107-120.
Некоторые варианты осуществления включают полинуклеотид, который кодирует синтетический слитый белок активаторов транскрипции, содержащий первый полипептид, содержащий ДНК-связывающий домен, функционально связанный со вторым полипептидом, содержащим мотив взаимодействия TAD. Полипептид ДНК-связывающего домена может представлять собой любой ДНК-связывающий домен, который специфично связывается с конкретным участком связывания ДНК-мишени. Например, но не ограничиваясь этим, полипептид ДНК-связывающего домена может представлять собой полипептид, выбранный из группы, состоящей из ДНК-связывающего домена в виде цинковых пальцев; ДНК-связывающего домена UPA; GAL4; TAL; LexA; Tet-репрессора; LacR и рецептора стероидных гормонов. В конкретных примерах последовательность, кодирующая ДНК-связывающий домен, может быть выбрана из группы, состоящей из SEQ ID NO:67; SEQ ID NO:68 и SEQ ID NO:99. В конкретных примерах полинуклеотид может содержать последовательность, кодирующую ДНК-связывающий белок, которая по меньшей мере на 80%, 85%, 90%, 95%, 98% или 100% идентична последовательности, выбранной из группы, состоящей из SEQ ID NO:67; SEQ ID NO:68 и SEQ ID NO:99.
В некоторых примерах полинуклеотид может содержать последовательность, кодирующую мотив взаимодействия TAD, которая кодирует мотив взаимодействия TAD или вариант мотива взаимодействия TAD, например, имеющий последовательность, выбранную из SEQ ID NO:10-58. Конкретные варианты осуществления включают полинуклеотид, который кодирует слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD. Конкретные варианты осуществления включают полинуклеотид, который кодирует слитый белок активатора транскрипции, содержащий по меньшей мере один ДНК-связывающий домен.
Примеры полинуклеотидов, которые кодируют синтетический слитый белок активатора транскрипции в соответствии с некоторыми вариантами осуществления изобретения, включают полинуклеотиды, содержащие по меньшей мере одну нуклеотидную последовательность, кодирующую ДНК-связывающий домен, и по меньшей мере одну нуклеотидную последовательность, кодирующую мотив взаимодействия TAD (или его вариант), где полинуклеотид содержит, например, но не ограничиваясь ими, по меньшей мере одну нуклеотидную последовательность, выбранную из группы, состоящей из: SEQ ID NO:79-93; нуклеотидную последовательность, которая по существу идентична одной из SEQ ID NO:79-93; нуклеотидную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с одной из SEQ ID NO:79-93; нуклеотидную последовательность, обладающую по меньшей мере 85% идентичностью последовательности с одной из SEQ ID NO:79-93; нуклеотидную последовательность, обладающую по меньшей мере 90% идентичностью последовательности с одной из SEQ ID NO:79-93; нуклеотидную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с одной из SEQ ID NO:79-93; нуклеотидную последовательность, обладающую по меньшей мере 97% идентичностью последовательности с одной из SEQ ID NO:79-93; нуклеотидную последовательность, обладающую по меньшей мере 98% идентичностью последовательности с одной из SEQ ID NO:79-93; нуклеотидную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с одной из SEQ ID NO:79-93; последовательность, комплементарную полинуклеотиду, который специфически гибридизуется по меньшей мере с одной из SEQ ID NO:79-93; и последовательность, обратно комплементарную полинуклеотиду, который специфически гибридизуется по меньшей мере с одной из SEQ ID NO:79-93.
В некоторых вариантах осуществления полинуклеотид, который кодирует слитый белок активатора транскрипции, можно включать, например, в рекомбинантный вектор, например, для обеспечения экспрессии белка в клетке-хозяине. Таким образом, некоторые примеры включают вектор, содержащий по меньшей мере один полинуклеотид по изобретению, и/или клетку-хозяина, в которую введен такой вектор.
Также в настоящем описании описано средство для трансактивации экспрессии генов растения. Как используют в рамках изобретения, "средство для трансактивации экспрессии генов растения" включает полипептид, выбранный из группы, состоящей из SEQ ID NO:10; SEQ ID NO:11; SEQ ID NO:14; SEQ ID NO:15; SEQ ID NO:22; SEQ ID NO:28; SEQ ID NO:46 и SEQ ID NO:52. В некоторых вариантах осуществления синтетический белок, содержащий по меньшей мере одно средство для трансактивации экспрессии генов растения можно использовать для модулирования экспрессии представляющего интерес гена в клетке растения.
Кроме того, в настоящем описании описаны средства для увеличения экспрессии генов, которые происходят из ERF2. Как используют в рамках изобретения, "средство для увеличения экспрессии генов, которое происходит из ERF2", включает полипептид, выбранный из группы, состоящей из SEQ ID NO:17-22 и SEQ ID NO:121. Кроме того описаны средства для увеличения экспрессии генов, которые происходят из PTI4. Как используют в рамках изобретения, "средство для увеличения экспрессии генов, которое происходит из PTI4" включает полипептид, выбранный из группы, состоящей из SEQ ID NO:23-28 и SEQ ID NO:122. Кроме того, описаны средства для увеличения экспрессии генов, которые происходят из AtERF1. Как используют в рамках изобретения, "средство для увеличения экспрессии генов, которое происходит из AtERF1", включает полипептид, выбранный из группы, состоящей из SEQ ID NO:29-34 и SEQ ID NO:123. Кроме того, описаны средства для увеличения экспрессии генов, которые происходят из ORCA2. Как используют в рамках изобретения, "средство для увеличения экспрессии генов, которое происходит из ORCA2", включает полипептид, выбранный из группы, состоящей из SEQ ID NO:35-40 и SEQ ID NO:124. Кроме того, описаны средства для увеличения экспрессии генов, которые происходят из DREB1A. Как используют в рамках изобретения, "средство для увеличения экспрессии генов, которое происходит из DREB1A", включает полипептид, выбранный из группы, состоящей из SEQ ID NO:41-46 и SEQ ID NO:125. Кроме того, описаны средства для увеличения экспрессии генов, которые происходят из CBF1. Как используют в рамках изобретения, "средство для увеличения экспрессии генов, которое происходит из CBF1", включает полипептид, выбранный из группы, состоящей из SEQ ID NO:47-52 и SEQ ID NO:126. Кроме того, описаны средства для увеличения экспрессии генов, которые происходят из DOF1. Как используют в рамках изобретения, "средство для увеличения экспрессии генов, которое происходит из DOF1", включает полипептид, выбранный из группы, состоящей из SEQ ID NO:53-58 и SEQ ID NO:127.
Также в настоящем описании описаны способы увеличения экспрессии генов с использованием синтетического слитого белка активатора транскрипции. Например, экспрессирующий вектор, содержащий полинуклеотид, кодирующий синтетический слитый белок активатора транскрипции, можно вводить в клетку-хозяина (например, клетку растения, дрожжевую клетку, клетку млекопитающего и иммортализованную клетку), содержащую представляющий интерес ген, функционально связанный с ДНК-связывающим участком, являющимся мишенью слитого белка. Экспрессия слитого белка в клетке-хозяине и последующее связывание слитого белка с функционально связанным ДНК-связывающим участком, являющимся мишенью, может приводить к инициации транскрипции или увеличенной транскрипции представляющего интерес гена. В конкретных примерах ДНК-связывающий участок, являющийся мишенью, можно вводить в клетку-хозяина, так чтобы ДНК-связывающий участок, являющийся мишенью, был функционально связан с представляющим интерес геном. В следующих примерах синтетический слитый белок активатора транскрипции может содержать полипептид ДНК-связывающего домена, который сконструирован так, чтобы он связывался с ДНК-связывающий участком, являющимся мишенью, который функционально связан с представляющим интерес геном.
В некоторых вариантах осуществления вектор, содержащий полинуклеотид, кодирующий синтетический слитый белок активатора транскрипции, можно вводить в клетку-хозяина, так чтобы полинуклеотид впоследствии встраивался в геномную ДНК клетки-хозяина (например, посредством гомологичной рекомбинации). Таким образом, синтетический слитый белок активатора транскрипции, и, более того, нуклеиновая кислота, кодирующая его, могут находиться в трансгенном организме (например, трансгенное растение). Таким образом, такие организмы также описаны в настоящем описании. В примерах нуклеиновая кислота, кодирующая синтетический слитый белок активатора транскрипции, может либо встраиваться случайным образом, либо в заданной области, в геноме клетки трансгенного организма.
Кроме того, описаны способы экспрессии представляющего интерес гена с использованием синтетического слитого белка активатора транскрипции и/или нуклеиновой кислоты, кодирующей его. В некоторых вариантах осуществления вектор, содержащий полинуклеотид, кодирующий синтетический слитый белок активатора транскрипции, можно вводить в клетку-хозяина, содержащую представляющий интерес ген, функционально связанный с участком связывания ДНК, являющимся мишенью для слитого белка. В некоторых примерах синтетический слитый белок активатора транскрипции содержит средство для трансактивации экспрессии генов растения. После введения вектора в клетку-хозяина, экспрессия представляющего интерес гена может инициироваться или увеличиваться, тем самым, продуцируя продукт экспрессии представляющего интерес гена в клетке-хозяине, например, в количестве в соответствии с регулирующим контролем слитого белка. Такие продукты экспрессии можно выделять и/или очищать из клетки-хозяина в соответствии с любым способом, известным в данной области.
Указанные выше и другие признаки станут очевидными из представленного ниже подробного описания нескольких вариантов осуществления, которое предоставлено с отсылкой на прилагаемые чертежи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлен идентифицированный мотив взаимодействия субдомена II домена трансактивации VP16 (TAD) (SEQ ID NO:9). Звездочками указаны аминокислоты субдомена II домена трансактивации VP16, которые предположительно прямо контактируют с субъединицей Tfb1 TFIIH, как предположено в Langlois et al. (2008) J. Am. Chem. Soc. 130:10596-604.
На фиг. 2 представлено выравнивание субдомена трансактивации II VP16 с идентифицированными TAD растений. Приведенные TAD растений содержат мотив взаимодействия. Выровненные мотивы взаимодействия выделены цветом. Остатки мотива взаимодействия субдомена II из VP16, которые предположительно контактируют с факторами транскрипции, обозначены звездочкой (*).
На фиг. 3 представлено выравнивание, демонстрирующее модификации, которые могут быть внесены в мотив взаимодействия TAD ERF2 для получения варианта мотива взаимодействия ERF2. Для сравнения приведены последовательности нативных мотивов взаимодействия ERF2 и VP16. Прямые контакты выделены.
На фиг. 4 представлено выравнивание, демонстрирующее модификации, которые могут быть внесены в мотив взаимодействия TAD PTI4 для получения варианта мотива взаимодействия PTI4. Для сравнения приведены последовательности нативных мотивов взаимодействия PTI4 и VP16. Прямые контакты выделены.
На фиг. 5 представлено выравнивание, демонстрирующие модификации, которые могут быть внесены в мотив взаимодействия TAD AtERF1 для получения варианта мотива взаимодействия AtEFR1. Для сравнения приведены последовательности нативных мотивов взаимодействия AtERF1 и VP16. Прямые контакты выделены.
На фиг. 6 представлено выравнивание, демонстрирующее модификации, которые могут быть внесены в мотив взаимодействия TAD ORCA2 для получения варианта мотива взаимодействия ORCA2. Для сравнения приведены последовательности нативных мотивов взаимодействия ORCA2 и VP16. Прямые контакты выделены.
На фиг. 7 представлено выравнивание, демонстрирующее модификации, которые могут быть внесены в мотив взаимодействия TAD DREB1A для получения варианта мотива взаимодействия DREB1A. Для сравнения приведены последовательности нативных мотивов взаимодействия DREB1A и VP16. Прямые контакты выделены.
На фиг. 8 представлено выравнивание, демонстрирующее модификации, которые могут быть внесены в мотив взаимодействия TAD CBF1 для получения варианта мотива взаимодействия CBF1. Для сравнения приведены последовательности нативных мотивов взаимодействия CBF1 и VP16. Прямые контакты выделены.
На фиг. 9 представлено выравнивание, демонстрирующее модификации, которые могут быть внесены в мотив взаимодействия TAD DOF1 для получения варианта мотива взаимодействия DOF1. Для сравнения приведены последовательности нативных мотивов взаимодействия DOF1 и VP16. Прямые контакты выделены.
На фиг. 10 представлена карта встраивающегося вектора дрожжей pHO-zBG-MEL1, который содержит участки связывания HAS (High Affinity Site, высокоаффинный участок) ZFP выше репортерного гена MEL1. Вектор был нацелен на локус HO S. cerevisiae и содержал ген устойчивости KanMX для селекции как в дрожжах, так и в бактериях.
На фиг. 11 представлена графическая иллюстрация уровней экспрессии репортерного гена Mel1, которая была результатом активации в дрожжах различных трансактивирующих мотивов взаимодействия.
На фиг. 12 представлена карта плазмиды pDAB9897: промотор актина 2 Arabidopsis thaliana, содержащий 8 тандемных участков связывания в виде цинковых пальцев (Z6) на 548-749 пар оснований выше участка начала транскрипции, запускающий репортерный ген gus, использованный для исследования слитых белков трансактивирующих мотивов взаимодействия растений в виде цинковых пальцев. Бинарный вектор также содержит промотор убиквитина 10 A. thaliana, контролирующий селективный маркер pat, для продукции заданного репортерного трансгенного объекта растений.
На фиг. 13 представлена карта плазмиды pDAB107881.
На фиг. 14 представлена карта плазмиды pDAB107882.
На фиг. 15 представлена карта плазмиды pDAB107883.
На фиг. 16 представлена карта плазмиды pDAB107884.
На фиг. 17 представлена карта плазмиды pDAB107885.
На фиг. 18 представлена карта плазмиды pDAB107886.
На фиг. 19 представлена карта плазмиды pDAB107887.
На фиг. 20 представлена карта плазмиды pDAB106272.
На фиг. 21 представлена карта плазмиды pDAB106238.
На фиг. 22 представлена карта плазмиды pDAB106273.
На фиг. 23 представлена карта плазмиды pDAB106274.
На фиг. 24 представлена карта плазмиды pDAB106275.
На фиг. 25 представлена карта плазмиды pDAB106276.
На фиг. 26 представлена карта плазмиды pDAB106277.
На фиг. 27 представлена карта плазмиды pDAB106278.
На фиг. 28 представлена карта плазмиды pDAB106279.
На фиг. 29 изображено графическое представление среднего значения и стандартного отклонения (робмы) и квартили (линии и рамки) уровня транскрипта gus, нормализованного к уровню эндогенной экспрессии гена, для различных введенных трансактивирующих мотивов взаимодействия растений. Активацию репортерного гена gus из различных трансактивирующих мотивов взаимодействия растений сравнивали с контролем в виде пустого вектора и активацией субъединицы домена II белка VP16.
На фиг. 30 представлена карта плазмиды pGalGUS: шесть тандемных участков связывания Gal4, слитых с промотором актина 2 A. thaliana, контролирующим репортерный ген gus, используют для исследования трансактивирующих мотивов взаимодействия растений, слитых со связывающим Gal4 белком. Бинарный вектор также содержит промотор убиквитина 10 A. thaliana, контролирующий селективный маркер pat, для продукции заданного репортерного трансгенного объекта растений.
На фиг. 30 представлена карта плазмиды pTALGUS: восемь тандемных участков связывания UPA-бокс, слитых с промотором актина 2 A. thaliana, контролирующим репортерный ген gus, используют для исследования трансактивирующих мотивов взаимодействия растений, слитых со связывающим TAL белком. Бинарный вектор также содержит промотор убиквитина 10 A. thaliana, контролирующий селективный маркер pat, для продукции заданного репортерного трансгенного объекта растений.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот, приведенные в прилагаемом списке последовательностей, представлены с использованием стандартных буквенных сокращений для нуклеотидных оснований, как определено в 37 C.F.R. § 1.822. Представлена только одна цепь каждой последовательности нуклеиновой кислоты, однако понятно, что комплементарная цепь включена путем любого указания на представленную цепь. На прилагаемом списке последовательностей:
В SEQ ID NO:1 представлен домен трансактивации растений VP16, содержащий мотив взаимодействия (подчеркнут): GMTHDPVSYGALDVDDFEFEQMFTDALGIDDFGG
В SEQ ID NO:2 представлен домен трансактивации растений ERF2, содержащий мотив взаимодействия (подчеркнут): NDSEDMLVYGLLKDAFHFDTSSSDLSCLFDFPA
В SEQ ID NO:3 представлен домен трансактивации растений PTI4, содержащий мотив взаимодействия (подчеркнут): CLTETWGDLPLKVDDSEDMVIYGLLKDALSVGWSPFSFTAG
В SEQ ID NO:4 представлен домен трансактивации растений AtERF1, содержащий мотив взаимодействия (подчеркнут): CFTESWGDLPLKENDSEDMLVYGILNDAFHGG
В SEQ ID NO:5 представлен домен трансактивации растений ORCA2, содержащий мотив взаимодействия (подчеркнут): FNENCEEIISPNYASEDLSDIILTDIFKDQDNYEDE
В SEQ ID NO:6 представлен домен трансактивации растений DREB1A, содержащий мотив взаимодействия (подчеркнут): GFDMEETLVEAIYTAEQSENAFYMHDEAMFEMPSLLANMAEGM
В SEQ ID NO:7 представлен домен трансактивации растений CBF1, содержащий мотив взаимодействия (подчеркнут): EQSEGAFYMDEETMFGMPTLLDNMAEG
В SEQ ID NO:8 представлен домен трансактивации растений DOF1, содержащий мотив взаимодействия (подчеркнут): SAGKAVLDDEDSFVWPAASFDMGACWAGAGFAD
В SEQ ID NO:9 представлен субдомен II домена трансактивации VP16, который представляет собой мотив взаимодействия в SEQ ID NO:1: DDFEFEQMFTD
В SEQ ID NO:10 представлен мотив взаимодействия домена трансактивации растений ERF2: DAFHFDTSSSD
В SEQ ID NO:11 представлен мотив взаимодействия домена трансактивации растений PTI4: DDSEDMVIYGLLKD
В SEQ ID NO:12 представлен мотив взаимодействия домена трансактивации растений AtERF1: ENDSEDMLV
В SEQ ID NO:13 представлен мотив взаимодействия домена трансактивации растений ORCA2: EDLSDIILTD
В SEQ ID NO:14 представлен мотив взаимодействия домена трансактивации растений DREB1A: ENAFYMHDEAMFEMP
В SEQ ID NO:15 представлен мотив взаимодействия домена трансактивации растений CBF1: DEETMFGMP
В SEQ ID NO:16 представлен мотив взаимодействия домена трансактивации растений DOF1: EDSFVWPAASFD
В SEQ ID NO:17-22 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений ERF2.
В SEQ ID NO:23-28 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений PTI4.
В SEQ ID NO:29-34 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений AtERF1.
В SEQ ID NO:35-40 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений ORCA2.
В SEQ ID NO:41-46 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений DREB1A.
В SEQ ID NO:47-52 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений CBF1.
В SEQ ID NO:53-58 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений DOF1.
В SEQ ID NO:59-66 представлены праймеры, используемые для конструирования плазмиды pHO-zBG-MEL1.
В SEQ ID NO:67 представлена полинуклеотидная последовательность ДНК-связывающего домена: TGTGGTGGGAGAGGAGGGTGG
В SEQ ID NO:68 представлена последовательность 8x тандемного повтора ДНК-связывающего домена Z6: GGTGTGGTGGGAGAGGAGGGTGGGAGTGTGGTGGGAGAGGAGGGTGGCTCTGTGGTGGGAGAGGAGGGTGGAGATGTGGTGGGAGAGGAGGGTGGTCTTGTGGTGGGAGAGGAGGGTGGGGATGTGGTGGGAGAGGAGGGTGGCCTTGTGGTGGGAGAGGAGGGTGGAGGTGTGGTGGGAGAGGAGGGTGGCTTAAGCCGC
В SEQ ID NO:69-74 представлены праймеры и зонды, использованные в анализах HP pat и pal.
В SEQ ID NO:75-78 представлены праймеры, использованные для анализа способом ПЦР PTU в табаке.
В SEQ ID NO:79 представлена синтетическая нуклеотидная последовательность, кодирующая нативный мотив взаимодействия домена трансактивации растений из VP16, который был слит со связывающим белком с цинковыми пальцами Z6: GGCATGACCCATGATCCTGTGTCTTATGGAGCCTTGGATGTTGATGACTTTGAGTTTGAGCAGATGTTCACAGATGCACTGGGCATCGATGACTTTGGTGGA
В SEQ ID NO:80 представлена синтетическая нуклеотидная последовательность (v3), кодирующая нативный мотив взаимодействия домена трансактивации растений из ERF2, который был слит со связывающим белком с цинковыми пальцами Z6: AATGACTCTGAGGACATGCTGGTGTATGGTTTGCTCAAGGATGCCTTTCACTTTGACACCTCCAGCTCAGACCTCTCCTGCCTCTTTGACTTCCCAGCC
В SEQ ID NO:81 представлена синтетическая нуклеотидная последовательность (v3), кодирующая нативный трансактивирующий мотив взаимодействия растений из PTI4, который был слит со связывающим белком с цинковыми пальцами Z6: TGCCTGACAGAAACTTGGGGAGACTTGCCTCTCAAGGTTGATGACTCTGAGGACATGGTGATCTATGGTCTGTTGAAGGATGCACTCTCAGTGGGGTGGTCCCCATTCTCTTTCACGGCTGGT
В SEQ ID NO:82 представлена синтетическая нуклеотидная последовательность (v3), кодирующая нативный мотив взаимодействия домена трансактивации растений из AtERF1, который был слит со связывающим белком с цинковыми пальцами Z6: TGCTTCACGGAATCCTGGGGAGACCTTCCTTTGAAGGAGAATGACTCTGAGGACATGTTGGTGTACGGAATCCTCAATGATGCTTTTCATGGTGGC
В SEQ ID NO:83 представлена синтетическая нуклеотидная последовательность (v3), кодирующая нативный мотив взаимодействия домена трансактивации растений из ORCA2, который был слит со связывающим белком с цинковыми пальцами Z6: TTCAATGAGAATTGTGAAGAAATCATCTCTCCAAACTACGCATCAGAGGACTTGTCTGACATCATCTTGACGGACATCTTCAAGGACCAAGACAACTATGAGGATGAG
В SEQ ID NO:84 представлена синтетическая нуклеотидная последовательность (v3), кодирующая нативный мотив взаимодействия домена трансактивации растений из DREB1A, который был слит со связывающим белком с цинковыми пальцами Z6: GGCTTTGACATGGAAGAAACATTGGTGGAGGCCATCTACACTGCTGAACAGAGCGAGAATGCCTTCTACATGCATGATGAGGCAATGTTTGAGATGCCATCTCTTCTGGCCAACATGGCTGAGGGAATG
В SEQ ID NO:85 представлена синтетическая нуклеотидная последовательность (v3), кодирующая нативный мотив взаимодействия домена трансактивации растений из CBF1, который был слит со связывающим белком с цинковыми пальцами Z6: GAACAGTCAGAAGGTGCTTTCTACATGGATGAAGAGACCATGTTTGGGATGCCAACCCTTCTGGATAACATGGCAGAGGGA
В SEQ ID NO:86 представлена синтетическая нуклеотидная последовательность (v3), кодирующая нативный мотив взаимодействия домена трансактивации растений из DOF1, который был слит со связывающим белком с цинковыми пальцами Z6: TCAGCTGGGAAGGCAGTCTTGGATGATGAGGACAGCTTTGTTTGGCCTGCTGCATCCTTTGACATGGGTGCCTGCTGGGCTGGAGCTGGCTTTGCTGAC
В SEQ ID NO:87 представлена синтетическая нуклеотидная последовательность (v2), кодирующая иллюстративный вариант мотива взаимодействия домена трансактивации растений из ERF2, который был слит со связывающим белком с цинковыми пальцами Z6: AATGACTCTGAGGACATGCTGGTGTATGGTTTGCTCAAGGATGATTTCCACTTTGAGACAATGTTCTCAGACCTGTCCTGCCTCTTTGACTTCCCAGCC
В SEQ ID NO:88 представлена синтетическая нуклеотидная последовательность (v2), кодирующая иллюстративный вариант мотива взаимодействия домена трансактивации растений из PTI4, который был слит со связывающим белком с цинковыми пальцами Z6: TGCCTGACAGAAACTTGGGGAGACTTGCCTCTCAAGGTTGATGACTTTGAGTTTGAGATGATGTTCACAGATGCACTCTCAGTGGGGTGGTCCCCATTCTCTTTCACGGCTGGT
В SEQ ID NO:89 представлена синтетическая нуклеотидная последовательность (v2), кодирующая иллюстративный вариант мотива взаимодействия домена трансактивации растений из AtERF1, который был слит со связывающим белком с цинковыми пальцами Z6: TGCTTCACGGAATCCTGGGGAGACCTTCCTTTGAAGGAGAATGACTTTGAGTTTGAAATGTTCACAGATTACGGAATCCTCAATGATGCTTTTCATGGTGGC
В SEQ ID NO:90 представлена синтетическая нуклеотидная последовательность (v2), кодирующая иллюстративный вариант мотива взаимодействия домена трансактивации растений из ORCA2, который был слит со связывающим белком с цинковыми пальцами Z6: TTCAATGAGAATTGTGAAGAAATCATCTCTCCAAACTACGCATCAGAGGACTTTGATCTTGAGATGTTGACGGACATCTTCAAGGACCAAGACAACTATGAGGATGAG
В SEQ ID NO:91 представлена синтетическая нуклеотидная последовательность (v2), кодирующая иллюстративный вариант мотива взаимодействия домена трансактивации растений из DREB1A, который был слит со связывающим белком с цинковыми пальцами Z6: GGCTTTGACATGGAAGAAACATTGGTGGAGGCCATCTACACTGCTGAACAGAGCGAGGACTTTGAGTTTGAAGCAATGTTCATGGATTCTCTTCTGGCCAACATGGCTGAGGGAATG
В SEQ ID NO:92 представлена синтетическая нуклеотидная последовательность (v2), кодирующая иллюстративный вариант мотива взаимодействия домена трансактивации растений из CBF1, который был слит со связывающим белком с цинковыми пальцами Z6: GAACAGTCAGAAGGTGCTTTCTACATGGATGACTTTGAGTTCGAGACAATGTTCATGGACACCCTTCTGGATAACATGGCAGAGGGA
В SEQ ID NO:93 представлена синтетическая нуклеотидная последовательность (v2), кодирующая иллюстративный вариант мотива взаимодействия домена трансактивации растений из DOF1, который был слит со связывающим белком с цинковыми пальцами Z6: TCAGCTGGGAAGGCAGTCTTGGATGATGAGGACTTTGAGTTTGAAGCCATGTTCACGGACATGGGTGCCTGCTGGGCTGGAGCTGGCTTTGCTGAC
В SEQ ID NO:94-98 представлены праймеры и зонды, использованные в анализах HP gus и BYEEF.
В SEQ ID NO:99 представлена последовательность тандемного повтора, взятая из консенсусной связывающей последовательности индуцируемых AVRBS3 генов, и называемая ДНК-связывающим доменом UPA: TATATAAACCTNNCCCTCT
В SEQ ID NO:100 представлен иллюстративный синтетический домен трансактивации, содержащий мотив взаимодействия домена трансактивации ERF2 растений (подчеркнут): GMTHDPVSYGALDVDAFHFDTSSSDALGIDDFGG
В SEQ ID NO:101 представлен иллюстративный синтетический домен трансактивации, содержащий мотив взаимодействия домена трансактивации PTI4 растений (подчеркнут): GMTHDPVSYGALDVDDSEDMVIYGLLKDALGIDDFGG
В SEQ ID NO:102 представлен иллюстративный синтетический домен трансактивации, содержащий мотив взаимодействия домена трансактивации AtERF1 растений (подчеркнут): GMTHDPVSYGALDVENDSEDMLVALGIDDFGG
В SEQ ID NO:103 представлен иллюстративный синтетический домен трансактивации, содержащий мотив взаимодействия домена трансактивации ORCA2 растений (подчеркнут): GMTHDPVSYGALDVEDLSDIILTDALGIDDFGG
В SEQ ID NO:104 представлен иллюстративный синтетический домен трансактивации, содержащий мотив взаимодействия домена трансактивации DREB1A растений (подчеркнут): GMTHDPVSYGALDVENAFYMHDEAMFEMPALGIDDFGG
В SEQ ID NO:105 представлен иллюстративный синтетический домен трансактивации, содержащий мотив взаимодействия домена трансактивации CBF1 растений (подчеркнут): GMTHDPVSYGALDVDEETMFGMPALGIDDFGG
В SEQ ID NO:106 представлен иллюстративный синтетический домен трансактивации, содержащий мотив взаимодействия домена трансактивации DOF1 растений (подчеркнут): GMTHDPVSYGALDVEDSFVWPAASFDALGIDDFGG
В SEQ ID NO:107 представлен иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации ERF2 растений (подчеркнут): GMTHDPVSYGALDVDDFHFETMFSDALGIDDFGG
В SEQ ID NO:108 представлен дополнительный иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации ERF2 растений (подчеркнут): NDSEDMLVYGLLKDDFHFETMFSDLSCLFDFPA
В SEQ ID NO:109 представлен иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации PTI4 растений (подчеркнут): GMTHDPVSYGALDVDDFEFEMMFTDALGIDDFGG
В SEQ ID NO:110 представлен дополнительный иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации PTI4 растений (подчеркнут): CLTETWGDLPLKVDDFEFEMMFTDALSVGWSPFSFTAG
В SEQ ID NO:111 представлен иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации AtERF1 растений (подчеркнут): GMTHDPVSYGALDVENDFEFEMFTDALGIDDFGG
В SEQ ID NO:112 представлен дополнительный иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации AtERF1 растений (подчеркнут): CFTESWGDLPLKENDFEFEMFTDYGILNDAFHGG
В SEQ ID NO:113 представлен иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации ORCA2 растений (подчеркнут): GMTHDPVSYGALDVEDFDLEMLTDALGIDDFGG
В SEQ ID NO:114 представлен дополнительный иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации ORCA2 растений (подчеркнут): FNENCEEIISPNYASEDFDLEMLTDIFKDQDNYEDE
В SEQ ID NO:115 представлен иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации DREB1A растений (подчеркнут): GMTHDPVSYGALDVEDFEFEAMFMDALGIDDFGG
В SEQ ID NO:116 представлен следующий иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации DREB1A растений (подчеркнут): GFDMEETLVEAIYTAEQSEDFEFEAMFMDSLLANMAEGM
В SEQ ID NO:117 представлен иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации CBF1 растений (подчеркнут): GMTHDPVSYGALDVDDFEFETMFMDALGIDDFGG
В SEQ ID NO:118 представлен следующий иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации CBF1 растений (подчеркнут): EQSEGAFYMDDFEFETMFMDTLLDNMAEG
В SEQ ID NO:119 представлен иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации DOF1 растений (подчеркнут): GMTHDPVSYGALDVEDFEFEAMFTDALGIDDFGG
В SEQ ID NO:120 представлен следующий иллюстративный синтетический домен трансактивации, содержащий вариант мотива взаимодействия домена трансактивации DOF1 растений (подчеркнут): SAGKAVLDDEDFEFEAMFTDMGACWAGAGFAD
В SEQ ID NO:121-127 представлены последовательности вариантов мотива взаимодействия домена трансактивации растений.
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор нескольких вариантов осуществления
В настоящем описании описаны новые домены трансактивации растений (TAD), мотивы взаимодействия TAD и синтетические варианты указанных выше, которые могут быть пригодными в качестве активаторов транскрипции, и которые могут быть слитыми в синтетическом слитом белке активатора транскрипции с ДНК-связывающим полипептидом для активации транскрипции представляющего интерес гена. Конкретные новые TAD растений и мотивы взаимодействия TAD, описанные в настоящем описании, были выделены из белков растений ERF2; PTI4; AtERF1; ORCA2; DREB1A; CBF1 и DOF1. Синтетические слитые белки активаторов транскрипции, содержащий новые TAD и/или мотивы взаимодействия TAD растений, как описано в настоящем описании, могут быть пригодными в конкретных вариантах осуществления для увеличения (например, инициации) экспрессии генов в различных клетках (например, клетки дрожжей и клетки растений) и практически для любого гена.
Домены трансактивации являются функционально автономными; т.е. один TAD может регулировать транскрипцию, когда он слит с одним из многих различных гетерологичных ДНК-связывающих доменов, и когда он связывается с различными положениями в промоторной области. Hall and Struhl (2002), выше. Полагают, что TAD обладают небольшой гомологией первичных последовательностей и приобретают определенную структуру только при связывании с мишенью. Sigler (1988), выше. Хотя полагают, что кислые и гидрофобные остатки в TAD являются важными (см., например, Cress and Triezenberg (1991), выше), полагают, что вклад индивидуальных остатков в активность является небольшим. Hall and Struhl (2002), выше.
Трудно априорно предсказать, будет ли синтетический мотив взаимодействия домена трансактивации функционировать, инициируя или усиливая экспрессию в клетке растения. Эта непредсказуемость может быть по меньшей мере частично следствием того факта, что некоторые TAD являются очень сильными трансактиваторами, которые могут приводить к "подавлению" (например, путем титрования компонентов аппарата транскрипции клетки) в зависимости как от их внутриклеточной концентрации, так и от силы их TAD. См., например, патент США 6271341 (мутантные TAD VP16 с градируемой регуляцией генов).
В настоящем описании описано неожиданное открытие, что новые TAD и мотивы взаимодействия TAD растений, обладающие гомологией последовательностей с TAD VP16, обеспечивают различные уровни регуляции генов под их контролем. С использованием обобщаемой стратегии "обмена" TAD для получения синтетических слитых белков активатора транскрипции, неожиданно было открыто, что новые TAD и мотивы взаимодействия TAD, выделенные из PTI4, DREB1A, ERF2 и CBF1, могут обеспечить большее увеличение транскрипции генов в клетке растения, чем VP16, который признан в данной области как очень хороший трансактиватор. Также было открыто, что новые TAD и мотивы взаимодействия TAD из AtERF1, ORCA2 и DOF1 обеспечивают меньшее увеличение транскрипции генов.
Также в настоящем описании описано неожиданное открытие, что варианты TAD и мотивов взаимодействия TAD, содержащие очень мало и незначительные изменения аминокислот в отношении нативной последовательности, могут обеспечить дополнительное усиление или регуляцию свойств регулирования генов, которые проявляет нативный TAD. Например, неожиданно было открыто, что варианты мотивов взаимодействия TAD ERF2 и CBF1 привели к значительно более высокой транскрипции гена под их контролем, чем соответствующий нативный мотив взаимодействия в растениях.
II. Сокращения
chs - ген хальконсинтазы
HAS - высокоаффинный участок
HP - зонд для гидролиза
HSV - Вирус простого герпеса
MS - Murashige и Skoog
PNPG - п-нитрофенил-альфа-D-глюкопиранозид
PTU - единица транскрипции растений
SSC - солевой раствор-цитрат натрия
TAD - домен трансактивации
TBP - TATA-связывающий белок
T-ДНК -переносимая ДНК
TFIIB - фактор транскрипции IIB
TFIIH - фактор транскрипции IIH
Ti - индуцирующие опухоль (плазмиды, происходящие из A. tumefaciens)
UAS - вышележащая последовательность активации
VP16 - белок 16 вириона простого герпеса
III. Термины
Чтобы упростить обзор различных вариантов осуществления изобретения, предоставлены следующие пояснения конкретных терминов:
Эндогенный: как используют в рамках изобретения, термин "эндогенный" относится к веществам (например, молекулы нуклеиновой кислоты и полипептиды), которые происходят из конкретного организма, ткани или клетки. Например, "эндогенный" полипептид, экспрессируемый в клетке растения, может относиться к полипептиду, который обычно экспрессируется в клетках того же типа из не модифицированных способами генной инженерии растений того же вида. Аналогично, "эндогенная" нуклеиновая кислота, содержащаяся в клетке растения может относиться к нуклеиновой кислоте (например, геномная ДНК), которая обычно встречается в клетках того же типа из не модифицированных способами инженерии растений того же вида.
Экспрессия: как используют в рамках изобретения, "экспрессия" кодирующей последовательности (например, гена или трансгена) относится к процессу, посредством которого кодируемая информация транскрипционного элемента нуклеиновой кислоты (включая, например, геномную ДНК или кДНК) преобразуется в функциональную, нефункциональную или структурную часть клетки (например, белок). На экспрессию генов могут влиять внешние сигналы; например, воздействие на клетку, ткань или организм агента, который увеличивает или снижает экспрессию гена, содержащегося в них. Экспрессия гена также может регулироваться на любом этапе в каскаде от ДНК к РНК к белку. Регуляция экспрессии гена происходить, например, путем контроля, действующего на транскрипцию, трансляцию, транспорт и процессинг РНК, деградацию промежуточных молекул, таких как мРНК, или путем активации, инактивации, компартментализации или деградации конкретных молекул белков после их получения, или путем комбинации любого из вышеуказанных. Экспрессию гена можно измерять на уровне РНК или на уровне белка любым способами, известными в данной области, включая, но не ограничиваясь ими, нозерн-блоттинг, ОТ-ПЦР, вестерн-блоттинг или анализ(ы) активности белка in vitro, in situ или in vivo.
Увеличение экспрессии: Как используют в рамках изобретения, термин "увеличение экспрессии" относится к инициации экспрессии, а также к количественному увеличению продукта экспрессии, продуцированного с конструкции матрицы. В некоторых вариантах осуществления полипептид, содержащий TAD, можно использовать для "увеличения экспрессии" с нуклеиновой кислоты. В таких вариантах осуществления увеличение экспрессии можно определять путем сравнения с количеством продукта экспрессии, продуцированного в контроле (например, с конструкции в отсутствие белка, содержащего домен трансактивации растений).
Слитый белок: как используют в рамках изобретения, термин "слитый белок" относится к молекуле, содержащей по меньшей мере два функционально связанных полипептида. В определенных примерах два функционально связанных полипептида могут в норме экспрессироваться в качестве части продуктов различных генов (например, в различных организмах). В следующих примерах по меньшей мере два функционально связанных полипептида могут происходить из полипептидов, в норме экспрессируемых в качестве части продуктов различных генов. Функционально связанные полипептиды, присутствующие в слитом белке, описанном в настоящем описании, как правило, взаимодействуют по меньшей мере с одним белком-мишенью или нуклеиновой кислотой-мишенью в клетке, где слитый белок будет экспрессироваться. Например, функционально связанный полипептид может взаимодействовать с одним или несколькими фактором(ами) транскрипции или белковым элементом(ами) клеточного аппарата транскрипции, или он может взаимодействовать с конкретным полинуклеотидом или структурным элементом нуклеиновой кислоты.
Гетерологичный: как используют в рамках изобретения, термин "гетерологичный" относится к веществам (например, молекулы нуклеиновой кислоты и полипептиды), которые не происходят из конкретного организма, ткани или клетки. Например, "гетерологичный" полипептид, экспрессируемый в клетке растения, может относиться к полипептиду, который обычно не экспрессируется в клетках того же типа из не модифицированных способами генной инженерии растений того же вида (например, полипептид, который экспрессируется в других клетках того же организма или клетках другого организма).
Выделенный: "выделенный" биологический компонент (такой как нуклеиновая кислота или белок) по существу отделен, продуцирован отдельно или очищен от других биологических компонентов в клетке организма, в которой компонент встречается в природе (например, другие хромосомные и внехромосомные ДНК и РНК, и белки), одновременно обеспечивая химическое или функциональное изменение компонента (например, нуклеиновая кислота может быть выделена из хромосомы путем разрушения химических связей, соединяющих нуклеиновую кислоту с остальной ДНК в хромосоме). Молекулы нуклеиновых кислот и белки, которые являются "выделенными", могут включать молекулы нуклеиновой кислоты и белки, очищенные стандартными способами очистки. Термин охватывает нуклеиновые кислоты и белки, полученные путем рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные молекулы нуклеиновой кислоты, белки и пептиды.
Молекула нуклеиновой кислоты: как используют в рамках изобретения, термин "молекула нуклеиновой кислоты" может относиться к полимерной форме нуклеотидов, которая может включать как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК, и их синтетические формы и смешанные полимеры. Нуклеотид может относиться к рибонуклеотиду, дезоксирибонуклеотиду или модифицированной форме любого типа нуклеотида. "Молекула нуклеиновой кислоты", как используют в рамках изобретения, является синонимом "нуклеиновой кислоты" и "полинуклеотида". Молекула нуклеиновой кислоты обычно имеет по меньшей мере 10 оснований в длину, если нет иных указаний. Термин включает одноцепечечные и двухцепочечные формы ДНК. Молекула нуклеиновой кислоты может включать либо модифицированные нуклеотиды, либо и те, и другие, связанные вместе встречающимися в природе и/или не встречающимися в природе нуклеотидными связями.
"Экзогенная" молекула представляет собой молекулу, которая не является нативной для определенной системы (например, зародышевая плазма, сорт, элитный сорт и/или растение) в отношении нуклеотидной последовательности и/или положения полинуклеотида в геноме, и в отношении аминокислотной последовательности и/или клеточной локализации полипептида. В вариантах осуществления экзогенные или гетерологичные полинуклеотиды или полипептиды могут представлять собой молекулы, которые искусственным образом предоставлены биологической системе (например, клетка растения, ген растения, конкретный вид или сорт растений, и/или хромосома растения) и они не являются нативными для конкретной биологической системы. Таким образом, обозначение нуклеиновой кислоты как "экзогенная" может указывать на то, что нуклеиновая кислота произошла из источника, отличного от природного источника, или оно может указывать на то, что нуклеиновая кислота имеет неприродную конфигурацию, генетическое положение или расположение элементов.
Напротив, например, "нативная" или "эндогенная" нуклеиновая кислота представляет собой нуклеиновую кислоту (например, ген), которая не содержит элемент нуклеиновой кислоты, отличный от элементов, в норме присутствующих в хромосоме или другом генетическом материале, в котором нуклеиновая кислота в норме встречается в природе. Транскрипт эндогенного гена кодируется нуклеотидной последовательностью в ее природном хромосомном локусе и не предоставляется искусственным образом клетке.
Молекулы нуклеиновых кислот могут быть модифицированными химически или биохимически, или могут содержать неприродные или преобразованные нуклеотидные основания, как хорошо понятно специалистам в данной области. Такие модификации включают, например, метки, метилирование, замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации (например, незаряженные связи: например, метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.; заряженные связи: например, фосфоротиоаты, фосфородитиоаты и т.д.; выступающие части: например, пептиды; интеркалирующие агенты: например, акридин, псорален и т.д.; хелаторы; алкилаторы и модифицированные связи: например, альфа-аномерные нуклеиновые кислоты и т.д.). Термин "молекула нуклеиновой кислоты" также включает любую топологическую конформацию, включая одноцепочечную, двухцепочечную, частично дуплексную, триплексную, шпилечную, кольцеобразную конформации и конформацию висячего замка.
В некоторых вариантах осуществления используется конкретная форма нуклеиновой кислоты - олигонуклеотид. Олигонуклеотиды представляют собой относительно короткие молекулы нуклеиновой кислоты, как правило, содержащие 50 или менее нуклеотидных оснований (хотя некоторые олигонуклеотиды могут содержать более 50). Олигонуклеотид может быть образован путем расщепления (например, рестрикционное расщепление) более длинной нуклеиновой кислоты, содержащей олигонуклеотидную последовательность, или он может быть химически синтезированным специфическим для последовательности образом из отдельных нуклеозидфосфорамидитов.
Олигонуклеотид можно использовать в качестве последовательности зонда для обнаружения молекулы нуклеиновой кислоты, содержащей конкретную нуклеотидную последовательность. В соответствии с вышеуказанным, олигонуклеотидный зонд можно получать синтетически или путем клонирования. Пригодные векторы для клонирования известны специалистам в данной области. Олигонуклеотидный зонд может быть меченым или немеченым. Существует широкое множество способов мечения молекул нуклеиновых кислот, включая, например, но не ограничиваясь ими, радиоактивное мечение способом ник-трансляции; использование случайных праймеров; и достраивание концевой дезокситрансферазой, где используемые нуклеотиды являются меченными, например, радиоактивным 32P. Другие метки, которые можно использовать, включают, например, но не ограничиваясь ими: флуорофоры; ферменты; субстраты ферментов; кофакторы ферментов; и ингибиторы ферментов. Альтернативно использование метки, которая обеспечивает поддающийся обнаружению сигнал сама по себе или совместно с другими реакционноспособными веществами, можно заменять лигандами, с которыми связываются рецепторы, где рецепторы являются мечеными (например, указанными выше метками) для обеспечения поддающихся обнаружению сигналов либо сами по себе, либо совместно с другими реагентами. См., например, Leary et al. (1983) Proc. Natl. Acad. Sci. USA 80:4045-9.
Некоторые варианты осуществления изобретения включают полинуклеотид, который "способен специфично гибридизоваться" или "специфически комплементарен" нуклеотидной последовательности-мишени. "Способный специфично гибридизоваться" и "специфически комплементарный" представляют собой термины, которые указывают на достаточную степень комплементарности, чтобы стабильное и специфическое связывание происходило между полинуклеотидом и молекулой нуклеиновой кислоты, содержащей конкретную нуклеотидную последовательность-мишень. Молекула нуклеиновой кислоты не должна быть на 100% комплементарной ее последовательности мишени, чтобы быть способной специфически гибридизоваться. Молекула нуклеиновой кислоты является специфически гибридизующейся, когда существует достаточная степень комплементарности, чтобы избежать неспецифического связывания нуклеиновой кислоты с не являющимися мишенями последовательностями в условиях, в которых является желательным специфическое связывание, например, в жестких условиях гибридизации.
Условия гибридизации, обеспечивающие конкретные степени жесткости, варьируют, в зависимости от типа выбранного способа гибридизации и композиции и длины гибридизующихся последовательностей нуклеиновых кислот. Как правило, жесткость гибридизации обеспечивается температурой гибридизации и ионной силой (особенно концентрацией Na+ и/или Mg++) буфера для гибридизации, хотя также на жесткость влияет количество раз промывания. Вычисления, касающиеся условий гибридизации, требуемых для достижения конкретных степеней жесткости, известны средним специалистам в данной области, и рассмотрены, например, в Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, chapters 9 and 11; and Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Дальнейшая детальная инструкция и руководство в отношении гибридизации нуклеиновых кислот могут быть найдены, например, в Tijssen, “Overview of principles of hybridization and the strategy of nucleic acid probe assays,” in Laboratory Techniques in Biochemistry and Molecular Biology- Hybridization with Nucleic Acid Probes, Part I, Chapter 2, Elsevier, NY, 1993; and Ausubel et al., Eds., Current Protocols in Molecular Biology, Chapter 2, Greene Publishing and Wiley-Interscience, NY, 1995.
Как используют в рамках изобретения, "жесткие условия" охватывают условия, при которых гибридизация происходит, только если существует менее 25% несоответствий между гибридизующейся молекулой и ДНК-мишенью. "Жесткие условия" включают другие конкретные уровни жесткости. Таким образом, как используют в рамках изобретения, условия "умеренной жесткости" представляют собой условия, в которых молекулы с более чем 25% несоответствием последовательностей не гибридизуются; условия "средней" жесткости представляют собой условия, в которых молекулы с более чем 15% несоответствием последовательностей не гибридизуются; условия "высокой жесткости" представляют собой условия, в которых последовательности с более чем 10% несоответствий не гибридизуются. Условия "очень высокой жесткости" представляют собой условия, при которых последовательности с более чем 6% несоответствий не гибридизуются.
В конкретных вариантах осуществления жесткие условия представляют собой гибридизацию в течение 1 часа при 65°C в буфере для гибридизации PerfectHyb™ plus (Sigma-Aldrich), а затем последовательные промывания в течение 40 минут при 65°C в 0,1X SSC/0,1% SDS.
Функционально связанный: первая нуклеотидная последовательность "функционально связана" со второй нуклеотидной последовательностью, когда первая нуклеотидная последовательность находится во функциональной взаимосвязи со второй нуклеотидной последовательностью. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. В случае рекомбинантной продукции функционально связанные нуклеотидные последовательности, как правило, являются соседними и, когда необходимо связать две кодирующих белок области, находятся в одной и той же рамке считывания. Однако нуклеотидные последовательности не должны быть соседними, чтобы быть функционально связанными.
Термин "функционально связанный", когда его используют в отношении регуляторной последовательности и кодирующей последовательности гена, означает, что регуляторная последовательность влияет на экспрессию связанной с ней кодирующей последовательности. "Регуляторные последовательности" или "элементы контроля" относятся к нуклеотидным последовательностям, которые влияют на время и уровень/величину транскрипции, процессинга или стабильности РНК, или трансляции ассоциированной с ними кодирующей последовательности. Традиционные регуляторные последовательности могут включать 5'-нетранслируемые области; промоторы; лидерные последовательности трансляции; интроны; энхансеры; структуры стебель-петля; связывающие репрессор последовательности; последовательности терминации; распознающие полиаденилирвоание последовательности и т.д. Конкретные регуляторные последовательности могут быть расположены выше и/или ниже кодирующей последовательности, функционально связанной с ней. Также конкретные регуляторные последовательности, функционально связанные с кодирующей последовательностью, могут быть расположены на ассоциированной с ними комплементарной цепи двухцепочечной молекулы нуклеиновой кислоты. Элементы, которые могут быть "функционально связанными" с кодирующей последовательностью, не ограничиваются промоторами или другими общепринятыми регуляторными последовательностями. Например, в некоторых вариантах осуществления ДНК-связывающий домен белка трансактиватора может связываться с нуклеотидной последовательностью, которая расположена проксимально относительно промотора или другой регуляторной области, так чтобы белок-трансактиватор мог взаимодействовать с промотором или другой регуляторной областью, или молекулой, связанной с ними (например, фактор транскрипции) для воздействия на транскрипцию. В таких примерах нуклеотидная последовательность, с которой связывается белок-трансактиватор через его ДНК-связывающий домен, является "функционально связанным" с кодирующей последовательностью под контролем промотора или другой регуляторной последовательности.
Функционально связанные полипептиды: как используют в рамках изобретения в отношении полипептидов, термин "функционально связанный" относится по меньшей мере к двум полипептидам, которые связаны в одной молекуле (например, слитый белок) и таким образом, чтобы каждый полипептид мог выполнять предназначенную ему функцию. Как правило, по меньшей мере два полипептида ковалентно связаны через пептидные связи. Слитый белок, содержащий функционально связанные полипептиды, можно получать стандартными способами рекомбинантных ДНК. Например, молекула ДНК, кодирующая первый полипептид, может быть лигирована с другой молекулой ДНК, кодирующей второй полипептид, и полученная гибридная молекула ДНК может экспрессироваться в клетке-хозяине с образованием слитого белка, содержащего первый и второй полипептиды. В конкретных примерах две молекулы ДНК могут быть лигированы друг с другом в ориентации от 5' к 3', так чтобы после лигирования рамка трансляции кодируемых полипептидов не изменялась (т.е. молекулы ДНК лигированы друг с другом в рамке считывания).
Промотор: как используют в рамках изобретения, термин "промотор" относится к области ДНК, которая может быть расположена выше от начала транскрипции, и которая может быть вовлечена в распознавание и связывание РНК-полимеразы и других белков для обеспечения транскрипции. Промотор может быть функционально связан с кодирующей последовательностью для экспрессии в клетке или промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с кодирующей последовательностью, для экспрессии в клетке. "Промотор растений" может представлять собой промотор, способный инициировать транскрипцию в клетке растения.
Примеры промоторов, находящихся под контролем стадии развития, включают промоторы, которые предпочтительно инициируют транскрипцию в определенных тканях, например, но не ограничиваясь ими, листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхиму. Такие промоторы обозначают в настоящем описании как "предпочтительные для тканей". Промоторы, которые инициируют транскрипцию только в определенных тканях, называют "тканеспецифическими". "Специфичный к типу клеток" промотор в основном обеспечивает транскрипцию в определенных типах клеток в одном или нескольких органах, например, но не ограничиваясь ими, в сосудистых клетках в корнях и листьях. Иллюстративные тканеспецифические или предпочтительные для тканей промоторы включают, но не ограничиваются ими: предпочтительный для корней промотор, такой как промотор из гена фазеолина; специфичный для листьев и индуцируемый светом промотор, такой как промотор из cab или rubisco; специфичный для пыльника промотор, такой как промотор из LAT52; специфичный для пыльцы промотор, такой как промотор из Zm13; и предпочтительный для микроспор промотор, такой как промотор из apg.
"Индуцибельный" промотор может представлять собой промотор, который может находиться под контролем условий окружающей среды. См. Ward et al. (1993) Plant Mol. Biol. 22:361-366. Примеры условий окружающей среды, которые могут инициировать транскрипцию посредством индуцибельных промоторов, включают, например, но не ограничиваясь ими, анаэробные условия и присутствие света. В случае индуцибельного промотора скорость транскрипции возрастает в ответ на индуцирующий агент. Иллюстративные индуцибельные промоторы включают, но не ограничиваются ими: промоторы из системы ACEI, которые отвечают на медь; ген In2 из кукурузы, который отвечает на антидоты бензолсульфонамидных гербицидов; Tet-репрессор из Tn10; и индуцибельный промотор из гена стероидного гормона, транскрипционная активность которого может быть индуцирована глюкокортикостероидным гормоном (Schena et al. (1991) Proc. Natl. Acad. Sci. USA 88:0421).
Тканеспецифические, предпочтительные для тканей, специфичные для типа клеток и индуцибельные промоторы составляют класс "неконститутивных" промоторов. "Конститутивный" промотор представляет собой промотор, который может быть активным в большинстве условий окружающей среды. Иллюстративные конститутивные промоторы включают, но не ограничиваются ими: промоторы из вирусов растений, такие как промотор 35S из CaMV; промоторы из генов актина риса; промоторы убиквитина; pEMU; MAS; промотор гистона H3 кукурузы; и промотор ALS, фрагмент XbaI/NcoI с 5'-стороны от структурного гена ALS3 Brassica napus (или последовательность, сходная с указанным фрагментом XbaI/NcoI) (международная публикация PCT № WO 96/30530).
Любой из указанных выше конститутивных и неконститутивных промоторов можно использовать в некоторых вариантах осуществления изобретения. Например, может быть предоставлен ген, регулируемый активностью синтетического слитого белка активатора транскрипции (например, в клетке-хозяине), где ген функционально связан с промотором.
Идентичность последовательностей: термин "идентичность последовательностей" или "идентичность", как используют в рамках изобретения в контексте двух последовательностей нуклеиновых кислот или полипептидов, может относиться к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на максимальное соответствие на протяжении указанного окна сравнения.
Как используют в рамках изобретения, термин "процент идентичности последовательностей" может относиться к величине, определяемой путем сравнения двух оптимально выровненных последовательностей (например, последовательностей нуклеиновых кислот и аминокислотных последовательностей) на протяжении окна сравнения, где часть последовательности в окне сравнения может содержать вставки или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит вставок или делеций) для оптимального выравнивания двух последовательностей. Процент вычисляют путем определения количества положений, в которых идентичный нуклеотидный или аминокислотный остаток встречается в обеих последовательностях, с получением количества совпавших положений, деления количества совпавших положений на общее количество положений в окне сравнения, и умножения результата на 100 с получением процента идентичности последовательностей.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например, в: Smith and Waterman (1981) Adv. Appl. Math. 2:482; Needleman and Wunsch (1970) J. Mol. Biol. 48:443; Pearson and Lipman (1988) Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988) Gene 73:237-44; Higgins and Sharp (1989) CABIOS 5:151-3; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) Comp. Appl. Biosci. 8:155-65; Pearson et al. (1994) Methods Mol. Biol. 24:307-31; Tatiana et al. (1999) FEMS Microbiol. Lett. 174:247-50. Детальное рассмотрение способов выравнивания последовательностей и вычисления гомологии может быть найдено, например, в Altschul et al. (1990) J. Mol. Biol. 215:403-10.
Basic Local Alignment Search Tool (BLASTTM; Altschul et al. (1990)) от National Center for Biotechnology Information (NCBI) доступен из нескольких источников, в том числе National Center for Biotechnology Information (Bethesda, MD), и через интернет, для применения совместно с несколькими программами анализа последовательностей. Описание того, как определять идентичность последовательностей с использованием этой программы, доступно через интернет в разделе "help" для BLASTTM. Для сравнений последовательностей нуклеиновых кислот можно использовать функцию "Blast 2 sequences" программы BLASTTM (Blastn) с использованием параметров. Последовательности нуклеиновых кислот с еще более высоким сходством с эталонными последовательностями будут демонстрировать увеличение процентной идентичности при оценке этим способом.
Как используют в рамках изобретения в отношении нуклеотидных последовательностей, термин "по существу идентичный" может относиться к последовательностям, которые являются более чем на 85% идентичными. Например, по существу идентичная нуклеотидная последовательность может быть по меньшей мере на 85,5%; по меньшей мере на 86%; по меньшей мере на 87%; по меньшей мере на 88%; по меньшей мере на 89%; по меньшей мере на 90%; по меньшей мере на 91%; по меньшей мере на 92%; по меньшей мере на 93%; по меньшей мере на 94%; по меньшей мере на 95%; по меньшей мере на 96%; по меньшей мере на 97%; по меньшей мере на 98%; по меньшей мере на 99%; или по меньшей мере на 99,5% идентична эталонной последовательности.
Консервативная замена: как используют в рамках изобретения, термин "консервативная замена" относится к замене, где аминокислотный остаток заменен другой аминокислотой того же класса. Неконсервативная аминокислотная замена представляет собой замену, где остатки не относятся к одному и тому же классу, например, замену основной аминокислотой нейтральной или неполярной аминокислотой. Классы аминокислот, которые можно определять для проведения консервативной замены, известны в данной области.
В некоторых вариантах осуществления консервативная замена включает замену первой алифатической аминокислоты второй отличающейся алифатической аминокислотой. Например, если первая аминокислота представляет собой одну из Gly; Ala; Pro; Ile; Leu; Val и Met, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Gly; Ala; Pro; Ile; Leu; Val и Met. В конкретных примерах, если первая аминокислота представляет собой одну из Gly; Ala; Pro; Ile; Leu и Val, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Gly; Ala; Pro; Ile; Leu и Val. В конкретных примерах, вовлекающих замену гидрофобных алифатических аминокислот, если первая аминокислота представляет собой одну из Ala; Pro; Ile; Leu и Val, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ala; Pro; Ile; Leu и Val.
В некоторых вариантах осуществления консервативная замена включает замену первой ароматической аминокислоты второй отличающейся ароматической аминокислотой. Например, если первая аминокислота представляет собой одну из His; Phe; Trp и Tyr, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из His; Phe; Trp и Tyr. В конкретных примерах, вовлекающих замену незаряженных ароматических аминокислот, если первая аминокислота представляет собой одну из Phe; Trp и Tyr, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Phe; Trp и Tyr.
В некоторых вариантах осуществления консервативная замена включает замену первой гидрофобной аминокислоты второй отличающейся гидрофобной аминокислотой. Например, если первая аминокислота представляет собой одну из Ala; Val; Ile; Leu; Met; Phe; Tyr и Trp, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ala; Val; Ile; Leu; Met; Phe; Tyr и Trp. В конкретных примерах, вовлекающих замену неароматических гидрофобных аминокислот, если первая аминокислота представляет собой одну из Ala; Val; Ile; Leu и Met, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ala; Val; Ile; Leu и Met.
В некоторых вариантах осуществления консервативная замена включает замену первой полярной аминокислоты второй отличающейся полярной аминокислотой. Например, если первая аминокислота представляет собой одну из Ser; Thr; Asn; Gln; Cys; Gly; Pro; Arg; His; Lys; Asp и Glu, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ser; Thr; Asn; Gln; Cys; Gly; Pro; Arg; His; Lys; Asp и Glu. В конкретных примерах, вовлекающих замену незаряженных полярных аминокислот, если первая аминокислота представляет собой одну из Ser; Thr; Asn; Gln; Cys; Gly и Pro, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ser; Thr; Asn; Gln; Cys; Gly и Pro. В конкретных примерах, вовлекающих замену заряженных полярных аминокислот, если первая аминокислота представляет собой одну из His; Arg; Lys; Asp и Glu, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из His; Arg; Lys; Asp и Glu. В следующих примерах, вовлекающих замену заряженных полярных аминокислот, если первая аминокислота представляет собой одну из Arg; Lys; Asp и Glu, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Arg; Lys; Asp и Glu. В конкретных примерах, вовлекающих замену положительно заряженных (основных) полярных аминокислот, если первая аминокислота представляет собой одну из His; Arg и Lys, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из His; Arg и Lys. В следующих примерах, вовлекающих замену положительно заряженных полярных аминокислот, если первая аминокислота представляет собой Arg или Lys, первая аминокислота может быть заменена аминокислотой, отличной от Arg и Lys. В конкретных примерах, вовлекающих замену отрицательно заряженных (кислых) полярных аминокислот, если первая аминокислота представляет собой Asp или Glu, первая аминокислота может быть заменена аминокислотой, отличной от Asp и Glu. В конкретных примерах, вовлекающих замену полярных аминокислот, отличных от положительно заряженных полярных аминокислот, если первая аминокислота представляет собой одну из Ser; Thr; Asn; Gln; Cys; Gly; Pro; Asp и Glu, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ser; Thr; Asn; Gln; Cys; Gly; Pro; Asp и Glu. В конкретных примерах, вовлекающих замену полярных аминокислот, отличных от отрицательно заряженных полярных аминокислот, если первая аминокислота представляет собой одну из Ser; Thr; Asn; Gln; Cys; Gly; Pro; Arg; His и Lys, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ser; Thr; Asn; Gln; Cys; Gly; Pro; Arg; His и Lys.
В некоторых вариантах осуществления консервативная замена включает замену первой электрически нейтральной аминокислоты второй отличающейся электрически нейтральной аминокислотой. Например, если первая аминокислота представляет собой одну из Gly; Ser; Thr; Cys; Asn; Gln и Tyr, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Gly; Ser; Thr; Cys; Asn; Gln и Tyr.
В некоторых вариантах осуществления консервативная замена включает замену первой неполярной аминокислоты второй отличающейся неполярной аминокислотой. Например, если первая аминокислота представляет собой одну из Ala; Val; Leu; Ile; Phe; Trp; Pro и Met, первая аминокислота может быть заменена второй отличающейся аминокислотой, выбранной из Ala; Val; Leu; Ile; Phe; Trp; Pro и Met.
Во многих примерах выбор конкретной второй аминокислоты для консервативной замены первой аминокислоты можно проводить для максимизации количества аминокислот указанных выше классов, к которым первая и вторая аминокислота принадлежат. Таким образом, если первая аминокислота представляет собой Ser (полярная неароматическая и электрически нейтральная аминокислота), вторая аминокислота может представлять собой другую полярную аминокислоту (т.е. Thr; Asn; Gln; Cys; Gly; Pro; Arg; His; Lys; Asp или Glu); другую неароматическую аминокислоту (т.е. Thr; Asn; Gln; Cys; Gly; Pro; Arg; His; Lys; Asp; Glu; Ala; Ile; Leu; Val или Met); или другую электрически нейтральную аминокислоту (т.е. Gly; Thr; Cys; Asn; Gln или Tyr). Однако может быть предпочтительным, чтобы вторая аминокислота в этом случае представляла собой одну из Thr; Asn; Gln; Cys и Gly, поскольку эти аминокислоты классифицируются одинаково в соответствии с полярностью, отсутствием ароматичности и электрической нейтральностью. Дополнительные критерии, которые необязательно можно использовать для выбора конкретной второй аминокислоты для применения для консервативной замены, известны в данной области. Например, когда Thr; Asn; Gln; Cys и Gly являются доступными для применения для консервативной замены на Ser, Cys может быть исключен из выбора во избежание образования поперечных сшивок и/или дисульфидных связей. Аналогично, Gly может быть исключен из выбора, поскольку он лишен боковой цепи. В этом случае, может быть выбран Thr, например, для сохранения функциональности гидроксильной группы боковой цепи. Однако выбор конкретной второй аминокислоты для применения для консервативной замены в конечном итоге осуществляется в соответствии с мнением квалифицированного специалиста.
Термин "производное", как используют в рамках изобретения в отношении аминокислотной последовательности, означает химическую модификацию слитого белка по изобретению.
Трансактивирующий белок: как используют в рамках изобретения, термин "трансактивирующий белок" (или "трансактиватор" или "белок-активатор транскрипции" или "слитый белок активатора транскрипции") относится к полипептиду, который связывается с элементом нуклеиновой кислоты или усиливает транскрипцию полинуклеотида (например, представляющий интерес ген), который функционально связан с элементом нуклеиновой кислоты. Трансактивирующие белки, которые являются нативными для определенных организмов, включают, например, но не ограничиваясь ими, белки, ДНК-связывающие белки с цинковыми пальцами; ДНК-связывающий домен UPA; GAL4 и TAL. Конкретные варианты осуществления изобретения включают синтетические трансактиваторы слитых белков, содержащие по меньшей мере один ДНК-связывающий домен из ДНК-связывающего белка и мотив взаимодействия из домена трансактивации растений.
Специфическое связывание: как используют в рамках изобретения в отношении полипептидов и доменов белков, термин "специфическое связывание" относится к достаточно сильному взаимодействию между полипептидом или доменом белка и его партнером(ами) по связыванию (например, полипептид(ы), содержащий конкретную аминокислотную последовательность, или нуклеиновая кислота(ы), содержащая конкретную нуклеотидную последовательность), так чтобы происходило стабильное и специфичное связывание с партером(ами) по связыванию, но не с другими молекулами, которые лишены конкретной аминокислотной последовательности или конкретной нуклеотидной последовательности, которая распознается специфически связывающимся полипептидом. Стабильное и специфичное связывание можно определять способами, известными специалистам в данной области; такими как анализы "pulldown" (например, GST-pulldown), 2-гибридные анализы на дрожжах, 3-гибридные анализы на дрожжах, ELISA и т.д. Для молекул, которые имеют признак "специфического связывания" друг с другом, может быть указано, что они "специфично связываются" друг с другом.
Трансформация: как используют в рамках изобретения, термин "трансформация" относится к переносу одной или нескольких молекулы(молекул) нуклеиновой кислоты(кислот) в клетку. Клетка "трансформирована" молекулой нуклеиновой кислоты, перенесенной в клетку, когда молекула нуклеиновой кислоты становится стабильно реплицируемой клеткой, либо путем включения молекулы нуклеиновой кислоты в клеточный геном, либо путем эписомной репликации. Как используют в рамках изобретения, термин "трансформация" охватывает все способы, посредством которых молекула нуклеиновой кислоты может быть введена в такую клетку. Примеры включают, но не ограничиваются ими: трансфекцию вирусными векторами; трансформацию плазмидными векторами; электропорацию (Fromm et al. (1986) Nature 319:791-3); липофекцию (Felgner et al. (1987) Proc. Natl. Acad. Sci. USA 84:7413-7); микроинъекцию (Mueller et al. (1978) Cell 15:579-85); опосредуемый Agrobacterium перенос (Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803-7); прямой захват ДНК; и бомбардировку микроснарядами (Klein et al. (1987) Nature 327:70).
Трансген: экзогенная последовательность нуклеиновой кислоты. В некоторых примерах трансген может представлять собой последовательность, которая кодирует полипептид, содержащий по меньшей мере один синтетический слитый белок активатора транскрипции. В некоторых примерах трансген может кодировать синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один TAD и/или по меньшей мере один вариант TAD растений. В некоторых примерах трансген может кодировать представляющий интерес ген (например, репортерный ген; ген, сообщающий устойчивость к гербициду; и ген обеспечивает важный с точки зрения сельского хозяйства признак растения). В этих и других примерах трансген может содержать одну или несколько регуляторных последовательностей (например, промотор), функционально связанных с кодирующей последовательностью трансгена. Для целей настоящего описания термин "трансгенный", когда его используют для указания на организм (например, растение), относится к организму, который содержит экзогенную последовательность нуклеиновой кислоты. В некоторых примерах организм, содержащий экзогенную последовательность нуклеиновой кислоты, может представлять собой организм, в который последовательность нуклеиновой кислоты была введена способами молекулярной трансформации. В других примерах организм, содержащий экзогенную последовательность нуклеиновой кислоты, может представлять собой организм, в который последовательность нуклеиновой кислоты была введена, например, путем интрогрессии или перекрестного опыления в растении.
Вектор: как используют в рамках изобретения, термин "вектор" относится к молекуле нуклеиновой кислоты, введенной в клетку, например, для получения трансформированной клетки. Вектор может включать последовательности нуклеиновых кислот, которые позволяют ему реплицироваться в клетке-хозяине, такие как ориджин репликации. Примеры векторов включают, но не ограничиваются ими: плазмиды; космиды; бактериофаги или вирусы, которые несут экзогенную ДНК в клетку. Вектор также может включать один или несколько генов, антисмысловых молекул и/или генов селективных маркеров и другие генетические элементы, известные в данной области. Вектор может быть трансдуцирован, трансформирован в клетку или он может инфицировать клетку, тем самым обеспечивая экспрессию клеткой молекул нуклеиновых кислот и/или белков, кодируемых вектором. Вектор необязательно включает материалы, способствующие достижению проникновения молекулы нуклеиновой кислоты в клетку (например, липосомы, белковое покрытие и т.д.).
Если нет иных указаний и не предполагается иное, форма единственного числа обозначает "по меньшей мере один", как используют в рамках изобретения.
Если конкретно не указано иное, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевают специалисты в области, к которой относится настоящее изобретение. Определения общих терминов молекулярной биологии могут быть найдены, например, в Lewin B., Genes V, Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
IV. Мотивы взаимодействия из доменов трансактивации растений
Настоящее изобретение относится к новым TAD растений и их мотивам белок-белкового взаимодействия, а также к нуклеиновым кислотам, кодирующим их. TAD, которые были идентифицированы и выделены из белков растений ERF2 (Arabidopsis thaliana); PTI4 (Solanum tuberosum); AtERF1 (A. thaliana); ORCA2 (Catharanthus roseus); DREB1A (A. thaliana); CBF1 (A. thaliana); и DOF1 (Zea mays), использовали для идентификации мотивов взаимодействия TAD растений, которые в некоторых вариантах осуществления могут быть "заменены" на гетерологичные TAD или использованы для получения вариантов мотивов взаимодействия TAD. Вновь идентифицированные TAD растений, их мотивы взаимодействия и варианты TAD можно использовать в конкретных вариантах осуществления (например, путем включения в синтетический белок-активатор-транскрипции) для сообщения нового и желаемого регуляторного контроля экспрессии представляющего интерес гена.
TAD VP16 (V16 TAD) были охарактеризованы и структурные области указанных выше новых TAD растений и доменов взаимодействия обозначаются по аналогии с соответствующими структурами в TAD VP16. TAD VP16 может быть подразделен на два субдомена, и каждый субдомен способен независимо и автономно активировать транскрипцию, когда он связан с ДНК-связывающим доменом. Субдомены VP16 иногда обозначают как амино-субдомен (или "субдомен трансактивации I VP16" или "VP16412-456") и карбоксильный субдомен (или "субдомен трансактивации II VP16" или "VP16456-490"). VP16 взаимодействует через его домены взаимодействия с несколькими белками-мишенями, вовлеченными в транскрипцию, включая субъединицу p62/Tfb1 фактора транскрипции IIB (TFIIB).
Активность VP16 зависит не только от кислотных остатков, но также и от гидрофобных и ароматических аминокислот в TAD. См., например, Cress and Triezenberg (1991) Science 251(4989):87-90. Однако кислотный TAD VP16 может быть более устойчивым к мутагенезу, чем многие другие полипептидные последовательности, вследствие отсутствие регулярной вторичной структуры в кислотных TAD. Sigler (1988) Nature 333:210-2. Неструктурированная природа субдоменов TAD VP16 может помогать TAD опосредовать множество взаимодействий белок/белок с различными профилями связывания (Dyson and Wright (2002) Curr. Opin. Struct. Biol. 12(1):54-60), и субдомены TAD могут приобретать более упорядоченную структуру (например, короткая α-спираль (Langlois et al. (2008), выше), когда они связаны с белками-мишенями, чем когда они являются свободными в растворе. См., например, Garza et al. (2009) Life Sci. 84(7-8):189-93; Jonker et al. (2005) Biochemistry 44(3):827-39; Langlois et al. (2008), выше.
Некоторые варианты осуществления включают синтетический белок-активатор транскрипции, содержащий мотив взаимодействия TAD растений, где мотив взаимодействия TAD растений выбран из группы, состоящей из SEQ ID NO:10-16. Некоторые иллюстративные синтетические белки-активаторы транскрипции включают TAD, который содержит мотив взаимодействия TAD растений, и такие белки могут иметь последовательность, включающую, например, но не ограничивающуюся ими, SEQ ID NO:2-8 и SEQ ID NO:100-106. Дополнительные иллюстративные TAD, содержащие мотив взаимодействия TAD растений, включают TAD, сконструированные путем замены нативной последовательности мотива взаимодействия TAD, содержащейся в нативном трансактиваторе TAD, посредством одной из SEQ ID NO:10-16.
В некоторых вариантах осуществления изобретения используется неожиданное открытие, что вариант мотива взаимодействия TAD, содержащий консервативные аминокислотные замены и/или замены на аминокислоты, встречающиеся в аналогичном положении в гомологичном мотиве взаимодействия (например, из оротолога нативного белка, содержащего эталонный мотив взаимодействия TAD), может обеспечивать новые и конкретные свойства регуляции генов. Эти конкретные свойства могут быть желательными для экспрессии полинуклеотида, где является желательным определенный уровень экспрессии. Например, вариант мотива взаимодействия TAD может обеспечить усиленную экспрессию относительно нативного эталонного мотива TAD, который сам по себе усиливает экспрессию, и, таким образом, он может быть желательным для синтеза белка и реакций очистки, где часто является целью максимальная экспрессия. В других примерах вариант мотива взаимодействия TAD может обеспечить меньшую экспрессию, чем нативный эталонный мотив TAD, когда является желательной менее чем максимальная экспрессия.
Таким образом, некоторые варианты осуществления включают синтетический белок-активатор транскрипции, содержащий вариант мотива взаимодействия TAD. В некоторых примерах вариант мотива взаимодействия TAD может представлять собой вариант одного из SEQ ID NO:10-16. Варианты мотивов взаимодействия TAD включают полипептиды, имеющие аминокислотную последовательность нативной последовательности взаимодействия TAD, но где одна или несколько аминокислот в последовательности изменены на аминокислоту, встречающуюся в соответствующем положении в отличающемся гомологичном TAD. Варианты мотивов взаимодействия TAD также включают полипептиды, имеющие аминокислотную последовательность нативной последовательности взаимодействия TAD, но где внесена консервативная замена одной или нескольких аминокислот в последовательности. Вариант мотива взаимодействия TAD может быть, например, но не ограничиваясь этим, по меньшей мере на 95% идентичным эталонной последовательности мотива взаимодействия TAD (например, последовательность, выбранная из SEQ ID NO:10-16); по меньшей мере на 90% идентичным эталонной последовательности; по меньшей мере на 85% идентичным эталонной последовательности; по меньшей мере на 80% идентичным эталонной последовательности; по меньшей мере на 75% идентичным эталонной последовательности; по меньшей мере на 70% идентичным эталонной последовательности; по меньшей мере на 65% идентичным эталонной последовательности; по меньшей мере на 60% идентичным эталонной последовательности; по меньшей мере на 55% идентичным эталонной последовательности; по меньшей мере на 50% идентичным эталонной последовательности; или менее чем на 50% идентичным эталонной последовательности.
Варианты мотивов взаимодействия TAD включают, например, но не ограничиваясь этим, SEQ ID NO:17-22 (иллюстративные варианты мотива взаимодействия TAD ERF2); SEQ ID NO:23-28 (иллюстративные варианты мотива взаимодействия TAD PTI4); SEQ ID NO:29-34 (иллюстративные варианты мотива взаимодействия TAD AtERF1); SEQ ID NO:35-40 (иллюстративные варианты мотива взаимодействия TAD ORCA2); SEQ ID NO:41-46 (иллюстративные варианты мотива взаимодействия TAD DREB1A); SEQ ID NO:47-52 (иллюстративные варианты мотива взаимодействия TAD CBF1); и SEQ ID NO:53-58 (иллюстративные варианты мотивов взаимодействия TAD DOF1). Иллюстративные TAD, содержащие вариант мотива взаимодействия TAD, включают TAD, сконструированные путем замены последовательности мотива взаимодействия TAD, содержащейся в нативном TAD трансактиватора, на вариант TAD, выбранный из группы, состоящей из SEQ ID NO:17-58. Например, иллюстративные TAD, содержащие вариант мотива взаимодействия TAD, включают SEQ ID NO:107-120.
Нуклеиновые кислоты, кодирующие любой и все из указанных выше полипептидов, идентифицируются непосредственно из аминокислотной последовательности полипептида. Например, TAD или мотив взаимодействия TAD может кодироваться нативным полинуклеотидом, который транскрибируется с образованием мРНК, которая затем транслируется в аминокислоты TAD или мотива взаимодействия TAD. Однако специалисту в данной области будет понятно, что вследствие вырожденности генетического кода существует множество других эквивалентных полинуклеотидов, которые кодируют идентичный полипептид. Варианты мотивов взаимодействия TAD (например, SEQ ID NO:17-58) могут кодироваться полинуклеотидами, которые можно без труда определить с помощью таблицы кодонов РНК из аминокислотной последовательности конкретного желаемого варианта. В конкретных вариантах осуществления может быть желательной сборка нуклеотидной последовательности полинуклеотида, кодирующего мотив взаимодействия TAD (или его вариант) в соответствии с использованием кодонов в клетке-хозяине, например, так, чтобы максимизировать или оптимизировать экспрессию белка (например, слитый белок), содержащего мотив взаимодействия TAD.
V. Активаторы транскрипции слитых белков
Настоящее изобретение также относится к синтетическим слитым белкам активаторов транскрипции, содержащим мотив взаимодействия TAD растений и/или вариант мотива взаимодействия TAD. В некоторых вариантах осуществления синтетический слитый белок активатора транскрипции дополнительно содержит по меньшей мере один ДНК-связывающий домен. Также предусматриваются нуклеиновые кислоты (например, ДНК), кодирующие такие синтетические слитые белки активаторов транскрипции.
В некоторых вариантах осуществления синтетический слитый белок активатора транскрипции содержит по меньшей мере первый полипептид, который связывается с ДНК специфичным для последовательности образом (т.е. "ДНК-связывающий домен"). Первый полипептид ДНК-связывающего домена синтетического слитого белка активатора транскрипции может быть функционально связан по меньшей мере со вторым полипептидом, содержащим мотив взаимодействия TAD растений или вариант мотива взаимодействия TAD. В некоторых примерах синтетический слитый белок активатора транскрипции может содержать дополнительные полипептиды, такие как спейсерная последовательность, расположенная между первым и вторым полипептидами в слитом белке; лидерный пептид; пептид, который нацеливает слитый белок в органеллу (например, ядро); полипептиды, которые расщепляются клеточным ферментом; пептидные метки; и другие аминокислотные последовательности, которые не препятствуют функционированию функционально связанных первого и второго полипептидов.
В некоторых вариантах осуществления первый и второй полипептиды синтетического слитого белка активатора транскрипции могут быть функционально связаны путем их экспрессии с одного полинуклеотида, кодирующего первый и второй полипептиды, лигированные друг с другом в рамке считывания, так чтобы получить химерный ген, кодирующий слитый белок. Примеры полинуклеотидов, кодирующих слитый белок активатора транскрипции, содержащий ДНК-связывающий домен и мотив взаимодействия TAD, включают, но не ограничиваются ими, SEQ ID NO:79-93. В альтернативных вариантах осуществления первый и второй полипептиды синтетического слитого белка активатора транскрипции могут быть функционально связаны другими способами, такими как поперечное связывание независимо экспрессируемых первого и второго полипептидов.
Мотивы взаимодействия TAD растений и варианты мотивов взаимодействия TAD растений, которые могут содержаться в синтетическом слитом белке активатора транскрипции, включают мотивы взаимодействия TAD и их варианты, описанные в разделе IV, выше. Например, синтетический слитый белок активатора транскрипции может содержать полипептид, выбранный из группы, состоящей из SEQ ID NO:10-58.
ДНК-связывающие домены, которые могут содержаться в синтетическом слитом белке активатора транскрипции, включают ДНК-связывающие домены с цинковыми пальцами (например, ДНК-связывающий домен Z6). Отдельные ДНК-связывающие домены с цинковыми пальцами можно конструировать для нацеливания и связывания с большим диапазоном участков ДНК. См., например, Wu et al. (2007) Cell. Mol. Life Sci. 64:2933-44. Канонические Cys2His2, а также неканонические белки с цинковыми пальцами Cys3His, связывают ДНК путем встраивания α-спирали в большую бороздку двойной спирали. Распознавание ДНК доменами с цинковыми пальцами является модульным; каждый палец контактирует в основном с тремя последовательно расположенными парами оснований в мишени и несколькими ключевыми остатками для опосредуемого белком распознавания. Путем включения нескольких ДНК-связывающих доменов с цинковыми пальцами в синтетический слитый белок активатора транскрипции, специфичность связывания ДНК слитого белка может быть далее увеличена (и, таким образом, специфичность любых эффектов регуляции генов, сообщаемых посредством этого, также может быть увеличена). См., например, Urnov et al. (2005) Nature 435:646-51. Таким образом, один или несколько ДНК-связывающих доменов с цинковыми пальцами можно конструировать и использовать так, чтобы синтетический слитый белок активатора транскрипции, введенный в клетку-хозяина, взаимодействовал с последовательностью ДНК, которая является уникальной в геноме клетки-хозяина.
В некоторых примерах синтетический слитый белок активатора транскрипции содержит ДНК-связывающий домен из GAL4, модулирующий трансактиватор в Saccharomyces cerevisiae, но он также функционирует в качестве трансактиватора во многих других организмах. См., например, Sadowski et al. (1988) Nature 335:563-4. В этой регуляторной системе экспрессия генов, кодирующих ферменты метаболического пути галактозы в S. cerevisiae строго регулируется доступным источником углерода. Johnston (1987) Microbiol. Rev. 51:458-76. Контроль транскрипции этих метаболических ферментов опосредуется взаимодействием между положительным регуляторным белком GAL4, и симметричной последовательностью ДНК размером 17 п. о., с которой GAL4 специфично связывается (UAS).
Нативный GAL4 состоит из 881 аминокислотных остатков с молекулярной массой 99 кДа. GAL4 содержит функционально автономные домены, совокупная активность которых обеспечивает активность GAL4 in vivo. Ma & Ptashne (1987) Cell 48:847-53); Brent & Ptashne (1985) Cell 43(3 Pt 2):729-36. 65 N-концевых аминокислот GAL4 содержат ДНК-связывающий домен GAL4. Keegan et al. (1986) Science 231:699-704; Johnston (1987) Nature 328:353-5. Специфичное для последовательности связывание требует присутствия двухвалентного катиона, координируемого 6 остатками Cys, присутствующими в ДНК-связывающем домене. Координированный содержащий катион домен взаимодействует и распознает консервативный триплет CCG на каждом конце UAS из 17 п. о. посредством прямых контактов с большой бороздкой спирали ДНК. Marmorstein et al. (1992) Nature 356:408-14. Функция связывания ДНК в белке обеспечивает положение C-концевых доменов активации транскрипции вблизи промотора, так чтобы активирующие домены могли контролировать транскрипцию.
Дополнительные ДНК-связывающие домены, которые могут содержаться в синтетическом слитом белке активатора транскрипции включают, например, но не ограничиваясь ими, связывающую последовательность из индуцируемого AVRBS3 гена; консенсусную связывающую последовательность из индуцируемого AVRBS3 гена или синтетическую связывающую последовательность, сконструированную из них (например, ДНК-связывающий домен UPA; SEQ ID NO:89); TAL; LexA (см., например, Brent & Ptashne (1985), выше); LacR (см., например, Labow et al. (1990) Mol. Cell. Biol. 10:3343-56; Baim et al. (1991) Proc. Natl. Acad. Sci. USA 88(12):5072-6); рецептор стероидных гормонов (Ellliston et al. (1990) J. Biol. Chem. 265:11517-121); репрессор Tet (патент США 6271341) и мутантный репрессор Tet, который связывается с последовательностью оператора tet в присутствии, но не в отсутствие, тетрациклина (Tc); и компоненты регуляторной системы, описанной в Wang et al. (1994) Proc. Natl. Acad. Sci. USA 91(17):8180-4, в которой используется слитая конструкция GAL4, рецептор гормонов, и VP16.
В некоторых примерах синтетический слитый белок активатора транскрипции содержит более одного мотива взаимодействия TAD. Например, но не ограничиваясь ими, синтетический слитый белок активатора транскрипции может содержать 2, 3, 4 или более доменов взаимодействия TAD. В некоторых примерах синтетический слитый белок активатора транскрипции содержит более одного ДНК-связывающего домена. Например, но не ограничиваясь ими, синтетический слитый белок активатора транскрипции может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10 или более ДНК-связывающих доменов.
VI. Молекулы нуклеиновых кислот, содержащие полинуклеотид, кодирующий слитый белок активатора транскрипции
В некоторых вариантах осуществления настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей по меньшей мере одну полинуклеотидную последовательность, кодирующую мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD. Такие молекулы нуклеиновой кислоты могут дополнительно содержать по меньшей мере одну полинуклеотидную последовательность, кодирующую ДНК-связывающий домен. Например, нуклеиновая кислота в некоторых вариантах осуществления содержит первую полинуклеотидную последовательность, кодирующую мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, слитые в рамке считывания со второй полинуклеотидной последовательностью, кодирующей ДНК-связывающий домен, так чтобы две полинуклеотидные последовательности транскрибировались в качестве части одного слитого белка.
В молекулах нуклеиновой кислоты, предусматриваемых в некоторых вариантах осуществления изобретения, последний кодон первой полинуклеотидной последовательности, кодирующей мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, и первый кодон второй полинуклеотидной последовательность, кодирующей ДНК-связывающий домен, могут быть разделены любым количеством нуклеотидных триплетов, например, без кодирования интрона или "остановки". Аналогично, последний кодон нуклеотидной последовательности, кодирующей первую полинуклеотидную последовательность, кодирующую ДНК-связывающий домен, и первый кодон второй полинуклеотидной последовательности, кодирующей мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, могут быть разделены любым количеством нуклеотидных триплетов. В этих и других вариантах осуществления последний кодон последней из (т.е. самый 3’-концевой в последовательности нуклеиновой кислоты) первой полинуклеотидной последовательности, кодирующей мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, и второй полинуклеотидной последовательности, кодирующей ДНК-связывающий домен, может быть слит в рамке считывания с первым кодоном кодирующей последовательности следующего полинуклеотида, непосредственно соседней или отделенной от них не более чем короткой пептидной последовательностью, такой как последовательность, кодируемая синтетическим нуклеотидным линкером (например, нуклеотидный линкер, который мог использоваться для обеспечения слияния). Примеры таких дополнительных полинуклеотидных последовательностей включают, например, но не ограничиваясь ими, метки, нацеливающие пептиды и участки расщепления ферментами. Аналогично, самый первый 5’-концевой кодон (в последовательности нуклеиновой кислоты) первой и второй полинуклеотидных последовательностей может быть слит в рамке считывания с последним кодоном следующей кодирующей полинуклеотид последовательности, непосредственно соседней с ней, или отделен от нее не более чем короткой пептидной последовательностью.
Последовательность, разделяющая полинуклеотидную последовательность, кодирующую мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, растение TAD или вариант TAD, и полинуклеотидную последовательность, кодирующую ДНК-связывающий домен, может состоять, например, из любой последовательности, так чтобы было маловероятно, что кодируемая аминокислотная последовательность значительно изменит трансляцию слитого белка. Вследствие автономной природы доменов взаимодействия TAD (и их вариантов), описанных в настоящем описании, и известных ДНК-связывающих доменов, встроенные последовательности в соответствии с примерами не препятствуют соответствующим функциям этих структур.
Некоторые варианты осуществления изобретения также включают молекулу нуклеиновой кислоты, содержащую полинуклеотидную последовательность, кодирующую мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, где молекула нуклеиновой кислоты не содержит полинуклеотидную последовательность, кодирующую ДНК-связывающий домен. Такие молекулы нуклеиновой кислоты могут быть пригодными, например, для упрощения манипулирования последовательностью, кодирующей мотив взаимодействия TAD, в способах молекулярной биологии. Например, в некоторых вариантах осуществления последовательность, кодирующую мотив взаимодействия TAD, можно встраивать в подходящий вектор для субклонирования последовательности в экспрессирующий вектор, или последовательность, кодирующую мотив взаимодействия TAD, можно встраивать в молекулу нуклеиновой кислоты, которая способствует продукции другой молекулы нуклеиновой кислоты, содержащей последовательность, кодирующую мотив взаимодействия TAD, функционально связанную с представляющей интерес нуклеотидной последовательностью.
Все нуклеотидные последовательности, которые кодируют, например, слитый белок, содержащий по меньшей мере один конкретный мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, и дополнительно содержащий по меньшей мере один конкретный ДНК-связывающий домен, будут сразу понятны специалистам в данной области. Вырожденность генетического кода обеспечивает конечное количество кодирующих последовательностей для конкретной аминокислотной последовательности. Выбор конкретной последовательности для кодирования слитого белка в соответствии с вариантами осуществления изобретения осуществляется по мнению квалифицированного специалиста. Различные кодирующие последовательности могут быть желательными в различных применениях.
В некоторых вариантах осуществления, может быть желательной модификация нуклеотидов полинуклеотидной последовательности, кодирующей мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD (и/или нуклеотидов последовательности, кодирующей ДНК-связывающий домен), например, для усиления экспрессии полинуклеотидной последовательности в конкретном хозяине. Генетический код является избыточным при наличии 64 возможных кодонов, однако большинство организмов предпочтительно используют подгруппу этих кодонов. Кодоны, которые используются наиболее часто видом, называются оптимальными кодонами, и не используемые кодоны очень часто классифицируют как редкие кодоны или низкоиспользуемые кодоны. Zhang et al. (1991), Gene 105:61-72. Кодоны можно заменять так, чтобы это отражало предпочтительное использование кодонов в конкретном хозяине в процессе, иногда обозначаемом как "оптимизация кодонов". Оптимизированные кодирующие последовательности, содержащие кодоны, предпочтительные для конкретного прокариотического или эукариотического хозяина, можно получать, например, для повышения скорости трансляции или для получения рекомбинантных РНК-транскриптов, имеющих желаемые свойства (например, более длительное время полужизни по сравнению с транскриптами, полученными из неоптимизированной последовательности).
VII. Экспрессия слитого белка активатора транскрипции
В некоторых вариантах осуществления по меньшей мере одну молекулу(ы) нуклеиновой кислоты, кодирующую слитый белок, содержащую по меньшей мере одну полинуклеотидную последовательность, кодирующую мотив взаимодействия TAD растений (или вариант мотива взаимодействия TAD, TAD растений или вариант TAD), и по меньшей мере одну полинуклеотидную последовательность, кодирующую ДНК-связывающий домен, можно вводить в клетку, ткань или организм для экспрессии в нем слитого белка.
В некоторых вариантах осуществления такая молекула нуклеиновой кислоты может представлять собой, например, векторную систему, включающую, например, но не ограничивающуюся ими, линейную плазмиду и замкнутую кольцевую плазмиду. В конкретных примерах вектор может представлять собой экспрессирующий вектор. Последовательности нуклеиновой кислоты в соответствии с конкретными вариантами осуществления могут, например, быть встроены в вектор, так чтобы последовательность нуклеиновой кислоты была функционально связана с одной или несколькими регуляторными последовательностями. Для этой цели доступно множество векторов, и выбор конкретного вектора может зависеть, например, от размера нуклеиновой кислоты, подлежащей встраиванию в вектор, конкретной клетки-хозяина, подлежащей трансформации вектором, и/или количества слитого белка, экспрессия которого желательна. Вектор как правило, содержит различные компоненты, тип которых зависит от функции вектора (например, амплификация ДНК и экспрессия ДНК), и конкретной клетки(ок)-хозяина, с которой вектор совместим.
Некоторые варианты осуществления могут включать вектор для трансформации растений, который содержит нуклеотидную последовательность, содержащую по меньшей мере одну регуляторную последовательность, функционально связанную с одной или несколькими нуклеотидной последовательностью(ями), кодирующей слитый белок, содержащий по меньшей мере один мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, функционально связанный по меньшей мере с одним ДНК-связывающим доменом. Одна или несколько нуклеотидная последовательность(ей) может экспрессироваться под контролем регуляторной последовательности(ей), в клетке растения, ткани или организме, с образованием слитого белка.
В некоторых вариантах осуществления регуляторная последовательность, функционально связанная с одной или несколькими нуклеотидной последовательностью(ями), кодирующей слитый белок, содержащий по меньшей мере один мотив взаимодействия TAD растений, вариант мотива взаимодействия TAD, TAD растений или вариант TAD, функционально связанные по меньшей мере с одним ДНК-связывающим доменом, может представлять собой промоторную последовательность, которая функционирует в клетке-хозяине, такой как бактериальная клетка, в которой молекула нуклеиновой кислоты должна амплифицироваться, или клетка растения, где молекула нуклеиновой кислоты должна экспрессироваться.
Промоторы, подходящие для применения в молекулах нуклеиновых кислот в соответствии с некоторыми вариантами осуществления, включают промоторы, которые являются индуцибельными, вирусными, синтетическими или конститутивными, все из которых хорошо известны в данной области. Неограничивающие примеры промоторов, которые могут быть пригодными в вариантах осуществления изобретения, предоставлены в: патентах США № 6437217 (промотор RS81 кукурузы); 5641876 (промотор актина риса); 6426446 (промотор RS324 кукурузы); 6429362 (промотор PR-1 кукурузы); 6232526 (промотор A3 кукурузы); 6177611 (конститутивные промоторы кукурузы); 5322938, 5352605, 5359142 и 5530196 (промотор 35S); 6433252 (промотор L3 олеосина кукурузы); 6429357 (промотор актина 2 риса и интрон актина 2 риса); 6294714 (индуцируемые светом промоторы); 6140078 (индуцируемые солью промоторы); 6252138 (индуцируемые патогеном промоторы); 6175060 (индуцируемые дефицитом фосфора промоторы); 6388170 (двунаправленные промоторы); 6635806 (промотор гамма-коиксина); и патентную заявку США с серийным номером № 09/757089 (промотор альдолазы хлоропластов кукурузы).
Дополнительные иллюстративные промоторы включают промотор нопалинсинтазы (NOS) (Ebert et al. (1987) Proc. Natl. Acad. Sci. USA 84(16):5745-9) и промотор октопинсинтазы (OCS) (который содержится в индуцирующих опухоль плазмидах Agrobacterium tumefaciens); промоторы колимовирусов, такие как промотор 19S вируса мозаики цветной капусты (CaMV) (Lawton et al. (1987) Plant Mol. Biol. 9:315-24); промотор 35S CaMV (Odell et al. (1985) Nature 313:810-2; промотор 35S вируса мозаики норичника (Walker et al. (1987) Proc. Natl. Acad. Sci. USA 84(19):6624-8); промотор сахарозосинтазы (Yang and Russell (1990) Proc. Natl. Acad. Sci. USA 87:4144-8); промотор комплекса генов R (Chandler et al. (1989) Plant Cell 1: 1175-83); промотор гена белка, связывающего хлорофилл a/b; CaMV35S (патенты США № 5322938, 5352605, 5359142 и 5530196); FMV35S (патенты США № 6051753 и 5378619); промотор PC1SV (патент США № 5850019); промотор SCP1 (патент США № 6677503); и промоторы AGRtunos (номер доступа GenBank № V00087; Depicker et al. (1982) J. Mol. Appl. Genet. 1: 561-73; Bevan et al. (1983) Nature 304: 184-7).
В конкретных вариантах осуществления молекулы нуклеиновой кислоты по изобретению могут содержать тканеспецифический промотор. Тканеспецифический промотор представляет собой нуклеотидную последовательность, которая обеспечивает более высокий уровень транскрипции функционально связанной нуклеотидной последовательности в ткани, для которой промотор является специфичным, относительно других тканей в организме. Примеры тканеспецифических промоторов включают, но не ограничиваются ими: специфичные для тапетума промоторы; специфичные для пыльника промоторы; специфичные для пыльцы промоторы (см., например, патент США № 7141424, и международную публикацию PCT № WO 99/042587); специфичные для семяпочки промоторы; (см., например, патентную заявку США № 2001/047525 A1); специфичные для плодов промоторы (см., например, патенты США № 4943674 и 5753475); и специфичные для семян промоторы (см., например, патенты США № 5420034 и 5608152). В некоторых вариантах осуществления в композиции или способе по изобретению можно использовать специфичный для стадии развития промотор (например, промотор, активный на более поздней стадии развития).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связаны с молекулой нуклеиновой кислоты, включают 5'-UTR, расположенные между промоторной последовательностью и кодирующей последовательностью, которые функционируют в качестве лидерных последовательностей трансляции. Лидерная последовательность трансляции присутствует в полностью процессированной мРНК, и она может влиять на процессинг первичного транскрипта и/или стабильность РНК. Примеры лидерных последовательностей трансляции включают лидерные последовательности белка теплового шока кукурузы и петунии (патент США № 5362865), лидерные последовательности белка оболочки вируса растений, лидерные последовательности рибулозо-1,5-бифосфаткарбоксилазы/оксигеназы растений и другие. См., например, Turner and Foster (1995) Molecular Biotech. 3(3):225-36. Неограничивающие примеры 5'-UTR представляют собой: GmHsp (патент США № 5659122); PhDnaK (патент США № 5362865); AtAntl; TEV (Carrington and Freed (1990) J. Virol. 64:1590-7); и AGRtunos (номер доступа GenBank № V00087; и Bevan et al. (1983), выше).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связанными с молекулой нуклеиновой кислоты, также включают 3'-нетранслируемые последовательности, 3'-области терминации транскрипции или области полиаденилирования. Они представляют собой генетические элементы, расположенные ниже нуклеотидной последовательности, и включают полинуклеотиды, которые обеспечивают сигнал полиаденилирования и/или другие регуляторные сигналы, способные влиять на транскрипцию или процессинг мРНК. Сигналы полиаденилирования функционируют в растениях, обеспечивая присоединение полиаденилатных нуклеотидов к 3′-концу мРНК-предшественника. Последовательность полиаденилирования может происходить из различных генов растений или из генов T-ДНК. Неограничивающим примером 3′-области терминации транскрипции является 3′-область нопалинсинтазы (nos 3′; Fraley et al. (1983), Proc. Natl. Acad. Sci. USA 80:4803-7). Пример применения различных 3′-нетранслируемых областей предоставлен в Ingelbrecht et al., (1989), Plant Cell 1:671-80. Неограничивающие примеры сигналов полиаденилирования включают сигнал полиаденилирования из гена Pisum sativum RbcS2 (Ps.RbcS2-E9; Coruzzi et al. (1984), EMBO J. 3:1671-9) и AGRtu.nos (номер доступа в GenBank № E01312).
Дополнительная информация, касающаяся регуляторных последовательностей, которые могут быть пригодными в конкретных вариантах осуществления, описана, например, в Goeddel (1990) "Gene Expression Technology", Methods Enzymol. 185, Academic Press, San Diego, CA.
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению могут содержать селективный маркер, который сообщает поддающийся селекции фенотип трансформированной клетке, такой как клетка растения. Селективные маркеры также можно использовать для селекции растений или клеток растений, которые содержат молекулу нуклеиновой кислоты по изобретению. Маркер может кодировать устойчивость к биоциду, устойчивость к антибиотику (например, канамицину, генетицину (G418), блеомицину и гигромицину), или устойчивость к гербициду (например, глифосат). Примеры селективных маркеров включают, но не ограничиваются ими: ген neo, который сообщает устойчивость к канамицину и его селекция может быть осуществлена, например, с использованием канамицина и G418; ген bar, который сообщает устойчивость к биалафосу; мутантный ген синтазы EPSP, который сообщает устойчивость к глифосату; ген нитрилазы, который сообщает устойчивость к бромксинилу; мутантный ген ацетолактатсинтазы (ALS), который сообщает устойчивость к имидазолинонму или сульфонилмочевине; и ген DHFR устойчивости к метотрексату. Доступно множество селективных маркеров, которые сообщают устойчивость химическим веществам, в том числе, например, но не ограничиваясь ими, к ампициллину, блеомицину, хлорамфениколу, гентамицину, гигромицину, канамицину, линкомицину, метотрексату, фосфинотрицину, пуромицину, спектиномицину, рифампицину, стрептомицину и тетрациклину и т.п. Примеры таких селективных маркеров проиллюстрированы, например, в патентах США № 5550318; 5633435; 5780708 и 6118047.
Молекула нуклеиновой кислоты или вектор по настоящему изобретению также или альтернативно могут включать маркеры для скрининга. Маркеры для скрининга можно использовать для того, чтобы осуществлять мониторинг экспрессии. Иллюстративные маркеры для скрининга включают ген β-глюкуронидазы или ген uidA (GUS), который кодирует фермент, для которого известны различные хромогенные субстраты (Jefferson et al. (1987) Plant Mol. Biol. Rep. 5:387-405); ген R-локуса, который кодирует продукт, который регулирует продукцию антоцианиновых пигментов (красный цвет) в тканях растений (Dellaporta et al. (1988) "Molecular cloning of the maize R-nj allele by transposon tagging with Ac", 18th Stadler Genetics Symposium, P. Gustafson and R. Appels, eds., Plenum, NY, pp. 263-82); ген β-лактамазы (Sutcliffe et al. (1978) Proc. Natl. Acad. Sci. USA 75:3737-41); ген, который кодирует фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин); ген люциферазы (Ow et al. (1986) Science 234:856-9); ген xylE, который кодирует катехолдиоксигеназу, которая конвертирует хромогенные катехолы (Zukowski et al. (1983) Gene 46(2-3):247-55); ген амилазы (Ikatu et al. (1990) Bio/Technol. 8:241-2); ген тирозиназы, который кодирует фермент, способный окислять тирозин в DOPA и допахинон, который, в свою очередь, конденсируется в меланин (Katz et al. (1983) J. Gen. Microbiol. 129:2703-14); и ген α-галактозидазы.
Пригодные способы для трансформации клеток-хозяев включают любой способ, посредством которого ДНК можно встраивать в клетку, например, и не ограничиваясь этим, трансформацию протопластов (см., например, патент США 5508184), захват ДНК, опосредуемый обезвоживанием/ингибированием (см., например, Potrykus et al. (1985) Mol. Gen. Genet. 199:183-8), электропорацию (см., например, патент США 5384253), встряхивание с волокнами из карбида кремния (см., например, патенты США 5302523 и 5464765), опосредуемую Agrobacterium трансформацию (см., например, патенты США № 5563055; 5591616; 5693512; 5824877; 5981840 и 6384301) и ускорение покрытых ДНК частиц (см., например, патенты США № 5015580; 5550318; 5538880; 6160208; 6399861 и 6403865). С использованием способов, таких как эти, можно стабильно трансформировать клетки практически любого вида. В некоторых вариантах осуществления трансформирующую ДНК встраивают в геном клетки-хозяина. В случае многоклеточных видов, трансгенные клетки можно регенерировать в трансгенный организм. Любой из этих способов можно использовать для получения трансгенного растения, например, содержащего одну или несколько последовательностей нуклеиновой кислоты по изобретению в геноме трансгенного растения.
Наиболее широко используемый способ введения экспрессирующего вектора в растения основан на природной системе трансформации Agrobacterium. A. tumefaciens и A. rhizogenes представляют собой патогенные для растений бактерии почвы, которые генетически трансформируют клетки растений. Плазмиды Ti и Ri из A. tumefaciens и A. rhizogenes, соответственно, содержат гены, ответственные за генетическую трансформацию растения. Плазмиды Ti (индуцирующие опухоль) содержат большой сегмент, известный как T-ДНК, который переносится в трансформированные растения. Другой сегмент плазмиды Ti, область vir, ответственен за перенос T-ДНК. Область T-ДНК ограничена левыми и правыми границами, каждая из которых состоит из концевых повторяющихся нуклеотидных последовательностей. В модифицированных бинарных векторах индуцирующие опухоль гены удалены, и функции области vir используются для переноса чужеродной ДНК, ограниченной пограничными последовательностями T-ДНК. T-область также может содержать селективный маркер для эффективного восстановления трансгенных растений и клеток, и участок множественного клонирования для встраивания последовательностей для переноса, таких как нуклеиновая кислота, кодирующая слитый белок по изобретению.
Таким образом, в некоторых вариантах осуществления вектор для трансформации растений происходит из плазмиды Ti A. tumefaciens (см., например, патенты США № 4536475, 4693977, 4886937 и 5501967; и патент Европы EP 0122791) или плазмиды Ri A. rhizogenes. Дополнительные векторы для трансформации растений включают, например и не ограничиваясь ими, векторы, описанные Herrera-Estrella et al. (1983) Nature 303:209-13; Bevan et al. (1983), выше; Klee et al. (1985) Bio/Technol. 3:637-42; и в патенте Европы EP 0120516, и векторы, происходящие из любого из вышесказанных. Другие бактерии, такие как Sinorhizobium, Rhizobium и Mesorhizobium, которые естественным образом взаимодействуют с растениями в природе, можно модифицировать для обеспечения переноса генов в ряд разнообразных растений. Эти ассоциированные с растениями симбиотические бактерии можно делать компетентными для переноса генов путем введения как обезвреженных плазмид Ti, так и подходящего бинарного вектора.
После предоставления экзогенной ДНК реципиентным клеткам трансформированные клетки, как правило, идентифицируют для дальнейшего культивирования и регенерации растений. Для повышения способности идентифицировать трансформированные клетки, может быть желательным использование селективного маркерного гена или маркерного гена для скрининга, как описано выше, с вектором, используемым для получения трансформанта. В случае, когда используют селективный маркер, трансформированные клетки идентифицируют в потенциально трансформированной популяции клеток путем воздействия на клетки селективного средства или средств. В случае, когда используют маркер для скрининга, клетки можно подвергать скринингу на желаемый признак маркерного гена.
Клетки, которые выживают после воздействия селективного средства, или клетки, оцененные как положительные в скрининговом анализе, можно культивировать в среде, которая поддерживает регенерацию растений. В некоторых вариантах осуществления любую подходящую культуральную среду для ткани растения (например, среду MS и N6) можно модифицировать путем включения дополнительных веществ, таких как регуляторы роста. Ткань можно поддерживать на основной среде с регуляторами роста до тех пор, пока не станет доступно достаточно ткани, чтобы начать попытку регенерации, или, после повторяющихся раундов селекции вручную, до тех пор, пока морфология ткани не станет пригодной для регенерации (например, по меньшей мере 2 недели), а затем переносить в среду, способствующую образованию побега. Культуры пересаживают периодически до тех пор, пока не произойдет достаточное образование побега. После образования побегов их переносят в среду, способствующую образованию корней. После образования достаточных корней, растения можно переносить в почву для дальнейшего роста и созревания.
Для подтверждения присутствия представляющей интерес молекулы нуклеиновой кислоты (например, нуклеотидная последовательность, кодирующая полипептид, содержащий по меньшей мере один слитый белок по изобретению) в регенерирующем растении, можно проводить множество анализов. Такие анализы включают, например: молекулярно-биологические анализы, такие как саузерн-блоттинг и нозерн-блоттинг, ПЦР и секвенирование нуклеиновых кислот; биохимические анализы, такие как выявление присутствия белкового продукта, например, с помощью иммунологических средств (ELISA и/или вестерн-блоттинг) или ферментативной функции; анализы частей растений, такие как анализы листьев или корней; и анализ фенотипа целого регенерировавшего растения.
Встраивающиеся трансгенные объекты можно анализировать, например, путем амплификации ПЦР с использованием, например, олигонуклеотидных праймеров, специфичных к представляющей интерес нуклеотидной последовательности. Подразумевают, что генотипирование ПЦР включает, но не ограничивается этим, амплификацию с использованием полимеразной цепной реакции (ПЦР) геномной ДНК, происходящей из выделенной ткани растения-хозяина, предположительно содержащей представляющую интерес молекулу нуклеиновой кислоты, встроенную в геном, с последующим стандартным клонированием и анализом последовательности продуктов амплификации с использованием ПЦР. Способы генотипирования с помощью ПЦР подробно описаны (см, например, Rios, G. et al (2002) Plant J. 32:243-53) и их можно применять в отношении геномной ДНК, происходящей из любого вида растений, или типа ткани, включая клеточные культуры.
Трансгенное растение, образованное с использованием зависимых от Agrobacterium способов трансформации, как правило, содержит одну рекомбинантную последовательность ДНК, встроенную в одну хромосому. Одну рекомбинантную последовательность ДНК обозначают как "трансгенный объект" или "встраивающийся объект". Такие трансгенные растения являются гетерозиготными по встроенной последовательности ДНК. В некоторых вариантах осуществления трансгенное растение, гомозиготное в отношении трансгена, можно получать путем полового скрещивания (самоопыления) независимого трансгенного растения-сегреганта, которое содержит одну экзогенную последовательность гена с самим собой, например, растение F0, с получением семян Fl. Четверть полученных семян Fl, будут гомозиготными в отношении трансгена. Проращивание семян Fl приводит к растениям, которые можно исследовать в отношении гетерозиготности, как правило, с использованием анализа SNP или анализа температурной амплификации, который позволяет различить гетерозиготы и гомозиготы (т.е., анализ зиготности).
В конкретных вариантах осуществления копии по меньшей мере одного синтетического слитого белка активатора транскрипции, содержащего по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен, продуцируются в клетке, в которую была введена по меньшей мере одна молекула(ы) нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую по меньшей мере один синтетический слитый белок активатора транскрипции. Каждый синтетический слитый белок активатора транскрипции может экспрессироваться с множества последовательностей нуклеиновой кислоты, введенных в различных трансформирующих объектах, или с одной последовательности нуклеиновой кислоты, введенной в одном трансформирующем объекте. В некоторых вариантах осуществления множество таких слитых белков может экспрессироваться под контролем одного промотора. В других вариантах осуществления множество таких слитых белков может экспрессироваться под контролем множества промоторов.
В дополнение к прямой трансформации растения или клетки растения молекулой нуклеиновой кислоты по изобретению, в некоторых вариантах осуществления трансгенные растения можно получать путем скрещивания первого растения, имеющего по меньшей мере один трансгенный объект, со вторым растением, лишенным такого объекта. Например, молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен, можно вводить в клетку первой линии растений, которая поддается трансформации, с получением трансгенного растения, которое можно скрещивать со второй линией растений для интрогрессии нуклеотидной последовательности, которая кодирует синтетический слитый белок активатора транскрипции, во вторую линию растений.
VIII. Растительные материалы, содержащие слитый белок активатора транскрипции
В некоторых вариантах осуществления предусматривается растение, где растение содержит клетку растения, содержащую нуклеотидную последовательность, кодирующую синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен. В конкретных вариантах осуществления такое растение можно получать путем трансформации ткани растения или клетки растения и регенерации целого растения. В следующих вариантах осуществления такое растение можно получать путем интрогрессии нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую синтетический слитый белок активатора транскрипции, в зародышевую плазму. Также предусматриваются растительные материалы, содержащие такую клетку растения. Такой растительный материал можно получать из растения, содержащего клетку растения.
Трансгенное растение или растительный материал, содержащие нуклеотидную последовательность, кодирующую синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен в некоторых вариантах осуществления может проявлять одну или несколько из следующих характеристик: экспрессия слитого белка в клетке растения; экспрессия слитого белка в пластиде клетки растения; экспрессия слитого белка в ядре клетки растения; локализация слитого белка в клетке растения; встраивание нуклеотидной последовательности в геном клетки растения; присутствие нуклеотидной последовательности во внехромосомной ДНК клетки растения; и/или присутствие РНК-транскрипта, соответствующего нуклеотидной последовательности в клетке растения. Кроме того, такое растение может иметь один или несколько желаемых признаков, отличных от экспрессии кодируемого слитого белка. Такие признаки могут включать признаки, являющиеся результатом экспрессии эндогенной или трансгенной нуклеотидной последовательности, экспрессия которой регулируется слитым белком в клетке растения, например, но не ограничиваясь этим: устойчивость к насекомым, другим паразитам и болезнетворным агентам; устойчивость к гербицидам; усиленная стабильность, выход или срок хранения; устойчивость к факторам внешней среды; фармацевтическое производство; производство промышленного продукта и улучшение питательных качеств.
Трансгенное растение по изобретению может представлять собой любое растение, способное быть трансформированным молекулой нуклеиновой кислоты по изобретению. Таким образом, растение может быть двудольным или однодольным. Неограничивающие примеры двудольных растений, пригодных в настоящих способах, включают Arabidopsis, люцерну, боб, брокколи, капусту, канолу, морковь, цветную капусту, сельдерей, китайскую капусту, хлопок, огурец, баклажан, салат-латук, дыню, горох, перец, арахис, картофель, тыкву обыкновенную, хрен, рапс, шпинат, сою, тыкву крупноплодную, сахарную свеклу, подсолнечник, табак, томат и арбуз. Неограничивающие примеры однодольных растений, пригодных в настоящих способах, включают кукурузу, лук, рис, сорго, пшеницу, рожь, просо культурное, сахарный тростник, тритикале, просо прутьевидное и траву рулонного газона. Трансгенные растения по изобретению можно использовать или культивировать любым образом.
Некоторые варианты осуществления также относятся к товарным продуктам, содержащим одну или несколько нуклеотидных последовательностей, кодирующих синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен; например, к товарному продукту, полученному из рекомбинантного растения или семени, содержащих одну или несколько таких нуклеотидных последовательностей. Товарные продукты, содержащие одну или несколько нуклеотидных последовательностей, кодирующих синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен, включают, например и не ограничиваются ими: продукты питания, муку, масла, или дробленые или цельные зерна или семена растения, содержащего одну или несколько нуклеотидных последовательностей, кодирующих такой синтетический слитый белок активатора транскрипции. Обнаружение одной или нескольких нуклеотидных последовательностей, кодирующих синтетический слитый белок активатора транскрипции по изобретению, в одном или нескольких товарах или товарных продуктах фактически является доказательством того, что товар или товарный продукт был по меньшей мере частично продуцирован из растения, содержащего одну или несколько нуклеотидных последовательностей, кодирующих синтетический слитый белок активатора транскрипции по изобретению. В конкретных вариантах осуществления товарный продукт по изобретению содержит поддающееся обнаружению количество последовательности нуклеиновой кислоты, кодирующей синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен. В некоторых вариантах осуществления такие товарные продукты можно получать, например, получая трансгенные растения и изготавливая из них продукты питания или корм.
В некоторых вариантах осуществления трансгенное растение или семя, содержащие трансген, содержащий нуклеотидную последовательность, кодирующую синтетический слитый белок активатора транскрипции по изобретению, также может содержать по меньшей мере один другой трансгенный объект в своем геноме, включая, но не ограничиваясь ими: трансгенный объект, с которого транскрибируется молекула РНК-i; ген, кодирующий инсектицидный белок (например, инсектицидный белок Bacillus thuringiensis); ген устойчивости к гербициду (например, ген, обеспечивающий устойчивость к глифосату); и ген, вносящий вклад в желаемый генотип в трансгенном растении (например, увеличенный выход, измененный метаболизм жирных кислот или восстановление цитоплазматической мужской стерильности).
В некоторых вариантах осуществления трансгенное растение или семя, содержащие трансген, содержащий нуклеотидную последовательность, кодирующую синтетический слитый белок активатора транскрипции по изобретению, могут содержать эндогенный или нативный ген-мишень в геноме трансгенного растения, включая, но не ограничиваясь ими: эндогенный ген-мишень для признака измененного метаболизма жирных кислот, эндогенный ген-мишень для признака устойчивости к засухе, эндогенный ген-мишень для признака эффективности утилизации азота, или любой другой эндогенный ген-мишень, вносящий вклад в желаемый фенотип в трансгенном растении (например, увеличенный выход или восстановление цитоплазматической мужской стерильности). Эндогенный или нативный ген-мишень могут быть функционально связаны с нуклеотидной последовательностью, с которой специфично связывается синтетический слитый белок активатора транскрипции, тем самым, осуществляя транскрипцию гена-мишени.
IX. Регуляция экспрессии слитым белком активатора транскрипции
В некоторых вариантах осуществления синтетический слитый белок активатора транскрипции, содержащий по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен можно использовать для увеличения (например, инициации) экспрессии представляющей интерес нуклеотидной последовательности (например, представляющего интерес гена) в клетке. Представляющая интерес нуклеотидная последовательность в некоторых вариантах осуществления может быть эндогенной для генома клетки. В других вариантах осуществления по меньшей мере одна экзогенная молекула(ы) нуклеиновой кислоты, содержащая представляющую интерес нуклеотидную последовательность, введена в клетку. Как правило, вторая нуклеотидная последовательность, функционально связанная с представляющей интерес нуклеотидной последовательностью, распознается ДНК-связывающим доменом слитого белка, так чтобы могло происходить стабильное и специфическое связывание между второй нуклеотидной последовательностью и слитым белком. В некоторых примерах по меньшей мере одна молекула(ы) нуклеиновой кислоты, содержащая представляющую интерес нуклеотидную последовательность, дополнительно содержит такую вторую нуклеотидную последовательность. В некоторых примерах по меньшей мере одну молекулу(ы) нуклеиновой кислоты, содержащую представляющую интерес нуклеотидную последовательность, вводят в клетку-хозяина, так чтобы представляющая интерес нуклеотидная последовательность была функционально связана со второй нуклеотидной последовательностью, которая является эндогенной для клетки-хозяина. Например, молекула нуклеиновой кислоты, содержащая представляющую интерес нуклеотидную последовательность, может облегчать гомологичную рекомбинацию, которая встраивает представляющую интерес нуклеотидную последовательность в геном клетки-хозяина, так чтобы представляющая интерес нуклеотидная последовательность была функционально связана с эндогенной последовательностью, которая распознается ДНК-связывающим доменом. В некоторых примерах по меньшей мере одна молекула(ы) нуклеиновой кислоты, содержащая представляющую интерес нуклеотидную последовательность, является эндогенной или нативной в клетке-хозяине, так чтобы представляющая интерес нуклеотидная последовательность была функционально связана со второй нуклеотидной последовательностью, которая является эндогенной для клетки-хозяина.
В некоторых примерах множество представляющих интерес нуклеотидных последовательностей, которые введены в различных трансформирующих объектах, может экспрессироваться под регуляторным контролем одного слитого белка. В других примерах одна представляющая интерес нуклеотидная последовательность (например, один встраивающийся объект) регулируется и экспрессируется. В некоторых вариантах осуществления множество представляющих интерес нуклеотидных последовательностей могут регулироваться путем связывания слитого белка по изобретению с одним участком связывания нуклеиновой кислоты; например, все из множества представляющих интерес нуклеотидных последовательностей могут быть функционально связанными с одной и той же второй нуклеотидной последовательностью, с которой специфично связывается ДНК-связывающий домен слитого белка. Представляющие интерес нуклеотидные последовательности, содержащие такое множество, не обязательно являются одними и теми же в определенных примерах. Таким образом, множество различных продуктов геном может экспрессироваться под регуляторным контролем одного слитого белка.
В конкретных вариантах осуществления продукт экспрессии представляющей интерес нуклеотидной последовательности, который находится под регуляторным контролем слитого белка по изобретению, может представлять собой продукт маркерного гена; например, но не ограничиваясь ими, флуоресцентную молекулу. Количественные и качественные наблюдения, касающиеся экспрессии такого продукта экспрессии, могут обеспечить систему для оценки конкретных регуляторных свойств конкретного мотива взаимодействия TAD или варианта мотива взаимодействия TAD.
Любой продукт экспрессии (например, белок, белок-предшественник и ингибиторная молекула РНК) могут экспрессироваться под регуляторным контролем синтетического слитого белка активатора транскрипции, содержащего по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен. В конкретных примерах продукт экспрессии под регуляторным контролем синтетического слитого белка активатора транскрипции может представлять собой, но не ограничиваться ими, эндогенный или нативный полипептид, который обычно экспрессируется в клетке-хозяине, в которую введена нуклеиновая кислота, кодирующая слитый белок. В других примерах продукт экспрессии под регуляторным контролем синтетического слитого белка активатора транскрипции может представлять собой гетерологичный полипептид, который обычно не экспрессируется в клетке-хозяине. Например, но не ограничиваясь ими, продукт экспрессии под регуляторным контролем синтетического слитого белка активатора транскрипции может представлять собой полипептид, вовлеченный в устойчивость к гербициду, устойчивость к вирусам, устойчивость к бактериальным патогенам, устойчивость к насекомым, устойчивость к нематодам или устойчивость к грибам. См., например, патенты США 5569823; 5304730; 5495071; 6329504 и 6337431. Продукт экспрессии под регуляторным контролем синтетического слитого белка активатора транскрипции альтернативно может представлять собой, но не ограничиваясь ими, полипептид, вовлеченный в мощность или выход растения (включая полипептиды, вовлеченные в устойчивость к экстремальным температурам, условиям почвы, уровням освещенности, уровням воды и химическим факторам среды), или полипептид, который можно использовать в качестве маркера для идентификации растения, содержащего представляющий интерес признак (например, продукт гена селективного маркера и полипептид, вовлеченный в цвет семян).
Неограничивающие примеры полипептидов, которые могут находиться под регуляторным контролем синтетического слитого белка активатора транскрипции, содержащего по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен, в некоторых вариантах осуществления изобретения включают: ацетолактатсинтазу (ALS), мутантную ALS и предшественники ALS (см., например, патент США 5013659); EPSPS (см., например, патенты США 4971908 и 6225114), такую как CP4 EPSPS или EPSPS класса III; ферменты, которые модифицируют физиологический процесс, который происходит в пластиде, включая, например, но не ограничиваясь ими, фотосинтез и синтез жирных кислот, аминокислот, масел, аротиноидов, терпеноидов и крахмала. Другие неограничивающие примеры полипептидов, которые могут находиться под регуляторным контролем синтетического слитого белка активатора транскрипции, в конкретных вариантах осуществления включают: зеаксантинэпоксидазу, холинмонооксигеназу, феррохелатазу, десатуразу омега-3-жирных кислот, глутаминсинтетазу, модифицирующие крахмал ферменты, полипептиды, вовлеченные в синтез незаменимых аминокислот, провитамин A, гормоны, Bt-токсин и белки. Нуклеотидные последовательности, кодирующие упомянутые выше пептиды, доступны в данной области и такие нуклеотидные последовательности могут быть функционально связанными с конкретным участком связывания для ДНК-связывающего домена, подлежащего экспрессии под регуляторным контролем синтетического слитого белка активатора транскрипции, содержащего по меньшей мере один мотив взаимодействия TAD растений (и/или вариант мотива взаимодействия TAD) и по меньшей мере один ДНК-связывающий домен, который специфично связывается с функционально связанным участком.
Более того, вариант представляющей интерес нуклеотидной последовательности в соответствии с любым из упомянутых выше полипептидов, которые должны быть помещены под регуляторный контроль, могут быть идентифицированы специалистами в данной области (например, путем клонирования генов с высокой гомологией с другими генами, кодирующими конкретный полипептид, или путем получения последовательности in silico с учетом вырожденности кодонов ДНК). Такие варианты могут быть желательными в конкретных вариантах осуществления, например, чтобы они соответствовали с предпочтительным использованием кодонов в организме-хозяине. После идентификации такого варианта представляющей интерес нуклеотидной последовательности можно конструировать молекулу нуклеиновой кислоты для обеспечения регуляторного контроля последовательности синтетическим полипептидом активатора транскрипции в соответствии с изобретением, например, путем функционального связывания варианта представляющей интерес нуклеотидной последовательности в молекуле нуклеиновой кислоты с известным участком связывания для ДНК-связывающего домена, содержащегося в конкретном синтетическом слитом белке активатора транскрипции, подлежащем применению. В вариантах осуществления, описанных в настоящем описании, неожиданное увеличение экспрессии такого варианта представляющей интерес нуклеотидной последовательности можно наблюдать (например, в клетке растения-хозяина), когда молекула нуклеиновой кислоты и один из конкретных синтетических слитых белков активаторов транскрипции, описанных в настоящем описании, присутствуют в клетке-хозяине одновременно.
Ссылки, рассмотренные в настоящем описании, предоставлены только для их раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не следует истолковывать как допущение того, что это изобретение дает право на противопоставление факта создания изобретения с более ранним приоритетом.
Представленные ниже примеры предоставлены для иллюстрации определенных конкретных признаков и/или вариантов осуществления. Примеры не следует истолковывать как ограничивающие раскрытие конкретных признаков или проиллюстрированных вариантов осуществления.
ПРИМЕРЫ
Пример 1: Идентификация мотивов взаимодействия трансактивации растений
Семь белков было идентифицировано в качестве гомологичных домену трансактивации VP16 (SEQ ID NO:1): PTI4 (номер доступа GenBank № ACF57857.1), ERF2 (номер доступа GenBank № NP_199533.1), AtERF1 (номер доступа GenBank № NP_567530.4), ORCA2 (номер доступа GenBank № CAB93940.1), DREB1A (номер доступа GenBank № NP_567720.1), CBF1 (номер доступа GenBank № NP_567721.1), и DOF1 (номер доступа GenBank № NP_001105709.1). Аминокислотная последовательность домена трансактивации VP16 (SEQ ID NO:1) обладает сходством последовательности с областями этих предполагаемых активаторов транскрипции растений, и последовательность VP16 использовали для определения локализации домена трансактивации в каждом активаторе. Идентифицированные домены трансактивации для этих белков-активаторов растений представляют собой: SEQ ID NO:2 (PTI4), SEQ ID NO:3 (ERF2), SEQ ID NO:4 (AtERF1), SEQ ID NO:5 (ORCA2), SEQ ID NO:6 (DREB1A), SEQ ID NO:7 (CBF1) и SEQ ID NO:8 (DOF1). Далее мотив взаимодействия субдомена трансактивации II VP16 (фиг.1; SEQ ID NO:9) использовали для определения локализации мотива взаимодействия из доменов трансактивации растений. На фиг. 2 представлено выравнивание VP16 с доменами трансактивации растений, где новые мотивы взаимодействия выделены цветом.
Пример 2: Модификация идентифицированных мотивов взаимодействия доменов трансактивации растений
Модифицировали мотивы взаимодействия идентифицированных доменов трансактивации растений. Получали новые варианты мотивов взаимодействия, которые содержали остатки контакта аминокислот в субдомене II мотива взаимодействия домена трансактивации VP16. Langlois et al. (2008) J. Am. Chem. Soc. 130:10596. Шесть остатков контакта аминокислот домена трансактивации VP16 предложены для прямого взаимодействия с Tfb1, субъединицей фактора транскрипции TFIIH. На фиг. 1. аминокислоты вносили в мотивы взаимодействия вновь идентифицированных доменов трансактивации растений с получением вариантов последовательностей.
Авторы настоящего изобретения предположили, что модификация мотивов взаимодействия так, чтобы они содержали шесть остатков контакта аминокислот, идентифицированных в мотиве взаимодействия VP16 субдомена II, может обеспечить модифицированные мотивы взаимодействия активаторов растений, способных взаимодействовать с более разнообразными факторами транскрипции, тем самым, обеспечивая более высокие уровни экспрессии белка.
Модификации ERF2
Область с Asn53 по Ala85 в ERF2, выровненная с субдоменом II домена трансактивации VP16 (фиг.2), была идентифицирована как последовательность домена трансактивации растений ERF2. Модификации вносят в область, для которой выявлено, что она соответствует мотиву взаимодействия субдомена II домена трансактивации VP16; с Asp66 по Asp76. Модифицировали аминокислотные остатки, которые отличались от шести остатков контакта мотива взаимодействия субдомена II домена трансактивации VP16. Эти изменения приводили к иллюстративным модифицированным мотивам взаимодействия ERF2 (т.е., последовательность варианта мотива взаимодействия), которые являются сходными с мотивами субдомена II домена трансактивации VP16. Фиг. 3.
Модификации мотивов взаимодействия PTI4, AtERF1, ORCA2, DREB1A, CBF1 и DOF1
В мотивы взаимодействия PTI4, AtERF1, ORCA2, DREB1A, CBF1 и DOF1, вносили модификации, сходные с модификациями, внесенными в ERF2. Аминокислотные остатки нативных последовательностей, которые отличались от шести остатков прямого контакта мотива взаимодействия субдомена II домена трансактивации VP16, модифицировали, тем самым получая иллюстративные варианты мотивов взаимодействия. Эти изменения вносили для получения вариантов мотивов взаимодействия растений, сходных (например, функционально сходных) с вариантами мотива взаимодействия субдомена II домена трансактивации VP16. Иллюстративные последовательности этих вариантных и модифицированных мотивов взаимодействия по сравнению с нативной последовательностью мотива взаимодействия субдомена II домена трансактивации VP16, приведены на фиг. 4-9.
Пример 3: Исследование мотивов взаимодействия доменов активации растений в репортерном штамме Saccharomyces cerevisiae
Репортерный штамм Saccharomyces cerevisiae
Репортерный штамм Saccharomyces cerevisiae получали для исследования доменов активации растений, содержащих либо нативные мотивы взаимодействия, либо варианты мотивов взаимодействия. Трехстадийная методика клонирования приводила к конструированию встраивающегося вектора дрожжей pHO-zBG-MEL1 (фиг.10).
Сначала два отдельных фрагмента репортерного вектора SSA дрожжей pNorMEL1 (Doyon et al. (2008) Nat. Biotechnol. 26(6):702-8), амплифицировали способом ПЦР. Первый фрагмент содержал экспрессирующую кассету KanMX, и ее амплифицировали с pNorMEL1 с использованием праймеров KanMX-For (SEQ ID NO:59) и KanMX-Rev (SEQ ID NO:60), которые добавляли участки рестрикции 5’ SpeI, BamHI, NheI, PacI, BglII, KpnI, и 3’ EcoRI, соответственно. Второй фрагмент содержал направленные наружу плечи гомологии локуса HO (Voth et al. (2001) Nucleic Acids Res. 29(12):E59-9), разделенные бактериальным ориджином репликации, и его амплифицировали с использованием праймеров HO-For (SEQ ID NO:61) и HO-Rev (SEQ ID NO:62). Эти два фрагмента расщепляли посредством EcoRI/SpeI и лигировали с получением поддающегося селекции с помощью KanMX нацеливающего на HO вектора.
Далее экспрессирующую кассету MEL1 из pMEL1α2 (Melcher et al. (2000) Gene 247(1-2):53-61) амплифицировали с помощью праймеров MEL1-For (SEQ ID NO:63) и MEL1-Rev (SEQ ID NO:64) и клонировали в участок KpnI поддающегося селекции с помощью KanMX нацеливающего на HO вектора.
Наконец участок связывания для белка с цинковыми пальцами (ZFP) (обозначаемый как "HAS" от High Affinity Site (высокоаффинный участок)) синтезировали de novo у постороннего поставщика (DNA2.0, Menlo Park, CA). Этот участок содержал участки связывания для белков с цинковыми пальцами (ZFP), нацеленных на ген CCR5 человека (Perez et al. (2008) Nat. Biotechnol. 26:808-16). Фрагмент HAS амплифицировали с помощью ПЦР с использованием праймеров HAS-For-F1 (SEQ ID NO:65) и HAS-For-R1 (SEQ ID NO:66) и клонировали в участки BamHI-PacI вектора KanMX HO MEL1, расположенного выше репортерного гена MEL1. Этот конечный вектор был обозначен как pHO-zBG-MEL1 (фиг.10).
pHO-zBG-MEL1 линеаризовывали с помощью NotI для раскрытия фланкирующих плеч гомологии для нацеливания на локус HO дрожжей и трансформировали в штамм S. cerevisiae, BY4741 MATα (Invitrogen, Carlsbad, CA), с использованием протокола, предложенного изготовителем. В кратком изложении, 3 мл культуры в фазе логарифмического роста BY4741 осаждали и промывали буфером TEL (10 мМ Tris HCL pH 8,0, 1 мМ EDTA, 100 мМ ацетат лития). Осадок в виде дрожжевых клеток ресуспендировали в 360 мкл раствора для трансформации дрожжей (33,3% PEG-3350 (Sigma-Aldrich, St. Louis, MO), 0,1 M ацетат лития (Sigma-Aldrich), и 0,2 мг/мл ДНК спермы лосося (Stratagene, La Jolla, CA) в 1X TE), содержащего 3 мкг линеаризованного pHO-zBG-MEL1, и подвергали тепловому шоку в течение 40 минут при 42°C. Клетки дрожжей осаждали, промывали и выращивали в обогащенной среде за 2 часа до селекции на чашках с YPD, содержащих 1 мг/л Geneticin® (Life Technologies, Carlsbad, CA). Устойчивые клоны повторно наносили штрихами на чашки с YPD + Geneticin®, и использовали для последующих трансформаций.
Конструирование экспрессирующей кассеты активатора транскрипции ZFP дрожжей
Конструировали конструкции ДНК, содержащие в рамке считывания связывающий белок с цинковыми пальцами CCR5 (CCR5-ZFP) - трансактивирующий мотив взаимодействия растений. Нативные и вариантные трансактивирующие мотивы взаимодействия растений, описанные в SEQ ID NO:80-93, использовали в качестве фрагмента, полученного расщеплением ферментом рестрикции BamHI/HindIII, и клонировали непосредственно ниже последовательностей, кодирующих домены CCR5-ZFP (Perez et al. (2008), выше). В полученной экспрессирующей кассете ZFP-активатор транскрипции использовался промотор GAL1.10 (West et al. (1987) Genes Dev. 1:1118-31) и терминатор CYC1 (Osborne et al. (1988) Genes Dev. 2:766-72), и она была основана на векторе дрожжей серии pRS315. Полученные векторы содержали нативные и вариантные трансактивирующие мотивы взаимодействия растений в качестве конструкций, слитых в рамке считывания с CCR5-ZFP.
Кроме того, было включено несколько контролей. В исследовании использовали контроль в виде пустого вектора и две различных экспрессирующих кассеты активаторов транскрипции VP-16, SGMO VP16-CCR5 (SEQ ID NO:79) и VP16v2 CCR5-CCR5. Обе экспрессирующие кассеты активаторов транскрипции VP-16 контролировались промотором GAL1.10 и терминировались терминатором CYC1. Контроль в виде пустого вектора содержал только домены CCR5-ZFP и не содержал трансактивирующий мотив взаимодействия.
Анализ активности в дрожжах
Ночные культуры штамма репортерной линии BY4741 выращивали в YPD + Geneticin®, и 1 мкг вектора, содержащего экспрессирующую кассету ZFP-активатор транскрипции, доставляли с использованием стандартного протокола трансформации дрожжей в 96-луночном формате. Все трансформации проводили в двух экземплярах. Трансформированные клетки дрожжей восстанавливали в синтетической среде с декстрозой без лейцина (SD - Leu) для селекции вектора, содержащего экспрессирующую кассету ZFP-активатор транскрипции. Через 72 часа клетки дрожжей обогащали трансформантами в разведении 1:10 в SD - Leu и выращивали в течение дополнительных 24 часов. Далее клетки дрожжей разбавляли 1:10 в синтетический среде с рафинозой без лейцина (SR - Leu) для устранения подавления промотора GAL1.10. Через 24 часа клетки дрожжей осаждали и ресуспендировали в синтетической среде с галактозой без лейцина (SG - Leu). В моменты времени через 0, 3 и 6 часов после индукции галактозой 110 мкл клеток дрожжей собирали для анализа MEL1.
В анализе MEL1 100 мкл из 110 мкл клеток дрожжей разбавляли в 100 мкл воды и измеряли оптическую плотность при 600 нм (OD600) с использованием спектрофотометра. Оставшиеся 10 мкл клеток дрожжей инкубировали в 90 мкл буфера MEL1 (77 мМ Na2HPO4, 61 мМ лимонная кислота, 2 мг/мл PNPG (Sigma-Aldrich)) в течение 1 часа при 30°C. Реакцию останавливали добавлением 100 мкл 1 M Na2CO3. Активность MEL1 оценивали при OD405, и mU вычисляли с использованием формулы на основе соотношения показателей OD405 и OD600 (Doyon et al. (2008) Nat. Biotechnol. 26(6):702-8).
Уровень экспрессии репортерного гена Mel1 в результате активации различными трансактивирующими мотивами взаимодействия растений, представлен на фиг. 11. Экспрессия белка MEL1 в результате этих различных трансактивирующих мотивов взаимодействия растений сравнивали с контролем в виде пустого вектора и активацией Mel1 из субдомена II домена трансактивации VP16 (SEQ ID NO:1) (VP16(v2)-CCR5) и SGMO VP16 (SGMO VP16-CCR5).
Модифицированный трансактивирующий мотив взаимодействия ERF2 (v2) растений обеспечивал неожиданно высокие уровни экспрессии по сравнению с контролем VP16. Кроме того, экспрессия Mel1 с этим вариантом трансактивирующего мотива взаимодействия растений была увеличенной относительно нативной версии трансактивирующего мотива взаимодействия ERF2 (v3) растений.
Модифицированный трансактивирующий мотив взаимодействия PTI4 (v2) растений экспрессировал белок MEL1 на уровнях, сходных с контролем в виде домена трансактивации VP16. Однако модификации, внесенные в мотив взаимодействия PTI4, приводили к значительно более высоким уровням экспрессии Mel1 по сравнению с нативным трансактивирующим мотивом взаимодействия PTI4 (v3) растений.
Трансактивирующие мотивы взаимодействия AtERF1(v3), AtERF1(v2), ORCA2(v3), ORCA2(v2), DOF1(v3), DOF1(v2), DREB1A(v3), DREB1A(v2), CBF1(v3) и CBF1(v2) растений не обеспечили высоких уровней экспрессии Mel1 в анализе дрожжей по сравнению с контролями VP16. Однако трансактивирующие мотивы взаимодействия AtERF1, DREB1A и CBF1 растений не контролировали экспрессию Mel1 в дрожжах. Только трансактивирующие мотивы взаимодействия ORCA2 (v3) и DOF1 (v2) растений не приводили ни к какой экспрессии Mel1 в анализе на дрожжах.
Уровни MEL1, продуцированного доменом трансактивации растений для модифицированных вариантов (v2) трансактивирующих мотивов взаимодействия, как правило, были более высокими по сравнению с нативными трансактивирующими мотивами взаимодействия (v3) в анализе Mel1 в дрожжах. Единственным модифицированным трансактивирующим мотивом взаимодействия растений, который не контролировал экспрессию Mel1 в анализе дрожжей, был мотив взаимодействия (v2) DOF1. Этот трансактивирующий мотив взаимодействия растений не обеспечивал никакой экспрессии MEL1 в анализе дрожжей.
Пример 4: Функция мотивов взаимодействия доменов активации растений в табаке, содержащем репортерную конструкцию, содержащую ДНК-связывающий домен с цинковыми пальцами
Репортерная конструкция pDAB9897
Восемь тандемных повторов полинуклеотидной последовательности ДНК-связывающего домена Z6 (SEQ ID NO:67; Yokoi et al. (2007) Mol Ther. 15(11):1917-23) синтезировали de novo (IDT, Coralsville, IA) с участками SacII, добавленными на 5’ и 3’-концы, для облегчения клонирования. Затем целый связывающий домен 8X-Z6 (SEQ ID NO:68) клонировали в предсуществующий исходный вектор Gateway®, содержащий желаемые элементы экспрессии растений. Участки связывания 8X-Z6 помещали на фрагмент SacII и клонировали непосредственно выше промотора актина-2 Arabidopsis thaliana (промотор v2 AtAct2; An et al. (1996) Plant J. 10:107-21) с использованием уникального участка SacII, находящегося в остове вектора. Затем ген gus (GUS; Jefferson (1989) Nature 342:837-8) клонировали в этот вектор под прямым контролем промотора актина-2 A. thaliana с использованием уникальных участков NcoI/SacI с кодоном ATG участка NcoI, формирующим кодон инициации. Для терминации транскрипции использовали 3’UTR Atu ORF23 (3’-нетранслируемая область открытой рамки считывания 23 Agrobacterium tumefaciens; патентная заявка Европы № EP 222493 A1).
Конечный трансформирующий вектор pDAB9897 (фиг. 12) был результатом лигирования Gateway® с конечным вектором, содержащим кассету с селективным маркером: промотор убиквитина 10 A. thaliana (промотор v2 At Ubi10 (Callis et al. (1990) J. Biol. Chem. 265:12486-93)):: ген фосфинотрицинацетилтрансферазы (pat v3 (Wohlleben et al. (1988) Gene 70:25-37)):: открытая рамка считывания-1 A. tumefaciens, 3’нетранслируемая область (AtuORF1 3’UTR v3 (Huang et al. (1990) J. Bacteriol. 172:1814-22) для селекции растений. Конечный вектор для трансформации подтверждали посредством секвенирования и трансформировали в штамм A. tumefaciens LBA4404 (Invitrogen, Carlsbad, CA).
Опосредуемая Agrobacterium трансформация табака посредством рDAB9897
Для получения трансгенных репортерных объектов растений, диски листьев (1 см2), вырезанные из растений табака Petit Havana, инкубировали в ночной культуре штамма A. tumefaciens LBA4404, содержащей плазмиду pDAB9897, выращенную до OD600 ~1,2 нм, промакивали насухо на стерильной фильтровальной бумаге, а затем помещали на среду MS (Phytotechnology Labs, Shawnee Mission, KS) и 30 г/л сахарозы с добавлением 1 мг/л индолуксусной кислоты и 1 мг/л бензиламинопурина в чашки размером 60×20 мм (5 дисков на чашку), закрытых Nescofilm® (Karlan Research Products Corporation, Cottonwood, AZ). После сокультивирования в течение 48 часов диски листьев переносили на ту же среду с 250 мг/л цефотаксима и 5 мг/л BASTA®. Через 3-4 недели ростки переносили в среду MS с 250 мг/л цефотаксима и 10 мг/л BASTA® в PhytaTrays™ на дополнительные 2-3 недели перед сбором листьев и молекулярным анализом.
Анализ количества копий и PTU для репортерных трансгенных объектов.
Выделение ДНК способом ПЦР. Трансгенную ткань растений табака собирали из вновь выращенных ростков и лиофилизировали (Labconco, Kansas City, MO) в течение по меньшей мере 2 суток в 96-луночных планшетах для сбора (Qiagen, Valencia, CA). Затем выделяли ДНК с использованием 96-луночного набора для экстракции DNEasy™ (Qiagen), в соответствии с инструкциями изготовителей. Для разрушения ткани использовали измельчитель для тканей Model 2-96A Kleco™ (Garcia Manufacturing, Visalia, CA).
Выделение ДНК саузерн-методом. Ткань трансгенных растений табака собирали из вновь выращенных ростков и лиофилизировали (Labconco, Kansas City, MO) в течение по меньшей мере 2 суток в 2-мл конических пробирках (Eppendorf). Затем ДНК выделяли с использованием набора для экстракции DNEasy™ Plant Mini extraction kit (Qiagen), в соответствии с инструкциями изготовителей. Для разрушения тканей использовали измельчитель для тканей Model 2-96A Kleco™ (Garcia Manufacturing).
Количественное определение ДНК. Полученную геномную ДНК количественно определяли с использованием набора для анализа Quant-iT™ PicoGreen® DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Пять стандартов ДНК с предварительно измеренным количеством от 20 нг/мкл до 1,25 нг/мкл (серийно разбавленных) использовали для получения стандартной кривой. Сначала образцы разбавляли в разведениях 1:10 или 1:20 так, чтобы они находились в линейном диапазоне для анализа, и концентрации геномной ДНК определяли в соответствии с протоколом изготовителя. Затем регистрировали флуоресценцию с использованием устройства для считывания планшетов Synergy2™ (Biotek, Winooski, VT). Концентрацию геномной ДНК оценивали из стандартной кривой, построенной с учетом поправки на фоновую флуоресценцию. С использованием TE или воды, затем ДНК разбавляли до общей концентрации 10 нг/мкл для ПЦР с использованием автоматизированного устройства для обработки жидкостей Biorobot3000™ (Qiagen). ДНК для саузерн-анализа оставляли неразбавленной.
Оценка количества копий. Предполагаемые трансгенные объекты анализировали в отношении комплексности встраивания с использованием a мультиплексного анализа гидролиза зонда ДНК, аналогичного анализу TaqMan® (Applied Biosystems, Carlsbad, CA). Количество копий вставки трансгена оценивали с использованием специфичных для последовательности праймеров и зондов как для трансгена pat, так и для эндогенного эталонного гена табака pal (фенилаланинаммонийлиаза; номер доступа GenBank № AB008199). Анализы обоих генов разрабатывали с использованием программного обеспечения LightCycler® Probe Design Software 2.0 (Roche Applied Science, Indianapolis, IN). Оценку способом ПЦР в реальном времени для обоих генов проводили с использованием системы LightCycler®480 (Roche Applied Science).
Для амплификации приготавливали смесь LightCycler®480 Probes Master mix (Roche Applied Science) в 1X конечной концентрации в мультиплексной реакционной смеси объемом 10 мкл, содержавшей 0,4 мкМ каждого праймера и 0,2 мкМ каждого зонда. Таблица 1. Двухстадийную реакцию амплификации проводили с удлинением при 58°C в течение 38 секунд регистрацией данных флуоресценции. Все образцы анализировали в трех экземплярах и для анализа каждого образца использовали усредненные величины Ct. Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCycler® (Roche Applied Science) через сравнительный квантовый модуль, и он был основан на способе ΔΔCt. Калибровочный образец гДНК с одной копией был включен для нормализации результатов. Калибровочный трансгенный объект с одной копией ранее был идентифицирован с помощью саузерн-анализа, и было подтверждено, что он имеет одну вставку гена pat.
Последовательности праймеров и зондов, использованных в анализе гидролиза зондов как для pat, так и для pal (HP). Флуоресцентный эпитоп каждого зонда отличался, что позволило одновременное проведение анализов в мультиплексной реакции.
(SEQ ID NO:69)
(SEQ ID NO:70)
(SEQ ID NO:71)
(SEQ ID NO:72)
(SEQ ID NO:73)
ПЦР для PTU. Затем трансгенные объекты с низким количеством копий подвергали скринингу способом ПЦР в отношении интактных единиц транскрипции растений (PTU). С использованием праймеров Blu636 (SEQ ID NO:75) и Blu637 (SEQ ID NO:76) правильная амплификация приводила к продукту размером 3,7 т.п.н., состоящему из Z6-Act2/GUS/AtORF23 PTU (3,771 п. о.). Использовали смесь Phusion® GC Master Mix (New England Biolabs, Beverley, MA) со следующими условиями реакции: 98°C в течение 30 секунд, затем 30 циклов при 98°C в течение 10 секунд, 67°C в течение 30 секунд, 72°C в течение 2 минут, и конечное удлинение при 72°C в течение 10 минут. В дополнение к реакции ПЦР для PTU, подробно описанной выше, также была включена амплификация эндогенного гена chs (хальконсинтаза; номер доступа Genbank № FJ969391.1), для подтверждения качестве геномных ДНК-матриц. В реакционную смесь были включены праймеры прямой 3’CHS Forward (SEQ ID NO:77) и обратный 3’CHS Reverse (SEQ ID NO:78), которые продуцировали продукт амплификации размером 350 п. о. Использовали реакционные смеси объемом 20 мкл с конечной концентрацией 0,5 мкМ для трансгенных праймеров и 0,2 мкМ для эндогенного эталонного гена.
Саузерн-анализ. Для каждого образца 5 мкг геномной ДНК тщательно расщепляли ферментом рестрикции AseI (New England Biolabs) путем инкубации при 37°C в течение ночи. Расщепленную ДНК концентрировали путем преципитации с раствором Quick Precip™ (Edge Biosystems, Gaithersburg, MD), в соответствии с предложенным изготовителем протоколом. Затем геномную ДНК ресуспендировали в 25 мкл воды при 65°C в течение 1 часа. Ресуспендированные образцы наносили на 0,8% агарозный гель, приготовленный в 1X буфере TAE, и подвергали электрофорезу в течение ночи при 1,1 В/см в 1X TAE. Гель погружали в буфер для денатурации (0,2 M NaOH/0,6 M NaCl) на 30 минут, а затем погружали в буфер для нейтрализации (0,5 M Tris-HCl (pH 7,5)/1,5 M NaCl) на 30 минут.
Перенос фрагментов ДНК на нейлоновые мембраны проводили путем пассивного затекания 20X буфера SSC в течение ночи через гель в обработанную мембрану для переноса Immobilon™-NY+ (Millipore, Billerica, MA) с использованием фитиля из хроматографической бумаги и бумажных полотенец. После переноса мембрану кратковременно промывали 2X SSC, поперечно сшивали с помощью Stratalinker® 1800 (Stratagene, LaJolla, CA), и термически обрабатывали в вакууме при 80°C в течение 3 часов.
Блоты инкубировали с раствором для предгибридизации (PerfectHyb™ plus, Sigma-Aldrich) в течение 1 часа при 65°C в стеклянных вращающихся бутылках с использованием инкубатора для гибридизации Robbins Scientific Model 400 (Robbins Scientific, Sunnyvale, CA). Знды получали из фрагмента ПЦР, содержавшего целую кодирующую последовательность. Ампликон ПЦР очищали с использованием набора для экстракции из геля Qiaex II® (Qiagen) и метили [α32P]dCTP с помощью набора для мечения Random RT Prime-iT® (Stratagene, La Jolla, CA). Блоты гибридизовали в течение ночи при 65°C с денатурированным зондом, добавляемым прямо в раствор для предгибридизации до приблизительно 2 миллионов импульсов-1 мл-1 на блот. После гибридизации блоты последовательно промывали при 65°C посредством 0,1X SSC/0,1% SDS в течение 40 минут. Наконец блоты экспонировали на экраны для визуализации с фосфором с длительным послесвечением и визуализировали с использованием системы для визуализации Molecular Dynamics™ Storm™ 860. Истинные встроенные трансгенные объекты с одной копией подтверждали путем идентификации одной гибридизующейся полосы.
Получение гомозиготных репортерных растений T2
Было получено всего 51 устойчивое к BASTA® растение, из которых было выявлено, что 24 обладают низкой комплексностью (1-2 копии pat) на основе анализа гидролиза зондов на количество копий. Из этих трансгенных объектов с низкой комплексностью 18 обладали интактными PTU, как определено с помощью анализа ПЦР. После анализа с использованием саузерн-блоттинга было выбрано два интактных трансгенных объекта PTU с одной копией, и их выращивали до созревания в теплице, где им позволяли самоопылиться. Затем семена T1 собирали, подвергали поверхностной стерилизации (в течение 3 мин в 20% отбеливателе, а затем два ополаскивания стерильной дистиллированной водой), и проращивали на среде MS (Phytotechnology Labs, Shawnee Mission, KS) с 30 г/л сахарозы в PhytaTrays™ (Sigma, St. Louis, MO). После скрининга зиготности посредством анализа количества копией pat проводили селекцию гомозиготных растений T1, выращивали их до созревания в теплице и позволяли им самоопыляться. Затем семена T2 собирали, подвергали поверхностной стерилизации и проращивали, как описано ранее, и использовали для получения репортерных растений для исследования трансактивации растений.
Экспрессирующие конструкции ZFP растений-активатор транскрипции растений
Конструировали конструкции ZFP растений-активатор транскрипции, содержавшие вариантный или нативный трансактивирующий мотив взаимодействия. Трансактивирующие мотивы взаимодействия растений (как нативные, так и модифицированные варианты), фланкированные участками ферментов рестрикции BamHI/SacI для клонирования, синтезировали de novo (DNA2.0, Menlo Park, CA). Трансактивирующие мотивы взаимодействия растений помещали на фрагмент BamHI/SacI и клонировали сразу ниже ДНК-связывающего домена Z6 с цинковыми пальцами (Yokoi et al. (2007), выше) с использованием уникальных участков BamHI/SacI, присутствующих в остове существующего исходного вектора Gateway®. После завершения этой стадии конструкции ZFP-активатор транскрипции (содержащие ДНК-связывающий домен белка Z6 с цинковыми пальцами, слитый с трансактивирующим мотивом взаимодействия растений) помещали под контроль конститутивного промотора вируса мозаики прожилок маниоки (промотор CsVMV v2; Verdaguer et al. (1996) Plant Mol. Biol. 31:1129-39), и терминировали ORF23 3’UTR из A. tumefaciens. Окончательные трансформирующие векторы (таблица 2) получали путем опосредуемого Gateway® лигирования (Invitrogen, Carlsbad, CA) с конечным вектором, содержащим кассету с промотором убиквитина 3 A. thaliana (промотор v2 At Ubi3; Callis et al. (1995) Genetics, 139(2):921-39))/геном гигромицинфосфотрансферазы II (HPTII v1; Gritz et al. (1983) Gene 25(2-3):179-88)/3’ нетранслируемой областью открытой рамки считывания-24 A. tumefaciens (Atu ORF24 3’UTR v2), использованную для селекции растений.
Конструкции ZFP-активатор транскрипции, исследованные в табаке. Идентификатор последовательности обеспечивает последовательность ДНК трансактивирующего мотива взаимодействия растений, который был слит со связывающим белком Z6 с цинковыми пальцами и экспрессировался в бинарном векторе.
SEQ ID NO:81
SEQ ID NO:88
SEQ ID NO:82
SEQ ID NO:89
SEQ ID NO:83
SEQ ID NO:90
SEQ ID NO:84
SEQ ID NO:91
SEQ ID NO:86
SEQ ID NO:93
SEQ ID NO:80
SEQ ID NO:87
SEQ ID NO:85
SEQ ID NO:92
SEQ ID NO:79
Конечный бинарный вектор подтверждали путем секвенирования ДНК и трансформировали в штамм A. tumefaciens, LBA4404 (Invitrogen). Кроме того, был включен контрольный вектор pDAB106238 (фиг. 21), который содержит связывающий домен с цинковыми пальцами и не включает активатора, состоящего из трансактивирующего мотива взаимодействия. В этой конструкции связывающий домен с цинковыми пальцами был помещен под контроль конститутивного промотора MAS A. tumefaciens (промотор v4 AtuMas; патенты США № 5001060; 5573932 и 5290924), и терминировался ORF23 3’UTR из A. tumefaciens. Кроме того, вектор содержит кассету с промотором убиквитина-3 A. thaliana/геном гигромицинфосфотрансферазы II/3’ нетранслируемой областью открытой рамки считывания-24 A. tumefaciens, используемую для селекции.
Для получения трансгенных объектов, содержащих конструкции ZFP растений-активатор транскрипции, диски листьев (1 см2), вырезанные из репортерных растений табака T2, инкубировали в ночной культуре штамма A. tumefaciens LBA4404 (Invitrogen, Carlsbad, CA), содержавшей одну из 16 плазмид, приведенных в таблице 2, выращенную до OD600 ~1,2 нм, промакивали насухо на стерильной фильтровальной бумаге, а затем помещали на среду MS (Phytotechnology Labs, Shawnee Mission, KS) и 30 г/л сахарозы с добавлением 1 мг/л индолуксусной кислоты и 1 мг/л бензиламинопурина в чашки размером 60×20 мм (5 дисков на чашку), закрытых Nescofilm® (Karlan Research Products Corporation, Cottonwood, AZ). После сокультивирования в течение 48 часов диски листьев переносили на ту же среду с 250 мг/л цефотаксима и 10 мг/л гигромицина. Через 3-4 недели ростки переносили в среду MS с 250 мг/л цефотаксима и 10 мг/л гигромицина в PhytaTrays™ на дополнительные 2-3 недели, а затем проводили сбор листьев и анализ экспрессии gus. Для каждой из 16 конструкций активаторов транскрипции получали всего 20-30 трансгенных объектов.
Анализ экспрессии gus
Выделение мРНК. Трансгенную ткань растений табака собирали из вновь выращенных ростков и быстро замораживали на сухом льду в 96-луночных планшетах для сбора (Qiagen). Затем РНК выделяли с использованием 96-луночного набора для экстракции RNEasy® (Qiagen) в соответствии с инструкциями изготовителя. Для разрушения тканей использовали измельчитель тканей Model 2-96A Kleco™ (Garcia Manufacturing).
Количественное определение РНК. Полученную мРНК количественно определяли с использованием спектрофотометра NanoDrop™ 8000 (Thermo Scientific, Wilmington, DE). Каждую лунку промывали 4 мкл не содержащей РНК-аз воды перед загрузкой и количественным определением 4 мкл неразбавленных образцов. Концентрацию мРНК оценивали из программного обеспечения NanoDrop™ 8000 с использованием стандартного способа измерения нуклеиновых кислот РНК. мРНК разбавляли вручную не содержащей РНКаз водой до ~83 нг/мкл.
Получение кДНК. кДНК получали из разбавленной мРНК с использованием набора Quantitect® RT kit (Qiagen, Carlsbad, CA), в соответствии с инструкциями изготовителя. В каждой реакционной смеси использовали 1 мкг тотальной мРНК. После завершения кДНК хранили при -20°C до завершения анализа.
ОТ-ПЦР. Трансгенные объекты, подвергнутые селекции на гигромицине, анализировали в отношении уровней транскрипта гена gus с использованием двух анализов гидролиза зонда для ДНК, оба из которых аналогичны анализам TaqMan®. Стационарные уровни мРНК gus для каждого индивидуального трансгенного объекта оценивали с использованием специфичных для последовательности праймеров и зонда. мРНК нормализовывали с использованием стационарного уровня мРНК для эндогенного эталонного гена табака BYEEF (номер доступа Genbank № GI:927382). Анализы для обоих генов разрабатывали с использованием программного обеспечения LightCycler® Probe Design Software 2.0 (Roche Applied Science). ПЦР в реальном времени для обоих генов оценивали с использованием системы LightCycler® 480. Для амплификации gus смесь LightCycler® 480 Probes Master mix приготавливали в конечной концентрации 1X в мультиплексной реакционной смеси объемом 10 мкл, содержащей 0,4 мкМ каждого праймера и 0,2 мкМ зонда. Таблица 3.
Двухстадийную реакцию амплификации проводили при удлинении при 56°C в течение 40 секунд с регистрацией данных флуоресценции. Все образцы анализировали неразбавленными в трех экземплярах, и для анализа каждого образца использовали усредненные величины Ct. Для амплификации BYEEF смесь LightCycler® 480 Probes Master mix приготавливали в 1X конечной концентрации в мультиплексной реакционной смеси объемом 10 мкл, содержащей 0,25 мкМ каждого праймера (таблица 3) и 0,1 мкМ зонда UPL 119 (Roche Applied Science). Двухстадийную реакцию амплификации проводили при удлинении при 58°C в течение 25 секунд с регистрацией данных флуоресценции. Все образцы анализировали в разбавлении 1:10 в трех экземплярах, и для анализа каждого образца использовали усредненные величины Ct. Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCycler® с использованием сравнительного квантового модуля, и он основан на способе ΔΔCt. Затем сравнивали относительные уровни экспрессии среди различных обработок активатором транскрипции растений. Фиг. 29.
Последовательности праймеров и зондов, используемых в обоих анализах гидролиза зондов (HP) gus и BYEEF.
Результаты
На фиг. 29 представлено полученное соотношение уровней транскрипта gus для различных трансактивирующих мотивов взаимодействия растений, нормализованных к уровням экспрессии эндогенного гена BYEEF. Активацию гена gus из различных трансактивирующих мотивов взаимодействия растений сравнивали с контролем в виде пустого вектора, и мотива взаимодействия субдомена II домена трансактивации VP16. Несколько трансактивирующих мотивов взаимодействия растений неожиданно продемонстрировали высокие уровни экспрессии по сравнению с субдоменом II трансактиватора VP16. Например, трансактивирующие мотивы взаимодействия PTI4, DREB1A, ERF2 и CBF1 растений экспрессировали больше мРНК gus, чем субдомен II домена активации транскрипции VP16.
Уровни мРНК, продуцированной трансактивирующим мотивом взаимодействия растений для модифицированного варианта (v2), по сравнению с нативной версией (v3) варьировали среди трансактивирующих мотивов взаимодействия растений. Модифицированная версия трансактивирующего мотива взаимодействия ERF2 растений продуцировала значительно больше мРНК gus, чем мотив взаимодействия ERF2 с нативной последовательностью. Аналогично, модифицированный трансактивирующий мотив взаимодействия CBF1 растений продуцировал больше мРНК, чем мотив взаимодействия CBF1 с нативной последовательностью. Напротив, модификации, внесенные в трансактивирующий мотив взаимодействия PTI4 и DREB1A, приводили к продукции более низких уровней мРНК gus, по сравнению с нативными версиями трансактивирующих мотивов взаимодействия PTI4 и DREB1A растений.
Пример 5: Функция мотива взаимодействия в табаке, содержащем репортерную конструкцию GAL4
Линия табака, содержащая репортерную конструкцию, состоящую из связывающего домена GAL4
Репортерную конструкцию pGalGUS конструируют с использованием стратегии, описанной ниже. Шесть тандемных повторов связывающей последовательности GAL4 дрожжей и спейсерные области размером 23 п. о. (как описано в Baleja et al. (1997) J. Biomol. NMR 10:397-401) синтезируют de novo (IDT) с добавлением участков SacII для облегчения клонирования. Участки связывания 6X Gal4 помещают на фрагмент SacII и используют для замены участков связывания Z6 из предсуществующего исходного вектора, который также расщеплялся SacII. Эта стадия клонирования помещает участки связывания GAL4 непосредственно выше промотора актина 2 Arabidopsis, который контролирует экспрессию гена gus. Окончательный трансформирующий вектор pGalGUS (фиг. 30) является результатом реакции трансформации Gateway® с конечным вектором, содержащим экспрессирующую кассету промотор убиквитина 10 Arabidopsis-ген pat, которую используют для селекции растений. Конечный трансформирующий вектор подтверждают секвенированием и трансформируют в штамм A. tumefaciens LBA4404 (Invitrogen).
Опосредуемая Agrobacterium трансформация табака посредством pGALGUS.
Трансгенные репортерные растения получают с использованием протокола, описанного выше. См. "Опосредуемая Agrobacterium трансформация табака посредством pDAB9897".
Анализ количества копий и PTU для репортерных трансгенных объектов.
Устойчивые к BASTA® трансгенные растения с количеством копий с низкой комплексностью получают и идентифицируют на основе анализа количества копий TaqMan®. Среди трансгенных объектов с низкой комплексностью, подгруппа обладает интактными PTU, при определении с помощью анализа с использованием ПЦР. Эти трансгенные объекты далее анализировали с помощью анализа с использованием вестерн-блоттинга. После анализа с использованием саузерн-блоттинга, по меньшей мере один трансгенный объект с интактной PTU с одной копией отбирают и выращивают до созревания в теплице и позволяют самоопыляться. Семена T1 собирают, подвергают поверхностной стерилизации и проращивают. После скрининга зиготности с помощью анализа числа копий pat гомозиготные растений T1 отбирают, выращивают до созревания в теплице и позволяют им самоопыляться. Затем семена T2 собирают, подвергают поверхностной стерилизации и проращивают (как описано ранее), и используют для получения репортерных растений для исследования активатора.
Экспрессирующие конструкции GAL4 растений-активатор транскрипции
Конструируют конструкции GAL4 растений-активатор транскрипции, содержащие вариантный или нативный трансактивирующий мотив взаимодействия растений. Конструкции ZFP растений-активатор транскрипции, описанные в примере 4 ("экспрессирующие конструкции ZFP растений-активатор транскрипции растений") модифицируют путем встраивания полинуклеотидной последовательности связывающего белка GAL4 вместо полинуклеотидной последовательности связывающего белка с цинковыми пальцами. Оптимизированную для двудольных растений полинуклеотидную последовательность ДНК-связывающего домена GAL4 (Keegan et al. (1986) Science 231(4739):699-704) встраивают вместо полинуклеотидной последовательности связывающего белка с цинковыми пальцами в качестве фрагмента NcoI/BamHI. После завершения этой стадии конструкцию GAL4-активатор транскрипции помещают под контроль конститутивного промотора вируса мозаики прожилок табака и терминируют 3’UTR ORF23 из A. tumefaciens. Окончательные бинарные трансформирующие векторы получают в результате трансформации Gateway® с конечным вектором, содержащим кассету убиквитин 3 Arabidopsis-HptII для селекции растений. Конечный трансформирующий вектор подтверждают путем секвенирования и трансформируют в штамм A. tumefaciens LBA4404 (Invitrogen).
Для получения трансгенных объектов растений, содержащих конструкцию GAL4 растений-активатор транскрипции, используют протокол временной трансформации, описанный в примере 4. Всего 20-30 трансгенных объектов получают для каждой из 16 конструкций GAL4-активатор транскрипции.
Анализ экспрессии gus
Трансгенные объекты, отобранные на гигромицине, анализируют в отношении уровней транскрипта гена gus с использованием двух анализов гидролиза зонда для ДНК. Стационарные уровни мРНК gus для каждого индивидуального трансгенного объекта оценивают с использованием специфичных для последовательности праймеров и зонда. мРНК для каждого трансгенного объекта нормализуют с использованием стационарного уровня мРНК для эндогенного эталонного гена табака, например, BYEEF. Анализы для обоих генов разрабатывают с использованием протокола, описанного в примере 4. Анализ данных ПЦР в реальном времени проводят с использованием программного обеспечения LightCycler® с использованием сравнительного квантового модуля, и он основан на способе ΔΔCt. Сравнивают относительные уровни экспрессии для различных конструкций активаторов. Результаты указывают на то, что трансактивирующие мотивы взаимодействия растений и сконструированные варианты этих трансактивирующих мотивов взаимодействия растений можно использовать в качестве активаторов транскрипции, и их можно подвергать слиянию со связывающим белком GAL4 для активации транскрипции гена.
Пример 6: Функция мотивов взаимодействия в табаке, содержащем репортерные конструкции TAL
Линия табака, содержащая репортерную конструкцию, содержащую связывающий домен TAL
Репортерную конструкцию pTalGUS конструируют с использованием стратегии, описанной ниже. Восемь последовательностей тандемных повторов (TATATAAACCTNNCCCTCT (SEQ ID NO:99)), взятых из консенсусной связывающей последовательности индуцируемых AVRBS3 генов и названных ДНК-связывающим доменом UPA (Kay et al. (2009) Plant J. 59(6):859-71), синтезируют de novo (IDT) с добавленными участками SacII для облегчения клонирования. 8X участков связывания UPA помещают во фрагмент SacII и используют для замены участков связывания Z6 из предсуществующего исходного вектора, который также расщепляется SacII. Эта стадия клонирования помещает участки связывания UPA непосредственно выше промотора актина 2 Arabidopsis, который контролирует экспрессию гена gus. Окончательный трансформирующий вектор pTalGUS (фиг.31), является результатом реакции трансформации Gateway® с конечным вектором, содержащим экспрессирующую кассету промотор убиквитина 10 A. thaliana/ген pat, которую используют для селекции растений. Конечный трансформирующий вектор подтверждают путем секвенирования и трансформируют в штамм A. tumefaciens LBA4404 (Invitrogen).
Опосредуемая Agrobacterium трансформация табака посредством pTALGUS
Трансгенные репортерные растения получают с использованием протокола, описанного выше. См. "Опосредуемая Agrobacterium трансформация табака pDAB9897".
Анализ количества копий и PTU для репортерных трансгенных объектов.
Устойчивые к BASTA® трансгенные растения с количеством копий с низкой комплексностью получают и идентифицируют на основе анализа количества копий TaqMan®. Среди трансгенных объектов с низкой комплексностью, подгруппа обладает интактными PTU, при определении с помощью анализа с использованием ПЦР. Эти трансгенные объекты далее анализировали с помощью анализа с использованием вестерн-блоттинга. После анализа с использованием саузерн-блоттинга, по меньшей мере 1 трансгенный объект с интактной PTU с одной копией отбирают и выращивают до созревания в теплице и позволяют самоопыляться. Семена T1 собирают, подвергают поверхностной стерилизации и проращивают. После скрининга зиготности с помощью анализа числа копий pat гомозиготные растений T1 отбирают, выращивают до созревания в теплице и позволяют им самоопыляться. Затем семена T2 собирают, подвергают поверхностной стерилизации и проращивают (как описано ранее), и используют для получения репортерных растений для исследования активатора.
Экспрессирующие конструкции TAL растений-активатор транскрипции.
Конструируют конструкции TAL растений-активатор транскрипции, содержащие вариантный или нативный трансактивирующий мотив взаимодействия растений. Экспрессирующие конструкции ZFP растений-активатор транскрипции, описанные в примере 4, модифицируют путем встраивания полинуклеотидной последовательности связывающего белка TAL вместо полинуклеотидной последовательности связывающего белка с цинковыми пальцами. 17,5 повторов TAL, которые необходимы для связывания ДНК, синтезируют de novo, и подвергают слиянию последовательностью ядерной локализации Opaque-2 Zea mays (Van Eenennaam et al. (2004) Metabolic Engineering 6:101-8). В последовательности каждого домена используются различные аминокислоты в различных остатках (положение 12 и 13) для обеспечения связывания ДНК, как предсказано для консенсусной последовательности UPA-бокса. Boch et al. (2009) Science 326(5959):1509-12. Оптимизированную для двудольных растений полинуклеотидную последовательность ДНК-связывающего домена TAL встраивают вместо полинуклеотидной последовательности связывающего белка с цинковыми пальцами в качестве фрагмента NcoI/BamHI. После завершения этой стадии конструкцию TAL-активатор транскрипции помещают под контроль конститутивного промотора вируса мозаики прожилок маниоки, и терминируют 3’UTR ORF23 из A. tumefaciens. Окончательные трансформирующие векторы получают путем трансформации Gateway® с конечным вектором, содержащим кассету убиквитин 3 Arabidopsis-HptII для селекции растений. Конечный трансформирующий вектор подтверждают путем секвенирования и трансформируют штамм A. tumefaciens LBA4404 (Invitrogen).
Для получения трансгенных объектов, содержащих конструкцию TAL растений-активатор транскрипции используют протокол временной трансформации, описанный в примере 4. Для каждой из 16 конструкций TAL-активатор транскрипции получают всего 20-30 трансгенных объектов растений.
Анализ экспрессии gus
Трансгенные объекты, подвергнутые селекции на гигромицине, анализируют в отношении уровней транскрипта гена gus с использованием двух анализов гидролиза зондов для ДНК. Стационарные уровни мРНК gus для каждого индивидуального трансгенного объекта оценивают с использованием последовательности специфических праймеров и зонда. мРНК нормализуют с использованием стационарного уровня мРНК для эндогенного эталонного гена табака, например, BYEEF. Анализы для обоих генов разрабатывают с использованием протокола, описанного в примере 4. Анализ данных ПЦР в реальном времени проводят с использованием программного обеспечения LightCycler® с использованием сравнительного квантового модуля и он основан на способе ΔΔCt. Сравнивают относительные уровни экспрессии для различных конструкций активаторов.
































































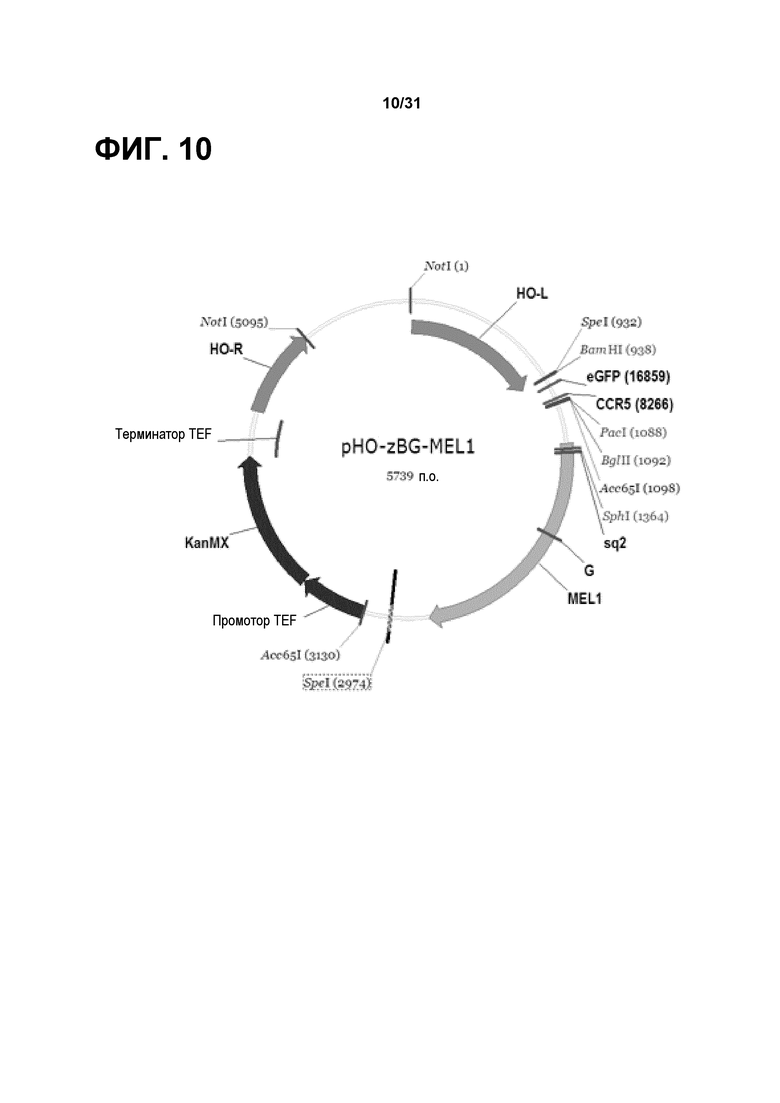
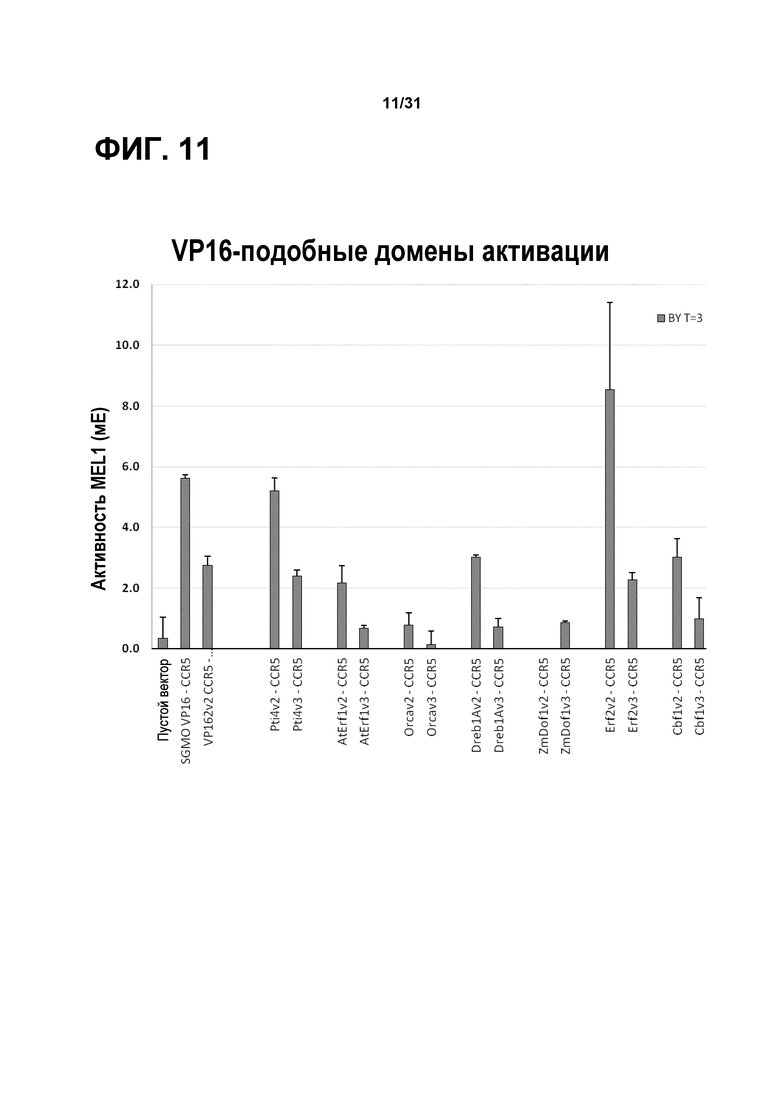
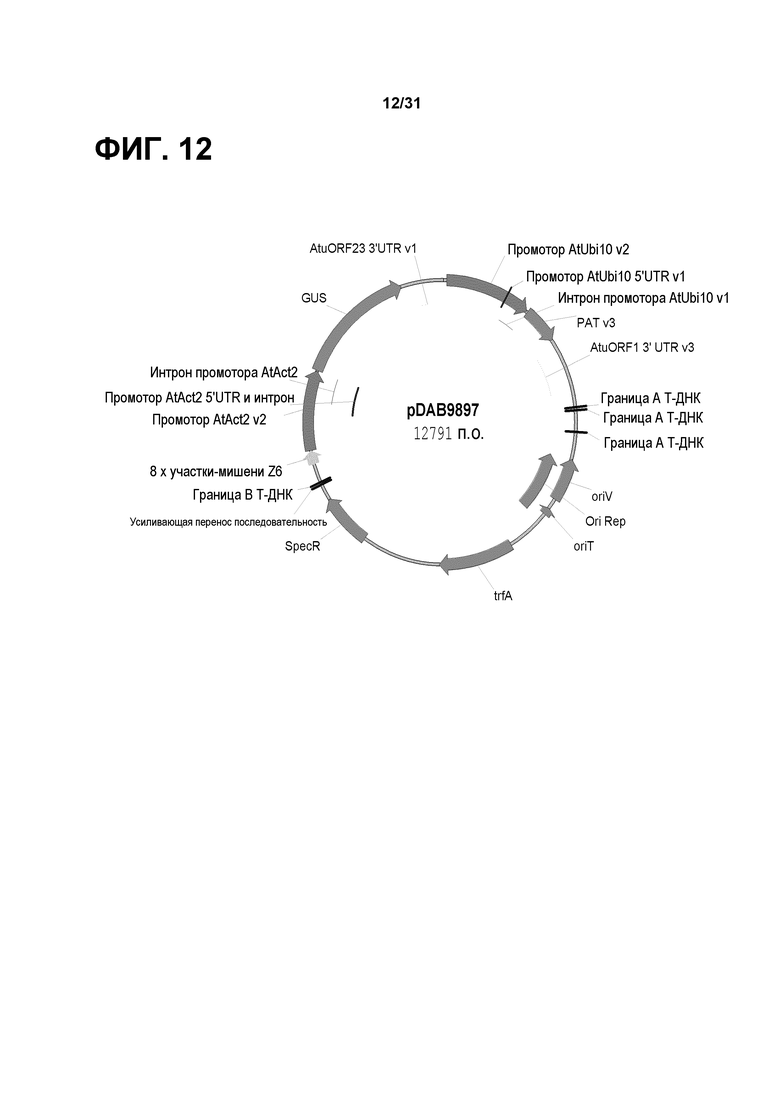
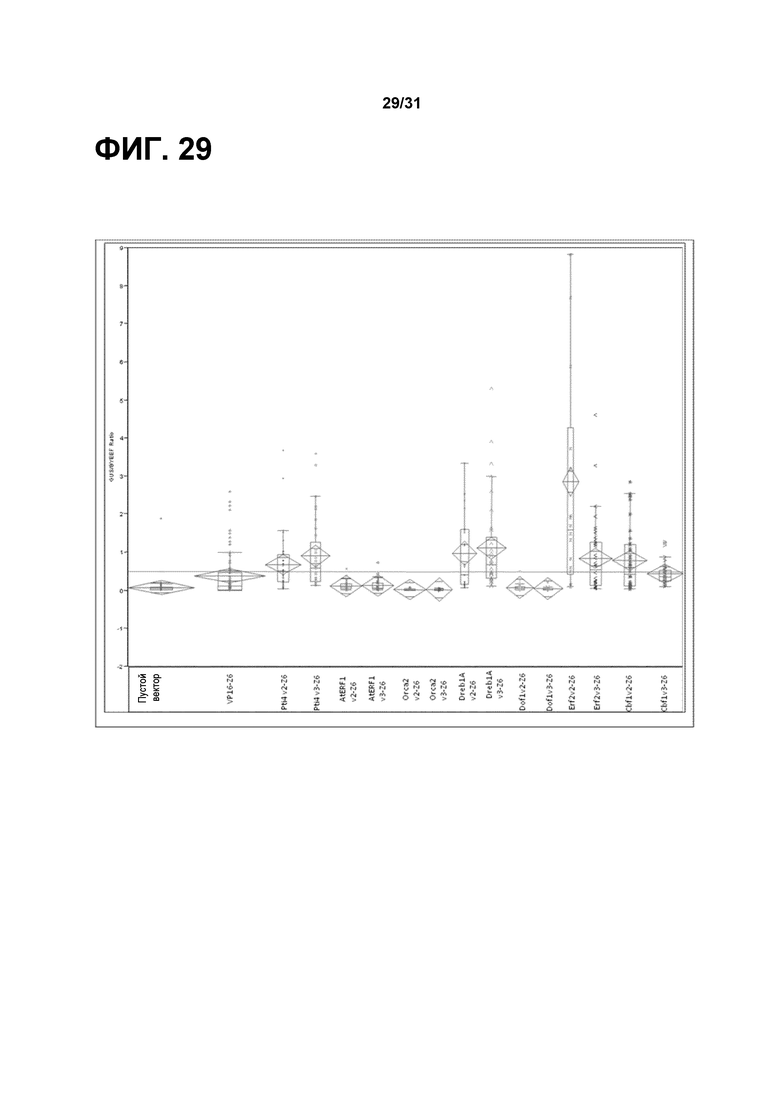
Изобретение относится к области биохимии, в частности к синтетическому слитому белку активатора транскрипции, который увеличивает экспрессию представляющей интерес полинуклеотидной последовательности, содержащему ДНК-связывающий полипептид и полипептид мотива взаимодействия домена трансактивации, а также к молекуле нуклеиновой кислоты, его кодирующему, и вектору, содержащему вышеуказанную молекулу нуклеиновой кислоты. Также раскрыт способ повышения экспрессии представляющего интерес полинуклеотида в клетке-хозяине, предусматривающий использование вышеуказанной молекулы нуклеиновой кислоты. Изобретение позволяет эффективно повышать экспрессию представляющего интерес полинуклеотида. 5 н. и 17 з.п. ф-лы, 31 ил., 3 табл., 6 пр.
1. Синтетический слитый белок активатора транскрипции, который увеличивает экспрессию представляющей интерес полинуклеотидной последовательности, когда представляющая интерес полинуклеотидная последовательность функционально связана со вторым полинуклеотидом, причем слитый белок содержит:
ДНК-связывающий полипептид, который специфически связывается со вторым полинуклеотидом, где ДНК-связывающий полипептид выбран из группы, состоящей из ДНК-связывающего домена с цинковыми пальцами; консенсусной связывающей последовательности из индуцируемого AVRBS3 гена или синтетической связывающей последовательности, сконструированной из них; GAL4; TAL; и
полипептид мотива взаимодействия домена трансактивации, выбранный из группы, состоящей из SEQ ID NO:22, SEQ ID NO:28, SEQ ID NO:46 и SEQ ID NO:52.
2. Синтетический слитый белок активатора транскрипции по п.1, где слитый белок активатора транскрипции содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2-8 и SEQ ID NO:100-120.
3. Молекула нуклеиновой кислоты, кодирующая синтетический слитый белок активатора транскрипции по п.1, причем нуклеиновая кислота содержит:
первую нуклеотидную последовательность, кодирующую ДНК-связывающий полипептид; и
вторую нуклеотидную последовательность, кодирующую полипептид мотива взаимодействия домена трансактивации,
где первая и вторая нуклеотидные последовательности экспрессируются с нуклеиновой кислотой в рамке считывания и в едином транскрипте.
4. Молекула нуклеиновой кислоты по п.3, где нуклеиновая кислота, кодирующая синтетический слитый белок активатора транскрипции, функционально связана с регуляторным элементом гена.
5. Молекула нуклеиновой кислоты по п.3, где первая и вторая нуклеотидные последовательности разделены третьей нуклеотидной последовательностью в нуклеиновой кислоте, кодирующей синтетический слитый белок активатора транскрипции.
6. Молекула нуклеиновой кислоты по п.3, где молекула нуклеиновой кислоты встроена в геном клетки-хозяина.
7. Синтетический слитый белок активатора транскрипции по п.1, где второй полинуклеотид выбран из группы, состоящей из SEQ ID NO:67, SEQ ID NO:68 и SEQ ID NO:99.
8. Экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты по п.6.
9. Экспрессирующий вектор по п.8, отличающийся тем, что вектор содержит селективный маркер или поддающийся скринингу маркер.
10. Экспрессирующий вектор по п.8, где вектор представляет собой экспрессирующий вектор растений.
11. Молекула нуклеиновой кислоты по п.3, где нуклеиновая кислота содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:80-93.
12. Способ повышения экспрессии представляющего интерес полинуклеотида в клетке-хозяине, представляющей собой клетку растения, причем способ включает:
введение молекулы нуклеиновой кислоты по п.3 в клетку-хозяина, представляющую собой клетку растения, содержащую представляющий интерес полинуклеотид, где представляющий интерес полинуклеотид функционально связан со вторым полинуклеотидом, который специфично связывается с ДНК-связывающим полипептидом,
тем самым повышая экспрессию представляющего интерес полинуклеотида в клетке-хозяине, представляющей собой клетку растения.
13. Способ по п.12, где введение молекулы нуклеиновой кислоты в клетку-хозяина, представляющую собой клетку растения, включает введение вектора, содержащего нуклеиновую кислоту, в клетку-хозяина, представляющую собой клетку растения.
14. Способ по п.12, где молекула нуклеиновой кислоты стабильно встраивается в геном клетки-хозяина, представляющей собой клетку растения.
15. Способ по п.12, где представляющий интерес полинуклеотид представляет собой экзогенный полинуклеотид.
16. Способ по п.12, где представляющий интерес полинуклеотид представляет собой эндогенный полинуклеотид.
17. Способ по п.12, где введение молекулы нуклеиновой кислоты в клетку-хозяина, представляющую собой клетку растения, включает скрещивание растения, содержащего молекулу нуклеиновой кислоты, со вторым растением, которое не содержит молекулу нуклеиновой кислоты, где клетка-хозяин, которая представляет собой клетку растения, является клеткой из потомка скрещенного растения.
18. Способ повышения экспрессии представляющего интерес полинуклеотида в клетке-хозяине, представляющей собой клетку растения, причем способ включает:
введение в клетку-хозяина, представляющую собой клетку растения, содержащую нуклеиновую кислоту по п.3, представляющего интерес полинуклеотида, где представляющий интерес полинуклеотид функционально связан со вторым полинуклеотидом, который специфически связывается с ДНК-связывающим полипептидом,
тем самым увеличивая экспрессию представляющего интерес полинуклеотида в клетке-хозяине.
19. Способ по п.18, где введение представляющего интерес полинуклеотида в клетку-хозяина, представляющую собой клетку растения, включает введение вектора, содержащего представляющий интерес полинуклеотид, в клетку-хозяина, представляющую собой клетку растения.
20. Способ по п.18, где молекула нуклеиновой кислоты стабильно встраивается в геном клетки-хозяина, представляющей собой клетку растения.
21. Способ по п.18, где представляющий интерес полинуклеотид, функционально связанный со вторым полинуклеотидом, стабильно встроен в геном клетки-хозяина, представляющей собой клетку растения.
22. Способ по п.18, где введение представляющего интерес полинуклеотида в клетку-хозяина, представляющую собой клетку растения, включает скрещивание растения, содержащего представляющий интерес полинуклеотид, со вторым растением, которое не содержит представляющий интерес полинуклеотид, где клетка-хозяин, которая представляет собой клетку растения, является клеткой из потомка скрещенного растения.
| Дорожная конструкция | 1979 |
|
SU823480A1 |
| OKANAMI M | |||
| et al., HALF-1, a bZIP-type protein, interacting with the wheat transcription factor HBP-1a contains a novel transcriptional activation domain | |||
| Genes to Cells, 1996 | |||
| US 7393946 B1, 01.07.2008 | |||
| US 6706866 B1, 16.03.2004 | |||
| Галкин А | |||
| П | |||
| и др., Регуляторные области промоторов генов растений и белки—регуляторы промоторной активности, Биополимеры и клетка, 2004, Т | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Способ получения бензонафтола | 1920 |
|
SU363A1 |
Авторы
Даты
2018-07-26—Публикация
2013-02-01—Подача