Приоритет настоящей заявки испрашивается на основании предварительных патентных заявок US 61/650098, 61/650093, 61/650077, 61/650084, поданных 22 мая 2012 г., и предварительной патентной заявки US 61/726225, поданной 14 ноября 2012 г., которые во всей полноте в порядке ссылки включены в настоящую заявку.
Область техники
В изобретении предложены способы и среды ферментации синтез-газа. Более точно, предложены способы и среды, обеспечивающие высокий уровень производительности по этанолу даже после исключения или снижения содержания компонентов, ранее считавшихся существенными или необходимыми в определенных концентрациях.
Уровень техники
Ферментация происходит в определенных жидких средах. Эти среды обычно содержат различные источники питательных макро- и микроэлементов, важных для повышения эффективности ферментации. Для оптимизации характеристик сред, используемых в сочетании с менее распространенными носителями, такими как газообразные носители, требуется их строгое определение. Для анаэробной ферментации также требуются строго определенные среды.
Анаэробные микроорганизмы способны синтезировать этанол из окиси углерода (CO) путем ферментации газообразных носителей. В результате ферментации с участием анаэробных микроорганизмов рода Clostridium образуется этанол и другие полезные продукты. Например, в патенте US 5173429 описан анаэробный микроорганизм Clostridium ljungdahlii (АТСС №49587), который синтезирует этанол и ацетат из синтез-газа. В патенте US 5807722 описаны способ и устройство для конверсии отходящих газов в органические кислоты и спирты с использованием Clostridium ljungdahlii (АТСС №55380). В патенте US 6136577 описаны способ и устройство для конверсии отходящих газов в этанол с использованием Clostridium ljungdahlii (АТСС №55988 и №55989).
В патенте US 7285402 описаны среды, применимые для анаэробной ферментации газообразных носителей с целью получения этанола. Различные компоненты и их концентрации в среде обеспечивают высокие уровни производительности по этанолу. За счет исключения определенных компонентов и снижения требуемых концентраций других компонентов с сохранением производительности по этанолу может достигаться значительное снижение себестоимости, в особенности, при ферментации в промышленном масштабе.
Сущность изобретения
Предложены способ ферментации синтез-газа и ферментационная среда с высокой производительностью по этанолу при исключении компонентов среды, ранее считавшихся существенными. Исключение некоторых компонентов среды и снижение содержания других компонентов среды обеспечивает значительное сокращение эксплуатационных затрат в промышленном масштабе.
Согласно одной из особенностей способ ферментации включает ферментацию синтез-газа в ферментационной среде. Способ обеспечивает удельный STY по меньшей мере около 1 грамма этанола/(л⋅сутки⋅грамм клеток). Согласно этой особенности ферментационная среда содержит менее около 1,04 части на миллион бора, менее около 0,16 части на миллион марганца, менее около 0,26 части на миллион молибдена или менее около 0,16 части на миллион меди.
Согласно другой особенности ферментационная среда содержит по меньшей мере около 112 мг азота на грамм образовавшихся клеток, по меньшей мере около 10,5 мг фосфора на грамм образовавшихся клеток или по меньшей мере около 26 мг калия на грамм образовавшихся клеток. Согласно другой особенности ферментационная среда содержит менее около 1,04 части на миллион бора, менее около 0,16 части на миллион марганца, менее около 0,26 части на миллион молибдена или менее около 0,16 части на миллион меди.
Согласно другой особенности способ ферментации включает ферментацию синтез-газа в ферментационной среде. Способ обеспечивает удельный STY по меньшей мере около 1 грамма этанола/(л⋅сутки⋅грамм клеток). Ферментационная среда содержит NH4+ и В в весовом соотношении около 625:1 или более или NH4+ и Mn в весовом соотношении около 4050:1 или более, или NH4+ и Мо в весовом соотношении около 2500:1 или более, или NH4+ и Cu в весовом соотношении около 4050:1 или более; ферментационная среда содержит Р и В в весовом соотношении около 30:1 или более или Р и Mn в весовом соотношении около 190:1 или более, или P и Mo в весовом соотношении около 120:1 или более, или Mn и Cu в весовом соотношении около 190:1 или более; или ферментационная среда содержит K и B в весовом соотношении около 35:1 или более или K и Mn в весовом соотношении около 245:1 или более, или K и Mo в весовом соотношении около 150:1 или более, или K и Cu в весовом соотношении около 245:1 или более.
Подробное описание изобретения
Следующее далее описание не следует считать ограничивающим, и оно имеет целью лишь изложение общих принципов примеров осуществления. Объем изобретения следует определять на основании формулы изобретения.
В изобретении предложены способ и состав среды, неожиданно обеспечивающие высокий уровень производительности по этанолу даже после исключения или снижения содержания одного или нескольких компонентов, ранее считавшихся существенными или необходимыми в определенных концентрациях. Согласно этой особенности в среде могут быть снижены уровни содержания одного или нескольких питательных элементов, включающих B, Mn, Mo и Cu. Среда может иметь следующие содержания питательных элементов:
B: менее около 1,04 части на миллион, согласно другой особенности менее около 1,0 части на миллион, согласно другой особенности менее около 0,75 части на миллион, согласно другой особенности менее около 0,5 части на миллион и согласно другой особенности менее около 0,025 части на миллион;
Mn: менее около 0,16 части на миллион, согласно другой особенности менее около 0,15 части на миллион, согласно другой особенности менее около 0,10 части на миллион, согласно другой особенности менее около 0,05 части на миллион и согласно другой особенности менее около 0,0025 части на миллион;
Mo: менее около 0,26 части на миллион, согласно другой особенности менее около 0,25 части на миллион, согласно другой особенности менее около 0,20 части на миллион, согласно другой особенности менее около 0,10 части на миллион Mo и согласно другой особенности менее около 0,001 части на миллион; или
Cu: менее около 0,16 части на миллион, согласно другой особенности менее около 0,15 части на миллион, согласно другой особенности менее около 0,10 части на миллион, согласно другой особенности менее около 0,05 части на миллион и согласно другой особенности менее около 0,01 части на миллион.
Согласно другой особенности возможны следующие весовые соотношения:
NH4+ и B: около 625:1 или более, согласно другой особенности около 650:1 или более, согласно другой особенности около 675:1 или более, согласно другой особенности около 700:1 или более, согласно другой особенности около 750:1 или более и согласно другой особенности около 800:1 или более; или
NH4+ и Mn: около 4050:1 или более, согласно другой особенности около 4100:1 или более, согласно другой особенности около 4200:1 или более, согласно другой особенности около 4300:1 или более, согласно другой особенности около 4400:1 или более и согласно другой особенности около 4500:1 или более; или
NH4+ и Mo: около 2500:1 или более, согласно другой особенности около 2600:1 или более, согласно другой особенности около 2700:1 или более, согласно другой особенности около 2800:1 или более, согласно другой особенности около 2900:1 или более и согласно другой особенности около 3000:1 или более; или
NH4+ и Cu: около 4050:1 или более, согласно другой особенности около 4100:1 или более, согласно другой особенности около 4200:1 или более, согласно другой особенности около 4300:1 или более, согласно другой особенности около 4400:1 или более и согласно другой особенности около 4500:1 или более; или
P и B: около 30:1 или более, согласно другой особенности около 35:1 или более, согласно другой особенности около 40:1 или более, согласно другой особенности около 45:1 или более, согласно другой особенности около 50:1 или более и согласно другой особенности около 100:1 или более; или
P и Mn: около 190:1 или более, согласно другой особенности около 200:1 или более, согласно другой особенности около 225:1 или более, согласно другой особенности около 250:1 или более, согласно другой особенности около 275:1 или более и согласно другой особенности около 300:1 или более; или
P и Mo: около 120:1 или более, согласно другой особенности около 130:1 или более, согласно другой особенности около 140:1 или более, согласно другой особенности около 150:1 или более, согласно другой особенности около 175:1 или более и согласно другой особенности около 200:1 или более; или
P и Cu: около 190:1 или более, согласно другой особенности около 200:1 или более, согласно другой особенности около 225:1 или более, согласно другой особенности около 250:1 или более, согласно другой особенности около 275:1 или более и согласно другой особенности около 300:1 или более; или
K и B: около 35:1 или более, согласно другой особенности около 40:1 или более, согласно другой особенности около 45:1 или более, согласно другой особенности около 50:1 или более, согласно другой особенности около 75:1 или более и согласно другой особенности около 100:1 или более; или
K и Mn: около 245:1 или более, согласно другой особенности около 250:1 или более, согласно другой особенности около 260:1 или более, согласно другой особенности около 270:1 или более, согласно другой особенности около 280:1 или более и согласно другой особенности около 300:1 или более; или
K и Mo: около 150:1 или более, согласно другой особенности около 250:1 или более, согласно другой особенности около 260:1 или более, согласно другой особенности около 270:1 или более, согласно другой особенности около 280:1 или более и согласно другой особенности около 300:1 или более; или
K и Cu: около 245:1 или более, согласно другой особенности около 250:1 или более, согласно другой особенности около 260:1 или более, согласно другой особенности около 270:1 или более, согласно другой особенности около 280:1 или более и согласно другой особенности около 300:1 или более.
Определения
Если не указано иное, следующие термины, используемые в описании настоящего изобретения, имеют следующее значение согласно приведенным далее определениям в единственном или множественном числе.
Термин "около", предшествующий любому численному значению, означает отклонение от указанного значения в реальных условиях, например, в лаборатории, на экспериментальной установке или эксплуатационном объекте. Например, численное значение с предшествующим ему термином "около" применительно к ингредиенту смеси или измерению количества, включает отклонение и степень точности, обычно применяемую при измерениях в экспериментальных условиях на промышленной установке или в лаборатории. Например, численное значение с предшествующим ему термином "около" применительно к компоненту продукта включает отклонение в зависимости от партий во множестве экспериментов на установке или в лаборатории и отклонение, присущее методу анализа. Независимо от использования термина "около" численные значения включают эквиваленты этих значений. Любое приведенное в описании численное значение с предшествующим ему термином "около" также может применяться в настоящем изобретении без термина "около".
Термином "синтез-газа" или "синтетический газ" называют газовую смесь, содержащую варьирующие количества окиси углерода и водорода. Примеры получения синтез-газа включают паровой реформинг природного газа или углеводородов с целью получения водорода, газификацию каменного угля и получение энергии путем газификации отходов на установках некоторых типов. Происхождение термина объясняется тем, что синтез-газ используется в качестве промежуточного продукта при получении заменителя природного газа (SNG) и производстве аммиака или метанола. Синтез-газа является горючим и часто используется в качестве источника топлива или промежуточного продукта при производстве других химикатов.
Термины "ферментация", "процесс ферментации" или "реакция ферментации" и т.п. относятся как к фазе роста, так и фазе биосинтеза продуктов. Согласно одной из особенностей ферментация означает конверсию CO в спирт.
Термин "плотность клеток" означает массу клеток микроорганизмов на единицу объема ферментационной среды, например, грамм/литр. Согласно этой особенности способ и среды обеспечивают плотность клеток по меньшей мере на около 1,0 г/л. Плотность клеток может составлять от около 1 до около 25 г/л, согласно другой особенности от около 1 до около 20 г/л, согласно другой особенности от около 1 до около 10 г/л, согласно другой особенности от около 2 до около 8 г/л, согласно другой особенности от около 3 до около 6 г/л и согласно другой особенности от около 4 до около 5 г/л.
Термин "рециркуляция клеток" означает отделение клеток микроорганизмов от ферментационной среды и возврат всех или части этих отделенных клеток микроорганизмов в ферментер. Обычно для отделения и используется фильтрационное устройство.
Состав среды
Описанные в изобретении способы и среды обеспечивают высокий уровень производительности. Согласно этой особенности способ обеспечивает удельный STY (удельный выход продукта за один проход в единицу) по меньшей мере около 1 грамма этанола/(л⋅сутки⋅грамм клеток)), согласно другой особенности от около 1 до около 10, согласно другой особенности от около 2 до около 8, согласно другой особенности от около 3 до около 7 и согласно другой особенности от около 4 до около 6.
Согласно одной из сопутствующих особенностей производительность может выражаться как STY (выход продукта за один проход в единицу) в граммах этанола/(л⋅сутки)). Согласно этой особенности способ обеспечивает STY по меньшей мере около 10 г этанола/(л⋅сутки). Возможные величины STY включают от около 10 г этанола/(л⋅сутки) до около 200 г этанола/(л⋅сутки), согласно другой особенности от около 10 г этанола/(л⋅сутки) до около 160 г этанола/(л⋅сутки), согласно другой особенности от около 10 г этанола/(л⋅сутки) до около 120 г этанола/(л⋅сутки), согласно другой особенности от около 10 г этанола/(л⋅сутки) до около 80 г этанола/(л⋅сутки), согласно другой особенности от около 20 г этанола/(л⋅сутки) до около 140 г этанола/(л⋅сутки), согласно другой особенности от около 20 г этанола/(л⋅сутки) до около 100 г этанола/(л⋅сутки), согласно другой особенности от около 40 г этанола/(л⋅сутки) до около 140 г этанола/(л⋅сутки) и согласно другой особенности от около 40 г этанола/(л⋅сутки) до около 100 г этанола/(л⋅сутки).
Согласно другой особенности способы и среды обеспечивают конверсию по меньшей мере от около 5% до около 99% CO, согласно другой особенности от около 10% до около 90%, согласно другой особенности от около 20% до около 80%, согласно другой особенности от около 30% до около 70% и согласно другой особенности от около 40% до около 90% CO.
Согласно одной из особенностей среда содержит по меньшей мере один или несколько источников азота, по меньшей мере один или несколько источников фосфора и по меньшей мере один или несколько источников калия. Среда может содержать любой из трех источников, любое их сочетание и согласно одной из важных особенностей содержит все три источника. Источник азота может включать источник азота, выбранный из группы, включающей хлорид аммония, фосфат аммония, сульфат аммония, нитрат аммония и их смеси. Источник фосфора может включать источник фосфора, выбранный из группы, включающей фосфорную кислоту, фосфат аммония, фосфат калия и их смеси. Источник калия может включать источник калия, выбранный из группы, включающей хлорид калия, фосфат калия, нитрат калия, сульфат калия и их смеси.
Согласно одной из особенностей среда содержит одно или несколько из следующего: железо, вольфрам, никель, кобальт, магний, серу и тиамин. Среда может содержать любой один из этих компонентов, любое их сочетание и согласно одной из важных особенностей содержит все эти компоненты. Источник железа может включать источник железа, выбранный из группы, включающей хлорид железа, сульфат железа и их смеси. Источник вольфрама может включать источник вольфрама, выбранный из группы, включающей вольфрамат натрия, вольфрамат кальция, вольфрамат калия и их смеси. Источник никеля может включать источник никеля, выбранный из группы, включающей хлорид никеля, сульфат никеля, нитрат никеля и их смеси. Источник кобальта может включать источник кобальта, выбранный из группы, включающей хлорид кобальта, фторид кобальта, бромид кобальта, йодид кобальта и их смеси. Источник магния может включать источник магния, выбранный из группы, включающей хлорид магния, сульфат магния, фосфат магния и их смеси. Источник серы может включать цистеин, сульфид натрия и их смеси. Далее приведены концентрации различных компонентов.
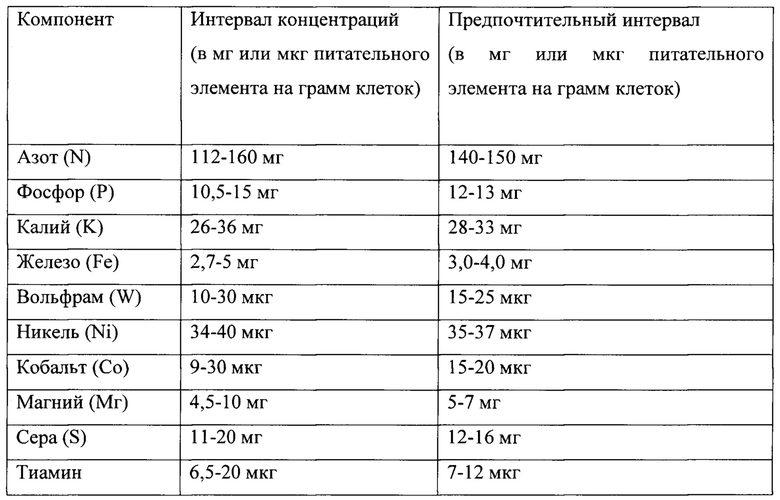
При осуществлении способа поддерживается рН на уровне от около 4,2 до около 4,8. Среда содержит менее около 0,01 г/л дрожжевого экстракта и менее около 0,01 г/л углеводов. Синтез-газ
Может использоваться синтез-газа из любого известного источника. Согласно одной из особенностей источником синтез-газа может являться газификация углеродистых материалов. Газификация предусматривает частичное сжигание биомассы в условиях ограниченной подачи кислорода. Образующийся газ по большей части содержит СО и Н2. Согласно этой особенности синтез-газа содержит по меньшей мере около 10 мол. % CO, согласно одной из особенностей по меньшей мере около 20 мол. %, согласно одной из особенностей от около 10 до около 100 мол. %, согласно другой особенности от около 20 до около 100 мол. % CO, согласно другой особенности от около 30 до около 90 мол. % CO, согласно другой особенности от около 40 до около 80 мол. % CO и согласно другой особенности от около 50 до около 70 мол. % CO. Синтез-газ имеет молярное соотношение CO/CO2 по меньшей мере около 0,75, согласно другой особенности по меньшей мере около 1,0 и согласно другой особенности по меньшей мере около 1,5. Некоторые примеры применимых способов и устройств для газификации описаны в заявках US 13/427144, 13/427193 и 13/427247, поданных 22 марта 2012 г. и в порядке ссылки включенных в настоящую заявку.
Согласно другой особенности синтез-газом, используемым для размножения ацетогенных бактерий, может являться преимущественно CO. Используемый оборот "преимущественно CO" означает, что газ содержит по меньшей мере около 50 мол. % CO, согласно другой особенности по меньшей мере около 60 мол. % CO, согласно другой особенности по меньшей мере около 70 мол. % CO, согласно другой особенности по меньшей мере около 80 мол. % СО и согласно другой особенности по меньшей мере около 90 мол. % СО.
Биореактор
Согласно одной из особенностей ферментация начинается с добавления среды в реакционный сосуд. Стерилизуют среду, чтобы удалить нежелательные микроорганизмы, и засевают реактор желаемыми микроорганизмами. Согласно одной из особенностей используемые микроорганизмы включают ацетогенные бактерии. Примеры применимых ацетогенных бактерий включают бактерии рода Clostridium, такие как штаммы Clostridium ljungdahlii, включая штаммы, описанные в WO 2000/68407, ЕР 117309, патентах US 5173429, 5593886 и 6368819, WO 1998/00558 и WO 2002/08438, штаммы Clostridium autoethanogenum (DSM 10061 и DSM 19630, депонированные в DSMZ, Германия), включая штаммы, описанные в WO 2007/117157 и WO 2009/151342, Clostridium ragsdalei (P11, АТСС ВАА-622) и Alkalibaculum bacchi (СР11, АТСС ВАА-1772), включая штаммы, описанные, соответственно, в патенте US 7704723 и докладе "Biofuels and Bioproducts from Biomass-Generated Synthesis Gas", Hasan Atiyeh от 29 апреля 2010 г. на Ежегодной Конференции по экспериментальной программе содействия исследовательским проектам в штате Оклахома (Oklahoma EPSCoR Annual State Conference), и Clostridium carboxidivorans (АТСС PTA-7827), описанные в патентной заявке US 2007/0276447. Другие применимые микроорганизмы включают микроорганизмы рода Moorella, в том числе Moorella sp. HUC22-1, и микроорганизмы рода Carboxydothermus. Каждый из указанных документов в порядке ссылки включен в настоящую заявку. Могут использоваться смешанные культуры из двух или более микроорганизмов.
Некоторые примеры применимых бактерий включают Acetogenium kivui, Acetoanaerobium noterae, Acetobacterium woodii, Alkalibaculum bacchi СР11 (ATCC BAA-1772), Blautia producta, Butyribacterium methylotrophicum, Caldanaerobacter subterraneous, Caldanaerobacter subterraneous pacificus, Carboxydothermus hydrogenoformans, Clostridium aceticum, Clostridium acetobutylicum, Clostridium acetobutylicum P262 (DSM 19630, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 19630, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 10061, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 23693, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 24138, депонирована в DSMZ, Германия), Clostridium carboxidivorans P7 (АТСС PTA-7827), Clostridium coskatii (АТСС PTA-10522), Clostridium drakei, Clostridium ljungdahlii PETC (ATCC 49587), Clostridium ljungdahlii ERI2 (ATCC 55380), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii O-52 (ATCC 55889), Clostridium magnum, Clostridium pasteurianum (DSM 525, депонирована в DSMZ, Германия), Clostridium ragsdali P11 (ATCC BAA-622), Clostridium scatologenes, Clostridium thermoaceticum, Clostridium ultunense, Desulfotomaculum kuznetsovii, Eubacterium limosum, Geobacter cepareducens, Methanosarcina acetivorans, Methanosarcina barkeri, Morrella thermoacetica, Morrella thermoautotrophica, Oxobacter pfennigii, Peptostreptococcus productus, Ruminococcus productus, Thermoanaerobacter kivui и их смеси.
После засева устанавливают начальный расход подаваемого газа для обеспечения начальной популяции микроорганизмов. Анализируют выходящий газ с целью определения его содержания. Используют результаты анализа для регулирования расхода подаваемого газа. После достижения желаемых уровней удаляют из реактора жидкую фазу и клеточный материал, и пополняют среду. Согласно этой особенности поддерживают в биореакторе плотность клеток по меньшей мере около 2 грамм/литр и согласно другой особенности от около 2 до около 50 грамм/литр, согласно различным другим особенностям от около 5 до около 40 грамм/литр, от около 5 до около 30 грамм/литр, от около 5 до около 20 грамм/литр, от около 5 до около 15 грамм/литр, от около 10 до около 40 грамм/литр, от около 10 до около 30 грамм/литр, от около 10 до около 20 грамм/литр и от около 10 до около 15 грамм/литр. Плотность клеток может регулироваться посредством фильтра рециркуляции. Некоторые примеры биореакторов описаны в предварительных заявках US 61/571654 и 61/571565, поданных 30 июня 2011 г., и предварительной заявке US 61/573845, поданной 13 сентября 2011 г., все из которых в порядке ссылки включены в настоящую заявку.
Примеры
Пример 1
Ферментация с ограничением концентрации бора, меди и марганца
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без очистки пермеата. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 38-39°С,
скорость перемешивания: около 850 об/мин на аналоговом индикаторе,
объем невыросшей культуры: около 1600-1650 мл.
Установили значение pH культуры 4,5. Использовали 7,7% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% H2, 45% N2, 30% CO и 10% CO2, которую подавали в культуру со скоростью 282 мл/мин.
Скорость подачи среды в реактор составляла ~0,88 мл/мин или ~1300 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 29-31 час.
В качестве исходной среды использовали описанную далее среду.
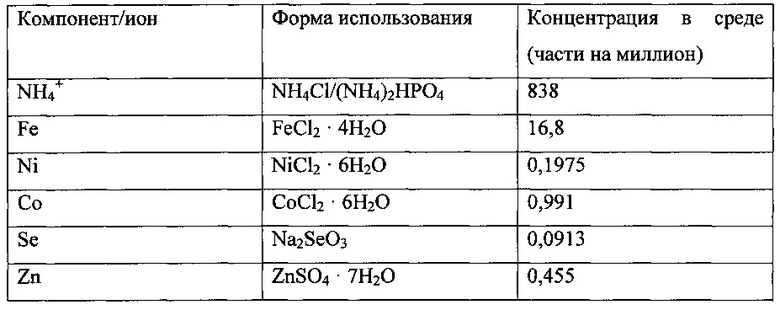
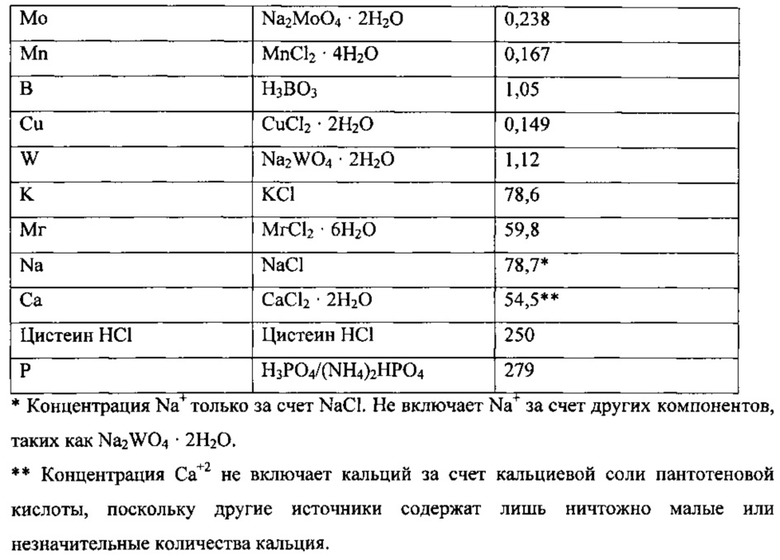
Культура находилась в биореакторе до достижения высокопродуктивного стабильного состояния. Высокопродуктивное стабильное состояние было определено как плотность клеток ~2,5-3 г/л, концентрация этанола >20 г/л, поглощение CO >3,0 ммоль/мин и поглощение водорода >0,5 ммоль/мин. В процессе достижения высокопродуктивного стабильного состояния концентрация CaCl2⋅2H2O была доведена до нуля, концентрация аммония была снижена до 546 частей на миллион.
После достижения культурой высокопродуктивного стабильного состояния из препарата среды были исключены источники B, Mn и Cu. Непосредственно перед исключением этих компонентов культура имела следующие параметры/продуктивность:
плотность клеток - 2,9 г/л
конверсия CO - 86%
конверсия H2 - 32%
поглощение CO - 3,0 ммоль/мин
поглощение H2 - 0,54 ммоль/мин
концентрация этанола - 21,8 г/л
полная концентрация ацетила - 2,7 г/л
концентрация бутанола - 0,35 г/л.
Затем осуществили мониторинг параметров культуры с целью обнаружения неблагоприятного влияния на поглощение газа, H2 и CO, концентрацию продуктов и плотность клеток. Если исключение B, Cu и Mn не повлияло на эти параметры по истечении многократного (>3) времени удержания клеток, считалось, что они не являются необходимыми для культуры.
По истечении ~5,7-кратного времени удержания клеток (170 часов) концентрация бора, меди и марганца в культуральной жидкости упала до ~0,41% начальных концентраций (до 0,0043 части на миллион B, 0,0006 части на миллион Cu и 0,0068 части на миллион Mn от 1,05 части на миллион B, 0,149 части на миллион Cu и 1,67 части на миллион Mn). Определили расчетные остаточные концентрации компонентов в жидкости путем расчета вымывания с учетом исходной концентрации кальция, MFR, LRT и любых добавлений этих компонентов в биореактор в составе среды или путем инъекций. Неблагоприятное влияние на продуктивность среды отсутствовало.
Через 170 часов без добавления бора, меди и марганца культура имела следующие параметры/продуктивность:
плотность клеток - 2,9 г/л
конверсия CO - 86%
конверсия H2 - 36%
поглощение CO - 3,0 ммоль/мин
поглощение H2 - 0,61 ммоль/мин
концентрация этанола - 21,0 т/л
полная концентрация ацетила - 2,9 г/л
концентрация бутанола - 0,32 г/л.
Пример 2
Ферментация с ограничением концентрации кобальта
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без очистки пермеата. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 37-39°С,
скорость перемешивания: 850 об/мин на аналоговом индикаторе (фактическая скорость перемешивания составляла 931 об/мин согласно калибровочной кривой счетчика числа оборотов),
объем невыросшей культуры: ~1600-1650 мл,
объем выросшей культуры: ~1950 мл.
Установили значение pH культуры 4,5. Использовали 7,7% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% H2, 45% N2, 30% СО и 10% СО2, которую подавали в культуру со скоростью 286 мл/мин.
Скорость подачи среды в реактор составляла от ~0,83 до ~0,86 мл/мин или ~1220 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 31-33 часа.
В качестве исходной среды, использовали описанную далее среду.
Использованная среда описана далее.


Культура находилась в биореакторе до достижения высокопродуктивного стабильного состояния. Высокопродуктивное стабильное состояние было определено как плотность клеток ~2,5-3 г/л, концентрация этанола >20 г/л, поглощение CO >3,0 ммоль/мин и поглощение водорода >0,5 ммоль/мин.
Затем осуществили мониторинг параметров культуры с целью обнаружения неблагоприятного влияния на поглощение газа, Н2 и CO, концентрацию продуктов и плотность клеток. Если снижение концентрации компонента не влияло на эти параметры по истечении многократного (>3) времени удержания клеток, концентрацию продолжали снижать. Если после снижения концентрации компонента происходило ухудшение параметров культуры, концентрацию снова доводили до предыдущего отвечающего требованиям уровня. Если культура восстанавливалась, концентрацию снова снижали иногда до такого же уровня, как и ранее, чтобы повторить полученный результат, а иногда до уровня между приемлемым и неприемлемым уровнями.
В начале эксперимента концентрация кобальта находилась на нормальном среднем уровне и составляла 0,991 части на миллион. Культура имела следующие стабильные параметры: плотность клеток ~3 г/л; концентрацию этанола 22-26 г/л; концентрацию ацетила 2,7-3,7 г/л; поглощение CO 3,1 ммоль/мин; и поглощение H2 0,5-0,7 ммоль/мин. Удалили кобальт из среды в момент t=0 часов. По мере вымывания кобальта из ферментера произошло лишь незначительное уменьшение поглощения СО с 3,1 до 2,9 ммоль/мин. Все остальные параметры оставались более или менее стабильными до момента t=121 час. В этот момент поглощение Н2 и СО уменьшилось до 0,16 и 2,6 ммоль/мин, соответственно. В этот момент также быстро снизилась полная концентрация ацетила до 0,77 г/л, что указывало на то, что концентрация кобальта упала до предельного уровня или ниже. Как показали расчеты вымывания кобальта, к тому моменту, когда параметры культуры стали изменяться вследствие низкой концентрации кобальта в реакторе, она упала до 0,0222 части на миллион или 2,24% первоначальной концентрации. Добавили в реактор кобальт, чтобы довести его концентрацию лишь до 23,3% нормального уровня или до 0,231 части на миллион. Был получен немедленный результат, выразившийся в увеличении поглощения СО, поглощения H2 и повышении концентрации кислоты. После этого в среду больше не добавляли кобальт, чтобы концентрация кобальта в реакторе еще раз снизилась до предельного уровня. Как и ранее, признаков ухудшения параметров культуры не наблюдалось, пока концентрация кобальта не упала ниже 0,0220 части на миллион. В момент t=210 часов поглощение H2 и СО, а также концентрация кислоты снова упала, что явилось результатом снижения концентрации кобальта. После этого в реактор и среду снова добавили кобальт, чтобы довести его концентрацию до 20% (0,198 части на миллион) в среде и до 21,2% (0,21 части на миллион) в реакторе. Как и ранее, результатом стало немедленное увеличение как поглощения газов, так и концентрации кислоты.
В результате двукратного вымывания кобальта из реактора до появления признаков ухудшения параметров культуры определили, что предельная концентрация кобальта в культуре составляет ~0,022 части на миллион. При концентрации кобальта 0,023 части на миллион культура являлась продуктивной без ухудшения параметров. На основании этой концентрации кобальта определили следующие расчетные параметры, использованные для улучшения корреляции добавления питательных элементов и продуктивности культуры: количество добавляемого кобальта составляло 0,005 мг на ммоль поглощаемого газа и ~9 мкг на грамм образовавшихся клеток. Восстановление после ограничения концентрации кобальта являлось быстрым и не сопровождалось длительными неблагоприятными эффектами. Культуре не наносился необратимый ущерб, если концентрацию кобальта повышали до того, как параметры ухудшались до такой степени, что возникали вторичные проблемы, т.е. токсичность газов или отсутствие кислоты.
Падение концентрации кобальта все же вызывало падение концентрации клеток. Отсутствовала явная корреляция между ограничением концентрации кобальта и синтезом бутанола. Ограничение концентрации кобальта оказывало влияние на конверсию/поглощение СО и H2, которое оставалось в пределах от незначительного до незаметного, пока концентрация кобальта в культуре не упала до ~0,022 части на миллион или ниже. Отсутствовало постепенное уменьшение конверсии газа. Тем не менее, после того, как концентрация кобальта упала ниже предельного уровня, конверсия СО и H2 очень быстро уменьшилась. После начала уменьшения конверсии СО и H2 концентрация кобальта в культуре уже находилась ниже критического уровня, и для восстановления культуры требовалось быстрое добавление кобальта. Более ранним признаком снижения концентрации кобальта являлся сдвиг от кислоты к этанолу в соотношении продуктов. Концентрация кислоты начинала падать, а концентрация этанола начинала расти даже до обнаружения уменьшения конверсии газов.
Пример 3
Ферментация с ограничением концентрации никеля
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без очистки пермеата. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 37-39°С,
скорость перемешивания: 700 об/мин на аналоговом индикаторе,
объем невыросшей культуры: ~1500-1650 мл,
объем выросшей культуры: ~1900 мл.
Установили значение pH культуры 4,5. Использовали 7,7% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% Н2, 45% N2, 30% СО и 10% СО2, которую подавали в культуру со скоростью 290 мл/мин.
Скорость подачи среды в реактор составляла от ~0,86 до ~0,88 мл/мин или ~1250 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 27-31 час.
Использованная среда описана далее.
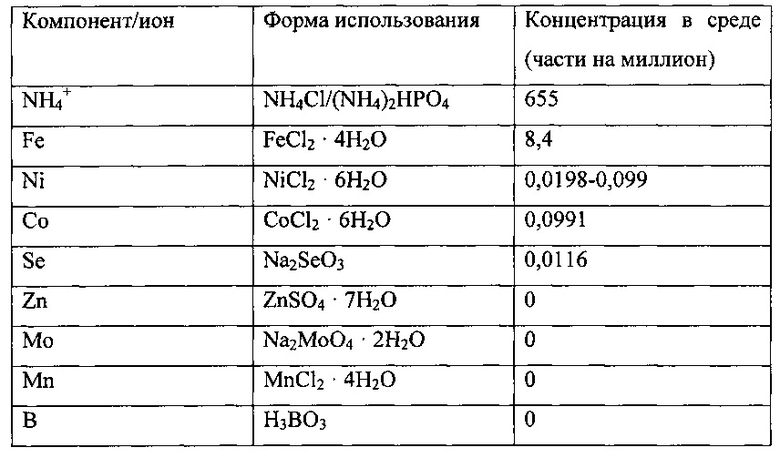
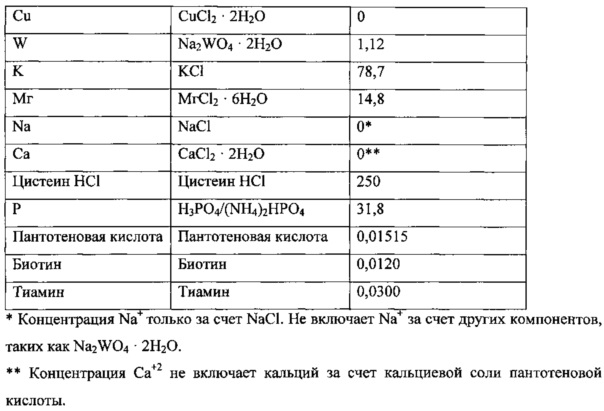
Культура находилась в биореакторе до достижения высокопродуктивного стабильного состояния. Высокопродуктивное стабильное состояние было определено как плотность клеток ~2,5-3 г/л, концентрация этанола >20 г/л, поглощение СО >3,0 ммоль/мин и поглощение водорода >0,5 ммоль/мин.
Затем осуществили мониторинг параметров культуры с целью обнаружения неблагоприятного влияния на поглощение газа, Н2 и CO, концентрацию продуктов и плотность клеток. Если снижение концентрации компонента не влияло на эти параметры по истечении многократного (>3) времени удержания клеток, концентрацию продолжали снижать. Если после снижения концентрации компонента происходило ухудшение параметров культуры, концентрацию снова доводили до предыдущего отвечающего требованиям уровня. Если культура восстанавливалась, концентрацию снова снижали иногда до такого же уровня, как и ранее, чтобы повторить полученный результат, а иногда до уровня между приемлемым и неприемлемым уровнями.
В начале этого эксперимента концентрация никеля в реакторе упала до 56% первоначальной концентрации никеля или до 0,11 части на миллион. Определили концентрацию никеля путем расчета вымывания с учетом концентрации никеля в среде, добавления никеля в среду и/или реактор и потоков жидкости через систему с целью вычисления изменения концентрации никеля в реакторе с течением времени. По мере продолжения вымывания никеля из реактора параметры культуры не изменялись. Плотность клеток оставалась ~2,8 г/л; поглощение СО составляло ~3,2 ммоль/мин; поглощение H2 составляло ~0,7 ммоль/мин; концентрация этанола составляла 24 г/л; а полная концентрация ацетила составляла ~2,5 г/л. Тем не менее, примерно в момент t=107 часов морфология клеток начала ухудшаться. Доля длинных клеток выросла с ~5% до 5-10%, и увеличивалась их длина. Теперь наблюдалась определенная деформация длинных клеток. Также увеличивалась общая длина клеток средней длины, но лишь с легкой деформацией или без деформации. Концентрация никеля в реакторе упала до 0,0996 части на миллион примерно в момент начала ухудшения морфологии клеток. К моменту t=~160 часов концентрация никеля в реакторе снизилась до 50% или до 0,0988 части на миллион. Как и ранее, параметры культуры значительно не изменились. Тем не менее, морфология клеток ухудшилась при наблюдении примерно в момент t=250 часов. Доля длинных клеток выросла до 10-20%, как и степень искривления или деформации этих длинных клеток. Остальные клетки культуры имели длину от средней до немного увеличенной с редким легким искривлением. Отсутствовали сильно искривленные клетки, такие как спиральные клетки, но наблюдалось несколько зернистых клеток и полых клеток. И в этом случае не изменились параметры культуры или концентрация никеля.
Концентрация никеля в реакторе оставалась на уровне 50% или 0,0988 части на миллион до момента t=1885 часов. При расходе среды ~0,87 мл/мин скорость подачи никеля составляла 0,12 мг/сутки. Параметры культуры оставались достаточно постоянными: плотность клеток ~2,8 г/л, поглощение СО ~3,2 ммоль/мин, поглощение Н2 ~0,7 ммоль/мин, концентрация этанола ~25 г/л, полная концентрация ацетила ~2,5 г/л, и концентрация бутанола ~0,3 г/л. При 50% скорости подачи никеля его добавляли в количестве ~34 мкг на грамм образовавшихся клеток или ~0,022 мкг на ммоль поглощаемого газа. Морфология клеток прекратила ухудшаться, когда концентрация никеля достигла 0,0988 части на миллион. В культуре оставалось ~10% длинных клеток с легкой деформацией, ~5% очень длинных клеток с умеренной деформацией, а остальные клетки имели длину от средней до немного увеличенной с редкой деформацией.
В момент t=445 часов концентрация никеля была снижена до 25% первоначальной концентрации или до 0,049 части на миллион. Почти немедленно началось медленное, но устойчивое изменение параметров культуры. Поглощение СО оставалось постоянным и составляло ~3,2 ммоль/мин, но поглощение H2 уменьшилось с 0,7-0,8 ммоль/мин до 0,6-0,7 ммоль/мин в течение ~120 часов снижения концентрации никеля. Концентрация этанола снизилась с ~24 г/л до ~21 г/л, а полная концентрация ацетила также упала с ~2,5 г/л до ~2,0 г/л в течение ~160 часов изменения концентрации никеля. Почти сразу после снижения концентрации никеля в среде концентрация бутанола начала медленно, но устойчиво повышаться. Она повысилась с ~0,21 г/л до ~0,34 г/л через ~635 часов после снижения концентрации никеля. Морфология клеток осталась относительно неизменной. Сниженная скорость подачи никеля теперь составляла 0,062 мг/сутки. При этой скорости подачи никеля его добавляли в количестве ~18 мкг на грамм образовавшихся клеток или ~0,011 мкг на ммоль поглощаемого газа. Чтобы ускорить воздействие низкой концентрации никеля на культуру, в момент t=638 часов снизили концентрацию никеля в среде до 10% первоначальной концентрации или до 0,0198 части на миллион. Тенденции изменения параметров культуры продолжились, но с более высокой скоростью. Поглощение H2 и концентрация кислоты продолжили снижаться. Плотность клеток и поглощение СО не изменилось, а концентрация бутанола продолжила расти. Плотность клеток не изменилась и оставалась на уровне ~2,8 г/л. Поглощение водорода составляло ~0,5-0,6 ммоль/мин. Поглощение окиси углерода оставалось на уровне ~3,2 ммоль/мин. Концентрация этанола составляла ~21 г/л, полная концентрация ацетила составляла ~1,5 г/л, а концентрация бутанола составляла ~0,65 г/л. Поддерживали концентрацию никеля на уровне 10% в течение еще 86 часов, чтобы определить ее более долгосрочное воздействие на параметры и морфологию клеток. Параметры культуры больше не ухудшались. Морфология культуры все же несколько ухудшилась, что выразилось в увеличении числа длинных клеток, а также в увеличении общей длины клеток. Приблизительно 10-15% клеток были отнесены к длинным клеткам с деформацией. Остальные клетки имели длину от небольшой до немного увеличенной, при этом большинство клеток имело среднюю длину и не имело деформации. При концентрации никеля в среде 10% или 0,01975 части на миллион скорость подачи никеля составляла 0,025 мг/сутки. Это соответствовало ~7 мкг добавляемого никеля на грамм образовавшихся клеток или ~0,0048 мкг добавляемого никеля на ммоль поглощаемого газа. В момент t=2270 часов снова повысили концентрацию никеля до 50% или 0,0988 части на миллион. Поглощение водорода выросло до ~0,7 ммоль/мин. Поглощение СО осталось на уровне ~3,2 ммоль/мин. Концентрация этанола достигла ~24 г/л. Концентрация кислоты увеличилась до ~2,5 г/л. Концентрация бутанола упала до ~0,24 г/л, а плотность клеток осталась без изменения на уровне ~2,9 г/л. Также улучшилась морфология клеток, что выразилось в общем уменьшении длины клеток, а также числа длинных клеток. Приблизительно 5-10% клеток были отнесены к длинным клеткам со слабой деформацией. Остальные клетки имели длину от небольшой до немного увеличенной, при этом большинство из них имело среднюю длину лишь с редкой слабой деформацией.
Снижение концентрации никеля в реакторе до 0,0988 части на миллион или до 50% не вызвало заметных изменений параметров культуры. Тем не менее, морфология клеток все же ухудшилась, что выразилось в увеличении общей длины клеток, при этом до 20% клеток были отнесены к длинным клеткам с деформации в пределах от слабой до умеренной. Морфология клеток перестала ухудшаться при концентрации никеля 50%, что доказывает, что при нахождении в этих условиях культура оставалась в устойчивом состоянии.
Когда концентрация никеля в среде упала до 25% нормальной концентрации или до 0,049 части на миллион, начала снижаться концентрация этанола, полная концентрация ацетила и уменьшаться поглощение H2. В то же время, концентрация бутанола начала медленно увеличиваться. Несмотря на все признаки ограничения концентрации никеля в культуре, морфология клеток оставалась относительно неизменной. С учетом вычисленной концентрация никеля в реакторе, когда параметры культуры и морфология клеток начали ухудшаться, морфология впервые ухудшилась, когда концентрация никеля снизилась до 50% или до 0,099 части на миллион. При дальнейшем снижении концентрации никеля до 36% или до 0,072 части на миллион снизилась концентрация бутанола. При концентрации никеля 29% или 0,057 части на миллион начало уменьшаться поглощение Н2. Наконец, при концентрации никеля 25% или 0,050 части на миллион начала снижаться концентрация этанола и кислоты. При концентрации никеля 50% была затронута только морфология культуры. При дальнейшем снижении концентрации никеля уменьшилось поглощение и производительность культуры. Это означает, что концентрация никеля 50% или скорость подачи 0,12 мг/сутки очень близка к предельной концентрации никеля. С учетом параметров культуры и скорости подачи никеля 0,12 мг/сутки его добавляли в количестве ~34 мкг на грамм образовавшихся клеток или ~0,022 мкг на ммоль поглощаемого газа.
Признаками предельной концентрации никеля являлись уменьшение поглощения H2, снижение концентрации кислоты и повышение концентрации бутанола с последующим снижением концентрации этанола. Не наблюдалось изменения плотности клеток. В конечном итоге была затронута морфология клеток, что выразилось в увеличении общего числа длинных клеток и общей длины этих длинных клеток. В целом, с увеличением длины клеток увеличивалось их искривление или деформация.
Пример 4
Ферментация с ограничением концентрации вольфрама
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без очистки пермеата. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 38-39°С,
скорость перемешивания: 700 об/мин на аналоговом индикаторе,
объем невыросшей культуры: ~1550-1700 мл,
объем выросшей культуры: ~1900 мл,
Установили значение pH культуры 4,5. Использовали 7,7% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% Н2, 45% N2, 30% СО и 10% CO2, которую подавали в культуру со скоростью 290 мл/мин.
Скорость подачи среды в реактор составляла от ~0,86 до ~0,88 мл/мин или ~1250 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 28-31 час.
Использованная среда описана далее.

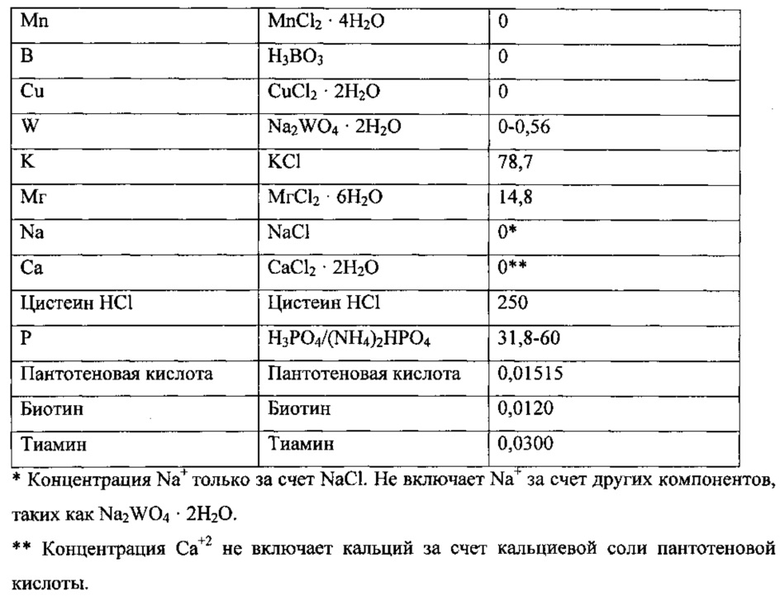
Культура находилась в биореакторе до достижения высокопродуктивного стабильного состояния. Высокопродуктивное стабильное состояние было определено как плотность клеток ~2,5-3 г/л, концентрация этанола >20 г/л, поглощение СО >3,0 ммоль/мин и поглощение водорода >0,5 ммоль/мин.
Затем осуществили мониторинг параметров культуры с целью обнаружения неблагоприятного влияния на поглощение газа, Н2 и СО, концентрацию продуктов и плотность клеток. Если снижение концентрации компонента не влияло на эти параметры по истечении многократного (>3) времени удержания клеток, концентрацию продолжали снижать. Если после снижения концентрации компонента происходило ухудшение параметров культуры, концентрацию снова доводили до предыдущего отвечающего требованиям уровня. Если культура восстанавливалась, концентрацию снова снижали иногда до такого же уровня, как и ранее, чтобы повторить полученный результат, а иногда до уровня между приемлемым и неприемлемым уровнями.
Во время испытания фосфора из среды исключили вольфрам в момент t=0 часов. Культура не восстанавливалась, как предполагалось во время испытания фосфора, несмотря на добавление фосфора в реактор и препарат среды. После ряда неудачных попыток улучшить среду в качестве последнего средства в момент t=812 часов добавили в реактор вольфрам в количестве 50% нормальной концентрации или 0,56 части на миллион путем добавления 8 мл раствора 0,2 г/л Na2WO4⋅2Н2О в 1,6 литра культуры. Как показали расчеты вымывания вольфрама, его концентрация в реакторе снизилась до <0,0001 части на миллион. После добавления вольфрама реакция культуры была почти немедленной. Начало увеличиваться поглощение Н2. С увеличением конверсии Н2 скорость подачи газа снова выросла до первоначальной скорости ~290 мл/мин к моменту t=885 часов. В результате поглощение СО и Н2 снова достигло 3,2 и ~0,75 ммоль/мин, соответственно. С увеличением поглощения газа плотность клеток увеличилась до ~2,7 г/л, а концентрация этанола выросла до ~22 г/л. Полная концентрация ацетила и концентрация бутанола остались примерно на том же уровне ~3,5 и ~0,45 г/л, соответственно. Другим изменением в культуре стало улучшение морфологии клеток. С добавлением вольфрама значительно уменьшилась общая длина клеток, и уменьшилось искривление и деформация клеток.
В среду не добавляли вольфрам, чтобы снизить его уровень в реакторе и попытаться определить концентрацию вольфрама, необходимую культуре. С вымыванием вольфрама примерно в момент t=904 часов началось уменьшение поглощения Н2. Вольфрам не добавляли ни в реактор, ни в среду. Примерно в момент t=981 часов начала медленно увеличиваться концентрация бутанола. Затем примерно в момент t=1030 часов начала снижаться концентрация этанола. Вольфрам по-прежнему не добавляли. К моменту t=1100 часов поглощение Н2 составляло ~0,2 ммоль/мин; концентрация этанола составляла ~17 г/л, и концентрация бутанола составляла ~0,74 г/л. Поглощение СО не было затронуто, а плотность клеток оставалась примерно такой же.
В момент t=1100 часов добавил в реактор вольфрам в количестве 50% нормальной концентрации или 0,56 части на миллион. Как и ранее, параметры культуры начали улучшаться почти немедленно. Начало увеличиваться поглощение Н2; повысилась концентрация этанола; снизилась концентрация кислот; несколько увеличилась плотность клеток; и начала снижаться концентрация бутанола. К концу отчетного периода плотность клеток составляла ~3,3 г/л; поглощение СО и Н2 составляло ~3,2 и ~0,75 ммоль/мин, соответственно; концентрация этанола составляла 22 г/л; концентрация кислоты составляла ~2,5 г/л; и концентрация бутанола составляла 0,52 г/л. К концу отчетного периода уровень вольфрама в реакторе снизился до 0,045 части на миллион или 4,0% первоначальной концентрации.
Предельная концентрация вольфрама составляла около 2,7% первоначальной концентрации или 0,030 части на миллион. Первые признаки ухудшения параметров культуры в виде уменьшения поглощения H2 появились, когда содержание вольфрама в реакторе снизилось до 0,030 части на миллион. При этой концентрации добавили вольфрам в количестве 10 мкг на грамм образовавшихся клеток или 0,0068 мкг на ммоль поглощаемого газа.
Пример 5
Ферментация с ограничением концентрации бора, меди, марганца и молибдена Засеяли в реактор New Brunswick BioFlo/CelliGen 115 со средой, не содержащей В, Cu, Mn или Мо (средой А), или известной средой (средой 402), содержащей В, Cu, Mn, Мо и 0,39 г/л активно растущего штамма Clostridium ljungdahlii СО-1.
После этого установили в реакторе скорость перемешивания 800 об/мин. Проанализировали образцы газа и жидкости, взятые из реактора с интервалами примерно 1 час, чтобы определить потребление или синтез различных газообразных компонентов, концентрацию уксусной кислоты в жидкости, концентрацию этанола в жидкости и оптическую плотность культуры. Кроме того, ежедневно определяли состав различных газов в синтез-газе и в реальном времени измеряли поток синтез-газа в реактор с помощью массового расходомера, регулирующего поступление синтез-газа в реактор. Вычислили фактический поток газа с использованием уравнения, полученного путем калибровки массового расходомера. Произвели расчеты, чтобы определить необходимую скорость потока газа в реактор с целью поддержания постоянной процентной доли поглощения H2 из H2 в поступающем в реактор газе или, иными словами, в этом конкретном эксперименте поддерживали такую скорость газа, поступающего в реактор, чтобы поглощение H2 культурой составляло 4,5% всех молекул газа, поступающего в реактор. Затем подали в реактор газ с вычисленной выше скоростью (чтобы процентная доля поглощения H2 из поступающего газа составляла 4,5% всех молекул газа).
Во всех трех экспериментах до засева реактора соединили с ним систему рециркуляции клеток, по которой на всем протяжении экспериментов циркулировала среда. В первом эксперименте со средой А через 2,75 часа после засева (после того, как конверсия СО достигла 80% или более) начали подачу среды в реактор и извлечение пермеата из реактора со скоростью 1,0 мл/мин. Через 6,83 часа после засева увеличили скорость подачи среды в реактор и скорость извлечения пермеата из реактора до 2,0 мл/мин.
Во втором эксперименте со средой 402 через 1,9 часа после засева (после того, как конверсия СО достигла 80% или более) начали подачу среды в реактор и извлечение пермеата из реактора со скоростью 2,0 мл/мин.
В третьем эксперименте со средой А через 2,0 часа после засева (после того, как конверсия СО достигла 80% или более) начали подачу среды в реактор и извлечение пермеата из реактора со скоростью 2,0 мл/мин. Во всех трех экспериментах для предотвращения быстрого накопления этанола в реакторе применяли систему рециркуляции клеток.
Среда А и среда 402 обеспечивали почти одинаковое поглощение водорода бактериями С. ljungdahlii.
Пример 6
Ферментация с ограничением концентрации молибдена
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без очистки пермеата. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 38-39°С,
скорость перемешивания: 850 об/мин на аналоговом индикаторе,
объем невыросшей культуры: ~1600-1650 мл,
объем выросшей культуры: ~1900 мл.
Установили значение pH культуры 4,5. Использовали 7,7% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% Н2, 45% N2, 30% СО и 10% СО2, которую подавали в культуру со скоростью 282 мл/мин.
Скорость подачи среды в реактор составляла ~0,88 мл/мин или ~1300 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 29-31 час.
Использованная среда описана далее.
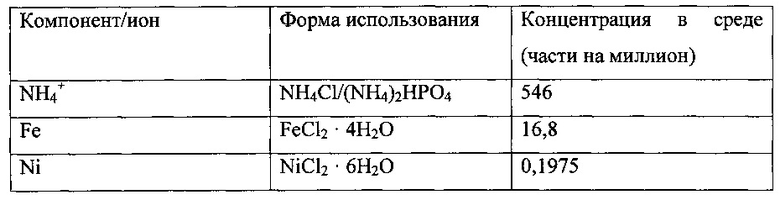
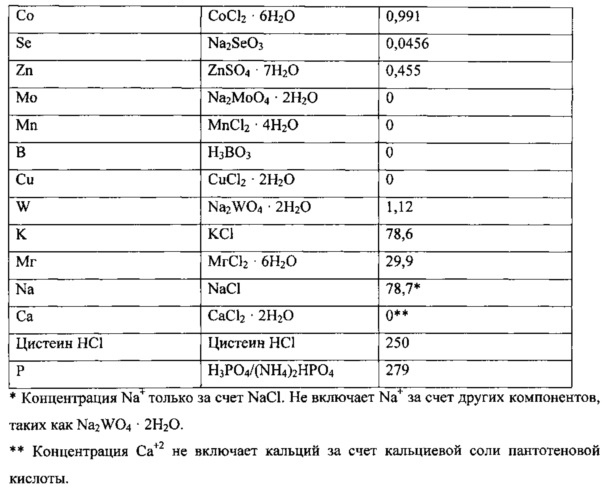
Культура находилась в биореакторе до достижения высокопродуктивного стабильного состояния. Высокопродуктивное стабильное состояние было определено как плотность клеток ~2,5-3 г/л, концентрация этанола >20 г/л, поглощение СО >3,0 ммоль/мин и поглощение водорода >0,5 ммоль/мин.
Затем осуществили мониторинг параметров культуры с целью обнаружения неблагоприятного влияния на поглощение газа, Н2 и СО, концентрацию продуктов и плотность клеток. Если снижение концентрации компонента не влияло на эти параметры по истечении многократного (>3) времени удержания клеток, концентрацию продолжали снижать. Если после снижения концентрации компонента происходило ухудшение параметров культуры, концентрацию снова доводили до предыдущего отвечающего требованиям уровня. Если культура восстанавливалась, концентрацию снова снижали иногда до такого же уровня, как и ранее, чтобы повторить полученный результат, а иногда до уровня между приемлемым и неприемлемым уровнями.
В момент t=0 часов исключили Na2MoO4⋅2Н2О из препарата среды, чтобы начать испытание с целью определения потребности в молибдене. Непосредственно перед исключением этих компонентов культура имела следующие параметры/продуктивность:
плотность клеток - 3,2 г/л
конверсия СО - 86%
конверсия Н2 - 36%
поглощение СО - 3,0 ммоль/мин
поглощение Н2 - 0,56 ммоль/мин
концентрация этанола - 21,8 г/л
полная концентрация ацетила - 2,3 г/л
концентрация бутанола - 0,32 г/л.
По истечении ~9,7-кратного времени удержания клеток (292 часа) концентрация молибдена в культуральной жидкости упала до <0,0001% начальной концентрации, составлявшей 0,238 части на миллион. Определили расчетные остаточные концентрации компонентов в жидкости путем расчета вымывания с учетом исходной концентрации кальция, MFR, LRT и любых добавлений молибдена в биореактор в составе среды или путем инъекций. Неблагоприятное влияние на продуктивность среды отсутствовало. Через 292 часа без добавления молибдена культура имела следующие параметры/продуктивность:
плотность клеток - 2,9 г/л
конверсия СО - 86%
конверсия Н2 - 36%
поглощение СО - 3,0 ммоль/мин
поглощение Н2 - 0,61 ммоль/мин
концентрация этанола - 21,0 г/л
полная концентрация ацетила - 2,9 г/л
концентрация бутанола - 0,32 г/л.
Пример 7
Ферментация с ограничением концентрации магния
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без контура рециркуляции клеток. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 37-39°С,
скорость перемешивания: 880-890 об/мин на аналоговом индикаторе,
объем невыросшей культуры: ~1275 мл,
объем выросшей культуры: ~1900 мл.
Установили значение pH культуры 4,2. Использовали 7,7% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% Н2, 45% N2, 30% СО и 10% СО2, которую подавали в культуру со скоростью 232 мл/мин.
Скорость подачи среды в реактор составляла ~0,70 мл/мин или ~1008 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 29-31 час.
Использованная среда описана далее.
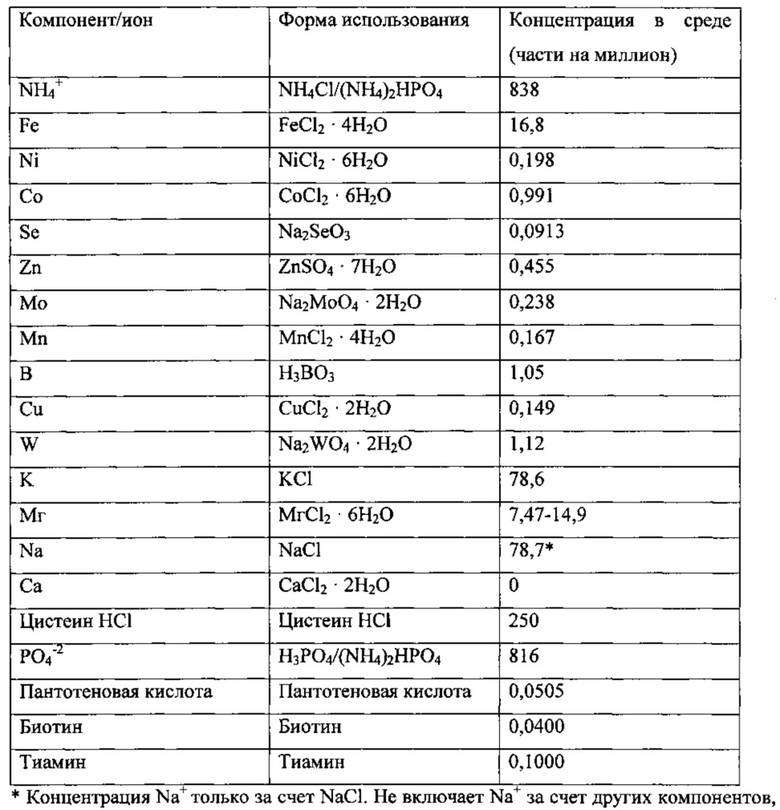

Культура находилась в биореакторе до достижения высокопродуктивного стабильного состояния. Высокопродуктивное стабильное состояние было определено как плотность клеток ~2,5-3 г/л, концентрация этанола >20 г/л, поглощение СО >3,0 ммоль/мин и поглощение водорода >0,5 ммоль/мин.
Затем осуществили мониторинг параметров культуры с целью обнаружения неблагоприятного влияния на поглощение газа, Н2 и СО, концентрацию продуктов и плотность клеток. Если снижение концентрации компонента не влияло на эти параметры по истечении многократного (>3) времени удержания клеток, концентрацию продолжали снижать. Если после снижения концентрации компонента происходило ухудшение параметров культуры, концентрацию снова доводили до предыдущего отвечающего требованиям уровня. Если культура восстанавливалась, концентрацию снова снижали иногда до такого же уровня, как и ранее, чтобы повторить полученный результат, а иногда до уровня между приемлемым и неприемлемым уровнями.
В начале эксперимента концентрация магния соответствовала нормальным уровням содержания этанола в среде и составляла 59,77 части на миллион. Культура имела следующие стабильные параметры: плотность клеток ~3,1 г/л; концентрацию этанола 20,5 г/л; концентрацию ацетила 3,0 г/л; поглощение СО 2,4 ммоль/мин; и поглощение Н2 0,42 ммоль/мин. В момент t=0 часов концентрация магния в среде была снижена до 14,97 части на миллион. По мере вымывания магния из ферментера контролировали все параметры с целью обнаружения потенциального воздействия на продуктивность культуры. Через ~300 часов или по истечении ~10-кратного времени удержания клеток отрицательного воздействия на продуктивность культуры не наблюдалось. Почти немедленно снижения концентрации магния снизилась концентрация ацетила, но это объяснялось проблемой с подачей среды. После ее устранения концентрация ацетила снова достигла уровня, аналогичного уровню при концентрации магния 59,77 части на миллион. Был сделан вывод о том, что среда, содержащая 14,97 части на миллион магния, способна поддерживать в культуре плотность клеток ~3 г/л при времени удержания клеток ~30 часов.
Концентрация магния - 59,77 части на миллион
плотность клеток - 3,1 г/л
конверсия СО - 84%
конверсия Н2 - 32%
поглощение СО - 2,4 ммоль/мин
поглощение Н2 - 0,42 ммоль/мин
этанол - 20,5 г/л
полная концентрация ацетила - 2,4 г/л.
Концентрация магния - 14,94 части на миллион
плотность клеток - 3,0 г/л
конверсия СО - 84%
конверсия Н2 - 34%
поглощение СО - 2,4 ммоль/мин
поглощение Н2 - 0,45 ммоль/мин
концентрация этанола - 21,0 г/л
полная концентрация ацетила - 2,7 г/л.
Начиная с момента t=403 часа, дополнительно снизили концентрацию магния в среде до 7,47 части на миллион. По мере вымывания магния из ферментера контролировали все параметры с целью обнаружения потенциального воздействия на продуктивность культуры. Только через 20 часов начала уменьшаться конверсия и поглощение водорода. Расчетная концентрация магния в культуре составляла ~11 частей на миллион. Продуктивность культуры продолжила ухудшаться, что выразилось в уменьшении конверсии/поглощения СО, повышении концентрации ацетила, снижении концентрации этанола и стабильном падении плотности клеток, несмотря на неоднократное добавление магния как в культуру, так и в среду. Впоследствии культура погибла. Был сделан вывод о том, что среды, содержащей 7,47 части на миллион магния, недостаточно для поддержания плотности клеток 3 г/л культуры при времени удержания клеток 30 часов.
Пример 8
Ферментация с ограничением концентрации калия
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без контура рециркуляции клеток. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 38-39°С.
скорость перемешивания: 950-1000 об/мин на аналоговом индикаторе,
объем выросшей культуры: ~1550 мл.
Установили значение pH культуры 4,2. Использовали 7,5% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% Н2, 45% N2, 30% СО и 10% СО2, которую подавали в культуру со скоростью 279 мл/мин.
Скорость подачи среды в реактор составляла ~0,80-0,85 мл/мин или ~1220 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 28-30 часов.
Использованная среда описана далее.
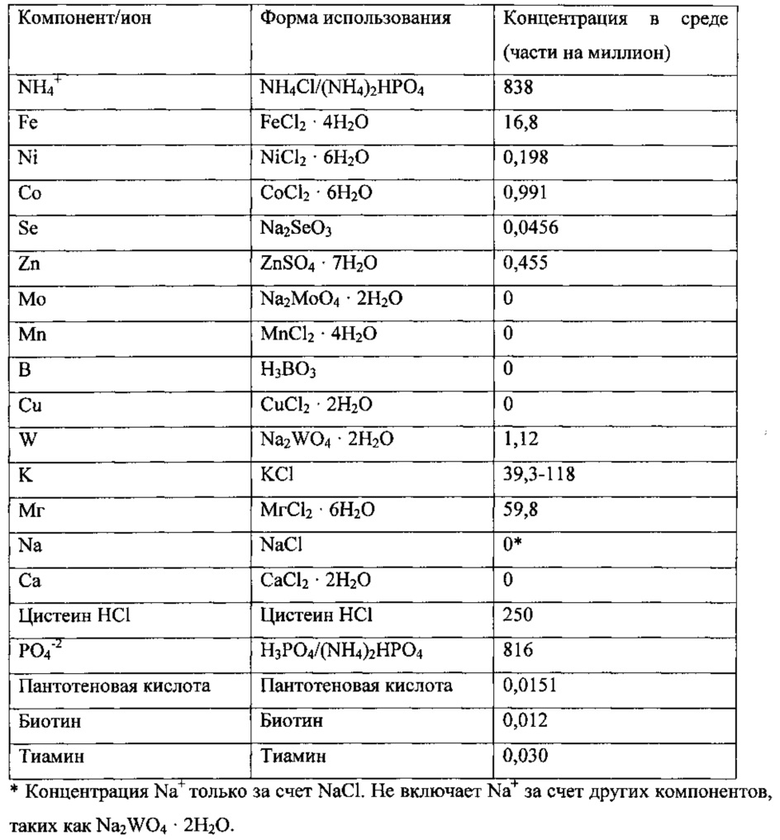
Культура находилась в биореакторе до достижения высокопродуктивного стабильного состояния. Высокопродуктивное стабильное состояние было определено как плотность клеток ~2,5-3 г/л, концентрация этанола >20 г/л, поглощение СО >3,0 ммоль/мин и поглощение водорода >0,5 ммоль/мин.
Затем осуществили мониторинг параметров культуры с целью обнаружения неблагоприятного влияния на поглощение газа, Н2 и СО, концентрацию продуктов и плотность клеток. Если снижение концентрации компонента не влияло на эти параметры по истечении многократного (>3) времени удержания клеток, концентрацию продолжали снижать. Если после снижения концентрации компонента происходило ухудшение параметров культуры, концентрацию снова доводили до предыдущего отвечающего требованиям уровня. Если культура восстанавливалась, концентрацию снова снижали иногда до такого же уровня, как и ранее, чтобы повторить полученный результат, а иногда до уровня между приемлемым и неприемлемым уровнями.
В начале эксперимента концентрация калия соответствовала нормальным уровням содержания этанола в среде и составляла 78,7 части на миллион. Культура имела следующие стабильные параметры: плотность клеток ~3 г/л; концентрацию этанола ~22 г/л; концентрацию ацетила ~2,6 г/л; концентрацию бутанола 0,5 г/л; поглощение СО 3,1 ммоль/мин; и поглощение Н2 0,5-0,6 ммоль/мин. Начиная с момента t=0 часов снизили концентрацию калия в среде до 39,3 части на миллион. По мере вымывания калия из ферментера контролировали параметры культуры с целью обнаружения изменений. Приблизительно через 30 часов начало уменьшаться поглощение Н2, а затем поглощение СО. Поглощение водорода упало до 0,078 ммоль/мин, а поглощение СО до 2,8 ммоль/мин. Приблизительно через 40 часов после снижения концентрации калия концентрация уксусной кислоты также снизилась до 0,78 г/л, а затем концентрация этанола до 19,2 г/л. Концентрация бутанола повысилась до 0,67 г/л. Плотность клеток также снизилась до 2,3 г/л, но это могло стать результатом непреднамеренного сокращения времени удержания клеток до 27 часов немедленно после снижения концентрации калия. Добавили калий в реактор, чтобы повысить его концентрацию до 78,7 части на миллион. Немедленно наблюдался эффект в виде увеличения поглощения СО, поглощения Н2, повышения концентрации этанола и кислоты. С повышением концентрации калия концентрация бутанола медленно снизилась до ~0,53 г/л.
После того, как параметры культуры восстановились до уровней, наблюдавшихся до снижения концентрации калия, в момент t=139 часов снизили концентрацию калия в среде до 59,0 частей на миллион. И снова контролировали параметры культуры с целью обнаружения изменений. Как и ранее, поглощение Н2 начало уменьшаться через ~8 часов после снижения концентрации калия. Тем не менее, в этот раз поглощение СО не изменилось. Концентрация бутанола немного повысилась до ~0,57 г/л. Снизилась концентрация уксусной кислоты, но это стало продолжением тенденции снижения, наблюдавшейся до снижения концентрации калия. Концентрация этанола осталась на уровне ~22 г/л. Со снижением концентрации калия плотность клеток немного снизилась приблизительно с 3,0 г/л до 2,8 г/л. Из-за разброса данных была определена лишь приблизительная плотность клеток. Добавили в реактор калий, чтобы повысить его концентрацию до 78,7 части на миллион. Немедленно наблюдался эффект в виде увеличения поглощения Н2, повышения концентрации этанола и кислоты и плотности клеток, что подтвердило зависимость культуры от концентрации калия.
Общее воздействие снижения концентрации калия до 59,0 частей на миллион оказалось меньшим, чем при снижении до 39,3 части на миллион, но в любом случае это уровень был признан предельным. Соответственно, концентрация калия в среде 78,7 части на миллион была признана близкой к предельной. Чтобы определить, является ли она в действительности предельной, в момент t=243 часа повысили концентрацию калия в среде до 98,3 части на миллион. С повышением концентрации калия поглощение Н2 увеличилось с ~0,61 ммоль/мин до ~0,71 ммоль/мин. Плотность клеток также повысилась с ~3,0 до ~3,3 г/л. Концентрация кислоты повысилась до ~3,3 г/л по сравнению с 2,6 г/л при концентрации калия 78,7 части на миллион. Концентрация бутанола оставалась более или менее постоянной в пределах разброса данных. Концентрация этанола немного повысилась до 24 г/л, но из-за разброса данных ее было сложно определить. Поскольку повышение концентрации калия до 98,3 части на миллион оказало ряд положительных воздействий, в момент t=375 часов дополнительно повысили концентрацию калия до 118 частей на миллион. Единственным положительным воздействием стало дальнейшее увеличение плотности клеток до ~3,9 г/л. Все остальные параметры оставались постоянными в пределах разброса данных.
Пример 9
Ферментация с ограничением концентрации цистеина
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR без контура рециркуляции клеток. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 38-39°С,
скорость перемешивания: 900 об/мин на аналоговом индикаторе,
объем выросшей культуры: ~1650 мл.
Установили значение pH культуры 4,5. Использовали 7,5% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% Н2, 45% N2, 30% СО и 10% СО2, которую подавали в культуру со скоростью 279 мл/мин.
Скорость подачи среды в реактор составляла ~0,83-0,86 мл/мин или ~1220 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 28-30 часов.
Использованная среда описана далее.
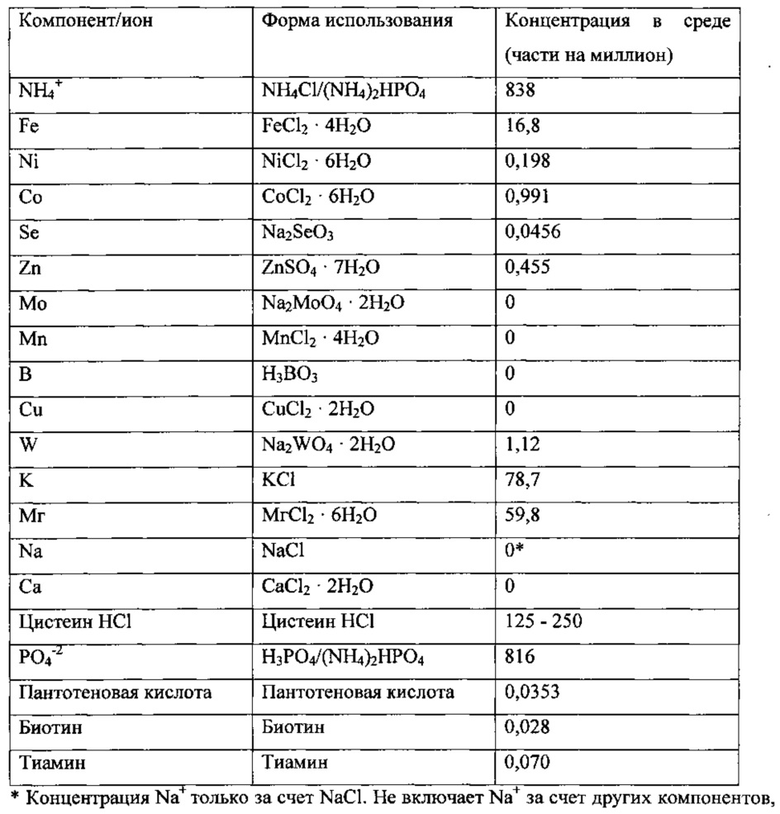

В начале эксперимента концентрация цистеина соответствовала нормальным уровням содержания этанола в среде и составляла 250 частей на миллион. Культура имела следующие стабильные параметры: плотность клеток ~3 г/л; концентрацию этанола 23 г/л; концентрацию ацетила 2,4 г/л; поглощение СО 3,1 ммоль/мин; и поглощение Н2 0,56 ммоль/мин. В момент t=0 часов снизили концентрацию цистеина в среде до 187,5 части на миллион. По мере вымывания цистеина из ферментера контролировали все параметры с целью обнаружения признаков предельной концентрации. Поддерживали концентрацию цистеина на этом уровне в течение 167 часов или 5-кратного времени удержания. Все параметры оставались постоянными. Концентрации цистеина 187,5 части на миллион было достаточно для поддержания плотности клеток 3 г/л культуры при времени удержании клеток 33 часа.
Затем в момент t=167 часов снизили концентрацию цистеина в среде с 187,5 части на миллион до 125 частей на миллион. Почти немедленно началось уменьшение поглощения и конверсии Н2 наряду со снижением концентрации уксусной кислоты. Поглощение и конверсия СО и плотность клеток оставались постоянными. Поглощение Н2 упало до 0,36 ммоль/мин, конверсия Н2 упала до 21%, а концентрация уксусной кислоты снизилась до 1,7 г/л. Повысили концентрацию цистеина в среде и биореакторе до 187,5 части на миллион, а затем до 250 частей на миллион. Произошло быстрое восстановление культуры. Концентрации цистеина 125 частей на миллион было недостаточно для поддержания плотности клеток 3 г/л культуры при времени удержании клеток 33 часа.
После полного восстановления культуры снова проверили предельную концентрацию цистеина. В момент t=407 часов снизили концентрацию цистеина в среде до 162,5 части на миллион. Как и ранее, почти немедленно началось уменьшение конверсии и поглощения Н2. Концентрация уксусной кислоты снова снизилась, но не так быстро или не так сильно, как при концентрации цистеина 125 частей на миллион. Поглощение Н2 упало до 0,49 ммоль/мин, конверсия Н2 упала до 29%, а концентрация уксусной кислоты снизилась с 3,0 до 2,7 r/л. Концентрации цистеина 162,5 части на миллион было недостаточно для поддержания плотности клеток 3 г/л культуры при времени удержании клеток 33 часа.
Пример 10
Ферментация с ограничением концентрации тиамина
Были проведены эксперименты в биореакторе (New Brunswick BioFlo I или IIc), который использовался как прямоточный CSTR. Использовали следующие условия эксплуатации биореактора:
тип культуры: Clostridium ljungdahlii С01,
поддерживаемая температура культуры: 38-39°С,
скорость перемешивания: 950 об/мин на аналоговом индикаторе,
объем выросшей культуры: ~1950 мл.
Установили значение pH культуры 4,5. Использовали 7,5% раствор NaHCO3 для регулирования pH.
В качестве газа использовали синтезированную смесь 15% Н2, 45% N2, 30% СО и 10% СО2, которую подавали в культуру со скоростью 279 мл/мин.
Скорость подачи среды в реактор составляла ~0,84-0,86 мл/мин или ~1220 мл/сутки.
Время удержания жидкости и клеток составляло приблизительно 30-32 часа.
Использованная среда описана далее
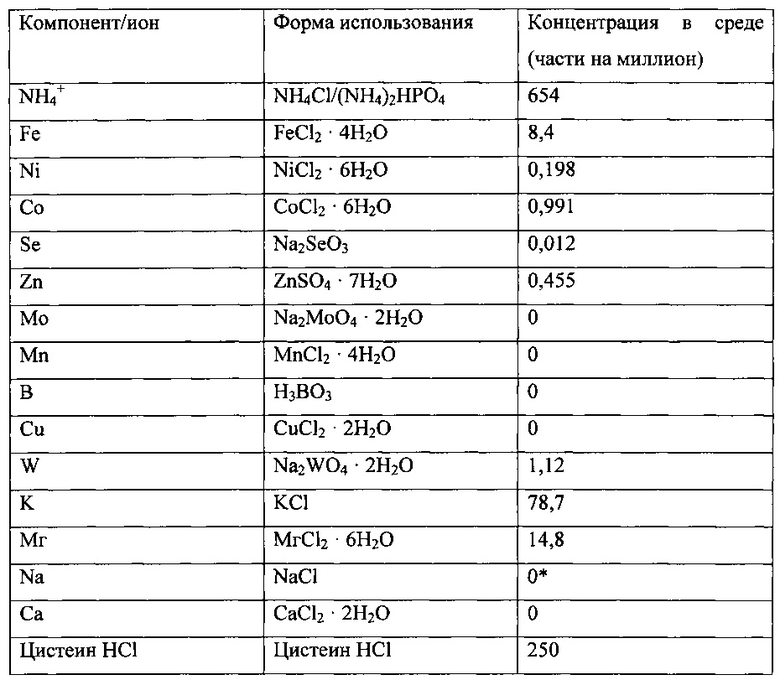

В качестве раствора питательных элементов добавили в среду раствор, содержащий 0,0505 г/л пантотената, 0,040 г/л биотина и 0,10 г/л тиамина. В этом исследовании разделили раствор питательных элементов на три раствора, по одному для каждого компонента. Поддерживали такие же концентрации этих растворов, как в исходной смеси питательных элементов. Тем самым можно было по мере необходимости корректировать концентрацию каждого компонента без изменения концентраций остальных питательных элементов.
В начале этого эксперимента концентрация пантотеновой кислоты в среде составляла 0,03535 части на миллион или 0,7 мл раствора пантотеновой кислоты в концентрации 0,0505 г на литр среды. Концентрация биотина в среде составляла 25% нормальной концентрации или 0,0070 части на миллион. Это являлось эквивалентом 0,175 мл раствора биотина в концентрации 0,04 г на литр среды. Концентрация тиамина в среде составляла 25% нормальной концентрации или 0,0175 части на миллион. Это являлось эквивалентом 0,175 мл раствора тиамина в концентрации 0,10 г на литр среды. В момент t=0 часов снизили концентрацию тиамина в среде до 15% нормальной концентрации или до 0,0105 части на миллион. Не произошло немедленного воздействия на плотность клеток. Тем не менее, почти немедленно началось уменьшение поглощения Н2, полной концентрации ацетила и концентрации этанола, что означало, что предыдущая концентрация тиамина 0,0175 части на миллион уже являлась близкой к предельной. В то же время, поглощение СО немного увеличилось с 3,1 до 3,2 ммоль/мин. Это могло являться признаком увеличения массопереноса за это время, несмотря даже на оставшуюся постоянной скорость перемешивания. Чтобы выяснить причину падения производительности культуры, сначала в момент t=43 часов добавили в реактор 0,5 мл раствора пантотеновой кислоты. Когда это не оказало воздействия на культуру, в момент t=84 часов добавили в реактор 0,115 мл раствора тиамина, чтобы повысить его концентрацию в реакторе до ~0,0175 части на миллион. Это оказало немедленное воздействие на культуру. Началось увеличение поглощения водорода, концентрации кислоты и этанола. Культуре требовался дополнительный тиамин.
В реактор больше ничего не добавляли, чтобы вымыть из него добавленную пантотеновую кислоту и тиамин и снова снизить концентрацию пантотеновой кислоты до 0,0354 части на миллион и концентрацию тиамина до 0,0105 части на миллион. В течение следующих 228 часов вымывания поглощение H2 сначала увеличилось до ~0,53 ммоль/мин, а затем снизилось до ~0,31 ммоль/мин, предположительно, в результате дальнейшего вымывания пантотената и тиамина из реактора. Тем не менее, в условиях постоянной концентрации питательных элементов и отсутствия других изменений в культуре поглощение H2 начало устойчиво возрастать и достигло ~0,5 ммоль/мин примерно в момент t=273 часа. Концентрация этанола и кислоты и не оставались постоянными и колебались в районе 25 г/л и 1,1-2,4 г/л, соответственно. Поглощение СО оставалось постоянным на уровне 3,2 ммоль/мин, а плотность клеток оставалась почти постоянной на уровне 2,8-3,0 г/л.
Когда в начале эксперимента концентрация тиамина в среде была снижена с 0,0175 части на миллион до 0,0105 части на миллион, это оказало почти немедленное воздействие на параметры культуры, что означало, что концентрация тиамина 0,0175 части на миллион уже являлась близкой к предельной. Были вычислены следующие параметры, которые использовали, чтобы лучше соотнести добавление питательных элементов с продуктивностью культуры до снижения концентрация тиамина до 0,0105 части на миллион. Количество добавленного тиамина составляло ~0,0041 мкг на ммоль поглощаемого газа. Количество добавленного тиамина составляло ~6,5 мкг на грамм образовавшихся клеток. Дополнительным подтверждением того, что предельной концентрацией тиамина действительно является 0,0105 части на миллион, стало немедленное улучшение параметров культуры, когда содержание тиамина в реакторе было временно увеличено до 0,0175 части на миллион.
Хотя рассмотренное изобретение описано со ссылкой на конкретные варианты его осуществления, примеры и применения, специалисты в данной области техники могут внести в него множество модификаций и изменений, не выходящих за пределы его объема согласно формуле изобретения.
Группа изобретений относится к среде для ферментации синтез-газа и способу ферментации синтез-газа. Среда для ферментации синтез-газа содержит от 546 до 838 частей на миллион ионов NH4+, от 31,8 до 279 частей на миллион ионов фосфора, от 39,3 до 118 частей на миллион ионов калия, от 8,4 до 16,8 частей на миллион ионов железа, от 14,8 до 59,8 частей на миллион ионов магния, и 250 частей на миллион цистеина HCl, при этом среда для ферментации содержит менее чем 0,025 части на миллион ионов бора, менее чем 0,0025 части на миллион ионов марганца, менее чем 0,001 части на миллион ионов молибдена и менее чем 0,01 части на миллион ионов меди. Способ ферментации синтез-газа с использованием ацетогенных бактерий предусматривает ферментацию синтез-газа в указанной ферментационной среде. Изобретение обеспечивает удельный выход продукта за один проход в единицу (STY) по меньшей мере 1 грамма этанола/(л⋅сутки⋅грамм клеток). 2 н. и 15 з.п. ф-лы, 10 табл., 10 пр.
1. Среда для ферментации синтез-газа, содержащая:
от 546 до 838 частей на миллион ионов NH4+;
от 31,8 до 279 частей на миллион ионов фосфора;
от 39,3 до 118 частей на миллион ионов калия;
от 8,4 до 16,8 частей на миллион ионов железа;
от 14,8 до 59,8 частей на миллион ионов магния; и
250 частей на миллион цистеина HCl,
при этом среда для ферментации содержит менее чем 0,025 части на миллион ионов бора, менее чем 0,0025 части на миллион ионов марганца, менее чем 0,001 части на миллион ионов молибдена и менее чем 0,01 части на миллион ионов меди.
2. Среда для ферментации по п.1, в которой используют ионы азота из источника азота, выбранного из группы, включающей хлорид аммония, фосфат аммония, сульфат аммония, нитрат аммония и их смеси, используют ионы фосфора из источника фосфора, выбранного из группы, включающей фосфорную кислоту, фосфат аммония, фосфат калия и их смеси, используют ионы калия из источника калия, выбранного из группы, включающей хлорид калия, фосфат калия, нитрат калия, сульфат калия и их смеси, используют ионы железа из источника железа, выбранного из группы, включающей хлорид железа, сульфат железа и их смеси, и используют ионы магния из источника магния, выбранного из группы, включающей хлорид магния, сульфат магния, фосфат магния.
3. Среда для ферментации по п.1, содержащая одно или несколько из следующего:
1,12 частей на миллион ионов вольфрама,
от 0,099 до 0,198 частей на миллион ионов никеля,
от 0,0991 до 0,991 частей на миллион ионов кобальта,
от 0,03 до 0,1 частей на миллион тиамина.
4. Среда для ферментации по п.3, в которой используют ионы вольфрама из источника вольфрама, выбранного из группы, включающей вольфрамат натрия, вольфрамат кальция, вольфрамат калия и их смеси, используют ионы никеля из источника никеля, выбранного из группы, включающей хлорид никеля, сульфат никеля, нитрат никеля и их смеси, используют ионы кобальта из источника кобальта, выбранного из группы, включающей хлорид кобальта, фторид кобальта, бромид кобальта, йодид кобальта и их смеси.
5. Среда для ферментации по п.1, имеющая рН от 4,2 до 4,8.
6. Способ ферментации синтез-газа с использованием ацетогенных бактерий, включающий ферментацию синтез-газа в ферментационной среде и обеспечивающий удельный выход продукта за один проход в единицу (STY) по меньшей мере 1 грамма этанола/(л·сутки·грамм клеток), при этом среда для ферментации содержит
от 546 до 838 частей на миллион ионов NH4+;
от 31,8 до 279 частей на миллион ионов фосфора;
от 39,3 до 118 частей на миллион ионов калия;
от 8,4 до 16,8 частей на миллион ионов железа;
от 14,8 до 59,8 частей на миллион ионов магния; и
250 частей на миллион цистеина HCl,
при этом среда для ферментации содержит менее чем 0,025 части на миллион ионов бора, менее чем 0,0025 части на миллион ионов марганца, менее чем 0,001 части на миллион ионов молибдена и менее чем 0,01 части на миллион ионов меди.
7. Способ ферментации по п.6, в котором используют ионы азота из источника азота, выбранного из группы, включающей хлорид аммония, фосфат аммония, сульфат аммония, нитрат аммония и их смеси, используют ионы фосфора из источника фосфора, выбранного из группы, включающей фосфорную кислоту, фосфат аммония, фосфат калия и их смеси, используют ионы калия из источника калия, выбранного из группы, включающей хлорид калия, фосфат калия, нитрат калия, сульфат калия и их смеси, используют ионы железа из источника железа, выбранного из группы, включающей хлорид железа, сульфат железа и их смеси и используют ионы магния из источника магния, выбранного из группы, включающей хлорид магния, сульфат магния, фосфат магния.
8. Способ ферментации по п.6, в котором среда для ферментации содержит одно или несколько из следующего:
1,12 частей на миллион ионов вольфрама,
от 0,099 до 0,198 частей на миллион ионов никеля,
от 0,0991 до 0,991 частей на миллион ионов кобальта,
от 0,03 до 0,1 частей на миллион тиамина.
9. Способ ферментации по п.8, в котором используют ионы вольфрама из источника вольфрама, выбранного из группы, включающей вольфрамат натрия, вольфрамат кальция, вольфрамат калия и их смеси, используют ионы никеля из источника никеля, выбранного из группы, включающей хлорид никеля, сульфат никеля, нитрат никеля и их смеси, и используют ионы кобальта из источника кобальта, выбранного из группы, включающей хлорид кобальта, фторид кобальта, бромид кобальта, йодид кобальта и их смеси.
10. Способ ферментации по п. 6, в котором поддерживают рН ферментационной среды в интервале от около 4,2 до около 4,8.
11. Способ ферментации по п.6, в котором синтез-газ имеет соотношение СО/СО2 по меньшей мере 0,75.
12. Способ ферментации по п.6, в котором ферментация включает введение синтез-газа в контакт с одной или несколькими ацетогенными бактериями.
13. Способ ферментации по п.12, в котором ацетогенные бактерии выбирают из группы, включающей Acetogenium kivui, Acetoanaerobium noterae, Acetobacterium woodii, Alkalibaculum bacchi СР11 (ATCC BAA-1772), Blautia producta, Butyribacterium methylotrophicum, Caldanaerobacter subterraneous, Caldanaerobacter subterraneous pacificus, Carboxydothermus hydrogenoformans, Clostridium aceticum, Clostridium acetobutylicum, Clostridium acetobutylicum P262 (DSM 19630, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 19630, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 10061, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 23693, депонирована в DSMZ, Германия), Clostridium autoethanogenum (DSM 24138, депонирована в DSMZ, Германия), Clostridium carboxidivorans P7 (ATCC PTA-7827), Clostridium coskatii (ATCC РТА-10522), Clostridium drakei, Clostridium ljungdahlii PETC (ATCC 49587), Clostridium ljungdahlii ERI2 (ATCC 55380), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii O-52 (ATCC 55889), Clostridium magnum, Clostridium pasteurianum (DSM 525, депонирована в DSMZ, Германия), Clostridium ragsdali P11 (ATCC BAA-622), Clostridium scatologenes, Clostridium thermoaceticum, Clostridium ultunense, Desulfotomaculum kuznetsovii, Eubacterium limosum, Geobacter cepareducens, Methanosarcina acetivorans, Methanosarcina barkeri, Morrella thermoacetica, Morrella thermoautotrophica, Oxobacter pfennigii, Peptostreptococcus productus, Ruminococcus productus, Thermoanaerobacter kivui и их смеси.
14. Способ ферментации по п.6, в котором способ обеспечивает плотность клеток по меньшей мере 1,0 г/л.
15. Способ ферментации по п.6, в котором способ обеспечивает конверсию СО по меньшей мере от 5 до 99%.
16. Способ ферментации по п.6, в котором среда для ферментации содержит менее чем 0,01 г/л дрожжевого экстракта.
17. Способ ферментации по п.6, в котором среда для ферментации содержит менее чем 0,01 г/л углеводов.
| WO 2009114127 А1, 17.09.2009 | |||
| WO 2002008438 A2, 31.01.2002 | |||
| WO 2009022925 A1, 19.02.2009 | |||
| ОГРАНИЧИТЕЛЬ ЭЛЕКТРИЧЕСКОГО ТОКА | 1926 |
|
SU6106A1 |
Авторы
Даты
2017-12-21—Публикация
2013-05-15—Подача