Изобретение относится к медицине, в частности к нейрофизиологии и психофизиологии, для изучения механизмов деятельности мозга в формировании различных физиологических состояний организма, для выявления структур и эндогенных веществ, участвующих в различной деятельности мозга. Изобретение может быть использовано в нейрофизиологических, психофизиологических, фармакологических, биохимических исследованиях и в молекулярной биологии.
В современной нейрофизиологии и нейрохирургии существуют и широко используются два отдельных, независимых друг от друга метода введения и извлечения веществ из мозга.
Первый метод предназначен только для введения различных биологически активных веществ в отдельные структуры мозга с дальнейшей оценкой их физиологических эффектов. С помощью стереотаксических координат вводят тонкую канюлю в определенную структуру мозга, заполненную биологически активным веществом, которое под действием гидростатического давления выводят в структуру мозга. Этот метод введения под давлением микроскопических количеств растворов в ткань с помощью тонкой иглы или канюли получил название - микроинъекция (1). Во время введения веществ животное фиксировано или ограничено в движении, поскольку давление для микроинъекции передается от шприца через тонкую трубку к канюле, фиксированной на голове животного.
Наряду с этим методом, существует метод микроионофореза (2, 3, 4), при котором биологически активные вещества, например ацетилхолин, норадреналин и др., находящиеся в ионизированном виде в многоканальном микроэлектроде, выводятся к клеткам мозга с помощью постоянного тока.
Данные методы ориентированы только на введение веществ в структуру мозга. Они не позволяет извлекать из структуры мозга эндогенные вещества и вводить их в другую структуру мозга того же или другого индивидуума.
Второй метод, получивший название - тканевой микродиализ, предназначен для забора эндогенных веществ из межклеточной жидкости in vivo и анализа их содержания. Delgado J.M. et al. (5) в 1972 году описали применение стеклянных катетеров для взятия проб внеклеточной жидкости, послужившее прототипом современного микродиализа. Urgenstedt U. и Pycock C. (6) опубликовали аналогичную методику, которая получила дальнейшее развитие и привела к созданию тканевого микродиализа в современном виде (7-10).
Для извлечения различных эндогенных веществ из структур мозга используются тонкие канюли, которые стереотаксическим методом вводятся в исследуемую структуру мозга. Для забора тканевых веществ внутрь канюли вводят катетер, на конце которого имеется полунепроницаемая мембрана, через которую из ткани, за счет градиента концентрации, происходит диффузия эндогенных веществ в диализную жидкость, циркулирующую внутри катетера. Непрерывное обновление раствора в области мембраны поддерживает трансмембранный градиент концентрации.
Катетер для микродиализа представляет собой двуполостную концентрическую полиуретановую трубочку с наружным диаметром 1 мм, конечный отдел которой представлен полунепроницаемой мембраной (стандартной длиной 10 мм). К катетеру подключают специальный инфузионный насос с раствором, близким по электролитному составу к тканевой жидкости.
Проницаемость мембраны для большинства веществ определяется размером ее пор (membrane cut-off size). Типовые катетеры имеют поры размером 20 килодальтон (катетер СМА70, для определения небольших молекул, ионов, аминокислот) и 100 килодальтон (катетер СМА71 позволяет дополнительное извлечение небольших белков и цитокинов). Раствор, содержащий извлеченные вещества, накапливается в микроампуле объемом 200 микролитров.
В собранной диализной жидкости определяют содержание и концентрацию различных веществ при помощи анализатора (жидкостная хроматография, масс-спектроскопия и т.п.).
Концентрация вещества в диализате никогда не соответствует его концентрации в тканевой жидкости. Извлекаемое количество - это часть истинной внеклеточной концентрации вещества, находящегося в ткани.
При стандартных длине мембраны (10 мм) и скорости перфузии (0.3 микролитра/мин) относительное извлечение составляет 70% от истинной концентрации (11).
Таким образом, концентрация веществ, содержащихся в диализате, не равна истинному содержанию веществ в тканевой жидкости. Она зависит от скорости перфузии диализной жидкости и свойств полупроницаемых мембран, которые в соответствии с проницаемостью, ограничивают выход веществ в диализную жидкость, и поэтому в диализной жидкости не представлены все вещества, присутствующие в ткани мозга.
Метод микродиализа ориентирован только на забор эндогенных веществ из ткани и не позволяет выводить извлеченные из ткани вещества в другую (ие) структуру мозга.
Во время микродиализа животное фиксировано или ограничено в движении, поскольку катетер для микродиализа, фиксированный на голове, соединен через тонкую трубку с инфузионным насосом.
Указанные методы имеют разные назначения и не позволяют:
- извлечь эндогенные вещества из исследуемой структуры мозга и ввести их в другую структуру мозга;
- проводить исследования в свободном поведении животных, т.к. имеются соединения канюль, находящихся в мозге, с внешними устройствами в виде проводов, трубок и пр.;
- извлечь и определить истинное содержание эндогенных веществ в структурах мозга при различных физиологических состояниях.
Таким образом, ни один из существующих методов не позволяет извлекать из структур мозга эндогенные вещества и переносить их в другие структуры мозга одного или нескольких индивидуумов. Каждый из указанных методов не является прототипом заявленного изобретения.
Целью является разработка и создание принципиально новой технологии извлечения эндогенных веществ из отдельных микроструктур мозга и последующего выведения их в другие структуры мозга при различных состояниях экспериментальных животных, в условиях свободного поведения, для определения физиологической роли эндогенных веществ в деятельности мозга и их химического анализа.
Способ для забора эндогенных веществ из одной структуры мозга и для последующего введения их в другую структуру мозга
Заявленный способ для забора эндогенных веществ из отдельных микроструктур мозга и последующего введения их в другие микроструктуры основан на том, что (единый) один и тот же универсальной капилляр сначала используют для извлечения за счет существующих капиллярных сил, эндогенных веществ, находящихся в определенной структуре мозга, а затем этот же капилляр используют для выведения из него забранных веществ в другую структуру мозга путем повышения давления в капилляре при нагревании лазерным лучом его замкнутой полости, находящейся снаружи.
Устройство для забора эндогенных веществ из одной структуры мозга и для последующего введения их в другую структуру мозга
Предлагаемое устройство (фиг. 1, 2) состоит из:
- тонкой направляющей канюли, в диаметре не более 1 мм, по длине соответствующей глубине погружения ее в мозг (1), изготовленной из биологически инертного полимера или металла;
- мандрена, соответствующего канюли по длине и внутреннему диаметру и размещаемого в каждой канюле с возможностью продольного перемещения в ней (2), изготовленного из биологически инертного полимера или металлической проволоки;
- единого универсального капилляра (3) для микрозабора и выведения веществ, равного по диаметру мандрену и заменяющего его в канюле, изготовленного из биологически инертного полимера, который имеет открытые с обоих концов отверстия (4) для сообщения с атмосферой при заборе веществ и закрытое внешнее отверстие (4) при выведении веществ;
- лазера, мощностью 500-3000 мВт, для дистанционного нагрева в пределах 1 м полости в наружной части капилляра (5).
Способ микрозабора эндогенных веществ из одной структуры и выведения их в другую структуру мозга у нефиксированных (свободных) животных характеризуется тем, что предварительно по стереотаксическим координатам вживляют в структуры мозга и фиксируют на голове определенное количество канюль с мандренами, длина которых равна глубине погружения их в мозг; затем для микрозабора веществ из канюли вынимают мандрен и помещают вместо него капилляр на необходимое время для заполнения его эндогенными веществами под действием капиллярных сил; далее этот капилляр извлекают из канюли и в нее вставляют мандрен; у извлеченного капилляра герметизируют внешнее отверстие, не имевшее контакта с мозгом; затем для выведения веществ, содержащихся в капилляре, из канюли, находящейся в другой структуре мозга, вынимают мандрен и вставляют в нее капилляр с эндогенными веществами; направляют лазерный луч мощностью 500-3000 мВт на внешний герметичный конец капилляра для теплового расширения воздуха внутри него, повышения давления и полного выведения веществ; далее капилляр извлекают и в эту канюлю вместо него вставляют мандрен.
Устройство для микрозабора эндогенных веществ из одной структуры мозга и последующего введения их в другую структуру мозга животных в свободном поведении характеризуется тем, что включает не менее 2-х (несколько) направляющих тонких канюль с внешним диаметром не более 1 мм и длиной, равной глубине погружения их в конкретную структуру мозга; мандрены, соответствующие канюлям по длине и внутреннему диаметру и размещаемые в каждой канюле с возможностью продольного перемещения в них; капилляры, открытые с обоих концов, равные по диаметру мандренам и заменяющие их в канюлях, а также лазер мощностью 500-3000 мВт.
Способ и устройство поясняется следующими чертежами.
Фиг. 1. Схема расположения канюли и мандрена, находящихся в структуре мозга, до забора в капилляр эндогенных веществ из мозга, и приготовленного капилляра для введения в канюлю, где цифрами обозначены следующие позиции: 1 - канюля, 2 - мандрен, 3 - капилляр, 4 - наружная часть капилляра 5 - лазер. Отверстие наружной части капилляра открыто.
Фиг. 2. Схема расположения канюли и капилляра, находящихся в структуре мозга во время забора в капилляр эндогенных веществ из мозга, и мандрена, удаленного из канюли (цифрами обозначены те же позиции). Отверстие наружной, не обращенной в мозг части капилляра закрыто.
Способ осуществляют следующим образом.
Для проведения исследования заранее изготавливают две одинаковые канюли, соответствующие им мандрены и капилляры необходимой длины и диаметра, для погружения их в определенные структуры мозга, одна из которых выбрана для забора веществ, другая - для выведения веществ.
Канюли, мандрены и капилляры могут быть изготовлены из стекла или биологически инертного полимера растягиванием до нужного диаметра при нагревании. Внешний конец капилляра имеет расширение, заканчивающееся отверстием. Внутренний конец капилляра - открытый кончик, обращенный в мозг, может быть растянут до необходимых микронных размеров в диаметре.
Предварительно под наркозом с помощью стереотаксической техники вживляют приготовленные канюли с мандреном в структуры мозга, из которых будут извлекаться вещества и в которые будут выводиться эти вещества.
Суть способа заключается в следующем: через вживленную в мозг тонкую канюлю, диаметром 0,3-1 мм, и находящийся внутри канюли микрокапилляр, соответствующий ее внутреннему диаметру, производят забор из определенной структуры мозга эндогенных веществ в микрокапилляр. Вхождение жидкости с эндогенными веществами в микрокапилляр происходит за счет капиллярных сил поверхностного натяжения.
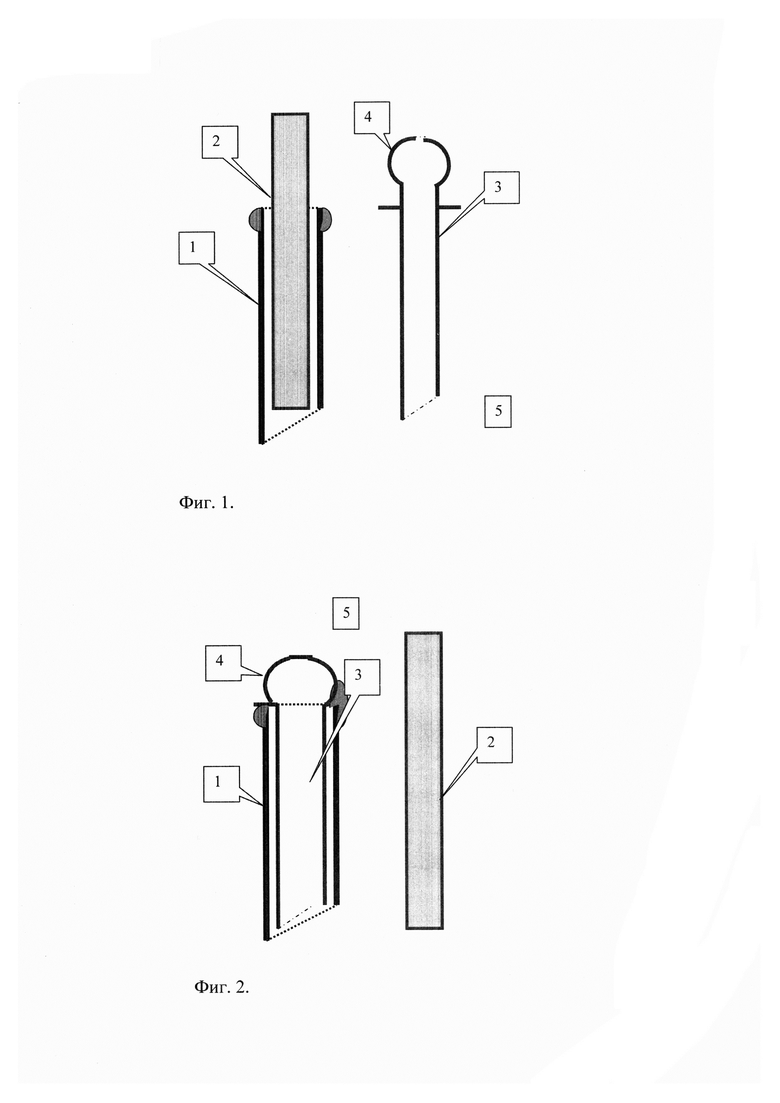
Высота капиллярного подъема определяется по формуле Жюрена:
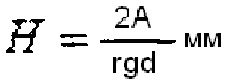 ,
,
где Н - высота поднятия воды, мм;
А - коэффициент поверхностного натяжения;
r - радиус капилляра, мм;
g - ускорение силы тяжести, м/сек;
d - плотность воды при данной температуре, г/ см3.
Из формулы следует, что жидкость по капиллярам поднимается тем выше, чем больше ее поверхностное натяжение, меньше диаметр капилляра и ниже плотность. Поверхностное натяжение тканевой жидкости, плазмы близко к величине поверхностного натяжения воды.
Важно отметить, что концентрация всех веществ, находящихся в микрокапилляре, эквивалента содержанию их в исследуемой структуре мозга.
Затем микрокапилляр с его содержимым вынимают из канюли и вставляют для выведения веществ в другую канюлю, находящуюся в структуре мозга этого же индивидуума или иного индивидуума. Для выведения веществ из капилляра в структуру мозга предварительно запаивают (заклеивают) отверстие в верхней, обращенной наружу части капилляра. Выведение веществ в структуру мозга из микрокапилляра происходит за счет теплового расширения воздуха в герметичной верхней полости капилляра при нагреве ее на 40-50 град с помощь дистанционного действия лазера. Свободные от капилляров канюли закрывают мандренами и в закрытом виде сохраняют эти канюли для повторных неоднократных экспериментов.
Зная объем микрокапилляра, можно рассчитать и увидеть с помощью микроскопа объем жидкости, находящейся в микрокапилляре, до и после введения ее в выбранную структуру мозга.
Во время выведения веществ и после того, как микродоза эндогенных веществ выведена в выбранную структуру мозга, исследователь наблюдает и регистрирует различные проявления поведенческих, вегетативных и др. реакций индивидуума в тех или иных экспериментальных моделях.
В зависимости от цели эксперимента проводят операции по вживлению канюль в разные структуры мозга - одни для взятия веществ, другие для выведения веществ в мозг, у одного животного или нескольких животных. Перенос веществ может быть из одной структуры мозга в другую структуру мозга одного и того же животного или из структуры мозга одного животного в структуру мозга другого животного.
Во время проведения эксперимента все животные могут находиться в свободном поведении, при этом полностью исключены какие-либо соединения их с помощью проводов, трубок и пр. с внешними устройствами.
В каждом конкретном эксперименте в зависимости от цели и задач используют различные по диаметру канюли и капилляры. Изменяя диаметр кончика капилляра, находящего внутри ткани мозга, можно избирательно забирать из структуры мозга более или менее крупные эндогенные вещества.
Собрав необходимое количество эндогенных веществ, содержащихся в микрокапиллярах, можно провести химический анализ с помощью жидкостной хроматографии, масс-спектроскопии и др. так, как это проводится при микродиализе.
Преимущества способа и устройства:
- позволяют извлечь эндогенные вещества из одной структуры мозга и перенести их в другую структуру мозга;
- позволяют изучить роль эндогенных веществ в отдельных структурах мозга при формировании эмоционально-мотивационных состояний, памяти и пр. форм деятельности мозга.
- позволяют проводить исследование эндогенных веществ в отдельных структурах мозга в условиях свободного поведения животных;
- позволяют определить истинное содержание эндогенных веществ с помощью современных аналитических методов в структурах мозга при различных физиологических состояниях животных. Разработанные способ и устройство для микрообмена эндогенными веществами между отдельными структурами мозга могут быть использованы для изучения роли разных структур мозга и выявления участия биологически активных веществ в формировании различных эмоционально-мотивационных состояний и патологических процессов, определения химической структуры эндогенных веществ.
Литература
1. Poland, R.S., Bull, С., Syed, W.A., Bowers, М.S. Rodent Brain Microinjection to Study Molecular Substrates of Motivated Behavior. 2015. J. Vis. Exp. (103), e53018, doi: 10.3791/53018 http://www.jove.com/video/53018/-?language=Russian
2. Юматов E.A., Фадеев Ю.А. Микроинофорез. 1971. Ежегодник БМЭ, с. 511-516.
3. Юматов Е.А. Методика фиксации ненаркотизированных крыс для микроэлектродного и микроионофоретического исследования мозга. 1980. Ж. Высш. Нерв. Деятел., т. 30, №6, с. 429-430.
4. Юматов Е.А., Кияткин Е.А. Методика микроионофоретического исследования нейронов у крыс в условиях свободного поведения. 1981. Ж. Высш. Нерв. Деятел., т. 31, №4, с. 878-882.
5. Delgado JM, DeFeudis FV, Roth RH, Ryugo DK, Mitruka BM. Dialytrode for long term intracerebral perfusion in awake monkeys. 1972. Arch Int. Pharmacodyn. Ther. 198(1), p. 9-21.
6. Ungerstedt U, Pycock C. 1974. Functional correlates of dopamine neurotransmission. Bull Schweiz. Akad. Med. Wiss. 30(1-3), p. 44-55.
7. Микродиализ. http://www.science-pribor.ru/Upload/files/CMA_Booklet2012.pdf
8. Lonnroth P, Jansson PA, Smith U. A microdialysis method allowing characterization of intercellular water space in humans. 1987. Am. J. Physiol. 253(2 Pt 1), p. E228-31.
9. Тканевой микродиализ, http://www.neuromonitoring.ru/tkanevoie-mikrodializ.html
10. Садыков А.М., Корабаев Р.С., Адильбеков Е.Б. Применение микродиализа головного мозга в нейрохирургии. Ж. Нейрохирургия и неврология Казахстана. 2013, №4(33), с. 31-35.
11. Hutchinson PJ, O'Connell МТ, al-Rawi PG, Kett-White R, Gupta AK, Kirkpatrick PJ, Pickard JD. Clinical cerebral microdialysis-determining the true extracellular concentration. 2002. Acta Neurochir. Suppl. №81, p. 359-62.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ канюлизации ликворных пространств головного мозга | 1989 |
|
SU1731231A1 |
| Способ моделирования смерти головного мозга в эксперименте | 2023 |
|
RU2798902C1 |
| Устройство, комплект и способ для введения трансплантата в костный регенерат | 2020 |
|
RU2741206C1 |
| Способ моделирования геморрагического инсульта у крыс | 2019 |
|
RU2721289C1 |
| Способ замедленного введения жидкости в организм животного и устройство для его осуществления | 1990 |
|
SU1783982A3 |
| СПОСОБ И УСТРОЙСТВО "СИМБИОТИЧЕСКОЙ" ГЕМОФИЛЬТРАЦИИ ДЛЯ КОМПЕНСАЦИИ ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ | 2015 |
|
RU2589658C2 |
| КОМПЛЕКТ ДЛЯ НЕФРОВЕЗИКУЛЯРНОГО ШУНТИРОВАНИЯ | 2022 |
|
RU2800305C1 |
| Способ стереотаксического доступа к мозговым структурам | 1977 |
|
SU1144697A1 |
| СТЕРЕОТАКСИЧЕСКИЙ СПОСОБ ЛОКАЛЬНОЙ ДЕСТРУКЦИИ ФУНКЦИОНАЛЬНО ЗНАЧИМЫХ СТРУКТУР ГОЛОВНОГО МОЗГА | 2000 |
|
RU2164787C1 |
| СПОСОБ ПРОБУЖДЕНИЯ ЧЕЛОВЕКА В ФИКСИРОВАННУЮ ФАЗУ СНА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1993 |
|
RU2061406C1 |
Группа изобретений относится к медицине, в частности к нейрофизиологии и психофизиологии, и касается микрозабора эндогенных веществ из одной структуры и последующего выведения их в другую структуру мозга. Способ микрозабора осуществляют у нефиксированных животных в условиях их свободного поведения. При этом предварительно по стереотаксическим координатам вживляют в структуры мозга и фиксируют на голове не менее 2-х канюль с мандренами с внешним диаметром канюль не более 1 мм и длиной, равной глубине погружения их в мозг. Затем для микрозабора веществ из канюли вынимают мандрен и помещают вместо него капилляр на необходимое время для заполнения его эндогенными веществами под действием капиллярных сил поверхностного натяжения. Далее этот капилляр извлекают из канюли и в нее вставляют мандрен. У извлеченного капилляра герметизируют внешнее отверстие, не имевшее контакта с мозгом. Затем для выведения веществ, содержащихся в капилляре, из канюли, находящейся в другой структуре мозга того же индивидуума или в структуре мозга другого индивидуума, вынимают мандрен и вставляют в нее капилляр с эндогенными веществами. Направляют луч лазера, дистанционно расположенного в пределах 1 м, мощностью 500-3000 мВт на внешний герметичный конец капилляра для нагревания полости капилляра до 40-50 градусов с целью теплового расширения воздуха внутри него, повышения давления и полного выведения веществ. Далее капилляр извлекают и в эту канюлю вместо него вставляют мандрен. Предложен также комплект для осуществления способа. Он включает не менее 2-х направляющих тонких канюль с внешним диаметром не более 1 мм и длиной, равной глубине погружения их в конкретную структуру мозга. Включает также мандрены, соответствующие канюлям по длине и внутреннему диаметру, для размещения в каждой канюле с возможностью продольного перемещения в них. Комплект включает также капилляры, открытые с обоих концов, равные по диаметру мандренам и замещающие их в канюлях. В комплекте содержится лазер мощностью 500-3000 мВт. Изобретения позволяют изучать роль разных структур мозга и выявлять эндогенные вещества, участвующие в формировании различных эмоционально-мотивационных состояний и патологических процессов у нефиксированных животных в условиях их свободного поведения. 2 н.п. ф-лы, 2 ил.
1. Способ микрозабора эндогенных веществ из одной структуры и введения их в другую структуру мозга у нефиксированных животных в условиях их свободного поведения, характеризующийся тем, что предварительно по стереотаксическим координатам вживляют в структуры мозга и фиксируют на голове не менее 2-х канюль с мандренами с внешним диаметром канюль не более 1 мм и длиной, равной глубине погружения их в мозг; затем для микрозабора веществ из канюли вынимают мандрен и помещают вместо него капилляр на необходимое время для заполнения его эндогенными веществами под действием капиллярных сил поверхностного натяжения; далее этот капилляр извлекают из канюли и в нее вставляют мандрен; у извлеченного капилляра герметизируют внешнее отверстие, не имевшее контакта с мозгом; затем для выведения веществ, содержащихся в капилляре, из канюли, находящейся в другой структуре мозга того же индивидуума или в структуре мозга другого индивидуума, вынимают мандрен и вставляют в нее капилляр с эндогенными веществами; направляют луч лазера, дистанционно расположенного в пределах 1 м, мощностью 500-3000 мВт на внешний герметичный конец капилляра для нагревания полости капилляра до 40-50 градусов с целью теплового расширения воздуха внутри него, повышения давления и полного выведения веществ; далее капилляр извлекают и в эту канюлю вместо него вставляют мандрен.
2. Комплект для осуществления способа по п. 1, характеризующийся тем, что включает не менее 2-х направляющих тонких канюль с внешним диаметром не более 1 мм и длиной, равной глубине погружения их в конкретную структуру мозга; мандрены, соответствующие канюлям по длине и внутреннему диаметру для размещения в каждой канюле с возможностью продольного перемещения в них; капилляры, открытые с обоих концов, равные по диаметру мандренам и заменяющие их в канюлях, а также лазер мощностью 500-3000 мВт.
| ТИМОФЕЕВ И.С | |||
| Тканевой микродиализ: принципы и клиническое применение метода в интенсивной терапии | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАЧАЛЬНОЙ ФУНКЦИИ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА В РАННЕМ ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ | 2013 |
|
RU2523663C1 |
| КАТЕТЕР ДЛЯ ОБМЕНА ТЕКУЧЕЙ СРЕДОЙ И СПОСОБ РАЗБЛОКИРОВАНИЯ КАТЕТЕРА ДЛЯ ОБМЕНА ТЕКУЧЕЙ СРЕДОЙ | 2013 |
|
RU2604714C2 |
| СИСТЕМА КАТЕТЕРА ГИДРОДИНАМИЧЕСКОГО ОБМЕНА | 2006 |
|
RU2449810C2 |
| CN 1911186 A, 14.02.2007 | |||
| US 20070287952 A1, 13.12.2007 | |||
| LONNROTH P | |||
| et al | |||
| A microdialysis method allowing characterization of intercellular water space in humans | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Am | |||
| J | |||
| Physiol | |||
| Прибор для измерения угла наклона | 1921 |
|
SU253A1 |
| Приспособление для нагрузки тендеров дровами | 1920 |
|
SU228A1 |
| ROSSELL S | |||
| et al | |||
| One-second time resolution brain microdialysis in fully awake rats | |||
| Protocol for the collection, separation and sorting of nanoliter dialysate volumes J Chromatogr B Analyt Technol Biomed Life Sci | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2018-01-24—Публикация
2017-01-17—Подача