Родственные заявки
[0001] Настоящая заявка испрашивает приоритет по заявке на патент США № 14/524832, поданной 27 октября 2014 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
Включение списка последовательностей
[0002] Содержимое текстового файла с названием «INHI002002WO_SeqList.txt», созданного 26 октября 2015 г., размером 228 Кбайт включено в настоящую заявку в полном объеме посредством ссылки.
Область техники, к которой относится изобретение
[0003] Настоящее изобретение относится к молекулам, в частности, к полипептидам, конкретнее, к слитым белкам, которые содержат серпиновый полипептид или аминокислотную последовательность, получаемую из серпиновых полипептидов, и второй полипептид. Дополнительно настоящее изобретение относится к слитым белкам, которые содержат серпиновый полипептид или аминокислотную последовательность, получаемую из серпиновых полипептидов, второй полипептид и третий полипептид. В частности, настоящее изобретение относится к слитым белкам, которые содержат по меньшей мере один серпиновый полипептид и второй полипептид, или к слитым белкам, которые содержат по меньшей мере один серпиновый полипептид, второй полипептид и третий полипептид, где второй и третий полипептид слитых белков настоящего изобретения может быть по меньшей мере одним из следующих: полипептидом Fc или аминокислотной последовательностью, получаемой из полипептида Fc; действующим на цитокины полипептидом, или последовательностью, получаемой действующего на цитокины полипептида; полипептидом, содержащим домен WAP, или последовательностью, получаемой из полипептида, содержащего домен WAP; или альбуминовым полипептидом или аминокислотной последовательностью, получаемой из полипептида сывороточного альбумина. Настоящее изобретение также относится к способам применения таких молекул по ряду терапевтических и диагностических показаний, а также к способам получения таких молекул.
Уровень техники
[0004] Нарушенная активность сериновых протеаз или нарушенный баланс протеазы и ингибитора протеазы могут привести к вызванному протеазой разрушению ткани и воспалительному ответу. Соответственно, существует необходимость в лекарственных средствах и способах терапии, действующих на нарушенную активность сериновых протеаз и/или на нарушенный баланс протеазы и ингибитора протеазы. Также терапевтический эффект может быть повышен при аттенуации нарушенного цитокинового пути передачи сигнала и нарушенной активность сериновых протеаз. Дополнительно, было показано, что серпиновые белки обладают противоинфекционной активностью, в то время как действие на цитокины повышает риск развития инфекции. Слитые белки настоящего изобретения обладают способностью уменьшать активность воспалительных цитокинов и ограничивать риск развития инфекции.
Краткое содержание изобретения
[0005] Слитые белки, описанные в настоящем изобретении, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпинового полипептида (Полипептида 1), и второй полипептид (Полипептид 2). Дополнительно слитые белки, описанные в настоящей заявке, включают серпиновый полипептид или аминокислотную последовательность, получаемую из серпинового полипептида (Полипептида 1), второй полипептид (Полипептид 2) и третий полипептид (Полипептид 3). Как взаимозаменяемо применяют в настоящей заявке, термины «слитый белок» и «слитый полипептид» относятся к серпиновому полипептиду или к аминокислотной последовательности, получаемой из серпинового полипептида, функционально связанным по меньшей мере с одним вторым полипептидом или с аминокислотной последовательностью, получаемой по меньшей мере из второго полипептида. Отдельные элементы слитых белков могут быть связаны любым из множества способов, включая, например, прямое присоединение, использование промежуточного или спейсерного пептида, использование линкерного участка, использование шарнирного участка или использование как линкерного, так и шарнирного участков. В некоторых вариантах осуществления настоящего изобретения линкерный участок может быть частью последовательности шарнирного участка или, в качестве альтернативы, шарнирный участок может быть частью последовательности линкерного участка. Предпочтительно, чтобы линкерный участок был пептидной последовательностью. Например, линкерный пептид включает любое количество аминокислот от нуля до 40 аминокислот, например, от нуля до 35 аминокислот, от нуля до 30 аминокислот, от нуля до 25 аминокислот или от нуля до 20 аминокислот. Предпочтительно, чтобы шарнирный участок был пептидной последовательностью. Например, шарнирный пептид включает любое количество аминокислот от нуля до 75 аминокислот, например, от нуля до 70 аминокислот, от нуля до 65 аминокислот, от нуля до 62 аминокислот. В тех вариантах осуществления настоящего изобретения, в которых слитый белок включает как линкерный участок, так и шарнирный участок, предпочтительно, чтобы и линкерный участок, и шарнирный участок были пептидными последовательностями. В этих вариантах осуществления настоящего изобретения шарнирный пептид и линкерный пептид вместе включают любое количество аминокислот от нуля до 90 аминокислот, например, от нуля до 85 аминокислот или от нуля до 82 аминокислот.
[0006] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и второй полипептид могут быть соединены промежуточным связывающим белком. В некоторых вариантах осуществления настоящего изобретения серпиновая часть и часть второго полипептида в слитом белке могут быть соединены нековалентно.
[0007] В некоторых вариантах осуществления настоящего изобретения слитые белки в соответствии с настоящим изобретением могут иметь одну из следующих формул в направлении от N-конца к C-концу или в направлении от C-конца к N-концу:
Полипептид 1(a) -шарнирm - Полипептид 2(b)
Полипептид 1(a) -линкерn - Полипептид 2(b)
Полипептид 1(a) -линкерn - шарнирm - Полипептид 2(b)
Полипептид 1(a) -шарнирm - линкерn - Полипептид 2(b)
Полипептид 1(a) -Полипептид 2(b)- Полипептид 3(c)
Полипептид 1(a) -шарнирm - Полипептид 2(b)- шарнирm - Полипептид 3(c)
Полипептид 1(a) -линкерn - Полипептид 2(b)- линкерn - Полипептид 3(c)
Полипептид 1(a) -шарнирm - линкерn - Полипептид 2(b)- шарнирm - линкерn - Полипептид 3(c) Полипептид 1(a) -линкерn - шарнирm - Полипептид 2(b)- линкерn - шарнирm- Полипептид 3(c),
где n является целым числом от нуля до 20, где m является целым числом от 1 до 62 и где a, b и c являются целыми числами равными по меньшей мере 1. Эти варианты осуществления настоящего изобретения включают указанные выше формулы и любые их варианты и комбинации. Например, последовательность полипептидов в формуле также включает «Полипептид 3(c) -Полипептид 1(a)- Полипептид 2(b)», «Полипептид 2(b) -Полипептид 3(c)- Полипептид 1(a)», и любые их варианты и комбинации.
[0008] В некоторых вариантах осуществления настоящего изобретения последовательность Полипептида 1 включает серпиновый полипептид. Серпины представляют собой группу белков со схожей структурой, впервые идентифицированную как группу белков, способных ингибировать протеазы. Серпиновые белки, подходящие для применения в слитых белках, представленных в настоящей заявке, включают, но не ограничиваются, например, альфа-1-антитрипсином (AAT, alpha-1 antitrypsin), антитрипсин-родственным белком (SERPINA2), альфа-1-антихимотрипсином (SERPINA3), каллистатином (SERPINA4), ингибитором эластазы моноцитов/нейтрофилов (SERPINB1), PI-6 (SERPINB6), антитромбином (SERPINC1), ингибитором активатора плазминогена 1 (SERPINE1), альфа-2-антиплазмином (SERPINF2), ингибитором комплемента 1 (SERPING1) и нейросерпином (SERPINI1).
[0009] В некоторых вариантах осуществления настоящего изобретения последовательность Полипептида 1 включает полипептидную последовательность альфа-1 антитрипсина (AAT) или аминокислотную последовательность, получаемую из AAT. В некоторых вариантах осуществления настоящего изобретения последовательность Полипептида 1 включает часть белка AAT. В некоторых вариантах осуществления настоящего изобретения последовательность Полипептида 1 включает по меньшей мере часть петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения часть петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность: GTEAAGAMFLEAIPMSIPPEVKFNK SEQ ID NO:1).
[00010] В предпочтительном варианте осуществления настоящего изобретения полипептидная последовательность AAT или аминокислотная последовательность, получаемая из AAT, является полипептидной последовательностью человеческого AAT или происходит из полипептидной последовательности человеческого AAT.
[00011] В некоторых вариантах осуществления настоящего изобретения слитый белок включает полноразмерную полипептидную последовательность человеческого AAT со следующей аминокислотной последовательностью:
1 EDPQGDAAQK TDTSHHDQDH PTFNKITPNL AEFAFSLYRQ LAHQSNSTNI FFSPVSIATA
61 FAMLSLGTKA DTHDEILEGL NFNLTEIPEA QIHEGFQELL RTLNQPDSQL QLTTGNGLFL
121 SEGLKLVDKF LEDVKKLYHS EAFTVNFGDT EEAKKQINDY VEKGTQGKIV DLVKELDRDT
181 VFALVNYIFF KGKWERPFEV KDTEEEDFHV DQVTTVKVPM MKRLGMFNIQ HCKKLSSWVL
241 LMKYLGNATA IFFLPDEGKL QHLENELTHD IITKFLENED RRSASLHLPK LSITGTYDLK
301 SVLGQLGITK VFSNGADLSG VTEEAPLKLS KAVHKAVLTI DEKGTEAAGA MFLEAIPMSI
361 PPEVKFNKPF VFLMIEQNTK SPLFMGKVVN PTQK (SEQ ID NO: 2)
[00012] В некоторых вариантах осуществления настоящего изобретения слитый белок включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная аминокислотной последовательности SEQ ID NO: 2.
[00013] В некоторых вариантах осуществления настоящего изобретения полипептидная последовательность AAT или аминокислотная последовательность, получаемая из полипептида AAT, является или происходит из одной или более полипептидных последовательностей человеческого AAT с учетными номерами в GenBank AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
[00014] В некоторых вариантах осуществления настоящего изобретения слитые белки содержат одну или более мутаций. Например, слитый белок содержит по меньшей мере одну мутацию остатка метионина (Met) в серпиновой части слитого белка. При таких мутациях Met остаток Met может быть замещен любой аминокислотой. Например, остаток Met может быть замещен аминокислотой с гидрофобной боковой цепью, такой как, например, лейцин (Leu, L). Не желая быть связанными какой-либо теорией, авторы настоящего изобретения считают, что мутация (мутации) Met предотвращают окисление и последующую инактивацию ингибиторной активности слитых белков настоящего изобретения. В некоторых вариантах осуществления настоящего изобретения остаток Met может быть замещен заряженным остатком, таким как, например, глутамат (Glu, E). В некоторых вариантах осуществления настоящего изобретения мутация Met находится в положении 358 полипептида AAT. Например, мутация Met является Met358Leu (M358L). В некоторых вариантах осуществления настоящего изобретения мутация Met находится в положении 351 полипептида AAT. Например, мутация Met является Met351Glu (M351E). В некоторых вариантах осуществления настоящего изобретения мутации Met находятся в положениях 351 и 358 полипептида AAT, например, мутации Met являются Met351Glu (M351E) и Met358Leu (M358L). Например, петля реакционного центра такого варианта слитого полипептида AAT имеет следующую последовательность: GTEAAGAEFLEAIPLSIPPEVKFNK (SEQ ID NO: 32). В некоторых вариантах осуществления настоящего изобретения мутации Met находятся в положениях 351 и 358 полипептида AAT, например, мутации Met являются Met351Leu (M351L) и Met358Leu (M358L). Например, петля реакционного центра такого варианта слитого полипептида AAT имеет следующую последовательность: GTEAAGALFLEAIPLSIPPEVKFNK (SEQ ID NO: 33).
[00015] В некоторых вариантах осуществления настоящего изобретения слитый белок включает полноразмерную полипептидную последовательность человеческого AAT, содержащую вариант петли реакционного центра, модифицированный в положениях M351 и M358, со следующей аминокислотной последовательностью:
 [00016] В некоторых вариантах осуществления настоящего изобретения слитый белок включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная аминокислотной последовательности SEQ ID NO: 80.
[00016] В некоторых вариантах осуществления настоящего изобретения слитый белок включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная аминокислотной последовательности SEQ ID NO: 80.
[00017] В некоторых вариантах осуществления настоящего изобретения второй полипептид (Полипептид 2) серпинового слитого белка является полипептидом Fc или является полипептидом, получаемым из полипептида Fc. В настоящей заявке эти варианты осуществления настоящего изобретения объединяют под названием «слитые белки «серпин-Fc»». Слитые белки «серпин-Fc», описанные в настоящей заявке. Включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, и полипептид Fc или аминокислотную последовательность, получаемую из полипептида Fc. В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает единственный серпиновый полипептид. В других вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает несколько серпиновых полипептидов, и эти варианты осуществления настоящего изобретения объединяют под названием «слитые белки «серпин(a')-Fc»», где (a') является целым числом, равным по меньшей мере 2. В некоторых вариантах осуществления настоящего изобретения все серпиновые полипептиды в слитом белке «серпин(a')-Fc» имеют одинаковую аминокислотную последовательность. В других вариантах осуществления настоящего изобретения каждый серпиновый полипептид в слитом белке «серпин(a')-Fc» включает серпиновые полипептиды с разной аминокислотной последовательностью. Серпиновые полипептиды слитых белков «серпин(a')-Fc» могут располагаться в любом положении слитого белка.
[00018] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-Fc» включает по меньшей мере аминокислотную последовательность части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения часть петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-Fc» включает по меньшей мере аминокислотную последовательность варианта части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения вариант части петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-Fc» включает по меньшей мере полноразмерную полипептидную последовательность человеческого AAT с аминокислотной последовательностью SEQ ID NO: 2. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-Fc» включает по меньшей мере полноразмерную полипептидную последовательность человеческого AAT с аминокислотной последовательностью SEQ ID NO: 80. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-Fc» включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2 или 32, или 33, или 80.
[00019] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-Fc» включает полипептидную последовательность ААТ или аминокислотную последовательность, получаемую из полипептида AAT, которая является или происходит из одной или более полипептидных последовательностей человеческого AAT с учетными номерами в GenBank AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
[00020] В некоторых вариантах осуществления настоящего изобретения полипептид Fc слитого белка является полипептидом человеческого Fc, например, полипептидной последовательностью Fc человеческого IgG или аминокислотной последовательностью, получаемой из полипептидной последовательности Fc человеческого IgG. Например, в некоторых вариантах осуществления настоящего изобретения полипептид Fc является полипептидом Fc человеческого IgG1 или аминокислотной последовательностью, получаемой из полипептидной последовательности Fc человеческого IgG1. В некоторых вариантах осуществления настоящего изобретения полипептид Fc является полипептидом Fc человеческого IgG2 или аминокислотной последовательностью, получаемой из полипептидной последовательности Fc человеческого IgG2. В некоторых вариантах осуществления настоящего изобретения полипептид Fc является полипептидом Fc человеческого IgG3 или аминокислотной последовательностью, получаемой из полипептидной последовательности Fc человеческого IgG3. В некоторых вариантах осуществления настоящего изобретения полипептид Fc является полипептидом Fc человеческого IgG4 или аминокислотной последовательностью, получаемой из полипептидной последовательности Fc человеческого IgG4. В некоторых вариантах осуществления настоящего изобретения полипептид Fc является полипептидом Fc человеческого IgM или аминокислотной последовательностью, получаемой из полипептидной последовательности Fc человеческого IgM.
[00021] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG1 со следующей аминокислотной последовательностью:
1 APELLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVKFNWYVD GVEVHNAKTK
61 PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA PIEKTISKAK GQPREPQVYT
121 LPPSRDELTK NQVSLTCLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSKL
181 TVDKSRWQQG NVFSCSVMHE ALHNHYTQKS LSLSPGK (SEQ ID NO: 3)
[00022] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, слитый белок включает шарнирный участок, слитый с N-концом полипептида Fc слитого белка, где полипептид Fc включает полипептидную последовательность Fc человеческого IgG1 со следующей аминокислотной последовательностью:
1 DKTHTCPPCP APELLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVKFNWYVD
61 GVEVHNAKTK PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA PIEKTISKAK
121 GQPREPQVYT LPPSRDELTK NQVSLTCLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS
181 DGSFFLYSKL TVDKSRWQQG NVFSCSVMHE ALHNHYTQKS LSLSPGK (SEQ ID NO: 43)
[00023] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG1, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 3 или 43.
[00024] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc мутирован или модифицирован для усиления связывания FcRn. В таких вариантах осуществления настоящего изобретения мутированный или модифицированный полипептид Fc включает следующие мутации: Met252Tyr, Ser254Thr, Thr256Glu (M252Y, S256T, T256E) или Met428Leu и Asn434Ser (M428L, N434S), или Met428Val и Asn434Ser (M428V, N434S) с применением системы нумерации по Kabat. В некоторых вариантах осуществления настоящего изобретения мутированный или модифицированный полипептид Fc включает одну или более мутаций, выбранных из группы, состоящей из Met252Tyr (M252Y), Ser254Thr (S256T), Thr256Glu (T256E), Met428Leu (M428L), Met428Val (M428V), Asn434Ser (N434S) и их комбинаций. В некоторых вариантах осуществления настоящего изобретения часть полипептида Fc мутирована или по-другому модифицирована для предотвращения опосредованной Fc димеризации. В этих вариантах осуществления настоящего изобретения слитый белок является мономерным в природе.
[00025] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc мутирован или модифицирован. В некоторых вариантах осуществления настоящего изобретения мутированный или модифицированный полипептид Fc включает одну или более мутаций в положении, выбранном из M252, T246, M428 и их комбинаций. В некоторых вариантах осуществления настоящего изобретения мутированный или модифицированный полипептид Fc включает следующие мутации: Met252Ile, Thr256Asp, Met428Leu (M252I, T256D, M428L) с применением системы нумерации по Kabat.
[00026] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает мутации в положениях M252, T256 и M428, соответствующие остаткам 22, 26 и 198 SEQ ID NO: 3 или остаткам 32, 36 и 208 SEQ ID NO: 43, указанным выше, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00027] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает мутации в положениях M252, T256 и M428, соответствующие остаткам 22, 26, и 198 указанной выше SEQ ID NO: 3 или остаткам 32, 36 и 208 указанной выше SEQ ID NO: 43, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00028] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG1, в которой остаток G236, соответствующий остатку 6 SEQ ID NO: 3 или остатку 16 SEQ ID NO: 43, указанным выше, делетирован, и имеет следующую аминокислотную последовательность:
1 APELLGPSVF LFPPKPKDTL MISRTPEVTC VVVDVSHEDP EVKFNWYVDG VEVHNAKTKP
61 REEQYNSTYR VVSVLTVLHQ DWLNGKEYKC KVSNKALPAP IEKTISKAKG QPREPQVYTL
121 PPSRDELTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD GSFFLYSKLT
181 VDKSRWQQGN VFSCSVMHEA LHNHYTQKSL SLSPGK (SEQ ID NO: 46)
[00029] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG1, в которой остаток G236, соответствующий остатку 6 SEQ ID NO: 3 или остатку 16 SEQ ID NO: 43, указанным выше, делетирован, и слитый белок включает по меньшей мере следующую аминокислотную последовательность:
1 DKTHTCPPCP APELLGPSVF LFPPKPKDTL MISRTPEVTC VVVDVSHEDP EVKFNWYVDG
61 VEVHNAKTKP REEQYNSTYR VVSVLTVLHQ DWLNGKEYKC KVSNKALPAP IEKTISKAKG
121 QPREPQVYTL PPSRDELTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD
181 GSFFLYSKLT VDKSRWQQGN VFSCSVMHEA LHNHYTQKSL SLSPGK (SEQ ID NO: 47)
[00030] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает мутации остатков L234 и L235, соответствующих остаткам 4 и 5 SEQ ID NO: 3 или остаткам 14 и 15 указанной выше SEQ ID NO: 43, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00031] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает мутации остатков L234 и L235, соответствующих остаткам 4 и 5 SEQ ID NO: 3 или остаткам 14 и 15 SEQ ID NO: 43, указанным выше, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00032] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает делецию остатка G236 и мутации остатков L234 и L235, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00033] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает делецию остатка G236 и мутации остатков L234 и L235, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00034] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает делецию остатка G236 и мутации остатков L234, L235, M252, T256 и M428, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00035] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает делецию остатка G236 и мутации остатков L234, L235, M252, T256 и M428, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00036] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG1, модифицированный полипептид Fc IgG1 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG1, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 44, 45, 46, 47, 48, 49, 50, 51, 52 или 53.
[00037] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG2 со следующей аминокислотной последовательностью:
1 APPVAGPSVF LFPPKPKDTL MISRTPEVTC VVVDVSHEDP EVQFNWYVDG VEVHNAKTKP
61 REEQFNSTFR VVSVLTVVHQ DWLNGKEYKC KVSNKGLPAP IEKTISKTKG QPREPQVYTL
121 PPSREEMTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPMLDSD GSFFLYSKLT
181 VDKSRWQQGN VFSCSVMHEA LHNHYTQKSL SLSPGK (SEQ ID NO: 4)
[00038] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG2, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 4.
[00039] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG2, модифицированный полипептид Fc IgG2 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG2 со следующей аминокислотной последовательностью, в которой мутированные аминокислотные остатки обведены рамками:

[00040] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG2, модифицированный полипептид Fc IgG2 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG2, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 54.
[00041] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG3 со следующей аминокислотной последовательностью:
1 APELLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVQFKWYVD GVEVHNAKTK
61 PREEQYNSTF RVVSVLTVLH QDWLNGKEYK CKVSNKALPA PIEKTISKTK GQPREPQVYT
121 LPPSREEMTK NQVSLTCLVK GFYPSDIAVE WESSGQPENN YNTTPPMLDS DGSFFLYSKL
181 TVDKSRWQQG NIFSCSVMHE ALHNRFTQKS LSLSPGK (SEQ ID NO: 5)
[00042] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG3, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 5.
[00043] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG3, модифицированный полипептид Fc IgG3 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG3 со следующей аминокислотной последовательностью, в которой мутированные аминокислотные остатки обведены рамками:

[00044] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG3, модифицированный полипептид Fc IgG3 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG3, в которой остаток G236, соответствующий остатку 6 указанной выше SEQ ID NO: 5 делетирован, и имеет следующую аминокислотную последовательность:
1 APELLGPSVF LFPPKPKDTL MISRTPEVTC VVVDVSHEDP EVQFKWYVDG VEVHNAKTKP
61 REEQYNSTFR VVSVLTVLHQ DWLNGKEYKC KVSNKALPAP IEKTISKTKG QPREPQVYTL
121 PPSREEMTKN QVSLTCLVKG FYPSDIAVEW ESSGQPENNY NTTPPMLDSD GSFFLYSKLT
181 VDKSRWQQGN IFSCSVMHEA LHNRFTQKSL SLSPGK (SEQ ID NO: 56)
[00045] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG3, модифицированный полипептид Fc IgG3 слитого белка включает мутации остатков L234 и L235, соответствующих остаткам 4 и 5 указанной выше SEQ ID NO: 5 и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00046] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG3, модифицированный полипептид Fc IgG3 слитого белка включает делецию остатка G236 и мутации остатков L234 и L235 и имеет следующую аминокислотную последовательность:

[00047] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG3, модифицированный полипептид Fc IgG3 слитого белка включает делецию остатка G236 и мутации остатков L234, L235, M252, T256 и M428 и имеет следующую аминокислотную последовательность:

[00048] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG3, модифицированный полипептид Fc IgG3 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG3, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 55, 56, 57, 58 или 59.
[00049] В некоторых вариантах осуществления настоящего изобретения участок Fc человеческого IgG3 модифицирован в положении Asn297 (нумерация по Kabat) для предотвращения гликозилирования антитела, напр., Asn297Ala (N297A). В некоторых вариантах осуществления настоящего изобретения участок Fc человеческого IgG3 модифицирован в положении 435 для увеличения времени полувыведения, напр., Arg435His (R435H). В некоторых вариантах осуществления настоящего изобретения участок Fc человеческого IgG3 не содержит Lys447 (индекс ЕС по Kabat et al 1991 Sequences of Proteins of Immunological Interest).
[00050] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG4 со следующей аминокислотной последовательностью:
1 APEFLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSQED PEVQFNWYVD GVEVHNAKTK
61 PREEQFNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKGLPS SIEKTISKAK GQPREPQVYT
121 LPPSQEEMTK NQVSLTCLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSRL
181 TVDKSRWQEG NVFSCSVMHE ALHNHYTQKS LSLSLGK (SEQ ID NO: 6)
[00051] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает шарнирный участок, связанный с N-концом полипептида Fc слитого белка, где полипептид Fc включает полипептидную последовательность Fc человеческого IgG4 со следующей аминокислотной последовательностью:
1 ESKYGPPCPS CPAPEFLGGP SVFLFPPKPK DTLMISRTPE VTCVVVDVSQ EDPEVQFNWY
61 VDGVEVHNAK TKPREEQFNS TYRVVSVLTV LHQDWLNGKE YKCKVSNKGL PSSIEKTISK
121 AKGQPREPQV YTLPPSQEEM TKNQVSLTCL VKGFYPSDIA VEWESNGQPE NNYKTTPPVL
181 DSDGSFFLYS RLTVDKSRWQ EGNVFSCSVM HEALHNHYTQ KSLSLSLGK (SEQ ID NO: 60)
[00052] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG4, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 6 или 60.
[00053] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации в положениях M252, T256 и M428, соответствующие остаткам 22, 26 и 197 SEQ ID NO: 6 или остаткам 34, 38 и 210 SEQ ID NO: 60, указанным выше, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00054] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации в положениях M252, T256 и M428, соответствующие остаткам 22, 26, и 197 SEQ ID NO: 6 или остаткам 34, 38 и 210 SEQ ID NO: 60, указанным выше, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00055] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG4, в которой остаток G236, соответствующий остатку 6 SEQ ID NO: 6 или остатку 19 SEQ ID NO: 60, указанным выше, делетирован, и имеет следующую аминокислотную последовательность:
1 APEFLGPSVF LFPPKPKDTL MISRTPEVTC VVVDVSQEDP EVQFNWYVDG VEVHNAKTKP
61 REEQFNSTYR VVSVLTVLHQ DWLNGKEYKC KVSNKGLPSS IEKTISKAKG QPREPQVYTL
121 PPSQEEMTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD GSFFLYSRLT
181 VDKSRWQEGN VFSCSVMHEA LHNHYTQKSL SLSLGK (SEQ ID NO: 63)
[00056] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG4, в которой остаток G236, соответствующий остатку 6 SEQ ID NO: 6 или остатку 19 SEQ ID NO: 60, указанным выше, делетирован, и слитый белок включает по меньшей мере следующую аминокислотную последовательность:
1 ESKYGPPCPS CPAPEFLGPS VFLFPPKPKD TLMISRTPEV TCVVVDVSQE DPEVQFNWYV
61 DGVEVHNAKT KPREEQFNST YRVVSVLTVL HQDWLNGKEY KCKVSNKGLP SSIEKTISKA
121 KGQPREPQVY TLPPSQEEMT KNQVSLTCLV KGFYPSDIAV EWESNGQPEN NYKTTPPVLD
181 SDGSFFLYSR LTVDKSRWQE GNVFSCSVMH EALHNHYTQK SLSLSLGK (SEQ ID NO: 64)
[00057] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутацию остатка L235, соответствующего остатку 5 указанной выше SEQ ID NO: 6 или остатку 17 указанной выше SEQ ID NO: 60, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00058] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутацию остатка L235, соответствующего остатку 5 указанной выше SEQ ID NO: 6 или остатку 17 указанной выше SEQ ID NO: 60, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00059] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации остатков L234 и L235, соответствующих остаткам 4 и 5 указанной выше SEQ ID NO: 6 или остаткам 16 и 17 указанной выше SEQ ID NO: 60, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00060] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации остатков L234 и L235, соответствующих остаткам 4 и 5 указанной выше SEQ ID NO: 6 или остаткам 16 и 17 указанной выше SEQ ID NO: 60, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00061] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутацию остатка S228, соответствующего остатку 10 указанной выше SEQ ID NO: 60, и имеет следующую аминокислотную последовательность, в которой мутированный аминокислотный остаток обведен рамкой:

[00062] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации остатков S228 и L235, соответствующих остаткам 10 и 17 указанной выше SEQ ID NO: 60, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00063] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации в положениях L235, M252, T256 и M428, соответствующие остаткам 5, 22, 26 и 197 SEQ ID NO: 6 или остаткам 17, 34, 38 и 210 указанной выше SEQ ID NO: 60, и имеет следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00064] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации в положениях L235, M252, T256 и M428, соответствующие остаткам 5, 22, 26 и 197 указанной выше SEQ ID NO: 6 или остаткам 17, 34, 38 и 210 указанной выше SEQ ID NO: 60, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00065] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает шарнирный участок, связанный с N-концом модифицированного полипептида Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает мутации в положениях S228, L235, M252, T256 и M428, соответствующие остаткам 10, 17, 34, 38 и 210 указанной выше SEQ ID NO: 60, и слитый белок включает по меньшей мере следующую аминокислотную последовательность, в которой мутированные аминокислотные остатки обведены рамками:

[00066] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает модифицированный полипептид Fc IgG4, модифицированный полипептид Fc IgG4 слитого белка включает модифицированную полипептидную последовательность Fc человеческого IgG4, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73.
[00067] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgM со следующей аминокислотной последовательностью:
1 IAELPPKVSV FVPPRDGFFG NPRKSKLICQ ATGFSPRQIQ VSWLREGKQV GSGVTTDQVQ
61 AEAKESGPTT YKVTSTLTIK ESDWLGQSMF TCRVDHRGLT FQQNASSMCV PDQDTAIRVF
121 AIPPSFASIF LTKSTKLTCL VTDLTTYDSV TISWTRQNGE AVKTHTNISE SHPNATFSAV
181 GEASICEDDW NSGERFTCTV THTDLPSPLK QTISRPKG (SEQ ID NO: 7)
[00068] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgM, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 7.
[00069] В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает по меньшей мере аминокислотную последовательность части петли реакционного центра белка AAT, функционально связанную с полипептидной последовательностью Fc, которая включает или происходит из аминокислотной последовательности любой из SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, выбираемую из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения часть петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок, например, глицин-сериновый линкер или линкер на основе глицина-серина. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через шарнирный участок. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок и шарнирный участок. В других вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc связаны напрямую.
[00070] В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает по меньшей мере аминокислотную последовательность варианта части петли реакционного центра белка AAT, функционально связанную с полипептидной последовательностью Fc, которая включает или происходит из аминокислотной последовательности любой из SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, выбираемую из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения вариант части петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок, например, глицин-сериновый линкер или линкер на основе глицина-серина. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через шарнирный участок. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок и шарнирный участок. В других вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc связаны напрямую.
[00071] В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает по меньшей мере аминокислотную последовательность варианта части петли реакционного центра белка ААТ, функционально связанную с полипептидной последовательностью Fc, которая включает или происходит из аминокислотной последовательности любой из SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, выбираемую из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2, функционально связанную с полипептидной последовательностью Fc, которая включает или происходит из аминокислотной последовательности любой из SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, выбираемую из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения полипептид Fc включает аминокислотную последовательность, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 и 73. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок, например, глицин-сериновый линкер или линкер на основе глицина-серина. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через шарнирный участок. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок и шарнирный участок. В других вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc связаны напрямую.
[00072] В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает по меньшей мере полноразмерную полипептидную последовательность человеческого AAT с аминокислотной последовательностью SEQ ID NO: 80, функционально связанную с полипептидной последовательностью Fc, которая включает или происходит из аминокислотной последовательности любой из SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-Fc» включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 80, функционально связанную с полипептидной последовательностью Fc, которая включает или происходит из аминокислотной последовательности любой из SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок, например, глицин-сериновый линкер или линкер на основе глицина-серина. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через шарнирный участок. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc функционально связаны через линкерный участок и шарнирный участок. В других вариантах осуществления настоящего изобретения серпиновый полипептид и полипептид Fc связаны напрямую.
[00073] В некоторых вариантах применения слитых белков, представленных в настоящей заявке, второй полипептид (Полипептид 2) серпинового слитого белка является полипептидом, действующим на цитокин, или является полипептидом, получаемым из полипептида, действующего на цитокин. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под названием «слитые белки «серпин-действующий на цитокины полипептид». Слитые белки «серпин-действующий на цитокины полипептид», описанные в настоящей заявке, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, которую получают из серпинового полипептида и действующего на цитокины полипептида, или их производные. В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-действующий на цитокины полипептид» включает единственный серпиновый полипептид. В других вариантах осуществления настоящего изобретения слитый белок «серпин-действующий на цитокины полипептид» включает несколько серпиновых полипептидов, и эти варианты осуществления настоящего изобретения объединяют в настоящей заявке под названием «слитые белки «серпин(a')- действующий на цитокины полипептид»», где (a') является целым числом, равным по меньшей мере 2. В некоторых вариантах осуществления настоящего изобретения все серпиновые полипептиды в слитом белке «серпин(a')- действующий на цитокины полипептид» имеют одинаковую аминокислотную последовательность. В других вариантах осуществления настоящего изобретения каждый серпиновый полипептид в слитом белке «серпин(a')- действующий на цитокины полипептид» включает серпиновые полипептиды с разными аминокислотными последовательностями.
[00074] В некоторых вариантах осуществления настоящего изобретения действующий на цитокины полипептид или слитый белок «серпин-действующий на цитокины полипептид» является цитокиновым рецептором или происходит из цитокинового рецептора. В предпочтительном варианте осуществления настоящего изобретения действующий на цитокины полипептид или аминокислотная последовательность, получаемая из цитокинового рецептора, является или происходит из последовательности человеческого цитокинового рецептора. В других вариантах осуществления настоящего изобретения действующий на цитокины полипептид является антителом или фрагментом антитела, например, антителом к цитокину или фрагментом антитела к цитокину. В предпочтительном варианте осуществления настоящего изобретения действующий на цитокины полипептид или аминокислотную последовательность, получаемую из антитела или фрагмента антитела, получают из последовательности химерного, гуманизированного или полностью человеческого антитела. Термин «фрагмент антитела» включает одноцепочечное антитело, Fab-фрагмент, F(ab')2-фрагмент, scFv, scAb, dAb, однодоменное антитело на основе тяжелой цепи и однодоменное антитело на основе легкой цепи.
[00075] В других вариантах осуществления настоящего изобретения действующий на цитокины полипептид связывает цитокиновый рецептор и предотвращает связывание цитокина с рецептором. В других вариантах осуществления настоящего изобретения действующий на цитокины полипептид является антителом или фрагментом антитела, например, антителом к рецептору цитокина или фрагментом антитела к рецептору цитокина.
[00076] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитых белков «серпин-действующий на цитокины полипептид» включает по меньшей мере аминокислотную последовательность части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения часть петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитых белков «серпин-действующий на цитокины полипептид» включает по меньшей мере аминокислотную последовательность варианта части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения вариант части петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-действующий на цитокины полипептид» включает или происходит из по меньшей мере полноразмерной полипептидной последовательности человеческого AAT с аминокислотной последовательностью SEQ ID NO: 2. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-действующий на цитокины полипептид» включает или происходит из по меньшей мере полноразмерной полипептидной последовательности человеческого AAT с аминокислотной последовательностью SEQ ID NO: 80. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-действующий на цитокины полипептид» включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2 или 32, или 33, или 80.
[00077] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-действующий на цитокины полипептид» включает полипептидную последовательность AAT или аминокислотную последовательность, получаемую из полипептида AAT, которая является или происходит из одной или более полипептидных последовательностей человеческого AAT, имеющих учетные номера в GenBank AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
[00078] Слитый белок «серпин-действующий на цитокины полипептид» может содержать часть слитого белка «серпин-Fc». Например, антитело содержит полипептид Fc. Таким образом, в некоторых вариантах осуществления настоящего изобретения, в которых действующий на цитокины полипептид является антителом к цитокину, слитый белок «серпин-действующий на цитокины полипептид» будет включать часть слитого белка «серпин-Fc». Также большинство рецепторных слитых белков, применяемых в терапевтических целях, являются слитыми с Fc белками. Таким образом, в некоторых вариантах осуществления настоящего изобретения, в которых слитый белок «серпин-действующий на цитокины полипептид» является слитым белком «серпин-рецептор цитокина», слитый белок «серпин-действующий на цитокины полипептид» может включать полипептид Fc в дополнение к серпиновой части и части рецептора цитокина.
[00079] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок «серпин-действующий на цитокины полипептид» включает полипептидную последовательность Fc, полипептидная последовательность Fc включает или происходит из аминокислотной последовательности любой из SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок «серпин-действующий на цитокины полипептид» включает полипептидную последовательность Fc, полипептидная последовательность Fc по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична любой из аминокислотных последовательностей SEQ ID NO: 3, 4, 5, 6, 7, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и действующий на цитокины полипептид функционально связаны через линкерный участок, например, через глицин-сериновый линкер или линкер на основе глицина-серина. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и действующий на цитокины полипептид функционально связаны через шарнирный участок. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид и действующий на цитокины полипептид функционально связаны через линкерный участок и шарнирный участок. В других вариантах осуществления настоящего изобретения серпиновый полипептид и действующий на цитокины полипептид связаны напрямую.
[00080] В некоторых вариантах применения слитых белков, представленных в настоящей заявке, второй полипептид (Полипептид 2) серпинового слитого белка является полипептидом, содержащим домен WAP (whey acidic protein, кислый белок сыворотки), или аминокислотной последовательностью, получаемой из полипептида, содержащего домен WAP. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки «серпин-домен WAP»». Слитые белки «серпин-домен WAP» включают по меньшей мере серпиновый полипептид или по меньшей мере аминокислотную последовательность, получаемую из серпина, полипептид, содержащий домен WAP или аминокислотную последовательность, получаемую из полипептида, содержащего домен WAP. В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-домен WAP» включает единственный серпиновый полипептид. В других вариантах осуществления настоящего изобретения слитый белок «серпин-действующий на WAP полипептид» включает несколько серпиновых полипептидов. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки «серпин(a')-домен WAP»», где (a') является целым числом, равным по меньшей мере 2. В некоторых вариантах осуществления настоящего изобретения серпиновые полипептиды слитого белка «серпин(a')-домен WAP» имеют одинаковую аминокислотную последовательность. В других вариантах осуществления настоящего изобретения серпиновые полипептиды слитого белка «серпин(a')- действующий на цитокины полипептид» включают серпиновые полипептиды с разными аминокислотными последовательностями.
[00081] Эти слитые белки «серпин(a')-домен WAP» включают полипептид, содержащий домен WAP, или полипептидную последовательность, которая является или происходит из полипептида, содержащего домен WAP. Домен WAP представляет собой мотив с эволюционно консервативной последовательностью из 50 аминокислот, содержащий восемь цистеинов, расположенных в виде характерной структуры с 4 дисульфидными связями (также называемой коровым мотивом с 4 дисульфидными связями). Мотив с последовательностью домена WAP представляет собой функциональный мотив, характеризующийся ингибирующей сериновые протеазы активностью в ряде белков.
[00082] Полипептиды, содержащие домен WAP, подходящие для применения в слитых белках, представленных в настоящей заявке, включают, но не ограничиваются, например, секреторным ингибитором лейкоцитарных протеаз (SLPI, secretory leukocyte protease inhibitor), элафином (Elafin) и эппином (Eppin).
[00083] В некоторых вариантах осуществления настоящего изобретения последовательность полипептида, содержащего домен WAP, слитого белка включает полипептидную последовательность секреторного ингибитора лейкоцитарных протеаз (SLPI) или аминокислотную последовательность, получаемую из SLPI. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки, получаемые из «серпина-SLPI». В некоторых вариантах осуществления настоящего изобретения полипептидная последовательность SLPI содержит часть белка SLPI, такую как, например, домен WAP2 или его часть. В предпочтительном варианте осуществления настоящего изобретения полипептидная последовательность SLPI или аминокислотная последовательность, получаемая из SLPI является или происходит из полипептидной последовательности человеческого SLPI.
[00084] В некоторых вариантах применения слитых белков «серпин-SLPI» настоящего изобретения последовательность SLPI или последовательность, получаемая из SLPI, слитого белка включает полноразмерную полипептидную последовательность человеческого SLPI со следующей аминокислотной последовательностью:
1 MKSSGLFPFL VLLALGTLAP WAVEGSGKSF KAGVCPPKKS AQCLRYKKPE CQSDWQCPGK
61 KRCCPDTCGI KCLDPVDTPN PTRRKPGKCP VTYGQCLMLN PPNFCEMDGQ CKRDLKCCMG
121 MCGKSCVSPV KA (SEQ ID NO:8)
[00085] В некоторых вариантах применения слитых белков «серпин-SLPI» настоящего изобретения последовательность SLPI или последовательность, получаемая из SLPI, слитого белка включает полноразмерную полипептидную последовательность человеческого SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 8.
[00086] В некоторых вариантах применения слитых белков «серпин-SLPI» настоящего изобретения последовательность SLPI или последовательность, получаемая из SLPI, слитого белка включает часть полноразмерной полипептидной последовательности человеческого SLPI со следующей аминокислотной последовательностью:
1 SGKSFKAGVC PPKKSAQCLR YKKPECQSDW QCPGKKRCCP DTCGIKCLDP VDTPNPTRRK
61 PGKCPVTYGQ CLMLNPPNFC EMDGQCKRDL KCCMGMCGKS CVSPVKA (SEQ ID NO: 9)
[00087] В некоторых вариантах применения слитых белков «серпин-SLPI» настоящего изобретения последовательность SLPI или последовательность, получаемая из SLPI, слитого белка включает полипептидную последовательность человеческого SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 9.
[00088] В некоторых вариантах применения слитого белка «серпин-SLPI» настоящего изобретения последовательность SLPI или последовательность, получаемая из SLPI, слитого белка включает домен WAP2 полноразмерной полипептидной последовательности человеческого SLPI со следующей аминокислотной последовательностью домена WAP2:
1 TRRKPGKCPV TYGQCLMLNP PNFCEMDGQC KRDLKCCMGM CGKSCVSPVK A (SEQ ID NO: 10)
[00089] В некоторых вариантах применения слитого белка «серпин-SLPI» настоящего изобретения последовательность SLPI или последовательность, получаемая из SLPI, слитого белка включает полипептидную последовательность человеческого SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 10.
[00090] В некоторых вариантах применения слитых белков «серпин-SLPI» настоящего изобретения полипептидная последовательность SLPI или аминокислотная последовательность, получаемая из полипептида SLPI, является или происходит из одной или более полипептидных последовательностей человеческого SLPI, имеющих учетные номера в GenBank CAA28187.1, NP_003055.1, EAW75869.1, P03973.2, AAH20708.1, CAB64235.1, CAA28188.1, AAD19661.1 и/или BAG35125.1.
[00091] В некоторых вариантах применения слитых белков «серпин-SLPI» настоящего изобретения полипептидная последовательность SLPI или последовательность, получаемая из SLPI, слитого белка включает полипептидную последовательность человеческого SLPI, модифицированную по остатку метионина (Met). При таких мутациях Met остаток Met может быть замещен любой аминокислотой. Например, остаток Met может быть замещен аминокислотой с гидрофобной боковой цепью, такой как, например, лейцин (Leu, L) или валин (Val, V). Не желая быть связанными какой-либо теорией, авторы настоящего изобретения считают, что мутация (мутации) Met предотвращают окисление и последующую инактивацию ингибиторной активности слитых белков настоящего изобретения. В некоторых вариантах осуществления настоящего изобретения мутация Met находится в положении 98 полипептида SLPI. Например, модифицированная полипептидная последовательность SLPI «серпина-SLPI» содержит мутацию M98L или M98V в SEQ ID NO: 8.
[00092] В других вариантах осуществления настоящего изобретения, полипептидная последовательность, содержащая домен WAP, слитого белка включает полипептидную последовательность элафина или аминокислотную последовательность, получаемую из элафина. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки «серпин-элафин»». В некоторых вариантах осуществления настоящего изобретения полипептидная последовательность элафина включает часть белка элафина, такую как, например, домен WAP или его часть. В предпочтительном варианте осуществления настоящего изобретения полипептидная последовательность элафина или аминокислотная последовательность, получаемая из элафина, является или происходит из полипептидной последовательности элафина человека.
[00093] В некоторых вариантах применения слитых белков «серпин-элафин» слитый белок включает полноразмерную полипептидную последовательность элафина человека со следующей аминокислотной последовательностью:
1 MRASSFLIVV VFLIAGTLVL EAAVTGVPVK GQDTVKGRVP FNGQDPVKGQ VSVKGQDKVK
61 AQEPVKGPVS TKPGSCPIIL IRCAMLNPPN RCLKDTDCPG IKKCCEGSCG MACFVPQ
(SEQ ID NO: 11)
[00094] В некоторых вариантах применения слитых белков «серпин-элафин» слитый белок включает полноразмерную полипептидную последовательность элафина человека, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 11.
[00095] В некоторых вариантах применения слитых белков «серпин-элафин» слитый белок включает часть полноразмерной полипептидной последовательности элафина человека со следующей аминокислотной последовательностью:
1 AVTGVPVKGQ DTVKGRVPFN GQDPVKGQVS VKGQDKVKAQ EPVKGPVSTK PGSCPIILIR
61 CAMLNPPNRC LKDTDCPGIK KCCEGSCGMA CFVPQ (SEQ ID NO: 12)
[00096] В некоторых вариантах применения слитых белков «серпин-элафин» слитый белок включает полипептидную последовательность элафина человека, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 12.
[00097] В некоторых вариантах слитых белков «серпин-элафин» слитый белок включает домен WAP полноразмерной полипептидной последовательности элафина человека со следующей аминокислотной последовательностью:
1 VSTKPGSCPI ILIRCAMLNP PNRCLKDTDC PGIKKCCEGS CGMACFVPQ (SEQ ID NO: 13)
[00098] В некоторых вариантах применения слитых белков «серпин-элафин» слитый белок включает полипептидную последовательность элафина человека, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 13.
[00099] В некоторых вариантах применения слитых белков «серпин-элафин» полипептидную последовательность элафина или аминокислотную последовательность, получаемую из полипептида элафина, получают из одной или более полипептидных последовательностей элафина человека, имеющих учетные номера в GenBank P19957.3, NP_002629.1, BAA02441.1, EAW75814.1, EAW75813.1, Q8IUB2.1 и/или NP_542181.1.
[000100] В других вариантах осуществления настоящего изобретения полипептидная последовательность, содержащая домен WAP, слитого белка включает полипептидную последовательность эппина или аминокислотную последовательность, получаемую из эппина. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки «серпин(a')- эппин». В некоторых вариантах осуществления настоящего изобретения полипептидная последовательность эппина слитого белка «серпин-эппин» включает часть белка эппина, такую как, например, домен WAP или его часть. В предпочтительном варианте осуществления настоящего изобретения полипептидная последовательность эппина или аминокислотная последовательность, получаемая из эппина, является или происходит из полипептидной последовательности эппина человека.
[000101] В некоторых вариантах применения слитых белков «серпин-эппин» полипептидная последовательность эппина или аминокислотная последовательность, получаемая из полипептида эппина, является или происходит из одной или более полипептидных последовательностей эппина человека, имеющих учетные номера в GenBank O95925.1, NP_065131.1, AAH44829.2, AAH53369.1, AAG00548.1, AAG00547.1 и/или AAG00546.1.
[000102] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-домен WAP» включает по меньшей мере аминокислотную последовательность части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения часть петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-домен WAP» включает по меньшей мере аминокислотную последовательность варианта части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения вариант части петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка ''серпин-домен WAP» включает по меньшей мере полноразмерную полипептидную последовательность человеческого AAT с аминокислотной последовательностью SEQ ID NO: 2. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-действующий на цитокины полипептид» включает или происходит из по меньшей мере полноразмерной полипептидной последовательности человеческого AAT с аминокислотной последовательностью SEQ ID NO: 80. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-домен WAP» включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная аминокислотной последовательности SEQ ID NO: 2 или 32, или 33, или 80.
[000103] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-домен WAP» включает полипептидную последовательность AAT или аминокислотную последовательность, получаемую из полипептида AAT, которые получают из одного или более полипептидных последовательностей человеческого AAT с учетными номерами в GenBank AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
[000104] В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-домен WAP» также может включать полипептид Fc или аминокислотную последовательность, получаемую из полипептида Fc. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки «серпин-Fc-домен WAP»». В этих вариантах осуществления настоящего изобретения этот термин не ограничивает конкретный порядок. Например, последовательность слитого белка может быть «серпин-Fc-домен WAP», «серпин-домен WAP-Fc» или любым вариантом их комбинации. Слитые белки «серпин-Fc-домен WAP», описанные в настоящей заявке, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, полипептид, содержащий домен WAP, или аминокислотную последовательность, получаемую из полипептида, содержащего домен WAP, и полипептид Fc или аминокислотную последовательность, получаемую из полипептида Fc.
[000105] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок «серпин-домен WAP» включает полипептидную последовательность Fc, полипептидная последовательность Fc может иметь аминокислотную последовательность SEQ ID NO: 3-7 и 43-73. В других вариантах осуществления настоящего изобретения, в которых слитый белок «серпин-домен WAP» включает полипептидную последовательность Fc, полипептидная последовательность Fc по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная аминокислотной последовательности SEQ ID NO 3-7 и 43-73. В некоторых вариантах осуществления настоящего изобретения слитый белок «серпин-домен WAP» может также включать альбуминовый полипептид или аминокислотную последовательность, получаемую из альбуминового полипептида. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки «серпин-альбумин-домен WAP». В этих вариантах осуществления настоящего изобретения этот термин не ограничивает конкретный порядок. Например, последовательность слитого белка может быть «серпин-альбумин-домен WAP», «серпин-домен WAP-альбумин» или любым вариантом их комбинации. Слитые белки «серпин-альбумин-домен WAP», описанные в настоящей заявке, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, полипептид, содержащий домен WAP, или аминокислотную последовательность, получаемую из полипептида, содержащего домен WAP, и альбуминовый полипептид или аминокислотную последовательность, получаемую из альбуминового полипептида.
[000106] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок «серпин-домен WAP» включает полипептидную последовательность альбумина, полипептидная последовательность альбумина включает аминокислотную последовательность SEQ ID NO: 14-15, описанную а настоящей заявке. В других вариантах осуществления настоящего изобретения, в которых слитый белок «серпин-домен WAP» включает полипептидную последовательность альбумина, полипептидная последовательность альбумина по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична любой из аминокислотных последовательностей SEQ ID NO: 14 или 15.
[000107] В некоторых вариантах осуществления настоящего изобретения второй полипептид (Полипептид 2) серпинового слитого белка является альбуминовым полипептидом или происходит из альбуминового полипептида. Эти варианты осуществления настоящего изобретения объединены в настоящей заявке под общим названием «слитые белки «серпин(a')-альбумин». Слитые белки «серпин-альбумин», описанные в настоящей заявке, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, и альбуминовый полипептид или аминокислотную последовательность, получаемую из альбуминового полипептида. Дополнительно, настоящее изобретение относится к слитым белкам «серпин-связывающий альбумин полипептид», в которых альбумин функционально связан с серпином через промежуточную связывающую молекулу. В настоящей заявке серпин нековалентно или ковалентно связан с человеческим сывороточным альбумином (HSA, human serum albumin).
[000108] В вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка является полипептидом человеческого сывороточного альбумина или аминокислотной последовательностью, получаемой из человеческого сывороточного альбумина. В некоторых вариантах осуществления настоящего изобретения слитый белок включает полипептидную последовательность человеческого сывороточного альбумина со следующей аминокислотной последовательностью:
DAHKSEVAHRFKDLGEENFKALVLIAFAQYLQQCPFEDHVKLVNEVTEFAKTCVADESAENCDKSLHTLFGDKLCTVATLRETYGEMADCCAKQEPERNECFLQHKDDNPNLPRLVRPEVDVMCTAFHDNEETFLKKYLYEIARRHPYFYAPELLFFAKRYKAAFTECCQAADKAACLLPKLDELRDEGKASSAKQRLKCASLQKFGERAFKAWAVARLSQRFPKAEFAEVSKLVTDLTKVHTECCHGDLLECADDRADLAKYICENQDSISSKLKECCEKPLLEKSHCIAEVENDEMPADLPSLAADFVESKDVCKNYAEAKDVFLGMFLYEYARRHPDYSVVLLLRLAKTYETTLEKCCAAADPHECYAKVFDEFKPLVEEPQNLIKQNCELFEQLGEYKFQNALLVRYTKKVPQVSTPTLVEVSRNLGKVGSKCCKHPEAKRMPCAEDYLSVVLNQLCVLHEKTPVSDRVTKCCTESLVNRRPCFSALEVDETYVPKEFNAETFTFHADICTLSEKERQIKKQTALVELVKHKPKATKEQLKAVMDDFAAFVEKCCKADDKETCFAEEGKKLVAASQAALGL (SEQ ID NO: 14)
[000109] В вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка включает полипептидную последовательность человеческого сывороточного альбумина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 14.
[000110] В вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка включает домен 3 полипептидной последовательности человеческого сывороточного альбумина со следующей аминокислотной последовательностью:
EEPQNLIKQNCELFEQLGEYKFQNALLVRYTKKVPQVSTPTLVEVSRNLGKVGSKCCKHPEAKRMPCAEDYLSVVLNQLCVLHEKTPVSDRVTKCCTESLVNRRPCFSALEVDETYVPKEFNAETFTFHADICTLSEKERQIKKQTALVELVKHKPKATKEQLKAVMDDFAAFVEKCCKADDKETCFAEEGKKLVA (SEQ ID NO: 15)
[000111] В вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка включает полипептидную последовательность человеческого сывороточного альбумина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 15.
[000112] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептидную последовательность альбумина, слитый белок связан с человеческим сывороточным альбумином через промежуточный альбумин-связывающий полипептид. Альбумин-связывающий полипептид может быть антителом или фрагментом антитела или может быть получен из антитела или фрагмента антитела. В предпочтительном варианте осуществления настоящего изобретения альбумин-связывающий полипептид или аминокислотную последовательность, получаемую из антитела или из фрагмента антитела, получают из последовательности химерного, гуманизированного или полностью человеческого антитела. Термин «фрагмент антитела» включает одноцепочечное антитело, Fab-фрагмент, F(ab')2-фрагмент, scFv, scAb, dAb и однодоменную тяжелую цепь антитела и однодоменную легкую цепь антитела. Дополнительно, альбумин-связывающий полипептид может быть альбумин-связывающим пептидом. Другим вариантом осуществления настоящего изобретения является слитый с серпином альбумин-связывающий полипептид, в котором альбумин-связывающий полипептид является доменом 3 стрептококкового белка G или последовательностью, получаемой из домена 3 стрептококкового белка G.
[000113] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитых белков «серпин(a')-альбумин» включает по меньшей мере аминокислотную последовательность части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения часть петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитых белков «серпин-альбумин» включает по меньшей мере аминокислотную последовательность варианта части петли реакционного центра белка AAT. В некоторых вариантах осуществления настоящего изобретения вариант части петли реакционного центра белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитых белков «серпин-альбумин» включает по меньшей мере полипептидную последовательность полноразмерного человеческого AAT с аминокислотной последовательностью SEQ ID NO: 2. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-действующий на цитокин полипептид» включает или происходит из по меньшей мере полноразмерной полипептидной последовательности человеческого AAT с аминокислотной последовательностью SEQ ID NO: 80. В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитого белка «серпин-альбумин» включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2 или 32, или 33, или 80.
[000114] В некоторых вариантах осуществления настоящего изобретения серпиновый полипептид слитых белков «серпин-альбумин» включает полипептидную последовательность AAT или аминокислотную последовательность, получаемую из полипептида AAT, являющуюся или получаемую из одной или более полипептидных последовательностей человеческого AAT с учетными номерами в GenBank AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
[000115] В некоторых вариантах осуществления настоящего изобретения слитые белки модифицированы для повышения или другого ингибирования протеолитического расщепления, например, посредством мутации одного или более сайтов протеолитического расщепления. В некоторых вариантах осуществления настоящего изобретения слитые белки модифицированы для изменения или другой модуляции эффекторной функции Fc слитого белка, при одновременном сохранении связывающей и ингибирующей функции по сравнению с неизмененным слитым белком. Эффекторные функции Fc включают, но не ограничиваются, например, связыванием Fc-рецептора, предотвращением высвобождения провоспалительного медиатора при связывании Fc-рецептора, фагоцитозом, модифицированной антителозависимой клеточноопосредованной цитотоксичностью, модифицированной комплементзависимой цитотоксичностью, модифицированным гликозилированием остатка Asn297 (индекс ЕС нумерации по Kabat, Kabat et al 1991 Sequences of Proteins of Immunological Interest) полипептида Fc. В некоторых вариантах осуществления настоящего изобретения слитые белки мутированы или по-другому модифицированы для регуляции связывания Fc-рецептора. В некоторых вариантах осуществления настоящего изобретения полипептид Fc модифицирован для усиления связывания FcRn. Примерами мутаций полипептида Fc, усиливающих связывание с FcRn, являются Met252Tyr, Ser254Thr, Thr256Glu (M252Y, S256T, T256E) (нумерация по Kabat, Dall'Acqua et al 2006, J. Biol Chem Vol 281(33) 23514-23524) или Met428Leu и Asn434Ser (M428L, N434S) (Zalevsky et al 2010 Nature Biotech, Vol. 28(2) 157-159) (индекс ЕС по Kabat et al 1991 Sequences of Proteins of Immunological Interest) или Met428Val и Asn434Ser (M428V, N434S) при использовании системы нумерации по Kabat. В некоторых вариантах осуществления настоящего изобретения мутированный или модифицированный полипептид Fc включает одну или более мутаций, выбранных из группы, состоящей из Met252Tyr (M252Y), Ser254Thr (S256T), Thr256Glu (T256E), Met428Leu (M428L), Met428Val (M428V), Asn434Ser (N434S) и их комбинаций. В некоторых вариантах осуществления настоящего изобретения часть полипептида Fc мутирована или по-другому модифицирована для предотвращения опосредованной Fc димеризации (Ying et al 2012 J. Biol Chem 287(23): 19399-19408). В этих вариантах осуществления настоящего изобретения слитый белок является мономерным в природе.
[000116] Слитые белки и их варианты, представленные в настоящей заявке, обладают ингибирующей активностью, например, ингибирующей сериновые протеазы, такие как эластаза нейтрофилов человека, сериновая протеаза с химотрипсиновым фолдом, секретирующаяся нейтрофилами при воспалительном ответе. Слитые белки, представленный в настоящей заявке, полностью или частично уменьшают или по-другому модулируют экспрессию или активность сериновых протеаз при связывании или при ином взаимодействии с сериновой протеазой, напр., с человеческой сериновой протеазой. Снижение или модуляция биологической функции сериновой протеазы происходит полностью или частично при взаимодействии слитых белков и белка, полипептида и/или пептида сериновой протеазы человека. Считается, что слитые белки полностью ингибируют экспрессию или активность сериновой протеазы, если уровень экспрессии или активности сериновой протеазы в присутствии слитого белка снижается по меньшей мере на 95%, напр., на 96%, 97%, 98%, 99% или 100% по сравнению с уровнем экспрессии или активности сериновой протеазы в отсутствии взаимодействия, напр., связывания, со слитым белком, описанным в настоящей заявке. Считается, что слитые белки частично ингибируют экспрессию или активность сериновой протеазы, если уровень экспрессии или активности сериновой протеазы в присутствии слитого белка снижается менее, чем на 95%, напр., 10%, 20%, 25%, 30%, 40%, 50%, 60%, 75%, 80%, 85% или 90% по сравнению с уровнем экспрессии или активности сериновой протеазы в отсутствии взаимодействия, напр., связывания, со слитым белком, описанным в настоящей заявке.
[000117] Слитые белки, описанные в настоящей заявке, применимы по ряду терапевтических, диагностических и профилактических показаний. Например, слитые белки применимы в лечении ряда заболеваний и нарушений у субъекта. В некоторых вариантах осуществления настоящего изобретения серпиновые слитые белки, включая описанные в настоящей заявке слитые белки, применимы для лечения, уменьшения симптомов, облегчения и/или задержки развития заболевания или нарушения у субъекта, страдающего от заболевания или нарушения или имеющего повышенный риск развития заболевания или нарушения, выбираемого из недостатка альфа-1-антитрипсина (AAT, alpha-1-antitrypsin), эмфиземы, хронической обструктивной болезни легких (ХОБЛ), синдрома острой дыхательной недостаточности, аллергической астмы, кистозного фиброза, рака легких, ишемически-реперфузионного повреждения, в том числе ишемически-реперфузионного повреждения после пересадки сердца, инфаркта миокарда, ревматоидного артрита, септического артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, псориаза, диабета I и/или II типа, бактериальных инфекций, грибковых инфекций, вирусных инфекций, пневмонии, сепсиса, реакции «трансплантат против хозяина», заживления раны, системной красной волчанки и рассеянного склероза.
[000118] Фармацевтические композиции в соответствии с настоящим изобретением включают слитый белок настоящего изобретения, включая модифицированные слитые белки и другие варианты, а также подходящий носитель. Эти фармацевтические композиции можно включить в наборы, такие как, например, диагностические наборы.
Краткое описание чертежей
[000119] Фигура 1A представляет собой схематическое изображение некоторых вариантов применение слитых белков «серпин-Fc» в соответствии с настоящим изобретением. Серпин может находиться в любом положении в составе слитого белка. Также представлены слитые белки «серпин-Fc», включающие несколько серпиновых полипептидов. Фигура 1B представляет собой фотографию результата электрофореза в полиакриламидном геле (ПААГ) с додецилсульфатом натрия, показывающую полученные из сыворотки AAT (дорожка 1), AAT-Fc1 (дорожка 2, Fc человеческого IgG1) и AAT-EL-Fc1 (дорожка 3, мутации Met351Glu, Met358Leu в AAT, Fc человеческого IgG1). Фигура 1C представляет собой график, показывающий ингибирование активности эластазы нейтрофилов слитыми белками AAT-Fc. Фигура 1D представляет собой фотографию результата электрофореза в ПААГ с додецилсульфатом натрия, показывающую четырехвалентный AAT-Fc-AAT, содержащий два полипептида AAT на один полипептид Fc. Фигура 1 E представляет собой график, показывающий ингибирование активности эластазы нейтрофилов слитым четырехвалентным белком AAT-Fc-AAT. Фигура 1F представляет собой график, показывающий эффект элюирования со смолы с протеином А при низком pH, при этом способность слитого белка «AAT-Fc», элюированного при низком рН, ингибировать эластазу нейтрофилов сильно снижена. Фигура 1G представляет собой график, показывающий, что двойной мутант AAT-EL-Fc (мутации Met351Glu, Met358Leu) устойчив к инактивации H2O2 (конц.) по сравнению с AAT дикого типа и с одиночным мутантом AAT-EM-Fc (Met351Glu). Фигура 1H представляет собой график, показывающий скорость сывороточного клиренса полученного из сыворотки AAT (sdAAT, serum derived AAT) по сравнению с AAT-Fc у крыс, получивших дозу мг/кг белка (3 крысы/исследуемый белок). Время полувыведения AAT-Fc значительно больше, чем у sdAAT.
[000120] Фигура 2A представляет собой схематическое изображение некоторых вариантов применение слитых белков «серпин-действующий на цитокин полипептид» настоящего изобретения. Серпин можно соединить либо с тяжелой цепью, либо с легкой цепью, либо как с тяжелой, так и с легкой цепью антитела. Также приведены слитые белки «серпин-рецептор цитокина». Фигура 2B представляет собой фотографию результата электрофореза в ПААГ с додецилсульфатом натрия, показывающую антитело D2E7 (дорожка 1) и антитело D2E7, с тяжелой цепью которого слит AAT (дорожка 2). Фигура 2C представляет собой график, показывающий ингибирование активности эластазы нейтрофилов антителом D2E7, слитым с AAT. Выделенный из сыворотки AAT показан в качестве положительного контроля, в то время как антитело D2E7 в индивидуальном виде показано в качестве отрицательного контроля ингибирования эластазы нейтрофилов.
[000121] Фигура 3A представляет собой схематическое изображение некоторых вариантов применение слитых белков «серпин-Fc-WAP». Фигура 3B представляет собой фотографию результата электрофореза в ПААГ с додецилсульфатом натрия, показывающую AAT-Fc-ELAFIN (дорожка 1) и AAT-Fc-SLPI (дорожка 2). Фигура 3C представляет собой график, показывающий ингибирование активности эластазы нейтрофилов посредством слитого белка «AAT-Fc-элафин» и слитого белка «AAT-Fc-SLPI». Слитый белок AAT-Fc и выделенный из сыворотки AAT включены для сравнения.
[000122] Фигура 4A представляет собой схематическое изображение некоторых вариантов применение слитых белков «AAT-HSA». Фигура 4B представляет собой фотографию результата электрофореза в ПААГ с додецилсульфатом натрия, показывающую слитый белок «AAT-HSA». Фигура 4C представляет собой график, показывающий ингибирование активности эластазы нейтрофилов посредством «AAT-HSA» по сравнению с выделенным из сыворотки AAT.
Подробное описание изобретения
[000123] Эластаза нейтрофилов человека является сериновой протеазой с химотрипсиновым доменом, секретирующейся во время воспаления. Нарушенная активность эластазы нейтрофилов приводит к прогрессирующей деградации эластиновых тканей и к медленному разрушению альвеолярных структур легких, что вызывает эмфизему и фиброз легких (Lungarella et al 2008 Int. J. Biochem Cell Biol 40:1287). Часто нарушенная активность эластазы нейтрофилов обусловлена нарушением баланса протеазы и ее природного ингибитора альфа-1-антитрипсина (AAT, alpha1-antitrypsin). Такой дисбаланс обусловлен усилением инфильтрации нейтрофилов в легких, что наблюдается в легких курильщиков и пациентов с кистозным фиброзом или с синдромом острой дыхательной недостаточности. В свою очередь, из-за недостатка AAT, как правило, вызванного точечной мутацией, из-за которой ATT агрегирует и накапливается в печени, в легких наблюдается неконтролируемая активность эластазы нейтрофилов. Индивиды с недостатком AAT имеют повышенный риск развития эмфиземы, ХОБЛ, заболеваний печени и ряда других состояний.
[000124] Недостаток AAT наблюдается приблизительно у 100000 американцев (по оценкам Фонда «Alpha-1 Foundation»), и многие больные умирают в возрасте 30-50 лет. В настоящее время существует лишь несколько одобренных FDA (Food and Drug Administration, Управление по контролю за качеством пищевых продуктов и лекарственных средств) лекарственных средств для лечения недостатка ATT (Prolastin®, Aralast™, Zemaira®, Glassia™). Каждое лекарственное средство является природным AAT, полученным из объединенной плазмы крови человека, что, очевидно, недостаточно для удовлетворения клинических потребностей. Также эти продукты обладают коротким временем полувыведения из сыворотки (T1/2 составляет приблизительно 5 дней) и требуют еженедельных инфузий высокой дозы (60 мг/кг веса тела). В настоящее время рынок этих лекарственных средств оценивается в 400 миллионов долларов США. Рынок AAT-подобных лекарственных средств, вероятно, значительно больше, судя по тому, что 95% индивидов с недостатком AAT остаются недиагносцированными и принимая во внимание тот факт, что эти лекарственные средства могут быть эффективными в терапии патологий, характеризующихся повышенной активностью эластазы нейтрофилов у индивидов без недостатка AAT (напр., с кистозным фиброзом, с синдромом острой дыхательной недостаточности, вызванной курением эмфиземой и/или ХОБЛ).
[000125] Предполагают, что AAT обладает широким спектром противовоспалительной активности (Tilg et al 1993 J Exp Med 178:1629-1636, Libert et al 1996 Immunol 157:5126-5129, Pott et al, Journal of Leukocyte Biology 85 2009, Janciauskiene et al 2007 J. Biol Chem 282(12): 8573-8582, Nita et al 2007 Int J Biochem Cell Biol 39:1165-1176). Недавно были получены доказательства возможности применения AAT для лечения многих патологий человека, не относящихся к обычно предполагаемым воспалительным состояниям дыхательных путей. Было показано, что человеческий AAT защищает мышей от проявления клинических и гистопатологических признаков экспериментального аутоиммунного энцефаломиелита, что позволяет предположить, что его можно применять для лечения аутоиммунных заболеваний, таких как рассеянный склероз или системная красная волчанка (Subramanian et al 2011 Metab Brain Dis 26:107-113). Было показано, что сывороточный AAT проявляет активность в моделях реакции «трансплантат против хозяина» у грызунов (Tawara et al 2011 Proc. Natl. Acad. Sci. USA 109: 564-569, Marcondes et al 2011 Blood Nov 3;118(18):5031-9), что стало основой проведения клинического исследования на человеке с применением AAT для лечения индивидов с рефрактерной к стероидам острой реакцией «трансплантат против хозяина» (NCT01523821). Дополнительно, AAT был эффективен в животных моделях диабета I и II типа, в уменьшении воспаления, защите клеток панкреатических островков от апоптоза и обеспечения устойчивости аллотрансплантата клеток панкреатических островков (Zhang et al 2007 Diabetes 56:1316-1323, Lewis et al 2005 Proc Natl Acad Sci USA 102:12153-12158, Lewis et al 2008 Proc Natl Acad Sci USA 105:16236-16241, Kalis et al 2010 Islets 2:185-189). В настоящее время проводится множество клинических исследований ранней фазы у людей с диабетом I типа с применением полученных из сыворотки AAT-продуктов (NCT01183468, NCT01319331, NCT01304537).
[000126] Существующие в настоящее время полученные из сыворотки AAT-продукты подвергаются тщательной очистке и исследованию для обеспечения удаления патогенных вирусов, однако нельзя полностью исключить риск заражения инфекционными агентами. Более того, количество сыворотки ограничено, что ограничивает возможности получения AAT из сыворотки. Попытки решить проблемы, связанные с получаемыми из сыворотки продуктами и с их производством, были сосредоточены на экспрессии рекомбинантного AAT. Однако за 20 лет работы поколение терапевтически доступного рекомбинантного AAT так и не вышло на рынок (Karnaukhova et al 2006 Amino Acids 30: 317). Как и получаемые из плазмы продукты, рекомбинантные варианты AAT обладают коротким временем полувыведения, низким выходом продукции и плохим распределением в легких.
[000127] Слитые белки настоящего изобретения обладают улучшенной функциональностью по сравнению с немодифицированной молекулой AAT. Связывание полипептида AAT со вторым полипептидом, который взаимодействует с неонатальным Fc-рецептором (FcRn, neonatal Fc receptor), служит для повышения времени полувыведения из сыворотки, что обеспечивает необходимое пациентам преимущество при дозировании. Эти взаимодействующие с FcRn полипептиды слитого белка включают полипептиды Fc иммуноглобулинов (Ig), получаемые из человеческих IgG1, IgG2, IgG3, IgG4 или IgM, и производные человеческого альбумина. В некоторых вариантах осуществления настоящего изобретения слитый белок включает мутации в части AAT, которые делают молекулу более устойчивой к инактивации окислением. Например, Met351Glu, Met358Leu (AAT-EL-Fc) демонстрируют устойчивость к инактивации при окислении H2O2 (Фигура 1G). В то время как AAT является природным противовоспалительным белком, некоторые варианты осуществления настоящего изобретения обладают увеличенной способностью уменьшать воспаление при связывании полипептида AAT и действующего на цитокины полипептида. Связывание двух противовоспалительных функции AAT и второго полипептида обеспечит более выраженную активность терапевтического белка, чем у каждого полипептида по отдельности. Дополнительно, связывание противоинфекционной активности AAT уменьшит риск развития инфекции большинства действующих на цитокины биологических препаратов. Некоторые варианты осуществления настоящего изобретения представляют более активные противовоспалительные и противоинфекционные белки за счет связывания полипептида AAT и полипептида, содержащего домен WAP. Ожидается, что слитые белки настоящего изобретения будут обладать большей терапевтической применимостью и будут превосходить существующие в настоящее время получаемые из сыворотки AAT-продукты.
[000128] Для увеличения времени полувыведения рекомбинантного AAT применяли технологию рекомбинантных ДНК для получения гена AAT, слитого с доменом Fc человеческих IgG1, IgG2, IgG3, IgG4, IgM или HSA, такого, что в ожидаемом белковом продукте за AAT будет следовать домен Fc ((AAT-Fc (IgG1), AAT-Fc (IgG2), AAT-Fc (IgG3), AAT-Fc (IgG4), AAT-Fc (IgM)) или за AAT будет следовать HSA. В то время как было известно, что связывание доменов Fc HSA с некоторыми белками, белковыми доменами или пептидами может увеличивать их время полувыведения (см., напр., Jazayeri et al. BioDrugs 22, 11-26, Huang et al. (2009) Curr Opin Biotechnol 20, 692-699, Kontermann et al. (2009) BioDrugs 23, 93-109, Schmidt et al. (2009) Curr Opin Drug Discov Devel 12, 284-295), не было известно, что связывание домена Fc или HSA с AAT обеспечивает надлежащий фолдинг и поддержание ингибирующей эластазу нейтрофилов активности или продлевает время полувыведения рекомбинантного AAT. Показано, что слитые белки настоящего изобретения являются сильными ингибиторами эластазы нейтрофилов, обладают увеличенным временем полувыведения и в некоторых вариантах осуществления настоящего изобретения устойчивы к окислению. В других вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, обладают определенными свойствами за счет включения других функциональных полипептидов, включая действующие на цитокины полипептиды и полипептиды, содержащие домен WAP.
[000129] У нейтрофилов, главного источника эластазы нейтрофилов, часто происходит окислительный взрыв одновременно с секрецией эластазы нейтрофилов. Таким образом, важным свойством слитых белков настоящего изобретения является активность в окислительной среде. Окисление AAT внутри петли реакционного центра по Met351 и/или Met358 уменьшает способность AAT ингибировать эластазу нейтрофилов. Как показано на Фигуре 1G, окислительную инактивацию можно уменьшить посредством мутаций Met351Glu и Met358Leu (M351E/M358L), показанных в SEQ ID NO:32. Также было показано, что окисление участка Fc по Met252 и Met428 уменьшает связывание FcRn и впоследствии сокращает время полувыведения содержащего Fc белка из сыворотки. Мутация Met252 и Met428 уменьшает окисление участка Fc. Настоящее изобретение раскрывает и оптимизирует слитый белок «AAT-Fc», который является устойчивым к окислительной инактивации в части AAT слитого белка, благодаря мутациям M351 и M358, и к окислительному нарушению взаимодействия с FcRn, благодаря мутациям M252 и M428, и обладает увеличенным временем полувыведения, благодаря набору мутаций M252I, T256D и M428L.
[000130] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc мутирован или модифицирован для усиления связывания FcRn. В этих вариантах осуществления настоящего изобретения мутированный или модифицированный полипептид Fc включает следующие мутации: Met252Ile, Thr256Asp и Met428Leu (M252I, T256D, M428L) при использовании системы нумерации по Kabat.
[000131] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc является модифицированным полипептидом Fc IgG1, и слитый белок включает по меньшей мере аминокислотную последовательность SEQ ID NO: 53.
[000132] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc является модифицированным полипептидом Fc IgG1, и слитый белок включает по меньшей мере аминокислотную последовательность SEQ ID NO: 73.
[000133] В некоторых вариантах осуществления настоящего изобретения, в которых слитый белок настоящего изобретения включает полипептид Fc, полипептид Fc мутирован или модифицирован для уменьшения связывания с рецепторами Fc-гамма (FcgR, Fc-gamma receptor). В некоторых вариантах осуществления настоящего изобретения уменьшения связывания FcgR можно достичь посредством модификации гликозилирования Fc по Asn297. Например, при мутации Asn297Ala (N297A) или Asn297Gln (N297Q). В некоторых вариантах осуществления настоящего изобретения уменьшения связывания FcgR можно достичь посредством модификации нижнего шарнирного участка Fc. В некоторых вариантах осуществления настоящего изобретения полипептид Fc получают из человеческого IgG1. В некоторых из этих вариантов осуществления настоящего изобретения нижний шарнирный участок модифицирован для имитации шарнирного участка IgG2 посредством мутации Leu234Val и Leu235Ala (L235V/L235A) и делеции Gly236 (ΔG236) при использовании системы нумерации по Kabat:

В некоторых из этих вариантов осуществления настоящего изобретения слитый белок включает по меньшей мере аминокислотную последовательность SEQ ID NO: 51.
[000134] В некоторых вариантах осуществления настоящего изобретения полипептид Fc получают из человеческого IgG4. В некоторых из этих вариантов осуществления настоящего изобретения нижний шарнирный участок модифицирован посредством мутации Leu235Glu (L235E). Дополнительно, в вариантах осуществления настоящего изобретения, в которых полипептид Fc получают из IgG4, шарнирный участок модифицирован посредством стабилизирующей мутации Ser228Pro (S228P) при использовании системы нумерации по Kabat:

В некоторых из этих вариантов осуществления настоящего изобретения слитый белок включает по меньшей мере аминокислотную последовательность SEQ ID NO: 70.
[000135] Слитые белки, описанные в настоящей заявке, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, и второй полипептид. В некоторых вариантах осуществления настоящего изобретения, например, настоящее изобретение представляет серпиновый полипептид, связанный с производными человеческого IgG1-Fc, IgG2-Fc, IgG3-Fc, IgG4-Fc, IgM-Fc или HSA. Ожидается, что слитые с серпином белки, описанные в настоящей заявке, будут применимы в лечении по ряду показаний, включая, но не ограничиваясь, например, недостатком альфа-1-антитрипсина (AAT, alpha-1-antitrypsin), эмфиземой, хронической обструктивной болезнью легких (ХОБЛ), синдромом острой дыхательной недостаточности, аллергической астмой, кистозным фиброзом, раком легких, ишемически-реперфузионным повреждением, в том числе ишемически-реперфузионным повреждением после пересадки сердца, инфарктом миокарда, ревматоидным артритом, септическим артритом, псориатическим артритом, анкилозирующим спондилитом, болезнью Крона, псориазом, диабетом I и/или II типа, бактериальными инфекциями, грибковыми инфекциями, вирусными инфекциями, пневмонией, сепсисом, реакцией «трансплантат против хозяина», заживлением раны, системной красной волчанкой и рассеянным склерозом.
[000136] В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере полипептид альфа-1-антитрипсина (AAT, alpha-1-antitrypsin) или аминокислотную последовательность, получаемую из AAT, и второй полипептид. Например, настоящее изобретение представляет альфа-1-антитрипсин (AAT), связанный с производными человеческого IgG1-Fc, IgG2-Fc, IgG3-Fc, IgG4-Fc, IgM-Fc или HSA.
[000137] В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпинового полипептида и действующий на цитокины полипептид или аминокислотную последовательность, получаемую из действующего на цитокины полипептида. Например, настоящее изобретение представляет серпиновый полипептид или последовательность, получаемую из серпинового полипептида, слитые с человеческим цитокиновым рецептором или его производным. Другой вариант осуществления настоящего изобретения представляет серпиновый полипептид или последовательность, получаемую из серпинового полипептида, слитые с действующим на цитокины антителом, напр., с антителом к цитокину или с последовательностью, получаемой из действующего на цитокины антитела, напр., с антителом к цитокину или с последовательностью, получаемой из фрагмента действующего на цитокины антитела, напр., из фрагмента антитела к цитокину. Например, настоящее изобретение представляет серпиновый полипептид или последовательность, получаемую из серпинового полипептида, слитые с действующим на цитокины полипептидом, где действующий на цитокины полипептид связывает любой из следующих человеческих цитокинов: TNFα (tumor necrosis factor, фактор некроза опухоли), IgE, IL-12 (interleukin, интерлейкин), IL-23, IL-6, IL-1α, IL-1β, IL-17, IL-13, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
[000138] Например, в некоторых вариантах осуществления настоящего изобретения действующий на цитокины полипептид действует на TNFα и включает любой из следующих действующих на TNFα полипептидов или последовательностей, получаемых из следующих действующих на TNFα полипептидов: Remicade®, Humira®, Simponi®, Cimiza®, Enbrel® или ATN-103 и ATN-192.
[000139] Например, в некоторых вариантах осуществления настоящего изобретения действующий на цитокины полипептид действует на IgE и включает любой из следующих действующих на IgE полипептидов или последовательностей, получаемых из следующих действующих на IgE полипептидов: Xolair или FcεRI.
[000140] Например, в некоторых вариантах осуществления настоящего изобретения действующий на цитокины полипептид действует на общую для IL-12 и IL-23 субъединицу p40 и включает полипептид Stelara® или последовательности, получаемые из полипептида Stelara®.
[000141] Например, действующий на цитокины полипептид Stelara® действует на IL-13 и включает полипептид CDP7766 или последовательности, получаемые из полипептида CDP7766.
[000142] В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере полипептид альфа-1-антитрипсина (AAT, alpha-1-antitrypsin) или аминокислотную последовательность, получаемую из AAT, и действующий на цитокины полипептид или аминокислотную последовательность, получаемую из действующего на цитокины полипептида. Например, настоящее изобретение представляет альфа-1-антитрипсиновый ингибитор (AAT), слитый с действующим на цитокины полипептидом, в котором действующий на цитокины полипептид связывает любой из следующих человеческих цитокинов: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
[000143] В некоторых вариантах осуществления настоящего изобретения действующий на цитокины полипептид связывает цитокиновый рецептор и предотвращает связывание цитокина. Например, настоящее изобретение включает серпин, связанный с действующим на цитокиновый рецептор антителом. Например, настоящее изобретение представляет а-1-антитрипсиновый ингибитор (AAT), слитый с действующим на цитокины полипептидом, в котором действующий на цитокины полипептид связывает любой из следующих человеческих цитокинов: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, субъединицу p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
[000144] Например, в некоторых вариантах осуществления настоящего изобретения действующий на цитокины полипептид действует на рецептор IL-6 и включает полипептид Actemra® (как описано в публикации патента EP0628639) или полипептид ALX-0061 (как описано в WO2010/115998), или последовательности, получаемые из полипептида Actemra® или из полипептида ALX-0061.
[000145] Например, действующий на цитокины полипептид Actemra® действует на рецептор IL-6 и включает полипептид тоцилизумаба или последовательности, получаемые из полипептида тоцилизумаба.
[000146] Было показано, что действие на воспалительные цитокины и иммуностимулирующие агенты белковыми лекарственными средствами является клинически эффективным при ряде воспалительных состояний. Наиболее распространенными белками, применяемыми в качестве действующих на цитокины агентов, являются растворимые цитокиновые рецепторы и моноклональные антитела и их фрагменты. Существенным недостатком при действии на цитокины является риск развития инфекции у пациентов, о чем свидетельствуют данные о действующих на TNFα биологических лекарственных средствах Remicade®, Humira®, Simponi®, Cimiza® и Enbrel® и о действующем на IL-12/23 p40 антителе Stelara®. Вероятно, это распространенная проблема при действии на воспалительные цитокины, приводящем к иммуносупрессии у пациентов. AAT и другие серпиновые белки интересны тем, что обладают как противоинфекционной, так и противовоспалительной активностью. Таким образом, слитые белки «серпин-действующий на цитокины полипептид» настоящего изобретения могут подавлять нарушенную активность цитокинов, уменьшая риск развития инфекции.
[000147] В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, содержащий домен WAP полипептид или аминокислотную последовательность, получаемую из содержащего домен WAP полипептида, и полипептид Fc или аминокислотную последовательность, получаемую из полипептида Fc. Например, настоящее изобретение представляет серпиновый полипептид, содержащий домен WAP полипептид и производные человеческих IgG1-Fc, IgG2-Fc, IgG3-Fc, IgG4-Fc или IgM-Fc, функционально связанных друг с другом в любой функциональной комбинации. В некоторых вариантах осуществления настоящего изобретения содержащий домен WAP белок является человеческим SLPI или происходит из человеческого SLPI. В других вариантах осуществления настоящего изобретения содержащий домен WAP белок является человеческим элафином или происходит из человеческого элафина. В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере полипептид альфа-1-антитрипсина (AAT, alpha-1-antitrypsin) или аминокислотную последовательность, получаемую из AAT, и полипептид SLPI или аминокислотную последовательность, получаемую из SLPI. В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере полипептид AAT или аминокислотную последовательность, получаемую из AAT, и полипептид элафина или аминокислотную последовательность, получаемую из элафина.
[000148] SLPI и элафин представляют собой содержащие домен WAP белки, обладающие ингибирующей сериновые протеазы активностью. Оба эти белка обладают противовоспалительной функцией. Кроме того, эти белки обладают широким спектром противоинфекционных свойств в отношении ряда штаммов бактерий, вирусов и грибков.
[000149] В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, и полипептид человеческого сывороточного альбумина или аминокислотную последовательность, получаемую из полипептида человеческого сывороточного альбумина. Другие варианты осуществления настоящего изобретения включают слитые белки «серпин-связывающий альбумин полипептид», в которых связывающий альбумин полипептид отвечает за связывание серпина и человеческого сывороточного альбумина. Таким образом, настоящее изобретение включает как ковалентные, так и нековалентные связи серпинового полипептида и полипептида HSA или последовательностей, получаемых из серпинового полипептида или полипептида HSA. Например, настоящее изобретение представляет серпиновый полипептид, связанный с человеческим HSA или с производными HSA, или со связывающим HSA пептидом или полипептидами.
[000150] В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере полипептид альфа-1-антитрипсина (AAT, alpha-1-antitrypsin) или аминокислотную последовательность, получаемую из AAT, и полипептид HSA или аминокислотную последовательность, получаемую из полипептида HSA. Например, настоящее изобретение представляет альфа-1-антитрипсин (AAT), связанный с HSA или с фрагментом, получаемым из HSA, или со связывающим альбумин полипептидом.
[000151] В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают серпиновый полипептид или аминокислотную последовательность, получаемую из серпина, полипептид HSA или аминокислотную последовательность, получаемую из полипептида HSA, и содержащий домен WAP полипептид или аминокислотную последовательность, получаемую из содержащего домен WAP полипептида. В некоторых вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере полипептид альфа-1-антитрипсина (AAT, alpha-1-antitrypsin) или аминокислотную последовательность, получаемую из AAT, полипептид HSA или аминокислотную последовательность, получаемую из полипептида HSA, и полипептид SLPI или аминокислотную последовательность, получаемую из полипептида SLPI. В других вариантах осуществления настоящего изобретения слитые белки, описанные в настоящей заявке, включают по меньшей мере полипептид альфа-1-антитрипсина (AAT, alpha-1-antitrypsin) или аминокислотную последовательность, получаемую из AAT, полипептид HSA или аминокислотную последовательность, получаемую из полипептида HSA, и полипептид элафина или аминокислотную последовательность, получаемую из элафина.
[000152] Слитые белки настоящего изобретения можно легко получить в экспрессионных системах на основе клеток млекопитающих. Например, клетки яичников китайского хомяка (CHO, Chinese Hamster Ovary), клетки эмбриональной почки человека 293 (HEK, Human Embryonic Kidney), клетки COS, клетки PER.C6®, клетки NS0, SP2/0, YB2/0 можно с успехом применять для экспрессии серпиновых слитых белков, описанных в настоящей заявке. Важно отметить, в экспрессионных системах на основе клеток млекопитающих получают белки, которые, как правило, являются более подходящими для терапевтического применения. В отличие от экспрессионных систем на основе бактерий, насекомых или дрожжей в экспрессионных системах на основе клеток млекопитающих получают белки, характер гликозилирования которых схож с характером гликозилирования встречающихся в природе белков. Надлежащее гликозилирование белка может иметь важное значение для стабильности в сыворотке, фармакокинетики биораспределения, фолдинга и функциональности белка. Таким образом, возможность получать терапевтические белки в системах экспрессии млекопитающих обладает определенными преимуществами по сравнению с другими системами. Также объем экспрессионных систем на основе клеток млекопитающих (напр., клеток CHO, NS0, PER.C6®) можно легко увеличить в условиях коммерческого производства для получения терапевтических белков для удовлетворения клинических потребностей. Слитые белки, описанные в настоящей заявке, обладают усовершенствованной функциональностью по сравнению с природной формой AAT и могут быть получены в экспрессионных системах на основе клеток млекопитающих для клинических и коммерческих поставок. Некоторые варианты осуществления настоящего изобретения включают систему очистки, которая позволяет выделять серпиновые слитые белки, сохраняющие способность ингибировать эластазу нейтрофилов. Важно отметить, что процесс очистки настоящего изобретения можно легко сделать частью существующих в настоящее время коммерческих процессов получения на основе клеток млекопитающих.
[000153] Если иное не определено, научные и технические термины, применяемые в связи с настоящим изобретением, будут иметь общепринятые для специалистов в данной области техники значения. Также, если иное не определено контекстом, термины в единственном числе включают и множественное число, а термины во множественном числе включают также единственное число. Как правило, применяемая в связи с настоящим изобретением номенклатура и техники ведения клеточной и тканевой культуры, молекулярной биологии, химии белков, олиго- или полинуклеотидов и гибридизации, описанные в настоящей заявке, хорошо известны и широко применяются в данной области техники. Стандартные техники применяют для синтеза рекомбинантной ДНК и олигонуклеотидов, для ведения культуры ткани и для трансформации (напр., электропорация, липофекция). Ферментативные реакции и техники очистки проводят в соответствии с инструкциями производителей или так, как это принято в данной области техники или как описано в настоящей заявке. Приведенные далее техники и процедуры, как правило, проводят в соответствии со стандартными способами, хорошо известными в данной области техники и описанными с различных общих и специальных источниках, на которые даны ссылки, которые цитируются и обсуждаются на протяжении настоящего описания изобретения. См., напр., Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Применяемые в контексте номенклатура, лабораторные процедуры и техники аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, описанные в настоящей заявке, хорошо известны и широко применяются в данной области техники. Стандартные техники применяют для проведения химического синтеза, химического анализа, фармацевтических средств, лекарственной формы, доставки лекарственных средств и лечения пациентов. Термин «пациент» включает человека и объектов ветеринарии.
[000154] Следует учитывать, что терапевтические средства в соответствии с настоящим изобретением будут вводить с подходящими носителями, буферами эксципиентами и другими агентами, которые включают в лекарственную форму для оптимизации транспорта, доставки, переносимости и подобного. Целый ряд подходящих форм можно найти в справочнике, известном всем химикам-фармацевтам: Remington's Pharmaceutical Sciences (15th ed, Mack Publishing Company, Easton, PA (1975)), особенно в Главе 87, написанной Blaug, Seymour, там же. Эти формы включают, например, порошки, пасты, мази, желе, воски, масла, липиды, содержащие липиды (катионные или анионные) везикулы (такие как Lipofectin™), конъюгаты ДНК, безводные адсорбирующие пасты, эмульсии «масло в воде» и «вода в масле», эмульсии карбовакс (полиэтиленгликоли разного молекулярного веса), полутвердые гели и полутвердые смеси, содержащие карбовакс. Любая из указанных смесей может подойти для лечения и терапии в соответствии с настоящим изобретением с учетом того, что активный ингредиент в форме не инактивируется лекарственной формой, и что лекарственная форма физиологически совместима со способом введения и переносима. См. также Baldrick P. ''Pharmaceutical excipient development: the need for preclinical guidance.'' Regul. Toxicol Pharmacol. 32(2):210-8 (2000), Wang W. ''Lyophilization and development of solid protein pharmaceuticals.'' Int. J. Pharm. 203(1-2):1-60 (2000), Charman WN ''Lipids, lipophilic drugs, and oral drug delivery-some emerging concepts.'' J Pharm Sci. 89(8):967-78 (2000), Powell et al. ''Compendium of excipients for parenteral formulations'' PDA J Pharm Sci Technol. 52:238-311 (1998) и ссылки, приведенные в них для дополнительной информации, касающейся составов, эксципиентов и носителей, хорошо известных химикам-фармацевтам.
[000155] Терапевтические формы настоящего изобретения, включающие слитый белок настоящего изобретения, применяют для лечения или уменьшения симптома, ассоциированного с заболеванием или нарушением, связанным с нарушением активности сериновой протеазы у субъекта. Настоящее изобретение также представляет способы лечения или уменьшения симптома, ассоциированного с заболеванием или нарушением, связанным с нарушением активности сериновой протеазы у субъекта. Схему лечения проводят, идентифицируя субъекта, напр., человека, страдающего (или имеющего высокий риск развития) заболеванием или нарушением, связанным с нарушением активности сериновой протеазы, применяя стандартные способы, включая любую из ряда клинических и/или лабораторных процедур. Термин «пациент» включает человека и объекты ветеринарии. Термин «субъект» включает человека и других млекопитающих.
[000156] Эффективность лечения определяют, применяя любой известный способ диагностики или лечения конкретного заболевания или нарушения, ассоциированного с нарушением активности сериновой протеазы. Уменьшение одного или более симптомов заболевания или нарушения, ассоциированного с нарушением активности сериновой протеазы, указывает на то, что слитый белок обладает клинической эффективностью.
[000157] Способы скрининга слитых белков, обладающих желаемой специфичностью, включают, но не ограничиваются твердофазным иммуноферментным анализом (ELISA, enzyme linked immunosorbent assay), ферментативными исследованиями, проточной цитометрией и другими иммунологическими техниками, известными в данной области техники.
[000158] Слитые белки, описанные в настоящей заявке, можно применять в способах, известных в данной области техники, относящихся к локализации и/или количественному анализу мишени, такой как сериновая протеаза, напр., для использования при измерении уровней этих мишеней в соответствующих физиологических образцах, для применения в способах диагностики, для применения при визуализации белка и подобном). Термины «физиологический образец» и «биологический образец», применяемые как взаимозаменяемые в настоящей заявке, включают ткани, клетки и биологические жидкости, взятые у субъекта, а также ткани, клетки и жидкости, находящиеся в организме субъекте. Таким образом, термины «физиологический образец» и «биологический образец» охватывают кровь и фракцию или компонент крови, включая сыворотку крови, плазму крови или лимфу.
[000159] В конкретном варианте осуществления настоящего изобретения слитые белки, специфичные к конкретной мишени или их производные, фрагменты, аналоги или гомологи, содержащие связывающий мишень домен, применяют в качестве фармакологически активных соединений (называемых здесь и далее терапевтическими средствами).
[000160] Слитый белок настоящего изобретения можно применять для выделения конкретной мишени, используя стандартные техники, такие как иммуноаффинные техники, хроматография или иммунопреципитация. Детектирование также можно проводить посредством связывания (т.е. физического присоединения) слитого белка с детектируемым веществом. Примеры детектируемых веществ включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают оксикумарин, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламин флуоресцеин, дансилхлорид или фикоэритрин; пример подходящих люминесцентного материала включает люминол; примеры биолюминесцентных материалов включают люциферазу, люциферин и экворин, и примеры подходящих радиоактивных материалов включают 125I, 131I, 35S или 3H.
[000161] Терапевтически эффективное количество слитого белка настоящего изобретения, как правило, относится к количеству, необходимому для достижения терапевтической цели. Как указано выше, это может быть связыванием слитого белка с мишенью, которое в определенных случаях нарушает функционирование мишени. Количество, которое необходимо ввести, будет также зависеть от аффинности связывания слитого белка с конкретной мишенью, а также будет зависеть от скорости, с которой введенный слитый белок выводится из организма субъекта, которому он был введен. Стандартные интервалы величины терапевтически эффективной дозы слитого белка настоящего изобретения или его фрагмента могут составлять, например, приблизительно от 0,1 мг/кг веса тела до приблизительно 250 мг/кг веса тела, но не ограничиваясь этим. Стандартная частота введения доз может варьировать, например, от двух раз в сутки до одного раза в месяц.
[000162] При применении фрагментов слитых белков предпочтительно использовать ингибирующий фрагмент наименьшего размера, который специфично связывается с мишенью. Например, можно создать пептидные молекулы, сохраняющие способность связывать мишень. Такие пептиды можно синтезировать химически и/или получить с помощью технологии рекомбинантных ДНК. (См., напр., Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993)). Лекарственная форма также может содержать несколько активных соединений в соответствии с конкретным показанием к терапевтическому применению, предпочтительно, с комплементарной активностью, которые не оказывают нежелательного действия друг на друга. Альтернативно или дополнительно, композиция может содержать агент, усиливающий функцию, такой как, например, цитотоксический агент, цитокин, химиотерапевтический агент, ингибирующий рост агент, противовоспалительный агент или противоинфекционный агент. Такие молекулы присутствуют в комбинации в количестве, эффективном для заданной цели.
[000163] Также активные ингредиенты могут быть заключены в микрокапсулы, полученные, например, посредством техник коацервации или полимеризации на границе раздела фаз, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии.
[000164] Лекарственные формы для применения для введения in vivo должны быть стерильными. Это легко достигается посредством фильтрации через стерильные фильтровальные мембраны.
[000165] Можно получить средства для высвобождения с задержкой. Подходящие примеры средств для высвобождения с задержкой включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие слитый белок, при этом указанные матрицы находятся в определенной форме, напр., в форме пленок или микрокапсул. Примеры матриц для высвобождения с задержкой включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной и гликолевой кислоты, такие как LUPRON DEPOT ™ (микросферы для инъекции, состоящие из сополимера молочной и гликолевой кислоты и лейпролида ацетата), и поли-D-(-)-3-гидроксимасляную кислоту. В то время как полимеры, такие как этиленвинилацетат и сополимеры молочной и гликолевой кислоты, обеспечивают высвобождение молекул на протяжении более чем 100 дней, определенные гидрогели высвобождают белки в течение более коротких периодов времени.
Фармацевтические композиции
[000166] Слитые белки настоящего изобретения (также называемые в настоящей заявке активными соединениями) и их производные, фрагменты, аналоги и гомологи можно включать в фармацевтические композиции, подходящие для введения. Такие композиции, как правило, содержат слитый белок и фармацевтически приемлемый носитель. Как применяют в настоящей заявке, термин «фармацевтически приемлемый носитель» включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие адсорбцию агенты и подобное, совместимые с фармацевтическим введением. Подходящие носители описаны в последнем издании Remington's Pharmaceutical Sciences, стандартном эталонном литературном источнике в данной области техники, включенном в настоящую заявку посредством ссылки. Предпочтительные примеры таких носителей или растворителей включают, но не ограничиваются водой, солевым раствором, растворами Рингера, раствором декстрозы и 5% человеческим сывороточным альбумином. Также можно применять липосомы и безводные инертные носители, такие как жирные масла. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. Предусмотрено применение таких композиций, кроме случаев, когда любая стандартная среда или агент несовместимы с активным соединением. Дополнительные активные соединения также можно включать в состав композиций.
[000167] Фармацевтическую композицию настоящего изобретения составляют в такой форме, которая совместима с желаемым способом введения. Примеры способов введения включают парентеральное, напр., внутривенное, интрадермальное, подкожное, пероральное (напр., ингаляционное), трансдермальное (т.е. местное), трансмукозальное и ректальное введение. Растворы или суспензии, применяемые для парентерального, интрадермального или подкожного введения, могут включать следующие компоненты: стерильный растворитель, такой как вода для инъекций, солевой раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА); буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регуляции тоничности, такие как хлорид натрия или декстроза. pH можно подводить кислотами или основаниями, такими как соляная кислота или гидроксид натрия. Парентеральные средства можно заключать в ампулы, одноразовые шприцы или многодозовые контейнеры из стекла или пластика.
[000168] Фармацевтические композиции, подходящие для инъекций, включают стерильные водные растворы (для водорастворимых композиций) или дисперсии и стерильные порошки для экстемпорального приготовления стерильных растворов или дисперсии для инъекции. Для внутривенного введения подходящие носители включают физиологический раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или фосфатно-солевой буфер. Во всех случаях композиция должна быть стерильной и жидкой, обеспечивающей возможность введения через шприц. Она должна быть стабильной в условиях получения и хранения и должна содержать консерванты, препятствующие контаминирующему действию микроорганизмов, таких как бактерии и грибки. Носитель может быть растворителем или диспергирующей средой, содержащей, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и подобные) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, применяя покрытие, такое как лецитин, поддерживая желаемый размер частиц в случае дисперсии и посредством применения сурфактантов. Предотвратить действие микроорганизмов можно с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и подобного. Во многих случаях в композицию предпочтительно включать изотонические агенты, например, сахара, многоатомные спирты, такие как маннит, сорбит, хлорид натрия. Пролонгированную адсорбцию композиций для инъекции можно обеспечить за счет включения в композицию агента, задерживающего адсорбцию, например, моностеарата алюминия и желатина.
[000169] Стерильные растворы для инъекции можно получить посредством включения активного соединения в необходимое количество соответствующего растворителя с одним ингредиентом, перечисленным выше, или с комбинацией ингредиентов, перечисленных выше, как это требуется, и последующей стерилизации фильтрованием. Как правило, дисперсии получают посредством включения активного соединения в стерильный инертный носитель, содержащий основную диспергирующую среду и другие необходимые ингредиенты из числа пересиленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекции способами получения являются вакуумное высушивание и лиофилизация с образованием порошка активного ингредиента с любыми дополнительными желаемыми ингредиентами из их раствора, предварительно стерилизованного фильтрованием.
[000170] Пероральные композиции, как правило, включают инертный растворитель или съедобный носитель. Они могут быть заключены в желатиновые капсулы или из них могут быть сформированы таблетки. Для перорального терапевтического введения к активному соединению можно добавлять эксципиенты и применять в форме таблеток, пастилок или капсул. Пероральные композиции также можно получить с помощью жидкого носителя для применения в качестве ополаскивателя для ротовой полости, в котором соединение в жидком носителе вводят перорально, проводят полоскание, сплевывают или проглатывают. Фармацевтически совместимые связывающие агенты и/или адъювантные материалы можно включать в качестве части композиции. Таблетки, пилюли, капсулы, пастилки и подобное могут содержать любой из следующих ингредиентов или соединения похожей природы: связывающий агент, такой как микрокристаллическая целлюлоза, трагантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, разрыхлитель, такой как альгиновая кислота, Primogel или кукурузный крахмал; лубрикант, такой как стеарат магния или Sterotes; регулятор сыпучести, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор.
[000171] Для ингаляционного введения соединения доставляют в форме аэрозоля, распыляемого из контейнера под давлением или из диспенсера, содержащего подходящий пропеллент, напр., газ, такой как углекислый газ, или из небулайзера.
[000172] Системное введение также может быть трансмукозальным или трансдермальным. Для трансмукозального или трансдермального введения в форме применяют смачивающий агент. Такие смачивающие агенты, как правило, известны в данной области техники и включают, например, для трансмукозального введения детергенты, соли желчных кислот и производные фусидовой кислоты. Трансмукозальное введение можно проводить, применяя назальные спреи или суппозитории. Для трансдермального введения активные соединения составляют в форме мазей, бальзамов, гелей или кремов, как хорошо известно в данной области техники.
[000173] Соединения также можно составить в форме суппозиториев (напр., со стандартными суппозиторными основами, такими как какао-масло и другие глицериды) или удерживающих клизм для ректальной доставки.
[000174] В одном варианте осуществления настоящего изобретения активные соединения получают с носителями, которые защищают соединение от быстрого выведения из организма, такие как формы с контролируемым высвобождением, включая импланты и микрокапсулированные системы доставки. Можно применять биодеградируемые, биосовместимые полимеры, такие как винилацетат, полиангидриды, полигликолевую кислоту, коллаген, сложные полиортоэфиры и полимолочную кислоту. Способы составления таких форм знакомы специалистам в данной области техники. Материалы также можно приобрести в Alza Corporation and Nova Pharmaceuticals, Inc. Также в качестве фармацевтически приемлемых носителей можно применять липосомные суспензии. Их можно получить в соответствии со способами, известными специалистам в данной области техники, например, как описано в патенте США № 4522811.
[000175] Особенно удобно составить пероральные или парентеральные композиции в дозированной форме для облегчения введения и обеспечения единообразия дозирования. Как применяют в настоящей заявке, дозированная лекарственная форма обозначает физически разделенные единицы, соответствующие однократным дозам для субъекта, проходящего лечение; каждая единица содержит заранее определенное количество активного соединения, рассчитанное таким образом, чтобы обеспечить желаемый терапевтический эффект, ассоциированное с желаемым фармацевтическим носителем. Технические характеристики дозированной лекарственной формы настоящего изобретения определяются и зависят от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, и от ограничений, известных в области составления смеси такого активного соединения для лечения индивидов.
[000176] Фармацевтические композиции могут быть включены в контейнер, упаковку или диспенсер вместе с инструкцией по введению.
[000177] Настоящее изобретение будет далее описано в следующих примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
ПРИМЕРЫ
Пример 1: слитые белки «AAT-Fc» и их варианты
[000178] Приведенные в качестве примера, но не ограничения слитые белки «AAT-Fc» в соответствии с настоящим изобретением включают следующие последовательности. В то время как эти примеры включают шарнирную последовательность и/или линкерную последовательность, слитые белки настоящего изобретения можно получать, применяя любую шарнирную последовательность и/или линкерную последовательность, подходящую по длине и/или гибкости. Альтернативно, слитые белки можно получать без применения шарнирной и/или линкерной последовательности. Например, можно напрямую соединять полипептидные компоненты.
[000179] Приведенным в качестве примера слитым белком «AAT-Fc» является AAT-hFc1 (Fc человеческого IgG1), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), а полипептид IgG-Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 3).
AAT-hFc1 (Fc человеческого IgG1)
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQKEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:16)
[000180] Приведенным в качестве примера слитым белком «AAT-Fc» является AAT-hFc2 (Fc человеческого IgG2), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), а полипептид IgG-Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 4).
AAT-hFc2 (Fc человеческого IgG2)
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK ERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 17)
[000181] Приведенным в качестве примера слитым белком «AAT-Fc» является AAT-MM-EL-hFc1 (Fc человеческого IgG1, Met351Glu/Met358Leu), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 34), полипептид IgG-Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 3), мутация Met351Glu обведена рамкой, а мутация Met358Leu выделена серым.
AAT-MM-EL-hFc1(Fc человеческого IgG1, Met351Glu/Met358Leu)

[000182] Приведенным в качестве примера слитым белком «AAT-Fc» является AAT-MM-EL-hFc2 (Fc человеческого IgG2, Met351Glu/Met358Leu), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 34), полипептид IgG-Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 4), мутация Met351Glu обведена рамкой, а мутация Met358Leu выделена серым.
AAT-MM-EL-hFc2(Fc человеческого IgG2, Met351Glu/Met358Leu)

[000183] Приведенным в качестве примера слитым белком «AAT-Fc» является AAT-MM-LL-hFc1 (Fc человеческого IgG1, Met351Leu/Met358Leu), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 35), полипептид IgG-Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 3), мутация Met351Leu выделена черным, а мутация Met358Leu выделена серым.
AAT-MM-LL-hFc1 (Fc человеческого IgG1, Met351Leu/Met358Leu)
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGALFLEAIPLSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK EPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:36)
[000184] Приведенным в качестве примера слитым белком «AAT-Fc» является AAT-MM:LL-hFc2 (Fc человеческого IgG2, Met351Leu/Met358Leu), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 35), полипептид IgG-Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 4), мутация Met351Leu выделена черным, а мутация Met358Leu выделена серым.
AAT-MM:LL-hFc2 (Fc человеческого IgG2, Met351Leu/Met358Leu)
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGALFLEAIPLSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQKERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:20)
[000185] Приведенным в качестве примера слитым белком «AAT-Fc» является AAT-hFc1-AAT (человеческий IgG1), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), полипептид IgG-Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 3).
AAT-hFc1-AAT (человеческий IgG1)
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQKEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKASTGSEDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK (SEQ ID NO:21)
AAT-EL-Fc-IgG1-DV,ΔG,IDL (AAT: Met351Glu/Met358Leu; Fc IgG1: Leu234Val/Leu235Ala, делеция Gly236, Met252Ile, Thr256Asp, Met428Leu)

AAT-EL-Fc-IgG4-PE,IDL (AAT: Met351Glu/Met358Leu; Fc IgG4: Ser228Pro Leu235Glu, Met252Ile, Thr256Asp, Met428Leu)

[000186] Эти приведенные в качестве примеров слитые белки «AAT-Fc» получали, применяя следующие техники.
[000187] Ген, кодирующий человеческий AAT, амплифицировали посредством ПЦР с кДНК печени человека (Zyagen). Специфичные точечные мутации в гене, кодирующем AAT или участок Fc, получали с помощью ПЦР с перекрывающимися праймерами. Ген, кодирующий AAT, клонировали в рамке с геном, кодирующим шарнирный участок, за которым следует домен CH2 и домен CH3 человеческого IgG1, IgG2, IgG3, IgG4 или IgM, в вектор для экспрессии в млекопитающих, содержащий последовательность секреторного сигнала млекопитающих, расположенную выше сайта вставки гена AAT. Этими экспрессионными векторами трансфицировали клетки млекопитающих (а именно клетки HEK293 или CHO) и выращивали в течение нескольких дней при 8% CO2 при 37°C. Рекомбинантные слитые белки «AAT-Fc» выделяли из супернатанта эксперссирующих клеток с помощью хроматографии на протеине А. Важно отметить, что элюирование слитого белка «AAT-Fc» со смолы с протеином А проводили буфером с нейтральным pH (Gentle Ag/Ab Elution Buffer, Thermo Scientific). Слитый белок «AAT-Fc» нельзя элюировать со смолы с протеином А, применяя стандартную элюцию при низком pH, поскольку способность AAT ингибировать эластазу нейтрофилов нарушается при обработке низким pH, вероятно, из-за опосредованной низким pH олигомеризации AAT. Фигура 1F показывает эффекты, которые оказывает элюирование при низком pH на способность AAT ингибировать эластазу нейтрофилов. Слитый белок «AAT-Fc» можно очистить либо с помощью протеина А и буфера для элюирования с низким pH, либо с помощью альфа-1-антитрипсиновой аффинной матрицы CaptureSelect® (BAC BV).
[000188] Очищенные слитые белки «AAT-Fc» исследовали на предмет активности, определяя их способность ингибировать эластазу нейтрофилов. Фигуры 1B и 1D показывают результаты электрофореза очищенного из сыворотки AAT (sdAAT) и слитых белков «AAT-Fc» в ПААГ с додецилсульфатом натрия в восстанавливающих условиях (Фиг. 1B- дорожка 1: sdAAT, дорожка 2: AAT-Fc (SEQ ID NO: 16), дорожка 3: AAT-EL-Fc (SEQ ID NO: 18), Фиг. 1D AAT-Fc-AAT (SEQ ID NO: 20). Белки визуализировали с помощью окрашивания Кумасси синим.
[000189] Для исследования активности эластазы нейтрофилов человека применяли исследование флуоресценции в микропланшетах. Ингибирующую активность измеряли по сопутствующему уменьшению остаточной активности эластазы нейтрофилов, проводя следующее исследование. Буфер для исследования состоит из 100 мМ Tris pH 7,4, 500 мМ NaCl и 0,0005% Triton X-100. Эластазу нейтрофилов человека применяют в конечной концентрации 5 нМ (также можно применять концентрацию 1-20 нМ). Флуоресцентный пептидный субстрат AAVP-AMC применяют в конечной концентрации 100 мкМ в данном исследовании. Планшетный спектрофотометр Gemini EM plate reader производства Molecular Devices применяют для считывания результатов исследования кинетики при длинах волн возбуждения и испускания 370 нм и 440 нм, соответственно, и при пороговом значении 420 нм. Результаты считывают в течение 10 мин при комнатной температуре, проводя сканирование каждые 5-10 секунд. Значение Vmax в секунду соответствует остаточной активности эластазы нейтрофилов; его отмечают на графике для каждой концентрации ингибитора. Пересечение с осью абсцисс указывает на концентрацию ингибитора, необходимую для полной инактивации исходной концентрации эластазы нейтрофилов в исследовании. Полученный из сыворотки человека AAT (sdAAT, serum derived AAT) применяли в качестве положительного контроля в этих исследованиях. Слитые белки «AAT-Fc» обладают способностью ингибировать эластазу нейтрофилов, как показано на Фигуре 1C. При связывании двух полипептидов AAT с одним полипептидом Fc (AAT-Fc-AAT) способность ингибировать эластазу нейтрофилов усиливается по сравнению как с sdAAT, так и со слитым белком «AAT-Fc», содержащим единственный полипептид AAT (Фигура 1E). Представленные здесь исследования впервые демонстрируют, что AAT можно связать с участком Fc при сохранении способности ингибировать эластазу нейтрофилов. Особенно интересно, что слитый белок «AAT-Fc-AAT» является более сильным ингибитором эластазы нейтрофилов.
[000190] Фигура 1F демонстрирует устойчивость слитого белка «AAT-EL-Fc (M351E, M358L)» к инактивации при окислении. Слитые белки AAT, AAT-Fc (wt), AAT-EL-Fc (M351E, M358L) и AAT-EM-Fc (M351E) обрабатывали 33 мМ H2O2 и сравнивали с необработанными слитыми белками в исследованиях ингибирования эластазы нейтрофилов. Ингибирование эластазы нейтрофилов AAT-EL-Fc не нарушалось при окислении в отличие от других исследуемых белков.
[000191] Также слитый белок «AAT-Fc» обладал более продолжительным временем полувыведения из сыворотки крыс по сравнению с получаемым из сыворотки AAT (Фигура 1H). В этих исследованиях трем крысам в каждом исследовании инъецировали внутривенно 10 мг/кг sdAAT или AAT-Fc. В разные временные точки в течение 48-часового периода отбирали образцы сыворотки. Концентрацию ATT в сыворотке определяли с помощью ELISA. Полученные результаты демонстрируют, что слитые белки настоящего изобретения обладают улучшенными фармакокинетическими свойствами и терапевтической формой, превосходящей получаемый из сыворотки AAT, в отношении многих воспалительных состояний и инфекционных заболеваний человека.
Пример 2: слитые белки «AAT-действующая на TNFα молекула»
[000192] Исследования, представленные в настоящей заявке, описывают несколько не ограничивающих примеров рекомбинантных производных AAT, содержащих человеческий AAT, связанный с антителом к TNFα или с производным рецептора TNFα. Эти примеры представлены ниже для дальнейшей иллюстрации различных свойств настоящего изобретения. Примеры также иллюстрируют подходящую методологию осуществления настоящего изобретения. Эти примеры не ограничивают и заявленное изобретения и не предназначены для ограничения заявленного изобретения.
[000193] Представленные ниже слитые белки включают последовательности действующих на цитокины полипептидов из (i) антитела к TNFα D2E7 (также известного как адалимумаб или Humira®) или (ii) внеклеточного домена рецептора TNFα типа 2 (TNFR2-ECD) или получаемых из(i) антитела к TNFα D2E7 (также известного как адалимумаб или Humira®) или (ii) внеклеточного домена рецептора TNFα типа 2 (TNFR2-ECD). Полипептид AAT, являющийся частью слитого белка, подчеркнут, константные области антитела (CH1-шарнир-CH2-CH3 или CL) выделены косым шрифтом, а 2E7-VH, D2E7-VK и TNFR2-ECD выделены в тексте жирным шрифтом. В то время как эти примеры включают шарнирную последовательность и/или линкерную последовательность, слитые белки настоящего изобретения можно получать, применяя любую шарнирную последовательность и/или линкерную последовательность, подходящую по длине и/или гибкости. Альтернативно, слитые белки можно получать без применения шарнирной и/или линкерной последовательности.
[000194] Приведенным в качестве примера слитым белком «AAT-TNFα» является «D2E7-легкая цепь-AAT линкер (G3S)2», описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), D2E7-VK выделен в тексте жирным шрифтом (SEQ ID NO: 37), а константные области антитела выделены косым шрифтом (SEQ ID NO: 38).
D2E7-легкая цепь-AAT линкер (G3S)2
DIQMTQSPSSLSASVGDRVTITCRASQGIRNYLAWYQQKPGKAPKLLIYAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQRYNRAPYTFGQGTKVEIK RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECGGGSGGGSEDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK (SEQ ID NO:22)
[000195] Приведенным в качестве примера слитым белком «AAT-TNFα» является «D2E7-легкая цепь-AAT линкер ASTGS», описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), D2E7-VK выделен в тексте жирным шрифтом (SEQ ID NO: 37), а константные области антитела выделены косым шрифтом (SEQ ID NO: 38).
D2E7-легкая цепь-AAT линкер ASTGS
DIQMTQSPSSLSASVGDRVTITCRASQGIRNYLAWYQQKPGKAPKLLIYAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQRYNRAPYTFGQGTKVEIK RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECASTGSEDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK (SEQ ID NO:23)
[000196] Приведенным в качестве примера слитым белком «AAT-TNFα» является «D2E7-тяжелая цепь-AAT линкер (G3S)2», описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), D2E7-VH выделен в тексте жирным шрифтом (SEQ ID NO: 39), а константные области антитела выделены косым шрифтом (SEQ ID NO: 40).
D2E7-тяжелая цепь-AAT линкер (G3S)2
EVQLVESGGGLVQPGRSLRLSCAASGFTFDDYAMHWVRQAPGKGLEWVSAITWNSGHIDYADSVEGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCAKVSYLSTASSLDYWGQGTL VTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKGGGSGGGSEDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK (SEQ ID NO:24)
[000197] Приведенным в качестве примера слитым белком «AAT-TNFα» является «D2E7- тяжелая цепь-AAT линкер ASTGS», описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), D2E7-VH выделен в тексте жирным шрифтом (SEQ ID NO: 39), а константные области антитела выделены косым шрифтом (SEQ ID NO: 40).
D2E7- тяжелая цепь-AAT линкер ASTGS
EVQLVESGGGLVQPGRSLRLSCAASGFTFDDYAMHWVRQAPGKGLEWVSAITWNSGHIDYADSVEGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCAKVSYLSTASSLDYWGQGTL VTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKASTGSEDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK (SEQ ID NO:25)
[000149] Приведенным в качестве примера слитым белком «AAT-TNFα» является «TNFR2-ECD-Fc1-AAT линкер (G3S)2», описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), TNFR2-ECD выделен в тексте жирным шрифтом (SEQ ID NO: 41), а константные области антитела выделены косым шрифтом (SEQ ID NO: 42).
TNFR2-ECD-Fc1-AAT линкер (G3S)2
LPAQVAFTPYAPEPGSTCRLREYYDQTAQMCCSKCSPGQHAKVFCTKTSDTVCDSCEDSTYTQLWNWVPECLSCGSRCSSDQVETQACTREQNRICTCRPGWYCALSKQEGCRLCAPLRKCRPGFGVARPGTETSDVVCKPCAPGTFSNTTSSTDICRPHQICNVVAIPGNASMDAVCTSTSPTRSMAPGAVHLPQPVSTRSQHTQPTPEPSTAPSTSFLLPMGPSPPAEGSTGD EPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPQVKFNWYVDGVQVHNAKTKPREQQYNSTYRVVSVLTVLHQNWLDGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK GGGSGGGSEDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK (SEQ ID NO:26)
[000150] Приведенным в качестве примера слитым белком «AAT-TNFα» является «TNFR2-ECD-Fc1-AAT линкер ASTGS», описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), TNFR2-ECD выделен в тексте жирным шрифтом (SEQ ID NO: 41), а константные области антитела выделены косым шрифтом (SEQ ID NO: 42).
TNFR2-ECD-Fc1-AAT линкер ASTGS
LPAQVAFTPYAPEPGSTCRLREYYDQTAQMCCSKCSPGQHAKVFCTKTSDTVCDSCEDSTYTQLWNWVPECLSCGSRCSSDQVETQACTREQNRICTCRPGWYCALSKQEGCRLCAPLRKCRPGFGVARPGTETSDVVCKPCAPGTFSNTTSSTDICRPHQICNVVAIPGNASMDAVCTSTSPTRSMAPGAVHLPQPVSTRSQHTQPTPEPSTAPSTSFLLPMGPSPPAEGSTGD EPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPQVKFNWYVDGVQVHNAKTKPREQQYNSTYRVVSVLTVLHQNWLDGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKASTGSEDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK (SEQ ID NO:27)
[000198] Эти приведенные в качестве примеров слитые белки «AAT-действующая на TNFα молекула» получали, применяя следующие техники.
[000199] Гены, кодирующие вариабельный участок тяжелой цепи (VH, variable heavy) и вариабельный участок каппа-цепи (VK, variable kappa) антитела D2E7 к TNFα получали посредством синтеза генов. Ген D2E7-VH клонировали в рамке с геном, кодирующим константную область тяжелой цепи человеческого IgG1, состоящую из домена CH1, шарнирного домена, домена CH2 и домена CH3, в вектор для экспрессии в млекопитающих, содержащий последовательность секреторного сигнала млекопитающих, расположенную выше сайта для вставки домена VH (D2E7-HC). Ген D2E7-VK клонировали в рамке с константным доменом легкой каппа-цепи человеческого антитела (CL) в вектор для экспрессии в млекопитающих, содержащий последовательность секреторного сигнала млекопитающих, расположенную выше сайта для вставки домена VK (D2E7-LC). Ген, кодирующий AAT, и расположенную рядом на 5'-конце линкерную последовательность клонировали в рамке с 3'-конца кодирующей последовательности либо домена CH3 гена тяжелой цепи D2E7 (D2E7-HC-AAT), либо домена CL гена легкой цепи D2E7 (D2E7-LC-AAT) в описанные выше векторы для экспрессии в млекопитающих. Внеклеточный домен рецептора TNFα 2 (TNFR2-ECD) получали посредством синтеза гена и клонировали в рамке с геном, кодирующим шарнирную область, за которой располагается домен CH2 и домен CH3 человеческого IgG1 (hFc1) в вектор для экспрессии в млекопитающих, содержащий последовательность секреторного сигнала млекопитающих, расположенную выше сайта для вставки TNFR2-ECD. Ген, кодирующий AAT, и расположенную рядом на 5'-конце линкерную последовательность клонировали в рамке с 3'-конца гена, кодирующего TNFR2-ECD-hFc1, в вектор для экспрессии в млекопитающих (TNFR2-ECD-hFc1-AAT).
[000200] Проводили котрансфекцию клеток млекопитающих (а именно клеток HEK293 или CHO) экспрессионным вектором D2E7-HC-AAT либо с экспрессионным вектором D2E7-LC, либо с экспрессионным вектором D2E7-LC-AAT для получения антитела D2E7 с AAT, связанным с С-концом тяжелой цепи или С-концом как тяжелой, так и легкой цепи, соответственно. Проводили котрансфекцию клеток млекопитающих D2E7-LC-AAT с экспрессионным вектором D2E7-HC для получения антитела D2E7 с AAT, связанным с С-концом легкой цепи. Проводили трансфекцию клеток млекопитающих экспрессионным вектором TNFR2-hFc1-AAT. Трансфицированные клетки выращивали в течение нескольких дней при 8% CO2 при 37°C.
[000201] Рекомбинантные слитые с AAT действующие на TNFα белки очищали из супернатанта экспрессирующих клеток с помощью хроматографии на протеине А. Применяли буфер с близким к нейтральному значением pH (Gentle Ag/Ab Elution Buffer, Thermo Scientific) для элюирования слитых с AAT действующих на TNFα белков со смолы с протеином А.
[000202] Фигура 2B показывает результаты электрофореза в ПААГ в присутствии додецилсульфата натрия с антителом D2E7 в индивидуальном виде (дорожка 1) и с вариантом, в котором AAT слит с тяжелой цепью D2E7 (дорожка 2). Белки визуализировали с помощью окрашивания Кумасси синим.
[000203] Очищенные слитые белки «AAT-действующая на TNFα молекула» исследовали на предмет активности, определяя их способность ингибировать эластазу нейтрофилов. Выделенный из сыворотки AAT (sdAAT, serum derived AAT) применяли в качестве положительного контроля в этих исследованиях. Исследования ингибирования эластазы нейтрофилов проводили, как описано выше. Фигура 2C показывает данные относительно sdAAT: слитый белок «AAT-действующая на TNFα молекула» проявляет похожее ингибирование эластазы нейтрофилов, что свидетельствует о том, что ингибирующая способность AAT не нарушается при связывании с антителом.
Пример 3: «AAT-Fc-SLPI» и «AAT-Fc-элафин»
[000204] Исследования, представленные в настоящей заявке, описывают несколько не ограничивающих примеров производных рекомбинантного AAT, содержащих человеческий AAT, связанный с белком, содержащим домен WAP. Эти примеры представлены ниже для дальнейшей иллюстрации различных свойств настоящего изобретения. Примеры также иллюстрируют полезную методологию осуществления настоящего изобретения. Полипептид AAT, являющийся частью слитого белка, подчеркнут, Fc, являющийся частью слитого белка, выделен косым шрифтом, а полипептид, содержащий домен WAP, выделен жирным шрифтом. В то время как эти примеры включают шарнирную последовательность и/или линкерную последовательность, слитые белки настоящего изобретения можно получать, применяя любую шарнирную последовательность и/или линкерную последовательность, подходящую по длине и/или гибкости. Альтернативно, слитые белки можно получать без применения шарнирной и/или линкерной последовательности. Например, можно напрямую соединять полипептидные компоненты.
[000205] Приведенным в качестве примера слитым белком «AAT-Fc-SLPI» является AAT-hFc1-SLPI (Fc человеческого IgG1), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 3), а полипептид, содержащий домен WAP, выделен жирным шрифтом (SEQ ID NO: 9).
AAT-hFc1-SLPI (Fc человеческого IgG1)
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK EPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKASTGS SGKSFKAGVCPPKKSAQCLRYKKPECQSDWQCPGKKRCCPDTCGIKCLDPVDTPNPTRRKPGKCPVTYGQCLMLNPPNFCEMDGQCKRDLKCCMGMCGKSCVSPVKA (SEQ ID NO:28)
[000206] Приведенным в качестве примера слитым белком «AAT-Fc-SLPI» является AAT-hFc1-SLPI (Fc человеческого IgG1), описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), Fc, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 3), а полипептид, содержащий домен WAP, выделен жирным шрифтом (SEQ ID NO: 12).
AAT-hFc1-элафин (Fc человеческого IgG1)
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQK EPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKASTGS AVTGVPVKGQDTVKGRVPFNGQDPVKGQVSVKGQDKVKAQEPVKGPVSTKPGSCPIILIRCAMLNPPNRCLKDTDCPGIKKCCEGSCGMACFVPQ (SEQ ID NO:29)
[000207] Гены, кодирующие SLPI и элафин, амплифицировали посредством ПЦР с кДНК селезенки человека (Zyagen). Эти гены клонировали в вектор для экспрессии в млекопитающих из Примера 1, в котором ген SLPI или элафина вставляли в рамке с геном AAT-Fc. Этими экспрессионными векторами трансфицировали клетки млекопитающих (а именно клетки HEK293 или CHO) и выращивали в течение нескольких дней при 8% CO2 при 37°C. Рекомбинантные слитые белки «AAT-Fc-домен WAP» выделяли из супернатанта эксперссирующих клеток с помощью хроматографии на протеине А. Применяли буфер с близким к нейтральному значением pH (Gentle Ag/Ab Elution Buffer, Thermo Scientific) для элюирования слитого белка «AAT-Fc-домен WAP» со смолы с протеином А.
[000208] Фигура 3B показывает результаты электрофореза в ПААГ в присутствии додецилсульфата натрия со слитыми белками «AAT-Fc-домен WAP» (дорожка 1: AAT-Fc-элафин, дорожка 2: AAT-Fc-SLPI). Белки визуализировали с помощью окрашивания Кумасси синим. Очищенные слитые белки «AAT-Fc-домен WAP» исследовали на предмет активности, определяя их способность ингибировать эластазу нейтрофилов. Исследования ингибирования эластазы нейтрофилов проводили, как описано выше. Выделенный из сыворотки человека AAT (sdAAT, serum derived AAT) и слитый белок «AAT-Fc» применяли в качестве положительного контроля в этих исследованиях. Относительно sdAAT слитый белок «AAT-Fc-действующая на WAP молекула» проявляет более выраженную активность в отношении ингибирования эластазы нейтрофилов (Фигура 3C).
Пример 4: «AAT-альбумин»
[000209] Исследования, представленные в настоящей заявке, описывают несколько не ограничивающих примеров производных рекомбинантного AAT, содержащих человеческий AAT, связанный с полипептидом альбумина. Эти примеры представлены ниже для дальнейшей иллюстрации различных свойств настоящего изобретения. Примеры также иллюстрируют полезную методологию осуществления настоящего изобретения. Эти примеры не ограничивают настоящее изобретение и не предназначены для ограничения заявленного изобретения. AAT, являющийся частью слитого белка, подчеркнут, альбумин, являющийся частью слитого белка, выделен косым шрифтом. Например, можно напрямую соединять полипептидные компоненты.
[000210] Приведенным в качестве примера слитым белком «AAT-альбумин» является AAT- HSA, описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), полипептид альбумина, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 14).
AAT-HSA
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQKASTGSDAHKSEVAHRFKDLGEENFKALVLIAFAQYLQQCPFEDHVKLVNEVTEFAKTCVADESAENCDKSLHTLFGDKLCTVATLRETYGEMADCCAKQEPERNECFLQHKDDNPNLPRLVRPEVDVMCTAFHDNEETFLKKYLYEIARRHPYFYAPELLFFAKRYKAAFTECCQAADKAACLLPKLDELRDEGKASSAKQRLKCASLQKFGERAFKAWAVARLSQRFPKAEFAEVSKLVTDLTKVHTECCHGDLLECADDRADLAKYICENQDSISSKLKECCEKPLLEKSHCIAEVENDEMPADLPSLAADFVESKDVCKNYAEAKDVFLGMFLYEYARRHPDYSVVLLLRLAKTYETTLEKCCAAADPHECYAKVFDEFKPLVEEPQNLIKQNCELFEQLGEYKFQNALLVRYTKKVPQVSTPTLVEVSRNLGKVGSKCCKHPEAKRMPCAEDYLSVVLNQLCVLHEKTPVSDRVTKCCTESLVNRRPCFSALEVDETYVPKEFNAETFTFHADICTLSEKERQIKKQTALVELVKHKPKATKEQLKAVMDDFAAFVEKCCKADDKETCFAEEGKKLVAASQAALGL (SEQ ID NO:30)
[000211] Приведенным в качестве примера слитым белком «AAT-альбумин» является «AAT- домен 3 HSA», описанный в настоящей заявке. Как показано ниже, полипептид AAT, являющийся частью слитого белка, подчеркнут (SEQ ID NO: 2), полипептид альбумина, являющийся частью слитого белка, выделен косым шрифтом (SEQ ID NO: 15).
AAT-домен 3 HSA
EDPQGDAAQKTDTSHHDQDHPTFNKITPNLAEFAFSLYRQLAHQSNSTNIFFSPVSIATAFAMLSLGTKADTHDEILEGLNFNLTEIPEAQIHEGFQELLRTLNQPDSQLQLTTGNGLFLSEGLKLVDKFLEDVKKLYHSEAFTVNFGDTEEAKKQINDYVEKGTQGKIVDLVKELDRDTVFALVNYIFFKGKWERPFEVKDTEEEDFHVDQVTTVKVPMMKRLGMFNIQHCKKLSSWVLLMKYLGNATAIFFLPDEGKLQHLENELTHDIITKFLENEDRRSASLHLPKLSITGTYDLKSVLGQLGITKVFSNGADLSGVTEEAPLKLSKAVHKAVLTIDEKGTEAAGAMFLEAIPMSIPPEVKFNKPFVFLMIEQNTKSPLFMGKVVNPTQKASTGSEEPQNLIKQNCELFEQLGEYKFQNALLVRYTKKVPQVSTPTLVEVSRNLGKVGSKCCKHPEAKRMPCAEDYLSVVLNQLCVLHEKTPVSDRVTKCCTESLVNRRPCFSALEVDETYVPKEFNAETFTFHADICTLSEKERQIKKQTALVELVKHKPKATKEQLKAVMDDFAAFVEKCCKADDKETCFAEEGKKLVA (SEQ ID NO:31)
[000212] Ген, кодирующий человеческий сывороточный альбумин (HSA, human serum albumin), амплифицировали посредством ПЦР с кДНК печени человека (Zyagen). Получали вектор для экспрессии в млекопитающих, в котором ген, кодирующий HSA или домен 3 HSA, клонировали в рамке с 3'-конца кодирующего AAT гена, содержащего последовательность секреторного сигнала млекопитающих, расположенную выше AAT.
[000213] Этими экспрессионными векторами трансфицировали клетки млекопитающих (а именно клетки HEK293 или CHO) и выращивали в течение нескольких дней при 8% CO2 при 37°C. Рекомбинантные слитые белки «AAT-HSA» выделяли из супернатанта эксперссирующих клеток с помощью с помощью альфа-1-антитрипсиновой аффинной матрицы CaptureSelect® (BAC BV), при этом буфер для связывания состоял из 20 мМ Трис, 150 мМ NaCl, pH 7,4, а буфер для элюирования состоял из 20 мМ Трис, 2M MgCl2 pH 7,4.
[000214] Фигура 4B показывает результаты электрофореза в ПААГ в присутствии додецилсульфата натрия со слитым белком «AAT-HSA». Белки визуализировали с помощью окрашивания Кумасси синим. Очищенные слитые белки «AAT-HSA» исследовали на предмет активности, определяя их способность ингибировать эластазу нейтрофилов. Исследования ингибирования эластазы нейтрофилов проводили, как описано выше. Выделенный из сыворотки человека AAT (sdAAT, serum derived AAT) применяли в качестве положительного контроля в этих исследованиях. Относительно sdAAT слитый белок «AAT- HSA» проявляет схожую активность в отношении ингибирования эластазы нейтрофилов, указывая на то, что связывание с альбумином не мешает ААТ ингибировать эластазу нейтрофилов (Фигура 4C).
Другие варианты осуществления настоящего изобретения
[000215] В то время как настоящее изобретение было описано вместе с его подробным описанием, приведенное выше описание предназначено для иллюстрации, но не для ограничения объема изобретения, определяемого объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации входят в объем следующей формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Inhibrx LP
Eckelman, Brendan P.
Timmer, John C.
Deveraux, Quinn
<120> СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> INHI-002/002WO
<150> US 14/524,832
<151> 2014-10-27
<160> 80
<170> PatentIn version 3.5
<210> 1
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность петли реактивного сайта
<400> 1
Gly Thr Glu Ala Ala Gly Ala Met Phe Leu Glu Ala Ile Pro Met Ser
1 5 10 15
Ile Pro Pro Glu Val Lys Phe Asn Lys
20 25
<210> 2
<211> 390
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn
385 390
<210> 3
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 4
<211> 216
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 5
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 6
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 7
<211> 218
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Ile Ala Glu Leu Pro Pro Lys Val Ser Val Phe Val Pro Pro Arg Asp
1 5 10 15
Gly Phe Phe Gly Asn Pro Arg Lys Ser Lys Leu Ile Cys Gln Ala Thr
20 25 30
Gly Phe Ser Pro Arg Gln Ile Gln Val Ser Trp Leu Arg Glu Gly Lys
35 40 45
Gln Val Gly Ser Gly Val Thr Thr Asp Gln Val Gln Ala Glu Ala Lys
50 55 60
Glu Ser Gly Pro Thr Thr Tyr Lys Val Thr Ser Thr Leu Thr Ile Lys
65 70 75 80
Glu Ser Asp Trp Leu Gly Gln Ser Met Phe Thr Cys Arg Val Asp His
85 90 95
Arg Gly Leu Thr Phe Gln Gln Asn Ala Ser Ser Met Cys Val Pro Asp
100 105 110
Gln Asp Thr Ala Ile Arg Val Phe Ala Ile Pro Pro Ser Phe Ala Ser
115 120 125
Ile Phe Leu Thr Lys Ser Thr Lys Leu Thr Cys Leu Val Thr Asp Leu
130 135 140
Thr Thr Tyr Asp Ser Val Thr Ile Ser Trp Thr Arg Gln Asn Gly Glu
145 150 155 160
Ala Val Lys Thr His Thr Asn Ile Ser Glu Ser His Pro Asn Ala Thr
165 170 175
Phe Ser Ala Val Gly Glu Ala Ser Ile Cys Glu Asp Asp Trp Asn Ser
180 185 190
Gly Glu Arg Phe Thr Cys Thr Val Thr His Thr Asp Leu Pro Ser Pro
195 200 205
Leu Lys Gln Thr Ile Ser Arg Pro Lys Gly
210 215
<210> 8
<211> 132
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Met Lys Ser Ser Gly Leu Phe Pro Phe Leu Val Leu Leu Ala Leu Gly
1 5 10 15
Thr Leu Ala Pro Trp Ala Val Glu Gly Ser Gly Lys Ser Phe Lys Ala
20 25 30
Gly Val Cys Pro Pro Lys Lys Ser Ala Gln Cys Leu Arg Tyr Lys Lys
35 40 45
Pro Glu Cys Gln Ser Asp Trp Gln Cys Pro Gly Lys Lys Arg Cys Cys
50 55 60
Pro Asp Thr Cys Gly Ile Lys Cys Leu Asp Pro Val Asp Thr Pro Asn
65 70 75 80
Pro Thr Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys
85 90 95
Leu Met Leu Asn Pro Pro Asn Phe Cys Glu Met Asp Gly Gln Cys Lys
100 105 110
Arg Asp Leu Lys Cys Cys Met Gly Met Cys Gly Lys Ser Cys Val Ser
115 120 125
Pro Val Lys Ala
130
<210> 9
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Ser Gly Lys Ser Phe Lys Ala Gly Val Cys Pro Pro Lys Lys Ser Ala
1 5 10 15
Gln Cys Leu Arg Tyr Lys Lys Pro Glu Cys Gln Ser Asp Trp Gln Cys
20 25 30
Pro Gly Lys Lys Arg Cys Cys Pro Asp Thr Cys Gly Ile Lys Cys Leu
35 40 45
Asp Pro Val Asp Thr Pro Asn Pro Thr Arg Arg Lys Pro Gly Lys Cys
50 55 60
Pro Val Thr Tyr Gly Gln Cys Leu Met Leu Asn Pro Pro Asn Phe Cys
65 70 75 80
Glu Met Asp Gly Gln Cys Lys Arg Asp Leu Lys Cys Cys Met Gly Met
85 90 95
Cys Gly Lys Ser Cys Val Ser Pro Val Lys Ala
100 105
<210> 10
<211> 51
<212> PRT
<213> Homo sapiens
<400> 10
Thr Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys Leu
1 5 10 15
Met Leu Asn Pro Pro Asn Phe Cys Glu Met Asp Gly Gln Cys Lys Arg
20 25 30
Asp Leu Lys Cys Cys Met Gly Met Cys Gly Lys Ser Cys Val Ser Pro
35 40 45
Val Lys Ala
50
<210> 11
<211> 117
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Met Arg Ala Ser Ser Phe Leu Ile Val Val Val Phe Leu Ile Ala Gly
1 5 10 15
Thr Leu Val Leu Glu Ala Ala Val Thr Gly Val Pro Val Lys Gly Gln
20 25 30
Asp Thr Val Lys Gly Arg Val Pro Phe Asn Gly Gln Asp Pro Val Lys
35 40 45
Gly Gln Val Ser Val Lys Gly Gln Asp Lys Val Lys Ala Gln Glu Pro
50 55 60
Val Lys Gly Pro Val Ser Thr Lys Pro Gly Ser Cys Pro Ile Ile Leu
65 70 75 80
Ile Arg Cys Ala Met Leu Asn Pro Pro Asn Arg Cys Leu Lys Asp Thr
85 90 95
Asp Cys Pro Gly Ile Lys Lys Cys Cys Glu Gly Ser Cys Gly Met Ala
100 105 110
Cys Phe Val Pro Gln
115
<210> 12
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Ala Val Thr Gly Val Pro Val Lys Gly Gln Asp Thr Val Lys Gly Arg
1 5 10 15
Val Pro Phe Asn Gly Gln Asp Pro Val Lys Gly Gln Val Ser Val Lys
20 25 30
Gly Gln Asp Lys Val Lys Ala Gln Glu Pro Val Lys Gly Pro Val Ser
35 40 45
Thr Lys Pro Gly Ser Cys Pro Ile Ile Leu Ile Arg Cys Ala Met Leu
50 55 60
Asn Pro Pro Asn Arg Cys Leu Lys Asp Thr Asp Cys Pro Gly Ile Lys
65 70 75 80
Lys Cys Cys Glu Gly Ser Cys Gly Met Ala Cys Phe Val Pro Gln
85 90 95
<210> 13
<211> 48
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Val Ser Thr Lys Pro Gly Ser Cys Pro Ile Ile Leu Ile Arg Cys Ala
1 5 10 15
Met Leu Asn Pro Pro Asn Arg Cys Leu Lys Asp Thr Asp Cys Pro Gly
20 25 30
Ile Lys Lys Cys Cys Glu Gly Ser Cys Gly Met Ala Cys Phe Val Pro
35 40 45
<210> 14
<211> 585
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Asp Ala His Lys Ser Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu
1 5 10 15
Glu Asn Phe Lys Ala Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln
20 25 30
Gln Cys Pro Phe Glu Asp His Val Lys Leu Val Asn Glu Val Thr Glu
35 40 45
Phe Ala Lys Thr Cys Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys
50 55 60
Ser Leu His Thr Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu
65 70 75 80
Arg Glu Thr Tyr Gly Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro
85 90 95
Glu Arg Asn Glu Cys Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu
100 105 110
Pro Arg Leu Val Arg Pro Glu Val Asp Val Met Cys Thr Ala Phe His
115 120 125
Asp Asn Glu Glu Thr Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg
130 135 140
Arg His Pro Tyr Phe Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg
145 150 155 160
Tyr Lys Ala Ala Phe Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala
165 170 175
Cys Leu Leu Pro Lys Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser
180 185 190
Ser Ala Lys Gln Arg Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu
195 200 205
Arg Ala Phe Lys Ala Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro
210 215 220
Lys Ala Glu Phe Ala Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys
225 230 235 240
Val His Thr Glu Cys Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp
245 250 255
Arg Ala Asp Leu Ala Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser
260 265 270
Ser Lys Leu Lys Glu Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His
275 280 285
Cys Ile Ala Glu Val Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser
290 295 300
Leu Ala Ala Asp Phe Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala
305 310 315 320
Glu Ala Lys Asp Val Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg
325 330 335
Arg His Pro Asp Tyr Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr
340 345 350
Tyr Glu Thr Thr Leu Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu
355 360 365
Cys Tyr Ala Lys Val Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro
370 375 380
Gln Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu
385 390 395 400
Tyr Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro
405 410 415
Gln Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys
420 425 430
Val Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys
435 440 445
Ala Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys Val Leu His
450 455 460
Glu Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser
465 470 475 480
Leu Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr
485 490 495
Tyr Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe His Ala Asp
500 505 510
Ile Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala
515 520 525
Leu Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu
530 535 540
Lys Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys
545 550 555 560
Ala Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val
565 570 575
Ala Ala Ser Gln Ala Ala Leu Gly Leu
580 585
<210> 15
<211> 196
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Glu Glu Pro Gln Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln
1 5 10 15
Leu Gly Glu Tyr Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys
20 25 30
Lys Val Pro Gln Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn
35 40 45
Leu Gly Lys Val Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg
50 55 60
Met Pro Cys Ala Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys
65 70 75 80
Val Leu His Glu Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys
85 90 95
Thr Glu Ser Leu Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val
100 105 110
Asp Glu Thr Tyr Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe
115 120 125
His Ala Asp Ile Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys
130 135 140
Gln Thr Ala Leu Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys
145 150 155 160
Glu Gln Leu Lys Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys
165 170 175
Cys Cys Lys Ala Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys
180 185 190
Lys Leu Val Ala
195
<210> 16
<211> 626
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Слитый белок AAT-hFc1
<400> 16
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Pro Lys Ser Cys Asp
385 390 395 400
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
405 410 415
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
420 425 430
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
435 440 445
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
450 455 460
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
465 470 475 480
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
485 490 495
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
500 505 510
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
515 520 525
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
530 535 540
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
545 550 555 560
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
565 570 575
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
580 585 590
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
595 600 605
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
610 615 620
Gly Lys
625
<210> 17
<211> 622
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Слитый белок AAT-hFc2
<400> 17
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Arg Lys Cys Cys Val
385 390 395 400
Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
405 410 415
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
420 425 430
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
435 440 445
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
450 455 460
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val
465 470 475 480
Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
485 490 495
Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
500 505 510
Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
515 520 525
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
530 535 540
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
545 550 555 560
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp
565 570 575
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
580 585 590
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
595 600 605
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 18
<211> 626
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Слитый белок AAT-MM-EL-hFc1
<400> 18
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Glu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Pro Lys Ser Cys Asp
385 390 395 400
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
405 410 415
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
420 425 430
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
435 440 445
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
450 455 460
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
465 470 475 480
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
485 490 495
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
500 505 510
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
515 520 525
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
530 535 540
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
545 550 555 560
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
565 570 575
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
580 585 590
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
595 600 605
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
610 615 620
Gly Lys
625
<210> 19
<211> 622
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Слитый белок AAT-MM-EL-hFc2
<400> 19
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Glu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Arg Lys Cys Cys Val
385 390 395 400
Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
405 410 415
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
420 425 430
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
435 440 445
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
450 455 460
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val
465 470 475 480
Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
485 490 495
Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
500 505 510
Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
515 520 525
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
530 535 540
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
545 550 555 560
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp
565 570 575
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
580 585 590
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
595 600 605
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 20
<211> 622
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Слитый белок AAT-MM:LL-hFc2
<400> 20
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Leu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Arg Lys Cys Cys Val
385 390 395 400
Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
405 410 415
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
420 425 430
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
435 440 445
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
450 455 460
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val
465 470 475 480
Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
485 490 495
Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
500 505 510
Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
515 520 525
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
530 535 540
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
545 550 555 560
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp
565 570 575
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
580 585 590
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
595 600 605
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 21
<211> 1025
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Слитый белок AAT-hFc1-AAT
<400> 21
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Pro Lys Ser Cys Asp
385 390 395 400
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
405 410 415
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
420 425 430
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
435 440 445
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
450 455 460
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
465 470 475 480
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
485 490 495
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
500 505 510
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
515 520 525
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
530 535 540
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
545 550 555 560
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
565 570 575
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
580 585 590
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
595 600 605
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
610 615 620
Gly Lys Ala Ser Thr Gly Ser Glu Asp Pro Gln Gly Asp Ala Ala Gln
625 630 635 640
Lys Thr Asp Thr Ser His His Asp Gln Asp His Pro Thr Phe Asn Lys
645 650 655
Ile Thr Pro Asn Leu Ala Glu Phe Ala Phe Ser Leu Tyr Arg Gln Leu
660 665 670
Ala His Gln Ser Asn Ser Thr Asn Ile Phe Phe Ser Pro Val Ser Ile
675 680 685
Ala Thr Ala Phe Ala Met Leu Ser Leu Gly Thr Lys Ala Asp Thr His
690 695 700
Asp Glu Ile Leu Glu Gly Leu Asn Phe Asn Leu Thr Glu Ile Pro Glu
705 710 715 720
Ala Gln Ile His Glu Gly Phe Gln Glu Leu Leu Arg Thr Leu Asn Gln
725 730 735
Pro Asp Ser Gln Leu Gln Leu Thr Thr Gly Asn Gly Leu Phe Leu Ser
740 745 750
Glu Gly Leu Lys Leu Val Asp Lys Phe Leu Glu Asp Val Lys Lys Leu
755 760 765
Tyr His Ser Glu Ala Phe Thr Val Asn Phe Gly Asp Thr Glu Glu Ala
770 775 780
Lys Lys Gln Ile Asn Asp Tyr Val Glu Lys Gly Thr Gln Gly Lys Ile
785 790 795 800
Val Asp Leu Val Lys Glu Leu Asp Arg Asp Thr Val Phe Ala Leu Val
805 810 815
Asn Tyr Ile Phe Phe Lys Gly Lys Trp Glu Arg Pro Phe Glu Val Lys
820 825 830
Asp Thr Glu Glu Glu Asp Phe His Val Asp Gln Val Thr Thr Val Lys
835 840 845
Val Pro Met Met Lys Arg Leu Gly Met Phe Asn Ile Gln His Cys Lys
850 855 860
Lys Leu Ser Ser Trp Val Leu Leu Met Lys Tyr Leu Gly Asn Ala Thr
865 870 875 880
Ala Ile Phe Phe Leu Pro Asp Glu Gly Lys Leu Gln His Leu Glu Asn
885 890 895
Glu Leu Thr His Asp Ile Ile Thr Lys Phe Leu Glu Asn Glu Asp Arg
900 905 910
Arg Ser Ala Ser Leu His Leu Pro Lys Leu Ser Ile Thr Gly Thr Tyr
915 920 925
Asp Leu Lys Ser Val Leu Gly Gln Leu Gly Ile Thr Lys Val Phe Ser
930 935 940
Asn Gly Ala Asp Leu Ser Gly Val Thr Glu Glu Ala Pro Leu Lys Leu
945 950 955 960
Ser Lys Ala Val His Lys Ala Val Leu Thr Ile Asp Glu Lys Gly Thr
965 970 975
Glu Ala Ala Gly Ala Met Phe Leu Glu Ala Ile Pro Met Ser Ile Pro
980 985 990
Pro Glu Val Lys Phe Asn Lys Pro Phe Val Phe Leu Met Ile Glu Gln
995 1000 1005
Asn Thr Lys Ser Pro Leu Phe Met Gly Lys Val Val Asn Pro Thr
1010 1015 1020
Gln Lys
1025
<210> 22
<211> 616
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> D2E7-легкая цепь-AAT линкер (G3S)2
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys Gly Gly Gly Ser Gly Gly Gly Ser Glu Asp
210 215 220
Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His Asp Gln
225 230 235 240
Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu Phe Ala
245 250 255
Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr Asn Ile
260 265 270
Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu Ser Leu
275 280 285
Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu Asn Phe
290 295 300
Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe Gln Glu
305 310 315 320
Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu Thr Thr
325 330 335
Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp Lys Phe
340 345 350
Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr Val Asn
355 360 365
Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr Val Glu
370 375 380
Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu Asp Arg
385 390 395 400
Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly Lys Trp
405 410 415
Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe His Val
420 425 430
Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu Gly Met
435 440 445
Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu Leu Met
450 455 460
Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp Glu Gly
465 470 475 480
Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile Thr Lys
485 490 495
Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu Pro Lys
500 505 510
Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly Gln Leu
515 520 525
Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly Val Thr
530 535 540
Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala Val Leu
545 550 555 560
Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe Leu Glu
565 570 575
Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys Pro Phe
580 585 590
Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe Met Gly
595 600 605
Lys Val Val Asn Pro Thr Gln Lys
610 615
<210> 23
<211> 613
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> D2E7-легкая цепь-AAT линкер ASTGS
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys Ala Ser Thr Gly Ser Glu Asp Pro Gln Gly
210 215 220
Asp Ala Ala Gln Lys Thr Asp Thr Ser His His Asp Gln Asp His Pro
225 230 235 240
Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu Phe Ala Phe Ser Leu
245 250 255
Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr Asn Ile Phe Phe Ser
260 265 270
Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu Ser Leu Gly Thr Lys
275 280 285
Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu Asn Phe Asn Leu Thr
290 295 300
Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe Gln Glu Leu Leu Arg
305 310 315 320
Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu Thr Thr Gly Asn Gly
325 330 335
Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp Lys Phe Leu Glu Asp
340 345 350
Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr Val Asn Phe Gly Asp
355 360 365
Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr Val Glu Lys Gly Thr
370 375 380
Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu Asp Arg Asp Thr Val
385 390 395 400
Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly Lys Trp Glu Arg Pro
405 410 415
Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe His Val Asp Gln Val
420 425 430
Thr Thr Val Lys Val Pro Met Met Lys Arg Leu Gly Met Phe Asn Ile
435 440 445
Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu Leu Met Lys Tyr Leu
450 455 460
Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp Glu Gly Lys Leu Gln
465 470 475 480
His Leu Glu Asn Glu Leu Thr His Asp Ile Ile Thr Lys Phe Leu Glu
485 490 495
Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu Pro Lys Leu Ser Ile
500 505 510
Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly Gln Leu Gly Ile Thr
515 520 525
Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly Val Thr Glu Glu Ala
530 535 540
Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala Val Leu Thr Ile Asp
545 550 555 560
Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe Leu Glu Ala Ile Pro
565 570 575
Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys Pro Phe Val Phe Leu
580 585 590
Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe Met Gly Lys Val Val
595 600 605
Asn Pro Thr Gln Lys
610
<210> 24
<211> 853
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> D2E7-тяжелая цепь-AAT линкер (G3S)2
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Gly Gly Gly Ser Gly Gly Gly Ser Glu Asp Pro Gln Gly
450 455 460
Asp Ala Ala Gln Lys Thr Asp Thr Ser His His Asp Gln Asp His Pro
465 470 475 480
Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu Phe Ala Phe Ser Leu
485 490 495
Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr Asn Ile Phe Phe Ser
500 505 510
Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu Ser Leu Gly Thr Lys
515 520 525
Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu Asn Phe Asn Leu Thr
530 535 540
Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe Gln Glu Leu Leu Arg
545 550 555 560
Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu Thr Thr Gly Asn Gly
565 570 575
Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp Lys Phe Leu Glu Asp
580 585 590
Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr Val Asn Phe Gly Asp
595 600 605
Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr Val Glu Lys Gly Thr
610 615 620
Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu Asp Arg Asp Thr Val
625 630 635 640
Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly Lys Trp Glu Arg Pro
645 650 655
Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe His Val Asp Gln Val
660 665 670
Thr Thr Val Lys Val Pro Met Met Lys Arg Leu Gly Met Phe Asn Ile
675 680 685
Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu Leu Met Lys Tyr Leu
690 695 700
Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp Glu Gly Lys Leu Gln
705 710 715 720
His Leu Glu Asn Glu Leu Thr His Asp Ile Ile Thr Lys Phe Leu Glu
725 730 735
Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu Pro Lys Leu Ser Ile
740 745 750
Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly Gln Leu Gly Ile Thr
755 760 765
Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly Val Thr Glu Glu Ala
770 775 780
Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala Val Leu Thr Ile Asp
785 790 795 800
Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe Leu Glu Ala Ile Pro
805 810 815
Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys Pro Phe Val Phe Leu
820 825 830
Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe Met Gly Lys Val Val
835 840 845
Asn Pro Thr Gln Lys
850
<210> 25
<211> 850
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> D2E7-тяжелая цепь-AAT линкер ASTGS
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Ala Ser Thr Gly Ser Glu Asp Pro Gln Gly Asp Ala Ala
450 455 460
Gln Lys Thr Asp Thr Ser His His Asp Gln Asp His Pro Thr Phe Asn
465 470 475 480
Lys Ile Thr Pro Asn Leu Ala Glu Phe Ala Phe Ser Leu Tyr Arg Gln
485 490 495
Leu Ala His Gln Ser Asn Ser Thr Asn Ile Phe Phe Ser Pro Val Ser
500 505 510
Ile Ala Thr Ala Phe Ala Met Leu Ser Leu Gly Thr Lys Ala Asp Thr
515 520 525
His Asp Glu Ile Leu Glu Gly Leu Asn Phe Asn Leu Thr Glu Ile Pro
530 535 540
Glu Ala Gln Ile His Glu Gly Phe Gln Glu Leu Leu Arg Thr Leu Asn
545 550 555 560
Gln Pro Asp Ser Gln Leu Gln Leu Thr Thr Gly Asn Gly Leu Phe Leu
565 570 575
Ser Glu Gly Leu Lys Leu Val Asp Lys Phe Leu Glu Asp Val Lys Lys
580 585 590
Leu Tyr His Ser Glu Ala Phe Thr Val Asn Phe Gly Asp Thr Glu Glu
595 600 605
Ala Lys Lys Gln Ile Asn Asp Tyr Val Glu Lys Gly Thr Gln Gly Lys
610 615 620
Ile Val Asp Leu Val Lys Glu Leu Asp Arg Asp Thr Val Phe Ala Leu
625 630 635 640
Val Asn Tyr Ile Phe Phe Lys Gly Lys Trp Glu Arg Pro Phe Glu Val
645 650 655
Lys Asp Thr Glu Glu Glu Asp Phe His Val Asp Gln Val Thr Thr Val
660 665 670
Lys Val Pro Met Met Lys Arg Leu Gly Met Phe Asn Ile Gln His Cys
675 680 685
Lys Lys Leu Ser Ser Trp Val Leu Leu Met Lys Tyr Leu Gly Asn Ala
690 695 700
Thr Ala Ile Phe Phe Leu Pro Asp Glu Gly Lys Leu Gln His Leu Glu
705 710 715 720
Asn Glu Leu Thr His Asp Ile Ile Thr Lys Phe Leu Glu Asn Glu Asp
725 730 735
Arg Arg Ser Ala Ser Leu His Leu Pro Lys Leu Ser Ile Thr Gly Thr
740 745 750
Tyr Asp Leu Lys Ser Val Leu Gly Gln Leu Gly Ile Thr Lys Val Phe
755 760 765
Ser Asn Gly Ala Asp Leu Ser Gly Val Thr Glu Glu Ala Pro Leu Lys
770 775 780
Leu Ser Lys Ala Val His Lys Ala Val Leu Thr Ile Asp Glu Lys Gly
785 790 795 800
Thr Glu Ala Ala Gly Ala Met Phe Leu Glu Ala Ile Pro Met Ser Ile
805 810 815
Pro Pro Glu Val Lys Phe Asn Lys Pro Phe Val Phe Leu Met Ile Glu
820 825 830
Gln Asn Thr Lys Ser Pro Leu Phe Met Gly Lys Val Val Asn Pro Thr
835 840 845
Gln Lys
850
<210> 26
<211> 869
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TNFR2-ECD-Fc1-AAT линкер (G3S)2
<400> 26
Leu Pro Ala Gln Val Ala Phe Thr Pro Tyr Ala Pro Glu Pro Gly Ser
1 5 10 15
Thr Cys Arg Leu Arg Glu Tyr Tyr Asp Gln Thr Ala Gln Met Cys Cys
20 25 30
Ser Lys Cys Ser Pro Gly Gln His Ala Lys Val Phe Cys Thr Lys Thr
35 40 45
Ser Asp Thr Val Cys Asp Ser Cys Glu Asp Ser Thr Tyr Thr Gln Leu
50 55 60
Trp Asn Trp Val Pro Glu Cys Leu Ser Cys Gly Ser Arg Cys Ser Ser
65 70 75 80
Asp Gln Val Glu Thr Gln Ala Cys Thr Arg Glu Gln Asn Arg Ile Cys
85 90 95
Thr Cys Arg Pro Gly Trp Tyr Cys Ala Leu Ser Lys Gln Glu Gly Cys
100 105 110
Arg Leu Cys Ala Pro Leu Arg Lys Cys Arg Pro Gly Phe Gly Val Ala
115 120 125
Arg Pro Gly Thr Glu Thr Ser Asp Val Val Cys Lys Pro Cys Ala Pro
130 135 140
Gly Thr Phe Ser Asn Thr Thr Ser Ser Thr Asp Ile Cys Arg Pro His
145 150 155 160
Gln Ile Cys Asn Val Val Ala Ile Pro Gly Asn Ala Ser Met Asp Ala
165 170 175
Val Cys Thr Ser Thr Ser Pro Thr Arg Ser Met Ala Pro Gly Ala Val
180 185 190
His Leu Pro Gln Pro Val Ser Thr Arg Ser Gln His Thr Gln Pro Thr
195 200 205
Pro Glu Pro Ser Thr Ala Pro Ser Thr Ser Phe Leu Leu Pro Met Gly
210 215 220
Pro Ser Pro Pro Ala Glu Gly Ser Thr Gly Asp Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Gln Val Lys Phe Asn Trp Tyr Val Asp Gly Val Gln Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Gln Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asn Trp Leu Asp Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys Gly Gly Gly Ser Gly Gly Gly Ser Glu Asp Pro Gln Gly
465 470 475 480
Asp Ala Ala Gln Lys Thr Asp Thr Ser His His Asp Gln Asp His Pro
485 490 495
Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu Phe Ala Phe Ser Leu
500 505 510
Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr Asn Ile Phe Phe Ser
515 520 525
Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu Ser Leu Gly Thr Lys
530 535 540
Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu Asn Phe Asn Leu Thr
545 550 555 560
Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe Gln Glu Leu Leu Arg
565 570 575
Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu Thr Thr Gly Asn Gly
580 585 590
Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp Lys Phe Leu Glu Asp
595 600 605
Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr Val Asn Phe Gly Asp
610 615 620
Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr Val Glu Lys Gly Thr
625 630 635 640
Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu Asp Arg Asp Thr Val
645 650 655
Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly Lys Trp Glu Arg Pro
660 665 670
Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe His Val Asp Gln Val
675 680 685
Thr Thr Val Lys Val Pro Met Met Lys Arg Leu Gly Met Phe Asn Ile
690 695 700
Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu Leu Met Lys Tyr Leu
705 710 715 720
Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp Glu Gly Lys Leu Gln
725 730 735
His Leu Glu Asn Glu Leu Thr His Asp Ile Ile Thr Lys Phe Leu Glu
740 745 750
Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu Pro Lys Leu Ser Ile
755 760 765
Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly Gln Leu Gly Ile Thr
770 775 780
Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly Val Thr Glu Glu Ala
785 790 795 800
Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala Val Leu Thr Ile Asp
805 810 815
Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe Leu Glu Ala Ile Pro
820 825 830
Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys Pro Phe Val Phe Leu
835 840 845
Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe Met Gly Lys Val Val
850 855 860
Asn Pro Thr Gln Lys
865
<210> 27
<211> 866
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TNFR2-ECD-Fc1-AAT линкер ASTGS
<400> 27
Leu Pro Ala Gln Val Ala Phe Thr Pro Tyr Ala Pro Glu Pro Gly Ser
1 5 10 15
Thr Cys Arg Leu Arg Glu Tyr Tyr Asp Gln Thr Ala Gln Met Cys Cys
20 25 30
Ser Lys Cys Ser Pro Gly Gln His Ala Lys Val Phe Cys Thr Lys Thr
35 40 45
Ser Asp Thr Val Cys Asp Ser Cys Glu Asp Ser Thr Tyr Thr Gln Leu
50 55 60
Trp Asn Trp Val Pro Glu Cys Leu Ser Cys Gly Ser Arg Cys Ser Ser
65 70 75 80
Asp Gln Val Glu Thr Gln Ala Cys Thr Arg Glu Gln Asn Arg Ile Cys
85 90 95
Thr Cys Arg Pro Gly Trp Tyr Cys Ala Leu Ser Lys Gln Glu Gly Cys
100 105 110
Arg Leu Cys Ala Pro Leu Arg Lys Cys Arg Pro Gly Phe Gly Val Ala
115 120 125
Arg Pro Gly Thr Glu Thr Ser Asp Val Val Cys Lys Pro Cys Ala Pro
130 135 140
Gly Thr Phe Ser Asn Thr Thr Ser Ser Thr Asp Ile Cys Arg Pro His
145 150 155 160
Gln Ile Cys Asn Val Val Ala Ile Pro Gly Asn Ala Ser Met Asp Ala
165 170 175
Val Cys Thr Ser Thr Ser Pro Thr Arg Ser Met Ala Pro Gly Ala Val
180 185 190
His Leu Pro Gln Pro Val Ser Thr Arg Ser Gln His Thr Gln Pro Thr
195 200 205
Pro Glu Pro Ser Thr Ala Pro Ser Thr Ser Phe Leu Leu Pro Met Gly
210 215 220
Pro Ser Pro Pro Ala Glu Gly Ser Thr Gly Asp Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Gln Val Lys Phe Asn Trp Tyr Val Asp Gly Val Gln Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Gln Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asn Trp Leu Asp Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys Ala Ser Thr Gly Ser Glu Asp Pro Gln Gly Asp Ala Ala
465 470 475 480
Gln Lys Thr Asp Thr Ser His His Asp Gln Asp His Pro Thr Phe Asn
485 490 495
Lys Ile Thr Pro Asn Leu Ala Glu Phe Ala Phe Ser Leu Tyr Arg Gln
500 505 510
Leu Ala His Gln Ser Asn Ser Thr Asn Ile Phe Phe Ser Pro Val Ser
515 520 525
Ile Ala Thr Ala Phe Ala Met Leu Ser Leu Gly Thr Lys Ala Asp Thr
530 535 540
His Asp Glu Ile Leu Glu Gly Leu Asn Phe Asn Leu Thr Glu Ile Pro
545 550 555 560
Glu Ala Gln Ile His Glu Gly Phe Gln Glu Leu Leu Arg Thr Leu Asn
565 570 575
Gln Pro Asp Ser Gln Leu Gln Leu Thr Thr Gly Asn Gly Leu Phe Leu
580 585 590
Ser Glu Gly Leu Lys Leu Val Asp Lys Phe Leu Glu Asp Val Lys Lys
595 600 605
Leu Tyr His Ser Glu Ala Phe Thr Val Asn Phe Gly Asp Thr Glu Glu
610 615 620
Ala Lys Lys Gln Ile Asn Asp Tyr Val Glu Lys Gly Thr Gln Gly Lys
625 630 635 640
Ile Val Asp Leu Val Lys Glu Leu Asp Arg Asp Thr Val Phe Ala Leu
645 650 655
Val Asn Tyr Ile Phe Phe Lys Gly Lys Trp Glu Arg Pro Phe Glu Val
660 665 670
Lys Asp Thr Glu Glu Glu Asp Phe His Val Asp Gln Val Thr Thr Val
675 680 685
Lys Val Pro Met Met Lys Arg Leu Gly Met Phe Asn Ile Gln His Cys
690 695 700
Lys Lys Leu Ser Ser Trp Val Leu Leu Met Lys Tyr Leu Gly Asn Ala
705 710 715 720
Thr Ala Ile Phe Phe Leu Pro Asp Glu Gly Lys Leu Gln His Leu Glu
725 730 735
Asn Glu Leu Thr His Asp Ile Ile Thr Lys Phe Leu Glu Asn Glu Asp
740 745 750
Arg Arg Ser Ala Ser Leu His Leu Pro Lys Leu Ser Ile Thr Gly Thr
755 760 765
Tyr Asp Leu Lys Ser Val Leu Gly Gln Leu Gly Ile Thr Lys Val Phe
770 775 780
Ser Asn Gly Ala Asp Leu Ser Gly Val Thr Glu Glu Ala Pro Leu Lys
785 790 795 800
Leu Ser Lys Ala Val His Lys Ala Val Leu Thr Ile Asp Glu Lys Gly
805 810 815
Thr Glu Ala Ala Gly Ala Met Phe Leu Glu Ala Ile Pro Met Ser Ile
820 825 830
Pro Pro Glu Val Lys Phe Asn Lys Pro Phe Val Phe Leu Met Ile Glu
835 840 845
Gln Asn Thr Lys Ser Pro Leu Phe Met Gly Lys Val Val Asn Pro Thr
850 855 860
Gln Lys
865
<210> 28
<211> 738
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-hFc1-SLPI
<400> 28
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Pro Lys Ser Cys Asp
385 390 395 400
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
405 410 415
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
420 425 430
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
435 440 445
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
450 455 460
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
465 470 475 480
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
485 490 495
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
500 505 510
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
515 520 525
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
530 535 540
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
545 550 555 560
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
565 570 575
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
580 585 590
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
595 600 605
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
610 615 620
Gly Lys Ala Ser Thr Gly Ser Ser Gly Lys Ser Phe Lys Ala Gly Val
625 630 635 640
Cys Pro Pro Lys Lys Ser Ala Gln Cys Leu Arg Tyr Lys Lys Pro Glu
645 650 655
Cys Gln Ser Asp Trp Gln Cys Pro Gly Lys Lys Arg Cys Cys Pro Asp
660 665 670
Thr Cys Gly Ile Lys Cys Leu Asp Pro Val Asp Thr Pro Asn Pro Thr
675 680 685
Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys Leu Met
690 695 700
Leu Asn Pro Pro Asn Phe Cys Glu Met Asp Gly Gln Cys Lys Arg Asp
705 710 715 720
Leu Lys Cys Cys Met Gly Met Cys Gly Lys Ser Cys Val Ser Pro Val
725 730 735
Lys Ala
<210> 29
<211> 726
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-hFc1-элафин
<400> 29
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Pro Lys Ser Cys Asp
385 390 395 400
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
405 410 415
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
420 425 430
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
435 440 445
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
450 455 460
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
465 470 475 480
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
485 490 495
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
500 505 510
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
515 520 525
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
530 535 540
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
545 550 555 560
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
565 570 575
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
580 585 590
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
595 600 605
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
610 615 620
Gly Lys Ala Ser Thr Gly Ser Ala Val Thr Gly Val Pro Val Lys Gly
625 630 635 640
Gln Asp Thr Val Lys Gly Arg Val Pro Phe Asn Gly Gln Asp Pro Val
645 650 655
Lys Gly Gln Val Ser Val Lys Gly Gln Asp Lys Val Lys Ala Gln Glu
660 665 670
Pro Val Lys Gly Pro Val Ser Thr Lys Pro Gly Ser Cys Pro Ile Ile
675 680 685
Leu Ile Arg Cys Ala Met Leu Asn Pro Pro Asn Arg Cys Leu Lys Asp
690 695 700
Thr Asp Cys Pro Gly Ile Lys Lys Cys Cys Glu Gly Ser Cys Gly Met
705 710 715 720
Ala Cys Phe Val Pro Gln
725
<210> 30
<211> 984
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-HSA
<400> 30
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Ala Ser Thr Gly Ser Asp
385 390 395 400
Ala His Lys Ser Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu Glu
405 410 415
Asn Phe Lys Ala Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln Gln
420 425 430
Cys Pro Phe Glu Asp His Val Lys Leu Val Asn Glu Val Thr Glu Phe
435 440 445
Ala Lys Thr Cys Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys Ser
450 455 460
Leu His Thr Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu Arg
465 470 475 480
Glu Thr Tyr Gly Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro Glu
485 490 495
Arg Asn Glu Cys Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu Pro
500 505 510
Arg Leu Val Arg Pro Glu Val Asp Val Met Cys Thr Ala Phe His Asp
515 520 525
Asn Glu Glu Thr Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg Arg
530 535 540
His Pro Tyr Phe Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg Tyr
545 550 555 560
Lys Ala Ala Phe Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala Cys
565 570 575
Leu Leu Pro Lys Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser Ser
580 585 590
Ala Lys Gln Arg Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu Arg
595 600 605
Ala Phe Lys Ala Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro Lys
610 615 620
Ala Glu Phe Ala Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys Val
625 630 635 640
His Thr Glu Cys Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp Arg
645 650 655
Ala Asp Leu Ala Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser Ser
660 665 670
Lys Leu Lys Glu Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His Cys
675 680 685
Ile Ala Glu Val Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser Leu
690 695 700
Ala Ala Asp Phe Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala Glu
705 710 715 720
Ala Lys Asp Val Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg Arg
725 730 735
His Pro Asp Tyr Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr Tyr
740 745 750
Glu Thr Thr Leu Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu Cys
755 760 765
Tyr Ala Lys Val Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro Gln
770 775 780
Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu Tyr
785 790 795 800
Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro Gln
805 810 815
Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys Val
820 825 830
Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys Ala
835 840 845
Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys Val Leu His Glu
850 855 860
Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser Leu
865 870 875 880
Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr Tyr
885 890 895
Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe His Ala Asp Ile
900 905 910
Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala Leu
915 920 925
Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu Lys
930 935 940
Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys Ala
945 950 955 960
Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val Ala
965 970 975
Ala Ser Gln Ala Ala Leu Gly Leu
980
<210> 31
<211> 595
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-домен 3 HSA
<400> 31
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Ala Ser Thr Gly Ser Glu
385 390 395 400
Glu Pro Gln Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln Leu
405 410 415
Gly Glu Tyr Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys Lys
420 425 430
Val Pro Gln Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn Leu
435 440 445
Gly Lys Val Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg Met
450 455 460
Pro Cys Ala Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys Val
465 470 475 480
Leu His Glu Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys Thr
485 490 495
Glu Ser Leu Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val Asp
500 505 510
Glu Thr Tyr Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe His
515 520 525
Ala Asp Ile Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys Gln
530 535 540
Thr Ala Leu Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys Glu
545 550 555 560
Gln Leu Lys Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys Cys
565 570 575
Cys Lys Ala Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys Lys
580 585 590
Leu Val Ala
595
<210> 32
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант последовательности петли реактивного сайта
<400> 32
Gly Thr Glu Ala Ala Gly Ala Glu Phe Leu Glu Ala Ile Pro Leu Ser
1 5 10 15
Ile Pro Pro Glu Val Lys Phe Asn Lys
20 25
<210> 33
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант последовательности петли реактивного сайта
<400> 33
Gly Thr Glu Ala Ala Gly Ala Leu Phe Leu Glu Ala Ile Pro Leu Ser
1 5 10 15
Ile Pro Pro Glu Val Lys Phe Asn Lys
20 25
<210> 34
<211> 394
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-MM-EL пептид
<400> 34
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Glu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys
385 390
<210> 35
<211> 394
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-MM-LL пептид
<400> 35
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Leu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys
385 390
<210> 36
<211> 626
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Слитый белок AAT-MM-LL-hFc1
<400> 36
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Leu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Pro Lys Ser Cys Asp
385 390 395 400
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
405 410 415
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
420 425 430
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
435 440 445
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
450 455 460
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
465 470 475 480
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
485 490 495
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
500 505 510
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
515 520 525
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
530 535 540
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
545 550 555 560
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
565 570 575
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
580 585 590
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
595 600 605
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
610 615 620
Gly Lys
625
<210> 37
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> D2E7-VK легкой цепи
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 38
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> константная область антитела
<400> 38
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
100 105
<210> 39
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> D2E7-VH тяжелой цепи
<400> 39
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu
115
<210> 40
<211> 335
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> константная область антитела
<400> 40
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
1 5 10 15
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
20 25 30
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
35 40 45
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
50 55 60
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
65 70 75 80
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
85 90 95
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
100 105 110
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
115 120 125
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
130 135 140
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
145 150 155 160
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
165 170 175
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
180 185 190
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
195 200 205
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
210 215 220
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
225 230 235 240
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
245 250 255
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
260 265 270
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
275 280 285
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
290 295 300
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
305 310 315 320
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330 335
<210> 41
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TNFR2-внеклеточный домен
<400> 41
Leu Pro Ala Gln Val Ala Phe Thr Pro Tyr Ala Pro Glu Pro Gly Ser
1 5 10 15
Thr Cys Arg Leu Arg Glu Tyr Tyr Asp Gln Thr Ala Gln Met Cys Cys
20 25 30
Ser Lys Cys Ser Pro Gly Gln His Ala Lys Val Phe Cys Thr Lys Thr
35 40 45
Ser Asp Thr Val Cys Asp Ser Cys Glu Asp Ser Thr Tyr Thr Gln Leu
50 55 60
Trp Asn Trp Val Pro Glu Cys Leu Ser Cys Gly Ser Arg Cys Ser Ser
65 70 75 80
Asp Gln Val Glu Thr Gln Ala Cys Thr Arg Glu Gln Asn Arg Ile Cys
85 90 95
Thr Cys Arg Pro Gly Trp Tyr Cys Ala Leu Ser Lys Gln Glu Gly Cys
100 105 110
Arg Leu Cys Ala Pro Leu Arg Lys Cys Arg Pro Gly Phe Gly Val Ala
115 120 125
Arg Pro Gly Thr Glu Thr Ser Asp Val Val Cys Lys Pro Cys Ala Pro
130 135 140
Gly Thr Phe Ser Asn Thr Thr Ser Ser Thr Asp Ile Cys Arg Pro His
145 150 155 160
Gln Ile Cys Asn Val Val Ala Ile Pro Gly Asn Ala Ser Met Asp Ala
165 170 175
Val Cys Thr Ser Thr Ser Pro Thr Arg Ser Met Ala Pro Gly Ala Val
180 185 190
His Leu Pro Gln Pro Val Ser Thr Arg Ser Gln His Thr Gln Pro Thr
195 200 205
Pro Glu Pro Ser Thr Ala Pro Ser Thr Ser Phe Leu Leu Pro Met Gly
210 215 220
Pro Ser Pro Pro Ala Glu Gly Ser Thr Gly Asp
225 230 235
<210> 42
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> константная область антитела
<400> 42
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
20 25 30
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
35 40 45
Val Asp Val Ser His Glu Asp Pro Gln Val Lys Phe Asn Trp Tyr Val
50 55 60
Asp Gly Val Gln Val His Asn Ala Lys Thr Lys Pro Arg Glu Gln Gln
65 70 75 80
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
85 90 95
Asn Trp Leu Asp Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 43
<211> 227
<212> БЕЛОК
<213> Homo sapiens
<400> 43
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 44
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 44
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 45
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 45
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Ile
20 25 30
Ile Ser Arg Asp Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 46
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 46
Ala Pro Glu Leu Leu Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 47
<211> 226
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 47
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
20 25 30
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
35 40 45
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
50 55 60
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
65 70 75 80
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
85 90 95
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
100 105 110
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
115 120 125
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
130 135 140
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
145 150 155 160
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
165 170 175
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
180 185 190
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
195 200 205
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
210 215 220
Gly Lys
225
<210> 48
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 48
Ala Pro Glu Val Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 49
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 49
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Val Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 50
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 50
Ala Pro Glu Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 51
<211> 226
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 51
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Val Ala Gly
1 5 10 15
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
20 25 30
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
35 40 45
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
50 55 60
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
65 70 75 80
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
85 90 95
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
100 105 110
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
115 120 125
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
130 135 140
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
145 150 155 160
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
165 170 175
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
180 185 190
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
195 200 205
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
210 215 220
Gly Lys
225
<210> 52
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 52
Ala Pro Glu Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 53
<211> 226
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG1
<400> 53
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Val Ala Gly
1 5 10 15
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Ile Ile
20 25 30
Ser Arg Asp Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
35 40 45
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
50 55 60
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
65 70 75 80
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
85 90 95
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
100 105 110
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
115 120 125
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
130 135 140
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
145 150 155 160
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
165 170 175
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
180 185 190
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His
195 200 205
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
210 215 220
Gly Lys
225
<210> 54
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG2
<400> 54
Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 55
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG3
<400> 55
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn Arg Phe Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 56
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG3
<400> 56
Ala Pro Glu Leu Leu Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 57
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG3
<400> 57
Ala Pro Glu Val Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 58
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG3
<400> 58
Ala Pro Glu Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 59
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG3
<400> 59
Ala Pro Glu Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile Phe
180 185 190
Ser Cys Ser Val Leu His Glu Ala Leu His Asn Arg Phe Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 60
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 60
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 61
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 61
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 62
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 62
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 63
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 63
Ala Pro Glu Phe Leu Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
85 90 95
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 64
<211> 228
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 64
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys
225
<210> 65
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 65
Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 66
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 66
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 67
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 67
Ala Pro Glu Val Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 68
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 68
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Val
1 5 10 15
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 69
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 69
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 70
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 70
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 71
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 71
Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 72
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 72
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 73
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc человеческого IgG4
<400> 73
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Ile Ile Ser Arg Asp Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 74
<211> 19
<212> БЕЛОК
<213> Homo sapiens
<400> 74
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser
<210> 75
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> IgG1-VA дельта G шарнир
<400> 75
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Val Ala Gly
1 5 10 15
Pro Ser
<210> 76
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 76
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser
20
<210> 77
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> IgG4-шарнир PE
<400> 77
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser
20
<210> 78
<211> 624
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-EL-Fc-IgG1-DV,дельта G,IDL
<400> 78
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Glu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Gly Gly Gly Gly Asp Lys
385 390 395 400
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Val Ala Gly Pro Ser
405 410 415
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Ile Ile Ser Arg
420 425 430
Asp Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
435 440 445
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
450 455 460
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
465 470 475 480
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
485 490 495
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
500 505 510
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
515 520 525
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
530 535 540
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
545 550 555 560
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
565 570 575
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
580 585 590
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala
595 600 605
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 79
<211> 623
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> AAT-EL-Fc-IgG4-PE,IDL
<400> 79
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Glu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys Glu Ser Lys Tyr Gly Pro
385 390 395 400
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val
405 410 415
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Ile Ile Ser Arg Asp
420 425 430
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
435 440 445
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
450 455 460
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
465 470 475 480
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
485 490 495
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
500 505 510
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
515 520 525
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
530 535 540
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
545 550 555 560
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
565 570 575
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
580 585 590
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
595 600 605
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
610 615 620
<210> 80
<211> 394
<212> БЕЛОК
<213> Homo sapiens
<400> 80
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Glu Phe
340 345 350
Leu Glu Ala Ile Pro Leu Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Glu Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys
385 390
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| Гетеродимерные слитые белки ИЛ-15/ИЛ-15Рα - Fc и их применение | 2019 |
|
RU2827796C2 |
| Вакцина против герпеса | 2019 |
|
RU2731073C1 |
| Новые варианты интерлейкина-2 для лечения рака | 2020 |
|
RU2833537C2 |
| Способы лечения кальцификации тканей | 2015 |
|
RU2770698C2 |
| ВАРИАНТЫ IgG-FC ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2814952C2 |
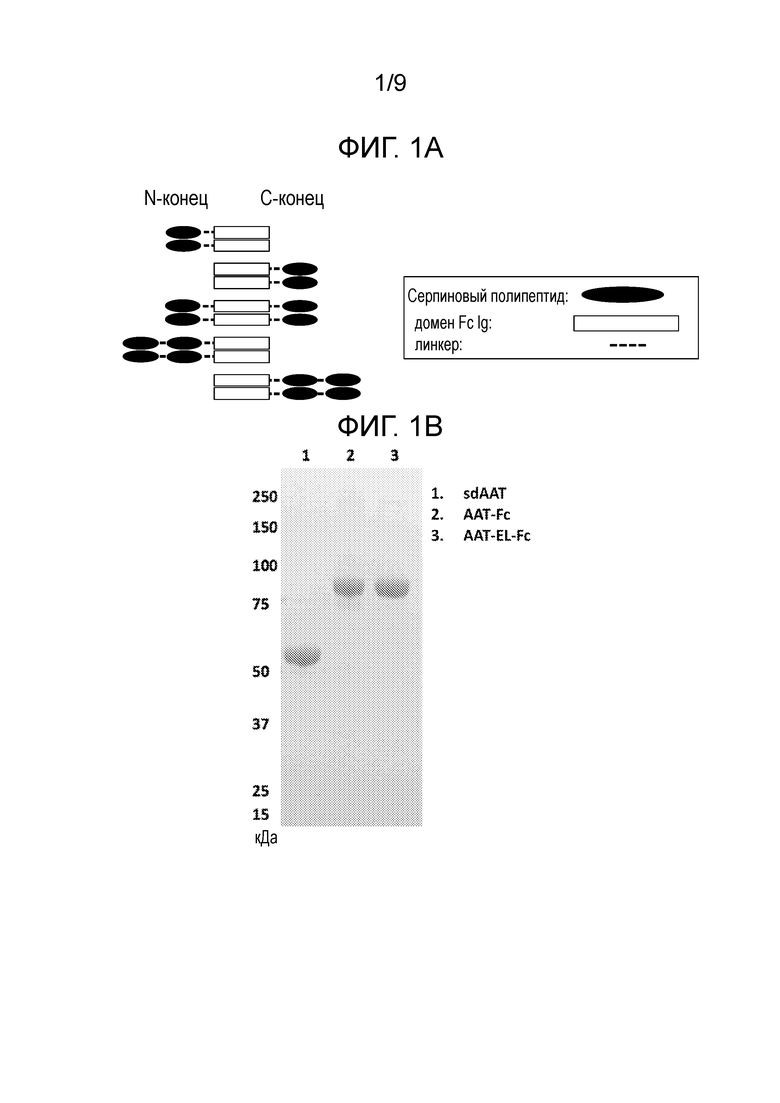
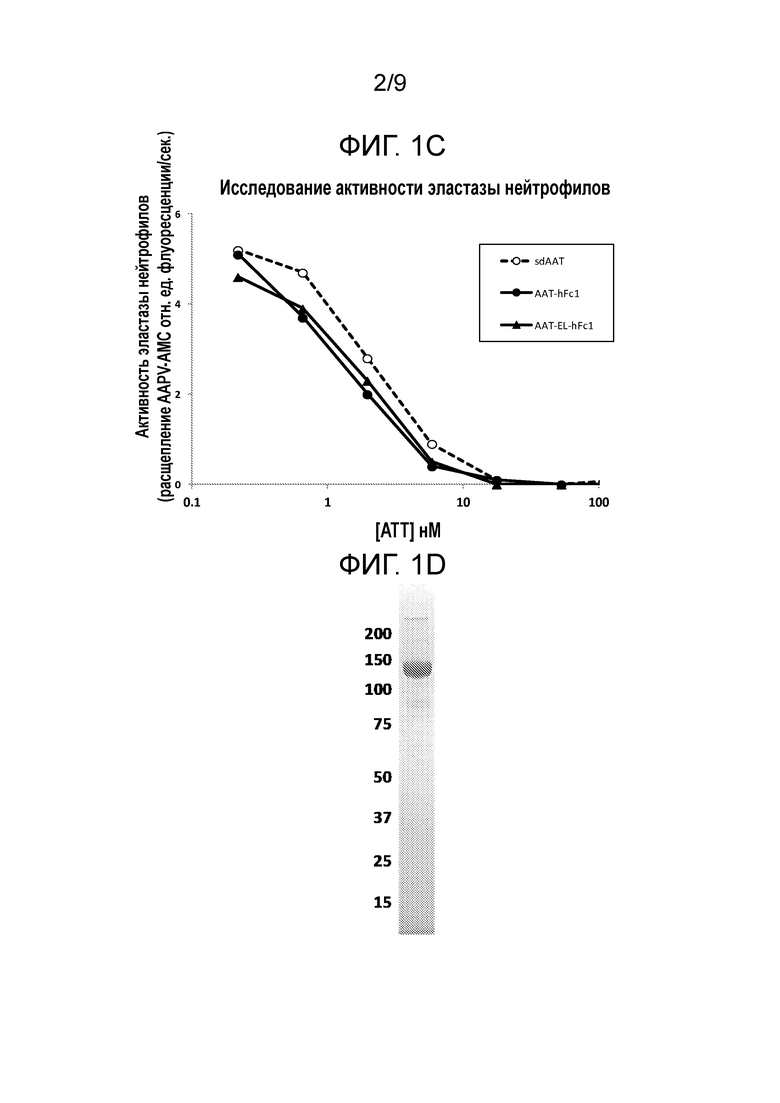
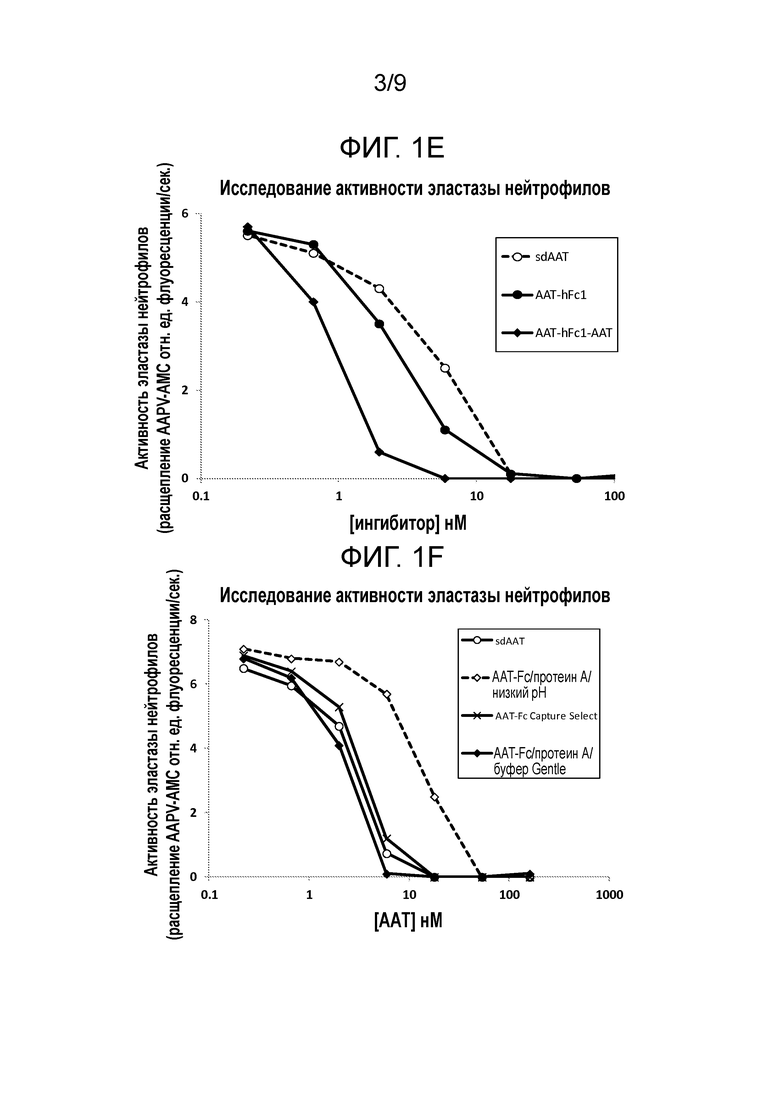
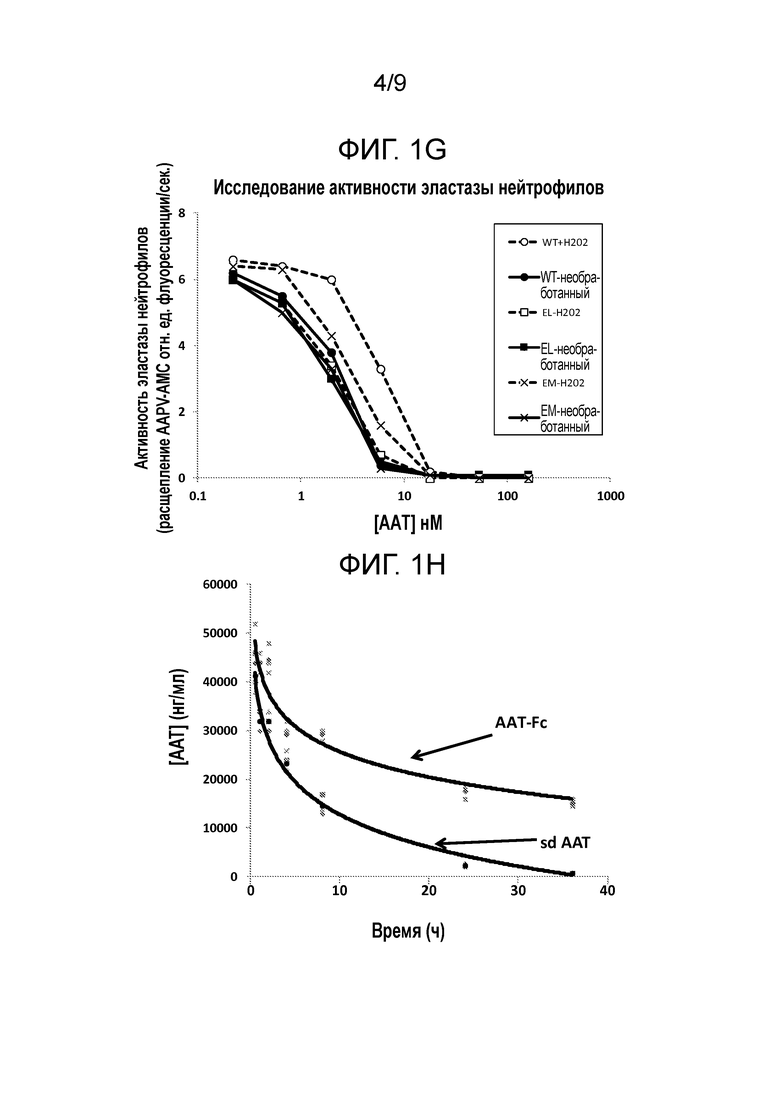
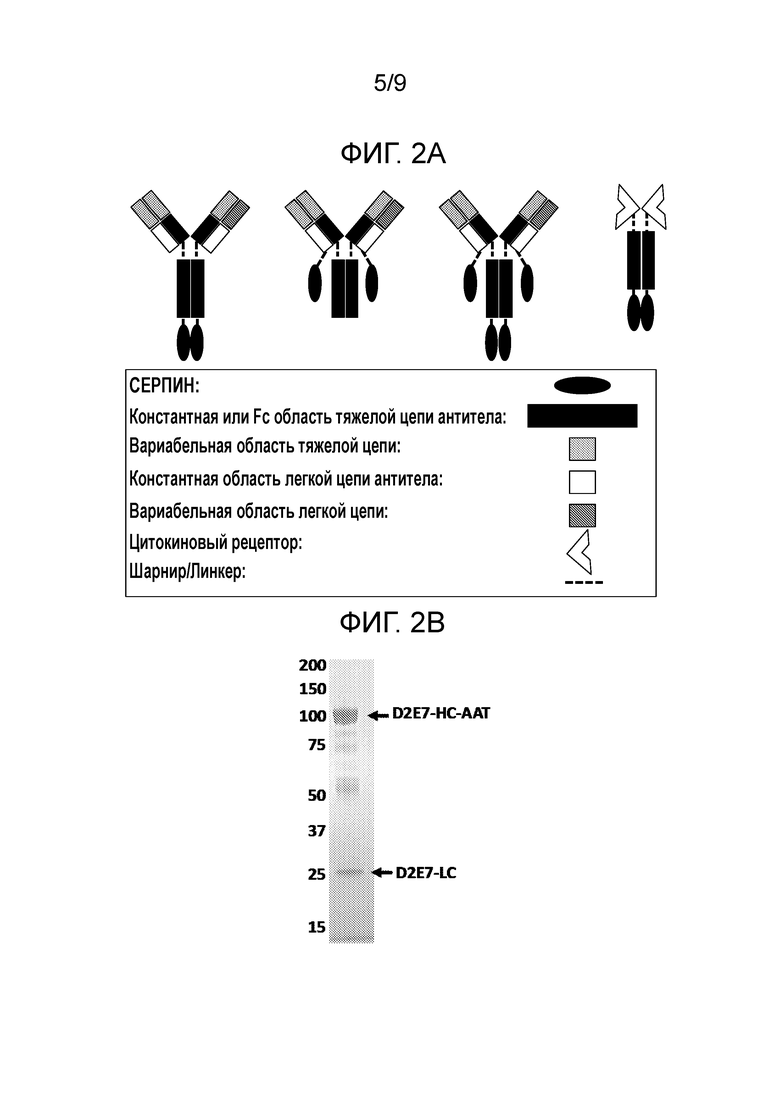
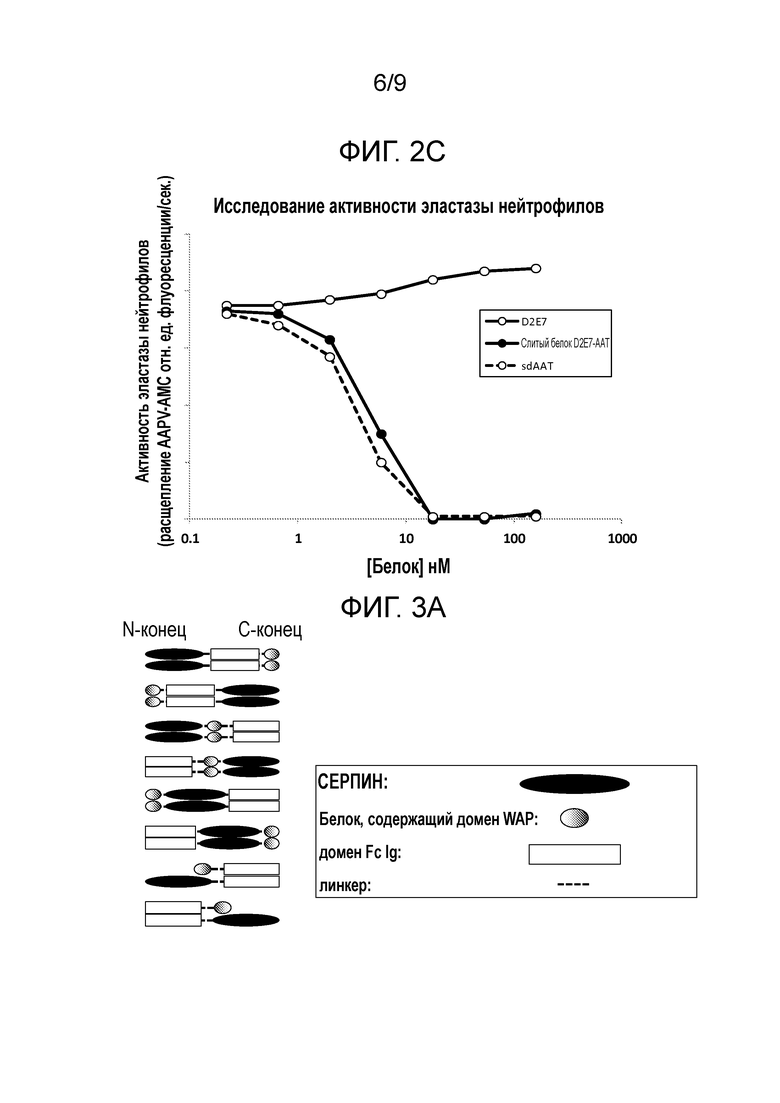
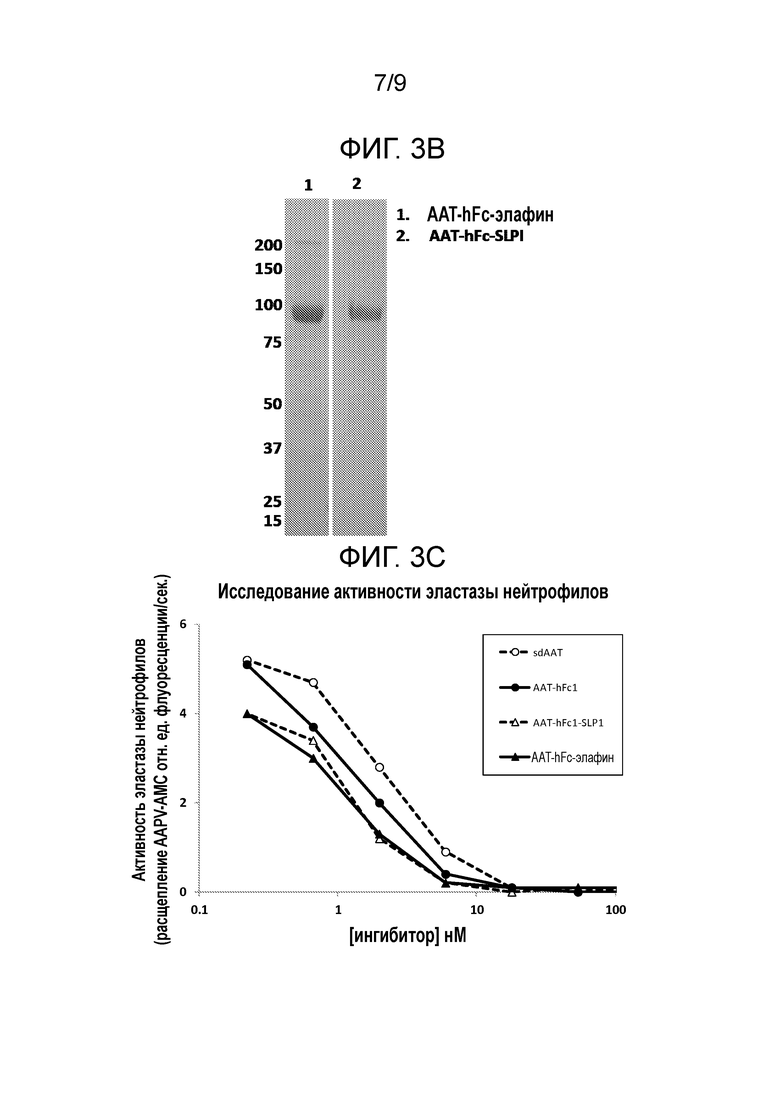
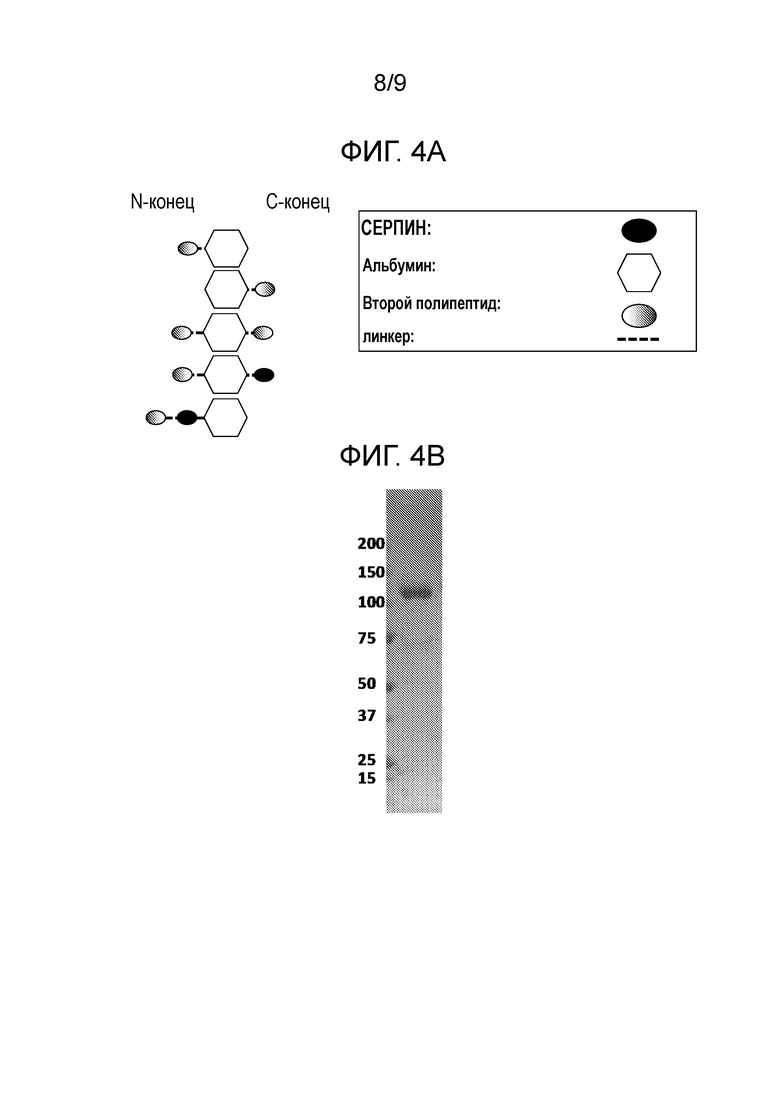
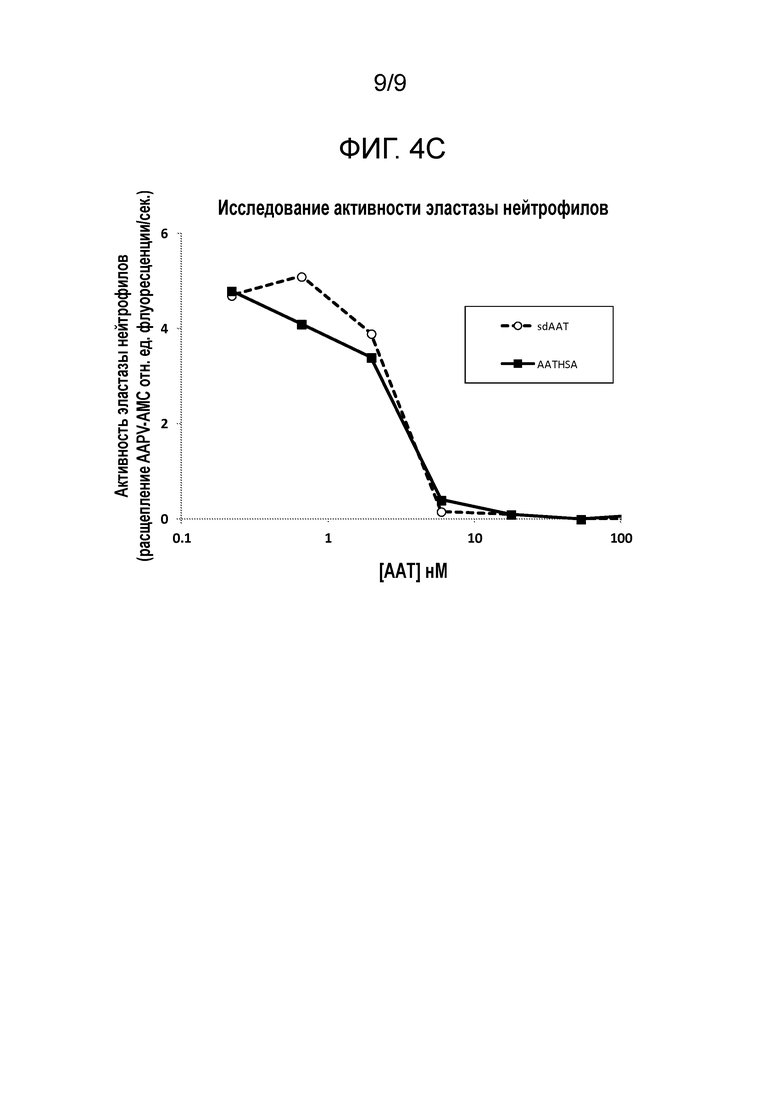
Изобретение относится к области биохимии, в частности к выделенному слитому белку, содержащему по меньшей мере один человеческий полипептид альфа-1-антитрипсина, функционально связанный с модифицированным полипептидом Fc человеческого IgG4. Изобретение эффективно для ингибирования или отрицательной регуляции нарушенной экспрессии или активности сериновой протеазы у нуждающегося в этом субъекта. 9 з.п. ф-лы, 4 ил., 4 пр.
1. Выделенный слитый белок, содержащий по меньшей мере один человеческий полипептид альфа-1-антитрипсина (AAT), функционально связанный с модифицированным полипептидом Fc человеческого IgG4, где указанный модифицированный полипептид Fc человеческого IgG4 содержит аминокислотную последовательность SEQ ID NO: 60, 69 или 70, где указанный модифицированный полипептид Fc человеческого IgG4 содержит мутацию в положении M252Y, которая соответствует остатку 34 SEQ ID NO: 60, и мутацию M428L, которая соответствует остатку 210 SEQ ID NO: 60, для применения в способе ингибирования или отрицательной регуляции нарушенной экспрессии или активности сериновой протеазы у нуждающегося в этом субъекта.
2. Выделенный слитый белок по п.1, где полипептид AAT содержит аминокислотную последовательность SEQ ID NO: 2 или SEQ ID NO: 80.
3. Выделенный слитый белок по п.1, где полипептид AAT содержит петлю реакционного центра AAT, содержащую аминокислотную последовательность SEQ ID NO: 1.
4 Выделенный слитый белок по п.1, где полипептид AAT содержит мутантную петлю реакционного центра AAT, содержащую аминокислотную последовательность SEQ ID NO: 32 или 33.
5. Выделенный слитый белок по п.1, где указанный модифицированный полипептид Fc IgG4 содержит аминокислотную последовательность SEQ ID NO: 73.
6. Выделенный слитый белок по п.1, где серпиновый полипептид и указанный модифицированный полипептид Fc IgG4 функционально связаны линкерным участком, необязательно где линкерный участок содержит пептидную последовательность.
7. Выделенный слитый белок по п.1, где слитый белок содержит аминокислотную последовательность SEQ ID NO: 79.
8. Выделенный слитый белок по п.1, где субъект является человеком.
9. Выделенный слитый белок по п.1, где указанный субъект имеет воспалительное заболевание или нарушение, выбранное из следующих: недостатка альфа-1 антитрипсина, эмфиземы, хронической обструктивной болезни легких (ХОБЛ), синдрома острой дыхательной недостаточности (СОДН), аллергической астмы, кистозного фиброза, рака легких, ишемически-реперфузионного повреждения, в том числе ишемически-реперфузионного повреждения после пересадки сердца, инфаркта миокарда, ревматоидного артрита, септического артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, псориаза, диабета I и/или II типа, пневмонии, сепсиса, заболевания «трансплантат против хозяина», заживления раны, системной красной волчанки и рассеянного склероза.
10. Выделенный белок по п.1, где указанный субъект имеет инфекцию или риск инфекции, где указанная инфекция выбрана из бактериальных инфекций, грибковых инфекций или вирусных инфекций.
| WO 2013003641 А2, 03.01.2013 | |||
| WO 2010080538 А1, 15.07.2010 | |||
| WO 2007021807 A1, 22.02.2007 | |||
| WO 2014020056 A1, 06.02.2014 | |||
| WO 2009158432 A2, 30.12.2009 | |||
| ИНГИБИТОРЫ СЕРИНОВЫХ ПРОТЕАЗ, В ЧАСТНОСТИ НС3-НС4А ПРОТЕАЗЫ | 2004 |
|
RU2412198C2 |
Авторы
Даты
2021-04-15—Публикация
2015-10-27—Подача