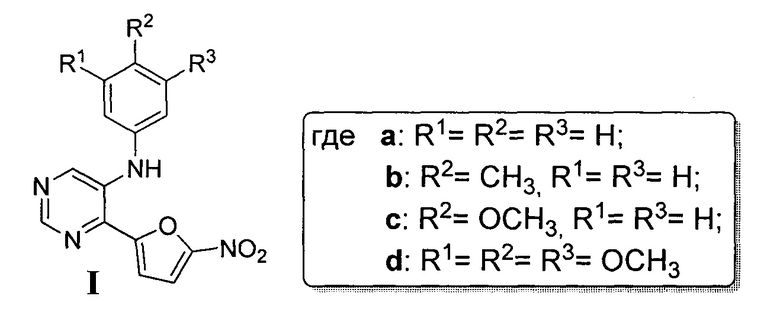
Область техники
Настоящее изобретение относится к области органического синтеза биологически активных соединений и касается N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-аминов, которые обладают широким спектром антибактериальной активности в отношении кокковых инфекций. Указанные соединения могут быть использованы в качестве антибактериальных агентов, в первую очередь для лечения больных с заболеваниями мочеполовой системы, вызванных гонококками и/или золотистым стафилококком, а также гнойно-воспалительных инфекционных заболеваний кожи и слизистых оболочек, вызванных стафилококками и стрептококками.
Уровень техники:
Сведения о способе синтеза, биологической активности и области применения N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-аминов общей формулы (I) в научно-технической и патентной литературе отсутствуют.
В литературе описан способ получения наиболее близких по структуре 2,5,6-тризамещенных производных 4-(5-нитрофуран-2-ил)пиримидинов (4), основанный на конденсации гидрохлорида соответствующего 2-замещенного амидина (1) с 1,2-дизамещенным 3-(фуран-2-ил)-3-оксопропионовый альдегидом (2), с последующим нитрованием получающегося 2,5,6-тризамещенного 4-(фуран-2-ил)пиримидина (3) дымящей азотной кислотой в смеси уксусного ангидрида и серной кислоты [Н. Berger, R. Gall, Н. Merdes, K. Stach, W. Voemel, W. Sauer. 4-(5-Nitrofuryl)pyrimidines. // Patent US 3704301 A, 1972].
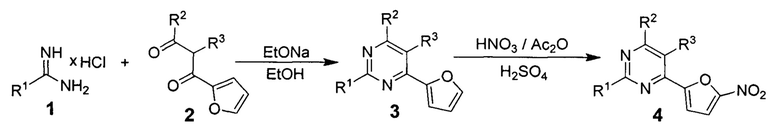 ,
,
где R1, R2, R3 - H, алкил-, алкокси-, амино- или ациламиногруппа.
Недостатками данного способа являются: 1) малая доступность исходных 2-замещенных амидинов (1) и 1,2-дизамещенных 3-(фуран-2-ил)-3-оксопропионовых альдегидов (2), вследствие чего необходим их предварительный трудоемкий многостадийный синтез; 2) низкий общий выход промежуточных 2,5,6-тризамещенного 4-(фуран-2-ил)пиримидина (3), составляющий в среднем 20-40%; 3) Необходимость проведения трудоемкой реакции нитрования, выход которой в среднем составляет 50-60%, каждый раз на стадии получения конечных 2,5,6-тризамещенных производных 4-(5-нитрофуран-2-ил)пиримидинов (4).
В литературе имеются сведения о наличии у 2,5,6-тризамещенных производных 4-(5-нитрофуран-2-ил)пиримидинов (4) антибактериальной активности в отношении шести штаммов бактерий, а именно: Staphylococcus aureus SG 511, Streptococcus pyogenes Aronson, Streptococcus faecalis, Escherichia coli, Proteus mirabilis, Pseudomonas aeruginosa [H. Berger, R. Gall, H. Merdes, K. Stach, W. Voemel, W. Sauer. 4-(5-Nitrofuryl)pyrimidines. // Patent US 3704301 A, 1972].
Таким образом, существующий способ является многостадийным, требует сложного предварительного синтеза исходных соединений и долгого времени протекания реакций.
Еще одним близким по структуре к N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-аминам (Ia-d) является соединение 5 - 4-(5-нитрофуран-2-ил)-5-фенилпиримидин, в структуре которого отсутствует промежуточная NH-группа между пиримидиновым циклом и фенильным заместителем в положении С(5).
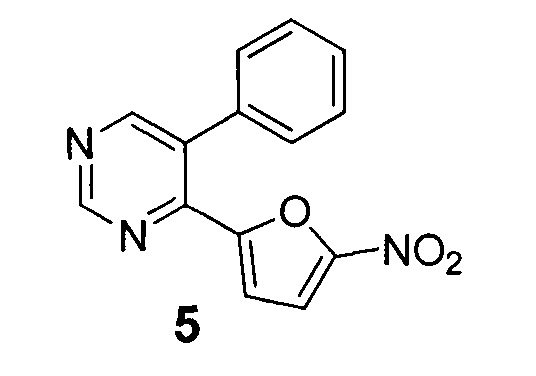
В литературе описан способ получения соединения 5, который основан на использовании промотируемой микроволновым излучением реакции кросс-сочетания по Сузуки 5-бром-4-(5-нитрофуран-2-ил)пиримидин (1.0 ммоль) с фенилборной кислотой (1.2 ммоль) в смеси 1,4-диоксан - вода (4:3) при 80°С в течение 30 минут [E.V. Verbitskiy, S.A. Baskakova, N.A. Gerasimova, N.P. Evstigneeva, N.V.  , N.V. Kungurov, M.A. Kravchenko, S.N. Skomyakov, M.G. Pervova, G.L. Rusinov, O.N. Chupakhin, V.N. Charushin. Synthesis and biological evaluation of novel 5-aryl-4-(5-nitrofuran-2-yl)-pyrimidines as potential anti-bacterial agents. // Bioorganic & Medicinal Chemistry Letters, 2017, DOI: 10.1016/j.bmcl.2017.05.013].
, N.V. Kungurov, M.A. Kravchenko, S.N. Skomyakov, M.G. Pervova, G.L. Rusinov, O.N. Chupakhin, V.N. Charushin. Synthesis and biological evaluation of novel 5-aryl-4-(5-nitrofuran-2-yl)-pyrimidines as potential anti-bacterial agents. // Bioorganic & Medicinal Chemistry Letters, 2017, DOI: 10.1016/j.bmcl.2017.05.013].
В литературе имеются сведения о наличии у 4-(5-нитрофуран-2-ил)-5-фенилпиримидина (5) антибактериальной активности в отношении некоторых штаммов кокковых бактерий, а именно: Neisseria gonorrhoeae NCTC12700/ATCC49226, NCTC 8375/АТСС19424 и клинического азитромицинрезистентного штамма Neisseria gonorrhoeae AzmR, а также Staphylococcus aureus АТСС 25923.
Задача изобретения: синтезировать соединения, обладающие высокой антибактериальной активностью широкого спектра действия в отношении кокковых инфекций из доступного сырья, в мягких условиях, с высоким выходом.
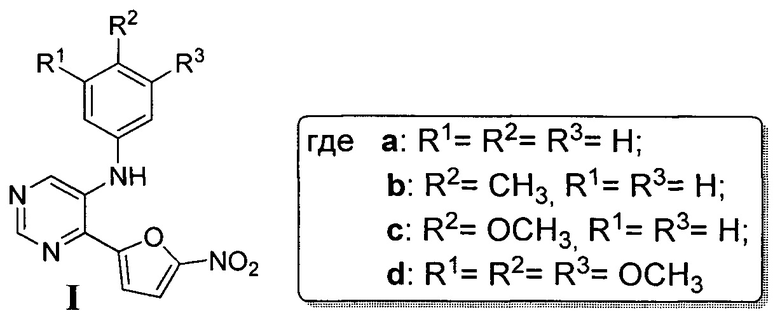
Поставленная задача решается тем, что N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-амин (Ia-d) получают реакцией 5-бром-4-(5-нитрофуран-2-ил)пиримидина (6) с ариламином (7a-d) в присутствии каталитической системы на основе ацетата палладия (II) и 1,1'-бис(дифенилфосфино)феррацена (dppf)2 и фосфата калия в качестве основания. Все реагенты растворяют в сухом дегазированном 1,4-диоксане, полученную смесь нагревают при 85°С при интенсивном перемешивании в течение 15 часов, растворитель отгоняют при пониженном давлении, полученный остаток подвергают хроматографическому разделению на силикагеле при соотношении в элюенте этилацетат-гексан 1:3. Исходный 5-бром-4-(5-нитрофуран-2-ил)пиримидин (6) получают согласно методике, описанной в литературе [E.V. Verbitskiy, S.A. Baskakova, N.A. Gerasimova, N.P. Evstigneeva, N.V.  , N.V. Kungurov, M.A. Kravchenko, S.N. Skornyakov, M.G. Pervova, G.L. Rusinov, O.N. Chupakhin, V.N. Charushin. Synthesis and biological evaluation of novel 5-aryl-4-(5-nitrofuran-2-yl)-pyrimidines as potential anti-bacterial agents. // Bioorganic & Medicinal Chemistry Letters, 2017, DOI: 10.1016/j.bmcl.2017.05.013].
, N.V. Kungurov, M.A. Kravchenko, S.N. Skornyakov, M.G. Pervova, G.L. Rusinov, O.N. Chupakhin, V.N. Charushin. Synthesis and biological evaluation of novel 5-aryl-4-(5-nitrofuran-2-yl)-pyrimidines as potential anti-bacterial agents. // Bioorganic & Medicinal Chemistry Letters, 2017, DOI: 10.1016/j.bmcl.2017.05.013].
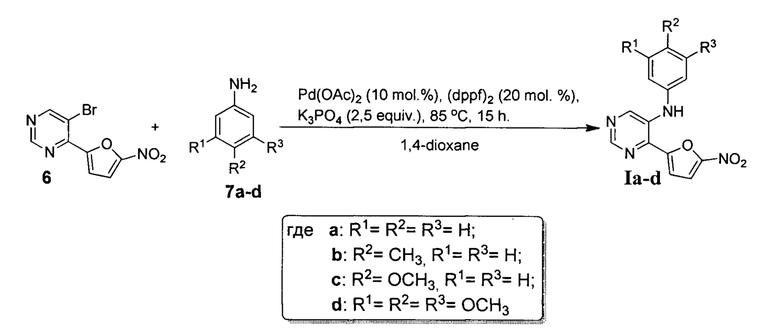
Проведение реакции 5-бром-4-(5-нитрофуран-2-ил)пиримидина (6) с полуторакратным избытком ариламина (7a-d) в сухом 1,4-диоксане осуществляют в температурном интервале 80÷85°С в течение не менее 15 часов, поскольку увеличение температуры ведет к разложению реакционной смеси и резкому уменьшению выхода целевого продукта Ia-d, в свою очередь уменьшение температуры ниже +80°С приводит к значительному увеличению времени протекания реакции. Время реакции не менее 15 часов достаточно для полного протекания реакции присоединения, тогда как его уменьшение также приводит к снижению выхода целевого продукта Ia-d.
Выделение продукта (Ia-d) осуществляют путем хроматографического разделения на силикагеле при соотношении в элюенте этилацетат: гексан=1:3. Увеличение данного соотношения в пользу гексана приведет к необоснованному расходу растворителя, тогда как при увеличении доли этилацетата в элюенте не происходит селективного отделения целевого продукта (I) от побочных примесей.
Анализ промежуточных и целевых соединений проводят с использованием ЯМР-спектроскопии [Спектры ЯМР 1Н и 13С измерены на спектрометре Bruker AVANCEIII-500 (500 и 126 МГц, соответственно) в растворе ДМСО-d6, внутренний стандарт ТМС] и элементного анализа на автоматическом анализаторе Perkin-Elmer РЕ-2400. ГЖХ/МС проведена на спектрометре Agilent GC 7890А MS 5975С Inert XL EI/CI с квадрупольным масс-спектрометрическим детектором и с кварцевой капиллярной колонкой HP-5MS Масс-спектры высокого разрешения записаны на спектрометре Bruker maXis Impact HD.
Пример 1
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (6) 270 мг (1.0 ммоль) смешивают с анилином (7а) 137 мкл (1.5 ммоль), ацетатом палладия (II) 22 мг (0.1 ммоль), 1,1'-бис(дифенилфосфино)ферраценом 111 мг (0.2 ммоль) и фосфатом калия 531 мг (2.5 ммоль). Полученную смесь растворяют в 20 мл дегазированного 1,4-диоксана и нагревают при 85°С при интенсивном перемешивании в течение 15 часов. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат-гексан 1:3). В результате получают 4-(5-нитрофуран-2-ил)-N-фенилпиримидин-5-амин (Iа) в виде красного порошка. Выход 189 мг (67%).
Т. пл. 123-124°С.
Спектр ЯМР 1Н (500 МГц, DMSO-d6) δ (м.д.): 8.89 (с, 1Н), 8.82 (с, 1Н), 8.30 (с, 1H), 7.84 (д, J=4.0 Гц, 1Н), 7.47 (д, J=4.0 Гц, 1Н), 7.28 (м, 2Н), 7.05 (д, J=7.6 Гц, 2Н), 6.95 (м, 1Н).
Спектр ЯМР 13С (126 МГц, DMSO-d6) δ (м.д.): 151.8, 151.6, 151.1, 150.5, 141.8, 141.5, 135.00, 129.4, 121.7, 117.9, 116.2, 114.2.
Элементный анализ для C14H10N4O3 (282.26):
Вычислено (%): С, 59.57; Н, 3.57; N, 19.85.
Найдено (%): С, 59.69; Н, 3.50; N, 19.67.
ГЖХ: tR=26.40 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 282 [М]+ (100).
Масс-спектр высокого разрешения: Найдено, m/z: 283.0826 [М+Н]+. C14H11N4O3.
Вычислено, m/z: 283.0822.
Пример 2
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (6) 270 мг (1.0 ммоль) смешивают с пара-анилином (7b) 165 мкл (1.5 ммоль), ацетатом палладия (II) 22 мг (0.1 ммоль), 1,1'-бис(дифенилфосфино)ферраценом 111 мг (0.2 ммоль) и фосфатом калия 531 мг (2.5 ммоль). Полученную смесь растворяют в 20 мл дегазированного 1,4-диоксана и нагревают при 85°С при интенсивном перемешивании в течение 15 часов. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат-гексан, 1:3). В результате получают 4-(5-нитрофуран-2-ил)-N-(пара-толил)пиримидин-5-амин (Ib) в виде оранжевого порошка. Выход 198 мг (67%).
Т. пл. 174-176°С.
Спектр ЯМР 1Н (500 МГц, CDCl3) δ (м.д.): 8.73 (с, 1Н), 8.68 (с, 1H), 7.52 (д, J=3.9 Гц, 1Н), 7.50 (д, J=3.9 Гц, 1Н), 7.36 (с, 1Н), 7.23 (д, J=8.2 Гц, 2Н), 7.17 (д, J=8.2 Гц, 2Н), 2.38 (с, 3Н).
Спектр ЯМР 13С (126 МГц, CDCl3) δ (м.д.): 154.9, 151.6, 148.6, 145.9, 135.9, 135.5, 135.3, 130.6, 122.9, 113.7, 113.2, 20.9.
Элементный анализ для C15H12N4O3 (296.28):
Вычислено (%): С, 60.81; Н, 4.08; N, 18.91.
Найдено (%): С, 60.70; Н, 4.19; N, 18.77.
ГЖХ: tR=27.23 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 296 [М]+ (100).
Масс-спектр высокого разрешения: Найдено, m/z: 297.0980 [М+Н]+. C15H13N4O3.
Вычислено, m/z: 297.0982.
Пример 3
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (6) 270 мг (1.0 ммоль) смешивают с пара-анизидином (7с) 185 мг (1.5 ммоль), ацетатом палладия (II) 22 мг (0.1 ммоль), 1,1'-бис(дифенилфосфино)ферраценом 111 мг (0.2 ммоль) и фосфатом калия 531 мг (2.5 ммоль). Полученную смесь растворяют в 20 мл дегазированного 1,4-диоксана и нагревают при 85°С при интенсивном перемешивании в течение 15 часов. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают N-(4-метоксифенил)-4-(5-нитрофуран-2-ил)-пиримидин-5-амин (Iс) в виде темно-красного порошка. Выход 72 мг (23%).
Т. пл. 182-183°С.
Спектр ЯМР 1Н (500 МГц, CDCl3) δ (м.д.):
8.67 (с, 1Н), 8.50 (с, 1H), 7.57 (д, J=3.9 Гц, 1Н), 7.55 (д, J=3.9 Гц, 1Н), 7.44 (с, 1Н), 7.22 (д, J=8.8 Гц, 2Н), 7.00 (д, J=8.8 Гц, 2Н), 3.86 (с, 3Н).
Элементный анализ для C15H12N4O4 (312.29):
Вычислено (%): С, 57.69; Н, 3.87; N, 17.94.
Найдено (%): С, 57.80; Н, 3.95; N, 17.88.
ГЖХ: tR=28.41 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 312 [М]+ (100).
Масс-спектр высокого разрешения: Найдено, m/z: 313.0933 [М+Н]+. C15H13N4O4.
Вычислено, m/z: 313.0931.
Пример 4
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (6) 270 мг (1.0 ммоль) смешивают с 3,5,7-триметоксианилином (7d) 275 мг (1.5 ммоль), ацетатом палладия (II) 22 мг (0.1 ммоль), 1,1''-бис(дифенилфосфино)ферраценом 111 мг (0.2 ммоль) и фосфатом калия 531 мг (2.5 ммоль). Полученную смесь растворяют в 20 мл дегазированного 1,4-диоксана и нагревают при 85°С при интенсивном перемешивании в течение 15 часов. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат-гексан, 1:3). В результате получают 4-(5-нитрофуран-2-ил)-N-(3,4,5-триметоксифенил)-пиримидин-5-амин (Id) в виде красного порошка. Выход 220 мг (59%).
Т. пл. 180-182°С.
Спектр ЯМР 1Н (500 МГц, CDCl3) δ (м.д.): 8.72 (с, 1Н), 8.68 (с, 1Н), 7.57 (д, J=3.9 Гц, 1H), 7.55 (д, J=3.9 Гц, 1H), 7.41 (с, 1Н), 6.50 (с, 2Н), 3.88 (с, 3Н), 3.87 (с, 6Н).
Элементный анализ для C17H16N4O6 (372.33):
Вычислено (%): С, 54.84; Н, 4.33; N, 15.05.
Найдено (%): С, 54.90; Н, 4.44; N, 15.00.
ГЖХ: tR=30.93 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 372 [М]+ (100).
Масс-спектр высокого разрешения: Найдено, m/z: 373.1140 [М+Н]+. C17H17N4O6.
Вычислено, m/z: 373.1143.
Сведения, подтверждающие возможность осуществления изобретения
Список условных сокращений
АТСС - American Type Culture Collection (Американская коллекция типовых культур)
NCTC - National Collection of Type Cultures (Culture Collection of Public Health England)
ГКПМ - Государственная коллекция патогенных микроорганизмов, Россия
SPEC - Спектиномицин (Spectinomycin), антибиотик класса аминоциклитолов. Механизм действия - ингибирует синтез белка в бактериальной клетке, путем связывания с 30S субъединицей рибосомы. Может нарушать функции и структуру цитоплазматических мембран
МИК - минимальная ингибирующая концентрация, мкг/мл
Neisseria gonorrhoeae SpeS, AzmR - клинический штамм, чувствительный к Спектиномицину и резистентный к Азитромицину (МИК AZM 1,0 мкг/мл)
Neisseria gonorrhoeae SpeS, AzmS - клинический штамм, чувствительный к Спектиномицину и Азитромицину
Контрольные штаммы
Neisseria gonorrhoeae NCTC 12700/АТСС 49226; Neisseria gonorrhoeae NCTC 8375/ATCC 19424, чувствительные к применяемым в лечении гонококковой инфекции антимикробным препаратам.
Staphylococcus aureus MRSA NCTC 12493 - штамм золотистого стафилококка резистентный к Метициллину - бета-лактамному антибиотику, пенициллинового ряда.
Изучение антибактериальной активности in vitro заявляемых соединений Ia-d.
Оценку чувствительности микроорганизмов к антимикробным препаратам проводят методом последовательных микроразведений - референсным методом, регламентированным международным стандартом ISO 20776-1:2006. В Российской Федерации действует Национальный Стандарт ГОСТ Р ИСО 20776-1-2010, идентичный международному стандарту. Критерии интерпретации результатов: новые химические соединения рассматриваются перспективными для дальнейшего изучения, если значения МИК in vitro для контрольных штаммов не превышают 10-20 мкг/мл [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 944 с. Порядок исследования при определении спектра антимикробного действия и активности нового соединения in vitro. С. 511-513].
Антибактериальную активность химических соединений в отношении облигатного патогена N. gonorrhoeae определяют методом двукратных серийных разведений в агаре (золотой стандарт). В качестве ростовой среды используют питательную среду - гонококковый агар с ростовой добавкой (например «Комплегон», Россия). Разведения химических соединений в агаре проводят в 24 луночных планшетах, рабочий объем лунки 2 мл. Для каждого химического соединения готовят не менее 12 точек с разведениями: 250 мкг/мл - 0,06 мкг/мл. Растворитель - ДМСО, разбавители дистиллированная стерильная вода (для инъекций), ростовая среда на агаровой основе. Посевная доза (конечная концентрация) инокулюма из суточной культуры N. gonorrhoeae - 105 КОЕ/мл. Инкубируют планшеты при условиях Т=37°С, [СО2=5%]. Оценку результатов проводят визуально через 18-24 часа [CLSI, 2014].
Антибактериальную активность химических соединений в отношении клиническизначимых патогенных и условно-патогенных микроорганизмов проводят методом последовательных микроразведений в бульоне Мюллера-Хинтон (Mueller Hinton Broth (например HiMedia, Индия). Разведения химических соединений проводят в стерильных 96-луночных планшетах. Растворитель - ДМСО, разбавители дистиллированная стерильная вода (для инъекций), ростовая среда бульон Мюллера-Хинтон. Готовят инокулюмы контрольных штаммов, в соответствии со стандартом 0,5 ЕД по МакФарланду (что соответствует 1,5×108 КОЕ/мл), затем разбавляют в 100 раз до концентрации 106 КОЕ/мл. В каждую лунку горизонтального ряда (в т.ч. и в контрольную) вносят по 50 мкл инокулюма соответствующего штамма. Инкубация планшета в термостате при 37°С 18-24 часа. Учет результатов проводят визуально. Последняя лунка с задержкой роста (прозрачный бульон) соответствует минимальной ингибирующей (бактериостатической) концентрации (МИК) в отношении данного штамма.
В качестве соединения сравнения используют лекарственный препарат Спектиномицин (Sigma-Aldrich, USA) формулы (SPEC):
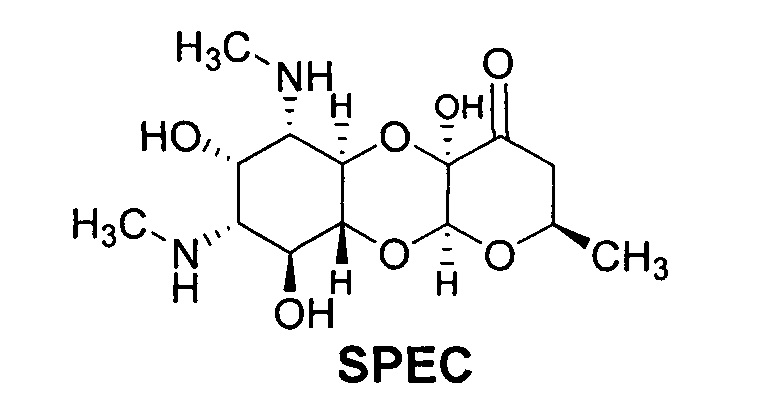
Спектиномицин используют в медицинской практике для лечения острого гонококкового уретрита, простатита и проктита у мужчин, острого гонококкового цервицита и проктита у женщин, вызванных чувствительными штаммами Neisseria gonorrhoeae, при непереносимости или неэффективности бета-лактамных антибиотиков.
Для изучения антибактериальной активности соединений Ia-d проведено определение минимальных ингибирующих концентраций по отношению к контрольным штаммам Neisseria gonorrhoeae NCTC12700/ATCC49226, NCTC 8375/АТСС19424, клиническим штаммам Neisseria gonorrhoeae SpeS, AzmR и Neisseria gonorrhoeae SpeS, AzmS.
Кроме того, определены минимальные ингибирующие концентрации заявляемых соединений Ia-d в отношении контрольных штаммов патогенных и условно-патогенных микроорганизмов из международных коллекций АТСС и российской ГКПМ:
Грамотрицательные палочки (энтеробактерии):
Escherichia coli АТСС 8739
Citrobacter braakii АТСС 101/57
Shigella flexneri 1а8516
Proteus vulgaris ГКПМ 160125 (222)
Serratia marcescens АТСС 13880
Klebsiella pneumoniae ATCC 13883
Неферментатирующие грамотрицательные палочки:
Pseudomonas aeruginosa АТСС 9027
Грамположительные кокки:
Streptococcus piogenes АТСС 19615
Staphylococcus aureus АТСС 25923/NCTC 12981(F-49)
Staphylococcus aureus MRSA NCTC 12493
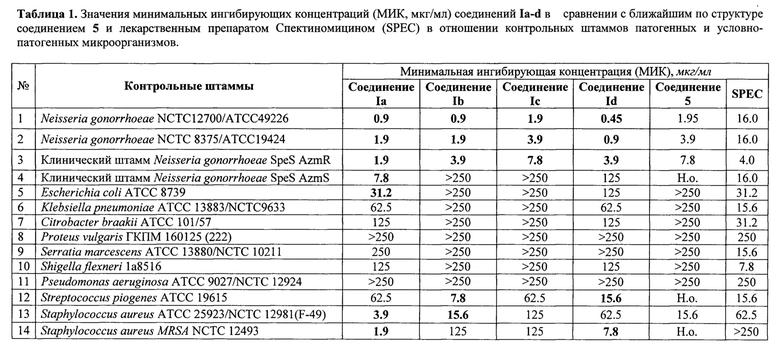
Н.о. - значение не определено.
Таким образом, нами впервые получены N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-амины, которые проявили широкий спектр антибактериальной активности в отношении кокковых инфекций, и предложен новый эффективный способ их получения. Преимуществами данного способа синтеза являются:
1. Доступность и дешевизна исходных реагентов.
2. Мягкие условия проведения реакций.
3. Высокий выход целевых продуктов (59-67%, за исключением продукта Iс, для которого выход не превысил 23%), в отличие от многостадийных (не менее 3-х стадий), описанных в литературе способов получения аналогичных продуктов с суммарным выходом не более 50%.
Полученные соединения, в сравнении с аналогичной активностью Спектиномицина, показали активность в отношении контрольных штаммов бактерий Neisseria gonorrhoeae NCTC12700/ATCC49226 и NCTC 8375/АТСС19424, превышающую в 8,4-35 раз; для клинических штаммов N. gonorrhoeae SpeS AzmR и N. gonorrhoeae SpeS AzmS - в 2 раза. В отношении же Staphylococcus aureus АТСС 25923/NCTC 12981(F-49) и Staphylococcus aureus MRSA NCTC 12493 заявляемые соединения с общей формулой I оказались более активнымы, чем препарат сравнения Спектиномицин в 2 - более 131 раз.
Кроме того, соединения общей формулой I проявили более широкий спектр антибактериальной активности в сравнении с ближайшим по структуре соединением 5, в частности, в отношении штаммов Escherichia coli АТСС 8739, Klebsiella pneumoniae АТСС 13883/NCTC9633, Citrobacter braakii АТСС 101/57, Shigella flexneri 1а8516, Staphylococcus aureus АТСС 25923/NCTC 12981(F-49) и Staphylococcus aureus MRSA ATCC/NCTC12493 в ряде случаев активность была выше от 2 до 8 раз. В отношении штаммов бактерий Neisseria gonorrhoeae NCTC12700/ATCC49226, Neisseria gonorrhoeae NCTC 8375/АТСС 19424 и клинического штамма N. gonorrhoeae SpeS AzmR соединения общей формулой I также оказались активнее ближайшего по структуре соединения 5 в 2-4 раза.
Заявляемые соединения по своим характеристикам превосходят свои структурные аналоги по действию и могут быть использованы в практической медицине для лечения больных с заболеваниями мочеполовой системы, вызванными гонококками и/или золотистым стафилококком, а также гнойно-воспалительных инфекционных заболеваний кожи и слизистых оболочек, вызванных стафилококками и стрептококками.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-Арилзамещенный 4-(5-нитрофуран-2-ил)пиримидин, обладающий широким спектром антибактериальной активности, способ его получения и промежуточное соединение, обладающее широким спектром антибактериальной активности | 2016 |
|
RU2626647C1 |
| СЕЛЕКТИВНЫЕ АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3-(АЗОЛ-1-ИЛ)-6-АМИНОЗАМЕЩЕННЫЕ 1,2,4,5-ТЕТРАЗИНЫ | 2017 |
|
RU2642882C1 |
| 4-ИЗОПРОПИЛ-6-R-ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИН-3(4H)-ОНЫ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ NEISSERIA GONORRHOEAE | 2020 |
|
RU2754554C1 |
| 3-ИЗОПРОПОКСИ-6-R-ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ NEISSERIA GONORRHOEAE | 2020 |
|
RU2767869C1 |
| 3-ГУАНИДИНО-6-R-ТРИАЗОЛО[4,3-b][1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2663890C1 |
| Смешанные металлокомплексы на основе 5-(4-метилфенил)-2,2'-бипиридина и (тетрафтор)салициловых кислот, обладающие антибактериальной и фунгистатической активностью | 2020 |
|
RU2737435C1 |
| Металлокомплексы на основе полифторсалицилатов и 1,10-фенантролина с антибактериальной активностью и способ их получения | 2019 |
|
RU2706702C1 |
| НОВЫЙ АНТИБАКТЕРИАЛЬНЫЙ АГЕНТ 3-(КАРБОКСИМЕТИЛ)-1-(ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИН-3-ИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛ-3-ИУМ ХЛОРИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО NEISSERIA GONORRHOEAE И MYCOBACTERIUM TUBERCULOSIS | 2023 |
|
RU2828876C1 |
| Способ получения монохлорацетатов замещенных 5-,6-,7-аминоиндолов, обладающих противомикробным действием | 2019 |
|
RU2724605C1 |
| Фторхинолоны на основе 4-дезоксипиридоксина | 2016 |
|
RU2634122C1 |
Изобретение относится к новым N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-аминам общей формулы I и способу их получения, заключающемуся в том, что 5-бром-4-(5-нитрофуран-2-ил)пиримидин (6) смешивают с соответствующим ариламином, взятым в 1,5-кратном избытке, ацетатом палладия (II) и 1,1'-бис(дифенилфосфино)ферраценом, взятыми в каталитических количествах, и фосфатом калия, взятым в 2,5-кратном избытке, полученную смесь растворяют в дегазированном 1,4-диоксане и нагревают при 85°С и интенсивном перемешивании в течение не менее 15 часов, с последующим отгоном растворителя на роторном испарителе при пониженном давлении и полученный остаток подвергают хроматографическому разделению на колонке с силикагелем с соотношением компонентов в элюенте этилацетат:гексан, равном 1:3. Технический результат: предложен высокоэффективный способ получения 4-(5-нитрофуран-2-ил)-N-фенилпиримидин-5-амина, который обладает широким спектром антибактериальной активности в отношении кокковых инфекций, вызванных гонококками и/или золотистым стафилококком, а также гнойно-воспалительных инфекционных заболеваний кожи и слизистых оболочек, вызванных стафилококками и стрептококками. 2 н.п. ф-лы, 1 табл., 4 пр.
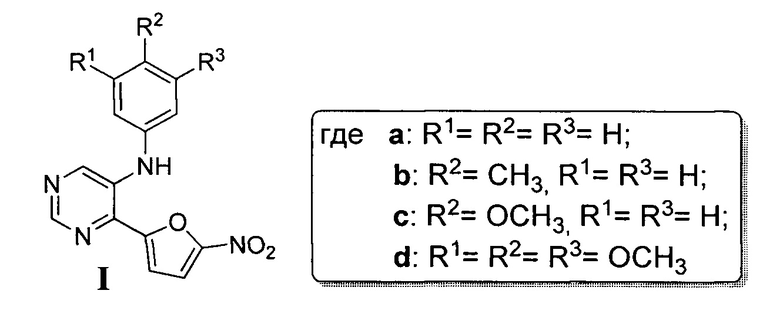
1. N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-амин общей формулы I (Ia-Id)
 ,
,
обладающий антибактериальной активностью.
2. Способ получения N-арил-4-(5-нитрофуран-2-ил)-пиримидин-5-аминов формулы (I), заключающийся в том, что 5-бром-4-(5-нитрофуран-2-ил)пиримидин (6) смешивают с соответствующим ариламином, взятым в 1,5-кратном избытке, ацетатом палладия (II) и 1,1'-бис(дифенилфосфино)ферраценом, взятыми в каталитических количествах, и фосфатом калия, взятым в 2,5-кратном избытке, затем полученную смесь растворяют в дегазированном 1,4-диоксане и нагревают при 85°С и интенсивном перемешивании в течение не менее 15 часов, затем растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем с соотношением компонентов в элюенте этилацетат:гексан, равном 1:3.
| US 3704301 28.11.1972 | |||
| Egor V.Verbitskiy et al, "Synthesis and biological evaluation of novel 5-aryl-4-(5-nitrofuran-2-yl)-pyrimidines as potential anti-bacterial agent", Bioorganic & Medicinal Chemistry Letters, 2017, 27,p.3003-3006 | |||
| Кетоны 1-алкил-2-(фурил-2)-бензимидазола, обладающие противогрибковой активностью | 1977 |
|
SU614630A1 |
Авторы
Даты
2018-01-25—Публикация
2017-07-11—Подача