Изобретение относится к фармакологии и медицинской диагностике, более конкретно к способу получения противоопухолевого конъюгата на основе человеческого сывороточного альбумина, содержащего два низкомолекулярных противоопухолевых агента и контрастирующий агент, для терапии и одновременной визуализации опухолевой ткани методом магнитно-резонансной томографии (МРТ) на ядрах атома 19F.
Высокая стабильность человеческого сывороточного альбумина (ЧСА) в сыворотке и возможность хранения растворов белка в течение многих лет делают альбумин привлекательным кандидатом для использования в качестве молекулы-транспортера лекарственных препаратов путем ковалентного присоединения активной субстанции к транспортному белку либо за счет образования прочных комплексов, либо в виде рекомбинантных составных белков, включающих как альбумин, так и белки другой специфичности [Liu, F.; Mu, J.; Xing, В. Recent advances on the development of pharmacotherapeutic agents on the basis of human serum albumin // Curr. Pharm. Des. - 2015. - Vol. 21. - N. 14. - P. 1866-1888].
Длительное время циркуляции терапевтических конструкций на основе альбумина дает возможность использовать сосудистые дефекты солидных опухолей через феномен, известный как эффект повышенной проницаемости и удерживания (накопления) (EPR-эффект), для пассивного накопления препарата в злокачественных опухолях [Maeda, Н.; Wu, J.; Sawa, Т.; Matsumura, Y.; Hori, K. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review // J. Control. Release. - 2000. - Vol. 65. - N. 1-2. - P. 271-284]. Кроме того, было показано, что аккумуляция наночастиц альбумина с лекарственным препаратом в опухолевых клетках может быть обусловлена трансцитозом в интерстициальное пространство опухоли, который инициируется связыванием альбумина с албондином (гликопротеин с молекулярной массой 60 кДа, gp60 рецептор) с последующим взаимодействием с другим вектором - рецептором SPARC (Secreted Protein Acid and Rich in Cysteine, кислый секретируемый белок, богатый цистеином) [Sleep, D. Albumin and its application in drug delivery // Expert Opin. Drug Deliv. - 2015. - Vol. 12. - N. 5. - P. 793-812].
ЧСА может также облегчить направленную транспортировку в опухоль агентов для молекулярной томографии, что крайне важно для ранней диагностики заболевания и мониторинга противоопухолевой терапии в режиме реального времени [Чубаров А.С., Годовикова Т.С., Ахмад С., Сильников В.Н. Визуализирующие системы на основе человеческого сывороточного альбумина для МРТ диагностики патологических процессов (обзор) // Химия в интересах устойчивого развития (2016). Т. 24, С. 585-595]. Подробная информация об опухоли необходима для выбора оптимальной стратегии лечения и точного определения локализации злокачественных областей при хирургическом лечении.
С другой стороны, для более эффективного подавления опухоли и снижения вероятности приобретения опухолью лекарственной устойчивости необходимо использовать комбинированную терапию, используя лекарственные препараты с различными механизмами действия.
Известен способ получения противоопухолевых конъюгатов на основе липосом для одновременной доставки различных терапевтических агентов в опухоль (патент WO 2009091531, оп. 01.10.2009). Различные терапевтические агенты находятся в различных липосомах, вовлеченных во внутренний объем липосом большего размера, либо когда один из препаратов включен в двухслойную мембрану, формирующую липосомы.
Известен способ получения противоопухолевого конъюгата на основе ЧСА, содержащего три терапевтических агента, включающий обработку раствора ЧСА смесью 5-фторурацила и медного комплекса тиосемикарбозида бензоилпиридина на первой стадии. За счет разной степени гидрофобности терапевтические агенты связываются в различных доменах (IIA и IB соответственно). На второй стадии образовавшийся комплекс ЧСА с двумя низкомолекулярными компонентами обрабатывают малеимидным производным терапевтического аптамера, что приводит к его ковалентному присоединению к свободной сульфгидрильной группе. В результате получают конъюгат на основе ЧСА, содержащий три терапевтических агента, один из которых (терапевтический аптамер) ковалентно присоединен к альбумину через сульфгидрильную группу, а два других (Cu(II) - тиосемикарбозид бензоилпиридина и 5-фторурацил) образуют нековалентные комплексы с субдаменами IB и IIA [Qi J, Zhang Y, Gou Y, et. al. Multidrug Delivery Systems Based on Human Serum Albumin for Combination Therapy with Three Anticancer Agents. // Mol Pharm. - 2016 - Vol. 13. - P. 3098-105].
Недостатком известного способа является низкое качество целевого продукта, связанное с нестабильностью и быстрым разрушением конъюгата в крови и перераспределением терапевтических агентов от конъюгата к свободным молекулам ЧСА, имеющимся в большом количестве в биологических жидкостях.
Наиболее близким к заявляемому способу – прототипом - является способ получения конъюгата, содержащего рекомбинантный ЧСА, терапевтический агент или контрастирующий агент. Конъюгат получают путем последовательной модификации ЧСА, при этом на первой стадии осуществляют синтез рекомбинантного белка, содержащего по С- и/или N-концу альбумина пептид, включающий несколько остатков цистеина, а на второй стадии проводят конъюгацию малеимидных производных флуоресцеина или малеимидных производных терапевтического агента по свободным сульфгидрильным группам цистеинсодержащего пептида. Количество вводимого контрастирующего или терапевтического агента регулируется на первой стадии путем получения рекомбинантного белка, содержащего необходимое число остатков цистеина (патентная заявка US 20100310468 A1, оп. 09.12.2010).
Недостатками способа-прототипа являются сложность выделения рекомбинантного ЧСА с чистотой, необходимой для последующего создания на его основе терапевтического или контрастирующего препарата, и, как следствие, его высокая цена. Кроме того, способ не позволяет получать конъюгат заданного строения, содержащего более одного терапевтического или контрастирующего агента, так как присоединение по различным остаткам цистеина происходит случайным образом. Выход целевых конъюгатов в прототипе не указан, однако хроматографическое разделение продуктов с применением разного типа сорбентов позволяет сделать вывод о сложном составе реакционных смесей и, как следствие, невысоком выходе целевых продуктов.
Задачей изобретения является разработка простого способа получения противоопухолевого конъюгата на основе ЧСА, содержащего два различных терапевтических агента, а также контрастирующий агент, позволяющего визуализировать опухоль методом МРТ на ядрах фтора.
Технический результат: обеспечение возможности получения конъюгата заданного строения, содержащего два различных терапевтических агента и контрастирующий агент, а также упрощение способа и повышение выхода целевого конъюгата.
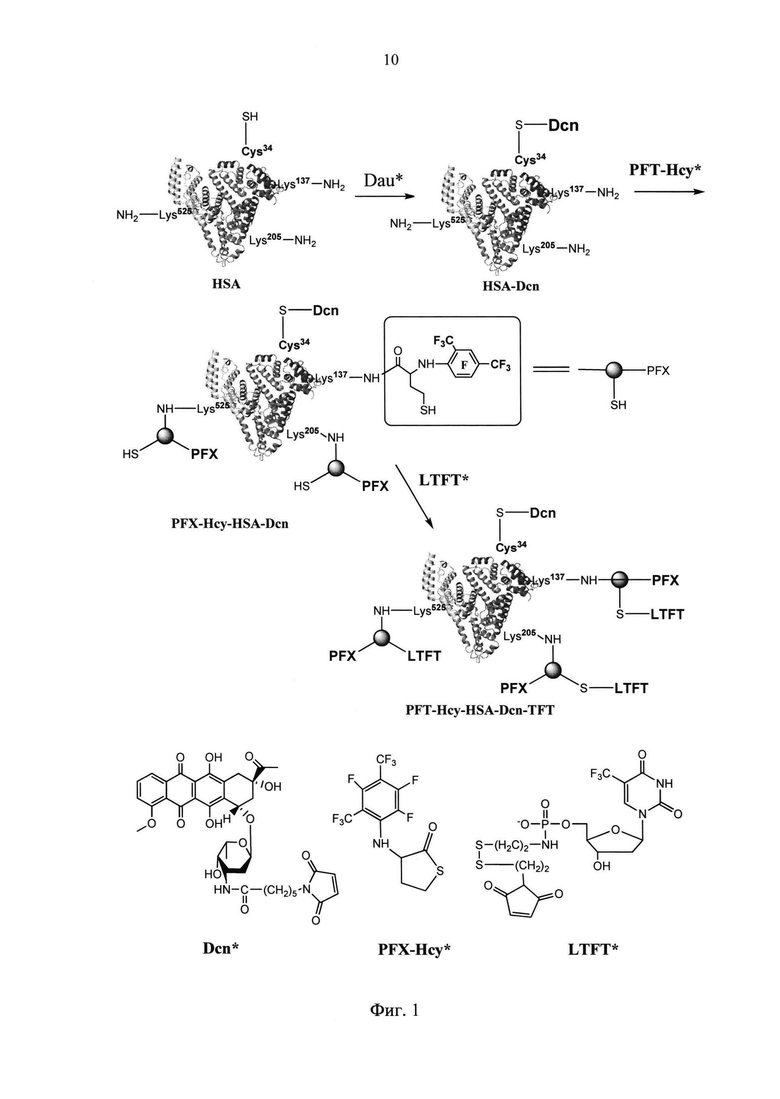
Поставленная задача достигается последовательной модификацией ЧСА путем присоединения по свободной сульфгидрильной группе ЧСА (цистин 34) малеимидного производного противоопухолевого антибиотика дауномицина, введения F19 метки по аминогруппам остатков лизина (лизин 137, 205, 525) и присоединения по образовавшимся на предыдущей стадии трем свободным сульфгидрильным группам малеимидного производного второго терапевтического агента - трифтортимидина.
На фиг. 1 представлена общая схема синтеза заявляемого конъюгата.
Предлагаемый способ заключается в следующем.
На первой стадии к раствору ЧСА (66.4 мг) в фосфатном буфере (PBS) с pH 7.4 добавляют избыток малеимидного производного противоопухолевого антибиотика дауномицина (7 мг) в диметилсульфоксиде (ДМСО, 50 мкл), смесь инкубируют при 37°С в течение 18 часов, избыток низкомолекулярных компонентов реакционной смеси отделяют с помощью концентратора «Centricon» при 9000g и получают конъюгат ЧСА с дауномицином (HSA-Dcn).
В полученный на первой стадии промежуточный конъюгат HSA-Dcn, растворенный в PBS (pH 7.4), вводят контрастирующий агент (остаток 2,3,5-трифтор-4,6-бис(трифторметил)фенила) путем добавления в смесь 0.03 М раствора N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)тиолактона гомоцистеина (110 мкл) в ДМСО и инкубируют при 37°С в течение 18 ч. После инкубации реакционную смесь очищают от низкомолекулярных веществ с помощью концентраторов «Centricon» при 9000g аналогично первой стадии и получают конъюгат PFX-Hcy-HSA-Dcn.
Далее полученный конъюгат PFX-Hcy-HSA-Dcn растворяют в PBS (pH 7.4), добавляют избыток малеимидного производного трифтортимидина (10 мг), реакционную смесь инкубируют при 37°С в течение 18 часов, очищают от низкомолекулярных веществ с помощью концентраторов «Centricon» при 9000g аналогично стадиям 1, 2 и получают целевой продукт, представляющий собой конъюгат, содержащий остатки трифторксилола, трифтортимидина и дауномицина (PFX-Hcy-HSA-Dcn-TFT), который высушивают и хранят при -20 С.
Предложенный способ отличается простотой проведения синтеза (инкубация растворов при 37°С в течение 18 часов) и простой унифицированной процедурой выделения, заключающейся в отделении избытка низкомолекулярных агентов с помощью концентраторов «Centricon» при 9000g, что позволяет использовать большие избытки низкомолекулярных реагентов и обеспечить практически количественные выходы на каждой стадии. В результате получают стабильный конъюгат ЧСА, в котором два низкомолекулярных терапевтических агента и контрастирующий агент связаны с ЧСА ковалентными связями и их положение в конъюгате строго определено строением ЧСА. Полученный конъюгат ЧСА может быть использован в медицине для комплексного лечения рака, поскольку он содержит противоопухолевый антибиотик дауномицин и ингибитор тимидилатсинтазы трифтортимидин, а также для одновременной визуализации опухолевой ткани методом магнитно-резонансной томографии (МРТ) на ядрах атома 19F.
Определяющими существенными признаками заявляемого способа по сравнению с прототипом являются:
1) исходный раствор ЧСА модифицируют путем присоединения по свободной сульфгидрильной группе ЧСА малеимидного производного противоопухолевого антибиотика дауномицина, что позволяет получить стабильный промежуточный продукт, представляющий собой конъюгат ЧСА с дауномицином (HSA-Dcn), присоединенным по остатку цистин 34;
2) полученный промежуточный конъюгат (HSA-Dcn) обрабатывают N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)-тиолактоном гомоцистеина, что позволяет ввести через ковалентную связь контрастирующий агент (остаток перфторированного ксилола) по аминогруппам лизина 137, 205, 525 ЧСА. При этом одновременно образуются новые реакционноспособные центры (три свободные сульфгидрильные группы), которые используются для введения второго терапевтического агента на заключительной стадии;
3) полученный промежуточный конъюгат (PFX-Hcy-HSA-Dcn) модифицируют (обрабатывают) избытком малеимидного производного второго терапевтического агента - трифтортимидина, что позволяет ковалентно присоединить остатки трифтортимидина по образовавшимся на второй стадии сульфгидрильным группам, связанным с остатками лизина 137, 205, 525. В результате получают конечный конъюгат PFX-Hcy-HSA-Dcn-TFT, в котором все три компонента (два терапевтических и контрастирующий агент) присоединены к ЧСА через стабильные ковалентные связи, и их положение в конъюгате строго определено.
Именно вышеперечисленная определенная последовательность стадий синтеза вкупе с экспериментально подобранными оптимальными режимами их проведения обеспечивают возможность получения стабильного конъюгата на основе ЧСА заданного строения, содержащего два различных терапевтических агента и контрастирующий агент.
В связи с тем, что поиск по источникам патентной и научно-технической информации не выявил аналогичного технического решения, можно сделать вывод, что заявляемый способ получения противоопухолевого конъюгата на основе ЧСА, содержащего два терапевтических агента и контрастирующий агент для визуализации опухоли методом МРТ, отвечает критериям патентоспособности, а именно обладает «новизной» и «изобретательским уровнем».
Изобретение иллюстрируется следующими примерами.
Пример 1
На первой стадии осуществляли синтез конъюгата дауномицина с человеческим сывороточным альбумином (HSA-Dcn, фиг. 1).
Для этого к 1 мл 0,001 М раствора ЧСА (66.4 мг) в фосфатном буфере (PBS) с pH 7.4 добавляли 7 мг малеимидного производного дауномицина (N-((3S,4S,6R)-6-((1S,3S)-3-ацетил-3,5,12-тригидрокси-10-метокси-6,11-диоксо-1,2,3,4,6,11-гексагидротетрацен-1-илокси)-3-гидрокси-2-метилтетрагидро-2Н-пиран-4-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамида) в 50 мкл ДМСО. Реакционную смесь инкубировали при 37°С в течение 18 ч. После инкубации реакционную смесь очищали от низкомолекулярных веществ с помощью концентраторов «Centricon» (Amicon Centriprep YM30, Millipore, Bedford) при 9000g. Для этого раствор белка концентрировали до минимально возможного объема (~0,2 мл), добавляли буфер PBS (0,4 мл × 4), а затем воду (0,4 мл × 6), после добавления каждой порции буфера или воды раствор концентрировали. Затем порции раствора конъюгата раскапывали по пробиркам и порциями по 0,2 мл упаривали досуха на вакуумной центрифуге Speed Vac при 30°С. УФ (PBS, pH 7.4), λmax: 278, 480.
Полученный на первой стадии конъюгат HSA-Dcn растворяли в 1 мл PBS (pH 7.4) и вводили контрастирующий агент путем добавления в смесь 110 мкл 0.03 М раствора N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)тиолактона гомоцистеина в ДМСО и инкубировали при 37°С в течение 18 ч. После инкубации реакционную смесь очищали от избытка низкомолекулярных веществ с помощью концентраторов «Centricon» при 9000g аналогично первой стадии и получали конъюгат PFX-Hcy-HSA-Dcn. Реагент N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)тиолактона гомоцистеин (контрастирующий агент) получали известным способом (патент RU 2599500 C1, оп. 10.10.2016).
УФ-спектр (буфер PBS, pH 7,4), λmax/нм: 259, 278, 480. 19F ЯМР (pH 7,4, буфер PBS): δ 109,3 (м, 3F, CF3(1)), 108,5 (м, 3F, CF3(2)), 47,0 (м, 1F, F-3), 33,8 (м, 1F, F-5), 4,0 (м, IF, F-6). С использованием 5,5'-дитиобис(2-нитробензойной кислоты) было показано, что на одну молекулу белка в среднем приходится 3,0±0,1 свободных сульфгидрильных групп. Молярная масса конъюгата, по данным MALDITOF масс-спектрометрии, составила 68,3 кг/моль (что соответствует присоединению трех остатков N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)гомоцистеина и производного дауномицина.
Затем полученный на второй стадии промежуточный конъюгат PFX-Hcy-HSA-Dcn растворяли в 600 мкл фосфатного буфера (PBS, pH 7.4), добавляли 10 мг малеимидного производного трифтортимидина в 300 мкл воды. Реакционную смесь инкубировали при 37°С в течение 18 ч. После инкубации реакционную смесь очищали от избытка низкомолекулярных веществ с помощью концентраторов «Centricon» при 9000g аналогично стадиям 1 и 2. На заключительном этапе объем водного раствора белкового конъюгата PFX-Hcy-HSA-Dcn-TFT доводили до 1 мл, раскапывали по пробиркам порциями по 0,2 мл, упаривали досуха на вакуумной центрифуге Speed Vac при 30°C и хранили при -20 С. Выход целевого конъюгата составил 66.5 мг (95%).
Молярная масса конъюгата PFX-Hcy-HSA-Dcn-TFT, по данным MALDITOF масс-спектрометрии, составила 70,1 кг/моль (что соответствует присоединению трех остатков малеимидного производного трифтортимидина, трех остатков N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)гомоцистеина и производного дауномицина).
УФ (PBS, pH 7.4), λmax: 259, 278, 480. 31Р ЯМР (H2O, δ, ppm): 8.9 (P-N, алифатический амидофосфат); 19F ЯМР (pH 7,4, буфер PBS): δ 109 (уш. м, 3F, CF3(1)), 108 (уш. м, 3F, CF3(2)), 47,0 (м, 1F, F-3), 33,8 (м, 1F, F-5), 4,0 (м, 1F, F-6).
Использование предлагаемого способа позволит получать противоопухолевый конъюгат, в котором все три компонента (два терапевтических агента и контрастирующий агент) присоединены к ЧСА через стабильные ковалентные связи, и их положение в конъюгате строго определено строением ЧСА и последовательностью стадий синтеза. Способ прост в исполнении, поскольку включает унифицированные стадии синтеза (инкубация при 37°С 18 ч) и выделения (отделение избытка низкомолекулярных агентов с помощью концентраторов «Centricon») и обеспечивает высокий выход целевого продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения контрастирующего препарата на основе человеческого сывороточного альбумина для визуализации опухолевых тканей | 2016 |
|
RU2629844C1 |
| Противоопухолевый конъюгат на основе человеческого сывороточного альбумина для визуализации и комбинированной терапии глиобластом | 2024 |
|
RU2835210C1 |
| КОНТРАСТИРУЮЩИЙ АГЕНТ ДЛЯ ВВЕДЕНИЯ ФТОР-19 МЕТКИ В БЕЛКИ, СОДЕРЖАЩИЕ ОСТАТКИ ЛИЗИНА | 2015 |
|
RU2599500C1 |
| Способ модификации поверхности биоразлагаемых полимерных материалов | 2018 |
|
RU2699045C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАДИОИММУННОГО ПРЕПАРАТА ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2537175C2 |
| Комплексы на основе микропузырьков и способы применения | 2012 |
|
RU2613321C2 |
| ПОВЯЗКИ НА РАНУ, СОДЕРЖАЩИЕ БЕЛКОВЫЙ ПОЛИМЕР И ПОЛИФУНКЦИОНАЛЬНЫЙ СПЕЙСЕР | 2005 |
|
RU2349347C2 |
| ВЫСОКОЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ АДРЕСНОГО ДЕЙСТВИЯ ДЛЯ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2019 |
|
RU2727924C1 |
| ПРОТИВООПУХОЛЕВЫЙ ПЕПТИДНЫЙ ПРЕПАРАТ НА ОСНОВЕ ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА, ЕГО КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГОРМОНЗАВИСИМЫХ ОПУХОЛЕЙ | 2005 |
|
RU2285537C1 |
| СЛИТЫЕ КОНСТРУКЦИИ ЛЕКАРСТВЕННОГО СРЕДСТВА И КОНЪЮГАТЫ | 2005 |
|
RU2428431C2 |
Изобретение относится к фармакологии и медицинской диагностике. Противоопухолевый конъюгат получают путем последовательной модификации человеческого сывороточного альбумина (ЧСА), который последовательно сначала обрабатывают избытком малеимидного производного дауномицина, затем полученный промежуточный конъюгат ЧСА с дауномицином обрабатывают избытком N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)тиолактона гомоцистеина в диметилсульфоксиде, а полученный на предыдущей стадии промежуточный конъюгат обрабатывают избытком мелеимидного производного трифтортимидина, причем после обработки ЧСА и промежуточных конъюгатов соответствующим реагентом осуществляют инкубацию реакционной смеси при 37°С в течение 18 ч с последующим отделением избытка низкомолекулярных компонентов реакционной смеси и высушиванием очищенной высокомолекулярной фракции. Изобретение обеспечивает возможность получения конъюгата заданного строения, содержащего два терапевтических и контрастирующий агенты, а также упрощение способа и повышение выхода целевого конъюгата. 2 з.п. ф-лы, 1 пр.,1 ил.
1. Способ получения противоопухолевого конъюгата на основе человеческого сывороточного альбумина (ЧСА), содержащего терапевтические и контрастирующий агенты, путем последовательной модификации ЧСА, отличающийся тем, что раствор ЧСА последовательно обрабатывают сначала избытком малеимидного производного дауномицина, затем полученный промежуточный конъюгат ЧСА с дауномицином обрабатывают избытком N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)тиолактона гомоцистеина в диметилсульфоксиде, а полученный на предыдущей стадии промежуточный конъюгат обрабатывают избытком малеимидного производного трифтортимидина, причем после обработки ЧСА и промежуточных конъюгатов соответствующим реагентом осуществляют инкубацию реакционной смеси при 37°C в течение 18 ч с последующим отделением избытка низкомолекулярных компонентов реакционной смеси и высушиванием очищенной высокомолекулярной фракции.
2. Способ по п. 1, отличающийся тем, что для растворения ЧСА и промежуточных конъюгатов используют фосфатный буфер PBS с рН 7.4.
3. Способ по п. 1, отличающийся тем, что избыток низкомолекулярных компонентов реакционной смеси отделяют с использованием концентратора «Centricon» при 9000g.
| СПОСОБЫ КОНЪЮГАЦИИ | 2010 |
|
RU2595424C2 |
| КОНЪЮГАТ, ОБЛАДАЮЩИЙ ИЗБИРАТЕЛЬНЫМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К РАКОВЫМ ОПУХОЛЯМ | 2005 |
|
RU2303997C2 |
| ПОСЫПАНОВА Г.А | |||
| Использование белковых и пептидных векторов для избирательной доставки противоопухолевых препаратов и терапевтических олигонуклеотидов в опухолевые клетки | |||
| Автореф | |||
| дис | |||
| д.б.н | |||
| Москва, 2013 | |||
| US 6441163 B1, 27.08.2002. | |||
Авторы
Даты
2018-02-08—Публикация
2016-12-12—Подача