Изобретение относится к контрастирующим препаратам на основе человеческого сывороточного альбумина для последующей визуализации опухолевых тканей, а также процессов фармакокинетики и фармакодинамики белковых препаратов в режиме оптической и магнитно-резонансной томографии (МРТ).
Способность альбумина связывать вещества различного размера и химической природы привела к тому, что в последние годы человеческий сывороточный альбумин (ЧСА) широко используется в качестве направленного носителя противоопухолевых лекарственных препаратов и контрастирующих реагентов.
Так, например, известен препарат на основе ЧСА, с которым ковалентными связями или посредством авидин-биотиновой системы связан аполипопротеин E, способствующий преодолению гематоэнцефалического барьера (патент EP 1392255 B1, оп. 08.06.2011).
Известна система-носитель действующих лекарственных веществ для клеточно-специфического обогащения действующих лекарственных веществ, которая находится, в том числе, в форме модифицированных авидином наночастиц на основе человеческого сывороточного альбумина (патент RU 2388463 C2, оп. 10.05.2010).
ЧСА широко используется для создания контрастирующих препаратов, позволяющих значительно улучшить качество визуализации опухолевых тканей методом MPT [Zhibo Liu, Xiaoyuan Chen Simple bioconjugate chemistry serves great clinical advances: Albumin as a versatile platform for diagnosis and precision therapy // Chem. Soc. Rev. (2016) V. 45, P. 1432-1456; Чубаров A.C., Годовикова T.C., Ахмад С., Сильников В.Н. Визуализирующие системы на основе человеческого сывороточного альбумина для МРТ диагностики патологических процессов (обзор) // Химия в интересах устойчивого развития (2016) Т. 24, С. 585-595].
Следующим шагом, позволяющим значительно улучшить визуализацию опухолевых тканей, является введение в ЧСА 19F метки и проведение МРТ на ядрах 19F (Патент RU 2599500 C1, оп. 10.10.2016; A.S. Chubarov, М.М. Shakirov, I.V. Koptyug, R.Z. Sagdeev, D.G. Knorre, T.S. Godovikova / Synthesis and characterization of fluorinated homocysteine derivatives as potential molecular probes for 19F magnetic resonance spectroscopy and imaging // Bioorgan. Med. Chem. Lett. (2011) V. 21, P. 4050-4053].
Существенной проблемой при создании медицинских визуализирующих препаратов на основе ЧСА является возможность вирусной, бактериальной или белковой контаминации препарата.
Существует два основных источника ЧСА, используемые для создания лекарственных препаратов и контрастирующих агентов. Наиболее часто ЧСА в настоящее время производят путем фракционирования крови, собранной у доноров крови. Однако данный способ получения неизбежно включает опасность контаминации инфекционными агентами, такими как вирус гепатита, вирус иммунодефицита человека и т.д. Поэтому очистка ЧСА из крови человека включает пастеризацию продукта и является очень дорогостоящей.
Вторым способом является биотехнологическое производство, включающее клонирование кДНК, кодирующей ЧСА, в экспрессионный вектор, трансформация бактериальных или дрожжевых клеток хозяина с использованием данного вектора, культивирование трансформированных хозяев и выделение полученного таким образом ЧСА, (например, ЕР 061276 (А1), оп. 31.08.1994, ЕР 0091527 (A3), оп. 25.07.1984; ЕР 0366400 (B1), оп. 27.12.1996; ЕР 0699687 (A1), оп. 06.03.1996).
Одной из проблем, связанных с выделением ЧСА из рекомбинантных клеток хозяина, является то, что остаточные микробные компоненты, такие как бактериальные или дрожжевые белки или липиды, являются высокоантигенными для человека. Тот факт, что ЧСА как белку-носителю присуща связывающая активность в отношении множества микробных продуктов и компонентов культуры ткани, дополнительно усложняет схему счистки и ее результативность.
Наиболее близким к заявляемому способу - прототипом, является способ получения контрастирующего препарата на основе ЧСА путем обработки ЧСА флуоресцентным красителем, содержащим малеимидную группу, непосредственно в крови лабораторных животных [Lau S., Graham В., Cao N., Boyd В.J., Pouton C.W., White P.J. Enhanced extravasation, stability and in vivo cardiac gene silencing via in situ siRNA-albumin conjugation. // Mol Pharm. (2012) V. 9, P. 71-80].
Однако применение данного способа ограничено, с одной стороны, токсичностью вводимых низкомолекулярных соединений (непрореагировавшие с ЧСА низкомолекулярные соединения имеют собственную фармакокинетику и фармакодинамику, отличные от их конъюгатов с ЧСА), а с другой стороны, не позволяет вводить в молекулу альбумина более одной метки.
Задачей изобретения является разработка способа получения контрастирующего препарата на основе ЧСА, позволяющего исключить дополнительную первичную вирусную или бактериальную контаминацию препарата, а также получать препарат, не содержащий иммуногенных компонентов.
Технический результат: повышение качества целевого продукта.
Поставленная задача достигается последовательной модификацией ЧСА непосредственно в сыворотке крови пациента, которому предполагается вводить данный препарат, малеимидным производным красителя sulfo-Cyanine5 и N-(2,3,5-трифтор-4,6-бис(трифторметил)фенил)-тиолактоном гомоцистеина.
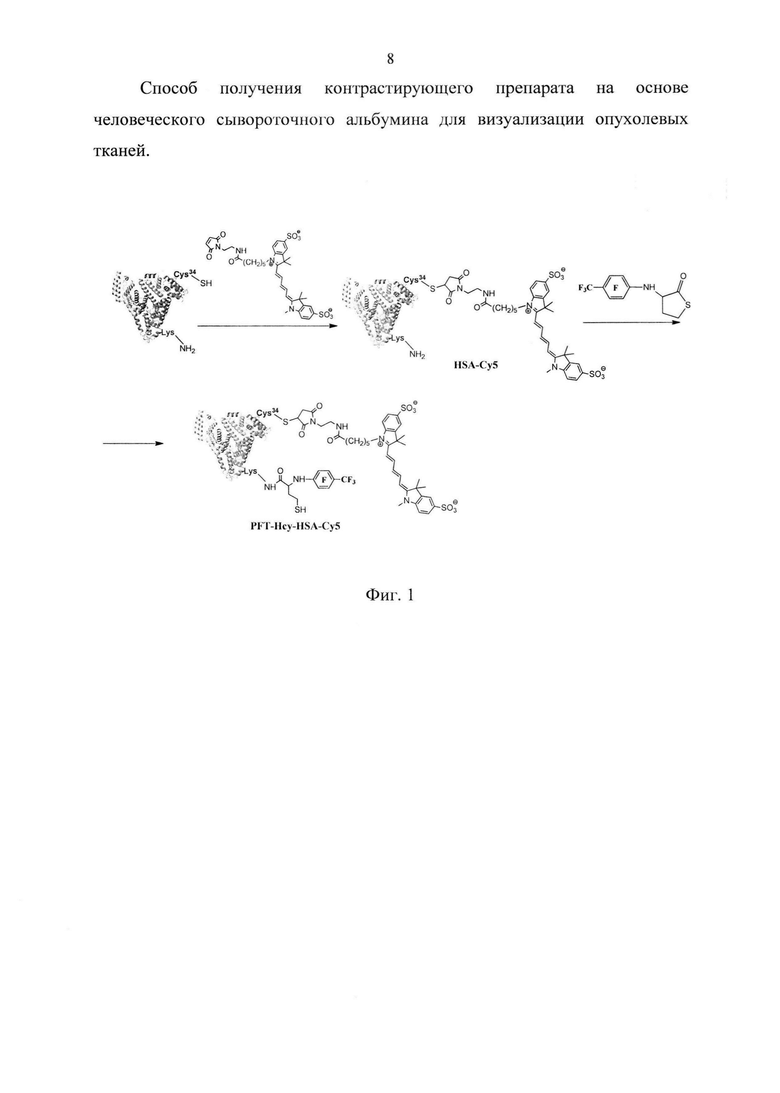
На фиг. 1 представлена общая схема последовательной модификации ЧСА.
Способ получения заявляемого контрастирующего препарата заключается в следующем.
Плазму крови пациента, полученную с использованием стандартного метода каскадного плазмафереза, последовательно обрабатывают 6,25 мМ раствором малеимидного производного красителя sulfo-Cyanine5 и 0,053 М раствор N-(2,3,5,6-тетрафтор-4-(трифторметил)фенил)тиолактона гомоцистеина в диметилсульфоксиде (ДМСО) с последующей инкубацией реакционной смеси при 37°C в течение 3,5 и 17 часов соответственно. Низкомолекулярные компоненты реакционной смеси отделяют с использованием концентраторов «Centricon». Очищенную высокомолекулярную фракцию высушивают, хранят при -20°C и вводят пациенту - донору плазмы, по мере необходимости. В результате получают контрастирующий препарат на основе модифицированного ЧСА, свободный от вирусной, бактериальной или белковой контаминации.
Модифицированный ЧСА представляет собой коньюгат, содержащий присоединенный по SH группе ЧСА цианиновый краситель (флуоресцентная метка) и 3 остатка N-(2,3,5,6-тетрафтор-4-(трифторметил)фенил гомоцистеина (19F метка), присоединенных по остаткам лизина. Молярная масса конъюгата (MALDI TOF) 70,7 кг/моль, λmax/нм: 278, 652 (pH 7,4).
Изобретение иллюстрируется следующими примерами.
Пример 1.
К 1 мл карантинизированной плазмы крови добавляют 96 мкл 6,25 мМ раствора малеимидного производного красителя sulfo-Cyanine5 в диметилсульфоксиде (ДМСО) и инкубируют при 37°C в течение 3,5 ч.
К реакционной смеси белков плазмы крови и малеимидного производного красителя sulfo-Cyanine5, без очистки, добавляют 70 мкл 0,053 М раствора N-(2,3,5,6-тетрафтор-4-(трифторметил)фенил)тиолактона гомоцистеина в ДМСО и инкубируют смесь при 37°C в течение 17 ч. После инкубации реакционную смесь очищают от низкомолекулярных веществ с помощью концентраторов «Centricon» (Amicon Centriprep YM30, Millipore, Bedford) при 9000 g. Для этого реакционную смесь распределяют поровну (по ~388 мкл) по 3 концентраторам и концентрируют до минимально возможного объема (~0,2 мл), добавляют фосфатный буферный раствор (PBS) с pH 7.4 (0,4 мл×4), а затем воду (0,4 мл×6), после добавления каждой порции буфера или воды раствор концентрируют до минимально возможного объема. Затем порции раствора белков плазмы раскапывают по пробиркам порциями но 0,2 мл, упаривают досуха на вакуумной центрифуге Speed Vac при 30°C и хранят при -20°C.
УФ-спектр (буфер PBS pH 7,4), λmax/нм: 278, 652. 19F ЯМР (pH 7,4, буфер PBS, δ, м.д.): 109 (уш. м, CF3), 17 (м, F-3, F-5), 0 (м, F-2, F-6). Выход модифицированного белка составляет ~95%.
Пример 2
Анализ белков плазмы крови после модификации, подтверждающий исключительную модификацию ЧСА.
По завершении процесса очистки от низкомолекулярных веществ проводили электрофоретическое разделение белков плазмы в денатурирующем полиакриламидном геле (SDS-PAGE). С помощью метода гель-электрофореза было показано соответствие по гель-электрофоретической подвижности флуоресцирующей полосы (с красителем sulfo-Cyanine5) полосе человеческого сывороточного альбумина.
Другие флуоресцирующие полосы отсутствовали, что подтверждает избирательное модифицирование только ЧСА.
Для выявления белков, содержащих SH-группы, перед нанесением белковых проб на гель, реакционные смеси инкубировали с малеимидным производным флуоресцеина в течение 20 мин при 25°С. Белковые полосы, соответствующие по гель-электрофоретической подвижности ЧСА, флуоресцировали зеленым светом, что связано с модификацией белка остатком флуоресцеина из-за появления в составе альбумина дополнительных сульфгидрильных групп остатков гомоцистамида, образующихся при введении 19F-MPT метки по реакции N-гомоцистеинилирования (Фиг. 1).
Использование изобретения позволит получать «чистые» контрастирующие препараты на основе ЧСА непосредственно из плазмы крови пациентов, свободные от вирусной, бактериальной или белковой контаминации, для последующей визуализации опухолевых тканей методом оптической томографии и МРТ на ядрах фтора.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения противоопухолевого коньюгата на основе человеческого сывороточного альбумина, содержащего терапевтические и контрастирующий агенты | 2016 |
|
RU2644280C1 |
| КОНТРАСТИРУЮЩИЙ АГЕНТ ДЛЯ ВВЕДЕНИЯ ФТОР-19 МЕТКИ В БЕЛКИ, СОДЕРЖАЩИЕ ОСТАТКИ ЛИЗИНА | 2015 |
|
RU2599500C1 |
| Противоопухолевый конъюгат на основе человеческого сывороточного альбумина для визуализации и комбинированной терапии глиобластом | 2024 |
|
RU2835210C1 |
| Способ получения препарата на основе магнитных наночастиц (МНЧ) оксида железа для МРТ-диагностики новообразований | 2017 |
|
RU2659949C1 |
| Способ модификации поверхности биоразлагаемых полимерных материалов | 2018 |
|
RU2699045C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАДИОИММУННОГО ПРЕПАРАТА ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2537175C2 |
| Фотосенсибилизатор на основе карбоцианинового красителя для фотодинамической терапии опухолей | 2016 |
|
RU2638131C1 |
| СПОСОБ ДИАГНОСТИКИ МУЛЬТИФОРМНОЙ ГЛИОБЛАСТОМЫ С ПОМОЩЬЮ МРТ | 2012 |
|
RU2530762C2 |
| Применение сывороточного альбумина в качестве противомикробного агента | 2019 |
|
RU2716003C1 |
| Способ получения сорбента для разделения биологических жидкостей | 1991 |
|
SU1788463A1 |
Изобретение относится к контрастирующим препаратам на основе человеческого сывороточного альбумина для последующей визуализации опухолевых тканей в режиме оптической или магнитно-резонансной томографии (МРТ). Плазму крови пациента, получаемую с использованием стандартного метода каскадного плазмафереза, последовательно обрабатывают раствором малеимидного производного красителя sulfo-Cyanine5 и N-(2,3,5,6-тетрафтор-4-(трифторметил)фенил)тиолактона гомоцистеина в диметилсульфоксиде с инкубацией при 37°C в течение 3,5 и 17 часов соответственно, низкомолекулярные компоненты реакционной смеси отделяют, а очищенную высокомолекулярную фракцию высушивают и хранят до использования при -20°C. Технический результат: повышение качества целевого продукта. 3 з.п. ф-лы, 1 ил., 2 пр.
1. Способ получения контрастирующего препарата на основе человеческого сывороточного альбумина (ЧСА) для визуализации опухолевых тканей, включающий обработку ЧСА непосредственно в крови флуоресцентным красителем, содержащим малеимидную группу, отличающийся тем, что плазму крови пациента-донора последовательно обрабатывают раствором малеимидного производного красителя sulfo-Cyanine5 и N-(2,3,5,6-тетрафтор-4-(трифторметил)фенил)тиолактона гомоцистеина в диметилсульфоксиде с последующей инкубацией реакционной смеси при 37°C в течение 3,5 и 17 часов соответственно, низкомолекулярные компоненты реакционной смеси отделяют, а очищенную высокомолекулярную фракцию высушивают и хранят до использования при -20°C.
2. Способ по п. 1, отличающийся тем, что плазму крови пациента-донора получают с использованием стандартного метода каскадного плазмафереза.
3. Способ по п. 1, отличающийся тем, что используют 6,25 мМ раствор малеимидного производного красителя sulfo-Cyanine5 и 0,053 М раствор N-(2,3,5,6-тетрафтор-4-(трифторметил)фенил)тиолактона гомоцистеина.
4. Способ по п. 1, отличающийся тем, что низкомолекулярные компоненты реакционной смеси отделяют с использованием концентратора «Centricon» при 9000 g.
| ПРЕПАРАТ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО СЫВОРОТОЧНОГО АЛЬБУМИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2337966C2 |
| С.С | |||
| Терехов и др | |||
| Создание высокоэффективного флуоресцентного зонда для изучения биодеградации фармакологических белковых препаратов in vivo / Acta naturae, 2014, т.6, N 4(23), стр | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| А.И | |||
| Чертенков | |||
| Флуоресцентное мечение гомоцистеинилированного альбумина человека / Медицина и образование в Сибири, N3, 2014, стр | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
Авторы
Даты
2017-09-04—Публикация
2016-11-08—Подача