Изобретение относится к области фармакологии и касается создания новых лекарственных средств для профилактики и лечения нарушений сердечного ритма.
Нарушения сердечного ритма сопровождают практически все заболевания сердечнососудистой системы, обусловленные как органическими поражениями сердца, так и его функциональными расстройствами. Аритмии широко распространены и возникают примерно у 25% больных при лечении сердечными гликозидами и более чем у 80% пациентов с острым инфарктом миокарда [Бертрам Г. Катцунг. Базисная и клиническая фармакология. - 2007. - Том 1, 648 с.]. Клиническая значимость нарушений сердечного ритма определяется их способностью повышать риск внезапной смерти у пациентов с сердечно-сосудистыми заболеваниями и значительно ухудшать качество жизни больных [Моисеева И.Я. и др. Основы клинической фармакологии противоаритмических средств / Учебное пособие. - 2006, 78 с.].
Лекарственные препараты широко используются в лечении аритмий, однако их эффективность ограничена. Только при некоторых вариантах нарушений сердечного ритма терапевтический эффект достигает 90-100%. Такое столь выраженное антиаритмическое действие имеет место при купировании реципрокных атриовентрикулярных тахикардий внутривенным введением АТФ, аденозина, верапамила [The «Sicilian Gambit». A new approach to the Classification of antiarrhythmic drugs based on their action on arrhythmogenic mechanism / Circulation, 1991, V. 84, №4, pp. 1831-1851], купировании и предупреждении пароксизмальной желудочковой тахикардии с комплексами типа блокады правой ножки пучка Гиса и резким отклонением оси сердца влево верапамилом, устранение антиаритмиками подкласса IC желудочковой экстрасистолии [Сметнев А.С. и др. Диагностика и лечение нарушения ритма. - Кишинев, 1990. - 325 с.].
Достигнуты значительные успехи в понимании механизмов действия тех или иных средств антиаритмической терапии, однако индивидуальный подбор препарата, который оказался бы эффективным и хорошо переносимым, зачастую по-прежнему осуществляется методом проб и ошибок [Беннетт Д.Х. Аритмии сердца. Практические заметки по интерпретации и лечению / под ред. Голицына С.П. - М.: МЕДпресс-информ, 2016. - 272 с.].
Другой отрицательной стороной некоторых современных противоаритмических средств является малая продолжительность их антиаритмического эффекта, а также отсутствие у них антифибрилляторного действия. Между тем фибрилляция желудочков относится к наиболее тяжелым нарушениям сердечного ритма и служит основной причиной внезапной смерти, особенно при инфаркте миокарда.
Многие антиаритмические средства способны ухудшать течение существующей аритмии или вызвать появление новых форм нарушения сердечного ритма, причем в отдельных случаях - с фатальными последствиями. И хотя этот факт известен уже несколько десятилетий, вся значимость проблемы осознана лишь в последние годы, в частности, после публикаций результатов исследований CAST и CAST II [Фогорос Р. Антиаритмические средства / под ред. Звартау Э.Э. - М.: Бином; СПб.: Нев. Диалект, 1999. - 190 с.]. Риск развиттия аритмогенного эффекта под влиянием лекарственных средств для лечения нарушений сердечного ритма может зависеть от пола пациентов. Так, по некоторым данным [UK propafenone PSVT study group. A randomized placebo-controlled trail of propafenone in the prophylaxis of paroxysmal supraventricular tachycardia and paroxysmal atrial fibrillation / Circulation, 1995, V. 92, pp. 2550-2557], 70% из 322 случаев желудочковой тахикардии типа «пирует» были зарегистрированы у женщин.
Наряду с кардиальными, имеют место и экстракардиальные побочные эффекты противоаритмических средств, связанные с воздействием на центральную нервную систему, желудочно-кишечный тракт и другие органы.
В этой связи разработка эффективной терапии нарушений сердечного ритма и поиск новых лекарственных препаратов с высокой антиаритмической активностью и лишенных нежелательных побочных эффектов являются одними из самых актуальных проблем современной кардиофармакологии.
Анализ литературы показывает, что из уровня техники [патент US 6172262 В1, опубл. 09.01.2001] известны близкие по структуре соединения с формулой:
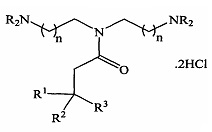 , где
, где
R=алкил; R1, R2, R3=алкил, циклоалкил, арил; n=1, 2, которые являются амфифильными агентами, легко солюбилизирующими мембраносвязанные белки.
Также из уровня техники [заявка на патент US 20140080708 А1, опубл. 20.03.2014] известны соединения с формулой:
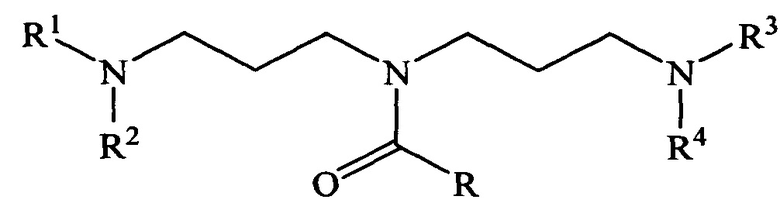 , где
, где
R=алкил; R1, R2, R3, R4=Н, алкил, СН2СН2ОН, СН2СН(СН3)ОН, которые являются биоразлагающими агентами.
Однако вышеприведенные соединения не обладают антиаритмическими свойствами.
Задача настоящего изобретения состоит в синтезе соединений, обладающих высокой антиаритмической активностью и перспективных для разработки на их основе лекарственных средств для лечения нарушений сердечного ритма.
Технический результат настоящего изобретения заключается в расширении арсенала средств, обладающих высокой антиаритмической активностью и перспективных для разработки на их основе лекарственных средств для лечения нарушений сердечного ритма.
Указанные задача и технический результат достигаются новым классом антиаритмических азотсодержащих соединений - N,N-бис(2-(диалкиламино)этил)карбоксамидами и их дигидрохлоридами следующей формулы:
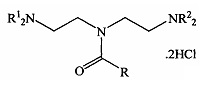 , где
, где
(при этом NC4H8 - пирролидино, NC5H10 - пиперидино, NC4H8O - морфолино).
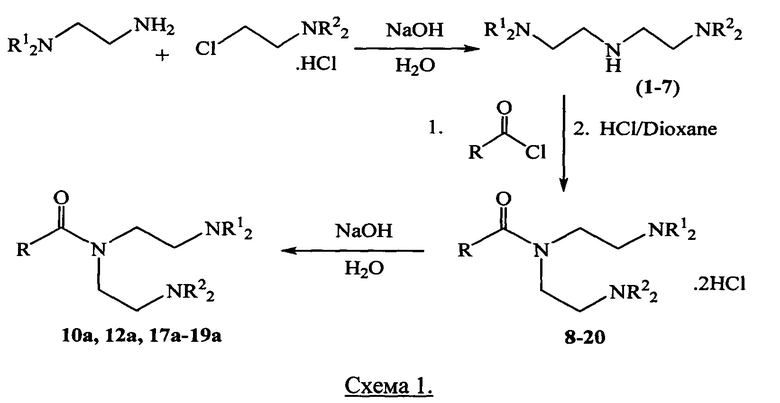
N-замещенные диэтилентриамины 1-7, необходимые для реакции ацилирования, синтезировали из N,N-диалкилэтилендиаминов и гидрохлорида N-замещенных 2-хлорэтиламинов по схеме 1 согласно известной методике [Louis J. Sacco et al. The synthesis of N,N-bis-(β-diethylaminoethyl)amine and some N-substituted alkanesulfonamides / Journal of the American Chemical Society, 1954, V. 76, рр. 303-305]. Реакцию проводили в 10% водном растворе NaOH при нагревании до 65-70°С в течение 15-18 часов с выходами 18-56%.
Ацилирование N-замещенных диэтилентриаминов 1-7 арилоксиацетилхлоридами проводили в сухом дихлорметане в течение 5 часов при комнатной температуре. Затем к реакционной смеси добавляли 3N раствор хлороводорода в диоксане до постоянного значения pH=2, что дало дигидрохлориды N,N-бис(2-(диалкиламино)этил)карбоксамиды 8-20 с выходами 47-80%.
Подщелачиванием водных растворов дигидрохлоридов 10, 12, 17-19 водным раствором NaOH были получены соответствующие основания 10а, 12а, 17а-19а с выходами 72-95%.
Строение соединений 8-20 подтверждено данными ИК-, ЯМР 1H-, 13C-спектроскопии, а также масс-спектрометрии, состав - элементным анализом.
Физико-химические характеристики предлагаемых соединений представлены в таблицах 1-2.

*Хроматографирование проводили на Silufol UV 254, элюент - метанол.
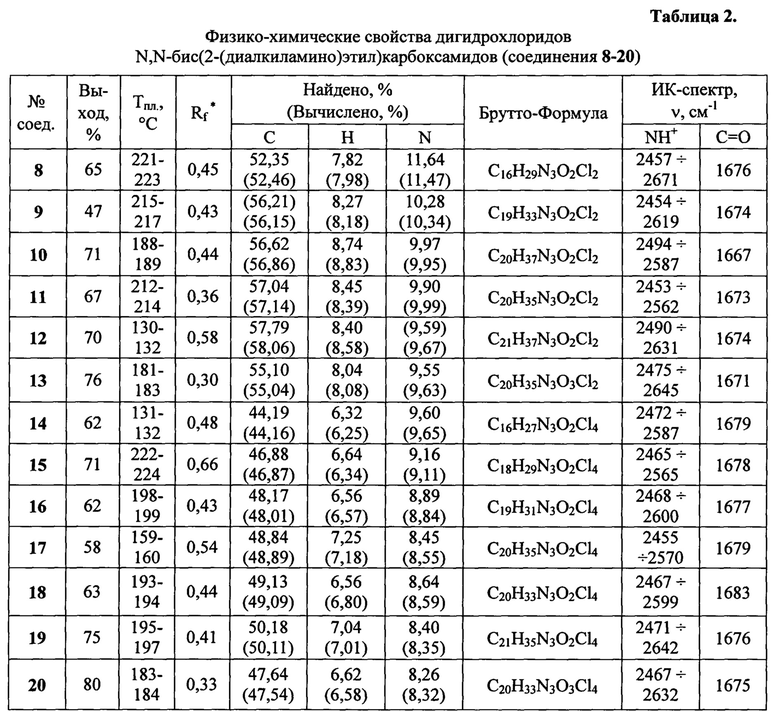
*Хроматографирование проводили на Silufol UV 254, элюент - метанол.
Пример 1. К смеси 3,9 г (0,044 моль) N,N-диметилэтилендиамина и 20 мл водного 10%-го раствора NaOH порционно при перемешивании добавляют 5,0 г (0,0295 моль) гидрохлорида N-(2-хлорэтил)пирролидина. Смесь перемешивают на магнитной мешалке при 65-70°С в течение 18 часов. Продукт экстрагируют этилацетатом (5×25 мл). Экстракты объединяют и сушат над Na2SO4. Растворитель отгоняют на роторе, остаток перегоняют под вакуумом, получают 1,9 г (35%) N,N-диметил-N'-(2-пирролидиноэтил)этилендиамина (соединение 3). Спектр ЯМР 1Н (CDCl3), 300 МГц, δ м.д.: 2,70 (м, 4Н, 2CH2N), 2,56 (т, 2Н, CH2N), 2,46 (м, 4Н, 2CH2N), 2,38 (т, 2Н, CH2N), 2,18 (с, 7Н, (CH3)2N+NH), 1,73 (м, 4Н, 2СН2, NC4H8). Спектр ЯМР 13C (CDCl3), 75 МГц, δ м.д.: 59,11 (CH2N), 55,99 (CH2N), 54,18 (2CH2N, NC4H8), 48,76 (CH2N), 47,50 (CH2N), 45,50 (2СН3), 23,32 (2СН2, NC4H8). Масс-спектр, m/z: вычислено для [C10H23N3+Н]+ 186,2, найдено 186,0.
Пример 2. К смеси 5,7 г (0,066 моль) N,N-диметилэтилендиамина и 25 мл водного 10%-го раствора NaOH порционно при перемешивании добавляют 6,0 г (0,033 моль) гидрохлорида N-(2-хлорэтил)пиперидина. Смесь перемешивают на магнитной мешалке при 65-70°С в течение 18 часов. Продукт экстрагируют этилацетатом (5×25 мл). Экстракты объединяют и сушат над Na2SO4. Растворитель отгоняют на роторе, остаток перегоняют под вакуумом, получают 1,8 г (28%) N,N-диметил-N'-(2-пиперидиноэтил)этилендиамина (соединение 4). Спектр ЯМР 1Н (CDCl3), 300 МГц, δ м.д.: 2,70 (м, 4Н, 2CH2N), 2,45-2,34 (м, 9Н, 4CH2N+NH), 2,17 (с, 6Н, 2СН3). 1,52 (м, 4Н, Hβ, NC5H10), 1,39 (м, 2Н, Hγ, NC5H10). Спектр ЯМР 13С (CDCl3), 75 МГц, δ м.д.: 58,72 (CH2N), 58,23 (CH2N), 54,26 (2Сα, NC5H10), 47,07 (CH2N), 46,47 (CH2N), 45,05 (2СН3), 25,49 (2Сβ, NC5H10), 23,96 (Сγ, NC5H10). Масс-спектр, m/z: вычислено для [C11H25N3+Н]+ 200,2127, найдено 200,2121, вычислено для [C11H25N3+Na]+ 222,1946, найдено 222,1942.
Пример 3. К смеси 6,2 г (0,053 моль) N,N-диэтилэтилендиамина и 26 мл водного 10%-го раствора NaOH порционно при перемешивании добавляют 6,0 г (0,035 моль) гидрохлорида N-(2-хлорэтил)пирролидина. Смесь перемешивают на магнитной мешалке при 65-70°С в течение 16 часов. Продукт экстрагируют этилацетатом (4×25 мл). Экстракты объединяют и сушат над Na2SO4. Растворитель отгоняют на роторе, остаток перегоняют под вакуумом, получают 3,2 г (42%) N,N-диэтил-N'-(2-пирролидиноэтил)этилендиамина (соединение 5). Спектр ЯМР 1Н (CDCl3), 300 МГц, δ м.д.: 2,70 (м, 4Н, 2CH2N), 2,57-2,43 (м, 12Н, 6CH2N), 2,17 (с, 1Н, NH), 1,71 (м, 4Н, 2СН2, NC4H8), 0,96 (т, 6Н, 2СН3). Спектр ЯМР 13С (CDCl3), 75 МГц, δ м.д.: 55,54 (CH2N), 53,73 (2CH2N, NC4H8), 52,20 (CH2N), 48,32 (CH2N), 47,28 (CH2N), 46,55 (2CH2N, N(C2H5)2), 22,91 (2CH2, NC4H8), 11,27 (2CH3). Масс-спектр, m/z: вычислено для [C12H27N3+H]+ 214,2283, найдено 214,2269, вычислено для [C12H27N3+Na]+ 236,2103, найдено 236,2087.
Пример 4. К смеси 6,3 г (0,054 моль) N,N-диэтилэтилендиамина и 23 мл водного 10%-го раствора NaOH порционно при перемешивании добавляют 5,0 г (0,027 моль) гидрохлорида N-(2-хлорэтил)пиперидина. Смесь перемешивают на магнитной мешалке при 65-70°С в течение 15 часов. Продукт экстрагируют этилацетатом (4×25 мл). Экстракты объединяют и сушат над Na2SO4. Растворитель отгоняют на роторе, остаток перегоняют под вакуумом, получают 3,4 г (56%) N,N-диэтил-N'-(2-пиперидиноэтил)этилендиамина (соединение 6). Спектр ЯМР lH (CDCl3), 300 МГц, δ м.д.: 2,67 (м, 4Н, 2CH2N), 2,52-2,32 (м, 13Н, 6CH2N+NH), 1,51 (м, 4Н, Hβ, NC5H10), 1,39 (м, 2Н, Нγ, NC5H10), 0,96 (т, 6Н, 2СН3). Спектр ЯМР 13С (CDCl3), 75 МГц, δ м.д.: 58,13 (CH2N), 54,23 (2Cα, NC5H10), 52,15 (CH2N), 47,17 (CH2N), 46,52 (2CH2N, N(C2H5)2), 46,34 (CH2N), 25,47 (2Cβ, NC5H10), 23,92 (Cγ, NC5H10), 11,27 (2CH3). Масс-спектр, m/z: вычислено для [C13H29N3+2H]+ 229,25, найдено 229,19.
Пример 5. К смеси 5,6 г (0,048 моль) N,N-диэтилэтилендиамина и 23 мл водного 10%-го раствора NaOH порционно при перемешивании добавляют 6,0 г (0,032 моль) гидрохлорида N-(2-хлорэтил)морфолина. Смесь перемешивают на магнитной мешалке при 65-70°С в течение 15 часов. Продукт экстрагируют этилацетатом (4×25 мл). Экстракты объединяют и сушат над Na2SO4. Растворитель отгоняют на роторе, остаток перегоняют под вакуумом, получают 2,8 г (38%) N,N-диэтил-N'-(2-морфолиноэтил)этилендиамина (соединение 7). Спектр ЯМР 1Н (CDCl3), 300 МГц, δ м.д.: 3,68 (т, 4Н, 2CH2O, NC4H8O), 3,07 (с, 1Н, NH) 2,72 (м, 4Н, 2CH2N), 2,57-2,41 (м, 12Н, 6CH2N), 0,99 (т, 6Н, 2СН3). Спектр ЯМР 13С (CDCl3), 75 МГц, δ м.д.: 66,49 (2CH2O, NC4H8O), 57,44 (CH2N), 53,18 (2CH2N, NC4H8O), 51,89 (CH2N), 46,86 (CH2N), 46,48 (2CH2N, N(C2H5)2), 45,46 (CH2N), 11,30 (2CH3). Масс-спектр, m/z: вычислено для [C12H27N3O+H]+ 230,2232, найдено 230,2220, вычислено для [C12H27N3O+Na]+ 252,2052, найдено 252,2039.
Пример 6. К охлажденному до 5°С раствору 1,3 г (0,008 моль) N,N-бис(2-(диметиламино)этил)амина (1) в 40 мл сухого дихлорметана при перемешивании медленно добавляют раствор 2,78 г (0,016 моль) феноксиацетилхлорида в 20 мл сухого дихлорметана, наблюдается выпадение белого осадка. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения pH=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир. Выделенный осадок фильтруется, промывается 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 1,9 г (65%) дигидрохлорида N,N-бис(2-(диметиламино)этил)-2-феноксиадетамида (соединение 8). Спектр ЯМР 1Н (D2O), 300 МГц, δ м.д.: 7,30 (м, 2Н, Ph), 7,00 (м, 1Н, Ph), 6,95 (м, 2Н, Ph), 4,89 (с, 2Н, CH2O), 3,73 (м, 4Н, 2CH2N), 3,37 (т, 2Н, CH2N), 3,29 (т, 2Н, CH2N), 2,87 (с, 6Н, 2СН3), 2,85 (с, 6Н, 2СН3). Спектр ЯМР 13С (D2O), 75 МГц, δ м.д.: 171,17 (С=O), 156,56 (С, Ph), 129,50 (2СН, Ph), 121,79 (СН, Ph), 114,21 (2СН, Ph), 65,24 (CH2O), 54,45 (CH2N), 53,24 (CH2N), 42,87 (2CH3), 42,82 (2CH3). 41,50 (CH2N), 41,15 (CH2N). Масс-спектр, m/z: вычислено для [C16H27N3O2+Н]+ 294,2182, найдено 294,2167.
Пример 7. К охлажденному до 5°С раствору 0,6 г (0,0031 моль) N,N-диметил-N'-(2-пиперидиноэтил)этилендиамина (4) в 15 мл сухого дихлорметана при перемешивании медленно добавляют раствор 0,78 г (0,0046 моль) феноксиацетилхлорида в 10 мл сухого дихлорметана, наблюдается выпадение выпадает белого осадка. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения pH=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир. Выделенный осадок фильтруется, промывается 3×10 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 0,58 г (47%) дигидрохлорида N-(2-(диметиламино)этил)-N-(2-пиперидиноэтил)-2-фенокси-ацетамида (соединение 9). Спектр ЯМР 1H (DMSO-d6), 300 МГц, δ м.д.: 11,04 (с, 1H, HN+), 10,32 (с, 1Н, HN+), 7,26 (м, 2Н, Ph), 7,03 (м, 2Н, Ph), 6,93 (м, 1H, Ph), 4,97 (с, 2Н, CH2O), 3,83 (м, 2Н, CH2N), 3,71 (м, 2Н, CH2N), 3,45-3,20 (м, 6Н, 2CH2N+2Нα в NC5H10), 2,91 (с, 2Н, Нα в NC5H10), 2,80/2,79 (оба с, 6Н, 2СН3), 1,80-1,67 (м, 5Н, 4Нβ+1Нγ, NC5H10), 1,41 (с, 1Н, Нγ, NC5H10). Спектр ЯМР 13С (DMSO-d6), 75 МГц, δ м.д.: 168,61/168,49 (С=O), 157,91 (С, Ph), 129,29 (2СН, Ph), 120,76 (СН, Ph), 114,70 (2СН, Ph), 65,40/65,38 (CH2O), 53,37/52,98 (CH2N), 52,55/52,03 (CH2N), 52,19 (2Cα, NC5H10), 42,38/42,29 (2CH3), 40,25/39,71 (CH2N), 39,11/38,97 (CH2N), 22,23 (2Cβ, NC5H10), 21,28/21,26 (Cγ, NC5H10). Масс-спектр, m/z: вычислено для [C19H31N3O2+H]+ 334,24, найдено 334,16.
Пример 8. К охлажденному до 5°С раствору 2,0 г (0,0093 моль) N,N-бис(2-(диэтиламино)этил)амина (2) в 40 мл сухого дихлорметана при перемешивании медленно добавляют раствор 2,4 г (0,014 моль) феноксиацетилхлорида в 50 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения pH=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир. Выделенный осадок фильтруется, промывается 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 2,8 г (71%) дигидрохлорида N,N-бис(2-(диэтиламино)этил)-2-феноксиацетамида (соединение 10). Спектр ЯМР 1Н (D2O), 300 МГц, δ м.д.: 7,28 (м, 2Н, Ph), 7,98 (м, 1H, Ph), 6,92 (м, 2Н, Ph), 4,85 (с, 2Н, CH2O), 3,76 (т, 2Н, CH2N), 3,66 (т, 2Н, CH2N), 3,31 (м, 2Н, CH2N), 3,25-3,12 (м, 10Н, 5CH2N), 1,19 (м, 12Н, 4СН3). Спектр ЯМР 13С (D2O), 75 МГц, δ м.д.: 170,98 (С=O), 156,54 (С, Ph), 129,47 (2СН, Ph), 121,78 (СН, Ph), 114,16 (2СН, Ph), 66,27 (CH2O), 48,40 (CH2N), 48,14 (CH2N), 47,39 (2CH2N), 47,24 (2CH2N), 41,68 (CH2N), 41,26 (CH2N), 7,68 (2CH3), 7,64 (2CH3). Масс-спектр, m/z: вычислено для [C20H35N3O2+H]+ 350,2808, найдено 350,2791.
Для получения основания 10а к охлажденному до 2-5°С водному раствору 0,3 г (0,0007 моль) соединения 10 в 10 мл H2O добавляют 10% раствор NaOH до постоянного значения рН=12. Продукты извлекают из водного слоя экстракцией дихлорметаном (3×10 мл), объединенные органические экстракты промывают насыщенным раствором NaCl (3×10 мл). После высушивания над безводным Na2SO4 отгоняют растворитель на роторе, получают 0,175 г (72%) бесцветного масла N,N-бис(2-(диэтиламино)этил)-2-феноксиацетамида (соединение 10а). Rf (MeOH) 0,58. ИК-спектр, νC=O: 1655 cm-1.
Пример 9. К охлажденному до 5°С раствору 1,25 г (0,006 моль) N,N-диэтил-N'-(2-пирролидиноэтил)этилендиамина (5) в 25 мл сухого дихлорметана при перемешивании медленно добавляют раствор 1,5 г (0,009 моль) феноксиацетилхлорида в 30 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир. Выделенный осадок фильтруется, промывается 3×10 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 1,65 г (67%) дигидрохлорида N-(2-(диэтиламино)этил)-N-(2-пирролидиноэтил)-2-феноксиацетамида (соединение 11). Спектр ЯМР 1Н (D2O), 300 МГц, δ м.д.: 7,30 (м, 2Н, Ph), 7,00 (м, 1Н, Ph), 6,94 (м, 2Н, Ph), 4,89/4,87 (оба с, 2Н, CH2O), 3,80-3,14 (м, 16Н, 8CH2N), 1,99 (м, 4Н, СН2СН2, NC4H8), 1,22 (м, 6Н, 2СН3). Спектр ЯМР 13С (D2O), 75 МГц, δ м.д.: 171,06/171,03 (С=O), 156,55/156,59 (С, Ph), 129,49 (2СН, Ph), 121,80/121,82 (СН, Ph), 114,16/114,21 (2С, Ph), 65,41/65,20 (CH2O), 54,15/54,23 (2CH2N, NC4H8), 51,41/50,74 (CH2N), 48,49/48,11 (CH2N), 47,45/47,29 (2CH2N, N(C2H5)2), 42,76/42,04 (CH2N), 41,24 (CH2N), 22,16/22,12 (2CH2, NC4H8), 7,69/7,65 (2CH3). Масс-спектр, m/z: вычислено для [C20H33N3O2+H]+ 348,2651, найдено 348,2623.
Пример 10. К охлажденному до 5°С раствору 1,25 г (0,0055 моль) N,N-диэтил-N'-(2-пиперидиноэтил)этилендиамина (6) в 25 мл сухого дихлорметана при перемешивании медленно добавляют раствор 1,97 г (0,0082 моль) феноксиацетилхлорида в 30 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир. Выделенный осадок фильтруется, промывается 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:2) получают 2,07 г (75%) дигидрохлорида N-(2-(диэтиламино)этил)-N-(2-пиперидиноэтил)-2-феноксиацетамида (соединение 12). Спектр ЯМР 1Н (D2O), 300 МГц, δ м.д.: 7,39 (м, 2Н, Ph), 7,10 (м, 1Н, Ph), 7,30 (м, 2Н, Ph), 4,96 (с, 2Н, CH2O), 3,90-3,75 (м, 4Н, 2CH2N), 3,56-2,97 (м, 12Н, 6CH2N), 1,84-1,41 (м, 6Н, Нβ+Нγ, NC5H10), 1,30 (м, 6Н, 2СН3). Спектр ЯМР 13С (D2O), 75 МГц, δ м.д.: 171,36/171,18 (С=O), 156,69/156,72 (С, Ph), 129,60 (2СН, Ph), 121,94/121,96 (СН, Ph), 114,33/114,35 (2СН, Ph), 65,42/65,61 (CH2O), 53,53/52,60 (CH2N), 53,44/53,48 (2Сα, NC5H10), 48,73/48,29 (CH2N), 47,63/47,47 (2CH2N, N(C2H5)2), 41,63/41,67 (CH2N), 41,02/41,45 (CH2N), 22,38/22,44 (2Cβ, NC5H10), 20,45/20,53 (Cγ, NC5H10), 7,81/7,76 (2CH3). Масс-спектр, m/z: вычислено для [C21H35N3O2+2H]+ 363,29, найдено 363,17.
Для получения основания 12а к охлажденному до 2-5°С водному раствору 0,5 г (1,15 ммоль) соединения 12 в 15 мл H2O добавляют 10% раствор NaOH до постоянного значения рН=12. Продукты извлекают из водного слоя экстракцией дихлорметаном (2×10 мл), объединенные органические экстракты промывают насыщенным раствором NaCl (3×10 мл). После высушивания над Na2SO4 отгоняют растворитель на роторе, получают 0,35 г (84%) бесцветного масла N-(2-(диэтиламино)этил)-N-(2-пиперидиноэтил)-2-феноксиацетамида (соединение 12а). Rf (МеОН) 0,22. ИК-спектр, νC=O: 1651 cm-1.
Пример 11. К охлажденному до 5°С раствору 1,5 г (0,0065 моль) N,N-диэтил-N'-(2-морфолиноэтил)этилендиамина (7) в 30 мл сухого дихлорметана при перемешивании медленно добавляют раствор 1,7 г (0,001 моль) феноксиацетилхлорида в 40 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруют, промывают 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 2,1 г (76%) дигидрохлорида N-(2-(диэтиламино)этил)-N-(2-морфолиноэтил)-2-феноксиацетамида (соединение 13). Спектр ЯМР 1Н (D2O), 300 МГц, δ м.д.: 7,31 (м, 2Н, Ph), 7,03-6,93 (м, 3Н, Ph), 4,88/4,89 (оба с, 2Н, CH2O), 4,00-3,67 (м, 8Н, 2CH2N+2CH2O), 3,55-3,14 (м, 12Н, 6CH2N), 1,22 (м, 6Н, 2СН3). Спектр ЯМР 13С (D2O), 75 МГц, δ м.д.: 171,35/171,02 (С=O), 156,60/156,56 (С, Ph), 129,51 (2СН, Ph), 121,83/121,80 (СН, Ph), 114,23/114,21 (2СН, Ph), 65,45/65,22 (CH2O), 63,24 (2CH2O, NC4H8O), 53,87/52,65 (CH2N), 51,81/51,68 (2CH2N, NC4H8O), 48,11/48,49 (CH2N), 47,29/47,44 (2CH2N, N(C2H5)2), 41,33/41,26 (CH2N), 41,05/40,23 (CH2N), 7,71/7,67 (2СН3). Масс-спектр, m/z: вычислено для [C20H33N3O3+Н]+ 364,2600, найдено 364,2579; вычислено для [C20H33N3O3+Na]+ 386,2420, найдено 386,2396.
Пример 12. К охлажденному до 5°С раствору 0,5 г (0,0031 моль) N,N-бис(2-(диметиламино)этил)амина (1) в 15 мл сухого дихлорметана при перемешивании медленно добавляют раствор 1,13 г (0,0047 моль) 2,4-дихлорфеноксиацетилхлорида в 10 мл сухого дихлорметана, выпадает белый осадок. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруется, промывается 3×10 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 0,68 г (62%) дигидрохлорида N,N-бис(2-(диметиламино)этил)-2-(2,4-дихлорфенокси)ацетамида (соединение 14). Спектр ЯМР 1Н (DMSO-d6), 300 МГц, δ м.д.: 11,15 (с, 1H, NH+), 10,43 (с, 1H, NH+), 7,57 (д, 4J=2.4 Гц, 1Н, 3-Н, Ar), 7,36 (д, 3J=9 Гц, 1Н, 6-Н, Ar), 7,30 (дд, 4J=2.4, 3J=9 Гц, 1H, 5-Н, Ar), 5,16 (с, 2Н, CH2O), 3,77 (т, 2Н, CH2N), 3,70 (т, 2Н, CH2N), 3,38 (м, 2Н, CH2N), 3,29 (т, 2Н, CH2N), 2,80 (с, 6Н, 2СН3), 2,78 (с, 6Н, 2СН3). Спектр ЯМР 13С (DMSO-d6), 75 МГц, δ м.д.: 167,83 (С=O), 152,63 (С, Ar), 129,06 (СН, Ar), 127,64 (СН, Ar), 124,43 (С, Ar), 121,86 (С, Ar), 115,75 (СН, Ar), 66,20 (CH2O), 53,21 (CH2N), 52,75 (CH2N), 42,33 (2СН3), 42,26 (2СН3). 40,13 (CH2N), 40,02 (CH2N). Масс-спектр, m/z: вычислено для [C16H25N3O2Cl2+Н]+ 362,14, найдено 362,04.
Пример 13. К охлажденному до 5°С раствору 0,6 г (0,0034 моль) N,N-диметил-N'-(2-пирролидиноэтил)этилендиамина (3) в 15 мл сухого дихлорметана при перемешивании медленно добавляют раствор 1,2 г (0,005 моль) 2,4-дихлорфеноксиацетилхлорида в 10 мл сухого дихлорметана, выпадает белый осадок. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруют, промывают 3×10 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 1,1 г (71%) дигидрохлорида N-(2-(диметиламино)этил)-N-(2-пирролидиноэтил)-2-(2,4-дихлорфенокси)ацетамида (соединение 15). Спектр ЯМР 1Н (D2O), 300 МГц, δ м.д.: 7,53 (д, 4J=2,4 Гц, 1Н, 3-Н, Ar), 7,33 (дд, 4J=2,4, 3J=8,9 Гц, 1H, 5-Н, Ar), 7,04 (д, 3J=8.9 Гц, 1Н, 6-Н, Ar), 5,03 (с, 2Н, CH2O), 3.81 (м, 4Н, 2CH2N), 3,73-3,33 (м, 8Н, 4CH2N), 2,95/2,96 (оба с, 6Н, 2СН3), 2,08 (м, 4Н, СН2СН2, NC4H8). Спектр ЯМР 13С (D2O), 75 МГц, δ м.д.: 170,30/170,19 (С=O), 151,21/151,16 (С, Ar), 129,56 (СН, Ar), 127,66/127,68 (СН, Ar), 126,40/126,37 (С, Ar), 122,40/122,35 (С, Ar), 114,85/114,88 (СН, Ar), 66,75/66,68 (CH2O), 54,54/54,40 (CH2N), 54,30/54,37 (2CH2N, NC4H8), 51,49/50,89 (CH2N), 42,99/42,93 (2CH3), 42,79/42,17 (CH2N), 41,66/41,34 (CH2N), 22,29/22,22 (2CH2, NC4H8). Масс-спектр, m/z: вычислено для [C18H27N3O2Cl2+H]+ 388,16, найдено 388,03.
Пример 14. К охлажденному до 5°С раствору 1,8 г (0,009 моль) N,N-диметил-N'-(2-пиперидиноэтил)этилендиамина (4) в 50 мл сухого дихлорметана при перемешивании медленно добавляют раствор 4,4 г (0,018 моль) 2,4-дихлорфеноксиацетилхлорида в 30 мл сухого дихлорметана, выпадает белый осадок. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруется, промывается 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 2,8 г (62%) дигидрохлорида N-(2-(диметиламино)этил)-N-(2-пиперидиноэтил)-2-(2,4-дихлорфенокси)ацетамида (соединение 16). Спектр ЯМР 1Н (DMSO-d6), 500 МГц, δ м.д.: 11,14 (с, 1Н, NH+), 10.49/11,40 (оба с, 1Н, NH+), 7,54 (д, 4J=2,5 Гц, 1H, 3-Н, Ar), 7,36 (дд, 4J=2.5, 3J=9 Гц, 1Н, 5-Н, Ar), 7,28 (д, 3J=9 Гц, 1Н, 6-Н, Ar), 5,18/5,17 (оба с, 2Н, CH2O), 3,84/3,78 (оба т, J=7.5 Гц, 2Н, CH2N), 3,74 (м, 2Н, CH2N), 3,47-3,39 (м, 4Н, CH2N+2Нα в NC5H10), 3,31/3.24 (оба т, J=6 Гц, 2Н, CH2N), 2,89 (с, 2Н, Нα в NC5H10), 2,80/2,77 (оба с, 6Н, 2СН3), 1,81-1,70 (м, 5Н, 4Нβ+Hγ в NC5H10), 1,38 (с, 1Н, Hγ в NC5H10). Спектр ЯМР 13С (DMSO-d6), 125 МГц, δ м.д.: 167,82/167,72 (С=O), 152,73/152,69 (С, Ar), 129,06 (СН, Ar), 127,63/127,56 (СН, Ar), 124,45 (С, Ar), 121,92 (С, Ar), 115,84 (СН, Ar), 66,38/66,33 (CH2O), 53,24/52,89 (CH2N), 52,48/51,91 (CH2N), 52,22/52,16 (2Сα, NC5H10), 42,34/42,31 (2СН3), 40,45/39,75 (CH2N), 39,10/38,95 (CH2N), 22,22/22,15 (2Сβ, NC5H10), 21,34 (Cγ, NC5H10). Масс-спектр, m/z: вычислено для [C19H29N3O2Cl2+H]+ 402,2, найдено 402,1.
Пример 15. К охлажденному до 5°С раствору 0,5 г (0,0023 моль) N,N-бис(2-(диэтиламино)этил)амина (2) в 10 мл сухого дихлорметана при перемешивании медленно добавляют раствор 0,53 г (0,0035 моль) 2,4-дихлорфеноксиацетилхлорида в 15 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруется, промывается 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 0,65 г (58%) дигидрохлорида N,N-бис(2-(диэтиламино)этил)-2-(2,4-дихлорфенокси)ацетамида (соединение 17). Спектр ЯМР 1Н (D2O), 300 МГц, δ м.д.: 7,35 (д, 4J=2.5, 1Н, 3-Н, Ar), 7,15 (дд, 4J=2.5 Гц, 3J=8.9 Гц, 1H, 5-Н, Ar), 6,91 (д, 3J=8.9 Гц, 1Н, 6-Н, Ar), 4,90 (с, 2Н, CH2O), 3,77 (т, 2Н, CH2N), 3,68 (т, 2Н, CH2N), 3,36 (т, 2Н, CH2N), 3,24 (т, 2Н, CH2N), 3,21-3,14 (м, 8Н, 4CH2N), 1,17 (м, 12Н, 4СН3). Спектр ЯМР 13С (D2O), 75 МГц, δ м.д.: 169,91 (С=O), 151,06 (С, Ar), 129,37 (СН, Ar), 127,53 (СН, Ar), 126,19 (С, Ar), 122,21 (С, Ar), 114,64 (СН, Ar), 66,51 (CH2O), 48,23 (CH2N), 47,39 (CH2N), 47,21 (CH2N), 41,80 (CH2N), 41,20 (CH2N), 7,68 (2CH3), 7,63 (2CH3). Масс-спектр, m/z: вычислено для [C20H33N3O2Cl2+H]+ 418,2028, найдено 418,2012.
Для получения основания 17а к охлажденному до 2-5°С водному раствору 0,28 г (0,00056 моль) соединения 17 в 10 мл H2O добавляют 10% раствор NaOH до постоянного значения рН=12. Продукты извлекают из водного слоя экстракцией дихлорметаном (3×10 мл), объединенные органические экстракты промывают насыщенным раствором NaCl (3×10 мл). После высушивания над безводным Na2SO4 отгоняют растворитель на роторе, получают 0,172 г (72%) бесцветного масла N,N-бис(2-(диэтиламино)этил)-2-(2,4-дихлорфенокси)ацетамида (соединение 17а). Rf (МеОН) 0,45. ИК-спектр, νC=O: 1665 cm-1.
Пример 16. К охлажденному до 5°С раствору 1,51 г (0,007 моль) N,N-диэтил-N'-(2-пирролидиноэтил)этилендиамина (5) в 40 мл сухого дихлорметана при перемешивании медленно добавляют раствор 2,53 г (0,0105 моль) 2,4-дихлорфеноксиацетилхлорида в 50 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруется, промывается 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 2,2 г (63%) дигидрохлорида N-(2-(диэтиламино)этил)-N-(2-пирролидиноэтил)-2-(2,4-дихлорфенокси)ацетамида (соединение 18). Спектр ЯМР 1Н (CDCl3), 300 МГц, δ м.д.: 12,01/12,23 (оба с, 1H, NH+), 11,51 (с, 1H, NH+), 7,34 (м, 1H, 3-Н, Ar), 7,20 (м, 2Н, 5-Н+6-Н, Ar), 5,10/5,08 (оба с, 2Н, CH2O), 4,13-3,49 (м, 8Н, 4CH2N), 3,34-2,93 (м, 8Н, 4CH2N), 2,11 (м, 4Н, СН2СН2, NC4H8), 1,38 (m, 6Н, 2СН3). Спектр ЯМР 13С (CDCl3), 75 МГц, δ м.д.: 168,67/168,32 (С=O), 151,53 (С, Ar), 129,53/129,50 (СН, Ar), 127,87/127,72 (СН, Ar), 126,45/126,31 (С, Ar), 122,20/121,85 (С, Ar), 114,67/114,56 (СН, Ar), 69,08/67,99 (CH2O), 54,12/53,06 (2CH2N, NC4H8), 51,60/51,48 (CH2N), 49,28/48,73 (CH2N), 45,72/46,20 (2CH2N, N(C2H5)2), 42,64/41,98 (CH2N), 40,33/39,95 (CH2N), 22,87 (2CH2, NC4H8), 7,96/7,86 (CH3). Масс-спектр, m/z: вычислено для [C20H31N3O2Cl2+H]+ 416,1872, найдено 416,1848.
Для получения основания 18а к охлажденному до 2-5°С водному раствору 0,3 г (0,00061 моль) соединения 18 в 10 мл H2O добавляют 10% раствор NaOH до постоянного значения рН=12. Продукты извлекают из водного слоя экстракцией дихлорметаном (3×10 мл), объединенные органические экстракты промывают насыщенным раствором NaCl (3×10 мл). После высушивания над Na2SO4 отгоняют растворитель на роторе, получают 0.22 г (86%) бесцветного масла N-(2-(диэтиламино)этил)-N-(2-пирролидиноэтил)-2-(2,4-дихлорфенокси)ацетамида (соединение 18а). Rf (МеОН) 0,25. ИК-спектр, νC=O: 1662 cm-1.
Пример 17. К охлажденному до 5°С раствору 1,25 г (0,0055 моль) N,N-диэтил-N'-(2-пиперидиноэтил)этилендиамина (6) в 25 мл сухого дихлорметана при перемешивании медленно добавляют раствор 1,97 г (0,0082 моль) 2,4-дихлорфеноксиацетилхлорида в 30 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруется, промывается 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:2) получают 2,07 г (75%) дигидрохлорида N-(2-(диэтиламино)этил)-N-(2-пиперидиноэтил)-2-(2,4-дихлорфенокси)ацетамида (соединение 19). Спектр ЯМР 1Н (CDCl3), 500 МГц, δ м.д.: 11,72/11,65 (оба с, 1Н, NH+), 11,12/10,85 (оба с, 1H, NH+), 7,34 (м, 1Н, 3-Н, Ar), 7,26 (д, 3J=9 Гц, 1Н, 6-Н, Ar), 7,22-7,20 (м, 1H, 5-Н, Ar), 5,14/5,13 (оба с, 2Н, CH2O), 4,18 (м, 2Н, CH2N), 3,99 (м, 2Н, CH2N), 3,75-3,54 (м, 2Н, Нα в NC5H10), 3,44-3,39 (м, 4Н, CH2N), 3,19 (м, 4Н, 2CH2N, N(C2H5)2), 2,88-2,74 (м, 2Н, Нα в NC5H10), 2,15 (м, 2Н, Hβ в NC5H10), 1,86 (м, 3Н, 2Нβ+Нγ в NC5H10), 1,44 (m, 1Н, Нγ в NC5H10), 1,38 (м, 6Н, 2СН3). Спектр ЯМР 13С (CDCl3), 125 МГц, δ м.д.: 168,71/168,95 (С=O), 152,00/152,01 (С, Ar), 129,76 (СН, Ar), 128,04/128,00 (СН, Ar), 126,51/126,59 (С, Ar), 122,45/122,41 (С, Ar), 115,12/115,17 (СН, Ar), 68,29/68,71 (CH2O), 53,40/53,80 (CH2N), 53,01/53,74 (2Сα, NC5H10), 48,84/49,70 (CH2N), 46,62/46,37 (2CH2N, N(C2H5)2), 41,80/42,06 (CH2N), 39.96/39.50 (CH2N), 22.70/22.46 (2Cβ, NC5H10), 21.60/21.75 (Cγ, NC5H10), 8.39, 8,22 (CH3). Масс-спектр, m/z: вычислено для [C21H33N3O2Cl2+2H]+ 431,21, найдено 431,09.
Для получения основания 19а к охлажденному до 2-5°С водному раствору 0,5 г (0,001 моль) соединения 19 в 15 мл H2O добавляют 10% раствор NaOH до постоянного значения рН=12. Продукты извлекают из водного слоя экстракцией дихлорметаном (3×15 мл), объединенные органические экстракты промывают насыщенным раствором NaCl (3×15 мл). После высушивания над Na2SO4 отгоняют растворитель на роторе, получают 0,41 г (95%) бесцветного масла N-(2-(диэтиламино)этил)-N-(2-пирролидиноэтил)-2-(2,4-дихлорфенокси)ацетамида (соединение 19а). Rf (МеОН) 0,26. ИК-спектр, νC=O: 1662 cm-1.
Пример 18. К охлажденному до 5°С раствору 1,3 г (0,0057 моль) N,N-диэтил-N'-(2-морфолиноэтил)этилендиамина (7) в 30 мл сухого дихлорметана при перемешивании медленно добавляют раствор 2,04 г (0,0085 моль) 2,4-дихлорфеноксиацетилхлорида в 40 мл сухого дихлорметана. После окончания добавления хлорангидрида, реакционную смесь перемешивают в течение 5 часов при комнатной температуре. Затем к охлажденной до 5°С реакционной смеси при перемешивании добавляют 3N раствор хлороводорода в диоксане до постоянного значения рН=2, перемешивают еще 2 часа. Отгоняют растворитель, к остатку добавляют диэтиловый эфир (30 мл). Выделенный осадок фильтруют, промывают 3×20 мл диэтиловым эфиром. После высушивания и перекристаллизации из смеси ацетон : этанол (1:3) получают 2,3 г (80%) дигидрохлорида N-(2-(диэтиламино)этил)-N-(2-морфолиноэтил)-2-(2,4-дихлорфенокси)ацетамида (соединение 20). Спектр ЯМР 1H (D2O), 300 МГц, δ, м.д.: 7,38 (д, 4J=2,4 Гц, 1Н, 3-Н, Ar), 7,21 (дд, 4J=2,4, 3J=8.9 Гц, 1H, 5-Н, Ar), 6,94/6,92 (оба д, 3J=8.9 Гц, 1H, 6-Н, Ar), 4,91/4,93 (оба с, 2Н, CH2O), 4,04-3,67 (м, 8Н, 2CH2N+2CH2O, NC4H8O), 3,59-3,12 (м, 12Н, 6CH2N), 1,20 (м, 6Н, 2СН3). Спектр ЯМР 13С (D2O), 75 МГц, δ, м.д.: 170,33/169,98 (С=O), 151,11, 151,08 (С, Ar), 129,41 (СН, Ar), 127,56 (СН, Ar), 126,25/126,19 (С, Ar), 122,25/122,17 (С, Ar), 114,64/114,77 (СН, Ar), 66,70/66,45 (CH2O), 63,23 (2CH2O, NC4H8O), 53,74/52,66 (CH2N), 51,80/51,67 (2CH2N, NC4H8O), 48,32/48,18 (CH2N), 47,43/47,25 (2CH2N, N(C2H5)2), 41,45/41,20 (CH2N), 41,16/40,20 (CH2N), 7,70/7,65 (2CH3). Масс-спектр, m/z: вычислено для [C20H31N3O3Cl2+H]+ 432,1821, найдено 432,1824.
Изучение антиаритмической активности и токсичности заявляемых соединений проведено на 260 мышах линии BALB/c (самцы и самки, масса тела 18-20 г), 947 крысах Wistar (самцы и самки, масса тела 180-240 г).
Изучение антиаритмических свойств заявляемых соединений проводили на моделях нарушения сердечного ритма у лабораторных животных. В качестве моделей использовали аконитиновую, хлоридкальциевую и хлоридбариевую аритмию у крыс Wistar. Данные модели аритмий моделируют тяжелые, в большинстве случаев несовместимые с жизнью нарушения ритма сердечной деятельности у человека и широко применяются при поиске антиаритмических препаратов [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. Миронова А.Н. - М.: Гриф и К, 2012. - 944 с.; Szekeres L. Experimental models for the study of antiarrhytmic agents / Progr. Pharmacol., 1979, V. 2, №4, pp. 25-31].
Изменения ритма сердечной деятельности при использовании указанных моделей аритмий у животных регистрировали электрокардиографически во II-ом стандартном отведении на электрокардиографе CARDIOVIT АТ-1 VET «Schiller».
Животных содержали в соответствии с нормами группового размещения в условиях естественного освещения с принудительной 16-ти кратной вентиляцией при температуре 18-20°С и относительной влажности 40-70%. Животные имели свободный доступ к питьевой воде и стандартному (ГОСТ Р50258-92) гранулированному корму ПК 120-1 (ООО «Лабораторснаб», Россия). Все исследовательские работы с лабораторными животными выполнялись в соответствии с общепринятыми нормами обращения с животными, которые соответствуют правилам, принятым Европейской Конвенцией по защите позвоночных животных, используемых для исследовательских и иных научных целей [European Convention for the protection of vertebrate animals used for experimental and other scientific purposes, Страсбург, 18.03.1986].
Аконитиновая модель аритмии на крысах Wistar. Внутривенное введение наркотизированным животным (уретан 950 мг/кг внутрибрюшинно) аконитина гидробромида в дозе 50 мкг/кг вызывает желудочковую экстрасистолию, быстро переходящую в тахисистолию, трепетание, мерцание и фибрилляцию желудочков, приводящих более чем в 90% случаев к гибели животных, и продолжается в случае отсутствия фибрилляции желудочков в среднем 49,3±10,4 мин. Электрокардиограмма представлена на фиг. 1а.
Хлоридбариевая модель аритмии на крысах Wistar. Внутривенное введение хлористого бария в дозе 25 мг/кг наркотизированным крысам (уретан 950 мг/кг внутрибрюшинно) вызывает политопную желудочковую аритмию, обусловленную нарушением автоматизма сердца, изменением возбудимости миокарда и характеризующуюся тахиаритмией и желудочковой экстрасистолией. Аритмия возникает через 10-15 сек после введения хлористого бария и, по данным электрокардиографии, отмечается на протяжении 42,7±5,2 мин, после чего наблюдается восстановление синусового ритма или в 85% случаев отмечается гибель животных. Типичная электрокардиограмма представлена на фиг. 2а.
Хлоридкальциевая модель аритмии на крысах Wistar. Внутривенное введение хлористого кальция в дозе 250 мг/кг наркотизированным крысам (уретан 950 мг/кг внутрибрюшинно) вызывает нарушение возбудимости или проводимости, или одновременно обеих функций миокарда, характеризующихся частыми политопными экстрасистолами, переходящими в желудочковую фибрилляцию, которая обычно в 85-90% случаев заканчивается остановкой сердца. Латентный период до появления аритмии составляет 7,5±1,2 сек, продолжительность аритмии 18±7 мин. Типичная электрокардиограмма представлена на фиг. 3а.
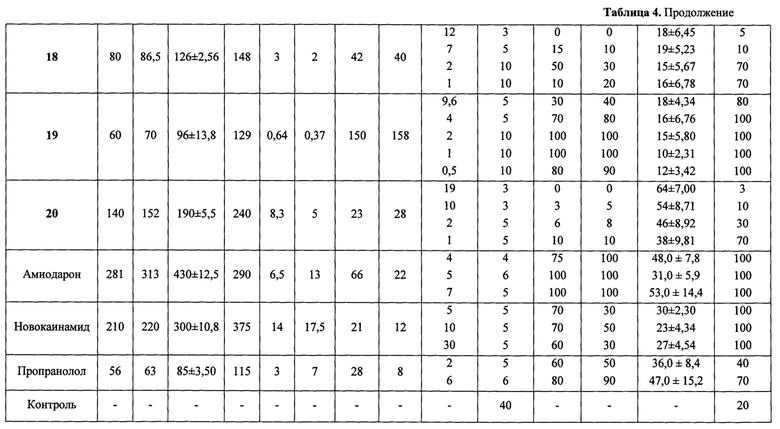
Исследованию антиаритмических свойств соединений предшествовало изучение «острой» токсичности на мышах линии BALB/c (самцы и самки, масса тела 18-20 г) при однократном внутрибрюшинном введении, с использованием метода пробит-анализа по Литчфилду и Уилкоксону [Беленький М.Л. Элементы количественной оценки фармакологического эффекта. - Л.: Медгиз, 1963. - 146 с.; Litchfild J.T., Wilcoxon F.J. Pharmacol Exper. Ther. 1949]. Как показали проведенные исследования, изучаемые соединения оказались малотоксичными при однократном внутрибрюшинном введении мышам линии BALB/c. При этом показатели ЛД50 находились в пределах 96-390 мг/кг. Результаты экспериментов представлены в таблице 3.
Оценка антиаритмического действия соединений проводилась по величине среднеэффективной дозы (ЭД50), предотвращающей или снимающей нарушения сердечного ритма, антиаритмическому индексу (АИ) и индексу Шнейдера-Брокка (ЛД10/ЭД90) [Schneider В. Arzneimittelsicherheit und therapeutischer Index. Prinzipien des pharmakologishen Screenings und der  auf die Klinik / Arzneim. - Forsch, 1982, Bd 32, №5, S. 471-474]. Последний позволяет более точно охарактеризовать фармакологическую активность препаратов, терапевтическую широту и перспективность создания на их основе лекарственных средств. В качестве препаратов сравнения использовали известные и широко применяемые в медицинской практике антиаритмические средства - амиодарон (Кордарон «Санофи-Авентис Франс»), пропранолол (Анаприлин «Татхимфармпрепараты»), верапамил (Алкалоид респ. Македония). Указанные параметры эффективности и токсичности устанавливали методом пробит-анализа по Литчфилду и Уилкоксону.
auf die Klinik / Arzneim. - Forsch, 1982, Bd 32, №5, S. 471-474]. Последний позволяет более точно охарактеризовать фармакологическую активность препаратов, терапевтическую широту и перспективность создания на их основе лекарственных средств. В качестве препаратов сравнения использовали известные и широко применяемые в медицинской практике антиаритмические средства - амиодарон (Кордарон «Санофи-Авентис Франс»), пропранолол (Анаприлин «Татхимфармпрепараты»), верапамил (Алкалоид респ. Македония). Указанные параметры эффективности и токсичности устанавливали методом пробит-анализа по Литчфилду и Уилкоксону.
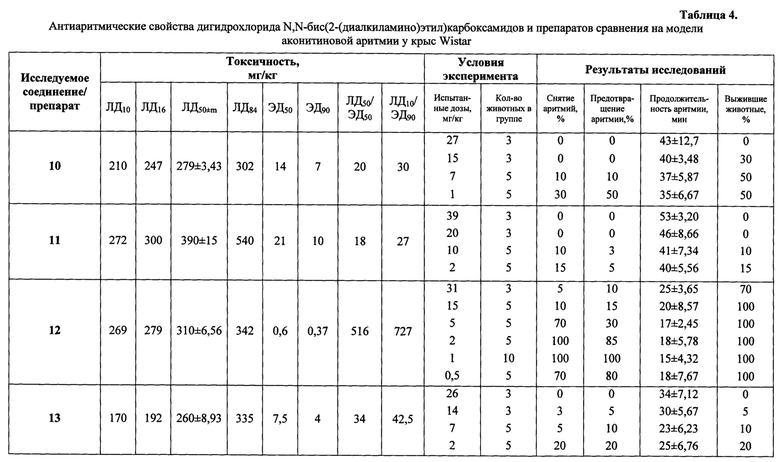
Эксперименты по первичной оценке антиаритмической активности выполнены на модели аконитиновой аритмии на наркотизированных уретаном (950 мг/кг) крысах Wistar (самцы и самки, масса тела 180-240 г). Нарушения ритма на аконитиновой модели аритмии вызывали по стандартной методике [Szekeres L. Experimental models for the study of antiarrhytmic agents / Progr. Pharmacol., 1979, V. 2, №4, pp. 25-31]. Аконитина гидробромид вводили в дозах 40-50 мкг/кг в бедренную вену крысы в течение 20 сек. Заявляемые соединения в дозе 1/10 от ЛД50 (для мышей при в/б введении) и препараты сравнения в эффективных антиаритмических дозах вводили в/в за 2-3 минуты до введения аконитина. После записи фоновой электрокардиограммы во II стандартном отведении вводили внутривенно исследуемое вещество и через 1-2 минуты аконитина гидробромид. Через 1, 2, 5, 10, 15, 20, 30, 45 и 60 минут осуществляли повторную регистрацию электрокардиограммы. Изучаемые соединения вводили в дозах 1/10-1/100 от ЛД50 для мышей при внутрибрюшинном введении, препараты сравнения в эффективных антиаритмических дозах. Каждую дозу исследуемых соединений испытывали на 5-10 животных.
Эффективность антиаритмического действия соединений оценивали по длительности аритмии, ее тяжести, времени ее возникновения и проценту животных, у которых аритмия полностью снималась, а также по указанным выше индексам ЛД50/ЭД50 и ЛД10/ЭД90. На основании нескольких серий экспериментов, в которых исследовались антиаритмические свойства различных доз изучаемых веществ, методом пробит-анализа по Литчфилду и Уилкоксону определяли дозы, снимающие аритмию у 50 и 90% животных.
Введение исследуемых соединений в диапазоне испытанных доз 1/100-1/10 от ЛД50 (для мышей при внутрибрюшинном введении) приводило к 30-100% выживаемости животных на модели аконитиновой аритмии. Заявляемые соединения в испытанных дозах увеличивали длительность скрытого периода аконитиновой аритмии или полностью предотвращали ее развитие. Кардиограммы представлены на фиг. 1-3. Высокая антиаритмическая активность заявляемых соединений подтверждается другим использованным критерием - процентом снятых аритмий (таблица 4). Применение этого критерия свидетельствует о выраженных антиаритмических свойствах заявляемых соединений. На моделях аконитиновой аритмии у крыс ряд заявляемых соединений в дозах до 4 мг/кг (соединения 12, 18, 19) в 50-100% случаев снимает аритмии, вызванные введением аконитина гидробромида. Наименьшими средними эффективными дозами (ЭД50) характеризуются соединения 10, 11, 19.
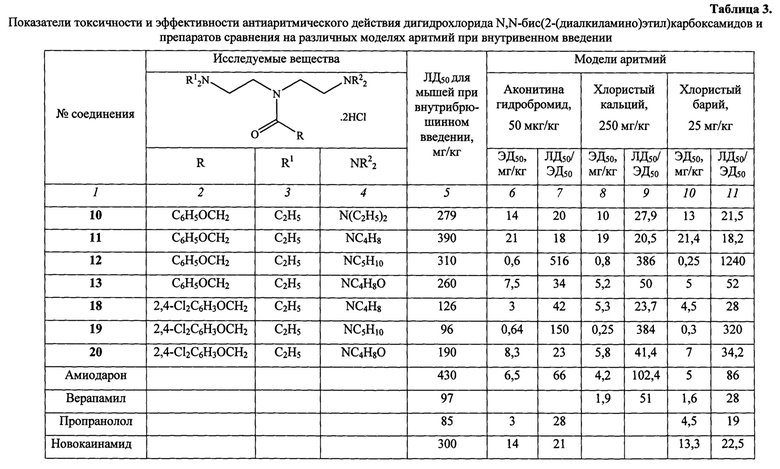
Такой показатель как терапевтический индекс (соотношение ЛД50/ЭД50), характеризующий широту терапевтического действия лекарственных препаратов, для ряда заявляемых соединений превышает показатель 100 и составляет для соединений 12 и 19 величины 516 и 150 соответственно.
Выраженные антиаритмические свойства заявляемых соединений, выявленные на модели аконитиновой аритмии, были подтверждены также и на моделях хлоридбариевой и хлоридкальциевой аритмии. Электрокардиограммы представлены на фиг. 2 и фиг. 3.
В качестве иллюстраций на графических изображениях (фиг. 1-3) представлены электрокардиограммы крыс с нарушениями сердечной деятельности, вызванные аконитином гидробромидом, хлористым барием и хлористым кальцием.
Полученные в экспериментах данные свидетельствуют о выраженных антиаритмических свойствах и заметных преимуществах заявленных соединений. По сравнению с известными антиаритмиками соединения обладают меньшей токсичностью, большими терапевтическими индексами (ЛД50/ЭД50 и ЛД10/ЭД90) - важнейшими показателями, необходимыми для оценки целесообразности дальнейшего изучения и перспективности клинических испытаний и практического применения в качестве лекарственных средств для профилактики и лечения нарушений ритма сердца.
Таким образом, проведенные исследования показали, что заявляемые аминоамиды являются малотоксичными веществами, обладают выраженными антиаритмическими свойствами, не уступающими по эффективности действия применяемым в настоящее время известным лекарственным средствам амиодарону, верапамилу и пропранололу. Заявляемые соединения являются препаратами комбинированного действия и перспективны для разработки на их основе новых высокоэффективных лекарственных средств для лечения и профилактики нарушений сердечного ритма.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-(2-(2-(ДИАЛКИЛАМИНО)ЭТОКСИ)ЭТИЛ)КАРБОКСАМИДЫ И ИХ ГИДРОХЛОРИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2019 |
|
RU2712638C1 |
| 2-(2-(диалкиламинополиэтокси))этилкарбоксилаты и их гидрохлориды, обладающие антиаритмической активностью, и фармацевтические композиции на их основе. | 2020 |
|
RU2775616C2 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| 4-ЗАМЕЩЕННЫЕ N-АРИЛ-1,8-НАФТАЛИМИДЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФЛУОРЕСЦЕНТНЫХ СЕНСОРОВ НА КАТИОНЫ МЕТАЛЛОВ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2515195C1 |
| АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ | 2014 |
|
RU2561281C1 |
| ЗАМЕЩЁННЫЕ ИЗОКСАЗОЛЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2733945C2 |
| Антибактериальные средства на основе производных ципрофлоксацина | 2016 |
|
RU2636751C1 |
| Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида | 2019 |
|
RU2697848C1 |
| Четвертичные аммониевые соединения на основе производных пентаэритрита и пиридоксина, обладающие антибактериальной активностью | 2023 |
|
RU2811203C1 |
| N,N'-ДИ(АЛКАДИИНИЛ)ДИАЗАЦИКЛОАЛКАНЫ И СПОСОБ ПОЛУЧЕНИЯ N,N'-ДИ(АЛКАДИИНИЛ)ДИАЗАЦИКЛОАЛКАНОВ, ПРОЯВЛЯЮЩИХ ФУНГИЦИДНУЮ АКТИВНОСТЬ ПО ОТНОШЕНИЮ К ГРИБАМ Bipolaris sorokiniana и Rhizoctonia solani | 2019 |
|
RU2727138C1 |



Группа изобретений относится к химико-фармацевтической промышленности и представляет собой N,N-бис(2-(диалкиламино)этил)карбоксамидам и их дигидрохлориды общей формулы:
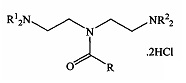 , где
, где
когда R=С6Н5ОСН2, a R1=СН3, то NR22=N(CH3)2 или NC5H10;
когда R=С6Н5ОСН2, a R1=С2Н5, то NR22=N(C2H5)2, NC4H8, NC5H10 или NC4H8O; когда R=2,4-Cl2C6H3OCH2, a R1=CH3, то NR22=N(CH3)2, NC4H8 или NC5H10; когда R=2,4-Cl2C6H3OCH2, a R1=C2H5, то NR22=N(C2H5)2, NC4H8, NC5H10 или NC4H8O, при этом NC4H8 - пирролидино, NC5H10 - пиперидино, NC4H8O - морфолино. Группа изобретений включает в себя в том числе лекарственное средство и фармацевтическую композицию, которые включают в себя в качестве активного агента соединения, описанные ранее, и обладают антиаритмической активностью. Предлагаемая группа изобретений обеспечивает расширение арсенала средств, обладающих низкой токсичностью и высокой антиаритмической активностью, и перспективных для разработки на их основе лекарственных средств для лечения нарушений сердечного ритма. 3 н.п. ф-лы, 3 ил., 4 табл., 18 пр.
1. N,N-Бис(2-(диалкиламино)этил)карбоксамиды и их дигидрохлориды общей формулы:
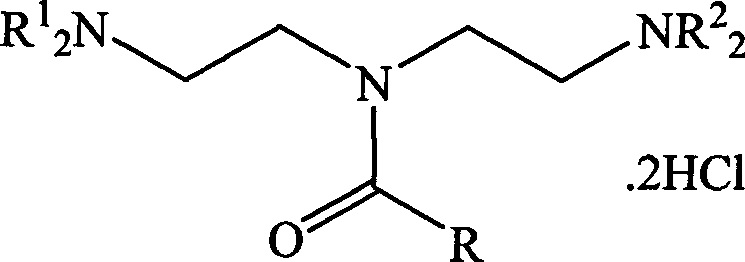 , где:
, где:
когда R=С6Н5ОСН2, a R1=СН3, то NR22=N(CH3)2 или NC5H10;
когда R=С6Н5ОСН2, a R1=С2Н5, то NR22=N(C2H5)2, NC4H8, NC5H10 или NC4H8O;
когда R=2,4-Cl2С6Н3ОСН2, a R1=СН3, то NR22=N(CH3)2, NC4H8 или NC5H10;
когда R=2,4-Cl2С6Н3ОСН2, a R1=С2Н5, то NR22=N(C2H5)2, NC4H8, NC5H10 или NC4H8O,
при этом NC4H8 - пирролидино, NC5H10 - пиперидино, NC4H8O - морфолино.
2. Лекарственное средство, обладающее антиаритмической активностью, включающее в качестве активного агента N,N-бис(2-(диалкиламино)этил)карбоксамиды и их дигидрохлориды по п. 1.
3. Фармацевтическая композиция, обладающая антиаритмической активностью, включающая в качестве активного агента N,N-бис(2-(диалкиламино)этил)карбоксамиды и их дигидрохлориды по п. 1 совместно с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
| Leslie W | |||
| Deady | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Med | |||
| Chem | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Способ изготовления и применения масс для многоцветного печатания | 1924 |
|
SU2040A1 |
| US2014080708 A1, 20.03.2014 | |||
| US6172262 B1, 19.01.2001 | |||
| ЗАМЕЩЕННЫЕ N-[2-(1-АДАМАНТИЛАМИНО)-2-ОКСОЭТИЛ]-N-(АМИНОАЛКИЛ)АМИДЫ НИТРОБЕНЗОЙНЫХ КИСЛОТ | 2011 |
|
RU2500666C2 |
Авторы
Даты
2018-02-15—Публикация
2017-07-13—Подача