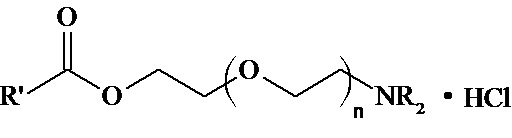
Изобретение относится к области фармакологии, а именно к соединениям указанной ниже общей формулы, которые проявляют антиаритмическую активность.
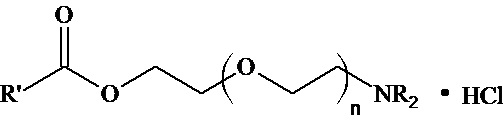
Когда n = 1, NR2=NEt2, то R’=Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 1, NR2=NC5H10, то R’= Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 1, NR2=NC4H8O, то R’= Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 2, NR2=NC5H10, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 2, NR2=N C4H8O, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 3, NR2=NC5H10, то R’= PhOCH2; 2,4-Cl2C6H3OCH2,
(при этом NC5H10 - пиперидино, NC4H8O - морфолино).
Изобретение относится также к лекарственному средству и фармацевтической композиции, которые включают указанные соединения.
3 н.п. ф-лы, 4 табл., 3 ил., 17 пр.
Изобретение относится к области фармакологии и касается создания новых лекарственных средств для профилактики и лечения нарушений сердечного ритма.
Анализ литературы показывает, что известны близкие по структуре соединения с формулами:
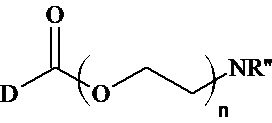 ,
,
где D - биологически активный остаток, n - целое число больше 2, R’’ - водород или алкильные остатки, в том числе замещенные [патент US 2004/0152769 A1 дата публикации 05.08.2004] и
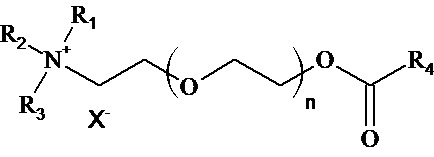 ,
,
где R1, R2, R3, R4 - алкилы, или их замещенные или непредельные производные, n = 1 - 10, X - органический или неорганический анион [патент US 2011/0097287 A1 дата публикации 28.04.2011].
Кроме того, в разных странах широко используется лекарственный препарат похожей структуры Пентоксиверин, обладающий противокашлевым действием ["Carbetapentane". Drugs.com; РЛС® Информационно-справочная система].
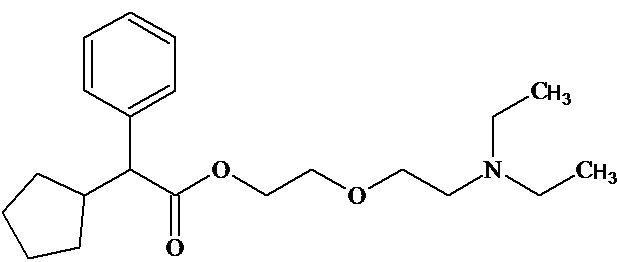
Однако все вышеприведенные соединения не обладают антиаритмическими свойствами.
Задача настоящего изобретения состояла в синтезе вышеуказанных соединений общей формулы (I), обладающих высокой антиаритмической активностью и перспективных для разработки на их основе лекарственных средств для лечения нарушений сердечного ритма. Указанные задача и технический результат достигаются новым классом антиаритмических азотсодержащих соединений - 2-(2-(Диалкиламинополиэтокси))этилкарбоксилатами и их гидрохлоридами следующей формулы:
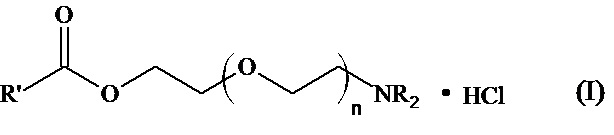
Когда n = 1, NR2=NEt2, то R’=Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 1, NR2=NC5H10, то R’= Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 1, NR2=NC4H8O, то R’= Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 2, NR2=NC5H10, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 2, NR2=NC4H8O, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2;
Когда n = 3, NR2=NC5H10, то R’= PhOCH2; 2,4-Cl2C6H3OCH2;
(при этом NC5H10 - пиперидино, NC4H8O - морфолино).
Получение заявляемых соединений общей формулы (I) представлено на Схеме 1 и описано ниже:
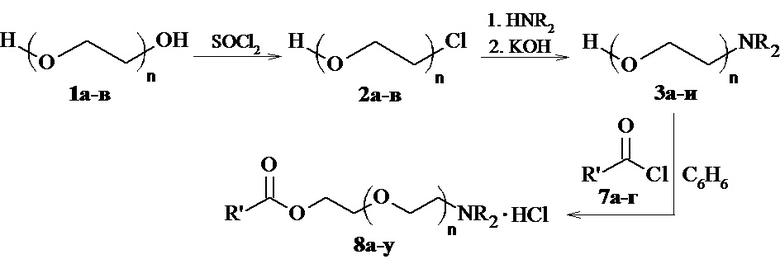
Схема 1
Количественный состав соединений 3-8 был подтверждён результатами массс-спектроскопии, а также на основании данных элементного анализа. Структура соединений 3-8 подтверждена методами ИК-, ЯМР 1Н-,13С-спектроскопии. Физико-химические характеристики данных соединений представлены в таблицах 1-2.
Аминоспирты оксиэтиленового ряда 3а-и, необходимые для реакции ацилирования были получены из соответствующих хлоргидринов 2а-в путём аминирования двукратным избытком амина в 5% водном растворе карбоната калия при кипячении реакционной смеси в течение 15 часов.
Для получения хлоргидринов 2а-в, в качестве исходных соединений были использованы соответствующие олигоэтиленгликоли 1а-в; которые подвергали взаимодействию с хлористым тионилом в среде пиридина при интенсивном перемешивании и охлаждении до 0-10°С, после чего реакционную массу кипятили в течение 4-5 часов.
Синтез соединений 8a-у осуществляли ацилированием соответствующих аминоспиротов 3а-и избытком хлорангидридов 7a-г в бензоле при температуре 10°С и перемешивании. При этом образуются аминоэфиры в форме гидрохлоридов 8a-у с выходами 53-92 %, которые представляют собой белые кристаллические соединения, в некоторых случаях гигроскопичные.
Пример 1.
К смеси 50,00 г (0,47 моль) диэтиленгликоля и 18,63 г (0,235 моль) пиидина охлажденной до 0°С, медленнно, при перемешивании, добавляют 28,06 г (0,235 моль) хлористого тионила. Реакционную смесь выдерживают 1,5-2 часа при температуре 10-20°С, а затем, в течение 3 часов при температуре 100-106°С. После чего, раствор охлаждают и экстрагируют продукт диэтиловым эфиром, растворитель упаривают, остаток перегоняют под вакуумом. Получено 9,40г (32%) 2-(2-хлорэтокси)этанола с Ткип. 79-81°С при 5мм рт. ст., nD20 1,4520.
Пример 2.
К охлажденному до 0°С раствору 45,00 г (0,30 моль) триэтиленгликоля и 11,85 г (0,15 моль) пиридина, порционно, при перемешивании добавляют 17,84 г (0,15 моль) хлористого тионила. Реакционную смесь выдерживают 1,5-2 часа при температуре 10-20°С, а затем, в течение 3 часов при температуре 100-106°С. После чего, раствор охлаждают и экстрагируют продукт диэтиловым эфиром, растворитель упаривают, остаток перегоняют под вакуумом. Получено 6,80 г (27%) 2-[2-(2-хлорэтокси) этокси]этанола с Ткип. 117-120°С при 5мм рт. ст., nD20 1,4580.
Пример 3.
К раствору 48,50 г (0,25 моль) тетраэтиленгликоля и 9,875г (0,125моль) пиридина, охлажденному до 0°С, порционно, при перемешивании добавляют 14,87 г (0,125 моль) хлористого тионила. Реакционную смесь выдерживают 1,5-2 часа при температуре 10-20°С, а затем, в течение 3 часов при температуре 100-106°С. После чего, раствор охлаждают и экстрагируют продукт диэтиловым эфиром, растворитель упаривают, остаток перегоняют под вакуумом. Получено 6,64 г (25%) 2-{2-[2-(2-хлорэтокси)этокси]этокси}этанола с Ткип. 136-139°С при 5мм рт. ст., nD20 1,4568.
Пример 4.
Смесь 9,97 г (0,08 моль) 2-(2-хлоэтокси)этанола и 11,68г (0,16 моль) диэтиламина кипятят в 50 мл 5% водного раствора гидроксида калия в течение 18 часов. Затем, реакционную массу охлаждают и экстрагируют продукт этилацетатом. Экстракт сушат сульфатом натрия, растворитель отгоняют на роторе, остаток перегоняют под вакуумом. Таким образом получено 7,34 г (57%) 2-(2-N,N-диэтиламиноэтокси)этанола (3а). Масс-спектр*, m/z (Iотн;%): 162[M+1]+ (2); 161[M]+ (5); 160[M-1]+ (3); 100(8); 86(100); 58(18); 45(13); 30 (15).
Пример 5.
Смесь 12,77 г (0,10 моль) 2-(2-хлорэтокси)этанола и 17,45 г (0,20 моль) пиперидина кипятят в 50 мл 5% водного раствора гидроксида калия в течение 10 часов. После чего, реакционную смесь охлаждают и экстрагируют продукт этилацетатом. Экстракт сушат сульфатом натрия, растворитель отгоняют на роторе, остаток перегоняют под вакуумом. В результате получено 12.59 г (71%) 2-(2-N-пиперидиноэтокси)этанола (3б). Масс-спектр*, m/z (Iотн;%): 174[М+1]+ (2); 173[M]+ (5); 172[M-1]+ (3); 112(10); 99(95); 60 (15).
Пример 6.
Смесь 12,46 г (0,10 моль) 2-(2-хлоэтокси)этанола и 17,43 г (0,20 моль) морфолина кипятят в 50 мл 5% водного раствора гидроксида калия в течение 12 часов. Далее смесь охлаждают и экстрагируют продукт этилацетатом. Экстракт сушат сульфатом натрия, растворитель отгоняют на роторе, остаток перегоняют под вакуумом. В итоге получено 10,51 г (60 %) 2-(2-N-морфолиноэтокси)этанола (3в). Масс-спектр*, m/z (Iотн;%): 177[M+2]+ (2); 176[M+1]+ (9); 175[M]+(20); 144 (16); 114 (37); 100 (100); 75 (11).
Пример 7.
Смесь 16,86 г (0,1 моль) 2-[2-(2-хлорэтокси)этокси]этанола и 14,62 г (0,2 моль) диэтиламина кипятят 50 мл 5% водного раствора гидроксида калия в течение 72 часов. Затем реакционную массу охлаждают, продукт экстрагируют этилацетатом. Экстракты объединяют и сушат над сульфатом натрия, после чего растворитель отгоняют на роторе. Полученный остаток перегоняют под вакуумом. В результате получено 13,40 г (65 %) 2-[2-(2-N,N-диэтиламиноэтокси)этокси]этанола (3г). Масс-спектр*, m/z (Iотн;%): 206[M+1]+ (4); 205[M]+ (3); 204[M-1]+ (2); 162(20); 146 (60); 100(14); 86(100); 58(12); 45(10).
Пример 8.
Смесь 10,78 г (0,06 моль) 2-[2-(2-хлорэтокси)этокси]этанола и 10,89 г (0,13 моль) пиперидина кипятят в 50 мл 5% водного раствора гидроксида калия в течение 60 часов. После чего смесь охлаждают, продукт экстрагируют этилацетатом. Экстракт сушат сульфатом натрия, растворитель отгоняют на роторе, остаток перегоняют под вакуумом. В результате получено 7,77 г (56%) 2-[2-(2-N-пиперидиноэтокси)этокси]этанола (3д). Масс-спектр*, m/z (Iотн;%): 218[M+1]+ (3); 217[M]+ (5); 216[M-1]+ (2); 174(40); 144(35); 112(10); 99(95); 60 (15).
Пример 9.
Смесь 8,43 г (0,05 моль) 2-[2-(2-хлорэтокси)этокси]этанола и 8,70 г (0,10 моль) морфолина кипятят в 50 мл 5% водного раствора гидроксида калия в течение 63 часов. Реакционную смесь охлаждают и экстрагируют продукт этилацетатом. Экстракт сушат над сульфатом натрия, растворитель отгоняют на роторе, остаток перегоняют под вакуумом. Таким образом получено 5,91 г (54%) 2-[2-(2-N-морфолиноэтокси)этокси]этанола (3е). Масс-спектр*, m/z (Iотн;%): 219 [M]+ (7); 201 (6); 158 (15); 144 (7); 131 (14); 114 (46); 101 (49); 100 (100); 86 (23).
Пример 10.
Смесь 12,76 г (0,06 моль) 2-{2-[2-(2-хлорэтокси)этокси] этокси}этанола и 8,78 г (0,12 моль) диэтиламина кипятят 50 мл 5% водного раствора гидроксида калия в течение 70 часов. Реакционную смесь охлаждают, продукт экстрагируют этилацетотом. Экстракт сушат над сульфатом натрия, после чего растворитель отгоняют на роторе, а полученный остаток перегоняют под вакуумом. В итоге получено 8,97 г (60 %) 2-[2-(2-(2-N,N-диэтиламиноэтокси)этокси)этокси]этанола (3ж). Масс-спектр*, m/z (Iотн;%): 249[M+] (3); 206 (4); 205(3); 204(2); 162(20); 146(60); 100(14); 86(100); 58(12); 45(10).
Пример 11.
Смесь 8,50 г (0,04 моль) 2-{2-[2-(2-хлорэтокси)этокси] этокси}этанола и 6,80 г (0,08 моль) пиперидина кипятят в 50 мл 5% водного раствора гидроксида калия в течение 75 часов. Затем реакционную массу охлаждают и экстрагитруют продукт этилацетатом. Экстракт сушат над сульфатом натрия, растворитель отгоняют на роторе, остаток перегоняют под вакуумом. В итоге получено 5,53 г (53%) 2-{2-[2-(2-пиперидиноэтокси)этокси]этокси}этанола (3з). Масс-спектр*, m/z (Iотн;%): 261[M+] (4); 218 (3); 217(5); 216(2); 174(40); 144(35); 112(10); 99(95); 60 (15).
Пример 12.
Смесь 19,14 г (0,09 моль) 2-{2-[2-(2-хлорэтокси)этокси] этокси}этанола и 15,68 г (0,18 моль) морфолина кипятят 50 мл 5% водного раствора гидроксида калия в течение 76 часов. Затем реакционную массу охлаждают, продукт экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия, растворитель отгоняют на роторе. Полученный остаток перегоняют под вакуумом. Таким образом получено 14,69 г (62 %) 2-[2-(2-(2-N-морфолиноэтокси)этокси)этокси]этанола (3и). Масс-спектр*, m/z (Iотн;%): 263[M+] (5); 219 (7); 201 (6); 158 (15); 144 (7); 131 (14); 114 (46); 101 (49); 100 (100); 86 (23).
Пример 13.
К раствору 1,31 г (9,32 ммоль) хлорангидрида бензойной кислоты и 4,5 мл сухого бензола, охлажденному до 0°С, порционно, при перемешивании добавляют 1,36 г (8,47 ммоль) 2-(2-N,N-диэтиламиноэтокси)этанола. Реакционную массу перемешивают на магнитной мешалке при комнатной температуре в течение 0,5 часа. Образовавшийся осадок отфильтровывали, промывали сухим эфиром и дважды перекристаллизовали из сухого ацетона. В итоге получено 1,68 г (75 %) 2-(2-N,N-диэтиламиноэтокси)этилбензоата гидрохлорида (8а). Масс-спектр*, m/z (Iотн;%): 265[M+] (9); 263[M-2]+ (5); 248 (15); 203 (57); 174 (43); 135 (21); 112 (65); 98 (100); 91 (71); 77 (66). Спектр ЯМР 1Н (300,13 MHz CDCl3;-*, м.д.): 8.02 (м. 2H); 7.59 (м. 1H); 7.46 (м. 2H); 4.38 (м. 2H); 3.64 (м. 2H); 3.58 (м. 2H); 2.94 (м. 2H); 2.64 (м. 4H); 0.96 (м. 6H). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 7.30 (2C); 47.53 (2C); 57.14 (1C); 64.50 (1C); 66.09 (1C); 70.69 (1C); 128.70 (2C); 129.28 (2C); 133.40 (1C); 166.48 (1C).
Пример 14.
К охлажденному до 0°С раствору 1,23 г (7,96 ммоль) хлорангидрида фенилуксусной кислоты и 5 мл бензола, при перемешивании добавляют 1,16 г (7,23 ммоль) 2-(2-N,N-диэтиламиноэтокси)этанола. Раствор перемешивают на магнитной мешалке, при комнатной температуре, на протяжении 0,5 часа. После чего, образовавшийся осадок отфильтровывают, промывают сухим диэтиловым эфиром и дважды перекристаллизовывают из сухого ацетона. Таким образом получено 1,59 г (79 %) 2-(2-N,N-диэтиламиноэтокси)этилбензилацетата гидрохлорида (8б). Масс-спектр*, m/z (Iотн;%): 279[M+] (5); 227 [M-2]+ (3); 198 (61); 154 (53); 112 (13); 103 (70); 98 (100); 74 (78). Спектр ЯМР 1Н (300,13 MHz CDCl3;-*, м.д.): 7.95 (м. 2H); 7.66 (м. 1H); 7.56 (м. 2H); 3.63-3.68 (м. 6H); 2.94 (м. 2H); 2.64 (м. 4H,); 0.96 (м. 6H). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 7.30 (2C); 47.53 (2C); 57.14 (1C); 66.09 (1C); 70.40 (1C); 70.84 (1C); 73.92 (1C); 127.05 (2C); 128.28 (2C); 133.37 (1C); 136.19 (1C); 194.23 (1C).
Пример 15.
К смеси 1.05 г (4.40 ммоль) хлорангидрида 2,4-дихлорфеноксиуксусной кислоты и 4 мл сухого бензола, охлажденной до 0°С, при перемешивании порционно добавляют 0.69 г (4.00 ммоль) 2-(2-N,N-диэтиламиноэтокси)этанола. Реакционную массу перемешивают на магнитной мешалке при комнатной температуре в течение 0,5 часа. Полученный осадок отфильтровывали, промывали сухим эфиром и дважды перекристаллизовывали из сухого ацетона или этанола. В результате получено 0.98 г (61%) 2-(2-N,N-диэтиламиноэтокси)этил-2,4-дихлорфеноксиацетата гидрохлорида (8в). Масс-спектр*, m/z (Iотн;%): 368[M+2]+ (9); 366[M]+ (7); 364[M-2]+ (14); 223 (38);145(56); 100 (41); 86 (100). Спектр ЯМР 1Н (300,13 MHz CDCl3;-*, м.д.): 7.78 (м. 1H); 7.38 (м. 1H); 7.31 (м. 1H); 4.36 (м. 2H); 3.64 (м. 2H); 3.58 (м. 2H); 2.94 (м. 2H); 2.64 (м. 4H); 0.96 (м. 6H). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 7.30 (2C); 47.53 (2C); 57.14 (1C); 64.50 (1C); 66.09 (1C); 70.69 (1C); 127.11 (1C); 127.20 (1C); 131.11 (1C); 133.72 (1C); 137.48 (1C); 164.86 (1C).
Пример 16.
К раствору 0.46 г (3.30 ммоль) хлористого бензоила и 3 мл сухого бензола, охлажденному до 0°С при перемешивании добавляют 0.52 г (3.00 ммоль) 2-(2-N-пиперидиноэтокси)этанола. Реакцию проводят при комнатной температуре и перемешивание в течение получаса. Полученный продукт отделяют от реакционноой массы фильтрацией и промывают небольшим количеством сухого диэтилового эфира, после чего полученное вещество перекристаллизовывают из сухого ацетона, при этом было получено 0.81 г (85%) 2-(2-N-пиперидиноэтокси)этилбензоата гидрохлорида (8г). Масс-спектр*, m/z (Iотн;%): 277[M]+ (5); 275[M-2]+ (17); 156 (61); 149 (53); 142 (13); 105 (70); 98 (100); 77 (71). Спектр ЯМР 1Н (300,13 MHz CDCl3;-*, м.д.): 12,04 (уш.с. 1Н); 7,99-7,96 (м. 2Н); 7,55-7,49 (м. 1Н); 7,42-7,37 (м. 2Н); 4,46-4,42 (м. 2Н); 4,04-4,02 (м. 2Н); 3,78-3,76 (м. 2Н); 3,53-3,49 (м. 2Н); 3,15-3,12 (м. 2Н); 2,71-2,60 (м. 2Н); 2,16-2,07 (м. 2Н); 1,77-1,61 (м. 3Н); 1,30-1,14 (м. 1Н). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 22,68 (1C); 23,54 (2C); 54,90 (2C); 57,73 (1C); 64,30 (2C); 66,69 (1C); 70,06 (1C);129,40 (2C); 130,46 (2C); 130,69 (1C); 134,16 (1C); 167,22 (1C).
Пример 17.
К охлажденному до 0°С раствору 1.41 г (9.13 ммоль) хлорангидрида фенилуксусной кислоты в ацетоне прибавляют 1.44 г (8.30 ммоль) 2-(2-N пиперидиноэтокси)этанола. Реакцию проводят при перемешивании в течение полутора часов. Полученный осадок отфильтровывают и промывают диэтиловым эфиром, затем перекристаллизовывают из сухого этанола. В результате получено 1.44 г (53%) 2-(2-N-пиперидиноэтокси)этилбензилацетата гидрохлорида (8д). Масс-спектр*, m/z (Iотн;%): 291[M]+ (6); 289[M-2]+ (15); 156 (57); 149 (43); 135 (21); 112 (65); 98 (100); 91 (71); 77 (66). Спектр ЯМР 1Н (300,13 MHz CDCl3;-*, м.д.): 7.95 (м. 2H); 7.66 (м. 1H); 7.56 (м. 2H); 4.43 (с. 2H); 3.63-3.68 (м. 4H); 3.64 (м. 2H); 2.98 (м. 4H); 2.78 (м. 2H); 1.88 (м. 4H). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 23.27 (2C); 54.45 (2C); 56.96 (1C); 66.32 (1C); 70.40 (1C); 70.84 (1C); 73.93 (1C); 127.05 (2C); 128.28 (2C); 133.37 (1C); 136.19 (1C); 194.23 (1C).
Пример 18.
Смесь 1.07 г (6.30 ммоль) хлорангидрида феноксиуксусной кислоты и 3 мл сухого бензола охлаждают до 0°С, и при интенсивном перемешивании добавляют 1.00 г (5.70 ммоль) 2-(2-N-пиперидиноэтокси)этанола, перемешивание продолжают на протяжении 0,5 часов. После чего, реакционную массу подвергаютфильтрации, полученный фильтрат промывают сухим диэтиловым эфиром. В итоге было получено 1.02 г (52%) 2-(2-N-пиперидиноэтокси)этилфеноксиацетата гидрохлорида (8е). Масс-спектр*, m/z (Iотн;%): 307[M]+ (4); 305[M-2]+ (21); 156 (67); 151(34); 112 (47); 98 (100); 94 (33); 77 (52). Спектр ЯМР 1Н (300,13 MHz CDCl3;-*, м.д.): 7.32 (м. 2H); 7.06 (м. 2H); 6.95 (м. 1H); 4.51 (с. 2H); 4.48 (м. 2H); 3.64 (м. 2H); 3.56 (м. 2H); 2.98 (м. 4H); 2.78 (м. 2H); 1.88 (м. 4H). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 23.27 (2C); 54.45 (2C); 56.96 (1C); 63.62 (1C); 65.52 (1C); 66.32 (1C); 69.65 (1C); 114.63 (2C); 119.60 (1C); 129.50 (2C); 157.62 (1C); 168.73 (1C).
Пример 19.
В среде бензола объемом 20 мл, охлажденного до 0°С растворили 10.53 г (44 ммоль) хлорангидрида 2,4-дихлорфеноксиуксусной кислоты. К полученному раствору порционно при перемешивании добавляют 7.20 г (40 ммоль) 2-(2-N-пиперидиноэтокси)этанола и перемешивают в течение 0.5 часа, затем отфильтровывают осадок. Полученный фильтрат промывают сухим диэтиловым эфиром, а затем перекристаллизовывают из ацетона. Таким образом было получено 14.16 г (83%) 2-(2-N-пиперидиноэтокси)этил-2,4-дихлорфеноксиацетата гидрохлорида (8ж). Масс-спектр*, m/z (Iотн;%): 375[M+1]+ (6); 374[M]+ (5); 220 (14); 175 (32);162 (24); 156 (24); 145 (42); 112 (50). Спектр ЯМР 1Н (300,13 MHz CDCl3; *, м.д.): 12,10 (уш.с. 1Н); 7,35 (д. 1Н); 7,18-7,13 (м. 1Н); 4,72 (с. 2Н); 4,34-4,31 (м. 2Н); 4,02 (т. 2Н, j=4,67); 3,69-3,66 (м. 2Н); 3,56 (м. 2Н); 2,70-2,60 (м. 2Н); 2,28-2,13 (м. 2Н); 1,93-1,75 (м. 4Н); 1,41-1,33 (м. 1Н). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 22,81 (1C); 23,57 (2C); 55,30(2C); 57,91 (1C); 64,88 (1C); 66,80 (1C); 67,34 (1C); 69,85 (1C); 115,96 (1C); 125,13(1C); 128,10 91C); 128,62 (1C); 131,23 (1C); 153,28 (1C); 168,94 (1C).
Пример 20.
К смеси 1,38 г (9,81 ммоль) бензоилхлорида и 4 мл сухого бензола, охлажденной до 0°С, медленно, при перемешивании добавили 1,56 г (8,91 ммоль) 2-(2-N-морфолиноэтокси)этанола. После чего смесь продолжают перемешивать на магнитной мешалке при комнатной температуре в течение 0,5 часа. Образовавшийся осадок отделяют фильтрацией. Фильтрат промывают сухим диэтиловым эфиром и перекристаллизовывают дважды из сухого ацетона. В итоге получено 2,11 г (85%) 2-(2-N-морфолиноэтокси)этилбензоата гидрохлорида (8з). Масс-спектр*, m/z (Iотн;%): 279[M]+ (8); 277 [M-2]+ (3); 254(17); 201 (35); 182 (23); 168 (72); 145 (50); 114 (15); 101 (38); 100 (100); 86 (32). Спектр ЯМР 1Н (300,13 MHz CDCl3; *, м.д.): 8.02 (м. 2H); 7.59 (м. 1H); 7.46 (м. 2H); 4.38 (м. 2H); 3.55-3.64 (м. 8H, 3.58); 2.83 (м. 2H); 2.46 (м. 4H). Спектр ЯМР 13C (75,47 MHz; CDCl3;-*, м.д.): 53.80 (2C); 57.36 (1C); 64.50 (1C); 66.33 (1C); 67.02 (2C); 70.69 (1C); 128.70 (2C); 129.02 (1C); 129.28 (2C); 133.40 (1C); 166.48 (1C).
Пример 21.
К охлажденному до 0°С раствору 0,75 г (4,40 ммоль) хлорангидрида феноксиуксусной кислоты в 2 мл сухого бензола добавляют, при перемешивании, 0,70 г (4,00 ммоль) 2-(2-N-морфолиноэтокси)этанола, затем смесь перемешивают при комнатной температуре в течение 0.5 часа. После чего реакционную массу подвергают фильтрации. Твердый остаток промывают сухим диэтиловым эфиром и перекристаллизовывают из сухого ацетона. В результате было получено 1,13г (82%) 2-(2-N-морфолиноэтокси)этилфеноксиацетата гидрохлорида с (8и). Масс-спектр*, m/z (Iотн;%): 310[M+3]+ (2); 309[M+2]+ (4); 308[M+1]+ (8); 307[M]+ (15); 179 (20); 158 (35); 152 (6); 135 (5); 114 (25); 107 (33); 100 (100); 86 (24); 77 (35). Спектр ЯМР 1Н (250,13 MHz ДМСО; *, м.д.): 11,61 (уш.с. 1Н); 7,31 (т. 2Н); 7,01-6,92 (м. 3Н); 4,81 (с. 2Н); 4,29 (т. 2Н); 3,88 (т. 2Н); 3,68 (т. 2Н); 3,42-3,12 (м. 10Н). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 53,77 (2C); 58,04 (1C); 64,46 (1C); 64,48 (2C); 66,21 (1C); 66,44 (1C); 69,84 (1C); 115,48 (2C); 122,73 (1C); 130,49 (2C); 158,56 (1C); 169,76 (1C).
Пример 22.
В 3 мл сухого бензола растворили 1.50 г (6.30 ммоль) хлорангидрида 2,4-дихлорфеноксиуксусной кислоты, затем раствор охладили до 0°С. К полученному раствору, при перемешивании, добавили 1.00 г (5.70 ммоль) 2-(2-N-морфолиноэтокси)этанола, после чего реакционную массу перемешивали в течение 0.5 часа при комнатной температуре, по окончании процесса, выделившийся осадок отфильтровали. Полученное таким образом вещество промыли сухим диэтиловым эфиром и перекристаллизовывали из сухого ацетона. В итоге было получено 2.18 г (92%) 2-(2-N-морфолиноэтокси)этил-2,4-дихлорфеноксиацетата гидрохлорида (8л). Масс-спектр*, m/z (Iотн;%): 379[M+2]+ (2); 377[M]+ (9); 375[M-2]+ (12); 220(7); 175 (35); 162 (23); 158 (72); 145 (50); 114 (15); 101 (38); 100 (100); 86 (32). Спектр ЯМР 1Н (250,13 MHz ДМСО;-*, м.д.): 11,53 (уш. с. 1Н); 7,59 (с. 1Н); 7,37 (д. 1Н); 7,13 (д. 1Н); 4,98 (с. 2Н); 4,29 (д. 2Н); 3,90 (д. 2Н); 3,69 (д. 2Н); 3,12-3,43 (м. 10Н). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 53,99 (2C); 58,22 (1C); 64,53 (2C); 64,74 (1C); 66,56 (1C); 67,29 (1C); 69,88 (1C); 115,84 (1C); 124,97 (1C); 128,01 (1C); 128,59 (1C); 131,18 (1C); 153,17 (1C); 168,92 (1C).
Пример 23.
К смеси состоящей из 0.71 г (5.07 ммоль) бензоилхлорида и 3 мл сухого ацетона, охлажденной до 0°С, порционно, при перемешивании, добавляют 1.00г (4.61 ммоль) 2-[2-(2-N-пиперидиноэтокси)этокси]этанола, затем смесь перемешивают в течение 0.5 часа при комнатной температуре. После чего, образовавшийся в ходе реакции осадок отфильтровывают и промывают сухим диэтиловым эфиром. Полученное вещество перекристаллизовывают из сухого ацетона. Таким образом было получено 1.44 г (88%) 2-[2-(2-N-пиперидиноэтокси)этокси]этилбензоата гидрохлорида (8м). Масс-спектр*, m/z (Iотн;%): 321[M]+ (4); 319[M-2]+ (14); 156 (25); 149 (40); 122 (22); 112 (38); 105 (47); 98 (100); 77 (51). Спектр ЯМР 1Н (250,13 MHz ДМСО;-*, м.д.): 8.02 (м. 2H); 7.59 (м.1H); 7.46 (м. 2H); 4.46 (м. 2H); 3.64 (м. 2H); 3.63-3.66 (м. 4H); 3.56 (м. 2H); 2.82 (м. 2H); 2.64 (м. 4H); 1.71 (м. 4H); 1.46 (м. 2H). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 23.84 (1C); 25.45 (2C); 54.89 (2C); 57.94 (1C); 64.78 (1C); 66.32 (1C); 69.93 (1C); 70.18 (1C); 70.63 (1C); 128.70 (2C); 129.02 (1C); 129.28 (2C); 133.40 (1C); 166.48 (1C).
Пример 24.
В 3 мл сухого ацетона растворяют 0.86 г (5.07 ммоль) хлорангидрида феноксиуксусной кислоты и охлаждают до 0°С, затем медленно, при перемешивании добавляют 1.00 г (4.61 ммоль) 2-[2-(2-N-пиперидиноэтокси)этокси]этанола. Реакционную массу перемешивают в течение 0.5 часов при комнатной температуре, затем смесь подвергают фильтрации, полученный фильтрат промывают сухим диэтиловым эфиром и перекристаллизовывают из ацетона. Таким образом получено 1.34 г (75%) 2-[2-(2-N-пиперидиноэтокси)этокси]этилфеноксиацетата гидрохлорида (8н). Масс-спектр*, m/z (Iотн;%): 352[M+1]+ (5); 351[M]+ (25); 350[M-1]+ (15); 349[M-2]+ (28); 200 (20); 156 (47); 151 (31); 112 (39); 98 (100); 94 (32); 77 (47). Спектр ЯМР 1Н (250,13 MHz ДМСО;-*, м.д.): 7.32 (м. 2H); 7.06 (м. 2H); 6.95 (м. 1H); 4.51 (с. 2H); 4.47 (м. 2H); 3.63-3.66 (м. 6H); 3.55 (м. 2H); 2.82 (м. 2H); 2.64 (м. 4H); 1.71 (м. 4H); 1.46 (м. 2H). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 23.84 (1C); 25.45 (2C); 54.89 (2C); 57.94 (1C); 63.91 (1C); 65.52 (1C); 66.32 (1C); 68.89 (1C); 70. 18 (1C); 70.63 (1C); 114.63 (2C); 119.60 (1C); 129.50 (2C); 157.62 (1C); 168.73 (1C).
Пример 25.
К раствору 1.05 г (4.40 ммоль) хлорангидрида 2,4-дихлорфеноксиуксусной кислоты в 3 мл сухого бензола, охлажденного до 0°С, при перемешивании, порционно вносят 0.87 г (4.00 ммоль) 2-[2-(2-N-пиперидиноэтокси)этокси]этанола. Реакционную массу перемешивают в течение 0.5 часа при комнатной температуре, затем, образующийся осадок отфильтровывают и промывают сухим диэтиловым эфиром, после чего перекристаллизовывают из сухого ацетона. В результате было получено 1.37 г (79%) 2-[2-(2-N-пиперидиноэтокси)этокси]этил-2,4-дихлорфеноксиацетата гидрохлорида (8о). Масс-спектр*, m/z (Iотн;%): 422[M+2]+ (3); 420[M+1]+ (5); 420[M]+ (23); 419[M-1]+ (13); 418[M-2]+ (28); 220 (33); 200 (26); 156 (44);); 112 (36); 98 (100). Спектр ЯМР 1Н (250,13 MHz ДМСО;-*, м.д.): 7.64 (м. 1H); 7.26 (м. 1H); 7.17 (м. 1H); 4.45-4.50 (м. 4H); 3.63-3.66 (м. 6H); 3.55 (м. 2H); 2.82 (м. 2H); 2.64 (м. 4H); 1.71 (м. 4H); 1.46 (м. 2H). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 23.84 (1C); 25.45 (2C); 54.89 (2C); 57.94 (1C); 63.91 (1C); 66.06 (1C); 66.32 (1C); 68.89 (1C); 70.18 (1C); 70.63 (1C); 115.43 (1C); 122.40 (1C); 124.23 (1C); 127.39 (1C); 128.89 (1C); 152.08 (1C); 168.73 (1C).
Пример 26.
Смесь 1.45 г (6.60 ммоль) бензоилхлорида и 6 мл сухого ацетона охлаждают до 0°С и медленно при перемешивании добавляют 0.84 г (6.00 ммоль) 2-[2-(2-N-морфолиноэтокси)этокси]этанол. Затем реакционную массу перемешивают при комнатной температуре в течение 0.5 часа. Выделившийся осадок отделяют фильтрацией и промывают сухим диэтиловым эфиром, после чего перекристаллизовывают из сухого ацетона. В итоге было получено 1.57 г (73%) 2-[2-(2-N-морфолиноэтокси)этокси]этилбензоата гидрохлорида (8п). Масс-спектр*, m/z (Iотн;%): 323[M]+ (3); 320[M-2]+ (12); 158 (18); 149 (36); 122 (20); 114 (35); 105 (45); 100 (100); 77 (42). Спектр ЯМР 1Н (250.13 MHz ДМСО;-*, м.д.): 8.02 (м. 2H); 7.59 (м. 1H); 7.46 (м.2H); 4.46 (м. 2H); 3.61 (м. 2H); 3.53-3.66 (м. 10H); 2.83 (м. 2H); 2.46 (м. 4H). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 53.80 (2C); 57.36 (1C); 64.78 (1C); 66.33 (1C); 67.02 (2C); 69.93 (1C); 70.18 (1C); 70.63 (1C); 128.70 (2C); 129.02 (1C); 129.28 (2C); 133.40 (1C); 166.48 (1C).
Пример 27.
К раствору 0.75 г (4.40 ммоль) хлорангидрида феноксиуксусной кислоты в 3 мл сухого ацетона при температуре 0°С, порционно, при перемешивании вносят 0.88 г (4.00 ммоль) 2-[2-(2-N-морфолиноэтокси)этокси]этанола. Перемешивание продолжают на протяжении 0.5 часа при комнатной температуре. Реакционную массу фильтруют, полученный осадок промывают сухим диэтиловым эфиром и перекристаллизовывают из сухого ацетона. В результате было получено гигроскопичное соединение - гидрохлорид 2-[2-(2-N-морфолиноэтокси)этокси]этилфеноксиацетата массой 1.22 г (78%) (8р). Масс-спектр*, m/z (Iотн;%): 354[M+1]+ (5); 353 [M]+ (22); 352[M-1]+ (16); 351[M-2]+ (30); 202 (23); 158 (42); 152 (35); 114 (42); 100 (100); 94 (32); 77 (46). Спектр ЯМР 1Н (300 MHz ДМСО;-*, м.д.): 7.32 (м. 2H); 7.06 (м. 2H); 6.95 (м. 1H); 4.51 (с. 2H); 4.47 (т. 2H); 3.55-3.66 (м. 10H); 3.55 (т. 2H); 2.83 (т. 2H); 2.46 (м. 4H). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 53.80 (2C); 57.36 (1C); 63.91 (1C); 65.52 (1C); 66.33 (1C); 67.02 (2C); 68.89 (1C); 70.18 (1C); 70.63 (1C); 114.63 (2C); 119.60 (1C); 129.50 (2C); 157.62 (1C); 168.73 (1C).
Пример 28.
К охлажденному до 0°С раствору 1.05 г (4.40 ммоль) хлорангидрида 2,4-дихлорфеноксиуксусной кислоты в 3 мл сухого бензола, при перемешивании, порционно прибавляют 0.88 г (4.00 ммоль) 2-[2-(2-N-морфолиноэтокси)этокси]этанола, продолжая перемешивание в течение 0.5 часа при комнатной температуре. Затем реакционную массу фильтруют, отделяя осадок, который промывают сухим диэтиловым эфиром и перекристаллизовывают из сухого ацетона. Таким образом получено 1.23 г (69%) 2-[2-(2-N-морфолиноэтокси)этокси]этил-2,4-дихлорфеноксиацетата (8с). Масс-спектр*, m/z (Iотн;%): 424[M+2]+ (2); 423[M+1]+ (7); 427[M]+ (27); 420[M-1]+ (16); 419[M-2]+ (30); 321 (5); 277 (2); 202 (21); 174 (5); 158 (40); 149 (48); 105 (60); 100 (100). Спектр ЯМР 1Н (300 MHz ДМСО;-*, м.д.): 7.64 (м. 1H); 7.26 (м. 1H), 7.17 (м. 1H), 4.45-4.50 (м. 4H); 3.55-3.66 (м. 10H); 3.55 (т. 2H,); 2.83 (т. 2H); 2.46 (м. 4H). ). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 53.80 (2C); 57.36 (1C); 63.91 (1C); 66.06 (1C); 66.33 (1C); 67.02 (2C); 68.89 (1C); 70.18 (1C); 70.63 (1C); 115.43 (1C); 122,40 (1C); 124.23 (1C); 127.39 (1C); 128.99 (1C); 152.08 (1C); 168.73 (1C).
Пример 29.
В 2 мл сухого ацетона растворяют 0.36 г (2.14 ммоль) хлорангидрида феноксиуксусной кислоты и охлаждают до 0°С, затем при перемешивании медленно вносят 0.51г (1.95 ммоль) 2-{2-[2-(2-N-пиперидиноэтокси)этокси]этокси}этанола, продолжая перемешивание при комнатной температуре в течение 0.5 часа. Образовавшийся в ходе реакции осадок отфильтровывают и промывают сухим диэтиловым эфиром, после чего перекристаллизовывают из сухого ацетона. В итоге получено 0.59 г (70%) 2-{2-[2-(2-N-пиперидиноэтокси)этокси]этокси}этилфеноксиацетата гидрохлорида (8т). Масс-спектр*, m/z (Iотн;%): 396[M+1]+ (6); 395[M]+ (19); 394[M-1]+ (10); 393[M-2]+ (23); 244 (7); 200 (17);186 (14); 156 (32); 151 (22);142 (26); 112 (21); 98 (100); 94 (11); 77 (35). Спектр ЯМР 1Н (300 MHz ДМСО;-*, м.д.): 7.32 (м. 2H); 7.06 (м. 2H); 6.95 (м. 1H); 4.51 (с. 2H); 4.47 (т. 2H); 3.63-3.66 (м. 10H); 3.55 (т. 2H); 2.82 (т. 2H); 2.64 (м. 4H); 1.71 (м. 4H); 1.46 (м. 2H). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 23,84 (1С); 25.45 (2C); 54.89 (2C); 57.94 (1C); 63.91 (1C); 65.52 (1C); 66.32 (1C); 68.89 (1C); 70.18 (1C); 70.23 (1C); 70.48 (1C); 70.63 (1C); 114.63 (2C); 129.50 (2C); 157.62 (1C); 168.73 (1C).
Пример 30.
К смеси 1.09 г (4.55 ммоль) хлорангидрида 2,4-дихлорфеноксиуксусной кислоты и 4 мл сухого ацетона, при охлаждении до 0°С и перемешивании вносят 1.08 г (4.14 ммоль) 2-{2-[2-(2-N-пиперидиноэтокси)этокси]этокси}этанола. Реакционную массу продолжают перемешивать при комнатной температуре на протяжении 0.5 ч, после чего, образовавшийся осадок отфильтровывают и промывают сухим диэтиловым эфиром, а затем перекристаллизовывают из сухого ацетона. В результате получено 1.57 г (76%) 2-{2-[2-(2-N-пиперидиноэтокси)этокси] этокси}этилфеноксиацетата гидрохлорида (8у). Масс-спектр*, m/z (Iотн;%): 466[M+2]+ (3); 465[M+1]+ (6); 464[M]+ (32); 463[M-1]+ (13); 462[M-2]+ (27); 321 (6); 277 (4); 244 (5); 200 (21);186 (25); 156 (34); 142 (29); 112 (33); 98 (100). Спектр ЯМР 1Н (300 MHz ДМСО;-*, м.д.): 7.32 (м. 2H); 7.06 (м. 2H); 6.95 (м. 1H); 4.51 (с. 2H); 4.47 (т. 2H); 3.63-3.66 (м. 10H); 3.55 (т. 2H); 2.82 (т. 2H); 2.64 (м. 4H); 1.71 (м. 4H); 1.46 (м. 2H). Спектр ЯМР 13C (75,47 MHz;-*, м.д.): 23.84 (1C); 25.45 (2C); 54.89 (2C); 57.94 (1C); 63.91 (1C); 65.52 (1C); 66.32 (1C); 68.89 (1C); 70.18 (1C); 70.23 (1C); 70.48 (1C); 114.63 (2C); 119.60 (1C); 129.50 (2C); 157.62 (1C); 168.73 (1C).
Изучение антиаритмической активности соединений формулы (I)
Исследование антиаритмических свойств изучаемых соединений проведено в соответствии с руководством по проведению доклинических исследований лекарственных средств [Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М: Гриф и К, 2012. с. 944].
Антиаритмические свойства веществ оценивались параллельно на различных моделях нарушения сердечного ритма, в которых аритмии возникают и поддерживаются различными механизмами. В качестве моделей использовали аконитиновую (аконитина гидробромид в дозах 40-50 мкг/кг), хлоридкальциевую (CaCl2 в дозе 200-250 мг/кг) и хлоридбариевую (BaCl2 в дозе 25 мг/кг) аритмии у крыс Wistar (самцы и самки, масса тела 180-240 г). Данные модели аритмий моделируют тяжелые, в большинстве случаев несовместимые с жизнью нарушения ритма сердечной деятельности у человека, и широко применяются при поиске антиаритмических препаратов [Szekeres L. Experimental models for the study of antiarrhytmic agents / Progr. Pharmacol., 1979, V.2, №4,pp. 25-31]. Эффективность антиаритмического действия соединений характеризуется способностью предотвращать развитие аритмии или прекращать уже развившиеся аритмии, облегчать их течение и восстанавливать нормальный синусовый ритм.
Исследования токсичности и антиаритмической активности заявляемых соединений проведены на 250 мышах линии Balb/c (самцы и самки, масса тела 18 -20 г), 560 крысах линии Wistar (самцы и самки, масса тела 180-240 г). Животных содержали в биоклиники ФГБУ «Национальный медицинский исследовательский центр кардиологии» Министерства здравоохранения РФ в соответствии с нормами группового размещения в условиях естественного освещения с принудительной 16-ти кратной вентиляцией при температуре 18-20°С и относительной влажности 40-70%. Животные имели свободный доступ к питьевой воде и стандартному (ГОСТ Р50258-92) гранулированному корму ПК 120-1 (ООО «Лабораторснаб», Россия). Условия содержания животных соответствовали приказу МЗ РФ №199н «Об утверждении правил надлежащей лабораторной практики» от 01.04.2016 и этическим нормам, изложенным в Правилах надлежащей лабораторной практики (GLP) Хельсинской декларации (2000). Все работы с животными выполнены на основе стандартных операционных процедур, принятых в ФГБУ «НМИЦ кардиологии» МЗ РФ, которые соответствуют правилам Европейской Конвенции по защите позвоночных животных, используемых для научных целей (ETS 123, Strasbourg, 1986).
Изменения ритма сердечной деятельности при использовании указанных моделей аритмий у животных регистрировали электрокардиографически во II-ом стандартном отведении на электрокардиографе CARDIOVIT AT-1 VET «Schiller».
Исследованию антиаритмических свойств впервые синтезированных соединений предшествовало изучение их «острой токсичности» на мышах линии Balb/c (самцы и самки, масса тела 18-22 г) при однократном внутрибрюшинном введении. На I этапе по методу Deichman, Le Blanc [Deichman W.B., Le Blanc T.J. Determination of the approximate lethal dose with about six animals. J. Indust. Hyg. ToxicoL, 1943, 25, 9, 415-41] на малом количестве животных (5-7) определяли показатели ориентировочной ЛД50. Затем ставили развернутый опыт на трех группах животных, по 5-6 голов в каждой, с дозами, равноудаленными от ЛД50. Наблюдение за животными осуществляли на протяжении 14 дней после введения веществ. Регулярно фиксировали общее состояние, особенности поведения и двигательной активности, регистрировали сроки развития интоксикации и гибели животных. Показатели «острой» токсичности ЛД10, ЛД16, ЛД50±m, ЛД84 определяли с использованием метода пробит-анализа по Литчфилду и Уилкоксону [Беленький М.Л. Элементы количественной оценки фармакологического эффекта. - Л.: Медгиз, 1963. - 146 с]. Показатели ЛД50 для аминоэфиров оксиэтиленового ряда составили 308-3900 мг/кг. Как показали проведенные исследования, заявляемые соединения оказались малотоксичными при однократном внутрибрюшинном введении мышам линии BALB/c. Результаты экспериментов представлены в таблице 3.
В качестве референс препаратов использовали известные и широко применяемые в медицинской практике антиаритмические средства - амиодарон (Кордарон «Санофи-Авентис Франс»), пропранолол (Анаприлин «Татхимфармпрепараты), верапамил (Алкалоид респ. Македония), лидокаин («Органика» Новокузнецкое АО), новокаинамид («Органика» Новокузнецкое АО). Антиаритмическую активность соединений оценивали по величине среднеэффективной дозы (ЭД50), предотвращающей или снимающей нарушения сердечного ритма, антиаритмическому индексу (АИ) и индексу Шнейдера-Брокка (ЛД10/ЭД90). Последний позволяет более точно охарактеризовать фармакологическую активность препаратов, терапевтическую широту и перспективность создания на их основе лекарственных средств [Arzamastsev E.V. The safety of drugs at the stage of screening and preclinical toxicological studies. Lab. Zhyvotnye, 1991, Vol. 1, N 2, 60-64]. Указанные параметры эффективности и токсичности устанавливали методом пробит-анализа по Литчфилду и Уилкоксона.
Для первичной оценки антиаритмических свойств соединений использовали аконитиновую модель аритмии, механизмы возникновения которой обусловлены изменением функционального состояния быстрых натриевых каналов возбудимой мембраны кардиомиоцитов и увеличением их проводимости [Галенко-Ярошевский П.А. и др., Антиаритмические средства: фармакотерапевтические аспекты, методы поиска и доклинического изучения/ Краснодар: Просвещение-Юг, 2012, 431 с.]. Данный тип аритмии смешанного предсердно-желудочкового типа близок расстройствам сердечного ритма, наблюдаемым в клинике при различных поражениях миокарда.
Наркотизированных животных (крысы Wistar, самцы и самки массой 180-240 г) (уретан 1100-1300 мг/кг, в/б) фиксировали в положении на спине на операционном столике, катетеризировали бедренную вену для введения аконитина и изучаемых соединений. Перед началом эксперимента у животных регистрировали ЭКГ (II стандартное отведение, калибровочный сигнал 10 мм/мВ, скорость записи 25 мм/сек). В качестве регистратора использовали кардиограф CARDIOVIT AT-1 VET Schiller (Швейцария). Заявляемые соединения в дозах 1/10-1/100 от ЛД50 (для мышей при в/б введении) и препараты сравнения вводили за 2 мин до введения аконитина. Регистрацию ЭКГ проводили через 3, 5, 10, 15 и 20 минут после введения аконитина.
Эффективность антиаритмического действия заявляемых соединений оценивали по величине латентного периода возникновения аритмии, по продолжительности аритмии или ее предотвращению. По окончании эксперимента рассчитывали среднеэффективную дозу соединения (ЭД50) методом пробит-анализа по Литчфилду и Уилкоксону. Для оценки эффективности антиаритмического действия аминоэфиров оксиэтиленового ряда и препаратов сравнения использовали антиаритмический индекс (ЛД50/ЭД50) и индекс Шнейдера-Брокка (ЛД10/ЭД90).
На основании нескольких серий экспериментов, в которых исследовались антиаритмические свойства различных доз изучаемых веществ, методом пробит-анализа по Литчфилду и Уилкоксону определяли дозы, снимающие аритмию у 50 и 90% животных.
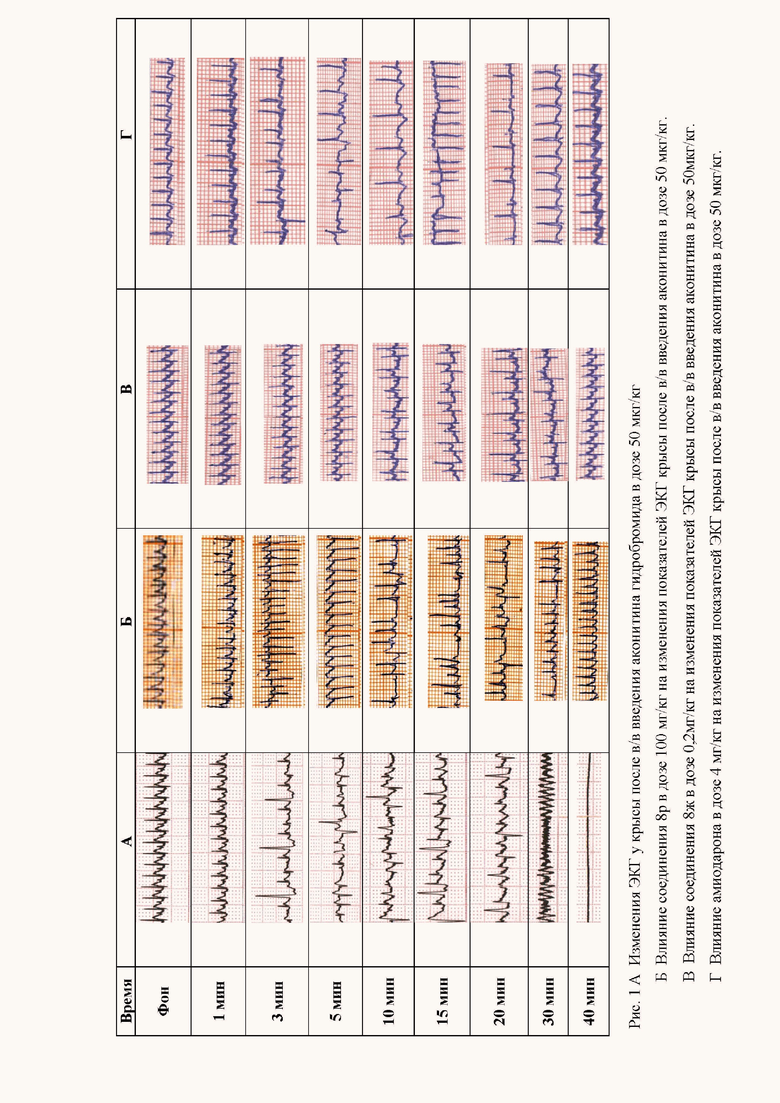
Введение соединений в диапазоне испытанных доз 1/100-1/10 от ЛД50 (для мышей при внутрибрюшинном введении) приводило к 50-100% выживаемости животных на модели аконитиновой аритмии. Заявляемые соединения в испытанных дозах увеличивали длительность скрытого периода развития аконитиновой аритмии или полностью ее предотвращали. Кардиограммы представлены на рис. 1-3.
Высокая антиаритмическая активность заявляемых соединений подтверждается другим использованным критерием - процентом снятых аритмий (таблица 4). Применение этого критерия свидетельствует о выраженных антиаритмических свойствах заявляемых соединений. На моделях аконитиновой аритмии у крыс ряд заявляемых соединений в дозах до 6 мг/кг (соединения 8ж, 8и) в 50-100% случаев снимает аритмии, вызванные введением аконитина гидробромида. Наименьшими средними эффективными дозами (ЭД50) характеризуются соединения 8л и 8ж.
Наиболее выраженные антиаритмические свойства показало соединение 8ж, проявляющее антиаритмический эффект в дозе 0,06 мг/кг (менее 1/500 ЛД50 для мышей при в/б введении). Далее в порядке снижения располагались соединения 8з>8и>8р>8л, превышающие по величине антиаритмического индекса антиаритмические средства (амиодарон, лидокаин, пропранолол), взятые в качестве референс препаратов.
Выраженные антиаритмические свойства заявляемых соединений, выявленные на модели аконитиновой аритмии, были подтвержены также и на моделях хлоридбариевой и хлоридкальциевой аритмии. Электрокардиограммы представлены на рис. 2, 3. При этом также применяли в качестве референс препаратов - известные антиаритмики, широко применяющиеся в клинической практике.
Нарушения ритма сердца, индуцированные хлоридом кальция (200-250 мг/кг), получали при в/в введении его в виде 10% раствора. При этом через 30 сек - 1 мин возникала фибрилляция желудочков сердца. Исследуемые соединения и препарат сравнения (верапамил) вводили в/в за 1-2 мин до введения кальция хлорида. ЭКГ регистрировали во II стандартном отведении, начиная с 1-й минуты, и далее через 5, 10, 15 и 20 мин после введения кальция хлорида. Исследование каждого соединения проводилось на 3-6 группах животных, в зависимости от количества исследуемых доз. Об антиаритмическом эффекте судили по уменьшению количества случаев летальной фибрилляции желудочков сердца.
Хлоридбариевую модель аритмии вызывали внутривенным введением хлористого бария в дозе 25 мг/кг наркотизированным крысам (уретан 1100 мг/кг внутрибрюшинно). Хлорид бария вызывает политопную желудочковую аритмию, обусловленную нарушением автоматизма сердца, изменением возбудимости миокарда и характеризующуюся тахиаритмией и желудочковой экстрасистолией. Аритмия возникает через 10-15 сек после введения хлористого бария и, по данным электрокардиографии, отмечается на протяжении 42,7±5,2 мин, после чего наблюдается восстановление синусового ритма или в 85% случаев отмечается гибель животных. Заявляемые соединения и референтные препараты вводили в/в за 1-3 минуты до введения бария хлорида.
В качестве иллюстраций на графических изображениях (рис.1-3) представлены электрокардиограммы крыс с нарушениями сердечной деятельности, вызванные аконитином гидробромидом, хлористым барием и хлористым кальцием.
Полученные в экспериментах данные свидетельствуют о выраженных антиаритмических свойствах и заметных преимуществах заявленных соединений. По сравнению с известными антиаритмиками соединения обладают меньшей токсичностью, большими терапевтическими индексами (ЛД50/ЭД50 и ЛД10/ЭД90) - важнейшими показателями, необходимыми для оценки целесообразности дальнейшего изучения и перспективности клинических испытаний и практического применения в качестве лекарственных средств для профилактики и лечения нарушений ритма сердца.
Таким образом, проведенные исследования показали, что заявляемые аминоэфиры являются малотоксичными веществами, обладают выраженными антиаритмическими свойствами, не уступающими по эффективности действия применяемым в настоящее время известным лекарственным средствам амиодарону, верапамилу и пропранололу. Заявляемые соединения являются веществами с комбинированным механизмом действия и перспективны для разработки на их основе новых высокоэффективных лекарственных средств для лечения и профилактики нарушений сердечного ритма.
Таблицы
Таблица 1
Выходы и свойства хлоргидратов аминоспиртов оксиэтиленового ряда 3а-и
%
(пр.эфир.)
(связ.)
(7.0)
1070
(18.0)
1070
(12.0)
1070
(7.0)
1070
(1.5)
1070
(1.5)
1070
(7.0)
1070
(2.0)
1070
(2.0)
1070
*Система ТСХ: метанол-хлороформ (1:3)
Таблица 2
Выходы и свойства хлоргидратов аминоэфиров оксиэтиленового ряда 8а-у
1250
2491
1280
1202
2485
1276
2484
1257
2491
1212
2456
1212
2448
1280
2452
1209
2448
1212
2376
1268
2482
1210
2458
1211
2467
1264
2434
1218
2458
Таблица 2 (продолжение)
1215
2396
1204
2452
1216
2486
Таблица 3.
Показатели токсичности и эффективности антиаритмического действия
гидрохлоридов аминоэфиров оксиэтиленового ряда и препаратов сравнения
на различных моделях аритмий при внутривенном введении
соединений
в/б, мг/кг
50 мкг/кг
250 мкг/кг
25 мкг/кг
ЭД50
Таблица 4.
Антиаритмические свойства гидрохлоридов аминоэфиров оксиэтиленового ряда и препаратов сравнения на модели
аконитиновой аритмии у крыс Wistar
соединения
%
%
85
42
21
10
1
1
5
5
5
5
0
60
80
100
100
0
0
0
20
20
42,0±13,8
83,3±6,6
80,4±7,5
77,2±16,8
62,2±8,6
0
80
100
80
100
110
1
0,5
0,25
8
2
4
4
100
100
50
50
0
0
0
0
82,7±9,9
100,3±1,3
80,0±10,0
88,6±12,4
100
100
100
50
20
8
100
0
105,6±1,4
100
20
10
5
2,5
1
0,5
0,25
0,125
0,06
4
4
6
5
3
2
2
5
7
100
25
67
100
100
100
100
100
100
0
0
17
60
0
0
0
40
14
79,7±10,9
103,5±4,0
117,4±6,7
33,5±8,5
61,0±2,0
47,0±12,0
69,0±6,0
72,7±5,5
87,2±15,1
100
100
100
100
100
100
100
100
100
5
7
5
5
100
100
60
40
31,0±5,9
53,0±14,4
100
100
10
5
60
80
35,0±9,8
100
6
5
80
40
47,0±15,2
100
| название | год | авторы | номер документа |
|---|---|---|---|
| N-(2-(2-(ДИАЛКИЛАМИНО)ЭТОКСИ)ЭТИЛ)КАРБОКСАМИДЫ И ИХ ГИДРОХЛОРИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2019 |
|
RU2712638C1 |
| N,N-бис(2-(диалкиламино)этил)карбоксамиды и их дигидрохлориды, проявляющие антиаритмическую активность, и фармацевтические композиции на их основе | 2017 |
|
RU2645080C1 |
| ФУНКЦИОНАЛЬНО ЗАМЕЩЕННЫЕ 1-ФЕНИЛОЛИГООКСИЭТИЛАМИНЫ, ПРОЯВЛЯЮЩИЕ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 1997 |
|
RU2141941C1 |
| Способ получения 4,6-дизамещенных 2-оксо-3,6-дигидропиримидин-1,5-дикарбальдегидов | 2025 |
|
RU2841546C1 |
| АРИЛАЛИФАТИЧЕСКИЕ АМИНОАМИДЫ ФЕНОКСИУКСУСНОЙ ИЛИ ЗАМЕЩЕННЫХ ФЕНОКСИУКСУСНЫХ КИСЛОТ, ПРОЯВЛЯЮЩИЕ АНТИАРИТМИЧЕСКУЮ, МЕСТНОАНЕСТЕЗИРУЮЩУЮ И АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ | 1997 |
|
RU2128163C1 |
| Способ получения 4-арилзамещенных 7-гидрокси-6'-фенил-5',6'-дигидро-1'Н-спиро[хроман-2,4'-пиримидин]-2'(3'H)-онов | 2023 |
|
RU2818006C1 |
| 2-(1-(2-(2-ХЛОР-10Н-ФЕНОТИАЗИН-10-ИЛ)-2-ОКСОЭТИЛ)-5-МЕТИЛ-1Н-1,2,4-ТРИАЗОЛ-3-ИЛ)ФЕНОЛ, ОБЛАДАЮЩИЙ ГИПОТЕНЗИВНЫМ И АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 2008 |
|
RU2394823C2 |
| 3-Имино-N-арил-2-хлорофуро[2,3-b]пиридин-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике и способ их получения | 2024 |
|
RU2829740C1 |
| ЗАМЕЩЕННЫЕ СУЛЬФОНЫ И СУЛЬФОКСИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ, ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2008 |
|
RU2379287C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛ(ФЕНИЛ)-N,N-БИС[4-АЛКОКСИ(ФЕНОКСИ-, БЕНЗИЛОКСИ-, ПРОП-2-ИНИЛОКСИ)-2-БУТИНИЛ]АМИНОВ | 2016 |
|
RU2675505C2 |


Изобретение относится к области фармакологии и касается создания новых лекарственных средств для профилактики и лечения нарушений сердечного ритма. Изобретение относится к соединениям, проявляющим антиаритмическую активность и представленным общей формулой (I), в которой когда n=1, NR2=NEt2, то R’=Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2; когда n=1, NR2=NC5H10, то R’=Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2; когда n=1, NR2=NC4H8O, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2; когда n=2, NR2=NC5H10, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2; когда n=2, NR2=N C4H8O, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2; когда n=3, NR2=NC5H10, то R’= PhOCH2; 2,4-Cl2C6H3OCH2 (при этом NC4H8O - морфолино, NC5H10 – пиперидино). Изобретение относится также к лекарственному средству и фармацевтической композиции, которые включают указанные соединения. 3 н.п. ф-лы, 4 табл., 3 ил., 30 пр.
 (I)
(I)
1. Соединения, проявляющие антиаритмическую активность и представленные общей формулой:
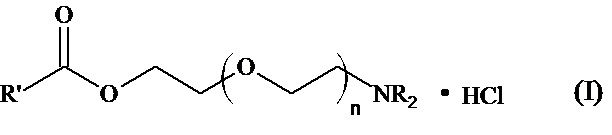 ,
,
когда n=1, NR2=NEt2, то R’=Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
когда n=1, NR2=NC5H10, то R’=Ph; PhCH2; PhOCH2; 2,4-Cl2C6H3OCH2;
когда n=1, NR2=NC4H8O, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2;
когда n=2, NR2=NC5H10, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2;
когда n=2, NR2=N C4H8O, то R’=Ph; PhOCH2; 2,4-Cl2C6H3OCH2;
когда n=3, NR2=NC5H10, то R’= PhOCH2; 2,4-Cl2C6H3OCH2
(при этом NC4H8O - морфолино, NC5H10 – пиперидино).
2. Лекарственное средство, обладающее антиаритмической активностью, включающее в качестве активного агента соединения по п. 1.
3. Фармацевтическая композиция, обладающая антиаритмической активностью, включающая в качестве активного агента соединения по п. 1 совместно с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ПРЕПАРАТ ОТ КАШЛЯ | 2009 |
|
RU2427388C2 |
Авторы
Даты
2022-07-05—Публикация
2020-12-25—Подача