Область техники
Изобретение относится к ветеринарии, в частности к ветеринарной терапии, и может быть использовано для стимуляции регенеративных процессов в организме лошади - в послеоперационный период, при дегенеративных заболеваниях органов и систем органов, при острых и хронических заболеваниях кожи, а также для адаптации лошадей к спортивным нагрузкам, улучшает качество жизни стареющих животных.
Уровень техники
Известны синтетические аналоги, обладающие регенеративной активностью, такие как натрия нуклеинат, метилурацил и прочие. Подобные лекарственные средства обладают восстановительными свойствами, улучшают гемапоэз, однако обладают относительно низкой эффективностью и узконаправленностью действия, при этом обладают рядом противопоказаний, связанных с риском угнетения нервной системы, возникновения брадикардии, обострения онкологических патологий системы крови, возникновения аллергических реакций.
Среди аналогов известен препарат для адаптации лошадей к спортивным нагрузкам [Патент РФ №2406511 С1, 29.10.2009], который включает экстракт из пантов северных оленей, стабилизаторы нипагин и нипазол и наполнитель 1,2-пропиленгликоль. Применение данного препарата ускоряет адаптацию организма лошади к спортивным нагрузкам. Однако для описываемого аналога не известно применение при травмах, в послеоперационный период и для регенерации жизненно важных органов при старении животного.
Наиболее близким техническим решением к настоящему изобретению является препарат «Гамавит» - комплексный препарат, основными действующими веществами которого являются плацента денатурированная эмульгированная (ПДЭ) и нуклеинат натрия [Патент РФ №2005475 С1 01.10.91]. Данный аналог изготавливается в форме раствора для инъекций либо выпаивания на основе ростовой питательной среды, содержащей сбалансированный раствор солей, аминокислот и витаминов. Обладает широким спектром действия, применяется для нормализации обменных процессов, обладает биостимулирующим, дезинтоксикационным, иммуномодулирующим и адаптогенным действием.
Однако при использовании указанного прототипа существует риск развития аллергической реакции на компоненты тканей плаценты. Сырье, используемое для получения данного препарата, не стандартизировано и несет опасность развития нежелательной микрофлоры, что может привести к инфицированию животных при применении препарата. Кроме того, использование «Гамавита» длительно и требует введения большого количества препарата (при профилактике в дозе 0,1 мл на 1 кг массы тела, в ходе лечения - по 0,3-0,5 мл в течение 2-4 недель). Жидкая форма выпуска препарата не позволяет обеспечить длительное хранение.
Стратегия регенеративной медицины, основанная на стимулировании собственного восстановительного потенциала, применяется при создании лекарственных средств для человека, например, кондиционная среда, обладающая лечебным эффектом при термических ожогах [патент RU №2292212, 27.01.07], однако не используется в ветеринарии.
Сущность изобретения
Настоящее изобретение ставит перед собой задачу обеспечения стимуляции регенеративных процессов в организме лошади при широком спектре дегенеративных заболеваний, после травм, при заболеваниях опорно-двигательного аппарата и кожи, облегчение приспособления лошадей к спортивным нагрузкам и расширение арсенала лекарственных средств, применяемых в восстановительной ветеринарии для лошадей.
Технический результат достигается путем разработки ветеринарного препарата для лошадей, обладающего регенеративной активностью в отношении широкого спектра заболеваний у лошадей, а также обеспечивающего адаптацию лошадей к спортивным нагрузкам.
Мезенхимальные стволовые клетки (МСК) обладают способностью секретировать широкий спектр хемокинов и ростовых факторов, быстро реагировать на изменение гомеостаза ткани модификацией профиля их секреции, что обеспечивает природный механизм регенерации тканей. Реализация потенциала МСК обеспечивается созданием и применением препарата на основе данных клеток, как выделенных de novo из костного мозга и/или жировой ткани лошадей, так и деконсервированных, и кондиционной среды (КС), образующейся в процессе их роста.
Предлагаемое изобретение представляет собой препарат, обладающий регенеративной и адаптогенной активностью, обеспечивающий нормализацию обменных процессов в организме лошади, что дает возможность коррекции широкого круга патологических состояний лошади. Препарат получают на основе экстракта мезенхимальных стволовых клеток и кондиционной среды.
Изготовление заявленного препарата выполняется в следующие этапы:
1. Накопление клеточной массы и формирование кондиционной среды. Для этого выполняют деконсервирование полученных ранее или непосредственное выделение мезенхимальных стволовых клеток из костного мозга либо жировой ткани лошадей. МСК лошади культивируют в ростовой среде на основе DMEM с 10% содержанием фетальной бычьей сыворотки (ФБС) до образования кондиционной среды, приемлемость которой оценивается по содержанию интерлейкинов (концентрация ИЛ-1 - не менее 2 пг/мл, ИЛ-2 - не менее 2 пг/мл, ИЛ-6 - не менее 10 пг/мл, ИЛ-10 - не менее 2 пг/мл).
2. Приготовление полупродукта на основе кондиционной среды и экстракта МСК. На данном этапе осуществляют сбор кондиционной среды, удовлетворяющей критериям приемлемости по концентрации интерлейкинов, снятие с подложки и диспергирование монослоя мезенхимальных стволовых клеток, получение экстракта клеток путем замораживания-оттаивания клеточной суспензии, объединение экстракта с кондиционной средой, полученной в ходе культивирования МСК лошади.
3. Изготовление конечного продукта. Полученный на предыдущем этапе полупродукт стабилизируют посредством добавления глицина в концентрации 20 мг на 1 мл раствора для лиофилизации, подвергают стерилизующей фильтрации, осуществляют розлив во флаконы в асептических условиях и сублимационную сушку.
Краткое описание иллюстративного материала
Изобретение поясняется графиками и таблицами.
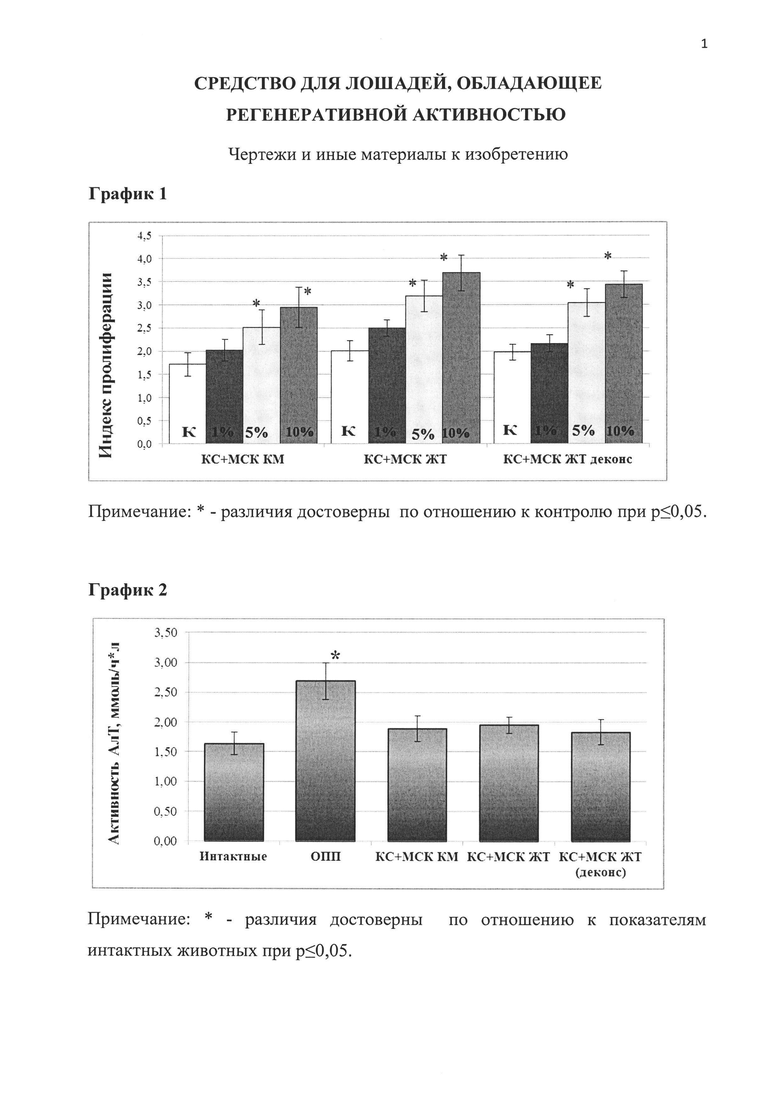
График 1. Влияние препарата на основе экстракта и кондиционной среды выделенных de novo мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК жировой ткани (СК+МСК ЖТ деконс) на пролиферацию культур клеток первичных дермальных фибробластов лошадей.
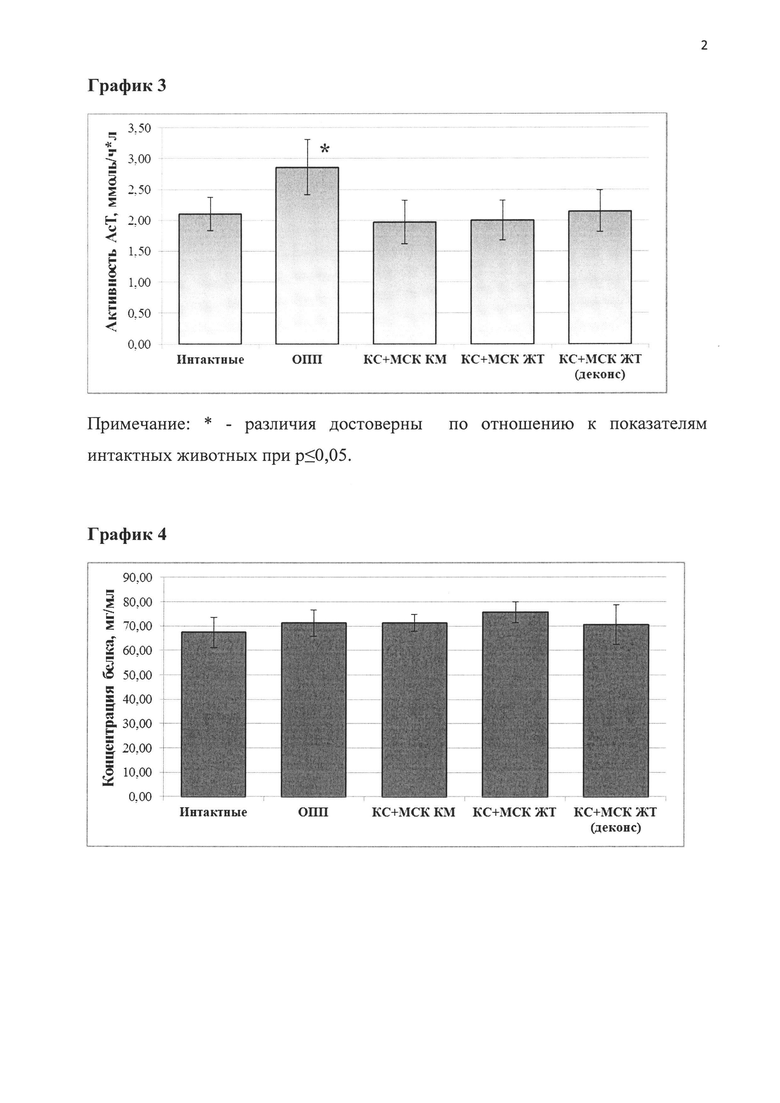
График 2. Влияние препарата на основе экстракта и кондиционной среды выделенных de novo мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК жировой ткани (СК+МСК ЖТ деконс) на активность АлТ в сыворотке крови крыс при моделировании острой патологии печени (ОПП).
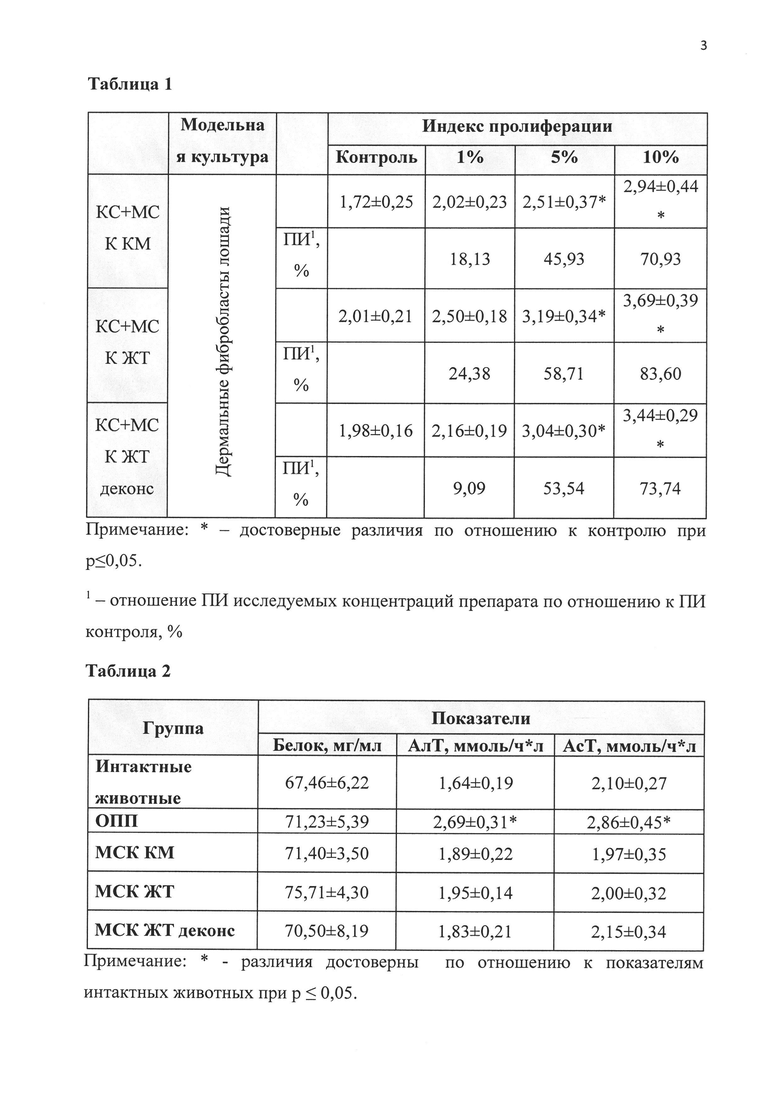
График 3. Влияние препарата на основе экстракта и кондиционной среды выделенных de novo мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК жировой ткани (СК+МСК ЖТ деконс) на активность АсТ в сыворотке крови крыс при моделировании острой патологии печени (ОПП).
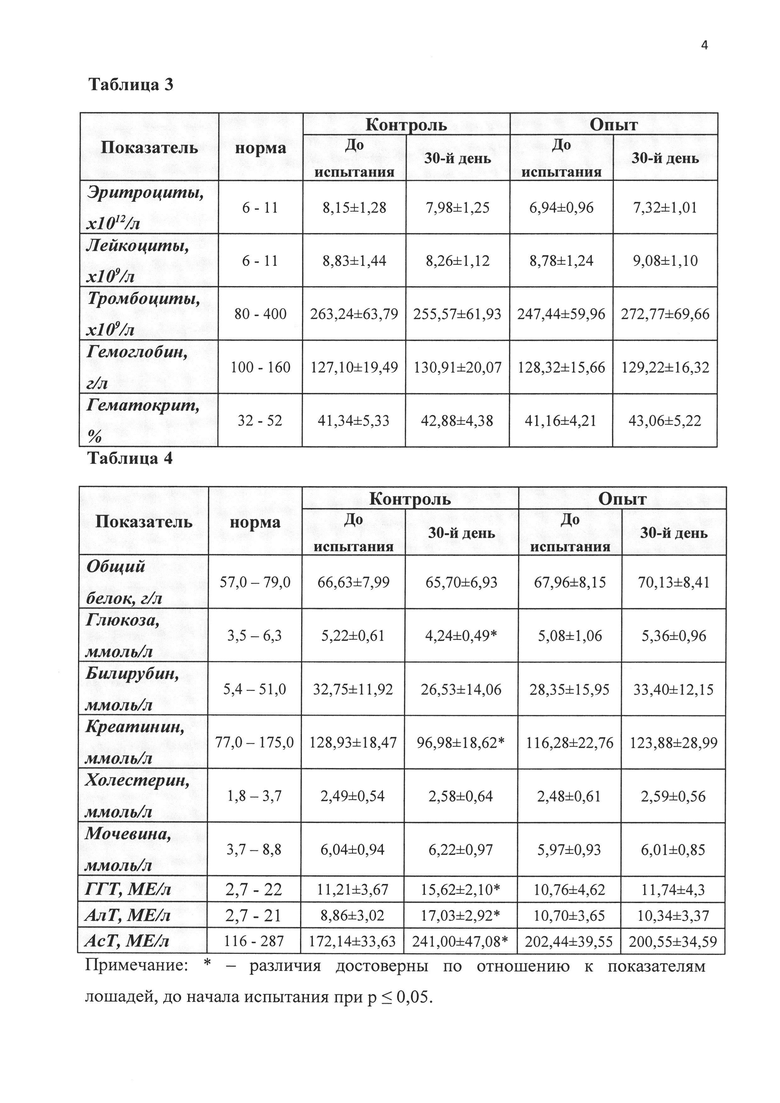
График 4. Влияние препарата на основе экстракта и кондиционной среды выделенных de novo мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК жировой ткани (СК+МСК ЖТ деконс) на содержание белка в сыворотке крови крыс при моделировании острой патологии печени (ОПП).
Таблица 1. Значение индекса пролиферации (ИП) первичной культуры дермальных фибробластов лошадей при добавлении разных концентраций регенеративного препарата.
Таблица 2. Биохимические параметры поражения печени в исследуемых группах лошадей.
Таблица 3. Данные гематологических показателей крови лошадей.
Таблица 4. Данные биохимических показателей сыворотки крови лошадей.
Возможность осуществления изобретения и эффективность его применения поясняется примерами.
Пример 1. Получение препарата на основе экстракта МСК жировой ткани лошади (как выделенных de novo так и деконсервированных) и кондиционной среды, образующейся в процессе роста данных клеток.
Мезенхимальные стволовые клетки получали из подкожной жировой ткани лошади: под местной анестезией делали кожный разрез длиной 2-4 см, из места разреза отбирали небольшой кусок подкожного жира объемом 0,5-1,0 мл, помещали в пробирку с буферным раствором Dulbecco's Phosphate Buffered Saline (PBS) (Biowest, USA), содержащим гентамицин (80 мкг/мл, Биолот, Россия). Жировую ткань фрагментировали до однородной массы, используя стерильные инструменты, после чего подвергали ступенчатой ферментативной обработке. Ферментативную обработку выполняли следующим образом: к измельченной жировой ткани добавляли питательную среду DMEM high glucose (Biowest, USA) с добавлением антибиотика и антимикотика, а также фермента трипсина (Biowest, USA) до конечной концентрации 0,1-0,15%, выдерживали 30±5 минут при температуре 37±1°С и постоянном перемешивании на магнитной мешалке, затем среду с клетками фильтровали через нейлоновые мембраны с размером пор 100 мкм (BD) и добавляли 0,2-0,5% ФБС (Sigma-Aldrich, USA) для инактивации трипсина. Повторяли описанную операцию дважды со снижением времени инкубации до 15±5 минут.
После фильтрации клеточную суспензию центрифугировали в течение 10 мин при 1200 об/мин, супернатант полностью удаляли. Полученный осадок ресуспендировали в питательной среде DMEM high glucose (Biowest, USA) с 10% ФБС (Sigma-Aldrich, USA), после чего клетки высевали в культуральные флаконы (70±5 мл клеточной суспензии/флакон) с площадью ростовой поверхности 175 см2 (SPL, Корея) с концентрацией 1×106 кл/мл и культивировали при 37°С с 5%-ной концентрацией СО2.
Спустя сутки после начала культивирования производили ополаскивание средой с антибиотиком для удаления неприкрепившихся клеток и производили замену ростовой среды. В дальнейшем замену среды выполняли раз в 3-4 суток. По достижении конфлюентности монослоя (контролируется визуально при помощи инвертированного микроскопа) не менее 85% его дезагрегировали диспергирующим раствором (0,05-0,1% трипсина (Biowest, USA) в растворе Версена (ПанЭко, Россия)) и проводили посев в новые культуральные флаконы с коэффициентом пересева 1:3.
Для получения кондиционной среды культуру вели в течение 3-4 пассажей, затем выполняли посев в культуральные флаконы из расчета 5-15×103 клеток на 1 см2 площади ростовой поверхности в 90±5 мл ростовой среды и культивировали в описанных выше условиях до достижения необходимой концентрации интерлейкинов в среде.
При достижении необходимой концентрации биологически активных веществ кондиционную среду, содержащую все продукты секреции МСК, собирали в стерильные центрифужные пробирки, очищали путем центрифугирования при 3000 об/мин и температуре 5±1°С в течение 10 минут от клеточного дебриса.
Полученная кондиционная среда может использоваться непосредственно по назначению или храниться в течение продолжительного времени в определенных условиях (до семи суток - при температуре 3±1°С, более длительно хранение требует температуры не выше минус 20°С).
После сбора кондиционной среды, получали экстракт МСК КМ: клеточный монослой, при конфлюентности не менее 90% дезагрегировали указанным выше диспергирующим раствором добавляли 0,9%-й раствор хлорида натрия (5-10 мл на 1 культуральный флакон), подвергали замораживанию при температуре минус 20±2°С, после чего выполняли оттаивание при комнатной температуре. Полученный экстракт МСК КМ собирали в стерильные центрифужные пробирки, очищали от клеточного дебриса путем центрифугирования при 3000 об/мин и температуре 5±3°С в течение 10 минут.
Для получения регенеративного препарата осадок после центрифугирвания, представляющий собой экстракт МСК КМ, объединяли с кондиционной средой, добавляли глицин (до конечной концентрации 20 мг/мл), разливали во флаконы по 1 мл и лиофильно высушивали.
Так, к концу четвертой недели от начала культивирования МСК КМ лошадей можно получить до 3000 мл (при посевной концентрации на этапе выделения не менее 1×106 кл/мл) раствора для лиофилизации на основе экстракта и кондиционной среды МСК КМ, который может быть использован для приготовления препарата, стимулирующего регенеративные процессы организма животного.
Пример 2. Специфическая активность препарата на основе экстракта и кондиционной среды культуры МСК (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани лошадей, на модели in vitro.
Первичные дермальные фибробласты лошадей третьего пассажа, высеивали в 12-луночные культуральные планшеты (SPL, Германия) с добавлением в ростовую среду с различной концентрацией (1%, 5%, 10%) исследуемого регенеративного препарата и культивировали в течение трех суток в стандартных условиях (инкубировали во влажной камере в СO2-инкубаторе при 37°С и 5% СO2) с добавлением 10% ФБС (Sigma-Aldrich, USA) к среде 199 (ГУЛ ИПВЭ им. М.П. Чумакова, Россия). Посевная концентрация клеток - 8-10×104 кл/мл среды. В качестве контроля использовали клетки, выращенные в ростовой среде без добавления регенеративного препарата.
По окончании инкубации проводили снятие культуры дермальных фибробластов лошадей с поверхности пластика и определение пролиферативного индекса. Индекс пролиферации определяли как отношение количества клеток в 1 мл суспензии, полученной в результате снятия клеток с подложки по достижении конфлюентности монослоя к посевной концентрации клеток (количество клеток в мл раствора при посеве на культуральные планшеты).
Полученные данные (табл. 1 и график 1) свидетельствуют о повышении уровня пролиферативных свойств клеток модельной культуры при добавлении в ростовую среду регенеративного препарата на основе экстракта и кондиционной среды МСК (как выделенных de novo, так и деконсервированных) лошади на 9-83% в зависимости от концентрации, в которой исследуемый препарат добавлялся в ростовую среду, по сравнению с контролем, при этом наблюдалась линейная зависимость между концентрацией препарата и значением индекса пролиферации (ИП).
Пример 3. Исследование гепатопротекторных свойств препарата на основе экстракта и кондиционной среды культуры мезенхимальных стволовых клеток (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани лошадей.
Регенеративное действие препарата на основе экстракта и кондиционной среды культуры мезенхимальных стволовых клеток костного мозга или жировой ткани было изучено на модели острого поражения печени (МОПП) крыс (in vivo). Модель острого поражения печени была выполнена путем однократного введения крысам в желудок через зонд парацетамола (N-(4-гидроксифенил)ацетамида) в виде суспензии в дозе 700 мг на 1 кг массы тела. Процедура лечения после МОПП заключалась в ежедневном внутримышечном введении 0,5 мл исследуемого препарата животным опытной группы в течение 5 дней. В качестве контроля использовали крыс с МОПП, которые не подвергались терапевтическим воздействиям.
Спустя сутки после окончания курса лечения крыс выводили из эксперимента путем декапитации, предварительно обеспечив наркоз за счет внутрибрюшинного введения хлоралгидрата в дозе 400 мг на 1 кг массы тела животного. В сыворотке крови определили активность ферментов аспартат-(АсТ) и аланинаминотрансферазы (АлТ) с помощью стандартного набора Vital и содержание общего белка - биуретовым методом. Исследованные биохимические параметры отражают функциональное состояние печени. Ферменты АсТ и АлТ присутствуют в значительных количествах в печени и почках, поэтому в норме концентрации АсТ и АлТ в крови невелики. При повреждении гепатоцитов происходит потеря ферментов АсТ и АлТ, и концентрация этих биохимических маркеров в крови возрастает. Изменение уровня общего белка (признак грубой патологии печени) не наблюдалось.
Результаты исследования (табл. 2 и графики 2-4) показывают, что применение предлагаемого регенеративного препарата на основе экстракта и кондиционной среды МСК, как полученных de novo из костного мозга и жировой ткани, так и деконсервированных, приводило к значительному улучшению состояния животных с ОПП, что подтверждается концентрацией исследованных маркеров повреждения печени (показатели уровней АсТ, АлТ). Так, концентрации указанных ферментов в группе животных, получавших регенеративный препарат, значимо не отличались от показателей в группе интактных крыс (не подвергшихся МОПП).
Таким образом, регенеративный препарат на основе экстракта и кондиционной среды МСК обладает выраженным терапевтическим эффектом при остром поражении печени животных. Существенных различий в эффективности препарата на основе кондиционной среды и экстракта мезенхимальных стволовых клеток, полученных из различных источников, также не было выявлено.
Пример 4. Влияние регенеративного препарата на основе экстракта и кондиционной среды культуры МСК (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани лошади на ранозаживление на модели механической раны у мышей in vivo.
Другая модель, использованная для изучения регенеративной активности препарата in vivo, представляет собой модель глубокой механической раны, края которой для предупреждения стягивания были подшиты к пластиковому кольцу. Препарат вводили на ранних этапах раневого процесса (в течение первых 5 дней после моделирования раны) в виде подкожных инъекций. Исследование проводили на 30 белых беспородных мышах (15 мышей - группа контроля (без лечения), 15 мышей - опытная группа, которой подкалывали исследуемый препарат).
Спустя 5 дней после моделирования ран у животных опытной группы в ране отсутствовал фибрин, экссудация и гиперемия окружающих тканей были слабо выражены, отмечалось набухание краев раны, что свидетельствовало о стихании воспаления. Смещение пика фазы воспаления в опытной группе на более ранний срок наиболее вероятно связано с действием факторов роста и цитокинов, содержащихся в исследуемом препарате. К концу фазы пролиферации на 14 сутки от начала эксперимента в контрольной группе наблюдали продолжающийся процесс эпителизации раневой поверхности, тогда как у животных опытной группы отмечали полное заживление раны и признаки процесса ремоделирования тканей, что указывало на более высокие темпы регенерации при использовании исследуемого препарата.
Пример 5. Исследование аномальной токсичности предлагаемого препарата
Испытания на аномальную токсичность исследуемого препарата проводили на белых мышах массой от 19 до 21 г. Препарат, подогретый до 37°С, вводили внутрибрюшинно в количестве 0,5 мл 20-ти мышам. Наблюдение за состоянием здоровья животных осуществляли в течение 7 суток. Считали, что образец выдерживает испытание, если в течение срока наблюдения не погибнет ни одно животное. Заявленный препарат не вызывал у животных признаков токсичности или других побочных признаков.
Пример 6. Изучение влияния на адаптацию лошадей к спортивным нагрузкам регенеративного препарата на основе экстракта и кондиционной среды культуры МСК (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани на организм лошадей.
Изучение влияния препарата на организм лошадей проводили на 10 лошадях. Животным опытной группы (5 лошадей) на протяжении всего эксперимента вводили заявленный препарат по 2 мл внутримышечно через каждые 3-е суток. Животные контрольной группы (5 лошадей) препарат не получали. Все животные получали активную физическую нагрузку. Наблюдение за состоянием здоровья лошадей осуществляли в течение 30 дней. Контрольный осмотр животных и взятие крови с определением основных биохимических и гематологических показателей проводили до начала опыта и на 30-й день.
Показатели крови в обеих группах животных остались в пределах нормы по завершении испытаний (табл. 3).
По окончании испытаний у животных опытной группы все показатели остались в пределах нормы. У животных контрольной группы наблюдалось повышение активности ферментов печени (АлТ - на 47,96%, АсТ - на 28,57%, ГГТ - на 28,5%), что говорит о значительной некомпенсированной нагрузке на печень. Кроме того, снизилось среднее содержание креатинина (на 24,78%) и глюкозы (18,87%) в сыворотке крови, что указывает на повышенную усталость скелетной мускулатуры у животных (табл. 4). Таким образом, применение предлагаемого препарата значительно ускоряет адаптацию организма к спортивным нагрузкам и способствует восстановлению животных после нагрузки в оптимальные сроки.
Пример 7. Терапевтическая эффективность регенеративного препарата на основе экстракта и кондиционной среды культуры МСК (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани лошадей.
1. Вороной жеребец по кличке «Красавчик», 4 года. Сухая экзема кожи в области поясницы (7,3×10,5 см) с выпадением шерстного покрова.
Лечение: ежедневные инъекции предлагаемого препарата по 2 мл внутримышечно в комплексе с (уже применяемыми ранее) повязками с левомеколем. Генерация экземного слоя эпителия кожи прекратилась на 5-е сутки, на 10-е сутки наблюдали рост шерсти на поврежденном участке кожи.
2. Кобыла по кличке «Фанта», 6 лет, травмирована - рвано-ушибленная рана в области крупа, размер раны примерно 9 на 15 см, отсутствует участок кожи. Частично задет мышечный слой. Рану обрабатывали раствором фурациллина. Исследуемый препарат вводили под основание раны в нескольких точках в дозе 2 мл в течение 5 дней. Заживление раны происходило по первичному натяжению. Было отмечено образование ровной грануляции по краям раны с постепенным перемещением к центру. Отмечено восстановление кожного покрова на 12 день.
3. Гнедой жеребец по кличке «Палермо», 11 месяцев, стал хромать на переднюю левую ногу. Диагноз - повреждение сухожилия поверхностного сгибателя левой передней ноги. Лечение: внутримышечные инъекции заявленного препарата в дозе 0,1 мл на 10 кг веса животного в течение 5 дней. На третьи сутки лошадь осторожно начала ступать на травмированную ногу, через 2 недели было отмечено восстановление целостности сухожилия.
4. Гнедой мерин по кличке «Норд», 6 лет, нарушение работы желудочно-кишечного тракта. Применяли заявленное средство в виде внутримышечных инъекций в течение 5 дней в дозе 0,01 мл на 1 кг живой массы. На 2 день лечения у животного значительно улучшился аппетит и перевариваемость корма, на 4-5 день - исчезли явления дисфункции со стороны желудочно-кишечного тракта и признаки утомляемости после работы, животное стало энергичнее.
5. Кобыла по кличке "Аерис" 10 лет. Диагноз энтероколит, сопровождающийся постоянными поносами с выделением жидкого кала и периодическими явлениями колик. Симптоматическое лечение, которое лошадь получала в течение 3 недель, не дало результатов. Назначили заявленное средство в виде внутримышечных инъекций в течение 7 дней в дозе 0,01 мл на 1 кг живой массы. На 4-е сутки диарея прекратилась, кал сформировался, колики исчезли, на 8-е - наступило выздоровление.
6. Жеребец "Дюранго" 3 года. Диагноз альвеолярная энфизема легких, сопровождающаяся кашлем, напряженным дыханием, хрипами, сильным утомлением, учащенным пульсом. Назначили заявленное средство в виде внутримышечных инъекций в течение 7 дней в дозе 0,01 мл на 1 кг живой массы. В результате симптомы, характерные для энфиземы легких, исчезли. Появился аппетит, повысился общий тонус, лошадь приступила к работе.
Таким образом, заявляемый препарат показывает терапевтический эффект во всех наблюдаемых случаях применения, обеспечивает нормализацию состояния лошадей, страдающих нарушениями желудочно-кишечного тракта, кожных покровов и опорно-двигательного аппарата, для адаптации животных к физическим нагрузкам, а также не вызывает у животных признаков токсикоза или других побочных признаков.
Рекомендации по применению предлагаемого препарата
Препарат был испытан при адаптациях лошадей к спортивным нагрузкам, травмах кожи и опорно-двигательного аппарата, расстройств со стороны желудочно-кишечного тракта и дыхательной системы у лошадей, при этом было доказано, что изобретение обладает выраженной регенеративной, тонизирующей, противовоспалительной, иммуностимулирующей и адаптогенной активностью. Ввиду сказанного данный препарат может быть использован в терапии для лечения дегенеративных заболеваний (цирроза печени, фиброза легких и др.), в послеоперационный период, для улучшения качества жизни стареющих животных, при острых и хронических заболеваниях кожи, а также для адаптации лошадей к спортивным нагрузкам.
Заявленный препарат рекомендовано применять путем внутримышечных или внутривенных инъекций один раз в день в течение 3-7 дней ежедневно. При необходимости курс повторить через 3-4 дня.
Источники информации
1. Иммуномодулятор-метаболик-детоксикант-адаптоген-радиопротектор. Патент на изобретение №2194502. Приор. 27.12.2000.
2. Дыгай A.M., Зюзьков Г.Н. Клеточная терапия: новые подходы // Наука в России. - Москва: Изд-во «Наука», 2009. - Том. 169. - №1. С. 4-8.
3. Гольдберг Е.Д., Дыгай A.M., Жданов В.В., Зюзьков Г.Н., Мирошниченко Л.А., Симанина Е.В., Ставрова Л.А., Удут Е.В., Фонима Т.Н., Ветошкина Т.В., Хричкова Т.Ю., Ермакова Н.Н., Плотников М.Б., Алиев О.И., Чернышова Г.А. Фармакологические аспекты регенеративной медицины // Бюл. эксперим. биол. и медицины. - 2008. - Приложение 2. - С. 14-21.
4. Патофизиология: Учебник для медицинских ВУЗов. / Под ред. В.В. Новицкого, Е.Д. Гольдберга. - Томск: Изд-во Томского ун-та, 2001. - 681-687.
5. Дыгай A.M., Зюзьков Т.Н., Жданов В.В., Мадонов П.Г., Артамонов А.В., Бекарев А.А., Удут В.В. Иммобилизированный гранулоцитарный колониестимулирующий фактор. Фармакологические свойства и перспективы использования. - Томск: Изд-во: ООО «Печатная мануфактура», 2011. - 149 с.
6. Патент РФ №2005475 С1, 01.10.91.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ КОШЕК, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2646791C1 |
| СРЕДСТВО ДЛЯ СОБАК, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2646793C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕГЕНЕРАТИВНОГО ВЕТЕРИНАРНОГО ПРЕПАРАТА НА ОСНОВЕ ЭКСТРАКТА МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И КОНДИЦИОННОЙ СРЕДЫ | 2016 |
|
RU2662172C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОВОСПАЛИТЕЛЬНОЙ, РЕГЕНЕРАТИВНОЙ, ИММУНОМОДУЛИРУЮЩЕЙ, ДЕТОКСИКАЦИОННОЙ, АДАПТОГЕННОЙ АКТИВНОСТЬЮ И СПОСОБНОГО РЕГУЛИРОВАТЬ МЕТАБОЛИЗМ | 2018 |
|
RU2720812C1 |
| СРЕДСТВО ДЛЯ КРУПНОГО РОГАТОГО СКОТА, ОБЛАДАЮЩЕЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ, РЕГЕНЕРАТИВНОЙ, ИММУНОМОДУЛИРУЮЩЕЙ, ДЕТОКСИКАЦИОННОЙ, АДАПТОГЕННОЙ АКТИВНОСТЬЮ И СПОСОБНОЕ РЕГУЛИРОВАТЬ МЕТАБОЛИЗМ | 2018 |
|
RU2720800C1 |
| МАТЕРИАЛ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2785588C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2620167C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ПОРАЖЕНИЙ ТКАНЕЙ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2012 |
|
RU2522778C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| Способ лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга | 2020 |
|
RU2748539C1 |
Изобретение относится к ветеринарии, в частности к ветеринарной терапии, и может быть использовано для стимуляции регенеративных процессов в организме лошади. Средство состоит из экстракта мезенхимальных стволовых клеток (МСК) и кондиционной среды, получаемой в процессе культивирования МСК, при этом средство получено с использованием следующих этапов: выделение de novo или деконсервирование культуры МСК из костного мозга или жировой ткани лошадей, культивирование и накопление МСК, получение и сбор кондиционной среды, получение экстракта МСК путем замораживания-оттаивания клеточной суспензии, добавление глицина в концентрации 20 мг/мл к смеси экстракта МСК и кондиционной среды, стерилизация, розлив во флаконы, лиофильная сушка. Изобретение может быть использовано в клинической практике при лечении травм кожи и опорно-двигательного аппарата, расстройств со стороны желудочно-кишечного тракта и дыхательной системы у лошадей, для улучшения уровня жизни стареющих животных. Также средство способствует адаптации лошадей к спортивным нагрузкам. При этом средство стабильно за счет добавления указанной концентрации глицина. 4 ил., 4 табл., 7 пр.
Средство для лошадей, обладающее регенеративной активностью, состоящее из экстракта мезенхимальных стволовых клеток (МСК) и кондиционной среды, получаемой в процессе культивирования МСК, при этом средство получено с использованием следующих этапов: выделение de novo или деконсервирование культуры МСК из костного мозга или жировой ткани лошадей, культивирование и накопление МСК, получение и сбор кондиционной среды, получение экстракта МСК путем замораживания-оттаивания клеточной суспензии, добавление глицина в концентрации 20 мг/мл к смеси экстракта МСК и кондиционной среды, стерилизация, розлив во флаконы, лиофильная сушка.
| КОМПОЗИЦИИ И СПОСОБЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ УСКОРЕНИЯ ЗАЖИВЛЕНИЯ РАН И РЕГЕНЕРАЦИИ ТКАНЕЙ | 2005 |
|
RU2438696C2 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И РЕГЕНЕРАЦИИ КЛЕТОК, А ТАКЖЕ СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2341270C2 |
| US 20100273141 A1, 28.10.2010 | |||
| СПОСОБ СТИМУЛЯЦИИ РОСТА И ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2012 |
|
RU2495565C1 |
| SIMONE PACINI et al | |||
| Suspension of Bone Marrow-Derived Undifferentiated Mesenchymal Stromal Cells for Repair of Superficial Digital Flexor Tendon in Race Horses./Tissue engineering | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Насос | 1917 |
|
SU13A1 |
| Сетчатое изголовье | 1925 |
|
SU2949A1 |
Авторы
Даты
2018-03-07—Публикация
2016-12-13—Подача