Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для профилактики и лечения аллергических заболеваний и ее применению.
Уровень техники
В заявке на выдачу патента CN № 1509760 А раскрыто лекарственное средство для профилактики и дополнительного лечения злокачественной опухоли, полученное из сырьевых материалов: порошка ферментированного Cordyceps sinensis, Ganoderma и Fructus Lycii, которое действует для усиления иммунитета и регулирования эндокринной системы, а также играет роль в очищении организма от вредных свободных радикалов и профилактики рецидива опухоли. В заявке на выдачу патента СN № 102228252 A раскрыта композиция традиционной китайской медицины, содержащая 5-150 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, 5-160 частей по массе Ganoderma и 1-90 частей по массе порошка ферментированного Cordyceps sinensis, которая действует для облегчения физического утомления. В заявке на выдачу патента CN № 102000129 А раскрыта фармацевтическая композиция, содержащая Cordyceps polysaccharides или порошок ферментированного Cordyceps sinensis, Ganoderma и Radix Panacis Quinquefolii, которая действует для усиления иммунитета. Вплоть до настоящего времени ни одно исследование или литературный источник не продемонстрировали, что композиция, полученная из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, действует для профилактики и лечения аллергических заболеваний.
Раскрытие изобретения
Целью настоящего изобретения является обеспечение композиции для профилактики и лечения аллергических заболеваний и способа их получения.
Согласно настоящему изобретению авторы настоящего изобретения выбрали и скомбинировали сырьевые материалы Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, и авторы настоящего изобретения неожиданно обнаружили, что такая композиция или полученные из нее продукты были способны к обеспечению профилактики и лечения аллергических заболеваний.
Настоящее изобретение предусматривает применение композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, композиции, полученной из сырьевых материалов, предусматривающих Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергических заболеваний.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: Flos Rosae Rugosae, порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali к композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергических заболеваний.
Настоящее изобретение дополнительно предусматривает применение композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергических заболеваний.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергических заболеваний.
Настоящее изобретение дополнительно предусматривает применение композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического ринита.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: Flos Rosae Rugosae, порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического ринита.
Предусмотрено применение композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического ринита.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического ринита.
Настоящее изобретение дополнительно предусматривает применение композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического дерматита.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: Flos Rosae Rugosae, порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического дерматита.
Предусмотрено применение композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического дерматита.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергического дерматита.
Настоящее изобретение дополнительно предусматривает применение композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения крапивницы.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: Flos Rosae Rugosae, порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения крапивницы.
Предусмотрено применение композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения крапивницы.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения крапивницы.
Настоящее изобретение дополнительно предусматривает применение композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергической бронхиальной астмы.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: Flos Rosae Rugosae, порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps, или к композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергической бронхиальной астмы.
Предусмотрено применение композиции, содержащей Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или композиции, полученной из Ganoderma, Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергической бронхиальной астмы.
Предусмотрено применение композиции, полученной путем добавления любого одного или нескольких компонентов: порошок из спор Ganoderma, масло из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali, к композиции, содержащей Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из сырьевых материалов, включающих в себя Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошок ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, или к композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и Flos Rosae Rugosae, в получении изделий медицинского назначения, лекарственных средств или продуктов для профилактики и лечения аллергической бронхиальной астмы.
Термин "продукты" в упомянутом выше выражении "изделия медицинского назначения, лекарственные средства или продукты" включают в себя то, что не включено в "изделия медицинского назначения" или "лекарственные средства", включая в себя любые изделия, использующие композицию согласно настоящему изобретению, например эфирные масла, продукты на основе ладана и подушки.
Предпочтительно композиция для применения согласно настоящему изобретению для профилактики и лечения аллергических заболеваний получают из следующих сырьевых материалов в частях по массе: 5-200 частей Ganoderma, 5-150 частей Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, 1-90 частей порошка ферментированного Cordyceps sinensis и/или 1-120 частей Cordyceps.
Предпочтительными являются 20-120 частей Ganoderma, 10-90 частей Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, 3-60 частей порошка ферментированного Cordyceps sinensis и/или 3-90 частей Cordyceps.
Более предпочтительными являются 40 частей Ganoderma, 30 частей Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, 20 частей порошка ферментированного Cordyceps sinensis и/или 6,7 частей Cordyceps.
Композиция для применения согласно настоящему изобретению может дополнительно содержать следующие дополнительные материалы, которые не оказывают негативное воздействие на эффективность настоящего изобретения, или водные и/или спиртовые экстракты указанных дополнительных материалов в частях по массе: один или несколько из 5-90 частей Flos Rosae Rugosae, 5-150 частей порошка из спор Ganoderma, 1-90 частей масла из спор Ganoderma, 10-400 частей Radix Pseudostellariae, 1-120 частей Folium Ginseng, 3-400 частей Radix Codonopsis и 3-400 частей Radix Astragali, или любая их комбинация.
Предпочтительными являются один или несколько из 10-60 частей Flos Rosae Rugosae, 10-120 частей порошка из спор Ganoderma, 10-60 частей масла из спор Ganoderma, 20-200 частей Radix Pseudostellariae, 20-90 частей Folium Ginseng, 20-200 частей Radix Codonopsis и 20-200 частей Radix Astragali, или любая их комбинация.
Более предпочтительными являются один или несколько из 30 частей Flos Rosae Rugosae, 30 частей порошка из спор Ganoderma, 20 частей масла из спор Ganoderma, 40 частей Radix Pseudostellariae, 30 частей Folium Ginseng, 40 частей Radix Codonopsis и 40 частей Radix Astragali, или любая их комбинация.
Предпочтительно композиция для применения согласно настоящему изобретению представляет собой композицию из 5-200 частей Ganoderma, 5-150 частей Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, 1-90 частей порошка ферментированного Cordyceps sinensis и/или 1-120 частей Cordyceps и 5-90 частей Flos Rosae Rugosae.
Более предпочтительными являются 20-120 частей Ganoderma, 10-90 частей Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, 3-60 частей порошка ферментированного Cordyceps sinensis и/или 3-90 частей Cordyceps, и 10-60 частей Flos Rosae Rugosae.
Более предпочтительными являются 40 частей Ganoderma, 30 частей Radix Panaris Quinquefolii или Radix Et Rhizoma Ginseng, 20 частей порошка ферментированного Cordyceps sinensis и/или 6,7 частей Cordyceps и 30 частей Flos Rosae Rugosae.
Согласно настоящему изобретению Folium Ginseng, Radix Pseudostellariae, Radix Codonopsis и/или Radix Astragali можно использовать вместо Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng.
Согласно другому аспекту настоящего изобретения предусмотрены упомянутые выше композиции.
Используемый в настоящем документе термин "Ganoderma" относится к сухому спорокарпию гриба вида Ganoderma lucidum (Leyss. ex Fr.) Karst. или Ganoderma sinense Zhao, Xu et Zhang семейства Polyporaceae. Он характеризуется сладким вкусом и ровной природой, вовлечен в функционирование каналов в сердце, легких, печени и почках и характеризуется эффектами в обеспечении физической силой и уравновешивании и успокоении ума. Используемый в настоящем документе термин "Radix Et Rhizoma Ginseng" относится к сухому корню и корневищу растения вида Panax ginseng С.А. Меу. семейства Araliaceae. Он может представлять собой различные типы женьшеня, такие как садовый женьшень, дикий женьшень, высушенный свежий женьшень, высушенный свежий дикий женьшень, обработанный сахаром женьшень и красный женьшень. Термин "Folium Ginseng" относится к сухим листьям растения вида Panax ginseng С.А. Меу. семейства Araliaceae. Используемый в настоящем документе термин "Radix Panacis Quinquefolii", также известный как американский женьшень, huaqishen, yangshen или guangdongshen, относится к сухому корню растения вида Panax quinquefolium L. семейства Araliaceae. Он характеризуется сладким и слегка горьким вкусом и холодной природой, вовлечен в функционирование каналов в сердце, легких и почках и характеризуется эффектами в активизации Ци, обеспечении питания Инь, очищении сердца и стимуляции продукции жидких сред организма. Используемый в настоящем документе термин "Cordyceps" относится к сухому комплексу из мертвых тел личинок насекомых семейства Hepialidae и стромы гриба вида Cordyceps sinensis (Berk.) sace. семейства Clavicipitaceae, паразитирующего на личинке.
Используемый в настоящем документе термин "порошок ферментированного Cordyceps sinensis" относится к продукту штаммов, которые изначально были выделены из природного Cordyceps Cordyceps sinensis (Berk.) sace. и были культивированы в условиях ферментации, причем штаммы могут представлять собой один из Paecilomyces hepialli Chen et Dai, sp.nov, Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov, Cephalosporium sinensis Chen sp.nov, Mortiscrslla hepialid C.T. & B. liu, Paecilomyces sinensis Chen, Xiao et Shi, sp.nov, Tolypocladium sinensis C. Ian Li, Cephalosporium sinens Chen sp.nov, Scytalidium hepialii C.L. Li, Chrysosporium sinens Z.Q. liang, Verticillium sinens Wamg sp.nov, Cephalosporium acremonium Corda, Icones Fungorum, Synnematium sinensis Yin & Shen, Isaria farinose (Holmsk.) Fr. Systema Mycologicum, Metarhizium anisopliae (Metsch) Sorokin, Hirsutella hepialid Chen et Shen, Sporothrix insectorum de Hong & H.C. Evans, Gliocladium roseum (link) Thom и Mortierella sp. или любую их комбинацию.
Штамм, из которого получают порошок ферментированного Cordyceps sinensis согласно настоящему изобретению, предпочтительно представляет собой один или несколько из Paecilomyces hepialli Chen et Dai, sp.nov, Mortiscrslla hepialid C.T. & B. liu, Synnematium sinensis Yin & Shen, Gliocladium roseum (link) Thom, Mortierella sp., Cephalosporium sinensis Chen sp.nov или Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov, или любую их комбинацию.
Используемый в настоящем документе термин "Flos Rosae Rugosae" относится к сухому бутону растения вида Rosa rugosa Thumb или Rose rugosacv. Plena семейства Rosaceae. Он характеризуется острым, сладким и слегка горьким вкусом и теплой природой и представляет собой лекарственное средство теплой природы. Его наиболее значительные эффекты заключаются в активации течения Ци, устранении застоя крови, гармонизации кровеносной системы и облегчении боли.
Термин "Radix Codonopsis" относится к сухому корню растения вида Codonopsis pilosula (Franch.) Nannf., Codonopsis pilosula Nannf. var. modesta (Nannf.) L.T. Shen, или Codonopsis tangshen Oliv. семейства Campanulaceae.
Используемый в настоящем документе термин "Radix Pseudostellariae" относится к сухому клубневидному корню растения вида Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm. семейства Cargophyllaceae.
Термин "Folium Ginseng" относится к сухим листьям растения вида Panax ginseng С.А. Меу. семейства Araliaceae.
Термин "Radix Astragali" относится к сухому корню растения вида Astragalus membranaceus (Fisch) Bge. var. Mongholicus (Bge) Hsiao или Astragalus membranaceus (Fisch) Bge. семейства Fabaceae.
Порошок из спор Ganoderma согласно настоящему изобретению представляет собой предпочтительно порошок из спор Ganoderma с разрушенной спородермой.
Порошок из спор Ganoderma согласно настоящему изобретению представляет собой половые репродуктивные клетки Ganoderma, т.е. порошок из базидиоспор.
Масло из спор Ganoderma согласно настоящему изобретению представляет собой маслянистое жидкое вещество, экстрагированное из порошка из спор Ganoderma.
Способ получения композиции согласно настоящему изобретению предусматривает прямое смешивание сырьевых материалов в частях по массе; или смешивание сырьевых материалов в частях по массе и их экстрагирование водой и/или спиртом для получения композиции; или экстрагирование одного или нескольких сырьевых материалов водой и/или спиртом и применение экстракта в качестве активного ингредиента для получения композиции.
Спирт согласно настоящему изобретению представляет собой метанол или этанол; метанол может содержаться в концентрации, составляющей 5-95%, и этанол может содержаться в концентрации, составляющей 5-95%.
Способ получения водных и/или спиртовых экстрактов сырьевых материалов для композиции традиционной китайской медицины согласно настоящему изобретению предусматривает следующие стадии:
1) взвешивание традиционных китайских лекарственных средств в качестве сырьевых материалов; и
2) экстрагирование сырьевых материалов с обратным холодильником с помощью спирта или воды для получения жидкого экстракта в качестве активного ингредиента и добавление вспомогательного(ых) средства (средств) для получения различных лекарственных форм.
Способ получения водных и/или спиртовых экстрактов сырьевых материалов для композиции традиционной китайской медицины согласно настоящему изобретению может предусматривать следующие стадии:
1) взвешивание традиционных китайских лекарственных средств в качестве сырьевых материалов, добавление к ним метанола или этанола для проведения экстракции, извлечение метанола или этанола из экстракционной жидкости для получения экстракта I;
2) выпаривание спирта из остаточных лекарственных средств, добавление воды для проведения экстракции для получения экстракта II; и
3) комбинирование экстракта I и экстракта II, проведение фильтрации, концентрирование фильтрата до соответствующего количества, добавление фармацевтически принятого(ых) вспомогательного(ых) средства (средств) для получения требуемого состава с помощью фармацевтически принятого способа.
Способ получения водных и/или спиртовых экстрактов сырьевых материалов для композиции традиционной китайской медицины согласно настоящему изобретению может предусматривать следующие стадии:
1) получение сырьевого материала: взвешивание традиционных китайских лекарственных средств в качестве сырьевых материалов;
2) экстракция и концентрация: замачивание сырьевых материалов на основе китайских лекарственных средств, обработанных на стадии 1) в воде, затем отваривание несколько раз путем нагревания, комбинирование жидких экстрактов для проведения фильтрации, концентрирование фильтрата до соответствующего количества, охлаждение концентрата и воздействие на него с помощью высокоскоростного центрифугирования для удаления примесей и хранение продукта до использования;
3) получение состава: введение концентрата, полученного на стадии 2), отдельно или вместе с медицински приемлемым(и) вспомогательным(и) средством(ами), в требуемый состав с помощью фармацевтически принятого способа;
причем на стадии 2) выше сырьевые материалы замачивают в течение 20-60 мин, затем отваривают 1-3 раза путем нагревания для экстракции, причем каждое отваривание длится в течение 1-2 ч и характеризуется 6-13-кратным количеством добавленной воды.
Композиция согласно настоящему изобретению может быть получена в любой лекарственной форме путем добавления вспомогательного средства или вспомогательного вещества, приемлемого в изделиях медицинского назначения, лекарственных средствах или продуктах.
Лекарственная форма может представлять собой любую одну из следующего: таблетка, жидкость для перорального применения, гранула, капсула, электуарий, драже с повышенной биодоступностью, драже, порошок, леденец, жидкий экстракт, экстракт, инъекция и сироп.
Для обеспечения лучшего понимания сущности настоящего изобретения эксперименты на животных с применением фармацевтической композиции, полученной из Ganoderma, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps и фармацевтической композиции, полученной из Ganoderma, Flos Rosae Rugosae, Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, порошка ферментированного Cordyceps sinensis и/или Cordyceps, а также их результаты, описаны ниже в настоящем документе для демонстрации эффективности композиции согласно настоящему изобретению в профилактике и лечении аллергических заболеваний, аллергического ринита, аллергического дерматита, крапивницы и аллергической бронхиальной астмы.
Аналогично, добавление любого одного или нескольких из порошка из спор Ganoderma, масла из спор Ganoderma, Ginseng, Radix Pseudostellariae, Radix Codonopsis и Radix Astragali или любой их комбинации, также может привести к таким же фармакологическим действиям.
Подробное раскрытие настоящего изобретения
Пример 1
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 67 г Cordyceps, 200 г порошка ферментированного Cordyceps sinensis (Paecilomyces hepialli Chen et Dai, sp.nov) и 300 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 1 ч и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; к полученному добавляли вспомогательное(ые) средство(а), часто используемое(ые) для жидкости для перорального применения, и однородно перемешивали, и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 2
Взвешивали 300 г Radix Panaris Quinquefolii, 400 г Ganoderma, 200 г порошка ферментированного Cordyceps sinensis (Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov) и 300 г Flos Rosae Rugosae. Radix Panaris Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Каждое отваривание продолжалось в течение 1 ч с 10-кратным количеством добавленной воды. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 3
Взвешивали 2 кг Ganoderma, 1,5 кг Radix Panacis Quinquefolii и 1 кг порошка ферментированного Cordyceps sinensis. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные три лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 13-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали. Фильтрат концентрировали для получения прозрачной пасты, которую затем высушивали распылением для получения композиционного порошка. Полученную композицию, обозначенную как композиция 3, применяли в описанных ниже экспериментах по эффективности.
Пример 4
Взвешивали 4 кг Ganoderma, 3 кг Radix Panacis Quinquefolii, и 0,67 кг Cordyceps. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные три лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 13-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали. Фильтрат концентрировали для получения прозрачной пасты, которую затем высушивали распылением для получения композиционного порошка. Полученную композицию, композицию 4, применяли в описанных ниже экспериментах по эффективности.
Пример 5
Взвешивали 4 кг Ganoderma, 3 кг Radix Panacis Quinquefolii, 0,67 кг Cordyceps и 2 кг порошка ферментированного Cordyceps sinensis. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 13-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали. Фильтрат концентрировали для получения прозрачной пасты, которую затем высушивали распылением для получения композиционного порошка. Полученную композицию, композицию 5, применяли в описанных ниже экспериментах по эффективности.
Пример 6
Взвешивали 2,0 кг Ganoderma, 1,5 кг Radix Panacis Quinquefolii, 1,0 кг порошка ферментированного Cordyceps sinensis (Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov) и 1,5 кг Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 13-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали. Фильтрат концентрировали для получения прозрачной пасты, которую затем высушивали распылением для получения композиционного порошка. Полученную композицию, композицию 6, применяли в описанных ниже экспериментах по эффективности.
Пример 7
Взвешивали 1,5 кг Radix Panacis Quinquefolii, 2,0 кг Ganoderma, 0,33 кг Cordyceps и 1,5 кг Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 13-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали. Фильтрат концентрировали для получения прозрачной пасты, которую затем высушивали распылением для получения композиционного порошка. Полученную композицию, композицию 7, применяли в описанных ниже экспериментах по эффективности.
Пример 8
Взвешивали 2,0 кг Ganoderma, 1,5 кг Radix Panacis Quinquefolii, 0,33 кг Cordyceps, 1,0 кг порошка ферментированного Cordyceps sinensis (Paecilomyces hepialli Chen et Dai, sp.nov) и 1,5 кг Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок вместе с порошком ферментированного Cordyceps sinensis. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 13-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали. Фильтрат концентрировали для получения прозрачной пасты, которую затем высушивали распылением для получения композиционного порошка. Полученную композицию, композицию 8, применяли в описанных ниже экспериментах по эффективности.
Пример 9
Взвешивали 150 г Radix Panacis Quinquefolii, 90 г порошка ферментированного Cordyceps sinensis (Hirsutella hepialid Chen et Shen), 120 г Cordyceps, 200 г Ganoderma и 90 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 1 ч и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч, с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 10
Взвешивали 500 г Radix Et Rhizoma Ginseng, 100 г порошка ферментированного Cordyceps sinensis (Synnematium sinensis Yin & Shen), 500 г Ganoderma и 500 г Flos Rosae Rugosae. Radix Et Rhizoma Ginseng и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis и Flos Rosae Rugosae помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 11
Взвешивали 500 г Radix Panacis Quinquefolii, 100 г порошка ферментированного Cordyceps sinensis (Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov), 500 г Ganoderma и 500 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis и Flos Rosae Rugosae помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 12
Взвешивали 150 г Radix Panacis Quinquefolii, 120 г Cordyceps, 200 г Ganoderma и 90 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 13
Взвешивали 150 г Radix Et Rhizoma Ginseng, 90 г порошка ферментированного Cordyceps sinensis (Gliocladium roseum (link) Thom), 200 г Ganoderma и 90 г Flos Rosae Rugosae. Radix Et Rhizoma Ginseng и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 1 ч и отваривали дважды путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и второе отваривание продолжающееся в течение 1,5 ч с 10-кратным количеством добавленной воды. Два жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 14
Взвешивали 150 г Radix Panacis Quinquefolii, 90 г порошка ферментированного Cordyceps sinensis (Hirsutella hepialid Chen et Shen), 120 г Cordyceps, 200 г Ganoderma и 90 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 1 ч и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 15
Взвешивали 100 г Radix Panacis Quinquefolii, 30 г Cordyceps, 200 г Ganoderma и 100 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 16
Взвешивали 150 г Radix Panacis Quinquefolii, 30 г порошка ферментированного Cordyceps sinensis (Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov), 200 г Ganoderma и 100 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 1 ч и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 17
Взвешивали 90 г Radix Panacis Quinquefolii, 90 г Cordyceps, 120 г Ganoderma и 60 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Каждое отваривание продолжалось в течение 1 ч с 10-кратным количеством добавленной воды. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 18
Взвешивали 90 г Radix Et Rhizoma Ginseng, 90 г Cordyceps, 120 г Ganoderma и 60 г Flos Rosae Rugosae. Radix Et Rhizoma Ginseng и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Каждое отваривание продолжалось в течение 1 ч с 10-кратным количеством добавленной воды. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 19
Взвешивали 90 г Radix Panacis Quinquefolii, 60 г порошка ферментированного Cordyceps sinensis (Cephalosporium sinensis Chen sp.nov), 120 г Ganoderma и 60 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Каждое отваривание продолжалось в течение 1 ч с 10-кратным количеством добавленной воды. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 20
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 67 г Cordyceps и 300 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 1 ч и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; к полученному добавляли часто используемые для таблеток вспомогательные средства и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток.
Пример 21
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 200 г порошка ферментированного Cordyceps sinensis (Paecilomyces hepialli Chen et Dai, sp.nov) и 300 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Каждое отваривание продолжалось в течение 1 ч с 10-кратным количеством добавленной воды. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 22
Взвешивали 500 г Radix Panacis Quinquefolii, 100 г Cordyceps, 500 г Ganoderma, 500 г Flos Rosae Rugosae и 500 г порошка из спор Ganoderma с разрушенной спородермой. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для таблеток вспомогательные средства и порошок из спор Ganoderma с разрушенной спородермой добавляли к полученному и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток.
Пример 23
Взвешивали 500 г Radix Et Rhizoma Ginseng, 100 г порошка ферментированного Cordyceps sinensis (Paecilomyces sinensis Chen, Xiao et Shi, sp.nov), 500 г Ganoderma, 500 г Flos Rosae Rugosae и 500 г порошка из спор Ganoderma с разрушенной спородермой. Radix Et Rhizoma Ginseng и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis и порошок из спор Ganoderma с разрушенной спородермой помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для гранул вспомогательные средства добавляли к полученному и однородно перемешивали; и гранулы получали с помощью общепринятых способов получения таблеток.
Пример 24
Взвешивали 150 г Radix Panacis Quinquefolii, 90 г порошка ферментированного Cordyceps sinensis (Tolypocladium sinensis C. Ian Li), 200 г Ganoderma, 90 г Flos Rosae Rugosae и 150 г порошка из спор Ganoderma с разрушенной спородермой. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для таблеток вспомогательные средства и порошок из спор Ganoderma добавляли к полученному и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток.
Пример 25
Взвешивали 500 г Radix Panacis Quinquefolii, 100 г Cordyceps, 500 г Ganoderma, 500 г Flos Rosae Rugosae и 100 г масла из спор Ganoderma. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок. При добавлении 80% этанола вышеперечисленные четыре лекарственных средства экстрагировали дважды с обратным холодильником, причем каждая экстракция продолжалась в течение 2 ч, и затем фильтровали. Этанол извлекали из жидкого фильтрата до тех пора, пока можно было ощутить запах этанола. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для драже с повышенной биодоступностью вспомогательные средства и масло из спор Ganoderma добавляли к полученному и однородно перемешивали; и драже с повышенной биодоступностью получали с помощью общепринятых способов получения драже с повышенной биодоступностью.
Пример 26
Взвешивали 500 г Radix Panacis Quinquefolii, 100 г порошка ферментированного Cordyceps sinensis (Synnematium sinensis Yin & Shen), 500 г Ganoderma, 500 г Flos Rosae Rugosae, 500 г порошка из спор Ganoderma с разрушенной спородермой, 100 г масла из спор Ganoderma и 100 г Folium Ginseng. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные лекарственные средства замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для гранул вспомогательные средства, порошок из спор Ganoderma с разрушенной спородермой и масло из спор Ganoderma добавляли к полученному и однородно перемешивали; и гранулы получали с помощью общепринятых способов получения гранул.
Пример 27
Взвешивали 150 г Radix Panacis Quinquefolii, 90 г порошка ферментированного Cordyceps sinensis (Hirsutella hepialid Chen et Shen), 200 г Ganoderma, 90 г Flos Rosae Rugosae и 400 г Radix Codonopsis. Radix Panacis Quinquefolii, Ganoderma и Radix Codonopsis разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для таблеток вспомогательные средства добавляли к полученному и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток.
Пример 28
Взвешивали 150 г Radix Panacis Quinquefolii, 120 г Cordyceps, 200 г Ganoderma, 90 г Flos Rosae Rugosae и 400 г Radix Astragali. Radix Panacis Quinquefolii, Ganoderma и Radix Astragali разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч с 14-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования, часто используемое(ые) для леденцов вспомогательное(ые) средство(а) добавляли к полученному и однородно перемешивали, и леденцы получали с помощью общепринятых способов получения леденцов.
Пример 29
Взвешивали 500 г Radix Panacis Quinquefolii, 50 г порошка ферментированного Cordyceps sinensis (Paecilomyces hepialli Chen et Dai, sp.nov), 50 г порошка ферментированного Cordyceps sinensis (Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov), 500 г Ganoderma, 500 г Flos Rosae Rugosae и 300 г Radix Codonopsis. Radix Panacis Quinquefolii, Ganoderma и Radix Codonopsis разрезали на части и порошки ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 1 ч и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемое(ые) для порошка вспомогательное(ые) средство(а) добавляли к полученному и однородно перемешивали; и порошок получали с помощью общепринятых способов получения порошка.
Пример 30
Взвешивали 500 г Radix Panacis Quinquefolii, 100 г Cordyceps, 500 г Ganoderma, 500 г Flos Rosae Rugosae и 300 г Radix Astragali. Radix Panacis Quinquefolii, Ganoderma и Radix Astragali разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч с 14-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 31
Взвешивали 100 г Radix Panacis Quinquefolii, 200 г Ganoderma, 30 г Cordyceps, 3 г порошка ферментированного Cordyceps sinensis (Cs-C-Q80 Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov), 100 г Flos Rosae Rugosae и 100 г порошка из спор Ganoderma. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и помещали в матерчатый мешок вместе с порошком из спор Ganoderma. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для таблеток вспомогательные средства добавляли к полученному и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток.
Пример 32
Взвешивали 100 г Radix Panacis Quinquefolii, 200 г Ganoderma, 30 г порошка ферментированного Cordyceps sinensis (Mortiscrslla hepialid C.T. & B.liu), 100 г Flos Rosae Rugosae и 100 г порошка из спор Ganoderma. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis и порошок из спор Ganoderma помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для драже вспомогательные средства добавляли к полученному и однородно перемешивали; и различные типы драже получали с помощью общепринятых способов получения драже.
Пример 33
Взвешивали 90 г Radix Panacis Quinquefolii, 120 г Ganoderma, 90 г Cordyceps, 60 г Flos Rosae Rugosae и 90 г масла из спор Ganoderma. Radix Panacis Quinquefolii и Ganoderma разрезали на части. Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч, с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для гранул вспомогательные средства и масло из спор Ganoderma добавляли к полученному и однородно перемешивали; и гранулы получали с помощью общепринятых способов получения гранул.
Пример 34
Взвешивали 100 г Radix Panacis Quinquefolii, 200 г Ganoderma, 30 г Cordyceps, 100 г Flos Rosae Rugosae и 200 г Radix Pseudostellariae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, часто используемое(ые) для густых экстрактов вспомогательное(ые) средство(а) добавляли к полученному и однородно перемешивали; и густой экстракт получали с помощью общепринятых способов получения густых экстрактов.
Пример 35
Взвешивали 100 г Radix Panacis Quinquefolii, 200 г Ganoderma, 30 г Cordyceps, 100 г Flos Rosae Rugosae и 200 г Folium Ginseng. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, часто используемые для сиропов вспомогательные средства добавляли к полученному и однородно перемешивали; и сироп получали с помощью общепринятых способов получения сиропов.
Пример 36
Взвешивали 100 г Radix Panacis Quinquefolii, 200 г Ganoderma, 30 г порошка ферментированного Cordyceps sinensis (Mortierella sp.), 100 г Flos Rosae Rugosae и 200 г Radix Codonopsis. Radix Panacis Quinquefolii, Ganoderma и Radix Codonopsis разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для таблеток вспомогательные средства добавляли к полученному и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток.
Пример 37
Взвешивали 100 г Radix Panacis Quinquefolii, 200 г Ganoderma, 30 г порошка ферментированного Cordyceps sinensis (Verticillium sinens Wamg sp.nov), 100 г Flos Rosae Rugosae и 200 г Radix Astragali. Radix Panacis Quinquefolii, Ganoderma и Radix Astragali разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; используемые для капсул вспомогательные средства часто добавляли к полученному и однородно перемешивали; и капсулы получали с помощью общепринятых способов получения капсул.
Пример 38
Взвешивали 90 г Radix Panacis Quinquefolii, 120 г Ganoderma, 30 г порошка ферментированного Cordyceps sinensis (Cephalosporium sinensis Chen sp.nov), 30 г порошка ферментированного Cordyceps sinensis (Synnematium sinensis Yin & Shen), 60 г Flos Rosae Rugosae и 60 г масла из спор Ganoderma. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошки ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 1 ч и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч, и каждое из последующих отвариваний продолжалось в течение 1 ч с 13-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для драже вспомогательные средства и масло из спор Ganoderma добавляли к полученному и однородно перемешивали; и различные типы драже получали с помощью общепринятых способов получения драже.
Пример 39
Взвешивали 90 г Radix Panacis Quinquefolii, 120 г Ganoderma, 90 г Cordyceps, 60 г Flos Rosae Rugosae, 200 г Radix Astragali и 10 г масла из спор Ganoderma. Radix Panacis Quinquefolii, Ganoderma и Radix Astragali разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, часто используемые для сиропов вспомогательные средства добавляли к полученному и однородно перемешивали; и сироп получали с помощью общепринятых способов получения сиропов.
Пример 40
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 200 г порошка ферментированного Cordyceps sinensis (Scytalidium hepialii C.L. Li), 300 г Flos Rosae Rugosae и 400 г порошка из спор Ganoderma. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 20 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для таблеток вспомогательные средства и порошок из спор Ganoderma добавляли к полученному и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток. Жидкость для перорального применения получали путем добавления вспомогательного(ых) средства (средств) часто используемого(ых) для жидкости для перорального применения. Полученную композицию, композицию 40, применяли в описанных ниже экспериментах по эффективности.
Пример 41
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 67 г Cordyceps, 300 г Flos Rosae Rugosae и 20 г масла из спор Ganoderma. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные четыре лекарственных средства замачивали в воде в течение 30 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для гранул вспомогательные средства и масло из спор Ganoderma добавляли к полученному и однородно перемешивали; и гранулы получали с помощью общепринятых способов получения гранул.
Пример 42
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 200 г порошка ферментированного Cordyceps sinensis (Cephalosporium sinens Chen sp.nov), 300 г Flos Rosae Rugosae и 400 г Radix Pseudostellariae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч и каждое из последующих отвариваний продолжалось в течение 1 ч, с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для таблеток вспомогательные средства добавляли к полученному и однородно перемешивали; и различные типы таблеток получали с помощью общепринятых способов получения таблеток.
Пример 43
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 67 г Cordyceps, 300 г Flos Rosae Rugosae и 400 г Radix Pseudostellariae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. Вышеперечисленные пять лекарственных средств замачивали в воде в течение 40 мин и отваривали 3 раза путем нагревания. Первое отваривание продолжалось в течение 2 ч с 15-кратным количеством добавленной воды, и каждое из последующих отвариваний продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Три жидких экстракта комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать, затем примеси в нем удаляли путем высокоскоростного центрифугирования, часто используемые для сиропов вспомогательные средства добавляли к полученному и однородно перемешивали; и сироп получали с помощью общепринятых способов получения сиропов.
Пример 44
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 100 г порошка ферментированного Cordyceps sinensis (Chrysosporium sinens Z.Q. liang), 100 г порошка ферментированного Cordyceps sinensis (Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov) и 300 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошки ферментированного Cordyceps sinensis помещали в матерчатый мешок. При добавлении 5% метанола лекарственные средства экстрагировали дважды с обратным холодильником, причем каждая экстракция продолжалась в течение 1 ч. Затем жидкие экстракты комбинировали, и метанол извлекали для получения спиртового экстракта. Остаточные лекарственные средства дополнительно отваривали дважды в воде путем нагревания. Первое отваривание продолжалось в течение 2 ч, и последующие отваривание продолжалось в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Спиртовой экстракт и водные экстракты комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для гранул вспомогательные средства добавляли к полученному и однородно перемешивали; и гранулы получали с помощью общепринятых способов получения гранул.
Пример 45
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 67 г Cordyceps, 20 г порошка ферментированного Cordyceps sinensis (Hirsutella sinensis Liu, Guo, Yu-et Zeng, sp.nov) и 300 г Flos Rosae Rugosae. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. При добавлении 75% этанола лекарственные средства экстрагировали в течение 2 ч с обратным холодильником и этанол извлекали для получения спиртового экстракта. Остаточные лекарственные средства дополнительно отваривали три раз в воде путем нагревания, причем каждое отваривание продолжалось в течение 2 ч. Спиртовой экстракт и водные экстракты комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 46
Взвешивали 300 г Radix Et Rhizoma Ginseng, 400 г Ganoderma, 200 г порошка ферментированного Cordyceps sinensis (Cephalosporium acremonium Corda, Icones Fungorum), 300 г Flos Rosae Rugosae и 400 г Radix Codonopsis. Radix Et Rhizoma Ginseng, Ganoderma и Radix Codonopsis разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. При добавлении 95% метанола лекарственные средства экстрагировали дважды с обратным холодильником, причем каждая экстракция продолжалась в течение 1 ч. Затем жидкие экстракты комбинировали и метанол извлекали для получения спиртового экстракта. Остаточные лекарственные средства дополнительно отваривали 3 раза в воде путем нагревания. Первое отваривание продолжалось в течение 2 ч, и последующие отваривания продолжались в течение 1 ч с 10-кратным количеством добавленной воды для каждого отваривания. Спиртовой экстракт и водные экстракты комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для гранул вспомогательные средства добавляли к полученному и однородно перемешивали; и гранулы получали с помощью общепринятых способов получения гранул.
Пример 47
Взвешивали 300 г Radix Et Rhizoma Ginseng, 400 г Ganoderma, 200 г порошка ферментированного Cordyceps sinensis (Sporothrix insectorum de Hong & H.C. Evans), 300 г Flos Rosae Rugosae и 400 г Radix Codonopsis. Radix Et Rhizoma Ginseng и Ganoderma разрезали на части и Cordyceps измельчали в порошок и помещали в матерчатый мешок. При добавлении 95% этанола лекарственные средства экстрагировали с обратным холодильником в течение 2 ч и этанол извлекали для получения спиртового экстракта. Остаточные лекарственные средства дополнительно отваривали 3 раза в воде путем нагревания, причем каждое отваривание продолжалось в течение 2 ч. Спиртовой экстракт и водные экстракты комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 48
Взвешивали 300 г Radix Et Rhizoma Ginseng, 400 г Ganoderma, 67 г Cordyceps, 300 г Flos Rosae Rugosae, 300 г порошка из спор Ganoderma и 400 г Radix Astragali. Radix Et Rhizoma Ginseng и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. При добавлении 5% этанола лекарственные средства экстрагировали с обратным холодильником в течение 2 ч и этанол извлекали для получения спиртового экстракта. Остаточные лекарственные средства дополнительно отваривали дважды в воде путем нагревания, причем каждое отваривание продолжалось в течение 2 ч. Спиртовой экстракт и водные экстракты комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 49
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 200 г порошка ферментированного Cordyceps sinensis (Isaria farinose (Holmsk.) Fr. Systema Mycologicum), 300 г Flos Rosae Rugosae и 400 г Radix Astragali. Radix Panacis Quinquefolii и Ganoderma разрезали на части и порошок ферментированного Cordyceps sinensis помещали в матерчатый мешок. При добавлении 95% метанола лекарственные средства экстрагировали дважды с обратным холодильником в течение 2 ч, причем каждая экстракция продолжалась в течение 1 ч. Затем жидкие экстракты комбинировали и метанол извлекали для получения спиртового экстракта. Остаточные лекарственные средства дополнительно отваривали 3 раза в воде путем нагревания. Первое отваривание продолжалось в течение 2 ч, и последующие отваривания продолжались в течение 1 ч, с 10-кратным количеством добавленной воды для каждого отваривания. Спиртовой экстракт и водные экстракты комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования. Пасту получали с помощью дополнительного концентрирования при отрицательном давлении или тонкодисперсные частицы получали путем высушивания распылением; часто используемые для гранул вспомогательные средства добавляли к полученному и однородно перемешивали; и гранулы получали с помощью общепринятых способов получения гранул.
Пример 50
Взвешивали 300 г Radix Panacis Quinquefolii, 400 г Ganoderma, 67 г Cordyceps, 300 г Flos Rosae Rugosae и 90 г Folium Ginseng. Radix Panacis Quinquefolii и Ganoderma разрезали на части и Cordyceps измельчали в порошок и затем помещали в матерчатый мешок. При добавлении 5% этанола лекарственные средства экстрагировали с обратным холодильником в течение 2 ч и этанол извлекали для получения спиртового экстракта. Остаточные лекарственные средства дополнительно отваривали 3 раза в воде путем нагревания, причем каждое отваривание продолжалось в течение 2 ч. Спиртовой экстракт и водные экстракты комбинировали и фильтровали, жидкий фильтрат концентрировали до соответствующего количества, жидкий концентрат оставляли остывать и затем примеси в нем удаляли путем высокоскоростного центрифугирования, к полученному добавляли часто используемое(ые) для жидкости для перорального применения вспомогательное(ые) средство(а) и однородно перемешивали; и 20000 мл жидкости для перорального применения получали с помощью общепринятых способов получения жидкости для перорального применения.
Пример 51. Отчет об эксперименте на животных в отношении действия полученной в примере 3 композиции 3 против аллергии и аллергического дерматита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 3 (Radix Panacis Quinquefolii, Ganoderma и порошок ферментированного Cordyceps sinensis) предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 11,41 г общих сырых лекарственных средств. Его суточная доза потребления, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела.
1.2 Лабораторные животные
Чистых высококачественных здоровых мышей Kunming, половина из которых являлись самцами и другая половина - самками, каждая массой 18-22 г, предоставляла Laboratory Animal Center, Jiangxi University of Traditional Chinese Medicine (сертификационный номер: SCXK (Jiangxi) 2005-0001). Чистых высококачественных здоровых крыс SD, половина из которых являлись самцами и другая половина самками, предоставляла Laboratory Animal Center, Jiangxi University of Traditional Chinese Medicine (сертификационный номер: SCXK (Jiangxi) 2006-0001).
1.3 Исходные реагенты
Овальбумин (OVA) (Sigma, № партии: 025K0594); Эванса голубой (ЕВ) (Sinopharm (Group) Shanghai Chemical Reagent Co., Ltd., № партии: F20030714); гистамина фосфат, произведенный Shanghai Biological Reagent Factory, № партии: 909035; 2,4-динитрохлорбензол, химически чистый, произведенный Guangzhou Chemical Reagent Factory, № партии: 0703428; преднизон, произведенный Xianju Pharmaceuticals Co. Ltd., № партии: 090678.
1.4 Исходные инструменты
Электронные весы BS110S, произведенные Sartorius Inc.; центрифуга (Anting, Shanghai); цифровая термостатическая водяная баня (Jintan, Zhejiang); перфоратор (8 мм в диаметре); микропипетка (Gilson, France). Микроскоп OLYMPUS; подающее устройство для предметных стекол с водяной баней YT-6C (Yaguang Medical Electronics Technology Inc., Xiaogan, Hubei); инкубатор/сушильный шкаф PH140A (Shanghai Yiheng Technology Co., Ltd).
2. Экспериментальные способы
2.1 Распределение животных по группам
Животных случайным образом делили на группы по 10 животных на группу на основании массы тела. Устанавливали контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 3 группы и группу положительного контроля с использованием лекарственного средства (преднизона).
2.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиции 3, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для мыши составляла: получающая низкую дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 4,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 12,0 г сырого лекарственного средства/кг массы тела, что составляло 5, 10 и 30-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (17,53 мг сухого порошка/мл, 35,06 мг сухого порошка/мл, и 105,18 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
Суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (8,765 мг сухого порошка/мл, 17,53 мг сухого порошка/мл, и 52,59 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
2.3 Эффект композиции 3 на пассивную анафилаксию (РСА) у крыс, вызванную овальбумином
2.3.1 Получение антисыворотки
5% OVA в физиологическом солевом растворе вводили с помощью инъекции в заднюю конечность крыс в количестве 0,2 мл/задняя конечность, при этом противококлюшную вакцину вводили с помощью инъекции интраперитонеально в количестве 0,15 мл/крыса. После нормального кормления в течение 13 дней кровь получали из глазницы и центрифугировали при 2000 об/мин в течение 15 мин. Из нее выделяли сыворотку к OVA и хранили в холодильной камере при -20°С до использования.
2.3.2 Установление крысиных моделей сыворотки к овальбумину
Получали сыворотку к овальбумину и разводили ее в соотношении 1:4 или 1:8 физиологическим солевым раствором. 50 крыс SD случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 3 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили с дистиллированной водой; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 3 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 14 последовательных дней. На 15 день спины крыс брили и интрадермально вводили с помощью инъекции разбавленную сыворотку в две области на каждой стороне по 0,1 мл на каждую область. Через 48 часов 1,0 мл смешанного раствора 1% Эванса голубого и 1% овальбумина в физиологическом солевом растворе вводили с помощью инъекции в хвостовую вену каждой крысы. Через 30 мин производили забор артериальной крови, сыворотку отделяли от нее и содержание гистамина определяли с помощью известного способа. Крыс затем умерщвляли и кожу на их спинах выворачивали для измерения диаметра голубых реакционных пятен для определения различия между получающими дозировку группами и модельной группой. Образец ткани кожи крысы фиксировали нейтральным формальдегидом, дегидратировали с помощью спиртового градиента, заливали парафином и исследовали в отношении дегрануляции тучных клеток в ткани.
2.3.3 Эффект композиции 3 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
50 мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 3 группы, и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. 5% раствор 2,4-динитрохлорбензола в этаноле наносили на кожу (побритую) брюшной поверхности мышей для сенсибилизации. Внутрижелудочное введение проводили за два дня до сенсибилизации; контрольной модельной группе внутрижелудочно вводили эквивалентный объем дистиллированной воды; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; группам, получающим низкую, среднюю и высокую дозы композиции 3, внутрижелудочно вводили соответствующие исследуемые растворы в объеме дозирования, составляющем 0,1 мл/10 г массы тела; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 7 дней после сенсибилизации 1% раствор 2,4-динитрохлорбензола наносили на правое ухо, мышей умерщвляли через 24 часа и оба уха отрезали вдоль основания наружного уха. Диски диаметром 8 мм извлекали с помощью пункции в одинаковом положении на обоих ушах, точно взвешивали на электронных весах и различие в массе между левым и правым ушами принимали в качестве объема для гиперчувствительности замедленного типа.
2.3.4 Эффект композиции 3 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
50 мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, группы, получающие низкую, среднюю и высокую дозы композиции 3, и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. Внутрижелудочное введение проводили мышам один раз в день в течение 10 последовательных дней. Через 30 мин после последнего введения 0,0125% раствора низкомолекулярного декстрана вводили с помощью инъекции в количестве 0,1 г/10 г в хвостовую вену. Число случаев зуда (случай зуда устанавливали по расчесу на голове с помощью передних лап, расчесу на теле с помощью задних лап и по укусам на различных частях по всему телу), которые происходили в течение 30 мин после инъекции раствора низкомолекулярного декстрана в хвостовые вены мышей в каждой группе, наблюдали и регистрировали.
2.3.5 Эффект композиции 3 на проницаемость капилляров у крыс
50 крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, группы, получающие низкую, среднюю и высокую дозы композиции 3, и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; группам, получающим низкую, среднюю и высокую дозы композиции 3, внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 1 час после последнего введения в побритую область (побритую перед введением) спины крыс интрадермально вводили с помощью инъекции 1 мг/мл гистамина фосфата в дозе, составляющей 0,1 мл/крыса, и затем в хвостовую вену немедленно вводили с помощью инъекции 1% водного раствора Эванса голубого в дозе, составляющей 1 мл/крыса. Через 20 минут животных умерщвляли путем смещения шейных позвонков. Области кожи с голубыми пятнами отрезали и разрезали на маленькие кусочки, замачивали в 5 мл раствора ацетона: физиологического солевого раствора (7:3) в течение 48 часов, центрифугировали и поглощение супернатанта измеряли при 610 нм.
2.4 Статистический метод
Экспериментальные данные представляли в 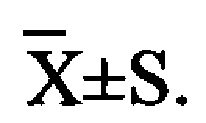 . Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 3 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
. Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 3 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 3 на пассивную анафилаксию у крыс
Результаты исследования показаны в таблицах 1 и 2 (см. в графической части). По сравнению с контрольной модельной группой получающая низкую дозу композиции 3 группа показала тенденцию к уменьшению диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, к уменьшению дегрануляции тучных клеток и к уменьшению содержания сывороточного гистамина, что, тем не менее, не характеризовалось статистической значимостью; все из контрольной группы преднизона и получающих средние и высокие дозы композиции 3 групп показали эффект в значительном снижении диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, уменьшении дегрануляции тучных клеток и снижении содержания сывороточного гистамина, со значимым или высокозначимым статистическим различием. Это указывает на то, что композиция 3 характеризовалась значительным ингибирующим эффектом на пассивную анафилаксию у крыс.
3.2 Эффект композиции 3 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
Результаты показаны в таблице 3 (см. в графической части). По сравнению с контрольной модельной группой степень отека дисков наружного уха мыши значительно снижалась в группах, получающих средние и высокие дозы композиции 3, указывая на то, что композиция 3 характеризовалась существенным ингибирующим эффектом на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом.
3.3 Эффект композиции 3 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Результаты исследования показаны в таблице 4 (см. в графической части). По сравнению с контрольной модельной группой Объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 3, указывая на то, что композиция 3 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
3.4 Эффект композиции 3 на проницаемость капилляров у крыс
Результаты исследования показаны в таблице 5 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 3, указывая на то, что композиция 3 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 3 является значительно эффективной в ингибировании пассивной анафилаксии у крыс, вызванной овальбумином, что композиция 3 является эффективной в ингибировании гиперчувствительности замедленного типа на коже наружного уха мыши, вызванной 2,4-динитрохлорбензолом, и что композиция 3 является значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом. Вышеперечисленные результаты указывают на хорошую эффективность композиции 3 в защите от аллергии и в профилактике и лечении таких аллергических заболеваний, как аллергический дерматит и крапивница.
Пример 52. Отчет об эксперименте на животных в отношении действия полученной в примере 3 композиции 3 в профилактике и лечении аллергического ринита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 3 (Radix Panacis Quinquefolii, Ganoderma и порошок ферментированного Cordyceps sinensis), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 11,41 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Чистых, высококачественных крыс SD, половина из которых являлись самцами и другая половина - самками, каждая массой 180-220 г, предоставляла Laboratory Animal Center, Jiangxi University of Traditional Chinese Medicine (Сертификационный номер: SCXK (Jiangxi) 2006-0001). Морских свинок, половина из которых являлись самцами и другая половина - самками, каждая массой 250-300 г, предоставлял Dongchuang Experimental Animal Service Department, Kaifu District, Changsha.
1.3 Исходные реагенты
Толуол-2,4-диизоцианат (TDI) (Shanghai First Reagent Factory, № партии: 090301); овальбумин (OVA) (Sigma, № партии: 025K0594); таблетки Bi-yan-kang (Foshan Dezhong Pharmaceutical Co., Ltd., № партии: 090701); наборы cAMP и cGMP (Great Wall Biochemicals).
1.4 Исходные инструменты
Автоматический биохимический анализатор крови Beckman-CX7; OLYMPUS микроскоп; инвертированный флуоресцентный фазово-контрастный цифровой микроскоп TE2000-S (Nikon Inc., Japan); микротом (Leica, Germany); подающее устройство для предметных стекол с водяной баней YT-6C (Yaguang Medical Electronics Technology Inc., Xiaogan, Hubei).
2. Экспериментальные способы
2.1 Эффект на аллергический ринит у крыс, вызванный OVA
2.1.1 Распределение животных по группам
Крыс случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс распределяли случайным образом, на основании их оценки в баллах, в следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа Bi-yan-kang) и получающие низкую, среднюю и высокую дозы композиции 3 группы, по 10 животных в каждой группе.
2.1.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 3, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Группе холостого контроля и группе модели аллергического ринита внутрижелудочно вводили эквивалентный объем физиологического солевого раствора; группе Bi-yan-kang вводили лекарственное средство в дозе, составляющей 410 мг/кг. Внутрижелудочное введение начинали после успешного моделирования и проводили один раз в день в течение 21 последовательного дня.
2.1.3 Установление животных моделей аллергического ринита у крыс
1 мл физиологического солевого раствора добавляли к 0,3 мг OVA в качестве антигена и 30 мг порошка гидроксида алюминия в качестве адъюванта для получения суспензии, которую вводили интраперитонеально с помощью инъекции один раз через день всего 7 раз. После этого местную иммунизацию проводили в каждой носовой полости с помощью 10 мкл 5% OVA один раз в день в течение 7 дней. Эквивалентный объем физиологического солевого раствора вводили группе холостого контроля. Во время введения исследуемого лекарственного средства назальное введение 50 мкл 1% OVA все еще проводили через день.
Критерии оценки эффективности моделирования: эффективность оценивали путем выставления баллов; в течение 30-минутного наблюдения после сенсибилизации регистрировали число чиханий, уровень зуда в носу и количество носового секрета. Критерии выставления баллов показаны в таблице 1 (см. в графической части).
Общий балл, составляющий 5 единиц, указывал на успешное моделирование, после чего назальное введение продолжали до завершения экспериментального лечения.
2.1.4 Индикаторы исследования
Измеряли содержание сАМР и cGMP в крови и подсчитывали количество тучных клеток в тканях слизистой оболочки носа.
2.1.4.1 Измерение сАМР и cGMP крови
Кровь получали из сонной артерии и сыворотку выделяли для ELISA.
2.1.4.2 Подсчет тучных клеток в слизистой оболочке носа
Снимали кожу в носовой верхнечелюстной области, верхнюю челюсть отделяли от черепа и отрезали вдоль средней линии носа, чтобы обнажить носовую перегородку и носовые полости с обеих сторон. Переднюю и среднюю часть носовой перегородки отрезали и фиксировали в 10% растворе формальдегида в течение 72 ч, затем помещали в декальцификацирующий раствор для декальцификации в течение 3 дней, дегидратировали с помощью спиртового градиента до прозрачности и заливали парафином. Получали традиционные срезы по 4 мкм, окрашивали их с помощью толуидинового синего и проводили наблюдение под микроскопом для подсчета общего количества тучных клеток в образце.
2.2 Эффект на аллергический ринит у морских свинок, вызванный TDI
2.2.1. Так же, как в 2.1.1.
2.2.2. Так же, как в 2.1.2.
2.2.3 Установление животных моделей аллергического ринита у морских свинок
Моделирование проводили с помощью TDI. Морских свинок, отличных от морских свинок в группе холостого контроля, подвергали моделированию с применением 10% TDI. 10 мкл вводили с помощью пипетки по каплям в обе носовые полости морских свинок (5 мкл для каждой стороны) один раз в день в течение последовательных 7 дней, для установления животных моделей аллергического ринита у морских свинок. Эквивалентный объем оливкового масла вводили назально группе холостого контроля. Назальное введение продолжали до завершения экспериментального лечения.
Критерии оценки для эффективности моделирования: эффективность оценивали путем выставления баллов; в течение 30-минутного наблюдения после сенсибилизации регистрировали число чиханий, уровень зуда в носу и количество носового секрета. Критерии выставления баллов показаны в таблице 1 (см. в графической части).
2.2.4 Индикаторы исследования
Наблюдение за поведением; количество эозинофилов в носовом секрете; измерения содержания общего сывороточного IgE и гистамина крови; измерение толщины слизистой оболочки носа.
2.2.4.1 Наблюдение за поведением морских свинок
После сенсибилизации путем назального введения TDI баллы присваивали согласно критериям в таблице 1 (см. в графической части).
2.2.4.2 Количество эозинофилов (EOS) в носовом секрете
Делали мазок носового секрета от морских свинок на предметное стекло и корректировали с помощью метода Лорена. Наблюдаемые EOS обнаруживали в поле при 40× увеличении под цифровым микроскопом и количество EOS в собственной пластинке в этом месте подсчитывали в 3-5 полях зрения при большом увеличении и применяли для установления степени инфильтрации EOS.
2.2.4.3 Измерение содержания общего сывороточного IgE и гистамина в крови
Через один день после в завершения ведения морским свинкам вводили анестезию с помощью 10% хлоралгидрата и кровь получали из брюшной аорты. Общий сывороточный IgE измеряли с помощью радиоиммуноанализа. Другие 5 мл крови добавляли в антикоагулирующую пробирку и хранили при -20°С до использования. Гистамин экстрагировали и содержание гистамин определяли с помощью флуоресцентной спектрофотометрии. Уравнение для расчета являлось следующим:
Содержание гистамина в крови (мг/л)=[(объем образца-объем холостого образца)/(объем стандарта - объем холостого стандарта)]×стандартная концентрация гистамина
(Стандартная концентрация гистамина составляла 50,2 мг⋅л-1).
2.2.4.4 Измерение толщины слизистой оболочки носа
Сбор материала и получение срезов были такими же как в эксперименте 2.1.4.2. После окрашивания НЕ толщину слизистой оболочки носа количественно измеряли с помощью анализатора изображений. Расстояние от верхушки выпячивания слизистой в области слизистой, покрытой псевдомногослойным реснитчатым столбчатым эпителием, до хряща носовой перегородки (включая в себя эпителиальный слой и собственную пластинку) в каждом образце определяли в качестве толщины слизистой оболочки.
2.3 Статистический метод
Экспериментальные данные представляли в 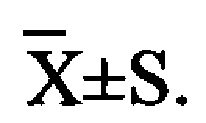 Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 3 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 3 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 3 на аллергический ринит у крыс, вызванный овальбумином
3.1.1 Эффект на поведение крыс
Результаты показаны в таблице 2 (см. в графической части). После моделирования баллы для признаков крыс в каждой смоделированной группе квалифицировали без значительного различия между ними, указывая на успешное моделирование. После введения доз и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалась (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.2 Эффект композиции 3 на содержание сАМР и cGMP в сыворотке крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание с AMP в сыворотке (Р<0,01) и значительно увеличенное содержание cGMP в сыворотке (Р<0,01). По сравнению с контрольной модельной группой группа Bi-yan-kang и все получающие исследуемое лекарственное средство группы показали значительно увеличенное содержание сАМР в сыворотке (Р<0,01 или Р<0,05); группа Bi-yan-kang и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное содержание cGMP в сыворотке (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.3 Эффект композиции 3 на тучные клетки в слизистой оболочке носа у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество тучных клеток в слизистой оболочке носа в контрольной модельной группе значительно увеличивалось с высокозначимым различием (Р<0,01). По сравнению с контрольной модельной группой количество тучных клеток в слизистой оболочке носа в группе Bi-yan-kang и во всех получающих исследуемое лекарственное средство группах лечения значительно снижалось со значимым различием (Р<0,01).
3.2 Эффект композиции 3 на аллергический ринит у морских свинок, вызванный TDI
3.2.1 Эффект на поведение морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования баллы для признаков морских свинок в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения, по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.2.2 Эффект на содержание гистамина в крови и общего сывороточного IgE у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). По сравнению с группой холостого контроля, как гистамин в крови, так и общий сывороточный IgE у модельной группе увеличивались (Р<0,01), указывая на успешное экспериментальное моделирование. По сравнению модельной группой поглощение флуоресценции концентрации гистамина и общего сывороточного IgE в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалось (Р<0,01 или Р<0,05), причем содержание гистамина в получающих среднюю и высокую дозы группах снижался почти до нормального содержания, указывая на то, что композиция 3 являлась эффективной в лечении аллергического ринита путем ингибирования содержания гистамина в крови и сывороточного IgE.
3.2.3 Эффект на эозинофилы (EOS) в носовом секрете морских свинок Экспериментальные результаты показаны в таблице 6 (см. в графической части). Количество эозинофилов в модельной группе значительно увеличивалось (Р<0,01). По сравнению с модельной группой все количества эозинофилов в группе Bi-yan-kang и в получающих лечение лекарственным средством группах значительно снижались (Р<0,05 или Р<0,01).
3.2.4 Эффект на толщину слизистой оболочки носа у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). В результате, по сравнению с группой холостого контроля в модельной группе эпителий слизистой оболочки на носовой перегородке морских свинок отслаивался в различной степени, характеризуясь неоднородной толщиной и неясной базальной структурой; венулы и капилляры в собственной пластинке показали заметное расширение, тканевое пространство расширялось, и толщина слизистой оболочки значительно увеличивалась (Р<0,01). По сравнению с контрольной модельной группой вышеперечисленные патологические изменения в группе Bi-yan-kang и в получающих лечение лекарственным средством группах снижались, и толщина слизистой оболочки значительно уменьшалась (Р<0,01).
4. Вывод
Экспериментальные исследования на животных демонстрируют, что эффективность композиции 3, главным образом, отражается в следующих аспектах: 1) она способна значительно уменьшить балл назального симптома смоделированных крыс, увеличить содержание сАМР в сыворотке и снизить содержание cGMP у крыс с аллергическим ринитом; 2) уменьшить количество тучных клеток в слизистой оболочке носа у крыс и уменьшить их инфильтрацию в участках воспаления; 3) она способна снизить балл назального симптома смоделированных морских свинок; 4) уменьшить количество EOS в носовом секрете морских свинок и снизить инфильтрацию EOS в участках воспаления; 5) она способна значительно уменьшить концентрацию гистамина в крови у морских свинок и снизить содержание медиаторов воспаления; 6) облегчить отек в слизистой оболочке носа морских свинок. В соответствии с результатами экспериментальных исследований, считают, что композиция 3 является эффективной в защите от аллергического ринита.
Пример 53. Отчет об эксперименте на животных в отношении действия полученной в примере 3 композиции 3 в профилактике и лечении аллергической бронхиальной астмы
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 3 (Radix Panacis Quinquefolii, Ganoderma и порошок ферментированного Cordyceps sinensis), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 11,41 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Крыс SD, половина из которых являлись самцами и другая половина - самками, каждая массой 180 - 220 г, предоставляла Laboratory Animal Center, Jiangxi University of Traditional Chinese Medicine (SCXK (Jiangxi) 2006-0001). Морских свинок, половина из которых являлись самцами и другая половина - самками, каждая массой 180-220 г, предоставлял Dongchuang Experimental Animal Scientific Service Department, Kaifu District, Changsha, Hunan Province (Сертификационный номер: SCXK (Hunan) 2006-0001).
1.3 Исходные реагенты
Овальбумин (OVA) (Sigma, № партии: 025К0594); ацетилхолинхлорид (Shanghai Jingchun Reagent Co., Ltd., № партии: 21205); гистамина фосфат (Shanghai Jingchun Reagent Co., Ltd., № партии: 22270); дексаметазон (Zhengzhou Zhuofeng Pharmaceuticals, № партии: 0904213); наборы для ELISA IL-4 и IFN-γ (Great Wall Biochemicals).
1.4 Исходные инструменты
Система получения и анализа биологических сигналов MD3000 (Huaibeizhenghua Bioinstrumentation Co., Ltd.); респираторный преобразователь ZH-100 (Huaibeizhenghua Bioinstrumentation Co., Ltd.); ультразвуковой распылитель 402A1 (Jiangsu Juyue Medical Device Co., Ltd.); микроскоп OLYMPUS; инвертированный флуоресцентный фазово-контрастный цифровой микроскоп TE2000-S (Nikon Inc., Japan); микротом (Leica, Germany).
2. Экспериментальные способы
2.1 Эффект на аллергическую бронхиальную астму у крыс, вызванную OVA
2.1.1 Распределение животных по группам
Крыс (половина из которых являлись самцами и другая половина - самками) случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс случайным образом делили на следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа дексаметазона), и группы, получающие низкую, среднюю и высокую дозы композиции 3, по 10 животных в каждой группе.
2.1.2 Установление животных моделей аллергической бронхиальной астмы у крыс
На 1 день всех животных за исключением животных в группе холостого контроля сенсибилизировали путем интраперитонеальной инъекции с помощью 1 мл суспензии, содержащей 10 мг OVA, 200 мг сухого порошка Al(ОН)3 и 6×109 инактивированных противококлюшных вакцин в физиологическом солевом растворе, и сенсибилизировали снова на 8 день. С 15 дня все группы животных, отличные от отрицательной контрольной группы сенсибилизировали с помощью ультразвукового распыления 1% OVA в течение приблизительно 20 мин каждый раз, с 8.00 до 9.00 утром каждый день, пока крысы показывали астматические манифестации, которые продолжались в течение 3 недель. Во время сенсибилизации распылением крысы показывали такие симптомы, как тревожное возбуждение, чихание, недержание мочи и кала, почесывание ушей и цианоз, что указывало на успешное воспроизведение модели астмы.
2.1.3 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 3, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (8,76 мг сухого порошка/мл, 17,52 мг сухого порошка/мл, 52,56 мг сухого порошка/мл) для проведения экспериментов. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Контрольной модельной группе внутрижелудочно вводили эквивалентный объем 0,9% физиологического солевого раствора за 30 минут до сенсибилизации; и получающей лекарственное средство положительной группе вводили дексаметазон в дозе, составляющей 0,5 мг/кг за 30 мин до каждой сенсибилизации. Каждой из групп, получающих низкую, среднюю и высокую дозы композиции 3, внутрижелудочно вводили соответствующую дозу исследуемого лекарственного средства за 30 мин до каждой сенсибилизации. Наряду с этим группе холостого контроля интраперитонеально вводили с помощью инъекции эквивалентный объем 0,9% физиологического солевого раствора, сенсибилизировали путем его распыления или вводили его внутрижелудочно. Внутрижелудочное введение проводили один раз в день в течение 21 последовательного дня.
2.1.4 Регистрация латентного периода астмы, вызванной у крыс
Респираторный преобразователь ZH-100 привязывали вокруг грудной клетки каждой крысы (натяжение доводили до приблизительно 1-2 г так, чтобы амплитуда респираторной волны составляла 1-2 мВ). Преобразователь соединяли с системой получения и анализа биологических сигналов MD3000. Животных помещали в закрытый стеклянный колпак, соединенный с ультразвуковым распылителем. Систему включали и записывали сегмент нормальной респираторной волны. Затем ультразвуковое распыление с помощью 1% OVA проводили в течение 20 мин и респираторные волны индуцированной бронхиальной астмы у крыс непрерывно регистрировали в течение 30 мин после начала распыления. При этом, период от начала распыления до появления симптомов (на которое указывает первое судорожное движение) визуально наблюдали и регистрировали в качестве латентного периода бронхиальной астмы.
2.1.5 Измерения содержания IL-4 и IFN-γ
Через 24 ч после последней сенсибилизации крысам вводили анестезию с помощью интраперитонеальной инъекции 3% пентобарбитала натрия (30 мг/кг). Производили забор 5-10 мл крови и содержание сывороточного IL-4 и IFN-γ измеряли с помощью ELISA.
2.1.6 Измерение содержание EOS в тканях легких
Ткани левого легкого отрезали и фиксировали в 4% полиформальдегиде в течение 4-5 ч, затем отмывали водой, дегидратировали с помощью спиртового градиента и погружали и заливали парафином. Окрашивание НЕ проводили с последующей обработкой срезов, наблюдали воспалительные изменения в тканях и подсчитывали инфильтрацию EOS. Для каждого среза один и тот же наблюдатель выбирал 10 полей случайным образом под микроскопом при большом увеличении (×400) и количества инфильтрации EOS вокруг бронха и сосудов рассчитывали и усредняли в качестве репрезентативного объема для указанного среза.
2.2 Эффект на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
2.2.1 Так же, как в 2.1.1.
2.2.2 Установление животных моделей аллергической бронхиальной астмы у морских свинок
На 1 день морских свинок помещали в закрытый 4 л стеклянный колпак, в который раствор смеси 1:1 2% Ach и 0,4% His распыляли с помощью ультразвукового распыления в течение 15 с. После завершения распыления регистрировали латентный период бронхиальной астмы, индуцированной у морских свинок (т.е. период от окончания распыления до астматических манифестаций, чрезвычайной трудности дыхания до судорожного движения и падения). Животных, характеризующихся латентным периодом бронхиальной астмы больше чем 120 с, исключали.
2.2.3 Режим дозирования
Так же, как в 2.1.3.
2.2.4 Регистрация латентного периода бронхиальной астмы
Так же, как в 2.1.4.1.
2.2.5 Измерение IgE в сыворотке и BALF
Использовали сэндвич-радиоиммуноанализ с двойным антителом.
2.3 Статистический метод
Экспериментальные данные представляли в 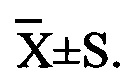 Однофакторный дисперсионный анализ использовали для сравнения различий среди групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
Однофакторный дисперсионный анализ использовали для сравнения различий среди групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 3 на аллергическую бронхиальную астму у крыс, вызванную OVA
3.1.1 Эффект на латентный период бронхиальной астмы, индуцированной у крыс
Результаты показаны в таблице 1 (см. в графической части). Латентные периоды бронхиальной астмы, индуцированной у крыс из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у крыс в положительной контрольной группе и в получающих среднюю и высокую дозу исследуемого лекарственного средства группах являлись значительно пролонгированными (Р<0,05 или Р<0,01).
3.1.2 Эффект на содержание сывороточного IL-4 и IFN-γ у крыс
Экспериментальные результаты показаны в таблице 2 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сывороточного IFN-γ (Р<0,01), но значительно увеличенное содержание сывороточного IL-4 (Р<0,01), указывая на тяжелый дисбаланс соотношения IFN-γ/IL-4 во время манифестации бронхиальной астмы. По сравнению с модельной группой все из получающей дексаметазон группы и получающих среднюю и высокую дозы исследуемого лекарственного средства групп показали значительно пониженное содержание IL-4 (Р<0,05 или Р<0,01) и значительно увеличенное содержание IFN-γ (Р<0,05 или Р<0,01), указывая на то, что исследуемое лекарственное средство может корректировать несбалансированное соотношение IFN-γ/IL-4.
3.1.3 Эффект на содержание EOS в тканях легких у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество EOS у крыс в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой положительная контрольная группа и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное количество EOS (Р<0,01), указывая на то, что композиция 3 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет снижения содержания EOS в тканях легких у крыс.
3.2 Эффект композиции 3 на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
3.2.1 Эффект на латентный период бронхиальной астмы, индуцированной у морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования латентные периоды бронхиальной астмы, индуцированной у морских свинок из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у морских свинок в положительной контрольной группе и в получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01), указывая на то, что композиция 3 существенно улучшает симптомы бронхиальной астмы у морских свинок.
3.2.2 Эффект на общий IgE в сыворотке и BALF у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). Содержание общего IgE в сыворотке и BALF в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все содержания общего IgE в сыворотке и BALF в группе дексаметазона и в получающих средние и высокие дозы исследуемого лекарственного средства группах значительно снижались (Р<0,01 или Р<0,05), указывая на то, что как дексаметазон, так и исследуемое лекарственное средство могут ингибировать аллергический воспалительный ответ в легких у морских свинок и облегчать симптомы бронхиальной астмы.
3.2.3 Эффект на содержание EOS в тканях легких у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). По сравнению с группой холостого контроля содержание EOS у морских свинок в модельной группе значительно увеличивалось (Р<0,01). По сравнению с модельной группой содержание EOS в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах значительно снижалось (Р<0,01), указывая на то, что композиция 3 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет уменьшения содержания EOS в тканях легких у морских свинок.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 3 способна значительно облегчать симптомы бронхиальной астмы у крыс и пролонгировать латентный период бронхиальной астмы, индуцированной у морских свинок в модельных группах; уменьшать содержание сывороточного IL-4, увеличивать содержание сывороточного IFN-γ и корректировать несбалансированное соотношение IFN-γ/IL-4 у крыс с бронхиальной астмой; уменьшать количества EOS в тканях легких у крыс и морских свинок и ослаблять инфильтрацию EOS в участках воспаления; уменьшать содержание общего IgE в сыворотке и BALF у морских свинок и облегчать легочные воспалительные симптомы. Таким образом, считают, что композиция 3 является эффективной в защите от аллергической бронхиальной астмы.
Пример 54. Отчет об эксперименте на животных в отношении действия полученной в примере 4 композиции 4 против аллергии и аллергического дерматита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 4 (Radix Panacis Quinquefolii, Ganoderma и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 10,97 г общих сырых лекарственных средств. Его суточная доза потребления, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела.
1.2 Лабораторные животные
Так же, как в примере 51.
1.3 Исходные реагенты
Так же, как в примере 51.
1.4 Исходные инструменты
Так же, как в примере 51.
2. Экспериментальные способы
2.1 Распределение животных по группам
Животные случайным образом делили на группы по 10 животных на группу на основании масс тела. Устанавливали следующие группы: контрольная модельная группа, получающие низкую, среднюю и высокую дозы композиции 4 группы и группа положительного контроля с использованием лекарственного средства (преднизона).
2.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиции 4, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для мыши составляла: получающая низкую дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 4,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 12,0 г сырого лекарственного средства/кг массы тела, что составляло 5, 10 и 30-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (18,23 мг сухого порошка/мл, 36,46 мг сухого порошка/мл, и 109,38 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
Суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (9,12 мг сухого порошка/мл, 18,23 мг сухого порошка/мл, и 54,69 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
2.3 Эффект композиции 4 на пассивную анафилаксию (PCA) у крыс, вызванную овальбумином
2.3.1 Получение антисыворотки
Так же, как в примере 51.
2.3.2 Установление крысиных моделей сыворотки к овальбумину
Получали сыворотку к овальбумину и разводили ее в соотношении 1:4 или 1:8 физиологическим солевым раствором. 50 крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 4 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 4 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 14 последовательных дней. На 15 день спины крысы брили и интрадермально вводили с помощью инъекции разбавленную сыворотку в две области на каждой стороне по 0,1 мл на каждую область. Через 48 часов 1,0 мл смешанного раствора 1% Эванса голубого и 1% овальбумина в физиологическом солевом растворе вводили с помощью инъекции в хвостовую вену каждой крысы. Через 30 мин производили забор артериальной крови, из нее выделяли сыворотку и содержание гистамина определяли с помощью способа и. Крыс затем умерщвляли и кожу на их спинах выворачивали для измерения диаметра голубых реакционных пятен для определения различия между получающими дозировку группами и модельной группой. Образец ткани кожи крысы фиксировали нейтральным формальдегидом, дегидратировали с помощью спиртового градиента, заливали парафином и исследовали в отношении дегрануляции тучных клеток в ткани.
2.3.3 Эффект композиции 4 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
50 мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 4 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. 5% раствор 2,4-динитрохлорбензола в этаноле наносили на кожу брюшной поверхности (побритую) мышей для сенсибилизации. Внутрижелудочное введение проводили за два дня до сенсибилизации; контрольной модельной группе внутрижелудочно вводили эквивалентный объем дистиллированной воды; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 4 группам внутрижелудочно вводили соответствующие исследуемые растворы в объеме дозирования, составляющем 0,1 мл/10 г массы тела; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 7 дней после сенсибилизации 1% раствор 2,4-динитрохлорбензола наносили на правое ухо, мышей умерщвляли через 24 часа и оба уха отрезали вдоль основания наружного уха. Диски диаметром 8 мм извлекали с помощью пункции в одинаковом положении на обоих ушах, точно взвешивали на электронных весах и различие в массе между левым и правым ушами принимали в качестве объема для гиперчувствительности замедленного типа.
2.3.4 Эффект композиции 4 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 4 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. Внутрижелудочное введение проводили мышам один раз в день в течение 10 последовательных дней. Через 30 мин после последнего введения 0,0125% раствор низкомолекулярного декстрана вводили с помощью инъекции по 0,1 г/10 г в хвостовую вену. Число случаев зуда (случаи зуда устанавливали по расчесу на голове с помощью передних лап, расчесу на теле с помощью задних лап и по укусам на различных частях по всему телу), которые происходили в течение 30 мин после инъекции раствора низкомолекулярного декстраны в хвостовые вены мышей в каждой группе, наблюдали и регистрировали.
2.3.5 Эффект композиции 4 на проницаемость капилляров у крыс
Крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 4 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 4 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 1 час после последнего введения в побритую область (побритую перед введением) на спинах крыс интрадермально вводили с помощью инъекции 1 мг/мл гистамина фосфат в дозе, составляющей 0,1 мл/крыса, и затем в хвостовую вену немедленно вводили инъекцию 1% водного раствора Эванса голубого в дозе, составляющей 1 мл/крыса. Через 20 минут животных умерщвляли путем смещения шейных позвонков. Области кожи с голубыми пятнами отрезали и разрезали на маленькие кусочки, замачивали в 5 мл раствора ацетона: физиологического солевого раствора (7:3) в течение 48 часов, центрифугировали и поглощение супернатанта измеряли при 610 нм.
2.4 Статистический метод
Экспериментальные данные представляли в 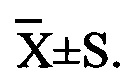 Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и групп, получающих различные дозы композиции 4. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и групп, получающих различные дозы композиции 4. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 4 на пассивную анафилаксию у крыс
Результаты исследования показаны в таблицах 1 и 2 (см. в графической части). По сравнению с контрольной модельной группой получающая низкую дозу композиции 4 группа показала тенденцию к уменьшению диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, к уменьшению дегрануляции тучных клеток и к уменьшению содержания сывороточного гистамина, что, тем не менее, не характеризовалось статистической значимостью; все из контрольной группы преднизона и получающих средние и высокие дозы композиции 4 групп показали эффект в значительном уменьшении диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, уменьшении дегрануляции тучных клеток и уменьшении содержания сывороточного гистамина со значимым или высокозначимым статистическим различием. Это указывает на то, что композиция 4 характеризовалась значительным ингибирующим эффектом на пассивную анафилаксию у крыс.
3.2 Эффект композиции 4 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
Результаты показаны в таблице 3 (см. в графической части). По сравнению с контрольной модельной группой степень отека дисков наружного уха мыши значительно снижалась в получающих средние и высокие дозы композиции 4 группах, указывая на то, что композиция 4 характеризовалась существенным ингибирующим эффектом на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом.
3.3 Эффект композиции 4 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Результаты исследования показаны в таблице 4 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 4, указывая на то, что композиция 4 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
3.4 Эффект композиции 4 на проницаемость капилляров у крыс
Результаты исследования показаны в таблице 5 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 4, указывая на то, что композиция 4 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 4 является значительно эффективной в ингибировании пассивной анафилаксии у крыс, вызванной овальбумином, что композиция 4 является эффективной в ингибировании гиперчувствительности замедленного типа на коже наружного уха мыши, вызванной 2,4-динитрохлорбензолом, и что композиция 4 является значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом. Вышеперечисленные результаты указывают на хорошую эффективность композиции 4 в защите от аллергии и в профилактике и лечении таких аллергических заболеваний, как аллергический дерматит и крапивница.
Пример 55. Отчет об эксперименте на животных в отношении действия полученной в примере 4 композиции 4 в профилактике и лечении аллергического ринита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 4 (Radix Panacis Quinquefolii, Ganoderma и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 10,97 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 52.
1.3 Исходные реагенты
Так же, как в примере 52.
1.4 Исходные инструменты
Так же, как в примере 52.
2. Экспериментальные способы
2.1 Эффект на аллергический ринит у крыс, вызванный OVA
2.1.1 Распределение животных по группам
Крыс случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс распределяли случайным образом, на основании их оценки в баллах, в следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа Bi-yan-kang) и получающие низкую, среднюю и высокую дозы композиции 4 группы, по 10 животных в каждой группе.
2.1.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 4, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека соответственно. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Группе холостого контроля и модельной группе аллергического ринита внутрижелудочно вводили эквивалентный объем физиологического солевого раствора; группе Bi-yan-kang вводили лекарственное средство в дозе, составляющей 410 мг /кг.Внутрижелудочное введение начинали после успешного моделирования и проводили один раз в день в течение 21 последовательного дня.
2.1.3 Установление животных моделей аллергического ринита у крыс
Так же, как в примере 52.
2.1.4 Индикаторы исследования
Так же, как в примере 52.
2.1.4.1 Измерение сАМР и cGMP в крови
Так же, как в примере 52.
2.1.4.2 Подсчет тучных клеток в слизистой оболочке носа
Так же, как в примере 52.
2.2 Эффект на аллергический ринит у морских свинок, вызванный TDI
2.2.1. Так же, как в 2.1.1.
2.2.2. Так же, как в 2.1.2.
2.2.3 Установление животных моделей аллергического ринита у морских свинок
Так же, как в примере 52.
2.2.4 Индикаторы исследования
Так же, как в примере 52.
2.2.4.1 Наблюдение за поведением морских свинок
Так же, как в примере 52.
2.2.4.2 Подсчет эозинофилов (EOS) в носовом секрете
Так же, как в примере 52.
2.2.4.3 Измерение содержания общего сывороточного IgE и гистамина в крови
Так же, как в примере 52.
2.2.4.4 Измерение толщины слизистой оболочки носа
Так же, как в примере 52.
2.3 Статистический метод
Экспериментальные данные представляли в 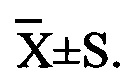 Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 4 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 4 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 4 на аллергический ринит у крыс, вызванный овальбумином
3.1.1 Эффект на поведение крыс
Результаты показаны в таблице 2 (см. в графической части). После моделирования баллы для признаков крыс в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.2 Эффект композиции 4 на содержание сАМР и cGMP в сыворотке крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание с AMP в сыворотке (Р<0,01) и значительно увеличенное содержание cGMP в сыворотке (Р<0,01). По сравнению с контрольной модельной группой группа Bi-yan-kang и все получающие исследуемое лекарственное средство группы показали значительно увеличенное содержание сАМР в сыворотке (Р<0,01 или Р<0,05); группа Bi-yan-kang и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное содержание cGMP в сыворотке (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.3 Эффект композиции 4 на тучные клетки в слизистой оболочке носа у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество тучных клеток в слизистой оболочке носа в контрольной модельной группе значительно увеличивалось с высокозначимым различием (Р<0,01). По сравнению с контрольной модельной группой все количества тучных клеток в слизистой оболочке носа в группе Bi-yan-kang и группах лечения исследуемым лекарственным средством значительно снижались со значимым различием (Р<0,01).
3.2 Эффект композиции 4 на аллергический ринит у морских свинок, вызванный TDI
3.2.1 Эффект на поведение морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования баллы для признаков морских свинок в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.2.2 Эффект на содержание гистамина в крови и общего сывороточного IgE у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). По сравнению с группой холостого контроля содержания как гистамина в крови, так и общего сывороточного IgE в модельной группе увеличивались (Р<0,01), указывая на успешное экспериментальное моделирование. По сравнению модельной группой поглощение флуоресценции концентрации гистамина и общего сывороточного IgE в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалась (Р<0,01 или Р<0,05), причем количество гистамина в получающих среднюю и высокую дозы группах уменьшалось почти до нормального содержания, указывая на то, что композиция 4 являлась эффективной в лечении аллергического ринита путем ингибирования содержания гистамина в крови и сывороточного IgE.
3.2.3 Эффект на эозинофилы (EOS) в носовом секрете морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). Количество эозинофилов в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все количества эозинофилов в группе Bi-yan-kang и получающих лечение лекарственным средством группах значительно снижались (Р<0,05 или Р<0,01).
3.2.4 Эффект на толщину слизистой оболочки носа у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). В результате по сравнению с группой холостого контроля в модельной группе эпителий слизистой оболочки на носовой перегородке морских свинок отслаивался в различной степени, характеризуясь неоднородной толщиной и неясной базальной структурой; венулы и капилляры в собственной пластинке демонстрировали заметное расширение, тканевое пространство расширялось, и толщина слизистой оболочки значительно увеличивалась (Р<0,01). По сравнению с контрольной модельной группой вышеперечисленные патологические изменения в группе Bi-yan-kang и в получающих лечение лекарственным средством группах снижались, и толщина слизистой оболочки значительно уменьшалась (Р<0,01).
4. Вывод
Экспериментальные исследования на животных демонстрируют, что эффективность композиции 4, главным образом, отражается в следующих аспектах: 1) она способна значительно уменьшить балл назального симптома смоделированных крыс, увеличить содержание сАМР в сыворотке и уменьшить содержание cGMP у крыс с аллергическим ринитом; 2) уменьшить количества тучных клеток в слизистой оболочке носа у крыс и уменьшить их инфильтрацию в участках воспаления; 3) она способна уменьшить балл назального симптома смоделированных морских свинок; 4) уменьшить количество EOS в носовом секрете морских свинок и снизить инфильтрацию EOS в участках воспаления; 5) она способна значительно уменьшить концентрацию гистамина в крови у морских свинок и снизить содержание медиаторов воспаления; 6) облегчить отек в слизистой оболочке носа морских свинок. В соответствии с результатами экспериментальных исследований считают, что композиция 4 является эффективной в защите от аллергического ринита.
Пример 56. Отчет об эксперименте на животных в отношении действия полученной в примере 4 композиции 4 в профилактике и лечении аллергической бронхиальной астмы
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 4 (Radix Panacis Quinquefolii, Ganoderma и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 10,97 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 53.
1.3 Исходные реагенты
Так же, как в примере 53.
1.4 Исходные инструменты
Так же, как в примере 53.
2. Экспериментальные способы
2.1 Эффект на аллергическую бронхиальную астму у крыс, вызванную OVA
2.1.1 Распределение животных по группам
Крысы (половина из которых являлись самцами и другая половина - самками) случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс случайным образом делили на следующие группы: контрольная модельная группа, принимающая лекарственное средство, положительная группа (группа дексаметазона) и получающие низкую, среднюю и высокую дозы композиции 4 группы, по 10 животных в каждой группе.
2.1.2 Установление животных моделей аллергической бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.3 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 4, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (9,12 мг сухого порошка/мл, 18,23 мг сухого порошка/мл, 54,69 мг сухого порошка/мл) для проведения экспериментов. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Контрольной модельной группе внутрижелудочно вводили эквивалентный объем 0,9% физиологического солевого раствора за 30 минут до сенсибилизации; и получающей лекарственное средство положительной группе вводили дексаметазон в дозе, составляющей 0,5 мг/кг за 30 мин до каждой сенсибилизации. Каждой из получающих низкую, среднюю и высокую дозы композиции 4 групп внутрижелудочно вводили соответствующую дозу исследуемого лекарственного средства за 30 мин до каждой сенсибилизации. При этом группе холостого контроля интраперитонеально вводили с помощью инъекции эквивалентный объем 0,9% физиологического солевого раствора, сенсибилизировали путем его распыления или вводили его внутрижелудочно. Внутрижелудочное введение проводили один раз в день в течение 21 последовательного дня.
2.1.4 Регистрация латентного периода бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.5 Измерения содержаний IL-4 и IFN-γ
Так же, как в примере 53.
2.1.6 Измерение содержания EOS в тканях легких
Так же, как в примере 53.
2.2 Эффект на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
2.2.1. Так же, как в 2.1.1.
2.2.2 Установление животных моделей аллергической бронхиальной астмы у морских свинок
Так же, как в примере 53.
2.2.3 Режим дозирования
Так же, как в 2.1.3.
2.2.4 Регистрация латентного периода бронхиальной астмы
Так же, как в 2.1.4.1.
2.2.5 Измерение IgE в сыворотке и BALF
Так же, как в примере 53.
2.3 Статистический метод
Так же, как в примере 53.
3. Результаты
3.1 Эффект композиции 4 на аллергическую бронхиальную астму у крыс, вызванную OVA
3.1.1 Эффект на латентный период бронхиальной астмы, индуцированной у крыс
Результаты показаны в таблице 1 (см. в графической части). Латентные периоды бронхиальной астмы, индуцированной у крыс из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у крыс в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01).
3.1.2 Эффект на содержание сывороточного IL-4 и IFN-γ у крыс
Экспериментальные результаты показаны в таблице 2 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сывороточного IFN-γ (Р<0,01), но значительно увеличенное содержание сывороточного IL-4 (Р<0,01), указывая на тяжелый дисбаланс соотношения IFN-γ/IL-4 во время манифестаций бронхиальной астмы. По сравнению с модельной группой все из группы дексаметазона и получающих среднюю и высокую дозы исследуемого лекарственного средства групп показали значительно пониженное содержание IL-4 (Р<0,05 или Р<0,01) и значительно увеличенное содержание IFN-γ (Р<0,05 или Р<0,01), указывая на то, что исследуемое лекарственное средство может корректировать несбалансированное соотношение IFN-γ/IL-4.
3.1.3 Эффект на содержание EOS в тканях легких у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество EOS у крыс в модельной группе значительно увеличивалось (Р<0,01). По сравнению с модельной группой положительная контрольная группа и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное количество EOS (Р<0,01), указывая на то, что композиция 4 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет снижения содержания EOS в тканях легких у крыс.
3.2 Эффект композиции 4 на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
3.2.1 Эффект на латентный период бронхиальной астмы, индуцированной у морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования латентные периоды бронхиальной астмы, индуцированной у морских свинок из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у морских свинок в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01), указывая на то, что композиция 4 существенно улучшает симптомы бронхиальной астмы у морских свинок.
3.2.2 Эффект на общий IgE в сыворотке и BALF у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). Содержание общего IgE в сыворотке и BALF в модельной группе значительно увеличивалось (Р<0,01). По сравнению с модельной группой все содержания общего IgE в сыворотке и BALF в группе дексаметазона и в получающих средние и высокие дозы исследуемого лекарственного средства группах значительно снижались (Р<0,01 или Р<0,05), указывая на то, что как дексаметазон, так и исследуемое лекарственное средство могут ингибировать аллергический воспалительный ответ в легких морских свинок и облегчать симптомы бронхиальной астмы.
3.2.3 Эффект на содержание EOS в тканях легких у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). По сравнению с группой холостого контроля количества EOS у морских свинок в модельной группе значительно увеличивались (Р<0,01). По сравнению модельной группой количества EOS в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах значительно уменьшались (Р<0,01), указывая на то, что композиция 4 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет уменьшения содержания EOS в тканях легких у морских свинок.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 4 способна значительно облегчать симптомы бронхиальной астмы у крыс и пролонгировать латентный период бронхиальной астмы, индуцированной у морских свинок в модельных группах; уменьшать содержание сывороточного IL-4, увеличивать содержание сывороточного IFN-γ и корректировать несбалансированное соотношение IFN-γ/IL-4 у крыс с бронхиальной астмой; уменьшать количества EOS в тканях легких крыс и морских свинок, и ослаблять инфильтрацию EOS в участках воспаления; уменьшать содержание общего IgE в сыворотке и BALF у морских свинок и облегчать легочные воспалительные симптомы. Таким образом, композиция 4 считается эффективной в защите от аллергической бронхиальной астмы.
Пример 57. Отчет об эксперименте на животных в отношении действия полученной в примере 5 композиции 5 против аллергии и аллергического дерматита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 5 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,39 г общих сырых лекарственных средств. Его суточная доза потребления, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела.
1.2 Лабораторные животные
Так же, как в примере 51.
1.3 Исходные реагенты
Так же, как в примере 51.
1.4 Исходные инструменты
Так же, как в примере 51.
2. Экспериментальные способы
2.1 Распределение животных по группам
Животные случайным образом делили на группы по 10 животных на группу на основании масс тела. Устанавливали такие группы, как: контрольная модельная группа, получающие низкую, среднюю и высокую дозы композиции 5 группы и группа положительного контроля с использованием лекарственного средства (преднизона).
2.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиции 5, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для мыши составляла: получающая низкую дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 4,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 12,0 г сырого лекарственного средства/кг массы тела, что составляло 5, 10 и 30-кратную суточную дозу потребления для человека соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (16,14 мг сухого порошка/мл, 32,28 мг сухого порошка/мл, и 96,84 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
Суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (8,08 мг сухого порошка/мл, 16,14 мг сухого порошка/мл, и 48,42 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
2.3 Эффект композиции 5 на пассивную анафилаксию (РСА) у крыс, вызванную овальбумином
2.3.1 Получение антисыворотки
Так же, как в примере 51.
2.3.2 Установление крысиной модели сыворотки к овальбумину
Получали сыворотку к овальбумину и ее разводили в соотношении 1:4 или 1:8 физиологическим солевым раствором. 50 крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 5 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 5 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 14 последовательных дней. На 15 день спины крыс брили и интрадермально вводили с помощью инъекции разбавленную сыворотку в две области на каждой стороне по 0,1 мл на каждую область. Через 48 часов 1,0 мл смешанного раствора 1% Эванса голубого и 1% овальбумина в физиологическом солевом растворе вводили с помощью инъекции в хвостовую вену каждой крысы. Через 30 мин производили забор артериальной крови, из нее выделяли сыворотку и содержание гистамина определяли с помощью известного способа. Затем крыс умерщвляли и кожу на их спинах выворачивали для измерения диаметра голубых реакционных пятен для определения различия между получающими дозировку группами и модельной группой. Образец ткани кожи крысы фиксировали нейтральным формальдегидом, дегидратировали с помощью спиртового градиента, заливали парафином и исследовали в отношении дегрануляции тучных клеток в ткани.
2.3.3 Эффект композиции 5 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
Мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 5 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. 5% раствор 2,4-динитрохлорбензола в этаноле наносили на кожу брюшной поверхности (побритую) мышей для сенсибилизации. Внутрижелудочное введение проводили за два дня до сенсибилизации; контрольной модельной группе внутрижелудочно вводили эквивалентный объем дистиллированной воды; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 5 группам внутрижелудочно вводили соответствующие исследуемые растворы в объеме дозирования, составляющем 0,1 мл/10 г массы тела; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 7 дней после сенсибилизации 1% раствор 2,4-динитрохлорбензола наносили на правое ухо, мышей умерщвляли через 24 часа, и оба уха отрезали вдоль основания наружного уха. Диски диаметром 8 мм извлекали с помощью пункции в одинаковом положении на обоих ушах, точно взвешивали на электронных весах и различие в массе между левым и правым ушами принимали в качестве объема для гиперчувствительности замедленного типа.
2.3.4 Эффект композиции 5 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 5 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. Внутрижелудочное введение проводили мышам один раз в день в течение 10 последовательных дней. Через 30 мин после последнего введения 0,0125% раствор низкомолекулярного декстрана вводили с помощью инъекции в дозе 0,1 г/10 г в хвостовую вену. Число случаев зуда (случаи зуда устанавливали по расчесу на голове с помощью передних лап, расчесу на теле с помощью задних лап и по укусам на различных частях по всему телу), которые происходили в пределах 30 мин после инъекции раствора низкомолекулярного декстрана в хвостовые вены мышей в каждой группе, наблюдали и регистрировали.
2.3.5 Эффект композиции 5 на проницаемость капилляров у крыс
Крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 5 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 5 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 1 час после последнего введения в побритую область (побритую перед введением) на спинах крыс интрадермально вводили с помощью инъекции 1 мг/мл гистамина фосфата в дозе, составляющей 0,1 мл/крыса, и затем в хвостовую вену немедленно вводили инъекцию 1% водного раствора Эванса голубого в дозе, составляющей 1 мл/крыса. Через 20 минут животных умерщвляли путем смещения шейных позвонков. Области кожи с голубыми пятнами отрезали и разрезали на маленькие кусочки, замачивали в 5 мл раствора ацетона: физиологического солевого раствора (7:3) в течение 48 часов, центрифугировали и поглощение супернатанта измеряли при 610 нм.
2.4 Статистический метод
Экспериментальные данные представляли в 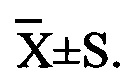 Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 5 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 5 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 5 на пассивную анафилаксию у крыс
Результаты исследования показаны в таблицах 1 и 2 (см. в графической части). По сравнению с контрольной модельной группой получающая низкую дозу композиции 5 группа показала тенденцию к уменьшению диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, к уменьшению дегрануляции тучных клеток и к уменьшению содержания сывороточного гистамина, что, тем не менее, не характеризовалось статистической значимостью; все из контрольной группы преднизона и получающих средние и высокие дозы композиции 5 групп показали эффект в значительном уменьшении диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, уменьшении дегрануляции тучных клеток и уменьшении содержания сывороточного гистамина, со значимым или высокозначимым статистическим различием. Это указывает на то, что композиция 5 характеризовалась значительным ингибирующим эффектом на пассивную анафилаксию у крыс.
3.2 Эффект композиции 5 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
Результаты показаны в таблице 3 (см. в графической части). По сравнению с контрольной модельной группой степень отека дисков наружного уха мыши значительно снижалась в группах, получающих средние и высокие дозы композиции 5, указывая на то, что композиция 5 характеризовалась существенным ингибирующим эффектом на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом.
3.3 Эффект композиции 5 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Результаты исследования показаны в таблице 4 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 5, указывая на то, что композиция 5 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
3.4 Эффект композиции 5 на проницаемость капилляров у крыс
Результаты исследования показаны в таблице 5 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 5, указывая на то, что композиция 5 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 5 является значительно эффективной в ингибировании пассивной анафилаксии у крыс, вызванной овальбумином, что композиция 5 является эффективной в ингибировании гиперчувствительности замедленного типа на коже наружного уха мыши, вызванной 2,4-динитрохлорбензолом, и что композиция 5 является значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом. Вышеперечисленные результаты указывают на хорошую эффективность композиции 5 в защите от аллергии и в профилактике и лечении таких аллергических заболеваний, как аллергический дерматит и крапивница.
Пример 58. Отчет об эксперименте на животных в отношении полученной в примере 5 композиции 5 в профилактике и лечении аллергического ринита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 5 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,39 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 52.
1.3 Исходные реагенты
Так же, как в примере 52.
1.4 Исходные инструменты
Так же, как в примере 52.
2. Экспериментальные способы
2.1 Эффект на аллергический ринит у крыс, вызванный OVA
2.1.1 Распределение животных по группам
Крыс случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс распределяли случайным образом, на основании их оценки в баллах, в следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа Bi-yan-kang) и получающие низкую, среднюю и высокую дозы композиции 5 группы, по 10 животных в каждой группе.
2.1.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 5, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека соответственно. Группе холостого контроля и модельной группе аллергического ринита внутрижелудочно вводили эквивалентный объем физиологического солевого раствора; группе Bi-yan-kang вводили лекарственное средство в дозе, составляющей 410 мг/кг. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Внутрижелудочное введение начинали после успешного моделирования и проводили один раз в день в течение 21 последовательного дня.
2.1.3 Установление животных моделей аллергического ринита у крыс
Так же, как в примере 52.
2.1.4 Индикаторы исследования
Так же, как в примере 52.
2.1.4.1 Измерение сАМР и cGMP в крови
Так же, как в примере 52.
2.1.4.2 Подсчет тучных клеток в слизистой оболочке носа
Так же, как в примере 52.
2.2 Эффект на аллергический ринит у морских свинок, вызванный TDI
2.2.1. Так же, как в 2.1.1.
2.2.2. Так же, как в 2.1.2.
2.2.3 Установление животных моделей аллергического ринита у морских свинок
Так же, как в примере 52.
2.2.4 Индикаторы исследования
Так же, как в примере 52.
2.2.4.1 Наблюдение за поведением морских свинок
Так же, как в примере 52.
2.2.4.2 Количества эозинофилов (EOS) в носовом секрете
Так же, как в примере 52.
2.2.4.3 Измерение содержания общего сывороточного IgE и гистамина в крови
Так же, как в примере 52.
2.2.4.4 Измерение толщины слизистой оболочки носа
Так же, как в примере 52.
2.3 Статистический метод
Экспериментальные данные представляли в 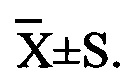 Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 5 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 5 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 5 на аллергический ринит у крыс, вызванный овальбумином
3.1.1 Эффект на поведение крыс
Результаты показаны в таблице 2 (см. в графической части). После моделирования баллы для признаков крыс в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.2 Эффект композиции 5 на содержание сАМР и cGMP в сыворотке крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сАМР в сыворотке (Р<0,01) и значительно увеличенное содержание cGMP в сыворотке (Р<0,01). По сравнению с контрольной модельной группой группа Bi-yan-kang и все получающие исследуемое лекарственное средство группы показали значительно увеличенное содержание с AMP в сыворотке (Р<0,01 или Р<0,05); группа Bi-yan-kang и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное содержание cGMP в сыворотке (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.3 Эффект композиции 5 на тучные клетки в слизистой оболочке носа у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество тучных клеток в слизистой оболочке носа в контрольной модельной группе значительно увеличивалось с высокозначимым различием (Р<0,01). По сравнению с контрольной модельной группой все количества тучных клеток в слизистой оболочке носа в группе Bi-yan-kang и группах лечения исследуемым лекарственным средством значительно снижались со значимым различием (Р<0,01).
3.2 Эффект композиции 5 на аллергический ринит у морских свинок, вызванный TDI
3.2.1 Эффект на поведение морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования баллы для признаков морских свинок в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.2.2 Эффект на содержание гистамина в крови и общего сывороточного IgE у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). По сравнению с группой холостого контроля содержания как гистамина в крови, так и общего сывороточного IgE в модельной группе увеличивались (Р<0,01), указывая на успешное экспериментальное моделирование. По сравнению модельной группой поглощение флуоресценции концентрации гистамина и общего сывороточного IgE в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалось (Р<0,01 или Р<0,05), причем содержание гистамина в получающих среднюю и высокую дозы группах уменьшалось почти до нормального содержания, указывая на то, что композиция 5 являлась эффективной в лечении аллергического ринита путем ингибирования содержания гистамина в крови и сывороточного IgE.
3.2.3 Эффект на эозинофилы (EOS) в носовом секрете морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). Количество эозинофилов в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все количества эозинофилов в группе Bi-yan-kang и в получающих лечение лекарственным средством группах значительно снижались (Р<0,05 или Р<0,01).
3.2.4 Эффект на толщину слизистой оболочки носа у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). В результате по сравнению с группой холостого контроля в модельной группе эпителий слизистой оболочки на носовой перегородке морских свинок отслаивался в различной степени, характеризуясь неоднородной толщиной и неясной базальной структурой; венулы и капилляры в собственной пластинке демонстрировали заметное расширение, тканевое пространство расширялось, и толщина слизистой оболочки значительно увеличивалась (Р<0,01). По сравнению с контрольной модельной группой вышеперечисленные патологические изменения в группе Bi-yan-kang и в получающих лечение лекарственным средством группах снижались и толщина слизистой оболочки значительно уменьшалась (Р<0,01).
4. Вывод
Экспериментальные исследования на животных демонстрируют, что эффективность композиции 5, главным образом, отражается в следующих аспектах: 1) она способна значительно уменьшить балл назального симптома смоделированных крыс, увеличить содержание сАМР в сыворотке и уменьшить содержание cGMP у крыс с аллергическим ринитом; 2) уменьшить количество тучных клеток в слизистой оболочке носа у крыс и уменьшить их инфильтрацию в участках воспаления; 3) она способна уменьшить балл назального симптома смоделированных морских свинок; 4) уменьшить количество EOS в носовом секрете морских свинок и снизить инфильтрацию EOS в участках воспаления; 5) она способна значительно уменьшить концентрацию гистамина в крови у морских свинок и снизить содержание медиаторов воспаления; 6) облегчить отек в слизистой оболочке носа морских свинок. В соответствии с результатами экспериментальных исследований считают, что композиция 5 является эффективной в защите от аллергического ринита.
Пример 59. Отчет об эксперименте на животных в отношении действия полученной в примере 5 композиции 5 в профилактике и лечении аллергической бронхиальной астмы
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 5 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,39 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 53.
1.3 Исходные реагенты
Так же, как в примере 53.
1.4 Исходные инструменты
Так же, как в примере 53.
2. Экспериментальные способы
2.1 Эффект на аллергическую бронхиальную астму у крыс, вызванную OVA
2.1.1 Распределение животных по группам
Крысы (половина из которых являлись самцами и другая половина - самками) случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс случайным образом делили на следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа дексаметазона) и получающие низкую, среднюю и высокую дозы композиции 5 группы, по 10 животных в каждой группе.
2.1.2 Установление животных моделей аллергической бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.3 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 5, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (8,07 мг сухого порошка/мл, 16,14 мг сухого порошка/мл, 48,43 мг сухого порошка/мл) для проведения экспериментов. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Контрольной модельной группе внутрижелудочно вводили эквивалентный объем 0,9% физиологического солевого раствора за 30 минут до сенсибилизации; и получающей лекарственное средство положительной группе вводили дексаметазон в дозе, составляющей 0,5 мг/кг за 30 мин до каждой сенсибилизации. Каждой из получающих низкую, среднюю и высокую дозы композиции 5 групп внутрижелудочно вводили соответствующую дозу исследуемого лекарственного средства за 30 мин до каждой сенсибилизации. При этом группе холостого контроля интраперитонеально вводили с помощью инъекции эквивалентный объем 0,9% физиологического солевого раствора, сенсибилизировали путем его распыления или вводили его внутрижелудочно. Внутрижелудочное введение проводили один раз в день в течение 21 последовательного дня.
2.1.4 Регистрация латентного периода бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.5 Измерения содержаний IL-4 и IFN-γ
Так же, как в примере 53.
2.1.6 Измерение содержания EOS в тканях легких
Так же, как в примере 53.
2.2 Эффект на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
2.2.1. Так же, как в 2.1.1.
2.2.2 Установление животных моделей аллергической бронхиальной астмы у морских свинок
Так же, как в примере 53.
2.2.3 Режим дозирования
Так же, как в 2.1.3.
2.2.4 Регистрация латентного периода бронхиальной астмы
Так же, как в 2.1.4.1.
2.2.5 Измерение IgE в сыворотке и BALF
Использовали сэндвич-радиоиммуноанализ с двойным антителом.
2.3 Статистический метод
Так же, как в примере 53.
3. Результаты
3.1 Эффект композиции 5 на аллергическую бронхиальную астму у крыс, вызванную OVA
3.1.1 Эффект на латентный период бронхиальной астмы, индуцированной у крыс
Результаты показаны в таблице 1 (см. в графической части). Латентные периоды бронхиальной астмы, индуцированной у крыс из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у крыс в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01).
3.1.2 Эффект на содержание сывороточного IL-4 и IFN-γ у крыс
Экспериментальные результаты показаны в таблице 2 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сывороточного IFN-γ (Р<0,01), но значительно увеличенное содержание сывороточного IL-4 (Р<0,01), указывая на тяжелый дисбаланс соотношения IFN-γ/IL-4 во время манифестаций бронхиальной астмы. По сравнению модельной группой все из группы дексаметазона и получающих среднюю и высокую дозы исследуемого лекарственного средства групп показали значительно пониженное содержание IL-4 (Р<0,05 или Р<0,01) и значительно увеличенное содержание IFN-γ (Р<0,05 или Р<0,01), указывая на то, что исследуемое лекарственное средство может корректировать несбалансированное соотношение IFN-γ/IL-4.
3.1.3 Эффект на содержание EOS в тканях легких у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество EOS у крыс в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой положительная контрольная группа и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное количество EOS (Р<0,01), указывая на то, что композиция 5 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет снижения содержания EOS в тканях легких у крыс.
3.2 Эффект композиции 5 на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
3.2.1 Эффект на латентный период бронхиальной астмы, индуцированной у морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования латентные периоды бронхиальной астмы, индуцированной у морских свинок из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у морских свинок в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01), указывая на то, что композиция 5 существенно улучшает симптомы бронхиальной астмы у морских свинок.
3.2.2 Эффект на общий IgE в сыворотке и BALF у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). Содержание общего IgE в сыворотке и BALF в модельной группе значительно увеличивалось (Р<0,01). По сравнению с модельной группой все содержания общего IgE в сыворотке и BALF в группе дексаметазона и в получающих средние и высокие дозы исследуемого лекарственного средства группах значительно снижались (Р<0,01 или Р<0,05), указывая на то, что как дексаметазон, так и исследуемое лекарственное средство могут ингибировать аллергический воспалительный ответ в легких морских свинок и облегчать симптомы бронхиальной астмы.
3.2.3 Эффект на содержание EOS в тканях легких у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). По сравнению с группой холостого контроля количества EOS у морских свинок в модельной группе значительно увеличивались (Р<0,01). По сравнению модельной группой количества EOS в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах значительно уменьшались (Р<0,01), указывая на то, что композиция 5 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет уменьшения содержания EOS в тканях легких у морских свинок.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 5 способна значительно облегчать симптомы бронхиальной астмы у крыс и пролонгировать латентный период бронхиальной астмы, индуцированной у морских свинок в модельных группах; уменьшать содержания сывороточного IL-4, увеличивать содержание сывороточного IFN-γ, и корректировать несбалансированное соотношение IFN-γ/IL-4 у крыс с бронхиальной астмой; уменьшать количества EOS в тканях легких крыс и морских свинок, и ослаблять инфильтрацию EOS в участках воспаления; уменьшать содержания общего IgE в сыворотке и BALF у морских свинок и облегчать легочные воспалительные симптомы. Таким образом, композиция 5 считается эффективной в защите от аллергической бронхиальной астмы.
Пример 60. Отчет об эксперименте на животных в отношении действия полученной в примере 6 композиции 6 против аллергии и аллергического дерматита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 6 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis и Flos Rosae Rugosae), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,56 г общих сырых лекарственных средств. Его суточная доза потребления, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела.
1.2 Лабораторные животные
Так же, как в примере 51.
1.3 Исходные реагенты
Так же, как в примере 51.
1.4 Исходные инструменты
Так же, как в примере 51.
2. Экспериментальные способы
2.1 Распределение животных по группам
Животные случайным образом делили на группы по 10 животных на группу на основании масс тела. Устанавливали такие группы, как: контрольная модельная группа, получающие низкую, среднюю и высокую дозы композиции 6 группы и группа положительного контроля с использованием лекарственного средства (преднизона).
2.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиции 6, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для мыши составляла: получающая низкую дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 4,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 12,0 г сырого лекарственного средства/кг массы тела, что составляло 5, 10 и 30-кратную суточную дозу потребления для человека соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (15,925 мг сухого порошка/мл, 31,85 мг сухого порошка/мл, и 95,55 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
Суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (7,96 мг сухого порошка/мл, 15,92 мг сухого порошка/мл, и 47,76 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
2.3 Эффект композиции 6 на пассивную анафилаксию (РСА) у крыс, вызванную овальбумином
2.3.1 Получение антисыворотки
Так же, как в примере 51.
2.3.2 Установление крысиной модели сыворотки к овальбумину
Получали сыворотку к овальбумину и ее разводили в соотношении 1:4 или 1:8 физиологическим солевым раствором. 50 крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 6 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 6 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 14 последовательных дней. На 15 день спины крыс брили и интрадермально вводили с помощью инъекции разбавленную сыворотку в две области на каждой стороне по 0,1 мл на каждую область. Через 48 часов 1,0 мл смешанного раствора 1% Эванса голубого и 1% овальбумина в физиологическом солевом растворе вводили с помощью инъекции в хвостовую вену каждой крысы. Через 30 мин производили забор артериальной крови, из нее выделяли сыворотку и содержание гистамина определяли с помощью известного способа. Затем крыс умерщвляли и кожу на их спинах выворачивали для измерения диаметра голубых реакционных пятен для определения различия между получающими дозировку группами и модельной группой. Образец ткани кожи крысы фиксировали нейтральным формальдегидом, дегидратировали с помощью спиртового градиента, заливали парафином и исследовали в отношении дегрануляции тучных клеток в ткани.
2.3.3 Эффект композиции 6 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
50 мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 6 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. 5% раствор 2,4-динитрохлорбензола в этаноле наносили на кожу брюшной поверхности (побритую) мышей для сенсибилизации. Внутрижелудочное введение проводили за два дня до сенсибилизации; контрольной модельной группе внутрижелудочно вводили эквивалентный объем дистиллированной воды; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 6 группам внутрижелудочно вводили соответствующие исследуемые растворы в объеме дозирования, составляющем 0,1 мл/10 г массы тела; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 7 дней после сенсибилизации 1% раствор 2,4-динитрохлорбензола наносили на правое ухо, мышей умерщвляли через 24 часа и оба уха отрезали вдоль основания наружного уха. Диски диаметром 8 мм извлекали с помощью пункции в одинаковом положении на обоих ушах, точно взвешивали на электронных весах и различие в массе между левым и правым ушами принимали в качестве объема для гиперчувствительности замедленного типа.
2.3.4 Эффект композиции 6 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 6 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. Внутрижелудочное введение проводили мышам один раз в день в течение 10 последовательных дней. Через 30 мин после последнего введения 0,0125% раствор низкомолекулярного декстрана вводили с помощью инъекции в дозе 0,1 г/10 г в хвостовую вену. Число случаев зуда (случаи зуда устанавливали по расчесу на голове с помощью передних лап, расчесу на теле с помощью задних лап и по укусам на различных частях по всему телу), которые происходили в пределах 30 мин после инъекции раствора низкомолекулярного декстрана в хвостовые вены мышей в каждой группе, наблюдали и регистрировали.
2.3.5 Эффект композиции 6 на проницаемость капилляров у крыс
Крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 6 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 6 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 1 час после последнего введения в побритую область (побритую перед введением) на спинах крыс интрадермально вводили с помощью инъекции 1 мг/мл гистамина фосфата в дозе, составляющей 0,1 мл/крыса, и затем в хвостовую вену немедленно вводили инъекцию 1% водного раствора Эванса голубого в дозе, составляющей 1 мл/крыса. Через 20 минут животных умерщвляли путем смещения шейных позвонков. Области кожи с голубыми пятнами отрезали и разрезали на маленькие кусочки, замачивали в 5 мл раствора ацетона : физиологического солевого раствора (7:3) в течение 48 часов, центрифугировали и поглощение супернатанта измеряли при 610 нм.
2.4 Статистический метод
Экспериментальные данные представляли в 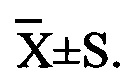 . Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 6 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
. Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 6 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 6 на пассивную анафилаксию у крыс
Результаты исследования показаны в таблицах 1 и 2 (см. в графической части). По сравнению с контрольной модельной группой получающая низкую дозу композиции 6 группа показала тенденцию к уменьшению диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, к снижению дегрануляции тучных клеток и к уменьшению содержания сывороточного гистамина, что, тем не менее, не характеризовалось статистической значимостью; все из контрольной группы преднизона и групп, получающих средние и высокие дозы композиции 6, показали эффект в значительном уменьшении диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, уменьшении дегрануляции тучных клеток и уменьшении содержания сывороточного гистамина, со значимым или высокозначимым статистическим различием. Это указывает на то, что композиция 6 характеризовалась значительным ингибирующим эффектом на пассивную анафилаксию у крыс.
3.2 Эффект композиции 6 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
Результаты показаны в таблице 3 (см. в графической части). По сравнению с контрольной модельной группой степень отека дисков наружного уха мыши значительно снижалась в группах, получающих средние и высокие дозы композиции 6, указывая на то, что композиция 6 характеризовалась существенным ингибирующим эффектом на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом.
3.3 Эффект композиции 6 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Результаты исследования показаны в таблице 4 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 6, указывая на то, что композиция 6 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
3.4 Эффект композиции 6 на проницаемость капилляров у крыс
Результаты исследования показаны в таблице 5 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 6, указывая на то, что композиция 6 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 6 является значительно эффективной в ингибировании пассивной анафилаксии у крыс, вызванной овальбумином, что композиция 6 является эффективной в ингибировании гиперчувствительности замедленного типа на коже наружного уха мыши, вызванной 2,4-динитрохлорбензолом, и что композиция 6 является значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом. Вышеперечисленные результаты указывают на хорошую эффективность композиции 6 в защите от аллергии и в профилактике и лечении таких аллергических заболеваний, как аллергический дерматит и крапивница.
Пример 61. Отчет об эксперименте на животных в отношении действия полученной в примере 6 композиции 6 в профилактике и лечении аллергического ринита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 6 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis и Flos Rosae Rugosae), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,56 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 52.
1.3 Исходные реагенты
Так же, как в примере 52.
1.4 Исходные инструменты
Так же, как в примере 52.
2. Экспериментальные способы
2.1 Эффект на аллергический ринит у крыс, вызванный OVA
2.1.1 Распределение животных по группам
Крыс случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс распределяли случайным образом, на основании их оценки в баллах, в следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа Bi-yan-kang) и получающие низкую, среднюю и высокую дозы композиции 6 группы, по 10 животных в каждой группе.
2.1.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 6, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Группе холостого контроля и модельной группе аллергического ринита внутрижелудочно вводили эквивалентный объем физиологического солевого раствора; группе Bi-yan-kang вводили лекарственное средство в дозе, составляющей 410 мг /кг. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Внутрижелудочное введение начинали после успешного моделирования и проводили один раз в день в течение 21 последовательного дня.
2.1.3 Установление животных моделей аллергического ринита у крыс
Так же, как в примере 52.
2.1.4 Индикаторы исследования
Так же, как в примере 52.
2.1.4.1 Измерение сАМР и cGMP в крови
Так же, как в примере 52.
2.1.4.2 Подсчет тучных клеток в слизистой оболочке носа
Так же, как в примере 52.
2.2 Эффект на аллергический ринит у морских свинок, вызванный TDI
2.2.1. Так же, как в 2.1.1.
2.2.2. Так же, как в 2.1.2.
2.2.3 Установление животных моделей аллергического ринита у морских свинок
Так же, как в примере 52.
2.2.4 Индикаторы исследования
Так же, как в примере 52.
2.2.4.1 Наблюдение за поведением морских свинок
Так же, как в примере 52.
2.2.4.2 Количества эозинофилов (EOS) в носовом секрете
Так же, как в примере 52.
2.2.4.3 Измерение содержания общего сывороточного IgE и гистамина в крови
Так же, как в примере 52.
2.2.4.4 Измерение толщины слизистой оболочки носа
Так же, как в примере 52.
2.3 Статистический метод
Экспериментальные данные представляли в 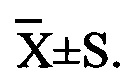 . Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 6 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
. Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 6 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 6 на аллергический ринит у крыс, вызванный овальбумином
3.1.1 Эффект на поведение крыс
Результаты показаны в таблице 2 (см. в графической части). После моделирования баллы для признаков крыс в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалась (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.2 Эффект композиции 6 на содержание сАМР и cGMP в сыворотке крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сАМР в сыворотке (Р<0,01) и значительно увеличенное содержание cGMP в сыворотке (Р<0,01). По сравнению с контрольной модельной группой группа Bi-yan-kang и все получающие исследуемое лекарственное средство группы показали значительно увеличенное содержание сАМР в сыворотке (Р<0,01 или Р<0,05); группа Bi-yan-kang и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное содержание cGMP в сыворотке (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.3 Эффект композиции 6 на тучные клетки в слизистой оболочке носа у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество тучных клеток в слизистой оболочке носа в контрольной модельной группе значительно увеличивалось с высокозначимым различием (Р<0,01). По сравнению с контрольной модельной группой все количества тучных клеток в слизистой оболочке носа в группе Bi-yan-kang и группах лечения исследуемым лекарственным средством значительно снижались со значимым различием (Р<0,01).
3.2 Эффект композиции 6 на аллергический ринит у морских свинок, вызванный TDI
3.2.1 Эффект на поведение морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования баллы для признаков морских свинок в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.2.2 Эффект на содержание гистамина в крови и общего сывороточного IgE у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). По сравнению с группой холостого контроля содержания как гистамина в крови, так и общего сывороточного IgE в модельной группе увеличивались (Р<0,01), указывая на успешное экспериментальное моделирование. По сравнению модельной группой поглощение флуоресценции концентрации гистамина и общего сывороточного IgE в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалось (Р<0,01 или Р<0,05), причем содержание гистамина в получающих среднюю и высокую дозы группах уменьшалось почти до нормального содержания, указывая на то, что композиция 6 являлась эффективной в лечении аллергического ринита за счет ингибирования содержания гистамина в крови и сывороточного IgE.
3.2.3 Эффект на эозинофилы (EOS) в носовом секрете морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). Количество эозинофилов в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все количества эозинофилов в группе Bi-yan-kang и в получающих лечение лекарственным средством группах значительно снижались (Р<0,05 или Р<0,01).
3.2.4 Эффект на толщину слизистой оболочки носа у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). В результате по сравнению с группой холостого контроля в модельной группе эпителий слизистой оболочки на носовой перегородке морских свинок отслаивался в различной степени, характеризуясь неоднородной толщиной и неясной базальной структурой; венулы и капилляры в собственной пластинке демонстрировали заметное расширение, тканевое пространство расширялось и толщина слизистой оболочки значительно увеличивалась (Р<0,01). По сравнению с контрольной модельной группой вышеперечисленные патологические изменения в группе Bi-yan-kang и в получающих лечение лекарственным средством группах снижались и толщина слизистой оболочки значительно уменьшалась (Р<0,01).
4. Вывод
Экспериментальные исследования на животных демонстрируют, что эффективность композиции 6, главным образом, отражается в следующих аспектах: 1) она способна значительно уменьшить балл назального симптома смоделированных крыс, увеличить содержание сАМР в сыворотке и уменьшить содержание cGMP у крыс с аллергическим ринитом; 2) уменьшить количество тучных клеток в слизистой оболочке носа у крыс и уменьшить их инфильтрацию в участках воспаления; 3) она способна уменьшить балл назального симптома смоделированных морских свинок; 4) уменьшить количество EOS в носовом секрете морских свинок и снизить инфильтрацию EOS в участках воспаления; 5) она способна значительно уменьшить концентрацию гистамина в крови у морских свинок и снизить содержание медиаторов воспаления; 6) облегчить отек в слизистой оболочке носа морских свинок. В соответствии с результатами экспериментальных исследований считают, что композиция 6 является эффективной в защите от аллергического ринита.
Пример 62. Отчет об эксперименте на животных в отношении действия полученной в примере 6 композиции 6 в профилактике и лечении аллергической бронхиальной астмы
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 6 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis и Flos Rosae Rugosae), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,56 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 53.
1.3 Исходные реагенты
Так же, как в примере 53.
1.4 Исходные инструменты
Так же, как в примере 53.
2. Экспериментальные способы
2.1 Эффект на аллергическую бронхиальную астму у крыс, вызванную OVA
2.1.1 Распределение животных по группам
Крысы (половина из которых являлись самцами и другая половина - самками) случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс случайным образом делили на следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа дексаметазона) и получающие низкую, среднюю и высокую дозы композиции 6 группы, по 10 животных в каждой группе.
2.1.2 Установление животных моделей аллергической бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.3 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 6, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (7,96 мг сухого порошка/мл, 15,92 мг сухого порошка/мл, 47,77 мг сухого порошка/мл) для проведения экспериментов. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Контрольной модельной группе внутрижелудочно вводили эквивалентный объем 0,9% физиологического солевого раствора за 30 минут до сенсибилизации; и получающей лекарственное средство положительной группе вводили дексаметазон в дозе, составляющей 0,5 мг/кг за 30 мин до каждой сенсибилизации. Каждой из получающих низкую, среднюю и высокую дозы композиции 6 групп внутрижелудочно вводили соответствующую дозу исследуемого лекарственного средства за 30 мин до каждой сенсибилизации. При этом группе холостого контроля интраперитонеально вводили с помощью инъекции эквивалентный объем 0,9% физиологического солевого раствора, сенсибилизировали путем его распыления или вводили его внутрижелудочно. Внутрижелудочное введение проводили один раз в день в течение 21 последовательного дня.
2.1.4 Регистрация латентного периода бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.5 Измерения содержаний IL-4 и IFN-γ
Так же, как в примере 53.
2.1.6 Измерение содержания EOS в тканях легких
Так же, как в примере 53.
2.2 Эффект на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
2.2.1. Так же, как в 2.1.1.
2.2.2 Установление животных моделей аллергической бронхиальной астмы у морских свинок
Так же, как в примере 53.
2.2.3 Режим дозирования
Так же, как в 2.1.3.
2.2.4 Регистрация латентного периода бронхиальной астмы
Так же, как в 2.1.4.1.
2.2.5 Измерение IgE в сыворотке и BALF
Так же, как в примере 53.
2.3 Статистический метод
Так же, как в примере 53.
3 Результаты
3.1 Эффект композиции 6 на аллергическую бронхиальную астму у крыс, вызванную OVA
3.1.1 Эффект на латентный период бронхиальной астмы, индуцированной у крыс
Результаты показаны в таблице 1 (см. в графической части). Латентные периоды бронхиальной астмы, индуцированной у крыс из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у крыс в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01).
3.1.2 Эффект на содержание сывороточного IL-4 и IFN-γ у крыс
Экспериментальные результаты показаны в таблице 2 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сывороточного IFN-γ (Р<0,01), но значительно увеличенное содержание сывороточного IL-4 (Р<0,01), указывая на тяжелый дисбаланс соотношения IFN-γ/IL-4 во время манифестаций бронхиальной астмы. По сравнению с модельной группой все из группы дексаметазона и получающих среднюю и высокую дозы исследуемого лекарственного средства групп показали значительно пониженное содержание IL-4 (Р<0,05 или Р<0,01) и значительно увеличенное содержание IFN-γ (Р<0,05 или Р<0,01), указывая на то, что исследуемое лекарственное средство может корректировать несбалансированное соотношение IFN-γ/IL-4.
3.1.3 Эффект на содержание EOS в тканях легких у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество EOS у крыс в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой положительная контрольная группа и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное количество EOS (Р<0,01), указывая на то, что композиция 6 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет снижения содержания EOS в тканях легких у крыс.
3.2 Эффект композиции 6 на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
3.2.1 Эффект на латентный период бронхиальной астмы, индуцированной у морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования латентные периоды бронхиальной астмы, индуцированной у морских свинок из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у морских свинок в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01), указывая на то, что композиция 6 существенно улучшает симптомы бронхиальной астмы у морских свинок.
3.2.2 Эффект на общий IgE в сыворотке и BALF у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). Содержание общего IgE в сыворотке и BALF в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все содержания общего IgE в сыворотке и BALF в группе дексаметазона и в получающих средние и высокие дозы исследуемого лекарственного средства группах значительно снижались (Р<0,01 или Р<0,05), указывая на то, что как дексаметазон, так и исследуемое лекарственное средство могут ингибировать аллергический воспалительный ответ в легких морских свинок и облегчать симптомы бронхиальной астмы.
3.2.3 Эффект на содержание EOS в тканях легких у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). По сравнению с группой холостого контроля количества EOS у морских свинок в модельной группе значительно увеличивались (Р<0,01). По сравнению модельной группой количества EOS в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах значительно уменьшались (Р<0,01), указывая на то, что композиция 6 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет уменьшения содержания EOS в тканях легких у морских свинок.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 6 способна значительно облегчать симптомы бронхиальной астмы у крыс и пролонгировать латентный период бронхиальной астмы, индуцированной у морских свинок в модельных группах; уменьшать содержание сывороточного IL-4, увеличивать содержание сывороточного IFN-γ и корректировать несбалансированное соотношение IFN-γ/IL-4 у крыс с бронхиальной астмой; уменьшать количество EOS в тканях легких крыс и морских свинок и ослаблять инфильтрацию EOS в участках воспаления; уменьшать содержание общего IgE в сыворотке и BALF у морских свинок и облегчать легочные воспалительные симптомы. Таким образом, композиция 6 считается эффективной в защите от аллергической бронхиальной астмы.
Пример 63. Отчет об эксперименте на животных в отношении действия полученной в примере 7 композиции 7 против аллергии и аллергического дерматита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 7 (Radix Panacis Quinquefolii, Ganoderma, Cordyceps и Flos Rosae Rugosae), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,19 г общих сырых лекарственных средств. Его суточная доза потребления, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела.
1.2 Лабораторные животные
Так же, как в примере 51.
1.3 Исходные реагенты
Так же, как в примере 51.
1.4 Исходные инструменты
Так же, как в примере 51.
2. Экспериментальные способы
2.1 Распределение животных по группам
Животные случайным образом делили на группы по 10 животных на группу на основании масс тела. Устанавливали такие группы, как контрольная модельная группа, получающие низкую, среднюю и высокую дозы композиции 7 группы и группа положительного контроля с использованием лекарственного средства (преднизона).
2.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиции 7, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для мыши составляла: получающая низкую дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 4,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 12,0 г сырого лекарственного средства/кг массы тела, что составляло 5, 10 и 30-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (16,405 мг сухого порошка/мл, 32,81 мг сухого порошка/мл, и 98,43 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
Суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (8,205 мг сухого порошка/мл, 16,41 мг сухого порошка/мл, и 49,23 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
2.3 Эффект композиции 7 на пассивную анафилаксию (РСА) у крыс, вызванную овальбумином
2.3.1 Получение антисыворотки
Так же, как в примере 51.
2.3.2 Установление крысиных моделей сыворотки к овальбумину
Получали сыворотка к овальбумину и ее разводили в соотношении 1:4 или 1:8 физиологическим солевым раствором. 50 крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 7 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 7 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 14 последовательных дней. На 15 день спины крыс брили и интрадермально вводили с помощью инъекции разбавленную сыворотку в две области на каждой стороне по 0,1 мл на каждую область. Через 48 часов 1,0 мл смешанного раствора 1% Эванса голубого и 1% овальбумина в физиологическом солевом растворе вводили с помощью инъекции в хвостовую вену каждой крысы. Через 30 мин производили забор артериальной крови, из нее выделяли сыворотку и содержание гистамина определяли с помощью способа Затем крыс умерщвляли и кожу на их спинах выворачивали для измерения диаметра голубых реакционных пятен для определения различия между получающими дозировку группами и модельной группой. Образец ткани кожи крысы фиксировали нейтральным формальдегидом, дегидратировали с помощью спиртового градиента, заливали парафином и исследовали в отношении дегрануляции тучных клеток в ткани.
2.3.3 Эффект композиции 7 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
50 мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 7 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. 5% раствор 2,4-динитрохлорбензола в этаноле наносили на кожу брюшной поверхности (побритую) мышей для сенсибилизации. Внутрижелудочное введение проводили за два дня до сенсибилизации; контрольной модельной группе внутрижелудочно вводили эквивалентный объем дистиллированной воды; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 7 группам внутрижелудочно вводили соответствующие исследуемые растворы в объеме дозирования, составляющем 0,1 мл/10 г массы тела; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 7 дней после сенсибилизации 1% раствор 2,4-динитрохлорбензола наносили на правое ухо, мышей умерщвляли через 24 часа и оба уха отрезали вдоль основания наружного уха. Диски диаметром 8 мм извлекали с помощью пункции в одинаковом положении на обоих ушах, точно взвешивали на электронных весах и различие в массе между левым и правым ушами принимали в качестве объема для гиперчувствительности замедленного типа.
2.3.4 Эффект композиции 7 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 7 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. Внутрижелудочное введение проводили мышам один раз в день в течение 10 последовательных дней. Через 30 мин после последнего введения 0,0125% раствор низкомолекулярного декстрана вводили с помощью инъекции в дозе 0,1 г/10 г в хвостовую вену. Число случаев зуда (случаи зуда устанавливали по расчесу на голове с помощью передних лап, расчесу на теле с помощью задних лап и по укусам на различных частях по всему телу), которые происходили в пределах 30 мин после инъекции раствора низкомолекулярного декстрана в хвостовые вены мышей в каждой группе, наблюдали и регистрировали.
2.3.5 Эффект композиции 7 на проницаемость капилляров у крыс
Крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 7 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 7 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 1 час после последнего введения в побритую область (побритую перед введением) на спинах крыс интрадермально вводили с помощью инъекции 1 мг/мл гистамина фосфата в дозе, составляющей 0,1 мл/крыса, и затем в хвостовую вену немедленно вводили инъекцию 1% водного раствора Эванса голубого в дозе, составляющей 1 мл/крыса. Через 20 минут животных умерщвляли путем смещения шейных позвонков. Области кожи с голубыми пятнами отрезали и разрезали на маленькие кусочки, замачивали в 5 мл раствора ацетона: физиологического солевого раствора (7:3) в течение 48 часов, центрифугировали и поглощение супернатанта измеряли при 610 нм.
2.4 Статистический метод
Экспериментальные данные представляли в 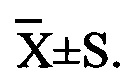 . Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 7 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
. Однофакторный дисперсионный анализ использовали для сравнения различий среди контрольной модельной группы и получающих различные дозы композиции 7 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 7 на пассивную анафилаксию у крыс
Результаты исследования показаны в таблицах 1 и 2 (см. в графической части). По сравнению с контрольной модельной группой получающая низкую дозу композиции 7 группа показала тенденцию к уменьшению диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, к снижению дегрануляции тучных клеток и к уменьшению содержания сывороточного гистамина, что, тем не менее, не характеризовалось статистической значимостью; все из контрольной группы преднизона и получающих средние и высокие дозы композиции 7 групп показали эффект в значительном уменьшении диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, уменьшении дегрануляции тучных клеток и уменьшении содержания сывороточного гистамина, со значимым или высокозначимым статистическим различием. Это указывает на то, что композиция 7 характеризовалась значительным ингибирующим эффектом на пассивную анафилаксию у крыс.
3.2 Эффект композиции 7 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
Результаты показаны в таблице 3 (см. в графической части). По сравнению с контрольной модельной группой степень отека дисков наружного уха мыши значительно снижалась в группах, получающих средние и высокие дозы композиции 7, указывая на то, что композиция 7 характеризовалась существенным ингибирующим эффектом на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом.
3.3 Эффект композиции 7 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Результаты исследования показаны в таблице 4 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 7, указывая на то, что композиция 7 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
3.4 Эффект композиции 7 на проницаемость капилляров у крыс
Результаты исследования показаны в таблице 5 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 7, указывая на то, что композиция 7 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 7 является значительно эффективной в ингибировании пассивной анафилаксии у крыс, вызванной овальбумином, что композиция 7 является эффективной в ингибировании гиперчувствительности замедленного типа на коже наружного уха мыши, вызванной 2,4-динитрохлорбензолом, и что композиция 7 является значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом. Вышеперечисленные результаты указывают на хорошую эффективность композиции 7 в защите от аллергии и в профилактике и лечении таких аллергических заболеваний, как аллергический дерматит и крапивница.
Пример 64. Отчет об эксперименте на животных в отношении действия полученной в примере 7 композиции 7 в профилактике и лечении аллергического ринита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 7 (Radix Panacis Quinquefolii, Ganoderma, Cordyceps и Flos Rosae Rugosae), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,19 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 52.
1.3 Исходные реагенты
Так же, как в примере 52.
1.4 Исходные инструменты
Так же, как в примере 52.
2. Экспериментальные способы
2.1 Эффект на аллергический ринит у крыс, вызванный OVA
2.1.1 Распределение животных по группам
Крыс случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс распределяли случайным образом, на основании их оценки в баллах, в следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа Bi-yan-kang) и получающие низкую, среднюю и высокую дозы композиции 7 группы, по 10 животных в каждой группе.
2.1.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 7, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Группе холостого контроля и модельной группе аллергического ринита внутрижелудочно вводили эквивалентный объем физиологического солевого раствора; группе Bi-yan-kang вводили лекарственное средство в дозе, составляющей 410 мг/кг. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Внутрижелудочное введение начинали после успешного моделирования и проводили один раз в день в течение 21 последовательного дня.
2.1.3 Установление животных моделей аллергического ринита у крыс
Так же, как в примере 52.
2.1.4 Индикаторы исследования
Так же, как в примере 52.
2.1.4.1 Измерение сАМР и cGMP в крови
Так же, как в примере 52.
2.1.4.2 Подсчет тучных клеток в слизистой оболочке носа
Так же, как в примере 52.
2.2 Эффект на аллергический ринит у морских свинок, вызванный TDI
2.2.1. Так же, как в 2.1.1.
2.2.2. Так же, как в 2.1.2.
2.2.3 Установление животных моделей аллергического ринита у морских свинок
Так же, как в примере 52.
2.2.4 Индикаторы исследования
Так же, как в примере 52.
2.2.4.1 Наблюдение за поведением морских свинок
Так же, как в примере 52.
2.2.4.2 Количества эозинофилов (EOS) в носовом секрете
Так же, как в примере 52.
2.2.4.3 Измерение содержания общего сывороточного IgE и гистамина в крови
Так же, как в примере 52.
2.2.4.4 Измерение толщины слизистой оболочки носа
Так же, как в примере 52.
2.3 Статистический метод
Экспериментальные данные представляли в 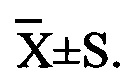 . Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 7 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
. Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 7 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 7 на аллергический ринит у крыс, вызванный овальбумином
3.1.1 Эффект на поведение крыс
Результаты показаны в таблице 2 (см. в графической части). После моделирования баллы для признаков крыс в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.2 Эффект композиции 7 на содержание сАМР и cGMP в сыворотке крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сАМР в сыворотке (Р<0,01) и значительно увеличенное содержание cGMP в сыворотке (Р<0,01). По сравнению с контрольной модельной группой группа Bi-yan-kang и все получающие исследуемое лекарственное средство группы показали значительно увеличенное содержание сАМР в сыворотке (Р<0,01 или Р<0,05); группа Bi-yan-kang и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное содержание cGMP в сыворотке (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.3 Эффект композиции 7 на тучные клетки в слизистой оболочке носа у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество тучных клеток в слизистой оболочке носа в контрольной модельной группе значительно увеличивалось с высокозначимым различием (Р<0,01). По сравнению с контрольной модельной группой все количества тучных клеток в слизистой оболочке носа в группе Bi-yan-kang и группах лечения исследуемым лекарственным средством значительно снижались со значимым различием (Р<0,01)
3.2 Эффект композиции 7 на аллергический ринит у морских свинок, вызванный TDI
3.2.1 Эффект на поведение морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования баллы для признаков морских свинок в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.2.2 Эффект на содержание гистамина в крови и общего сывороточного IgE у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). По сравнению с группой холостого контроля содержания как гистамина в крови, так и общего сывороточного IgE в модельной группе увеличивались (Р<0,01), указывая на успешное экспериментальное моделирование. По сравнению модельной группой поглощение флуоресценции концентрации гистамина и общего сывороточного IgE в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалось (Р<0,01 или Р<0,05), причем содержание гистамина в получающих среднюю и высокую дозы группах уменьшалось почти до нормального содержания, указывая на то, что композиция 7 являлась эффективной в лечении аллергического ринита за счет ингибирования содержания гистамина в крови и сывороточного IgE.
3.2.3 Эффект на эозинофилы (EOS) в носовом секрете морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). Количество эозинофилов в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все количества эозинофилов в группе Bi-yan-kang и в получающих лечение лекарственным средством группах значительно снижались (Р<0,05 или Р<0,01).
3.2.4 Эффект на толщину слизистой оболочки носа у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). В результате по сравнению с группой холостого контроля в модельной группе эпителий слизистой оболочки на носовой перегородке морских свинок отслаивался в различной степени, характеризуясь неоднородной толщиной и неясной базальной структурой; венулы и капилляры в собственной пластинке демонстрировали заметное расширение, тканевое пространство расширялось, и толщина слизистой оболочки значительно увеличивалась (Р<0,01). По сравнению с контрольной модельной группой вышеперечисленные патологические изменения в группе Bi-yan-kang и в получающих лечение лекарственным средством группах снижались и толщина слизистой оболочки значительно уменьшалась (Р<0,01).
4. Вывод
Экспериментальные исследования на животных демонстрируют, что эффективность композиции 7, главным образом, отражается в следующих аспектах: 1) она способна значительно уменьшить балл назального симптома смоделированных крыс, увеличить содержание сАМР в сыворотке и уменьшить содержание cGMP у крыс с аллергическим ринитом; 2) уменьшить количество тучных клеток в слизистой оболочке носа у крыс и уменьшить их инфильтрацию в участках воспаления; 3) она способна уменьшить балл назального симптома смоделированных морских свинок; 4) уменьшить количество EOS в носовом секрете морских свинок и снизить инфильтрацию EOS в участках воспаления; 5) она способна значительно уменьшить концентрацию гистамина в крови у морских свинок и снизить содержание медиаторов воспаления; 6) облегчить отек в слизистой оболочке носа морских свинок. В соответствии с результатами экспериментальных исследований считают, что композиция 7 является эффективной в защите от аллергического ринита.
Пример 65. Отчет об эксперименте на животных в отношении действия полученной в примере 7 композиции 7 в профилактике и лечении аллергической бронхиальной астмы
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 7 (Radix Panacis Quinquefolii, Ganoderma, Cordyceps и Flos Rosae Rugosae), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 12,19 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 53.
1.3 Исходные реагенты
Так же, как в примере 53.
1.4 Исходные инструменты
Так же, как в примере 53.
2. Экспериментальные способы
2.1 Эффект на аллергическую бронхиальную астму у крыс, вызванную OVA
2.1.1 Распределение животных по группам
Крысы (половина из которых являлись самцами и другая половина - самками) случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс случайным образом делили на следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа дексаметазона) и получающие низкую, среднюю и высокую дозы композиции 7, по 10 животных в каждой группе.
2.1.2 Установление животных моделей аллергической бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.3 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 7, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (8,20 мг сухого порошка/мл, 16,41 мг сухого порошка/мл, 49,22 мг сухого порошка/мл) для проведения экспериментов. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Контрольной модельной группе внутрижелудочно вводили эквивалентный объем 0,9% физиологического солевого раствора за 30 минут до сенсибилизации; и получающей лекарственное средство положительной группе вводили дексаметазон в дозе, составляющей 0,5 мг/кг за 30 мин до каждой сенсибилизации. Каждой из получающих низкую, среднюю и высокую дозы композиции 7 групп внутрижелудочно вводили соответствующую дозу исследуемого лекарственного средства за 30 мин до каждой сенсибилизации. При этом группе холостого контроля интраперитонеально вводили с помощью инъекции эквивалентный объем 0,9% физиологического солевого раствора, сенсибилизировали путем его распыления или вводили его внутрижелудочно. Внутрижелудочное введение проводили один раз в день в течение 21 последовательного дня.
2.1.4 Регистрация латентного периода бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.5 Измерения содержаний IL-4 и IFN-γ
Так же, как в примере 53.
2.1.6 Измерение содержания EOS в тканях легких
Так же, как в примере 53.
2.2 Эффект на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
2.2.1. Так же, как в 2.1.1.
2.2.2 Установление животных моделей аллергической бронхиальной астмы у морских свинок
Так же, как в примере 53.
2.2.3 Режим дозирования
Так же, как в 2.1.3.
2.2.4 Регистрация латентного периода бронхиальной астмы
Так же, как в 2.1.4.1.
2.2.5 Измерение IgE в сыворотке и BALF
Так же, как в примере 53.
2.3 Статистический метод
Так же, как в примере 53.
3. Результаты
3.1 Эффект композиции 7 на аллергическую бронхиальную астму у крыс, вызванную OVA
3.1.1 Эффект на латентный период бронхиальной астмы, индуцированной у крыс
Результаты показаны в таблице 1 (см. в графической части). Латентные периоды бронхиальной астмы, индуцированной у крыс из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у крыс в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01).
3.1.2 Эффект на содержание сывороточного IL-4 и IFN-γ у крыс
Экспериментальные результаты показаны в таблице 2 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сывороточного IFN-γ (Р<0,01), но значительно увеличенное содержание сывороточного IL-4 (Р<0,01), указывая на тяжелый дисбаланс соотношения IFN-γ/IL-4 во время манифестаций бронхиальной астмы. По сравнению модельной группой все из группы дексаметазона и получающих среднюю и высокую дозы исследуемого лекарственного средства групп показали значительно пониженное содержание IL-4 (Р<0,05 или Р<0,01) и значительно увеличивалось содержание IFN-γ (Р<0,05 или Р<0,01), указывая на то, что исследуемое лекарственное средство может корректировать несбалансированное соотношение IFN-γ/IL-4.
3.1.3 Эффект на содержание EOS в тканях легких у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество EOS у крыс в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой положительная контрольная группа и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное количество EOS (Р<0,01), указывая на то, что композиция 7 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет снижения содержания EOS в тканях легких у крыс.
3.2 Эффект композиции 7 на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
3.2.1 Эффект на латентный период бронхиальной астмы, индуцированной у морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования латентные периоды бронхиальной астмы, индуцированной у морских свинок из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у морских свинок в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01), указывая на то, что композиция 7 существенно улучшает симптомы бронхиальной астмы у морской свинки.
3.2.2 Эффект на общий IgE в сыворотке и BALF у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). Содержание общего IgE в сыворотке и BALF в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все содержания общего IgE в сыворотке и BALF в группе дексаметазона и в получающих средние и высокие дозы исследуемого лекарственного средства группах значительно снижались (Р<0,01 или Р<0,05), указывая на то, что как дексаметазон, так и исследуемое лекарственное средство могут ингибировать аллергический воспалительный ответ в легких морских свинок и облегчать симптомы бронхиальной астмы.
3.2.3 Эффект на содержание EOS в тканях легких у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). По сравнению с группой холостого контроля количества EOS у морских свинок в модельной группе значительно увеличивались (Р<0,01). По сравнению модельной группой количества EOS в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах значительно уменьшались (Р<0,01), указывая на то, что композиция 7 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет уменьшения содержания EOS в тканях легких у морских свинок.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 7 способна значительно облегчать симптомы бронхиальной астмы у крыс и пролонгировать латентный период бронхиальной астмы, индуцированной у морских свинок в модельных группах; уменьшать содержание сывороточного IL-4, увеличивать содержание сывороточного IFN-γ и корректировать несбалансированное соотношение IFN-γ/IL-4 у крыс с бронхиальной астмой; уменьшать количество EOS в тканях легких крыс и морских свинок и ослаблять инфильтрацию EOS в участках воспаления; уменьшать содержание общего IgE в сыворотке и BALF у морских свинок и облегчать легочные воспалительные симптомы. Таким образом, композиция 7 считается эффективной в защите от аллергической бронхиальной астмы.
Пример 66. Отчет об эксперименте на животных в отношении действия полученной в примере 8 композиции 8 против аллергии и аллергического дерматита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 8 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis, Flos Rosae Rugosae и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 13,78 г общих сырых лекарственных средств. Его суточная доза потребления, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела.
1.2 Лабораторные животные
Так же, как в примере 51.
1.3 Исходные реагенты
Так же, как в примере 51.
1.4 Исходные инструменты
Так же, как в примере 51.
2. Экспериментальные способы
2.1 Распределение животных по группам
Животные случайным образом делили на группы по 10 животных на группу на основании масс тела. Устанавливали такие группы, как контрольная модельная группа, получающие низкую, среднюю и высокую дозы композиции 8 группы и группа положительного контроля с использованием лекарственного средства (преднизона).
2.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиции 8, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для мыши составляла: получающая низкую дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 4,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 12,0 г сырого лекарственного средства/кг массы тела, что составляло 5, 10 и 30-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (14,515 мг сухого порошка/мл, 29,03 мг сухого порошка/мл, и 87,09 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
Суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (7,255 мг сухого порошка/мл, 14,51 мг сухого порошка/мл, и 43,53 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов.
2.3 Эффект композиции 8 на пассивную анафилаксию (РСА) у крыс, вызванную овальбумином
2.3.1 Получение антисыворотки
Так же, как в примере 51.
2.3.2 Установление крысиных моделей сыворотки к овальбумину
Получали сыворотка к овальбумину и ее разводили в соотношении 1:4 или 1:8 физиологическим солевым раствором. 50 крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 8 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 8 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 14 последовательных дней. На 15 день спины крыс брили и интрадермально вводили с помощью инъекции разбавленную сыворотку в две области на каждой стороне по 0,1 мл на каждую область. Через 48 часов 1,0 мл смешанного раствора 1% Эванса голубого и 1% овальбумина в физиологическом солевом растворе вводили с помощью инъекции в хвостовую вену каждой крысы. Через 30 мин производили забор артериальной крови, из нее выделяли сыворотку и содержание гистамина определяли с помощью известного способа. Затем крыс умерщвляли и кожу на их спинах выворачивали для измерения диаметра голубых реакционных пятен для определения различия между получающими дозировку группами и модельной группой. Образец ткани кожи крысы фиксировали нейтральным формальдегидом, дегидратировали с помощью спиртового градиента, заливали парафином и исследовали в отношении дегрануляции тучных клеток в ткани.
2.3.3 Эффект композиции 8 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
50 мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 8 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. 5% раствор 2,4-динитрохлорбензола в этаноле наносили на кожу брюшной поверхности (побритую) мышей для сенсибилизации. Внутрижелудочное введение проводили за два дня до сенсибилизации; контрольной модельной группе внутрижелудочно вводили эквивалентный объем дистиллированной воды; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 8 группам внутрижелудочно вводили соответствующие исследуемые растворы в объеме дозирования, составляющем 0,1 мл/10 г массы тела; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 7 дней после сенсибилизации 1% раствор 2,4-динитрохлорбензола наносили на правое ухо, мышей умерщвляли через 24 часа и оба уха отрезали вдоль основания наружного уха. Диски диаметром 8 мм извлекали с помощью пункции в одинаковом положении на обоих ушах, точно взвешивали на электронных весах и различие в массе между левым и правым ушами принимали в качестве объема для гиперчувствительности замедленного типа.
2.3.4 Эффект композиции 8 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Мышей случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 8 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 мышей на группу. Внутрижелудочное введение проводили мышам один раз в день в течение 10 последовательных дней. Через 30 мин после последнего введения 0,0125% раствор низкомолекулярного декстрана вводили с помощью инъекции в дозе 0,1 г/10 г в хвостовую вену. Число случаев зуда (случаи зуда устанавливали по расчесу на голове с помощью передних лап, расчесу на теле с помощью задних лап и по укусам на различных частях по всему телу), которые происходили в пределах 30 мин после инъекции раствора низкомолекулярного декстрана в хвостовые вены мышей в каждой группе, наблюдали и регистрировали.
2.3.5 Эффект композиции 8 на проницаемость капилляров у крыс
Крыс случайным образом делили на 5 групп, т.е. контрольную модельную группу, получающие низкую, среднюю и высокую дозы композиции 8 группы и группу положительного контроля с использованием лекарственного средства (преднизона), по 10 крыс на группу. Контрольной модельной группе внутрижелудочно вводили дистиллированную воду; группе положительного контроля с использованием лекарственного средства внутрижелудочно вводили преднизон в дозе, составляющей 5 мг/кг; получающим низкую, среднюю и высокую дозы композиции 8 группам внутрижелудочно вводили исследуемые растворы в различных концентрациях в объеме дозирования, составляющем 10 мл/кг; внутрижелудочное введение проводили один раз в день в течение 10 последовательных дней. Через 1 час после последнего введения в побритую область (побритую перед введением) на спинах крыс интрадермально вводили с помощью инъекции 1 мг/мл гистамина фосфата в дозе, составляющей 0,1 мл/крыса, и затем в хвостовую вену немедленно вводили инъекцию 1% водного раствора Эванса голубого в дозе, составляющей 1 мл/крыса. Через 20 минут животных умерщвляли путем смещения шейных позвонков. Области кожи с голубыми пятнами отрезали и разрезали на маленькие кусочки, замачивали в 5 мл раствора ацетона: физиологического солевого раствора (7:3) в течение 48 часов, центрифугировали и поглощение супернатанта измеряли при 610 нм.
2.4 Статистический метод
Так же, как в примере 51.
3. Результаты
3.1 Эффект композиции 8 на пассивную анафилаксию у крыс
Результаты исследования показаны в таблицах 1 и 2 (см. в графической части). По сравнению с контрольной модельной группой получающая низкую дозу композиции 8 группа показала тенденцию к уменьшению диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, к уменьшению дегрануляции тучных клеток и к уменьшению содержания сывороточного гистамина, что, тем не менее, не характеризовалось статистической значимостью; все из контрольной группы преднизона и получающих средние и высокие дозы композиции 8 групп показали эффект в значительном уменьшении диаметра голубых пятен у сенсибилизированных сывороткой к овальбумину в соотношении 1:4 и 1:8 крыс, уменьшении дегрануляции тучных клеток и уменьшении содержания сывороточного гистамина, со значимым или высокозначимым статистическим различием. Это указывает на то, что композиция 8 характеризовалась значительным ингибирующим эффектом на пассивную анафилаксию у крыс.
3.2 Эффект композиции 8 на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом
Результаты показаны в таблице 3 (см. в графической части). По сравнению с контрольной модельной группой степень отека дисков наружного уха мыши значительно снижалась в получающих средние и высокие дозы композиции 8 группах, указывая на то, что композиция 8 характеризовалась существенным ингибирующим эффектом на гиперчувствительность замедленного типа на коже наружного уха мыши, вызванную 2,4-динитрохлорбензолом.
3.3 Эффект композиции 8 на локальный зуд у мышей, вызванный низкомолекулярным декстраном
Результаты исследования показаны в таблице 4 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 8, указывая на то, что композиция 8 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
3.4 Эффект композиции 8 на проницаемость капилляров у крыс
Результаты исследования показаны в таблице 5 (см. в графической части). По сравнению с контрольной модельной группой объем OD значительно снижался в группе крыс, получающих средние и высокие дозы композиции 8, указывая на то, что композиция 8 являлась значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 8 является значительно эффективной в ингибировании пассивной анафилаксии у крыс, вызванной овальбумином, что композиция 8 является эффективной в ингибировании гиперчувствительности замедленного типа на коже наружного уха мыши, вызванной 2,4-динитрохлорбензолом, и что композиция 8 является значительно эффективной в снижении увеличения проницаемости капилляров у крыс, вызванного гистамина фосфатом. Вышеперечисленные результаты указывают на хорошую эффективность композиции 8 в защите от аллергии и в профилактике и лечении таких аллергических заболеваний, как аллергический дерматит и крапивница.
Пример 67. Отчет об эксперименте на животных в отношении действия полученной в примере 8 композиции 8 в профилактике и лечении аллергического ринита
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 8 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis, Flos Rosae Rugosae и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 13,78 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 52.
1.3 Исходные реагенты
Так же, как в примере 52.
1.4 Исходные инструменты
Так же, как в примере 52.
2. Экспериментальные способы
2.1 Эффект на аллергический ринит у крыс, вызванный OVA
2.1.1 Распределение животных по группам
Крыс случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс распределяли случайным образом, на основании их оценки в баллах, в следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа Bi-yan-kang) и получающие низкую, среднюю и высокую дозы композиции 8 группы, по 10 животных в каждой группе.
2.1.2 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 8, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (7,26 мг сухого порошка/мл, 14,51 мг сухого порошка/мл, и 43,54 мг сухого порошка/мл) с помощью дистиллированной воды для проведения экспериментов. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Группе холостого контроля и модельной группе аллергического ринита внутрижелудочно вводили эквивалентный объем физиологического солевого раствора; группе Bi-yan-kang вводили лекарственное средство в дозе, составляющей 410 мг/кг. Внутрижелудочное введение начинали после успешного моделирования и проводили один раз в день в течение 21 последовательного дня.
2.1.3 Установление животных моделей аллергического ринита у крыс
Так же, как в примере 52.
2.1.4 Индикаторы исследования
Так же, как в примере 52.
2.1.4.1 Измерение сАМР и cGMP в крови
Так же, как в примере 52.
2.1.4.2 Подсчет тучных клеток в слизистой оболочке носа
Так же, как в примере 52.
2.2 Эффект на аллергический ринит у морских свинок, вызванный TDI
2.2.1. Так же, как в 2.1.1.
2.2.2. Так же, как в 2.1.2.
2.2.3 Установление животных моделей аллергического ринита у морских свинок
Так же, как в примере 52.
2.2.4 Индикаторы исследования
Так же, как в примере 52.
2.2.4.1 Наблюдение за поведением морских свинок
Так же, как в примере 52.
2.2.4.2 Количества эозинофилов (EOS) в носовом секрете
Так же, как в примере 52.
2.2.4.3 Измерение содержания общего сывороточного IgE и гистамина в крови
Так же, как в примере 52.
2.2.4.4 Измерение толщины слизистой оболочки носа
Так же, как в примере 52.
2.3 Статистический метод
Экспериментальные данные представляли в 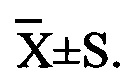 . Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 8 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
. Однофакторный дисперсионный анализ использовали для сравнения различий среди группы холостого контроля, контрольной модельной группы и получающих различные дозы композиции 8 групп. Р<0,05 рассматривали как значимое различие. Р<0,01 рассматривали как высокозначимое различие.
3. Результаты
3.1 Эффект композиции 8 на аллергический ринит у крыс, вызванный овальбумином
3.1.1 Эффект на поведение крыс
Результаты показаны в таблице 2 (см. в графической части). После моделирования баллы для признаков крыс в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.2 Эффект композиции 8 на содержание с AMP и cGMP в сыворотке крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание с AMP в сыворотке (Р<0,01) и значительно увеличенное содержание cGMP в сыворотке (Р<0,01). По сравнению с контрольной модельной группой группа Bi-yan-kang и все получающие исследуемое лекарственное средство группы показали значительно увеличенное содержание сАМР в сыворотке (Р<0,01 или Р<0,05); группа Bi-yan-kang и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное содержание cGMP в сыворотке (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.1.3 Эффект композиции 8 на тучные клетки в слизистой оболочке носа у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество тучных клеток в слизистой оболочке носа в контрольной модельной группе значительно увеличивалось с высокозначимым различием (Р<0,01). По сравнению с контрольной модельной группой все количества тучных клеток в слизистой оболочке носа в группе Bi-yan-kang и группах лечения исследуемым лекарственным средством значительно снижались со значимым различием (Р<0,01).
3.2 Эффект композиции 8 на аллергический ринит у морских свинок, вызванный TDI
3.2.1 Эффект на поведение морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования баллы для признаков морских свинок в каждой смоделированной группе квалифицировали без значимого различия между ними, указывая на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все баллы для признаков в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижались (Р<0,01 или Р<0,05), и получающая низкую дозу группа также показала тенденцию к снижению.
3.2.2 Эффект на содержание гистамина в крови и общего сывороточного IgE у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). По сравнению с группой холостого контроля содержания как гистамина в крови, так и общего сывороточного IgE в модельной группе увеличивались (Р<0,01), указывая на успешное экспериментальное моделирование. По сравнению модельной группой поглощение флуоресценции концентрации гистамина и общего сывороточного IgE в получающих среднюю и высокую дозы исследуемого лекарственного средства группах и в группе Bi-yan-kang значительно снижалось (Р<0,01 или Р<0,05), причем содержание гистамина в получающих среднюю и высокую дозы группах уменьшалось почти до нормального содержания, указывая на то, что композиция 8 являлась эффективной в лечении аллергического ринита за счет ингибирования содержания гистамина в крови и сывороточного IgE.
3.2.3 Эффект на эозинофилы (EOS) в носовом секрете морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). Количество эозинофилов в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все количества эозинофилов в группе Bi-yan-kang и в получающих лечение лекарственным средством группах значительно снижались (Р<0,05 или Р<0,01).
3.2.4 Эффект на толщину слизистой оболочки носа у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). В результате по сравнению с группой холостого контроля в модельной группе эпителий слизистой оболочки на носовой перегородке морских свинок отслаивался в различной степени, характеризуясь неоднородной толщиной и неясной базальной структурой; венулы и капилляры в собственной пластинке демонстрировали заметное расширение, тканевое пространство расширялось, и толщина слизистой оболочки значительно увеличивалась (Р<0,01). По сравнению с контрольной модельной группой вышеперечисленные патологические изменения в группе Bi-yan-kang и в получающих лечение лекарственным средством группах снижались и толщина слизистой оболочки значительно уменьшалась (Р<0,01).
4. Вывод
Экспериментальные исследования на животных демонстрируют, что эффективность композиции 8, главным образом, отражается в следующих аспектах: 1) она способна значительно уменьшить балл назального симптома смоделированных крыс, увеличить содержание сАМР в сыворотке и уменьшить содержание cGMP у крыс с аллергическим ринитом; 2) уменьшить количество тучных клеток в слизистой оболочке носа у крыс и уменьшить их инфильтрацию в участках воспаления; 3) она способна уменьшить балл назального симптома смоделированных морских свинок; 4) уменьшить количество EOS в носовом секрете морских свинок и снизить инфильтрацию EOS в участках воспаления; 5) она способна значительно уменьшить концентрацию гистамина в крови у морских свинок и снизить содержание медиаторов воспаления; 6) облегчить отек в слизистой оболочке носа морских свинок. В соответствии с результатами экспериментальных исследований считают, что композиция 8 является эффективной в защите от аллергического ринита.
Пример 68. Отчет об эксперименте на животных в отношении действия полученной в примере 8 композиции 8 в профилактике и лечении аллергической бронхиальной астмы
1. Материалы и способы
1.1 Источники образцов
Исследуемое лекарственное средство представляло собой композицию 8 (Radix Panacis Quinquefolii, Ganoderma, порошок ферментированного Cordyceps sinensis, Flos Rosae Rugosae и Cordyceps), предоставленную Jiangzhong Pharmaceutical Co. Ltd. в виде композиционного порошка. 1 г сухого композиционного порошка являлся эквивалентным 13,78 г общих сырых лекарственных средств.
1.2 Лабораторные животные
Так же, как в примере 53.
1.3 Исходные реагенты
Так же, как в примере 53.
1.4 Исходные инструменты
Так же, как в примере 53.
2. Экспериментальные способы
2.1 Эффект на аллергическую бронхиальную астму у крыс, вызванную OVA
2.1.1 Распределение животных по группам
Крысы (половина из которых являлись самцами и другая половина - самками) случайным образом делили на две группы, т.е. группу холостого контроля из 10 животных и группу моделирования из 70 животных. После успешного моделирования крыс случайным образом делили на следующие группы: контрольная модельная группа, принимающая лекарственное средство положительная группа (группа дексаметазона) и получающие низкую, среднюю и высокую дозы композиции 8 группы, по 10 животных в каждой группе.
2.1.2 Установление животных моделей аллергической бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.3 Режим дозирования
Суточная доза потребления исследуемого лекарственного средства, композиционного порошка композиции 8, рекомендованная для одного индивидуума, составляла 24 г сырого лекарственного средства/60 кг массы тела. Исходя из этого, расчетная суточная доза потребления для крысы составляла: получающая низкую дозу группа: 1,0 г сырого лекарственного средства/кг массы тела; получающая среднюю дозу группа: 2,0 г сырого лекарственного средства/кг массы тела; получающая высокую дозу группа: 6,0 г сырого лекарственного средства/кг массы тела, что составляло 2,5, 5 и 15-кратную суточную дозу потребления для человека, соответственно. Образцы получали в виде внутрижелудочных растворов в соответствующих концентрациях (7,26 мг сухого порошка/мл, 14,51 мг сухого порошка/мл, 43,54 мг сухого порошка/мл) для проведения экспериментов. Объем внутрижелудочного введения рассчитывали как 1,0 мл/100 г массы тела. Контрольной модельной группе внутрижелудочно вводили эквивалентный объем 0,9% физиологического солевого раствора за 30 минут до сенсибилизации; и получающей лекарственное средство положительной группе вводили дексаметазон в дозе, составляющей 0,5 мг/кг за 30 мин до каждой сенсибилизации. Каждой из получающих низкую, среднюю и высокую дозы композиции 8 групп внутрижелудочно вводили соответствующую дозу исследуемого лекарственного средства за 30 мин до каждой сенсибилизации. При этом группе холостого контроля интраперитонеально вводили с помощью инъекции эквивалентный объем 0,9% физиологического солевого раствора, сенсибилизировали путем его распыления или вводили его внутрижелудочно. Внутрижелудочное введение проводили один раз в день в течение 21 последовательного дня.
2.1.4 Регистрация латентного периода бронхиальной астмы у крыс
Так же, как в примере 53.
2.1.5 Измерения содержаний IL-4 и IFN-γ
Так же, как в примере 53.
2.1.6 Измерение содержания EOS в тканях легких
Так же, как в примере 53.
2.2 Эффект на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
2.2.1. Так же, как в 2.1.1.
2.2.2 Установление животных моделей аллергической бронхиальной астмы у морских свинок
Так же, как в примере 53.
2.2.3 Режим дозирования
Так же, как в 2.1.3.
2.2.4 Регистрация латентного периода бронхиальной астмы
Так же, как в 2.1.4.1.
2.2.5 Измерение IgE в сыворотке и BALF
Так же, как в примере 53.
2.3 Статистический метод
Так же, как в примере 53.
3. Результаты
3.1 Эффект композиции 8 на аллергическую бронхиальную астму у крысы, вызванную OVA
3.1.1 Эффект на латентный период бронхиальной астмы, индуцированной у крыс
Результаты показаны в таблице 1 (см. в графической части). Латентные периоды бронхиальной астмы, индуцированной у крыс из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у крыс в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01).
3.1.2 Эффект на содержание сывороточного IL-4 и IFN-γ у крыс
Экспериментальные результаты показаны в таблице 2 (см. в графической части). По сравнению с группой холостого контроля модельная группа показала значительно пониженное содержание сывороточного IFN-γ (Р<0,01), но значительно увеличенное содержание сывороточного IL-4 (Р<0,01), указывая на тяжелый дисбаланс соотношения IFN-γ/IL-4 во время манифестаций бронхиальной астмы. По сравнению с модельной группой все из группы дексаметазона и получающих среднюю и высокую дозы исследуемого лекарственного средства групп показали значительно пониженное содержание IL-4 (Р<0,05 или Р<0,01) и значительно увеличенное содержание IFN-γ (Р<0,05 или Р<0,01), указывая на то, что исследуемое лекарственное средство может корректировать несбалансированное соотношение IFN-γ/IL-4.
3.1.3 Эффект на содержание EOS в тканях легких у крыс
Экспериментальные результаты показаны в таблице 3 (см. в графической части). Количество EOS у крыс в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой положительная контрольная группа и получающие среднюю и высокую дозы исследуемого лекарственного средства группы показали значительно пониженное количество EOS (Р<0,01), указывая на то, что композиция 8 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет снижения содержания EOS в тканях легких у крыс.
3.2 Эффект композиции 8 на аллергическую бронхиальную астму у морских свинок, вызванную газовой смесью Ach и His
3.2.1 Эффект на латентный период бронхиальной астмы, индуцированной у морских свинок
Результаты показаны в таблице 4 (см. в графической части). После моделирования латентные периоды бронхиальной астмы, индуцированной у морских свинок из каждой смоделированной группы, квалифицировали без значимого различия между ними, что указывает на успешное моделирование. После введения дозы и лечения по сравнению с контрольной модельной группой все латентные периоды бронхиальной астмы, индуцированной у морских свинок в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах, являлись значительно пролонгированными (Р<0,05 или Р<0,01), указывая на то, что композиция 8 существенно улучшает симптомы бронхиальной астмы у морской свинки.
3.2.2 Эффект на общий IgE в сыворотке и BALF у морских свинок
Экспериментальные результаты показаны в таблице 5 (см. в графической части). Содержание общего IgE в сыворотке и BALF в модельной группе значительно увеличивалось (Р<0,01). По сравнению модельной группой все содержания общего IgE в сыворотке и BALF в группе дексаметазона и в получающих средние и высокие дозы исследуемого лекарственного средства группах значительно снижались (Р<0,01 или Р<0,05), указывая на то, что как дексаметазон, так и исследуемое лекарственное средство могут ингибировать аллергический воспалительный ответ в легких морских свинок и облегчать симптомы бронхиальной астмы.
3.2.3 Эффект на содержание EOS в тканях легких у морских свинок
Экспериментальные результаты показаны в таблице 6 (см. в графической части). По сравнению с группой холостого контроля количества EOS у морских свинок в модельной группе значительно увеличивались (Р<0,01). По сравнению модельной группой количества EOS в положительной контрольной группе и получающих среднюю и высокую дозы исследуемого лекарственного средства группах значительно уменьшались (Р<0,01), указывая на то, что композиция 8 является эффективной в лечении аллергической бронхиальной астмы, вероятно, за счет уменьшения содержания EOS в тканях легких у морских свинок.
4. Вывод
Экспериментальные исследования на животных демонстрируют, что композиция 8 способна значительно облегчать симптомы бронхиальной астмы у крыс и пролонгировать латентный период бронхиальной астмы, индуцированной у морских свинок в модельных группах; уменьшать содержание сывороточного IL-4, увеличивать содержание сывороточного IFN-γ и корректировать несбалансированное соотношение IFN-γ/IL-4 у крыс с бронхиальной астмой; уменьшать количество EOS в тканях легких крыс и морских свинок и ослаблять инфильтрацию EOS в участках воспаления; уменьшать содержание общего IgE в сыворотке и BALF у морских свинок и облегчать легочные воспалительные симптомы. Таким образом, композиция 8 считается эффективной в защите от аллергической бронхиальной астмы.


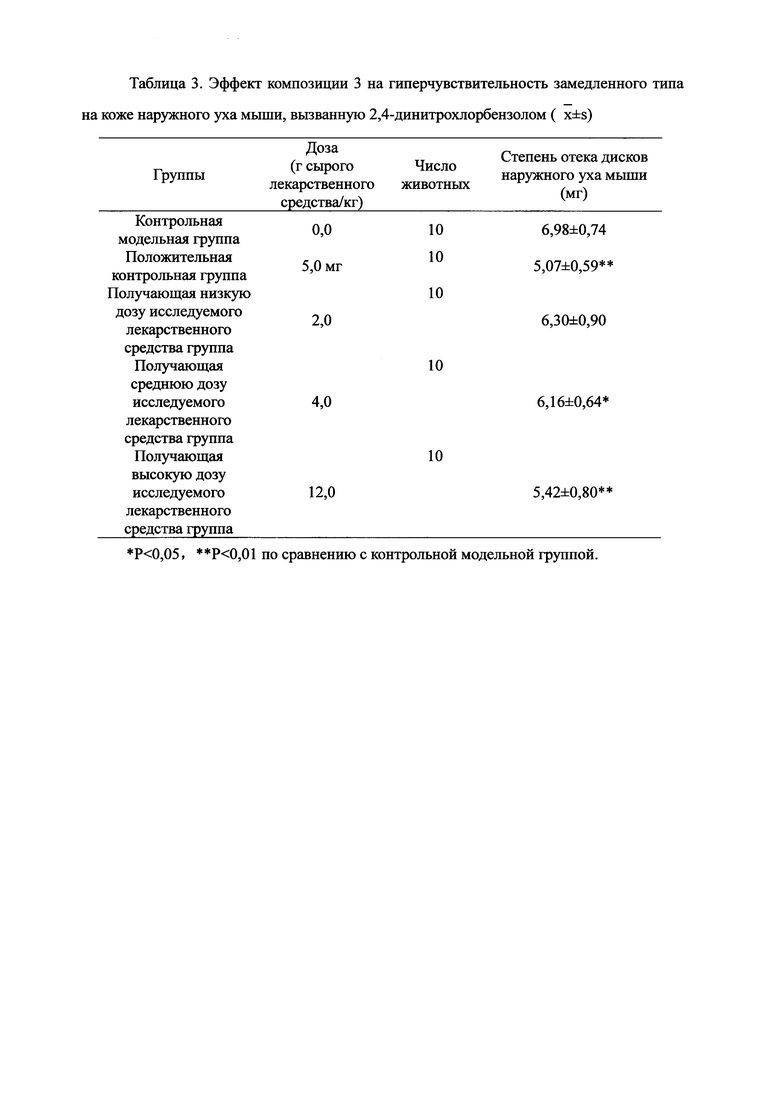




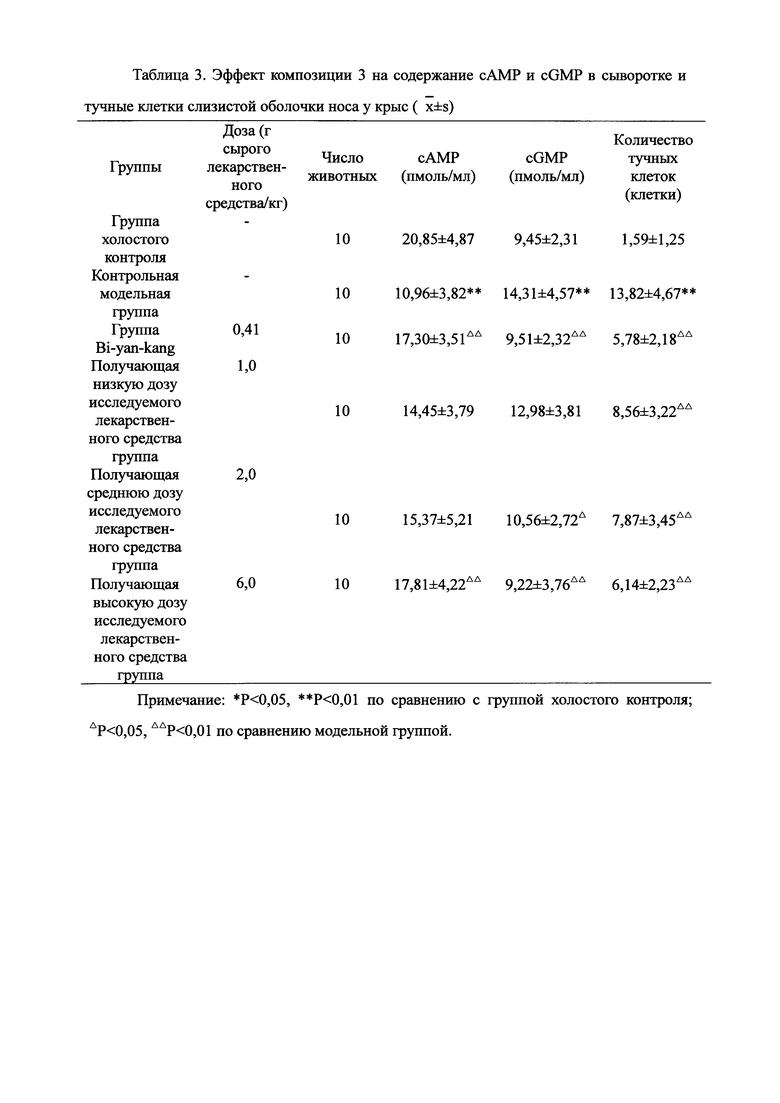
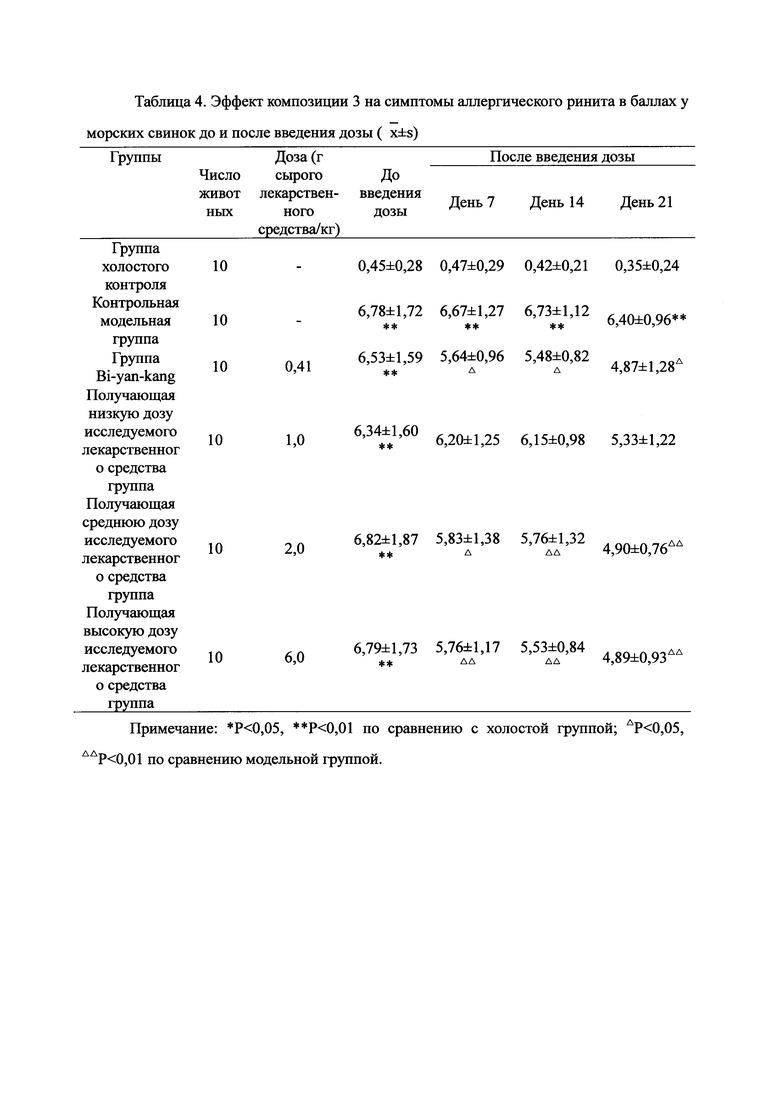
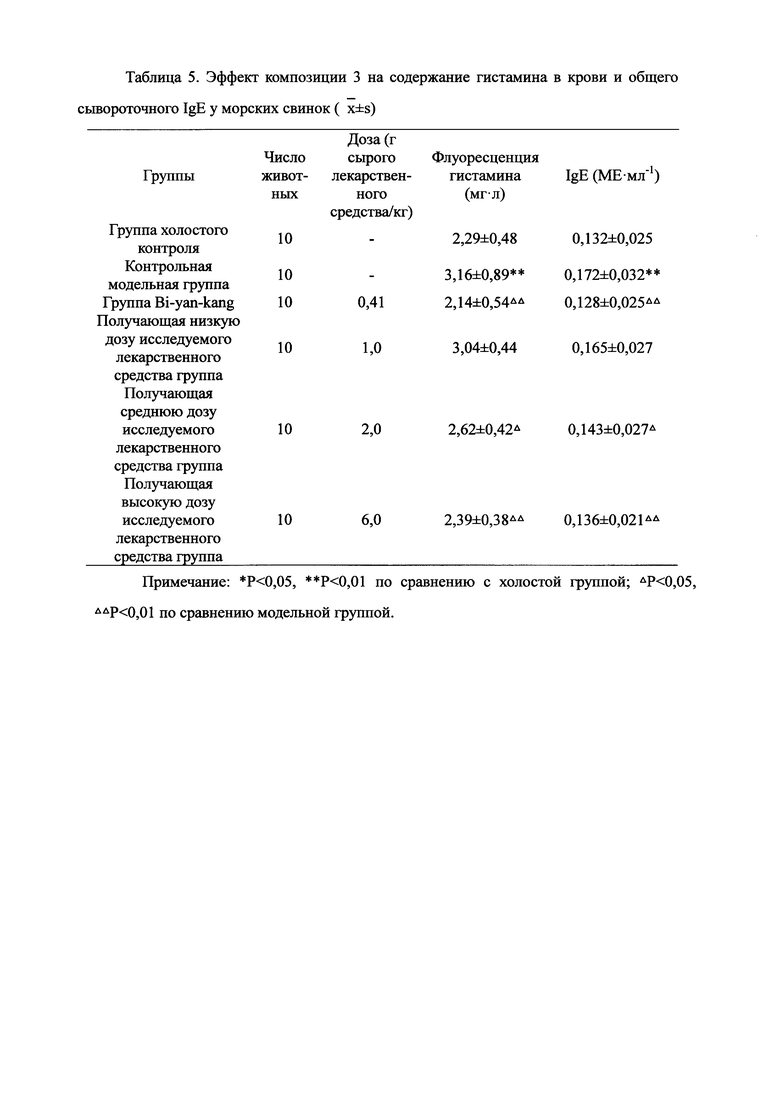




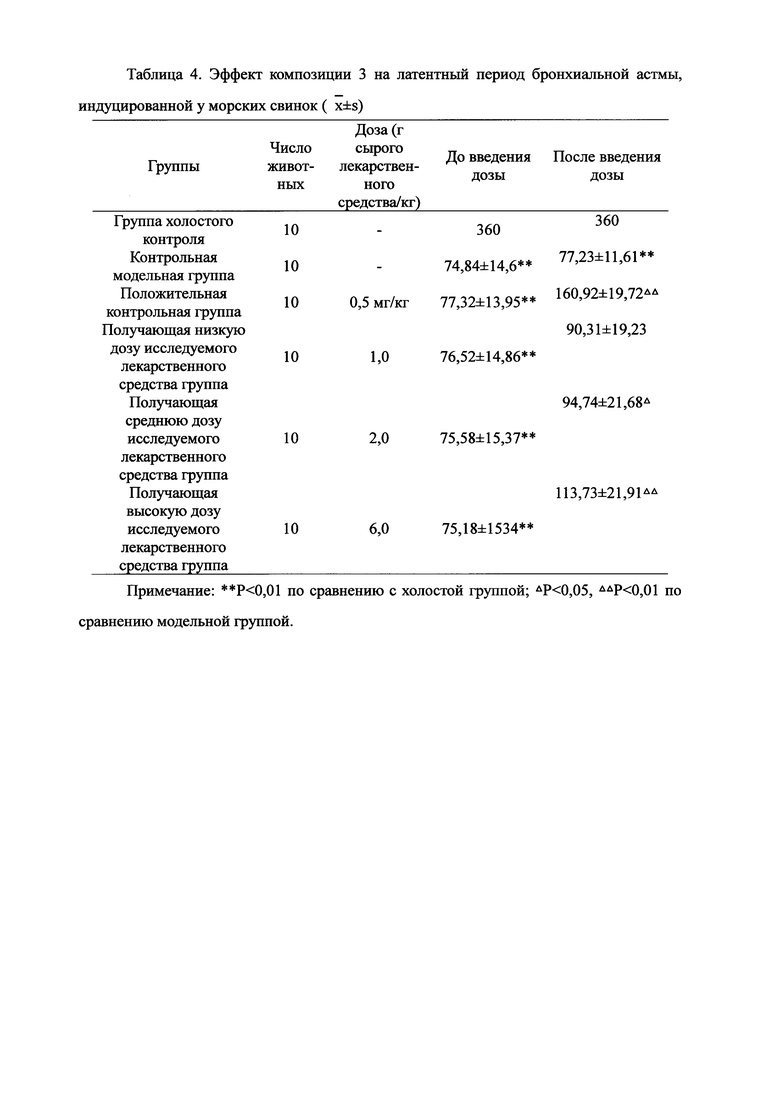
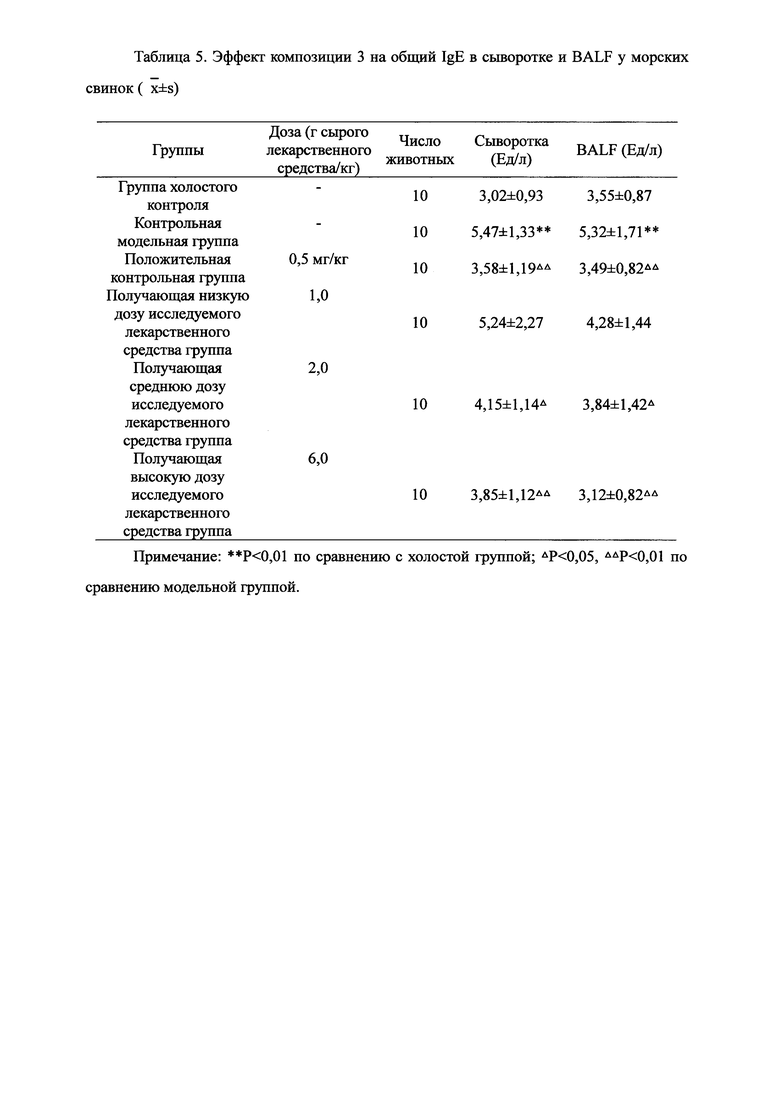

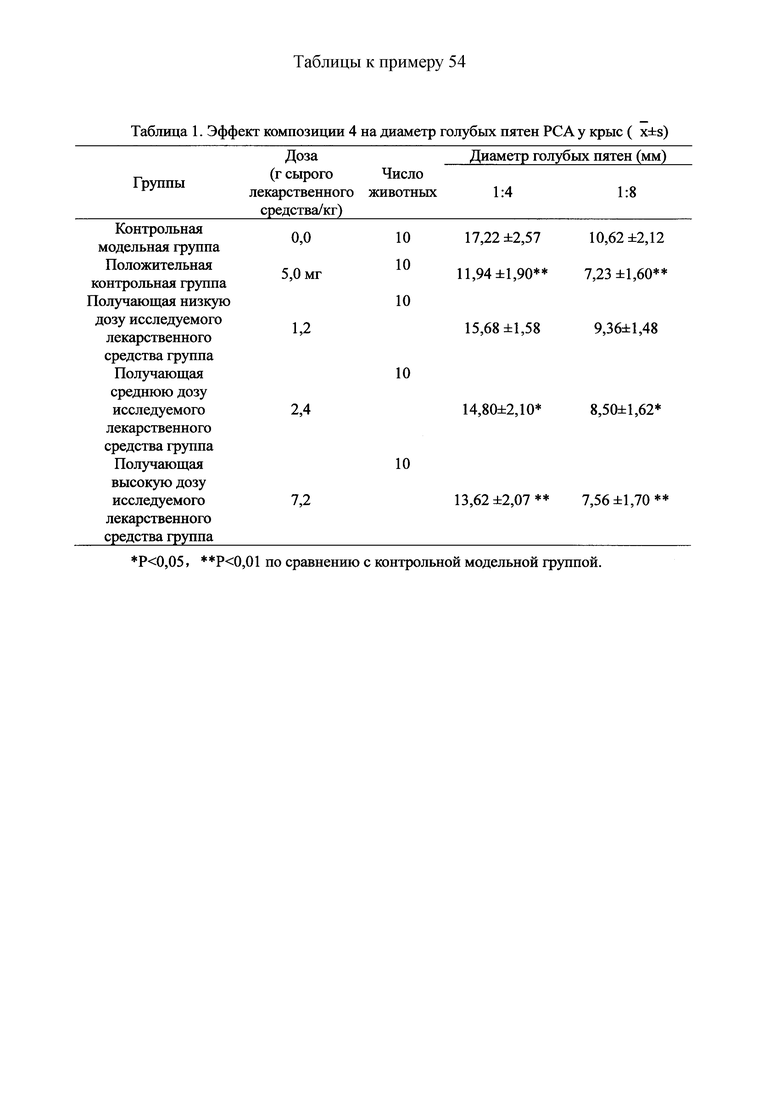
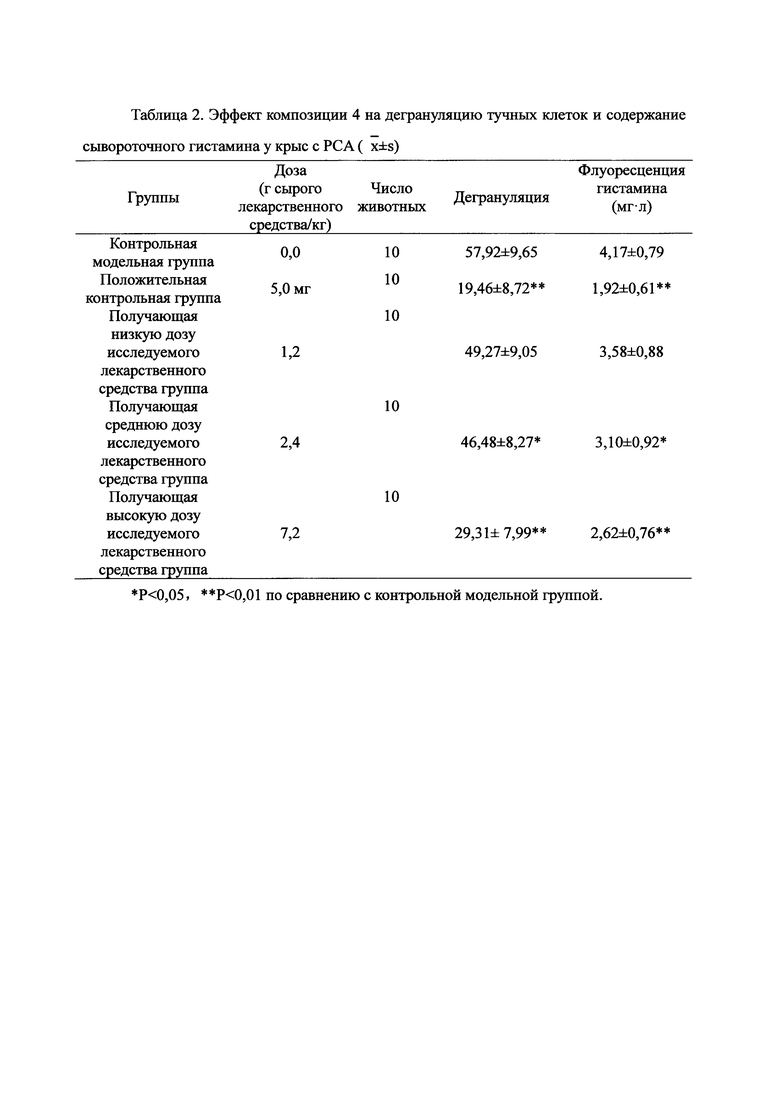

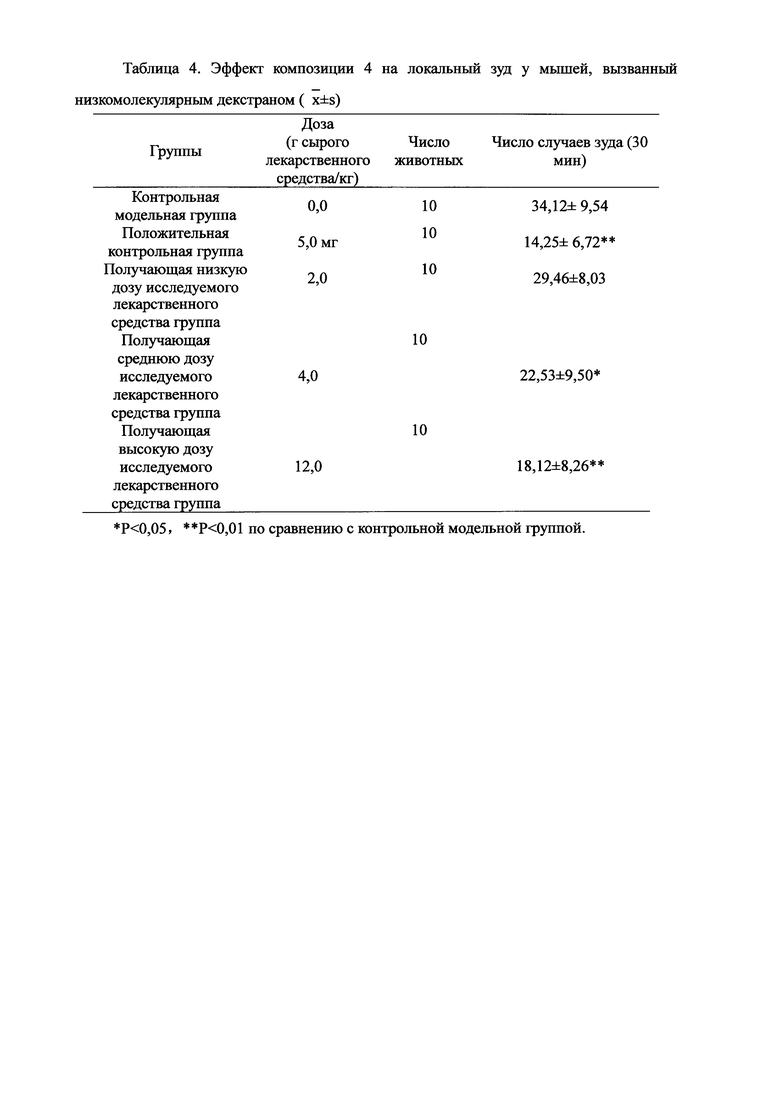
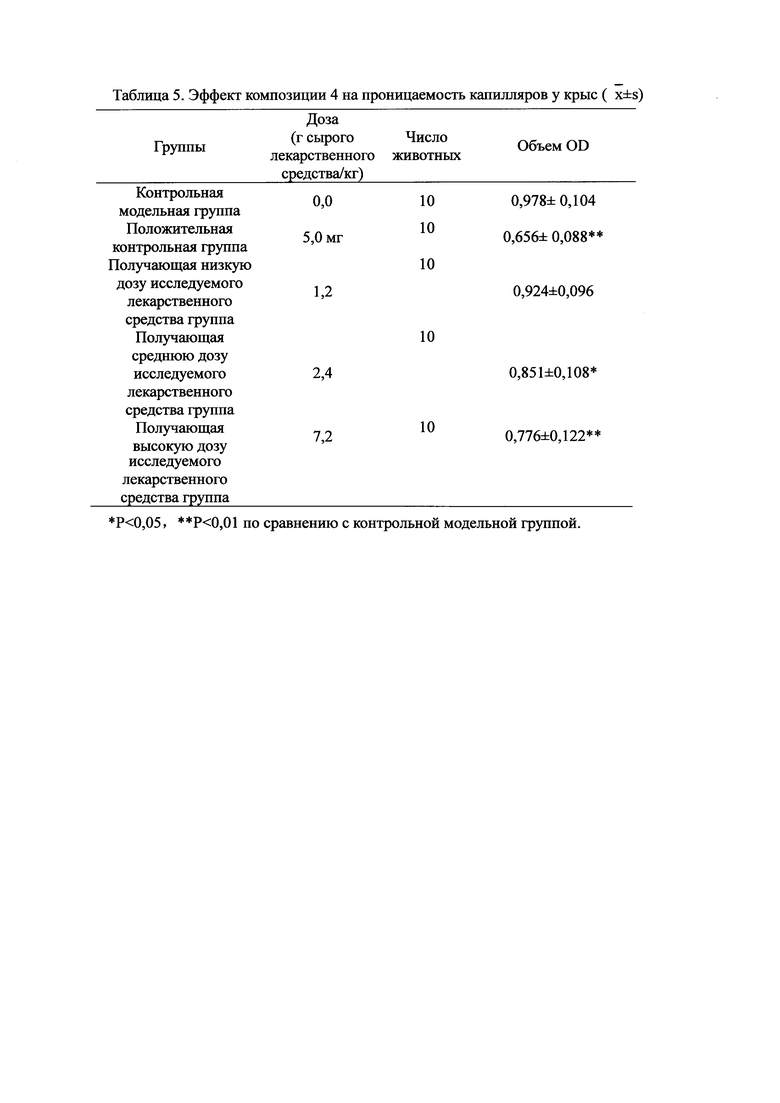
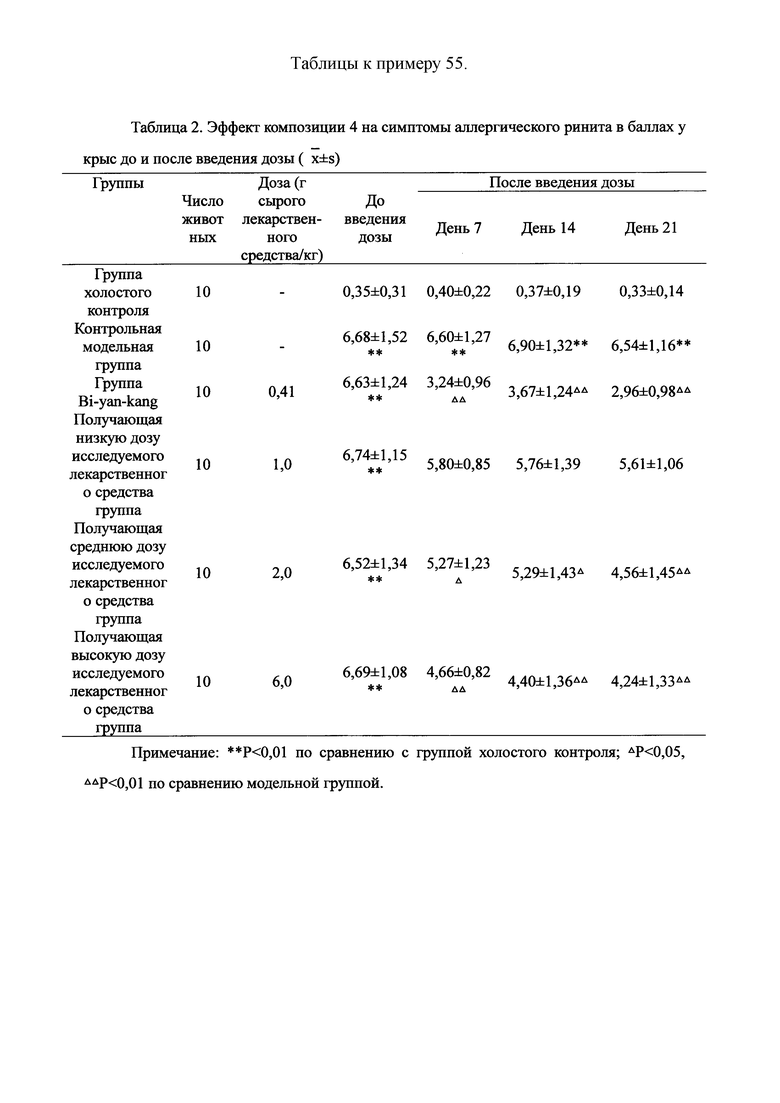
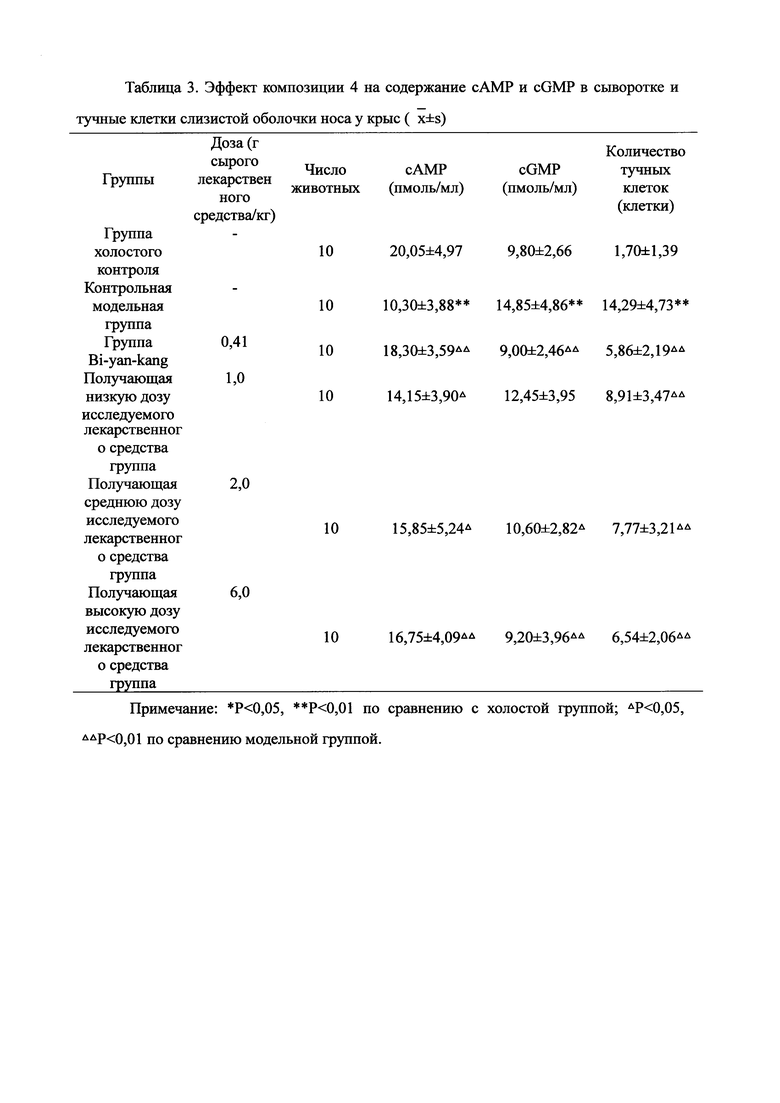
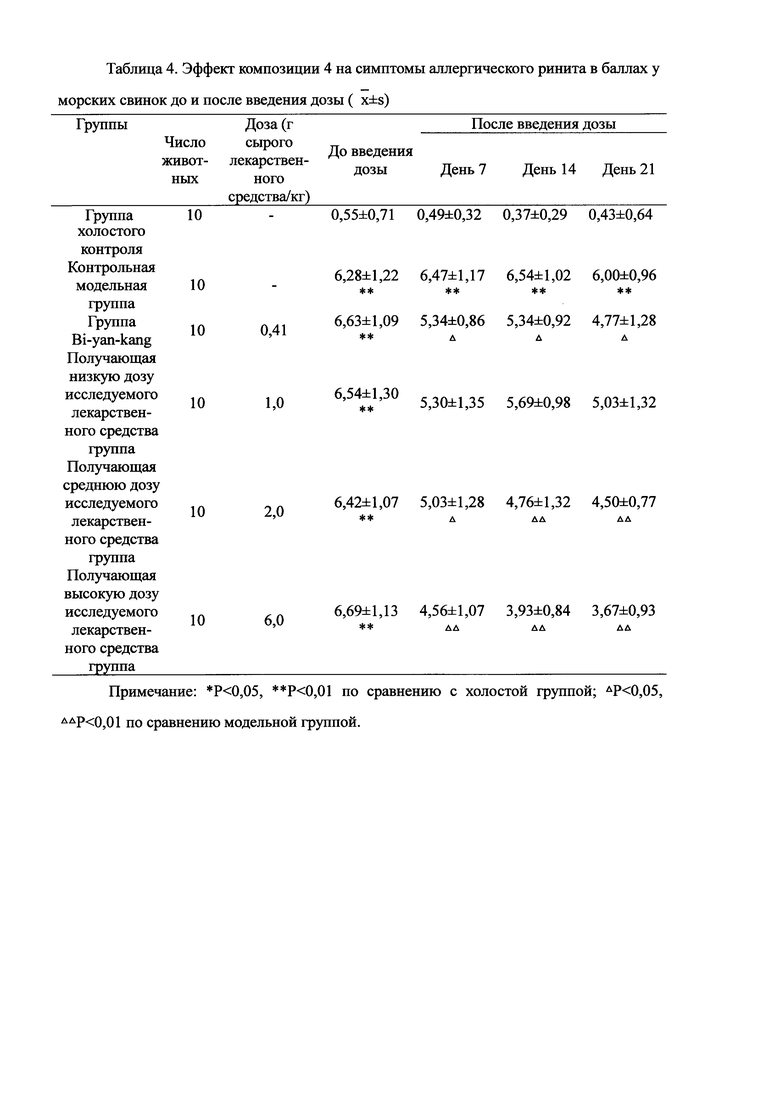
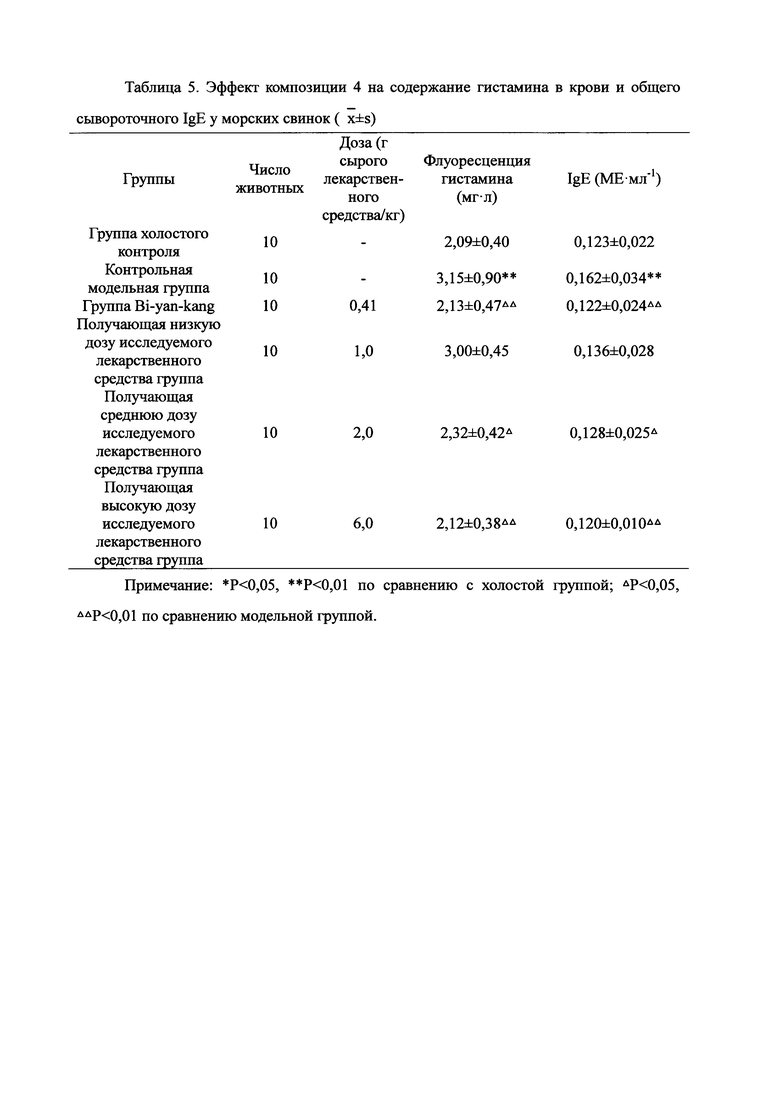


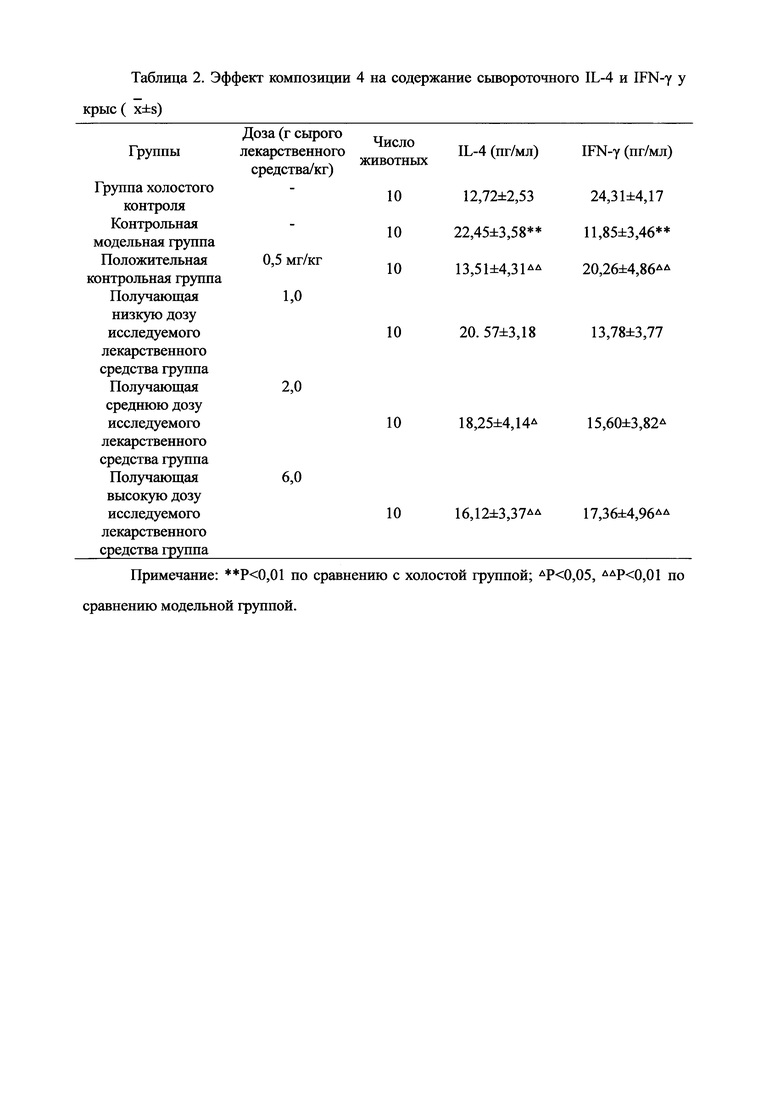




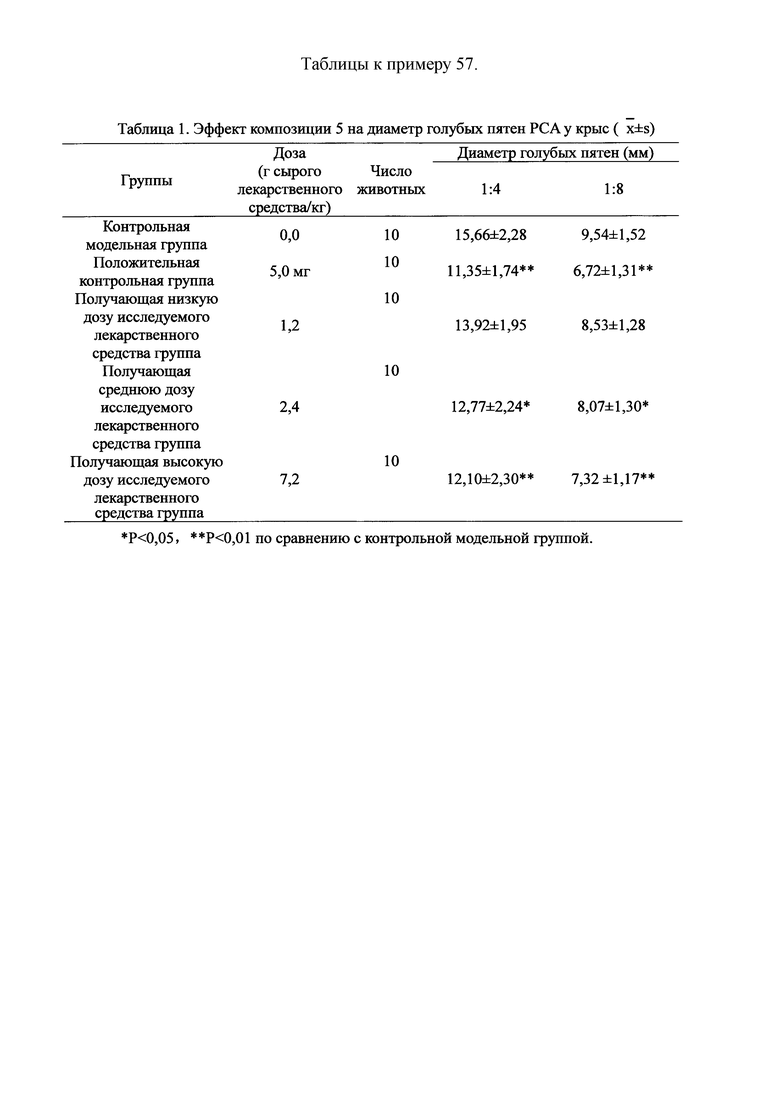




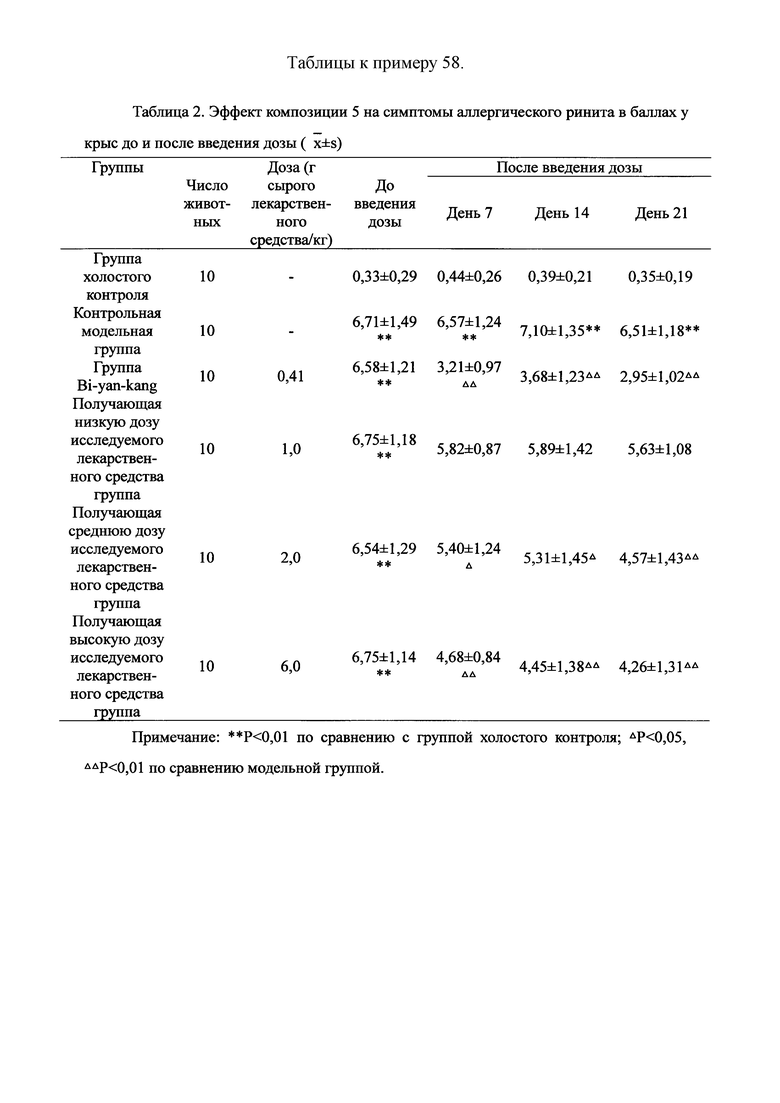
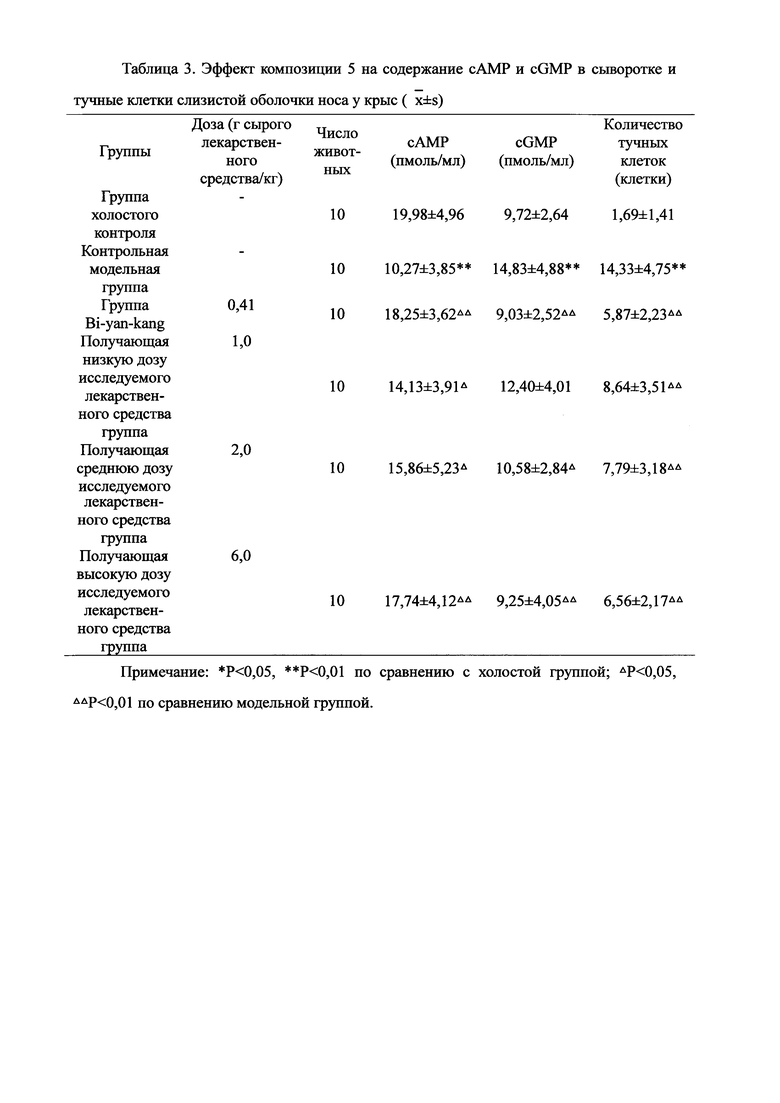
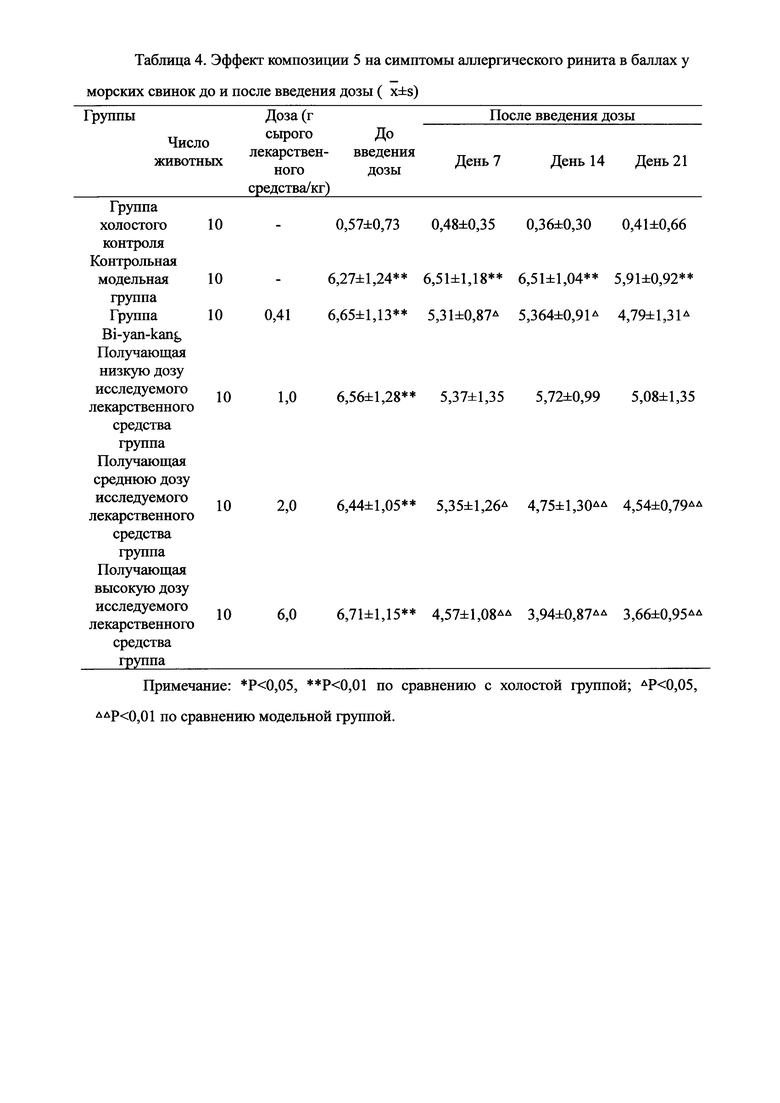
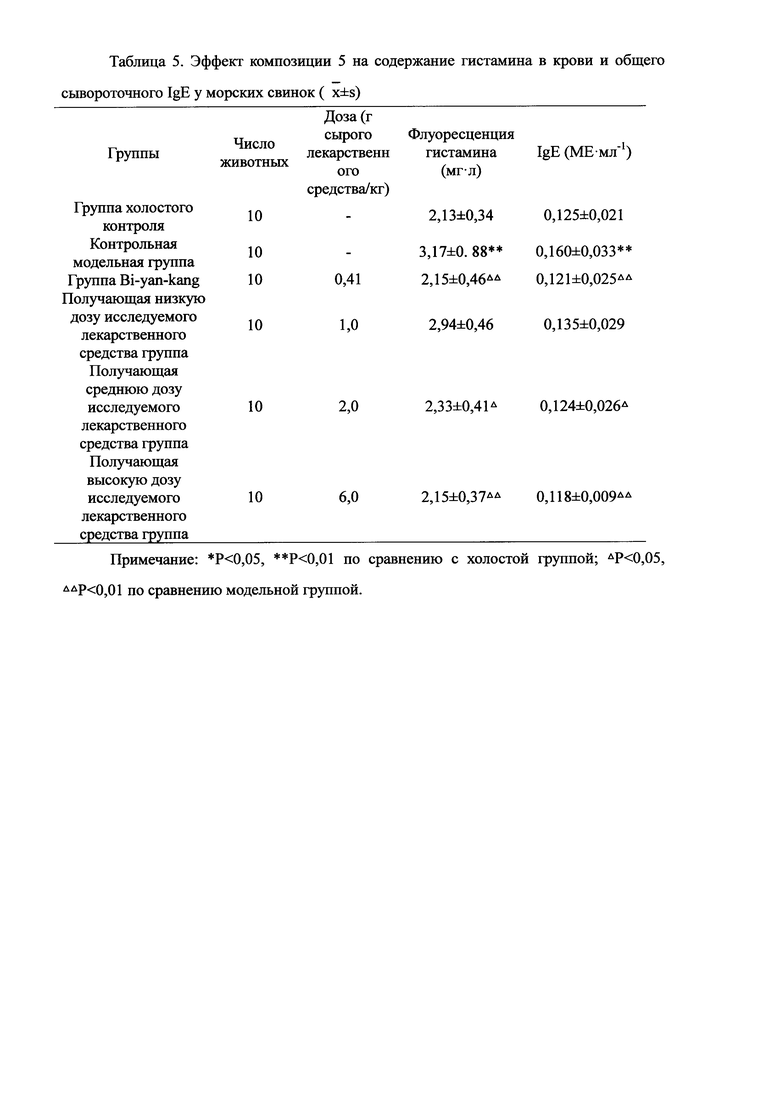





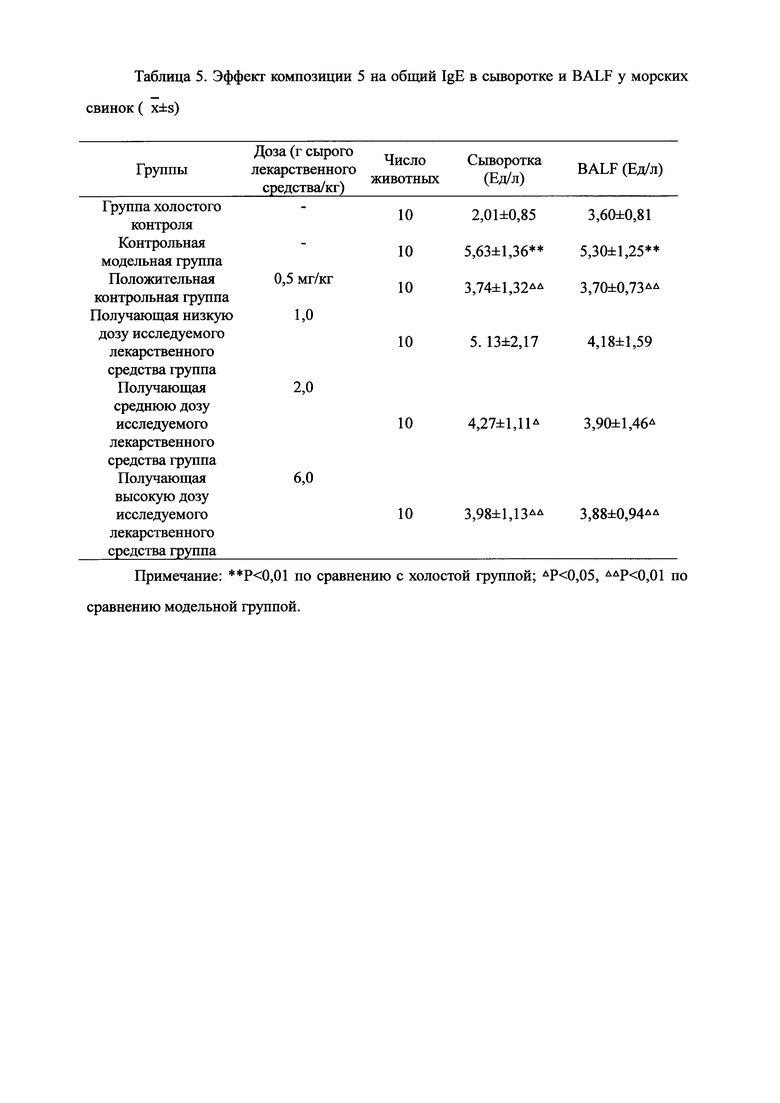

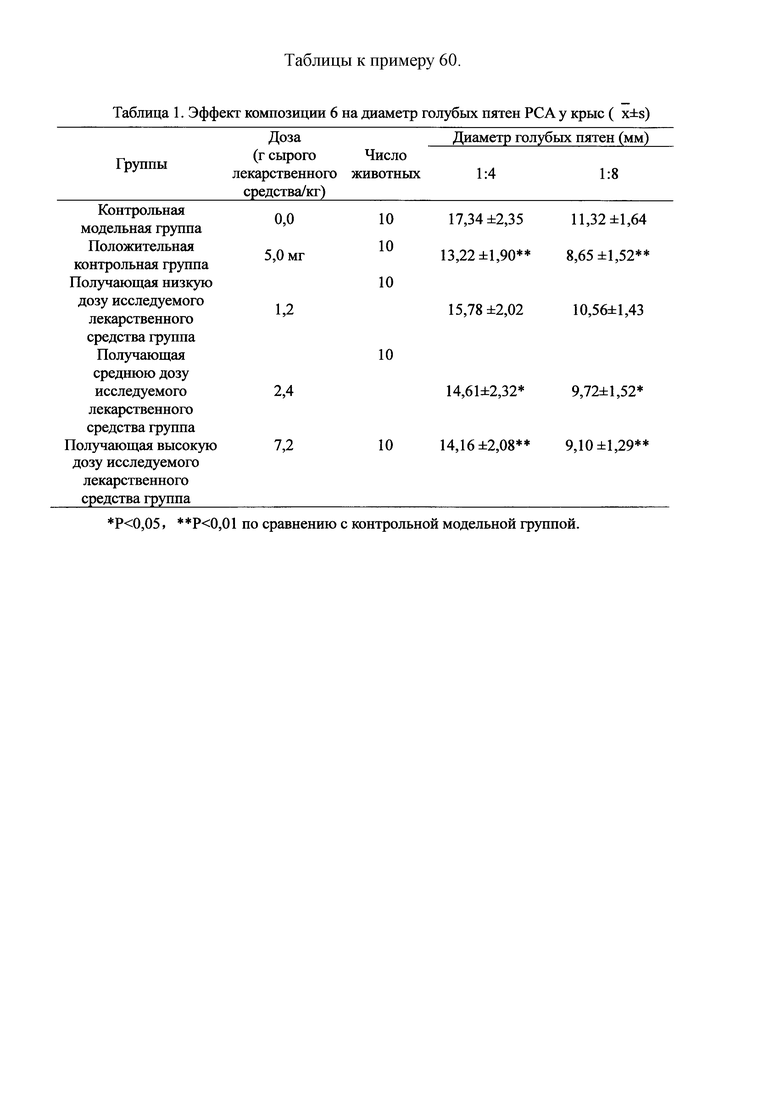
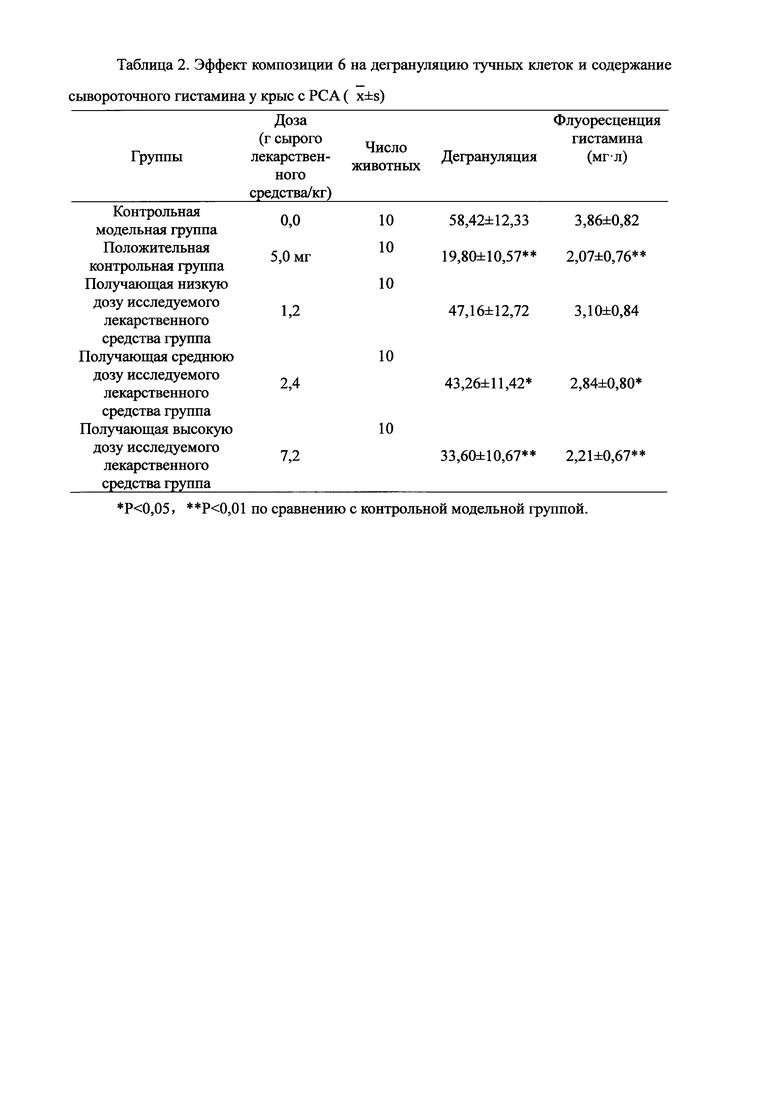

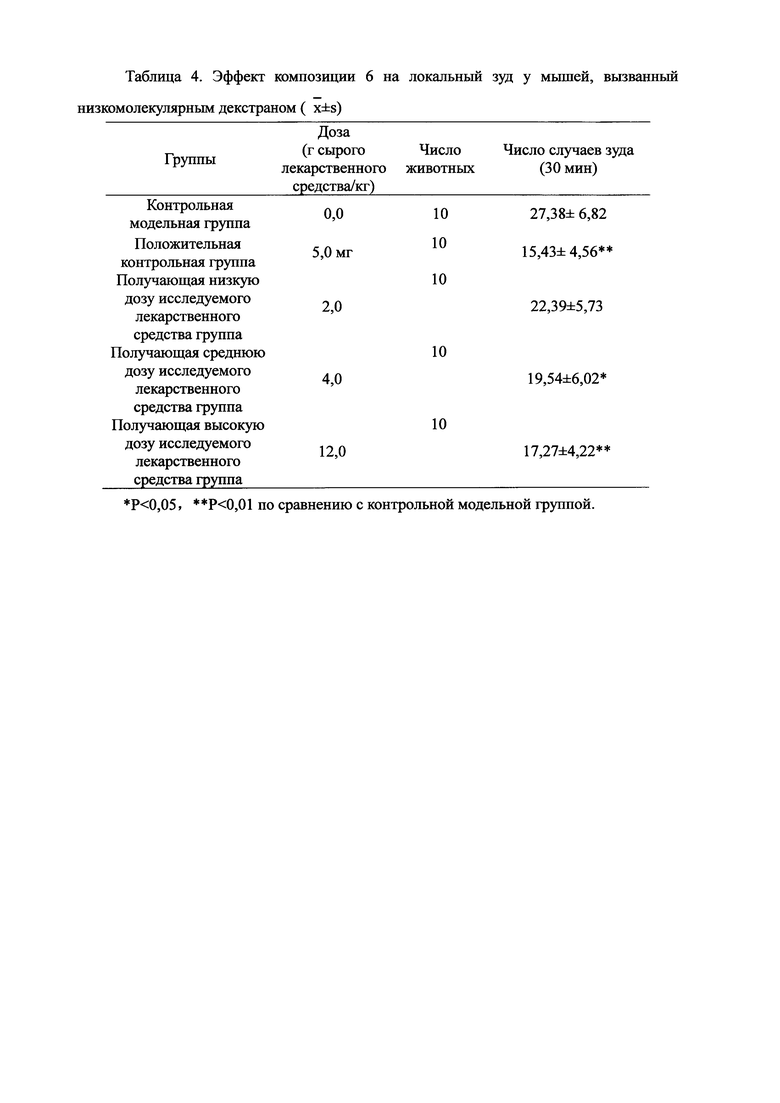

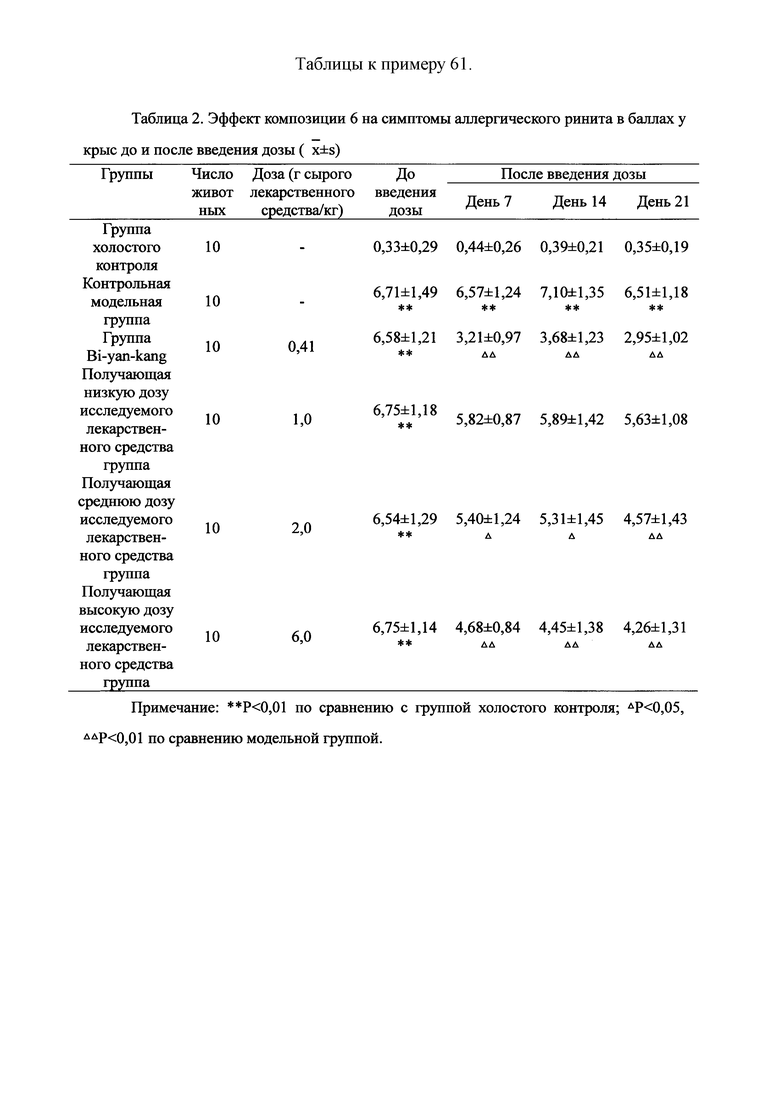
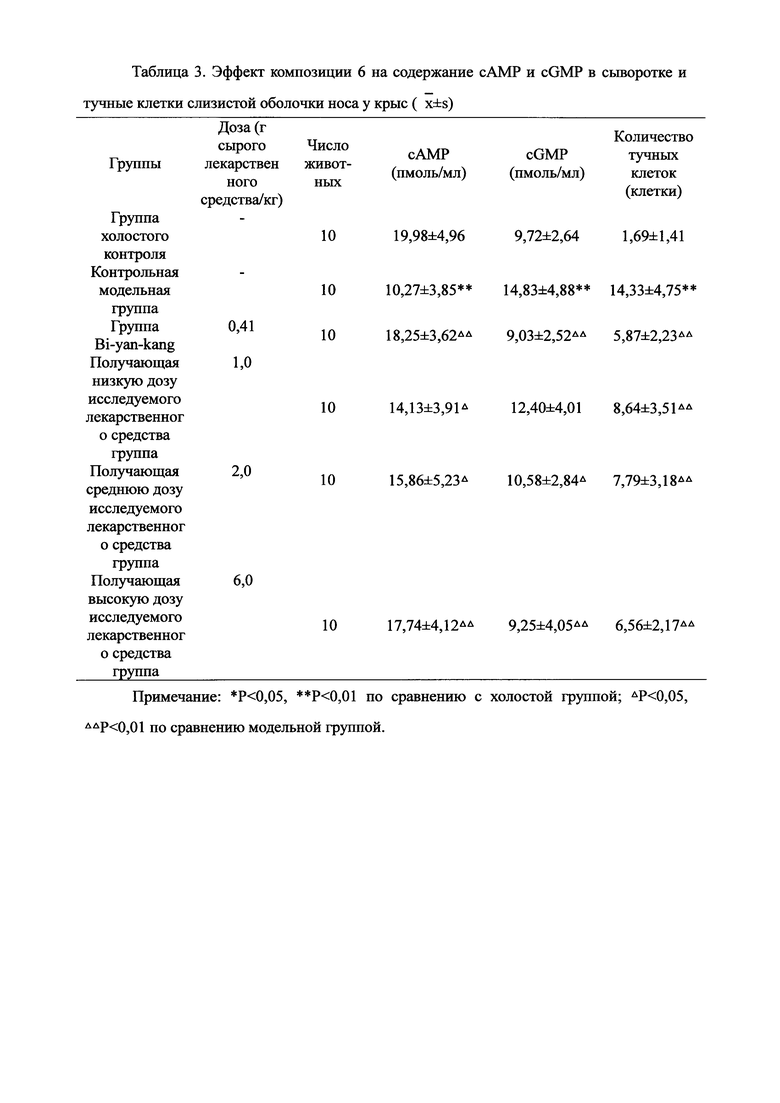
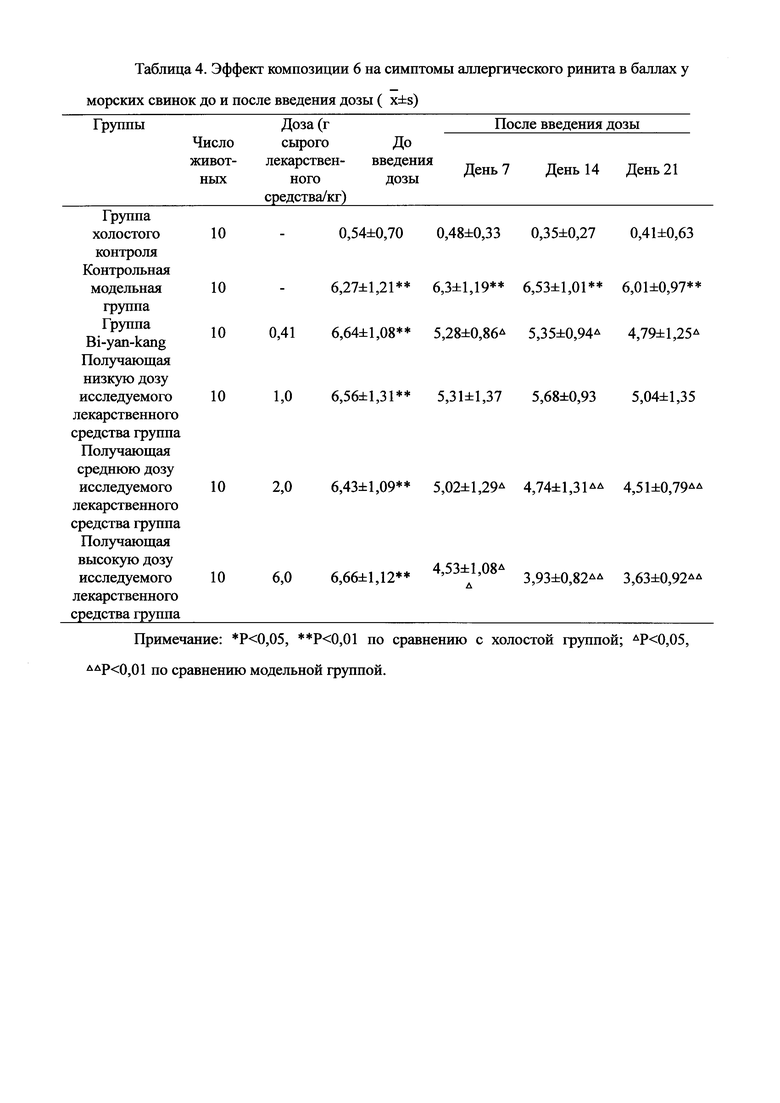






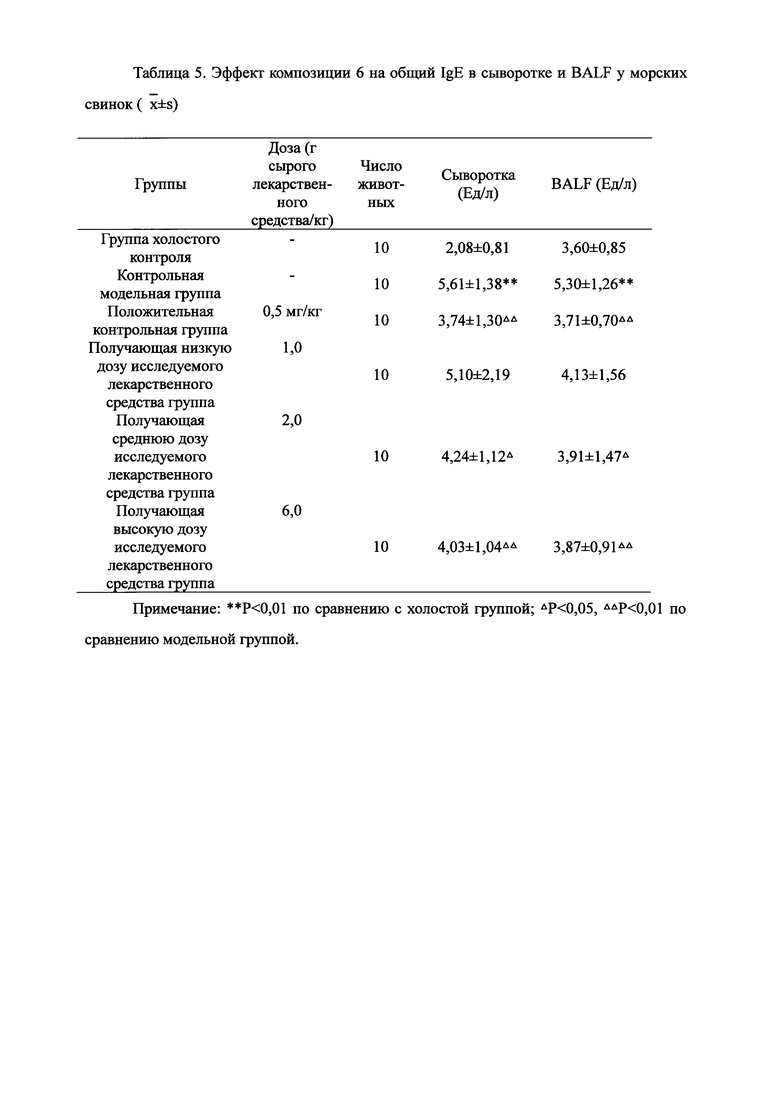

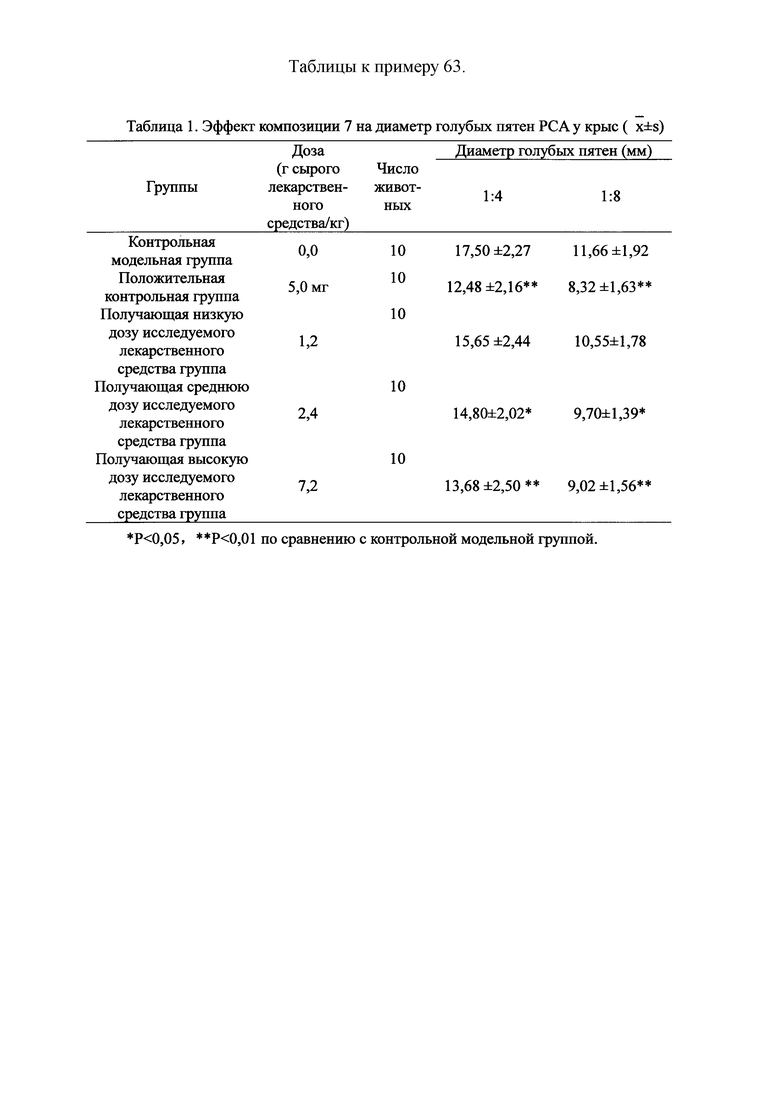
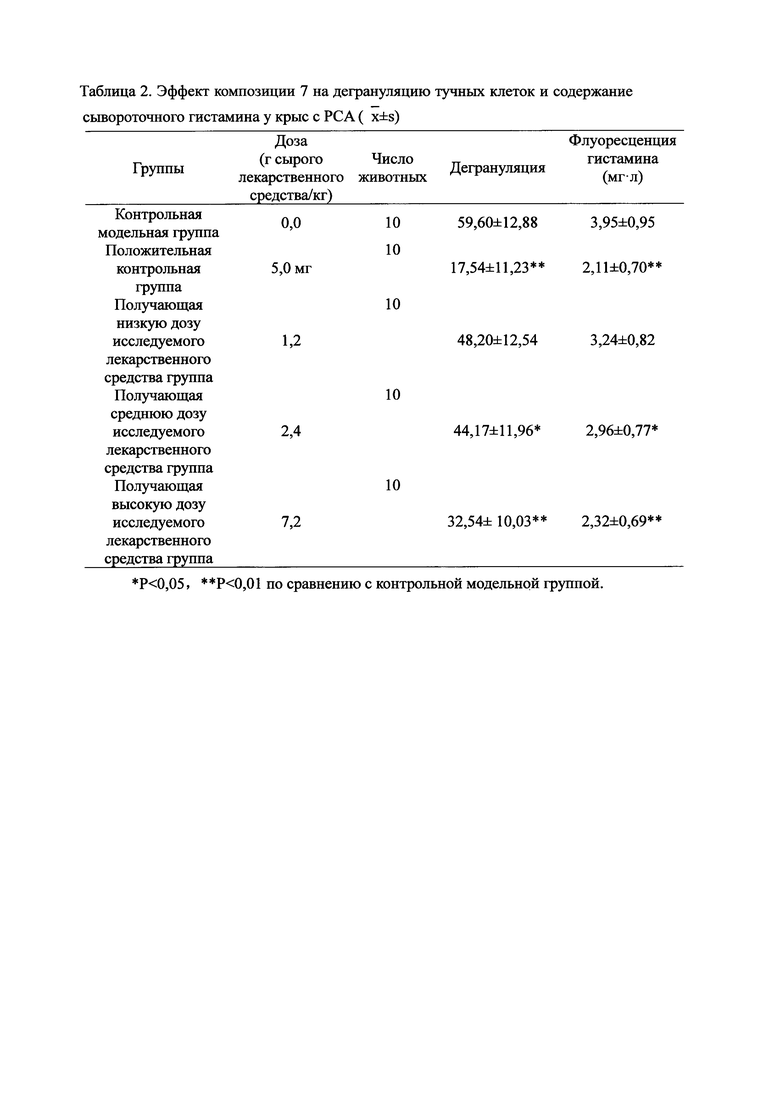
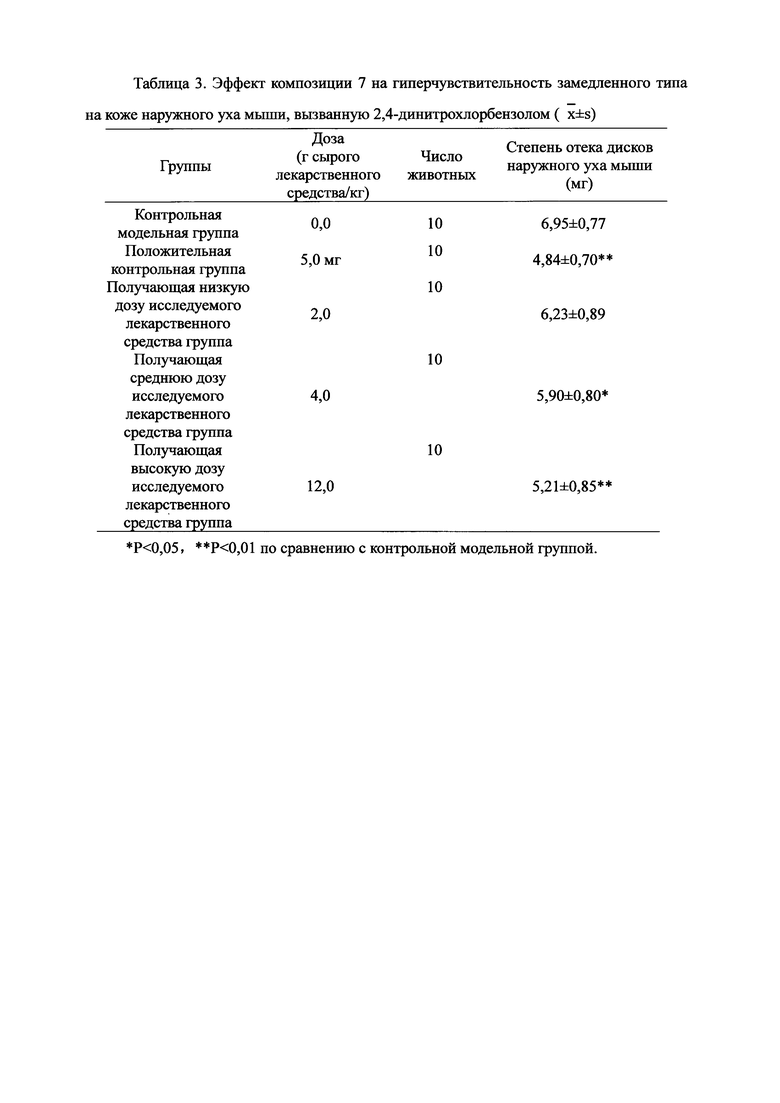



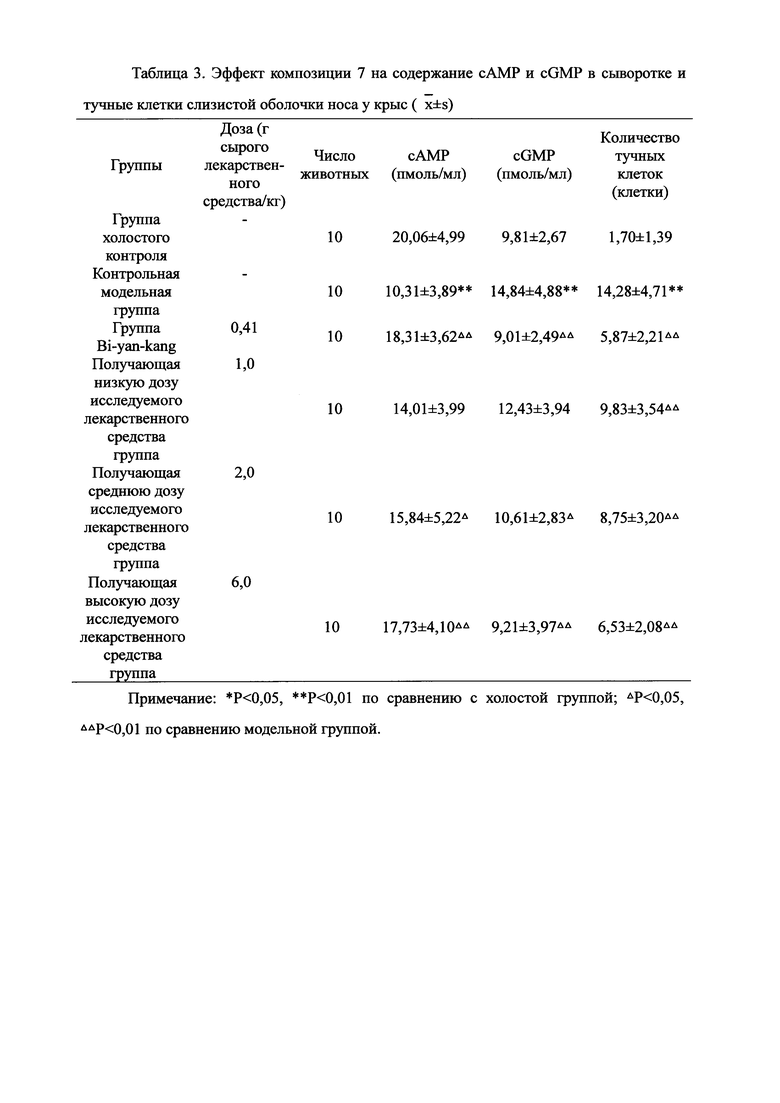
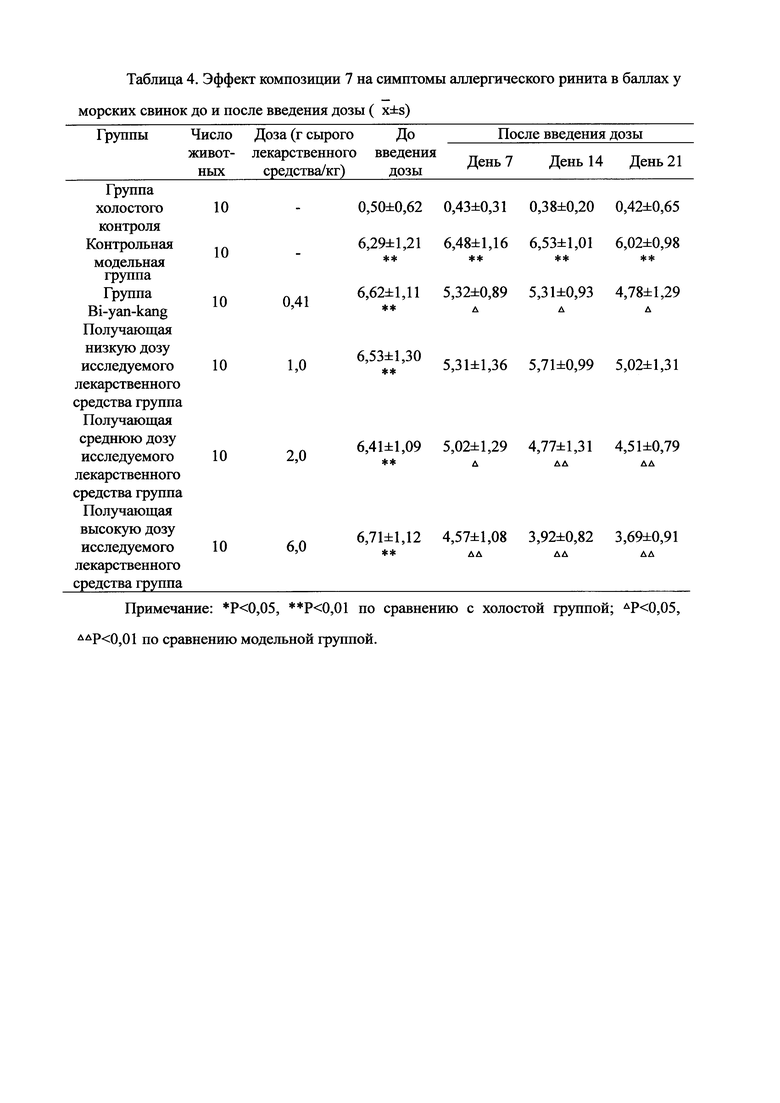




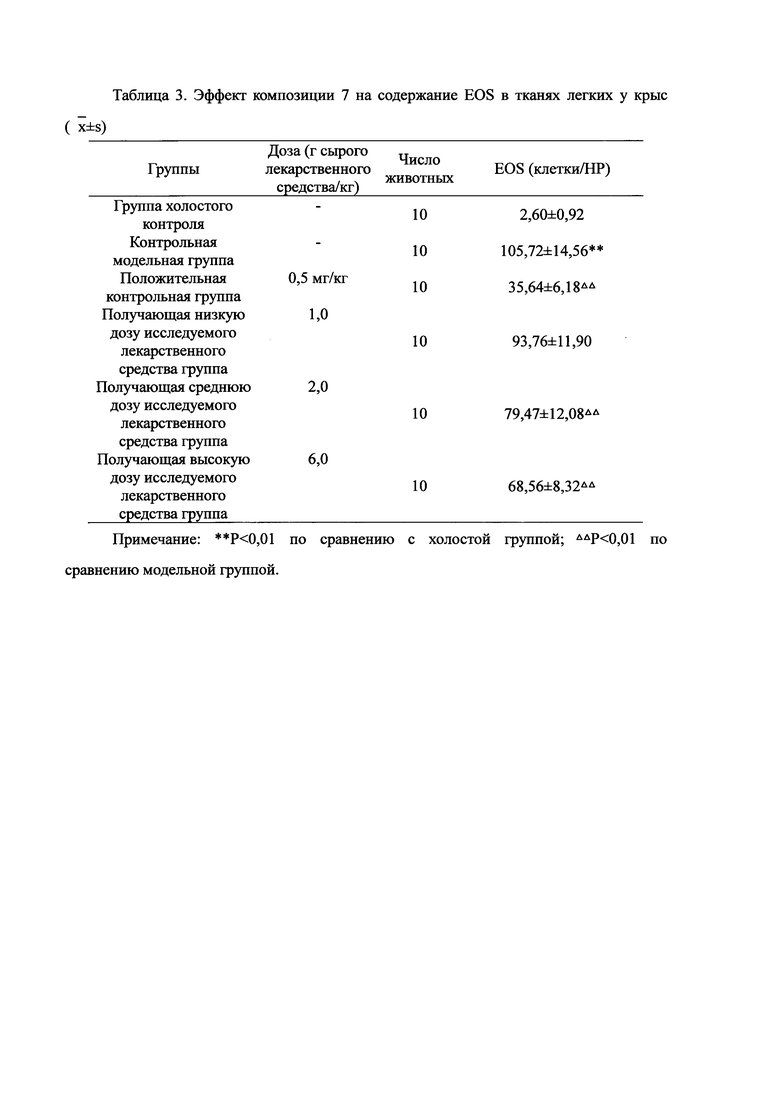

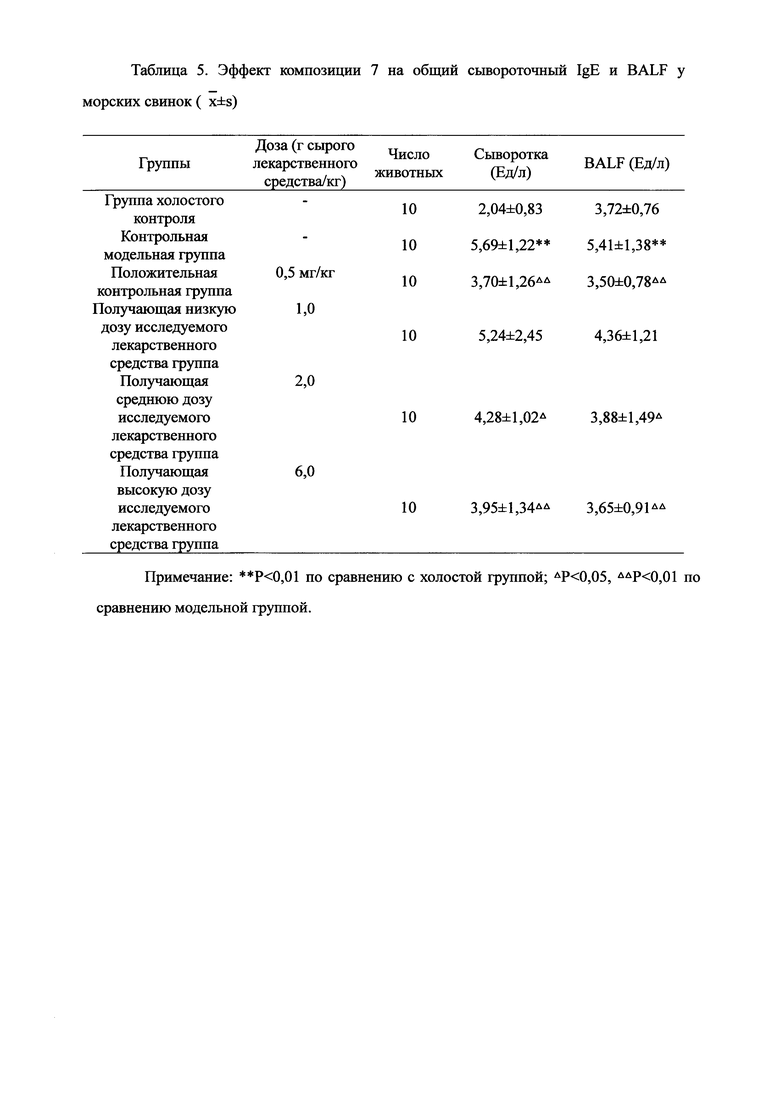

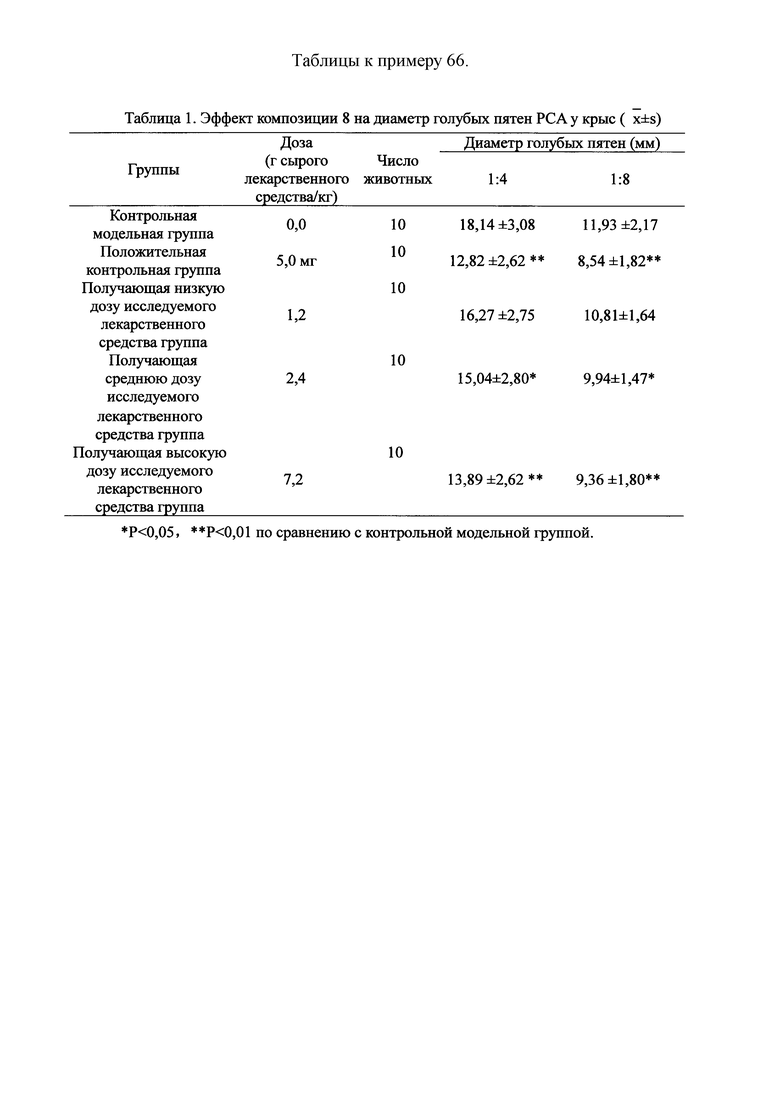




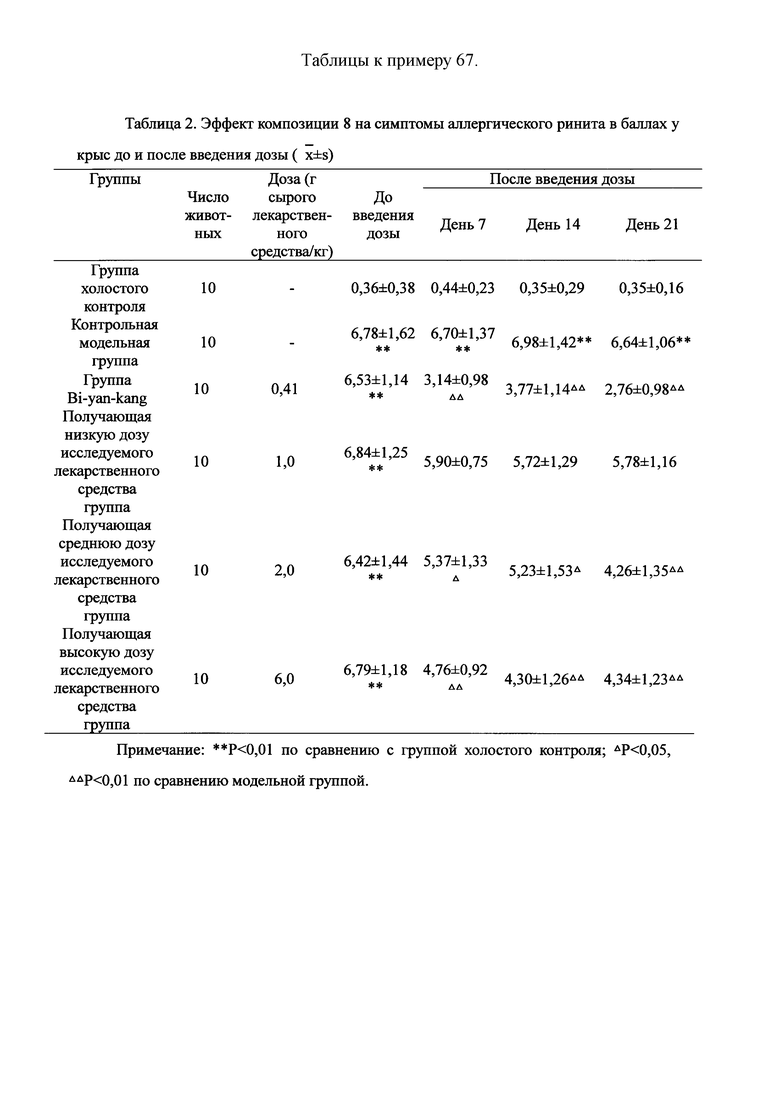

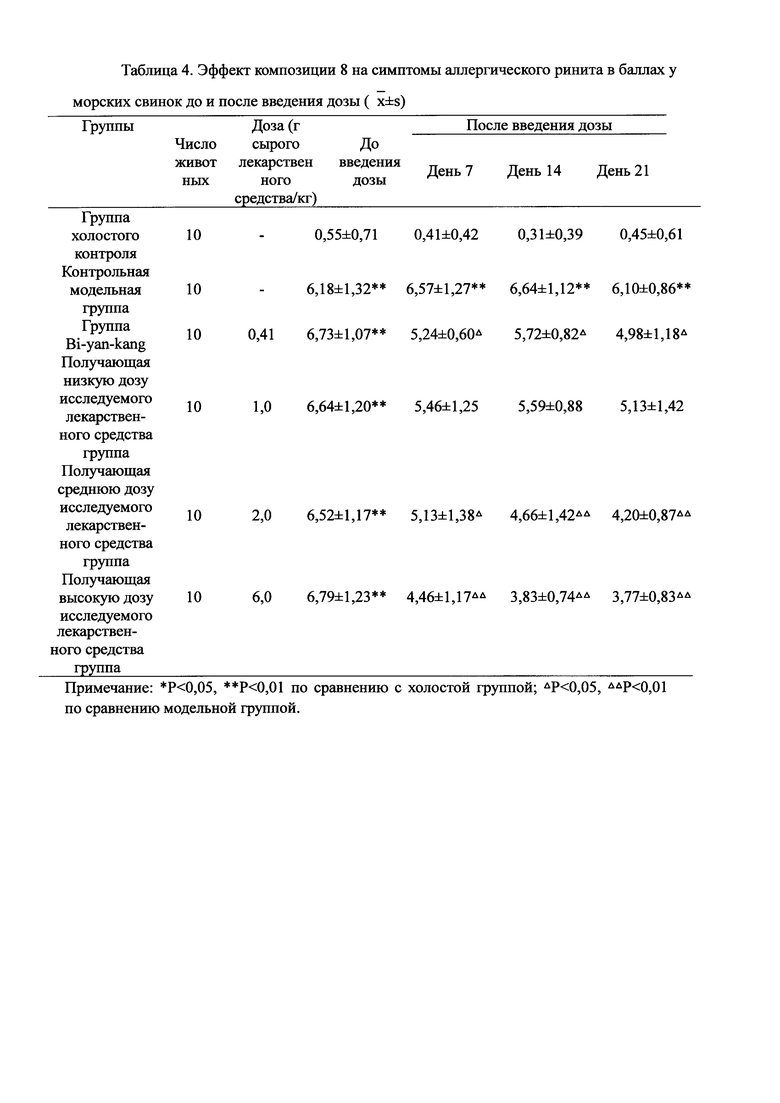
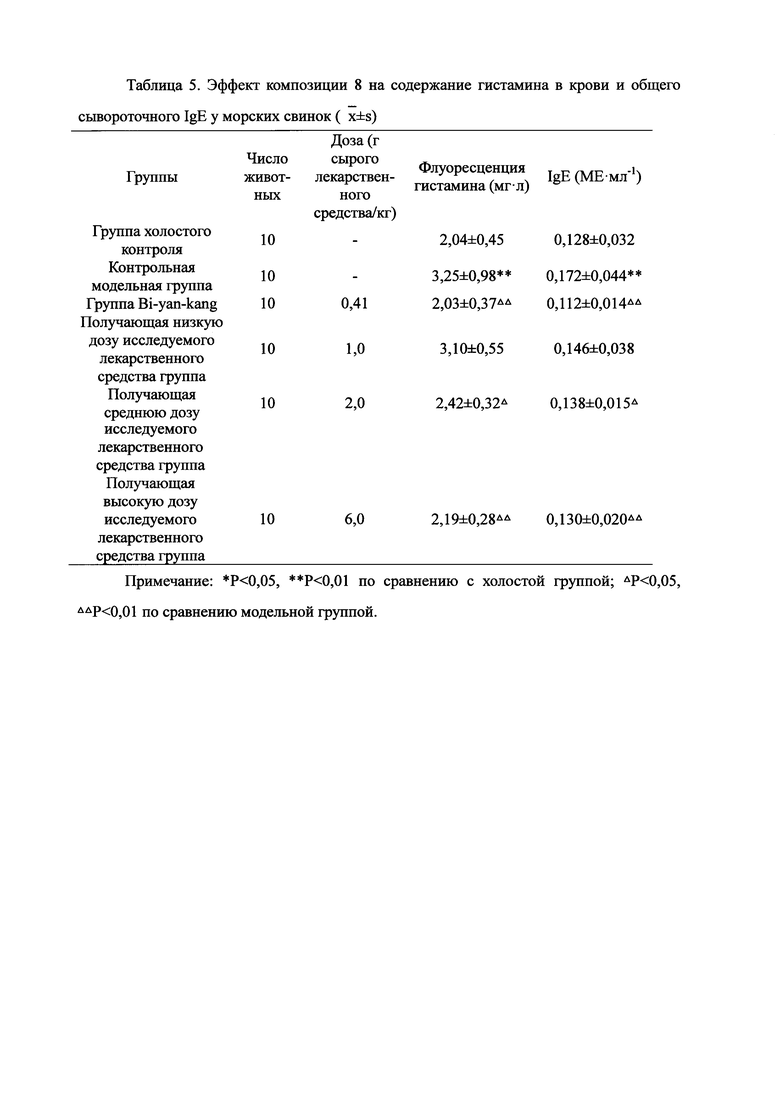

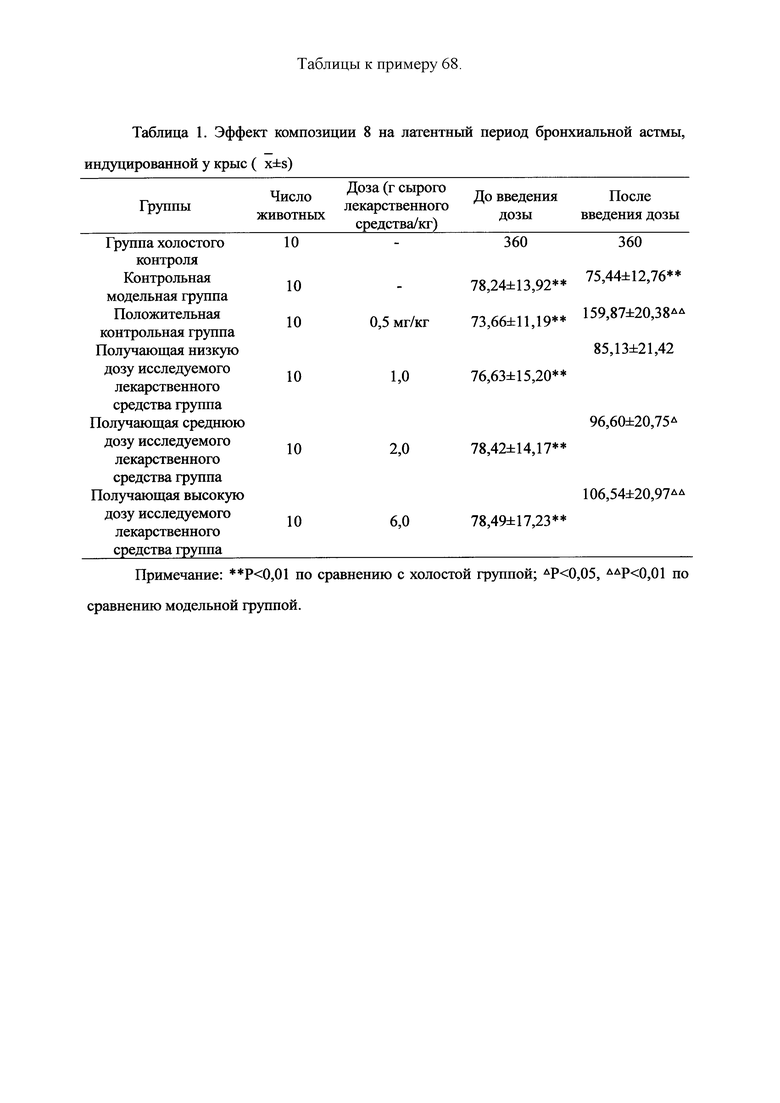
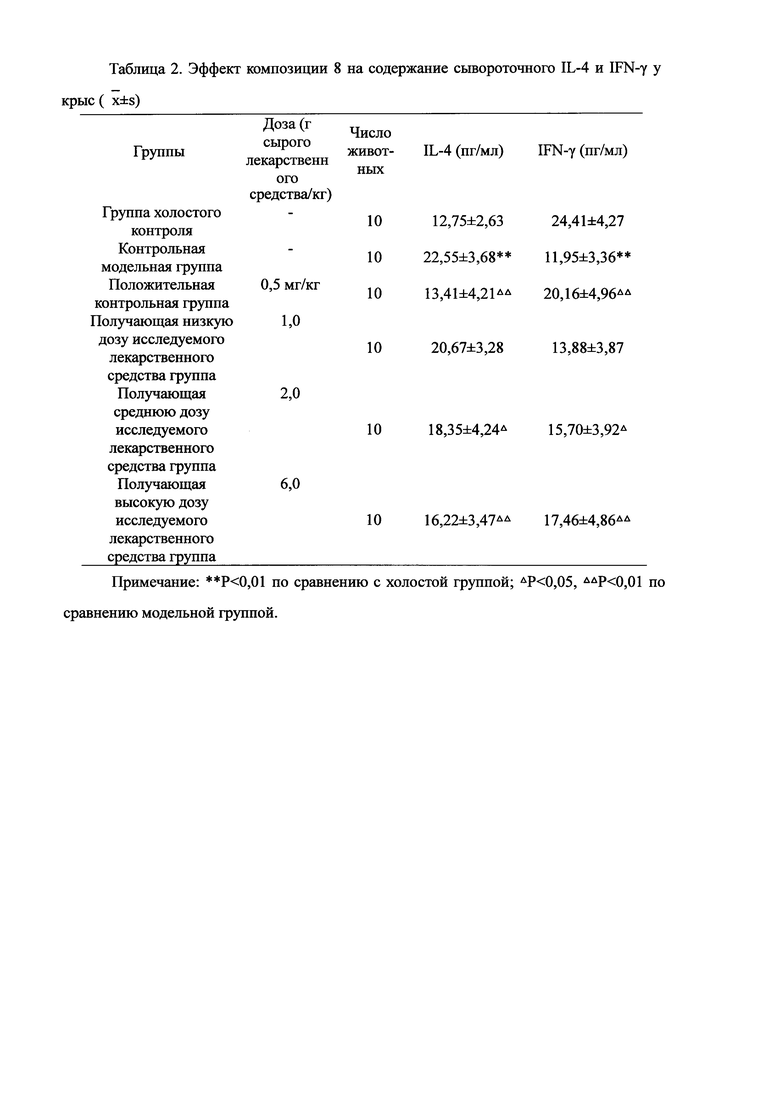


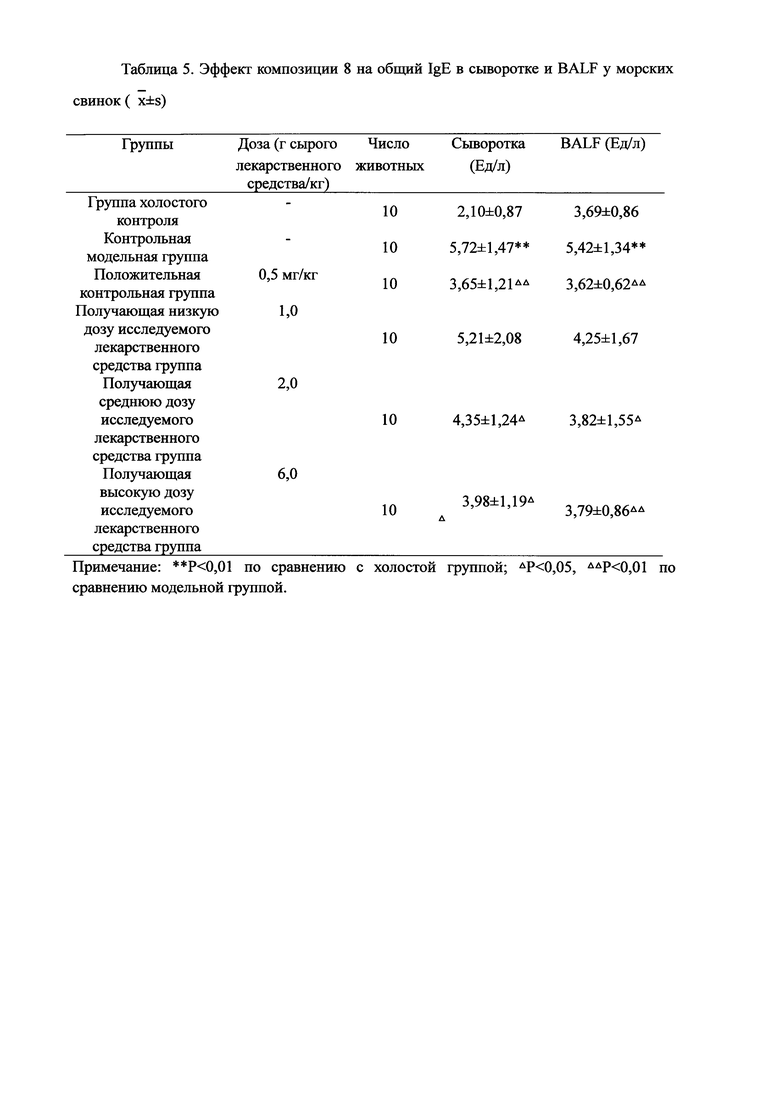

Настоящее изобретение относится к фармацевтической промышленности, а именно к применению композиции для профилактики и лечения аллергических заболеваний. Применение композиции в получении медицинской продукции или лекарственного средства для профилактики и лечения аллергических заболеваний, где активные ингредиенты указанной композиции состоят из водного и/или спиртового экстрактов следующих сырьевых материалов: i) 5-200 частей по массе Ganoderma, ii) 5-150 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, iii) 1-90 частей по массе порошка ферментированного Cordyceps sinensis и/или 1-120 частей по массе Cordyceps и iv) 5-90 частей по массе Flos Rosae Rugosae. Применение композиции в получении медицинской продукции или лекарственного средства для профилактики и лечения аллергических заболеваний, где активные ингредиенты указанной композиции состоят из водного и/или спиртового экстрактов следующих сырьевых материалов: i) 5-200 частей по массе Ganoderma, ii) 5-150 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng, iii) 1-90 частей по массе порошка ферментированного Cordyceps sinensis и/или 1-120 частей по массе Cordyceps, iv) 5-90 частей по массе Flos Rosae Rugosae и v) одно или более из порошка из спор Ganoderma, масла из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali. Вышеописанные композиции эффективны для профилактики и лечения аллергических заболеваний. 2 н. и 13 з.п. ф-лы, 96 табл., 68 пр.
1. Применение композиции в получении медицинской продукции или лекарственного средства для профилактики и лечения аллергических заболеваний, где активные ингредиенты указанной композиции состоят из водного и/или спиртового экстрактов следующих сырьевых материалов:
i) 5-200 частей по массе Ganoderma,
ii) 5-150 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng,
iii) 1-90 частей по массе порошка ферментированного Cordyceps sinensis и/или 1-120 частей по массе Cordyceps и
iv) 5-90 частей по массе Flos Rosae Rugosae.
2. Применение композиции в получении медицинской продукции или лекарственного средства для профилактики и лечения аллергических заболеваний, где активные ингредиенты указанной композиции состоят из водного и/или спиртового экстрактов следующих сырьевых материалов:
i) 5-200 частей по массе Ganoderma,
ii) 5-150 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng,
iii) 1-90 частей по массе порошка ферментированного Cordyceps sinensis и/или 1-120 частей по массе Cordyceps,
iv) 5-90 частей по массе Flos Rosae Rugosae и
v) одно или более из порошка из спор Ganoderma, масла из спор Ganoderma, Radix Pseudostellariae, Folium Ginseng, Radix Codonopsis и Radix Astragali.
3. Применение по п. 1, где сырьевые материалы представляют собой
i) 20-120 частей по массе Ganoderma,
ii) 10-90 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng,
iii) 3-60 частей по массе порошка ферментированного Cordyceps sinensis и/или 3-90 частей по массе Cordyceps и
iv) 10-60 частей по массе Flos Rosae Rugosae.
4. Применение по п. 1, где сырьевые материалы представляют собой
i) 40 частей по массе Ganoderma,
ii) 30 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng,
iii) 20 частей по массе порошка ферментированного Cordyceps sinensis и/или 6,7 частей по массе Cordyceps и
iv) 30 частей по массе Flos Rosae Rugosae.
5. Применение по п. 2, где v) представляет собой одно или более из 5-150 частей по массе порошка из спор Ganoderma, 1-90 частей по массе масла из спор Ganoderma, 10-400 частей по массе Radix Pseudostellariae, 1-120 частей по массе Folium Ginseng, 3-400 частей по массе Radix Codonopsis и 3-400 частей по массе Radix Astragali или любую их комбинацию.
6. Применение по п. 2, где v) представляет собой одно или более из 10-120 частей по массе порошка из спор Ganoderma, 10-60 частей по массе масла из спор Ganoderma, 20-200 частей по массе Radix Pseudostellariae, 20-90 частей по массе Folium Ginseng, 20-200 частей по массе Radix Codonopsis и 20-200 частей по массе Radix Astragali или любую их комбинацию.
7. Применение по п. 2, где v) представляет собой одно или более из 30 частей по массе порошка из спор Ganoderma, 20 частей по массе масла из спор Ganoderma, 40 частей по массе Radix Pseudostellariae, 30 частей по массе Folium Ginseng, 40 частей по массе Radix Codonopsis и 40 частей по массе Radix Astragali или любую их комбинацию.
8. Применение по п. 6, где сырьевые материалы i)-iv) представляют собой
i) 20-120 частей по массе Ganoderma,
ii) 10-90 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng,
iii) 3-60 частей по массе порошка ферментированного Cordyceps sinensis и/или 3-90 частей по массе Cordyceps и
iv) 10-60 частей по массе Flos Rosae Rugosae.
9. Применение по п. 7, где сырьевые материалы i)-iv) представляют собой
i) 40 частей по массе Ganoderma,
ii) 30 частей по массе Radix Panacis Quinquefolii или Radix Et Rhizoma Ginseng,
iii) 20 частей по массе порошка ферментированного Cordyceps sinensis и/или 6,7 частей по массе Cordyceps и
iv) 30 частей по массе Flos Rosae Rugosae.
10. Применение по любому из пп. 1-9, где аллергические заболевания представляют собой аллергический ринит, аллергический дерматит, аллергическую астму и/или крапивницу.
11. Применение по п. 1 или 2, где композицию получают с помощью следующих стадий:
1) взвешивание традиционных китайских лекарственных средств в качестве сырьевых материалов и
2) экстрагирование сырьевых материалов с обратным холодильником с помощью спирта или воды так, чтобы получить жидкий экстракт в качестве активного ингредиента, и добавление вспомогательного(ых) средства (средств) для получения различных лекарственных форм.
12. Применение по п. 1 или 2, где композицию получают с помощью следующих стадий:
1) взвешивание традиционных китайских лекарственных средств в качестве сырьевых материалов, добавление к ним метанола или этанола для проведения экстракции, извлечение метанола или этанола из экстракционной жидкости для получения экстракта I;
2) выпаривание метанола или этанола из остаточных лекарственных средств, добавление воды для проведения экстракции для получения экстракта II и
3) комбинирование экстракта I и экстракта II, проведение фильтрации, концентрирование фильтрата до соответствующего количества, добавление фармацевтически принятого(ых) вспомогательного(ых) средства (средств) для получения требуемого состава с помощью фармацевтически принятого способа.
13. Применение по п. 1 или 2, где композицию получают с помощью следующих стадий:
1) получение сырьевого материала: взвешивание традиционных китайских лекарственных средств в качестве сырьевых материалов;
2) экстракция и концентрация: замачивание сырьевых материалов на основе китайских лекарственных средств, обработанных на стадии 1) в воде, затем отваривание несколько раз путем нагревания, комбинирование жидких экстрактов для проведения фильтрации, концентрирование фильтрата до соответствующего количества, охлаждение концентрата и воздействие на него с помощью высокоскоростного центрифугирования для удаления примесей и хранение продукта до использования;
3) получение состава: подготовка концентрата, полученного на стадии 2), отдельно или вместе с медицински приемлемым(и) вспомогательным(и) средством(ами), в виде требуемого состава с помощью фармацевтически принятого способа;
4) в приведенной выше стадии 2) время замачивания составляет 20-60 мин, и после замачивания проводят отваривание 1-3 раза путем нагревания, причем каждое отваривание продолжается в течение 1-2 ч и оно характеризуется 6-13-кратным количеством добавленной воды.
14. Применение по любому одному из пп. 1-9, где композицию можно получить в любой лекарственной форме путем добавления к ней вспомогательного(ых) средства (средств) или вспомогательного вещества (веществ), которое(ые) является(ются) приемлемым(и) в медицинской продукции, лекарственных средствах или продуктах.
15. Применение по п. 14, где лекарственная форма представляет собой любую из таблетки, жидкости для перорального применения, гранулы, капсулы, электуария, драже с повышенной биодоступностью, драже, порошка, леденца, жидкого экстракта, экстракта, инъекции и сиропа.
| KR 2009116873 A, 12.11.2009 | |||
| CN 102205055 А, 05.10.2011 | |||
| Соединение труб с внутренним рукавом из термопласта | 1988 |
|
SU1539440A1 |
| AU 2007100050 A4, 15.02.2007. | |||
Авторы
Даты
2018-03-07—Публикация
2013-05-27—Подача