Область техники
Настоящее изобретение относится к новым фармацевтическим композициям для лечения инфаркта миокарда, содержащим пептидный фрагмент HMGB1, и к их применению.
Уровень техники
Острый инфаркт миокарда, который приводит к некрозу сердечной мышцы благодаря закупорке коронарной артерии, представляет собой заболевание с неблагоприятным прогнозом и является основной причиной сердечных заболеваний, которые являются второй причиной смерти в Японии. Существующие терапии, катеризация острой фазы и аортокоронарное шунтирование смягчают поражение миокарда и вносят вклад в уменьшение смертности; однако, имеются проблемы, такие как миокардиальное повреждение, которое имеет место при перезапуске блокированного коронарного кровотока (ишемически-реперфузионное повреждение). Таким образом, целесообразна разработка дополнительных терапий.
Недавно в базовых экспериментах с использованием животных моделей было обнаружено, что трансплантация мезенхимальных стволовых клеток костного мозга подавляет инфаркт миокарда посредством регенерации сердечной мышцы путем прямой дифференцировки трансплантированных клеток в клетки сердечной мышцы, а также посредством подавления левого вентрикулярного ремоделирования, вызванного паракринным эффектом продуцируемых цитокинов. В настоящее время проводятся клинические испытания трансплантации аутологических клеток посредством различных путей введения. Однако остается решить множество проблемных моментов, таких как, например, проблемы, касающиеся трансплантации аутологических клеток, такие как физические затраты, связанные со сбором клеток, стоимость и человеческие усилия, вовлеченные в культивирование клеточных культур, и требуемое время до момента клеточной трансплантации. При этом недавно было подтверждено, что существует механизм, в котором пораженная ткань высвобождает факторы, которые привлекают стволовые плюрипотентные клетки костного мозга в кровь для индуцирования регенерации ткани на пораженном участке. Тканевая регенерация, которая использует механизмы индуцирования регенерации пораженной ткани in vivo путем введения факторов, индуцирующих стволовые клетки костного мозга, представляет собой нестандартную новую концепцию в регенерационной терапии, и считается, что она является предпочтительной по сравнению с клеточной терапией, при которой используют стволовые клетки, она не требует людских ресурсов, возможно стабильное снабжение, а также возможно введение на ранней стадии поражения.
В предыдущих исследованиях авторы настоящего изобретения идентифицировали белок HMGB1 в качестве нового фактора, который мобилизует плюрипотентные стволовые клетки костного мозга. HMGB1 представляет собой основной компонент не гистоновых ядерных белков и высвобождается во внеклеточное пространство из дендритных клеток, макрофагов или некротических клеток, которые аккумулируются в пораженных участках, и подтверждено, что он ассоциирован с различными заболеваниями.
Документы предшествующего уровня техники
[Патентные Документы]
[Патентный Документ 1] WO 2008/053892.
[Патентный Документ 2] WO 2007/015546.
[Патентный Документ 3] WO 2009/133939.
[Патентный Документ 4] WO 2009/133940.
[Патентный Документ 5] WO 2009/133940.
[Патентный Документ 6] WO 2004/004763.
[Патентный Документ 7] WO 2002/074337.
[Непатентные Документы]
[Непатентный Документ 1] Bustin et al., Mol Cell Biol, 19: 5237-5246, 1999.
[Непатентный Документ 2] Hori et al., J. Biol. Chem., 270, 25752-25761, 1995.
[Непатентный Документ 3] Wang et al., Science, 285: 248-251, 1999.
[Непатентный Документ 4] Muller et al., EMBO J, 20: 4337-4340, 2001.
[Непатентный Документ 5] Wang et al., Science, 285: 248-251, 1999.
[Непатентный Документ 6] Germani et al., J Leukoc Biol., 81(1): 41-5, 2007.
[Непатентный Документ 7] Palumbo et al., J. Cell Biol., 164: 441-449, 2004.
[Непатентный Документ 8] Merenmies et al., J. Biol. Chem., 266: 16722-16729, 1991.
[Непатентный Документ 9] Wu Y et al., Stem cells, 25: 2648-2659, 2007.
[Непатентный Документ 10] Tamai et al., Proc Natl Acad Sci US, 108(16): 6609-6614, 2011.
[Непатентный Документ 11] Yang et al., J Leukoc Biol., 81(1): 59-66, 2007.
Сущность изобретения
Проблемы, решенные изобретением
Недавно в таких заболеваниях, как церебральный инфаркт, было подтверждено, что существует механизм, в котором пораженная ткань индуцирует тканевую регенерацию в пораженном участке путем высвобождения факторов, которые мобилизуют плюрипотентные стволовые клетки костного мозга в кровь, и что данный механизм способствует предотвращению дальнейшей экспансии поражения. В настоящем изобретении целью авторов настоящего изобретения было разработать новые терапевтические агенты для инфаркта миокарда с применением пептидных фрагментов, выделенных из белка HMGB1, который был идентифицирован в качестве нового фактора, мобилизующего плюрипотентные стволовые клетки костного мозга.
Способы решения проблем
Авторы настоящего изобретения получили пептидный фрагмент (1-44) белка HMGB1, который обладает активностью клеточной миграции, и впервые обнаружили на модели инфаркта миокарда, что системное введение пептидного фрагмента усиливает аккумуляцию PDGFRα-положительных клеток в инфарктных участках и поблизости от них. Кроме того, было продемонстрировано продолжительное улучшение функции сердца у животных с моделью инфаркта миокарда, которым вводили пептидный фрагмент (1-44). Вышесказанное предполагает, что пептидный фрагмент (1-44) индуцирует тканевую регенерацию путем применения механизма индуцирования регенерации пораженной ткани in vivo и подавляет развитие острого инфаркта миокарда. Таким образом, показано, что пептидный фрагмент по настоящему изобретению может представлять собой применяемый терапевтический агент для острого инфаркта миокарда человека с неблагоприятным прогнозом.
Настоящее изобретение раскрывает новые фармацевтические композиции для лечения инфаркта миокарда, содержащие пептидный фрагмент HMGB1, и их применения.
Конкретно, авторы настоящего изобретения с помощью пептидного синтеза получили пептид, состоящий из аминокислот в положениях 1-44 белка HMGB1 (SEQ ID NO: 3). Мышиным моделям, в которых есть возможность оценивать терапевтический эффект в отношении инфаркта миокарда, вводили полученные фрагменты HMGB1 и подтверждали терапевтические эффекты фрагментов в отношении инфаркта миокарда.
На основе этих открытий в настоящей заявке предлагается следующее изобретение:
[1] фармацевтическая композиция для применения в лечении инфаркта миокарда, содержащая пептидный фрагмент HMGB1;
[2] фармацевтическая композиция [1], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность SEQ ID NO: 3;
[3] фармацевтическая композиция [1], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности SEQ ID NO: 3;
[4] способ лечения инфаркта миокарда, включающий стадию введения пептидного фрагмента HMGB1;
[5] способ [4], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность SEQ ID NO: 3;
[6] способ [4], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности SEQ ID NO: 3;
[7] пептидный фрагмент HMGB1 для применения в лечении инфаркта миокарда;
[8] пептидный фрагмент HMGB1 [7], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность SEQ ID NO: 3;
[9] пептидный фрагмент HMGB1 [7], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности SEQ ID NO: 3;
[10] применение для получения лекарственного средства для применения в лечении инфаркта миокарда, которое содержит пептидный фрагмент HMGB1;
[11] применение [10], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность SEQ ID NO: 3; и
[12] применение [10], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности SEQ ID NO: 3.
Краткое описание чертежей
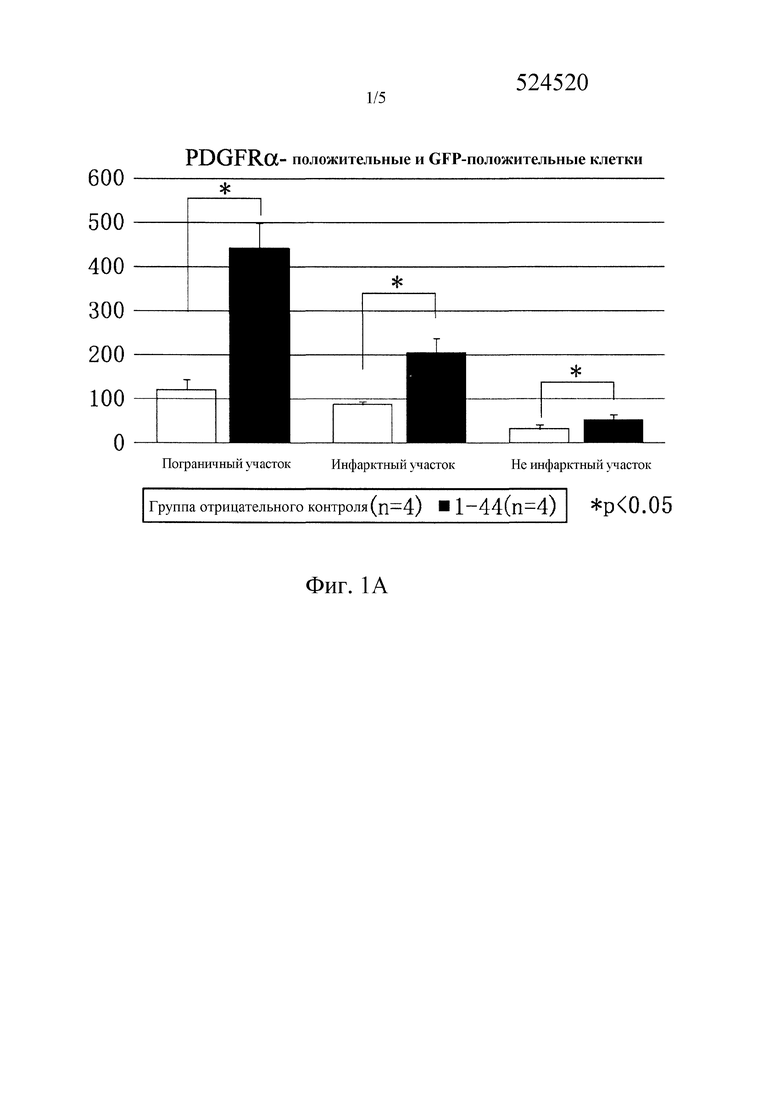
Фиг. 1A представляет собой график, указывающий количество PDGFRα-положительных мезенхимальных стволовых клеток костного мозга в инфарктных участках (INFARCT), в пограничных участках (BORDER), и в не пораженных инфарктом участках (REMOTE) через семь дней после образования инфаркта миокарда. PDGFRα-положительные мезенхимальные стволовые клетки костного мозга были существенно привлечены (1-факторный дисперсионный анализ ANOVA, *P<0,05 против 1-44) во все инфарктные области, в пограничные участки и в не инфарктные участки в группе введения пептидного фрагмента (1-44) (1-44; N=4) по сравнению с группой отрицательного контроля (CONT; N=4).
Фиг. 1В представляет собой фотографию, демонстрирующую иммунофлуоресцентное окрашивание в пограничных участках мыши, которой вводили пептидный фрагмент (1-44). Клетки, положительные для зеленой флуоресценции, представляют собой GFP-положительные клетки, выделенные из костного мозга, и клетки, положительные для красной флуоресценции, характеризуют PDGFRα-экспрессирующие клетки. Клетки, положительные для обоих, GFP и PDGFRα, указаны стрелками.
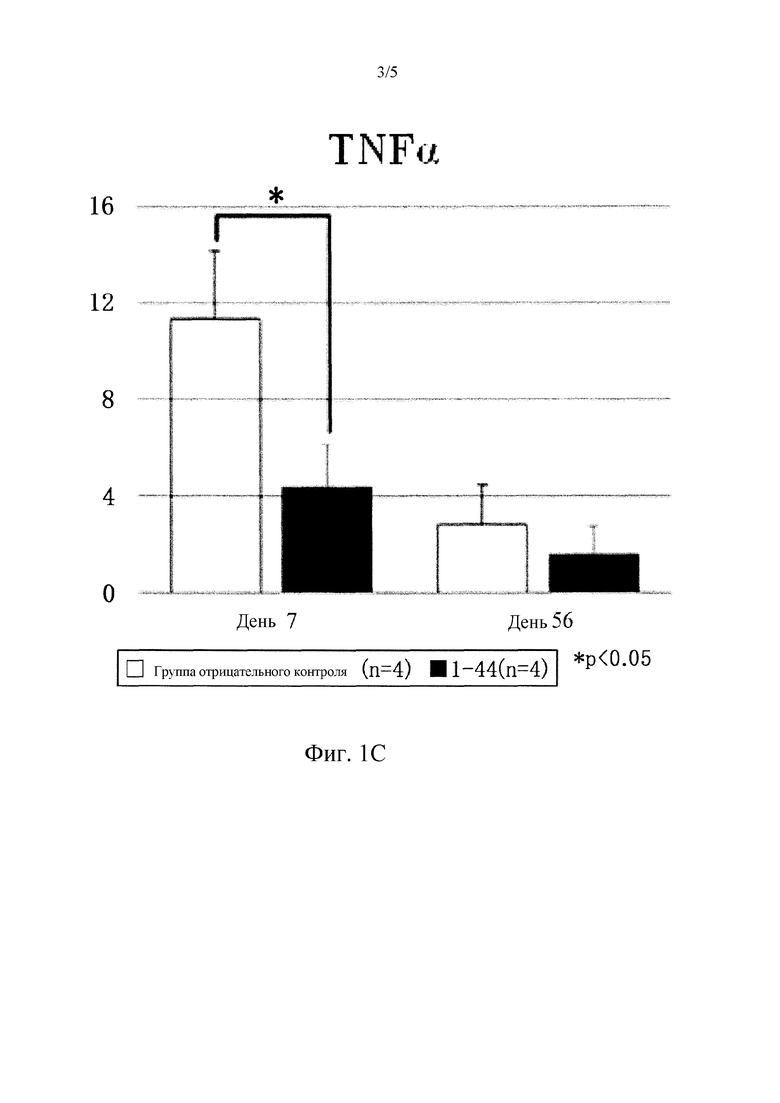
Фиг. 1С представляет собой график, демонстрирующий уровень мРНК воспалительного цитокина TNFα в инфарктных участках (INFARCT), в пограничных участках (BORDER), и в не инфарктных участках (REMOTE) через 7 и 56 дней после образования инфаркта миокарда. Уровень воспалительного цитокина (TNFα, IL-1β в не инфарктных участках был значительно ниже (1-факторный дисперсионный анализ ANOVA, #P<0,05 1-44 против CONT) в группе введения пептидного фрагмента (l-44) (1-44; N=4) по сравнению с группой отрицательного контроля (CONT: N=4).
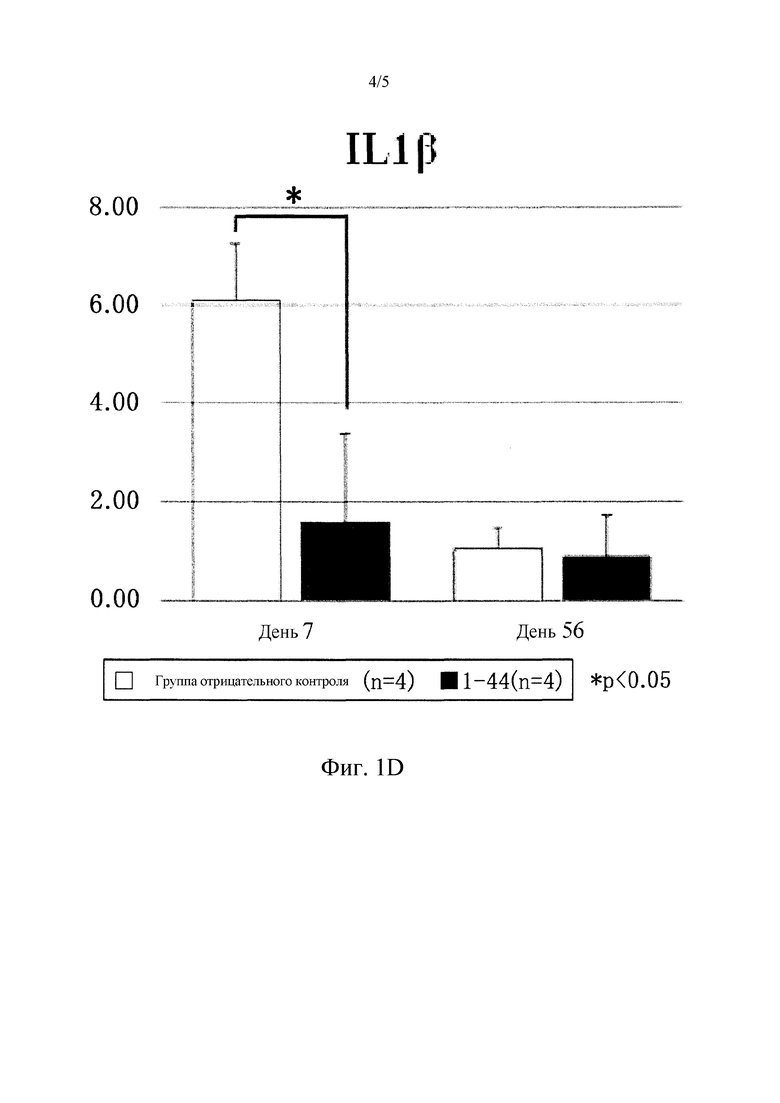
Фиг. 1D представляет собой график, демонстрирующий уровень мРНК воспалительного цитокина IL-1β в инфарктных участках (INFARCT), в пограничных участках (BORDER), и в не инфарктных участках (REMOTE) через 7 и 56 дней после образования инфаркта миокарда. Уровень воспалительного цитокина (TNFα, IL-1β в не инфарктных участках был значительно ниже (1-факторный дисперсионный анализ ANOVA, #P<0,05 1-44 против CONT) в группе введения пептидного фрагмента (l-44) (1-44; N=4) по сравнению с группой отрицательного контроля (CONT: N=4).
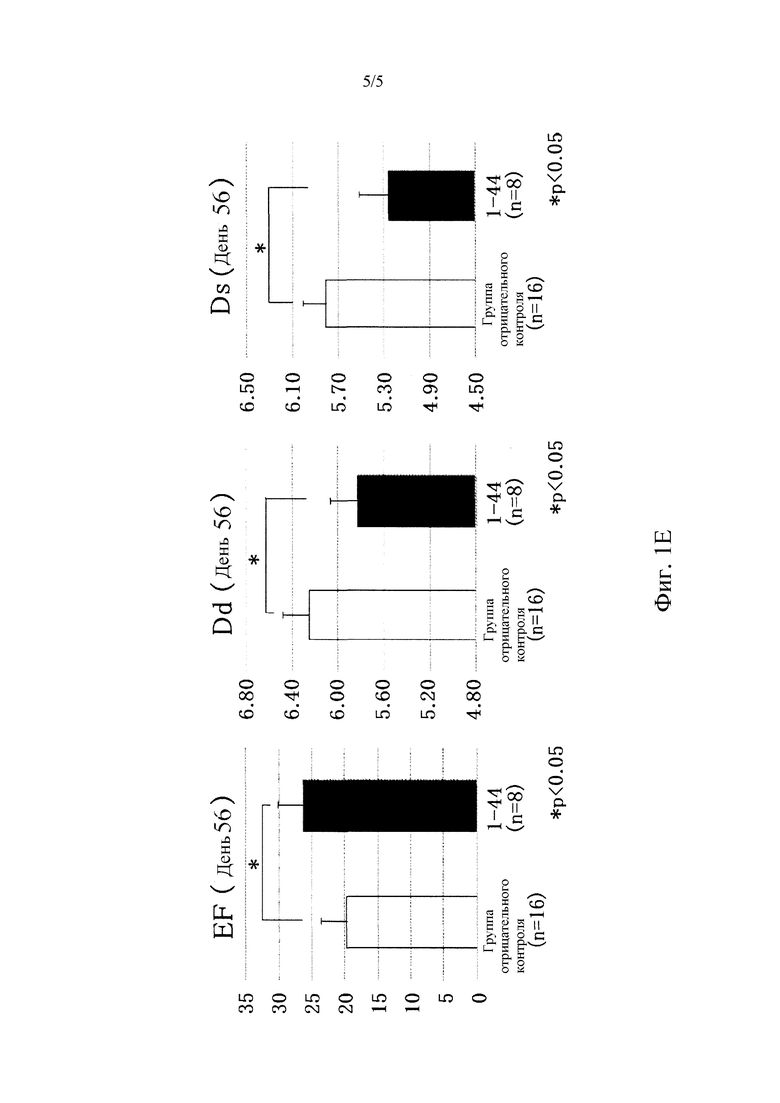
Фиг. 1E представляет собой график, демонстрирующий фракцию выброса левого желудочка (EF), конечно-диастолический диаметр левого желудочка (DD), и конечно-систолический диаметр левого желудочка (DS) группы отрицательного контроля и группы введения пептидного фрагмента (l-44) через 56 дней после образования инфаркта миокарда.
Способы осуществления изобретения
В настоящем изобретении предлагаются фармацевтические композиции для применения в лечении инфаркта миокарда, которые содержат пептидный фрагмент HMGB1, обладающий активностью, стимулирующей миграцию клеток. В данном документе фармацевтические композиции для применения в лечении инфаркта миокарда по настоящему изобретению также представлены в виде лекарственных средств, фармацевтических агентов или лекарственных композиций.
В настоящем изобретении активность, стимулирующая миграцию клеток, относится к активности стимулирования клеточной миграции. В данном документе активность, стимулирующая миграцию клеток, также выражена в виде активности, индуцирующей миграцию клеток, или активности притягивания клеток.
Фармацевтические композиции по настоящему изобретению могут вводиться/добавляться в любые участки. То есть композиции могут оказывать их эффекты независимо от того, в какой участок они вводятся, как например, в участок инфаркта миокарда, который нуждается в регенерации, в участок, отличный от него, или в кровь. Например, когда композиции вводят/добавляют, то клетки привлекаются к участку введения/добавления или в соседние участки, индуцируя таким образом или стимулируя регенерацию пораженных участков. Кроме того, например, когда композиции вводят/добавляют в инфарктный участок или поблизости от него, то клетки привлекаются в инфарктный участок, индуцируя таким образом или стимулируя регенерацию инфарктного участка. Кроме того, например, когда композиции вводят/добавляют в ткань, нуждающуюся в регенерации, клетки костного мозга мобилизуются из костного мозга к участку, нуждающемуся в регенерации, посредством периферической циркуляции, индуцируя таким образом или стимулируя регенерацию. В данном документе "периферическую циркуляцию" также называют "циркуляцией крови" или "периферической циркуляцией кровотока".
Введение в ткань, отличную от ткани, нуждающейся в регенерации, относится к введению в участок, который не является участком, нуждающимся в регенерации (участок, отличный от участка, нуждающегося в регенерации). Соответственно, "ткань, отличная от ткани, нуждающейся в регенерации", также может относиться к:
участку, отличному от ткани, нуждающейся в регенерации; участку, отличному от участка, нуждающегося в регенерации; участку, удаленному от ткани, нуждающейся в регенерации; участку, отдаленному от участка, нуждающегося в регенерации; участку, удаленному от участка, нуждающегося в регенерации; к ткани, удаленной от ткани, нуждающейся в регенерации; к удаленному участку; или к отдаленной ткани.
Таким образом, композиции по настоящему изобретению эффективно используются для регенерации тканей, в которые трудно непосредственно вводить фармацевтические агенты извне организма. Примеры ткани, отличной от ткани, нуждающейся в регенерации, включают гематопоэтические ткани, мышечные ткани, подкожные ткани, внутрикожные ткани, брюшную полость и так далее.
В настоящем изобретении клетки, которые стимулируют для миграции, или клетки, мобилизованные из костного мозга в периферическую кровь, включают недиференцированные клетки и клетки на различных стадиях дифференцировки, но не ограничиваются ими. В настоящем изобретении клетки, которые стимулируют для миграции, или клетки, мобилизованные из костного мозга в периферическую кровь, включают стволовые клетки, не стволовые клетки и так далее, но не ограничиваются ими. Стволовые клетки включают циркуляторные стволовые клетки и не циркуляторные стволовые клетки. Не циркуляторные стволовые клетки представляют собой, например, стволовые клетки, находящиеся в ткани. Циркуляторные стволовые клетки представляют собой, например, циркуляторные стволовые клетки в крови.
Кроме того, клетки, стимулированные для миграции или клетки, мобилизованные из костного мозга в периферическую кровь, включают клетки, выделенные из костного мозга, и гематопоэтические стволовые клетки, но не ограничиваются ими. В настоящем описании, "гематопоэтические стволовые клетки" представляют собой стволовые клетки, которые могут дифференцироваться в клетки крови, такие как эритроциты, тромбоциты, тучные клетки и дендритные клетки, а также в лейкоциты, включающие нейтрофилы, эозинофилы, базофилы, лимфоциты, моноциты и макрофаги и так далее. Известно, что их маркеры являются CD34-положительными у человека и CD34-отрицательными, c-Kit-положительными, Sea-1-положительными и негативными к маркеру линии дифференцировки у мыши. Гематопоэтические стволовые клетки трудно культивировать индивидуально при культивировании в культуральных чашках, и они нуждаются в совместном культивировании со стромальными клетками.
В настоящем описании "клетки костного мозга" означают клетки, присутствующие внутри костного мозга, в то время как "клетки, выделенные из костного мозга" означают "клетки костного мозга", мобилизованные из костного мозга во внешние относительно костного мозга участки. "Клетки костного мозга" включают клетки, содержащие клеточные популяции предшественников ткани, присутствующие внутри костного мозга. Кроме того, "клетки, выделенные из костного мозга", могут представлять собой клетки, содержащие мезоангиобласты или клетки, свободные от мезоангиобластов.
Клетки - тканевые предшественники определяются как не дифференцированные клетки, обладающие однонаправленным потенциалом дифференцироваться в мезенхимальные ткани, эпителиальные ткани, нервные ткани, паренхиматозные органы и в васкулярный эндотелий, как упомянуто выше.
"Клетки костного мозга" и "клетки, выделенные из костного мозга" представляют собой гематопоэтические стволовые клетки, выделенные таким образом, такие как лейкоциты, эритроциты, тромбоциты, остеобласты и фиброциты, или представляют собой стволовые клетки, представленные клетками, которые ранее назывались мезенхимальными стволовыми клетками костного мозга, стромальными плюрипотентными стволовыми клетками костного мозга или плюрипотентными стволовыми клетками костного мозга. При использовании в данном документе, "стволовые клетки костного мозга" относятся к стволовым клеткам, присутствующим внутри костного мозга, в то время как "клетки, выделенные из костного мозга" относятся к "стволовым клеткам костного мозга", мобилизованным из костного мозга во внешние относительно костного мозга участки. В настоящем изобретении, клетки, стимулированные к миграции, или клетки, мобилизованные из костного мозга в периферическую кровь, включают "стволовые клетки, выделенные из костного мозга", но не ограничиваются ими. "Клетки костного мозга" и "клетки, выделенные из костного мозга", могут быть выделены путем забора костного мозга (забор клеток костного мозга) или путем забора клеток периферической крови. Гематопоэтические стволовые клетки являются неадгезивными, в то время как некоторые из "клеток костного мозга" и "клеток, выделенных из костного мозга", получают как адгезивные клетки посредством культивирования клеточной культуры моноцитарной фракции крови, полученной путем забора костного мозга (забор клеток костного мозга) или забора клеток периферической крови.
Кроме того, "клетки костного мозга" и "клетки, выделенные из костного мозга", включают мезенхимальные стволовые клетки и обладают потенциалом к дифференцировке, предпочтительно, в остеобласты (которые могут быть идентифицированы путем наблюдения кальцификации после индуцирования дифференцировки), в хондроциты (которые могут быть идентифицированы путем положительного окрашивания альциановым синим, положительного окрашивания сафранином О или подобным способом), в адипоциты (которые могут быть идентифицированы путем положительного окрашивания Судановым III), и в другие мезенхимальные клетки, такие как фибробласты, гладкомышечные клетки, стромальные клетки и тендиноциты; и, кроме того, в нервные клетки, эпителиальные клетки (например, эпидермальные кератиноциты и эпителиальные клетки кишечника, экспрессирующие белки семейства цитокератинов), и в васкулярные эндотелиальные клетки. Клетки, которые будут дифференцироваться, не ограничиваются вышеописанными клетками и обладают потенциалом дифференцироваться в клетки паренхиматозных органов, таких как печень, почки и поджелудочная железа.
В данном документе, "мезенхимальные стволовые клетки костного мозга", "стромальные плюрипотентные клетки костного мозга" или "плюрипотентные стволовые клетки костного мозга" относятся к клеткам, существующим в костном мозге, которые непосредственно собирают из костного мозга или косвенно собирают из других тканей (крови, кожи, жира и других тканей), и могут культивироваться и пролиферировать как адгезионные клетки на культуральных чашках (сделанных из пластика или стекла). Эти клетки характеризуются наличием потенциала к дифференцировке в мезенхимальные ткани, такие как кость, хрящ и жир (мезенхимальные стволовые клетки), или в скелетную мышцу, сердечную мышцу, нервные ткани и в эпителиальные ткани (плюрипотентные стволовые клетки), и могут быть получены путем забора клеток костного мозга.
С другой стороны, "выделенные из костного мозга мезенхимальные стволовые клетки костного мозга", "выделенные из костного мозга стромальные плюрипотентные клетки костного мозга" или "выделенные из костного мозга плюрипотентные стволовые клетки костного мозга", мобилизованные из костного мозга во внешнее пространство относительно костного мозга, представляют собой клетки, которые могут быть получены путем забора из периферической крови, мезенхимальных тканей, таких как жир, эпителиальных тканей, таких как кожа, или нервных тканей, таких как мозг.
Кроме того, эти клетки также характеризуются наличием потенциала дифференцировки, например, в эпителиальные ткани, такие как кератиноциты, которые составляют кожу, или в нервные ткани, которые составляют мозг, при введении в пораженную область живого организма сразу после забора или после адгезии на культуральной чашке.
Мезенхимальные стволовые клетки костного мозга, стромальные плюрипотентные стволовые клетки костного мозга, плюрипотентные стволовые клетки костного мозга или эти клетки, привлеченные из костного мозга во внешнее пространство относительно костного мозга, предпочтительно обладают потенциалом к дифференцировке в: остеобласты (которые могут быть идентифицированы путем наблюдения кальцификации после индуцирования дифференцировки), в хондроциты (которые могут быть идентифицированы путем положительного окрашивания альциановым синим, положительного окрашивания сафранином О или подобным способом), в адипоциты (которые могут быть идентифицированы путем положительного окрашивания Судановым III), и в другие мезенхимальные клетки, такие как фибробласты, гладкомышечные клетки, стромальные клетки и тендиноциты; и, кроме того, в нервные клетки, эпителиальные клетки (например, эпидермальные кератиноциты и эпителиальные клетки кишечника, экспрессирующие белки семейства цитокератинов или подобные), и в эндотелиальные клетки; и кроме того, в клетки паренхиматозных органов, таких как печень, почки и поджелудочная железа. Однако дифференцированные клетки не ограничиваются вышеописанными клетками.
Человеческие клетки костного мозга и человеческие клетки, выделенные из костного мозга, могут быть представлены, например, в частности, клетками, которые могут быть непосредственно собраны из костного мозга (клетки костного мозга), из периферической крови или жира или получены в виде адгезионных клеток посредством культивирования выделенной моноцитарной фракции. Маркеры человеческих клеток костного мозга и человеческих клеток, выделенных из костного мозга, включают, например, все или некоторые из следующих, но не ограничиваются ими: PDGFRα-положительные, Lin-отрицательные, CD45-отрицательные, CD44-положительные, CD90-положительные, и CD29-положительные, Flk-1-отрицательные, CD105-положительные, CD73-положительные, CD90-положительные, CD71-положительные, Stro-1-положительные, CD106-положительные, CD166-положительные и CD31-отрицательные.
Кроме того, мышиные клетки костного мозга и мышиные клетки, выделенные из костного мозга, могут быть представлены, например, в частности, клетками, которые могут быть непосредственно собраны из костного мозга (клетки костного мозга), из периферической крови или жира или получены в виде адгезионных клеток посредством культивирования выделенной моноцитарной фракции. Маркеры мышиных клеток костного мозга и мышиных клеток, выделенных из костного мозга, включают, например, все или некоторые из следующих, но не ограничиваются ими: CD44-положительные, PDGFRα-положительные, PDGFRβ-положительные, CD45-отрицательные, Lin-отрицательные, Sea-1-положительные, c-kit-отрицательные, CD90-положительные, CD29-положительныеи и Flk-1-отрицательные.
В настоящем изобретении клетки, стимулированные к миграции, включают PDGFRα-положительные клетки, но не ограничиваются ими. Кроме того, PDGFRα-положительные клетки, стимулированные к миграции, не ограничены ничем конкретным, но предпочтительно представляют собой PDGFRα-положительные клетки, выделенные из костного мозга. Кроме того, маркеры, отличные от PDGFRα, могут быть представлены, например, всеми или некоторыми из CD29-положительных, CD44-положительных, CD90-положительных, CD271-положительных, CD11b-отрицательных и Flk-1-отрицательных, но не ограничиваются ими. PDGFRα-положительные клетки включают, в частности, например, PDGFRα-положительные клетки, выделенные из костного мозга, PDGFRα-положительные мезенхимальные стволовые клетки, выделенные из костного мозга, тканевые клетки, находящиеся в PDGFRα-положительных тканях (например, фибробласты и подобные), PDGFRα-положительные клетки, выделенные из костного мозга, полученные в виде адгезионных клеток посредством культивирования клеток моноцитарной фракции крови, полученной путем забора костного мозга (забор клеток костного мозга), или путем забора периферической крови.
Белок HMGB1 в настоящем изобретении включает, например, в частности, белок, содержащий аминокислотную последовательность SEQ ID NO: 1 в качестве человеческого белка HMGB1 и ДНК, кодирующая указанный белок, включает, в частности, например, ДНК, содержащую нуклеотидную последовательность SEQ ID NO: 2.
В настоящем изобретении "пептидный фрагмент HMGB1, обладающий активностью стимулирования клеточной миграции" относится к пептиду, состоящему из участка белка HMGB1, и обладающему активностью стимулирования клеточной миграции. Пептидные фрагменты, состоящие из участка белка HMGB1 по настоящему изобретению, конкретно не ограничены при условии, что они обладают активностью стимулирования клеточной миграции, но предпочтительно они представляют собой пептидные фрагменты HMGB1, содержащие, по меньшей мере, аминокислотную последовательность положений 1-44 белка HMGB1 (SEQ ID NO: 3), которые представляют собой пептидные фрагменты, обладающие активностью стимулирования клеточной миграции.
В настоящем изобретении пептидные фрагменты HMGB 1, обладающие активностью стимулирования клеточной миграции, могут быть представлены, например, фрагментами, описанными ниже, но не ограничиваясь ими.
В настоящем изобретении пептидные фрагменты HMGB1, обладающие активностью стимулирования клеточной миграции, включают пептидные фрагменты HMGB1, которые содержат аминокислотную последовательность SEQ ID NO: 3 и обладают активностью стимулирования клеточной миграции. Такие пептидные фрагменты включают без ограничения, например, в качестве верхнего ограничения любой произвольный пептид выделенного из HMGB 1 фрагмента, который, содержит, по меньшей мере, пептидный фрагмент HMGB1 (1-44), но не содержит полноразмерного белка HMGB1.
В настоящем изобретении пептидные фрагменты, обладающие активностью стимулирования клеточной миграции, включают пептидный фрагмент HMGB1 (1-44).
Методы введения композиции по настоящему изобретению включают пероральное введение и парентеральное введение. Конкретно, парентеральное введение включает, в частности, инъекцию, трансназальное введение, транспульмонарное введение, трансдермальное введение и тому подобные. В качестве примеров инъекции внутривенная инъекция, внутримышечная инъекция, внутрибрюшинная инъекция, подкожная инъекция и тому подобные могут использоваться для введения композиции по настоящему изобретению системно или местно (например, под кожу, в кожу, на поверхность кожи, в глазное яблоко или в оболочку века, в слизистую носа, в слизистую рта и в слизистую желудочно-кишечного тракта, в вагинальную слизистую/во внутриматочную слизистую, в участок повреждения или тому подобные участки).
Методы введения композиции по настоящему изобретению включают, в частности, например, внутриваскулярное введение (внутриартериальное введение, внутривенное введение или тому подобные), введение в кровь, внутримышечное введение, подкожное введение, внутрикожное введение, внутрибрюшинное введение.
Не существует ограничений по участку введения и, например, он может представлять собой участок ткани, нуждающийся в регенерации или соседнюю с ним область, участок, отличный от ткани, нуждающейся в регенерации, или участок, отдаленный и отличный от участка ткани, нуждающегося в регенерации. Участок, например, находится в крови (в артериях, в венах или тому подобных), мышце, под кожей, в коже, в брюшной полости или тому подобных без ограничения.
Метод введения может быть соответственно выбран согласно возрасту и симптомам пациента. Когда вводят пептид по настоящему изобретению, то доза пептида на единицу времени может быть выбрана в интервале 0,0000001 – 1000 мг на 1 кг массы тела пациента. Альтернативно, доза может быть выбрана, например, в интервале 0,00001 – 100000 мг на массу тела пациента. При введении клеток, секретирующих пептид по настоящему изобретению или векторов генной терапии, в которые вставлена ДНК, кодирующая пептид, они могут вводиться так, чтобы количество пептида находилось внутри вышеописанного интервала. Однако доза фармацевтических композиций по настоящему изобретению не ограничена этим.
Пептидные фрагменты HMGB1 по настоящему изобретению могут быть получены в виде рекомбинантов путем включения ДНК, кодирующей пептид, в подходящую экспрессирующую систему или могут быть синтезированы искусственно. Фармацевтические композиции по настоящему изобретению могут быть включены в состав согласно обычным методам (например, Remington's Pharmaceutical Science, latest edition, Mark Publishing Company, Easton, U.S.A), и могут содержать фармацевтически приемлемые носители и добавки. Примеры включают поверхностно-активные вещества, эксципиенты, красители, отдушки, консерванты, стабилизаторы, буферы, суспендирующие агенты, изотонические агенты, связующие вещества, дезинтеграторы, смазки, стимуляторы текучести и вкусовые агенты, хотя они не ограничены этим, и могут, соответственно, использоваться и другие носители. Конкретные примеры включают легкую безводную кремниевую кислоту, лактозу, кристаллическую целлюлозу, маннит, крахмал, кармеллозу кальция, кармеллозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилацетальдиэтиламино ацетат, поливинилпирролидон, желатин, триглецирид среднецепочечной жирной кислоты, полиоксиэтилен гидрогенизированное касторовое масло 60, белый сахар, карбоксиметилцеллюлозу, кукурузный крахмал и неорганические соли.
Все документы предшествующего уровня техники, процитированные в данном документе, включены сюда ссылкой.
Здесь ниже настоящее изобретение будет дополнительно проиллюстрировано со ссылкой на Примеры, но их не следует понимать как ограничение.
Пример 1. Цель
Терапевтический эффект при системном введении пептидного фрагмента белка HMGB1 (1-44) в полном объеме оценивают с использованием мышиной модели острого инфаркта миокарда посредством сердечной физиологии, гистопатологии и молекулярной биологии.
Материалы и методы
Клетки костного мозга собирали из берцовой кости/кости нижней лапы трехнедельных мышей (C57BL6-CAG-GFP трансгенные мыши), и суспензии клеток костного мозга вводили (300 мл/на мышь) в хвостовую вену шестинедельных мышей (C57BL6) после облучения (10GY) для получения химерных по костному мозгу мышей. Через шестьдесят дней после трансплантации костного мозга, проводили торакотомию в области левого четвертого межреберного пространства под общей анестезией в горизонтальном положении, и лигировали проксимальную левую переднюю межжелудочковую ветвь левой коронарной артерии с получением модели обширного инфаркта миокарда (передняя межжелудочковая ветвь левой коронарной артерии/огибающая окклюзионная модель). Чтобы получить низкомолекулярный вариант белка HMGB1, пептидный фрагмент (1-44) белка HMGB1 разрабатывали так, чтобы сохранялась активность привлечения мезенхимальных стволовых клеток костного мозга. Через 6, 24, 48, 72 и 96 ч после образования инфаркта, пептидный фрагмент белка HMGB1 (1-44) (5 мкг/300 мкл), или 300 мкл PBS (группа отрицательного контроля) вводили пять раз в хвостовую вену. Мышей подвергали эвтаназии путем введения избытка кетамина и ксилазина и проводили забор их сердец. После того, как ткани погружали в соединение OCT, готовили криосрезы толщиной 5 мкм. Иммуногистологические исследования осуществляли, как указано ниже, путем использования мышиного антитела к PDGFRα. В качестве первичного антитела использовали кроличьи антитела к рецептору альфа PDGF, PDGFRα (Abeam, AB61219). Козьи антикроличьи антитела Alexa 555 (Molecular Probes) использовали в качестве вторичных антител, и 4,6-диамино-2-фенилинодол (DAPI, Molecular Probes) использовали для окрашивания ядра. Для фотографий использовали конфокальный сканирующий лазерный микроскоп (FV300, Olympus). Что касается количества мезенхимальных стволовых клеток, выделенных из костного мозга, аккумулированных в ткани, то количество клеток, положительных для обоих, GFP и PDGFRα, присутствующих во всех областях 5 случайно выбранных срезов, определяли и рассчитывали среднее значение. Кроме того, РНК экстрагировали из миокардиальной ткани с использованием набора реагентов RNeasy Kit (Qiagen), и кДНК получали путем реакции обратной транскрипции с использованием Обратной Транскриптазы Omniscript (Qiagen). ПЦР в реальном времени осуществляли с использованием ПЦР-системы Gene Amp(R) 9700 (Life Technologies Japan) с использованием вышеописанной кДНК в качестве матрицы, и уровень мРНК TNFα и IL-1β определяли как отношение к уровню мРНК GAPDH. Улучшение функции сердца оценивали путем измерения конечно-диастолического диаметра левого желудочка (LVDd: Dd), конечно-систолического диаметра левого желудочка (LVDs: Ds), и фракции выброса левого желудочка (LVEF: EF) с использованием системы эхокардиографии Vivid 7 и преобразователя 12-MГц (General Electric).
Путем системного введения пептидного фрагмента белка HMGB1 (1-44), PDGFRα-положительные мезенхимальные клетки, выделенные из костного мозга, значительно привлекались в области не инфарктных участков, в пограничные участки и в инфарктные участки на 7 день после образования инфаркта (не инфарктный участок: неполный фрагмент белка HMGBI (1-44 пептид), 52±11#*; отрицательный контроль, 32±9 клеток/мм2, N=4 каждая, #P<0,05 против отрицательного контроля) (Фиг. 1A). Кроме того, в группе пептидного фрагмента белка HMGBI (1-44) уровень воспалительных цитокинов (TNFα, IL-1β) в не инфарктных участках был значительно ниже (TNFα: пептидный фрагмент белка HMGB1 (1-44), 4±2#*; отрицательный контроль, 11±3 GAPDH; N=4 каждый, #P<0,05 против отрицательного контроля), (IL-1β: неполный фрагмент белка HMGBI (1-44 пептид), 2±1#*; отрицательный контроль, 6±1 GAPDH; N=4 каждый, #P<0,05 против отрицательного контроля) (Фиг. 1С, 1D). Ультразвуковое обследование сердца на 56 день обнаружило, что систолическая дисфункция левого желудочка после инфаркта миокарда значительно подавлялась в группе введения пептидного фрагмента белка HMGBI (1-44) (EF: пептидный фрагмент белка HMGBI (1-44) (N=8), 26±4#*; отрицательный контроль (N=16), 20±4%, #P<0,05 против отрицательного контроля). Кроме того, гипертрофия левого желудочка значительно подавлялась в группе введения пептидного фрагмента HMGB1 (1-44) (DD: пептидный фрагмент белка HMGB1 (1-44) (N=8), 5,8±0,2#*, отрицательный контроль (N=16), 6,3±0,2 мм, #P<0,05 против отрицательного контроля) (Фиг. 1E).
В настоящем исследовании было продемонстрировано, что пятидневное введение пептидного фрагмента белка HMGB1 (1-44) привлекает PDGFRα-положительные мезенхимальные стволовые клетки костного мозга в инфарктный участок и в соседние с ним участки при острой стадии (День 7) после образования инфаркта (Фиг. 1 A, 1B). Конкретно, было продемонстрировано, что введение пептидного фрагмента (1-44) усиливает привлечение PDGFRα-положительных мезенхимальных стволовых клеток в миокардиальную ткань не инфарктного участка. Известно, что мезенхимальные стволовые клетки костного мозга обладают эффектом подавления воспаления и эффектом регенерации ткани. В настоящем Примере было также обнаружено, что они подавляют воспалительные реакции (Фиг. 1С, 1D). Кроме того, введение пептидного фрагмента HMGB1 (1-44) значительно подавляло ухудшение систолической функции левого желудочка, гипертрофии левого желудочка и ремоделирование левого желудочка. Также наблюдали значительное продолжительное улучшение миокардиальной функции (Фиг. 1E).
Промышленная применимость
В настоящем изобретении предлагаются новые применения пептидов фрагментов HMGB1, которые сохраняют активность привлечения PDGFRα-положительных клеток для лечения инфаркта миокарда. Пептидные фрагменты HMGB1 по настоящему изобретению включают пептидные фрагменты с молекулярной массой около 20 процентов полноразмерного белка HMGB1, состоящего из 215 аминокислот. Такие пептидные фрагменты могут быть получены путем химического синтеза с использованием пептидных синтезаторов, и поэтому ожидается, что они будут иметь повышенную чистоту, обеспечивать стабильное получение и уменьшат стоимость в ситуации получения пептидов в качестве лекарственных средств.
Кроме того, известно, что полноразмерный HMGB1 обладает активностью связывания с липополисахаридами (LPS), которые относятся к одному типу эндотоксинов. Контаминация даже следовым количеством LPS в лекарственных средствах вызывает лихорадку и тому подобное и часто приводит к серьезным побочным эффектам. Таким образом, контаминация LPS в лекарственных средствах строго регулируется. HMGB1 имеет аффинность к LPS, трудно полностью исключить LPS из загрязненных им лекарственных средств. Однако превращение HMGB1 в пептиды уменьшает его аффинность к LPS, и, таким образом, ожидается, что это уменьшит контаминацию LPS в лекарственных средствах. Соответственно, путем применения фрагмента HMGB1, содержащего участок для привлечения PDGFRα-положительных клеток, как определено в настоящем изобретении, возможна разработка более безопасных фармацевтических композиций для лечения инфаркта миокарда.
Непосредственное введение пептидного фрагмента HMGB1 по настоящему изобретению в участок инфаркта миокарда, нуждающийся в регенерации, или поблизости от него, может индуцировать или усилить регенерацию инфарктного участка или пораженной инфарктом ткани. Кроме того, регенерация инфаркта миокарда может индуцироваться или усиливаться введением пептидного фрагмента HMGB1 по настоящему изобретению в участок, отличный от участка, нуждающегося в регенерации, например, посредством внутривенного введения. Как таковое, настоящее изобретение дает возможность лечения инфаркта миокарда с помощью внутривенного введения, которое широко применяется в общей практике; и, таким образом, терапевтические агенты могут безопасно и легко вводиться в произвольных концентрациях в течение произвольного количества раз. Данный факт представляет собой один из чрезвычайно предпочтительных аспектов настоящего изобретения по сравнению со стандартными терапевтическими методами.
В текущей практике регенерационной медицины или клеточной терапии, немногочисленные плюрипотентные стволовые клетки костного мозга, выделенные из тканей пациентов, культивируют ex vivo и используют для терапий после пролиферации; однако так как процессы культивирования несут с собой риск деградации клеток (появление признаков злокачественности или контаминация бактериями, вирусами и тому подобное), то требуется достаточный контроль безопасности. Напротив, терапевтические агенты на основе настоящего изобретения не включают стадию забора клеток извне организма или стадию, включающую ручную операцию и, таким образом, считается, что они относительно безопасны. Этот факт также является одним из предпочтительных аспектов настоящего изобретения по сравнению со стандартными терапевтическими методами.




Группа изобретений относится к медицине и может быть использована для применения при лечении инфаркта миокарда. Для этого пациенту вводят фармацевтическую композицию, содержащую пептид, состоящий из аминокислотной последовательности SEQ ID NO: 3 (пептидный фрагмент белка HMGB1). Также предложены лекарственное средство для лечения инфаркта миокарда, способ лечения инфаркта миокарда, применение указанного пептида при получении лекарственного средства для лечения инфаркта миокарда. Группа изобретений позволяет снизить развитие побочных эффектов у пациентов при внутривенном введении указанной фармацевтической композиции. 4 н.п. ф-лы, 5 ил.,1 пр.
1. Фармацевтическая композиция для применения при лечении инфаркта миокарда, содержащая пептид, состоящий из аминокислотной последовательности SEQ ID NO: 3.
2. Лекарственное средство для лечения инфаркта миокарда, содержащее пептид, состоящий из аминокислотной последовательности SEQ ID NO: 3.
3. Способ лечения инфаркта миокарда, включающий стадию введения пептида, состоящего из аминокислотной последовательности SEQ ID NO: 3.
4. Применение пептида, состоящего из аминокислотной последовательности SEQ ID NO: 3, при получении лекарственного средства для лечения инфаркта миокарда.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНСЕРВОВ "КАРАМ ШУРПА" | 2006 |
|
RU2301559C1 |
| LIMANA F | |||
| et al., Exogenous high-mobility group box 1 protein induces myocardial regeneration after infarction via enhanced cardiac c-kit+ cell proliferation and differentiation, Circulation Research | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
Авторы
Даты
2018-03-15—Публикация
2013-10-24—Подача