Область техники
Настоящее изобретение относится к новым терапевтическим фармацевтическим композициям для лечения повреждения спинного мозга, которые содержат фрагмент HMGB1, и к их применению.
Уровень техники
Мезенхимальные стволовые клетки костного мозга представляют собой плюрипотентные стволовые клетки in vivo, и известно, что они дифференцируются в остеобласты, адипоциты, хрящ и так далее. Недавно начали появляться сообщения, что у пациентов с повреждением ткани, таким как церебральный инфаркт, введение их собственных мезенхимальных стволовых клеток костного мозга может стимулировать заживление поврежденной ткани. Однако так как мезенхимальные стволовые клетки костного мозга немногочисленны, то существует ограничение по количеству клеток, которые могут быть собраны у пациента. Таким образом, получение количества мезенхимальных стволовых клеток костного мозга, необходимого для лечения широкого спектра повреждений тканей, затруднено. В настоящее время на вооружение принят способ культивирования мезенхимальных стволовых клеток костного мозга для пролиферации, чтобы гарантировать количество, необходимое для лечения. Однако очень трудно культивировать мезенхимальные стволовые клетки костного мозга с поддержанием их недифференцированного состояния. Кроме того, существует много связанных с этим проблем, требующих решения, таких как вирусная и бактериальная контаминация и перерождение клеток в злокачественные. Кроме того, стоимость культивирования клеток, которые будут гарантированы по безопасности и качеству, огромна.
С другой стороны, известно, что мезенхимальные стволовые клетки костного мозга обладают также эффектом заживления повреждения костного мозга. Предполагается получение нервных клеток в результате дифференцировки мезенхимальных плюрипотентных стволовых клеток костного мозга и обеспечение компонентами, обладающими эффектом улучшения поврежденной ткани, такими как факторы роста, с помощью мезенхимальных стволовых клеток костного мозга, аккумулированных в поврежденных тканях.
Документы предшествующего уровня техники
[Патентные Документы]
[Патентный Документ 1] WO 2008/053892
[Патентный Документ 2] WO 2007/015546
[Патентный Документ 3] WO 2009/133939
[Патентный Документ 4] WO 2009/133943
[Патентный Документ 5] WO 2009/133940
[Патентный Документ 6] WO 2004/004763
[Непатентные Документы]
[Непатентный Документ 1] Bustin et al., Mol Cell Biol, 19: 5237-5246, 1999
[Непатентный Документ 2] Hori et al., J. Biol. Chem., 270, 25752-25761, 1995
[Непатентный Документ 3] Wang et al., Science, 285: 248-251, 1999
[Непатентный Документ 4] Muller et al., EMBO J, 20: 4337-4340, 2001
[Непатентный Документ 5] Wang et al., Science, 285: 248-251, 1999
[Непатентный Документ 6] Germani et al., J Leukoc Biol., 81(1): 41-5, 2007
[Непатентный Документ 7] Palumbo et al., J. Cell Biol., 164: 441-449, 2004
[Непатентный Документ 8] Merenmies et al., J. Biol. Chem., 266: 16722-16729, 1991
[Непатентный Документ 9] Wu Y et al., Stem cells, 25: 2648-2659, 2007
[Непатентный Документ 10] Tamai et al., Proc Natl Acad Sci USA., 108(16): 6609-6614, 2011
[Непатентный Документ 11] Yang et al., J Leukoc Biol., 81(1): 59-66, 2007
[Непатентный Документ 12] Basso et al., J Neurotrauma., 23(5): 635-659, 2006
[Непатентный Документ 13] Rahimi-Movaghar et al., Int J Neurosci., 118(10): 1359-1373, 2008
[Непатентный Документ 14] Quertainmont R et al., PloS One., 7(6):e39500, 2012
Сущность Изобретения
[Проблемы, решенные изобретением]
Повреждение спинного мозга представляет собой заболевание, при котором пациенты испытывают экстремальную потерю качества жизни в виде трудностей хождения, связанных с параличом нижней половины тела. Однако спонтанное излечение ожидаться не может, а эффективные методы лечения пока не созданы. Как описано выше, в настоящее время есть ожидания от применения регенеративной медицины, такой как клеточная терапия для лечения повреждения спинного мозга, но она еще находится на стадии разработки. Кроме того, даже если приложить этот метод к практике, то еще не разрешена проблема большой дороговизны с медицинской точки зрения.
Однако если заживление повреждения спинного мозга может быть простимулировано введением лекарственного средства, обладающего активностью мобилизации мезенхимальных стволовых клеток костного мозга в пораженный участок, то ожидается, что недорогие и безопасные терапевтические методы могут быть предоставлены пациентам с повреждением спинного мозга, для которых едва ли существуют методы лечения в настоящее время.
Способы Решения Проблем
К настоящему моменту авторы настоящего изобретения обнаружили, что белок Бокс 1 Группы с Высокой Подвижностью (High Mobility Group Box 1) (HMGB1) представляет собой белок, который обладает активностью стимулирования миграции мезенхимальных стволовых клеток в костный мозг и активностью мобилизации клеток в кровь. Известно, что HMGB1 прежде всего является главным компонентом негистоновых ядерных белков и содержит в молекуле два ДНК-связывающих домена, Box A и Box B. Кроме того, известная функция HMGB1 в ядре заключается в релаксации нуклеосомной структуры и в образовании структуры, оптимальной для реакции транскрипции. Однако в последние годы становится очевидно, что ядерный белок HMGB1 секретируется во внешнее пространство клеток, вызывая различные активности, даже если у него нет сигнала секреции. Наиболее предпочтительно исследование его функции как медиатора воспаления. Например, в модели мышиного сепсиса (модель введения LPS) было обнаружено, что HMGB1, секретированный из макрофагов благодаря стимулированию TNFα, является медиатором сепсиса (Wang et al.: Science 1999; 285: 248-251), и известно, что TLR4 является кандидатным рецептором. Кроме того, наиболее хорошо изученный рецептор HMGB1 представляет собой RAGE, и сообщалось, что связывание между этим рецептором и HMGB1 влияет на миграционную активность клеток и передачу воспалительного сигнала.
В настоящем изобретении раскрыты новые терапевтические фармацевтические композиции для повреждения спинного мозга, которые включают фрагмент HMGB1, и к их применениям.
Конкретно, авторы настоящего изобретения с помощью пептидного синтеза получили пептид, состоящий из аминокислот в положениях 1-44 белка HMGB1 (SEQ ID NO: 5), и фрагмент HMGB1, состоящий из аминокислот 11-44 (SEQ ID NO: 4). Каждый из полученных фрагментов HMGB1 вводили в мышиную модель заболевания, которая дает возможность оценки терапевтических эффектов в отношении повреждения спинного мозга, и подтверждали терапевтические эффекты фрагментов в отношении повреждения спинного мозга.
На основе этих открытий в настоящей заявке предлагается следующее изобретение:
[1] фармацевтическая композиция для применения в лечении повреждения спинного мозга, которая содержит пептидный фрагмент HMGB1;
[2] фармацевтическая композиция [1], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4, и SEQ ID NO: 5;
[3] фармацевтическая композиция [1], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5;
[4] способ лечения повреждения спинного мозга, включающий стадию введения пептидного фрагмента HMGB1;
[5] способ [4], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4, и SEQ ID NO: 5;
[6] способ [4], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4, и SEQ ID NO: 5;
[7] пептидный фрагмент HMGB1 для применения в лечении повреждения спинного мозга;
[8] пептидный фрагмент HMGB1 [7], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4, и SEQ ID NO: 5;
[9] пептидный фрагмент HMGB1 [7], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5;
[10] применение для получения лекарственного средства, содержащего пептидный фрагмент HMGB1, для применения в лечении повреждения спинного мозга;
[11] применение [10], где пептидный фрагмент HMGB1 представляет собой пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5; и
[12] применение [10], где пептидный фрагмент HMGB1 представляет собой пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5.
Краткое Описание Чертежей
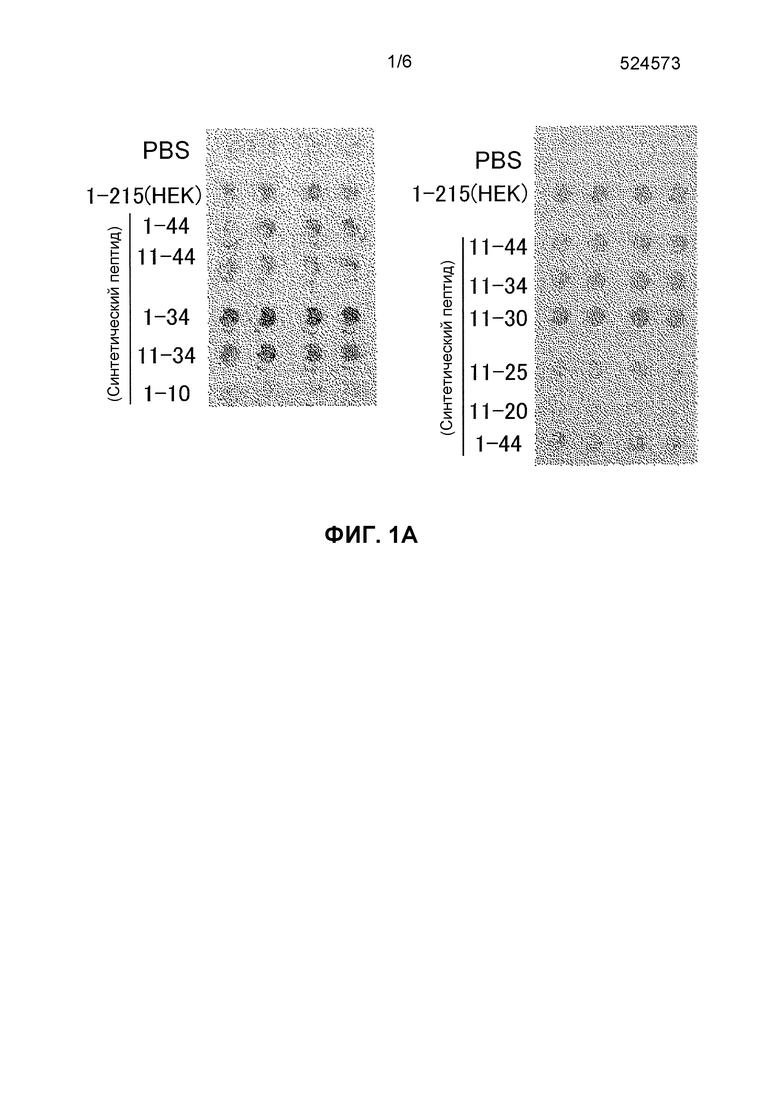
На Фиг. 1A представлены фотографии, выявляющие активность различных синтетических пептидов по стимулированию миграции в отношении созданных PDGFRα-положительных мезенхимальных стволовых клеток костного мозга. Все пептидные фрагменты, содержащие самый короткий фрагмент, пептидный фрагмент HMGB1 (17-25), демонстрируют активность стимулирования миграции клеток.
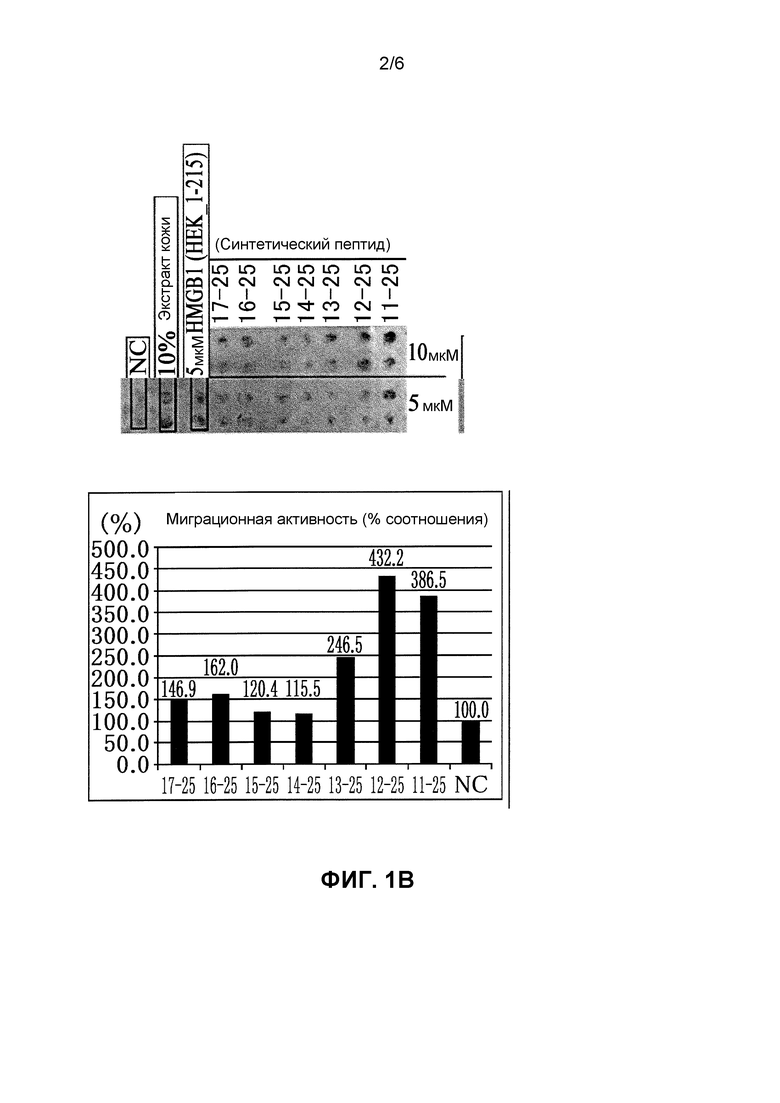
Фиг. 1B представляет собой фотографию, демонстрирующую активность пептидных фрагментов HMGB1 различной длины по стимулированию миграции в отношении созданных PDGFRα-положительных мезенхимальных стволовых клеток костного мозга. Каждый пептид получали с помощью пептидного синтеза. Прилагающийся график демонстрирует количественную активность каждого пептидного фрагмента по стимулированию миграции клеток. Эксперимент демонстрирует, что пептидный фрагмент HMGB1 (17-25) представляет собой самый короткий фрагмент, обладающий активностью стимулирования миграции.
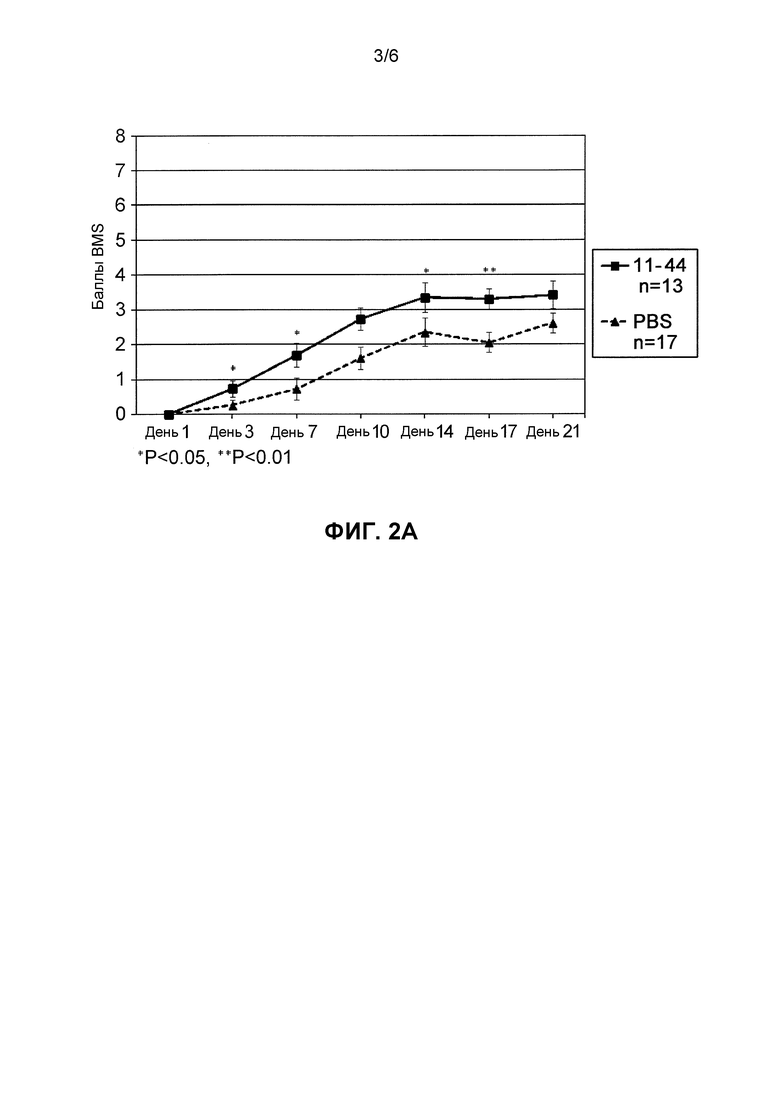
На Фиг. 2A представлено, что значительные эффекты улучшения неврологических симптомов наблюдались в группе введения фрагмента HMGB1 (11-44) по сравнению с группой отрицательного контроля (группа введения PBS) (*p<0,05, **p<0,01 против PBS).
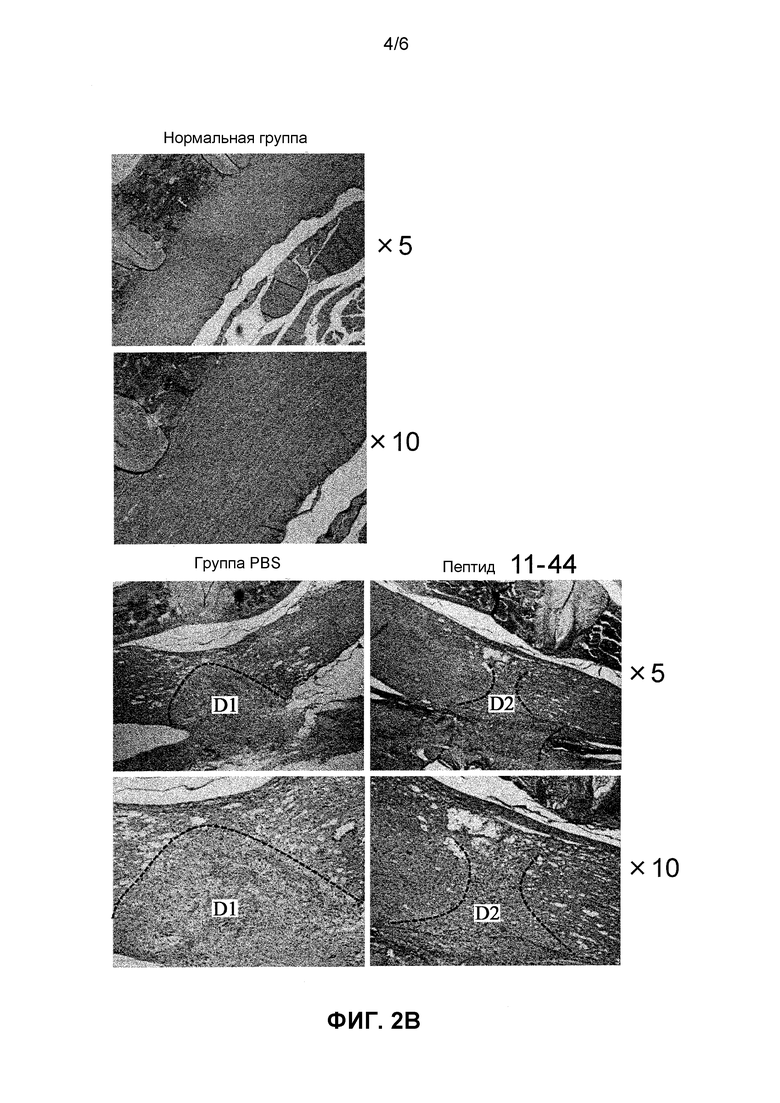
На Фиг. 2B представлено HE-окрашивание спинного мозга. Размер области повреждения спинного мозга уменьшался в группе введения фрагмента HMGB1 (11-44) по сравнению с группой отрицательного контроля (группа введения PBS), и в патологических тканях также наблюдались терапевтические эффекты.
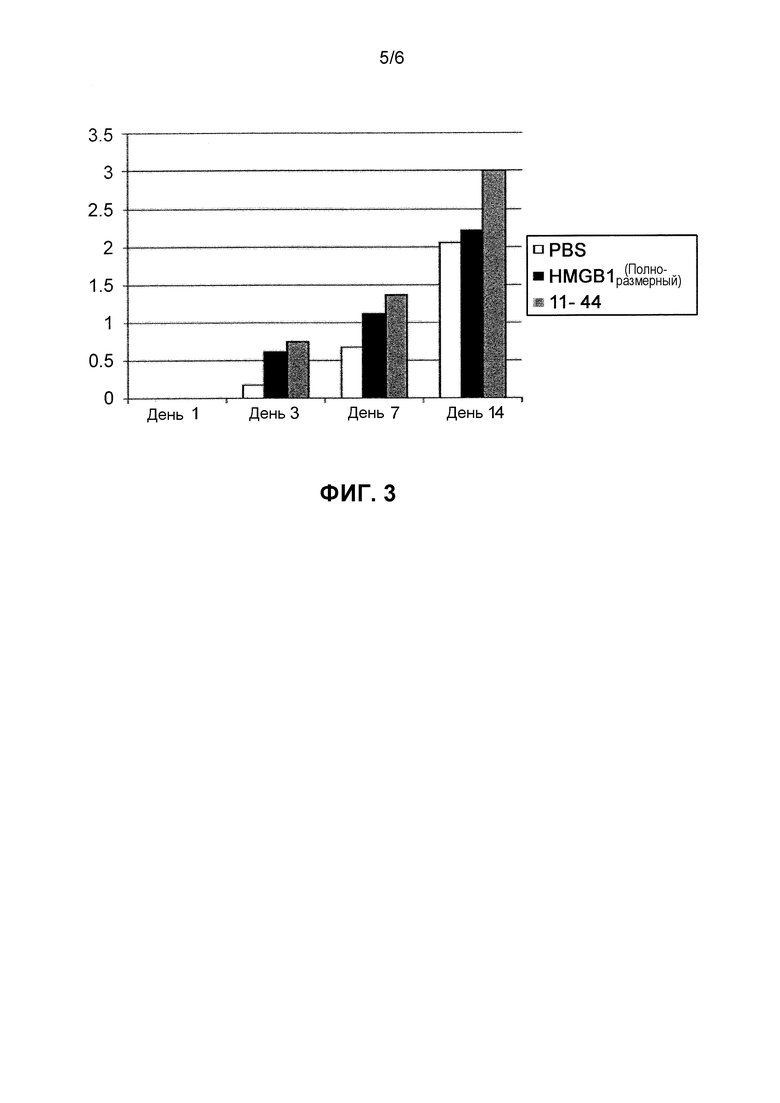
Фиг. 3 представляет собой график, который сравнивает в течение времени группу введения полноразмерного HMGB1 и группу введения фрагмента HMGB1 (11-44) на предмет эффекта улучшения неврологических симптомов в моделях болезней животных, которым было нанесено повреждение спинного мозга.
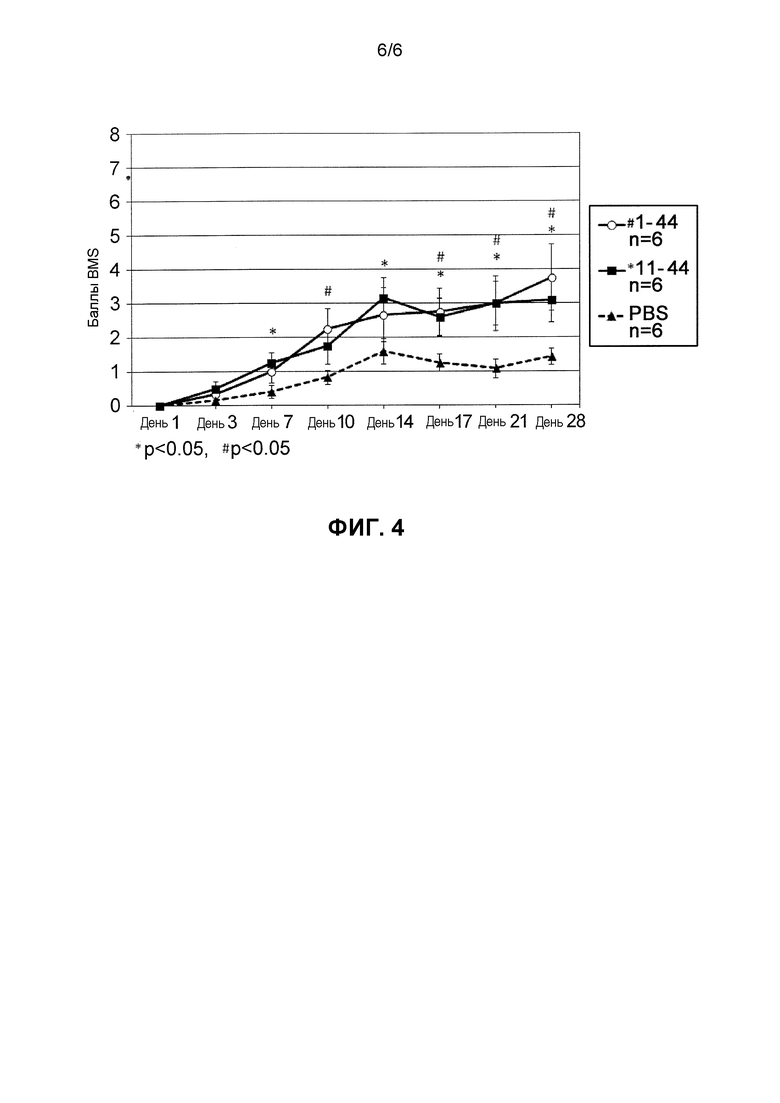
Фиг. 4 представляет собой график, который сравнивает группы введения фрагментов HMGB1 (11-44 и 1-44) на предмет эффекта улучшения неврологических симптомов в моделях болезней животных, которым было нанесено повреждение спинного мозга. (#: 1-44, #p<0,05 против PBS; *: 11-44, *p<0,05 против PBS).
Способ Осуществления Изобретения
В настоящем изобретении предлагаются фармацевтические композиции для применения в лечении повреждения спинного мозга, которые содержат пептидный фрагмент HMGB1, обладающий активностью стимулирования миграции клеток. В данном документе фармацевтические композиции для применения в лечении повреждения спинного мозга по настоящему изобретению также представлены в виде лекарственных средств, фармацевтических агентов или лекарственных композиций.
В настоящем изобретении “повреждение спинного мозга” означает наружное или внутреннее повреждение спинного мозга. Наружное повреждение спинного мозга включает, например, травматическое повреждение спинного мозга, но не ограничивается этим. В данном документе наружное повреждение спинного мозга может обозначаться как “повреждение спинного мозга”.
В настоящем изобретении активность стимулирования миграции клеток относится к активности стимулирования клеточной миграции. В данном документе активность стимулирования миграции клеток также выражена в виде активности, индуцирующей миграцию клеток, или активности притягивания клеток.
Фармацевтические композиции по настоящему изобретению могут вводиться/добавляться в любые участки. То есть композиции могут оказывать их эффекты независимо от того, в какой участок они вводятся, например в участок повреждения спинного мозга, который нуждается в регенерации, в участок, отличный от него, или в кровь. Например, когда композиции вводят/добавляют, то клетки привлекаются к участку введения/добавления или в соседние участки, индуцируя таким образом или стимулируя регенерацию пораженных участков. Кроме того, например, когда композиции вводят/добавляют в пораженный участок или поблизости от него, клетки привлекаются в пораженный участок, индуцируя таким образом или стимулируя регенерацию пораженного участка. Кроме того, например, когда композиции вводят/добавляют в ткань, нуждающуюся в регенерации, клетки костного мозга мобилизуются из костного мозга к ткани, нуждающейся в регенерации, посредством периферической циркуляции, индуцируя таким образом или стимулируя регенерацию. В данном документе "периферическую циркуляцию" также называют "циркуляцией крови" или "периферической циркуляцией кровотока".
Введение в ткань, отличную от ткани, нуждающейся в регенерации, относится к введению в участок, который не является участком, нуждающимся в регенерации (участок, отличный от участка, нуждающегося в регенерации). Соответственно, "ткань, отличная от ткани, нуждающейся в регенерации", также может относиться к:
участку, отличному от ткани, нуждающейся в регенерации; участку, отличному от участка, нуждающегося в регенерации; участку, удаленному от ткани, нуждающейся в регенерации; участку, отдаленному от участка, нуждающегося в регенерации; участку, удаленному от участка, нуждающегося в регенерации; к ткани, удаленной от ткани, нуждающейся в регенерации; к удаленному участку; или к отдаленной ткани.
Таким образом, композиции по настоящему изобретению эффективно используются для регенерации тканей, в которые трудно непосредственно вводить фармацевтические агенты извне организма. Примеры ткани, отличной от ткани, нуждающейся в регенерации, включают гематопоэтические ткани, мышечные ткани, подкожные ткани, внутрикожные ткани, брюшную полость, и так далее.
В настоящем изобретении клетки, которые стимулируют для миграции, или клетки, мобилизованные из костного мозга в периферическую кровь, включают недифференцированные клетки и клетки в различных стадиях дифференцировки, но не ограничиваются ими. В настоящем изобретении клетки, которые стимулируются к миграции, или клетки, мобилизованные из костного мозга в периферическую кровь, включают стволовые клетки, нестволовые клетки и тому подобные, но не ограничиваются ими. Стволовые клетки включают циркуляторные стволовые клетки и нециркуляторные своловые клетки. Нециркуляторные стволовые клетки представляют собой, например, стволовые клетки, находящиеся в ткани. Циркуляторные стволовые клетки представляют собой, например, циркуляторные стволовые клетки в крови.
Кроме того, клетки, стимулированные для миграции или клетки, мобилизованные из костного мозга в периферическую кровь, включают клетки, выделенные из костного мозга, и гематопоэтические стволовые клетки, но не ограничиваются ими. В настоящем описании, "гематопоэтические стволовые клетки" представляют собой стволовые клетки, которые могут дифференцироваться в клетки крови, такие как эритроциты, тромбоциты, тучные клетки и дендритные клетки, а также в лейкоциты, включающие нейтрофилы, эозинофилы, базофилы, лимфоциты, моноциты и макрофаги и так далее. Известно, что их маркеры являются CD34-положительными и CD133-положительными у человека и CD34-отрицательными, c-Kit-положительными, Sca-1-положительными и негативными к маркеру линии дифференцировки у мыши. Гематопоэтические стволовые клетки трудно культивировать индивидуально при культивировании в культуральных чашках, и они нуждаются в совместном культивировании со стромальными клетками.
В настоящем описании "клетки костного мозга" означают клетки, присутствующие внутри костного мозга, в то время как "клетки, выделенные из костного мозга" означают "клетки костного мозга", мобилизованные из костного мозга во внешние относительно костного мозга участки. "Клетки костного мозга" включают клетки, содержащие клеточные популяции предшественников ткани, присутствующие внутри костного мозга. Кроме того, "клетки, выделенные из костного мозга", могут представлять собой клетки, содержащие мезоангиабласты или клетки, свободные от мезоангиобластов.
Клетки - тканевые предшественники определяются как недифференцированные клетки, обладающие однонаправленным потенциалом дифференцироваться в мезенхимальные ткани, эпителиальные ткани, нервные ткани, паренхиматозные органы и в васкулярный эндотелий, как упомянуто выше.
В данном документе "мезенхимальные стволовые клетки костного мозга", "стромальные плюрипотентные клетки костного мозга" или "плюрипотентные стволовые клетки костного мозга" относятся к клеткам, существующим в костном мозге, которые непосредственно собирают из костного мозга или косвенно собирают из других тканей (крови, кожи, жира и других тканей), и могут культивироваться и пролиферировать как адгезионные клетки на культуральных чашках (сделанных из пластика или стекла). Эти клетки характеризуются наличием потенциала к дифференцировке в мезенхимальные ткани, такие как кость, хрящ и жир (мезенхимальные стволовые клетки), или в скелетную мышцу, сердечную мышцу, нервные ткани и в эпителиальные ткани (плюрипотентные стволовые клетки), и могут быть получены путем забора клеток костного мозга.
"Клетки костного мозга" и "клетки, выделенные из костного мозга" представляют собой гематопоэтические стволовые клетки, выделенные таким образом, такие как лейкоциты, эритроциты, тромбоциты, остеобласты и фиброциты, или представляют собой стволовые клетки, представленные клетками, которые ранее были обозначены как мезенхимальные стволовые клетки костного мозга, стромальные плюрипотентные стволовые клетки костного мозга или плюрипотентные стволовые клетки костного мозга. При использовании в данном документе "стволовые клетки костного мозга" относятся к стволовым клеткам, присутствующим внутри костного мозга, в то время как "клетки, выделенные из костного мозга" относятся к "стволовым клеткам костного мозга", мобилизованным из костного мозга во внешние относительно костного мозга участки. В настоящем изобретении клетки, стимулированные к миграции, или клетки, мобилизованные из костного мозга в периферическую кровь, включают "стволовые клетки, выделенные из костного мозга", но не ограничиваются ими. "Клетки костного мозга" и "клетки, выделенные из костного мозга", могут быть выделены путем забора костного мозга (забор клеток костного мозга) или путем забора клеток периферической крови. Гематопоэтические стволовые клетки являются неадгезионными, в то время как некоторые из "клеток костного мозга" и "клеток, выделенных из костного мозга" получают как адгезионные клетки посредством культивирования клеточной культуры моноцитарной фракции крови, полученной путем забора костного мозга (забор клеток костного мозга) или забора клеток периферической крови.
Кроме того, «клетки костного мозга» и «клетки, выделенные из костного мозга» включают мезенхимальные стволовые клетки и обладают потенциалом к дифференцировке предпочтительно в остеобласты (которые могут быть идентифицированы путем наблюдения кальцификации после индуцирования дифференцировки), в хондроциты (которые могут быть идентифицированы путем положительного окрашивания альциановым синим, положительного окрашивания сафранином О или подобным способом), в адипоциты (которые могут быть идентифицированы путем положительного окрашивания Судановым III) и в другие мезенхимальные клетки, такие как фибробласты, гладкомышечные клетки, стромальные клетки и тендиноциты; и, кроме того, в нервные клетки, эпителиальные клетки (например, эпидермальные кератиноциты и эпителиальные клетки кишечника, экспрессирующие белки семейства цитокератинов), и в васкулярные эндотелиальные клетки. Клетки, которые будут дифференцироваться, не ограничиваются вышеописанными клетками и обладают потенциалом дифференцироваться в клетки паренхиматозных органов, такие как печень, почки и поджелудочная железа.
С другой стороны, "выделенные из костного мозга мезенхимальные стволовые клетки костного мозга", "выделенные из костного мозга стромальные плюрипотентные клетки костного мозга" или "выделенные из костного мозга плюрипотентные стволовые клетки костного мозга", мобилизованные из костного мозга во внешнее пространство относительно костного мозга, представляют собой клетки, которые могут быть получены путем забора из периферической крови, мезенхимальных тканей, таких как жир, эпителиальных тканей, таких как кожа, или нервных тканей, таких как мозг.
Кроме того, эти клетки также характеризуются наличием потенциала дифференцировки, например, в эпителиальные ткани, такие как кератиноциты, которые составляют кожу, или в нервные ткани, которые составляют мозг, при введении в пораженную область живого организма сразу после забора или после адгезии на культуральной чашке.
Мезенхимальные стволовые клетки костного мозга, стромальные плюрипотентные стволовые клетки костного мозга, плюрипотентные стволовые клетки костного мозга или эти клетки, привлеченные из костного мозга во внешнее пространство относительно костного мозга, предпочтительно обладают потенциалом к дифференцировке в: остеобласты (которые могут быть идентифицированы путем наблюдения кальцификации после индуцирования дифференцировки), в хондроциты (которые могут быть идентифицированы путем положительного окрашивания альциановым синим, положительного окрашивания сафранином О или подобным способом), в адипоциты (которые могут быть идентифицированы путем положительного окрашивания Судановым III или подобным способом), и в другие мезенхимальные клетки, такие как фибробласты, гладкомышечные клетки, клетки скелетной мышцы, стромальные клетки и тендиноциты; в нервные клетки, пигментные клетки, эпидермальные клетки, клетки волосяной фолликулы (которые экспрессируют белки семейства цитокератинов, семейство волосяных кератинов или подобные), эпителиальные клетки (например, эпидермальные кератиноциты и эпителиальные клетки кишечника экспрессируют белки семейства цитокератинов или подобные) и в эндотелиальные клетки; и, кроме того, в клетки паренхиматозных органов, таких как печень, почки и поджелудочная железа. Однако дифференцированные клетки не ограничиваются вышеописанными клетками.
Человеческие клетки костного мозга и человеческие клетки, выделенные из костного мозга, могут быть представлены, например, в частности, клетками, которые могут быть непосредственно собраны из костного мозга (клетки костного мозга), из периферической крови или жира или получены в виде адгезионных клеток посредством культивирования выделенной моноцитарной фракции. Маркеры человеческих клеток костного мозга и человеческих клеток, выделенных из костного мозга, включают, например, все или некоторые из следующих, но не ограничиваются ими: PDGFRα-положительные, Lin-отрицательные, CD45-отрицательные, CD44-положительные, CD90-положительные, и CD29-положительные, Flk-1-отрицательные, CD105-положительные, CD73-положительные, CD90-положительные, CD71-положительные, Stro-1-положительные, CD106-положительные, CD166-положительные, и CD31-отрицательные.
Кроме того, мышиные клетки костного мозга и мышиные клетки, выделенные из костного мозга, могут быть представлены, например, в частности, клетками, которые могут быть непосредственно собраны из костного мозга (клетки костного мозга), из периферической крови или жира или получены в виде адгезионных клеток посредством культивирования выделенной моноцитарной фракции. Маркеры мышиных клеток костного мозга и мышиных клеток, выделенных из костного мозга, включают, например, все или некоторые из следующих, но не ограничиваются ими: CD44-положительные, PDGFRα-положительные, PDGFRβ-положительные, CD45-отрицательные, Lin-отрицательные, Sea-1-положительные, c-kit-отрицательные, CD90-положительные, CD29-положительные, и Flk-1-отрицательные.
В настоящем изобретении клетки, стимулированные к миграции, включают PDGFRα-положительные клетки, но не ограничиваются ими. Кроме того, PDGFRα-положительные клетки, стимулированные к миграции, не ограничены ничем конкретным, но предпочтительно представляют собой PDGFRα-положительные клетки, выделенные из костного мозга. Кроме того, маркеры, отличные от PDGFRα, могут быть представлены, например, всеми или некоторыми из CD29-положительными, CD44-положительными, CD90-положительными, CD271-положительными, CD11b-отрицательными и Flk-1-отрицательными, но не ограничиваются ими. PDGFRα-положительные клетки включают, в частности, например, PDGFRα-положительные клетки, выделенные из костного мозга, PDGFRα-положительные мезенхимальные стволовые клетки, выделенные из костного мозга, тканевые клетки, находящиеся в PDGFRα-положительных тканях (например, фибробласты и подобные), PDGFRα-положительные клетки, выделенные из костного мозга, полученные в виде адгезионных клеток посредством культивирования клеток моноцитарной фракции крови, полученной путем забора костного мозга (забор клеток костного мозга), или путем забора периферической крови.
Белок HMGB1 в настоящем изобретении включает, например, в частности, белок, содержащий аминокислотную последовательность SEQ ID NO: 1, в качестве человеческого белка HMGB1, и ДНК, кодирующая указанный белок, включает, в частности, например, ДНК, содержащую нуклеотидную последовательность SEQ ID NO: 2.
В настоящем изобретении "пептидный фрагмент HMGB1, обладающий активностью стимулирования клеточной миграции" относится к пептиду, состоящему из участка белка HMGB1 и обладающему активностью стимулирования клеточной миграции. Пептидные фрагменты, состоящие из участка белка HMGB1 по настоящему изобретению, конкретно не ограничены при условии, что они обладают активностью стимулирования клеточной миграции, но предпочтительно они представляют собой пептидный фрагмент HMGB1, который содержит, по меньшей мере, аминокислотную последовательность в положениях 17-25 белка HMGB1 (SEQ ID NO: 3), который, как подтверждено экспериментами, осуществленными авторами настоящего изобретения, представляет собой самый короткий пептидный фрагмент среди фрагментов, обладающих активностью стимулирования клеточной миграции (Фиг. 1).
В настоящем изобретении пептиды, состоящие из фрагментов HMGB 1, обладающих активностью стимулирования клеточной миграции, представляют собой, например, фрагменты, описанные ниже, но не ограничиваясь ими.
В настоящем изобретении фрагменты HMGB1, которые обладают активностью стимулирования клеточной миграции, включают пептидный фрагмент, содержащий аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5, который представляет собой пептидный фрагмент HMGB1, обладающий активностью стимулирования клеточной миграции. Эти пептидные фрагменты включают, по меньшей мере, пептидный фрагмент (17-25) SEQ ID NO: 3 с верхней границей, представляющей собой пептидный фрагмент (11-44) SEQ ID NO: 4; пептидный фрагмент, содержащий, по меньшей мере, пептидный фрагмент (11-44) SEQ ID NO: 4 с верхней границей, представляющей собой пептидный фрагмент (1-44) SEQ ID NO: 5; или пептидный фрагмент, содержащий, по меньшей мере, пептидный фрагмент (17-25) SEQ ID NO: 3 с верхней границей, представляющей собой пептидный фрагмент (1-44) SEQ ID NO: 5; но не ограничиваясь этим.
В настоящем изобретении пептидные фрагменты HMGB1, которые обладают активностью стимулирования клеточной миграции, включают, например, пептидный фрагмент, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5, который представляет собой пептидный фрагмент HMGB1, обладающий активностью стимулирования клеточной миграции.
Методы введения композиции по настоящему изобретению включают пероральное введение и парентеральное введение. Конкретно, парентеральное введение включает, в частности, инъекцию, трансназальное введение, транспульмонарное введение, трансдермальное введение и тому подобные. В качестве примеров инъекции внутривенная инъекция, внутримышечная инъекция, внутрибрюшинная инъекция, подкожная инъекция и тому подобные могут использоваться для введения композиции по настоящему изобретению системно или местно (например, под кожу, в кожу, на поверхность кожи, в глазное яблоко или в оболочку века, в слизистую носа, во внутриротовую слизистую и в слизистую желудочно-кишечного тракта, в вагинальную слизистую/во внутриматочную слизистую, в участок повреждения или тому подобные участки).
Методы введения композиции по настоящему изобретению включают, в частности, например, внутриваскулярное введение (внутриартериальное введение, внутривенное введение, или тому подобные), введение в кровь, внутримышечное введение, подкожное введение, внутрикожное введение, внутрибрюшинное введение.
Не существует ограничений по участку введения, и, например, он может представлять собой участок ткани, нуждающийся в регенерации, или соседнюю с ним область, участок, отличный от ткани, нуждающейся в регенерации, или участок, отдаленный и отличный от участка ткани, нуждающегося в регенерации. Участок, например, находится в крови (в артериях, в венах или тому подобные), в мышце, под кожей, в коже, в брюшной полости или тому подобное без ограничения.
Метод введения может быть соответственно выбран согласно возрасту и симптомам пациента. Когда вводят пептид по настоящему изобретению, то доза пептида на единицу времени может быть выбрана в интервале 0,0000001 мг – 1000 мг на 1 кг массы тела пациента. Альтернативно, доза может быть выбрана, например, в интервале 0,00001 мг – 100000 мг на массу тела пациента. При введении клеток, секретирующих пептид по настоящему изобретению, или векторов генной терапии со вставкой ДНК, кодирующей пептид, они могут вводиться так, чтобы количество пептидов находилось в вышеуказанном интервале. Однако доза фармацевтических композиций по настоящему изобретению не ограничена этим.
Пептидные фрагменты HMGB1 по настоящему изобретению могут быть получены в виде рекомбинантов путем включения ДНК, кодирующей пептид, в подходящую экспрессирующую систему или могут быть синтезированы искусственно. Фармацевтические композиции по настоящему изобретению могут быть включены в состав согласно обычным методам (например, Remington's Pharmaceutical Science, latest edition, Mark Publishing Company, Easton, U.S.A) и могут содержать фармацевтически приемлемые носители и добавки. Примеры включают поверхностно-активные вещества, эксципиенты, красители, отдушки, консерванты, стабилизаторы, буферы, суспендирующие агенты, изотонические агенты, связующие вещества, дезинтеграторы, смазки, стимуляторы текучести и вкусовые агенты, хотя они не ограничены этим, и могут, соответственно, использоваться другие носители. Конкретные примеры включают легкую безводную кремниевую кислоту, лактозу, кристаллическую целлюлозу, маннит, крахмал, кармеллозу кальция, кармеллозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилацетальдиэтиламино ацетат, поливинилпирролидон, желатин, триглецирид среднецепочечной жирной кислоты, полиоксиэтилен гидрогенизированное касторовое масло 60, белый сахар, карбоксиметилцеллюлоза, кукурузный крахмал и неорганические соли.
Все документы предшествующего уровня техники, процитированные в данном документе, включены сюда ссылкой.
Здесь ниже настоящее изобретение будет дополнительно проиллюстрировано со ссылкой на Примеры, но их не следует понимать как ограничение.
Пример 1
Оценка синтетических пептидов на предмет активности стимулирования миграции
(Методы)
Был заказан синтез пептидов, перечисленных ниже, с использованием твердофазного метода синтеза с помощью Medical & Biological Laboratories (MBL). Пептиды синтезировали на основе последовательности мышиного HMGB1. Аминокислотные последовательности в положениях от 1 до 169 мышиного HMGB1 и человеческого HMGB1 идентичны, т.e. имеют 100% гомологии последовательности.
Синтетический пептид, состоящий из аминокислотной последовательности в положениях от 1 до 10 HMGB1 (1-10);
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 1 до 34 HMGB1 (1-34);
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 11 до 20 HMGB1 (11-20);
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 11 до 25 HMGB1 (11-25);
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 11 до 30 HMGB1 (11-30);
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 11 до 34 HMGB1 (11-34);
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 11 до 44 HMGB1 (11-44); и
полноразмерный мышиный HMGB1, продуцируемый в HEK293 (1-215(HEK)) в качестве положительного контроля, доводили до 100 мкг/мл и помещали в нижний отдел камеры хемотаксиса для оценки активности стимулирования миграции в отношении клеточной линии мезенхимальных стволовых клеток костного мозга (MSC-1 клетки; получены в Университете Осака, Tamai et al. (Tamai et al., Proc Natl Acad Sci USA., 108(16): 6609-6614, 2011)).
(Результаты)
Было обнаружено, что, по меньшей мере, синтетические пептиды (11-34), (1-34), (11-44), (1-44) и (11-30) обладают активностью, которая сравнима с положительным контролем или выше (Фиг. 1A). Кроме того, также было обнаружено, что синтетический пептид (11-25) обладает активностью (Фиг. 1A).
(Методы)
С целью сузить локализацию активного центра синтезировали более короткие пептиды, перечисленные ниже.
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 11 до 25 HMGB1 (11-25),
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 12 до 25 HMGB1 (12-25),
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 13 до 25 HMGB1 (13-25),
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 14 до 25 HMGB1 (14-25),
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 15 до 25 HMGB1 (15-25),
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 16 до 25 HMGB1 (16-25); и
синтетический пептид, состоящий из аминокислотной последовательности в положениях от 17 до 25 HMGB1 (17-25).
В качестве положительных контролей центрифугированную надосадочную жидкость кожи однодневной мыши (один индивидуум) инкубировали в PBS при 4°C в течение 12 часов и использовали полноразмерный мышиный HMGB1, продуцируемый в HEK293 (1-215(HEK)). Клетки клеточной линии мезенхимальных стволовых клеток костного мозга (MSC-1) помещали в верхний отдел камеры хемотаксиса и добавляли белок и синтетические пептиды в концентрации 5 мкM или 10 мкM в нижний отдел камеры хемотаксиса. Анализ миграции проводили с помощью такого же метода, как описано выше.
(Результаты)
Было обнаружено, что все синтетические пептиды обладают активностью (Фиг. 1B). Было представлено, что пептидный фрагмент HMGB1 (17-25) является самым коротким фрагментом, который обладает активностью стимулирования миграции.
Пример 2
(Методы)
В качестве тестируемых животных использовали семинедельных самок мышей C57BL6/J. После того как мышей подвергали анестезии с помощью изофлурановой ингаляции, делали надрезы кожи вдоль тыльной срединной линии и позвоночную дугу девятого грудного позвонка экспонировали и вырезали. Твердую мозговую оболочку экспонировали в том же участке и спинной мозг удерживали эпидурально в течение трех секунд с использованием микроиглодержателя для получения травматического повреждения спинного мозга. После генерирования повреждения спинного мозга кожу зашивали. Повреждение спинного мозга подтверждали на следующий день операции путем оценки паралича обеих задних конечностей, и мышей, которые не демонстрировали паралича, исключали из анализа. Аналитический реагент получали путем разведения 100 мкг фрагмента HMGB1 (аминокислотная последовательность: аминокислоты в положениях 11-44; синтезированный пептид получали в MBL) в 200 мкл Dulbecco-PBS (D-PBS). 200 мкл D-PBS использовали для отрицательного контроля. На следующий день операции осуществляли первое введение через хвостовую вену, и за этим следовали введения в количестве пяти ежедневных введений. Неврологические симптомы оценивали с использованием балльной оценки по шкале Basso Mouse Scale (BMS) в Дни 1, 3, 7, 10, 14, 17 и 21 после операции.
(Результаты)
На основе баллов BMS наблюдали значительное улучшение неврологических симптомов с Дня 3 после операции в группе введения фрагмента HMGB1 по сравнению с группой введения PBS. Конкретно, значительное улучшение симптомов наблюдали в Дни 3, 7, 14 и 17 после операции (Фиг. 2A). Кроме того, в то время как изображения HE-окрашивания поврежденного участка спинного мозга для группы отрицательного контроля демонстрировали повреждение в широком интервале (D1), при этом поврежденный участок (D2) для группы введения фрагмента HMGB1 (11-44 пептид) уменьшался и терапевтические эффекты также наблюдали гистопатологически (Фиг. 2B).
(Обсуждение)
Очевидное улучшение неврологических симптомов мышей, которым наносили повреждение спинного мозга, наблюдали при введении фрагмента HMGB1. Активность мобилизации мезенхимальных стволовых клеток костного мозга была обнаружена для фрагментов HMGB1, используемых в данном исследовании, и ожидались терапевтические эффекты мобилизованных мезенхимальных стволовых клеток костного мозга в области повреждения. Эффекты мезенхимальных стволовых клеток костного мозга в отношении тканевых повреждений, как ожидается, представляют собой регенерацию ткани посредством дифференцировки в нервные клетки с помощью плюрипотентности, а также защитное действие факторов роста, цитокинов и тому подобных, секретированных мезенхимальными стволовыми клетками костного мозга, в отношении поврежденных тканей. В настоящем анализе кратковременные эффекты в период до первой недели после операции могут быть связаны с более поздним действием и, следовательно, могут быть вовлечены эффекты, упомянутые ранее.
Пример 3
(Методы)
В качестве тестируемых животных использовали семинедельных самок мышей C57BL6/J. После того, как мышей подвергали анестезии с помощью изофлурановой ингаляции, делали надрезы кожи вдоль тыльной срединной линии и позвоночную дугу девятого грудного позвонка экспонировали и вырезали. Твердую мозговую оболочку экспонировали в том же участке и спинной мозг удерживали эпидурально в течение трех секунд с использованием микроиглодержателя для получения травматического повреждения спинного мозга. После получения повреждения спинного мозга, кожу зашивали. Повреждение спинного мозга подтверждали на следующий день операции путем оценки паралича обеих задних конечностей и мышей, которые не демонстрировали паралича, исключали из анализа. Фрагмент HMGB1 (аминокислотная последовательность: аминокислоты в положениях 11-44; синтетический пептид получали в MBL) получали путем разведения 100 мкг фрагмента в 200 мкл Dulbecco-PBS (D-PBS). Полноразмерный белок HMGB1 получали путем экспрессии в HEK293, как сообщалось ранее, и очищенный HMGB1 (100 мкг) растворяли в 200 мкл D-PBS. 200 мкл D-PBS использовали для отрицательного контроля. На следующий день после операции осуществляли первое введение через хвостовую вену, и за этим следовали введения в количестве пяти ежедневных введений. Неврологические симптомы оценивали с использованием баллов BMS в Дни 1, 3, 7 и 14 после операции.
(Результаты)
Эффекты улучшения неврологических симптомов оценивали с использованием баллов BMS. Терапия была наиболее эффективна в группе введения фрагмента HMGB1 (аминокислоты в положениях 11-44) в Дни 7 и 14. В то время как терапевтические эффекты наблюдали в группе введения HMGB1 (полноразмерный) по сравнению с группой отрицательного контроля, они не были настолько эффективными, как в группе введения фрагмента HMGB1 (аминокислоты в положениях 11-44) (Фиг. 3).
(Обсуждение)
После получения повреждения спинного мозга на ранней стадии терапевтический эффект группы введения полноразмерного HMGB1, как было обнаружено, является промежуточным между эффектом группы введения фрагмента HMGB1 (аминокислоты в положениях 11-44) и в группе отрицательного контроля; однако на 14 День после получения повреждения спинного мозга наблюдали гораздо больше удовлетворительного улучшения терапевтического эффекта в группе введения фрагмента HMGB1 (аминокислоты в положениях 11-44), чем в других группах. Эти эксперименты обнаружили, что фрагмент, а не полноразмерный белок демонстрирует больше терапевтических эффектов в отношении повреждений спинного мозга. Пептиды, которые могут быть химически синтезированы, такие как данный фрагмент, могут быть особенно полезны в практических применениях, так как они дают возможность получения недорогих и гомогенных продуктов в больших количествах в процессе фармацевтического производства.
Пример 4
(Методы)
В качестве тестируемых животных использовали семинедельных самок мышей C57BL6/J. Мышей подвергали анестезии с помощью изофлурановой ингаляции, делали надрезы кожи вдоль тыльной срединной линии и позвоночную дугу девятого грудного позвонка экспонировали и вырезали. Твердую мозговую оболочку экспонировали в том же участке и спинной мозг удерживали эпидурально в течение трех секунд с использованием микроиглодержателя для получения травматического повреждения спинного мозга. После получения повреждения спинного мозга кожу зашивали. Повреждение спинного мозга подтверждали на следующий день операции путем оценки паралича обеих задних конечностей и мышей, которые не демонстрировали паралича, исключали из анализа. Фрагменты HMGB1 (аминокислотные последовательности: аминокислоты в положениях 11-44 и аминокислоты в положениях 1-44; синтетические пептиды получали в MBL) получали путем разведения 100 мкг фрагмента в 200 мкл D-PBS. 200 мкл D-PBS использовали для отрицательного контроля. На следующий день после операции осуществляли первое введение через хвостовую вену, и за этим следовали введения в количестве пяти ежедневных введений. Неврологические симптомы оценивали с использованием баллов BMS в Дни 1, 3, 7, 10, 14, 17, 21 и 28 после операции.
(Результаты)
Эффекты улучшения неврологических симптомов оценивали с использованием баллов BMS. По сравнению с группой отрицательного контроля терапевтические эффекты наблюдали в группе введения фрагмента HMGB1 (аминокислоты в положениях 11-44 и аминокислоты в положениях 1-44) в Дни 17, 21 и 28. Фрагмент HMGB1, состоящий из аминокислот в положениях 11-44, и фрагмент HMGB1, состоящий из аминокислот в положениях 1-44, имели сравнимые терапевтические эффекты (Фиг. 4).
(Обсуждение)
Было обнаружено, что оба фрагмента HMGB1, 11-44 и 1-44 были эффективны в лечении повреждения спинного мозга. Как представлено на Фиг. 1, авторы настоящего изобретения показали, что один из коровых доменов HMGB1 для активности привлечения мезенхимальных стволовых клеток костного мозга представляет собой пептид, состоящий из аминокислот в положениях 17-25. Оба фрагмента, 11-44 и 1-44, включают положения 17-25, и прогнозируется, что коровый пептид, который демонстрирует эффективность этих пептидов, представляет собой последовательность в положениях 17-25. Сообщалось, что RAGE не вовлечен в мобилизацию мезенхимальных стволовых клеток костного мозга с помощью полноразмерного белка HMGB1 (Tamai, 2011, PNAS; и так далее), и так как нет сообщений о том, что фрагмент 11-44 и фрагмент 1-44 представляют собой лиганды для известного рецептора, такого как RAGE, то ожидается, что эти фрагменты будут направленно воздействовать на рецептор, который еще не известен.
Промышленная применимость
В настоящем изобретении предлагаются новые применения пептидных фрагментов HMGB 1, которые сохраняют активность привлечения PDGFRα-положительных клеток для лечения повреждения спинного мозга. Пептидные фрагменты HMGB1 по настоящему изобретению представляют собой пептидные фрагменты с молекулярной массой, составляющей около 20 процентов или менее от полноразмерного белка HMGB1, состоящего из 215 аминокислот. Такие пептидные фрагменты могут быть получены путем химического синтеза с использованием пептидных синтезаторов, и поэтому ожидается, что они имеют повышенную чистоту, обеспечивают стабильное получение и уменьшают стоимость в ситуации получения пептидов в качестве лекарственных веществ.
Кроме того, известно, что полноразмерный HMGB1 обладает активностью связывания с липополисахаридами (LPS), которые относятся к одному типу эндотоксинов. Контаминация даже следовым количеством LPS в лекарственных веществах вызывает лихорадку и тому подобное и часто приводит к серьезным побочным эффектам. Таким образом, контаминация LPS в лекарственных веществах строго регулируется. Так как HMGB1 имеет аффинность к LPS, то трудно полностью исключить LPS из загрязненных им лекарственных веществ. Однако превращение HMGB1 в пептиды уменьшает их аффинность к LPS, и, таким образом, ожидается, что это уменьшает контаминацию LPS в лекарственных веществах. Соответственно, путем применения фрагмента HMGB1, содержащего участок для привлечения PDGFRα-положительных клеток, как определено в настоящем изобретении, возможна разработка более безопасных фармацевтических композиций для лечения повреждения спинного мозга.
Непосредственное введение фрагмента HMGB1 по настоящему изобретению в участок повреждения спинного мозга, нуждающийся в регенерации, или поблизости от него, может индуцировать или усиливать регенерацию пораженного участка. Кроме того, регенерация повреждения спинного мозга может индуцироваться или усиливаться введением фрагмента HMGB1 по настоящему изобретению в участок, отличный от участка, нуждающегося в регенерации, например, посредством внутривенного введения. Как таковое, настоящее изобретение дает возможность лечения повреждения спинного мозга с помощью внутривенного введения, которое широко применяется в общей практике; и, таким образом, терапевтические агенты могут безопасно и легко вводиться в произвольных концентрациях в течение произвольного количества раз. Данный факт представляет собой один из чрезвычайно предпочтительных аспектов настоящего изобретения по сравнению со стандартными терапевтическими методами.
В текущей практике регенерационной медицины или клеточной терапии, немногочисленные плюрипотентные стволовые клетки костного мозга, выделенные из тканей пациентов, культивируют ex vivo и используют для терапий после пролиферации; однако так как процессы культивирования несут с собой риск деградации клеток (появление признаков злокачественности или контаминация бактериями, вирусами и тому подобное), то требуется достаточный контроль безопасности. Напротив, терапевтические агенты на основе настоящего изобретения не включают стадию забора клеток извне организма или стадию, включающую ручную операцию, и, таким образом, считается, что они относительно безопасны. Этот факт также является одним из предпочтительных аспектов настоящего изобретения по сравнению со стандартными терапевтическими методами.



Изобретение относится к области биотехнологии, конкретно к пептидам из HMGB1, и может быть использовано в медицине для лечения повреждения спинного мозга. Полученные пептиды демонстрируют терапевтические эффекты в отношении восстановления спинного мозга после повреждений. 8 н.п. ф-лы, 4 ил., 4 пр.
1. Фармацевтическая композиция для применения при лечении повреждения спинного мозга, которая содержит пептидный фрагмент HMGB1, выбранный из группы, состоящей из a)-c), где:
a) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:4;
b) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:4, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:5;
c) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:5.
2. Фармацевтическая композиция для применения при лечении повреждения спинного мозга, которая содержит пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5.
3. Лекарственное средство для лечения повреждения спинного мозга, которое содержит пептидный фрагмент HMGB1, выбранный из группы, состоящей из a)-c), где:
a) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:4;
b) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:4, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:5; а также
c) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:5.
4. Лекарственное средство для лечения повреждения спинного мозга, которое содержит пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5.
5. Способ лечения повреждения спинного мозга, включающий стадию введения пептидного фрагмента HMGB1, выбранного из группы, состоящей из:
a) пептидного фрагмента, содержащего по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:4;
b) пептидного фрагмента, содержащего по меньшей мере аминокислотную последовательность SEQ ID NO:4, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:5; и
c) пептидного фрагмента, содержащего по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:5.
6. Способ лечения повреждения спинного мозга, включающий стадию введения пептида, состоящего из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5.
7. Применение пептидного фрагмента HMGB1, выбранного из группы, состоящей из a)-c), при получении лекарственного средства для лечения повреждения спинного мозга, где:
a) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:4;
b) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:4, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO: 5;
c) пептидный фрагмент, содержащий по меньшей мере аминокислотную последовательность SEQ ID NO:3, причем верхняя граница пептидной последовательности представляет собой аминокислотную последовательность SEQ ID NO:5.
8. Применение пептида, состоящего из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, при получении лекарственного средства для лечения повреждения спинного мозга.
| US 2008214454 A1, 04.09.2008 | |||
| ESPOSITO E | |||
| et al | |||
| Melatonin reduces stress-activated/mitogen-activated protein kinases in spinal cord injury, J | |||
| Pineal | |||
| Res., 2009, v.46, n.1, p.79-86 | |||
| RU 2010148785 A, 10.06.2012. |
Авторы
Даты
2018-04-02—Публикация
2013-10-24—Подача