Изобретение относится к области биофизики, в частности к лабораторным методам исследования с помощью атомно-силовой микроскопии, и может быть использовано для визуализации и изучения структурного строения вируса гриппа методом атомно-силовой микроскопии.
Исследования биологических объектов с помощью нанотехнологий все активнее внедряются в сферу медицины. Не является исключением и ее раздел - вирусология, объекты исследования которой имеют в среднем размеры от 1 до 500 нм [Пул Ч., Оуэне Ф. Мир материалов и технологий. Нанотехнологии 5-е издание: М., Техносфера, - 2010. - С. 234].
В задачи любой микроскопии входит возможность обеспечить наблюдателю увеличенное изображение мелких объектов с необходимым числом деталей (разрешением).
Широко известно использование оптического микроскопа. Например, в способе оптического анализа вирусных суспензий анализируют оптическую плотность суспензии в видимом диапазоне и по частотным характеристикам спектрам поглощения определяют размеры и концентрацию вирусов гриппа (Авторское свидетельство СССР №1467447, G01N 15/02, 23.03.89).
Известен способ определения типа вируса гриппа, в соответствии с которым на полимерной основе, обладающей способностью связывать антитела к вирусам гриппа, формируют комплекс, содержащий антитела к вирусу определенного типа и определяемые вирусы гриппа, на которую затем наносят слой жидкого кристалла, формирующий регистрируемое в поляризованном свете изображение. Пленку жидкого кристалла на поверхности тест-образца анализируют в поляризационном микроскопе.
Наблюдаемые при этом в слое жидкого кристалла характерные структуры сравнивают со структурами, типичными для вирусов гриппа другого типа. При этом визуализацию вирусов гриппа определенного типа констатируют по совпадению характерных особенностей структур тестируемых объектов со структурами, присущими определенному типу вирусов гриппа, что позволяет произвести отнесение изучаемых вирусов к определенному типу (Патент РФ №2290444, C12Q 1/00, 27.12.2006).
Как следует из вышеизложенного, при визуализации вируса гриппа посредством оптического микроскопа вирус находится в связанном состоянии. Кроме того, поскольку оптические микроскопы используют световой пучок и отличия в коэффициентах поглощения, отражения или преломления между отдельными областями объекта, то их разрешающая способность ограничивается дифракционным пределом, длиной волны света и коэффициентом преломления прозрачной среды. В результате использование для визуализации вируса гриппа оптического микроскопа позволяет только регистрировать наличие вируса, что, в свою очередь, не позволяет изучать его внутреннюю структуру.
Широкими возможностями обладают электронные микроскопы, которые имеют атомное разрешение. Однако в этом случае присутствует необходимость видоизменять исследуемый объект, например, в электронной микроскопии на образцы наносят слой металла. Кроме того, работа ведется в условиях сверхвысокого вакуума, что приводит к изменению структур биологических молекул (Хейденрайх Р. Основы просвечивающей электронной микроскопии, Москва, Мир, 1966, с. 472).
Например, известен способ дифференциации вирулентных и вакцинных штаммов вируса гриппа, в котором для визуальной дифференциации вирулентных и вакцинных штаммов вируса гриппа посредством электронного микроскопа исследуемую среду иммобилизуют путем приготовления на основе эпоновых смол ультратонких срезов, содержащих дифференцируемые вирулентные и вакцинные штаммы вирусов (СССР, авторское свидетельство №778263, C12N 7/00, C12Q 1/70, 15.01.84), т.е. при визуализации вирус гриппа находится не в свободном неизмененном состоянии, а в связанном состоянии в присутствии балластных веществ, что не позволяет изучать его внутреннюю структуру.
Атомно-силовая микроскопия принадлежит к семейству проксимальной зондовой микроскопии для анализа поверхности и ее свойств на атомномолекулярном уровне. Свойства атомного силового микроскопа (АСМ) имеют ряд преимуществ перед другими видами микроскопий, одним из которых является отсутствие необходимости в видоизменении объекта исследования (Баллюзек Ф.В., Куркаев А.С., Сенте Л. Нанотехнологий для медицины В кн. С-Пб, Принт, 2008, 109 с. ).
Известен способ исследования нативных клеток, в соответствии с которым осуществляют забор крови и проводят приготовление образцов крови. Образец готовят из суспензии нативных клеток путем нанесения капли на чистое обезжиренное предметное стекло, помещают образец во влажную камеру, насыщенную парами воды, закрытую мембраной. Предлагаемая подготовка образца позволяет использовать визуализацию для дальнейшего исследования клеток с помощью атомно-силового сканирования. Путем сканирования клеток в режиме полуконтактной атомно-силовой микроскопии проводят измерение геометрических параметров клеток. Сканирование проводят в парах воды в полуконтактном режиме, используя кантилевер серии NSG 03 с жесткостью 0,4 Н/м, длиной балки 100 мкм и резонансной частотой в пределах 62-123 KHz. Использование способа позволяет сократить время исследования и получать сканы клеток с высоким разрешением, сохраняя их жизнеспособность, нативные размеры и форму (Патент РФ №2398234, G01N 33/49, 27.08.2010).
Наиболее близким к предлагаемому является способ определения наличия бактерий Escherichia coli по детектированию их фрагментов с помощью атомно-силовой микроскопии. Изобретение относится к области биотехнологии, а именно к способу определения наличия бактерий Escherichia coli. Способ включает специфическую иммобилизацию фрагментов указанных бактерий из раствора на аффинную поверхность, состоящую из слоя белка G с нанесенным на него слоем антител, специфичных к выявляемым бактериальным клеткам. Осуществляют двухэтапную промывку образца от неспецифически связавшегося материала, включающую в себя промывку в буфере со значением рН 8,5-9,5 и последующую промывку деионизованной водой. Предлагаемая подготовка образца позволяет использовать атомно-силовую микроскопию как инструмент визуализации связавшихся бактериальных фрагментов с возможностью прямого подсчета объема связавшегося аналита на единицу поверхности (Патент РФ №2437937, C12Q 1/00, G01N 13/00, B01D 15/38, 27.12.2011). Изобретение позволяет определять наличие сверхмалых концентраций клеток в анализируемом растворе.
Анализ содержания подготовки образца исследуемого биологического материала для визуализации посредством АСМ в изложенных выше способах показал, что поскольку использование атомно-силовой микроскопии не требует видоизменения объекта исследования, то в приготовленном образце исследуемые объекты (нативные клетки, бактерии Escherichia coli) остаются в свободном, неизмененном состоянии. Кроме того, предлагаемая подготовка образцов исследуемых объектов позволяет использовать для их визуализации атомно-силовую микроскопию.
Однако используемая в обоих способах подготовка образца, а именно подготовка исследуемого материла и его иммобилизации для исследования, при которых исследуемый биологический материал остается в неизмененном состоянии, являются специфичными, поскольку в известных способах используют применение АСМ для конкретного биологического материала (нативные клетки, бактерии Escherichia coli).
Возникает проблема, заключающаяся в отсутствии методики подготовки исследуемого материла, содержащего вирус гриппа, и его иммобилизации для исследования, при которых исследуемый вирус гриппа остается в неизмененном состоянии, и которые позволяют использовать для визуализации вируса гриппа атомно-силовую микроскопию.
Предлагаемый способ визуализации вируса гриппа при осуществлении решает проблему подготовки исследуемого материла, содержащего вирус гриппа, и его иммобилизации для исследования, при которых исследуемый вирус гриппа остается в неизмененном состоянии, и которые позволяют использовать для визуализации вируса гриппа атомно-силовую микроскопию.
Решение этой проблемы при осуществлении заявленного способа визуализации вируса гриппа позволяет получить технический результат, заключающийся в возможности использования атомно-силовой микроскопии для визуализации вируса гриппа, в возможности исследования структуры вируса гриппа посредством атомно-силовой микроскопии.
Сущность изобретения состоит в том, что в заявленном способе визуализации вируса гриппа новым является то, что получают вирусосодержащую жидкость из аллантоисной жидкости куриных эмбрионов путем заражения куриных эмбрионов вирусом гриппа, затем полученную инфицированную вирусом гриппа неочищенную аллантоисную жидкость куриных эмбрионов инактивируют ультрафиолетовым излучением длиной волны 254 нм с дозой 4 мДж/см2, при этом время экспозиции составляет 1 час 20 минут, после чего выполняют очистку образцов вирусосодержащей жидкости от белковых и других сопутствующих балластных компонентов методом гель-фильтрации, при этом инактивированную вируссодержащую жидкость вносят в препаративную хроматографическую колонку, заполненную Sephadex G-100 (Pharmacia, Швеция), в качестве элюэнта используют фосфатный буферный раствор с рН 7,4, элюцию проводят при комнатной температуре со скоростью 5 мл/час, для визуализации вируса гриппа берут пиковую фракцию очищенной аллантоисной жидкости, первую по времени появления на выходе хроматографической колонки, отобранные пиковые фракции объединяют и концентрируют в диализных мешках с полиэтиленгликолем с молекулярным весом 15000 а.е.м., который используют из расчета 0,5 г порошка полиэтиленгликоля на 1 мл суспензии, при этом концентрацию выполняют в течение 16 часов при температуре 4°C, затем готовят образец для исследования, для чего каплю концентрированного препарата объемом 3 мкл наносят на свежий скол слюдяной подложки и выдерживают в течение одной минуты, после чего излишек жидкости удаляют с помощью бумажного фильтра, затем образец тщательно высушивают продувкой чистым сухим воздухом или азотом в течение не менее 30 секунд и закрепляют в держателе микроскопа, после чего выполняют визуализацию вируса гриппа с помощью сканирующего зондового микроскопа в режиме полуконтактной атомно-силовой микроскопии с использованием кремниевых зондов серии NSG01 (НТ-МДТ, Зеленоград, Россия) с резонансной частотой 150 кГц, жесткостью 5,1 Н/м, радиусом закругления 10 нм, позволяющих анализировать размеры и детали строения молекул и молекулярных комплексов, масса которых не превышает 60 кДа, при амплитуде колебаний кантилевера в диапазоне 100÷300 нм, при этом величина амплитуды колебаний кантилевера составляет 40÷60% от амплитуды свободных колебаний и удовлетворяет условию совпадения фазовых кривых подвода-отвода в рабочей точке, сканирование препарата производят с разрешением не менее 512×512 точек при частоте строчной развертки 0,6-0,8 Гц. Кроме того, используют препаративную хроматографическую колонку ХК16(LКВ, Швеция) длиной 40 см, диаметром 1,6 см, а инактивированную вируссодержащую жидкость вносят в хроматографическую колонку в объеме 500 мкл. При этом свежий скол слюдяной подложки получают посредством скотча, который клеящей поверхностью плотно прижимают к поверхности слюдяной пластинки и затем отрывают от нее вместе с верхним слоем слюды.
Технический результат достигается следующим образом.
Существенные признаки изобретения: "Способ визуализации вируса гриппа, …" - являются неотъемлемой частью заявленного способа и обеспечивают его осуществимость, а следовательно, обеспечивают достижение заявленного технического результата.
В заявленном способе вирусосодержащую жидкость получают широко известным способом из аллантоисной жидкости куриных эмбрионов путем заражения куриных эмбрионов вирусом гриппа. Использование аллантоисной жидкости обусловлено тем, что в ней вирус гриппа находится в свободном состоянии, несвязанном с белками, присутствующими в жидкости, что создает предпосылку для возможности отделения их друг от друга.
Полученную инфицированную вирусом гриппа неочищенную аллантоисную жидкость куриных эмбрионов инактивируют, что обеспечивает безопасную работу персонала при визуализации вирусов гриппа с использованием АСМ. Инактивацию выполняют ультрафиолетовым излучением (УФ) длиной волны 254 нм с дозой 4 мДж/см2. Использование УФ-излучения обусловлено тем, что обеззараживающий эффект УФ-излучения обусловлен фотохимическими реакциями, в результате которого происходят необратимые повреждения РНК вируса, вызывая гибель микроорганизма без повреждения их поверхностных структур, что позволяет сохранить вирус гриппа в неповрежденном состоянии. Длина волны УФ-излучения 254 нм с дозой облучения 4 мДж/см2 обеспечивают поражение генетического аппарата вируса гриппа без повреждения его поверхностных структур. Как показал опыт, при использовании УФ-излучения с предлагаемыми характеристиками обеспечивается инактивация 99,9% микроорганизмов.
Время экспозиции 1 час 20 мин при облучении УФ соответствует оптимальному поражающему эффекту на генетический аппарат вируса гриппа и подобрано эмпирическим путем (с серийной проверкой в РГА гемагглютинирующей активности и на лабораторных животных - отсутствие инфекционности).
В случае, когда исследуемая суспензия многокомпонентна, довольно затруднительно определить какие из увиденных на поверхности объектов являются вирусами, особенно при большом разрешении средства визуализации, каким является АСМ. Для достоверной трактовки результатов визуализации необходимо иметь «высокоочищенный» вирус гриппа.
Поскольку в заявленном способе источником вирусосодержащей среды выбрана аллантоисная жидкость, в которой вирусы гриппа, белки и другие балластные компоненты находятся в несвязанном состоянии, это позволяет использовать для их разделения метод гель-фильтрации (http://www.ibmc.msk.ru/content/Education/w-o_pass/MMoB/3a.pdf).
Гель-фильтрация (синоним гель-хроматография) - метод разделения смеси веществ с различными молекулярными массами по их размерам и конформации (пространственной форме) путем фильтрации через различные матрицы (гели) - составляющие твердую основу неподвижной хроматографической фазы.
Гель-фильтрацию проводят на хроматографических колонках, заполненных набухшим гранулированным гелем, например гелем сефадексов (Pharmacia, Швеция), - коммерческое название полисахаридов декстранов, прошедших специальную химическую обработку, в результате которой между линейными структурами их молекул образуется множество поперечных связей, или «сшивок». Гель является неподвижной фазой.
Элюируют (вымывают) разделяемые вещества разбавленными солевыми или буферными растворами.
Эффективность гель-фильтрация определяется размерами пор между гранулами геля и величиной ячеек каждой гранулы: мелкие молекулы вещества (значительно меньше ячейки геля) диффундируют внутрь гранулы и задерживаются при фильтрации через эти своеобразные молекулярные сита, а более крупные молекулы не могут попасть в ячейки и проходят в поры между гранулами.
Декстрановые гели получают поперечным сшиванием полисахаридных цепочек декстрана эпихлоргидрином, благодаря чему растворимый в воде декстран становится водонерастворимым, сохраняя при этом свои гидрофильные свойства и способность к быстрому набуханию в водной среде. Варьируя число поперечных сшивок и размер гранул, удалось получить несколько различных типов сефадексов, различающихся степенью пористости частиц, что позволяет применять их для разделения веществ с различными размерами молекул. Оптимальным для выполнения заявляемого способа является гель Sephadex G-100 (Pharmacia, Швеция). Это объясняется следующим.
Гранула матрицы (геля) может вместить внутрь определенное количество вещества, остальное проскочит мимо гранул в свободном объеме и не разделится. Область фракционирования Sephadex G-100 (Pharmacia, Швеция) находится в пределах от 4000 до 150000 дальтон. В эту область попадают основные белки, находящиеся в аллантоисной жидкости, что обеспечивает их гарантированное разделение в процессе хроматографического функционирования, а также гарантированное разделение обломков клеток и разрушенных вирусов.
В заявленном способе используют препаративную хроматографическую колонку ХК16 (LKB, Швеция) длиной 40 см, диаметром 1,6 см, а инактивированную вируссодержащую жидкость вносят в хроматографическую колонку в объеме 500 мкл. Это позволяет оптимизировать время разделения (до 6 часов) при получении оптимального объема исследуемого вируса гриппа. Кроме того, верхний предел используемого количества вирусосодержащей жидкости ограничивается техническими характеристиками матрицы (геля) (размерами гранул и пор, количеством пор на единицу площади гранул, внутренним объемом гранул).
Для используемого в способе Sephadex G-100 объем вируссодержащей жидкости 500 мл, которую вносят в хроматографическую колонку, является оптимальным.
Гели сефадекса нерастворимы и стабильны в воде, солевых растворах и органических растворителях, а также в щелочных и слабокислых растворах. Это позволяет использовать в качестве элюэнта фосфатный буферный раствор с рН 7,4. Выбор количественного значения рН 7,4 обусловлен близостью к рН аллантоисной жидкости. В результате при использовании в качестве элюэнта фосфатного буферного раствора с рН 7,4 оболочка вируса гриппа не разрушается. Кроме того, поскольку в предлагаемом способе для получения вируса гриппа используют только один источник - аллантоисную жидкость, то при смене штамма вируса в вирусосодержащей жидкости, загружаемой в колонку, не требуется смена элюэнта, не требуется смена геля, который выбирают заранее под определенный буфер при подготовке хроматографической колонки, в которую входят: микширование, набивка, промывка и уравновешивание, проверка качества набивки, регенерация, калибровка.
При этом элюцию проводят при комнатной температуре со скоростью 5 мл/час, что, как показал опыт, в совокупности с вышеизложенными существенными признаками, является оптимальным для получения вирусосодержащей жидкости высокой степени очистки.
Факт отделения балластных белков от вируса гриппа подтверждается реакцией торможения гемагглютинации с диагностической сывороткой против вируса гриппа A/PR/8/34 (H1N1). Выявлена гемагглютинация с титром антител 1:40 в первой по времени появления на выходе хроматографической колонки пиковой фракции аллантоисной жидкости, пропущенной через хроматогрфическую колонку. В результате для визуализации вируса гриппа берут пиковую фракцию очищенной аллантоисной жидкости первую по времени появления на выходе хроматографической колонки.
Отобранные пиковые фракции объединяют и концентрируют в диализных мешках с полиэтиленгликолем с молекулярным весом 15000 а.е.м. (Ferak Berlin), который используют из расчета 0,5 г на 1 мл вирусосодержащей суспензии. Как показал опыт, концентрация вируса гриппа в полученной суспензии тем выше, чем выше молекулярный вес полиэтилен гликоля. Количественные параметры операции концентрации: выбор полиэтиленгликоля с молекулярным весом 15000 а.е.м., его использование из расчета 0,5 г на 1 мл вирусосодержащей суспензии, выполнение концентрации в течение 16 часов при температуре 4°C, - являются оптимальными, получены опытным путем и позволяют получить максимальную концентрацию вируса гриппа из объема вируссодержащей жидкости 500 мл, которую вносят в хроматографическую колонку. Это, кроме того, не требует больших количеств исходной суспензии вирусосодержащей жидкости.
Концентрация вируса осаждением полиэтиленгликолем широко используется для получения вируса из аллантоисной жидкости и культуральной среды (http://bib.social/mikrobiologiya_1050/ochistka-virusov-grippa-74466.html). Однако использование для этой цели полиэтиленгликоля с молекулярным весом 15000 а.е.м. (Ferak Berlin), который используют из расчета 0,5 г на 1 мл вирусосодержащей суспензии, и выполнение концентрации в течение 16 часов при температуре 4°С ранее неизвестно и предложено впервые авторами изобретения.
Таким образом, из вышеизложенного следует, что в заявленном способе для визуализации получают вирус гриппа в неизмененном, в свободном (несвязанном) состоянии, в состоянии, свободном от присутствия балластных веществ (белков, обломков клеток и разрушенных вирусов).
Из подготовленного таким образом концентрированной вирусосодержащей жидкости готовят образец для исследования. Препарат в виде капли объемом 3 мкл наносят на свежий скол слюдяной подложки.
Свежий скол слюдяной подложки получают посредством скотча, который клеящей поверхностью плотно прижимают к поверхности слюдяной пластинки и затем отрывают от нее вместе с верхним слоем слюды. При этом обнажается чистый внутренний слой пластинки слюды, что максимально снижает вероятность внесения балластных веществ в каплю вирусосодержащей жидкости при нанесении ее на поверхность слюды.
Проведенные авторами заявленного способа эксперименты с различными видами подложек показали, что оптимальной оказалась подложка скола чистой слюды. Это является оптимальным вариантом, во-первых, потому, что удовлетворяет требованию, в соответствии с которым при исследовании АСМ шероховатость подложки должна быть меньше структурных особенностей исследуемых объектов;
во-вторых, у вирусов гриппа, как показал опыт, более энергичная сорбция происходит на поверхности слюды, что обеспечивает их надежную иммобилизацию на подложке. Последнее позволяет иммобилизовать вирусы гриппа на слюдяную подложку в виде капли вирусосодержащей жидкости, т.е. в неизмененном виде.
Нанесенную на поверхность слюды каплю выдерживают в течение одной минуты, что является оптимальным для сорбции вирусов гриппа в подложку. При этом благодаря используемой в способе операции концентрации очищенной от балластных составляющих вирусосодержащей суспензии, количественное содержание вирусов гриппа на подложке позволяет удалить излишек жидкости с помощью бумажного фильтра, а затем тщательно высушить образец продувкой чистым сухим воздухом или азотом в течение не менее 30 секунд, без ощутимых количественных потерь исследуемого объекта. В результате подложка содержит иммобилизованные вирусы гриппа в неизмененном, в несвязанном состоянии, свободные от присутствия балластных веществ.
Для визуализации вируса гриппа с помощью атомно-силового микроскопа образец закрепляют в держателе микроскопа.
Как уже упоминалось, раздел медицины вирусология, объекты исследования которой имеют в среднем размеры от 1 до 500 нм, является предметом изучения нанообъектов. Одним из инструментов, обеспечивающим возможность их визуализации, является сканирующая зондовая микроскопия, которая получила такое название благодаря элементу, обязательно присутствующему во всех ее модификациях - зонду.
Атомно-силовая микроскопия принадлежит к семейству проксимальной зондовой микроскопии для анализа поверхности и ее свойств на атомномолекулярном уровне. Свойства атомного силового микроскопа имеют ряд преимуществ, в числе которых отсутствие необходимости видоизменять объект исследования, что и обуславливает использование АСМ в заявленном способе для визуализации вируса гриппа (Филонов. А., Яминский И. Обработка и анализ данных в сканирующей зондовой микроскопии: алгоритмы и методы // Наноиндустрия, 2007, №2, 32-34; Comparative studies of bacteria with atomic force microscopy operating in different modes / A.V Bolshakova., O.I., Kiselyova A.S., Filonov, O.Yu Frolova., Yu.L Lyubchenko. I.V Yaminsky // Ultramicroscopy, - 2001, - №86 (1-2), - P.121-128; Yaminsky I. / Three dimensional image analysis in biomedical scanning probe microscopy // Nanomedicine: Nanotechnology, Biology and Medicine, - 2006, Vol.2, Issue 4, December - p.288).
Принцип действия ACM основан на использовании сил атомных связей, действующих между атомами вещества. На малых расстояниях между двумя атомами (около одного нанометра - 10-9 м) действуют силы отталкивания. На расстояниях более одного нанометра действуют силы притяжения. В сканирующем атомном силовом микроскопе такими телами служат исследуемая поверхность и скользящий построчно вдоль нее зонд или острие, которое сканирует эту поверхность, обеспечивая возможность детектирования количественной характеристики этого взаимодействия и передачи информации о свойствах объекта с помощью сигнала на датчик (http://www.vevivi.ru/best/Atomno-silovaya-mikroskopiya-ref149537.htmlhttp://www.vevivi.ru/best/Atomno-silovaya-mikroskopiya-ref19537.html; http://www.nanoscopy.org/tutorial/afm./afm.htm).
Таким образом, в сканирующих зондовых микроскопах исследование микрорельефа поверхности и ее локальных свойств проводится с помощью специальным образом приготовленных зондов в виде игл. Рабочая часть таких зондов (острие) имеет размеры порядка десяти нанометров.
В основе работы АСМ лежит силовое взаимодействие между зондом и поверхностью, для регистрации которого используются специальные зондовые датчики представляющие собой упругую консоль с острым зондом на конце. Сила, действующая на зонд со стороны поверхности, приводит к изгибу консоли. Регистрируя величину изгиба, можно контролировать силу взаимодействия зонда с поверхностью.
Пространственное разрешение АСМ определяется радиусом закругления зонда и чувствительностью системы, регистрирующей отклонения консоли.
Разрешение скана образца зависит не только от радиуса закругления зонда, но и от шероховатости поверхности. Именно поэтому при исследовании биологических объектов посредством АСМ шероховатость подложки должна быть меньше структурных особенностей исследуемых объектов. В заявленном способе в качестве подложки используют скол слюды. Как упоминалось выше, проведенные авторами заявленного способа эксперименты с различными видами подложек показали, что оптимальной оказалась подложка скола слюды, поскольку более энергичная сорбция вирусов гриппа происходит на поверхности слюды, что обеспечивает их надежную иммобилизацию на подложке и позволяет позиционировать вирусы гриппа на слюдяную подложку в виде капли вирусосодержащей жидкости, т.е. в неизмененном виде.
В настоящее время реализованы конструкции АСМ, позволяющие получать атомарное разрешение при исследовании поверхности образцов.
Как отмечено выше, зонд АСМ испытывает притяжение со стороны образца на больших расстояниях и отталкивание на малых.
В заявленном способе для визуализации вируса гриппа используют полуконтактный метод сканирования. В основе лежит использование колеблющегося кантилевера в сканирующей силовой микроскопии, которое впервые было предложено Г. Биннигом. Было продемонстрировано влияние градиентов сил на сдвиг резонансной частоты кантилевера и возможность бесконтактного сканирования поверхности образца. Относительно слабый сдвиг частоты колебаний под влиянием отталкивающих сил означает, что контакт зонда с поверхностью образца в процессе колебаний не является постоянным. Только в течение короткой части периода колебаний зонд ощущает контактные отталкивающие силы.
Полуконтактный метод обладает определенными преимуществами по сравнению с контактными методами. Прежде всего, при использовании этого метода давление кантилевера на поверхность образца существенно меньше, что позволяет работать с более мягкими и легко разрушающимися материалами: биоматериалы, клетки и другие живые объекты, в случае предлагаемого способа - вирусы гриппа.
Полуконтактный метод также более чувствителен к различным взаимодействиям с поверхностью, что дает возможность измерять ряд характеристик поверхности - распределение вязкости и упругости электрических и магнитных доменов. Используется для получения двух- и трехмерных топографических изображений микроорганизмов, позволяющий определять длину, ширину, высоту, шероховатость.
Использование в заявленном способе полуконтактного метода атомно-силовой микроскопии при амплитуде колебаний кантилевера в диапазоне 100÷300 нм с использованием кремниевых зондов серии NSG01 (НТ-МДТ, Зеленоград, Россия) с резонансной частотой 150 кГц, жесткостью 5,1 Н/м, радиусом закругления 10 нм. При этом величина амплитуды колебаний кантилевера составляет 40÷60% от амплитуды свободных колебаний и удовлетворяет условию совпадения фазовых кривых подвода-отвода в этой рабочей точке. В совокупности это позволяет визуализировать вирусы гриппа посредством АСМ без их разрушения.
Для получения изображения в АСМ осуществляют специальным образом организованный процесс сканирования образца. При сканировании зонд вначале движется над образцом вдоль определенной линии (строчная развертка), при этом величина сигнала на исполнительном элементе, пропорциональная рельефу поверхности, записывается в память компьютера. Затем зонд возвращается в исходную точку и переходит на следующую строку сканирования (кадровая развертка) и процесс повторяется вновь. Затем изображение рельефа поверхности строится с помощью средств компьютерной графики. В заявленном способе сканирование препарата производят с разрешением не менее 512×512 точек при частоте строчной развертки 0,6-0,8 Гц.
Кроме того, частота развертки сканирования 0,6-0,8 Гц минимизирует эффект увлечения биологического объекта острием зонда вследствие наличия латеральной составляющей.
Таким образом, в заявленном способе визуализацию вируса гриппа с помощью сканирующего зондового микроскопа в режиме полуконтактной атомно-силовой микроскопии выполняют со следующими параметрами:
амплитуда колебаний кантилевера в диапазоне 100÷300 нм, при этом величина амплитуды колебаний кантилевера составляет 40÷60% от амплитуды свободных колебаний и удовлетворяет условию совпадения фазовых кривых подвода-отвода в рабочей точке,
используют кремниевые зонды серии NSG01 (НТ-МДТ, Зеленоград, Россия) с резонансной частотой 150 кГц, жесткостью 5,1 Н/м, радиусом закругления 10 нм, позволяющие анализировать размеры и детали строения молекул и молекулярных комплексов, масса которых не превышает 60 кДа,
сканирование препарата производят с разрешением не менее 512×512 точек при частоте строчной развертки 0,6-0,8 Гц, что в совокупности обеспечивают визуализацию вируса гриппа без его разрушения, обеспечивает требуемое пространственное разрешение АСМ и обеспечивает получение четкого достоверного изображения на мониторе.
Количественные характеристики режима выполнения визуализации с помощью АСМ получены опытным путем и являются оптимальными для осуществления заявленного способа визуализации вируса гриппа.
Таким образом, авторами заявленного способа визуализации вируса гриппа впервые решена в комплексе проблема обработки материала, содержащего вирус гриппа, и его иммобилизации на подложке, в результате которой вирус гриппа остается с неразрушенным суперкапсидом, в свободном, неизмененном состоянии без присутствия балластных веществ (обломков клеток и разрушенных вирусов).
При этом решение авторами изложенной выше проблемы обеспечило возможность достижения заявленного технического результата, заключающегося в возможности использования атомно-силовой микроскопии для визуализации вируса гриппа, в возможности исследования структуры вируса гриппа посредством атомно-силовой микроскопии.
Кроме того, учитывая то, что прямое назначение атомно-силовой микроскопии - это исследование поверхностей, то авторами изобретения впервые предложено использование атомно-силовой микроскопии для визуализации вируса гриппа, а также впервые предложен способ визуализации вируса гриппа, реализующий возможность использования атомно-силовой микроскопии для визуализации вируса гриппа.
Таким образом, из вышеизложенного следует, что предлагаемый способ визуализации вируса гриппа при осуществлении решает проблему подготовки исследуемого материла, содержащего вирус гриппа, и его иммобилизации для исследования, при которых исследуемый вирус гриппа остается в неизмененном состоянии, и которые позволяют использовать для визуализации вируса гриппа атомно-силовую микроскопию, при этом осуществление заявленного способа обеспечивает достижение заявленного технического результата, заключающегося в возможности использования атомно-силовой микроскопии для визуализации вируса гриппа, в возможности исследования структуры вируса гриппа посредством атомно-силовой микроскопии.
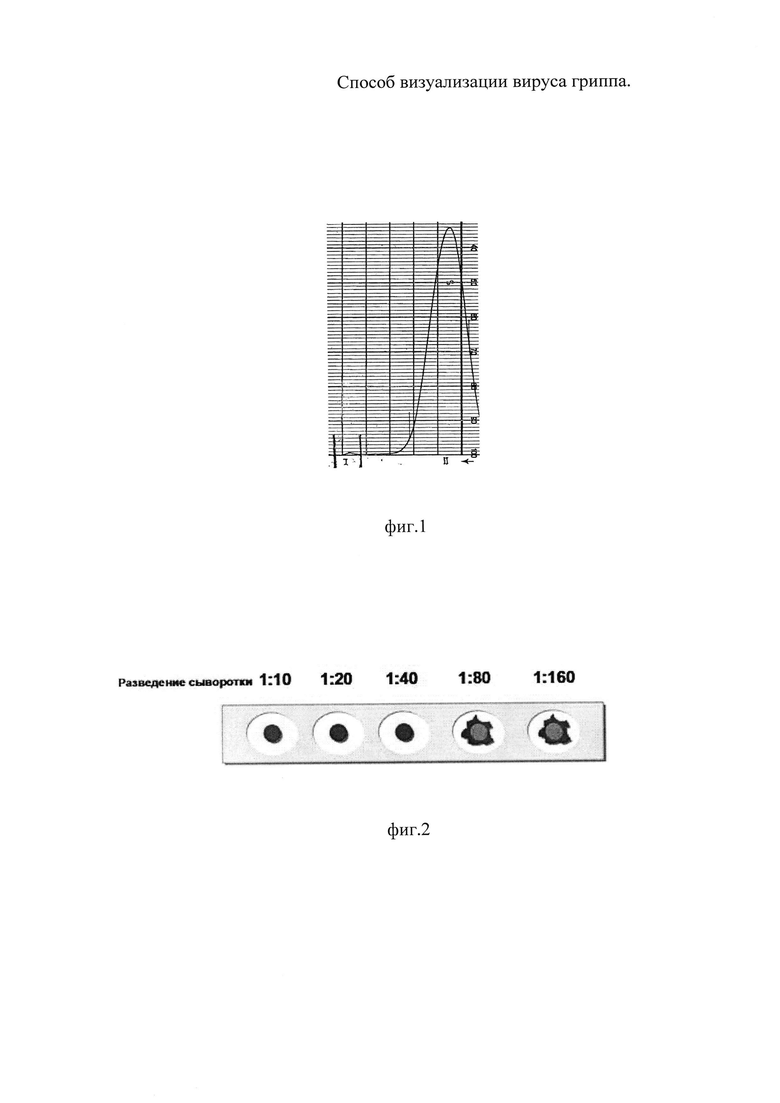
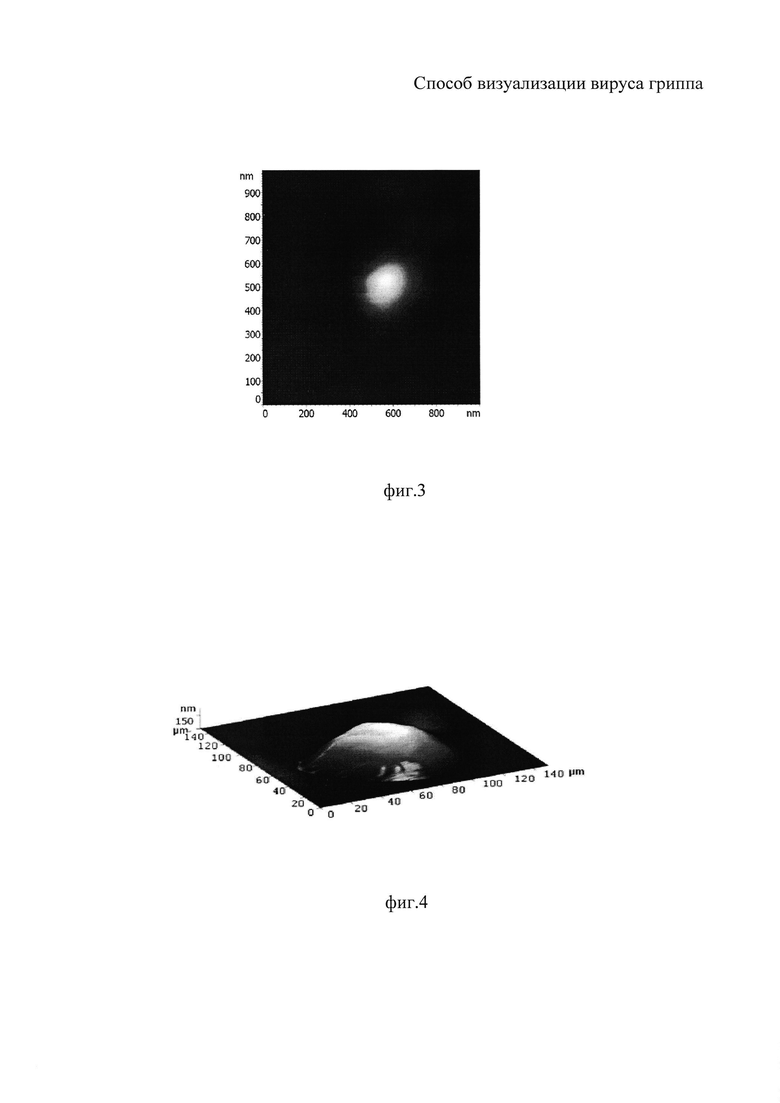
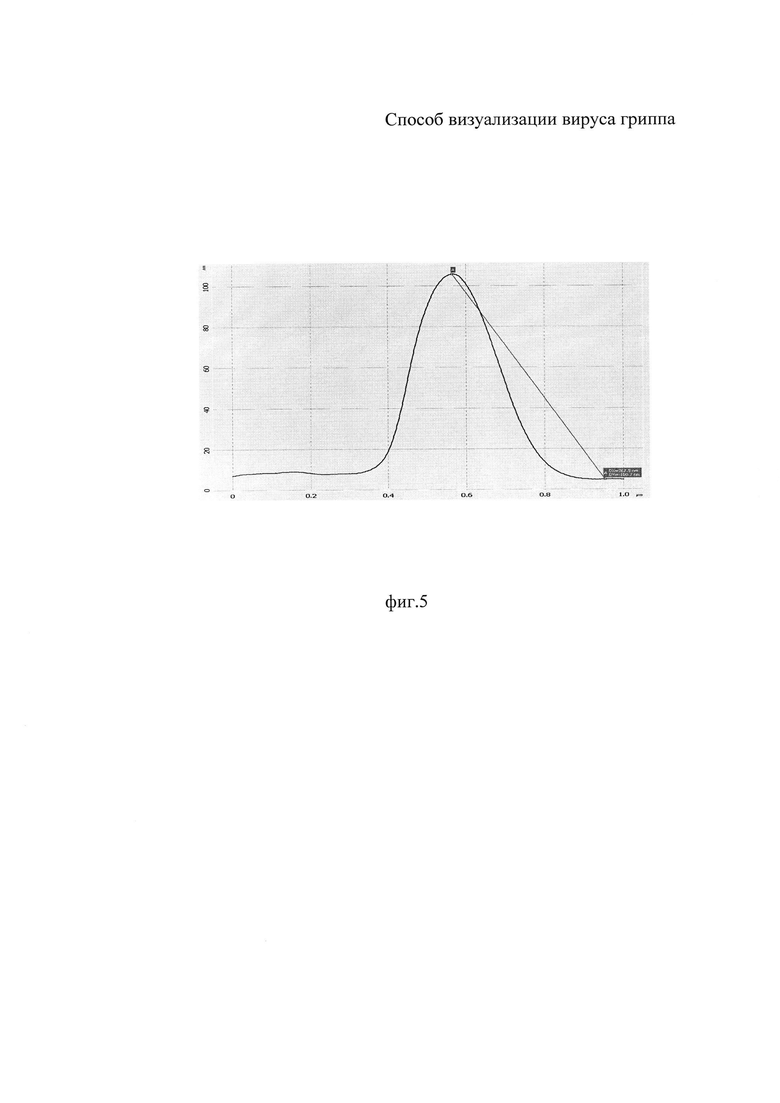
На фиг. 1 показано формирование пиковых фракций аллантоисной жидкости на выходе хроматографической колонки; на фиг. 2 иллюстрировано определение диагностического титра антител в реакции торможения гемагглютинации для вируса гриппа A/PR/8/34(H1N1); на фиг 3 - изображение вирусов гриппа A/PR/8/34 (H1N1), полученное с помощью атомно-силового микроскопа; на фиг. 4 - трехмерная реконструкция участка поверхности образца, полученная с помощью атомно-силового микроскопа, площадь сканирования 3,0×3,0 нм2; на фиг. 5 - вертикальный профиль поверхности вирусной частицы, полученный с помощью атомно-силового микроскопа.
Заявленный способ визуализации вируса гриппа осуществляют следующим образом. Получают вирусосодержащую жидкость из аллантоисной жидкости куриных эмбрионов путем заражения куриных эмбрионов вирусом гриппа. Затем полученную инфицированную вирусом гриппа неочищенную аллантоисную жидкость куриных эмбрионов инактивируют ультрафиолетовым излучением длиной волны 254 нм с дозой 4 мДж/см2, при этом время экспозиции составляет 1 час 20 минут. После чего выполняют очистку от сопутствующих балластных белковых компонентов образцов вирусосодержащей жидкости методом гель-фильтрации. Используют препаративную хроматографическую колонку ХК16 (LKB, Швеция) длиной 40 см, диаметром 1,6 см, а инактивированную вируссодержащую жидкость вносят в хроматографическую колонку в объеме 500 мкл. Инактивированную вируссодержащую жидкость вносят в препаративную хроматографическую колонку, заполненную Sephadex G-100 (Pharmacia, Швеция), в качестве элюэнта используют фосфатный буферный раствор с рН 7,4, элюцию проводят при комнатной температуре со скоростью 5 мл/час. Для визуализации вируса гриппа берут пиковую фракцию очищенной аллантоисной жидкости первую по времени появления на выходе хроматографической колонки. Отобранные пиковые фракции объединяют и концентрируют в диализных мешках с полиэтиленгликолем с молекулярным весом 15000 а.е.м., который используют из расчета 0,5 г порошка полиэтиленгликоля на 1 мл суспензии. Концентрацию выполняют в течение 16 часов при температуре 4°C.
Затем готовят образец для исследования, для чего каплю концентрированного препарата объемом 3 мкл наносят на свежий скол слюдяной подложки и выдерживают в течение одной минуты.
Свежий скол слюдяной подложки получают посредством скотча, который клеящей поверхностью плотно прижимают к поверхности слюдяной пластинки и затем отрывают от нее вместе с верхним слоем слюды.
По истечении одной минуты излишек жидкости удаляют с помощью бумажного фильтра, затем образец тщательно высушивают продувкой чистым сухим воздухом или азотом в течение не менее 30 секунд и закрепляют в держателе микроскопа.
После чего выполняют визуализацию вируса гриппа с помощью сканирующего зондового микроскопа в режиме полуконтактной атомно-силовой микроскопии с использованием кремниевых зондов серии NSG01 (НТ-МДТ, Зеленоград, Россия) с резонансной частотой 150 кГц, жесткостью 5,1 Н/м, радиусом закругления 10 нм, позволяющих анализировать размеры и детали строения молекул и молекулярных комплексов, масса которых не превышает 60 кДа, при амплитуде колебаний кантилевера в диапазоне 100÷300 нм, при этом величина амплитуды колебаний кантилевера составляет 40÷60% от амплитуды свободных колебаний и удовлетворяет условию совпадения фазовых кривых подвода-отвода в рабочей точке, сканирование препарата производят с разрешением не менее 512×512 точек при частоте строчной развертки 0,6-0,8 Гц.
Пример. Для правильной трактовки результатов атомно-силового микроскопирования необходимо иметь в наличии «высокоочищенный» вирус гриппа без сопутствующих балластных белковых веществ. В связи с тем, что источником получения жидкости, содержащей вирусы гриппа, является аллантоисная жидкость куриных эмбрионов, широко используемая для получения различных штаммов вируса гриппа, то предлагаемое в заявленном способе разделение вирусов гриппа и сопутствующих балластных белковых и других веществ методом гель-фильтрации распространяется на все виды штаммов вируса гриппа.
Кроме того, поскольку в предлагаемом способе для получения вируса гриппа используют только один источник - аллантоисную жидкость, то при смене штамма вируса в вирусосодержащей жидкости, загружаемой в колонку, не требуется смена элюэнта, не требуется смена геля, который выбирают заранее под определенный буфер при подготовке хроматографической колонки, в которую входят: микширование, набивка, промывка и уравновешивание, проверка качества набивки, регенерация, калибровка. Это еще раз подтверждает, что предлагаемое в заявленном способе разделение вирусов гриппа и сопутствующих балластных белковых и других веществ методом гель-фильтрации распространяется на все виды штаммов вируса гриппа.
В эксперименте для получения вируса гриппа использовали аллантоисную жидкость куриных эмбрионов, инфицированную вирусом гриппа A/PR/8/34 (H1N1).
Несмотря на то, что в эксперименте использовали вируссодержащий материал только штамма вируса гриппа A H1N1 A/PR/8/34, в виду сходства морфологии остальных вирусов данного типа предлагаемый способ визуализации вируса гриппа можно использовать при изучении других штаммов данного вируса.
Для безопасной работы при исследовании посредством АСМ полученного образца, содержащего очищенный, но активный вирус гриппа, инактивировали. Для этого использовали ультрафиолетовое излучение длиной волны 254 нм с дозой 4 мДж/см2, при этом время экспозиции составляло 1 час 20 минут. Обеззараживающий эффект УФ-излучения был обусловлен фотохимическими реакциями, в результате которых происходили необратимые повреждения РНК вируса, вызывающие его гибель.
Для разделения вирусов гриппа и сопутствующих балластных белковых веществ методом гель-фильтрации использовали препаративную хроматографическую систему низкого давления фирмы LKB (Швеция). Инактивированную вирусосодержащую жидкость, выделенную из восьмидневных куриных эмбрионов, вносили в хроматографическую колонку ХК16 (LKB, Швеция), длиной 40 см, диаметром 1,6 см, заполненную Sephadex G-100 (Pharmacia, Швеция). Оптимальный объем наносимого образца составлял 500 мкл.
Для подачи элюента на колонку использовали перистальтический насос Microperpex 2123 (LKB, Швеция). Элюцию проводили фосфатным буферным раствором рН 7,4 при комнатной температуре со скоростью 5 мл/час.
Ультрафиолетовый монитор Uvicord S2 2238 (LKB, Швеция), с длиной волны 206 нм.
Результат хроматографии фиксировали с помощью двухканального самописца с отметчиком событий LBK 2210 (LKB, Швеция).
В результате хроматографического разделения были выявлены две пиковые фракции (фиг. 1).
Для определения наличия вирусов гриппа в пиковых фракциях была поставлена реакция торможения гемагглютинации (РТГА) с диагностической сывороткой против вируса гриппа A/PR/8/34 (H1N1) (фиг. 2). Только в первой фракции была выявлена гемагглютинация с титром антител 1:40, что предполагало наличие в данном образце вирусов гриппа.
Во второй фракции РТГА показала полное отсутствие гемагглютинирующей активности.
Отбор фракций проводили на коллекторе фракций Ultrorac 2070 (LKB, Швеция), по 5 мл в пробирку.
По окончании хроматографического разделения пиковые фракции объединяли и концентрировали в диализных мешках с полиэтиленгликолем с молекулярным весом 15000 а.е.м., который использовали из расчета 0,5 г на 1 мл суспензии. Концентрацию выполняли в течение 16 часов при температуре 4°C (в холодильнике).
Сухой полиэтиленгликоль добавляли к содержащей вирус жидкости и перемешивали. Затем вирус осаждали центрифугированием.
Визуализацию вирусов гриппа выполняли на сканирующем атомно-силовом микроскопе "Интегра Вита NT-MDT" (конфигурация на базе инвертированного оптического микроскопа "Olympus 1Х-71") в режиме полуконтактного сканирования.
Суспензию вируссодержащей жидкости наносили в виде капли на свежую поверхность пластинки слюды, которую получали посредством скотча.
В случае, когда визуализация препарата затруднена присутствием микрокристаллов соли, сформировавшихся при высушивании буферного раствора, проводили дополнительную промывку образцов. Для этого образец с осажденным и высушенным на поверхности слюды препаратом помещали на поверхность капли деионизованной воды (рабочей стороной образца вниз), выдерживали в течение одной минуты, после чего остатки жидкости удаляли вытягиванием с помощью бумажного фильтра. При необходимости процедуру повторяли несколько раз (каждый раз с новой каплей деионизованной воды). После этого образец высушивали продувкой чистым сухим воздухом или азотом в течение не менее 30 секунд.
В процессе визуализации строили изображения рельефа поверхности вирусных частиц.
АСМ изображения получали в режиме полуконтактного сканирования.
Сканирование осуществляли кремниевыми зондами серии NSG03 (IMT-MDT) жесткостью 1,1 Н/м и радиусом закругления 10 нм.
Разрешающая способность прибора от 1 до 500 нанометров. В заявленном способе сканирование препарата производят с разрешением не менее 512×512 точек при частоте строчной развертки 0,6-0,8 Гц. Кроме того, используемая в заявленном способе частота развертки сканирования порядка 0,6-0,8 Гц минимизирует эффект увлечения биологического объекта острием зонда вследствие наличия латеральной составляющей.
Чувствительность прибора: подобрана чувствительность, которая позволяет анализировать размеры и детали строения молекул и молекулярных комплексов, масса которых не превышает 60 кДа.
Результат визуализации вируса гриппа A/PR/8/34 (H1N1) продемонстрирован на фигурах 3, 4, 5.
Возможность использования для визуализации АСМ дает большие преимущества в исследовании вирусов гриппа, по сравнению с электронным микроскопом. В сравнении с электронным микроскопом (например растровым - РЭМ) атомно-силовой микроскоп обладает рядом преимуществ. Так, в отличие от последнего, который дает псевдотрехмерное изображение поверхности образца, АСМ позволяет получить истинно трехмерный рельеф поверхности. На фиг. 4 представлена трехмерная реконструкция участка поверхности образца, полученная с помощью атомно-силового микроскопа, площадь сканирования 3,0×3,0 нм2; на фиг. 5 представлен вертикальный профиль поверхности вирусной частицы, полученный с помощью атомно-силового микроскопа.
Кроме того, для нормальной работы РЭМ требуется вакуум, в то время как большинство режимов АСМ могут быть реализованы на воздухе или даже в жидкости. Данное обстоятельство открывает возможность изучения биомакромолекул и живых клеток.
АСМ способен дать более высокое разрешение, чем РЭМ. Так было показано, что АСМ в состоянии обеспечить реальное атомное разрешение в условиях сверхвысокого вакуума. Сверхвысоковакуумный АСМ по разрешению сравним со сканирующим туннельным микроскопом и просвечивающим электронным микроскопом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНОВ ДЛЯ ВАКЦИНЫ ПРОТИВ ВИРУСОВ ГРИППА | 2005 |
|
RU2283139C1 |
| СПОСОБ ИСПОЛЬЗОВАНИЯ ПОЛУКОНТАКТНОГО РЕЖИМА С ФИКСИРОВАННЫМ ПИКОМ СИЛЫ ДЛЯ ИЗМЕРЕНИЯ ФИЗИЧЕСКИХ СВОЙСТВ ОБРАЗЦА | 2011 |
|
RU2571446C2 |
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ПРОТИВ ГРИППА | 2009 |
|
RU2423995C1 |
| Пентавалентная субъединичная вакцина против респираторных инфекций и способ ее получения | 2022 |
|
RU2804948C2 |
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАВАЛЕНТНОЙ СУБЪЕДИНИЧНОЙ ПРОТИВОГРИППОЗНОЙ ВАКЦИНЫ | 2019 |
|
RU2740751C1 |
| ПОЛИАНИЛИН В КАЧЕСТВЕ СОРБЕНТОВ ДЛЯ УДАЛЕНИЯ ВИРУСОВ, БЕЛКОВ НЕВИРУСНОЙ ПРИРОДЫ И В КАЧЕСТВЕ ОСНОВЫ ИММУНОСОРБЕНТОВ, СПОСОБ УДАЛЕНИЯ ИЛИ ФИКСАЦИИ ВИРУСОВ С ПОМОЩЬЮ ЭТИХ СОРБЕНТОВ, СПОСОБ ИММУНОСОРБЦИИ С ПОМОЩЬЮ ЭТИХ СОРБЕНТОВ, СПОСОБ СОРБЦИИ С ПОМОЩЬЮ ЭТИХ СОРБЕНТОВ | 2007 |
|
RU2372951C2 |
| СПОСОБ ИССЛЕДОВАНИЯ НАТИВНЫХ КЛЕТОК | 2009 |
|
RU2398234C1 |
| Способ повышения противоопухолевой резистентности, антиоксидантного и иммуностимулирующего воздействия на организм | 2019 |
|
RU2755638C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2003 |
|
RU2330885C2 |
Изобретение относится к медицине и касается способа визуализации вируса гриппа, при котором получают вирусосодержащую жидкость из аллантоисной жидкости куриных эмбрионов путем заражения куриных эмбрионов вирусом гриппа, затем полученную инфицированную вирусом гриппа неочищенную аллантоисную жидкость куриных эмбрионов инактивируют ультрафиолетовым излучением, после чего выполняют очистку образцов вирусосодержащей жидкости от белковых и других сопутствующих балластных компонентов методом гель-фильтрации, для визуализации вируса гриппа берут пиковую фракцию очищенной аллантоисной жидкости первую по времени появления на выходе хроматографической колонки, отобранные пиковые фракции объединяют и концентрируют, затем готовят образец для исследования, после чего выполняют визуализацию вируса гриппа с помощью сканирующего зондового микроскопа. Изобретение обеспечивает исследование структуры вируса гриппа посредством атомно-силовой микроскопии. 2 з.п. ф-лы, 5 ил., 1 пр.
1. Способ визуализации вируса гриппа, отличающийся тем, что получают вирусосодержащую жидкость из аллантоисной жидкости куриных эмбрионов путем заражения куриных эмбрионов вирусом гриппа, затем полученную инфицированную вирусом гриппа неочищенную аллантоисную жидкость куриных эмбрионов инактивируют ультрафиолетовым излучением длинной волны 254 нм с дозой 4 мДж/см2, при этом время экспозиции составляет 1 час 20 минут, после чего выполняют очистку образцов вирусосодержащей жидкости от белковых и других сопутствующих балластных компонентов методом гель-фильтрации, при этом инактивированную вируссодержащую жидкость вносят в препаративную хроматографическую колонку, заполненную Sephadex G-100 (Pharmacia, Швеция), в качестве элюэнта используют фосфатный буферный раствор с pH 7,4, элюцию проводят при комнатной температуре со скоростью 5 мл/час, для визуализации вируса гриппа берут пиковую фракцию очищенной аллантоисной жидкости, первую по времени появления на выходе хроматографической колонки, отобранные пиковые фракции объединяют и концентрируют в диализных мешках с полиэтиленгликолем с молекулярным весом 15000 а.е.м., который используют из расчета 0,5 г порошка полиэтиленгликоля на 1 мл суспензии, при этом концентрацию выполняют в течение 16 часов при температуре 4°С, затем готовят образец для исследования, для чего каплю концентрированного препарата объемом 3 мкл наносят на свежий скол слюдяной подложки и выдерживают в течение одной минуты, после чего излишек жидкости удаляют с помощью бумажного фильтра, затем образец тщательно высушивают продувкой чистым сухим воздухом или азотом в течение не менее 30 секунд и закрепляют в держателе микроскопа, после чего выполняют визуализацию вируса гриппа с помощью сканирующего зондового микроскопа в режиме полуконтактной атомно-силовой микроскопии с использованием кремниевых зондов серии NSG01 (НТ-МДГ, Зеленоград, Россия) с резонансной частотой 150 кГц, жесткостью 5,1 Н/м, радиусом закругления 10 нм, позволяющих анализировать размеры и детали строения молекул и молекулярных комплексов, масса которых не превышает 60 кДа, при амплитуде колебаний кантилевера в диапазоне 100÷300 нм, при этом величина амплитуды колебаний кантилевера составляет 40÷60% от амплитуды свободных колебаний и удовлетворяет условию совпадения фазовых кривых подвода-отвода в рабочей точке, сканирование препарата производят с разрешением не менее 512×512 точек при частоте строчной развертки 0,6-0,8 Гц.
2. Способ по п. 1, отличающийся тем, что используют препаративную хроматографическую колонку ХК16 (LKB, Швеция) длиной 40 см, диаметром 1,6 см, а инактивированную вируссодержащую жидкость вносят в хроматографическую колонку в объеме 500 мкл.
3. Способ по п. 1, отличающийся тем, что свежий скол слюдяной подложки получают посредством скотча, который клеящей поверхностью плотно прижимают к поверхности слюдяной пластинки и затем отрывают от нее вместе с верхним слоем слюды.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| MORRISON IE | |||
| et al | |||
| Analysis of receptor clustering on cell surfaces by imaging fluorescent particles.Biophys J | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
Авторы
Даты
2018-04-04—Публикация
2017-04-10—Подача