Изобретение относится к медицинской биотехнологии, в частности к способу получения гриппозной вакцины.
Грипп остается актуальной проблемой современного здравоохранения. По данным Всемирной организации здравоохранения (ВОЗ) ежегодно гриппом заболевают до 10% взрослых и 30% детей. Инфекция гриппом, особенно в группах риска, может протекать в тяжелой форме, требовать госпитализации, приводить к летальному исходу. При этом вирусы гриппа сохраняют высокий пандемический потенциал, в частности, вирусы гриппа птиц, а также свиней и свиного происхождения.
В настоящее время основной подход в борьбе с гриппом - вакцинопрофилактика с использованием инактивированных антигрипозных вакцин, вводимых внутримышечно. [Итоги и перспективы развития вакцинопрофилактики в XXI в., И.В. Фельдблюм, http://www.rusmedserv.com/epidinf/m-dokl/].
В то же время используемые, как правило, трехвалентные инактивированные вакцины против гриппа, не всегда эффективны для ряда популяционных групп: маленьких детей, беременных, пожилых людей, лиц с различными хроническими заболеваниями, которых относят к группам риска по гриппу, а также в отношении антигенно отличных штаммов (дрейфовых и гетерологичных), не содержащихся в вакцине.
Известно использование для повышения эффективности вакцин применение адъювантов различного происхождения: минеральных (гидроксид или фосфат алюминия и др.); растительных (сапонины - QuilA, QS21); микробных (убитые бактерии, липополисахарид и его производные, CpG-мотивы ДНК) и др. При использовании адъювантов появляется возможность повысить иммуногенность вакцин против гриппа в отношении набора антигенноотличных штаммов, а также для иммунизации различных популяционных групп, в том числе групп риска. Кроме того, при значительном повышении иммуногенности за счет добавления адъюванта к вакцине появляется возможность перехода на простые (однократные) схемы иммунизации, а также снижения дозы антигена (гемагглютинина), что улучшает экономику их производства.
Однако вследствие токсичности или недостаточной эффективности большинства адъювантов для широкого клинического использования разрешены только соли алюминия и водно-масляная эмульсия MF-59, а в некоторых странах вирусоподобные частицы (VLP - virus-likeparticles) и иммуностимулирующий комплекс (ISCOM - immuno stimulating complex).
В настоящее время на российском рынке представлены две вакцины против гриппа с адъювантами - это вакцина гриппозная инактивированная субъединичная «Совигрипп» и четырехвалентная полимер-субъединичная вакцина «Гриппол®».
Вакцина «Совигрипп» (RU 2446824, 2012) содержит в качестве адъюванта и носителя сополимер 2-метил-5-винилпиридина и N-винил-пирролидона. Способ ее получения предусматривает культивирование вируса гриппа в развивающихся куриных эмбрионах с последующим отделением вируссодержащей аллантоисной жидкости, концентрирование, очистку, инактивацию и расщепление вируса. Концентрирование и очистку осуществляют сорбцией вируса на куриных эритроцитах с последующим ультрацентрифугированием в градиенте плотности сахарозы. Инактивацию и расщепление вируса проводят любыми разрешенными к применению средствами. Расщепленный концентрат вируса центрифугируют и подвергают ультрафильтрации. Полученный концентрат очищенных антигенов каждого штамма вируса гриппа рассматривается как моновакцина. После сведения моновакцин в поливакцину добавляют адъювант - сополимер 2-метил-5-винилпиридина и N-винилпирролидона. Полученная полимерная тривалентная вакцина содержит штаммы вируса гриппа типа А, В при массовом соотношении антиген-адъювант от 1:5 до 1:30.
Недостатком данной вакцины является ограниченность применения трехвалентных инактивированных вакцин против гриппа, для ряда популяционных групп: маленьких детей, беременных, пожилых людей, лиц с различными хроническими заболеваниями, которых относят к группам риска по гриппу, а также в отношении антигенно отличных штаммов (дрейфовых и гетерологичных), не содержащихся в вакцине.
Для повышения эффективности инактивированных вакцин против состав двух линий гриппа В (ямагатской и викторианской), а также добавлять иммуноадъюванты.
Наиболее близкой по технической сущности к заявляемому изобретению является технология получения тетравалентной вакцины «Гриппол®», (chttps://www.rlsnet.ru/tn_index_id_96550.htm), которая содержит антигены вируса гриппа подтипов A (H1N1), A (H3N2), B/Yamagata lineage, B/Victoria lineage, в качестве адъюванта и носителя - производное поли-1,4-этиленпиперазина - Полиоксидоний, а в качестве вспомогательных веществ фосфатно-солевой буферный раствор, тиомерсал, манитол, повидон, тритон Х-100. Способ получения вакцин «Гриппол®» предусматривает культивирование вируса гриппа в развивающихся куриных эмбрионах, получение вирусного концентрата, очистка вирусного концентрата методом ультрацентрифугирования в градиенте плотности сахарозы, инактивация вирусного материала, расщепление вирусного концентрата детергентом, выделение антигенов вируса гриппа, сведение моновалентов в поливалентную вакцину с последующим добавлением адъюванта поли-1,4-этиленпиперазина «Полиоксидоний».
Недостатком данной вакцины является недостаточная эффективность, обусловленная тем, что используемый адъювант недостаточно повышают иммуногенность при добавлении к вакцинам против гриппа, в частности по эффективности она соответствует трехвалентным референсвакцинам по трем совпадающим штаммам, хотя и превосходит их в отношении четвертого штамма - вируса гриппа В, не включенного в трехвалентные аналоги (chttps://www.rlsnet.ru/tn_index_id_96550.htm).
Вместе с тем в настоящее время разработаны новые адъюванты, способные повысить эффективность вакцин. Одними из наиболее перспективных адъювантов являются наночастицы (НЧ), преимуществом которых является то, что они эффективно поглощаются антиген-представляющими клетками. В результате этого, если с НЧ связать антиген, то он будет направленно поглощаться макрофагами, что приведет к усилению иммунного ответа. Среди наночастиц наибольший интерес представляют адъюванты на основе тритерпеноидов бересты, с частности, наночастицы на основе природного пентациклического тритерпенового вещества - бетулина. Его применение (RU 2322091, 2008) в отличии от известных адъювантов обеспечивает наряду с адъювантными свойствами широкий спектр биологической активности, в частности противобактериальное, противогрибковое, противовирусное действия, гепатопротективное, противовоспалительное, противораковое, противоаллергическое, мембраностабилизирующее, иммуномодулирующее, антиоксидантное действие.
В настоящее время бетулин в виде сферических аморфных наночастиц предложено применять в составе моновакцин против гепатита В, дифтерии, вируса ньюкаслской болезни, реовируса птиц, штамма гриппа А/Калифорния/7/09 (H1N1) (RU 2355423, 2009; RU 2546861, 2015; RU 2545714, 2015). Применение его для поливакцин в просмотренной литературе не описано.
Задачей, решаемой авторами, являлось расширение номенклатуры используемых вакцин за счет применения тетравалентных вакцин, характеризующихся большей эффективностью, в частности, обладающих биоцидными, антиоксидантными и иными позитивными свойствами.
Технический результат достигался тем, в технологии получения вакцины, включающей в себя культивирование вирусов гриппа подтипов А (H1N1), A (H3N2), B/Yamagata lineage, B/Victoria lineage в развивающихся куриных эмбрионах с последующим отделением вируссодержащей аллан-тоисной жидкости, концентрирование, очистку, инактивацию и расщепление вируса, его последующее центрифугирование и ультрафильтрацию, сведение моновакцин в поливакцину с добавлением адъюванта, в которой культивирование вирусов проводят раздельно, после ультрафильтрации в каждый из монопрепаратов вводят в качестве адъюванта бетулин в соотношении антиген-носитель в массовом соотношении от 1:1,25 до 1:12,5, а затем монопрепараты объединяют.
Введение бетулина в концентрации менее 1:1,25 не позволяет добиться необходимого уровня иммунного ответа, а его использование в концентрации более 1:12.5 не позволяет улучшить вакцину и ведет к снижению концентрации активного начала и экономически нецелесообразно.
Сущность и преимущества изобретения иллюстрируются следующими примерами.
Пример 1. Для получения тетравалентной субъединичной вакцины против гриппа, содержащей корпускулярный адъювант на основе природного бетулина использовались штаммы вируса гриппа типа A(H1N1), А(Н3Н2), В1 и В2.
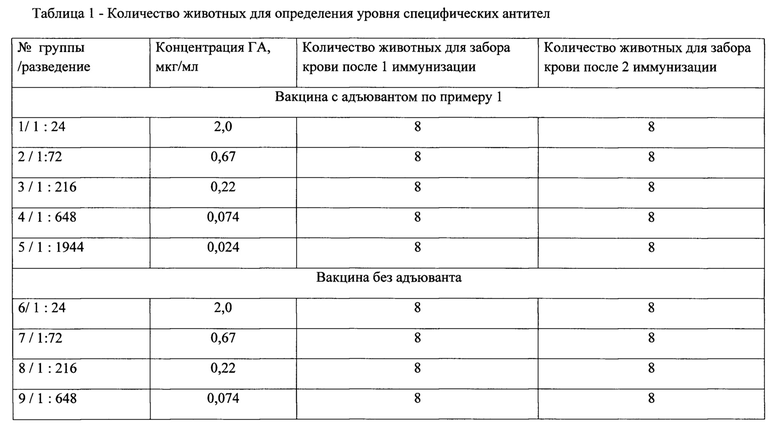
Куриные эмбрионы 10-12-суточного возраста заражали вирусом гриппа в аллантоисную полость. Зараженные эмбрионы помещали в термальную комнату при температуре 32-35°С и влажности (60±10) %. Для штаммов гриппа типа А продолжительность инкубации составляло 48 ч, для штаммов вируса типа В - 72 ч. По окончании инкубации эмбрионы проверяли с помощью овоскопов. Жизнеспособные эмбрионы помещали в холодильную камеру при температуре (4±2)°С на (18±2) ч для охлаждения. Сбор вируссодержащей аллантоисной жидкости (ВАЖ) осуществляли методом слива в бутыль. В бутыли, содержащие 5-6 л вируссодержащей аллантоисной жидкости, добавляли равное количество фосфатного буферного раствора, перемешивали в течение 10 мин на шейкере и проводили микрофильтрацию через каскад фильтрующих элементов с размерами пор соответственно: 2,3; 1,6; 1,2; 0,8; 0,44 мкм. В содержимое бутыли (фильтрат) добавляли раствор бета-пропиолактона до конечной концентрации 0,1%, тщательно перемешивали и оставляли в холодильной камере на шейкере на 17-18 часов. Далее проводили концентрирование и частичную очистку инактивированной ВАЖ: ультрафильтрацию проводили на установке для ультрафильтрации в тангенциальном потоке с 4 кассетными модулями с размером пор 300 кД. Полученный концентрат ВАЖ очищали ультрацентрифугированием в градиенте плотности при помощи двух растворов сахарозы 50% и 20% при скорости вращения ротора 30000 об/мин. Содержимое ротора раскапывали по фракциям объемом 20 мл. После чего титровали в РГА для определения пика вируса и собирали в единый объем с максимальным содержанием гемагглютинина. Для очистки ультрацентифугата концентрата использовали гель-хроматографию на полимерном носителе. Объем носителя для хроматографии определяли из расчета 5 объемов носителя к одному объему пробы. После нанесения концентрата с сахарозой на колонку через насос подавали с трис-буфером. Сбор целевого элюата осуществляли по оптической плотности при длине волны 280 нм. Для инактивации вируса использовали установку, содержащую источник ультрафиолетовых лучей с силой потока ультрафиолетового облучения не менее 90 люменов. Для разрушения инактивированного вирусного концентрата использовали октилглюкозид (Octil-D-Glucopyranoside) в массовом соотношении детергента к суммарному белку 10:1 Инкубацию проводили в течение 1 часа в холодильной камере при температуре от 5±3°С. Далее проводили концентрирование расщепленного вирусного препарата на установке ультрафильтрации с 2 кассетными модулями с диаметром пор 10 кДа. Сконцентрированный расщепленный препарат далее очищали от детергента методом гельфильтрации на хроматографическом носителе на основе агарозы с пределом эксклюзии 150 кД. Собирали элюат в стерильную емкость. Для отделения липопротеинов использовали ультрацентрифугирование при ускорении 90000 g в течение 2 часов при температуре от 2 до 8°С. Центрифугат передавали на стерилизующую фильтрацию через набор фильтров с диаметром пор 0,45 и 0,22 мкм. Полученный полуфабрикат (моновалентная субстанция) контролировали по следующим показателям: стерильность, остаточное содержание детергента, специфическая активность по ОРИД (содержание гемагглютинина), гемагглютинирующая активность, специфическая безопасность, подлинность, белок по методу Лоури с осаждением. После проведения контроля в бутыль-приемник добавляли предварительно приготовленный адъювант-бетулин в массовом соотношении гемагглютинина моновалента-адъювант 1:5 и фосфатно-солевой буферный раствор до рН 6.8. Бутыль тщательно перемешивали и помещали в шейкере в холодильник на 3 часа. Затем бутыли с моновалентной субстанцией и адъювантом хранили в холодильной камере при температуре 4±2°С. Полуфабрикаты четырех различных штаммов вируса гриппа: тип A (H1N1; H3N2) и тип В1 и В2, прошедшие все контроли, объединяли в стерильной бутыли в равном соотношении (1:1:1:1). Полученный объединенный балк помещали в холодильную камеру на +4С и перемешивали на шейкере 2 часа. Затем хранили при той же температуре, и при необходимости подсоединяли к разливочной машине и при использовании дозирующего устройства вели розлив во флаконы, шприцы или ампулы.
Пример 2. Вакцину получали по технологии примера 1 с введением адъюванта при соотношении в массовом соотношении гемагглютинина моновалента-адъювант 1:1.25.
Пример 3. Вакцину получали по технологии примера 1 с введением адъюванта при соотношении в массовом соотношении гемагглютинина моновалента-адъювант 1:12.5
Пример 4. Вакцину получали по технологии примера 1 с введением адъюванта при соотношении в массовом соотношении гемагглютинина адъювант 1:5, причем адъювант вводили после смешения моновакцин.
Пример 5. Изучение безопасности тетравалентной субъединичной вакцины против гриппа, содержащей корпускулярный адъювант на основе природного бетулина в опытах на животных.
Исследование безопасности проводили в тестах острой и хронической токсичности.
При изучении острой токсичности вакцину по примеру 1, адъювант и плацебо вводили животным внутримышечно однократно в дозе эквивалентной курсовой человеческой - 1 мл на животное с массой 20 г (мыши) и 200 г (крысы). Дополнительно мышам вводили вакцину по примеру 1 и плацебо внутривенно в дозе 0,5 мл на животное с массой 20 г.
Определение «хронической» токсичности проводили на двух видах животных: на б/п крысах и морских свинках. Половозрелым б/п крысам вводили вакцину в дозе 8 мкл в течение 10 дней (суммарно 80 мкл), адьювант в дозе 3,2 мкг в течение 10 дней (суммарно 32 мкг) и плацебо. Половозрелым морским свинкам вводили вакцину в дозе 13 мкл в течение 10 дней (суммарно 130 мкл), адьювант в дозе 5,2 мкг в течение 10 дней (суммарно 52 мкг) и плацебо. Препараты вводили в объеме 0,5 мл.
При проведении исследования «острой» и «хронической» токсичности после введения препаратов и раствора плацебо за животными наблюдали в течение 24 суток. Ежедневной регистрации подлежали: гибель животных, их масса, поведение и внешнее состояние, а также наличие клинических симптомов интоксикации. На 11, 17 и 24 сутки исследования животные опытных и контрольной групп были подвергнуты эвтаназии. Проводили полную некропсию тел и макроосмотр органов, гистопатологические исследования.
Для оценки гематологических и биохимических показателей крови проводили забор крови до введения препарата, через 11, 17 и 24 суток у крыс из хвостовой вены, у морских свинок - из сердца.
Результаты исследования показали, что при однократном и многократном введении вакцина не вызывала гибели животных, изменения поведения, снижения двигательной активности, снижения аппетита, изменения волосяного покрова, снижения массы тела, что свидетельствует об отсутствии токсического действия препарата на системы и органы лабораторных животных.
Проведенное макроскопическое и гистопатоморфологическое исследование систем и органов лабораторных животных показало, что введение вакцины и адъюванта не вызывает патологических, в том числе выраженных дистрофических и некробиотических изменений во внутренних органах животных, что свидетельствует об отсутствии токсичности вакцины.
Результаты анализа гематологических и биохимических показателей крови лабораторных животных не выявили существенных различий до введения и после введения вакцины и адьюванта, значения всех показатели крови находились в пределах физиологической нормы для данных видов животных, что подтверждает отсутствие токсического действия препаратов.
Пример 6. Исследование иммуногенности тетравалентной субъединичной вакцины против гриппа.
Иммуногенность определяли по содержанию специфических антител в сыворотке крови животных в отношении каждого антигена, входящего в состав вакцины в сравнении с аналогичным комплексом моновалентов, входящих в ее состав, без адъюванта (далее вакцина без адъюванта). Исследование проводили "in vivo" на мышах линии Balb/c.
Испытуемые препараты вводили однократно и двукратно (по схеме 0-14) внутрибрюшинно по 0,5 мл шприцем вместимостью 1 мл. Аналогично контрольным группам животных вводили раствор адъюванта и натрия хлорид, раствор для инфузий 0,9%. Забор крови осуществляли на 14 день после однократной иммунизации и на 14 день после двукратной иммунизации. Антитела определяли в сыворотках с помощью метода ИФА.
Данные о числе животных, о вакцинах и их дозировке при иммунизации представлены в таблице 1.
Полученные из крови мышей сыворотки (индивидуально от каждого животного) контролировали на наличие антител к каждому моноваленту методом иммуноферментного анализа с использованием экспериментальной тест-системы (ИФТС). При конструировании ИФТС использовались коммерческие реагенты: a/mouse IgG (H+L) Strong Zyme HRP Conjugate (фирмы «SDT», Германия); хромоген - 3,3,5,5-тетраметилбензидин (фирмы «Хема», Россия); в качестве стоп-реагента применялся 5% раствор серной кислоты. Иммуноферментную реакцию выполняли на полистироловых планшетах фирмы Greiner bio-one, Германия. Результаты иммуноферментного анализа регистрировали на спектрофотометре PR 2100 производства фирмы «Sanofi Diagnostiks Pasteur» (Франция) при двух длинах волн 450/620 нм.
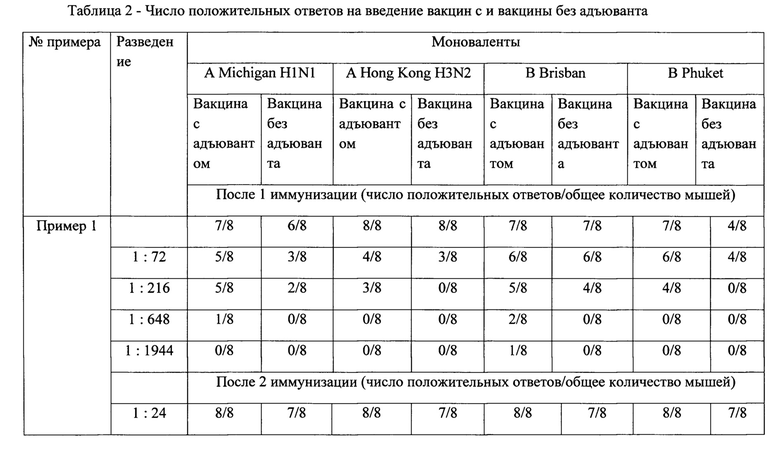
Для расчета иммуногенной активности вакцин вычисляли среднее арифметическое значение оптической плотности (ОП) сывороток мышей группы, которой вводили натрия хлорид раствор 0,9% и адъювант (группы отрицательного контроля). Положительными считали сыворотки, ОП которых равны или выше среднего арифметического ОП сывороток мышей отрицательных контрольных групп плюс коэффициент тест-системы (0,075).
На основании полученных результатов по формуле Кербера рассчитывали величины ED50:
lg ED50=lg DN - s (S Li - 0,5), где
DN - величина максимальной из испытуемых доз;
s - логарифм отношения каждой последующей дозы к предыдущей (логарифм кратности разведения);
Li - отношение числа сероположительных животных к общему числу животных, получивших данную дозу;
S Li - сумма значений Li, найденных для всех доз при контроле.
Далее вычисляли anti lg полученного значения.
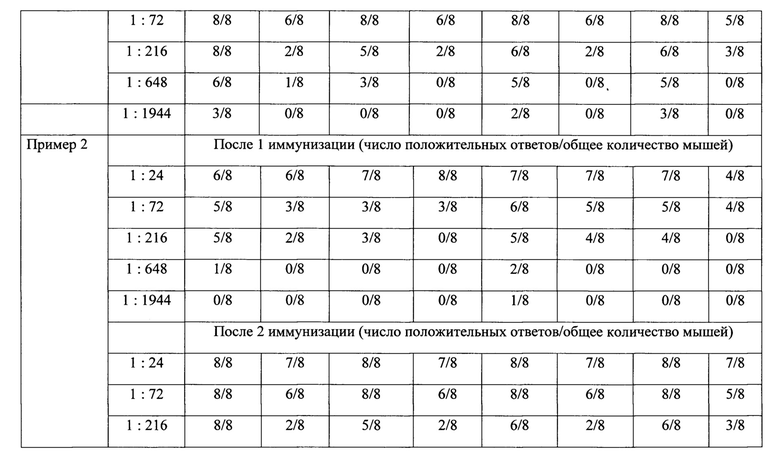
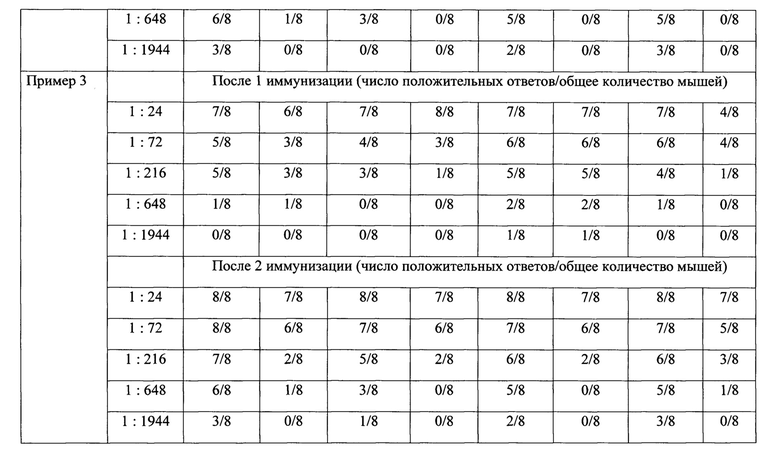
Число положительных ответов на введение вакцин с адъювантом и вакцины без адъюванта представлены в таблице 2.
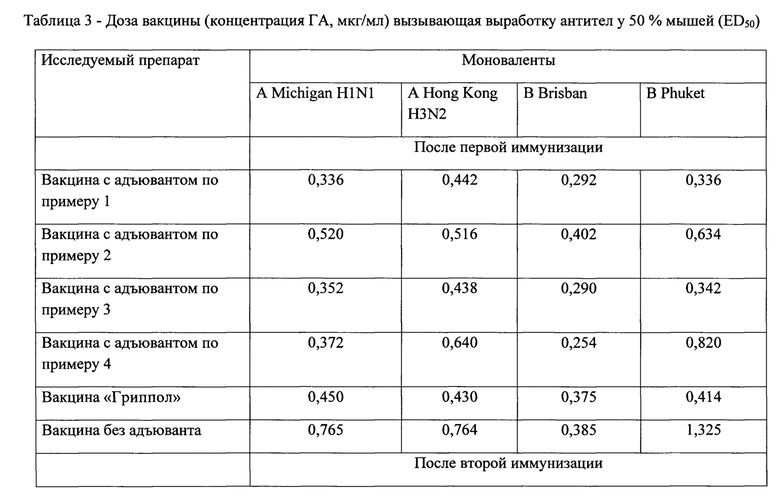
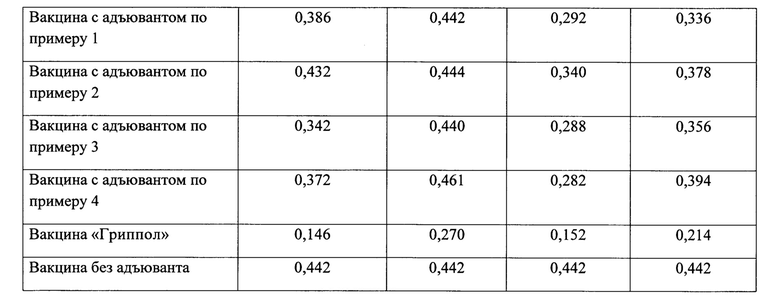
Дозы вакцин (концентрация ГА, мкг/мл) вызывающие выработку антител у 50% мышей (ED50) представлены в таблице 3.
Таким образом, иммунизация животных гриппозными вакцинами способствует нарастанию титра антител, при этом следует отметить, что более выраженным действием обладает препарат, в состав которого входит адъювант-бетулин в массовом соотношении гемагглютинина моновалента-адъювант 1:5.
Пример 7. Изучение антигенной активности тетравалентной субъединичной вакцины против гриппа, содержащей корпускулярный адъювант на основе природного бетулина.
Антигенную активность оценивали по уровню антительного ответа в сыворотках крови мышей после однократной и двукратной иммунизации образцами вакцины в реакции торможения гемагглютинации, которая позволяет определить иммунный ответ на каждый из компонентов вакцины отдельно.
Мышей иммунизировали внутрибрюшинно, вводя объем 250 мкл вакцины или адьюванта.
На 28 день после первой иммунизации у мышей были собраны образцы крови из нижнечелюстной вены. Образцы крови центрифугировали (6000 об/мин в течение 10 мин), сыворотку переносили в пластиковые пробирки типа Эппендорф и хранили при температуре -20°С до момента постановки РТГА. В качестве отрицательного контроля были использованы сыворотки мышей, вакцинированных препаратом плацебо.
Для постановки РТГА сыворотки мышей были обработаны реагентом RDE согласно инструкции производителя (RDE, Receptor destroying enzyme, Denka Seiken, Japan). Для удаления неспецифических агглютининов сыворотки были дополнительно обработаны равным объемом 10% куриных эритроцитов. После осаждения куриных эритроцитов на дно из сывороток были приготовлены серии двукратных разведений в 96-луночных панелях для серологических реакций («Медполимер») в 25 мкл раствора NaCl 0,9%. Затем к разведениям сывороток было добавлено 25 мкл антигена, содержащего 4 ГАЕ (гемагглютинирующие единицы). Сыворотки с антигеном были проинкубированы в течение часа при комнатной температуре, после чего во все лунки было добавлено 50 мкл 0.5% куриных эритроцитов, растворенных в NaCl 0,9%. Максимальное разведение сыворотки, которое полностью инги-бировало гемагглютинацию куриных эритроцитов, принималось за титр сыворотки. РТГА титром являлось значение обратное разведению сыворотки в последней лунки с отсутствием гемагглютинации.
Для представления полученных данных использовали такие показатели описательной статистики, как среднегеометрические титры (СГТ), рассчитанные с помощью компьютерной программы Excel (версия 10). Оценку статистической достоверности различий проводили при помощи компьютерной программы Statistica (версия 6,0) с использованием теста непараметрических критериев Манна-Уитни, используемого для малых биологических выборок, нормальность распределения которых не доказана. Различия считались достоверными при значении р <0,05.
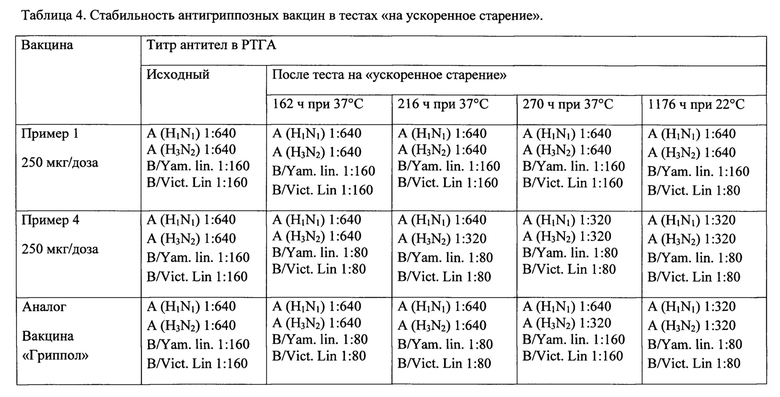
Результаты представлены в таблице 4. В результате исследования было показано, что наиболее выраженная антигенная активность была у H1N1pdm и H3N2 компонентов тетравакцины. Компоненты вируса гриппа В тетравакцины вызывали формирование менее выраженного специфического иммунитета у мышей после двукратной иммунизации. Все животные группы, получавшей адьювант, не имели специфического иммунного ответа к вирусным антигенам, входящим в состав вакцины.
Пример 8. Влияние длительного хранения на иммуногенные вакцинных препаратов были изучены путем оценки антигенной активности и гуморального иммунного ответа (иммуногенность).
При определении антигенной активности вариантов вакцин по примерам 1-3 исследовали образование антител в сыворотках крови животных. Опыты проводились на белых беспородных мышах массой тела 10-12 г. После двукратного с интервалом 7 суток внутрибрюшинного введения вакцины сыворотки иммунизированных мышей исследовались в реакции торможения гемагглютинации (РТГА) с гомологичными антигенами вакцины. Изучение стабильности антигенной активности во время хранения заявленного препарата проводилось методом «ускоренного старения». Образцы заявленных вакцин и ближайшего аналога закладывали на ускоренное хранение при температуре 37°С и 22°С. Показатели антигенной активности заявленной вакцины приведены в табл. 4.
Результаты исследования стабильности антигенной активности показали, что разработанный препарат имеет высокую стабильность, сохраняя показатели, соответствующие требованиям нормативных документов.

| название | год | авторы | номер документа |
|---|---|---|---|
| Пентавалентная субъединичная вакцина против респираторных инфекций и способ ее получения | 2022 |
|
RU2804948C2 |
| ВАКЦИНА ПРОТИВ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2446824C2 |
| Способ повышения противоопухолевой резистентности, антиоксидантного и иммуностимулирующего воздействия на организм | 2019 |
|
RU2755638C2 |
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| ВАКЦИНА ГРИППОЗНАЯ ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2584594C1 |
| РЕАССОРТАНТ ReM8 - ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А ПОДТИПА Н1N1 | 2011 |
|
RU2457245C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2003 |
|
RU2330885C2 |
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ПРОТИВ ГРИППА | 2009 |
|
RU2423995C1 |
| ВАКЦИНА ПРОТИВ ГРИППА | 2014 |
|
RU2546861C1 |
Изобретение относится к медицинской биотехнологии, в частности к способу получения гриппозной вакцины. Способ получения тетравалентной субъединичной противогриппозной вакцины включает культивирование вирусов гриппа подтипов A (H1N1), A (H3N2), B/Yamagata lineage, B/Victoria lineage в развивающихся куриных эмбрионах с последующим отделением вируссодержащей аллантоисной жидкости, концентрирование, очистку, инактивацию и расщепление вируса, его последующее центрифугирование и ультрафильтрацию, сведение моновакцин в поливакцину с добавлением адъюванта, в котором культивирование вирусов проводят раздельно, а после ультрафильтрации в каждый из монопрепаратов вводят в качестве адъюванта бетулин в соотношении антиген:носитель 1:1,25-12,5. Использование данного изобретения обеспечивает получение стабильной и эффективной тетравалентной субъединичной противогриппозной вакцины при включении в качестве адъюванта бетулина в массовом соотношении антиген:носитель 1:1,25-12,5. 4 табл., 8 пр.
Способ получения тетравалентной субъединичной противогриппозной вакцины, включающий культивирование вирусов гриппа подтипов A (H1N1), A (H3N2), B/Yamagata lineage, B/Victoria lineage в развивающихся куриных эмбрионах с последующим отделением вируссодержащей аллантоисной жидкости, концентрирование, очистку, инактивацию и расщепление вируса, его последующее центрифугирование и ультрафильтрацию, сведение моновакцин в поливакцину с добавлением адъюванта, отличающийся тем, что культивирование вирусов проводят раздельно, а после ультрафильтрации в каждый из монопрепаратов вводят в качестве адъюванта бетулин в массовом соотношении антиген:носитель 1:1,25-12,5.
| ВАКЦИНА ГРИППОЗНАЯ ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2584594C1 |
| ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2164148C1 |
| ВАКЦИНА ПРОТИВ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2446824C2 |
| ВАКЦИНА ПРОТИВ ГРИППА | 2014 |
|
RU2546861C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДЪЮВАНТА ДЛЯ ВАКЦИН | 2014 |
|
RU2545717C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДЪЮВАНТА ДЛЯ ВИРУСНЫХ ВАКЦИН | 2014 |
|
RU2545714C1 |
| АДЪЮВАНТ | 2007 |
|
RU2355423C1 |
| WO 2010092479 A2, 19.08.2010 | |||
| US 0010016495 B2, 10.07.2018. | |||
Авторы
Даты
2021-01-20—Публикация
2019-08-28—Подача