Изобретение относится к медицине и касается применения соединений полианилина в качестве сорбента для удаления вирусов, белков невирусной природы и в качестве матрицы для получения иммуносорбента и может быть использовано в диагностических целях, для дезактивации и удаления вирусов из окружающей среды.
Широкое распространение вредных, токсических для людей веществ, патогенных микроорганизмов, в том числе и вирусов, ставит вопрос о дезактивации и удалении их из окружающей среды. Известно, что для удаления вирусов из растворов существует два методических подхода -ультрацентрифугирование или связывание их с помощью сорбентов.
Иммуносорбция - извлечение антител или антигенов из сложных смесей с помощью иммуносорбентов, основанное на реакции антиген-антитело («Энциклопедический словарь медицинских терминов». М., «Советская энциклопедия», 1982, т.1, с.409). При такой технологии органические полимеры или неорганические материалы применяют в качестве матрицы для приготовления иммуносорбентов, представляющих собой комплексы сорбентов с антигеном или антителами, которые используются для извлечения соответственно антител или антигенов из сложных смесей. Известны матрицы для приготовления иммуносорбентов на основе целлюлозы (Гурвич А.Е. Использование целлюлозных матриц в иммунохимии. В кн: «Иммуносорбенты и их использование в биотехнологии», М., 1987, стр.5-22). Предложены иммуносорбенты на основе вермикулита (природных соединений кремния) или смеси вермикулита с магнитным порошком (RU 2192013, G01N 33/531).
С помощью иммуносорбции можно выделять и выявлять специфические антитела, например, к вирусам. В частности, для выявления антител к вирусу гепатита С в качестве матрицы (носителя) предложен полистирол с фиксированным (иммобилизованным) на нем вирусспецифическим рекомбинантным белком или синтетическим пептидом (RU 2095815, G01N 33/543, RU 2138286, G01N 33/53). Эти иммуносорбенты ограничены в использовании, т.к. решают узкоспециализированную задачу, предназначены лишь для совершенствования диагностики вирусного гепатита С и осуществляются на хорошо известных материалах, применяемых для диагностических целей.
Классическим методом получения (выделения) антител к вирусу гриппа с помощью иммуносорбции является применение куриных эритроцитов с адсорбированными на них вирусом (Ровнова З.И. Получение специфических противогриппозных сывороток «Вопр. вирусологии», 1959, №4, стр.465-470) Известен иммуносорбент на основе BaSO4 для выделения противогриппозных антител. С этой целью сухой поршок BaSO4 при 4°С в течение 1 ч инкубируют с вируссодержащей жидкостью, из расчета 1 г BaSO4 на начальную концентрацию вируса гриппа - миллион гемагглютинирующих единиц (ГЕ) или 1000 ГЕ на 1 мг (Закстельская Л.Я, Шендерович С.Ф. Использование иммуносорбента для удаления противогриппозных антител из диагностических сывороток. «Лабораторное дело», 1979, №12, стр.748-749).
Для сорбции специфических противогриппозных антител из иммунных сывороток предложены углеродсодержащие иммуносорбенты. С этой целью ультрадисперсный Z-расщепленный графит с частицами 20-100 нм инкубировали с жидкостями, содержащими вирусы гриппа А и В человека (Курочкина Я.Е. и др. «Метод очистки воды и растворов, контаминированных вирусами гриппа, с использованием углеродсодержащих сорбентов» // Материалы IX съезда всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов, М., 2007, т.1, стр.247-248).
Иммуносорбцию можно применять и для выделения вирусов с определенной антигенной структурой. Такие подходы требуют предварительной иммобилизации специфических антител на сорбент. Известен способ иммуносорбции для выделения вирусов гриппа с определенной антигенной структурой поверхностных белков. В качестве матрицы для приготовления иммуносорбента предложен сорбент, приготовленный в виде гранул из криогеля поливинилового спирта, с иммобилизированными (фиксированными) на нем вирусоспецифическими антителами (Плиева Ф.М., Исаева Е.И., Лозинский В.И. Применение криогелей поливинилового спирта в биотехнологии. VI. Биоафинные собренты на основе сверхмакропористого носителя для работы с вирусными частицами, «Биотехнология»,1998, №5, стр.32-37).
Известна разработка, в которой для элюции и концентрирования вируса гриппа птиц используют магноиммуносорбенты, матрицей которых является твердая магнитная основа с иммобилизованными (фиксированными) гомологичными антителами. Созданная для этих целей установка позволяет проводить мониторинг открытых водных объектов на наличие патогена (И.В.Левченко, В.И.Ефременко, Д.К.Львов и др. Разработка магноиммуносорбентных тест-систем и установка для селективного концентрирования для выявления вирусов гриппа птиц // Материалы IX съезда всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов, М., 2007, т.1, стр.248-249).
Как известно, элюцию вирусов из растворов можно проводить не только с помощью иммуносорбции. Одним из первых органических сорбентов для связывания (агглютинации) вирусов гриппа были формализированные куриные эритроциты. Этот классический метод требует поддерживания специфического температурного режима, т.к. в противном случае происходит диссоциация комплексов эритроцитов с вирусами, и вирионы выходят в раствор. Последнее свойство активно использовалось при выделении вируса гриппа из раствора с последующим получением очищенных элюатов.
Использование в качестве сорбента полипиррола в виде мембран позволяет удалять из водных растворов ряд вирусов животных, включающих полиовирусы, коксаки, эхо и другие энтеровирусы, вирусы рео, рота и гепатита А (патент США 6156202, заявка от 1999-03-30, Conducting polymer membrane and a process for the preparation of the same memdrane S.Chandra, R.Singh, H.Singh, A.K.Narula, S.Broor).
Известно применение для адсорбции вирусов различных модификаций углеродсодержащих материалов, например активированного угля. В работе Clark K.J, Sarr A.B et al. Vet. Microbiol. 1998, v.63(2-4), p.137-146 глина или древесный уголь использовались как сорбенты для рота- и коронавирусов коров, вызывающих гастроэнтериты у млекопитающих и птиц. С помощью угольного сорбента можно удалить из растворов энтеровирусы (полиовирус типа 2) (Zadorozhnaia V. I. «Mikrobiol. J»., 1996, v.58(3), p.83-87). В патенте RU 2237022, C02F 1/28, C02F 1/50, опубл. 27.09.2004, приоритет США от 20.05.1999 предложен угольный сорбент, представляющий собой частицы активированного угля, способный удалять из воды вирусы бактерий, например бактериофаги MS-2, имеющие размер от 25 нм. Следует отметить, что в зависимости от состава и способа получения активированных углей наблюдается широкий диапазон их сорбционных свойств, в частности распределения пор по размерам и величины удельной поверхности. Известен способ удаления вирусов гриппа А и В человека с помощью ультрадисперсного Z-расщепленного графита, полученного из модифицированного графита путем гидротермической обработки. Авторы разработки предлагают использовать этот метод для очистки водоемов (Курочкина Я.Е. и др. «Метод очистки воды и растворов, контаминированных вирусами гриппа, с использованием углеродсодержащих сорбентов» // Материалы IX съезда всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов, М., 2007, т.1, стр.247-248).
В патенте США 7018538, опубликованном 28.03.2006, приводятся данные по получению препаратов ДНК из лизата бактерий Escherichia coli. Лизат наносили на хроматографическую колонку, наполненную носителями (стеклянными шариками или дисками, покрытыми полианилином или его производными). Образцы, содержащие ДНК, выходили из колонки в первых фракциях после элюции ТЕ-буфером. Степень очистки ДНК проверялась электрофоретически в агарозном геле. О сорбции и элюции белков из лизата Е.coli не сообщалась.
Предлагаемое изобретение решает задачу увеличения сорбционной способности сорбента к веществам белковой природы, к вирусам, обладающим наружной белковой оболочкой, с различными антигенными свойствами, получения иммуносорбента на его основе для выделения специфических противовирусных антител, упрощения и расширения условий сорбции вирусов, а также получения возможности иметь сорбент, фактуру которого можно изменять в зависимости от предполагаемого применения (порошок или пленка).
Это достигается за счет использования в качестве сорбента полианилина: или основания эмеральдина (т.е. основной полуокисленной формы полианилина) формулы
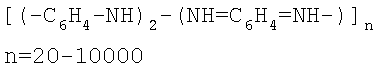
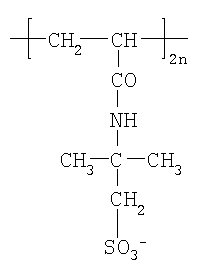
или солевой формы полуокисленного полианилина и поли-(2-акриламидо-2-метил-1-пропан-сульфоновой кислоты формулы
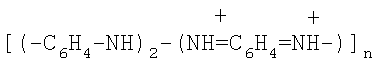
n=50-50000
Выбор полианилина был обусловлен тем, что он является синтетическим полимером с известной структурой, химическим составом и изученными физико-химическими свойствами. Химическая структура полианилина включает химические функциональные группы различной природы, обеспечивающие их взаимодействие с гидрофобными и гидрофильными участками антигенов. Наличие этих групп в составе полианилина обеспечивает их сорбционную способность к белкам.
Сущность изобретения заключается в использовании основания эмеральдина (т.е. основной полуокисленной формы полианилина) (ПАН-О) или солевой формы полуокисленного полианилина и поли-(2-акриламидо-2-метил-1-пропан-сульфоновой кислоты формулы (ПАН-С) в качестве сорбента для удаления вирусов, белков невирусной природы и в качестве матрицы для получения иммуносорбента для выделения специфических противовирусных антител.
ПАН-О получают по методике, описанной в работе Cao Y., Andreatta A., Heeger A.J., Smith P. Influence of chemical polymerization conditios on the properties ofpolyaniline, «Polymer», 1989, V.30, N.12, p.2305-2311. ПАН-С - по методике, описанной в работе Иванов В.Ф., Грибкова О.Л., Чеберяко К.В., Некрасов А.А., Тверской В.А., Ванников А.В. Матричный синтез полианилина в присутствии поли-(2-акриламидо-2-метил-1-пропан)-сульфоновой кислоты, «Электрохимия», 2004, т.40, №3, стр.339-345.
ПАН-О представляет собой порошок, нерастворимый в воде.
Солевая форма ПАН-С растворима в воде и в водно-органических смесях при определенных условиях. Растворы представляют собой гомогенные высокодисперсные системы, вплоть до молекулярно-дисперсных, стабильные в течение длительного времени. Данные атомной силовой микроскопии свидетельствуют о формировании интерполимерных комплексов поли-(2-акриламидо-2-метил-1-пропан-сульфоновой кислоты (ПАМПСК) длиной до 50-300 нм и диаметром 20-40 нм. Кроме того, обнаружены линейные ассоциаты этих комплексов длиной до 1500 нм (O.L.Gribkova, G.B.Meshkov, V.F.Ivanov, A.A.Isakova, A.A.Nekrasov, A.V.Vannikov, I.V.Yaminsky, Nanoobjects of interpolymer complexes of polyaniline and PAMPSA in aqueous solutions, J. Phys.: Conf. Ser. 61 (2007) 359-363). ПАН-О и ПАН-С могут быть использованы в виде порошка или в виде пленок, что расширяет возможности использования этих сорбентов. Они отличаются методом и временем синтеза, степенью упорядоченности полимерных звеньев. Оба соединения были использованы в дальнейшем для связывания вирусных частиц и других белков из различных жидкостей.
В данной работе представлены данные по изучению условий сорбции и десорбции вирусов гриппа А и В с предлагаемыми сорбентами, сорбции белков невирусной природы, а также противогриппозных антител из иммунных сывороток с помощью иммуносорбента, матрицей которых служат предлагаемые сорбенты.
Вирусы
Известно, что вирусы животных и птиц имеют множество отличий между собой. Это касается как размеров вирионов, их геномов, состава и свойств вирионных белков, в том числе и поверхностных (Гайдамович С.Я. Классификация вирусов. В кн.: «Общая и частная вирусология». М., Медицина, 1982, стр.26-60). Вирусы семейства ортомиксовирусов (вирусы гриппа), парамиксовирусов, тоговирусов (например, флавивирусы) имеют внешнюю оболочку. Наличие в составе внешней оболочки гликопротеидов обусловливает способность их сорбироваться на эритроцитах животных.
В качестве представителей вирусов, имеющих внешнюю оболочку, для выявления сорбционных свойств предлагаемых полианилинов и для приготовления иммуносорбентов были взяты эталонные и эпидемические штаммы вируса гриппа A (H1N1, H3N2) и В, изолированные в период 1977-2007 гг., обладающие различной структурой поверхностных белков и соответственно свойствами. Вирусы культивировали в различных системах (куриные эмбрионы, клетки культуры ткани MDCK). В работе использовались также очищенные в градиенте концентрации сахарозы 10-50% и концентрированные аллантоисные вирусы.
Методы
Определения: 1) вирусов в растворе проводили с помощью реакции гемагглютинирующей активности (РГА); 2) антител в сыворотках - реакции торможения гемагглютинирующей активности (РТГА) с использованием 0,75% взвеси эритроцитов человека 0 (1) группой крови; 3) наличие белка в препаратах определялось при электрофорезе образцов в полиакриламидном геле по методу Laemmli U.K. (Cleavage of structural proteins of the head ofbacteriophage T4, «Nature» 1970, v.227, p.680-685).
В исследованиях с сорбентом на разных стадиях использовали шейкер (Shaker PSU 2T plus) и настольную низкоскоростную центрифугу (Comb spin).
Пример 1. Получение сорбента ПАН-О.
Химический синтез полианилина проводили при комнатной температуре, добавляя 0,11 М раствора персульфата аммония в 0,22 М раствор солянокислого анилина в 2 М соляной кислоте при перемешивании. Молярное соотношение анилина и окислителя составляло 2:1 (Сао Y., Andreatta A., Heeger A.J., Smith P. Influence of chemical polymerization conditios on the properties ofpolyaniline, «Polymer», 1989, V.30, N.12, p.2305-2311). Осадок отфильтровывали, промывали дистиллированной водой, ацетонитрилом и этанолом, а затем сушили под вакуумом. Полученную соль эмеральдина переводили в основание путем обработки в 15%-ном водном растворе аммиака в течение часа. Осадок отфильтровывали и сушили под вакуумом.
Пример 2. Получение сорбента ПАН-С.
Химический синтез ПАН-С проводили при комнатной температуре при последовательном смешивании водных растворов ПАМПСК, анилина и персульфата аммония. Соотношение ПАМПСК и анилина составляло 1:1 моль-звено/моль, а анилина и окислителя - 2:1 моль/моль. Концентрации анилина и ПАМПСК в реакционной смеси - 0,04 М (Иванов В.Ф., Грибкова О.Л., Чеберяко К.В., Некрасов А.А., Тверской В.А., Ванников А.В. "Матричный синтез полианилина в присутствии поли-(2-акриламидо-2-метил-1-пропан-сульфоновой кислоты)", Электрохимия, 2004, т.40, №3 стр.339-345). Полученный ПАН-С осаждали диоксаном и сушили под вакуумом.
3. Сорбции вирусов гриппа на сорбенты.
Сорбенты в опытах использованы в виде порошка или в виде пленок. Для определения оптимального соотношения массы сорбентов в виде порошка к постоянному объему раствора вируса V=200 мкл проведены исследования, в которых масса сорбента варьировалась от 5 до 50 мг. Как показали исследования, сорбция вирусов происходила интенсивно при навесках сорбента при выбранных массах сорбентов, поэтому в дальнейшем все исследования были проведены на навеске 5 мг.
Процедура сорбции вирусов была следующая. Приготовленный сорбент добавляли к вируссодержащему раствору. Для активного контакта вируса с сорбентом реакционную смесь помещали на шейкер. После контакта вируса с сорбентом смесь центрифугировали при 2000 тыс. об/мин в течение 4 мин, надосадочную жидкость исследовали на наличие вируса в РГА. Осадок, содержащий сорбент с иммобилизованным вирусом, исследовали в экспериментах по десорбции вируса, а также по сорбции антител на иммуносорбент. Сорбция вирусов изучалась в зависимости от сорбентов, антигенной вирусов гриппа А и В, а также от разных условий эксперимента.
Исследование сорбции разных штаммов вирусов гриппа А и В на любой из сорбентов (ПАН-О или ПАН-С) представлено в табл.1. Показано, что все вирусы успешно взаимодействовали с сорбентом при разных условиях независимо от антигенных свойств поверхностных белков. Вирусы гриппа А и В сорбировались на сорбент из любой вируссодержащей жидкости: из буферных растворов (Трис-HCl-буфера с pH 7.2-STE, физиологическом раствора - ФР), аллантоисной жидкости куриных эмбрионов как неразведенной, так и разведенной в ФР, культуральной жидкости (клетки культуры ткани MDCK). В опытах навески сорбента варьировались от 5 до 50 мг при постоянном объеме вируссодержащей жидкости V=200 мкл. Начальные титры вирусов, исследуемых в данном эксперименте, в пересчете на 1 мг сорбента находились в диапазоне от 10 до 400 гемагглютинирующих единиц (ГЕ). Конечные титры в пересчете на 1 мг сорбента варьировались от меньше 2 до 10 ГЕ. Падение гемагглютинирующего титра вирусов гриппа, содержащихся в растворе после сорбции, происходило в 8 - 256 раз, в зависимости от начальной концентрации вирусов. Аналогичные результаты были получены и при использовании предложенных сорбентов в виде пленок.
Было проанализировано влияние температур на сорбцию вирусов. Полученные данные свидетельствовали, что адсорбция вирусов с любым из сорбентов происходила одинаково интенсивно в диапазоне температур от 4 до 37°С. Результаты опытов с ПАН-С представлены в табл.2.
Для определения оптимального времени контакта вирус-сорбент были проведены исследования влияния длительности взаимодействия вируса с сорбентом на сорбцию вирусов. Результаты исследования показали, что сорбция вирусов гриппа на любой из сорбентов происходила практически одинаково в диапазоне времени от 15 до 120 мин. В табл.2 представлены результаты опытов с ПАН-С при различном времени сорбции.
Таким образом, сорбционные свойства предлагаемых сорбентов были одинаковы для различных штаммов вируса гриппа и имели общую закономерность в выбранных условиях опыта.
4. Десорбция вируса с иммуносорбента.
Как известно, иммуносорбент - это вещество с сорбированными на нем антигенами или антителами, используемое для извлечения соответственно антител или антигенов из сложных смесей. Особый интерес представляло определить, насколько стабильно связан вирус с иммуносорбентом, приготовленным на основе ПАН-О или ПАН-С. Для этого мы исследовали десорбцию вируса с иммуносорбентов в два раствора буфер STE и ФР. Иммуносорбенты смешивали с растворами и инкубировали при 4, 22 и 37°С в течение 1, 24, 48 ч. Затем иммуносорбенты осаждали и центрифугировали в течение 5 мин. Надосадочную жидкость исследовали на наличие вируса в РГА. Десорбция вируса с иммуносорбентов была исследована на аллантоисных вирусах и после их очистки при ультрацентрифугировании (табл.3). Таким образом, было установлено, что десорбция вирусов с поверхности обоих сорбентов не происходит в выбранных температурных и времененных режимах.
5. Взаимодействие иммуносорбента с антителами (иммуносорбция).
Для определения, сохраняется ли антигенная активность вирионных поверхностных белков, в частности наиболее важного - гемагглютинина, в иммобилизованном на сорбенте вируса, мы провели исследования взаимодействия сорбированных вирусов А/Сичуань/2/87 A(H3N2) и В/Малазия/2506/04 с антителами из иммунных сывороток, полученных к этим вирусам. Приготовленные иммуносорбенты смешивали с раствором иммунной сыворотки, содержащей гомологичные антитела к этому вирусу. Смесь ставили на контакт в различных температурных и временных условиях, затем центрифугировали. Надосадочную жидкость исследовали на наличие антител в растворе в РТГА. Анализ раствора сыворотки до и после взаимодействия с иммуносорбентом показал, что титры сыворотки существенно снижались при использовании любого из предложенных иммуносорбентов. Связывание антител происходило при использовании любого из иммуносорбентов при различных температурных и временных условиях. В табл.4 приведены результаты, полученные при температуре 4°С.
6. Сушка вирусов на сорбенте.
Особый интерес представляло установить возможность сохранения иммуносорбента в течение длительного времени. С этой целью был применен метод лиофилизации вирусных препаратов, широко используемый в вирусологии и позволяющий сохранять вирусы гриппа в течение многих лет.
Для определения влияния лиофилизации на свойства вирусов, соединенных с порошком полианилина, этот комплекс лиофилизировали в ампулах при стандартных условиях лиофилизации вирусов гриппа. После различных сроков хранения (несколько месяцев) полученный препарат исследовали на активность вирусов в РТГА. Для этого лиофилизированный иммуносорбент инкубировали с иммунной сывороткой при температуре 4°С в течение 18 ч и затем образовавшийся комплекс центрифугировали. Титр сыворотки в надосадочной жидкости снизился в 4 раза, что свидетельствует о взаимодействие вируса, входящего в иммуносорбент с антителами. Эти данные свидетельствуют также о сохранении антигенных свойств вирусов в комплексе с порошком полианилина обоих сорбентов ПАН-О и ПАН-С после лиофилизации.
7. Взаимодействие сорбентов с белками невирусной природы.
Представлялось важным исследовать сорбцию на сорбенты ПАН-О и ПАН-С белков невирусной природы: 1% бычьего сывороточного альбумина, который широко используется в вирусологии в иммунологических реакциях, белков иммунных сывороток, белков аллантоисной жидкости. Поэтому мы провели сорбцию этих белков на сорбенты при Т=22°С в течение 30 мин. После центрифугирования комплекса (сорбент + белки) количество несорбированного белка в надосадочной жидкости оценивались качественно по наличию белковых полос в ПАГ и сравнению их с белковыми полосами в препаратах до сорбции на ПАН-О и ПАН-С. Широко используемый для оценки концентрации белка в растворах метод Лоури не мог быть использован в случае применения сорбентов ПАН-О или ПАН-С (Lowry O.K., Roenbrough N.J. Faff N.J, Randal R.J. Protein measurement with folin reagent. «J.Biol.Chem.», 1951, том 193, стр.265-267).
Дело в том, что часть частиц сорбентов была столь мала, что они не осаждались при центрифугировании до 10000 об/мин и присутствовали в тестовых растворах, создавая неспецифическое окрашивание. Анализ биологических материалов при электрофорезе в полиакриамидном геле до и после сорбции на сорбенты ПАН-О или ПАН-С показал, что 1% бычий сывороточный альбумин садится примерно на 70%, аллантоисные белки иммобилизуются полностью, белки иммунной сыворотки сорбируются примерно 90%. На фиг.1 и 2 приведены данные по электрофорезу альбумина и сывороточных белков.
Таким образом, предлагаемые сорбенты - приготовленный двумя способами полианилин (основание и соль) - способны в широком диапазоне температур в короткое время сорбировать на себя оболочечные вирусы, в качестве которых использовали вирусы гриппа. Вирусы гриппа А и В, независимо от их антигенной структуры, степени их очистки и способа культивирования, с помощью предлагаемых сорбентов могут быть удалены из вируссодержащих жидкостей. При этом иммобилизованные вирусы сохраняли возможность соединяться со специфическими антителами, содержащимися в иммунных сыворотках, даже спустя несколько месяцев после лиофилизации. Эти сорбенты можно также использовать для других вирусов. Полученные данные указывают на широкий спектр белковых материалов, которые могут быть удалены из различных биологических жидкостей с помощью предложенных образцов полианилина, приготовленных разными методами. Это специфические противовирусные антитела и белки невирусной природы: белки аллантоисной жидкости, белки иммунной сыворотки, в том числе альбумин.
Эти сорбенты могут быть применены для обеззараживания жидкостей. В последние годы участились случаи передачи вируса гриппа А от птиц к людям в районах близкого контакта птиц с человеком, предлагаемое изобретение можно использовать для удаления вирусов из резервуаров, зараженных вирусами гриппа птиц. Полученные иммуносорбенты на основе предложенных полианилинов можно применить для определения спектра антител в иммунных сыворотках при диагностических исследованиях. Совокупность выявленных адсорбционных свойств препаратов полианилина с уникальными физико-химическими свойствами (проводимостью, электрохромизмом, инертностью), экономичностью (дешевизной сырья), позволяет приступить к разработкам детекторов на вирусы или комплексов вирусов с антителами для экспресс-диагностики вирусных инфекций. Заявленное соединение в качестве сорбента пригодно не только для удаления оболочечных вирусов (например, вирусов гриппа А и В), но и других вирусов, например вируса полиомиелита, бактериофага.
Иммунная сыворотка к вирусу гриппа
| название | год | авторы | номер документа |
|---|---|---|---|
| СОРБЕНТ, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ НАНОАЛМАЗНЫЙ МАТЕРИАЛ (ВАРИАНТЫ), СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ. | 2013 |
|
RU2569510C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСОРБЕНТА ДЛЯ СВЯЗЫВАНИЯ ВИРУССПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2007 |
|
RU2329505C1 |
| РЕАССОРТАНТ ReM8 - ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А ПОДТИПА Н1N1 | 2011 |
|
RU2457245C1 |
| СПОСОБ КОНЦЕНТРИРОВАНИЯ ВИРУСА | 1997 |
|
RU2130069C1 |
| РЕАССОРТАНТНЫЙ ШТАММ ВИРУСА ГРИППА RN 1/09-SWINE A(H7N1) ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К НЕЙРАМИНИДАЗЕ ПРИ ГРИППОЗНОЙ ИНФЕКЦИИ И ВАКЦИНАЦИИ | 2010 |
|
RU2428476C1 |
| РЕКОМБИНАНТНАЯ ПРОТИВОГРИППОЗНАЯ ВАКЦИНА С ШИРОКИМ СПЕКТРОМ ЗАЩИТЫ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2017 |
|
RU2757013C2 |
| ВАКЦИНА ПРОТИВ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2446824C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ | 2005 |
|
RU2308289C2 |
| ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А(Н3N2)-А/8/Perth/16/2009 ДЛЯ ПРОИЗВОДСТВА ИНАКТИВИРОВАННОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2010 |
|
RU2458124C2 |
| Способ оценки репродуктивной активности вирусов гриппа в составе тривалентной и квадривалентной живой гриппозной вакцины | 2019 |
|
RU2735293C1 |


Описан полианилин в виде основания эмеральдина формулы
n=20-10000
или интерполимерного комплекса полианилина с поли-(2-акриламидо-2-метил-1-пропан-сульфоновой кислотой), т.е. соли эмеральдина с поли-2-акриламидо-2-метил-1-пропансульфоновой кислотой формулы
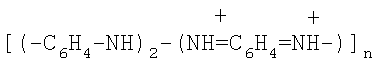
n=50-50000
в качестве сорбента для удаления вирусов, белков невирусной природы и для получения иммуносорбента на его основе для выделения противовирусных антител. Также описаны следующие способы: способ удаления вирусов посредством иммобилизации их на сорбенте; способ иммуносорбции; способ сорбция белков невирусной природа из сложных смесей с помощью сорбента. 4 н. и 16 з.п. ф-лы, 4 табл., 2 ил.
1. Полианилин в виде основания эмеральдина формулы
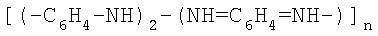
n=20-10000
или интерполимерного комплекса полианилина с поли-(2-акриламидо-2-метил-1-пропан-сульфоновой кислотой), т.е. соли эмеральдина с поли-2-акриламидо-2-метил-1-пропансульфоновой кислотой формулы

n=50-50000
в качестве сорбента для удаления вирусов, белков невирусной природы и для получения иммуносорбента на его основе для выделения противовирусных антител.
2. Способ удаления вирусов посредством иммобилизации их на сорбенте, включающий инкубацию его с вируссодержащей жидкостью при определенных температурных и временных условиях, отличающийся тем, что сорбция проводится с помощью любого из сорбентов по п.1.
3. Способ по п.2, отличающийся тем, что жидкость содержит вирусы, имеющие наружную оболочку.
4. Способ по п.2, отличающийся тем, что жидкость содержит вирусы гриппа.
5. Способ по п.2, отличающийся тем, что жидкость содержит вирусы гриппа A (H1N1).
6. Способ по п.2, отличающийся тем, что жидкость содержит вирусы гриппа A (H3N2).
7. Способ по п.2, отличающийся тем, что жидкость содержит вирусы гриппа В.
8. Способ по любому из пп.3-7, отличающийся тем, что сорбция проводится при температуре 4-37°С в течение 15 и более минут.
9. Способ по любому из пп.3-7, отличающийся тем, что сорбция проводится при перемешивании.
10. Способ иммуносорбции, включающий в себя смешивание раствора, содержащего специфические антитела, и сорбента с фиксированным на нем антигеном, инкубацию при определенных температурных и временных режимах, центрифугирование, отличающийся тем, что для выделения специфических антител используют любой из полученных при осуществлении способа по п.2 сорбентов с фиксированными на нем вирусами.
11. Способ по п.10, отличающийся тем, что для извлечения из смесей специфических антител к вирусу используют любой из сорбентов с фиксированными на нем вирусами, полученных при осуществлении способа по п.3.
12. Способ по п.10, отличающийся тем, что для извлечения специфических антител к вирусу гриппа из сложных смесей используют любой из сорбентов с фиксированными на нем вирусами, полученных при осуществлении способа по п.4.
13. Способ по п.10, отличающийся тем, что для извлечения специфических антител к вирусу гриппа A (H1N1) из сложных смесей используют любой из сорбентов с фиксированными на нем вирусами, полученных при осуществлении способа по п.5.
14. Способ по п.10, отличающийся тем, что для извлечения специфических антител к вирусу гриппа A (H3N2) из сложных смесей используют любой из сорбентов с фиксированными на нем вирусами, полученных при осуществлении способа по п.6.
15. Способ по п.10, отличающийся тем, что для извлечения специфических антител к вирусу гриппа В из сложных смесей используют любой из сорбентов с фиксированными на нем вирусами, полученных при осуществлении способа по п.7.
16. Способ по любому из пп.11-15, отличающийся тем, что для выделения специфических антител инкубацию проводят в течение 16 ч при 4°С.
17. Способ сорбции белков невирусной природы из сложных смесей с помощью сорбента, отличающийся тем, что иммобилизация проводится с помощью любого из сорбентов по п.1.
18. Способ по п.17, отличающийся тем, что из смесей удаляют белки иммунной сыворотки, в том числе альбумин.
19. Способ по п.17, отличающийся тем, что из смесей удаляют альбумин.
20. Способ по п.17, отличающийся тем, что из смесей удаляют белки аллантоисной жидкости куриных эмбрионов.
| US 7018538 В2, 28.03.2006 | |||
| US 5776370 А, 07.07.1998 | |||
| US 6156202 А, 05.12.2000 | |||
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСОРБЕНТА ДЛЯ ДИАГНОСТИКИ ВИРУСНОГО ГЕПАТИТА С | 1994 |
|
RU2095815C1 |
| ИММУНОСОРБЕНТ ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К ЯДЕРНОМУ БЕЛКУ ВИРУСА ГЕПАТИТА С В СЫВОРОТКЕ КРОВИ | 1997 |
|
RU2138286C1 |
| СПОСОБ УДАЛЕНИЯ ПАТОГЕНОВ НАНО-РАЗМЕРА ИЗ ЖИДКОСТЕЙ | 2000 |
|
RU2237022C2 |
Авторы
Даты
2009-11-20—Публикация
2007-08-01—Подача