Настоящее изобретение относится к нецитотоксическим слитым белкам и к их терапевтическому применению в качестве анальгетических молекул.
Токсины можно, в целом, разделить на две группы в зависимости от типа воздействия, которое они оказывают на клетку-мишень. Более конкретно, токсины первой группы убивают свои естественные клетки-мишени и поэтому известны как цитотоксические молекулы токсинов. Данная группа токсинов представлена, среди прочего, растительными токсинами, такими как рицин и абрин, и бактериальными токсинами, такими как дифтерийный токсин и экзотоксин A псевдомонад. Цитотоксические токсины привлекли большой интерес в области разработки «волшебных пуль» (например, иммуноконъюгатов, которые содержат компонент цитотоксического токсина и антитело, которое связывается с определенным маркером на клетке-мишени) для лечения клеточных заболеваний и состояний, таких как рак. Цитотоксические токсины, как правило, убивают свои клетки-мишени путем ингибирования процесса белкового синтеза клеток.
Токсины второй группы, которые известны как нецитотоксические токсины, не убивают (как следует из их названия) свои естественные клетки-мишени. Нецитотоксические токсины с коммерческой точки зрения представляют меньший интерес, чем их цитотоксические аналоги, и проявляют свое действие на клетку-мишень путем ингибирования иных клеточных процессов, нежели белковый синтез. Нецитотоксические токсины продуцируются различными растениями и разнообразными микроорганизмами, такими как Clostridium sp. и Neisseria sp.
Клостридиальные нейротоксины представляют собой белки, как правило, имеющие молекулярную массу порядка 150 кДа. Они продуцируются бактериями различных видов, особенно из рода Clostridium, главным образом, C. tetani и некоторыми штаммами C. botulinum, C. butyricum и C. argentinense. В настоящее время известны восемь различных классов клостридиальных нейротоксинов, а именно: столбнячный токсин и ботулинические нейротоксины серотипов A, B, C1, D, E, F и G, и все они имеют сходные структуры и механизмы действия.
Клостридиальные нейротоксины представляют собой основную группу нецитотоксических молекул токсинов и синтезируются бактерией-хозяином в виде одиночных полипептидов, которые модифицируются посттрансляционно путем протеолитического расщепления, с образованием двух полипептидных цепей, связанных вместе дисульфидной связью. Две цепи носят названия «тяжелая цепь» (H-цепь), которая имеет молекулярную массу примерно 100 кДа, и «легкая цепь» (L-цепь или LC), которая имеет молекулярную массу примерно 50 кДа.
L-цепи имеют протеазную функцию (цинк-зависимая эндопептидазная активность) и проявляют высокую субстратную специфичность в отношении связанных с везикулярными и/или плазматическими мембранами белков, вовлеченных в процесс экзоцитоза. L-цепи из разных видов или серотипов клостридий могут гидролизовать разные, но определенные пептидные связи в одном из трех субстратных белков, а именно в синаптобревине, синтаксине или SNAP-25. Эти субстраты являются важными компонентами нейросекреторной системы.
Бактерии Neisseria sp., главным образом из вида N. gonorrhoeae, продуцируют функционально сходные нецитотоксические протеазы. Примером такой протеазы является IgA-протеаза (смотрите WO 99/58571).
В данной области существует много документальных подтверждений того, что молекулы токсина могут быть перенаправлены в клетку, которая не является естественной клеткой-мишенью для токсина. Будучи таким образом перенаправленным, модифицированный токсин способен связываться с нужной клеткой-мишенью и после перемещения в цитозоль может оказывать свое действие на клетку-мишень. Такое перенаправление достигается путем замены природного направляющего фрагмента (TM) токсина другим TM. В этом отношении, TM выбирают таким образом, чтобы он связывался с нужной клеткой-мишенью и делал возможным последующее прохождение модифицированного токсина в эндосомы внутри клетки-мишени. Модифицированный токсин также содержит домен транслокации для проникновения нецитотоксической протеазы в цитозоль клетки. Домен транслокации может быть природным доменом транслокации токсина или может быть другим доменом транслокации, полученным из микробного белка с транслокационной активностью.
Вышеупомянутую замену TM можно осуществлять общепринятым методом химической конъюгации, который хорошо известен специалисту в данной области. В этом отношении, можно сослаться на статью Hermanson, G.T. (1996), Bioconjugate techniques, Academic Press, и статью Wong, S.S. (1991), Chemistry of protein conjugation and cross-linking, CRC Press. Альтернативно, можно использовать рекомбинантные методы, такие как те, что описаны в WO 98/07864. Все процитированные выше литературные источники включены в настоящий документ посредством ссылки.
Чувствительные к боли клетки обладают рецепторами самых различных типов. Однако не все типы рецепторов подходят (менее всего желательны) для опосредованного рецепторами эндоцитоза. Аналогично, способность к связыванию может варьироваться в широких пределах у различных TM в отношении одного и того же рецептора, и тем более в случае разных TM и разных рецепторов.
Вследствие этого, существует потребность в разработке модифицированных нецитотоксических слитых белков, которые позволят решить одну или более из вышеуказанных проблем. Особый интерес представляет разработка альтернативного/усовершенствованного нецитотоксического слитого белка для использования в лечении боли.
Настоящее изобретение направлено на решение одной или более из вышеуказанных проблем путем предоставления уникальных слитых белков.
Настоящее изобретение направлено на решение одной или более из вышеуказанных проблем путем предоставления одноцепочечного полипептидного слитого белка, содержащего:
a. нецитотоксическую протеазу, которая расщепляет белок экзоцитозного аппарата слияния ноцицептивного сенсорного афферента;
b. направляющий фрагмент галанина, который связывается с сайтом связывания на ноцицептивном сенсорном афференте, при этом сайт связывания подвергается эндоцитозу, встраиваясь в эндосому в ноцицептивном сенсорном афференте;
c. сайт расщепления протеазой, в котором слитый белок расщепляется протеазой, при этом сайт расщепления протеазой расположен между нецитотоксической протеазой и направляющим фрагментом галанина;
d. домен транслокации, который переносит протеазу из эндосомы через эндосомальную мембрану в цитозоль ноцицептивного сенсорного афферента, при этом направляющий фрагмент расположен между сайтом расщепления протеазой и доменом транслокации;
e. первый спейсер, расположенный между нецитотоксической протеазой и сайтом расщепления протеазой, при этом указанный первый спейсер содержит аминокислотную последовательность из 4-25 аминокислотных остатков;
f. второй спейсер, расположенный между направляющим фрагментом галанина и доменом транслокации, при этом указанный второй спейсер содержит аминокислотную последовательность из 4-35 аминокислотных остатков.
Компонент нецитотоксической протеазы по настоящему изобретению представляет собой нецитотоксическую протеазу, которая способна расщеплять различные, но определенные пептидные связи в одном из трех субстратных белков, а именно синаптобревине, синтаксине или SNAP-25, экзоцитозного аппарата слияния в ноцицептивном сенсорном афференте. Эти субстраты являются важными компонентами нейросекреторной системы. Компонент нецитотоксической протеазы по настоящему изобретению предпочтительно представляет собой IgA-протеазу нейссерии или L-цепь клостридиального нейротоксина. Термин «нецитотоксическая протеаза» охватывает функционально эквивалентные фрагменты и производные указанной нецитотоксической протеазы(протеаз). Особенно предпочтительным компонентом нецитотоксической протеазы является L-цепь ботулинического нейротоксина (BoNT).
Транслокационный компонент по настоящему изобретению делает возможным перемещение нецитотоксической протеазы (или ее фрагмента) в клетку-мишень так, что функциональная экспрессия протеазной активности происходит в цитозоле клетки-мишени. Транслокационный компонент предпочтительно способен образовывать ионопроницаемые поры в липидных мембранах в условиях низкого значения pH. Как установлено, предпочтительно использовать только те части белковой молекулы, которые способны образовывать поры в эндосомальной мембране. Транслокационный компонент можно получать из микробного источника белка, в частности, из бактериального или вирусного источника белка. Таким образом, в одном варианте осуществления транслокационный компонент представляет собой транслоцирующий домен фермента, такого как бактериальный токсин или вирусный белок. Транслокационный компонент по настоящему изобретению предпочтительно представляет собой H-цепь клостридиального нейротоксина или ее фрагмент. Наиболее предпочтительно он представляет собой домен HN (или его функциональный компонент), при этом HN означает часть или фрагмент H-цепи клостридиального нейротоксина, приблизительно эквивалентный аминоконцевой половине H-цепи, или домен, соответствующий этому фрагменту в интактной H-цепи.
Компонент TM галанина по настоящему изобретению отвечает за связывание слитого белка по настоящему изобретению с сайтом связывания на клетке-мишени. Таким образом, компонент TM галанина представляет собой лиганд, с помощью которого слитые белки по настоящему изобретению связываются с выбранной клеткой-мишенью.
В контексте настоящего изобретения клетка-мишень представляет собой ноцицептивный сенсорный афферент, предпочтительно основной ноцицептивный афферент (например, A-волокно, такое как Αδ-волокно, или C-волокно). Таким образом, слитые белки по настоящему изобретению способны ингибировать высвобождение нейромедиатора или нейромодулятора [например, глутамата, вещества P, пептида, связанного с геном кальцитонина (CGRP), и/или нейропептида Y] из отдельных популяций ноцицептивных сенсорных афферентных нейронов. На практике слитые белки уменьшают или предотвращают передачу сенсорных афферентных сигналов (например, нейротрансмиттеров или нейромодуляторов) от периферии к центральным болевым волокнам и, таким образом, находят применение в качестве терапевтических молекул для лечения боли, в частности, хронической боли.
Подтверждение того, что TM связывается с ноцицептивным сенсорным афферентом, является обычной процедурой. Например, можно использовать простой эксперимент с вытеснением радиоактивности, в котором ткань или клетки, представляющие собой ноцицептивный сенсорный афферент (например, DRGs), подвергают воздействию меченого (например, меченного тритием) лиганда в присутствии избытка немеченого лиганда. В таком эксперименте можно оценивать относительные пропорции неспецифического и специфического связывания, тем самым подтверждая то, что лиганд связывается с ноцицептивной сенсорной афферентной клеткой-мишенью. Необязательно, анализ может включать один или более связывающихся антагонистов и анализ может дополнительно включать наблюдение исчезновения связывания лиганда. Примеры эксперимента такого типа можно найти в Hulme, E.C. (1990), Receptor-binding studies, a brief outline, pp. 303-311, In Receptor biochemistry, A Practical Approach, Ed. E.C. Hulme, Oxford University Press.
Слитые белки по настоящему изобретению, как правило, демонстрируют сниженную аффинность связывания (примерно вплоть до 10 раз) для рецептора галанина (например, GALR1) при сравнении с соответствующим «свободным» TM (например, gal16). Однако, несмотря на это наблюдение, слитые белки по настоящему изобретению неожиданно демонстрируют хорошую эффективность. Это может быть связано с двумя основными особенностями. Во-первых, компонент нецитотоксической протеазы является каталитическим - таким образом, терапевтический эффект нескольких таких молекул быстро усиливается. Во-вторых, рецепторы галанина, присутствующие на ноцицептивных сенсорных афферентах, должны действовать только в качестве шлюза для поступления внутрь терапевтического средства и не обязательно должны быть стимулированы до уровня, необходимого для достижения опосредованного взаимодействием лиганд-рецептор фармакологического ответа. Соответственно, слитые белки по настоящему изобретению можно вводить в дозе, которая намного ниже, чем та, которая потребовалась бы для анальгетических молекул других типов, таких как НПВС, морфин и габапентин. Последние молекулы, как правило, вводят в количествах от многих микрограмм до миллиграмм (даже до сотен миллиграмм), в то время как слитые белки по настоящему изобретению можно вводить в гораздо меньших дозах, как правило, по меньшей мере в 10 раз в меньших дозах, и более конкретно, в 100 раз в меньших дозах.
TM галанина по изобретению может также представлять собой молекулу, которая действует как «агонист» на один или более рецепторов галанина, находящихся на ноцицептивном сенсорном афференте, более конкретно, на основном ноцицептивном афференте. Обычно агонистом считают любую молекулу, которая может либо повышать, либо снижать активность в клетке, а именно, любую молекулу, которая просто вызывает изменение клеточной активности. Например, общепринятое значение слова «агонист» будет включать химическое вещество, способное объединяться с рецептором на клетке и инициировать реакцию или активность, либо лекарственное средство, которое вызывает активный ответ за счет активации рецепторов, выражается ли ответ в возрастании или снижении клеточной активности.
Однако для целей настоящего изобретения агонист более конкретно определяют как молекулу, которая способна стимулировать процесс экзоцитозного слияния в клетке-мишени, процесс, который подвержен ингибированию протеазой (или ее фрагментом), способной расщеплять белок экзоцитозного аппарата слияния в указанной клетке-мишени.
Соответственно, конкретное определение агониста по настоящему изобретению будет исключать многие молекулы, которые в обычном смысле считались бы агонистами. Например, фактор роста нервов (NGF) является агонистом с точки зрения его способности стимулировать нейрональную дифференциацию посредством связывания с рецептором TrkA. Однако NGF не является агонистом при оценке в соответствии с вышеуказанными критериями, поскольку он не является основным индуктором экзоцитозного слияния. Кроме того, процесс, который NGF стимулирует (то есть клеточная дифференциация), не восприимчив к ингибированию протеазной активностью нецитотоксической молекулы токсина.
В одном варианте осуществления слитые белки по настоящему изобретению демонстрируют предпочтительное связывание с рецептором и/или свойства интернализации. Это, в свою очередь, может приводить к более эффективной доставке протеазного компонента к восприимчивой к боли клетке-мишени.
Использование агониста, такого как TM, имеет собственные ограничения с точки зрения побочных эффектов. Более конкретно, связывание агониста TM с восприимчивой к боли клеткой-мишенью увеличивает экзоцитозное слияние, что может усиливать ощущение боли. Однако процесс экзоцитоза, который стимулируется связыванием агониста, впоследствии уменьшается или ингибируется протеазным компонентом слитого белка.
Агонистические свойства TM, который связывается с рецептором на ноцицептивном афференте, можно подтверждать с помощью методов, описанных в примере 9.
Направляющий фрагмент по настоящему изобретению содержит или состоит из галанина и/или производных галанина. Рецепторы галанина (например, GALR1, GALR2 и GALR3) локализованы пре- и постсинаптически в DRGs (Liu & Hokfelt, (2002), Trends Pharm. Sci., 23(10), 468-74), и их экспрессия повышена во время состояний невропатической боли. В статье Xu et al., (2000) Neuropeptides, 34 (3&4), 137-147 приведена дополнительная информация относительно галанина. Все процитированные выше литературные источники включены в настоящий документ посредством ссылки.
В одном варианте осуществления изобретения мишенью для TM галанина является рецептор GALR1, GALR2 и/или GALR3. Эти рецепторы являются членами класса связанных с G-белками рецепторов и имеют структуру с семью трансмембранными доменами.
В одном варианте осуществления TM галанина представляет собой молекулу, которая связывается (предпочтительно, которая специфически связывается) с рецептором GALR1, GALR2 и/или GALR3. Более предпочтительно, TM галанина является «агонистом» рецептора GALR1, GALR2 и/или GALR3. Термин «агонист» в данном контексте имеет то значение, которое определено выше.
Человеческий пептид галанина дикого типа представляет собой пептид из 30 аминокислот, обозначенный в настоящем документе аббревиатурой «GA30» (представлен SEQ ID NO: 7). В одном варианте осуществления TM галанина содержит или состоит из SEQ ID NO: 7.
Изобретение также охватывает фрагменты, варианты и производные TM галанина, описанного выше. Эти фрагменты, варианты и производные в значительной степени сохраняют свойства, которые приписывают указанному TM галанина (то есть являются функционально эквивалентными). Например, фрагменты, варианты и производные могут сохранять способность связываться с рецептором GALR1, GALR2 и/или GALR3. В одном варианте осуществления TM галанина по изобретению содержит или состоит из 16-аминокислотного фрагмента полноразмерного пептида галанина и называется в настоящем документе GA16 (представлен SEQ ID NO: 8).
В одном варианте осуществления TM галанина содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере 70%, предпочтительно по меньшей мере 80% (например, по меньшей мере 82, 84, 85, 86, 88 или 89%), более предпочтительно по меньшей мере 90% (например, по меньшей мере 91, 92, 93 или 94%) и наиболее предпочтительно по меньшей мере 95% (например, по меньшей мере 96, 97, 98, 99 или 100%) идентичности аминокислотной последовательности с SEQ ID NO: 7 или SEQ ID NO: 8.
В одном варианте осуществления TM галанина содержит или состоит из аминокислотной последовательности, имеющей по меньшей 70% (например, по меньшей мере 80, 82, 84, 85, 86, 88 или 89%), более предпочтительно по меньшей мере 90% (например, по меньшей мере 91, 92, 93 или 94%) и наиболее предпочтительно по меньшей мере 95% (например, по меньшей мере 96, 97, 98, 99 или 100%) идентичности аминокислотной последовательности с полноразмерной аминокислотной последовательностью SEQ ID NO: 7 или SEQ ID NO: 8, или фрагментом SEQ ID NO: 7 или SEQ ID NO: 8, содержащим или состоящим из по меньшей мере 10 (например, по меньшей мере 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29) смежных аминокислотных остатков из них.
В одном варианте осуществления направляющий фрагмент галанина содержит или состоит из аминокислотной последовательности SEQ ID NO: 7 или фрагмента, содержащего или состоящего из по меньшей мере 16 (например, по меньшей мере 10, 11, 12, 13, 14 или 15) смежных аминокислотных остатков из нее, или вариантной аминокислотной последовательности указанной SEQ ID NO: 7 или указанного фрагмента, имеющих максимум 6 (например, максимум 5, 4, 3, 2 или 1) консервативных аминокислотных замен.
Сайт расщепления протеазой по настоящему изобретению делает возможным расщепление (предпочтительно контролируемое расщепление) слитого белка в положении между компонентом нецитотоксической протеазы и компонентом TM. Именно эта реакция расщепления преобразует слитый белок из одноцепочечного полипептида в связанный дисульфидной связью двухцепочечный полипептид.
В предпочтительном варианте осуществления настоящего изобретения TM галанина связывается через домен или аминокислотную последовательность, которая находится далеко от С-конца TM галанина. Например, соответствующий связывающий домен может включать внутренний домен или аминокислотную последовательность, расположенную ближе к середине (то есть линейной пептидной последовательности) TM. Предпочтительно, соответствующий связывающий домен расположен ближе к N-концу TM галанина, более предпочтительно на N-конце или рядом с ним.
В одном варианте осуществления одноцепочечный слитый полипептид может содержать более одного сайта протеолитического расщепления. Однако в случае, когда существуют два или более таких сайтов, они являются разными, тем самым в значительной степени предотвращается множественное расщепление в присутствии одной протеазы. В другом варианте осуществления предпочтительно, чтобы одноцепочечный слитый полипептид имел один сайт расщепления протеазой.
Последовательность(и) расщепления протеазой может быть внесена (и/или любая изначально присутствующая последовательность расщепления удалена) на уровне ДНК общепринятыми методами, такими как сайт-направленный мутагенез. Скрининг для подтверждения присутствия последовательностей расщепления можно выполнять вручную или с помощью компьютерного программного обеспечения (например, программы MapDraw от компании DNASTAR, Inc.).
Хотя можно использовать любой сайт расщепления протеазой, следующие являются предпочтительными:
В одном варианте осуществления сайт расщепления протеазой представляет собой сайт расщепления энтерокиназой (DDDDK↓). В одном варианте осуществления протеазу энтерокиназу используют для расщепления в сайте расщепления энтерокиназой и активации слитого белка.
Термин «сайт расщепления протеазой» также охватывает интеин, который представляет собой саморасщепляющуюся последовательность. Реакция самосплайсинга является контролируемой, например, путем изменения концентрации присутствующего восстанавливающего агента.
На практике в сайте расщепления протеазой происходит расщепление и N-концевая область (предпочтительно N-конец) TM обнажается. Полученный полипептид содержит TM с N-концевым доменом или внутренним доменом, который практически свободен от остатка слитого белка. Такое расположение гарантирует, что N-концевой компонент (или внутренний домен) TM может взаимодействовать непосредственно с сайтом связывания на клетке-мишени.
В одном варианте осуществления TM и сайт расщепления протеазой отстоят друг от друга в слитом белке не более чем на 10 аминокислотных остатков, более предпочтительно не более чем на 5 аминокислотных остатков и наиболее предпочтительно на ноль аминокислотных остатков. В одном варианте осуществления TM и сайт расщепления протеазой отстоят друг от друга в слитом белке на 0-10 (например, 0-9, 0-8, 0-7, 0-6, 0-5, 0-4, 0-3, 0-2) и предпочтительно 0-1 аминокислотный остаток. Таким образом, после расщепления в сайте расщепления протеазой, получается слитый белок с TM, который имеет N-концевой домен, практически свободный от остатка слитого белка. Такое расположение гарантирует, что N-концевой компонент направляющего фрагмента может взаимодействовать непосредственно с сайтом связывания на клетке-мишени.
Одним из преимуществ, связанных с вышеупомянутым этапом активации, является то, что TM становится восприимчивым к N-концевой деградации только после того, как происходит протеолитическое расщепление слитого белка. Кроме того, выбор определенного сайта расщепления протеазой делает возможной избирательный переход слитого полипептида в двухцепочечную конформацию.
При конструировании слитого полипептида по настоящему изобретению, сайт расщепления протеазой помещают между TM и компонентом нецитотоксической протеазы.
Предпочтительно, чтобы в одноцепочечном слитом белке TM находился между сайтом расщепления протеазой и транслокационным компонентом. Это гарантирует, что ТМ присоединен к домену транслокации (то есть как это происходит в природном клостридиальном голотоксине), хотя в ситуации по настоящему изобретению порядок этих двух компонентов изменен на противоположный по сравнению с природным голотоксином. Еще одним преимуществом такой конструкции является то, что TM находится в области открытой петли слитого белка, которая оказывает минимальное структурное воздействие на конформацию слитого белка. В этом отношении указанную петлю называют по-разному: линкер, петля активации, междоменный линкер или просто экспонированная на поверхности петля (Schiavo et al., 2000, Phys. Rev., 80, 717-766; Turton et al., 2002, Trends Biochem. Sci., 27, 552-558).
Одноцепочечный слитый белок по настоящему изобретению содержит первый спейсер, расположенный между нецитотоксической протеазой и сайтом расщепления протеазой, при этом первый спейсер содержит (или состоит из) аминокислотную последовательность из 4-25 (например, 6-25, 8-25, 10-25, 15-25 или 4-21, 4-20, 4-18, 4-15, 4-12 или 4-10) аминокислотных остатков. В одном варианте осуществления первый спейсер содержит (или состоит из) аминокислотную последовательность из по меньшей мере 4 (например, по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15) аминокислотных остатков. В одном варианте осуществления первый спейсер содержит (или состоит из) аминокислотную последовательность из не более чем 25 (например, не более чем 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 10) аминокислотных остатков. Указанный первый спейсер делает возможным расщепление слитого белка в сайте расщепления протеазой.
Без первого спейсера по настоящему изобретению расщепление протеазой и активация слитого белка происходят в очень слабой степени. Не желая быть связанными теорией, авторы изобретения предположили, что направляющий фрагмент галанина может пространственно блокировать или взаимодействовать с сайтом расщепления протеазой, что приводит к слабой активации слитых белков, лишенных первого спейсера по настоящему изобретению. Авторы настоящего изобретения считают, что именно гибкость, обеспечиваемая первым спейсером, придает свойство усиленной/улучшенной активации заявленным в настоящем изобретении слитым белкам. Жесткие линкеры, такие как альфа-спиральные линкеры, не допускают необходимую гибкость. Это также верно для слитых белков галанина, имеющих «природные» спейсерные последовательности, содержащие сайт расщепления протеазой, которые могут копировать нежелательные жесткие альфа-спиральные структуры линкеров. Гибкость и подвижность полипептидных доменов можно подтверждать с помощью ряда методов, включая определение рентгеновского кристаллографического B-фактора (смотрите, например, статью Smith et al., 2003 Protein Science, 12: 1060-1072; включенную в настоящий документ посредством ссылки). Специально выбранные спейсерные последовательности по настоящему изобретению обеспечивают усиленную активацию в большей степени, чем любые «природные» спейсерные последовательности. Активация в этом контексте означает, что первый спейсер делает возможным расщепление слитого белка в сайте расщепления протеазой. Особенно предпочтительные аминокислотные остатки для использования в первом спейсере включают глицин, треонин, аргинин, серин, аланин, аспарагин, глутамин, аспарагиновую кислоту, пролин, глутаминовую кислоту и/или лизин. Вышеуказанные аминокислоты считаются наиболее гибкими аминокислотами - смотрите Smith et al. 2003 Protein Science 2003; 12: 1060-1072.
В одном варианте осуществления аминокислотные остатки первого спейсера выбраны из группы, состоящей из глицина, треонина, аргинина, серина, аспарагина, глутамина, аланина, аспарагиновой кислоты, пролина, глутаминовой кислоты, лизина, лейцина и/или валина. В одном варианте осуществления аминокислотные остатки первого спейсера выбраны из группы, состоящей из глицина, серина, аланина, лейцина и/или валина. В одном варианте осуществления аминокислотные остатки первого спейсера выбраны из группы, состоящей из глицина, серина и/или аланина. Глицин и серин являются особенно предпочтительными. В одном варианте осуществления первый спейсер содержит или состоит из одного или более пентапептидов, содержащих остатки глицина, серина и/или треонина. Один из способов оценки того, обладает ли необходимой гибкостью первый спейсер в заявленных по настоящему изобретению слитых белках, заключается в проведении простого анализа расщепления протеазой. Для специалиста в данной области будет несложно оценить расщепление/активацию слитого белка - стандартная методология описана, например, в примере 1.
В одном варианте осуществления первый спейсер можно выбирать из спейсеров GS5, GS10, GS15, GS18, GS20, FL3 и/или FL4. Последовательность указанных спейсеров приведена в таблице 1 ниже.
В одном варианте осуществления первый спейсер допускает по меньшей мере 45% (например, по меньшей мере 50, 55, 60, 65, 70, 75, 80, 90, 95, 98, 99 или 100%) активацию слитого белка за счет расщепления протеазой. В одном варианте осуществления первый спейсер допускает по меньшей мере 70% активацию слитого белка за счет расщепления протеазой.
В одном варианте осуществления первый спейсер не является природной спейсерной последовательностью. В одном варианте осуществления первый спейсер не содержит или не состоит из аминокислотной последовательности, свойственной природному (то есть дикого типа) клостридиальному нейротоксину, такому как ботулинический нейротоксин. Иными словами, первый спейсер может представлять собой неклостридиальную последовательность (то есть не встречающуюся в природном клостридиальном нейротоксине). В одном варианте осуществления слитый белок не содержит или не состоит из аминокислотной последовательности GIITSK (BoNT/A); VK (BoNT/B); AIDGR (BoNT/C); LTK (BoNT/D); IVSVK (BoNT/E); VIPR (BONT/F); VMYK (BoNT/G) и/или IIPPTNIREN (TeNT) в качестве первого спейсера.
В одном варианте осуществления первый спейсер начинается на третьем аминокислотном остатке после консервативного остатка цистеина в L-цепи клостридиального нейротоксина (смотрите таблицу 3 ниже). В одном варианте осуществления первый спейсер начинается после аминокислотных остатков VD L-цепи клостридиальной нецитотоксической протеазы, сконструированной с сайтом sal1, после консервативного остатка цистеина. В одном варианте осуществления первый спейсер заканчивается аминокислотным остатком, отмечающим начало сайтов расщепления протеазой, упомянутых выше.
В одном варианте осуществления одноцепочечный слитый белок содержит второй спейсер, который расположен между направляющим фрагментом галанина и доменом транслокации. Указанный второй спейсер может содержать (или состоять из) аминокислотную последовательность из 4-35 (например, 6-35, 10-35, 15-35, 20-35 или 4-28, 4-25, 4-20 или 4-10) аминокислотных остатков. Авторы настоящего изобретения неожиданно обнаружили, что слитые белки по настоящему изобретению могут демонстрировать улучшенную связывающую способность, если размер второго спейсера выбирают так, что (на практике) C-конец TM и N-конец транслокационного компонента отделены друг от друга на 40-105 ангстрем, предпочтительно на 50-100 ангстрем и более предпочтительно на 50-90 ангстрем.
Подходящие вторые спейсеры можно обычным образом идентифицировать и получать методом, описанным в статье Crasto, C.J. and Feng, J.A. (2000) May, 13(5), pp. 309-312 - смотрите также http://www.fccc/edu/research/labs/feng/limker.html. В одном варианте осуществления второй спейсер выбран из спейсеров GS5, GS10, GS15, GS18, GS20 или HX27. Последовательности указанных спейсеров приведены в таблице 2 ниже.
Авторы изобретения неожиданно установили, что заявленные в настоящем изобретении слитые белки, имеющие указанные первый и второй спейсеры, демонстрируют улучшенное свойство активации и повышенный выход при рекомбинантной экспрессии. Кроме того, заявленные в настоящем изобретении слитые белки демонстрируют повышенную эффективность по сравнению со слитыми белками, в которых TM галанина является C-концевым для компонента домена транслокации.
В одном варианте осуществления изобретение относится к одноцепочечному полипептидному слитому белку, содержащему (или состоящему из) аминокислотную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85, 90, 92, 94, 95, 96, 97, 98, 99 или 100%) идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 10, 11, 13, 14, 16, 17, 19, 20, 22, 23, 25, 26, 28, 29, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 53, 56 и/или 59.
В одном варианте осуществления изобретение относится к одноцепочечному полипептидному слитому белку, содержащему (или состоящему из) аминокислотную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85, 90, 92, 94, 95, 96, 97, 98, 99 или 100%) идентичности последовательности с полноразмерной аминокислотной последовательностью SEQ ID NO: 10, 11, 13, 14, 16, 17, 19, 20, 22, 23, 25, 26, 28, 29, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 53, 56 и/или 59.
В одном варианте осуществления в одноцепочечном полипептиде компонент нецитотоксической протеазы и транслокационный компонент связаны вместе дисульфидной связью. Таким образом, после расщепления в сайте расщепления протеазой полипептид принимает двухцепочечную конформацию, в которой протеазный и транслокационный компоненты остаются связанными друг с другом посредством дисульфидной связи. Для этой цели предпочтительно, чтобы протеазный и транслокационный компоненты были разнесены друг от друга в одноцепочечном слитом белке не более чем на 100 аминокислотных остатков, более предпочтительно не более чем на 80 аминокислотных остатков, особенно предпочтительно не более чем на 60 аминокислотных остатков и наиболее предпочтительно не более чем на 50 аминокислотных остатков.
В одном варианте осуществления компонент нецитотоксической протеазы образует дисульфидную связь с транслокационным компонентом слитого белка. Например, аминокислотный остаток протеазного компонента, который образует дисульфидную связь, находится в числе последних 20, предпочтительно в числе последних 10 C-концевых аминокислотных остатков протеазного компонента. Аналогично, аминокислотный остаток в составе транслокационного компонента, который образует вторую часть дисульфидной связи, может находиться в числе первых 20, предпочтительно в числе первых 10 N-концевых аминокислотных остатков транслокационного компонента.
Альтернативно, в одноцепочечном полипептиде компонент нецитотоксической протеазы и TM могут быть связаны вместе дисульфидной связью. С этой точки зрения, аминокислотный остаток TM, который образует дисульфидную связь, предпочтительно расположен вдали от N-конца TM, более предпочтительно около C-конца TM.
В одном варианте осуществления компонент нецитотоксической протеазы образует дисульфидную связь с компонентом TM слитого белка. С этой точки зрения, аминокислотный остаток протеазного компонента, который образует дисульфидную связь, предпочтительно находится в числе последних 20, более предпочтительно в числе последних 10 C-концевых аминокислотных остатков протеазного компонента. Аналогично, аминокислотный остаток в составе компонента TM, который образует вторую часть дисульфидной связи, предпочтительно находится в числе последних 20, более предпочтительно в числе последних 10 C-концевых аминокислотных остатков TM.
Вышеописанное расположение дисульфидных связей имеет то преимущество, что протеазный и транслокационный компоненты расположены аналогично тому, как это имеет место в природном клостридиальном нейротоксине. Для сравнения, что касается первичной аминокислотной последовательности природного клостридиального нейротоксина, соответствующие аминокислотные остатки цистеина отстоят друг от друга на 8-27 аминокислотных остатков - взято из книги Popoff, MR & Marvaud, J-C, 1999, Structural & genomic features of clostridial neurotoxins, Chapter 9, in The Comprehensive Sourcebook of Bacterial Protein Toxins. Ed. Alouf & Freer:
Слитый белок может содержать один или более маркеров для очистки, которые расположены с N-конца от протеазного компонента и/или с C-конца от транслокационного компонента.
Хотя можно использовать любой маркер для очистки, следующие являются предпочтительными:
His-маркер (например, 6 остатков гистидина), предпочтительно в качестве C-концевого и/или N-концевого маркера;
MBP-маркер (мальтоза-связывающий белок), предпочтительно в качестве N-концевого маркера;
GST-маркер (глутатион-S-трансфераза), предпочтительно в качестве N-концевого маркера;
His-MBP-маркер, предпочтительно в качестве N-концевого маркера;
GST-MBP-маркер, предпочтительно в качестве N-концевого маркера;
тиоредоксин-маркер, предпочтительно в качестве N-концевого маркера;
CBD-маркер (хитин-связывающий домен), предпочтительно в качестве N-концевого маркера.
В следующем варианте осуществления настоящего изобретения в слитый белок можно включать одну или более дополнительных молекул пептидного спейсера. Например, пептидный спейсер можно использовать между маркером для очистки и остальной частью молекулы слитого белка (например, между N-концевым маркером для очистки и протеазным компонентом по настоящему изобретению; и/или между C-концевым маркером для очистки и транслокационным компонентом по настоящему изобретению).
Второй аспект настоящего изобретения относится к последовательности ДНК, кодирующей вышеупомянутый одноцепочечный полипептид. В предпочтительном аспекте настоящего изобретения последовательность ДНК получают в виде части ДНК-вектора, при этом вектор содержит промотор и терминатор.
В предпочтительном варианте осуществления вектор содержит промотор, выбранный из:
ДНК-конструкт по настоящему изобретению предпочтительно разработан in silico, а затем синтезирован общепринятым методом синтеза ДНК.
Вышеуказанную информацию о последовательности ДНК необязательно модифицируют для обеспечения статистического отклонения от равномерности использования кодонов (codon bias), характерного для системы экспрессии конечной клетки-хозяина (например, E. coli), которую предстоит использовать.
ДНК-каркас предпочтительно подвергают скринингу на любую характерную нуклеотидную последовательность, которая, будучи транскрибированной и транслированной, приведет к образованию аминокислотной последовательности, соответствующей сайту расщепления протеазой, кодируемому второй кодирующей пептид последовательностью. Этот скрининг можно выполнять вручную или с помощью компьютерного программного обеспечения (например, программы MapDraw от компании DNASTAR, Inc.).
Следующий вариант осуществления настоящего изобретения относится к способу получения нецитотоксического средства, включающему:
a. создание контакта одноцепочечного полипептидного слитого белка по изобретению с протеазой, способной расщеплять сайт расщепления протеазой;
b. расщепление сайта расщепления протеазой и, таким образом, образование двухцепочечного слитого белка.
Данный аспект относится к двухцепочечному полипептиду, который, в целом, имитирует структуру клостридиального голотоксина. Более подробно, полученный двухцепочечный полипептид, как правило, имеет структуру, в которой:
a. первая цепь содержит нецитотоксическую протеазу, способную расщеплять белок экзоцитозного аппарата слияния ноцицептивного сенсорного афферента;
b. вторая цепь содержит TM галанина и домен транслокации, способный перемещать протеазу из эндосомы через эндосомальную мембрану в цитозоль ноцицептивного сенсорного афферента; и
первая и вторая цепи связаны между собой дисульфидной связью.
В одном аспекте изобретения одноцепочечный или двухцепочечный полипептид по изобретению предназначен для применения в качестве лекарственного средства/терапевтической молекулы.
На практике одноцепочечный или двухцепочечный полипептид по изобретению лечит, предотвращает или облегчает боль.
На практике терапевтически эффективное количество одноцепочечного или двухцепочечного полипептида по изобретению вводят пациенту.
Следующий аспект настоящего изобретения относится к применению одноцепочечного или двухцепочечного полипептида по изобретению для производства лекарственного средства для лечения, профилактики или облегчения боли.
Сопутствующий аспект относится к способу лечения, профилактики или облегчения боли у индивида, включающему введение указанному пациенту терапевтически эффективного количества одноцепочечного или двухцепочечного полипептида по изобретению.
Соединения, описанные в настоящем документе, можно использовать для лечения пациента, страдающего от хронической боли одного или более видов, включая невропатическую боль, воспалительную боль, головную боль, соматическую боль, висцеральную боль и реперкуссионную боль.
Используемый в настоящем документе термин «лечить» означает оказание воздействия медицинскими средствами. Сюда входит, например, введение соединения по изобретению для профилактики против появления боли или для ее ослабления.
Используемый в настоящем документе термин «боль» означает любое неприятное сенсорное ощущение, как правило, связанное с физическим нарушением. Физическое нарушение может быть или не быть очевидным для врача. Боль бывает двух видов: хроническая и острая. «Острая боль» представляет собой боль, продолжающуюся недолго и начинающуюся внезапно. Одним из типов острой боли является, например, кожная боль, ощущаемая в результате травмы кожи или других поверхностных тканей, например, вызванная порезом или ожогом. Кожные ноцицепторы заканчиваются сразу под кожей, и вследствие высокой концентрации нервных окончаний возникает отчетливая, локализованная боль короткой продолжительности. «Хроническая боль» представляет собой боль, отличную от острой боли. Хроническая боль включает невропатическую боль, воспалительную боль, головную боль, соматическую боль, висцеральную боль и реперкуссионную боль.
I. Невропатическая боль
Соединения по изобретению можно использовать для лечения боли, вызванной или иным образом ассоциированной с любым из следующих невропатических болевых состояний.
«Невропатическая боль» означает аномальный приток сенсорных чувствительных импульсов, «сенсорный вход», приводящий к ощущению дискомфорта, со стороны периферической нервной системы, центральной нервной системы или обеих.
A. Симптомы невропатической боли
Симптомы невропатической боли могут включать постоянную, спонтанную боль, а также аллодинию (болезненную реакцию на стимул, который обычно не является болезненным), гипералгезию (усиленную реакцию на болезненный стимул, который обычно вызывает лишь легкий дискомфорт, такой как булавочный укол) или гиперпатию (когда непродолжительный дискомфорт становится длительной сильной болью).
B. Причины невропатической боли
Невропатическая боль может быть вызвана любой из перечисленных далее причин.
1. Травматическое повреждение, такое как, например, компрессионная травма нерва (например, травматическое сжатие нерва, растяжение нерва, ущемление нерва или неполное рассечение нерва); травма спинного мозга (например, половинное поражение спинного мозга); ампутация конечности; ушиб; воспаление (например, воспаление спинного мозга) или хирургическая процедура.
2. Ишемический приступ, включая, например, инсульт и инфаркт.
3. Возбудитель инфекции.
4. Воздействие токсического средства, включая, например, лекарственное средство, спирт, тяжелые металлы (например, свинец, мышьяк, ртуть), промышленные вещества (например, растворитель, дым от клея) или оксид азота.
5. Заболевание, включая, например, воспалительное заболевание, неопластическую опухоль, синдром приобретенного иммунодефицита (СПИД), болезнь Лайма, лепру, метаболическое заболевание, заболевание периферических нервов, такое как неврома, мононевропатию или полиневропатию.
C. Виды невропатической боли
1. Невралгия
Невралгия представляет собой боль, которая иррадиирует по ходу одного или более конкретных нервов, как правило, без какого-либо очевидного патологического изменения в структуре нерва. Причины невралгии различны. Химическое раздражение, воспаление, травма (включая хирургическую операцию), сдавливание соседними структурами (например, опухолями) и инфекции, все это может приводить к невралгии. Во многих случаях, однако, причина неизвестна или не поддается определению. Невралгия наиболее распространена у пожилых людей, хотя может возникать в любом возрасте. Невралгия включает, без ограничения, невралгию тройничного нерва (TN), постгерпетическую невралгию, постгерпетическую невралгию, невралгию языкоглоточного нерва, пояснично-крестцовый радикулит и атипичную лицевую боль.
Невралгия представляет собой боль в месте расположения нерва или нервов. Примерами являются невралгия тройничного нерва, атипичная лицевая боль и постгерпетическая невралгия (вызываемая опоясывающим лишаем или герпесом). Пораженные нервы вызывают ощущение прикосновения, повышенной температуры и давления в лицевой области от челюсти до лба. При заболевании, как правило, имеют место короткие эпизоды мучительной боли обычно в течение менее двух минут и только на одной стороне лица. Боль может быть описана в различных выражениях, например «колющая», «острая», «молниеносная», «жгучая» и даже «зудящая». При атипичной форме TN боль может также присутствовать в виде сильной или обычной боли и продолжаться в течение длительного времени. Боль, ассоциированную с TN, признают одной из самых мучительных болей, которые можно испытывать.
Простые раздражители, такие как прием пищи, разговор, умывание лица, или любое легкое прикосновение или ощущение может спровоцировать приступ (даже ощущение слабого ветра). Приступы могут случаться в кластерах или как отдельный приступ.
Симптомы включают острую колющую боль или постоянную жгучую боль, локализованную в любом месте, как правило, на поверхности или вблизи поверхности тела, в одном и том же месте для каждого приступа; боль, распространяющуюся по пути определенного нерва; нарушение функции пораженной части тела из-за болей или мышечную слабость из-за сопутствующего повреждения двигательного нерва; повышенную чувствительность кожи или онемение пораженной области кожи (ощущение как при местной анестезии, такой как инъекция новокаина); и любое прикосновение или давление воспринимается как боль. Движение также может быть болезненным.
Невралгия тройничного нерва является наиболее распространенной формой невралгии. Она затрагивает основной сенсорный лицевой нерв, тройничный нерв («тройничный» буквально означает «тройное разветвление», что связано с разделением нерва на 3 ветви). Данное состояние предполагает внезапные и короткие приступы сильной боли на одной стороне лица, на площади, которая иннервируется тройничным нервом на этой стороне. Приступы боли могут быть достаточно сильными, чтобы вызвать на лице гримасу, которую обычно называют болезненным тиком (болевым тиком). Иногда причиной невралгии тройничного нерва является кровеносный сосуд или небольшая опухоль, которая давит на нерв. Такие заболевания, как рассеянный склероз (воспалительное заболевание, поражающее головной и спинной мозг), некоторые формы артрита и диабет (высокий уровень сахара в крови), также могут вызывать невралгию тройничного нерва, однако причину не всегда можно определить. В этом состоянии некоторые движения, такие как жевание, разговор, глотание или прикосновение к области лица, могут вызывать мучительный болевой спазм.
Родственный, но довольно редкий вид невралгии затрагивает языкоглоточный нерв, который обеспечивает чувствительность горла. Симптомами этой невралгии являются короткие, похожие на шок приступы боли, локализованной в горле.
Невралгия может возникать после инфекции, такой как опоясывающий лишай, которая вызвана вирусом ветряной оспы, разновидностью герпесвируса. Эта невралгия вызывает постоянную жгучую боль после заживления сыпи опоясывающего лишая. Боль усугубляется при движении или контакте с пораженной областью. Не все больные с диагнозом опоясывающего лишая впоследствии будут страдать постгерпетической невралгией, которая может быть более болезненной, чем опоясывающий лишай. Боль и чувствительность могут длиться в течение нескольких месяцев или даже лет. Боль обычно проявляется в виде невыносимой чувствительности к любому прикосновению, но особенно легкому прикосновению. Постгерпетическая невралгия не ограничивается лицом; она может возникать на любом участке тела, но, как правило, возникает в месте сыпи опоясывающего лишая. Нередко возникает депрессия из-за боли и социальной изоляции во время болезни.
Постгерпетическая невралгия может продолжаться изнуряюще долго после того, как исчезли признаки исходной герпесной инфекции. Другими инфекционными заболеваниями, которые могут вызывать невралгию, являются сифилис и болезнь Лайма.
Диабет является еще одной распространенной причиной невралгии. Это очень распространенная медицинская проблема затрагивает 1 из почти каждых 20 взрослых американцев. Диабет повреждает крошечные артерии, которые снабжают кровью нервы, что приводит к нарушению функции нервных волокон и, иногда, гибели нервов. Диабет может вызывать практически любые невралгии, в том числе невралгию тройничного нерва, запястный туннельный синдром (боль и онемение рук и запястья) и невралгию латерального кожного нерва бедра (онемение и боль в бедре из-за повреждения латерального кожного нерва бедра). Строгий контроль уровня сахара в крови может предотвращать диабетическое повреждение нервов и может ускорять восстановление у пациентов, у которых уже развилась невралгия.
Другими медицинскими состояниями, которые могут быть ассоциированы с невралгиями, являются хроническая почечная недостаточность и порфирия - наследственное заболевание, при котором организм не может избавляться от некоторых веществ, образующихся после нормального распада элементов крови в организме. Некоторые лекарственные средства также могут являться причиной данной проблемы.
2. Деафферентация
Деафферентация указывает на потерю притока сенсорных чувствительных импульсов «сенсорного входа» от какой-либо части тела, и может быть вызвана повреждением либо периферических сенсорных волокон, либо нервов от центральной нервной системы. Деафферентационный болевой синдром включает, без ограничения, повреждение головного или спинного мозга, постинсультную боль, фантомную боль, параплегию, травмы разрыва плечевого сплетения, поясничные радикулопатии.
3. Комплексные региональные болевые синдромы (КРБС, CRPS)
КРБС представляет собой хронический болевой синдром, являющийся следствием симпатически поддерживаемой боли, и проявляется в двух формах. КРБС 1 в настоящее время заменяет термин «синдром рефлекторной симпатической дистрофии». Он является хроническим заболеванием нервов, которое наиболее часто развивается в руках или ногах после незначительных или тяжелых травм. КРБС 1 ассоциирован с сильной болью, изменениями в ногтях, костях и коже, а также повышенной чувствительностью к прикосновениям в пораженной конечности. КРБС 2 заменяет термин «каузалгия» и возникает в результате установленного повреждения нерва. КРБС включает, без ограничения, КРБС I типа (рефлекторную симпатическую дистрофию) и КРБС II типа (каузалгию).
4. Невропатия
Невропатия представляет собой функциональное или патологическое изменение нерва и клинически характеризуется аномалией сенсорных или двигательных нейронов.
Центральная невропатия представляет собой функциональное или патологическое изменение в центральной нервной системе.
Периферическая невропатия представляет собой функциональное или патологическое изменение одного или более периферических нервов. Периферические нервы передают информацию от центральной нервной системы (головного и спинного мозга) к мышцам и другим органам, а также от кожи, суставов и других органов обратно к мозгу. Периферическая невропатия возникает, когда эти нервы неспособны передавать информацию головному и спинному мозгу и от них, что приводит к боли, потери чувствительности или неспособности контролировать мышцы. В некоторых случаях потеря функции нервов, которые контролируют кровеносные сосуды, кишечник и другие органы, является причиной аномального кровяного давления, проблем с пищеварением и утраты других основных функций организма. Факторы риска для невропатии включают диабет, злоупотребление алкоголем и воздействие некоторых химических веществ и лекарственных средств. Некоторые люди имеют наследственную предрасположенность к невропатии. Длительное давление на нерв является еще одним фактором риска развития травмы нерва. Травма сжатия может быть вызвана длительной неподвижностью (например, при длительной хирургической процедуре или продолжительной болезни) или сжатием нерва литым протезом, медицинскими шинами, ортодонтическими скобами, костылями или другими устройствами. Полиневропатия предполагает распространенный процесс, который, как правило, поражает обе стороны тела в равной степени. Симптомы зависят от того, нерв какого типа затронут. Тремя основными типами нервов являются сенсорные, двигательные и вегетативные. Невропатия может затрагивать любой из них или все три типа нервов в совокупности. Симптомы также зависят от того, затрагивает ли состояние все тело или только один нерв (как из-за травмы). Причиной хронической воспалительной полиневропатии является аномальный иммунный ответ. Конкретные антигены, иммунные процессы и провоцирующие факторы варьируются и во многих случаях остаются неизвестными. Она может возникать в сочетании с другими состояниями, такими как ВИЧ, воспалительное заболевание кишечника, красная волчанка, хронический активный гепатит и аномалии клеток крови.
Периферическая невропатия может затрагивать функцию или вызывать патологические изменения одного нерва или группы нервов (мононевропатия), или затрагивать функцию или вызывать патологические изменения многих нервов (полиневропатия).
Периферические невропатии
Наследственные заболевания:
болезнь Шарко-Мари-Тута,
атаксия Фридрейха.
Системные или метаболические заболевания:
диабет (диабетическая невропатия),
недостаточность питания (особенно витамина B-12),
избыточное потребление алкоголя (алкогольная невропатия),
уремия (из-за почечной недостаточности),
рак.
Инфекционные или воспалительные заболевания:
СПИД,
гепатит,
колорадская клещевая лихорадка,
дифтерия,
синдром Гийена-Барре,
ВИЧ-инфекция без развития СПИДа,
лепра,
болезнь Лайма,
узелковый полиартериит,
ревматоидный артрит,
саркоидоз,
синдром Шегрена,
сифилис,
системная красная волчанка,
амилоид.
Воздействие токсических соединений:
вдыхание клея или других токсических соединений,
оксид азота,
промышленные средства - особенно растворители,
тяжелые металлы (свинец, мышьяк, ртуть и так далее).
Невропатия, вызываемая лекарственными средствами, такая как анальгетическая невропатия.
Разные причины:
ишемия (пониженное содержание кислорода/уменьшение кровотока),
длительное воздействие низких температур.
a. Полиневропатия
Полиневропатия является периферической невропатией, выражающейся в потере подвижности или чувствительности в некоторой области, что вызвано повреждением или гибелью нескольких периферических нервов. Полиневропатическая боль включает, без ограничения, постполиомиелитный синдром, постмастэктомический синдром, диабетическую невропатию, алкогольную невропатию, амилоид, токсины, СПИД, гипотиреоз, уремию, недостаток витаминов, вызванную химиотерапией боль, лечение 2',3'-дидезоксицитидином (ddC), синдром Гийена-Барре или болезнь Фабри.
b. Мононевропатия
Мононевропатия является периферической невропатией, выражающейся в потере подвижности или чувствительности в некоторой области, что вызвано повреждением или гибелью одного периферического нерва или группы нервов. Мононевропатия наиболее часто бывает вызвана поражением локальной области в результате повреждения или травмы, хотя иногда системные заболевания могут вызывать поражение отдельного нерва (как в случае множественного мононеврита). Обычными причинами являются прямая травма, длительное давление на нерв и сдавливание нерва в результате отека или повреждения находящихся рядом структур организма. Поражение включает разрушение миелиновой оболочки (покрытия) нерва или части нервной клетки (аксона). Это поражение замедляет или предотвращает проведение импульсов через нерв. Мононевропатия может затрагивать любую часть тела. Мононевропатическая боль включает, без ограничения, дисфункцию седалищного нерва, дисфункцию общего малоберцового нерва, дисфункцию лучевого нерва, дисфункцию локтевого нерва, мононевропатию VI черепного нерва, мононевропатию VII черепного нерва, мононевропатию III черепного нерва (компрессионного типа), мононевропатию III черепного нерва (диабетического типа), дисфункцию подмышечного нерва, запястный туннельный синдром, дисфункцию бедренного нерва, дисфункцию большеберцового нерва, паралич Белла, синдром грудного выхода, запястный туннельный синдром и паралич шестого (отводящего) нерва.
c. Генерализованные периферические невропатии
Генерализованные периферические невропатии являются симметричными и, как правило, возникают вследствие различных системных заболеваний и болезненных процессов, которые влияют на периферическую нервную систему в целом. Они в свою очередь подразделяются на несколько категорий:
i. Дистальные аксонопатии являются результатом некоторых метаболических или токсических дисфункций нейронов. Они могут быть вызваны метаболическими заболеваниями, такими как диабет, почечная недостаточность, синдромами недостаточности, такими как недоедание и алкоголизм, или воздействием токсинов или лекарственных средств. Дистальная аксонопатия (также известная как дистальная аксональная полиневропатия) является разновидностью периферической невропатии, которая возникает в результате некоторых метаболических или токсических дисфункций нейронов периферической нервной системы (ПНС). Это наиболее распространенный ответ нервов на метаболические или токсические нарушения, и вследствие этого, она может быть вызвана такими метаболическими заболеваниями, как диабет, почечная недостаточность, синдромами недостаточности, такими как недоедание и алкоголизм, или воздействием токсинов или лекарственных средств. Наиболее распространенной причиной дистальной аксонопатии является диабет, и наиболее распространенной дистальной аксонопатией является диабетическая невропатия.
ii. Миелинопатии возникают вследствие первичной атаки на миелин, вызывающей острую недостаточность проведения импульса. Наиболее распространенной причиной является острая воспалительная демиелинизирующая полиневропатия (AIDP; также известная как синдром Гийена-Барре), хотя другие причины включают синдром хронической воспалительной демиелинизации (CIDP), генетические метаболические заболевания (например, лейкодистрофию) или токсины. Миелинопатия возникает вследствие первичного разрушения миелина или миелинизирующих шванновских клеток, что оставляет аксоны неповрежденными, но вызывает острую недостаточность проведения импульса. Эта демиелинизация замедляет или полностью блокирует проведение электрических импульсов через нерв. Наиболее распространенной причиной является острая воспалительная демиелинизирующая полиневропатия (AIDP, более известная как синдром Гийена-Барре), хотя другие причины включают хроническую воспалительную демиелинизирующую полиневропатию (CIDP), генетические метаболические заболевания (например, лейкодистрофию или болезнь Шарко-Мари-Тута) или токсины.
iii. Нейронопатии являются результатом разрушения нейронов периферической нервной системы (ПНС). Они могут быть вызваны заболеваниями двигательных нейронов, заболеваниями сенсорных нейронов (например, опоясывающим герпесом), токсинами или вегетативной дисфункцией. Нейронопатии могут быть вызваны нейротоксинами, такими как химиотерапевтическое средство винкристин. Нейронопатия представляет собой дисфункцию вследствие повреждения нейронов периферической нервной системы (ПНС), приводящего к периферической невропатии. Она может быть вызвана заболеваниями двигательных нейронов, заболеваниями сенсорных нейронов (например, опоясывающим герпесом), токсичными веществами или вегетативной дисфункцией. У человека с нейронопатией она может проявляться по-разному, в зависимости от причины, от того, каким образом затронуты нервные клетки, и от типа нервных клеток, которые затронуты более всего.
iv. Очаговые компрессионные невропатии (например, запястный туннельный синдром).
II. Воспалительная боль
Соединения по изобретению можно использовать для лечения боли, вызванной или иным образом ассоциированной с любым из следующих воспалительных состояний.
A. Артрит
Артриты включают, например, ревматоидный артрит; ювенильный ревматоидный артрит; системную красную волчанку (СКВ); подагрический артрит; склеродермию; остеоартрит; псориатический артрит; анкилозирующий спондилит; синдром Рейтера (реактивный артрит); болезнь Стилла у взрослых; артрит от вирусной инфекции; артрит от бактериальной инфекции, такой как, например, гонококковой артрит и негонококковый бактериальный артрит (септический артрит); третичную болезнь Лайма; туберкулезный артрит и артрит от грибковой инфекции, такой как, например, бластомикоз.
B. Аутоиммунные заболевания
Аутоиммунные заболевания включают, например, синдром Гийена-Барре, тиреоидит Хашимото, пернициозную анемию, болезнь Аддисона, диабет I типа, системную красную волчанку, дерматомиозит, синдром Шегрена, красную волчанку, рассеянный склероз, миастению, синдром Рейтера и болезнь Грэйва.
C. Заболевание соединительной ткани
Заболевания соединительной ткани включают, например, спондилоартрит, дерматомиозит и фибромиалгию.
D. Травма
Воспаление, вызванное травмой, включая, например, размозжение, колотую рану, растяжение ткани или сустава, может вызывать хроническую воспалительную боль.
E. Инфекция
Воспаление, вызванное инфекцией, включая, например, туберкулез или интерстициальный кератит, может вызывать хроническую воспалительную боль.
F. Неврит
Неврит является воспалительным процессом, затрагивающим нерв или группу нервов. Симптомы зависят от вовлеченных нервов, но могут включать боль, парестезию, парез или гипестезию (онемение).
Примеры включают:
a. плечевой неврит;
b. ретробульбарную невропатию, воспалительный процесс, затрагивающий часть зрительного нерва, лежащую непосредственно за глазным яблоком;
c. оптическую невропатию, воспалительный процесс, затрагивающий зрительный нерв, вызывающий внезапное снижение зрения в пораженном глазу. Причина оптического неврита неизвестна. Внезапное воспаление зрительного нерва (нерва, соединяющего глаз и мозг) приводит к набуханию и разрушению миелиновой оболочки. Иногда воспаление может быть результатом вирусной инфекции или оно может быть вызвано аутоиммунными заболеваниями, такими как рассеянный склероз. Факторы риска связаны с возможными причинами;
d. вестибулярный неврит, вирусная инфекция вызывает воспалительный процесс, затрагивающий вестибулярный нерв.
G. Воспаление суставов
Воспаление суставов, такое как воспаление, вызванное бурситом или тендинитом, например, может приводить к хронической воспалительной боли.
III. Головная боль
Соединения по изобретению можно использовать для лечения боли, вызванной или иным образом ассоциированной с любым из следующих состояний головной боли. Головная боль (известная в медицине как цефалгия) - это состояние легкой или сильной боли в голове; иногда боль в шее или боль в верхней части спины также может восприниматься как головная боль. Она может свидетельствовать о первопричинном местном или системном заболевании, или сама являться заболеванием.
A. Мышечная/миогенная головная боль
Мышечные/миогенные головные боли, судя по всему, связаны со стягиванием или напряжением мышц головы и шеи; они могут иррадиировать ко лбу. Головная боль напряжения является наиболее распространенной формой миогенной головной боли.
Головная боль напряжения является состоянием, включающим боль или дискомфорт в голове, волосистой части головы, или в шее, которое, как правило, связано со стягиванием мышц в этих областях. Головные боли напряжения возникают вследствие сокращения мышц шеи и волосистой части головы. Одной из причин этого сокращения мышц является реакция на стресс, депрессия или тревожность. Любая активность, из-за которой голова удерживается в одном положении в течение долгого времени без движения, может вызвать головную боль. Такие активности включают печатание или работу на компьютере, тонкую ручную работу и использование микроскопа. Сон в холодном помещении или неудобное положение шеи во время сна также может вызвать головную боль такого типа. Головная боль напряжения включает, без ограничения, эпизодическую головную боль напряжения и хроническую головную боль напряжения.
B. Сосудистая головная боль
Наиболее распространенным типом сосудистой головной боли является мигрень. Другие виды сосудистых головных болей включают кластерные головные боли с повторяющимися приступами сильной боли и головные боли вследствие высокого кровяного давления.
1. Мигрень
Мигрень представляет собой гетерогенное заболевание, которое, как правило, включает повторяющиеся головные боли. Мигрени отличаются от других видов головной боли, поскольку они сопровождаются другими симптомами, такими как, например, тошнота, рвота или чувствительность к свету. У большинства людей пульсирующая боль ощущается только на одной стороне головы. Клинические признаки, такие как вид симптомов ауры, наличие предвестников приступа или ассоциированные симптомы, такие как головокружение, можно наблюдать в подгруппах пациентов с различными лежащими в основе патофизиологическими и генетическими механизмами. Мигрень включает, без ограничения, мигрень без ауры (обычную мигрень), мигрень с аурой (классическую мигрень), менструальную мигрень, эквивалент мигрени (ацефалгическую мигрень), сложную мигрень, абдоминальную мигрень и смешанную с головной болью напряжения мигрень.
2. Кластерные головные боли
Кластерные головные боли затрагивают одну сторону головы (односторонние) и могут быть ассоциированы со слезотечением и заложенностью носа. Они случаются в кластерах, происходят повторно каждый день в одно и то же время в течение нескольких недель и затем временно ослабевают.
D. Головная боль из-за высокого кровяного давления
E. Головная боль при растяжении и воспалении
Головные боли при растяжении и воспалении, как правило, являются симптомами других заболеваний, от инсульта до синусита.
F. Гормональная головная боль
G. Рикошетная головная боль
Рикошетные головные боли, также известные как головные боли при избыточном применении лекарственных препаратов, возникают при слишком частом применении препаратов для облегчения головной боли. Рикошетные головные боли часто возникают ежедневно и могут быть очень болезненными.
H. Головная боль при хроническом синусите
Синусит представляет собой воспаление, либо бактериальной, грибковой, вирусной, аллергической, либо аутоиммунной природы, придаточных пазух носа. Хронический синусит является одним из наиболее распространенных осложнений простуды. Симптомы включают: заложенность носа, лицевую боль, головную боль, лихорадку, общее недомогание, густые зеленые или желтые выделения, ощущение «припухлости» лица, усугубляющееся при наклоне. В небольшом количестве случаев хронический верхнечелюстной синусит может также быть вызван распространением бактерий из инфицированных зубов. Хронический гиперпластический эозинофильный синусит является неинфекционной формой хронического синусита.
I. Органическая головная боль
J. Иктальные головные боли
Иктальные головные боли представляют собой головные боли, ассоциированные с судорожной активностью.
IV. Соматическая боль
Соединения по изобретению можно использовать для лечения боли, вызванной или иным образом ассоциированной с любым из следующих соматических болевых состояний. Соматическая боль возникает в связках, сухожилиях, костях, кровеносных сосудах и даже самих нервах. Она воспринимается соматическими ноцицепторами. Из-за дефицита болевых рецепторов в этих областях возникает тупая, плохо локализованная боль большей продолжительности, чем кожная боль; примеры включают вывихи и переломы костей. Дополнительные примеры включают следующее.
A. Чрезмерное мышечное напряжение
Чрезмерное мышечное напряжение может быть вызвано, например, вывихом или растяжением.
B. Расстройства повторяющихся движений
Расстройства повторяющихся движений могут быть результатом чрезмерного движения рук, запястий, локтей, плеч, шеи, спины, бедер, коленей, ступней, ног или лодыжек.
C. Мышечные болезни
Мышечные болезни, вызывающие соматическую боль, включают, например, полимиозит, дерматомиозит, волчанку, фибромиалгию, ревматическую полимиалгию и острый некроз скелетных мышц.
D. Миалгия
Миалгия представляет собой мышечную боль и является симптомом многих заболеваний и нарушений. Наиболее распространенной причиной миалгии является либо перегрузка, либо слишком сильное растяжение мышцы или группы мышц. Миалгия без предшествующей травмы часто возникает вследствие вирусной инфекции. Долгосрочные миалгии могут свидетельствовать о метаболической миопатии, некоторой недостаточности питания или синдроме хронической усталости.
E. Инфекция
Инфекция может приводить к соматической боли. Примеры такой инфекции включают, например, абсцесс в мышцах, трихинеллез, грипп, болезнь Лайма, малярию, пятнистую лихорадку скалистых гор, птичий грипп, простуду, внебольничную пневмонию, менингит, обезьянью оспу, тяжелый острый респираторный синдром, синдром токсического шока, трихинеллез, брюшной тиф и инфекцию верхних дыхательных путей.
F. Лекарственные средства
Лекарственные средства могут вызывать соматическую боль. Такие лекарственные средства включают, например, кокаин, статин для снижения уровня холестерина (такой как аторвастатин, симвастатин и ловастатин) и ингибитор ACE для снижения кровяного давления (такой как эналаприл и каптоприл).
V. Висцеральная боль
Соединения по изобретению можно использовать для лечения боли, вызванной или иным образом ассоциированной с любым из следующих висцеральных болевых состояний. Висцеральная боль возникает во внутренних органах. Висцеральные ноцицепторы находятся в органах тела и внутренних полостях. Из-за еще большего дефицита ноцицепторов в этих областях возникает боль, как правило, более ноющая и более продолжительная, чем соматическая боль. Висцеральную боль чрезвычайно сложно локализовать, и некоторые повреждения висцеральной ткани вызывают «реперкуссионную» боль, когда ощущение боли локализовано в области, совершенно не связанной с зоной повреждения. Примеры висцеральной боли включают следующие.
A. Функциональная висцеральная боль
Функциональная висцеральная боль включает, например, синдром раздраженной кишки и хроническую функциональную абдоминальную боль (CFAP), функциональный запор и функциональную диспепсию, несердечную боль в груди (NCCP) и хроническую абдоминальную боль.
B. Хроническое желудочно-кишечное воспаление
Хроническое желудочно-кишечное воспаление включает, например, гастрит, воспалительное заболевание кишечника, такое как, например, болезнь Крона, язвенный колит, микроскопический колит, дивертикулит и гастроэнтерит, интерстициальный цистит, ишемию кишечника, холецистит, аппендицит, гастроэзофагеальный рефлюкс, язву, почечнокаменную болезнь, инфекцию мочевыводящих путей, панкреатит и грыжу.
C. Аутоиммунная боль
Аутоиммунная боль включает, например, саркоидоз и васкулит.
D. Органическая висцеральная боль
Органическая висцеральная боль включает, например, боль, возникающую в результате травматического, воспалительного или дегенеративного поражения кишечника или производимую опухолью, давящей на область сенсорной иннервации.
E. Висцеральная боль, вызванная лечением
Висцеральная боль, вызванная лечением, включает, например, боль, сопутствующую химиотерапии, или боль, сопутствующую лучевой терапии.
VI. Реперкуссионная боль
Соединения по изобретению можно использовать для лечения боли, вызванной или иным образом ассоциированной с любым из следующих реперкуссионных болевых состояний.
Реперкуссионная боль представляет собой боль, локализованную в области, отдельной от области стимуляции боли. Часто реперкуссионная боль возникает, когда нерв сдавлен или поврежден в его начале или рядом с ним. В этом случае ощущение боли будет, как правило, возникать в области, иннервируемой данным нервом, даже если повреждение происходит в других местах. Обычным примером является грыжа межпозвоночного диска, при которой нервный корешок, выходящий из спинного мозга, сдавливается массой близлежащего диска. Хотя причиной боли может быть сам поврежденный диск, боль может также ощущаться в области, иннервируемой сдавленным нервом (например, в бедре, колене или ступне). Уменьшение давления на корешок нерва может облегчать реперкуссионную боль при условии, что не произошло постоянное повреждение нерва. Миокардиальная ишемия (прекращение потока крови к части ткани сердечной мышцы), возможно, самый известный пример реперкуссионной боли; ощущение может возникать в верхней части грудной клетки как четко ограниченная боль, или как боль в левом плече, руке или даже кисти руки.
Настоящее изобретение затрагивает широкий диапазон болевых состояний, особенно хронических болевых состояний. Предпочтительные состояния включают боль от раковых и доброкачественных опухолей, воспалительную боль и невропатическую боль. Слитые белки с опиоидом по настоящей заявке особенно подходят для использования в случае воспалительной боли, хотя возможно, менее подходят для использования в случае невропатической боли. Слитые белки с галанином более подходят для использования в случае невропатической боли.
На практике полипептиды по настоящему изобретению, как правило, используют в форме фармацевтической композиции вместе с фармацевтическим носителем, разбавителем и/или эксципиентом, хотя точную форму композиции можно адаптировать к способу введения. Введение предпочтительно осуществляют млекопитающему, более предпочтительно человеку.
Полипептиды, например, можно использовать в форме стерильного раствора для внутрисуставного введения или внутричерепного введения. Предпочтительной является спинальная инъекция (например, эпидуральная или интратекальная).
Диапазоны доз для введения полипептидов по настоящему изобретению являются такими, которые создают желаемый терапевтический эффект. Следует иметь в виду, что требуемый диапазон доз зависит от конкретной природы компонентов, пути введения, характера препарата, возраста пациента, характера, распространения или степени тяжести состояния пациента, противопоказаний, в случае их наличия, и мнения лечащего врача.
Подходящие суточные дозы лежат в диапазоне 0,0001-1 мг/кг, предпочтительно 0,0001-0,5 мг/кг, более предпочтительно 0,002-0,5 мг/кг и особенно предпочтительно 0,004-0,5 мг/кг. Стандартная лекарственная доза может варьироваться от менее чем 1 микрограмма до 30 мг, однако, как правило, будет находиться в диапазоне от 0,01 до 1 мг на дозу, которую можно вводить раз в сутки или предпочтительно реже, например, раз в неделю или раз в полгода.
Особенно предпочтительный режим дозирования основан на введении 2,5 нг слитого белка в виде 1× дозы. В этом отношении, предпочтительные дозы находятся в диапазоне 1×-100× (то есть 2,5-250 нг). Этот диапазон доз значительно ниже (то есть по меньшей мере в 10 раз, как правило, в 100 раз ниже), чем тот, который используют в случае других анальгетических молекул, таких как НПВС, морфин и габапентин. Более того, вышеуказанная разница значительно возрастает, когда такое же сравнение проводят на молярной основе - это происходит потому, что слитые белки по настоящему изобретению имеют гораздо большую молекулярную массу (Mw), чем общепринятые «низкомолекулярные» терапевтические средства.
Следует, однако, ожидать широких вариаций в необходимой дозировке в зависимости от конкретной природы компонентов и разной эффективности различных путей введения.
Различия в этих уровнях доз можно корректировать с использованием стандартных эмпирических процедур для оптимизации, как хорошо известно в данной области.
Композиции, подходящие для инъекции, могут быть в виде растворов, суспензий или эмульсий, или сухих порошков, которые растворяют или суспендируют в подходящем носителе перед использованием.
Жидкие стандартные лекарственные формы, как правило, получают, используя апирогенный стерильный носитель. Активные ингредиенты, в зависимости от носителя и используемой концентрации, можно либо растворять, либо суспендировать в носителе.
При получении растворов для введения полипептиды можно растворять в носителе, при этом раствор делают изотоническим, если необходимо, путем добавления хлорида натрия, и стерилизовать фильтрованием через стерильный фильтр с использованием асептических методик перед разливанием в подходящие стерильные сосуды или ампулы и запаиванием. Альтернативно, в случае адекватной стабильности раствора, раствор в запаянных контейнерах можно стерилизовать в автоклаве.
Предпочтительно такие добавки, как буферы, солюбилизирующие средства, стабилизаторы, консерванты или бактерицидные средства, суспендирующие или эмульгирующие средства, можно растворять в носителе.
Сухие порошки, которые растворяют или суспендируют в подходящем носителе перед использованием, можно получать, помещая предварительно стерилизованную лекарственную субстанцию и другие ингредиенты в стерильный контейнер с использованием асептических методик в стерильной зоне.
Альтернативно, полипептиды и другие ингредиенты можно растворять в водном носителе, раствор стерилизовать фильтрованием и распределять в подходящие контейнеры с использованием асептических методик в стерильной зоне. Затем продукт лиофилизируют и контейнеры герметизируют в асептических условиях.
Парентеральные суспензии, подходящие для внутримышечной, подкожной или внутрикожной инъекции, получают практически таким же образом, за исключением того, что стерильные компоненты суспендируют в стерильном носителе вместо растворения и для стерилизации нельзя использовать фильтрование. Компоненты можно выделять в стерильном состоянии или, альтернативно, их можно стерилизовать после выделения, например, гамма-излучением.
Предпочтительно, суспендирующее средство, например поливинилпирролидон, включают в композицию(и) для облегчения равномерного распределения компонентов.
Раздел «Определения»
Направляющий фрагмент (TM) означает любую химическую структуру, связанную со средством, которая функционально взаимодействует с сайтом связывания, создавая физическую связь между средством и поверхностью клетки-мишени. В контексте настоящего изобретения клетка-мишень представляет собой ноцицептивный сенсорный афферент. Термин TM охватывает любые молекулы (то есть природные молекулы или их химически/физически модифицированные варианты), которые способны связываться с сайтом связывания на клетке-мишени, при этом сайт связывания способен к интернализации (например, образованию эндосомы) - также называемой рецептор-опосредованным эндоцитозом. TM может иметь функцию транслокации через эндосомальную мембрану, в этом случае нет необходимости в присутствии отдельно компонентов TM и домена транслокации в средстве по настоящему изобретению.
TM по настоящему изобретению связывается (предпочтительно специфически связывается) с ноцицептивным сенсорным афферентом (например, основным ноцицептивным афферентом). В этом смысле «специфически связывается» означает, что TM связывается с ноцицептивным сенсорным афферентом (например, основным ноцицептивным афферентом) с большей аффинностью, чем он связывается с другими нейронами, такими как неноцицептивные афференты, и/или с двигательными нейронами (то есть естественной мишенью для голотоксина клостридиального нейротоксина). Термин «специфически связывается» может также означать, что данный TM связывается с данным рецептором, например, рецепторами галанина, такими как рецепторы GALR1, GALR2 и/или GALR3, с аффинностью связывания (Ka), равной 106 M-1 или более, предпочтительно 107 M-1 или более, более предпочтительно 108 M-1 или более и наиболее предпочтительно 109 M-1 или более.
Для целей настоящего изобретения агонист определяют как молекулу, которая способна стимулировать процесс экзоцитозного слияния в клетке-мишени, процесс, который подвержен ингибированию протеазой, способной расщеплять белок экзоцитозного аппарата слияния в указанной клетке-мишени.
Соответственно, конкретное определение агониста по настоящему изобретению будет исключать многие молекулы, которые в общепринятом смысле считались бы агонистами.
Например, фактор роста нервов (NGF) является агонистом с точки зрения его способности стимулировать нейрональную дифференциацию посредством связывания с рецептором TrkA. Однако NGF не является агонистом при оценке в соответствии с вышеуказанными критериями, поскольку он не является основным индуктором экзоцитозного слияния. Кроме того, процесс, который NGF стимулирует (то есть клеточная дифференциация), не восприимчив к ингибированию протеазной активностью нецитотоксической молекулы токсина.
Термин «фрагмент», используемый применительно к белку, означает пептид, имеющий по меньшей мере тридцать пять, предпочтительно по меньшей мере двадцать пять, более предпочтительно по меньшей мере двадцать и наиболее предпочтительно по меньшей мере 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 аминокислотных остатков интересующего белка.
Термин «вариант», используемый применительно к белку, означает пептид или пептидный фрагмент белка, содержащий один или более аналогов аминокислот (например, неприродные аминокислоты) или замещенную связь.
Термин «производное», используемый применительно к белку, означает белок, который содержит интересующий белок и дополнительную пептидную последовательность. Дополнительная пептидная последовательность предпочтительно не должна препятствовать основному сворачиванию и, следовательно, конформационной структуре исходного белка. Два или более пептидов (или фрагментов, или вариантов) могут быть соединены вместе, образуя производное. Альтернативно, пептид (или фрагмент, или вариант) может быть связан с посторонней молекулой (например, вторым посторонним пептидом). Производные можно синтезировать химическими методами, однако, как правило, их получают методами рекомбинантных нуклеиновых кислот. Могут быть включены такие дополнительные компоненты, как липидные и/или полисахаридные, и/или полипептидные компоненты.
Термин «нецитотоксическая» означает, что интересующая молекула протеазы не убивает клетку-мишень, на которую она была перенаправлена.
Протеаза по настоящему изобретению включает все природные нецитотоксические протеазы, способные расщеплять один или более белков экзоцитозного аппарата слияния в эукариотических клетках.
Нецитотоксическая протеаза по настоящему изобретению предпочтительно является бактериальной протеазой. В одном варианте осуществления нецитотоксическая протеаза выбрана из протеаз рода Clostridium или Neisseria (например, L-цепь клостридий или IgA-протеаза нейссерий, предпочтительно из N. gonorrhoeae). Термин «протеаза» охватывает ее функционально эквивалентные фрагменты и молекулы.
Настоящее изобретение также охватывает модифицированные нецитотоксические протеазы, которые содержат аминокислотные последовательности, не существующие в природе, и/или синтетические аминокислотные остатки, при условии, что модифицированные протеазы продолжают проявлять вышеуказанную протеазную активность.
Протеаза по настоящему изобретению предпочтительно проявляет сериновую или металлопротеиназную активность (например, эндопептидазную активность). Протеаза предпочтительно является специфичной для белка SNARE (например, SNAP-25, синаптобревина/VAMP или синтаксина).
Особого упоминания заслуживают протеазные домены нейротоксинов, например протеазные домены бактериальных нейротоксинов. Таким образом, настоящее изобретение охватывает применение доменов нейротоксинов, существующих в природе, а также полученных рекомбинантными методами вариантов указанных природных нейротоксинов.
Иллюстративные нейротоксины продуцируются клостридиями, и термин «клостридиальный нейротоксин» охватывает нейротоксины, продуцируемые C. tetani (TeNT) и C. botulinum (BoNT) серотипов A-G, а также близкородственные BoNT-подобные нейротоксины, продуцируемые C. baratii и C. butyricum. Вышеуказанные аббревиатуры используются во всем тексте настоящей спецификации. Например, номенклатура BoNT/A обозначает источник нейротоксина как BoNT (серотип A). Соответствующая номенклатура относится и к другим серотипам BoNT.
Термин «L-цепь» или «фрагмент LC» означает компонент L-цепи нейротоксина, проявляющий металлопротеиназную активность и способный протеолитически расщеплять связанный с везикулярной и/или плазматической мембраной белок, вовлеченный в клеточный экзоцитоз.
Домен транслокации представляет собой молекулу, делающую возможным перенос протеазы (или ее фрагмента) в клетку-мишень таким образом, что функциональная экспрессия протеазной активности происходит внутри цитозоля клетки-мишени. Обладает ли какая-либо молекула (например, белок или пептид) необходимой функцией транслокации по настоящему изобретению, можно определять любым из целого ряда общепринятых анализов.
Например, в статье Shone C. (1987) описан in vitro анализ с использованием липосом, на которые воздействуют тестируемой молекулой. Наличие необходимой функции транслокации подтверждается высвобождением из липосом K+ и/или меченого NAD, которое можно легко отслеживать [смотрите Shone C. (1987) Eur. J. Biochem; vol. 167(1): pp. 175-180].
Другой пример приведен в статье Blaustein R. (1987), в которой описан простой in vitro анализ с использованием плоских фосфолипидных бислойных мембран. На мембраны воздействуют тестируемой молекулой, и наличие необходимой функции транслокации подтверждается увеличением проводимости через мембраны [смотрите Blaustein (1987) FEBS Letts; vol. 226, no. 1: pp. 115-120].
Дополнительные методики, позволяющие оценивать слияние мембран и таким образом идентифицировать домены транслокации, подходящие для использования по настоящему изобретению, приведены в сборниках Methods in Enzymology, том 220 и 221, Membrane Fusion Techniques, части A и B, Academic Press 1993.
Домен транслокации предпочтительно способен образовывать ионопроницаемые поры в липидных мембранах в условиях низкого значения pH. Как установлено, предпочтительно использовать только те части белковой молекулы, которые способны образовывать поры в эндосомальной мембране.
Домен транслокации можно получать из микробного источника белка, в частности, из бактериального или вирусного источника белка. Таким образом, в одном варианте осуществления домен транслокации представляет собой транслоцирующий домен фермента, такого как бактериальный токсин или вирусный белок.
Документально подтверждено, что некоторые домены молекул бактериальных токсинов способны образовывать такие поры. Также известно, что некоторые домены транслокации экспрессированных в вирусах мембранных слитых белков способны образовывать такие поры. Такие домены можно использовать по настоящему изобретению.
Домен транслокации может быть клостридиального происхождения, а именно, представлять собой домен HN (или его функциональный компонент). HN означает часть или фрагмент H-цепи клостридиального нейротоксина, примерно эквивалентный аминоконцевой половине H-цепи, или домен, соответствующий этому фрагменту в интактной H-цепи. Предпочтительно, если H-цепь практически лишена естественной функции связывания HC компонента H-цепи. В связи с этим, функцию HC можно удалять путем делеции аминокислотной последовательности HC (либо на уровне синтеза ДНК, либо на уровне после синтеза за счет обработки нуклеазой или протеазой). Альтернативно, функцию HC можно инактивировать путем обработки химическими или биологическими веществами. Таким образом, H-цепь предпочтительно неспособна связываться с сайтом связывания на клетке-мишени, с которым связывается природный клостридиальный нейротоксин (то есть голотоксин).
В одном варианте осуществления домен транслокации представляет собой домен HN (или его фрагмент) клостридиального нейротоксина. Примеры подходящих доменов транслокации включают:
Для более подробной информации о генетической основе продуцирования токсина в Clostridium botulinum и C. tetani авторы изобретения ссылаются на статью Henderson et al. (1997) в The Clostridia: Molecular Biology and Pathogenesis, Academic press.
Термин «HN» охватывает природные HN части нейротоксина, и модифицированные HN части, которые имеют аминокислотные последовательности, не существующие в природе, и/или синтетические аминокислотные остатки, при условии, что модифицированные HN части все еще проявляют вышеуказанную функцию транслокации.
Альтернативно, домен транслокации может быть не клостридиального происхождения (смотрите таблицу 4). Примеры доменов транслокации не клостридиального происхождения включают, но не ограничиваются ими, домен транслокации дифтерийного токсина [O’Keefe et al., Proc. Natl. Acad. Sci. USA (1992) 89, 6202-6206; Silverman et al., J. Biol. Chem. (1993) 269, 22524-22532; и London, E. (1992) Biochem. Biophys. Acta., 1112, pp.25-51], домен транслокации экзотоксина типа A Pseudomonas [Prior et al., Biochemistry (1992) 31, 3555-3559], домены транслокации токсина сибирской язвы [Blanke et al., Proc. Natl. Acad. Sci. USA (1996) 93, 8437-8442], разнообразные фузогенные или гидрофобные пептиды с транслокационной функцией [Plank et al., J. Biol. Chem. (1994) 269, 12918-12924; и Wagner et al. (1992) PNAS, 89, pp.7934-7938], а также амфифильные пептиды [Murata et al. (1992) Biochem., 31, pp. 1986-1992]. Домен транслокации может дублировать домен транслокации, присутствующий в природном белке, или может содержать аминокислотные вариации такой длины, чтобы эти вариации не нарушали транслокационную способность домена транслокации.
Конкретные примеры вирусных доменов транслокации, подходящих для использования по настоящему изобретению, включают некоторые транслоцирующие домены экспрессируемых в вирусах мембранных слитых белков. Например, в статьях Wagner et al. (1992) и Murata et al. (1992) описана функция транслокации (то есть слияния мембран и везикуляции) ряда фузогенных и амфифильных пептидов, происходящих из N-концевой области гемагглютинина вируса гриппа. Другие экспрессируемые в вирусах мембранные слитые белки, которые, как известно, имеют нужную транслокационную активность, представляют собой транслоцирующий домен фузогенного пептида вируса леса Семлики (SFV), транслоцирующий домен гликопротеина G вируса везикулярного стоматита (VSV), транслоцирующий домен F-белка вируса SER и транслоцирующий домен гликопротеина оболочки вируса пенистости обезьян. Кодируемые вирусами белки Aspike имеют конкретное применение в контексте настоящего изобретения, например, белок E1 SFV и белок G VSV.
Использование доменов транслокации, перечисленных в таблице (ниже), включает использование их вариантных последовательностей. Вариант может содержать одну или более консервативных нуклеотидных замен и/или нуклеотидных делеций или вставок при условии, что вариант обладает необходимой транслокационной функцией. Вариант может также содержать одну или более аминокислотных замен и/или аминокислотных делеций или вставок при условии, что вариант обладает необходимой транслокационной функцией.
Далее следует краткое описание чертежей, которые иллюстрируют аспекты и/или варианты осуществления настоящего изобретения.
Фиг.1 - Очистка слитого белка LC/A-спейсер-галанин-спейсер-HN/A
Следуя методологии, приведенной в примере 3, слитый белок LC/A-GS18-галанин-GS20-HN/A очищали из клеток BL21 E. coli. Вкратце, растворимые продукты, полученные после разрушения клеток, наносили на колонку для аффинной хроматографии с ионами никеля. Связанные белки элюировали 100 мМ имидазолом, обрабатывали энтерокиназой для активации слитого белка и обрабатывали фактором Xa для удаления маркера мальтоза-связывающего белка (MBP). Активированный слитый белок затем вновь наносили на вторую колонку для аффинной хроматографии с ионами никеля. Образцы, собранные во время процедуры очистки, оценивали методами ДСН-ПААГ (панель A) и вестерн-блоттинга (панель B). Антисыворотку против галанина (полученную от компании Abcam) и антисыворотку против his-маркера (полученную от компании Qiagen) использовали в качестве первичного антитела для вестерн-блот анализа. Конечный очищенный материал в отсутствие и в присутствии восстанавливающего агента идентифицировали на дорожках панели A, обозначенных [-] и [+], соответственно. Панель A, дорожка 1 = набор маркеров молекулярной массы Benchmark; 2 = растворимая фракция; 3 = 1-й His-продукт; 4 = активированный очищенный белок; 5 = второй His-продукт; 6 = конечный очищенный белок 5 мкл; 7 = конечный очищенный белок 10 мкл; 8 = конечный очищенный белок 20 мкл; 9 = конечный очищенный белок 5 мкл + DTT; 10 = конечный очищенный белок 10 мкл + DTT. Панель B, дорожка 1 = набор маркеров молекулярной массы Benchmark; 2 = растворимая фракция; 3 = 1-й His-продукт; 4 = активированный очищенный белок; 5 = второй His-продукт; 6 = конечный очищенный белок 2 мкл; 7 = конечный очищенный белок 5 мкл; 8 = конечный очищенный белок 10 мкл; 9 = конечный очищенный белок 2 мкл + DTT; 10 = конечный очищенный белок 5 мкл + DTT.
Фиг.2 - Очистка слитого белка LC/C-спейсер-галанин-спейсер-HN/C
Следуя методологии, приведенной в примере 3, слитый белок LC/C-галанин-HN/C очищали из клеток BL21 E. coli. Вкратце, растворимые продукты, полученные после разрушения клеток, наносили на колонку для аффинной хроматографии с ионами никеля. Связанные белки элюировали 100 мМ имидазолом, обрабатывали энтерокиназой для активации слитого белка, затем вновь наносили на вторую колонку для аффинной хроматографии с ионами никеля. Образцы, собранные во время процедуры очистки, оценивали методами ДСН-ПААГ (панель A) и вестерн-блоттинга (панель B). Антисыворотку против галанина (полученную от компании Abcam) и антисыворотку против his-маркера (полученную от компании Qiagen) использовали в качестве первичного антитела для вестерн-блот анализа. Конечный очищенный материал в отсутствие и в присутствии восстанавливающего агента идентифицировали в панели A на дорожках, обозначенных [-] и [+], соответственно. Панель A, дорожка 1 = набор маркеров молекулярной массы Benchmark; 2 = растворимая фракция; 3 = продукт с 1-й колонки; 4 = активированный энтерокиназой белок; 5 = конечный продукт 0,1 мг/мл (5 мкл); 6 = конечный продукт 0,1 мг/мл + DTT (5 мкл); 7 = конечный продукт 0,1 мг/мл (10 мкл); 8 = конечный продукт 0,1 мг/мл + DTT (10 мкл). Панель B, дорожка 1 = набор маркеров молекулярной массы Magic mark; 2 = растворимая фракция; 3 = продукт с 1-й колонки для His-маркера; 4 = активированный слитый белок; 5 = очищенный продукт 0,1 мг/мл (5 мкл); 6 = очищенный продукт 0,1 мг/мл + DTT (5 мкл); 7 = очищенный продукт 0,1 мг/мл + 100 мМ DTT (10 мкл); 8 = очищенный продукт 0,1 мг/мл + 100 мМ DTT (10 мкл) + DTT.
Фиг.3 - Сравнение эффективности расщепления SNARE слитым белком LC-спейсер-галанин-спейсер-HN и слитым белком LC-HN-галанин
Панели A и B: Оценивали способность слитых белков с галанином расщеплять SNAP-25 в клетках CHO GALR1 SNAP25. Клетки яичника китайского хомячка (CHO) трансфицировали таким образом, чтобы они экспрессировали рецептор GALR1. Указанные клетки дополнительно трансфицировали для экспрессии белка SNARE (SNAP-25). Трансфицированные клетки подвергали воздействию различных слитых белков с галанином в различных концентрациях в течение 24 часов. Клеточные белки разделяли ДСН-ПААГ, проводили вестерн-блоттинг и обрабатывали блоты анти-SNAP-25 антителами для облегчения оценки расщепления SNAP-25. Процент расщепленного SNAP-25 рассчитывали при помощи денситометрического анализа. Из полученных данных видно, что слитый белок LC-спейсер-галанин-спейсер-HN (слитый белок 1) является более эффективным, чем слитый белок LC-HN-галанин и контрольная молекула без лиганда LC/A-HN/A.
Фиг.4 - Изучение активации рецепторов GALR1 в анализе расщепления CHO-GALCHO-GALR1 SNAP-25 слитыми белками с галанином по настоящему изобретению, имеющими каркасы различных серотипов
Клетки яичника китайского хомячка (CHO) трансфицировали таким образом, чтобы они экспрессировали рецептор GALR1 и SNAP-25. Указанные клетки использовали для измерения исчезновения цАМФ, которое происходит, когда рецептор активируется лигандом галанином, с помощью набора для определения цАМФ, основанном на методе FRET (набор LANCE от компании Perkin Elmer). Трансфицированные клетки подвергали воздействию слитых белков с галанином (GA16) в различных концентрациях, имеющих каркасы различных серотипов (то есть серотипов A, B, C и D ботулинического нейротоксина), в течение 2 часов. Затем определяли уровни цАМФ, добавляя смесь для обнаружения, содержащую флуоресцентно меченный цАМФ-индикатор (европий-стрептавидин/биотин-цАМФ) и флуоресцентно (Alexa) меченное анти-цАМФ антитело, и инкубируя при комнатной температуре в течение 24 часов. Затем на образцы воздействовали возбуждающим светом с длиной волны 320 нМ и измеряли излучаемый свет с длиной волны 665 нМ для определения уровней цАМФ. Данные показали, что слитые белки с галанином по настоящему изобретению, имеющие каркасы различных серотипов, активировали рецептор GALR1.
Фиг.5 - Расщепление белка SNARE слитыми белками с галанином (GA16 и GA30) в анализе расщепления CHO-GALR1 SNAP-25
Клетки яичника китайского хомячка (CHO) трансфицировали таким образом, чтобы они экспрессировали рецептор GALR1. Указанные клетки дополнительно трансфицировали для экспрессии белка SNARE (SNAP-25). Трансфицированные клетки подвергали воздействию различных слитых белков с галанином в различных концентрациях в течение 24 часов. Клеточные белки разделяли ДСН-ПААГ, проводили вестерн-блоттинг и обрабатывали блоты анти-SNAP-25 антителами для облегчения оценки расщепления SNAP-25. Процент расщепленного SNAP-25 рассчитывали при помощи денситометрического анализа. Данные продемонстрировали, что слитые белки с галанином, имеющие лиганды галанин-16 и галанин-30, расщепляют белок SNARE. Кроме того, данные подтвердили, что слитые белки с галанином, имеющие спейсеры GS5, GS10 и GS18 между компонентом нецитотоксической протеазы и сайтом расщепления протеазой, являются функциональными.
Фиг.6 - Результаты in vivo анализа защитного отдергивания лапы с использованием слитых белков с галанином
Ноцицептивный сгибательный рефлекс (также известный как анализ защитного отдергивания лапы) представляет собой быстрое движение отдергивания лапы, являющееся защитным механизмом от возможного повреждения конечностей. Его можно количественно определять путем оценки электромиографического (ЭМГ) ответа у анестезированной крысы на низкую дозу капсаицина, электрическую стимуляцию или электрический ответ при сенсибилизации капсаицином. Проводили внутриподошвенную предварительную обработку (за 24 часа) слитыми белками по настоящему изобретению самцов крыс Sprague-Dawley весом 300-380 г. Защитное отдергивание лапы вызывали при помощи 0,006% капсаицина, 10 мкл в PBS (7,5% ДМСО), введенного инъекцией в течение 10 секунд. Это вызывает сильный рефлекторный ответ двуглавой мышцы бедра. Уменьшение/подавление ноцицептивного сгибательного рефлекса свидетельствует о том, что тестируемое вещество проявляет антиноцицептивный эффект. Данные продемонстрировали антиноцицептивный эффект слитых белков с галанином по настоящему изобретению.
Фиг.7 - Эффективность слитых белков с галанином в анализе индуцированной капсаицином тепловой гипералгезии
Оценивали способность различных слитых белков с галанином по изобретению подавлять индуцированную капсаицином тепловую гипералгезию. Проводили внутриподошвенную предварительную обработку слитыми белками крыс Sprague-Dawley, через 24 часа вводили инъекцией 0,3% капсаицин и крыс помещали на нагретую до 25°C стеклянную пластину (крыс содержали в акриловых боксах на пластине, нагретой до 25°C). Световой луч (с регулируемой интенсивностью света) фокусировали на задней лапе. Датчики регистрировали движение лапы, останавливая таймер. Задержка отдергивания лапы представляет собой время до отдергивания лапы от источника тепла (порог отсечения 20,48 секунды). Уменьшение/подавление задержки отдергивания лапы свидетельствует о том, что тестируемое вещество проявляет антиноцицептивный эффект. № 1 = LC-HN-GA16; № 2 = LC-HN-GA30; № 3 = LC-GS5-EN-CPGA16-GS20-HN-HT; № 4 = LC-GS18-EN-CPGA16-GS20-HN-HT; № 5 = BOTOX; № 6 = морфин. Данные продемонстрировали усиленный антиноцицептивный эффект слитых белков с галанином по настоящему изобретению по сравнению со слитыми белками с представленным на C-конце лигандом.
Фиг.8 - Эффективность слитых белков с галанином в анализе индуцированной капсаицином тепловой гипералгезии
Оценивали способность различных слитых белков с галанином по изобретению подавлять индуцированную капсаицином тепловую гипералгезию. Проводили внутриподошвенную предварительную обработку слитыми белками крыс Sprague-Dawley, через 24 часа вводили инъекцией 0,3% капсаицин и крыс помещали на нагретую до 25°C стеклянную пластину (крыс содержали в акриловых боксах на пластине, нагретой до 25°C). Световой луч (с регулируемой интенсивностью света) фокусировали на задней лапе. Датчики регистрировали движение лапы, останавливая таймер. Задержка отдергивания лапы представляет собой время до отдергивания лапы от источника тепла (порог отсечения 20,48 секунды). Уменьшение/подавление задержки отдергивания лапы свидетельствует о том, что тестируемое вещество проявляет антиноцицептивный эффект. Данные продемонстрировали антиноцицептивный эффект слитых белков с галанином по настоящему изобретению, имеющих каркасы различных серотипов (то есть A, B, C и D).
Фиг.9 - Активация слитых белков с галанином, имеющих один и два спейсера
Слитые белки с галанином, лишенные первого спейсера (спейсера 1) по настоящему изобретению, расположенного между компонентом нецитотоксической протеазы и компонентом направляющего фрагмента, продемонстрировали плохую активацию протеазой (панели A и B). Панель C демонстрирует усиленную активацию слитых белков с галанином по настоящему изобретению, имеющих как первый (спейсер 1), так и второй (спейсер 2) спейсеры. Панели A и B: 1) набор маркеров молекулярной массы Benchmark; 2) неактивированный контроль; 3) неактивированный контроль + DTT; 4) активированный протеазой белок + 0,0 мМ ZnCl2; 5) активированный протеазой белок + 0,0 мМ ZnCl2 + DTT; 6) активированный протеазой белок + 0,2 мМ ZnCl2; 7) активированный протеазой белок + 0,2 мМ ZnCl2 + DTT; 8) активированный протеазой белок + 0,4 мМ ZnCl2; 9) активированный протеазой белок + 0,4 мМ ZnCl2 + DTT; 10) активированный протеазой белок + 0,8 мМ ZnCl2; 11) активированный протеазой белок + 0,8 мМ ZnCl2 + DTT. Панель C: 1) набор маркеров молекулярной массы Benchmark; 2) неактивированный контроль 25°C; 3) неактивированный контроль 25°C + DTT; 4) активированный протеазой белок 25°C; 5) активированный протеазой белок 25°C + DTT; 6) набор маркеров молекулярной массы Benchmark.
SEQ ID NO
Там, где начальный аминокислотный остаток Met или соответствующий начальный кодон указан в любой из следующих SEQ ID NO, указанный остаток/кодон является необязательным.
Примеры
Пример 1 - Конструирование и активация слитых белков с галанином
Получение клонов каркасов LC/A и HN/A
Следующую методику использовали для получения фрагментов LC и HN, используемых в качестве каркасного компонента для экспрессии мультидоменного слитого белка. В основе данного примера лежит получение клона на базе серотипа A (SEQ ID NO: 1 и SEQ ID NO: 2), хотя процедуры и методы в равной степени применимы и в случае других серотипов (то есть серотипов A, B, C, D и E), что проиллюстрировано списком последовательностей для серотипа B (SEQ ID NO: 3 и SEQ ID NO: 4) и серотипа C (SEQ ID NO: 5 и SEQ ID NO: 6).
Получение клонирующих и экспрессионных векторов
pCR 4 (Invitrogen) выбран в качестве стандартного клонирующего вектора благодаря отсутствию последовательностей рестрикции в составе вектора и примыкающим сайтам праймеров для секвенирования для легкого подтверждения конструктов. Вектор экспрессии основан на экспрессионном векторе pMAL (NEB), который имеет нужные последовательности рестрикции в составе сайта множественного клонирования в правильной ориентации для вставки конструкта (BamHI-SalI-PstI-HindIII). Фрагмент экспрессионного вектора был удален для создания немобилизуемой плазмиды, и множество различных меток слияния были вставлены для расширения возможностей очистки.
Получение протеазной (например, LC/A) вставки
LC/A (SEQ ID NO: 1) получали одним из двух способов:
Последовательность ДНК разрабатывали путем обратной трансляции аминокислотной последовательности LC/A [полученной из находящихся в свободном доступе источников баз данных, таких как GenBank (регистрационный номер P10845) или Swissprot (регистрационный локус BXA1_CLOBO) с использованием одного из множества программных инструментов обратной трансляции (например, EditSeq best E. coli reverse translation (DNASTAR Inc.) или Backtranslation tool v2.0 (Entelechon)]. Последовательности узнавания BamHI/SalI вставляли на 5'- и 3'-концах последовательности, соответственно, сохраняя правильную рамку считывания. Проводили скрининг последовательности ДНК (с использованием такой программы, как MapDraw, DNASTAR Inc.) на последовательности расщепления ферментами рестрикции, вставленные в процессе обратной трансляции. Любые последовательности расщепления, которые, как было установлено, являются общими с теми, которые необходимы для системы клонирования, удаляли вручную из планируемой кодирующей последовательности, обеспечивая сохранение характерного для E. coli использования кодонов. Использование кодонов E. coli оценивали, обращаясь к таким программам, как Graphical Codon Usage Analyser (Geneart), и содержание % GC и коэффициент использования кодонов оценивали, обращаясь к опубликованным таблицам использования кодонов (например, GenBank Release 143, 13 сентября 2004 г.). Эта оптимизированная последовательность ДНК, содержащая открытую рамку считывания (ORF) LC/A, затем была синтезирована на коммерческой основе (например, в компаниях Entelechon, Geneart или Sigma-Genosys) и предоставлена в векторе pCR 4.
Альтернативный способ заключался в использовании ПЦР-амплификации из существующей последовательности ДНК с последовательностями для ферментов рестрикции BamHI и SalI, вставленными в 5' и 3' ПЦР-праймеры, соответственно. Комплементарные олигонуклеотидные праймеры были химически синтезированы поставщиком (например, MWG или Sigma-Genosys) таким образом, что каждая пара могла гибридизоваться с противоположными цепями (3'-концы, направленные «в сторону» друг друга), фланкируя участок целевой ДНК Clostridium, по одному олигонуклеотиду для каждой из двух цепей ДНК. Для получения ПЦР-продукта пару коротких олигонуклеотидных праймеров, специфичных для последовательности ДНК Clostridium, смешивали с ДНК-матрицей Clostridium и другими компонентами реакции и помещали в прибор («прибор для ПЦР»), который мог менять температуру инкубации пробирки с реакционной смесью автоматически, проводя циклы от примерно 94°C (для денатурации), 55°C (для отжига олигонуклеотидов) и 72°C (для синтеза). Другие реагенты, необходимые для амплификации ПЦР-продукта, включали ДНК-полимеразу (такую как полимераза Taq или Pfu), каждый из четырех нуклеотидов дНТФ, строительных блоков ДНК, в эквимолярных количествах (50-200 мкМ) и буфер, подходящий для фермента, оптимизированный по концентрации Mg2+ (0,5-5 мМ).
Продукт амплификации клонировали в pCR 4 с использованием либо набора для клонирования TOPO TA для Taq ПЦР-продуктов, либо набора для клонирования Zero Blunt TOPO для Pfu ПЦР-продуктов (оба набора коммерчески доступны от компании Invitrogen). Полученный клон проверяли секвенированием. Любые дополнительные последовательности рестрикции, не совместимые с системой клонирования, затем удаляли с помощью сайт-направленного мутагенеза [например, с использованием Quickchange (Stratagene Inc.)].
Получение транслокационной (например, HN) вставки
HN/A (SEQ ID NO: 2) получали одним из двух способов:
Последовательность ДНК разрабатывали путем обратной трансляции аминокислотной последовательности HN/A [полученной из находящихся в свободном доступе источников баз данных, таких как GenBank (регистрационный номер P10845) или Swissprot (регистрационный локус BXA1_CLOBO) с использованием одного из множества программных инструментов обратной трансляции (например, EditSeq best E. coli reverse translation (DNASTAR Inc.) или Backtranslation tool v2.0 (Entelechon)]. Последовательность рестрикции PstI добавляли на N-конце и XbaI-стоп-кодон-HindIII на C-конце, обеспечивая сохранность правильной рамки считывания. Проводили скрининг последовательности ДНК (с использованием такой программы, как MapDraw, DNASTAR Inc.) на последовательности расщепления ферментами рестрикции, вставленные в процессе обратной трансляции. Любые последовательности, которые, как было установлено, являются общими с теми, которые необходимы для системы клонирования, удаляли вручную из планируемой кодирующей последовательности, обеспечивая сохранение характерного для E. coli использования кодонов. Использование кодонов E. coli оценивали, обращаясь к таким программам, как Graphical Codon Usage Analyser (Geneart), и содержание % GC и коэффициент использования кодонов оценивали, обращаясь к опубликованным таблицам использования кодонов (например, GenBank Release 143, 13 сентября 2004 г.). Эта оптимизированная последовательность ДНК затем была синтезирована на коммерческой основе (например, в компаниях Entelechon, Geneart или Sigma-Genosys) и предоставлена в векторе pCR 4.
Альтернативный способ заключался в использовании ПЦР-амплификации из существующей последовательности ДНК с последовательностями для ферментов рестрикции PstI и XbaI-стоп-кодон-HindIII, вставленными в 5' и 3' ПЦР-праймеры, соответственно. ПЦР-амплификацию проводили, как описано выше. ПЦР-продукт вставляли в вектор pCR 4 и проверяли секвенированием. Любые дополнительные последовательности рестрикции, не совместимые с системой клонирования, затем удаляли с помощью сайт-направленного мутагенеза [например, с использованием Quickchange (Stratagene Inc.)].
Получение слитого белка LC/A-GS18-EN-CPGA16-GS20-HN/A
Для получения конструкта LC/A-GS18-EN-CPGA16-GS20-HN/A синтезировали линкер серотипа A с добавлением сайта энтерокиназы для активации, составленный в виде BamHI-SalI-GS18-сайт-протеазы-GS20-PstI-XbaI-стоп-кодон-HindIII. Вектор pCR 4, кодирующий линкер, расщепляли ферментами рестрикции BamHI+SalI. Этот расщепленный вектор затем служил в качестве реципиента для вставки и лигирования ДНК LC/A (SEQ ID NO: 1), также расщепленной BamHI+SalI. Затем данный конструкт расщепляли BamHI+HindIII и вставляли в вектор экспрессии, такой как плазмида pMAL (NEB) или плазмида на основе pET (Novagen). Полученную плазмидную ДНК затем расщепляли ферментами рестрикции PstI+XbaI и ДНК HN/A (SEQ ID NO: 2) затем расщепляли ферментами рестрикции PstI+XbaI и вставляли в расщепленный аналогичным образом вектор pMAL, получая pMAL-LC/A-GS18-EN-CPGA16-GS20-HN/A-XbaI-His-маркер-стоп-кодон-HindIII. Конечный конструкт содержал ORF спейсера GS18-EN-CPGA16-GS20 для экспрессии в виде белка с последовательностью, приведенной в SEQ ID NO: 10.
Анализ активации
NuPAGE 4-12% Bis-Tris гели (10, 12 и 15-луночные предварительно залитые гели) использовали для анализа активации слитых белков после обработки протеазой. Образцы белка готовили в NuPAGE 4× LDS буфере для образцов, как правило, до конечного объема 100 мкл. Образцы либо разбавляли, либо оставляли неразбавленными (75 мкл образца, 25 мкл буфера для образцов) в зависимости от концентрации белка. Образцы смешивали и затем нагревали в термоблоке при 95°C в течение 5 мин перед нанесением на гель. 5-20 мкл образца наносили вместе с 5 мкл набора белков-маркеров молекулярной массы (набор белков-маркеров Benchmark™ от компании Invitrogen). Электрофорез, как правило, проводили в течение 50 мин при 200 В. Гель погружали в дH2O и обрабатывали в течение 2 мин в микроволновой печи, установленной на полную мощность. Гель промывали и стадию обработки в микроволновой печи повторяли. Гель переносили в емкость для окрашивания и заливали красителем Simply Blue SafeStain (Invitrogen). Его обрабатывали в микроволновой печи при полной мощности в течение 1 минуты и оставляли на 0,5-2 ч для окрашивания. Затем гель обесцвечивали, сливая краситель Safestain и промывая гель дH2O. Гели оставляли в дH2O для обесцвечивания на ночь и получали их изображение с помощью устройства формирования изображений GeneGnome (Syngene). Общее количество активированного белка рассчитывали, сравнивая плотность полосы, соответствующей полноразмерному слитому белку (после обработки протеазой), в невосстанавливающих и восстанавливающих условиях.
Пример 2 - Получение семейства слитых белков LC/A-GS18-EN-CPGA16-GS20-HN/A с разными длинами спейсера
С использованием той же стратегии, что и в примере 1, получали диапазон ДНК линкеров, кодирующих галанин-16 и спейсеры разной длины. С использованием одного из множества программных инструментов обратной трансляции (например, EditSeq best E. coli reverse translation (DNASTAR Inc.) или Backtranslation tool v2.0 (Entelechon)] определяли последовательность ДНК, кодирующую область спейсер 1-сайт протеазы-лиганд-спейсер 2. Затем сайты рестрикции вставляли в последовательность ДНК, которая могла быть составлена в виде BamHI-SalI-спейсер 1-сайт протеазы-CPGA16-NheI-спейсер 2-SpeI-PstI-XbaI-стоп-кодон-HindIII. Важно обеспечивать сохранение правильной рамки считывания для спейсера, GA16 и последовательностей рестрикции и чтобы последовательности XbaI не предшествовали основания TC, что может приводить к метилированию DAM. Проводили скрининг последовательности ДНК на включение последовательностей рестрикции и любые дополнительные последовательности удаляли вручную из оставшейся последовательности, обеспечивая сохранение характерного для E. coli использования кодонов. Использование кодонов E. coli оценивали, обращаясь к таким программам, как Graphical Codon Usage Analyser (Geneart), и содержание % GC и коэффициент использования кодонов оценивали, обращаясь к опубликованным таблицам использования кодонов (например, GenBank Release 143, 13 сентября 2004 г.). Эта оптимизированная последовательность ДНК затем была синтезирована на коммерческой основе (например, в компаниях Entelechon, Geneart или Sigma-Genosys) и предоставлена в векторе pCR 4.
Полученные спейсер-линкеры включали:

В качестве примера, для получения слитого конструкта LC/A-GS5-EN-CPGA16-GS20-HN/A (SEQ ID NO: 12) вектор pCR 4, кодирующий линкер BamHI-SalI-GS5-сайт протеазы-GS20-PstI-XbaI-стоп-кодон-HindIII, расщепляли ферментами рестрикции BamHI+SalI. Этот расщепленный вектор затем служил в качестве вектора-реципиента для вставки и лигирования ДНК LC/A (SEQ ID NO: 1), также расщепленной BamHI+SalI. Полученную плазмидную ДНК затем расщепляли ферментами рестрикции BamHI+HindIII и фрагмент LC/A-линкер вставляли в расщепленный аналогичным образом вектор, содержащий уникальный сайт множественного клонирования для BamHI, SalI, PstI и HindIII, такой как вектор pMAL (NEB) или вектор pET (Novagen). ДНК HN/A (SEQ ID NO: 2) затем расщепляли ферментами рестрикции PstI+HindIII и вставляли в расщепленный аналогичным образом конструкт pMAL-LC/A-линкер. Конечный конструкт содержал ORF LC/A-GS5-EN-CPGA16-GS20-HN/A для экспрессии в виде белка с последовательностью, приведенной в SEQ ID NO: 13.
Пример 3 - Метод очистки слитого белка с галанином
Размораживают пробирку фирмы Falcon, содержащую 25 мл 50 мМ HEPES pH 7,2, 200 мМ NaCl и примерно 10 г пасты из клеток BL21 E. coli. Доводят объем оттаявшей клеточной пасты до 80 мл раствором 50 мМ HEPES pH 7,2, 200 мМ NaCl и обрабатывают ультразвуком на льду в течение 10 циклов по 30 секунд работы, 30 секунд перерыва, с установкой на 22 микрона, обеспечивая прохладную температуру образца. Центрифугируют лизированные клетки при 18000 об/мин, 4°C в течение 30 минут. Наносят супернатант на колонку с хелатирующей смолой, загруженной 0,1 M NiSO4 (достаточно колонки объемом 20-30 мл), уравновешенную 50 мМ HEPES pH 7,2, 200 мМ NaCl. Используя ступенчатый градиент 10 и 40 мМ имидазола, смывают неспецифически связанные белки и элюируют слитый белок 100 мМ раствором имидазола. Диализуют элюированный слитый белок против 5 л 50 мМ HEPES pH 7,2, 200 мМ NaCl при 4°C в течение ночи и измеряют OD диализованного слитого белка. Добавляют 1 мкг энтерокиназы (1 мг/мл) на 100 мкг очищенного слитого белка и 10 мкл фактора Xa на мг очищенного слитого белка, если слитый белок содержит мальтоза-связывающий белок. Инкубируют в течение ночи при 25°C в статическом состоянии. Наносят на колонку с хелатирующей смолой, загруженной 0,1 M NiSO4 (достаточно колонки объемом 20-30 мл), уравновешенную 50 мМ HEPES pH 7,2, 200 мМ NaCl. Промывают колонку до базовой линии 50 мМ HEPES pH 7,2, 200 мМ NaCl. Используя ступенчатый градиент 10 и 40 мМ имидазола, смывают неспецифически связанный белок и элюируют слитый белок 100 мМ раствором имидазола. Диализуют элюированный слитый белок против 5 л 50 мМ HEPES pH 7,2, 200 мМ NaCl при 4°C в течение ночи и концентрируют слитый белок до концентрации примерно 2 мг/мл, разделяют образец на аликвоты и замораживают при температуре -20°C.
Пример 4 - Получение слитого белка LC/C-GA16-HN/C с последовательностью активации серотипа A
Следуя методикам, используемым в примерах 1 и 2, получали LC/C (SEQ ID NO: 5) и HN/C (SEQ ID NO: 6) и вставляли в линкер серотипа A, составленный в виде BamHI-SalI-спейсер 1-сайт протеазы-GA16-NheI-спейсер 2-SpeI-PstI-XbaI-стоп-кодон-HindIII. Конечный конструкт содержал ORF LC-спейсер 1-GA16-спейсер 2-HN для экспрессии в виде белка с последовательностью, приведенной в SEQ ID NO: 25.
Пример 5 - Получение слитого белка IgA-протеаза-GA16-HN/A
Аминокислотную последовательность IgA-протеазы получали из находящихся в свободном доступе источников баз данных, таких как GenBank (регистрационный номер P09790). Информация о структуре гена IgA-протеазы N. gonorrhoeae доступна в литературе (Pohlner et al., Gene structure and extracellular secretion of Neisseria gonorrhoeae IgA protease, Nature, 1987, 325(6103), 458-62). С использованием программного инструмента Backtranslation v2.0 (Entelechon) определяли последовательность ДНК, кодирующую IgA-протеазу, модифицированную для экспрессии в E. coli. Последовательность узнавания BamHI вставляли на 5'-конце и кодон, кодирующий аминокислоту цистеин, и последовательность узнавания SalI вставляли на 3'-конце ДНК IgA. Проводили скрининг последовательности ДНК с использованием MapDraw, (DNASTAR Inc.) на последовательности расщепления ферментами рестрикции, вставленные в процессе обратной трансляции. Любые последовательности расщепления, которые, как было установлено, являются общими с теми, которые необходимы для клонирования, удаляли вручную из планируемой кодирующей последовательности, обеспечивая сохранение характерного для E. coli использования кодонов. Использование кодонов E. coli оценивали с помощью Graphical Codon Usage Analyser (Geneart), и содержание % GC и коэффициент использования кодонов оценивали, обращаясь к опубликованным таблицам использования кодонов. Эта оптимизированная последовательность ДНК (SEQ ID NO: 51), содержащая открытую рамку считывания (ORF) IgA, затем была синтезирована на коммерческой основе.
IgA (SEQ ID NO: 51) вставляли в ORF LC-GS5-CPGA16-GS20-HN, используя ферменты рестрикции BamHI и SalI для замены LC на ДНК IgA-протеазы. Конечный конструкт содержал ORF IgA-GS5-CPGA16-GS20-HN для экспрессии в виде белка с последовательностью, приведенной в SEQ ID NO: 53.
Пример 6 - Получение слитого белка направляемой галанином эндопептидазы, содержащего домен LC из столбнячного токсина
Последовательность ДНК разрабатывали путем обратной трансляции аминокислотной последовательности LC столбнячного токсина (полученной из находящихся в свободном доступе источников баз данных, таких как GenBank (регистрационный номер X04436), с использованием одного из множества программных инструментов обратной трансляции (например, EditSeq best E. coli reverse translation (DNASTAR Inc.) или Backtranslation tool v2.0 (Entelechon)]. Последовательности узнавания BamHI/SalI вставляли на 5'- и 3'-концах последовательности, соответственно, сохраняя правильную рамку считывания (SEQ ID NO: 57). Проводили скрининг последовательности ДНК (с использованием такой программы, как MapDraw, DNASTAR Inc.) на последовательности расщепления ферментами рестрикции, вставленные в процессе обратной трансляции. Любые последовательности расщепления, которые, как было установлено, являются общими с теми, которые необходимы для системы клонирования, удаляли вручную из планируемой кодирующей последовательности, обеспечивая сохранение характерного для E. coli использования кодонов. Использование кодонов E. coli оценивали, обращаясь к таким программам, как Graphical Codon Usage Analyser (Geneart), и содержание % GC и коэффициент использования кодонов оценивали, обращаясь к опубликованным таблицам использования кодонов (например, GenBank Release 143, 13 сентября 2004 г.). Эта оптимизированная последовательность ДНК, содержащая открытую рамку считывания (ORF) LC столбнячного токсина, затем была синтезирована на коммерческой основе (например, в компаниях Entelechon, Geneart или Sigma-Genosys) и предоставлена в векторе pCR 4 (invitrogen). Вектор pCR 4, кодирующий TeNT LC, расщепляли BamHI и SalI. Фрагмент BamHI-SalI затем вставляли в вектор LC/A-GA16-HN/A, который также был расщеплен BamHI и SalI. Конечный конструкт содержал последовательности ORF TeNT LC-GS5-GA16-GS20-HN для экспрессии в виде белка с последовательностью, приведенной в SEQ ID NO: 58.
Пример 7 - Схема анализа активации рецепторов GALR1 и GALR2 CHO-K1 и анализа расщепления SNAP-25
Получение линии клеток
Клетки CHO-K1, стабильно экспрессирующие либо рецептор галанина 1 человека (CHO-K1-Gal-1R; продукт номер ES-510-C), либо рецептор галанина 2 человека (CHO-K1-Gal-2R; продукт номер ES-511-C), приобретали у компании Perkin-Elmer (Bucks, UK). При необходимости, клетки трансфицировали ДНК SNAP-25 с использованием липофектамина™ 2000 и инкубировали в течение 4 часов до замены среды. Через 24 часа клетки переносили в колбу T175. Еще через 24 часа добавляли 100 мкг/мл зеоцина для начала отбора экспрессирующих SNAP-25 клеток и добавляли 5 мкг/мл бластицидина для поддержания давления отбора для рецептора. Клетки поддерживали в среде, содержащей селективные агенты, в течение двух недель, пассируя клетки каждые два-три дня для поддержания 30-70% конфлюэнтности. Затем клетки разбавляли селективной средой до достижения плотности 0,5 клетки на лунку в 96-луночном планшете для микротитрования. Через несколько дней планшеты изучали под микроскопом и отмечали лунки, которые содержали одиночные колонии. Среду в этих лунках меняли еженедельно. Когда клетки в лунках достигали конфлюэнтности, их переносили в колбы T25. Когда они достаточно разрастались, каждый клон высевали в 24 лунки 96-луночного планшета, плюс замораживали один флакон маточной суспензии. Слитые белки с галанином по изобретению и LC/A-HNA добавляли к клеткам в течение 24 часа, а затем проводили вестерн-блот анализ для обнаружения расщепления SNAP-25. Клоны, полосы SNAP-25 из которых были сильно выраженными и уровни расщепления слитым белком были высокие, сохраняли для дальнейшего исследования. Для них строили кривые полных доз, и отбирали клоны с наибольшей разницей между количеством слитого белка с галанином и уровнями расщепления LC/A-HNA.
Анализ активации рецептора GALR1
Анализ активации рецептора GALR1 позволяет измерять активность и внутреннюю эффективность лигандов на рецепторах GALR1 в трансфицированных клетках CHO-K1 путем количественного определения восстановления стимулированного форсколином внутриклеточного цАМФ с использованием метода определения цАМФ на основе FRET (набор Perkin Elmer LANCE cAMP). После стимуляции флуоресцентно меченый цАМФ-индикатор (европий-стрептавидин/биотин-цАМФ) и флуоресцентно (Alexa) меченное анти-цАМФ антитело добавляли к клеткам в буфере для лизиса. цАМФ из клеток конкурирует с цАМФ-индикатором за центры связывания антитела. При снятии показаний световой импульс с длиной волны 320 нм возбуждает флуоресцентную часть (европий) цАМФ-индикатора. Энергия, излучаемая европием, передается меченным Alexa fluor антителам, связанным с индикатором, генерируя TR-FRET сигнал с длиной волны 665 нм (резонансный перенос энергии флуоресценции с временным разрешением основан на непосредственной близости метки донора, европия, и метки акцептора, Alexa fluor, которые сведены вместе за счет специфической реакции связывания). Остаточная энергия от европия производит свет с диной волны 615 нм. В клетках, обработанных агонистом, будет меньше цАМФ для конкуренции с индикатором, так что будет наблюдаться дозозависимое увеличение сигнала с длиной волны 665 нм по сравнению с образцами, обработанными только форсколином. Сигнал с длиной волны 665 нм переводят в концентрацию цАМФ путем интерполяции на стандартную кривую цАМФ, которая включена в каждый эксперимент.
Используя пипетки Gilson и силиконизированные (Sigmacote) или LoBind наконечники для пипеток, тестируемые материалы и стандарты разводили до соответствующих концентраций в лунках первых двух колонок планшета Eppendorf LoBind с глубокими лунками на 500 мкл в буфере для анализа, содержащем 10 мкМ форсколин. Выбранные концентрации в колонках один и два различались на половину логарифмической единицы. Из них производили серийные разведения 1:10 в поперечном направлении планшета (используя электронную восьмиканальную пипетку с Sigmacote или LoBind наконечниками), получая одиннадцать концентраций с интервалами в половину логарифма. В двенадцатой колонке был добавлен только буфер для анализа в качестве «базовой» линии. Используя 12-канальную цифровую пипетку, по 10 мкл образца из LoBind планшета переносили в 96-луночный планшет для микротитрования OptiPlate.
В лунки, содержащие материал для построения стандартной кривой, добавляли 10 мкл буфера для анализа, используя многоканальную цифровую пипетку. В лунки, содержащие тестируемые материалы, добавляли 10 мкл клеток в соответствующей концентрации в буфере для анализа. Планшеты запечатывали и инкубировали в течение 120 мин при комнатной температуре, на протяжении первого часа на орбитальном шейкере IKA MTS 2/4, установленном на максимальную скорость.
Меченый стрептавидин (Eu-SA) LANCE EU-W8044 и биотин-цАМФ (б-цАМФ) разбавляли в буфере для определения цАМФ (оба реактива из набора Perkin Elmer LANCE cAMP kit), получая субматочные растворы в разведениях 1:17 и 1:5, соответственно. Конечную смесь для определения получали, делая разведения двух субматочных растворов в буфере для определения в соотношении 1:125. Смесь инкубировали в течение 15-30 мин при комнатной температуре перед добавлением меченого Alexa Fluor® 647 анти-цАМФ антитела (Alexa-Fluor Аb) в разведении 1:200. После быстрого перемешивания на вихревой мешалке сразу же добавляли 20 мкл в каждую лунку, используя цифровую многоканальную пипетку. Планшеты запечатывали и инкубировали в течение 24 ч при комнатной температуре (на протяжении первого часа на орбитальном шейкере IKA MTS 2/4, установленном на максимальную скорость). Перед снятием показаний на приборе Envision крышки с планшетов удаляли.
Анализ активации рецептора GALR2
Анализ активации рецептора GALR2 позволяет измерять активность и внутреннюю эффективность лигандов на рецепторах GALR2 в трансфицированных клетках CHO-K1 путем количественного определения мобилизации кальция, происходящей, когда рецептор активирован. Трансфицированные клетки предварительно нагружали чувствительным к кальцию красителем (FLIPR) перед обработкой. При снятии показаний с использованием микропланшетного ридера Flexstation 3 (Molecular devices) световой импульс с длиной волны 485 нм возбуждает флуоресцентный краситель и вызывает излучение с длиной волны 525 нм. Это позволяет получать данные флуоресценции в режиме реального времени при изменении уровня внутриклеточного кальция. В обработанных агонистом клетках будет происходить активация рецептора, приводящая к возрастанию мобилизации кальция. Это можно измерять как увеличение относительных единиц флуоресценции (RFU) с длиной волны 525 нМ.
Культура клеток для анализа активации рецепторов:
Клетки высевали и культивировали в колбах T175, содержащих среду Ham F12 с глютамаксом, 10% эмбриональной бычьей сыворотки, 5 мкг/мл бластицидина и 100 мкг/мл зеоцина. Колбы инкубировали при 37°C в увлажненной среде, содержащей 5% CO2, до 60-80% конфлюэнтности. В день сбора клеток среду удаляли и клетки промывали два раза по 25 мл PBS. Клетки снимали с колбы добавлением 10 мл Tryple Express и инкубацией при 37°C в течение 10 мин с последующим осторожным постукиванием колбы. Отделившиеся клетки переносили в 50-мл центрифужную пробирку и колбу промывали два раза по 10 мл среды, которую добавляли к клеточной суспензии. Пробирку центрифугировали при 1300×g в течение 3 мин и супернатант удаляли. Клетки осторожно ресуспендировали в 10 мл среды (в случае замораживания клеток) или буфера для анализа (в случае использования в анализе «свежих» клеток) и отбирали образец для подсчета с использованием прибора NucleoCounter (ChemoMetec). Клетки, используемые в анализе «свежими», дополнительно разбавляли в буфере для анализа до соответствующей концентрации. Клетки, собранные для замораживания, повторно центрифугировали (1300×g; 3 мин), супернатант удаляли и клетки ресуспендировали в среде Synth-a-Freeze при 4°C до плотности 3×106 клеток/мл. Криопробирки, содержащие каждая по 1 мл суспензии, помещали в охлажденный контейнер для замораживания Nalgene Mr Frosty (скорость охлаждения -1°C/минуту) и оставляли на ночь в морозильной камере при -80°C. На следующий день пробирки переносили в паровую фазу резервуара с жидким азотом.
На фиг.4 показано, что слитые белки с галанином по настоящему изобретению, имеющие различные лиганды галанина (то есть галанин-16 и галанин-30) и каркасы различных серотипов (то есть LC/A-HN/A, LC/B-HN/B, LC/C-HN/C и LC/D-HN/D), активируют рецепторы GALR1.
Анализы расщепления SNAP-25 из CHO-K1 GALR1
Культуры клеток подвергали воздействию слитого белка с галанином в различных концентрациях в течение 24 часов. Клеточные белки разделяли электрофорезом в ДСН-ПААГ и проводили вестерн-блот анализ с анти-SNAP-25 антителом для облегчения оценки расщепления SNAP-25. Расщепление SNAP-25 рассчитывали при помощи денситометрического анализа (Syngene).
Посев клеток
Подготавливают клетки с плотностью 2×10e5 клеток/мл и высевают по 125 мкл в лунку 96-луночного планшета. Используют следующую среду: 500 мл Gibco Ham F12 с глютамаксом (код продукта 31765068), 50 мл FBS, 5 мкг/мл бластицидина (аликвота 250 мкл из бокса в морозильной камере, G13) (Calbiochem № 203351, 10 мл в концентрации 10 мг/мл), 100 мкг/мл зеоцина (500 мкл из бокса в морозильной камере, G35) (Invitrogen from Fisher, 1 г в 8×1,25 мл пробирках в концентрации 100 мг/мл, код продукта VXR25001). Клетки оставляют для роста на 24 часа (37°C, 5% CO2, влажная атмосфера).
Обработка клеток
Готовят разведения тестируемого белка для диапазона доз каждого из тестируемых белков (готовят в двукратных (2×) желаемых конечных концентрациях, поскольку 125 мкл будет добавлено непосредственно в 125 мкл среды, уже находящейся в каждой лунке). Стерилизуют фильтрованием питательную среду CHO GALR1 (20-мл шприц, 0,2-мкм фильтр для шприца), используемую для разведений. Добавляют профильтрованную среду в 5 помеченных миниатюрных флаконов (7-мл пробирки), по 0,9 мл в каждую, используя пипетку Gilson или многоканальную пипетку. Разводят маточный раствор тестируемого белка до 2000 нМ (рабочий маточный раствор 1) и 600 нМ (рабочий маточный раствор 2). Используя пипетку Gilson, готовят 10-кратные серийные разведения каждого рабочего маточного раствора, серийно добавляя по 100 мкл в следующую концентрационную точку. Набирают и спускают пипеткой раствор для тщательного перемешивания. Повторяют для получения 4 серийных разведений для раствора 1, и 3 серийных разведений для раствора 2. 0 нМ контроль (только профильтрованная питательная среда) также следует приготовить в качестве отрицательного контроля для каждого планшета. Повторяют вышеперечисленные операции для каждого тестируемого белка. В каждый эксперимент в качестве контрольного/эталонного материала следует включать «стандартную» партию материала, которая представляет собой LC/A-HN/A без лиганда.
Добавляют разведенный образец в планшеты с CHO GALR1
Добавляют 125 мкл тестируемого образца (в двойной концентрации) в лунку. Каждый тестируемый образец следует добавлять в три параллельные лунки и каждый диапазон доз должен включать 0 нМ контроль. Инкубируют в течение 24 часов (37°C, 5% CO2, влажная атмосфера).
Лизис клеток
Готовят свежий буфер для лизиса (20 мл на планшет) с 25% (4×) буфера для образцов NuPAGE LDS, 65% дH2O и 10% 1 M DTT. Удаляют среду с планшета с CHO GALR1, переворачивая его над емкостью для отходов. Отбирают оставшуюся среду из каждой лунки, используя пипетку с оттянутым концом. Лизируют клетки путем добавления 125 мкл буфера для лизиса на лунку, используя многоканальную пипетку. Через минимум 20 минут отбирают буфер из каждой лунки в 1,5 мл микроцентрифужную пробирку. Пробирки должны быть пронумерованы, чтобы иметь возможность отслеживать обработку CHO GALR1 на протяжении процедуры блоттинга. От A1-A3 до H1-H3 с номерами 1-24, от A4-A6 до H4-H6 с номерами 25-48, от A7-A9 до H7-H9 с номерами 49-72, от A10-A12 до H10-H12 с номерами 73-96. Каждый образец перемешивают на вихревой мешалке и нагревают при 90°C в течение 5-10 минут в предварительно нагретом термоблоке. Хранят при -20°C или используют в тот же день для электрофореза в ДСН-геле.
Электрофорез в геле
Если образец хранился в течение ночи или дольше, его помещают в термоблок, предварительно нагретый до 90°C, на 5-10 минут. Готовят ДСН-ПАА гели, используют 1 гель на 12 образцов, готовят электродный буфер (1×, Invitrogen NuPAGE MOPS SDS Running Buffer (20×) (NP0001)) приблизительно 800 мл/резервуар для гель-электрофореза. Добавляют 500 мкл антиоксиданта NuPAGE в верхнюю камеру для буфера. Наносят по 15 мкл образцов в лунки геля слева направо и наносят предварительно окрашенный стандарт 2,5 мкл Invitrogen Magic Marker XP и 5 мкл Invitrogen See Blue Plus 2, а также 15 мкл необработанного контроля. Важно максимально увеличивать разрешение при разделении во время электрофореза в ДСН-ПААГ. Этого можно добиться проводя электрофорез в 12% Bis-Tris гелях при 200 В в течение 1 часа и 25 минут (до того, как розовый маркер (17 кДа) достигнет дна резервуара).
Вестерн-блоттинг
Выполняют полусухой перенос, используя Invitrogen iBlot (используют iBlot Programme 3 в течение 6 минут). Помещают нитроцеллюлозные мембраны в отдельные небольшие лотки. Инкубируют мембраны с блокирующим буферным раствором (5 г сухого молока Marvel на 100 мл 0,1% PBS/Tween) на качалке при комнатной температуре в течение 1 часа. Добавляют первичное антитело (анти-SNAP-25 в разведении 1:1000) и инкубируют мембраны с первичным антителом (разведенным в блокирующем буфере) в течение 1 часа на качалке при комнатной температуре. Промывают мембраны ополаскиванием 3 раза в PBS/Tween (0,1%). Затем добавляют вторичное антитело (конъюгированное с HRP антитело против иммуноглобулинов кролика, разведенное 1:1000) и инкубируют мембраны с вторичным антителом (разведенным в блокирующем буфере) на качалке при комнатной температуре в течение 1 часа. Промывают мембраны ополаскиванием 3 раза в PBS/Tween (0,1%), выдерживают мембраны в течение минимум 20 мин при последнем промывании. Обнаруживают связанное антитело с помощью Syngene: Высушивают блоты от PBS/Tween, смешивают реагенты WestDura 1:1 и добавляют к блотам на 5 минут. Следует убедиться, что к блотам добавлено достаточно раствора для полного их покрытия. Помещают мембраны в лоток Syngene, устанавливают программу Syngene на время экспозиции 5 минут.
На фиг.3 и 5 показано, что слитые белки с галанином по изобретению эффективно расщепляют SNAP-25.
Пример 8 - Оценка in vivo эффективности слитых продуктов с галанином
Ноцицептивный сгибательный рефлекс (также известный как анализ защитного отдергивания лапы) представляет собой быстрое движение отдергивания лапы, являющееся защитным механизмом от возможного повреждения конечностей. Его можно количественно определять путем оценки электромиографического (ЭМГ) ответа у анестезированной крысы на низкую дозу капсаицина, электрическую стимуляцию или электрический ответ при сенсибилизации капсаицином. Проводили внутриподошвенную предварительную обработку (за 24 часа) слитыми белками по настоящему изобретению самцов крыс Sprague-Dawley весом 300-380 г. Защитное отдергивание лапы вызывали при помощи 0,006% капсаицина, 10 мкл в PBS (7,5% ДМСО), введенного инъекцией в течение 10 секунд. Это вызывает сильный рефлекторный ответ двуглавой мышцы бедра. Уменьшение/подавление ноцицептивного сгибательного рефлекса свидетельствует о том, что тестируемое вещество проявляет антиноцицептивный эффект. Данные продемонстрировали антиноцицептивный эффект слитых белков с галанином по настоящему изобретению, представленный в процентном выражении (фиг.6).
Оценивали способность различных слитых белков с галанином по изобретению подавлять индуцированную капсаицином тепловую гипералгезию (фиг.7 и 8). Проводили внутриподошвенную предварительную обработку слитыми белками крыс Sprague-Dawley, через 24 часа вводили инъекцией 0,3% капсаицин и крыс помещали на нагретую до 25°C стеклянную пластину (крыс содержали в акриловых боксах на пластине, нагретой до 25°C). Световой луч (с регулируемой интенсивностью света) фокусировали на задней лапе. Датчики регистрировали движение лапы, останавливая таймер. Задержка отдергивания лапы представляет собой время до отдергивания лапы от источника тепла (порог отсечения 20,48 секунды). Уменьшение/подавление задержки отдергивания лапы свидетельствует о том, что тестируемое вещество проявляет антиноцицептивный эффект. Данные продемонстрировали усиленный антиноцицептивный эффект слитых белков с галанином по настоящему изобретению по сравнению со слитыми белками с представленным на C-конце лигандом.
Пример 9 - Подтверждение активности агониста TM путем измерения высвобождения вещества P в культурах нейрональных клеток
Материалы
ИФА на вещество P приобретали у компании R&D Systems, UK.
Методы
Первичные нейрональные культуры eDRG получали, как описано ранее (Duggan et al., 2002). Высвобождение вещества P в клеточных культурах оценивали с помощью ИФА, по существу, как описано ранее (Duggan et al., 2002). Интересующий TM добавляли к нейрональным культурам (полученным по меньшей мере за 2 недели до обработки); параллельно обрабатывали контрольные культуры, добавляя носитель вместо TM. Стимулированное (100 мМ KCl) и базовое высвобождение, вместе с общим содержанием клеточного лизата, вещества P получали как для контрольных, так и для обработанных TM культур. Иммунную реакцию вещества P измеряли с использованием наборов для иммуноферментного анализа вещества P (Cayman Chemical Company, USA или R&D Systems, UK) в соответствии с инструкциями производителя.
Количество вещества P, высвобожденное нейрональными клетками в присутствии интересующего TM, сравнивали с высвобождением, полученным в присутствии и в отсутствие 100 мМ KCl. Стимуляция высвобождения вещества P за счет интересующего TM выше базового высвобождения указывает на то, что интересующий TM является «лигандом-агонистом» в соответствии с определением в данной спецификации. При желании, стимуляцию высвобождения вещества P за счет интересующего TM можно сравнивать со стандартной кривой высвобождения вещества P, полученной с использованием природного лиганда рецептора ORL-1, ноцицептина (Tocris).
Пример 10
Способ лечения, профилактики или облегчения боли у индивида, включающий введение указанному пациенту терапевтически эффективного количества слитого белка, при этом указанная боль выбрана из группы, состоящей из: хронической боли, вызванной злокачественным заболеванием, хронической боли, вызванной не злокачественным заболеванием (периферические невропатии).
Пациент A
73-летнюю женщину, страдающую от сильной боли, вызванной постгерпетической невралгией, лечили периферической инъекцией слитого белка для уменьшения высвобождения нейромедиаторов в синапсах нервных окончаний с целью уменьшения боли. Пациент испытывал хороший анальгетический эффект в течение 2 часов после указанной инъекции.
Пациент B
32-летнего мужчину, страдающего от фантомной боли конечностей после ампутации его левой руки вследствие автомобильной аварии, лечили периферической инъекцией слитого белка для уменьшения боли. Пациент испытывал хороший анальгетический эффект в течение 1 часа после указанной инъекции.
Пациент C
55-летнего мужчину, страдающего от диабетической невропатии, лечили периферической инъекцией слитого белка для уменьшения высвобождения нейромедиаторов в синапсах нервных окончаний с целью уменьшения боли. Пациент испытывал хороший анальгетический эффект в течение 4 часов после указанной инъекции.
Пациент D
63-летнюю женщину, страдающую от боли при раке, лечили периферической инъекцией слитого белка для уменьшения высвобождения нейромедиаторов в синапсах нервных окончаний с целью уменьшения боли. Пациент испытывал хороший анальгетический эффект в течение 4 часов после указанной инъекции.
Все документы, книги, справочники, статьи, патенты, опубликованные патентные заявки, руководства, рефераты и другие справочные материалы, цитированные в настоящем документе, включены в настоящий документ посредством ссылки в полном объеме. При том, что вышеприведенное описание раскрывает принципы настоящего изобретения, с примерами, приведенными в целях иллюстрации, специалисту в данной области при прочтении данного описания будет понятно, что различные изменения формы и деталей можно осуществлять без отступления от истинного объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЕ БЕЛКИ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ | 2012 |
|
RU2651492C2 |
| МЕЧЕННЫЕ СОРТАЗОЙ НЕЙРОТОКСИНЫ КЛОСТРИДИЙ | 2020 |
|
RU2801120C2 |
| РЕКОМБИНАНТНАЯ ЭКСПРЕССИЯ БЕЛКОВ В ДВУХЦЕПОЧЕЧНОЙ ФОРМЕ С ДИСУЛЬФИДНЫМ МОСТИКОМ | 2006 |
|
RU2412253C2 |
| ПОДАВЛЕНИЕ АЛЛОДИНИИ, ВЫЗВАННОЙ РАКОМ КОСТЕЙ | 2019 |
|
RU2791640C2 |
| АНАЛИЗ РАСЩЕПЛЕНИЯ КЛЕТОЧНОГО VAMP | 2017 |
|
RU2807994C2 |
| КАТИОННЫЕ НЕЙРОТОКСИНЫ | 2015 |
|
RU2733493C2 |
| НЕЙРОТОКСИНЫ, ПРОЯВЛЯЮЩИЕ УКОРОЧЕННУЮ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ | 2012 |
|
RU2646110C2 |
| ГИБРИДНЫЕ НЕЙРОТОКСИНЫ | 2017 |
|
RU2782382C2 |
| КЛЕТКИ, ВЫСОКОЧУВСТВИТЕЛЬНЫЕ К КЛОСТРИДИАЛЬНОМУ НЕЙРОТОКСИНУ | 2020 |
|
RU2831112C2 |
| СЛИТЫЙ БЕЛОК, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ФАКТОРА VII | 2011 |
|
RU2585231C2 |







































































































































































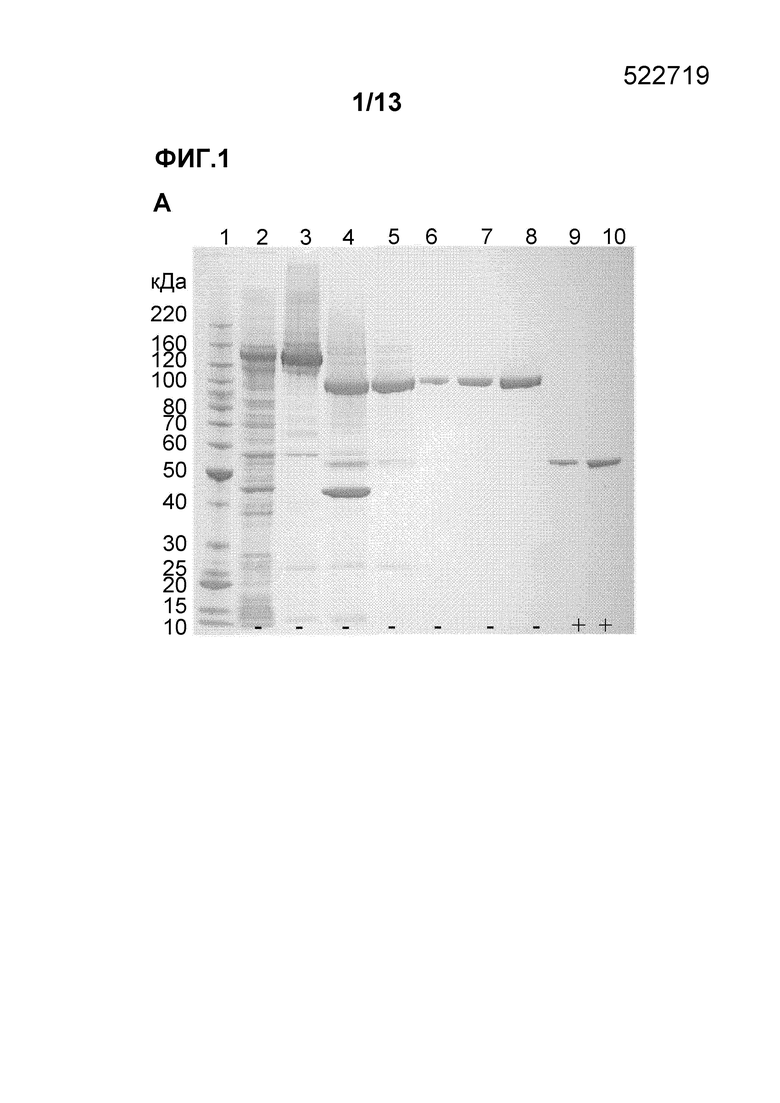


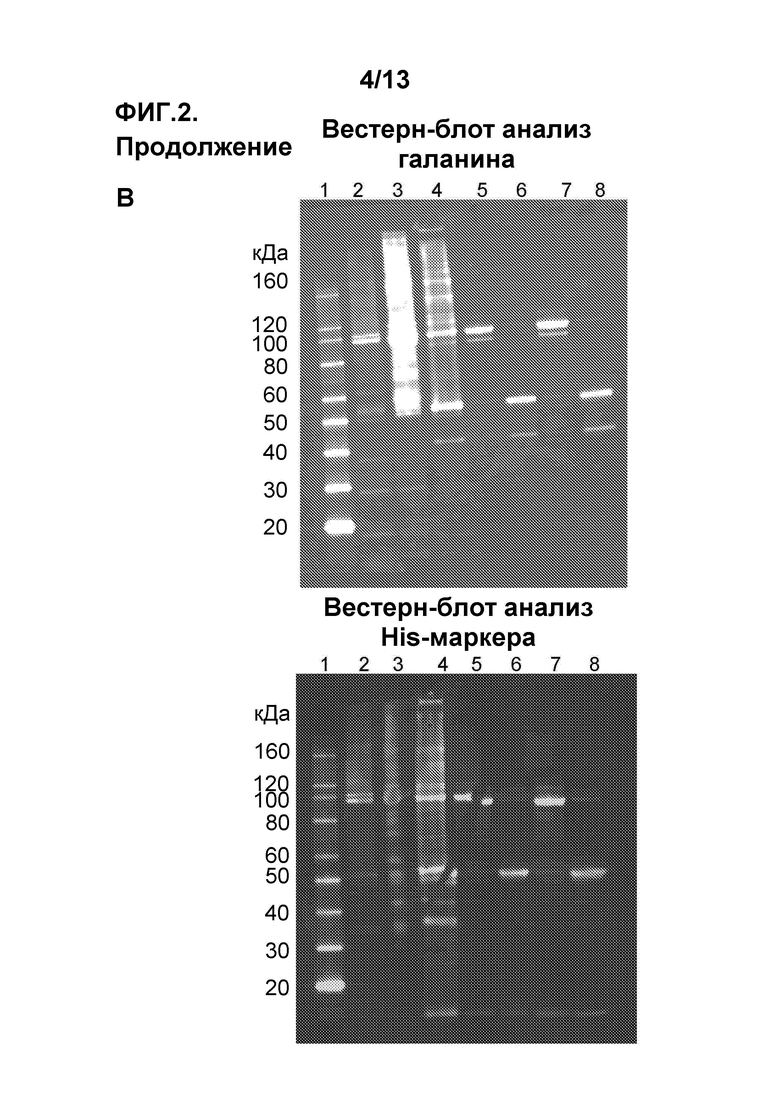

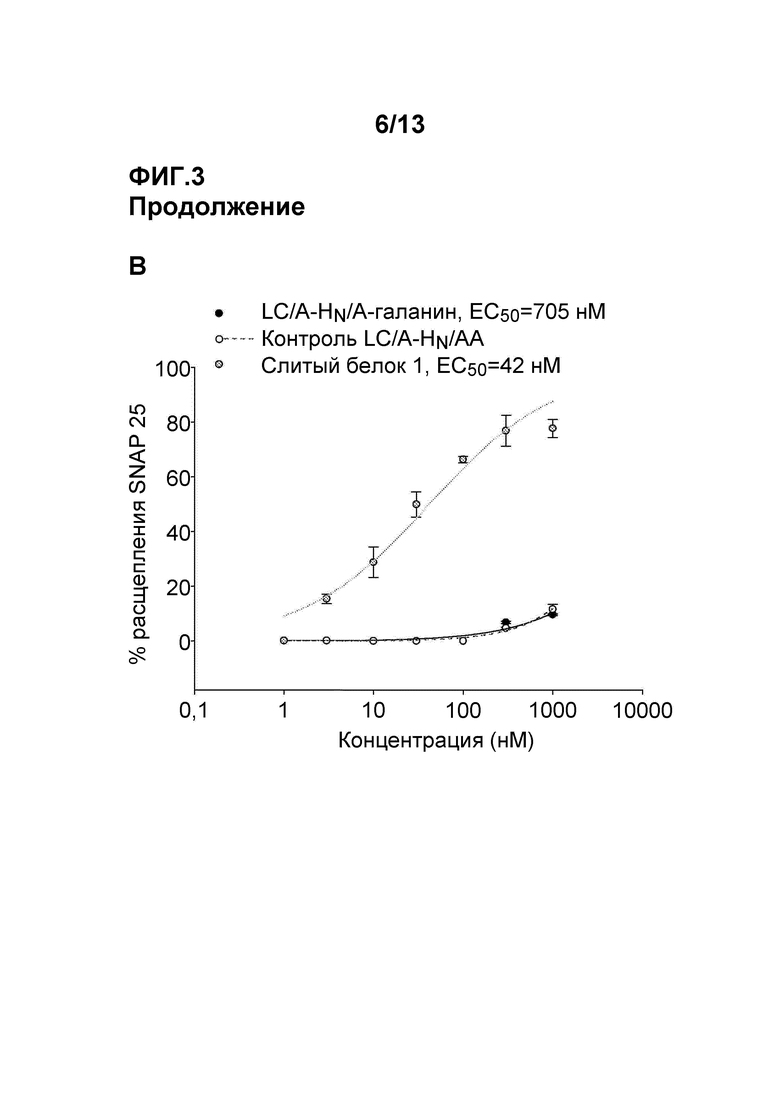
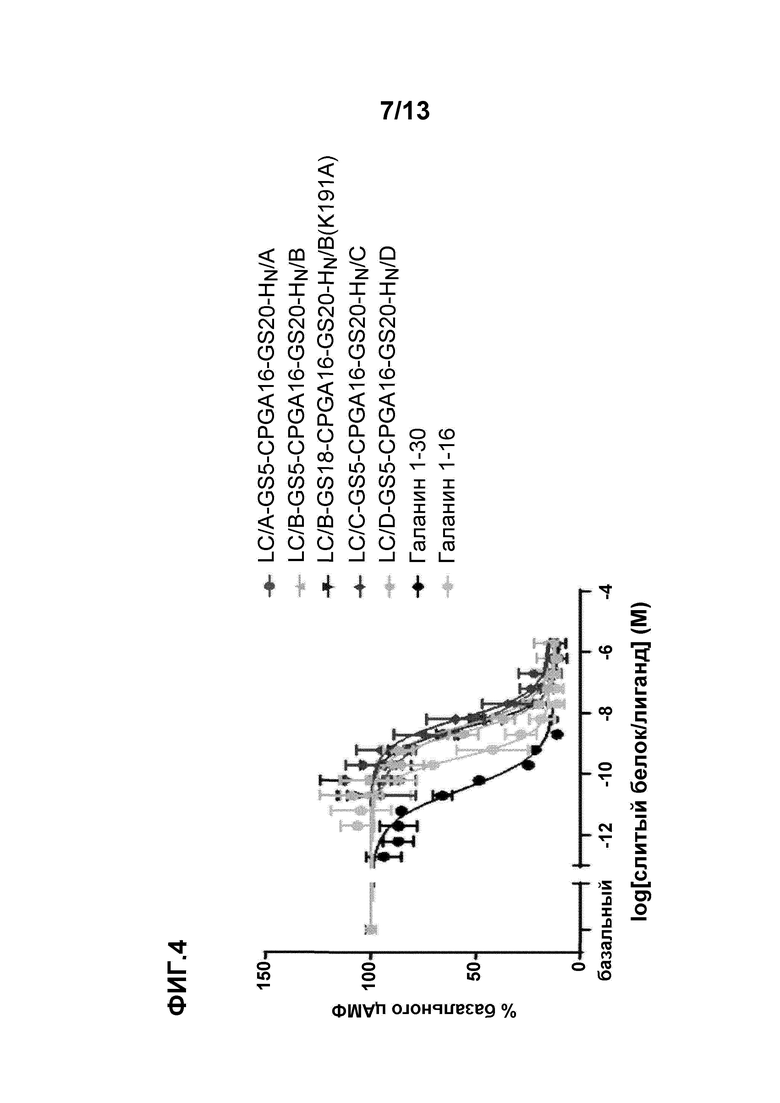
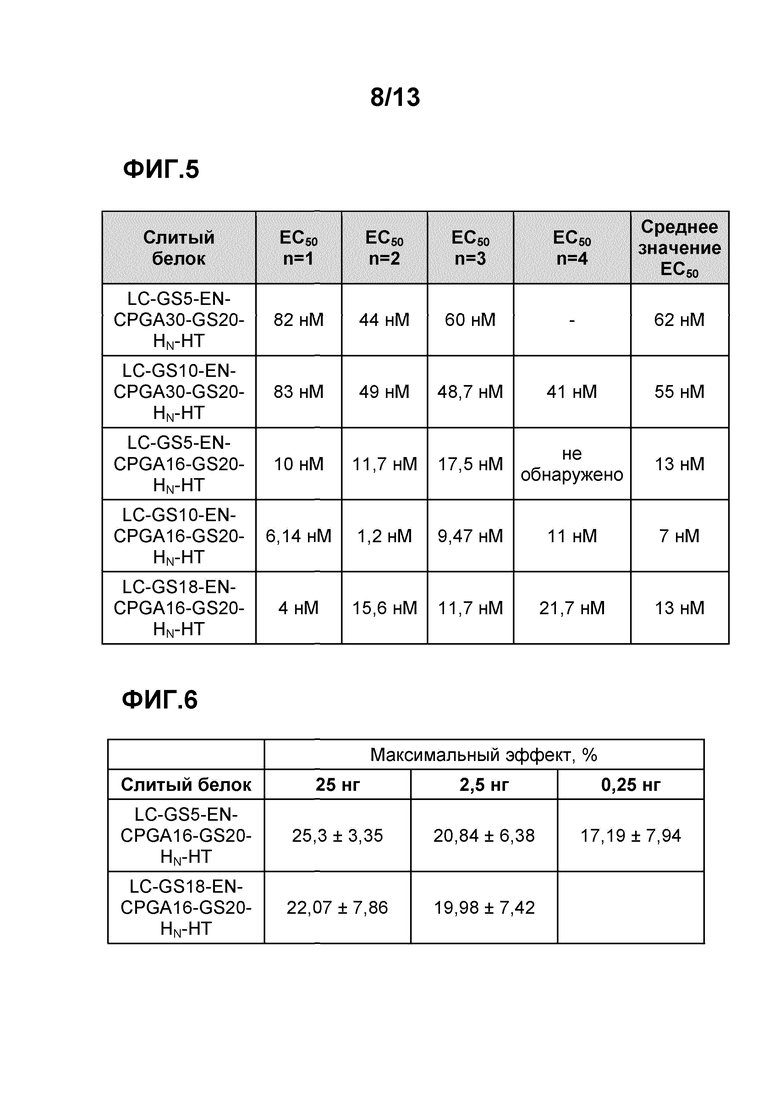
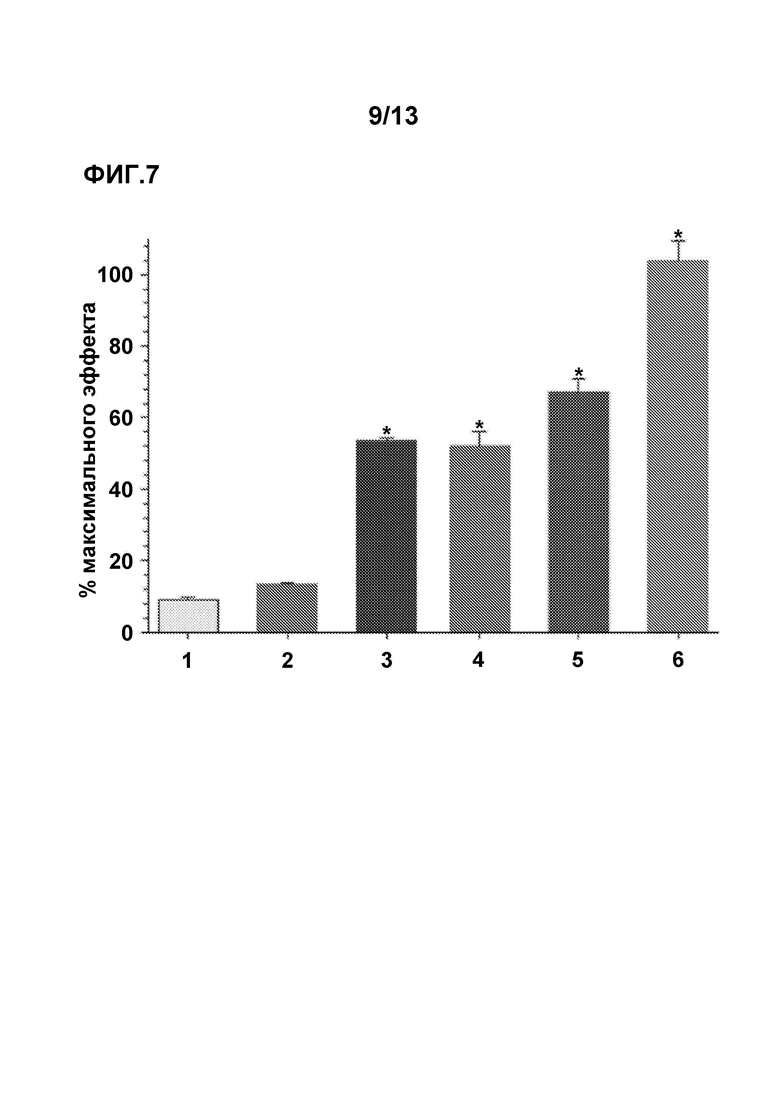

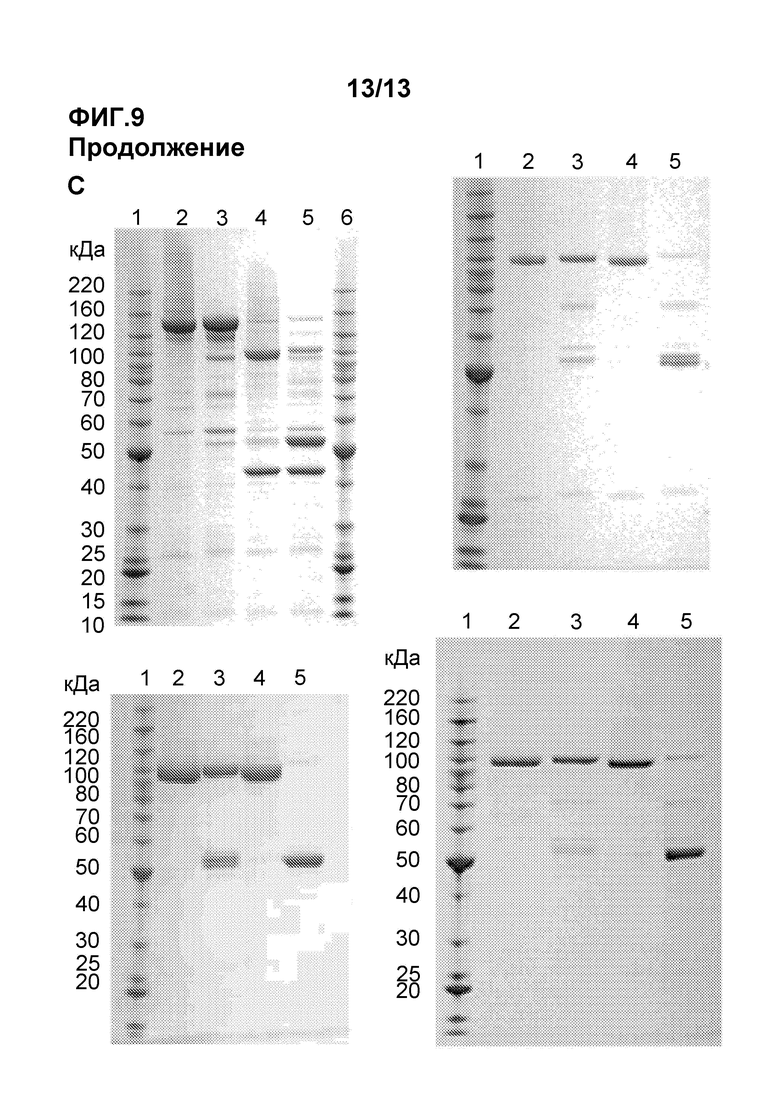
Изобретение относится к области биохимии и биотехнологии, в частности к нецитотоксическому анальгетическому одноцепочечному полипептидному слитому белку. Настоящий слитый белок содержит нецитотоксическую протеазу, первый спейсер, сайт расщепления протеазой, направляющий фрагмент галанина, второй спейсер и домен транслокации. Указанный домен транслокации переносит протеазу из эндосомы через эндосомальную мембрану в цитозоль ноцицептивного сенсорного афферента. Указанный белок отличается тем, что первый спейсер расположен между нецитотоксической протеазой и сайтом расщепления протеазой, является гибким и состоит из 4-25 аминокислотных остатков. Изобретение также относится к способу получения указанного слитого белка и к способу получения двухцепочечного нецитотоксического анальгетического полипептида путем расщепления указанного одноцепочечного слитого белка протеазой. Настоящее изобретение также относится к способам лечения, профилактики или облегчения боли, включающим введение пациенту указанных слитого белка или двухцепочечного полипептида. Настоящее изобретение позволяет получать полипептиды для лечения, профилактики или облегчения боли. 9 н. и 13 з.п. ф-лы, 9 ил., 5 табл., 10 пр.
1. Нецитотоксический анальгетический одноцепочечный полипептидный слитый белок, содержащий:
a. нецитотоксическую протеазу, которая расщепляет белок экзоцитозного аппарата слияния ноцицептивного сенсорного афферента;
b. направляющий фрагмент галанина, который связывается с сайтом связывания на ноцицептивном сенсорном афференте, при этом сайт связывания подвергается эндоцитозу, встраиваясь в эндосому в ноцицептивном сенсорном афференте;
c. сайт расщепления протеазой, в котором слитый белок расщепляется протеазой, при этом сайт расщепления протеазой расположен между нецитотоксической протеазой и направляющим фрагментом галанина;
d. домен транслокации, который переносит протеазу из эндосомы через эндосомальную мембрану в цитозоль ноцицептивного сенсорного афферента, при этом направляющий фрагмент расположен между сайтом расщепления протеазой и доменом транслокации;
e. первый гибкий спейсер, расположенный между нецитотоксической протеазой и сайтом расщепления протеазой, при этом указанный первый спейсер содержит аминокислотную последовательность из 4-25 аминокислотных остатков;
f. второй спейсер, расположенный между направляющим фрагментом галанина и доменом транслокации, при этом указанный второй спейсер содержит аминокислотную последовательность из 4-35 аминокислотных остатков.
2. Слитый белок по п.1, в котором первый спейсер содержит аминокислотную последовательность из 6-16 аминокислотных остатков.
3. Слитый белок по п.1 или 2, в котором указанные аминокислотные остатки указанного первого спейсера выбраны из группы, состоящей из глицина, треонина, аргинина, серина, аланина, аспарагина, глутамина, аспарагиновой кислоты, пролина, глутаминовой кислоты и/или лизина.
4. Слитый белок по п.1 или 2, в котором аминокислотные остатки первого спейсера выбраны из группы, состоящей из глицина, серина и аланина.
5. Слитый белок по п.1 или 2, в котором первый спейсер выбран из спейсера с последовательностью GGGGSA, GGGGSGGGGSA, ALAGGGGSGGGGSALV, GGGGSGGGGSGGGGSA, ALAGGGGSGGGGSGGGGSALV или ALAAEAAAKEAAAKEAAAKAGGGGSALV.
6. Слитый белок по п.1 или 2, в котором направляющий фрагмент галанина специфически связывается с рецептором GALR1, GALR2 и/или GALR3.
7. Слитый белок по п.1 или 6, в котором направляющий фрагмент галанина по существу состоит из аминокислотной последовательности, имеющей по меньшей мере 70% идентичности последовательности с SEQ ID NO:7 или SEQ ID NO:8.
8. Слитый белок по п.1 или 6, в котором направляющий фрагмент галанина по существу состоит из аминокислотной последовательности, соответствующей SEQ ID NO:7, или фрагмента, состоящего из по меньшей мере 16 смежных аминокислотных остатков из нее, или вариантной аминокислотной последовательности, указанной SEQ ID NO:7 или указанного фрагмента, имеющей максимум 5 или 6 консервативных аминокислотных замен.
9. Слитый белок по п.1, в котором нецитотоксическая протеаза представляет собой L-цепь клостридиального нейротоксина или IgA-протеазу.
10. Слитый белок по п.1, в котором домен транслокации представляет собой домен HN клостридиального нейротоксина.
11. Слитый белок по п.1, содержащий аминокислотную последовательность, имеющую по меньшей мере 90% идентичности последовательности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:10, 11, 13, 16, 17, 19, 20, 22, 23, 25, 26, 28, 31, 32, 34, 35, 36, 37, 38, 39, 40, 41, 47, 48, 49, 50, 53, 56 и/или 59.
12. Полинуклеотидная молекула, кодирующая полипептидный слитый белок по любому из пп.1-11.
13. Вектор экспрессии, содержащий промотор, полинуклеотидную молекулу по п.12, при этом указанная полинуклеотидная молекула расположена ниже промотора, а терминатор расположен ниже полинуклеотидной молекулы.
14. Способ получения одноцепочечного полипептидного слитого белка, включающий:
a. трансфицирование клетки-хозяина вектором экспрессии по п.13, и
b. культивирование указанной клетки-хозяина в условиях, способствующих экспрессии полипептидного слитого белка вектором экспрессии.
15. Способ получения нецитотоксического анальгетического полипептида, включающий:
a. создание контакта одноцепочечного полипептидного слитого белка по любому из пп.1-11 с протеазой, способной расщеплять сайт расщепления протеазой;
b. расщепление сайта расщепления протеазой и, таким образом, образование двухцепочечного нецитотоксического анальгетического полипептида.
16. Нецитотоксический анальгетический полипептид, полученный способом по п.15, который представляет собой двухцепочечный полипептид и в котором:
a. первая цепь содержит нецитотоксическую протеазу, способную расщеплять белок экзоцитозного аппарата слияния ноцицептивного сенсорного афферента;
b. вторая цепь содержит направляющий фрагмент галанина и домен транслокации, способный перемещать протеазу из эндосомы через эндосомальную мембрану в цитозоль ноцицептивного сенсорного афферента; и
первая и вторая цепи связаны между собой дисульфидной связью.
17. Способ лечения, профилактики или облегчения боли у индивида, включающий введение указанному пациенту терапевтически эффективного количества слитого белка по любому из пп.1-11.
18. Способ по п.17, в котором боль представляет собой хроническую боль, выбранную из невропатической боли, воспалительной боли, головной боли, соматической боли, висцеральной боли и реперкуссионной боли.
19. Способ лечения, профилактики или облегчения боли у индивида, включающий введение указанному пациенту терапевтически эффективного количества полипептида по п.16.
20. Способ по п.19, в котором боль представляет собой хроническую боль, выбранную из невропатической боли, воспалительной боли, головной боли, соматической боли, висцеральной боли и реперкуссионной боли.
21. Применение слитого белка по любому из пп.1-11 или полипептида по п.16 для лечения, профилактики или облегчения боли.
22. Применение по п.21, где боль представляет собой хроническую боль, выбранную из невропатической боли, воспалительной боли, головной боли, соматической боли, висцеральной боли и реперкуссионной боли.
| WO 2006059093 A2, 08.06.2006 | |||
| GUSTAVSSON M et al., Stable linker peptides for a cellulose-binding domain-lipase fusion protein expressed in Pichia pastoris, Protein engineering, 2001 | |||
| ROBERGE M et al., Fusion of two distinct peptide exosite inhibitors of Factor VIIa, Biochemical Journal, 2002 | |||
| CRASTO CJ et al., LINKER: a program to generate linker sequences for fusion proteins, Protein engineering, 2000 | |||
| VOGTENTANZ G et al., A Bacillus subtilis fusion protein system to produce soybean Bowman-Birk protease inhibitor, Protein expression and purification, 2007 | |||
| WO 2011152694 A1, 08.12.2011 | |||
| US 2004063912 A1, 01.04.2004 | |||
| US 2009299040 A1, 03.12.2009 | |||
| US 2010197581 A1, 05.08.2010 | |||
| US 6410319 B1, 25.06.2002 | |||
| LANG R et al., The galanin peptide family: receptor pharmacology, pleiotropic biological actions, and implications in health and disease, Pharmacology and therapeutics, 2007 | |||
| US 2009281031 A1, 12.11.2009 | |||
| US 2012156186 A1, 21.06.2012 | |||
| US 2010233741 A1, 16.09.2010 | |||
| MASUYER G et al., Structures of engineered Clostridium botulinum neurotoxin derivatives, Acta Crystallographica Section F: Structural Biology and Crystallization Communications, 2011 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 2009004174 A1, 01.01.2009 | |||
| US 2011160135 A1, 30.06.2011 | |||
| US 2011027256 A1, 03.02.2011 | |||
| US 7658933 B2, 09.02.2010 | |||
| НЕЦИТОТОКСИЧЕСКОЕ ВЕЩЕСТВО, СПОСОБ РЕГУЛЯЦИИ ВЫДЕЛЕНИЯ НЕЙРОМЕДИАТОРА ИЛИ НЕЙРОМОДУЛЯТОРА ИЗ ПЕРВИЧНЫХ СЕНСОРНЫХ АФФЕРЕНТНЫХ КЛЕТОК И СПОСОБ РЕГУЛЯЦИИ ВЫДЕЛЕНИЯ НЕЙРОМЕДИАТОРА И НЕЙРОМОДУЛЯТОРА ИЗ ПЕРВИЧНЫХ НОЦИЦЕПТИВНЫХ АФФЕРЕНТНЫХ КЛЕТОК | 1996 |
|
RU2165976C2 |
Авторы
Даты
2018-05-03—Публикация
2013-08-27—Подача