ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Область изобретения
Изобретение в целом относится к остеопорозу и терапевтическим вмешательствам при нем у млекопитающих. Более конкретно, настоящее изобретение относится к терапевтическому потенциалу калебина А для лечения остеопороза, где показано, что калебин А в терапевтически эффективных количествах ингибирует остеокластогенез у млекопитающих посредством подавления биохимического пути передачи сигнала лиганда рецептора-активатора ядерного фактора (NF)-κB (RANKL), что, таким образом, убедительно демонстрирует терапевтический потенциал в отношении остеопороза.
Описание предшествующего уровня техники
Согласно оценкам, к 2020 г. 61 млн. человек в возрасте 50 лет или старше в США будут склонны к риску переломов вследствие заболеваний костей, обусловленных остеокластами, таких как остеопороз или низкая костная масса, из-за недоступности широко применимого на практике и эффективного лечения. По данным Американской академии ортопедических хирургов проектная стоимость лечения остеопороза в течение двух следующих десятилетий будет составлять приблизительно 474 млрд. долларов (Z. Jin, X. Li, Y. Wan, Mol. Endocrinol. 29 (2015) 172-186).
Костный метастаз является частым осложнением множественной миеломы или распространенного рака молочной железы, карцином предстательной железы, легкого, ободочной кишки, почки, щитовидной железы и желудка (R.E. Coleman, Cancer Treat. Rev. 27 (2001) 165-176 и R.E. Coleman, Clin. Cancer Res. Off. J. Am. Assoc). Вовлеченность цитокина, принадлежащего к семейству фактора некроза опухоли (TNF), называемого лигандом-активатором рецептора ядерного фактора (NF)-κB (RANKL), при таком метастазе описана в данной области техники (Т. Onishi, N. Hayashi, R.L. Theriault, G.N. Hortobagyi, NT. Ueno, Nat. Rev. Clin. Oncol. 7 (2010) 641-651). Продемонстрировано, что RANKL обладает остеокластогенной активностью, посредством которой RANKL направляет дифференциацию костных моноцитов в остеокласты, которые стимулируют резорбцию кости (D.L. Lacey, Е. Timms, H.L. Tan, M.J. Kelley, C.R. Dunstan, T. Burgess, R. Elliott, A. Colombero, G. Elliott, S. Scully, H. Hsu, J. Sullivan, N. Hawkins, E. Davy, C. Capparelli, A. Eli, Y.X. Qian, S. Kaufman, I. Sarosi, V. Shalhoub, G. Senaldi, J. Guo, J. Delaney, W.J. Boyle, Cell 93 (1998) 165-176 и S.L. Teitelbaum, Science 289 (2000) 1504-1508).
Согласно сообщениям, куркумин также подавляет остеокластогенез (А.С. Bharti, Y. Takada, В.В. Aggarwal, J. Immunol. (2004) 172, 5940-5947). Другие натуральные ингредиенты для борьбы с остеокластогенезом, индуцированным остеопорозом и раком, еще остаются неисследованными. Калебин А как натуральный ингредиент известен в данной области техники благодаря его противораковым свойствам (Li Y et al, "Calebin-A induces apoptosis and modulates МАРК family activity in drug resistant human gastric cancer cells", Eur J Pharmacol. 2008 Sep 4; 591 (1-3): 252-258 и Aggarwal BB et al, "Curcumin-free turmeric exhibits anti-inflammatory and anticancer activities: Identification of novel components of turmeric", Mol Nutr Food Res. 2013 Sep; 57 (9): 1529-42). В настоящем изобретении исследуется способность калебина А к подавлению остеокластогенеза у млекопитающих.
Основная цель изобретения состоит в раскрытии терапевтического потенциала калебина А для лечения остеопороза млекопитающих, где показано, что калебин А ингибирует как RANKL-индуцированный, так и индуцированный раком остеокластогенез.
В настоящем изобретении выполнена указанная выше цель, а также представлена соответствующие преимущества.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении раскрыт терапевтический потенциал калебина А для лечения остеопороза (потери костной массы), вызванного старением или хроническими болезненными состояниями, такими как рак. Показано, что калебин А осуществляет понижающее модулирование остеокластогенеза, индуцированного передачей сигнала лигандом рецептора-активатора ядерного фактора (NF)-κB (RANKL), и, следовательно, обладает терапевтическим потенциалом для лечения остеопороза. Другие признаки и преимущества настоящего изобретения станут очевидными из последующего более подробного описания, рассматриваемого в сочетании с сопроводительными графическими материалами, которые иллюстрируют на примерах принципа изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
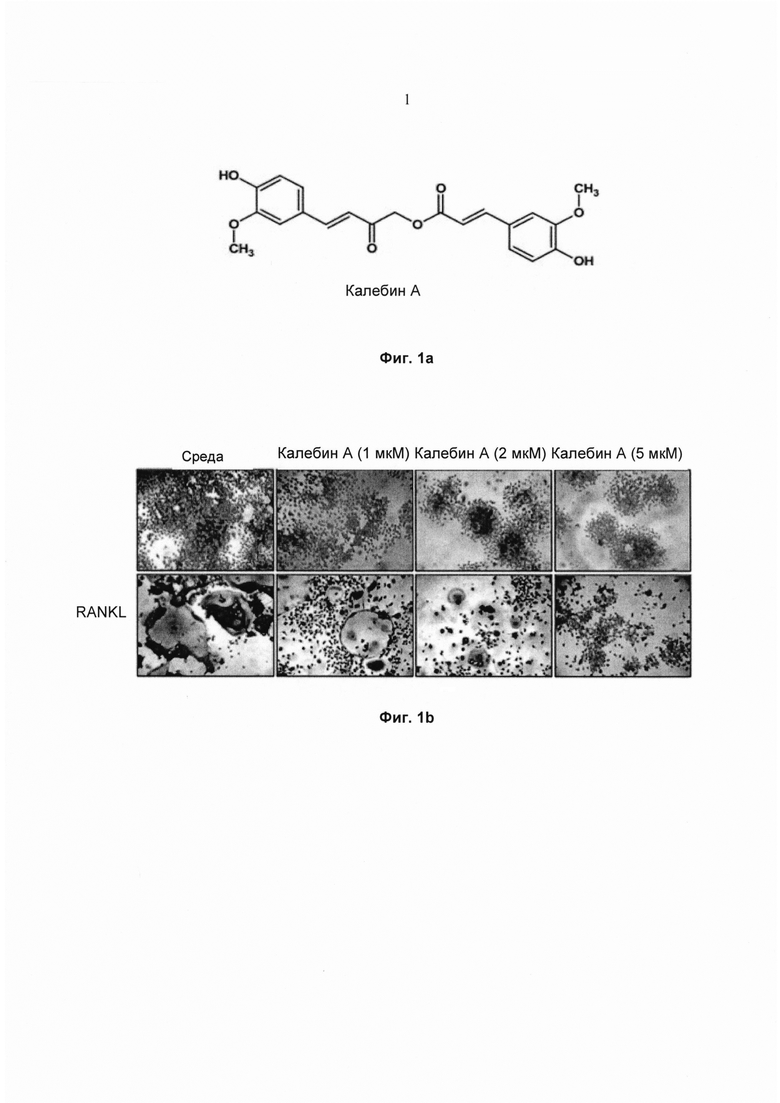
На фиг. 1а показана структура калебина А.
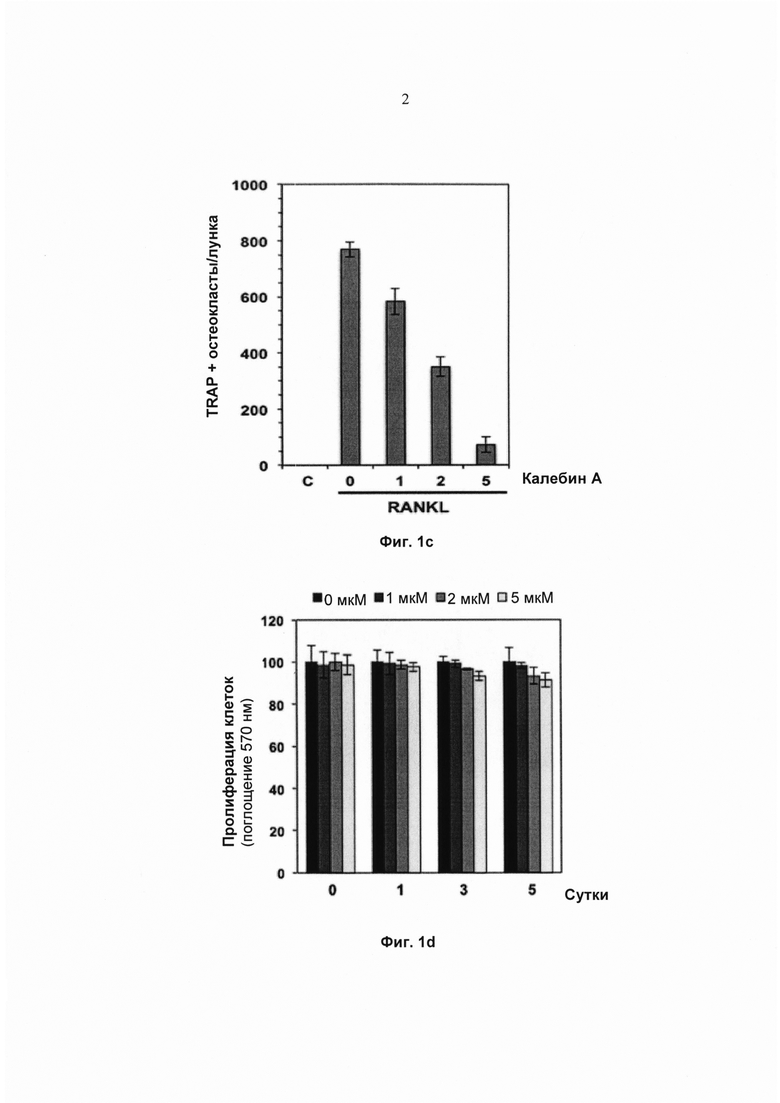
На фиг. 1b показана экспрессия TRAP (тартрат-резистентной кислой фосфатазы) (TRAP-положительные клетки) в макрофагах мыши RAW264.7 (5×103 клеток/мл), окрашенных для выявления остеокластогенеза. Клетки инкубировали с RANKL (5 нМ) или RANKL с добавлением калебина А концентраций 0, 1, 2, 5 мМ в течение 5 суток. Исходное увеличение - 100×.
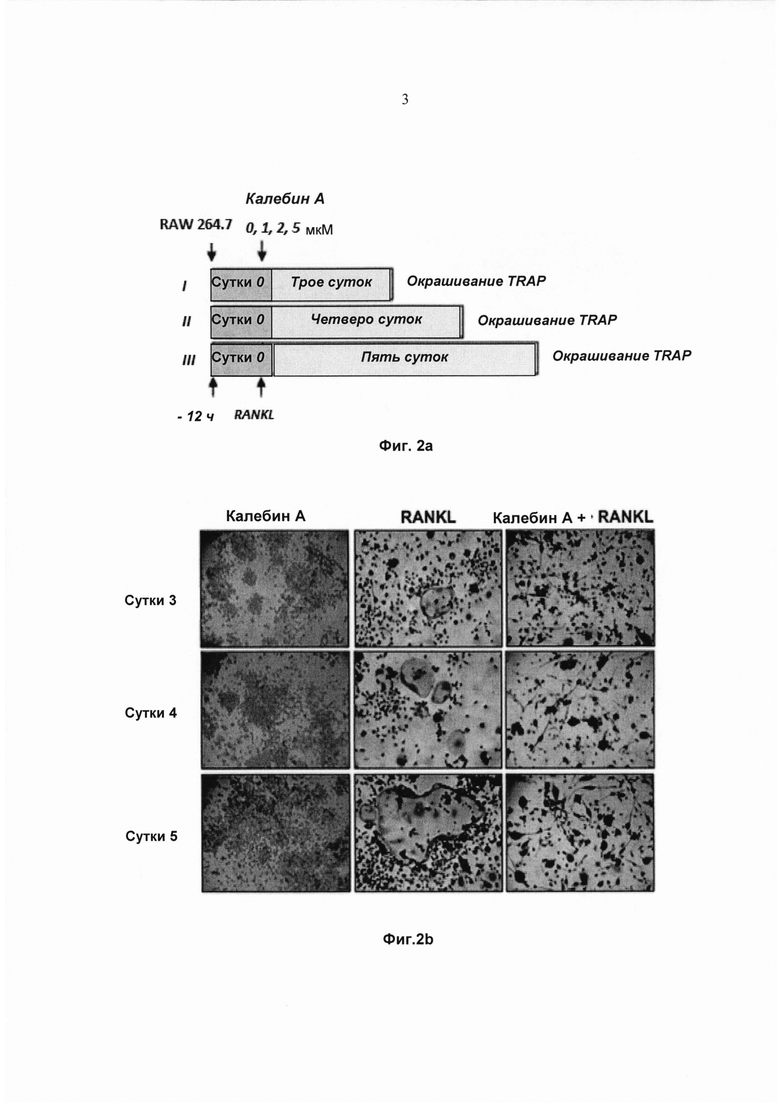
На фиг. 1с показано количественное определение многоядерных остеокластов (≥3 или более ядер) после обработки одним RANKL (5 нМ) или RANKL с добавлением калебина А концентраций 0, 1, 2, 5 мМ в течение 5 суток. Значения выражены в виде среднего 3 измерений ± стандартное отклонение (SD).
На фиг. 1d показана пролиферация макрофагов мыши согласно оценке методом МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолиум бромид). Клетки RAW 264.7 (3×103 клеток на 100 мл) инкубировали только со средой (контроль) или с 1, 2 или 5 мМ концентрациями калебина А в течение 1, 3 и 5 суток.
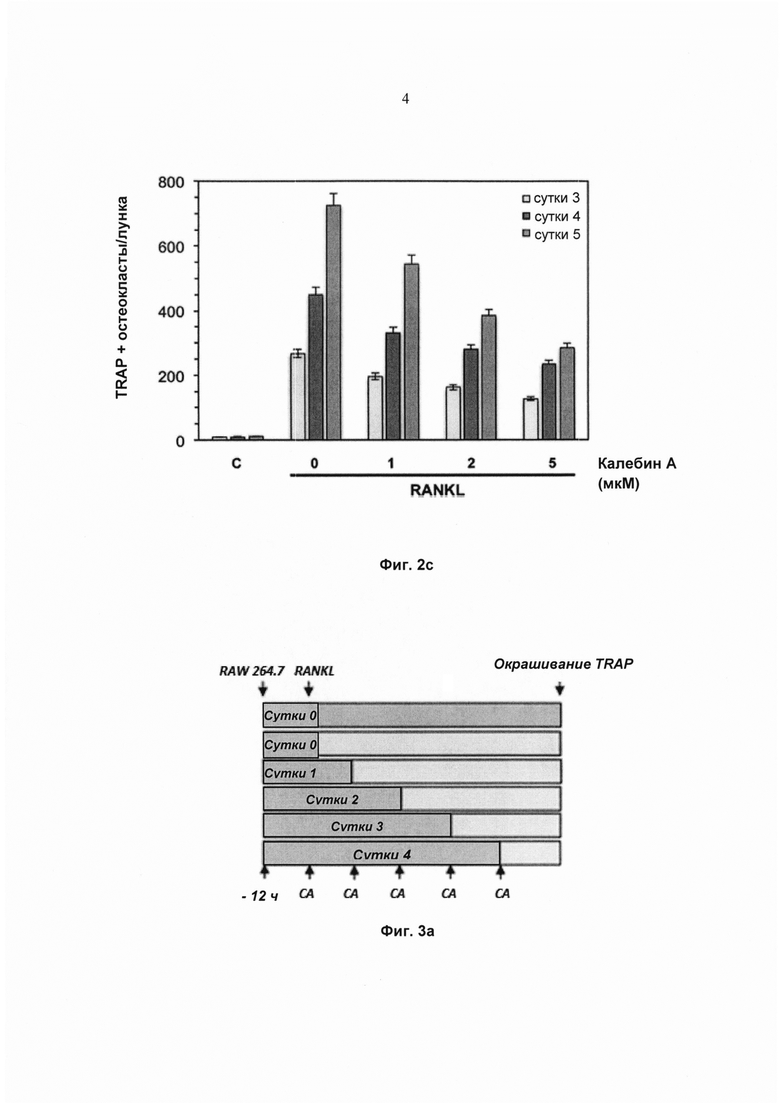
На фиг. 2а показано схематическое изображение графика обработки для валидации ингибирования RANKL-индуцированного остеокластогенеза калебином А.
На фиг. 2b показана экспрессия TRAP в окрашенных макрофагах мыши - RAW264.7 (5×103 клеток/мл), проинкубированных с 5 нМ RANKL, 5 мМ калебином А или с обоими веществами в течение 3, 4 и 5 суток. Исходное увеличение - 100×.
На фиг. 2с показано количество многоядерных остеокластов (≥3 ядер) RAW264.7 (5×103 клеток/мл), проинкубированных либо со средой (С), либо с RANKL (5 нМ) вместе с указанными концентрациями калебина А в течение 3, 4 и 5 суток, окрашенных для выявления экспрессии TRAP. Значения представляют собой среднее 3 измерений ± SD.
На фиг. 3а показано схематическое изображение графика обработки для выявления ингибирования RANKL-индуцированного остеокластогенеза калебином А, 24 ч после стимуляции.
На фиг. 3b показана экспрессия TRAP в окрашенных клетках RAW264.7 (5×103 клеток/мл) после 5 суток инкубации со средой, RANKL (5 нМ), калебином А (5 мМ) или RANKL и калебином А.
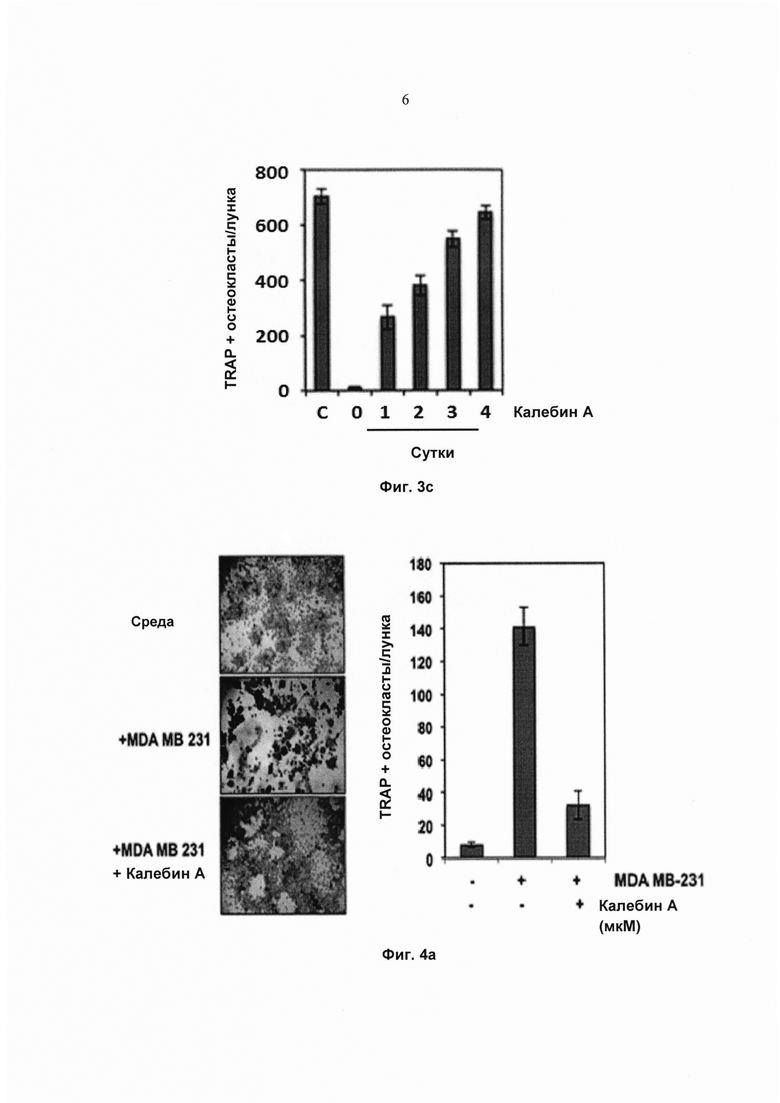
На фиг. 3с показано количество многоядерных остеокластов (≥3 ядер). С обозначает клетки, проинкубированные только со средой. Значения представляют собой среднее 3 измерений ± SD.
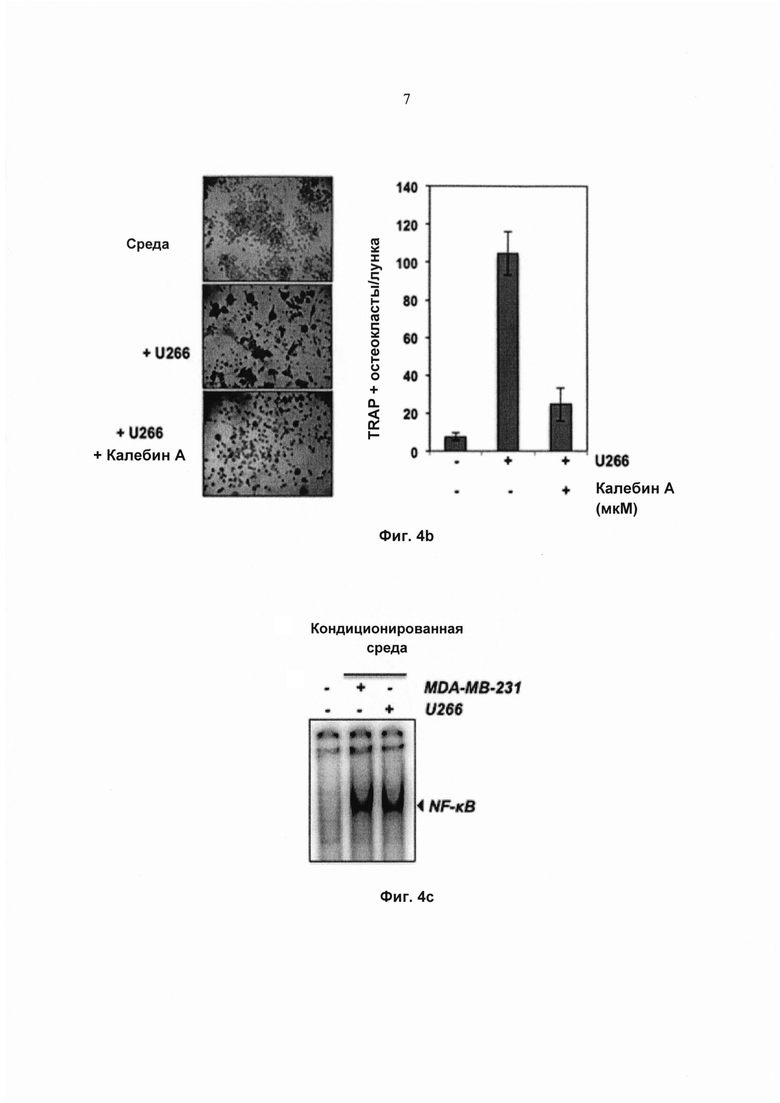
На фиг. 4а показана экспрессия TRAP в окрашенных клетках RAW 264.7 (5×103 клеток/мл), проинкубированных в присутствии клеток MDA-MB-231 (клетки аденокарциномы молочной железы человека) (1×103 клеток/мл) под действием калебина А (5 мМ) в течение 5 суток, и соответствующее количество многоядерных остеокластов (среднее ± SD).
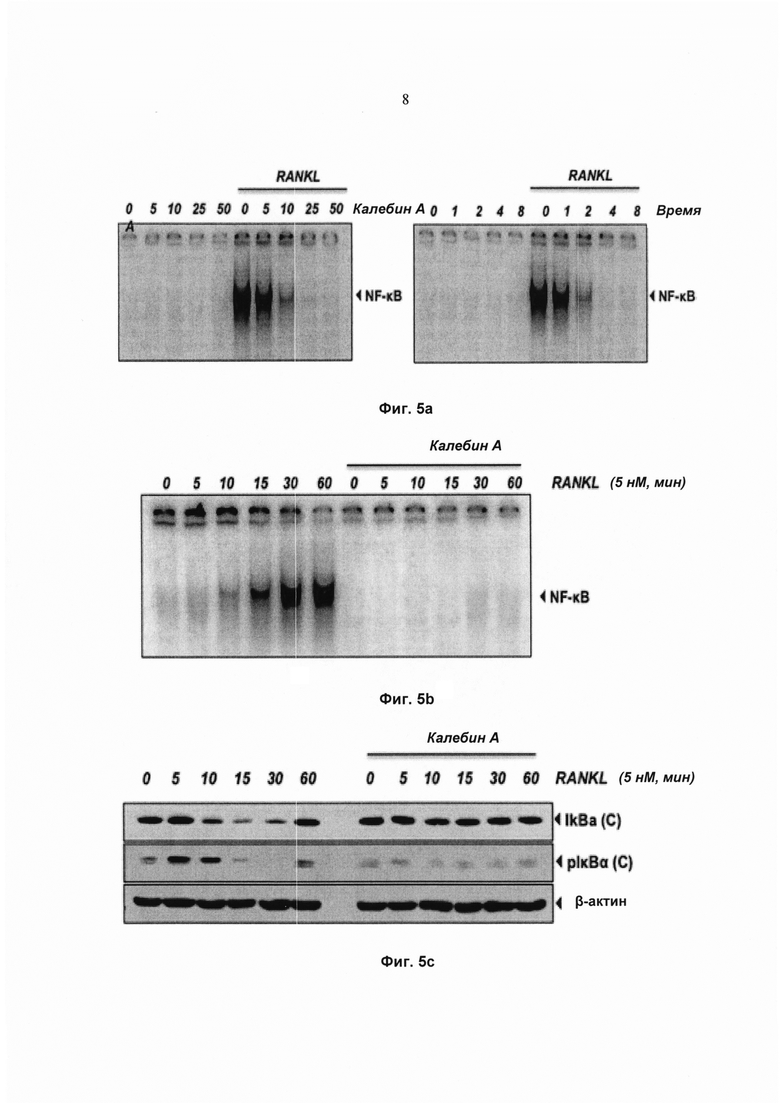
На фиг. 4b показана экспрессия TRAP в окрашенных клетках RAW 264.7 (5×103 клеток/мл), проинкубированных в присутствии клеток U266 (клетки множественной миеломы) (1×103 клеток/мл, под действием калебина А (5 мМ) в течение 5 суток, и соответствующее количество многоядерных остеокластов (среднее ± SD).
На фиг. 4с показан анализ изменения электрофоретической подвижности (EMSA) для определения активности ядерного фактора-кВ (NFκB) в клетках RAW 264.7 (1,5×103 клеток на лунку), проинкубированных в присутствии кондиционированной среды клеток MDA-MB-231 или U266 в течение 24 ч.
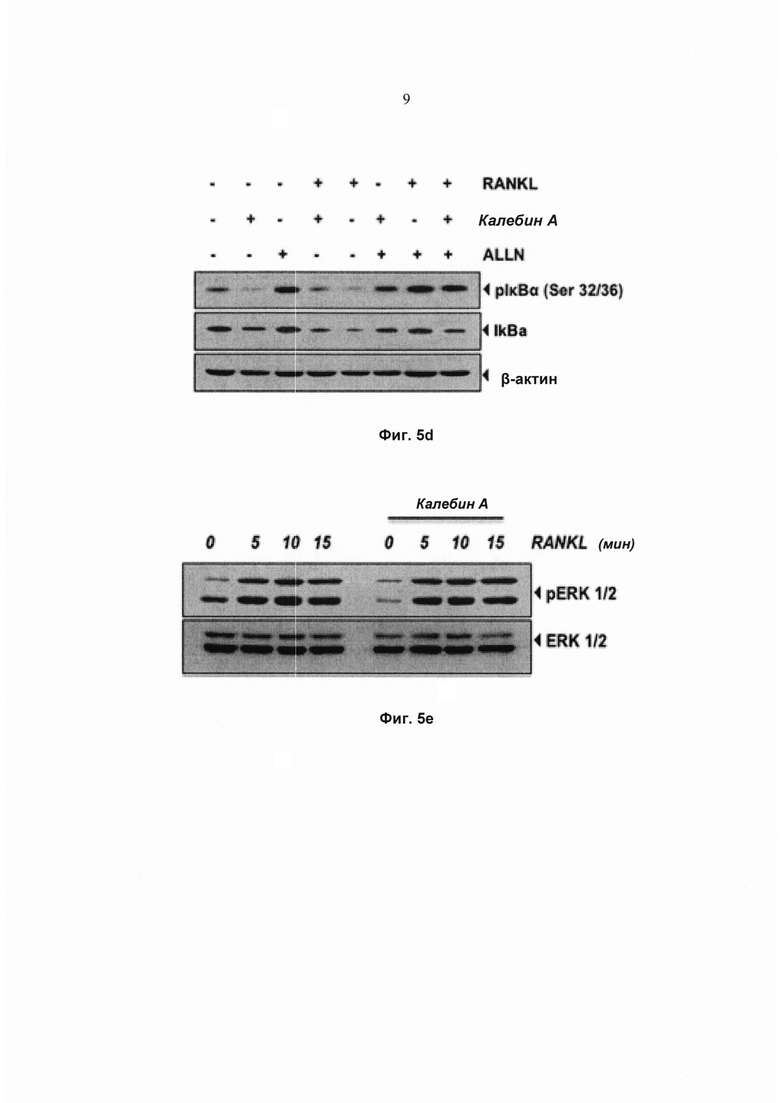
На фиг. 5а показан анализ изменения электрофоретической подвижности (EMSA) для определения активности ядерного фактора-кВ (NFκB) в ядерных экстрактах клеток RAW 264.7 (1,5×103 клеток на лунку), проинкубированных с 50 мМ калебина А в течение 8 ч и обработанных 10 нМ RANKL в течение 30 мин.
На фиг. 5b показан анализ изменения электрофоретической подвижности (EMSA) для активности ядерного фактора-κВ (NFκB) в клетках RAW 264.7 (1,5×103 клеток на лунку), обработанных указанными концентрациями калебина А в течение 8 ч и обработанных 10 нМ RANKL в течение 30 мин.
На фиг. 5с показано репрезентативное изображение анализа методом Вестерн-блоттинга распада и фосфорилирования lκВα в цитоплазматических экстрактах клеток RAW 264.7 (1,5×103 клеток на лунку), проинкубированных с 50 мМ калебина А в течение 8 ч, а затем обработанных 10 нМ RANKL в течение указанного времени (мин). β-актин использовали в качестве контроля нанесения.
На фиг. 5d показано репрезентативное изображение анализа методом Вестерн-блоттинга экспрессии фосфо-lκκВα в цитоплазматических экстрактах клеток RAW 264.7 (1,5×103 клеток на лунку), проинкубированных с 50 мМ калебина А в течение 8 ч, а затем проинкубированных с ALLN (N-ацетиллейцил-лейцил-норлейциналь) (50 мг/мл) в течение 30 мин и, наконец, обработанных RANKL (10 нМ) в течение 15 мин. Ту же мембрану снова гибридизовали с антителами к lκВα и к β-актину.
На фиг. 5е показано репрезентативное изображение анализа методом Вестерн-блоттинга экспрессии фосфорилированной регулируемой внеклеточными сигналами киназы (p-ERK) в цельноклеточных экстрактах клеток RAW 264.7 (1,5×103 клеток на лунку), предварительно проинкубированных с калебином А в течение 8 ч, а затем подвергнутых воздействию RANKL (10 нМ) в течение указанного времени. ERK 1/2 использовали в качестве контроля нанесения.
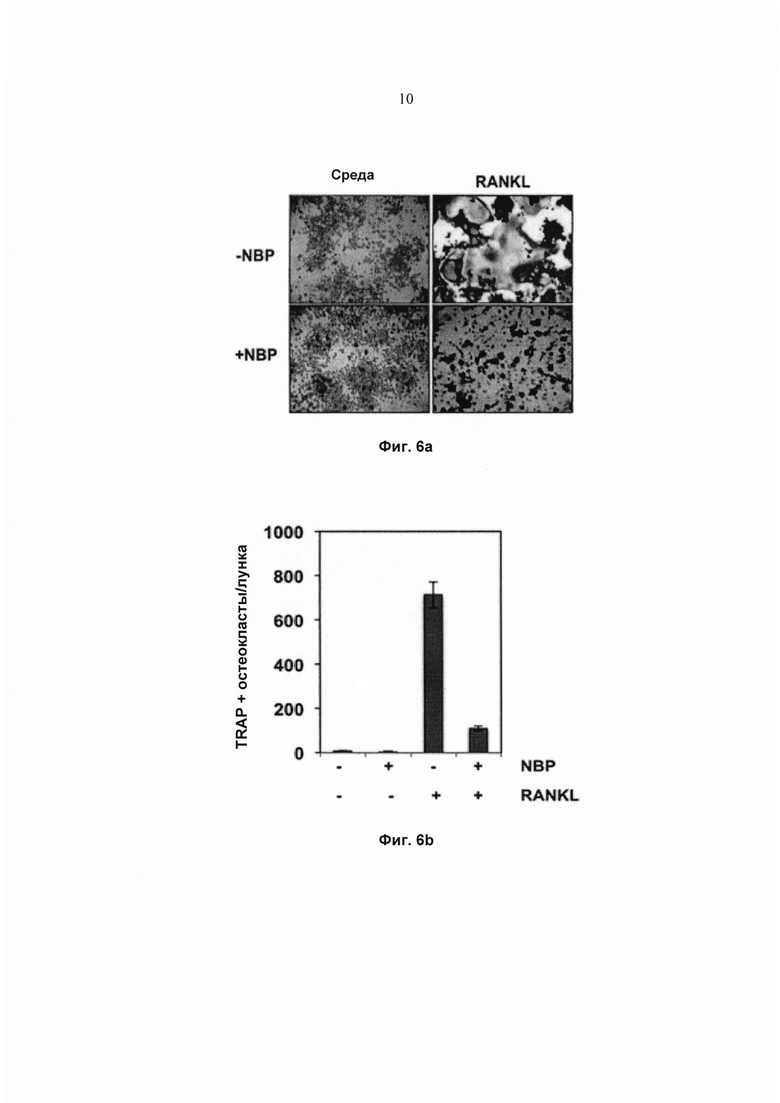
На фиг. 6а показана экспрессия TRAP в окрашенных клетках RAW 264.7 (5×103 клеток/мл), предварительно обработанных 100 мМ пептида NEMO-связывающего домена (NBP) в течение 2 ч и проинкубированных с RANKL (5 нМ) в течение 5 суток. Исходное увеличение - 100×.
На фиг. 6b показано количество многоядерных остеокластов (≥3 ядер). Значения представляют собой среднее 3 измерений ± SD.
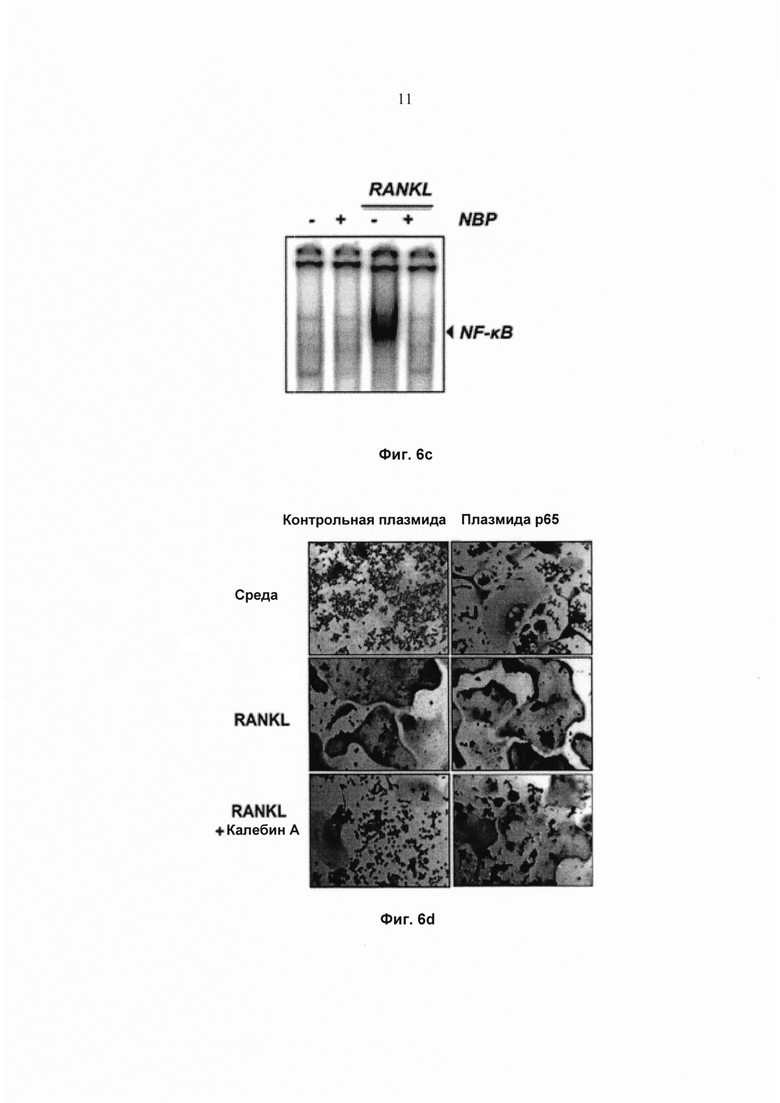
На фиг. 6с показан анализ сдвига электрофоретической подвижности (EMSA) для определения активности ядерного фактора-κВ (NFκB) в клетках RAW 264.7 (1,5×103 клеток на лунку), проинкубированных со 100 мМ NBP в течение 2 ч и с 10 нМ RANKL в течение 30 мин.
На фиг. 6d показаны сниженные ингибиторные воздействия калебина А на RANKL-индуцированный остеокластогенез в результате гиперэкспрессии NFκB/p65. Клетки RAW 264.7 (5×103 клеток/лунка) сначала трансфицировали контрольной плазмидой и плазмидой р65. Через 24 ч клетки обрабатывали 5 мМ калебина А и 5 нМ RANKL в течение 5 суток, а затем окрашивали для выявления экспрессии TRAP. Исходное увеличение - 100×.
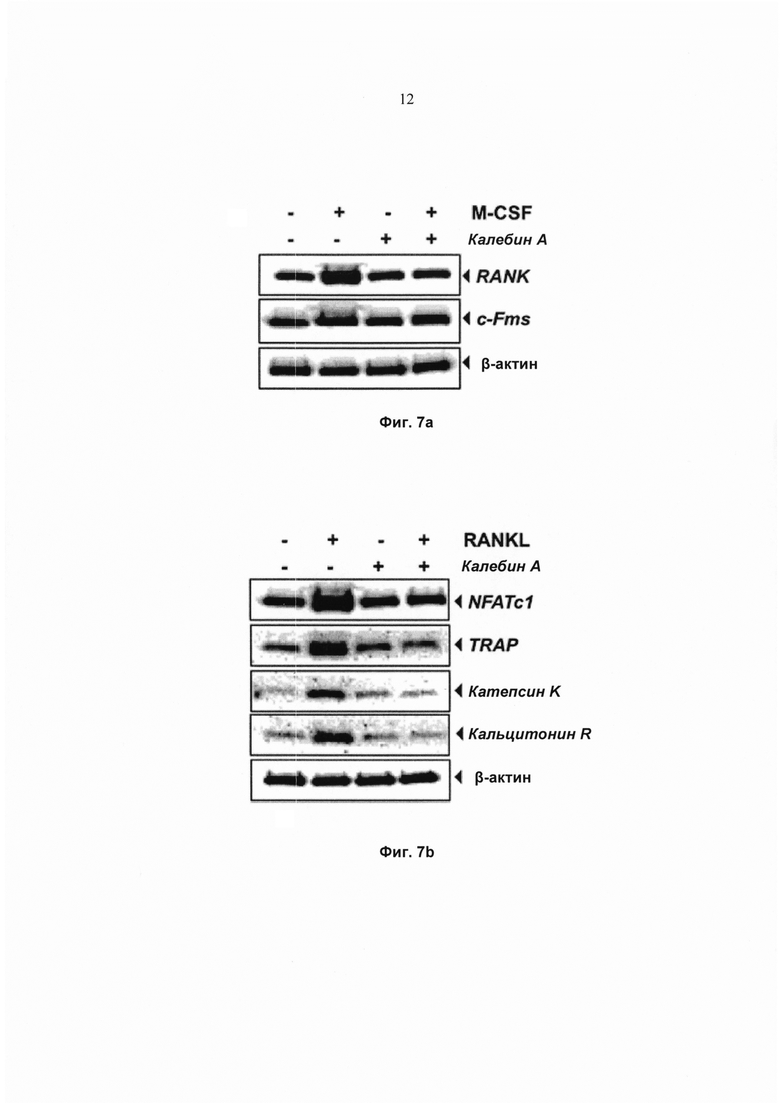
На фиг. 7а показано изображение иммуноблоттинга экспрессии RANK и М-CSF в клеточных лизатах RAW 264.7 (1,5×103 клеток на лунку), проинкубированных с 50 мМ калебина А в течение 8 ч и обработанных 20 нг/мл M-CSF в течение 24 ч. В-актин использовали в качестве контроля нанесения.
На фиг. 7b показан анализ методом Вестерн-блоттинга экспрессии различных генов, связанных с остеокластогенезом, клеток RAW 264.7 (1,5×103 клеток на лунку), проинкубированных с 50 мМ калебином А в течение 8 ч и обработанных 10 нМ RANKL в течение 24 ч. В-актин использовали в качестве контроля нанесения.
ПОДРОБНОЕ ОПИСАНИЕ НАИБОЛЕЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
(Фиг. 1b, 1с, 1d, 2а, 2b, 2с, 3а, 3b, 3с, 4а, 4b, 4с, 5а, 5b, 5с, 5d, 5е, 6а, 6b, 6с, 6d, 7а, 7b)
В наиболее предпочтительных воплощениях изобретение относится к описанному ниже.
Способ ингибирования остеокластогенеза у млекопитающих, где указанный способ включает стадии приведения в контакт клеток-предшественников остеокластов млекопитающих с эффективной концентрацией калебина А, чтобы вызвать ингибирование дифференциации указанных клеток-предшественников в остеокласты. В предпочтительном воплощении изобретения указанная клетка-предшественник представляет собой макрофаг.
Способ ингибирования экспрессии на уровне генов и белков, связанных с повышающей регуляцией остеокластогенеза у млекопитающих, где указанный способ включает стадию приведения в контакт клеток-предшественников остеокластов млекопитающих с эффективной концентрацией калебина А, чтобы вызвать понижающую регуляцию указанной экспрессии на уровне генов и белков в клетках-предшественниках млекопитающих.
Калебин А для применения в терапевтическом лечении остеопороза у млекопитающих, у которых остеопороз является результатом остеокластогенеза.
Композиции, содержащие калебин А, для применения в терапевтическом лечении остеопороза у млекопитающих, у которых остеопороз является результатом остеокластогенеза.
Способ терапевтического лечения остеопороза, индуцированного остеокластогенезом, у млекопитающих, включающий стадию введения млекопитающим, нуждающимся в таком терапевтическом лечении, терапевтически эффективных количеств калебина А, чтобы вызвать действие ингибирования остеокластогенеза.
Способ терапевтического лечения у млекопитающих остеопороза, являющегося результатом индуцированной раком дифференциации клеток-предшественников остеокластов в остеокласты, где указанный способ включает стадию приведения в контакт эффективной концентрации калебина А, указанных клеток-предшественников и указанных раковых клеток, чтобы вызвать ингибирование остеокластогенеза.
Конкретные примеры, включенные в настоящий документ ниже, иллюстрируют наиболее предпочтительные воплощения настоящего изобретения.
ПРИМЕРЫ
Пример 1: Материалы и методы
Реагенты
Готовили 50 мМ раствор калебина A (Sabinsa Corporation, штат Нью-Джерси, США) в диметилсульфоксиде и хранили небольшими аликвотами при -20°С. Перед применением его соответствующим образом разводили в культуральной среде. Модифицированная Дульбекко среда Игла (DMEM), DMEM/F-12, RPMI 1640, фетальная бычья сыворотка (ФБС), смесь антибиотиков и противогрибковых средств и прижизненный краситель 0,4% трипановый синий приобретали у компании Mediatech, Inc. (г. Манассас, штат Вирджиния). Рекомбинантный белок RANKL был предоставлен д-ром Bryant Darnay Онкологического центра им. М.Д. Андерсона в Техасском университете (г. Хьюстон, штат Техас). Антитела к lκκα, lκκβ и lκВα приобретали у компании Imgenex (г. Сан-Диего, штат Калифорния). Антитела к фосфо-lκВα (Ser32/36), cFms, TRAP, катепсину K и кальцитонину R приобретали у компании Cell Signalling Technology (г. Денвер, штат Массачусетс). Антитела к RANK, регулируемой внеклеточными сигналами киназе 2 (ERK2) и фocфo-ERK1/2 (Thr202/Tyr204) были получены от компании Santa Cruz Biotechnology (г. Санта-Крус, штат Калифорния). Антитело к NFATc1 было получено от компании Addgene (г. Кембридж, штат Массачусетс, США), M-CSF был получен от компании R&D Systems (г. Миннеаполис, штат Миннесота, США). Конъюгаты антител коза против кролика и коза против мыши с пероксидазой хрена приобретали у компании Bio-Rad (г. Геркулес, штат Калифорния). Антитело к 3-актину и набор лейкоцитарной кислой фосфатазы (387-А) для окрашивания тартрат-резистентной кислой фосфатазы (TRAP) приобретали у компании Sigma-Aldrich (Сент-Луис, штат Миссури). Трансмембранный, незаменимый модулятор NFκB (NEMO; также называемый lκκg)-связывающий домен пептид (NBP) приобретали у компании Imgenex. [g-32Р]АТФ приобретали у компании MP Biomedicals (г. Солон, штат Огайо).
Линии клеток
Макрофаги мыши RAW264.7 были получены от д-ра Bryant Darnay. Клетки культивировали в среде DMEM/F-12 с добавлением 10% ФБС и антибиотиков. Показано, что линия клеток RAW 264.7 экспрессирует RANK и дифференцируется в функциональные TRAP-положительные остеокласты при культивировании с растворимым RANKL. Кроме того, показано, что RANKL активирует NFκB в клетках RAW264.7. Клетки MDA-MB-231 (аденокарциномы молочной железы человека) и U266 (множественной миеломы человека) были получены из Американской типовой коллекции культур клеток (г. Манассас, штат Вирджиния). Клетки MDA-MB-231 культивировали в среде DMEM, а клетки U266 - в RPMI 1640 с 10% ФБС.
Количественный анализ дифференциации остеокластов
Чтобы определить действия калебина А на RANKL-индуцированную дифференциацию остеокластов, клетки RAW264.7 культивировали при плотности 5×103 клеток на лунку в 24-луночных планшетах и давали возможность прикрепиться в течение ночи. Затем среду заменяли, и клетки обрабатывали 5 нМ RANKL в течение 5 суток. После инкубации клетки подвергали окрашиванию на TRAP, используя набор лейкоцитарной щелочной фосфатазы. Для экспериментов по совместному культивированию с раковыми клетками клетки RAW 264.7 высевали при плотности 5×103 клеток на лунку и давали возможность прикрепиться в течение ночи. На следующий день к клеткам RAW 264.7 добавляли клетки U266 или MDA-MB-231 при плотности 1×103. Лунки обрабатывали калебином А и совместно культивировали в течение 5 суток, после чего подвергали окрашиванию на TRAP. Для экспериментов с кондиционированной средой клетки RAW 264.7 высевали при плотности 5×103 клеток на лунку и давали возможность прикрепиться в течение ночи. На следующий день среду заменяли 4/5 среды RAW 264.7 (DMEM/F12) и 1/5 кондиционированной среды из клеток MDA-MB-231 или U266. Для этой процедуры использовали супернатант культивированных раковых клеток, осажденных центрифугированием. Наконец, клетки RAW264.7 культивировали в течение 5 суток и подвергали окрашиванию TRAP и анализу изменения электрофоретической подвижности (EMSA).
Анализ пролиферации клеток
Действия калебина А на пролиферацию клеток RAW 264.7 определяли путем измерения активности митохондриальной дегидрогеназы по отношению к 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолиум бромиду (МТТ) в качестве субстрата, как описано В. Sung, S. Prasad, V.R. Yadav, S.C. Gupta, S. Reuter, N. Yamamoto, A. Murakami, B.B. Aggarwal, PloS One 8 (2013) e64118. Кратко, 3000 клеток RAW264.7 (в 0,1 мл среды) на лунку инкубировали с различными концентрациями калебина А в трех повторах в 96-луночных планшетах при 37°С в течение 1, 3 или 5 суток. На каждом интервале в каждую лунку добавляли раствор МТТ, и планшеты инкубировали в течение 2 ч при 37°С. Добавляли буфер экстракции (100 мМ), состоящий из 20% додецилсульфата натрия (ДСН) и 50% диметилформамида, и клетки инкубировали в течение ночи при 37°С для растворения формазана, образующегося в процессе реакции. Затем измеряли поглощение окрашенного продукта при 570 нм, используя 96-луночный мультисканер (MRX Revelation, Dynex Technologies, г. Чантили, штат Вирджиния).
Анализ с помощью Вестерн-блоттинга
Для определения уровней экспрессии белка получали цитоплазматические и цельноклеточные экстракты и фракционировали их с использованием электрофореза в 10% полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ). После электрофореза белки переносили на нитроцеллюлозные мембраны, подвергали блоттингу с релевантными антителами и определяли с помощью усиленной люминесцентной метки (GE Healthcare, г. Пискатавэй, штат Нью-Джерси).
Анализ измерения электрофоретической подвижности для определения NFκB
Для оценки активации NFκB в ядерных экстрактах проводили EMSA, используя процедуру, описанную в Y. Li, S. Li, Y. Han, J. Liu, J. Zhang, F. Li, Y. Wang, X. Liu, L. Yao, Eur. J. Pharmacol. 591 (2008) 252-258. Кратко, ядерные экстракты из необработанных и RANKL-обработанных клеток RAW 264.7 инкубировали с меченым 32Р-концевой меткой 45-мерным двунитевым олигонуклеотидом NFκB (15 мг белка с 16 фемтомоль (фМ) ДНК) из длинного концевого повтора HIV, 5'-TTGTTACAAGGGACTTTCCGCTGGGGACTTTCCAGGGGGAGGCGTGG-3' (жирным шрифтом показаны сайты связывания NFκB) в течение 30 мин при 37°С. Образовавшийся комплекс ДНК-белок отделяли от свободных олигонуклеотидов на 6,6% нативных полиакриламидных гелях. Высушенные гели визуализировали с помощью устройства для молекулярной визуализации Storm 820 (Amersham, г. Пискатавэй, штат Нью-Джерси, США), и радиоактивные полосы определяли количественно с использованием денситометра и программного обеспечения Image Quant (программа ImageJ, Национальный институт здоровья (NIH), США).
Трансфекция плазмидой р65
Чтобы определить роль экспрессии NF-κB/p65 в калебин А-индуцированном ингибировании остеокластогенеза, клетки RAW 264.7 (5×105 клеток/лунка) высевали в 6-луночные планшеты и транзитно трансфицировали плазмидной ДНК pNF-κВ (0,5 мг) и контрольной плазмидной ДНК pCMVFLAG1 кальцийфосфатным методом в течение 24 ч. Затем среду заменяли, и клетки обрабатывали RANKL (5 нМ) и/или калебином А (5 мМ) в течение 5 суток. Все клетки подвергали окрашиванию TRAP с использованием набора лейкоцитарной кислой фосфатазы.
Статистический анализ
Данные анализировали с использованием программы ImageJ (NIH, США) и представляли в виде среднего ± стандартное отклонение (SD). Статистическую значимость различий оценивали с помощью t-критерия Стьюдента. Значения Р менее 0,05 считали статистически значимыми.
Пример 2: Результаты
Калебин А ингибирует RANKL-индуцированный остеокластогенез
Для валидации потенциала ингибирования RANKL-индуцированного остеокластогенеза калебином А клетки RAW 264.7 обрабатывали различными концентрациями калебина А в присутствии RANKL. Затем клеткам давали возможность дифференцироваться в остеокласты. Наблюдали морфологические признаки клеток, позволяющие четко выявить дифференциацию клеток в остеокласты (Фиг. 1b). Тем не менее при воздействии возрастающих концентраций калебина А наблюдалось понижающееся RANKL-индуцированное образование остеокластов, измеренное путем подсчета количества TRAP-положительных остеокластов на лунку (Фиг. 1с). При тех же концентрациях калебина А оценивали пролиферацию клеток на 1, 3 и 5 сутки. Обработка калебином А не оказывала значимого влияния на пролиферацию клеток RAW 264.7, что исключает возможность связать наблюдаемое уменьшение количества TRAP-положительных остеокластов со снижением пролиферации клеток в результате обработки калебином А (Фиг. 1d).
Чтобы определить, зависит ли ингибиторное воздействие калебина А на остеокластогенез от времени, клетки RAW 264.7 обрабатывали RANKL и калебином А и инкубировали в течение 3, 4 или 5 суток до дифференциации в остеокласты (Фиг. 2а). Морфологическое наблюдение позволило выявить, что клетки RAW 264.7, обработанные RANKL, дифференцировались в остеокласты, и добавление калебина А ингибировало эту дифференциацию (Фиг. 2b). Кроме того, наблюдали, что RANKL-индуцированная дифференциация зависит от времени, при этом максимальное число TRAP-положительных остеокластов на лунку достигалось на 5 сутки (Фиг. 2b). Тем не менее, под действием калебина А число TRAP-положительных остеокластов дозозависимо уменьшалось, при этом во все моменты времени самое сильное ингибирование достигалось при дозе 5 мМ (Фиг. 2с).
Калебин А действует на ранней стадии биохимического пути RANKL-индуцированного остеокластогенеза
Полная RANKL-индуцированная дифференциация остеокласта в клетках RAW 264.7 обычно занимает около 5 суток. Чтобы определить момент, в который калебин А действует на биохимический путь дифференциации, клетки RAW 264.7 обрабатывали RANKL, и калебин А добавляли на 0, 1, 2, 3 и 4 сутки. Действия на образование остеокластов измеряли на 5 сутки (Фиг. 3а). Наблюдение под микроскопом (Фиг. 3d) и подсчет количества TRAP-положительных остеокластов на лунку (Фиг. 3с) показали, что воздействие калебина А существенно ингибирует образование остеокластов на 1-2 сутки после стимуляции RANKL. Тем не менее, калебин А уже не предотвращал образование остеокласта на сутки 3 и 4 после воздействия RANKL (Фиг. 3b и Фиг. 3c), что указывает на то, что он, вероятно, действует на ранней стадии в биохимическом пути дифференциации.
Калебин А ингибирует индуцированный раковыми клетками остеокластогенез
Поскольку повышенный остеокластогенез часто связан с раком молочной железы и множественной меланомой, исследовали, модулирует ли калебин А остеокластогенез клеток RAW264.7, индуцированный этими раковыми клетками. Клетки RAW264.7 и клетки рака молочной железы MDA-MB-231 или множественной миеломы U266 инкубировали совместно и давали возможность дифференцироваться в течение 5 суток. Наблюдали, что клетки MDA-MB-231 индуцировали дифференциацию клеток RAW264.7 в остеокласты, и калебин А ингибировал их дифференциацию (Фиг. 4а). Подобный паттерн наблюдали для клеток U266 (Фиг. 4b), что указывает на то, что калебин А подавляет процесс остеокластогенеза, индуцированный раковыми клетками. Одним из основных механизмов, связанных с остеокластогенезом, является биохимический путь активации NF-κВ. Поэтому исследовали, индуцирует ли кондиционированная среда от клеток MDA-MB-231 и U266 активацию NF-κВ в клетках RAW 264.7. Результаты позволили выявить, что кондиционированная среда действительно эффективно активировала NF-κВ (Фиг. 4с) в клетках RAW 264.7. Эти результаты указывают на то, что фактор транскрипции NF-κВ вовлечен в дифференциацию остеокластов, индуцированную раковыми клетками. В настоящем исследовании показано, что калебин А ингибирует остеокластогенез, индуцированный клетками MDA-MB-231 и U266, что позволяет предположить, что калебин А является привлекательным потенциальным средством лечения пациентов с костными метастазами.
Калебин А нейтрализует RANKL-индуцированную активацию NF-κB
Для дальнейшего исследования модулирования RANKL-индуцированной активации NF-κВ калебином А клетки RAW 264.7 предварительно обрабатывали либо различными концентрациями калебина А в течение 8 ч (Фиг. 5а, левая панель), либо калебином А (50 мМ) в течение различных периодов времени (Фиг. 5а, правая панель), а затем подвергали воздействию RANKL в течение 30 мин (Фиг.5а). Активацию NF-κВ количественно определяли, используя EMSA. Результаты указывают на то, что RANKL активирует NF-κВ; тем не менее, калебин А полностью нейтрализует RANKL-индуцированную активацию NF-κB (Фиг. 5а). Для определения воздействия дозы калебина А на активацию NF-κВ в клетках, подвергнутых воздействию RANKL, клетки RAW 264.7 предварительно обрабатывали различными концентрациями калебина А в течение 8 ч, а затем подвергали воздействию RANKL в течение 30 мин. Наблюдали, что калебин А полностью подавлял активацию NF-κВ при дозе 50 мМ (Фиг. 5b). Воздействие на активацию NF-κВ не наблюдали, когда клетки обрабатывали 50 мМ калебином А, но без RANKL, в течение 8 ч.
Калебин А ингибирует RANKL-индуцированное фосфорилирование и распад lκВα
Поскольку для ядерной транслокации NF-κВ требуется протеолитический распад lκВα, исследовали, было ли подавление NF-κВ калебином А вызвано ингибированием распада lκВα. Для количественного определения распада цитоплазматического lκВα после стимуляции RANKL в диапазоне временных интервалов использовали Вестерн-блоттинг (Фиг. 5с). RANKL индуцировал распад lκВα в необработанных контрольных клетках в пределах 10 мин, но уровни lκВα возвращались к нормальным в пределах 60 мин. Напротив, клетки, предварительно обработанные калебином А, проявляли полное ингибирование распада lκВα (Фиг. 5с).
Фосфорилирование lκВα необходимо для распада lκВα. Следовательно, исследовали, влияет ли калебин А на фосфорилирование lκВα. Наблюдали, что RANKL индуцировал фосфорилирование lκВα в пределах 5 мин. Тем не менее фосфорилирование полностью ингибировалось предварительной обработкой калебином А. Воздействие калебина А на фосфорилирование lκВα также исследовали путем использования ингибитора протеасом N-ацетиллейцил-лейцил-норлейциналя (ALLN), который предотвращает RANKL-индуцированный распад lκВα (Фиг. 5d). Анализ с помощью Вестерн-блоттинга указывает на то, что совместная обработка RANKL и ALLN индуцирует фосфорилирование lκВα при серинах 32 и 36 в клетках RAW264.7. Предварительная обработка калебином А ингибировала индукцию фосфорилирования. Один калебин А не индуцировал фосфорилирование lκВα (Фиг. 5d). Фосфорилирование, убиквитинирование и опосредованный протеасомами распад lκВα в ответ на RANKL представляет собой быстрый процесс. Эти результаты указывают на то, что калебин А ингибирует RANKL-индуцированную активацию NF-κВ посредством подавления распада и фосфорилирования lκВα.
Ингибирование остеокластогенеза калебином А является NF-κB-специфичным
Поскольку RANKL-индуцированный остеокластогенез запускается 2 основными биохимическими путями передачи сигнала, а именно биохимическими путями NF-κВ и митоген-активируемой протеинкиназы (МАРК), наблюдали, влияет ли предварительная обработка калебином А также и на биохимический путь МАРК. Исследовали действие калебина А на активацию ERK1/2. RANKL индуцировал фосфорилирование ERK1/2 в клетках-предшественниках остеокластов RAW 264.7 (Фиг. 5е). Тем не менее предварительная обработка клеток калебином А не ингибировала RANKL-индуцированную активацию фосфорилирования ERK, что указывает на то, что индуцированное калебином А ингибирование остеокластогенеза не опосредовано биохимическим путем МАРК.
Ингибирование NF-κВ нейтрализует остеокластогенез
Дополнительно исследовали, вызван ли RANKL-индуцированный остеокластогенез активацией NF-κВ, используя специфичный ингибитор регуляторной субъединицы комплекса IKK, который также известен как незаменимый модулятор NF-κВ (NEMO). NEMO-связывающий пептид (NBP) блокирует активацию NF-κВ. Чтобы определить действие NBP на RANKL-индуцированный остеокластогенез, клетки RAW264.7 предварительно обрабатывали 100 мМ NBP в течение 2 ч, а затем RANKL в течение 5 суток. Результаты показали, что RANKL индуцировал остеокластогенез, и что NBP ингибировал его (Фиг. 6а и Фиг. 6b). Кроме того, наблюдали, что ядерные экстракты из клеток RAW 264.7, обработанные 100 мМ NBP в течение 2 ч, а затем RANKL в течение 30 мин, полностью ингибировали активацию NF-κВ (Фиг. 6с). Эти результаты подтверждают, что активация NF-κВ была ответственна за дифференциацию остеокластов в клетках RAW 264.7 и что ингибирование NF-κB либо калебином А, либо NBP предотвращало остеокластогенез.
Гиперэкспрессия NF-κВ/p65 устраняет ингибиторные действия калебина А на остеокластогенез
Чтобы определить, ингибирует ли калебин А RANKL-индуцированный остеокластогенез, опосредованный активацией NF-κВ, осуществляли гиперэкспрессию р65 в клетках, а затем изучали действие калебина А на RANKL-индуцированный остеокластогенез. В клетках RAW 264.7, трансфицированных р65, наблюдали минимальное ингибирование RANKL-индуцированного остеокластогенеза калебином А, тем не менее, почти полное его ингибирование происходило в клетках, трансфицированных контрольной плазмидой (Фиг.6d). Этот результат указывает на то, что р65 играет роль в RANKL-индуцированном остеокластогенезе, и, следовательно, ингибирование NF-κВ/p65 калебином А ингибирует остеокластогенез.
Калебин А нейтрализует маркеры M-CSF-индуцированной дифференциации остеокластов
Кроме того, для исследования возможной роли калебина А в регуляции дифференциации остеокластов на ранней стадии клетки RAW 264.7 предварительно обрабатывали калебином А и индуцировали клетками M-CSF в течение 24 ч. Экспрессия RANK претерпевала повышающую регуляцию M-CSF, и наблюдали, что калебин А осуществляет понижающее модулирование M-CSF-индуцированной экспрессии RANK (Фиг. 7а). Значительные изменения экспрессии c-Fms, обработанного как M-CSF, так и калебином А, отсутствовали. Таким образом, сделали вывод, что калебин А ингибирует M-CSF-индуцированную экспрессию RANK.
Калебин А ингибирует RANKL-индуцированную экспрессию NFATc1 и других маркерных генов, связанных с остеокластогенезом
NFATc1 играет основную роль в регуляции остеокластогенеза. Следовательно, исследовали действие калебина А на RANKL-индуцированную экспрессию NFATc1. Результаты показали, что экспрессия NFATc1 претерпевает повышающую регуляцию под действием RANKL, а предварительная обработка калебином А нейтрализовала RANKL-индуцированную экспрессию NFATc1 (Фиг. 7b). В сущности, активация и ядерная транслокация NFATc1 и дифференциация остеокластов опосредованы регулируемой NFATc1 экспрессией большого числа маркерных генов, включая TRAP, катепсин K и кальцитонин R. Эти гены активируются RANKL-опосредованным биохимическим путем передачи сигнала. Следовательно, также исследовали действие калебина А на экспрессию маркерных генов, относящихся к RANKL-индуцированному остеокластогенезу. Наблюдали, что RANKL индуцировал экспрессию TRAP, катепсина K и кальцитонина R. Однако действие одного калебина А на экспрессию этих маркерных белков не отмечено (Фиг. 7b). Эти результаты указывают на то, что калебин А ингибирует RANKL-индуцированную экспрессию NFATc1, TRAP, катепсина K и кальцитонина R.
Хотя изобретение описано со ссылкой на предпочтительное воплощение, специалистам в данной области техники очевидно, что изобретение не ограничено ими. Вероятнее, объем изобретения следует интерпретировать только в сочетании с прилагаемой формулой изобретения.

Группа изобретений относится к медицине, в частности к способу ингибирования остеокластогенеза у млекопитающих; способу ингибирования экспрессиина на уровне генов и белков, связанных с повышающей регуляцией остеокластогенеза у млекопитающих; а также к применению калебина А в терапевтическом лечении остеопороза у млекопитающих, у которых остеопороз является результатом остеокластогенеза или результатом индуцированной раком дифференциации клеток-предшественников остеокластов в остеокласты. Раскрыт терапевтический потенциал калебина А для лечения остеопороза млекопитающих, который вызван передачей сигнала лиганда рецептора-активатора ядерного фактора (NF)-κB (RANKL), а также дифференциацией клеток-предшественников остеокластов, индуцированной раком. 4 н. и 1 з.п. ф-лы, 2 пр., 7 ил.
1. Способ ингибирования остеокластогенеза у млекопитающих, включающий стадии приведения в контакт клеток-предшественников остеокластов млекопитающих с эффективной концентрацией калебина А, чтобы вызвать ингибирование дифференциации указанных клеток-предшественников в остеокласты.
2. Способ по п. 1, где указанная клетка-предшественник представляет собой макрофаг.
3. Способ ингибирования экспрессии на уровне генов и белков, связанных с повышающей регуляцией остеокластогенеза у млекопитающих, включающий стадии приведения в контакт клеток-предшественников остеокластов млекопитающих с эффективной концентрацией калебина А, чтобы вызвать понижающую регуляцию указанной экспрессии на уровне генов и белков в клетках-предшественниках млекопитающих.
4. Применение калебина А в терапевтическом лечении остеопороза у млекопитающих, у которых остеопороз является результатом остеокластогенеза.
5. Применение калебина А для терапевтического лечения у млекопитающих остеопороза, являющегося результатом индуцированной раком дифференциации клеток-предшественников остеокластов в остеокласты.
| Ana Luísa de P | |||
| Oliveira, Stephanie E | |||
| Martinez, et al | |||
| "Calebin A: Analytical Development for Pharmacokinetics Study, Elucidation of Pharmacological Activities and Content Analysis of Natural Health Products", J Pharm Pharm Sci (www.cspsCanada.org) 18(4) 494 - 514, 2015 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Гл | |||
| ред | |||
| Покровский В.И.- Т | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Лабиринт - Нефротический синдром | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| "Краткий курс молекулярной фармакологии" под ред | |||
| Сергеева П.В., М., 1975 | |||
| Холодов Л.Е.и др | |||
| "Клиническая фармакокинетика", М., "Медицина", 1985 | |||
| ПОТЕНЦИАЛ КАЛЕБИНА А В КАЧЕСТВЕ СРЕДСТВА ПРОТИВ ОЖИРЕНИЯ | 2012 |
|
RU2543334C1 |
| US 2007167510 A1, 19.07.2007. | |||
Авторы
Даты
2018-05-07—Публикация
2016-08-09—Подача