ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В соответствии с кодексом США, раздел 35, § 119(e), данная заявка испрашивает приоритет по дате подачи предварительной заявки на патент США №61/887870, зарегистрированной 7 октября 2013 года, описание которой включено в данный документ посредством ссылки.
Введение
Боль является наиболее частой причиной посещения врача в США. Боль представляет собой неприятное сенсорное и эмоциональное ощущение, связанное с реальным или возможным повреждением тканей, костей, нервов или клеток. В большинстве случаев боль проходит после устранения болевого раздражителя и излечивания организма, но иногда боль сохраняется, несмотря на устранение раздражителя и кажущееся излечение организма. Она является основным симптомом при многих медицинских патологических состояниях и может значительно ухудшать качество жизни и общее функционирование организма человека. Боль также может возникать в отсутствие какого-либо явного раздражителя, повреждения или заболевания. Обычно боль длится только некоторое время до устранения вредного раздражителя или вылечивания лежащего в основе повреждения или патологии, однако некоторые причиняющие боль патологические состояния могут сохраняться годами.
Дексмедетомидин представляет собой S-энантиомер медетомидина и является антагонистом α2-адренергических рецепторов, используется в качестве седативного средства в отделениях интенсивной терапии и анестезиологами для интубированных и неинтубированных пациентов, которым необходима седация для хирургического вмешательства или кратковременных процедур, α2-адренергический рецептор представляет собой рецептор, сопряженный с G-белком, связанный с гетеротримерным G-белком Gi, включающий три высоко гомологичных субтипа, в том числе α2a, α2b и α2c-адренергические рецепторы. Антагонисты а2-адренергического рецептора участвуют в седации, расслаблении мышц и анальгезии посредством влияния на центральную нервную систему.
Дексмедетомидин используется в клинических условиях в качестве седативного средства посредством парентерального, внутривенного и перорального введения и поэтому требует тщательного наблюдения специалиста в области медицины в условиях стационара. Дексмедетомидин в настоящее время применяется для седации интубированных субъектов или субъектов, находящихся на искусственной вентиляции, в клинических условиях (например, условиях стационара), а также для седации неинтубированных субъектов, как компонент контролируемой седации во время хирургического вмешательства, радиографии или диагностических процедур. Дексмедетомидин также одобрен для непрерывных внутривенных инфузий у неинтубированных субъектов, так как он не оказывает побочного действия на дыхание.
Сущность изобретения
Аспекты изобретения включают способы лечения боли у субъекта путем нанесения устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, составленную так, чтобы доставлять эффективное для обезболивания количество дексмедетомидина субъекту, который испытывает боль. Для практического осуществления способов согласно некоторым вариантам реализации изобретения, устройство для трансдермальной доставки, содержащее композицию на основе дексмедетомидина, наносят субъекту и удерживают в контакте с субъектом таким образом, чтобы доставлять количество дексмедетомидина, эффективное для лечения боли у субъекта. Также предложены устройства для трансдермальной доставки, выполненные с возможностью доставлять эффективное количество дексмедетомидина, достаточное для практического осуществления рассматриваемых способов, а также наборы, содержащие устройства для трансдермальной доставки.
Краткое описание чертежей
Фиг. 1 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина с клеем, содержащим полиизобутилен/полибутен и поперечно сшитый поливинилпирролидон, согласно одному варианту реализации изобретения.
Фиг. 2(A) иллюстрирует пример суммарного доставленного количества дексмедетомидина в зависимости от времени согласно одному варианту реализации изобретения. Фиг. 2В иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции, содержащей нефункционализированный акрилатный клей, согласно одному варианту реализации изобретения. Фиг. 2С иллюстрирует пример потребления дексмедетомидина в зависимости от времени согласно одному варианту реализации изобретения.
Фиг. 3 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей нефункционализированный акрилатный клей, согласно одному варианту реализации изобретения.
Фиг. 4 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, согласно одному варианту реализации изобретения.
Фиг. 5 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, согласно другому варианту реализации изобретения.
Фиг. 6 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, согласно другому варианту реализации изобретения.
Фиг. 7А-7В иллюстрируют пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей нефункционализированный акрилатный клей, гидрокси-функционализированный акрилатный клей, и гидрокси-функционализированный акрилатный клей, включающий винилацетат, согласно одному варианту реализации изобретения.
Фиг. 8 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей карбокси-функционализированный акрилатный клей, согласно другому варианту реализации изобретения.
Фиг. 9 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей акрилатный клей с карбокси и гидрокси функциональными группами, включающий винилацетат, согласно другому варианту реализации изобретения.
Фиг. 10 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей полиизобутиленовый/полибутеновый клей с карбокси-функционализированным акрилатным клеем, согласно одному варианту реализации изобретения.
Фиг. 11 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей полиизобутиленовый/полибутеновый клей с усилителем растворимости левулиновой кислотой, согласно одному варианту реализации изобретения.
Фиг. 12 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей полиизобутиленовый/полибутеновый клей с усилителем растворимости лауриллактатом, согласно одному варианту реализации изобретения.
Фиг. 13 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей полиизобутиленовый/полибутеновый клей с усилителем растворимости пропиленгликольмонолауратом, согласно одному варианту реализации изобретения.
Фиг. 14А иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, и левулиновую кислоту, согласно одному варианту реализации изобретения.
Фиг. 14В иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, и поливинилпирролидон, согласно одному варианту реализации изобретения.
Фиг. 14С иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, и карбокси-функционализированный акрилатный клей, согласно одному варианту реализации изобретения.
Фиг. 15 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей акрилатный клей, склеивающий при надавливании, в отсутствие и в присутствии левулиновой кислоты, олеиновой кислоты или карбокси-функционализированного акрилатного клея, согласно одному варианту реализации изобретения.
Фиг. 16 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, и карбокси-функционализированный акрилатный клей, согласно другому варианту реализации изобретения.
Фиг. 17 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, и олеиновую кислоту или карбокси-функционализированный акрилатный клей, согласно другому варианту реализации изобретения.
Фиг. 18 иллюстрирует пример зависимости среднего потока дексмедетомидина от времени нанесения устройства для трансдермальной доставки трансдермальной композиции на основе дексмедетомидина, содержащей гидрокси-функционализированный акрилатный клей, включающий винилацетат, и усилители растворимости, такие как карбокси-функционализированные акрилатные клеи, лауриллактат или олеиновая кислота, согласно другому варианту реализации изобретения.
Фиг. 19 иллюстрирует средний поток дексмедетомидина через кожу in vitro в зависимости от времени для различных составов.
Фиг. 20 и 21 иллюстрируют поток через два различных образца кожи для различных составов.
Подробное описание изобретения
Аспекты изобретения включают способы лечения боли у субъекта путем нанесения устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, составленную так, чтобы доставлять эффективное для обезболивания количество дексмедетомидина субъекту, который испытывает боль. Для практического осуществления способов согласно некоторым вариантам реализации изобретения, устройство для трансдермальной доставки, содержащее композицию на основе дексмедетомидина, наносят субъекту и удерживают в контакте с субъектом таким образом, чтобы доставлять количество дексмедетомидина, эффективное для лечения боли у субъекта. Также предложены устройства для трансдермальной доставки, выполненные с возможностью доставлять эффективное количество дексмедетомидина субъекту, достаточное для практического осуществления рассматриваемых способов, а также наборы, содержащие устройства для трансдермальной доставки.
Перед тем как описать настоящее изобретение более подробно, следует отметить, что данное изобретение не ограничивается конкретными вариантами реализации, которые, конечно, могут изменяться. Также следует понимать, что употребляемая в данном документе терминология предназначена для описания только конкретных вариантов реализации изобретения и не должна считаться ограничивающей, так как объем настоящего изобретения ограничен только прилагаемой формулой изобретения.
Если представлен диапазон величин, следует понимать, что каждое промежуточное значение, до десятой части единицы нижнего предела диапазона, если из контекста явно не следует иное, между верхним и нижним пределом этого интервала и любое другое заданное или промежуточное значение в этом заданном интервале, находятся в рамках изобретения. Верхний и нижний пределы этих меньших интервалов могут независимо быть включены в меньшие интервалы и также находятся в рамках изобретения, кроме любого специально исключенного предела в заданном интервале. Когда заданный интервал включает один или оба предела, интервалы без или одного, или обоих пределов, также включены в изобретение.
Некоторые интервалы представлены в данном документе численными значениями, которым предшествует термин «около». Термин «около» используется в данном документе для буквенного сопровождения точного числа, которому оно предшествует, а также числа, которое близко или приблизительно равно числу, которому этот термин предшествует. Для определения того, является ли число близким или приблизительно равным конкретно указанному числу, близкое или приближенное незаданное число может являться числом, в том контексте, в котором оно присутствует, которое является существенным эквивалентом конкретного указанного числа.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, что обычно понимается специалистом в данной области техники, к которой относится настоящее изобретение. Хотя любые способы и материалы, аналогичные или эквивалентные тем, которые описаны в данном документе, также могут быть использованы на практике или для тестирования настоящего изобретения, сейчас будут описаны типичные иллюстративные способы и материалы.
Все публикации и патенты, цитируемые в данном описании, включены в данный документ посредством ссылки, как если бы было указано, что каждая отдельная публикация или патент включена посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которыми цитируются публикации. Цитирование любой публикации представлено в отношении ее описания до даты подачи и его не следует толковать как признание того, что настоящее изобретение не имеет права датировать такую публикацию более ранним числом из-за действия более раннего изобретения. Дополнительно, данные представленных публикаций могут отличаться от фактически опубликованных данных, что может потребовать независимого подтверждения.
Следует отметить, что при использовании в настоящем документе и прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если из контекста очевидно не следует иное. Дополнительно следует отметить, что может быть составлен план формулы изобретения, чтобы исключить любой необязательный элемент. В связи с этим предполагается, что данное утверждение служит в качестве предшествующего основания для таких исключающих терминов, как «исключительно», «только» и тому подобных в связи с перечислением элементов формулы изобретения, или для использования «отрицательных» ограничений.
Специалистам в данной области при прочтении этого описания должно быть понятно, что каждый из отдельных вариантов реализации изобретения, описанных и проиллюстрированных в данном изобретении, содержит отдельные компоненты и признаки, которые можно легко разъединить или объединить с признаками любого из других нескольких вариантов реализации изобретения, не отклоняясь от рамок или сущности настоящего изобретения. Любой указанный способ можно осуществить с помощью указанной последовательности действий или с помощью любой другой логически возможной последовательности.
При дальнейшем описании различных вариантов реализации изобретения, во-первых, более подробно рассматриваются способы нанесения субъекту, который испытывает боль, устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, и удержания устройства для трансдермальной доставки в контакте с субъектом таким образом, чтобы доставлять неседативное количество дексмедетомидина субъекту. Во-вторых, описаны устройства для трансдермальной доставки, пригодные для практического осуществления рассматриваемых способов. Затем рассмотрены наборы, которые содержат описываемые устройства для трансдермальной доставки.
Способы лечения боли с помощью устройств для трансдермальной доставки, содержащих композицию на основе дексмедетомидина, составленную так, чтобы доставлять эффективное количество дексмедетомидина
Аспекты изобретения включают способы лечения боли путем нанесения устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, составленную так, чтобы доставлять эффективное для обезболивания количество дексмедетомидина субъекту, который испытывает боль. Для практического осуществления способов согласно некоторым вариантам реализации изобретения, устройство для трансдермальной доставки, содержащее композицию на основе дексмедетомидина, наносят субъекту и удерживают в контакте с субъектом таким образом, чтобы доставить субъекту эффективное для обезболивания количество дексмедетомидина. Термин «трансдермальный» используется в своем традиционном смысле для обозначения способа введения, когда активный агент (т.е. лекарственное средство) доставляют через кожу (например, местное введение) или слизистую оболочку для обеспечения системного распределения. В связи с этим трансдермальные композиции на основе дексмедетомидина, как описано в данном документе, включают композиции, которые доставляют субъекту через один или более слоев из подкожного жира, дермы или эпидермиса, в том числе через роговой слой, зернистый слой, шиповатый слой и базальный слой. Следовательно, устройства для трансдермальной доставки с продленным действием, содержащие трансдермальную композицию на основе дексмедетомидина, можно наносить на любое удобное место, такое как руки, ноги, ягодицы, живот, спина, шея, мошонка, влагалище, лицо, область за ухом, вводить трансбуккально, а также сублингвально. При описании способов настоящего изобретения, термин «субъект» означает человека или организм, которому наносят и в контакте с которым находится трансдермальная композиция. В связи с этим субъекты изобретения могут включать, но не ограничиваясь ими, млекопитающих, например людей и других приматов, таких как шимпанзе и другие человекообразные обезьяны, и другие виды обезьян; и тому подобное, при этом в некоторых вариантах реализации изобретения субъектами являются люди. Подразумевается, что термин субъект также включает человека или организм с любым возрастом, массой или другими физическими характеристиками, при этом субъект может быть взрослым, ребенком, младенцем или новорожденным.
Трансдермальное введение дексмедетомидина может быть пассивным или активным. Под «пассивным» транспортом подразумевают, что композицию на основе дексмедетомидина доставляют через кожу или слизистую оболочку, не прилагая энергию (например, трение или нагревание), и он зависит, главным образом, от проницаемости барьера (например, кожи или слизистой оболочки) и от энтропии доставки. Однако трансдермальное введение согласно некоторым вариантам реализации изобретения также может включать активный транспорт композиции на основе дексмедетомидина через кожу или слизистую оболочку. Активный транспорт может представлять собой любой способ, подходящий для транспорта композиции через кожу или слизистую оболочку в сочетании с прилагаемой энергией, и может включать, но не ограничиваясь этим, доставку с помощью микроиглы, облегченную диффузию, электрохимически вызываемые градиенты, ионтофоретические системы, среди других способов.
В вариантах реализации изобретения способы включают нанесение устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, субъекту, который испытывает боль, и удержание устройства для трансдермальной доставки в контакте с субъектом таким образом, чтобы доставить субъекту эффективное для обезболивания количество дексмедетомидина. Под эффективным для обезболивания количеством понимают количество, которое оказывает по меньше мере некоторое, если не существенное, облегчение боли, что ощущается субъектом, при этом в некоторых случаях степень облегчения боли представляет собой полное прекращение ощущения или восприятия боли. Степень обезболивания можно количественно определить или оценить иным образом, используя любой подходящий протокол.
В некоторых случаях количество дексмедетомидина, которое доставляют субъекту, представляет собой неседативное количество. Под «неседативным» подразумевают, что композиция на основе дексмедетомидина составлена так, чтобы доставлять субъекту количество дексмедетомидина, которое не вызывает полную седацию субъекта. Другими словами, субъект остается в сознании и способен реагировать в течение всего периода трансдермального введения дексмедетомидина субъекту. В некоторых случаях в течение введения трансдермальной композиции на основе дексмедетомидина, субъект остается контактным, ориентированным и спокойным. В других случаях в течение введения трансдермальной композиции на основе дексмедетомидина, субъект остается активным и способен реагировать на команды (например, устные или письменные команды). В других случаях в течение введения трансдермальной композиции на основе дексмедетомидина, субъект остается активным, контактным, ориентированным и спокойным и способен реагировать на команды (например, устные или письменные команды).
Пригодные протоколы для определения уровня седации могут включать, но не ограничиваясь ими, шкалу седации Ramsay (Рамсея), ванкуверскую шкалу восстановления после седации, шкалу комы Глазго, модифицированную Cook&Palma, шкалу комфорта, новую шкалу седации Sheffield, шкалу седации-возбуждения и шкалу оценки двигательной активности, среди других подходящих протоколов для определения уровня седации.
В некоторых вариантах реализации изобретения способы могут дополнительно включать оценку уровня седации субъекта, чтобы определить наблюдается ли уменьшение быстроты реакции или когнитивной или двигательной активности после введения устройства для трансдермальной доставки, разработанного для доставки неседативного количества дексмедетомидина. Уровень седации можно оценить с помощью любого подходящего протокола, такого как описаны выше. В некоторых вариантах реализации изобретения уровень седации оценивают с использованием шкалы седации Рамсея (как описано в Ramsay, et al. Controlled sedation with alphaxalone-alphadolone, British Med Journal1974; 2:656-659, описание которой включено в данный документ посредством ссылки). Например, квалифицированный медицинский работник может оценить каждого субъекта и определить уровень седации согласно шкале седации Рамсея, представленной ниже.
Шкала седации Рамсея

В некоторых вариантах реализации изобретения при введении субъекту трансдермальной композиции на основе дексмедетомидина оценивают уровень седации и определяют количество баллов, равное 4 или менее согласно шкале Рамсея, например 3 балла или менее согласно шкале Рамсея, например 2 балла или менее согласно шкале Рамсея и в том числе 1 балл для субъекта согласно шкале Рамсея. В некоторых случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект демонстрирует быструю реакцию на легкий удар по глабелле или громкий слуховой раздражитель. В других случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект способен реагировать на устные команды. В других случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект остается контактным, ориентированным и спокойным. В других случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект тревожен, возбужден или беспокоен.
Уровень седации субъекта можно оценить в любой момент времени в течение осуществления способов. В некоторых случаях уровень седации оценивают, удерживая устройство для трансдермальной доставки с продленным действием в контакте с субъектом, через одинаковые интервалы, например, каждые 0,25 часа, каждые 0,5 часа, каждый 1 час, каждые 2 часа, каждые 4 часа или через другой интервал. Например, уровень седации можно оценить, удерживая устройство для трансдермальной доставки в контакте с субъектом, через 15 минут после нанесения субъекту устройства для трансдермальной доставки, через 30 минут после нанесения устройства для трансдермальной доставки, через 1 час после нанесения устройства для трансдермальной доставки, через 2 часа после нанесения устройства для трансдермальной доставки, через 4 часа после нанесения устройства для трансдермальной доставки, в том числе через 8 часов после нанесения устройства для трансдермальной доставки.
Уровень седации субъекта можно оценить один или более раз в течение интервала введения лекарственного средства, например 2 и больше раз, например 3 или больше раз, в том числе 5 или больше раз до, в течение или после интервала введения лекарственного средства. Верхний предел возможного количества оцениваний субъекта в течение интервала введения лекарственного средства в некоторых случаях составляет 10 раз или меньше, например 7 раз или меньше, например 5 раз или меньше, например 3 раза или меньше, и в том числе 2 раза или меньше. В некоторых вариантах реализации изобретения возможное количество оцениваний субъекта в течение интервала введения лекарственного средства варьируется, например, от 2 раз до 10 раз, например, от 3 раз до 9 раз, например, от 4 раз до 8 раз и в том числе от 5 раз до 7 раз.
В некоторых вариантах реализации изобретения за уровнем седации можно наблюдать в течение всего периода, когда устройство для трансдермальной доставки находится в контакте с субъектом, например наблюдая за частотой сердечных сокращений, дыханием или с помощью визуального осмотра, в том числе используя видеомонитор.
В некоторых вариантах реализации изобретения субъект, которого лечат, находится в неседированном состоянии, он находится в сознании, активен, ориентирован, способен логически мыслить и реагировать на устные и письменные команды, в том числе вопросы или требования. Например, субъект может быть в неседированном состоянии в начале введения. В других вариантах реализации изобретения субъект находится в неседированном состоянии в начале введения и остается в неседированном состоянии в течение одного или более интервалов введения лекарственного средства (т.е. период времени, в течение которого описываемые устройства для трансдермальной доставки находятся в контакте с субъектом). В других вариантах реализации изобретения субъект находится в неседированном состоянии в начале введения и остается в неседированном состоянии в течение всего протокола лечения.
В других вариантах реализации изобретения количество дексмедетомидина, которое доставляют субъекту, представляет собой седативное количество. Под «седативным» подразумевают, что композиция на основе дексмедетомидина составлена так, чтобы доставлять субъекту количество дексмедетомидина, которое вызывает седацию субъекта. В таких вариантах реализации изобретения уровень седации пациента может составлять 5 баллов или более по шкале Рамсея, в том числе 6 баллов.
Как описано выше, при практическом осуществлении способов согласно вариантам реализации изобретения, устройство для трансдермальной доставки, содержащее композицию на основе дексмедетомидина, наносят субъекту и удерживают в контакте с субъектом таким образом, чтобы доставить количество дексмедетомидина, эффективное для лечения боли у субъекта. Термин «боль» используется в своем традиционном смысле для обозначения неприятного сенсорного и эмоционального ощущения, связанного с реальным или возможным повреждением тканей или описанного в контексте такого повреждения (например, как определено Международной ассоциацией по изучению боли). Боль также может включать неприятное сенсорное или эмоциональное ощущение, когда местоположение повреждения не очевидно, или невозможно продемонстрировать, что повреждение существует. В некоторых случаях боль включает любое сенсорное ощущение, которое вызывает страдания (физическое, психологическое, эмоциональное, душевное и т.д.) у субъекта. Типы боли согласно вариантам реализации изобретения могут включать, но не ограничиваясь ими, невралгию, такую как невралгия тройничного нерва, мышечную боль, гипералгезию, гиперпатию, неврит, невропатию, невропатическую боль, идиопатическую боль, острую боль, симпатически опосредованную боль, боль, связанную с комплексным регионарным болевым синдром, хроническую боль, такую как боль, связанная с раковыми заболеваниями, послеоперационную боль, постгерпетическую невралгию, синдром раздраженного кишечника и боль, связанную с другими внутренними органами, боль, связанную с лучевой терапией, диабетическую невропатию, боль, связанную с мышечной спастичностью, комплексный регионарный болевой синдром (КРБС), симпатически поддерживаемую боль, головную боль, в том числе мигреневые головные боли, аллодиническую боль, воспалительную боль, такую как боль, связанная с артритом, боль желудочно-кишечного тракта, такую как синдром раздраженного кишечника (СРК) и болезнь Крона. Боль согласно некоторым вариантам реализации изобретения может представлять собой симптом лежащего в основе физиологического нарушения, такого как рак, артрит, вирусная инфекция, например опоясывающий лишай, или физической травмы, такой как ожог, ранение или хирургическое вмешательство, боль, связанную с химиотерапией, боль, связанную с хронической периферической невропатией, вызванной химиотерапией (CCIPN), боль, связанную с лучевой терапией.
В некоторых вариантах реализации изобретения боль представляет собой невропатическую боль. Термин «невропатическая боль» используется в своем традиционном смысле для обозначения боли, вызванной повреждением или заболеванием, которое поражает соматосенсорную систему. Невропатическая боль может быть связана с парестезией, дизестезией, гипестезией, гиперестезией, гипалгезией, гипералгезией, или аллодинией, или другими родственными признаками. Невропатическая боль может быть постоянной или эпизодической. Невропатическая боль, которую можно лечить с помощью рассматриваемых способов, может представлять собой любой тип невропатической боли и включает, но не ограничиваясь этим, постгерпетическую невралгию, невралгию тройничного нерва, дистальную сенсорную полиневропатию, связанную с ВИЧ, диабетическую невропатию, травматическое повреждение нервов, послеоперационную боль, боль, вызванную химиотерапией, боль, связанную с хронической периферической невропатией, вызванной химиотерапией (CCIPN), боль, связанную с лучевой терапией, спортивные травмы, боль, связанную с инсультом, множественным склерозом, сирингомиелией, эпилепсией, повреждением спинного мозга, раковыми заболеваниями, фантомные боли в ампутированных конечностях, синдром запястного канала, воспаление седалищного нерва, пудендальную невралгию, таламический синдром, головную боль, мигрень, боли в спине, хронические боли в спине, фибромиалгию, среди других типов невропатической боли.
Как обсуждалось выше, в некоторых случаях способы включают нанесение на поверхность кожи субъекта, испытывающего боль, который может быть в неседированном состоянии, устройства для трансдермальной доставки с композицией на основе дексмедетомидина, содержащей дексмедетомидин и клей, склеивающий при надавливании, и удержание устройства для трансдермальной доставки в контакте с субъектом таким образом, чтобы доставлять эффективное количество дексмедетомидина в течение некоторого периода времени для лечения боли у субъекта. Как обсуждалось выше, по желанию количество может быть неседативным или се дативным. Неседативное количество может включать способность к реагированию или активность пациента и может быть связано с показателем не более 3, в том числе 2 или менее, по шкале седации Рамсея. Под «лечением боли» понимают по меньшей мере подавление или уменьшение интенсивности боли, при этом подавление и уменьшение интенсивности относятся по меньшей мере к снижению степени боли.
В некоторых вариантах реализации изобретения способы включают длительную трансдермальную доставку дексмедетомидина субъекту. Под «длительной трансдермальной доставкой» понимают, что трансдермальное введение выполняют так, чтобы обеспечить доставку композиции на основе дексмедетомидина в течение длительного периода времени, такого как часы, дни и недели, в том числе в течение 1 часа или более, например 2 часов или более, например 4 часов или более, например 8 часов или более, например 12 часов или более, например 24 часов или более, например 48 часов или более, например 72 часов или более, например 96 часов или более, например 120 часов или более, например 144 часов или более, и в том числе 168 часов или более. Для вышеприведенных интервалов верхний предел периода времени в некоторых случаях составляет 168 часов или менее, например 144 часа или менее, например 120 часов или менее, например 96 часов или менее, например 72 часа или менее, например 48 часов или менее, и в том числе 24 часа или менее. В некоторых вариантах реализации изобретения длительная трансдермальная доставка изменяется в интервале, например, от 0,5 часа до 168 часов, например, от 1 часа до 144 часов, например, от 1,5 часов до 120 часов, например, от 2 часов до 96 часов, например, от 2,5 часов до 72 часов, например, от 3 часов до 48 часов, например, от 3,5 часов до 24 часов, например, от 4 часов до 12 часов, и в том числе от 5 часов до 8 часов.
В некоторых вариантах реализации изобретения трансдермальное замедленное высвобождение композиции на основе дексмедетомидина включает многодневную доставку терапевтически эффективного количества активного агента дексмедетомидина, который наносят на кожу субъекта. Под многодневной доставкой понимают, что трансдермальная композиция составлена так, чтобы обеспечить субъекту терапевтически эффективное количество, при этом устройство для трансдермальной доставки наносят на кожу субъекта на период времени, который составляет 1 день или более, например 2 дня или более, например 4 дня или более, например 7 дней или более, например 14 дней или более, и в том числе 30 дней или более. В некоторых вариантах реализации изобретения устройства для трансдермальной доставки обеспечивает субъекта терапевтически эффективным количеством дексмедетомидина в течение периода, который составляет 10 дней или более. Для многодневной доставки верхний предел периода времени в некоторых случаях составляет 30 дней или менее, например 28 дней или менее, например 21 день или менее, например 14 дней или менее, например 7 дней или менее, и в том числе 3 дня или менее. В некоторых вариантах реализации изобретения многодневная трансдермальная доставка изменяется в интервале, например, от 2 дней до 30 дней, например, от 3 дней до 28 дней, например, от 4 дней до 21 дня, например, от 5 дней до 14 дней и в том числе от 6 дней до 10 дней.
В зависимости от конкретного применяемого протокола лечение боли согласно вариантам реализации изобретения может включать один или более интервалов введения лекарственного средства. Термин «интервал введения лекарственного средства» используется в данном документе в своем традиционном смысле для обозначения длительности однократного нанесения и удержания устройства для трансдермальной доставки в контакте с субъектом. Другими словами, интервал введения лекарственного средства начинается при нанесении трансдермальной композиции на основе дексмедетомидина на кожу или слизистую оболочку субъекта и заканчивается при прекращении контакта трансдермальной композиции на основе дексмедетомидина с субъектом. В связи с этим интервал введения лекарственного средства представляет собой период времени, который количество дексмедетомидина находится в контакте с кожей или слизистой оболочкой субъекта, и который может длиться около 0,5 часа или более, например 1 час или более, например 2 часа или более, например 4 часа или более, например 8 часов или более, например 12 часов или более, например 16 часов или более, например 20 часов или более, например 24 часа или более, например 48 часов или более, например 72 часа или более, например 96 часов или более, например 120 часов или более, например 144 часа или более, и в том числе около 168 часов или более. Верхний предел периода времени для продолжительности интервалов введения лекарственного средства в некоторых случаях составляет 168 часов или менее, например 144 часа или менее, например 120 часов или менее, например 96 часов или менее, например 72 часа или менее, например 48 часов или менее, и в том числе 24 часа или менее. В некоторых вариантах реализации изобретения продолжительность интервалов введения изменяется в диапазоне, например, от 0,5 часа до 168 часов, например от 1 часа до 144 часов, например от 1,5 часов до 120 часов, например от 2 часов до 96 часов, например от 2,5 часов до 72 часов, например от 3 часов до 48 часов, например от 3,5 часов до 24 часов, например от 4 часов до 12 часов, и в том числе от 5 часов до 8 часов.
Термин «протокол лечения», при использовании в данном документе, относится к одному или более последовательным интервалам введения лекарственного средства, достаточным для оказания желаемого терапевтического действия трансдермальной композиции на основе дексмедетомидина. В некоторых вариантах реализации изобретения протоколы могут включать повторяющиеся интервалы введения лекарственного средства. Под «повторяющимися интервалами введения лекарственного средства» подразумевают, что более одного устройства для трансдермальной доставки последовательно наносят и удерживают в контакте с субъектом. В связи с этим прекращают контакт одного устройства для трансдермальной доставки с субъектом, а субъекту снова наносят новое устройство для трансдермальной доставки. При практическом осуществлении способов изобретения схемы лечения могут включать два или более интервалов введения лекарственного средства, например три или более интервалов введения лекарственного средства, например четыре или более интервалов введения лекарственного средства, например пять или более интервалов введения лекарственного средства, в том числе десять или более интервалов введения лекарственного средства.
Период времени между интервалами введения лекарственного средства в протоколе лечения с повторяющимся интервалом введения может изменяться в зависимости от физиологии субъекта или протокола лечения, что определяет специалист в области медицины. Например, период времени между интервалами введения лекарственного средства в протоколе лечения с многократным введением доз может быть определен заранее и представлять собой одинаковые интервалы. В связи с этим период времени между интервалами введения лекарственного средства может изменяться и может составлять 1 день или более, например 2 дня или более, например 3 дня или более, например 4 дня или более, например 5 дней или более, например 6 дней или более, например 7 дней или более, например 10 дней или более, в том числе 30 дней или более. Верхний предел периода времени между двумя интервалами введения лекарственного средства в некоторых случаях составляет 30 дней или менее, например 28 дней или менее, например 21 день или менее, например 14 дней или менее, например 7 дней или менее, и в том числе 3 дня или менее. В некоторых вариантах реализации изобретения период времени между интервалами введения лекарственного средства изменяется в диапазоне, например, от 2 дней до 30 дней, например, от 3 дней до 28 дней, например, от 4 дней до 21 дня, например, от 5 дней до 14 дней и в том числе от 6 дней до 10 дней.
В некоторых случаях период времени между интервалами введения может зависеть от концентрации дексмедетомидина в плазме в течение времени, когда устройство для трансдермальной доставки не находится в контакте с субъектом между интервалами введения лекарственного средства. Например, следующий интервал введения лекарственного средства может начинаться, когда концентрация дексмедетомидина в плазме станет ниже определенного уровня.
В некоторых вариантах реализации изобретения устройства для трансдермальной доставки обеспечивают субъекта терапевтически эффективным количеством дексмедетомидина в течение периода, который составляет 10 дней.
Как описано выше, аспекты изобретения включают лечение боли у субъекта путем нанесения субъекту устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, составленную так, чтобы доставлять эффективное количество дексмедетомидина. В некоторых вариантах реализации изобретения способы включают удержание устройства для трансдермальной доставки в контакте с субъектом таким образом, чтобы доставлять целевую дозу дексмедетомидина для лечения боли у субъекта, как например, доставка целевой дозы, определенной по общей экспозиции лекарственного средства или среднесуточной экспозиции лекарственного средства, для лечения боли. Термин «целевая доза» означает желаемое количество прошедшего дексмедетомидина. В зависимости от желаемого терапевтического действия трансдермальной композиции на основе дексмедетомидина, протокола лечения, физиологии субъекта и уровня седации субъекта в момент введения, целевая экспозиция лекарственного средства для лечения боли может изменяться. В некоторых вариантах реализации изобретения целевая экспозиция дексмедетомидина представляет собой количество, которое находится в терапевтическом диапазоне субъекта, причем в некоторых вариантах реализации изобретения терапевтический диапазон является терапевтическим диапазоном концентраций, не оказывающих седативное действие.
Термин «терапевтический диапазон концентраций, не оказывающих седативное действие» используется в данном документе для обозначения интервала дозировок дексмедетомидина, который является терапевтически эффективным для лечения боли у субъекта, и который если и приводит, то только к небольшой седации. Другими словами, терапевтический диапазон концентраций дексмедетомидина, не оказывающих седативное действие, для конкретного субъекта, которого лечат от боли, находится в интервале концентраций дексмедетомидина, которые ниже количества, которое считают «полностью седирующим» или «вызывающим полную седацию», и выше количества, которое считают «неэффективным» для лечения боли у субъекта. В некоторых вариантах реализации изобретения неседативное терапевтически эффективное количество обеспечивает системное количество дексмедетомидина, которое делает возможным осуществить желаемое лечение, при этом показатель шкалы Рамсея у субъекта остается равным 4 или менее. Например, при лечении боли у субъекта целевая неседативная дозировка дексмедетомидина может изменяться от 50 мкг/сутки до 350 мкг/сутки, например от 100 мкг/сутки до 340 мкг/сутки, например от 145 мкг/сутки до 330 мкг/сутки, например от 155 мкг/сутки до 320 мкг/сутки, например от 165 мкг/сутки до 310 мкг/сутки, например от 175 мкг/сутки до 300 мкг/сутки, например от 185 мкг/сутки до 290 мкг/сутки, например от 195 мкг/сутки до 280 мкг/сутки, и в том числе от 50 мкг/сутки до 250 мкг/сутки в течение интервала введения лекарственного средства (например, интервал введения лекарственного средства длительностью 168 часов). В некоторых вариантах реализации изобретения целевая дозировка дексмедетомидина изменяется от 147 мкг/сутки до 290 мкг/сутки в течение интервала введения лекарственного средства (например, интервал введения лекарственного средства длительностью 168 или более часов).
В некоторых вариантах реализации изобретения целевая дозировка представляет собой количество, которое при нанесении субъекту обеспечивает такое системное количество дексмедетомидина, которое дает желаемую среднюю концентрацию дексмедетомидина в плазме в конкретные моменты времени в течение лечения боли. В других вариантах реализации изобретения целевая дозировка представляет собой количество, которое при нанесении субъекту, обеспечивает стационарную среднюю концентрацию дексмедетомидина в плазме в течение всего интервала введения лекарственного средства или в течение всего протокола лечения. В других вариантах реализации изобретения целевая дозировка представляет собой количество, которое при нанесении субъекту, обеспечивает определенную скорость доставки дексмедетомидина субъекту in vivo.
В некоторых вариантах реализации изобретения нанесение и удержание устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, в контакте с субъектом включает доставку целевого количества дексмедетомидина. как например, среднего суммарного количества дексмедетомидина, доставленного в течение интервала введения лекарственного средства (например, 7 дней или более). Термин «целевое суммарное количество» означает общее количество дексмедетомидина, которое субъект получает через кожу, и оно может изменяться вследствие различной проницаемости кожи или слизистой оболочки и метаболической активности места нанесения. В некоторых вариантах реализации изобретения среднее суммарное количество дексмедетомидина может составлять 5 мкг/см2 или более, например 25 мкг/см2 или более, например 50 мкг/см2 или более в течение 7-дневного периода доставки, например 75 мкг/см2 или более, например 100 мкг/см2 или более, например 125 мкг/см2 или более, и в том числе 200 мкг/см2 или более в течение интервала введения лекарственного средства. Для среднего суммарного количества дексмедетомидина, доставленного в течение интервала введения лекарственного средства, верхний предел в некоторых случаях составляет 500 мкг/см2 или менее, например 400 мкг/см2 или менее, например 300 мкг/см2 или менее, например 200 мкг/см2 или менее, например 100 мкг/см2 или менее, и в том числе 50 мкг/см2 или менее. В некоторых вариантах реализации изобретения среднее суммарное количество дексмедетомидина, доставленное в течение интервала введения лекарственного средства, изменяется, например, от 5 мкг/см2 до 500 мкг/см2, например, от 25 мкг/см2 до 400 мкг/см2 и в том числе от 50 мкг/см2 до 300 мкг/см2.
Способы согласно некоторым вариантам реализации изобретения могут включать нанесение субъекту устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, и удержание трансдермальной композиции на основе дексмедетомидина в контакте с субъектом так, чтобы средняя концентрация в плазме была в интервале от 0,05 нг/мл до 0,5 нг/мл в течение интервала введения лекарственного средства, например от 0,1 нг/мл до 0,45 нг/мл, например от 0,15 нг/мл до 0,4 нг/мл, например от 0,2 нг/мл до 0,35 нг/мл, и в том числе от 0,25 нг/мл до 0,3 нг/мл. Например, устройство для трансдермальной доставки может находиться в контакте с субъектом так, чтобы средняя концентрация в плазме была в интервале от 0.16 нг/мл до 0.36 нг/мл в течение интервала введения лекарственного средства (например, интервал введения лекарственного средства длительностью 168 или более часов). В других вариантах реализации изобретения способы включают удержание трансдермальной композиции на основе дексмедетомидина в контакте с субъектом так, чтобы средняя концентрация в плазме была в интервале от 0,05 нг/мл до 0,5 нг/мл в течение всего протокола лечения (т.е. в течение одного или более интервалов введения лекарственного средства), например от 0,1 нг/мл до 0,45 нг/мл, например от 0,15 нг/мл до 0.4 нг/мл. например от 0,2 нг/мл до 0,35 нг/мл, и в том числе от 0,25 нг/мл до 0,3 нг/мл в течение всего протокола лечения. Например, устройство для трансдермальной доставки может находиться в контакте с субъектом так, чтобы средняя концентрация в плазме была в интервале от 0,16 нг/мл до 0,36 нг/мл в течение всего протокола лечения.
В некоторых вариантах реализации изобретения способы также могут включать определение концентрации дексмедетомидина в плазме субъекта в течение лечения боли у субъекта. Концентрацию в плазме можно определить, используя любую подходящую процедуру, например, с помощью жидкостной хроматографии с масс-спектрометрическим детектированием (ЖХ/МС). Концентрацию дексмедетомидина в плазме можно определить в любой желаемый момент времени. В некоторых вариантах реализации изобретения за концентрацией дексмедетомидина в плазме наблюдают в течение всего периода, который устройство для трансдермальной доставки находится в контакте с субъектом, например, путем сбора данных в реальном времени. В других случаях за концентрацией дексмедетомидина в плазме наблюдают, пока устройство для трансдермальной доставки находится в контакте с субъектом, собирая данные через одинаковые интервалы, например, собирая данные каждые 0,25 часа, каждые 0,5 часа, каждый 1 час, каждые 2 часа, каждые 4 часа, каждые 12 часов, каждые 24 часа, в том числе каждые 72 часа, или через другой интервал. В других случаях за концентрацией дексмедетомидина в плазме наблюдают, пока устройство для трансдермальной доставки находится в контакте с субъектом, собирая данные согласно определенному расписанию после нанесения устройства для трансдермальной доставки субъекту. Например, концентрацию дексмедетомидина в плазме можно определять через 15 минут после нанесения устройства для трансдермальной доставки субъекту, через 30 минут после нанесения устройства для трансдермальной доставки субъекту, через 1 час после нанесения устройства для трансдермальной доставки субъекту, через 2 часа после нанесения устройства для трансдермальной доставки субъекту, через 4 часа после нанесения устройства для трансдермальной доставки субъекту, через 8 часов после нанесения устройства для трансдермальной доставки субъекту, через 12 часов после нанесения устройства для трансдермальной доставки субъекту, через 24 часа после нанесения устройства для трансдермальной доставки субъекту, через 48 часов после нанесения устройства для трансдермальной доставки субъекту, через 72 часа после нанесения устройства для трансдермальной доставки субъекту, через 76 часов после нанесения устройства для трансдермальной доставки субъекту, через 80 часов после нанесения устройства для трансдермальной доставки субъекту, через 84 часа после нанесения устройства для трансдермальной доставки субъекту, через 96 часов после нанесения устройства для трансдермальной доставки субъекту, через 120 часов после нанесения устройства для трансдермальной доставки субъекту и в том числе через 168 часов после нанесения устройства для трансдермальной доставки субъекту.
В некоторых вариантах реализации изобретения концентрацию дексмедетомидина в плазме определяют до нанесения субъекту устройства для трансдермальной доставки, чтобы, например, определить исходную концентрацию дексмедетомидина в плазме. Например, концентрацию в плазме можно определять за 5 минут до нанесения устройства для трансдермальной доставки, например за 10 минут до, например за 30 минут до, например за 60 минут до, например за 120 минут до, например за 240 минут до, и в том числе за 480 минут до нанесения устройства для трансдермальной доставки. Как описано более подробно ниже, способы могут включать повторяющиеся интервалы введения лекарственного средства, когда нанесение и удержание в контакте с субъектом устройства для трансдермальной доставки может повторяться. В таких вариантах реализации изобретения концентрацию в плазме можно определять после удаления первого устройства для трансдермальной доставки и перед нанесением второго устройства для трансдермальной доставки.
Концентрацию дексмедетомидина в плазме крови можно определять один или более раз в любой заданный период измерений, например 2 или более раз, например 3 или более раз, в том числе 5 или более раз в каждый период измерений. Верхний предел количества определений концентрации дексмедетомидина в плазме крови в любой заданный период измерений в некоторых случаях составляет 10 раз или менее, например 7 раз или менее, например 5 раз или менее, например 3 раза или менее, и в том числе 2 раза или менее. В некоторых вариантах реализации изобретения количество определений концентрации дексмедетомидина в плазме крови в любой заданный период измерений изменяется, например, от 2 раз до 10 раз, например, от 3 раз до 9 раз, например, от 4 раз до 8 раз и в том числе от 5 раз до 7 раз.
Способы лечения боли согласно некоторым вариантам реализации изобретения могут включать нанесение субъекту устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, и удержание устройства для трансдермальной доставки в контакте с субъектом таким образом, чтобы поддерживать трансдермальный поток дексмедетомидина в рамках 30% или более от максимального трансдермального потока дексмедетомидина после достижения максимального трансдермального потока. В связи с этим после того, как описываемые устройства для трансдермальной доставки достигают максимального трансдермального потока дексмедетомидина, устройство для трансдермальной доставки выполнено так, чтобы поддерживать поток дексмедетомидина у субъекта, который составляет по меньшей мере 30% от максимального потока в течение любого заданного интервала введения лекарственного средства, например по меньшей мере 35%, например по меньшей мере 40% и в том числе по меньшей мере 50% от максимального потока в течение любого заданного интервала введения лекарственного средства. Другими словами, после достижения максимального потока устройством для трансдермальной доставки согласно этим конкретным вариантам реализации изобретения, трансдермальный поток дексмедетомидина у субъекта не падает ниже 30% или более от максимального потока в любой момент времени в течение интервала введения лекарственного средства.
Например, трансдермальная композиция на основе дексмедетомидина может находиться в контакте с субъектом таким образом, чтобы поддерживать трансдермальный поток дексмедетомидина в рамках 80% или более от максимального трансдермального потока дексмедетомидина, например в рамках 85% или более, например в рамках 90% или более, например в рамках 95%, и в том числе в рамках 99% от максимального трансдермального потока дексмедетомидина после достижения максимального трансдермального потока. В некоторых вариантах реализации изобретения трансдермальный поток дексмедетомидина совсем не уменьшается после достижения максимального потока и остается равным 100% от максимального потока дексмедетомидина от момента достижения максимального потока до конца заданного интервала введения лекарственного средства.
Поток активного агента при трансдермальном введении представляет собой скорость, с которой активный агент проникает через кожу или слизистую оболочку субъекта. В некоторых случаях поток дексмедетомидина можно определить, используя уравнение:
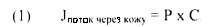 ,
,
где J представляет собой поток через кожу, С - концентрационный градиент через кожу или слизистую оболочку, а Р - коэффициент проницаемости. Поток через кожу представляет собой изменение суммарного количества лекарственного средства, поступающего в организм через кожу или слизистую оболочку, в зависимости от времени.
В некоторых случаях трансдермальная композиция на основе дексмедетомидина находится в контакте с субъектом таким образом, чтобы поддерживать максимальный поток равным 0,05 мкг/см2/ч или выше, например 0,1 мкг/см2/ч или выше, например 0,5 мкг/см2/ч или выше, например 1 мкг/см2/ч, например 2 мкг/см2/ч, например 3 мкг/см2/ч или выше, например 5 мкг/см2/ч или выше, например 7,5 мкг/см2/ч или выше, и в том числе удержание одного слоя трансдермальной композиции на основе дексмедетомидина в контакте с субъектом таким образом, чтобы поддерживать максимальный поток равным 10 мкг/см2/ч или выше. Для максимального потока трансдермальной доставки дексмедетомидина верхний предел в некоторых случаях составляет 10 мкг/см2/ч или менее, например 9 мкг/см2/ч или менее, например 8 мкг/см2/ч или менее, например 7 мкг/см2/ч или менее, 6 мкг/см2/ч или менее, например 5 мкг/см2/ч или менее, и в том числе 2 мкг/см2/ч или менее. В некоторых вариантах реализации изобретения максимальный поток трансдермальной доставки дексмедетомидина изменяется в интервале, например, от 0,05 мкг/см2/ч до 10 мкг/см2/ч, например, от 1 мкг/см2/ч до 9 мкг/см2/ч и в том числе от 2 мкг/см2/ч до 8 мкг/см2 1 ч.
В связи с этим, когда трансдермальная композиция на основе дексмедетомидина находится в контакте с субъектом таким образом, чтобы трансдермальный поток дексмедетомидина составлял по меньшей мере 30% от максимального трансдермального потока дексмедетомидина, один слой трансдермальной композиции может находиться в контакте с субъектом таким образом, чтобы поток составлял 0,15 мкг/см2/ч или выше после достижения максимального трансдермального потока 0,5 мкг/см2/ч, например 0,18 мкг/см2/ч или выше после достижения максимального трансдермального потока 0,6 мкг/см2/ч, например 0,225 мкг/см2/ч или выше после достижения максимального трансдермального потока 0,75 мкг/см2/ч, например 0,27 мкг/см2/ч или выше после достижения максимального потока 0,9 мкг/см2/ч, например 0,3 мкг/см2/ч или выше после достижения максимального потока 1,0 мкг/см2/ч, например 1,5 мкг/см2/ч после достижения максимального потока 5 мкг/см2/ч или выше, и в том числе удержание трансдермальной композиции на основе дексмедетомидина в контакте с субъектом таким образом, чтобы поток составлял 3,0 мкг/см2/ч или выше после достижения максимального потока 10,0 мкг/см2/ч.
В зависимости от количества дексмедетомидина, содержащегося в трансдермальной композиции, физиологии субъекта, места нанесения, время, необходимое для достижения максимального потока дексмедетомидина, может различаться. В некоторых случаях максимальный поток дексмедетомидина достигается через 2 часа или более после нанесения устройства для трансдермальной доставки субъекту, например через 4 часа или более, например через 6 часов или более, например через 12 часов или более, например через 18 часов или более, и в том числе через 24 часа или более после нанесения устройства для трансдермальной доставки субъекту. В других случаях максимальный поток дексмедетомидина достигается через 168 часов или раньше, например через 144 часа или раньше, например через 120 часов или раньше, например через 96 часов или раньше, например через 72 часа или раньше, например через 48 часов или раньше, например через 24 часа или раньше, например через 12 часов или раньше, например через 8 часов или раньше, например через 4 часа или раньше, и в том числе через 2 часа или раньше. В некоторых вариантах реализации изобретения максимальный поток дексмедетомидина достигается через 24 часа после нанесения устройства для трансдермальной доставки субъекту.
В некоторых вариантах реализации изобретения при лечении боли у субъекта трансдермальная композиция находится в контакте с субъектом так, чтобы обеспечить стационарный средний поток дексмедетомидина субъекту. Термин «стационарный» используется в данном документе в своем традиционном смысле для обозначения того, что количество дексмедетомидина, высвобождаемое из трансдермальной композиции, поддерживает практически постоянный средний поток дексмедетомидина. В связи с этим поток дексмедетомидина из описываемых устройств для трансдермальной доставки увеличивается или уменьшается на 30% или менее в любой момент времени, пока устройство для трансдермальной доставки находится в контакте с субъектом, например на 20% или менее, например на 15% или менее, например на 12% или менее, например на 10% или менее, например на 6% или менее, например на 5% или менее, например на 4% или менее, и в том числе на 1% или менее в любой момент времени, пока устройство для трансдермальной доставки находится в контакте с субъектом.
Когда трансдермальная композиция на основе дексмедетомидина находится в контакте с субъектом таким образом, чтобы обеспечить стационарный средний поток дексмедетомидина, стационарный средний поток дексмедетомидина может поддерживаться в течение 0,5 часа или более, например 1 часа или более, например 2 часов или более, например 3 часов или более, например 4 часов или более, например 8 часов или более, 12 часов или более, например 24 часов или более, например 36 часов или более, например 48 часов или более, например 72 часов или более, например 96 часов или более, например 120 часов или более, например 144 часов или более, и в том числе 168 часов или более. Для поддержания стационарного среднего потока дексмедетомидина верхний предел в некоторых случаях составляет 168 часов или менее, например 144 часа или менее, например 120 часов или менее, например 96 часов или менее, например 72 часа или менее, например 48 часов или менее, например 24 часа или менее, например 12 часов или менее, например 8 часов или менее, например 4 часа или менее, и в том числе 2 часа или менее.
В таких вариантах реализации изобретения устройство для трансдермальной доставки выполнено так, чтобы обеспечить постоянный поток, как например, путем создания концентрационного градиента через кожу или слизистую оболочку или путем введения избыточной дозировки дексмедетомидина. Например, описываемые трансдермальные композиции на основе дексмедетомидина могут включать дозировку дексмедетомидина, которая на 5% или более выше по сравнению с нормальным размером дозировки, например на 10% или более, например на 15% или более, например на 20% или более, и в том числе на 25% или более по сравнению с нормальным размером дозировки. Для избыточного количества дексмедетомидина, содержащегося в устройстве для трансдермальной доставки для обеспечения постоянного потока, верхний предел в некоторых случаях составляет 50% или менее, например 45% или менее, например 25% или менее, например 20% или менее, и в том числе 10% или менее свыше нормального размера дозировки. Хотя описываемые трансдермальные композиции на основе дексмедетомидина могут содержать избыток для обеспечения постоянного потока, избыточное количество не абсорбируется в течение интервала введения лекарственного средства, и его недостаточно для получения дозировки, которая оказывает полную седацию (т.е. дозировка дексмедетомидина, вводимая субъекту, все также остается неседативным количеством). В связи с этим в некоторых вариантах реализации изобретения, когда трансдермальная композиция на основе дексмедетомидина находится в контакте таким образом, чтобы обеспечивать постоянный поток, 25% или менее дексмедетомидина, содержащегося в трансдермальной композиции, может не использоваться, например 20% или менее, например 15% или менее, например 10% или менее, например 5% или менее, и в том числе 1% или менее дексмедетомидина, содержащегося в трансдермальной композиции, может не использоваться в течение интервала введения лекарственного средства.
Способы лечения боли у субъекта согласно некоторым вариантах реализации изобретения могут включать нанесение субъекту устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, разработанного с возможностью доставки неседативного количества дексмедетомидина, и удержание трансдермальной композиции на основе дексмедетомидина в контакте с субъектом таким образом, чтобы обеспечивать средний поток дексмедетомидина in vivo от около 0,005 до около 5 мкг/см2⋅ч, например от около 0,01 до около 4 мкг/см2⋅ч, например от около 0,02 до около 3 мкг/см2⋅ч, например от около 0,05 до около 2,5 мкг/см2⋅ч, например от около 0,1 до около 2 мкг/см2⋅ч, и в том числе от около 0,1 до около 1 мкг/см2⋅ч в любой момент времени после нанесения устройства для трансдермальной доставки. В некоторых вариантах реализации изобретения способы включают нанесение субъекту трансдермальной композиции на основе дексмедетомидина и удержание трансдермальной композиции в контакте с субъектом таким образом, чтобы средний поток дексмедетомидина in vivo составлял от около 0,005 до около 2,0 мкг/см2⋅ч через 24 часа после нанесения, например от около 0,01 до около 1,75 мкг/см2⋅ч, например от около 0,02 до около 1,5 мкг/см2⋅ч, например от около 0,05 до около 1,25 мкг/см2⋅ч, и в том числе от около 0,1 до около 1 мкг/см2⋅ч через 24 часа после нанесения. В других вариантах реализации изобретения способы включают нанесение субъекту трансдермальной композиции на основе дексмедетомидина и удержание трансдермальной композиции в контакте с субъектом таким образом, чтобы средний поток дексмедетомидина in vivo составлял от около 0,005 до около 2,0 мкг/см2⋅ч через 168 часов после нанесения, например от около 0,01 до около 1,75 мкг/см2⋅ч, например от около 0,02 до около 1,5 мкг/см2⋅ч, например от около 0,05 до около 1,25 мкг/см2⋅ч, и в том числе от около 0,1 до около 1 мкг/см2⋅ч через 168 часов после нанесения.
В некоторых вариантах реализации изобретения способы включают определение трансдермального потока дексмедетомидина. Трансдермальный поток дексмедетомидина можно определить, используя любую подходящую процедуру, как например с помощью процедуры, в которой используется кожа трупа человека со слоями эпидермиса (роговой слой и эпидермис) в ячейке Франца, которая имеет донорную и рецепторную стороны, скрепленные вместе, и рецепторный раствор, содержащий фосфатный буфер. Количество прошедшего дексмедетомидина можно далее определить с помощью жидкостной хроматографии. Трансдермальный поток дексмедетомидина можно определить в любой момент времени в течение осуществления способов изобретения. В некоторых вариантах реализации изобретения за трансдермальным потоком дексмедетомидина можно наблюдать в течение всего периода, который трансдермальная композиция на основе дексмедетомидина находится в контакте с проницаемым барьером (например, кожей трупа человека), например, путем сбора данных в реальном времени. В других случаях за трансдермальным потоком дексмедетомидина наблюдают, собирая данные через одинаковые интервалы, например, собирая данные каждые 0,25 часа, каждые 0,5 часа, каждый 1 час, каждые 2 часа, каждые 4 часа, каждые 12 часов, каждые 24 часа, в том числе каждые 72 часа или через другие одинаковые или неодинаковые интервалы. В других случаях за трансдермальным потоком дексмедетомидина наблюдают, собирая данные согласно определенному расписанию. Например, трансдермальный поток дексмедетомидина можно определить через 15 минут после нанесения устройства для трансдермальной доставки, через 30 минут после нанесения устройства для трансдермальной доставки, через 1 час после нанесения устройства для трансдермальной доставки, через 2 часа после нанесения устройства для трансдермальной доставки, через 4 часа после нанесения устройства для трансдермальной доставки, через 8 часов после нанесения устройства для трансдермальной доставки, через 12 часов после нанесения устройства для трансдермальной доставки, через 24 часа после нанесения устройства для трансдермальной доставки, через 48 часов после нанесения устройства для трансдермальной доставки, через 72 часа после нанесения устройства для трансдермальной доставки, через 76 часов после нанесения устройства для трансдермальной доставки, через 80 часов после нанесения устройства для трансдермальной доставки, через 84 часа после нанесения устройства для трансдермальной доставки, через 96 часов после нанесения устройства для трансдермальной доставки, через 120 часов после нанесения устройства для трансдермальной доставки и в том числе через 168 часов после нанесения устройства для трансдермальной доставки.
Трансдермальный поток дексмедетомидина можно определять один или более раз в любой заданный период измерений, например 2 или более раз, например 3 или более раз, в том числе 5 или более раз в каждый период измерений. Верхний предел количества определений трансдермального потока дексмедетомидина в некоторых случаях составляет 10 раз или менее, например 7 раз или менее, например 5 раз или менее, например 3 раза или менее и в том числе 2 раза или менее. В некоторых вариантах реализации изобретения количество определений трансдермального потока дексмедетомидина изменяется, например, от 2 раз до 10 раз, например, от 3 раз до 9 раз, например, от 4 раз до 8 раз и в том числе от 5 раз до 7 раз.
В некоторых вариантах реализации изобретения, когда трансдермальная композиция на основе дексмедетомидина находится в контакте с субъектом, среднее суммарное количество прошедшего дексмедетомидина увеличивается с практически линейной скоростью в течение интервала введения лекарственного средства (например, 7 дней или более). Под «практически линейным» понимают, что суммарное количество дексмедетомидина, высвобождаемое из трансдермальной композиции, увеличивается с практически постоянной скоростью (т.е. определяется кинетикой нулевого порядка). В связи с этим скорость накопления прошедшего дексмедетомидина увеличивается или уменьшается на 10% или менее в любой заданный момент времени, пока трансдермальная композиция находится в контакте с субъектом, например на 8% или менее, например на 7% или менее, например на 6% или менее, например на 5% или менее, например на 3% или менее, например на 2,5% или менее, например на 2% или менее, и в том числе на 1% или менее в любой момент времени, пока трансдермальная композиция на основе дексмедетомидина находится в контакте с субъектом.
Как описано выше, аспекты изобретения включают лечение боли у субъекта путем нанесения субъекту устройства для трансдермальной доставки, содержащего композицию на основе дексмедетомидина, и удержания композиции на основе дексмедетомидина в контакте с субъектом в течение периода времени, достаточного для доставки субъекту эффективного для обезболивания количества дексмедетомидина. В некоторых вариантах реализации изобретения способы лечения боли могут включать удержание трансдермальной композиции на основе дексмедетомидина в контакте с субъектом таким образом, чтобы доставить заранее заданное количество дексмедетомидина субъекту. Когда протоколы включают доставку заранее заданного количества дексмедетомидина субъекту, количество дексмедетомидина в описываемых трансдермальных композициях на основе дексмедетомидина может изменяться от 0,001 мг до 50 мг, например от 0,005 до 40 мг, например от 0,01 мг до 30 мг, например от 0,05 до 20 мг, например от 0,1 мг до 15 мг, например от 0,5 мг до 12,5 мг, и в том числе от 0,5 мг до 10 мг.
В некоторых вариантах реализации изобретения заранее заданное количество дексмедетомидина, доставляемое субъекту, может представлять собой часть от общего количества дексмедетомидина, содержащегося в трансдермальных композициях на основе дексмедетомидина. Например, заранее заданное количество дексмедетомидина, доставляемое субъекту, может составлять 1% или более от общего количества дексмедетомидина, содержащегося в трансдермальной композиции на основе дексмедетомидина, как например 2% или более, например 5% или более, например 10% или более, например 25% или более, и в том числе 50% или более от общего количества дексмедетомидина, содержащегося в трансдермальной композиции на основе дексмедетомидина. Другими словами, способы лечения боли могут включать удержание трансдермальной композиции на основе дексмедетомидина в контакте с субъектом таким образом, чтобы доставить субъекту 5% или более дексмедетомидина в трансдермальной композиции на основе дексмедетомидина в течение одного интервала введения лекарственного средства. В таких вариантах реализации изобретения потребление дексмедетомидина составляет 5% или более в течение периода, который устройство для трансдермальной доставки находится в контакте с субъектом. В связи с этим 95% или менее от первоначального количества дексмедетомидина остается в трансдермальной композиции на основе дексмедетомидина после интервала введения лекарственного средства. Как описано более детально ниже, для рассматриваемых устройств для трансдермальной доставки возможен более высокий процент потребления. Другими словами, рассматриваемые устройства для трансдермальной могут доставлять дексмедетомидин субъекту, при этом оставляя небольшое остаточное количество дексмедетомидина в устройстве для трансдермальной доставки после заданного интервала введения лекарственного средства. Потребление может составлять 5% или более в течение интервала введения лекарственного средства, как например 10% или более, например 25% или более, например 40% или более, например 45% или более и в том числе 50% или более дексмедетомидина в течение интервала введения лекарственного средства. Для потребления верхний предел в течение интервала введения лекарственного средства в некоторых случаях составляет 90% или менее, например 50% или менее, например 25% или менее, и в том числе 5% или менее в течение интервала введения лекарственного средства.
Например, когда рассматриваемая трансдермальная композиция на основе дексмедетомидина содержит 1 мг дексмедетомидина, способы лечения боли могут включать удержание устройства для трансдермальной доставки в контакте с субъектом таким образом, чтобы доставить 0,05 мг или более дексмедетомидина в трансдермальной композиции на основе дексмедетомидина в течение интервала введения лекарственного средства (например, 7 дней или более), как например 0,1 мг или более, например 0,25 мг или более, например 0,4 мг или более, например 0,45 мг или более, и в том числе удержание устройства для трансдермальной доставки в контакте с субъектом таким образом, чтобы доставить 0,5 мг или более дексмедетомидина в композиции на основе дексмедетомидина. В связи с этим 0,95 мг или менее дексмедетомидина остается в трансдермальной композиции на основе дексмедетомидина через 7 дней или более, как например 0,9 мг или менее, например 0,75 мг или менее, например 0,6 мг или менее, и в том числе 0,5 мг или менее дексмедетомидина остается в трансдермальной композиции на основе дексмедетомидина после интервала введения лекарственного средства.
Как описано более подробно ниже, в некоторых вариантах реализации изобретения устройства для трансдермальной доставки включают однослойную матриксную композицию на основе дексмедетомидина, которая выполнена так, чтобы доставлять неседативное количество дексмедетомидина субъекту. В связи с этим способы согласно некоторым случаям включают нанесение субъекту устройства для трансдермальной доставки, содержащего однослойную матриксную композицию на основе дексмедетомидина, и удержание однослойной композиции на основе дексмедетомидина в контакте с субъектом в течение периода времени, достаточного для доставки эффективного количества дексмедетомидина субъекту.
В некоторых вариантах реализации изобретения каждый из рассматриваемых способов, которые описаны более подробно ниже, может дополнительно включать стадию прекращения контакта устройства для трансдермальной доставки с субъектом в конце интервала введения лекарственного средства. Например, контакт устройства для трансдермальной доставки с субъектом прекращают после удержания устройства для трансдермальной доставки в контакте с субъектом в течение 0,5 часа или более, например 1 часа или более, например 2 часов или более, например 4 часов или более, например 8 часов или более, например 12 часов или более, например 24 часов или более, например 36 часов или более, например 48 часов или более, например 60 часов или более, например 72 часов или более, например 96 часов или более, например 120 часов или более, в том числе 144 часов или более, и в том числе 168 часов или более. Верхний предел количества раз, которое устройство для трансдермальной доставки находится в контакте с субъектом перед удалением, составляет в некоторых случаях 168 часов или менее, например 144 часа или менее, например 120 часов или менее, например 96 часов или менее, например 72 часа или менее, например 48 часов или менее, например 24 часа или менее, например 12 часов или менее, например 8 часов или менее, например 4 часа или менее, и в том числе 2 часа или менее.
Под «прекращением контакта» устройства для трансдермальной доставки с субъектом подразумевают отсутствие контакта дексмедетомидина из трансдермальной композиции с субъектом, в том числе любого остаточного количества дексмедетомидина на поверхности кожи или слизистой оболочки, оставшегося после нанесения устройства для трансдермальной доставки. Другими словами, когда удаляют устройство для трансдермальной доставки, на поверхности кожи или слизистой оболочки в месте нанесения больше нет следов дексмедетомидина, что приводит к нулевому трансдермальному потоку дексмедетомидина у субъекта.
Как описано выше, интервал введения лекарственного средства представляет собой однократное нанесение и удержание в контакте с субъектом устройства для трансдермальной доставки, которое начинается с нанесения трансдермальной композиции на основе дексмедетомидина на кожу или слизистую оболочку субъекта и заканчивается прекращением контакта устройства для трансдермальной доставки с субъектом. В некоторых вариантах реализации изобретения протоколы могут включать повторяющиеся интервалы введения лекарственного средства. Под «повторяющимися интервалами введения лекарственного средства» подразумевают, что более одного устройства для трансдермальной доставки последовательно наносят и удерживают в контакте с субъектом. В связи с этим прекращают контакт одного устройства для трансдермальной доставки с субъектом, а субъекту снова наносят новое устройство для трансдермальной доставки. При практическом осуществлении способов изобретения схемы лечения могут включать два или более интервалов введения лекарственного средства, например три или более интервалов введения лекарственного средства, например четыре или более интервалов введения лекарственного средства, например пять или более интервалов введения лекарственного средства, в том числе десять или более интервалов введения лекарственного средства.
Расположение при последовательном нанесении новых устройств для трансдермальной доставки в схемах лечения с повторяющимися интервалами введения лекарственного средства может быть таким же или отличаться от расположения на субъекте предыдущего устройства для трансдермальной доставки, которое было удалено. Например, если первое устройство для трансдермальной доставки нанесено и находится в контакте с ногой субъекта, одно или более последующих устройств для трансдермальной доставки могут быть нанесены на то же самое место на ноге субъекта. С другой стороны, если первое устройство для трансдермальной доставки нанесено и находится в контакте с ногой субъекта, одно или более последующих устройств для трансдермальной доставки могут быть нанесены на другое место, такое как живот или спина субъекта. Одинаковые или разные составы на основе дексмедетомидина могут использоваться для введения последовательных доз в схемах с повторяющимися интервалами введения лекарственного средства. В некоторых случаях последующий интервал введения лекарственного средства в схеме лечения может включать более высокую или более низкую концентрацию дексмедетомидина, чем предыдущий интервал введения лекарственного средства. Например, концентрация дексмедетомидина в последующих интервалах введения лекарственного средства может быть увеличена на 10% или более, например на 20% или более, например на 50% или более, например на 75% или более, например на 90% или более, и в том числе на 100% или более. Верхний предел увеличения концентрации дексмедетомидина в последующих интервалах введения лекарственного средства в некоторых случаях составляет 10 раз или менее, например 5 раз или менее, например 2 раза или менее, например 1 раз или менее, например 0,5 раз или менее, и в том числе 0,25 раз или менее.
С другой стороны, концентрация дексмедетомидина в последующих интервалах введения лекарственного средства может быть уменьшена на 10% или более, например на 20% или более, например на 50% или более, например на 75% или более, например на 90% или более, и в том числе на 100% или более. Верхний предел уменьшения концентрации дексмедетомидина в последующих интервалах введения лекарственного средства в некоторых случаях составляет 10 раз или менее, например 5 раз или менее, например 2 раза или менее, например 1 раз или менее, например 0,5 раз или менее, и в том числе 0,25 раз или менее.
В других случаях в последующем интервале введения лекарственного средства может использоваться другой состав на основе дексмедетомидина по сравнению с предыдущим интервалом введения лекарственного средства, как например, другой клей, склеивающий при надавливании, или наличие или отсутствие усилителя проницаемости, что описано выше.
В некоторых вариантах реализации изобретения композиции на основе дексмедетомидина для лечения невропатической боли можно вводить до, совместно с или после других терапевтических средств для устранения или лечения боли. При введении одновременно с другим терапевтическим средством, рассматриваемые композиции на основе дексмедетомидина можно вводить в одной и той же или в другой композиции. Таким образом, описываемые композиции на основе дексмедетомидина и другие терапевтические средства можно вводить субъекту посредством одновременной терапии. Под «одновременной терапией» понимают такое введение субъекту комбинации веществ, что у субъекта, которого подвергают терапии, возникает терапевтический эффект. Например, одновременную терапию можно проводить, вводя композиции изобретения на основе дексмедетомидина и фармацевтическую композицию, содержащую по меньшей мере один другой агент, такую как композиции для лечения боли, включая, но не ограничиваясь этим, НПВС (аспирин, ибупрофен, напроксен, целекоксиб, ацетаминофен), ингибиторы циклооксигеназы, опиоиды, такие как кодеин, оксикодон, морфин, метадон, бупренорфин и фентанил, анестезирующие средства, антидепрессанты, противосудорожные средства, местнодействующие средства, каннабиноиды, N-метил-D-аспартат, нейромодуляторы, среди других средств, которые в комбинации дают терапевтически эффективную дозу согласно конкретному режиму дозирования. Введение отдельных фармацевтических композиций может быть выполнено одновременно или в разное время (т.е. последовательно, в любом порядке, в тот же день или в различные дни) до тех пор, пока у субъекта, подвергаемого терапии, возникает терапевтический эффект от комбинации этих веществ.
Когда дексмедетомидин вводят одновременно со вторым терапевтическим средством для лечения боли, отношение масс дексмедетомидина и второго терапевтического средства может изменяться от 1:2 до 1:2,5; от 1:2,5 до 1:3; от 1:3 до 1:3,5; от 1:3,5 до 1:4; от 1:4 до 1:4,5; от 1:4,5 до 1:5; от 1:5 до 1:10; и от 1:10 до 1:25 и в интервале между этими значениями. Например, отношение масс дексмедетомидина и второго терапевтического средства может изменяться между 1:1 и 1:5; 1:5 и 1:10; 1:10 и 1:15; или 1:15 и 1:25. В альтернативном варианте отношение масс второго терапевтического средства и дексмедетомидина изменяется между 2:1 и 2,5:1; 2,5:1 и 3:1; 3:1 и 3,5:1; 3,5:1 и 4:1; 4:1 и 4,5:1; 4,5:1 и 5:1; 5:1 и 10:1; и 10:1 и 25:1 или в интервале между этими значениями. Например, отношение второго терапевтического средства к дексмедетомидину может изменяться между 1:1 и 5:1; 5:1 и 10:1; 10:1 и 15:1;или 15:1 и 25:1.
В зависимости от второго терапевтического средства, которое вводят, и обнаруженного патологического состояния, одновременное введение с дексмедетомидином может уменьшать необходимое для введения количества второго терапевтического средства. Например, одновременное введение с дексмедетомидином может уменьшать количество опиоида или другого болеутоляющего средства, требуемого для эффективного устранения или лечения боли, такой как послеоперационная боль, боль, вызванная химиотерапией, или боль, вызванная лучевой терапией. Одновременное введение с дексмедетомидином может уменьшать необходимое для введения количество второго терапевтического средства на 10% или более, например на 25% или более, например на 35% или более, и в том числе уменьшение необходимого для введения количества второго терапевтического средства на 50% или более.
УСТРОЙСТВА ДЛЯ ТРАНСДЕРМАЛЬНОЙ ДОСТАВКИ ДЕКСМЕДЕТОМИДИНА, СОДЕРЖАЩИЕ КОМПОЗИЦИЮ НА ОСНОВЕ ДЕКСМЕДЕТОМИДИНА, ДЛЯ ЛЕЧЕНИЯ БОЛИ У СУБЪЕКТА
Аспекты изобретения также включают устройства для трансдермальной доставки эффективного (например, седативного или неседативного) количества дексмедетомидина субъекту, пригодные для практического осуществления рассматриваемых способов. Описываемые устройства для трансдермальной доставки включают композицию, содержащую дексмедетомидин и клей, склеивающий при надавливании. Дексмедетомидин представляет собой S-энантиомер медетомидина, имеющего формулу:
Дексмедетомидин согласно вариантам реализации изобретения может быть в форме свободного основания, соли, сольвата, гидрата или комплекса. Например, дексмедетомидин может быть в форме фармацевтически приемлемой соли, включая, но не ограничиваясь этим, следующие соли: мезилат, малеат, фумарат, тартрат, гидрохлорид, гидробромид, эзилат, n-толуолсульфонат, бензоат, ацетат, фосфат и сульфат. Дексмедетомидин согласно некоторым вариантам реализации изобретения может быть в форме свободного основания. В других случаях дексмедетомидин может образовывать комплекс.
В зависимости от места нанесения, типа боли, который подвергают лечению, и физиологии субъекта (например, масса тела), количество дексмедетомидина в описываемых композициях может изменяться, в некоторых случаях количество дексмедетомидина изменяется от 0,001 мг до 50 мг, например от 0,005 мг до 40 мг, например от 0,01 до 30 мг, например от 0,05 до 20 мг, и в том числе от 0,1 мг до 10 мг. В некоторых вариантах реализации изобретения количество дексмедетомидина в трансдермальной композиции изменяется от 0,1% до 20% масс., например от 0,5% до 18% масс., например от 1% до 15%, например от 2% до 12,5% масс., и в том числе от 3% до 10% масс. В других вариантах реализации изобретения количество дексмедетомидина в рассматриваемых трансдермальных композициях составляет 10% по массе или менее от общей массы трансдермальной композиции, например 9% по массе или менее, например 8% по массе или менее, например 7% по массе или менее, например 6% по массе или менее, например 5% по массе или менее, и в том числе 3% по массе или менее от общей массы трансдермальной композиции. В некоторых вариантах реализации изобретения композиции на основе дексмедетомидина содержат количество дексмедетомидина, которое ниже точки насыщения. В других вариантах реализации изобретения композиции на основе дексмедетомидина содержат количество дексмедетомидина, соответствующее точке насыщения. В других вариантах реализации изобретения композиции на основе дексмедетомидина содержат количество дексмедетомидина, превышающее точку насыщения.
В некоторых вариантах реализации изобретения композиции на основе дексмедетомидина, описанные в данном документе, составлены так, чтобы доставлять неседативное количество дексмедетомидина. Как указано выше, под «неседативным» подразумевают, что композиция на основе дексмедетомидина составлена так, чтобы доставлять субъекту количество дексмедетомидина, которое не вызывает полную седацию субъекта. Другими словами, субъект остается в сознании и способен реагировать в течение всего периода трансдермального введения описываемых композиций на основе дексмедетомидина субъекту. В некоторых случаях в течение введения трансдермальной композиции на основе дексмедетомидина, субъект остается контактным, ориентированным и спокойным. В других случаях в течение введения трансдермальной композиции на основе дексмедетомидина, субъект остается активным и способен реагировать на команды (например, устные или письменные команды). В других случаях в течение введения трансдермальной композиции на основе дексмедетомидина, субъект остается активным, контактным, ориентированным и спокойным и способен реагировать на команды (например, устные или письменные команды).
Как описано более детально ниже, в некоторых вариантах реализации изобретения описываемые трансдермальные композиции на основе дексмедетомидина составлены так, что в течение трансдермального введения состояние субъекта можно оценить согласно шкале Рамсея, и определить показатель шкалы Рамсея, который равен 4 или менее по шкале Рамсея, например 3 балла или менее по шкале Рамсея, например 2 балла или менее по шкале Рамсея, и в том числе 1 балл для субъекта по шкале Рамсея. В некоторых случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект демонстрирует быструю реакцию на легкий удар по глабелле или громкий слуховой раздражитель. В других случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект способен реагировать на устные команды. В других случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект остается контактным, ориентированным и спокойным. В других случаях в течение всего периода введения трансдермальной композиции на основе дексмедетомидина, субъект тревожен, возбужден или беспокоен.
В вариантах реализации настоящего изобретения трансдермальные композиции на основе дексмедетомидина также содержат клей, склеивающий при надавливании. Клеи, склеивающие при надавливании, могут включать, но не ограничиваясь этим, полиизобутеновые клеи, полиизобутиленовые клеи, смеси полиизобутенового клея и полиизобутиленового клея, карбоксилированные полимеры, акриловые или акрилатные сополимеры, такие как карбоксилированные акрилатные сополимеры.
Если клей, склеивающий при надавливании, содержит полибутен, полибутен может представлять собой насыщенный полибутен. В альтернативном варианте полибутен может представлять собой ненасыщенный полибутен. Более того, полибутен может представлять собой смесь или комбинацию насыщенного полибутена и ненасыщенного полибутена. В некоторых вариантах реализации изобретения клей, склеивающий при надавливании, может содержать композицию, которая представляет собой или представляет практически то же самое, что и композиция Indopol® L-2, Indopol® L-3, Indopol® L-6, Indopol® L-8, Indopol® L-14, Indopol® H-7, Indopol® H-8, Indopol® H-15, Indopol® H-25, Indopol® H-35, Indopol® H-50, Indopol® H-100, Indopol® H-300, Indopol® H-1200, Indopol® H-1500, Indopol® H-1900, Indopol® H-2100, Indopol® H-6000, Indopol® H-18000, Panalane® L-14E, Panalane® H-300E и их комбинаций. В некоторых вариантах реализации изобретения полибутеновый клей, склеивающий при надавливании, представляет собой Indopol® Н-1900. В других вариантах реализации изобретения полибутеновый клей, склеивающий при надавливании, представляет собой Panalane® Н-300Е.
Представляющие интерес акрилатные сополимеры включают сополимеры различных мономеров, таких как «мягкие» мономеры, «твердые» мономеры или «функциональные» мономеры. Акрилатные сополимеры могут представлять собой сополимер, являющийся биполимером (т.е. состоящим из двух мономеров), терполимером (т.е. состоящим из трех мономеров) или тетраполимером (т.е. состоящим из четырех мономеров), или сополимером, имеющим большее количество мономеров. Акрилатные сополимеры могут быть или не быть поперечно сшитыми. Полимеры могут быть сшиты с помощью известных способов для получения желаемого полимера. Мономеры из акрилатных сополимеров могут включать по меньшей мере два или более иллюстративных компонента, выбранных из группы, включающей акриловые кислоты, алкилакрилаты, метакрилаты, способные к сополимеризации вторичные мономеры или мономеры с функциональными группами. Мономеры («мягкие» и «твердые» мономеры) могут представлять собой метоксиэтилакрилат, этилакрилат, бутилакрилат, бутилметакрилат, гексилакрилат, гексилметакрилат, 2-этилбутилакрилат, 2-этилбутилметакрилат, изооктилакрилат, изооктилметакрилат, 2-этилгексилакрилат, 2-этилгексилметакрилат, децилакрилат, децилметакрилат, додецилакрилат, додецилметакрилат, тридецилакрилат, тридецилметакрилат, акрилонитрил, метоксиэтилакрилат, метоксиэтилметакрилат и тому подобное. Дополнительные примеры мономеров для акриловых клеев описаны в книге Satas, "Acrylic Adhesives," Handbook of Pressure-Sensitive Adhesive Technology, 2nd ed., pp. 396-456 (D. Satas, ed.), Van Nostrand Reinhold, New York (1989), описание которой включено в данный документ посредством ссылки. В некоторых вариантах реализации изобретения клей, склеивающий при надавливании, представляет собой сополимер акрилата и винилацетата. В некоторых вариантах реализации изобретения клей, склеивающий при надавливании, может содержать композицию, которая представляет собой или представляет практически то же самое, что и композиция Duro-Tak® 87-9301, Duro-Tak® 87-200А, Duro-Tak®87-2353, Duro-Tak®87-2100, Duro-Tak®87-2051, Duro-Tak®87-2052, Duro-Tak®87-2194, Duro-Tak®87-2677, Duro-Tak®87-201A, Duro-Tak®87-2979, Duro-Tak®87-2510, Duro-Tak®87-2516, Duro-Tak®87-387, Duro-Tak®87-4287, Duro-Tak®87-2287 и Duro-Tak®87-2074 и их комбинаций. Термин «практически то же самое», при использовании в данном документе, относится к композиции, которая представляет собой раствор сополимера акрилата и винилацетата в органическом растворителе. В некоторых вариантах реализации изобретения акриловый клей, склеивающий при надавливании, представляет собой Duro-Tak® 87-2054.
В некоторых вариантах реализации изобретения клей, склеивающий при надавливании, представляет собой акриловый клей, который является нефункционализированным акрилатом, гидрокси-функционализированным акрилатом или карбокси-функционализированным акрилатом. Например, акрилатный клей может представлять собой акриловый клей, содержащий одну или более функциональных групп -ОН. Если акриловый клей содержит одну или более функциональных групп -ОН, в некоторых случаях клей, склеивающий при надавливании, может являться композицией, которая представляет собой или представляет практически то же самое, что и композиция Duro-Tak® 87-4287, Duro-Tak® 87-2287, Duro-Tak® 87-2510 и Duro-Tak® 87-2516 и их комбинаций. В альтернативном варианте акрилатный клей может представлять собой акриловый клей, содержащий одну или более функциональных групп -СООН. Если акриловый клей содержит одну или более функциональных групп -СООН, в некоторых случаях клей, склеивающий при надавливании, может являться композицией, которая представляет собой или представляет практически то же самое, что и композиция Duro-Tak® 87-387, Duro-Tak® 87-2979 и Duro-Tak® 87-2353 и их комбинаций. Более того, акрилатный клей может представлять собой нефункционализированный акриловый клей. Если акриловый клей является нефункционализированным, в некоторых случаях клей, склеивающий при надавливании, может являться композицией, которая представляет собой или представляет практически то же самое, что и композиция Duro-Tak® 87-9301.
Количество клея, склеивающего при надавливании, в описываемых трансдермальных композициях на основе дексмедетомидина может изменяться, при этом количество клея, склеивающего при надавливании, находится в диапазоне от 0,1 мг до 2000 мг, например от 0,5 мг до 1500 мг, например от 1 до 1000 мг, например от 10 до 750 мг, и в том числе от 10 мг до 500 мг. В связи с этим количество клея, склеивающего при надавливании, в трансдермальной композиции изменяется от 1% до 99% масс., например от 5% до 95% масс., например от 10% до 95%, например от 15% до 90%, и в том числе от 20% до 85% масс. В других вариантах реализации изобретения количество клея, склеивающего при надавливании, в рассматриваемых трансдермальных композициях составляет 70% по массе или более от общей массы трансдермальной композиции, например 75% по массе или более, например 80% по массе или более, например 85% по массе или более, например 90% по массе или более, например 95% по массе или более, и в том числе 97% по массе или более от общей массы трансдермальной композиции.
Отношение масс клея, склеивающего при надавливании, и дексмедетомидина в рассматриваемых композициях может изменяться от 1:2 до 1:2,5; от 1:2,5 до 1:3; от 1:3 до 1:3,5; от 1:3,5 до 1:4; от 1:4 до 1:4,5; от 1:4,5 до 1:5; от 1:5 до 1:10; от 1:10 до 1:25; от 1:25 до 1:50; от 1:50 до 1:75; и от 1:75 до 1:99 или в интервале между этими значениями. Например, отношение масс клея, склеивающего при надавливании, и дексмедетомидина в описываемых композициях может изменяться между 1:1 и 1:5; 1:5 и 1:10; 1:10 и 1:15; 1:15 и 1:25; 1:25 и 1:50; 1:50 и 1:75; или 1:75 и 1:99. В альтернативном варианте отношение масс дексмедетомидина и клея, склеивающего при надавливании, в рассматриваемых композициях изменяется между 2:1 и 2,5:1; 2,5:1 и 3:1; 3:1 и 3,5:1; 3,5:1 и 4:1; 4:1 и 4,5:1; 4,5:1 и 5:1; 5:1 и 10:1; 10:1 и 25:1; 25:1 и 50:1; 50:1 и 75:1; и 75:1 и 99:1 или в интервале между этими значениями. Например, отношение масс дексмедетомидина и клея, склеивающего при надавливании, в описываемых композициях может изменяться между 1:1 и 5:1; 5:1 и 10:1; 10:1 и 15:1; 15:1 и 25:1; 25:1 и 50:1; 50:1 и 75:1; или 75:1 и 99:1.
В некоторых вариантах реализации изобретения трансдермальные композиции на основе дексмедетомидина могут дополнительно содержать один или более поперечно сшитых гидрофильных полимеров. Например, поперечно сшитый полимер может представлять собой аминосодержащий гидрофильный полимер. Аминосодержащие полимеры могут включать, но не ограничиваясь ими, полиэтиленимин, полиэтиленоксид с концевыми аминогруппами, полиэтилен/полипропиленоксид с концевыми аминогруппами, полимеры диметиламиноэтилметакрилата и сополимеры диметиламиноэтилметакрилата и винилпирролидона. В некоторых вариантах реализации изобретения поперечно сшитый полимер представляет собой поперечно сшитый поливинилпирролидон, как например, ПВП CLM.
Матрикс может содержать другие добавки в зависимости от используемого клея. Например, материалы, такие как ПВП CLM, ПВП K17, ПВП K30, ПВП K90, которые подавляют кристаллизацию лекарственного средства, обладают гигроскопичными свойствами, что увеличивает длительность ношения, и улучшают физические свойства клея, например, текучесть в холодном состоянии, закрепление, силу сцепления.
Количество поперечно сшитого полимера в описываемых трансдермальных композициях на основе дексмедетомидина может изменяться, при этом количество поперечно сшитого полимера находится в диапазоне от 0,1 мг до 500 мг, например от 0,5 мг до 400 мг, например от 1 до 300 мг, например от 10 до 200 мг, и в том числе от 10 мг до 100 мг. В связи с этим количество поперечно сшитого полимера в трансдермальной композиции изменяется от 2% до 30% масс., например от 4% до 30% масс., например от 5% до 25%, например от 6% до 22,5% масс., и в том числе от 10% до 20% масс. В других вариантах реализации изобретения количество поперечно сшитого полимера в рассматриваемых трансдермальных композициях составляет 8% по массе или более от общей массы трансдермальной композиции, например 10% по массе или более, например 12% по массе или более, например 15% по массе или более, например 20% по массе или более, например 25% по массе или более, и в том числе 30% по массе или более от общей массы трансдермальной композиции.
В некоторых вариантах реализации изобретения рассматриваемые трансдермальные композиции на основе дексмедетомидина могут дополнительно содержать усилитель растворимости дексмедетомидина. Под «усилителем растворимости» понимают соединение или композицию, которая увеличивает растворимость дексмедетомидина в рассматриваемых композициях, чтобы, например, предотвратить нежелательную кристаллизацию дексмедетомидина в композиции. Усилитель растворимости дексмедетомидина включают в композицию на основе дексмедетомидина в количестве от 0,01% до 20% (масс.), например от 0,05% до 15% (масс.), например от 0,1% до 10% (масс.), например от 0,5% до 8% (масс.), и в том числе от 1% до 5% (масс.).
Примеры усилителей растворимости включают, но не ограничиваясь ими, кислоты, в том числе линолевую кислоту, олеиновую кислоту, линоленовую кислоту, стеариновую кислоту, изостеариновую кислоту, левулиновую кислоту, пальмитиновую кислоту, октановую кислоту, декановую кислоту, додекановую кислоту, тетрадекановую кислоту, гексадекановую кислоту, октадекановую кислоту (т.е. стеариновую кислоту), N-лауроилсаркозин, L-пироглутаминовую кислоту, лауриновую кислоту, янтарную кислоту, пировиноградную кислоту, глутаровую кислоту, себациновую кислоту, циклопентанкарбоновую кислоту; ацилированные аминокислоты. Другие представляющие интерес усилители растворимости могут включать, но не ограничиваясь ими, алифатические спирты, такие как насыщенные или ненасыщенные высшие спирты, содержащие от 12 до 22 атомов углерода (например, олеиловый спирт или лауриловый спирт); сложные эфиры жирных кислот, такие как изопропилмиристат, диизопропиладипинат, лауриллактат, пропиллаурат, этилолеат и изопропилпальмитат; аминоспирты, такие как триэтаноламин, триэтаноламина гидрохлорид и диизопропаноламин; алкиловые эфиры многоатомных спиртов, такие как алкиловые эфиры таких многоатомных спиртов, как глицерин, этиленгликоль, пропиленгликоль, 1,3-бутиленгликоль, диглицериновый спирт, полиглицериновый спирт, диэтиленгликоль, полиэтиленгликоль, дипропиленгликоль, полипропиленгликоль, полипропиленгликольмонолаурат, сорбитан, сорбит, изосорбид, метилглюкозид, олигосахариды и восстанавливающие олигосахариды, где количество атомов углерода алкильной группы в алкиловых эфирах многоатомного спирта предпочтительно составляет от 6 до 20; алкиловые эфиры полиоксиэтилена, такие как алкиловые эфиры полиоксиэтилена, в которых количество атомов углерода в алкильной группе составляет от 6 до 20, а количество повторяющихся единиц (например, -О-СН2СН2-) полиоксиэтиленовой цепи составляет от 1 до 9, например, но не ограничиваясь ими, полиоксиэтиленовый эфир лаурилового спирта, полиоксиэтиленовый эфир цетилового спирта, полиоксиэтиленовый эфир стеарилового спирта и полиоксиэтиленовый эфир олеилового спирта; глицериды (т.е. сложные эфиры жирных кислот и глицерина), такие как сложные эфиры глицерина и жирных кислот, содержащих от 6 до 18 атомов углерода, где глицериды могут представлять собой моноглицериды (т.е. молекула глицерина ковалентно связана с одной цепью жирной кислоты посредством сложноэфирной связи), диглицериды (т.е. молекула глицерина ковалентно связана с двумя цепями жирных кислот посредством сложноэфирных связей), триглицериды (т.е. молекула глицерина ковалентно связана с тремя цепями жирных кислот посредством сложноэфирных связей) или их комбинации, где жирные кислоты, образующие глицериды, включают октановую кислоту, декановую кислоту, додекановую кислоту, тетрадекановую кислоту, гексадекановую кислоту, октадекановую кислоту (т.е. стеариновую кислоту) и олеиновую кислоту; сложные эфиры многоатомных спиртов и среднецепочечных жирных кислот; сложные алкиловые эфиры молочной кислоты; сложные алкиловые эфиры двухосновных кислот; ацилированные аминокислоты; пирролидон; производные пирролидона и их комбинации. Дополнительные типы усилителей растворимости могут включать молочную кислоту, винную кислоту, 1,2,6-гексантриол, бензиловый спирт, ланолин, гидроксид калия (KOH), трис(гидроксиметил)метиламин, глицеролмоноолеат (GMO), сорбитанмонолаурат (SML), сорбитанмоноолеат (SMO), лаурет-4 (LTH) и их комбинации. В некоторых вариантах реализации изобретения усилитель абсорбции и растворимости представляет собой левулиновую кислоту, лауриллактат или пропиленгликольмонолаурат.
Состав рассматриваемой трансдермальной композиции на основе дексмедетомидина может быть различным. Например, композиции изобретения могут быть в форме жидкого раствора или суспензии, сиропа, геля, пены или их любой комбинации для нанесения с помощью устройства для трансдермальной доставки.
В некоторых вариантах реализации изобретения устройство для трансдермальной доставки выполнено так, что содержит однослойную матриксную композицию на основе дексмедетомидина. Под «однослойной» подразумевают, что устройство для трансдермальной доставки содержит только один слой композиции на основе дексмедетомидина, расположенный на поверхности или подложке устройства для трансдермальной доставки и не содержит отдельных слоев клея, склеивающего при надавливании, трансдермальной композиции на основе дексмедетомидина или, если присутствуют, усилителей растворимости. Кроме того, однослойные устройства для трансдермальной доставки по настоящему изобретению не содержат дополнительной емкости для дексмедетомидина (т.е. емкости для активного агента) отдельно от клея, склеивающего при надавливании. В связи с этим однослойные устройства для трансдермальной доставки по настоящему изобретению могут содержать в одном матриксе количества каждого из компонентов трансдермальных композиций на основе дексмедетомидина, необходимые для осуществления на практике рассматриваемых способов, как описано более подробно ниже. Например, в некоторых вариантах реализации изобретения описываемые однослойные устройства для трансдермальной доставки включают один слой матрикса, содержащего дексмедетомидин и клей, склеивающий при надавливании, который выполнен с возможностью доставлять неседативное количество дексмедетомидина субъекту. В других вариантах реализации изобретения описываемые однослойные устройства для трансдермальной доставки включают один слой матрикса, содержащего дексмедетомидин, клей, склеивающий при надавливании, и усилитель растворимости, который выполнен с возможностью доставлять неседативное количество дексмедетомидина субъекту. В другом варианте реализации изобретения описываемые однослойные устройства для трансдермальной доставки включают один слой матрикса, содержащего дексмедетомидин, клей, склеивающий при надавливании, и сложный эфир жирной кислоты, который выполнен с возможностью доставлять неседативное количество дексмедетомидина субъекту. В некоторых вариантах реализации изобретения описываемые однослойные устройства для трансдермальной доставки включают один слой матрикса, содержащего только дексмедетомидин и клей, склеивающий при надавливании. В зависимости от длины интервала введения лекарственного средства и желаемой целевой дозировки, толщина одного слоя описываемых матриксов может изменяться и в некоторых случаях находиться в интервале от 10 до 260 мкм, например от 15 до 250 мкм, например от 25 до 225 мкм, например от 50 до 200 мкм, например от 75 до 175 мкм, и в том числе от 20 to 130 мкм, как например от 35 до 110 мкм.
Размер рассматриваемых устройств для трансдермальной доставки может различаться, в некоторых случаях они имеют такой размер, чтобы полностью покрывать место нанесения у субъекта. В связи с этим устройство для трансдермальной доставки может иметь длину в диапазоне от 1 до 100 см, например от 1 до 60 см, и ширину в диапазоне от 1 до 100 см, например от 1 до 60 см. В связи с этим площадь устройства для трансдермальной доставки может изменяться от 4 см2 до 10000 см2, например от 5 см2 до 1000 см2, например от 10 см2 до 100 см2, например от 15 см2 до 50 см2, и в том числе от 20 см2 до 40 см2. В некоторых вариантах реализации изобретения устройство для трансдермальной доставки изготовлено так, что имеет площадь 30 см2. В некоторых случаях устройство для трансдермальной доставки нерастворимо в воде. Под нерастворимостью в воде подразумевают, что устройство для трансдермальной доставки может быть погружено в воду на 1 день или более, например на 1 неделю или более, в том числе на 1 месяц или более, и при этом практически или совсем не происходит растворение, например, растворение незаметно.
В некоторых вариантах реализации изобретения устройство для трансдермальной доставки, описанное выше, дополнительно содержит наружный защитный слой. Наружный защитный слой может быть гибким, чтобы он мог находиться в тесном контакте с желаемым местом нанесения у субъекта. Наружный защитный слой может быть изготовлен из материала, который не абсорбирует дексмедетомидин и не позволяет дексмедетомидину вымываться из матрикса. Описываемые наружные защитные слои могут включать, но не ограничиваясь ими, нетканые материалы, тканые материалы, пленки (в том числе пластины), пористые тела, вспенивающиеся материалы, бумагу, композитные материалы, полученные наслаиванием пленки на нетканый или тканый материал, и их комбинации.
Нетканые материалы могут включать полиолефиновые смолы, такие как полиэтилен и полипропилен; полиэфирные смолы, такие как полиэтилентерефталат, полибутилентерефталат и полиэтиленнафталат; вискозное волокно, полиамид, поли(сложный эфир простой эфир), полиуретан, полиакрилатные смолы, поливиниловый спирт, сополимеры стирол-изопрен-стирол и сополимеры стирол-этилен-пропилен-стирол; и их комбинации. Материалы могут включать хлопчатобумажную ткань, вискозное волокно, полиакрилатные смолы, полиэфирные смолы, поливиниловый спирт и их комбинации. Пленки могут включать полиолефиновые смолы, такие как полиэтилен и полипропилен; полиакрилатные смолы, такие как полиметилметакрилат и полиэтилметакрилат; полиэфирные смолы, такие как полиэтилентерефталат, полибутилентерефталат и полиэтиленнафталат; и кроме того, целлофан, поливиниловый спирт, сополимеры этилена и винилового спирта, поливинилхлорид, полистирол, полиуретан, полиакрилонитрил, фтор-каучуки, сополимеры стирол-изопрен-стирол, бутадиенстирольный каучук, полибутадиен, сополимеры этилена и винилацетата, полиамид и полисульфон; и их комбинации. Бумаги могут включать пропитанную бумагу, покрытую бумагу, бумагу без древесной массы, крафт-бумагу, японскую бумагу, пергамин, синтетическую бумагу и их комбинации.
В зависимости от интервала введения лекарственного средства и желаемой целевой дозировки, размер наружного защитного слоя может изменяться и в некоторых случаях полностью покрывать место нанесения у субъекта. В связи с этим защитный слой может иметь длину в диапазоне от 2 до 100 см, например от 4 до 60 см, и ширину в диапазоне от 2 до 100 см, например от 4 до 60 см. В некоторых случаях наружный защитный слой может быть нерастворимым в воде. Под нерастворимостью в воде подразумевают, что защитный слой может быть погружен в воду на 1 день или более, например на 1 неделю или более, в том числе на 1 месяц или более, и при этом практически или совсем не происходит растворение, например, растворение незаметно.
Устройства для трансдермальной доставки, содержащие композицию на основе дексмедетомидина согласно вариантам реализации изобретения, не раздражают кожу субъекта в месте нанесения. Раздражение кожи упоминается в данном документе в своем обычном смысле для обозначения побочных эффектов, изменения цвета или повреждения кожи, такого как покраснение, боль, отек или сухость. В связи с этим при практическом осуществлении способов с рассматриваемыми устройствами для трансдермальной доставки, кожа остается в нормальном состоянии, и трансдермальная доставка совместима в течение всего интервала введения лекарственного средства.
В некоторых вариантах реализации изобретения оценивают раздражение кожи, чтобы определить состояние и цвет кожи в месте нанесения, и чтобы определить возникает ли какое-либо повреждение, боль, отек или сухость вследствие нахождения трансдермальной композиции в контакте с субъектом. Раздражение кожи можно оценить, используя любой подходящий протокол, например используя шкалу Дрейза, как описано в публикации Draize, J. Н., Appraisal of the Safety of Chemicals in Foods, Drugs and Cosmetics, pp. 46-49, The Association of Food and Drug Officials of the United States: Austin, Texas, описание которой включено в данный документ посредством ссылки. В частности, можно определять возникает ли на коже в месте трансдермального нанесения эритема или отек. Например, степень эритемы или отека можно установить на основании визуального осмотра или пальпации:
5 = образование струпа
Раздражение кожи в месте нанесения можно оценивать в любой момент в течение осуществления рассматриваемых способов. В некоторых случаях раздражение кожи оценивают, пока устройство для трансдермальной доставки находится в контакте с субъектом, путем осмотра или пальпации кожи через одинаковые интервалы, например, каждые 0,25 часа, каждые 0,5 часа, каждый 1 час, каждые 2 часа, каждые 4 часа, каждые 12 часов, каждые 24 часа, в том числе каждые 72 часа или через другой интервал. Например, раздражение на коже в месте нанесения можно оценить, пока устройство для трансдермальной доставки находится в контакте с субъектом, например: через 15 минут после нанесения субъекту устройства для трансдермальной доставки, через 30 минут после нанесения устройства для трансдермальной доставки, через 1 час после нанесения устройства для трансдермальной доставки, через 2 часа после нанесения устройства для трансдермальной доставки, через 4 часа после нанесения устройства для трансдермальной доставки, через 8 часов после нанесения устройства для трансдермальной доставки, через 12 часов после нанесения устройства для трансдермальной доставки, через 24 часа после нанесения устройства для трансдермальной доставки, через 48 часов после нанесения устройства для трансдермальной доставки, через 72 часа после нанесения устройства для трансдермальной доставки, через 76 часов после нанесения устройства для трансдермальной доставки, через 80 часов после нанесения устройства для трансдермальной доставки, через 84 часа после нанесения устройства для трансдермальной доставки, через 96 часов после нанесения устройства для трансдермальной доставки, через 120 часов после нанесения устройства для трансдермальной доставки, в том числе через 168 часов после нанесения устройства для трансдермальной доставки.
В других вариантах реализации изобретения раздражение кожи в месте трансдермального нанесения оценивают после прекращения контакта устройства для трансдермальной доставки с субъектом. Например, раздражение кожи в месте нанесения можно оценить через 30 минут после удаления устройства для трансдермальной доставки, например через 1 час после удаления устройства для трансдермальной доставки, например через 2 часа после удаления устройства для трансдермальной доставки, например через 4 часа после удаления устройства для трансдермальной доставки, например через 8 часов после удаления устройства для трансдермальной доставки, например через 12 часов после удаления устройства для трансдермальной доставки, например через 24 часа после удаления устройства для трансдермальной доставки, например через 48 часов после удаления устройства для трансдермальной доставки, и в том числе через 72 часа после удаления устройства для трансдермальной доставки.
В некоторых вариантах реализации изобретения раздражение кожи в месте трансдермального нанесения оценивают до нанесения субъекту устройства для трансдермальной доставки, чтобы зафиксировать цвет и структуру кожи до начала интервала введения лекарственного средства. Например, раздражение кожи в месте нанесения можно оценить за 5 минут до нанесения устройства для трансдермальной доставки, например за 10 минут, например за 30 минут, например за 60 минут, например за 120 минут, например за 240 минут, и в том числе за 480 минут до нанесения устройства для трансдермальной доставки. Если способы включают последовательно повторяющиеся интервалы введения лекарственного средства, раздражение кожи в месте нанесения можно оценить после удаления каждого устройства для трансдермальной доставки и перед нанесением следующего устройства для трансдермальной доставки. Например, когда удалено первое устройство для трансдермальной доставки, раздражение кожи в месте нанесения можно оценить через 2 часа, 24 часа и 48 часов после удаления и перед нанесением второго устройства для трансдермальной доставки. Следующее устройство для трансдермальной доставки можно наносить на предыдущее место нанесения непосредственно после оценки раздражения кожи или после заранее заданного времени после оценки раздражения кожи, такого как 4 часа, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 120 часов, 144 часа или 168 часов после оценки раздражения кожи.
Раздражение кожи в месте нанесения можно оценить один или более раз до, во время или после интервала введения лекарственного средства, например 2 или более раз, например 3 или более раз, и в том числе 5 или более раз до, во время или после интервала введения лекарственного средства. Верхний предел количества возможных оценок раздражения кожи в месте нанесения до, в течение или после интервала введения лекарственного средства в некоторых случаях составляет 10 раз или меньше, например 7 раз или меньше, например 5 раз или меньше, например 3 раза или меньше, и в том числе 2 раза или меньше. В некоторых вариантах реализации изобретения количество возможных оценок раздражения кожи в месте нанесения до, в течение или после интервала введения лекарственного средства варьируется, например, от 2 раз до 10 раз, например, от 3 раз до 9 раз, например, от 4 раз до 8 раз и в том числе от 5 раз до 7 раз. В некоторых вариантах реализации изобретения за раздражением кожи можно наблюдать в течение всего периода, который устройство для трансдермальной доставки находится в контакте с субъектом, например, путем видеонаблюдения.
Наборы
Также предложены наборы для практического осуществления некоторых способов, описанных в данном документе. В некоторых вариантах реализации изобретения наборы включают одно или более устройств для трансдермальной доставки с композицией на основе дексмедетомидина, содержащей дексмедетомидин и клей, склеивающий при надавливании, как описано выше. В некоторых вариантах реализации изобретения наборы включают клейкий наружный слой, как описано выше. В данном наборе, включающий два или более рассматриваемых устройств для трансдермальной доставки, композиции могут быть упакованы отдельно или находиться в общем контейнере.
В некоторых вариантах реализации изобретения наборы могут дополнительно включать инструкции по практическому осуществлению рассматриваемых способов или способы получения той же информации (например, URL веб-сайта, направляющий пользователя к странице, на которой представлена инструкция), при этом эти инструкции могут быть напечатаны на подложке, причем подложка может представлять собой одно или более из следующего: листок-вкладыш в упаковке, упаковка, контейнеры для веществ и тому подобное. В рассматриваемых наборах один или более компонентов находятся в одном или различных контейнерах в зависимости от того, как удобно или желательно.
Следующие ниже примеры приведены с целью иллюстрации и не предназначены для ограничения изобретения. Конкретнее, следующие ниже примеры представляют собой конкретные варианты реализации настоящего изобретения. Примеры предназначены только для иллюстративных целей и никоим образом не ограничивают объем настоящего изобретения. Были предприняты усилия, чтобы обеспечить точность в отношении используемых чисел (например, количества, температуры и т.д.), но, конечно, некоторые экспериментальные ошибки и отклонения должны допускаться.
Экспериментальная часть
Материалы и методы
Приготовление образцов трансдермальных составов на основе дексмедетомидина Составы готовили путем смешивания дексмедетомидина и клея, склеивающего при надавливании, в органических растворителях (например, 30-60% масс. сухого вещества в этилацетате, изопропиловом спирте, гексане или гептане) с последующим перемешиванием. После получения гомогенной смеси раствор заливали на подложку (пластины из силиконизированного полиэфира или полиэфира, покрытого фторполимером, длиной 2-3 мила) и сушили при 60°-80°С в течение 10-90 минут. Однослойные клеящие пленки затем припрессовывали к защитному слою из ПЭТ, разрезали на куски желаемого размера и штамповали. В некоторых случаях к клеевой композиции добавляли поперечно сшитый поливинилпирролидон (ПВП CLM), поливинилпирролидон K90 (ПВП K90), левулиновую кислоту (ЛК), олеиновую кислоту (ОК), лауриллактат (ЛЛ) и пропиленгликольмонолаурат (ПГМЛ).
Определения трансдермального потока
Использовали кожу трупа человека, слои эпидермиса (роговой слой и жизнеспособный эпидермис) отделяли от кожи обычной толщины в виде кожной мембраны. Из образцов с помощью пуансона с закругленной кромкой высекали куски с конечным диаметром около 2,0 см. Подложку удаляли, и систему помещали сверху на эпидермис/роговой слой, при этом клеевой слой дексмедетомидина покрывает наружную поверхность рогового слоя. Оказывали небольшое давление для обеспечения хорошего контакта между клеевым слоем и роговым слоем. Донорную и рецепторную стороны ячейки Франца соединяли вместе, и в ячейку Франца добавляли рецепторный раствор, содержащий фосфатный буфер с pH 6,5 и 0,01% гентамицина. Ячейки хранили при 32°С-35°С в течение эксперимента. Через одинаковые интервалы отбирали образцы рецепторного раствора, и концентрацию активного агента измеряли с помощью ВЭЖХ. Отобранный рецепторный раствор заменяли свежим раствором, чтобы поддерживать условия погружения. Поток вычисляли из углового коэффициента зависимости суммарного количества лекарственного средства, перешедшего в рецепторный отсек, от времени.
Примеры
Пример 1
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в ПИБ/ПБ полимерах
Клеи, склеивающие при надавливании, которые используются в этом примере, представляют собой полиизобутиленовый/полибутеновый (ПИБ/ПБ) клеи. ПИБ/ПБ клеи представляют собой смеси высокомолекулярного ПИБ (5% Oppanol В100), низкомолекулярного ПИБ (25% Oppanol В12) и полибутенового усилителя клейкости, например, Indopol H1900 или Panalane Н-300е (20%) в органическом растворителе, например, гептане (50%). Смесь перемешивали в течение около 3 дней, пока она не становилась гомогенной. Примеры составов трансдермальных композиций на основе дексмедетомидина представлены в Таблицах 1 и 2.
Изучение потока через кожу in vitro было выполнено, как описано выше, с устройствами для трансдермальной доставки, содержащими различные концентрации дексмедетомидина, как показано в Таблице 1. Средний поток дексмедетомидина через кожу in vitro в зависимости от времени представлен на фиг. 1. Как показано на фиг. 1, поток дексмедетомидина через кожу in vitro был высоким в первые часы в случае 1%-ого состава (состав 1) по сравнению с более высоким содержанием лекарственного средства (составы 2 и 3). Установлено, что в составах 2 и 3 присутствуют игольчатые кристаллы дексмедетомидина, поэтому профиль потока был постоянным и не изменялся в зависимости от содержания лекарственного средства. Однако в составе 1 не наблюдали кристаллов. Состав 1 содержит количество дексмедетомидина, соответствующее точке насыщения или выше этого значения.
Трансдермальный состав на основе дексмедетомидина также был получен с использованием ПИБ, полученного из Indopol H1900, как показано в Таблице 2. Результаты in vitro проникновения дексмедетомидина из 1%-ого состава на основе дексмедетомидина, приготовленного с 20% ПВП CLM в ПИБ/ПБ клее (состав 4), через образцы кожи с различной проницаемостью представлены на фиг. 2. Фиг. 2(A) иллюстрирует суммарное доставленное количество дексмедетомидина в зависимости от времени. Проникновение дексмедетомидина in vitro отличается в зависимости от проницаемости кожи. Доставленное in vitro количество дексмедетомидина может изменяться от 4-35 мкг/см2 через 8 ч до 15-67 мкг/см2 через 24 ч. Фиг. 2(B) иллюстрирует поток или производную суммарного доставленного количества лекарственного средства в зависимости от времени. Скорость доставки дексмедетомидина из состава 2 достигала максимума через около 5-7 часов, затем оставалась постоянной в течение по меньшей мере 24 ч. В случае высоко проницаемой кожи (кожа №14), поток мог уменьшаться вследствие исчерпания количества лекарственного средства. Фиг. 2(C) иллюстрирует % лекарственного средства, оставшийся в пластыре, в зависимости от времени. Как показано на фиг. 2(C), потребление дексмедетомидина из состава 4 составляло 20-70% после нанесения пластыря на 24 ч.

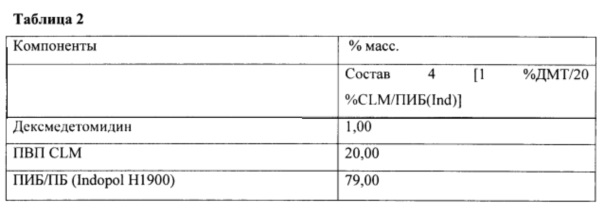
Пример 2
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в нефункционализированных акрилатных полимерах
Поток дексмедетомидина in vitro измеряли, используя нефункционализированный акрилатный клей. Пример нефункционализированного акрилатного клея, используемого в эксперименте, включает нефункционализированный акрилатный полимер Duro-Tak 87-9301. Изучение потока через кожу in vitro было выполнено, как описано выше, с устройствами для трансдермальной доставки, содержащими различные концентрации дексмедетомидина в нефункционализированном Duro-Tak 87-9301. Составы трансдермальных композиций на основе дексмедетомидина представлены в Таблице 3. Средний поток дексмедетомидина in vitro в зависимости от времени представлен на фиг. 3. Как показано на фиг. 3, более высокое содержание дексмедетомидина приводило к увеличению потока через кожу in vitro.

Пример 3
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в гидрокси-функционализированных (-ОН) акрилатных полимерах
Поток дексмедетомидина in vitro измеряли, используя гидрокси-функционализированные (-ОН) акрилатные клеи. Примеры гидрокси-функционализированных акрилатных клеев, используемых в эксперименте, включают гидрокси-функционализированные акрилатные полимеры, например, Duro-Tak 87-4287, Duro-Tak 387/87-2510, Duro-Tak 387/87-2287 и Duro-Tak 387/87-2516. Изучение потока через кожу in vitro было выполнено, как описано выше, с устройствами для трансдермальной доставки, содержащими различные концентрации дексмедетомидина с различными гидрокси-функционализированными акрилатными клеями.
Таблицы 4 и 5 иллюстрируют составы трансдермальных композиций на основе дексмедетомидина с различными концентрациями дексмедетомидина в Duro-Tak 87-4287 (акрилат-винилацетатный полимер) или Duro-Tak 387/87-2510 (акрилатный полимер). Средние потоки дексмедетомидина in vitro представлены на фиг. 4 и 5. Как показано на фиг. 4 и 5, поток дексмедетомидина in vitro увеличивался с увеличением содержания дексмедетомидина в составе.
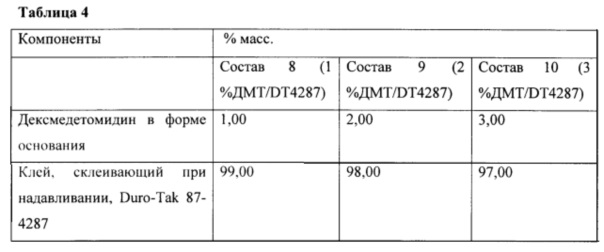

Таблица 6 иллюстрирует составы трансдермальных композиций на основе дексмедетомидина, содержащие 1% дексмедетомидина в других гидрокси-функционализированных акрилатных полимерах, содержащих винилацетат, например, Duro-Tak 87-2287 (полимер без добавок сшивателя) и Duro-Tak 87-2516 (полимер с добавками сшивателя). Средние потоки дексмедетомидина in vitro представлены на фиг. 6. Как показано на фиг. 6, поток in vitro, полученный из Duro-Tak 387/87-2287, был немного выше, чем поток из Duro-Tak 387/87-2516, возможно, вследствие более хороших адгезионных свойств Duro-Tak 387/87-2287 по сравнению с Duro-Tak 387/87-2516.
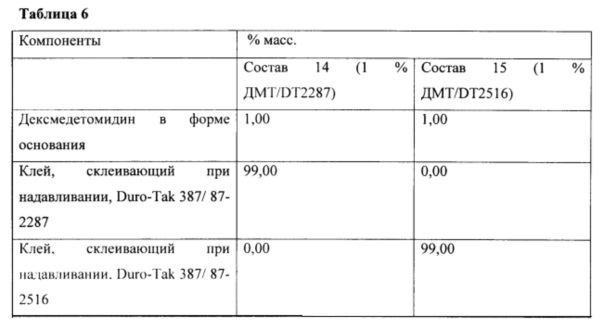
Пример 4
Поток in vitro, полученный для 1%-ых составов трансдермальных композиций на основе дексмедетомидина в нефункционализированных или гидрокси-функционализированных (-ОН) акрилатных полимерах
Другая группа примеров трансдермальных составов на основе дексмедетомидина представляет собой трансдермальные композиции, которые содержат 1% масс.дексмедетомидина с нефункционализированным акрилатным полимером (Duro-Tak 87-9301, состав 5), гидрокси-функционализированным акрилатным полимером (Duro-Tak 387/87-2510, состав 11) и гидрокси-функционализированным акрилатным полимером, содержащим винилацетат (Duro-Tak 87-4287, состав 8). Эксперименты по изучению потока in vitro были выполнены в течение 3 дней и 1 дня, и результаты показаны на фиг. 7А и 7В, соответственно. Как показано и на фиг. 7А, и на 7В, поток дексмедетомидина in vitro был меньше в нефункционализированных клеях по сравнению с гидрокси-функционализированными клеями при одном и том же содержании дексмедетомидина.
Пример 5
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в карбокси-функционализированных (-СООН) или карбокси/гидрокси-функционализированных (-СООН/ОН) акрилатных полимерах
Поток дексмедетомидина in vitro измеряли, используя карбокси-функционализированные (-СООН) или карбокси/гидрокси-функционализированные (-СООН/ОН) акрилатные клеи. Примером карбокси-функционализированного (-СООН) акрилатного клея, используемого в этом исследовании, является Duro-Tak 387/87-2353 (акрилатный полимер без добавок сшивателя). Карбокси/гидрокси-функционализированный (-СООН/ОН) акрилатный клей, используемый в данном исследовании, представляет собой Duro-Tak 87-2979 (акрилат-винилацетатный полимер с добавками сшивателя).
Таблицы 7 и 8 демонстрируют составы трансдермальных композиций на основе дексмедетомидина с различными карбокси-функционализированными (-СООН) или карбокси/гидрокси-функционализированными (-СООН/ОН) акрилатными полимерами. Концентрацию дексмедетомидина в составах выбирали на основании растворимости дексмедетомидина в каждом клее. Установлено, что растворимость дексмедетомидина в Duro-Tak 387/87-2353 составляет около 10-15%, тогда как в Duro-Tak 87-2979 - менее 2%. Растворимость лекарственного средства в карбокси-функционализированных акрилатных клеях была выше, чем в нефункционализированных или гидрокси-функционализированных акрилатных клеях.
Изучение потока через кожу in vitro было выполнено, как описано выше. Средние потоки дексмедетомидина in vitro представлены на фиг. 8 и 9.


Пример 6
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в ПИБ/ПБ полимерах, содержащих ПВП CLM и Duro-Tak 387/87-2353
Другой пример состава трансдермальной композиции на основе дексмедетомидина представлен в Таблице 9. Для увеличения растворимости лекарственного средства в ПИБ/ПБ (например, Indopol Н-1900) клее, использовали ПВП CLM и карбокси-функционализированный (-СООН) акрилатный полимер (Duro-Tak 387/87-2353). Составы 18-21 были приготовлены с различным содержанием Duro-Tak 387/87-2353.
Как показано на фиг. 10, составы, содержащие карбокси-функционализированный (-СООН) акрилатный полимер (Duro-Tak 387/87-2353), а именно составы 19. 20 и 21, характеризуются более низким начальным потоком по сравнению с составами без Duro-Tak 2353 (состав 18). Поток дексмедетомидина in vitro не изменялся с увеличением содержания функционализированного клея от 3% до 6%, однако для клея, содержащего 9% функционализированного клея, наблюдалось небольшое уменьшение потока in vitro.
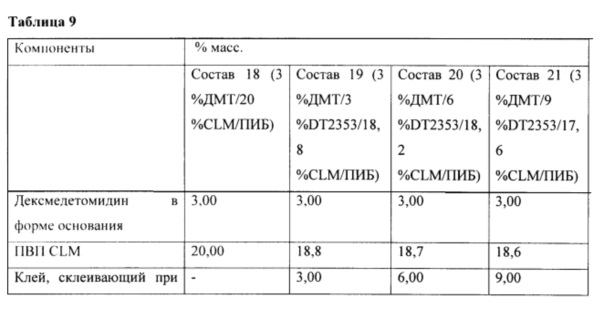

Пример 7
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в ПИБ/ПБ полимерах, содержащих ПВП CLM и левулиновую кислоту
Другой пример состава трансдермальной композиции на основе дексмедетомидина представлен в Таблице 10. Для увеличения растворимости лекарственного средства в ПИБ/ПБ (например, Indopol Н-1900) клее в присутствии 20% ПВП CLM, использовали различные концентрации кислоты для тестирования увеличения растворимости дексмедетомидина. Составы 22-25 были приготовлены с различным содержанием левулиновой кислоты.
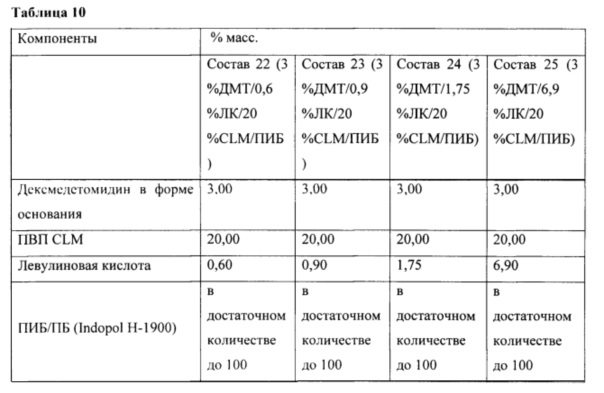
Как показано на фиг. 11, поток дексмедетомидина in vitro сильно уменьшался, когда состав содержал 6,9% левулиновой кислоты. Однако при концентрации левулиновой кислоты 1,75%, поток in vitro был сравним с более низкими концентрациями левулиновой кислоты (т.е. 0,6% и 0,9%). Начальный поток, полученный для составов, содержащих левулиновую кислоту (составы 22, 23, 24 и 25), был ниже, чем для состава без левулиновой кислоты (состав 18). Однако через 24 ч поток, полученный для составов, содержащих левулиновую кислоту (составы 22, 23, 24 и 25), стал выше, чем для состава без левулиновой кислоты (состав 17). Кристаллы дексмедетомидина наблюдались при концентрациях левулиновой кислоты 1,75% и ниже.
Пример 8
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в ПИБ/ПБ полимерах, содержащих ПВП CLM и лауриллактат или пропиленгликольмонолаурат
Другой пример составов трансдермальных композиций на основе дексмедетомидина представлен в Таблицах 11 и 12. Растворимость дексмедетомидина составляет от 5 до 10% в лауриллактате и пропиленгликольмонолаурате. И лауриллактат, и пропиленгликольмонолаурат увеличивают растворимость дексмедетомидина в ПИБ/ПБ клее в рассматриваемых составах. Профили потока in vitro составов 26-28 представлены на фиг. 12. Профили потока in vitro составов 29-31 представлены на фиг. 13. Установлено, что в составах 26-31 присутствовали игольчатые кристаллы дексмедетомидина.


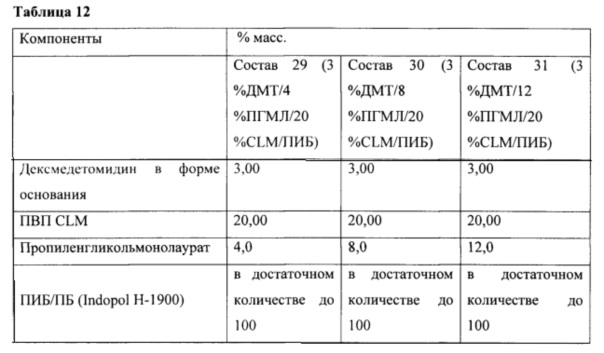
Пример 9
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в полимерах Duro-Tak 387/87-2287, содержащих левулиновую кислоту, ПВП К90 или Duro-Tak 387/87-2353
Другая группа примеров трансдермального состава на основе дексмедетомидина включает трансдермальные композиции, содержащие 1% масс, дексмедетомидина с солюбилизатором для улучшения физической стабильности композиции. В этих составах использовались левулиновая кислота, ПВП К90 и Duro-Tak 87-2353. Состав композиций представлен в Таблицах 13, 14 и 15. Профили потока in vitro для трансдермальных композиций, содержащих 1% дексмедетомидина с 0,3% и 0,6% левулиновой кислоты, представлены на фиг. 14(A). Профили потока in vitro для трансдермальных композиций, содержащих 1% дексмедетомидина с 5% и 10% ПВП К90, представлены на фиг. 14(B). Профили потока in vitro для трансдермальных композиций, содержащих 1% дексмедетомидина с 2% и 3% Duro-Tak 387/87-2353, представлены на фиг. 14(C). Из профилей потока in vitro следует, что левулиновая кислота усиливает проникновение через 15 ч после нанесения, ПВП К90 задерживает трансдермальный поток дексмедетомидина, тогда как Duro-Tak 2353 немного уменьшает трансдермальный поток.

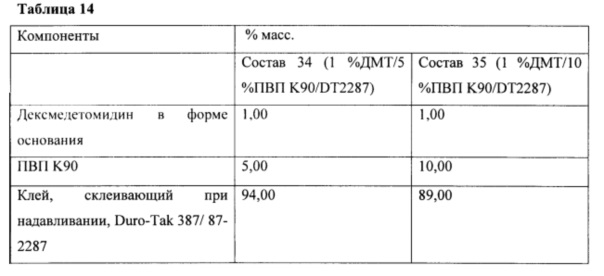


Пример 10
Поток in vitro, полученный для составов трансдермальных композиций на основе дексмедетомидина в полимерах Duro-Tak 87-9301, содержащих левулиновую кислоту, олеиновую кислоту или Duro-Tak 387/87-2353
Другая группа примеров трансдермального состава на основе дексмедетомидина включает трансдермальные композиции, содержащие 3% масс, дексмедетомидина и нефункционализированный акрилатный полимер Duro-Tak 87-9301 в сочетании с 3,3% левулиновой кислоты, 5% олеиновой кислоты или 15% Duro-Tak 387/87-2353. Состав композиций представлен в Таблице 16. Профили потока in vitro для этих составов (составы 38, 39 и 40) по сравнению с 3% дексмедетомидина в нефункционализированных акрилатных полимерах Duro-Tak 87-9301 без добавок (состав 7) представлены на фиг. 15. Композиции, содержащие только 3% дексмедетомидина и нефункционализированный акрилатный полимер Duro-Tak 87-9301, были пересыщенными. Левулиновую и олеиновую кислоты использовали в качестве солюбилизатора и усилителя проницаемости, они увеличивали поток in vitro вначале, но со временем происходило его уменьшение. Как и в случае композиций, содержащих 1% дексмедетомидина, Duro-Tak 87-2353 уменьшал поток.

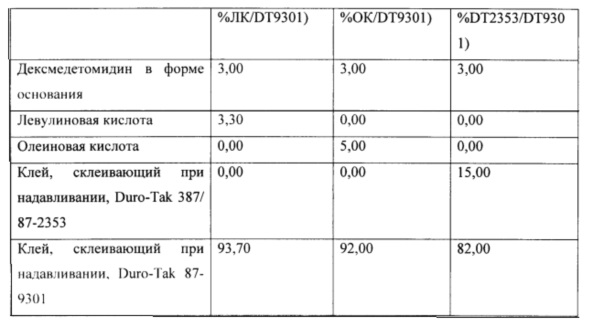
Пример 11
Проницаемость по отношению к дексмедетомидину in vitro, полученная для 1%, 2%, 3% и 4% дексмедетомидина в смеси клеев (15% Duro-Tak2353 в Duro-Tak 2287)
Составы трансдермальных композиций на основе дексмедетомидина, содержащие смесь гидрокси-функционализированного акрилатного полимера (например, Duro-Tak 87-2287) и карбокси-функционализированного акрилатного полимера (например, Duro-Tak 87-2353), представлены в Таблице 17. Составы 41-44 были приготовлены с различным содержанием дексмедетомидина.


Как показано на фиг. 16, поток дексмедетомидина in vitro увеличивался с увеличением содержания дексмедетомидина.
Пример 12
Проницаемость по отношению к дексмедетомидину in vitro, полученная для составов на основе дексмедетомидина, содержащих олеиновую кислоту
Другой пример составов трансдермальных композиций на основе дексмедетомидина представлен в Таблице 18. Для увеличения растворимости дексмедетомидина в гидрокси-функционализированном акрилатном полимере (например, Duro-Tak 87-2287) использовали олеиновую кислоту. Составы 45-47 были приготовлены с различным содержанием олеиновой кислоты и дексмедетомидина.

Как показано на фиг. 17, дексмедетомидин в составах, содержащих олеиновую кислоту, характеризуется более высоким потоком, чем композиция на основе дексмедетомидина (например, состав 43), которая не содержит олеиновой кислоты. Олеиновая кислота усиливает проникновение дексмедетомидина через кожу. При увеличении содержания олеиновой кислоты от 5% до 7% (например, состав 46) не наблюдалось эффекта усиления по сравнению с составом, содержащим 5% олеиновой кислоты (например, состав 45). Это может являться результатом вклада олеиновой кислоты в увеличение растворимости дексмедетомидина в композиции. Сравнение состава 45 и состава 47 показывает, что поток in vitro увеличивается с увеличением содержания лекарственного средства.
Пример 13
Проницаемость по отношению к дексмедетомидину in vitro, полученная для составов на основе дексмедетомидина, содержащих левулиновую кислоту
Трансдермальные составы на основе дексмедетомидина были также приготовлены с левулиновой кислотой. Композиция представлена в Таблице 19.
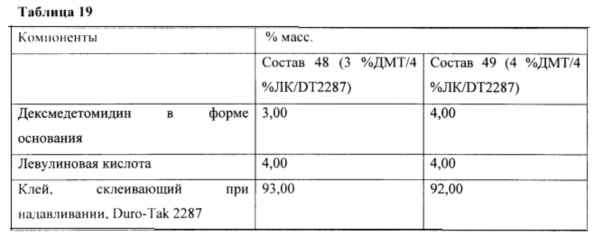
Как показано на фиг. 18, поток дексмедетомидина in vitro в составах, содержащих левулиновую кислоту (составы 48 и 49), увеличивался с увеличением содержания дексмедетомидина. Усиливающий эффект левулиновой кислоты на проникновение дексмедетомидина через кожу был выше, чем у олеиновой кислоты.
Результаты in vitro проникновения дексмедетомидина (в процентах) для составов 43. 45 и 48 по отношению к количеству дексмедетомидина в пластыре представлены в Таблице 20. Составы 45 и 48, которые содержат левулиновую кислоту и олеиновую кислоту, демонстрируют значительное усиление проникновения дексмедетомидина в условиях in vitro.
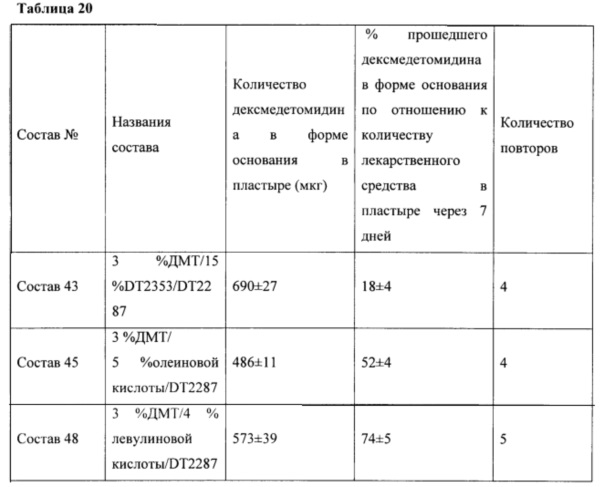
Растворимость дексмедетомидина в гидрокси-функционализированном акрилатном полимере составляла менее 1%. Для увеличения растворимости дексмедетомидина, использовали карбокси-функционализированный акрилатный полимер (например, Duro-Tak2353), олеиновую кислоту и левулиновую кислоту. Растворимость дексмедетомидина в Duro-Tak2353, олеиновой кислоте и левулиновой кислоте составляла около 10-15%, 40% и 60%, соответственно. Количество кислоты, добавляемое в состав, подбирали в соответствии с растворимостью каждого компонента в составе.
После приготовления проверяли наличие кристаллов с помощью микроскопа. Результаты, полученные в этом микроскопическом исследовании, указывали на то, что все составы (составы 41-48) не содержали кристаллов.
Профиль потока для всех составов (составы 41-48) указывал на отчетливое увеличение потока со временем в первые 24 часа (фиг. 16-18). Затем происходит постепенное уменьшение потока со временем. В связи с этим увеличение потока в первые 24 часа может в некоторых случаях использоваться для быстрого достижения более высокой изначальной терапевтической концентрации в организме. Если наблюдается уменьшение потока со временем, это может происходить вследствие кристаллизации лекарственного средства в клее, вызванной абсорбированной водой в пластыре.
Пример 14
Поток in vitro, полученный для различных защитных слоев
Клеи, склеивающие при надавливании, которые используются в этом примере, представляют собой полиизобутиленовый/полибутеновый (ПИБ/ПБ) клеи. ПИБ/ПБ клеи представляют собой смеси высокомолекулярного ПИБ (5% Oppanol В100), низкомолекулярного ПИБ (25% Oppanol В12) и полибутенового усилителя клейкости, например, Indopol HI900 или Panalane Н-300е (20%) в органическом растворителе, например, гептане (50%). Смесь перемешивали в течение около 3 дней, пока она не становилась гомогенной. Пример составов трансдермальных композиций на основе дексмедетомидина представлен в Таблице 21. Один и тот же состав наносили на подложку, но покрывали тремя различными защитными слоями: защитный слой 1 имеет значение СПВП около 10 (г/м2/24 ч), защитный слой 2 имеет значение СПВП около 50 (г/м2/24 ч), и защитный слой 3 имеет значение СПВП около 150 (г/м2/24 ч).
Средний поток дексмедетомидина через кожу in vitro в зависимости от времени представлен на фиг. 19. Как показано на фиг. 19, поток дексмедетомидина через кожу in vitro был подобен для защитных слоев 1 и 2. Но он был значительно ниже для защитного слоя 3.

Пример 15
Поток in vitro, полученный для составов, содержащих лауриллактат в качестве усиливающего агента
Другая группа примеров трансдермального состава на основе дексмедетомидина включает
трансдермальные композиции, содержащие 2-4% масс, дексмедетомидина с усиливающим агентом для улучшения проницаемости кожи. В этих составах использовались лауриллактат (ЛЛ) и Duro-Tak 87-2287. Состав композиций представлен в Таблице 22. Профили потоков in vitro для трансдермальных композиций. Фиг. 20 и 21 иллюстрируют поток через два различных образца кожи. Из профилей потока in vitro следует, что ЛЛ демонстрирует эффект усиления проницаемости кожи. Поток также пропорционален содержанию АФИ.

Независимо от прилагаемой формулы изобретения, описание, изложенное в данном документе, также определяется следующими пунктами:
1. Способ лечения боли у субъекта, включающий нанесение на поверхность кожи субъекта, испытывающего боль, устройства для трансдермальной доставки, содержащего: композицию на основе дексмедетомидина, которая содержит: дексмедетомидин; и клей, склеивающий при надавливании; и защитный слой, причем композиция на основе дексмедетомидина составлена так, чтобы доставлять эффективное количество дексмедетомидина для лечения боли у субъекта.
2. Способ по п. 1, отличающийся тем, что боль выбрана из группы, состоящей из идиопатической боли, острой боли, симпатически опосредованной боли, боли, связанной с комплексным регионарным болевым синдромом, и невропатической боли, и их комбинаций.
3. Способ по п. 2, отличающийся тем, что боль представляет собой невропатическую боль.
4. Способ по п. 3, отличающийся тем, что невропатическая боль связана с симпатической нервной системой.
5. Способ по п. 3, отличающийся тем, что невропатическая боль выбрана из группы, состоящей из боли, связанной с раковыми заболеваниями, послеоперационной боли, боли, связанной с инфекцией, боли, связанной с опоясывающим лишаем, и боли, связанной с ВИЧ-инфекцией.
6. Способ по п. 5, отличающийся тем, что субъект находится в неседированном состоянии.
7. Способ по п. 6, включающий доставку субъекту неседативного количества дексмедетомидина.
8. Способ по любому из пп. 6-7, включающий доставку субъекту неседативного количества дексмедетомидина в течение 1 дня или более.
9. Способ по п. 8, включающий доставку субъекту неседативного количества дексмедетомидина в течение 3 дней или более.
10. Способ по п. 9, включающий доставку субъекту неседативного количества дексмедетомидина в течение 7 дней или более.
11. Способ по любому из пп. 6-10, включающий доставку субъекту неседативного количества дексмедетомидина таким образом, чтобы показатель шкалы Рамсея для субъекта составлял не более 3 баллов.
12. Способ по п. 11, включающий доставку субъекту неседативного количества дексмедетомидина таким образом, чтобы показатель шкалы Рамсея для субъекта составлял не более 2 баллов.
13. Способ по п. 1, включающий доставку субъекту седативного количества дексмедетомидина.
14. Способ по п. 1, отличающийся тем, что субъект активен и способен реагировать на устные команды.
15. Способ по п. 1, включающий доставку дексмедетомидина субъекту с помощью устройства для трансдермальной доставки со скоростью, которая изменяется от около 5 мкг/сутки до около 500 мкг/сутки.
16. Способ по п. 15, включающий доставку дексмедетомидина субъекту с помощью устройства для трансдермальной доставки со скоростью, которая изменяется от около 145 мкг/сутки до около 300 мкг/сутки.
17. Способ по п. 1, включающий доставку дексмедетомидина субъекту таким образом, чтобы поддерживать среднюю концентрацию дексмедетомидина в плазме у субъекта в интервале от около 0,01 нг/мл до около 0,4 нг/мл.
18. Способ по п. 1, который дополнительно включает совместное введение субъекту соединения, выбранного из группы, состоящей из болеутоляющих средств, анестезирующих средств, антидепрессантов, противосудорожных средств, местнодействующих средств, каннабиоидов, N-метил-D-аспартата, и нейромодуляторов, и их комбинаций.
19. Способ по п. 18, который дополнительно включает совместное введение субъекту болеутоляющего средства.
20. Способ по п. 19, отличающийся тем, что болеутоляющее средство представляет собой опиоид.
21. Способ по п. 18, отличающийся тем, что совместно вводимое соединение включено в композицию на основе дексмедетомидина.
22. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, содержит виниловый полимер.
23. Способ по п. 22, отличающийся тем, что виниловый полимер выбран из группы, состоящей из полиэтилена, полипропилена, полиизобутилена, полибутена, полистирола, поливинилхлорида, поливинилацетата, поливинилового спирта и кремнийорганических соединений.
24. Способ по п. 22, отличающийся тем, что клей, склеивающий при надавливании, содержит полиизобутилен, или полибутен, или их комбинацию.
25. Способ по п. 24, отличающийся тем, что клей, склеивающий при надавливании, содержит насыщенный полибутен.
26. Способ по п. 24, отличающийся тем, что клей, склеивающий при надавливании, содержит ненасыщенный полибутен.
27. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, содержит акриловый полимер, акрилатный полимер, сополимер акрилата и винилацетата или полиакрилонитрил.
28. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, содержит нефункционализированный полимер.
29. Способ по п. 28, отличающийся тем, что клей, склеивающий при надавливании, содержит нефункционализированный акрилатный полимер.
30. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, содержит карбокси- или гидрокси-функционализированный полимер.
31. Способ по п. 30, отличающийся тем, что клей, склеивающий при надавливании, содержит карбокси-функционализированный полимер.
32. Способ по п. 31, отличающийся тем, что клей, склеивающий при надавливании, содержит карбокси-функционализированный акрилатный полимер.
33. Способ по п. 39, отличающийся тем, что клей, склеивающий при надавливании, содержит гидрокси-функционализированный полимер.
34. Способ по п. 33, отличающийся тем, что клей, склеивающий при надавливании, содержит гидрокси-функционализированный акрилатный полимер.
35. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, содержит смесь гидрокси-функционализированного полимера и карбокси-функционализированного полимера.
36. Способ по п. 35, отличающийся тем, что клей, склеивающий при надавливании, содержит смесь гидрокси-функционализированного акрилатного полимера и карбокси-функционализированного акрилатного полимера.
37. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, выбран из группы, состоящей из Duro-Tak® 87-9301, Duro-Tak®87-2353, Duro-Tak®87-2510, Duro-Tak®87-2516 и Duro-Tak®87-4287, Duro-Tak®87-2052, Duro-Tak®87-2194, Duro-Tak®87-2677, Duro-Tak®87-201 A, Duro-Tak®87-2979 и Duro-Tak®87-2074, или представляет собой практически то же самое.
38. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, содержит поперечно сшитый поливинилпирролидон, или поперечно сшитую полиакриловую кислоту, или их комбинации.
39. Способ по п. 1, отличающийся тем, что устройство для трансдермальной доставки содержит однослойный матрикс, содержащий композицию на основе дексмедетомидина, причем однослойный матрикс разработан с возможностью доставлять неседативное количество дексмедетомидина субъекту.
40. Способ по п. 1, отличающийся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять 30% или более дексмедетомидина в композиции на основе дексмедетомидина.
41. Способ по п. 1, отличающийся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять 50% или более дексмедетомидина в композиции на основе дексмедетомидина.
42. Способ по п. 1, отличающийся тем, что количество дексмедетомидина в композиции составляет 3% масс. или менее.
43. Способ по п. 1, отличающийся тем, что композиция на основе дексмедетомидина состоит из дексмедетомидина и клея, склеивающего при надавливании.
44. Устройство для трансдермальной доставки для лечения боли у субъекта, которое содержит: композицию на основе дексмедетомидина, составленную так, чтобы доставлять субъекту эффективное для обезболивания количество дексмедетомидина, причем композиция на основе дексмедетомидина содержит: дексмедетомидин; и
клей, склеивающий при надавливании; и защитный слой.
45. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что композиция на основе дексмедетомидина составлена так, чтобы доставлять субъекту дексмедетомидин в течение 6 часов или более.
46. Устройство для трансдермальной доставки по п. 45, отличающееся тем, что композиция на основе дексмедетомидина составлена так, чтобы доставлять субъекту дексмедетомидин в течение 1 дня или более.
47. Устройство для трансдермальной доставки по п. 46, отличающееся тем, что композиция на основе дексмедетомидина составлена так, чтобы доставлять субъекту дексмедетомидин в течение 7 дней или более.
48. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что количество дексмедетомидина в композиции составляет 20% масс.или менее.
49. Устройство для трансдермальной доставки по п. 48, отличающееся тем, что количество дексмедетомидина в композиции составляет 10% масс.или менее.
50. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что композиция на основе дексмедетомидина содержит количество дексмедетомидина, соответствующее насыщению.
51. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что композиция на основе дексмедетомидина содержит количество дексмедетомидина, соответствующее перенасыщению.
52. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту неседативное количество дексмедетомидина со скоростью от около 10 мкг/сутки до около 1000 мкг/сутки.
53. Устройство для трансдермальной доставки по п. 52, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту неседативное количество дексмедетомидина со скоростью от около 145 мкг/сутки до около 300 мкг/сутки.
54. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять дексмедетомидин таким образом, чтобы поддерживать среднюю концентрацию дексмедетомидина в плазме субъекта в интервале от около 0,01 нг/мл до около 0,4 нг/мл.
55. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту неседативное количество дексмедетомидина.
56. Устройство для трансдермальной доставки по п. 55, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту дексмедетомидин таким образом, чтобы показатель шкалы Рамсея для субъекта составлял не более 2 или 3 баллов.
57. Устройство для трансдермальной доставки по п. 56, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту дексмедетомидин таким образом, чтобы показатель шкалы Рамсея составлял не более 2 баллов.
58. Устройство для трансдермальной доставки по п. 56, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту дексмедетомидин таким образом, чтобы показатель шкалы Рамсея составлял не более 3 баллов.
59. Устройство для трансдермальной доставки по п. 56, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту седативное количество дексмедетомидина.
60. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту 30% или более дексмедетомидина в течение длительного периода времени.
61. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что устройство для трансдермальной доставки выполнено с возможностью доставлять субъекту 90% или более дексмедетомидина в течение длительного периода времени.
62. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что клей, склеивающий при надавливании, содержит виниловый полимер.
63. Устройство для трансдермальной доставки по п. 62, отличающееся тем, что виниловый полимер выбран из группы, состоящей из полиэтилена, полипропилена, полиизобутилена, полибутена, полистирола, поливинилхлорида, поливинилацетата, поливинилового спирта и кремнийорганических соединений.
64. Устройство для трансдермальной доставки по п. 63, отличающееся тем, что клей, склеивающий при надавливании, содержит полиизобутилен, или полибутен, или их комбинации.
65. Устройство для трансдермальной доставки по п. 64, отличающееся тем, что клей, склеивающий при надавливании, содержит насыщенный полибутен.
66. Устройство для трансдермальной доставки по п. 64, отличающееся тем, что клей, склеивающий при надавливании, содержит ненасыщенный полибутен.
67. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что клей, склеивающий при надавливании, содержит акриловый полимер, акрилатный полимер, сополимер акрилата и винилацетата, или полиакрилонитрил, или их смеси.
68. Устройство для трансдермальной доставки по п. 67, отличающееся тем, что клей, склеивающий при надавливании, содержит нефункционализированный полимер.
69. Устройство для трансдермальной доставки по п. 68, отличающееся тем, что клей, склеивающий при надавливании, содержит нефункционализированный акрилатный полимер.
70. Устройство для трансдермальной доставки по п. 67, отличающееся тем, что клей, склеивающий при надавливании, содержит карбокси- или гидрокси-функционализированный полимер или их комбинации.
71. Устройство для трансдермальной доставки по п. 70, отличающееся тем, что клей, склеивающий при надавливании, содержит карбокси-функционализированный полимер.
72. Устройство для трансдермальной доставки по п. 71, отличающееся тем, что клей, склеивающий при надавливании, содержит карбокси-функционализированный акрилатный полимер.
73. Устройство для трансдермальной доставки по п. 70, отличающееся тем, что клей, склеивающий при надавливании, содержит гидрокси-функционализированный полимер.
74. Устройство для трансдермальной доставки по п. 73, отличающееся тем, что клей, склеивающий при надавливании, содержит гидрокси-функционализированный акрилатный полимер.
75. Устройство для трансдермальной доставки по п. 67, отличающееся тем, что клей, склеивающий при надавливании, содержит смесь гидрокси-функционализированного полимера и карбокси-функционализированного полимера.
76. Устройство для трансдермальной доставки по п. 67, отличающееся тем, что клей, склеивающий при надавливании, содержит смесь гидрокси-функционализированного акрилатного полимера и карбокси-функционализированного акрилатного полимера.
77. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что клей, склеивающий при надавливании, выбран из группы, состоящей из Duro-Tak® 87-9301, Duro-Tak®87-2353, Duro-Tak®87-2510, Duro-Tak®87-2516, Duro-Tak®87-4287, Duro-Tak®87-2287, Duro-Tak®87-2052, Duro-Tak®87-2194, Duro-Tak®87-2677, Duro-Tak®87-201A, Duro-Tak®87-2979 и Duro-Tak®87-2074, или представляет собой практически то же самое.
78. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что клей, склеивающий при надавливании, содержит поперечно сшитый поливинилпирролидон или поперечно сшитую полиакриловую кислоту.
79. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что композиция на основе дексмедетомидина содержит поливинилпирролидон, ПВП К90, левулиновую кислоту, олеиновую кислоту, ПГМЛ, лауриллактат или их смеси.
80. Устройство для трансдермальной доставки по п. 44, которое содержит однослойную матриксную композицию на основе дексмедетомидина.
81. Устройство для трансдермальной доставки по п. 44, отличающееся тем, что композиция на основе дексмедетомидина состоит из дексмедетомидина и клея, склеивающего при надавливании.
82. Набор, содержащий:
два или более устройств для трансдермальной доставки, причем каждое устройство для трансдермальной доставки содержит: композицию на основе дексмедетомидина, которая составлена так, чтобы доставлять субъекту эффективное для обезболивания количество дексмедетомидина, при этом композиция на основе дексмедетомидина содержит: дексмедетомидин; клей, склеивающий при надавливании; и защитный слой.
Хотя вышеприведенное изобретение было описано довольно подробно посредством иллюстраций и примеров с целью ясности понимания, специалистам в данной области должно быть очевидно, что в рамках идей данного изобретения могут быть осуществлены определенные изменения и модификации без отклонения от сущности и объема прилагаемой формулы изобретения.
Таким образом, приведенное выше всего лишь иллюстрирует принципы изобретения. Следует отметить, что специалисты в данной области техники могут разработать различные схемы, которые, хотя отдельно не описаны и не показаны в данном документе, воплощают собой принципы изобретения и находятся в рамках его сущности и объема. Кроме того, все примеры и условные конструкции, используемые в данном документе, предназначены, главным образом, для того, чтобы помочь читателю понять принципы изобретения и направления исследований, в которые исследователи внесли вклад для развития области техники, и их не следует истолковывать, как ограничивающие до таких конкретно указанных примеров и условий. Более того, предполагается, что все заявленные в данном документе принципы, аспекты и варианты реализации изобретения, а также конкретные их примеры. охватывают их структурные и функциональные эквиваленты. Дополнительно предполагается, что такие эквиваленты включают как эквиваленты, известные в настоящий момент, так и эквиваленты, которые будут разработаны в будущем, т.е. любые разработанные элементы, которые выполняют такие же функции, вне зависимости от структуры. Поэтому предполагается, что настоящее изобретение не ограничено иллюстративными вариантами реализации, представленными и описанными в данном документе. Объем и сущность настоящего изобретения скорее определяется прилагаемой формулой изобретения.
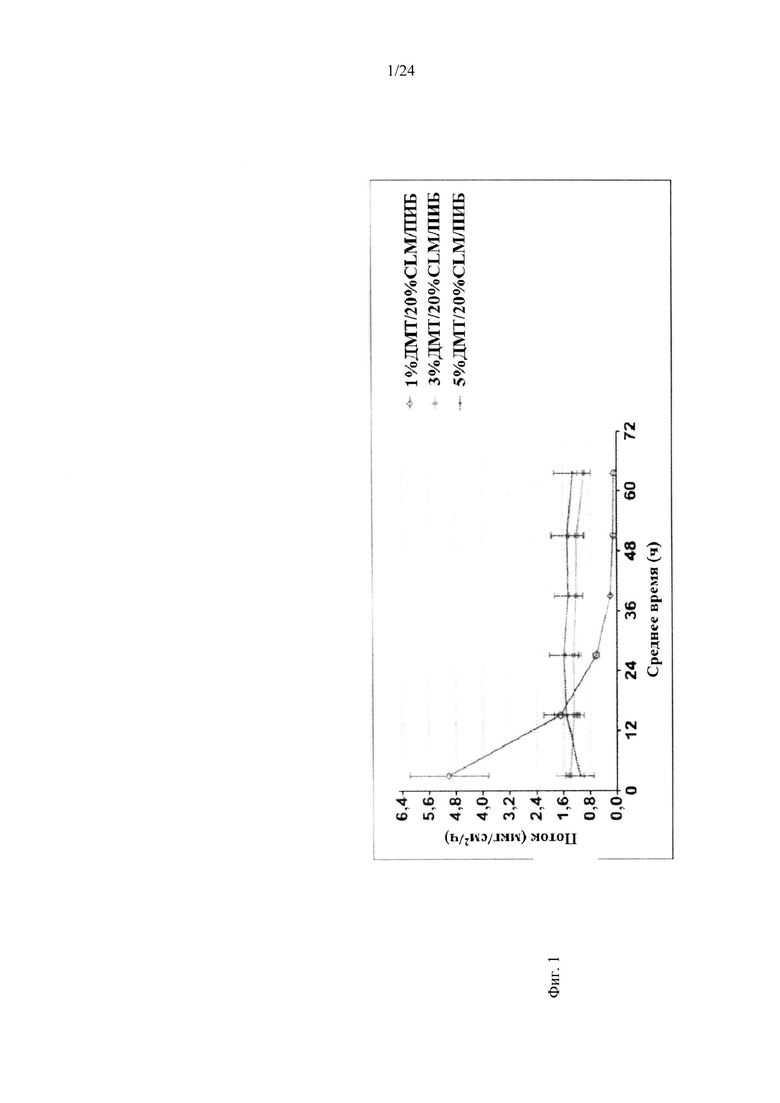
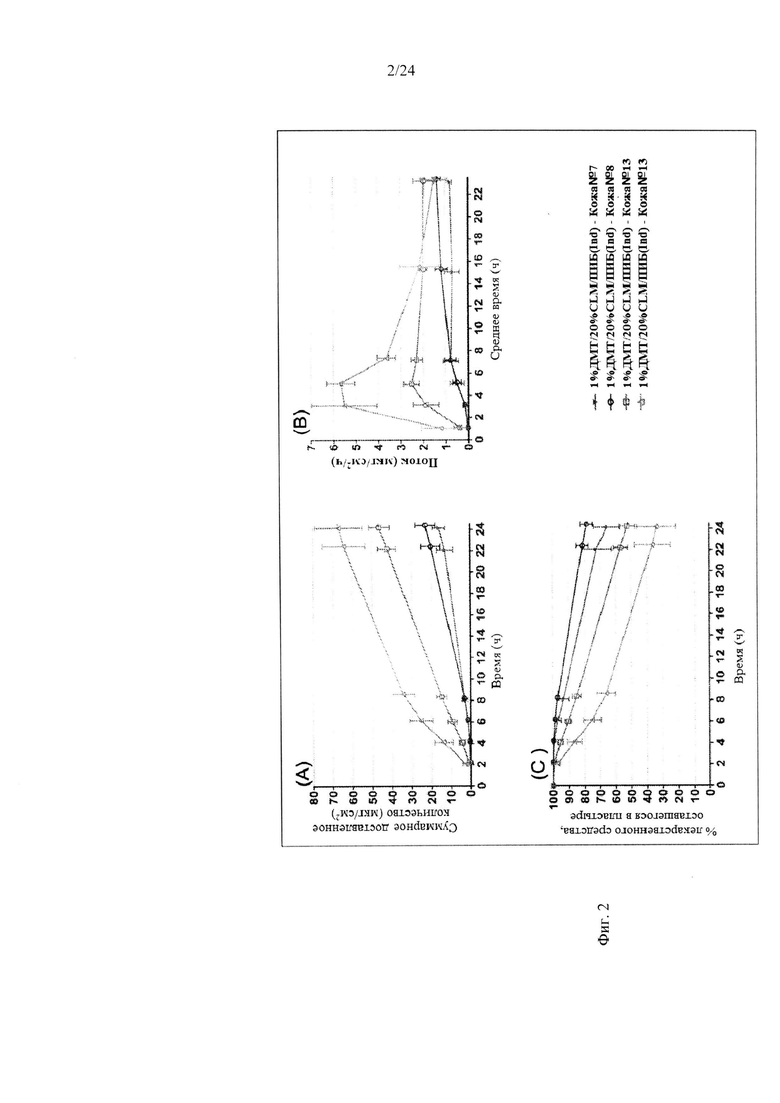

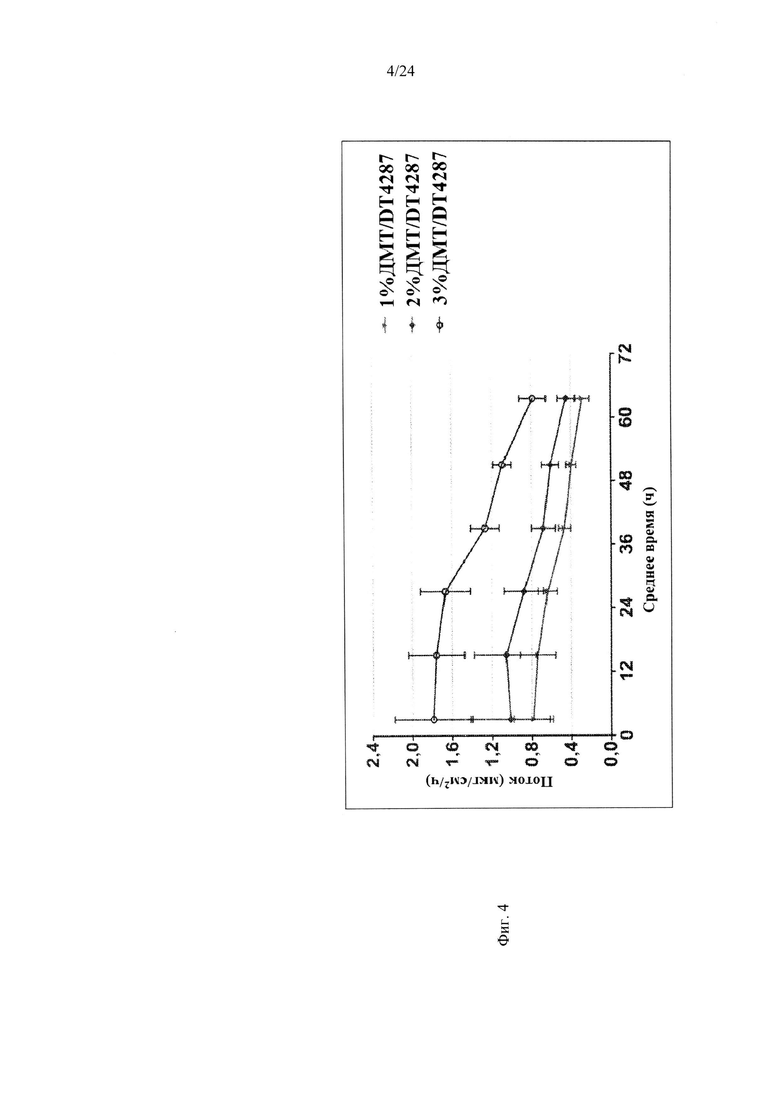
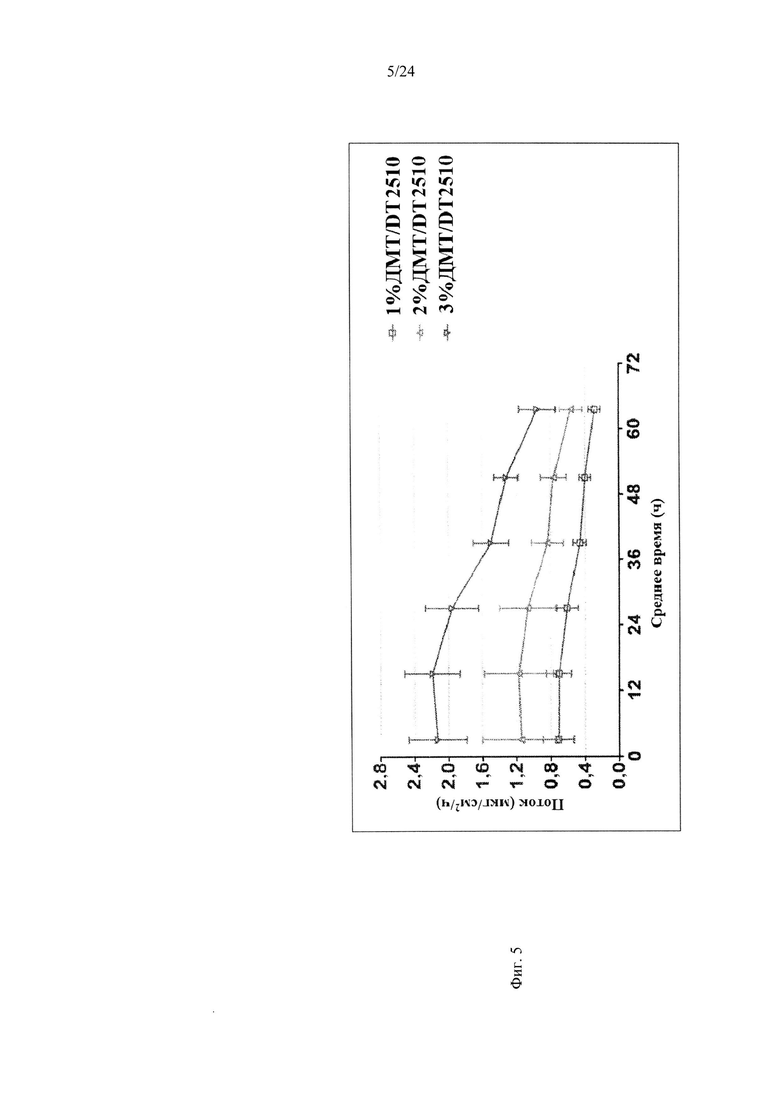
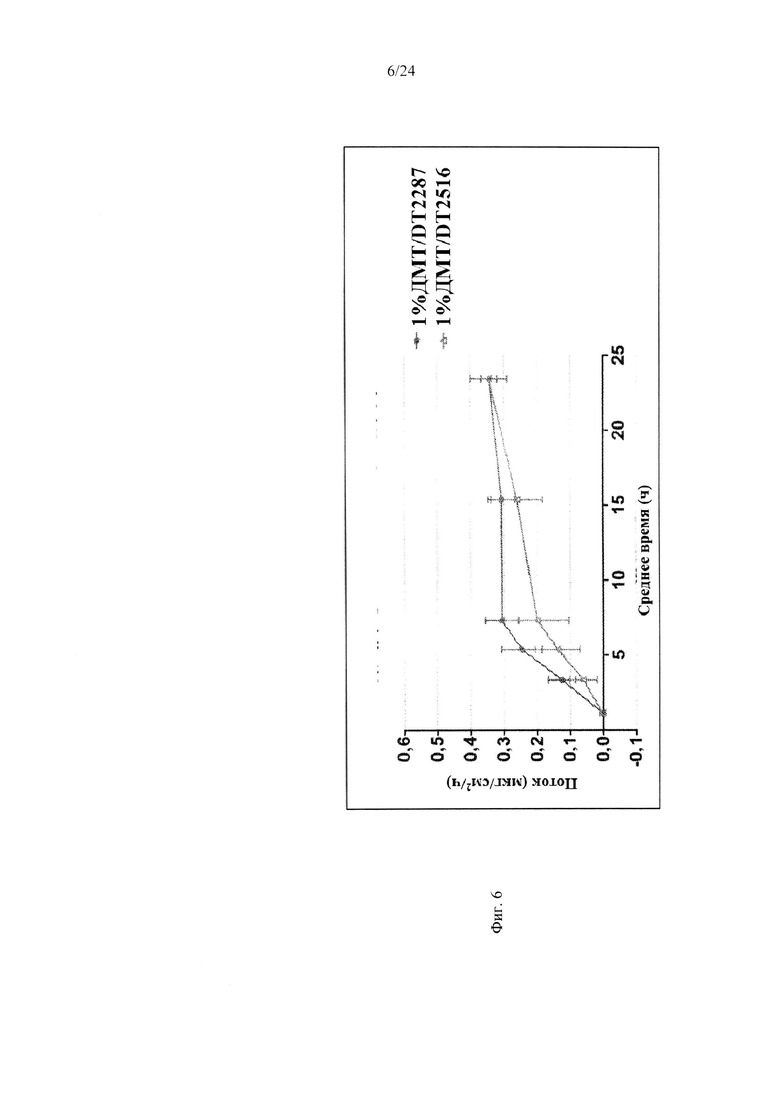
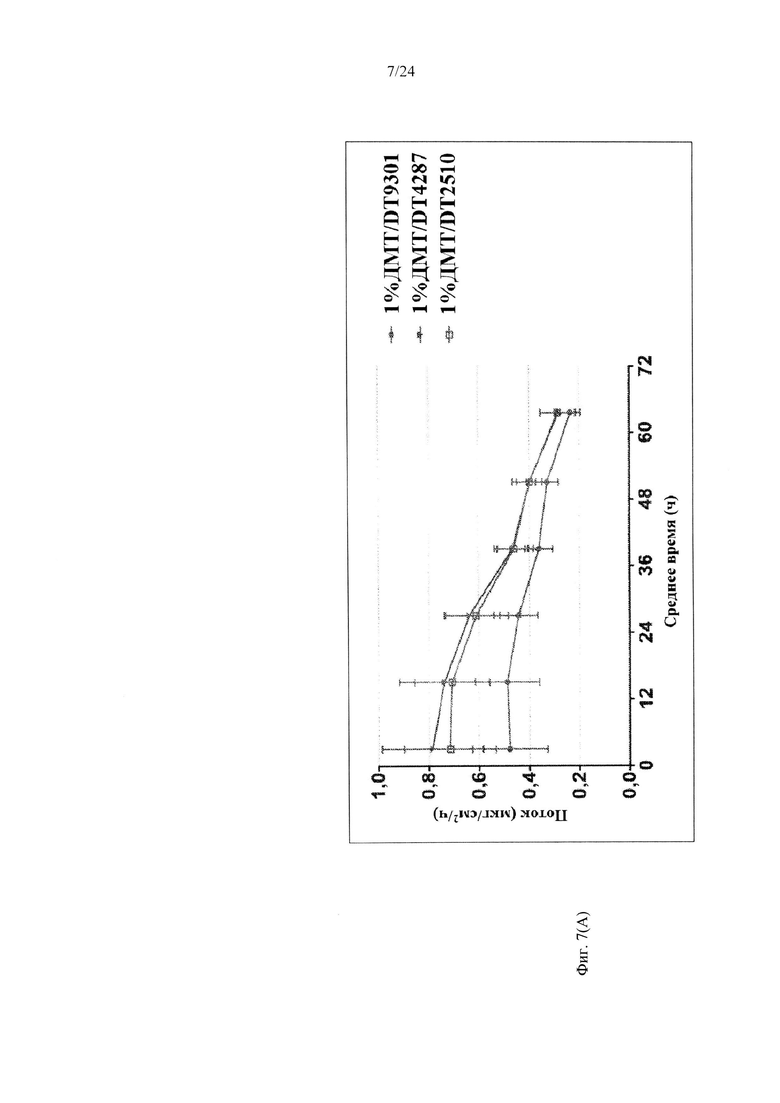
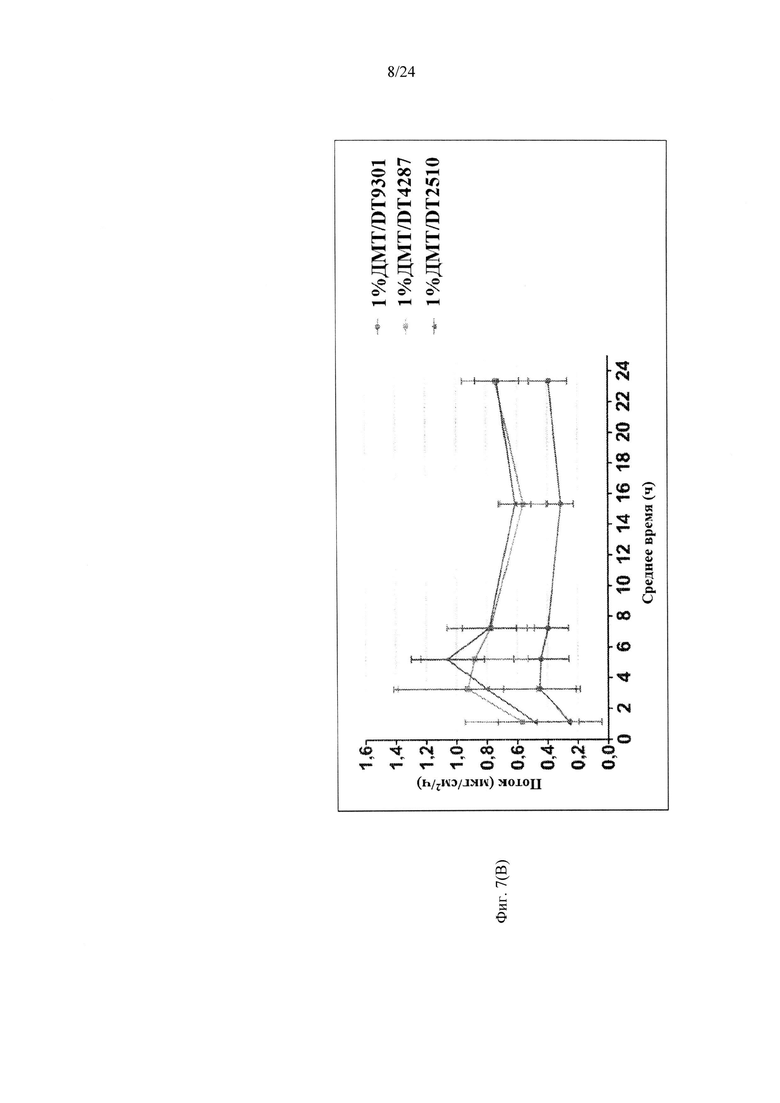
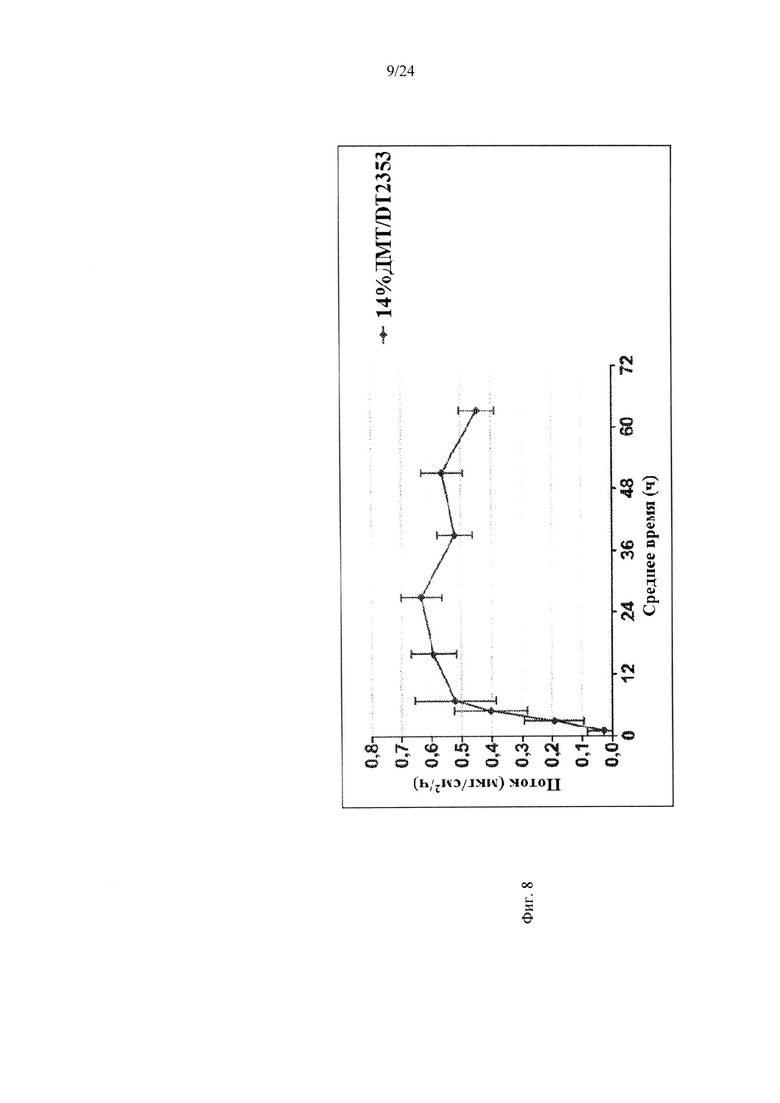

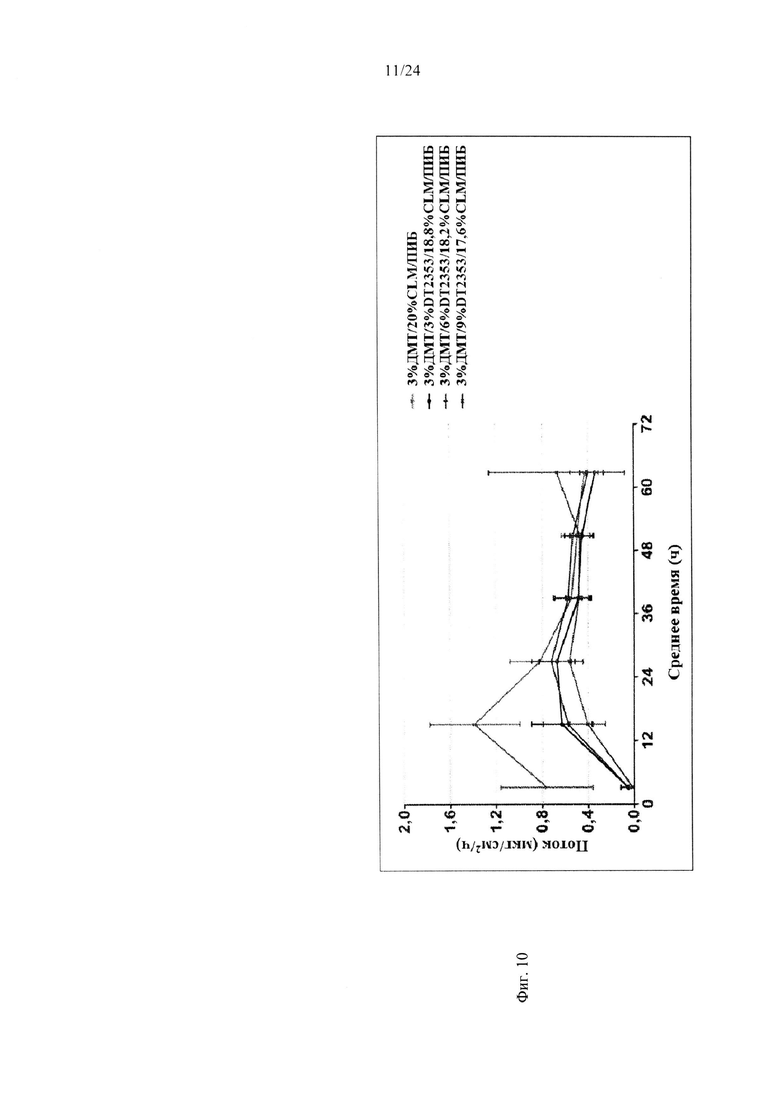

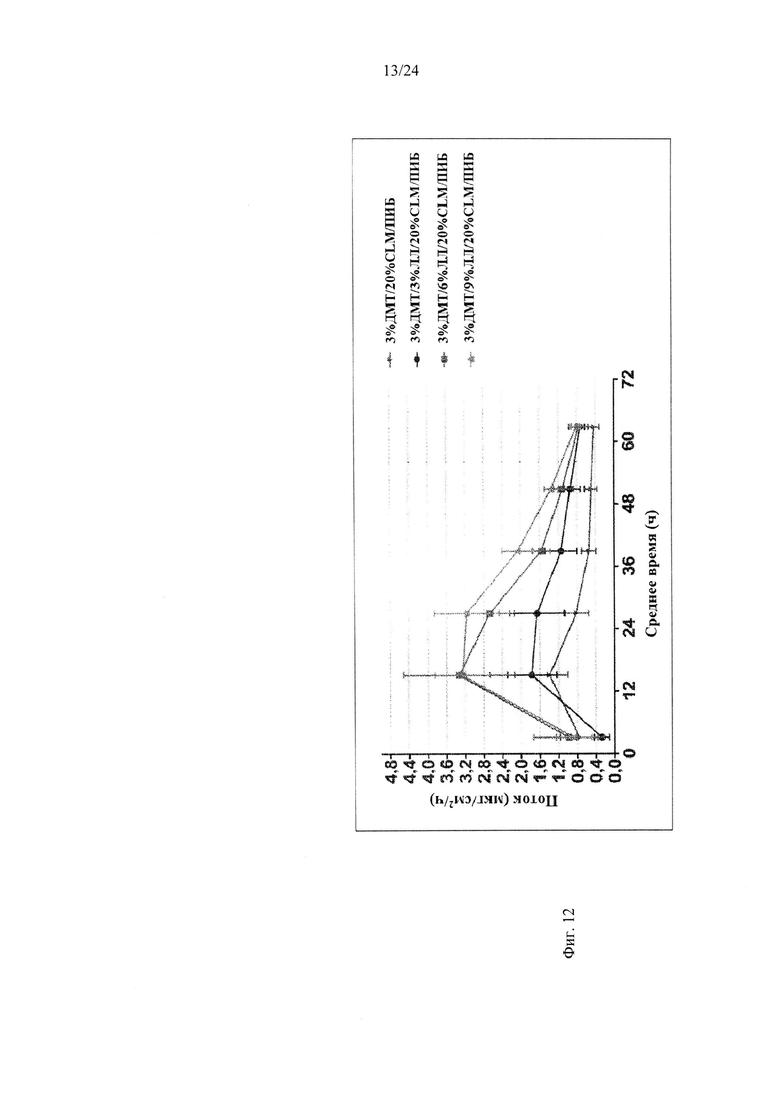
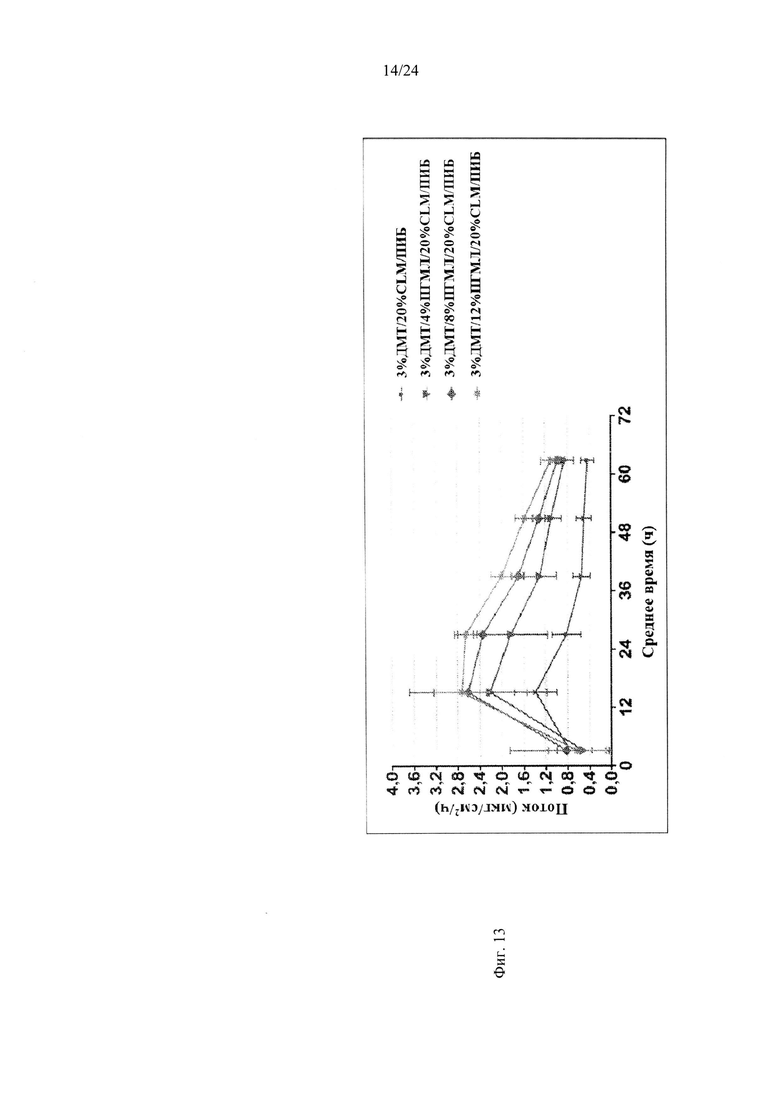
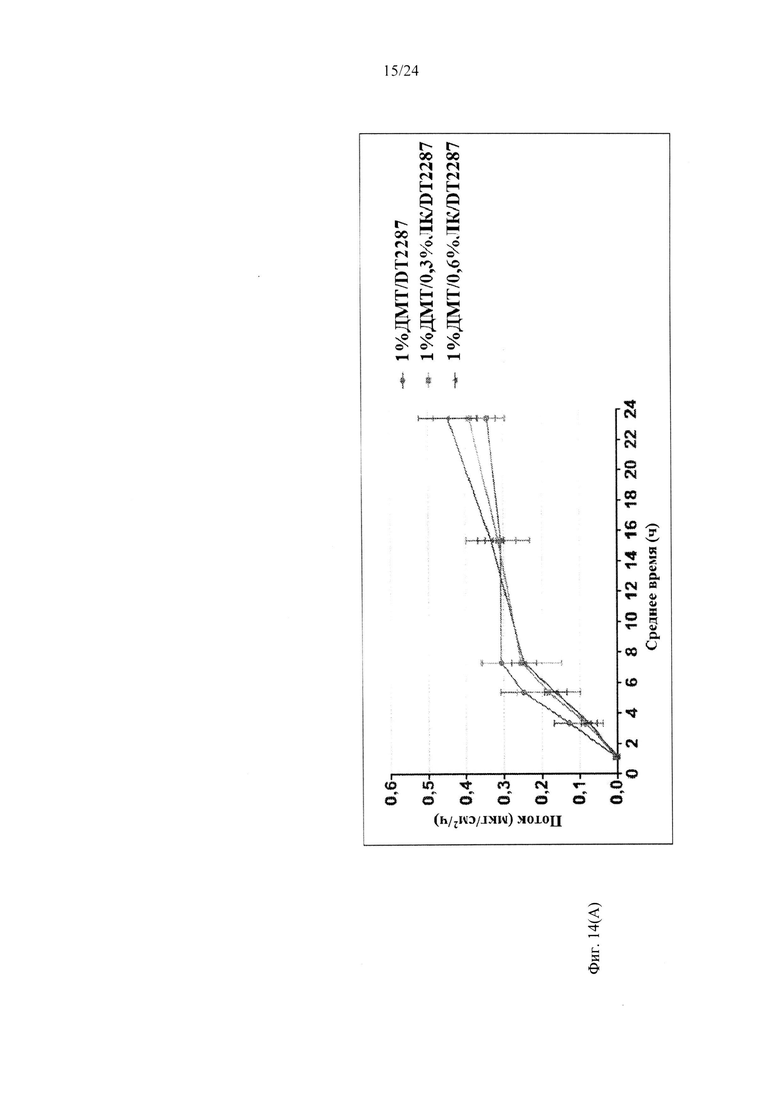

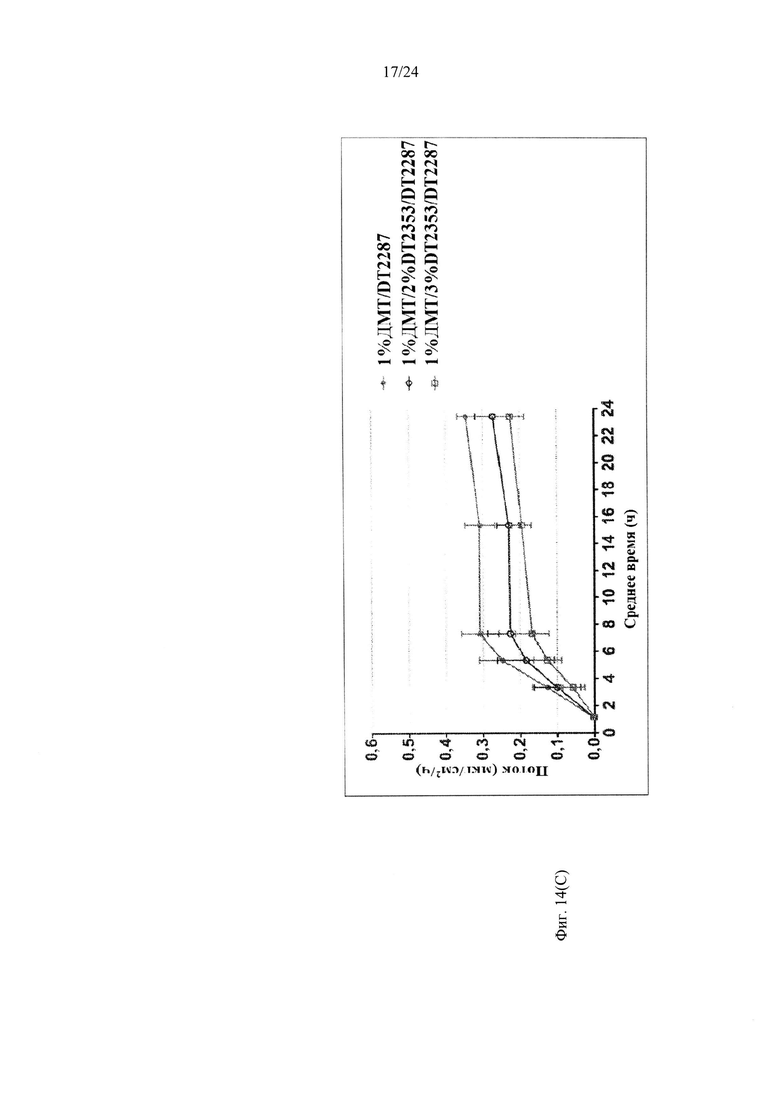
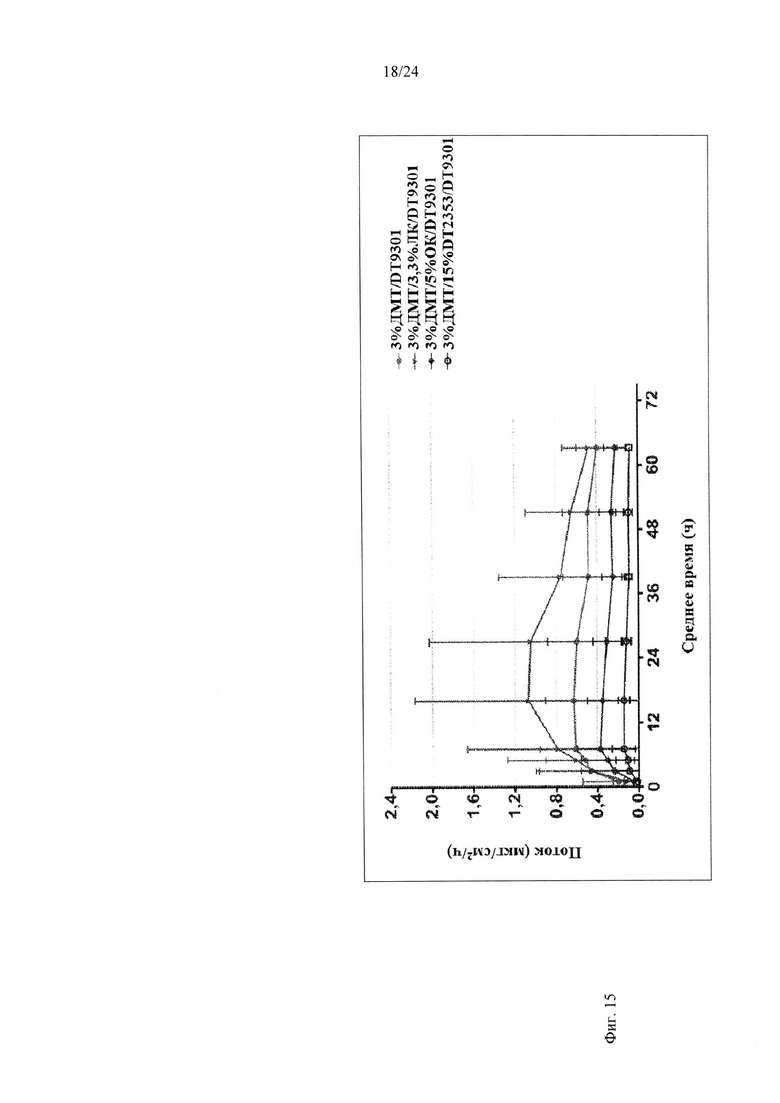
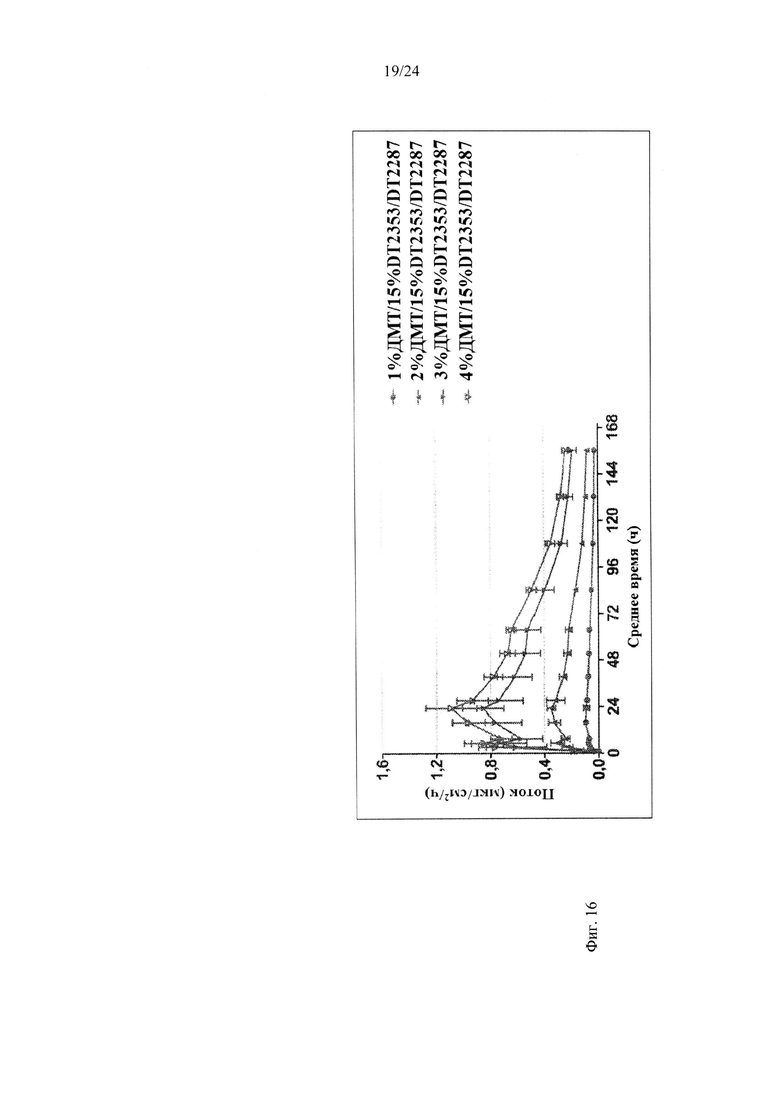

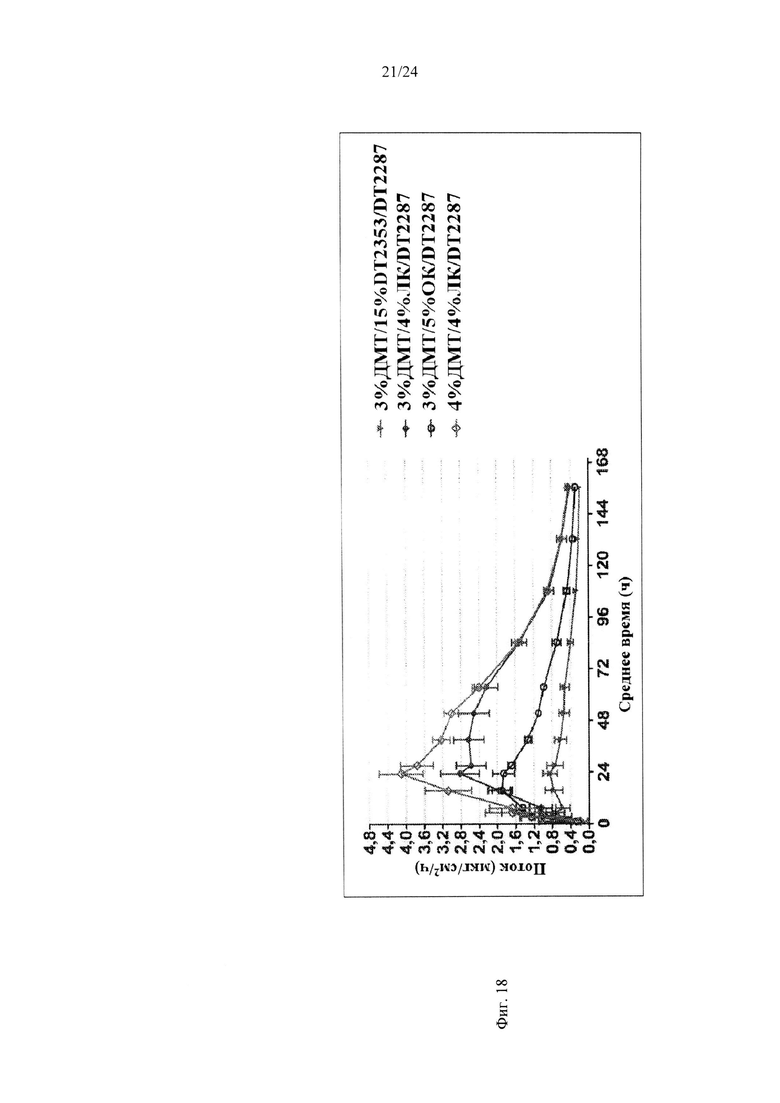
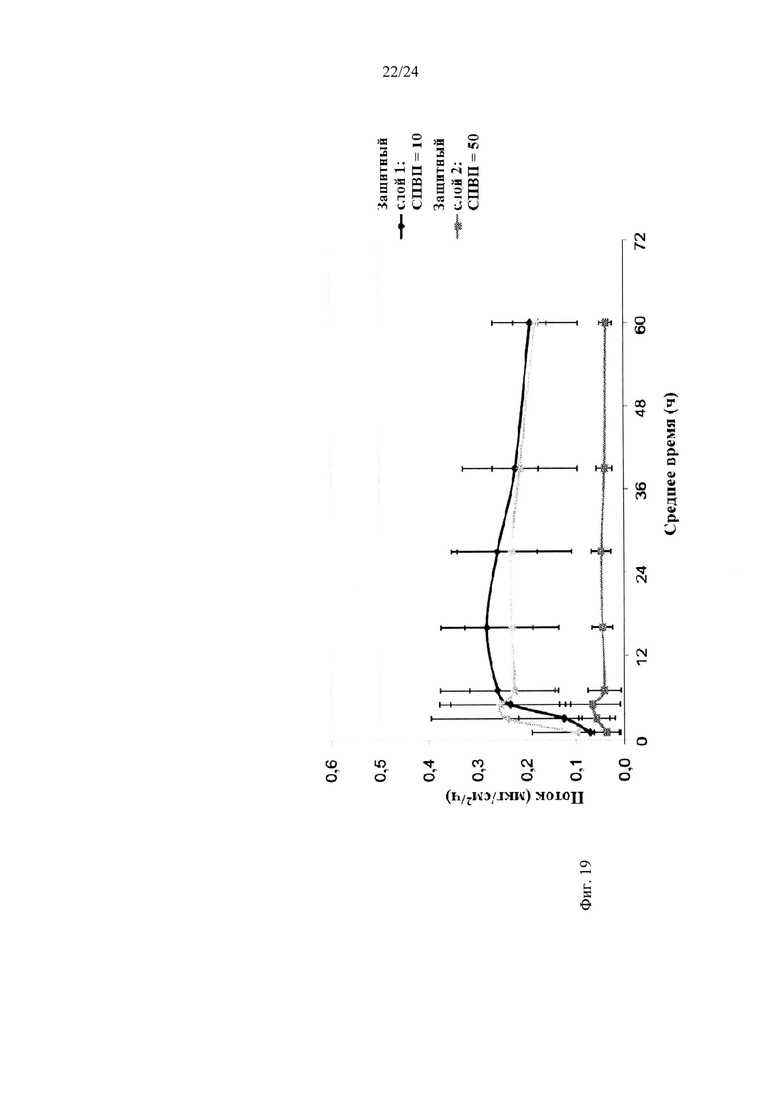
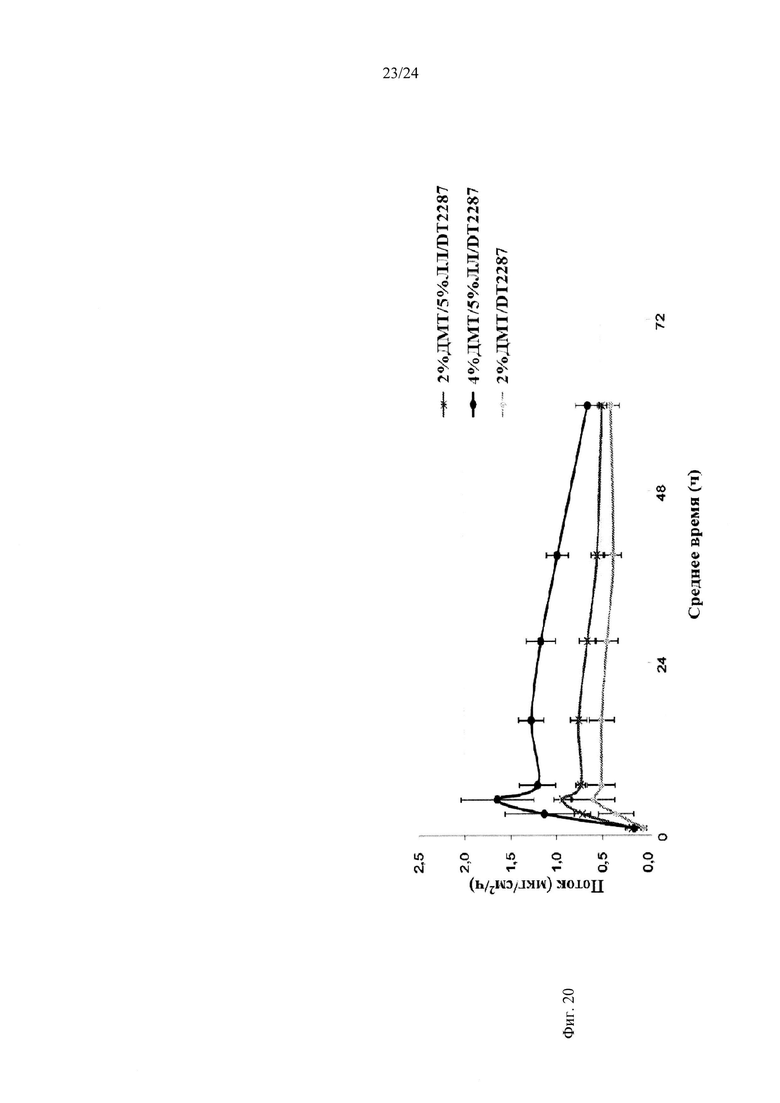
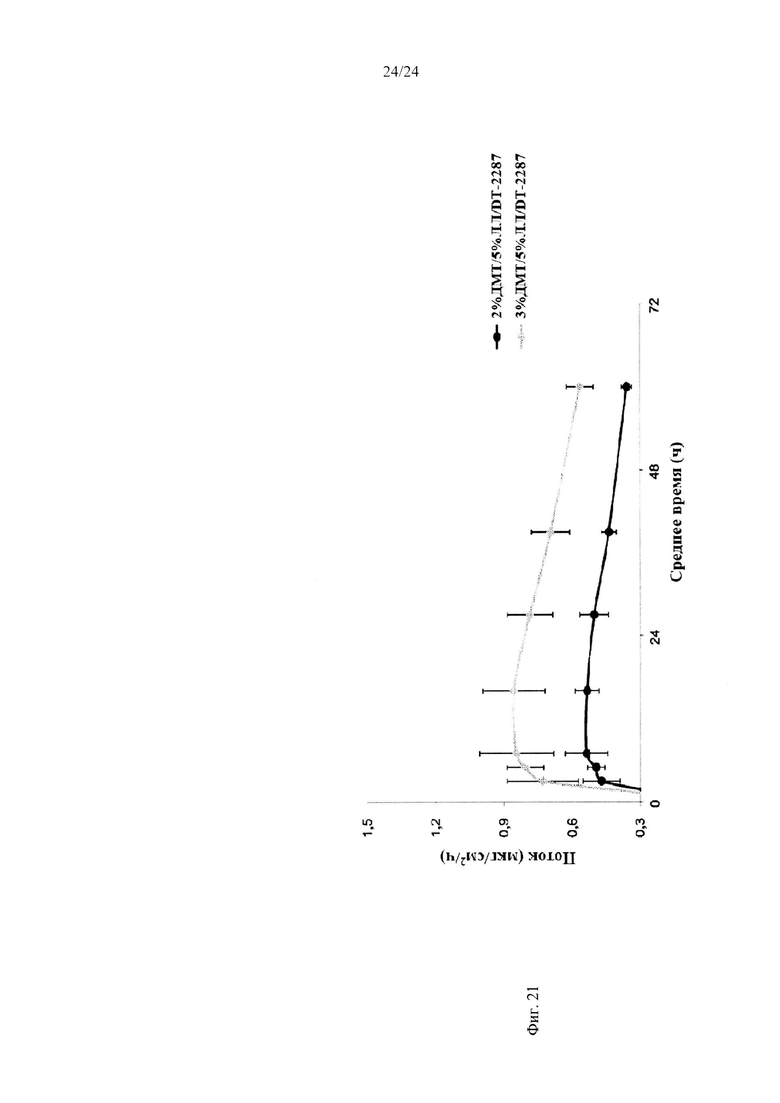
Группа изобретений относится к медицине, а именно к неврологии, и может быть использована для лечения боли у субъекта. Для этого неседированному пациенту на поверхность кожи наносят устройство для трансдермальной доставки, состоящее из композиции на основе дексмедетомидина, содержащей дексмедетомидин, усилитель растворимости и акрилатный клей с гидроксильными функциональными группами, склеивающий при надавливании, и защитного слоя, в контакте с указанной композицией на основе дексмедетомидина, составленной так, чтобы пассивно доставлять эффективное для обезболивания количество дексмедетомидина субъекту, который испытывает боль. Также предложены устройство для трансдермальной доставки и набор, содержащий два или более устройств для трансдермальной доставки, с возможностью применения для лечения боли у субъекта. Группа изобретений позволяет пассивно доставить субъекту эффективное для обезболивания количество дексмедетомидина без значительной седации. 3 н. и 15 з.п. ф-лы, 24 ил., 22 табл., 14 пр.
1. Способ лечения боли у субъекта, включающий нанесение на поверхность кожи находящегося в неседированном состоянии субъекта, который испытывает боль, устройства для трансдермальной доставки, состоящего из:
композиции на основе дексмедетомидина, содержащей: дексмедетомидин; усилитель растворимости; и
акрилатный клей, склеивающий при надавливании, имеющий гидроксильные функциональные группы; и
защитного слоя в контакте с указанной композицией на основе дексмедетомидина, причем композиция на основе дексмедетомидина составлена так, чтобы пассивно
доставлять терапевтически эффективное количество дексмедетомидина, эффективное для лечения боли у субъекта.
2. Способ по п. 1, отличающийся тем, что боль выбрана из группы, состоящей из идиопатической боли, острой боли, симпатически опосредованной боли, боли, связанной с комплексным регионарным болевым синдромом, и невропатической боли и их комбинаций.
3. Способ по п. 2, отличающийся тем, что боль представляет собой невропатическую боль.
4. Способ по п. 3, отличающийся тем, что невропатическая боль связана с симпатической нервной системой.
5. Способ по п. 3, отличающийся тем, что невропатическая боль выбрана из группы, состоящей из боли, связанной с раковыми заболеваниями, послеоперационной боли, боли, связанной с инфекцией, боли, связанной с опоясывающим лишаем, и боли, связанной с ВИЧ-инфекцией.
6. Способ по п. 1, включающий доставку субъекту неседативного количества дексмедетомидина.
7. Способ по п. 6, включающий доставку субъекту неседативного количества дексмедетомидина в течение 1 дня или более.
8. Способ по п. 7, включающий доставку субъекту неседативного количества дексмедетомидина в течение 3 дней или более.
9. Способ по п. 8, включающий доставку субъекту неседативного количества дексмедетомидина в течение 7 дней или более.
10. Способ по любому из пп. 6-9, включающий доставку субъекту неседативного количества дексмедетомидина таким образом, чтобы показатель шкалы Рамсея для субъекта составлял не более 3 баллов.
11. Способ по п. 1, включающий доставку субъекту седативного количества дексмедетомидина.
12. Способ по п. 1, включающий доставку субъекту дексмедетомидина с помощью устройства для трансдермальной доставки со скоростью, которая изменяется от 5 мкг/сутки до 500 мкг/сутки.
13. Способ по п. 1, отличающийся тем, что клей, склеивающий при надавливании, содержит виниловый полимер.
14. Устройство для трансдермальной доставки, выполненное с возможностью применения в способе по любому из пп. 1-13.
15. Набор для лечения боли у субъекта, содержащий:
два или более устройств для трансдермальной доставки, выполненных с возможностью применения в способе по любому из пп. 1-13.
16. Способ по п. 1, причем усилитель растворимости представляет собой соединение, выбранное из группы, состоящей из лауриллактата, пропиленгликольмонолаурата, линолевой кислоты, олеиновой кислоты, линоленовой кислоты, стеариновой кислоты, изостеариновой кислоты, левулиновой кислоты, пальмитиновой кислоты, октановой кислоты, декановой кислоты, додекановой кислоты, тетрадекановой кислоты, гексадекановой кислоты, N-лауроилсаркозина, L-пироглутаминовой кислоты, лауриновой кислоты, янтарной кислоты, пировиноградной кислоты, глутаровой кислоты, себациновой кислоты и циклопентанкарбоновой кислоты.
17. Способ по п. 16, причем соединение представляет собой лауриллактат.
18. Способ по п. 16, причем соединение представляет собой левулиновую кислоту.
| WO 2011085162 A2, 14.07.2011 | |||
| 1972 |
|
SU413487A1 | |
| Прибор для склеивания кинофильмов | 1927 |
|
SU14504A1 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ БЕНЗАМИДА И ИНГИБИТОР АКТИВНОСТИ ПОДТИПА 1 РЕЦЕПТОРА ВАНИЛЛОИДА (VR1) | 2005 |
|
RU2392278C2 |
| КАРЛОВ В.А | |||
| Терапия нервных болезней// М., 1996, с.607-612 | |||
| WU F | |||
| et al | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
Авторы
Даты
2018-05-22—Публикация
2014-10-03—Подача