Изобретение относится к области медицины и может быть использовано для улучшения адаптации организма к изменению суточных (циркадианных) ритмов, вызванному нарушением режима дня, недостатком сна, сменой часовых поясов и другими десинхронизирующими факторами - для улучшения самочувствия, повышения работоспособности, устранения симптомов стресса, коррекции нарушений сна и других нарушений, характерных для состояний десинхроноза.
Как известно, нарушение биологических ритмов (или так называемый десинхроноз) является широко распространенной проблемой в жизни современного человека. Изучение десинхронозов и разработка методов их коррекции является одной из главных задач хронобиологии, возникшей как самостоятельное научное направление в конце 60-х годов 20-го века [Оранский И.Е., Царфис П.Г. Биоритмология и хронотерапия (хронобиология и хронобальнеофизиотерапия). - М., 1989. - 159 с.]. Десинхронозы могут вызываться сменой географических поясов, пребыванием в условиях заполярья, неритмичным режимом работы, недостатком сна, переутомлением, повышенным уровнем стресса и многими другими причинами. Типичные проявления десинхроноза - нарушения сна (бессонница, затрудненное засыпание, беспокойный сон), а в период бодрствования - плохое самочувствие, особенно по утрам, снижение умственной и физической работоспособности, ощущение разбитости, подавленности. При этом, помимо субъективного дискомфорта, подобные состояния сопровождаются снижением общего адаптационного статуса организма, повышается риск инфекционных, сердечно-сосудистых заболеваний, возрастает нагрузка на нервную систему [Хронобиология и хрономедицина / Под ред. Ф.И. Комарова. - М.: Медицина, 1989. - 401 с].
Очень часто десинхронозы приобретают хроническую форму и в этом случае они служат источниками других, более серьезных заболеваний. Считается, что возникновение многих хронических болезней, таких как гипертоническая болезнь, атеросклероз, диабет, депрессии и т.д. в значительной степени связано с нарушениями естественных биоритмов.
Нарушение циркадианного ритма приводит к эндокринным нарушениям, сопровождающимся снижением репродуктивной функции, патологии углеводного и липидного обмена. Установлено, что нарушение светового режима приводит к развитию метаболического синдрома, сопровождающегося снижением толерантности к глюкозе и чувствительности к инсулину, ожирением, увеличением содержания холестерина и его атерогенных фракций. Воздействие постоянного света приводит к активации перекисного окисления липидов, снижению активности супероксиддисмутазы и общей антиокислительной активности. Как следствие происходит увеличение повреждений ДНК и нестабильности генома, что приводит к преждевременному старению и активации канцерогенеза.
В связи с этим в последнее десятилетие активно прорабатываются хронобиологические проблемы и возможности их коррекции, в том числе фармакологической.
Для лечения десинхронозов и улучшения самочувствия при нарушении суточных ритмов используется несколько подходов. Достаточно распространенной является чисто симптоматическая терапия, когда в ночное время для улучшения сна пациенты принимают снотворные средства, а в период бодрствования - препараты стимулирующего действия. Недостатки этого подхода очевидны - как снотворные, так и стимулирующие средства обладают побочными эффектами и вызывают зависимость, не устраняя при этом эндогенных нарушений.
Другой, более современный и более безопасный для организма человека подход основан на использовании хронобиотиков - средств, которые так или иначе способствуют гармонизации биоритмов.
Хронобиотики подразделяются на два основных подкласса: D-хронобиотики (от лат. diurnal - дневной) и N-хронобиотики (от лат. nocturnal - ночной). При этом D-хронобиотики регулируют преимущественно активную (дневную) фазу биологических ритмов, а N-хронобиотики - релаксационную (ночную) фазу. Некоторые исследователи дополнительно выделяют еще один класс - С-хронобиотики, которые одновременно регулируют обе фазы биоритмов [Оранский И.Е., Царфис П.Г. Биоритмология и хронотерапия (хронобиология и хронобальнеофизиотерапия). - М., 1989. - 159 с.].
К средствам для лечения десинхронозов можно отнести:
- препараты на основе мелатонина и его аналогов (агонистов MT1 и МТ2 - рецепторов), таких как рамелтеон [Roth Т, Seiden D, Sainati S, Wang-Weigand S, Zhang J, Zee P. Sleep Med 2006; 7: 312-18], тасимелтион [Rajaratnam SM, Polymeropoulos MH, Fisher DM, Lancet 2009; 373: 482-91] и агомелатин [Dubovsky SL, Warren C. Expert Opin Investig Drugs 2009; 18: 1533-40];
- пептидные нейрорегуляторы, такие как дельта-сон индуцирующий пептид (ДСИП), АГАТ;
- микстура Павлова и ее аналоги;
- препараты на основе витаминов, микроэлементов;
- растительные хронобиотики, присутствующие в таких источниках, как левзея, дягиль, хвоя пихты, зеленый чай, кофейное дерево, элеутерококк (D-хронобиотики) и валериана, душица, хмель, мята перечная, пион (N-хронобиотики) [Хронобиология и хрономедицина / Под ред. Ф.И. Комарова. - М.: Медицина, 1989. - 401 с.].
Из перечисленных средств наибольшее внимание в настоящий момент уделяется мелатонину - гормону, который синтезируется в головном мозгу человека и животных и играет важную роль в регуляции биоритмов [von Gall С, Stehle JH, Weaver DR. Cell Tissue Res 2002; 309: 151-62]. Мелатонин в составе лекарственных средств и биологически активных добавок является естественным регулятором суточного ритма человека, который обеспечивает быстрое засыпание, качественный сон и комфортное пробуждение.
При нарушениях временной адаптации (например, во время путешествий, когда возникает джетлаг - синдром резкой смены часовых поясов) мелатонин способен корректировать суточные ритмы организма и регулировать естественный цикл сон-бодрствование [Машковский М.Д. Лекарственные средства, 16-е издание, «Новая Волна» - 2012, 1216 с.]. Препарат облегчает засыпание в непривычное время, нормализует ночной сон, ускоряя засыпание и снижая частоту ночных пробуждений. Помимо этого препарат улучшает самочувствие после утреннего пробуждения, снимая ощущения усталости, вялости и разбитости после сна, устраняет дневную сонливость. Таким образом мелатонин, не являясь ни снотворным, ни стимулятором, оказывает хронобиотическое действие, то есть обладает свойствами корректора биоритмов, облегчающего адаптацию внутренних хронометрических механизмов организма к внешним условиям. С одной стороны, мелатонин в условиях десинхроноза облегчает переход в режим сна в нужное время, восстанавливает нарушенный сон, а с другой стороны - улучает состояние в период бодрствования [Buscemi, N. et al. (2004). U.S. Department of Health & Human Services, Agency for Healthcare Research and Quality. 2010-05-25].
Значительное число химических аналогов и производных мелатонина запатентовано в качестве средств для лечения десинхронизационных нарушений [Флаф М.Э., патент РФ 2160101, опуб. 10.12.2000].
Вместе с тем, как лекарственный препарат мелатонин обладает рядом недостатков. Известна его низкая биодоступность: при пероральном приеме мелатонин практически не усваивается из пищевых продуктов [Webley G.Е., 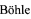 A., Leidenberger F.A. Journal of pineal research. - 1988. - Т. 5. - №. 1. - С. 19-33]. С этим связано, очевидно, и медленное наступление эффекта при использовании мелатонина в пероральных формах. Кроме того, при использовании мелатонина для повышения активности в период бодрствования его эффективность оставляет желать лучшего. Также отмечается, что наряду с хронобиотическими эффектами мелатонин снижает уровень бдительности и нейрокогнитивные функции, уменьшает температуру тела, в ряде случаев повышает потребность заснуть. Такие свойства желательны в ночное время, но могут рассматриваться как побочные эффекты, если мелатонин применяется в дневное время.
A., Leidenberger F.A. Journal of pineal research. - 1988. - Т. 5. - №. 1. - С. 19-33]. С этим связано, очевидно, и медленное наступление эффекта при использовании мелатонина в пероральных формах. Кроме того, при использовании мелатонина для повышения активности в период бодрствования его эффективность оставляет желать лучшего. Также отмечается, что наряду с хронобиотическими эффектами мелатонин снижает уровень бдительности и нейрокогнитивные функции, уменьшает температуру тела, в ряде случаев повышает потребность заснуть. Такие свойства желательны в ночное время, но могут рассматриваться как побочные эффекты, если мелатонин применяется в дневное время.
В качестве прототипа настоящего изобретения принят препарат мелатонин [Машковский М.Д. Лекарственные средства, 16-е издание, «Новая Волна» - 2012, 1216 с.].
Задачей настоящего изобретения является разработка средства для фармакологической коррекции и лечения состояний десинхроноза, обладающего большей эффективностью, чем мелатонин.
Согласно изобретению, заявляемое средство представляет собой производное с общей формулой:
где R выбран из группы:
1. COCH2CH2COOH,
2. COCH2NH2,
3. COCH2(NH2)CH2CH2COOH,
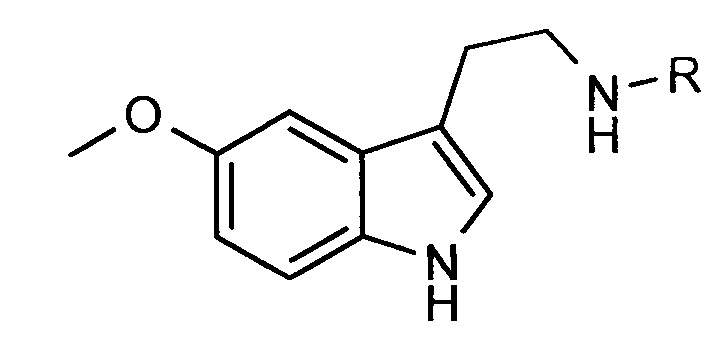
4. COCH2NHCOCH2(NH2)CH2CH2COOH,
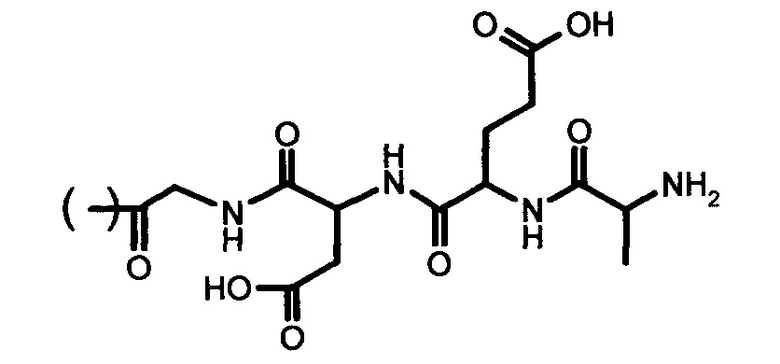
5. 
Заявленные вещества получают следующим образом.
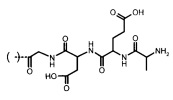
Пример 1. Получение 3-[2-(5-метокси-1H-3-индолил)этилкарбамоил]- пропановой кислоты 1 (Схема 1)
Растворяют 1,9 г (0.01 моль) 5-метокситриптамина в 6 мл диметилформамида. К полученному раствору добавляют г (0.015 моль) янтарного ангидрида и 1.01 г (0.01 моль) триэтиламина и перемешивали при 50°С 1 ч. Затем реакционную смесь охлаждают до комнатной температуры, разбавляли 20 мл воды и подкисляли НСl до рН 1. Выделившийся осадок отделяют на фильтре, промывают водой. Сырой продукт растворяют в водном растворе аммиака и высаживали добавлением НСl, осадок отфильтровывают, промывают водой и сушат на воздухе. Получают 2.44 г целевого продукта 1 в виде бесцветного кристаллического порошка с Тпл 129°С, выход 84% от теоретического.
Пример 2. Получение N1-[2-(5-метокси-1H-3-индолил)этил]-2-аминоацетамида 2 (Схема 2)
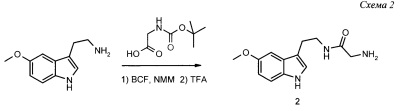
Растворяют 17.6 г (0.1 моль) N-t-бутоксикарбонилглицина в 90 мл безводного диметилформамида, к полученному раствору при -20°С добавляют 10 г (0.1 моль) N,-метилморфолина (NMM) и 0.1 моль трет-бутилхлорформиата (BCF) и выдерживают 30 мин. Затем, при перемешивании, добавляют 19 г (0.1 моль) 5-метокситриптамина и реакционную смесь перемешивают ч при -20°С, а затем еще 2 ч при 0°С. К полученному раствору приливают 1 мл трифторуксусной кислоты и выдерживают 1 ч при комнатной температуре. Затем реакционную смесь разбавляют 25 мл воды, фильтруют, охлаждают фильтрат до 0°С и подщелачивают аммиаком. Выделившийся осадок отделяют на фильтре и промывают водой. Сырой продукт растворяют в водном растворе муравьиной кислоты и высаживают добавлением аммиака, осадок отфильтровывают, промывают водой и сушат в вакуум-эксикаторе над КОН. Получают 17.9 г целевого продукта 2 в виде бесцветного кристаллического вещества с Тпл 122°С, выход 73% от теоретического.
Пример 3. Получение N-глутамил-5-метокситриптамина 3 (Схема 3)
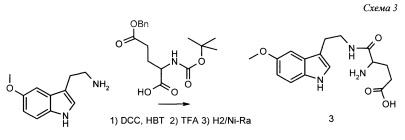
К раствору 19 г (0.1 моль) 5-метокситриптамина, 37.1 г (0,11 моль) γ-бензилового эфира N-Вос-L-глутаминовой кислоты и 16.9 г (0,11 моль) моногидрата N-гидроксибензотриазола (НВТ) в 200 мл диметилформамида при 0-5°С прикапывают раствор 25 г (0,12 моль) дициклогексилкарбодиимида (DCC) в 100 мл диметилформамида. Перемешивают 1 час при +5°С и затем 12 ч при комнатной температуре. Разбавляют реакционную массу 1 л воды и экстрагируют 0.5 л дихлорметана. Органическую фазу промывают водным раствором НСl 1%, водным гидрокарбонатом натрия, затем прибавляют к ней 11,4 г (0.1 моль) трифторуксусной кислоты (TFA) и выдерживают 30 мин. Полноту удаления ВОС-защиты контролируют ТСХ. Затем раствор промывают водным аммиаком, сушат сульфатом натрия и упаривают в вакууме. Остаток растворяют в 200 мл метанола, добавляют 5 г свежеприготовленного никеля Ренея (Ni-Ra) и гидрируют 16 ч при давлении водорода 1 атм. при 40°С. После завершения процесса раствор фильтруют, растворитель удаляют в вакууме, а остаток обрабатывают диэтиловым эфиром, фильтруют, промывают эфиром и сушат в вакууме. Получают 20 г (63%) целевого продукта 3 в виде белого порошка с Тпл 236°С.
Пример 4. Получение N-[N-аспаргил(глицил)]-5-метокситриптамина 4 (Схема 4)
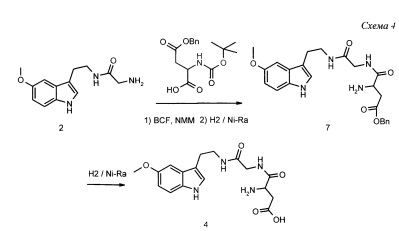
К раствору 12.4 г (0.05 моль) 3-аминометилкарбоксамидо-5-метоксииндола 2 (полученного согласно примеру 2), 17.8 г (0,055 моль) β-бензилового эфира N-Boc-L,-аспаргиновой кислоты и 8,5 г (0,055 моль) моногидрата N-гидроксибензотриазола (НВТ) в 100 мл диметилформамида при 0-5°С прикапывают раствор 12.5 г (0,06 моль) дициклогексилкарбодиимида (DCC) в 50 мл диметилформамида. Перемешивают 1 час при +5°С и затем 15 ч при комнатной температуре. Разбавляют реакционную массу 500 мл воды и экстрагируют 300 мл дихлорметана. Органическую фазу промывают водным раствором НСl 1%, водным гидрокарбонатом натрия, затем прибавляют к ней 5.7 г (0.05 моль) трифторуксусной кислоты (TFA) и выдерживают 30 мин. Полноту удаления ВОС-защиты контролируют ТСХ. Затем реакционный раствор промывают водным аммиаком, сушат сульфатом натрия и упаривают в вакууме. Остаток растирают с гексаном, промывают гексаном и сушат. Получают 18.1 г (80%) промежуточного вещества 7 в виде бесцветного порошка с Тпл 187°С.
Полученное вещество 7 растворяют в 100 мл метанола, добавляют 3 г свежеприготовленного никеля Ренея (Ni-Ra) и гидрируют 15 ч при 40°С и давлении водорода 1 атм. После завершения процесса раствор фильтруют, фильтрат упаривают в вакууме, а остаток обрабатывают диэтиловым эфиром, фильтруют, промывают эфиром и сушат в вакууме. Получают 11.5 г (61%) целевого продукта 4 в виде белого порошка с Тпл 241°С.
Пример 5. Получение N-[(NH2)Ala-Glu-Asp-Gly]-5-метокситриптамина 5 (Схема 5)

К раствору 4.66 г (0.01 моль) промежуточного продукта 7 (полученного согласно примеру 4), 3.69 г (0,011 моль) γ-бензилового эфира N-Boc-L-глутаминовой кислоты и 1.69 г (0,011 моль) моногидрата N-гидроксибензотриазола (НВТ) в 15 мл диметилформамида при 0-5°С прикапывают раствор 2.1 г (0,012 моль) дициклогексилкарбодиимида (DCC) в 6 мл диметилформамида. Перемешивают 1 час при +5°С и затем 20 ч при комнатной температуре. Разбавляют реакционную массу 50 мл воды и экстрагируют 25 мл дихлорметана. Органическую фазу промывают водным раствором НСl 1%, водным гидрокарбонатом натрия, затем прибавляют к ней 1.14 г (0.01 моль) трифторуксусной кислоты (TFA) и выдерживают 30 мин. Полноту удаления ВОС-защиты контролируют ТСХ. Затем реакционный раствор промывают водным аммиаком, сушат сульфатом натрия и упаривают в вакууме.
Остаток растворяют в 20 мл диметилформамида, прибавляют 2.08 г (0,011 моль) N-Boc-L-аланина и 1.69 г (0,011 моль) моногидрата N-гидроксибензотриазола (НВТ) и при 0-5°С прикапывают раствор 2.1 г (0,012 моль) дициклогексилкарбодиимида (DCC) в 6 мл диметилформамида. Перемешивают 1 час при +5°С и затем 20 ч при комнатной температуре. Разбавляют реакционную массу 60 мл воды и экстрагируют 30 мл дихлорметана. Органическую фазу промывают водным раствором НСl 1%, водным гидрокарбонатом натрия, затем прибавляют к ней 1.1 г (0.01 моль) трифторуксусной кислоты (TFA) и выдерживают 30 мин. Полноту удаления ВОС-защиты контролируют ТСХ. Затем реакционный раствор промывают водным аммиаком, сушат сульфатом натрия и упаривают в вакууме. Остаток растворяют в 25 мл метанола, добавляют 0.5 г свежеприготовленного никеля Ренея (Ni-Ra) и гидрируют 15 ч при 40°С и давлении водорода 1 атм. После завершения процесса раствор фильтруют, фильтрат упаривают в вакууме, а остаток обрабатывают диэтиловым эфиром, фильтруют, промывают эфиром и сушат в вакууме. Получают 2.1 г (37%) целевого продукта 5 в виде белого порошка с Тпл. 248°С.
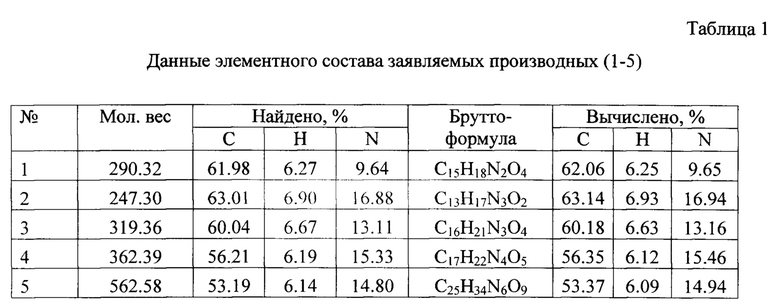
Данные элементного анализа и масс-спектров заявляемых веществ 1-5 приведены в таблице 1, данные спектров1Н ЯМР - в таблице 2.

Заявителю не известны какие-либо источники информации, в которых бы содержались сведения об идентичных технических решениях, что позволяет сделать вывод о соответствии заявленного изобретения условию патентоспособности «Новизна».
Как показывают приведенные ниже примеры, заявленное вещество обеспечивает важный технический результат, состоящий в значительном повышении эффективности лечения и профилактики нарушений,
Заявителем не выявлены какие-либо источники информации, содержащие сведения о влиянии признаков изобретения на достигаемый вследствие их реализации технический результат. Это, по мнению заявителя, свидетельствует о соответствии данного технического решения условию патентоспособности «Изобретательский уровень».
Реализация изобретения поясняется примерами.
Пример 6. Изучение влияния заявляемых веществ на физическую выносливость животных в условиях десинхроноза
Описание эксперимента
В качестве модели десинхроноза используют джетлаг (синдром резкой смены часовых поясов). Эксперимент проводят на белых нелинейных крысах массой 220-240 г, возраст 14-15 недель, прошедших карантин и предварительную отборку. Джетлаг моделируют, помещая крыс на яркий свет в темное время суток и лишая сна с помощью шумовых раздражителей. Для этого в 20.00 (за 13 ч до начала тестирования) клетки с крысами помещают в освещенную комнату и лишали сна, в течение 12 ч поддерживая звуковой фон с помощью шумового генератора. На следующий день в 8-00 крысам вводили препараты и через 1 ч (в 9-00) начинают процедуру тестирования.
Физическую выносливость оценивают по методу (Dawson С.A., Horvath S.A., 1970) по продолжительности принудительного плавания крыс с нагрузкой, составляющей 10% от веса животного. Тестирование проводят в стеклянном бассейне цилиндрической формы с вертикальными стенками, при температуре воды 20°С. Критерием утомления животного считают погружение ниже уровня воды, при котором оно в течение 10 секунд не может всплыть на поверхность. Каждая экспериментальная группа включала по 12 животных. Крысы, набранные для эксперимента, предварительно проходят отбор и рандомизацию по группам таким образом, чтобы время плавания у каждой особи отличалось от среднего показателя в группе не более чем на 10%. Эксперимент включает тройное тестирование: первое плавание проводилось через 1 ч после введения препаратов, затем еще через 5 мин - второе плавание, и еще через 40 мин - третье плавание. Первый тест характеризует физическую выносливость животных, а второй и третий - способность к восстановлению организма после физической нагрузки. В качестве контрольных животных используют интактных крыс, не подвергавшихся десинхронизирующему воздействию и не получавших препаратов, а также группу «плацебо» - десинхронизированных животных, получавшие вместо препаратов плацебо (дистиллированную воду).
Действие препаратов исследовали в двух сериях экспериментов, где в одном случае вещества вводили за 1 ч до начала плавательного теста (лечебное введение), а в другом случае - за 24 ч до плавательного теста (профилактическое введение). В качестве вещества сравнения в условиях лечебного введения использовали стимулирующий препарат кофеин в дозе 10 мг/кг.
Заявляемые вещества и прототип вводят крысам подкожно в дозе 1 мг/кг. Для введения заявляемые вещества №1, №3-5 растворяют в водном растворе NaHCO3, вещество №2 - в водном растворе NaH2PO4 1%, а прототип вводят в виде водной суспензии с добавкой 5% ТВИН-80. Объем введения во всех случаях составляет 0.1 мл.
Результаты тестирования приведены в таблице 3.
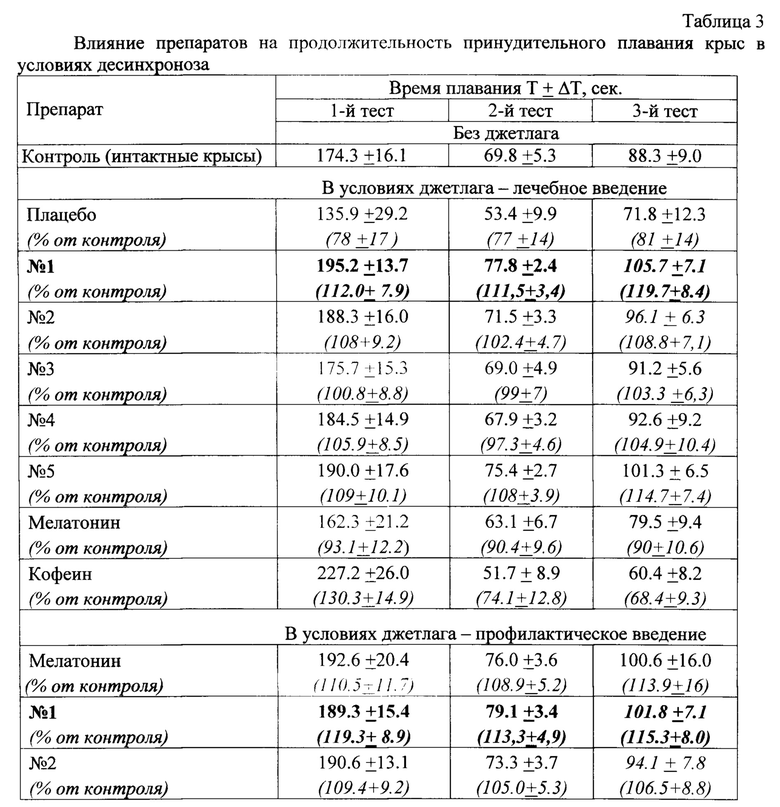
Как видно из полученных результатов, продолжительность плавания крыс в состоянии джетлага без фармкоррекции (плацебо) заметно меньше, чем у группы интактных крыс. Лечебное введение заявляемых веществ 1-5 в условиях джетлага приводит во всех трех тестах к достоверному увеличению (от 21% до 133% в первом тесте, от 27% до 45% во втором и от 25% до 45% в третьем тесте) продолжительности плавания по сравнению с плацебо. Это говорит о том, что физические способности крыс, нарушенные джетлагом, восстанавливаются под действием заявляемого вещества до уровня здоровых интактных животных и даже повышаются. При лечебном использовании (введение за 1 ч до плавательного теста) заявляемое вещество значительно превосходит по эффективности прототип (мелатонин), который в этих условиях дает лишь слабо выраженное и недостоверное повышение результатов плавательного теста, Эффективность мелатонина проявляется только в случае его профилактического введения до джетлага (за 24 ч до плавательного теста). Заявляемые вещества 1, 2 при введении до начала джетлага (за 24 ч до плавательного теста) также обладают профилактическим действием, не уступающим мелатонину.
Таким образом, заявляемые вещества обладают как лечебным, так и профилактическим эффектом в условиях джетлага. При этом заявляемые вещества значительно превосходят прототип по уровню лечебного действия, и не уступают прототипу в профилактическом отношении. Таким образом, заявляемые вещества имеют достоверное преимущество перед прототипом.
Важно отметить принципиальное отличие заявляемых веществ от препарата стимулирующего типа - кофеина. Психомоторный стимулятор кофеин в первом тесте значительно повышает продолжительность плавания, но во втором и особенно - в третьем тесте он дает результаты хуже чем в группе плацебо. Это подтверждает известное представление об истощающем характере действия кофеина, типичном для стимулирующих препаратов. Напротив, заявляемые вещества дает стабильное увеличение физических показателей относительно плацебо, что свидетельствует о другом механизме действия, в частности, об улучшении энергетического обмена.
Следует отметить также и тот факт, что заявляемые вещества существенно уменьшает разброс значений показателей плавательного теста при джетлаге. Как было сказано выше, все группы экспериментальных крыс были рандомизированы по продолжительности первого плавания, так что индивидуальные отличия не превышали 10%, но в условиях десинхроноза разброс значений резко увеличивается (до 32%). Введение заявляемого вещества, помимо увеличения продолжительности плавания, снижает разброс показателей до уровня группы интактных животных, что является признаком нормализации различных функций организма, разбалансированных в результате джетлага.
Таким образом, на модели джетлага заявляемые вещества обладает большей эффективностью, чем прототип, и они могут быть использованы для лечения и коррекции состояний десинхроноза.
Пример 7. Изучение влияния заявляемых веществ на содержание гормонов в крови животных в норме и в условиях десинхроноза
Описание эксперимента
В эксперименте изучали содержание в сыворотке крови крыс тестостерона, тироксина и трийодтиронина. Оценка динамики этих гормонов дает важную информации о состоянии физиологических функций организма, адаптивном статусе и т.п. Тестостерон - мужской половой гормон, который помимо регуляции половой функции, в значительной степени управляет психоэмоциональным состоянием, отвечает за концентрацию внимания, адаптацию к стрессовым ситуациям и изменениям внешней среды. Тироксин и трийодтироксин - гормоны щитовидной железы, которые участвуют в регуляции сердечного ритма и температуры тела, активируют процессы обмена веществ, метаболизма и контролируют синтез ряда белков.
Исследование проводили на белых нелинейных крысах-самцах массой 220-240 г, возраст 14-15 недель, прошедших карантин. Формировали экспериментальные группы по 8 животных в каждой группе. Для моделирования десинхроноза 6 групп крыс помещали в условия постоянного освещения на 10 суток (световой десинхроноз). Другие 6 групп помещали на 10 суток в условия постоянной темноты (темновой десинхроноз). Остальные животные (группа контроля) содержались в условиях обычного режима смены дня и ночи.
На 11-й день животных возвращали в условия обычного режима смены дня и ночи и вводили препараты. Заявляемые вещества и прототип вводились подкожно в дозе 1 мг/кг.
На 12-й день, через сутки после введения препаратов, у животных определяли содержание тестостерона, тироксина и трийодтиронина в сыворотке крови.
Полученные результаты приведены в таблице 4.
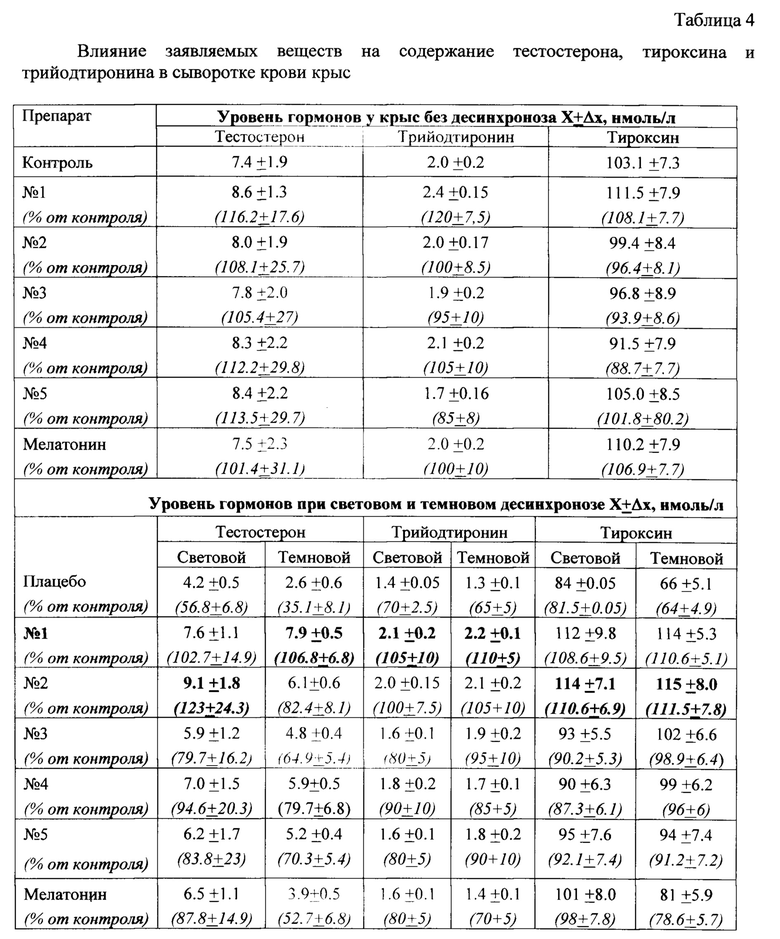
Приведенные результаты свидетельствуют, что в крови крыс уровень гормонов, особенно тестостерона, в условиях десинхронозов достоверно снижается. Введение заявляемых веществ на фоне светового и темнового десинхроноза повышает содержание гормонов до естественного уровня, наблюдаемого у интактных животных, не подвергавшихся световой или темновой депривации. Мелатонин оказывает корректирующее действие, которое при темновом десинхронозе выражено слабее, чем при световом десинхронозе.
Приведенные данные также позволяют отметить, что в отсутствии десинхроноза, заявляемые вещества не изменяет эндогенный гормональный фон у контрольных животных, то есть не оказывает гормонального действия.
Можно заключить, что в эксперименте на животных заявляемые вещества позволяет нормализовать уровень тестостерона и тиреоидных гормонов в условиях десинхроноза. Корректирующие эффекты у заявляемых веществ и прототипа в случае светового десинхроноза сопоставимы, а в случае темнового десинхроноза заявляемые вещества заметно превосходит прототип. Таким образом, заявляемые вещества обладают преимуществом перед прототипом.
Пример 8. Изучение влияния заявляемых веществ на содержание катехоламинов в моче животных в условиях десинхроноза
Описание эксперимента
В эксперименте изучали содержание катехоламинов - адреналина, норадреналина и дофамина в моче крыс. Данные нейромедиаторы у животных регулируют быстрые ответные реакции на внешние факторы. Содержание катехоламинов в моче служит интегральным показателем нейромедиаторной активности, повышение которого у здоровых особей свидетельствует о состоянии стресса, угнетенности, нарушении сна и т.д.
Исследование проводили на белых нелинейных крысах-самцах массой 220-240 г, возраст 14-15 недель, прошедших карантин. Формировали экспериментальные группы по 8 животных в каждой группе. Для моделирования десинхроноза крыс помещали в условия постоянного освещения на 7 суток, а затем - на 7 суток в условия постоянной темноты. Животные группы контроля содержались в условиях обычного режима смены дня и ночи.
На 15-й день животным подкожно вводили исследуемые вещества в дозе 1 мг/кг, или плацебо, и помещали в специализированные клетки для сбора мочи. Суточную мочу, собранную у каждого животного, исследовали на содержание катехоламинов методом высокоэффективной жидкостной хроматографии с электрохимическим детектированием.
Полученные результаты приведены в таблице 5.
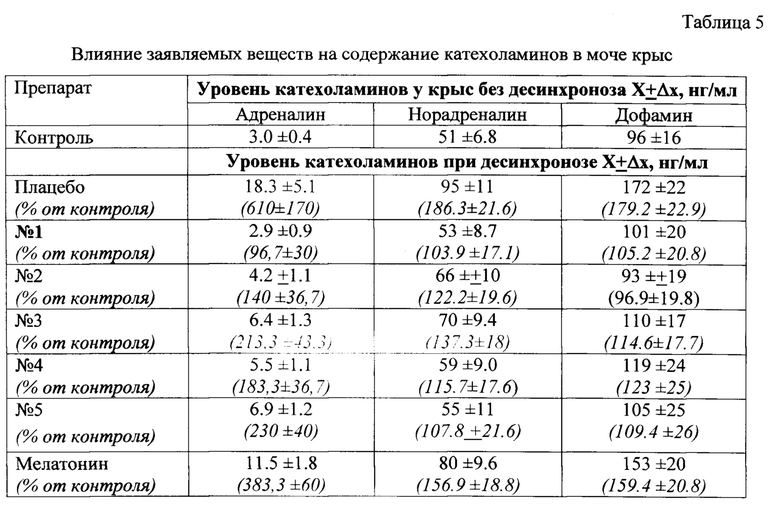
Из приведенных результатов видно, что в содержание катехоламинов в моче крыс в условиях десинхроноза без фармкоррекции (в группе «плацебо») достоверно повышается, особенно в случае адреналина. Это свидетельствует о нарушении адаптации и повышенном уровне стресса у животных. Введение заявляемых веществ (особенно производного №1) на фоне десинхроноза снижает содержание катехоламинов в моче до уровня, близкого к естественному, наблюдаемому у контрольных животных. Действие мелатонина в этих условиях выражено слабее, чем у заявляемых веществ.
Таким образом, судя по изменению содержания котехоламинов в моче, заявляемые вещества более эффективно, чем прототип, снижают симптомы, вызванные десинхронозом.
Пример 9. Изучение влияния заявляемых веществ на поведение животных в состоянии десинхроноза методом «открытое поле»
Описание эксперимента
Исследование проводили на белых нелинейных крысах массой 220-240 г, возраст 14-15 недель, прошедших карантин и предварительную отборку. Формировали экспериментальные группы по 10 животных в каждой группе. Для моделирования десинхроноза крыс помещали в условия постоянного освещения на 7 суток, а затем - на 7 суток в условия постоянной темноты. Животные группы контроля содержались в условиях обычного режима смены дня и ночи.
На 15-й день животным вводили заявляемые вещества, прототип в дозе 1 мг/кг, или плацебо (подкожно). Через 1 ч после введения препаратов крыс помещали в камеру «Открытое поле» (установка «Ореn Field Phenomaster Activity, TSE, Германия) и фиксировали число актов двигательной активности животных с помощью автоматического регистратора, период регистрации охватывал 2 мин. Результаты представлены в таблице 6.
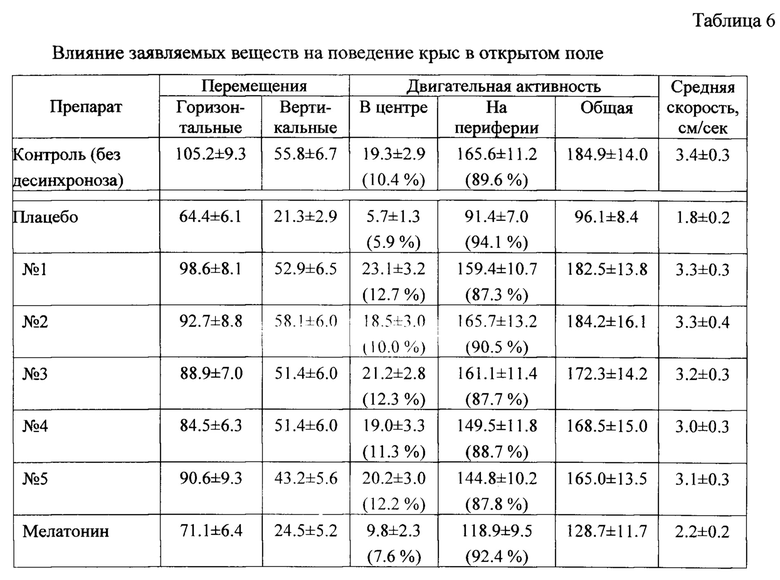
Как видно из полученных результатов, в условиях десинхроноза без фармкоррекции (в группе «плацебо») двигательная активность крыс заметно снижаются, что отражается на всех контролируемых параметрах. Особо следует отметить снижение активности в центре поля, что указывает на состояние тревожности и стресса у животных.
Под действием заявляемых веществ (особенно производных №1 и №2) на фоне десинхроноза наблюдается восстановление параметров двигательной активности животных до уровня группы контроля, а также, судя по увеличению относительной активности в центре поля, снижение состояние тревожности. Мелатонин в этих условиях дает лишь слабое и недостоверное повышение активности относительно плацебо.
Таким образом, по результатам теста «открытое поле», можно заключить, что в условиях десинхроноза заявляемые вещества восстанавливают двигательную активность и снижают симптомы тревожности у животных значительно эффективнее, чем прототип.
Пример 10. Изучение острой токсичности заявленных веществ
Острую токсичность заявленных веществ определяли на белых беспородных мышах-самцах в условиях перорального пути введения. Для этого вещества в дозах, кратных 500 мг/кг, вводили соответствующим группам животных. Число животных в каждой группе составляло 5 особей. Вещества вводили мышам внутрижелудочно с помощью атравматического зонда в виде водной суспензии с добавкой 5% ТВИН-80. Количество павших животных оценивали на третьи сутки после введения веществ. На основе этих данных рассчитывали среднесмертельную дозу ЛД-50, вызывающую гибель 50% животных.
Результаты исследования приведены в таблице 7.
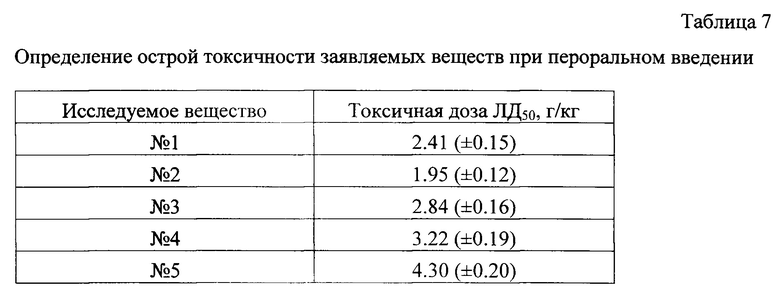
Полученные результаты свидетельствуют, что заявленные вещества, согласно существующей классификации, по уровню токсичности может быть отнесено к 3-му или 4-му классу опасности, то есть к средне токсичным или мало токсичным веществам. С учетом низкой действующей дозы (1 мг/кг), это обеспечивает заявляемым веществам широкий терапевтический индекс - от 2000 и выше.
Таким образом, на различных моделях десинхроноза показано, что заявляемые вещества обладает хронобиотической активностью, более высокой чем у прототипа. Заявляемые вещества мало токсичны, промышленно применимы и могут быть использовано для лечения и коррекции десинхронизационных нарушений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство для коррекции десинхроноза, вызванного нарушением светового режима | 2017 |
|
RU2660578C1 |
| СПОСОБ КОРРЕКЦИИ НАРУШЕНИЙ ПОВЕДЕНИЯ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ДЕСИНХРОНОЗЕ В УСЛОВИЯХ СВЕТОДИОДНОГО ОСВЕЩЕНИЯ | 2016 |
|
RU2611392C1 |
| АНТИДОТ ОКИСИ УГЛЕРОДА | 2015 |
|
RU2581467C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ХРОНОКОРРЕКТИРУЮЩЕЙ И АДАПТОГЕННОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2577701C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДЕПРЕССИВНЫХ СОСТОЯНИЙ | 2011 |
|
RU2475235C2 |
| ПОРИСТЫЙ СОРБЕНТ С ХРОНОТРОПНЫМИ СВОЙСТВАМИ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ | 2015 |
|
RU2577580C1 |
| Способ оценки центральной десинхронизации организма у крыс | 2020 |
|
RU2753000C1 |
| КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ПОВЕДЕНЧЕСКИХ, ПСИХИЧЕСКИХ, КОГНИТИВНЫХ И НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ ПРИ ОРГАНИЧЕСКИХ ЗАБОЛЕВАНИЯХ ЦНС | 2012 |
|
RU2493838C1 |
| АНТИДОТ ОКИСИ УГЛЕРОДА И ГЕПАТОТОКСИЧЕСКИХ ВЕЩЕСТВ | 2015 |
|
RU2584586C1 |
| СРЕДСТВО ХРОНОБИОЛОГИЧЕСКОЙ КОРРЕКЦИИ | 2015 |
|
RU2601894C1 |
Изобретение относится к химико-фармацевтической промышленности и представляет собой средство коррекции и профилактики состояний десинхроноза, содержащее соединения общей формулы:
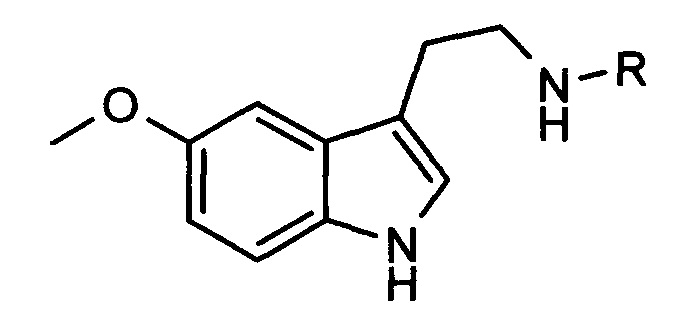
где R представляет собой СОСН2СН2СООН, COCH2NH2, COCH2(NH2)CH2CH2COOH, COCH2NHCOCH2(NH2)CH2CH2COOH или
 .
.
Изобретение позволяет достичь высокой эффективности нового средства для улучшения адаптации организма к изменениям суточных ритмов и лечения нарушений, вызванных различными десинхронизирующими факторами. 1 з.п. ф-лы, 7 табл., 10 пр.
1. Средство коррекции и профилактики состояний десинхроноза, содержащее соединения общей формулы:
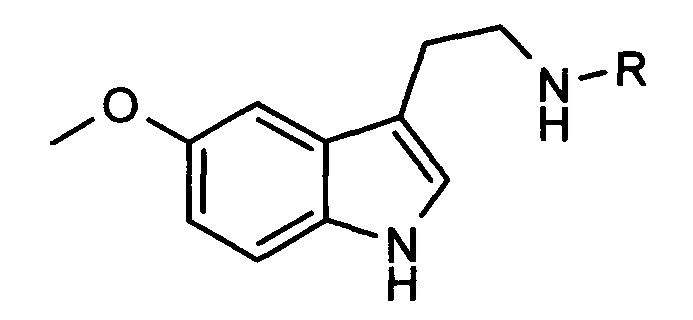
где R:
СОСН2СН2СООН,
COCH2NH2,
COCH2(NH2)CH2CH2COOH,
COCH2NHCOCH2(NH2)CH2CH2COOH,
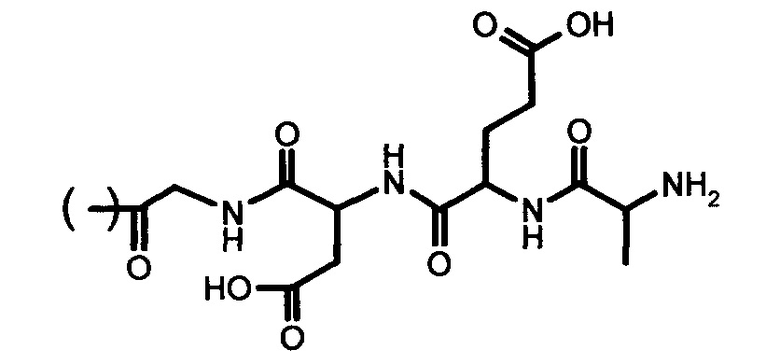
2. Средство по п. 1, отличающееся тем, что включает в себя любые таутомерные формы и фармакологически приемлемые соли заданной структуры.
| Garaeva L | |||
| D., et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| - Vol | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| P | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ УПРАЖНЕНИЙ НА МУНДШТУКЕ ДУХОВЫХ ИНСТРУМЕНТОВ | 1923 |
|
SU619A1 |
| Soriano-Agaton, Flor, et al | |||
| Extraction, hemisynthesis, and synthesis of canthin-6-one analogues | |||
| Evaluation of their antifungal activities // Journal of Natural Products | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Vol | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| P | |||
| Визирный прибор | 1924 |
|
SU1581A1 |
| A | |||
| D | |||
| Neklyudov, et al | |||
| Synthesis and pharmacological activity of aminoalkyl derivatives of substituted tryptamines // Pharmaceutical Chemistry Journal | |||
| ПРИБОР ДЛЯ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКОВ | 1923 |
|
SU1974A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| P | |||
| Приспособление, обнаруживающее покушение открыть замок | 1910 |
|
SU332A1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДЕСИНХРОНИЗАЦИОННЫХ НАРУШЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2160101C2 |
| СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ СНА У МАЛЬЧИКОВ С ОЖИРЕНИЕМ | 2012 |
|
RU2479841C1 |
| AU 0000726758 B2, 23.11.2000. | |||
Авторы
Даты
2018-05-29—Публикация
2017-06-09—Подача