Изобретение относится к области медицины, а именно абдоминальной хирургии и онкологии, и может быть использовано для хирургического лечения больных, которым требуется замещение желудка после гастрэктомии по поводу рака желудка, путем создания резервуара из тонкой кишки с включением в пищеварение двенадцатиперстной кишки.
Известно, что злокачественные опухоли желудочно-кишечного тракта, являются одной из основных проблем онкологической науки и практического здравоохранения. Рак желудка до сих пор занимает лидирующие позиции по показателям заболеваемости и смертности, а единственным радикальным лечением является хирургический метод. Метастатическая агрессивность карциномы желудка требует обширного хирургического вмешательства, - резекции желудка или гастрэктомии с расширенной лимфодиссекцией (D2-D3). Последние два десятилетия гастрэктомия в спектре вмешательств, выполняемых при раке желудка, составляет от 50 до 80%. Наряду с неуклонным увеличением количества больных, успешно перенесших гастрэктомию, и улучшением отдаленных результатов, продолжает оставаться проблема послеоперационных диспепсий, обусловленных полным удалением желудка и изменением нормальных анатомо-физиологических условий в пищеварительном тракте [Ена И.И., Шаназаров Н.А. Современные подходы к хирургическому лечению рака желудка // Фундаментальные исследования. - 2011. - №10-1. - С. 204-211.; Панибратец Л.С., Бебезов Б.Х. Варианты кишечной пластики после гастрэктомии // Вестник КРСУ. 2008. Том 8. №5. - С. 62-67.; Щепотин И.Б., Эванс Т.С.Р., 2000; Черноусов А.Ф. и др., 2004; Чернявский А.А., Лавров Н.А., 2008; Давыдов М.И., Тер-Аванесов М.Д., 2009; Чиссов В.И., Трахтенберг А.Х., 2009; Nadrowski L., 2003; Collard J.M. et al., 2003].
После гастрэктомии неизбежно утрачиваются очень важные в функциональном отношении пептический и механический компоненты пищеварения. Происходит разрыв последовательной пищеварительной цепочки с потерей процесса дробного поступления пищи в двенадцатиперстную кишку. Частота и выраженность нарушений пищеварения после гастрэктомии зависят от способа восстановления непрерывности пищеварительного тракта, функциональной состоятельности выполненной реконструкции, адекватной компенсации резервуарной функции созданного органа и включения двенадцатиперстного компонента пассажа пищи [Reconstruction of the digestive tract after total gastrectomy /А. Hubens, R. Van Нее, Van Vooren, R. Peters // Hepatogastroenterology. - 1989. - Vol. 36, N 1. - P. 18-22.; Kono K. Improved quality of life with jejunal pouch reconstruction after total gastrectomy / K. Kono // Am. J. Surg. - 2003. - 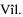 185. - P. 150-154].
185. - P. 150-154].
На современном этапе развития хирургии восстановление пищеварительной системы после гастрэктомии должно соответствовать высочайшей степени надежности и функциональности для сохранения хорошего качества жизни пациентов после операции. Не вызывает сомнений факт функционального преимущества пациентов после еюногастропластического замещения желудка, в отличие от выключающих двенадцатиперстную кишку реконструктивных вмешательств. Хорошей реабилитации больных после гастрэктомии можно добиться только после сохранения всех заложенных природой этапов пассажа пищи.
Конечно же, нужно стремиться не просто к попаданию пищи в двенадцатиперстную кишку, необходимо компенсировать резервуарную функцию желудка и добиться дробного поступления пищевого комка в двенадцатиперстную кишку. Сохранение анатомического пассажа пищи позволяет добиться скорейшей стабилизации самочувствия за счет восстановления белкового и углеводного обмена, а следовательно, с одной стороны, минимизировать время пребывания больного в стационаре, и с другой, - полноценно стабилизировать гомеостаз и иммунитет, что непременно улучшит онкологические результаты лечения пациентов. Создание условий для обеспечения хорошего качества жизни больных после гастрэктомии является актуальной и многогранной проблемой, имеющей большое медико-социальное и экономическое значение, особенно у пациентов трудоспособного возраста.
Все это подчеркивает актуальность разработки новых способов восстановления непрерывности пищеварительного тракта после гастрэктомии.
Известны способы создания анатомической структуры, замещающей желудок. В данных способах используют трансплантат тонкой и толстой кишки, нить с иглой. / См. приложение 1: копия из кн. «Хирургия пищеварительного тракта». Лечение рака желудка - А.А. Шалимов, В.Ф. Саенко. - 1987. - с. 284-288/.
В приложение 1, на рис. 115 приведены методики восстановления непрерывности желудочно-кишечного тракта после гастрэктомии: 1) по Balog, 2) по Seo, 3) по Tomoda, 4) по Dziadek, 5) по Розанову, 6) по Knopfler, 7) по Шалимову, 8) по Hoffmann, 9) по Engel, 10) по Day Cuhna, 11) по Mandl, 12) по Nakayama, 12) по Кирикуцэ - Урбановичу, 14) по Бетанели, 15) по Hart, 16) по Errigo, 17) по Lee Hunnicult, 18) по Moroney.
Способы лечения, взятые за аналог, выполняют следующими образами: по методике Tomoda заключается в том, что короткую петлю тощей кишки располагают впереди поперечной ободочной кишки в изоперистальтическом положении и анастомозируют с пищеводом и двенадцатиперстной кишкой по типу конец в бок. Тотально замещать желудок тонкой кишкой предложил Balog (1926 г.), апробировав свой способ на собаках, выполнил эту операцию Seo (1942 г.). Использовать для гастропластики поперечно-ободочную кишку предлагал Nico Ladoni (1887 г.), П.А. Куприянов (1924 г.) разработал технику еюногастропластики на трупе, а первым в клинике предложенную им методику стал использовать Е.И. Захаров (1938 г.). Longmire (1952 г.) предложил свой вариант, несколько изменив методику Balog.
Данные способы лечения имеет следующие недостатки:
1. не обеспечивают условиям выполнения резервуарной и дробной моторно-эвакуаторной функции сформированного искусственного желудка;
2. не обеспечивают процесс накопления, задержки и перемешивания пищи после ее продвижения из пищевода в трансплантат, порционного поступления пищи в двенадцатиперстную кишку и наиболее физиологичного восстановления до гастрэктомических условий пищеварения;
3. не обеспечивают удовлетворительный питательный статус больных в раннем и позднем послеоперационном периоде;
4. нет сформированного антирефлюксного клапанного механизма между кишечным трансплантатом и пищеводом.
За ближайший аналог принят способ замещения желудка тощей кишкой по Balog. В данном способе используют трансплантат тонкой кишки, нить с иглой. / См. приложение 1: копия из кн. «Хирургия пищеварительного тракта». Лечение рака желудка - А.А. Шалимов, В.Ф. Саенко. - 1987. - с. 284-288/.
Способ лечения выполняют следующим образом, отступя около 15-20 см от связки Трейца, мобилизуют участок тощей кишки протяженностью 30 см, пересекают кишку и перемещают ее в окне брыжейки поперечно-ободочной кишки на сохраненных сосудах, дефект в тощей кишке восстанавливают анастомозом конец в конец. Проксимальный конец изолированной части тощей кишки прошивают ручным швом, погружают в кисет. Формируют анастомозы: пищеводно-тонкокишечный конец в бок и тонкокишечно-двенадцатиперстный - конец в конец.
Данный способ лечения имеет следующие недостатки:
1. не обеспечивает условиям выполнения резервуарной и дробной моторно-эвакуаторной функции сформированного искусственного желудка;
2. не позволяет потреблять адекватный объем принятой однократно пищи и, как следствие, добиться ранней реабилитации больных в послеоперационном периоде;
3. не исключает заброс желчи в трансплантат и пищевод;
4. не обеспечивает качественной компенсации нарушений белкового и углеводного обмена, реабилитации гомеостаза;
5. не отвечает современной концепции обеспечения максимально хорошего качества жизни после операции.
Задачами данного предложения являются:
1. Создать физиологические параметры вновь формируемого органа, которые обеспечивают выполнение пищеварительной, резервуарной и моторно-эвакуаторной функции желудка, то есть процессы задержки, перемешивания и продвижение пищи после попадания из пищевода в трансплантат, порционное поступление пищи в двенадцатиперстную кишку и полноценную реабилитацию до-гастрэктомических условий пищеварения в кишечном трансплантате и других отделах кишечника.
2. Создать резервуар в тонкокишечном трансплантате, позволяющий больному съедать за один прием 350,0-400,0 мл пищи.
3. Разработать такую конструкцию тонкокишечного резервуара, которая позволит использовать различные способы авторских эзофагоеюноанастомозов с надежным антирефлюксным клапанным механизмом.
4. Создать подобие угла желудка и кишечный клапан, обеспечивающих порционное поступление пищи из сформированного резервуара и исключающий рефлюкс желчи.
5. Упростить манипуляции с кишечным трансплантатом для минимизации продолжительности операции и исключения послеоперационных осложнений, а также получения возможности применения данного способа в рутинной практике.
6. Улучшить самочувствие и питательный статус больных в раннем и позднем послеоперационном периоде.
7. Добиться максимально качественной реабилитации гомеостаза и качества жизни больных.
8. Достигнуть максимальной надежности и эффективности хирургических манипуляций с учетом требований современной онкологии к выполнению лимфодиссекции расширенного объема, снижения тяжести общего состояния больных ввиду наличия онкологического процесса, предшествующих диспептических нарушений, обширности операционной травмы, зачастую имеющейся сопутствующей патологией в пожилом возрасте пациентов.
Технический результат
Данный способ восстановления непрерывности пищеварительного тракта после гастрэктомии позволяет создать на основе тонкокишечного трансплантата новый орган, замещающий по физическим и функциональным параметрам желудок, обеспечивающий выполнение пищеварительной, резервуарной и клапанно-эвакуаторной функции, порционное поступление пищи в двенадцатиперстную кишку, перемешивание, продвижение, задержку и накопление пищи после попадания из пищевода в трансплантат. Сформированный резервуар позволяет больному съедать за один прием 350,0-400,0 мл пищи, тем самым быстрее восстанавливаются обменные процессы, улучшается общее самочувствие и питательный статус в раннем и позднем послеоперационном периоде. Созданное подобие угла желудка и кишечный клапан обеспечивают порционное поступление пищи из резервуара и исключают заброс желчи и панкреатического секрета в зону пищеводно-тонкокишечного анастомоза.
Минимальные временные затраты и простота способа формирования резервуара при замещении желудка тощекишечным трансплантатом позволяет, с одной стороны, использовать различные авторские варианты формирования клапанного пищеводно-тонкокишечного соустья, а с другой, - с легкостью применять разработанный вариант восстановления непрерывности пищеварительного тракта после гастрэктомии в рутинной практике.
Сущностью способа является то, что выкраивают фрагмент кишки длиной 30,0 см на сосудистой ножке; непрерывность тощей кишки восстанавливают анастомозом конец в конец, формируют эзофагоеюноанастомоз, отступя 3,0 см от которого создают резервуар путем продольного рассечения протяженностью 5,0 см противобрыжеечной стенки кишки и растягивания разреза нитями держалками в стороны за середины противоположных краев до поперечного состояния разреза и ушивают стенку кишки отдельными узловыми швами однорядно, затем формируют угол и клапан для порционной эвакуации содержимого из резервуара: на 6,0 см ниже линии полученных швов тощую кишку сгибают вправо и сшивают между собой околобрыжеечные стороны полученного угла кишки на протяжении 1,5 см отдельными узловыми серозно-мышечно-подслизистыми швами, затем отрезок кишки поворачивают против часовой стрелки на 90 градусов и ушивают несколькими стежками между собой левые околобрыжеечные края кишки на протяжении 1,0 см серозно-мышечно-подслизистыми швами напротив и параллельно шву, сформированному в углу на правой стенке кишки, после чего завершают восстановление непрерывности пищеварительного тракта двухрядным еюнодуоденоанастомозом конец в конец.
Способ апробирован на 28 больных в течение двух лет в условиях 1-го и 2-го хирургических отделений ГБУЗ «Научно-исследовательского института - Краевой клинической больницы №1 имени профессора С.В. Очаповского» министерства здравоохранения Краснодарского края, получены хорошие результаты.
У всех больных, а также в группе пожилых и ослабленных пациентов с тяжелыми сопутствующими заболеваниями удалось добиться максимально качественной реабилитации обменных процессов, показателей гомеостаза и качества жизни, что улучшает ближайшие результаты лечения, а также позволяет избежать лишних материальных затрат лечебного учреждения на приобретение для пациентов парентерального питания. Послеоперационных осложнений не было. Разработанный способ доказал на практике надежность и возможность ускоренного получения 100% гарантированного результата восстановления резервуарной функции вновь созданного трансплантата, а также его способность обеспечить порционное поступление пищи в двенадцатиперстную кишку.
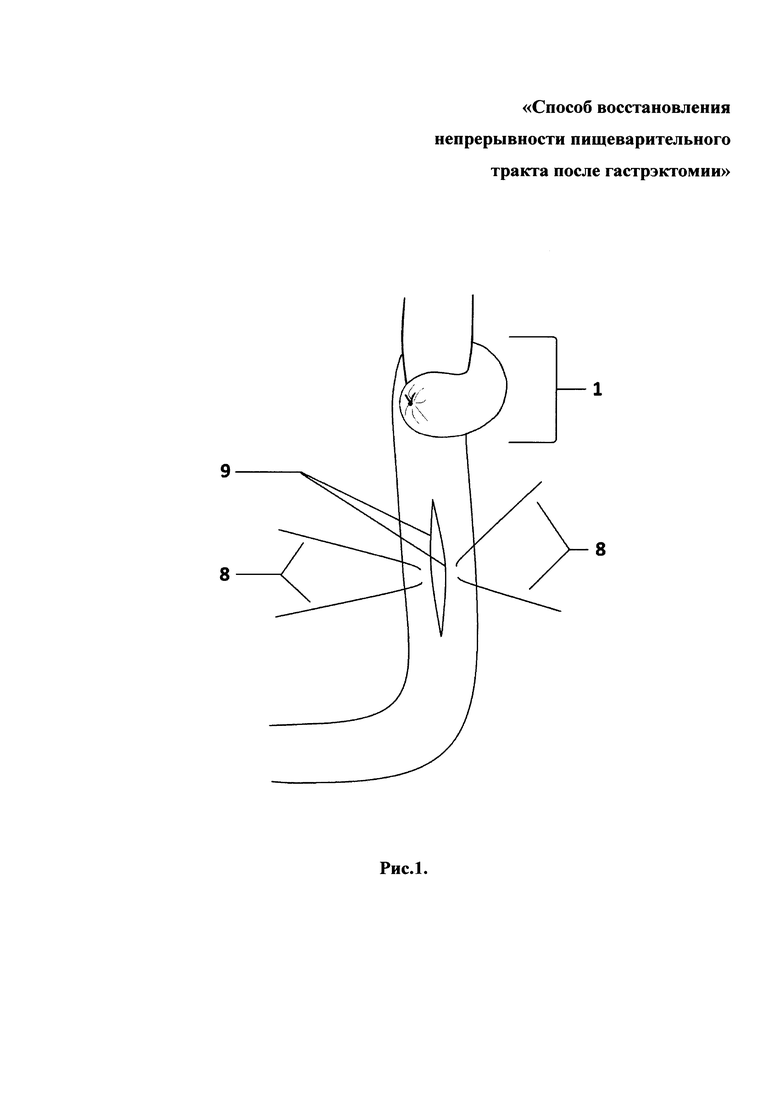
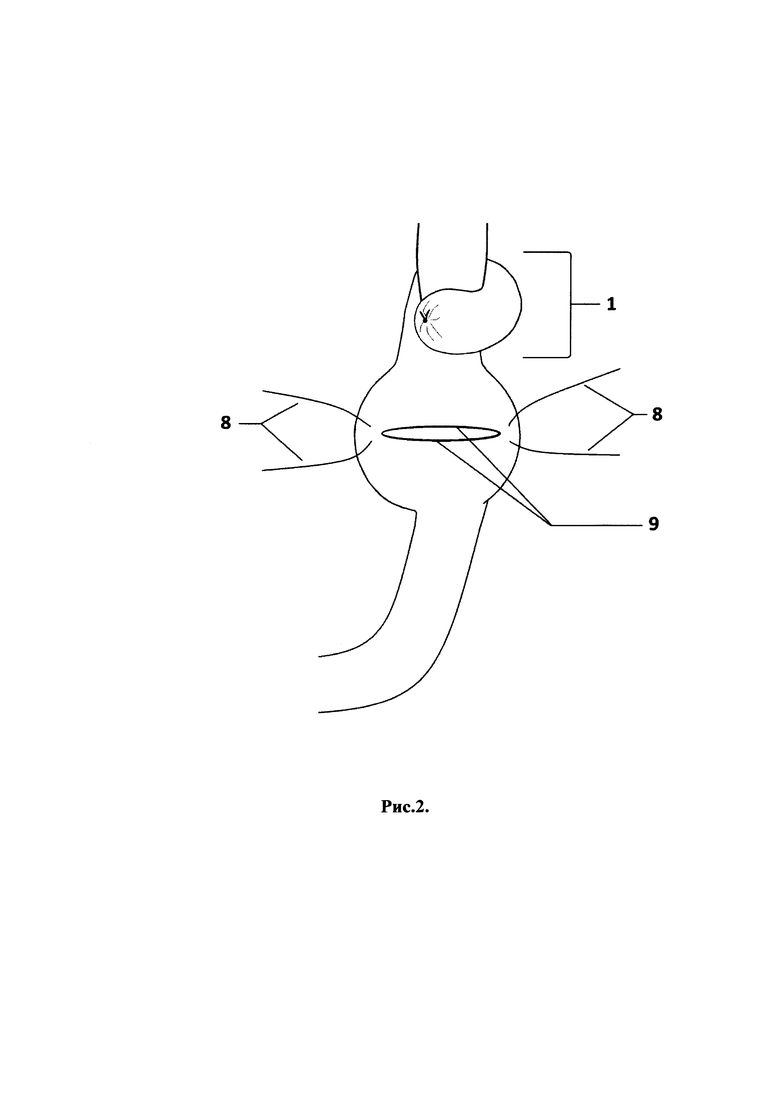
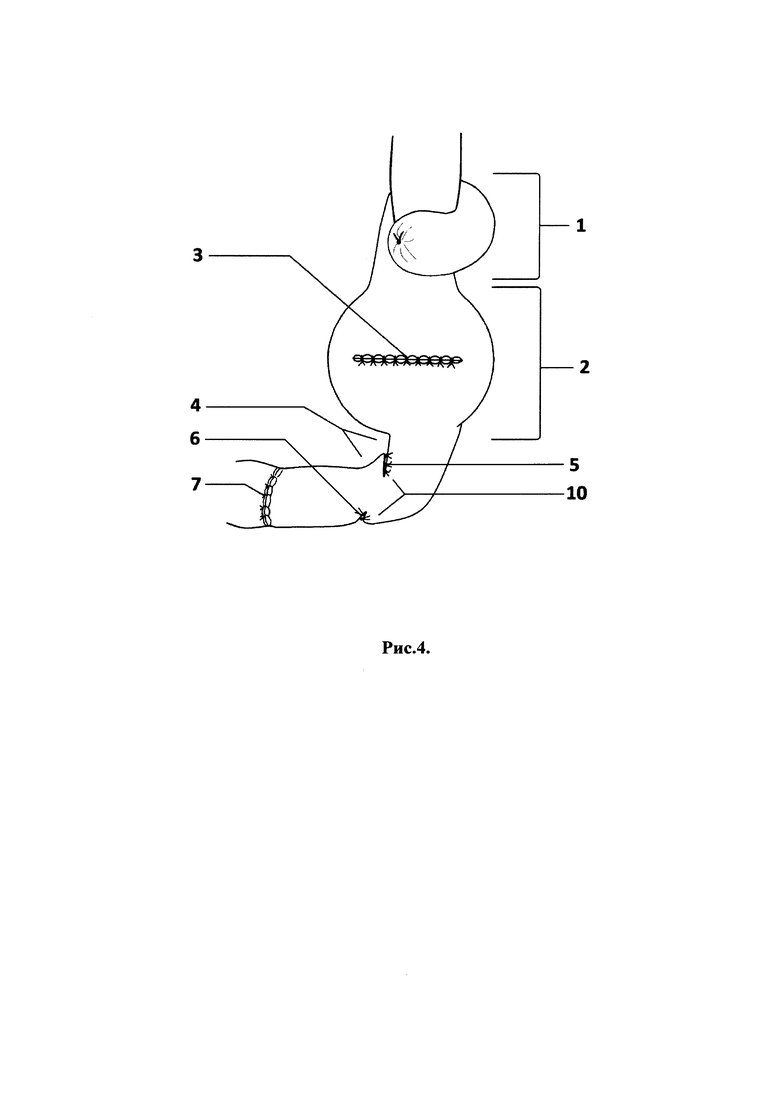
Способ продемонстрирован на рис. 1, 2, 3, 4 - поэтапные схемы выполнения предлагаемого способа лечения: рис. 1 - продольно рассеченная противобрыжеечная стенка кишки с фиксированными за середину противоположных краев разреза нитями держалками, рис. 2 - растянутые нитями держалками рассеченные края кишки в стороны, рис. 3 - ушитая линия рассеченной кишки отдельными узловыми швами однорядно, рис. 4 - окончательно сформированный искусственный желудок: с резервуаром, углом и клапанном, на которых п. 1 - эзофагоеюноанастомоз, 2 - резервуар искусственного желудка, 3 - ушитая линия рассечения кишки, 4 - угол искусственного желудка, 5 - правые околобрыжеечные стороны кишки, сшитые между собой, 6 - левые ушитые околобрыжеечные края кишки, 7 - еюнодуоденоанастомоз, 8 - нить держалка, 9 - рассеченные края противобрыжеечной стенки кишки, 10 - клапан искусственного желудка.
Способ выполняют следующим образом
Под комбинированным наркозом, производят обработку операционного поля с выполнением верхней срединной лапаротомии, ревизию органов брюшной полости, гастрэктомию с расширенной лимфодиссекцией D2-3.
Мобилизуют начальные отделы тощей кишки на 10-15 см дистальнее связки Трейца и выкраивают фрагмент кишки длиной 30,0 см на сосудистой ножке, непрерывность тощей кишки восстанавливают монофиламентной нитью однорядным прецизионным узловым анастомозом конец в конец.
Проксимальный конец сегмента тощей кишки прошивают линейным сшивающим аппаратом и погружают в кисетный шов.
Мобилизованный тонкокишечный трансплантат проводят через «окно» в брыжейке позади и перемещают выше поперечно-ободочной кишки.
Формируют эзофагоеюноанастомоз (1) с антирефлюксным клапанным механизмом, например, по принципу, изложенному в описании работы патента РФ на изобретения №2474392. Также возможно выполнять эзофагоеюноанастомоз и в других авторских модификациях.
Отступя 3,0 см от сформированного эзофагоеюноанастомоза (1), создают резервуар (2) путем продольного рассечения протяженностью 5,0 см противобрыжеечной стенки кишки (9) и растягивания разреза (9) нитями держалками (8) в стороны за середины противоположных краев до поперечного состояния разреза и ушивают стенку кишки (3) отдельными узловыми швами однорядно, затем формируют угол (4) и клапан (10) для порционной эвакуации содержимого из резервуара (2): на 6,0 см ниже линии полученных швов (3) тощую кишку сгибают вправо и сшивают между собой околобрыжеечные стороны (5) полученного угла (4) кишки на протяжении 1,5 см отдельными узловыми серозно-мышечно-подслизистыми швами, затем отрезок кишки поворачивают против часовой стрелки на 90 градусов и ушивают несколькими стежками между собой левые околобрыжеечные края кишки (6) на протяжении 1,0 см серозно-мышечно-подслизистыми швами напротив и параллельно шву (5), сформированному в углу на правой стенке кишки, после чего завершают восстановление непрерывности пищеварительного тракта двухрядным еюнодуоденоанастомозом (7) конец в конец.
При помощи простейшего пластического приема - рассечения (9) кишки в продольном и сшивания (3) в поперечном направлении - добиваются создания резервуара (2) в тощей кишке, что позволяет достичь увеличения возможного объема принимаемой однократно пищи уже в раннем послеоперационном периоде.
Формирование подобия «угла желудка» (4) в проекции малой кривизны и фиксирующие швы (5 и 6) на противоположных симметричных участках углов трансплантата позволяет создать искусственный клапан (10), зафиксировать поворот кишки против часовой стрелки вокруг собственной оси на 90 градусов, что, с одной стороны, обеспечивает необходимую задержку пищи в созданном резервуаре (2) и дробное ее поступление в участок кишки перед тощекишечно-двенадцатиперстным соустьем, а с другой, - создает подобие клапана (10) между резервуаром (2) и двенадцатиперстной кишки, что исключает заброс желчи и панкреатического секрета в зону пищеводно-тонкокишечного анастомоза (1).
С помощью данного способа лечения больных раком желудка добиваются быстрого восстановления белкового и углеводного обмена, останавливают катаболические процессы уже в раннем послеоперационном периоде, максимально быстро компенсируют дефицит массы тела и обеспечивают пищевую и социальную адаптацию перенесших тяжелую операцию больных.
Быстрое восстановление обменных процессов и гомеостаза, привычного ритма питания помогает скорейшему восстановлению психоэмоционального статуса пациентов.
Ранняя коррекция нарушенных обменных процессов обеспечивает возможность скорейшего применения адъювантной химиотерапии, что вкупе с качественным восстановлением гомеостаза и иммунного статуса обеспечивает условия получения благоприятных онкологических результатов лечения.
Пример 1. Больной, 34 лет.
Диагноз: с-г желудка T3NxM0, 2 кл. гр.
Операция: комбинированная гастрэктомия с лимфодиссекцией D2-3, резекция абдоминального сегмента пищевода, холецистэктомия, резервуарная еюногастропластика.
Под комбинированным наркозом, после обработки операционного поля разрезом от мечевидного отростка до гипогастрия, с обходом пупка слева послойно вскрыта брюшная полость. При ревизии: опухоль по малой кривизне тела, субкардиального отдела желудка до кардии, в серозу не прорастает, увеличены лимфоузлы в зоне левой желудочной артерии. Печень не увеличена. Абдоминальный отдел пищевода, двенадцатиперстная кишка, тонкая кишка и ее брыжейка, селезенка без особенностей.
Учитывая локализацию и форму роста опухоли, решено выполнить комбинированную гастрэктомию с расширенной лимфодиссекцией, холецистэктомией, резекцией абдоминального сегмента пищевода и резервуарной еюногастропластикой.
Желудок мобилизован с лимфодиссекцией ретропанкреатодуоденально, по ходу печеночно-двенадцатиперстной связки, малый сальник отделен у основания печени, вскрыта брюшина над пищеводом и по переднему краю правой ножки диафрагмы выполнена лимфодиссекция по ходу печеночной артерии, селезеночной артерии, чревного ствола. Коронарная вена и левая желудочная артерия обработаны поэтапно - перевязаны, пересечены, обработаны правые желудочные сосуды. Мобилизованы: большой сальник - от поперечно-ободочной кишки рассечена желудочно-ободочная связка, правые и левые желудочно-сальниковые сосуды. Выполнена лимфодиссекция в воротах селезенки, сагиттальная диафрагмотомия, лимфодиссекция наддиафрагмально. Мобилизован абдоминальный отдел пищевода, пересечены блуждающие нервы и пищевод после предварительного рассечения мышечной оболочки на уровне диафрагмального сегмента пищевод пересечен, двенадцатиперстная кишка пересечена на зажиме. Комбинированная гастрэктомия, лимфодиссекция D2-3. Линия отсечения пищевода отправлена на срочное патогистологическое исследование - ответ отрицательный. По стандартной методике сделана холецистэктомия.
Мобилизовали начальные отделы тощей кишки на 10-15 см дистальнее связки Трейца и выкраивали фрагмент кишки длиной 30,0 см на сосудистой ножке, непрерывность тощей кишки восстановили монофиламентной нитью однорядным прецизионным узловым анастомозом конец в конец. Проксимальный конец сегмента тощей кишки прошили линейным сшивающим аппаратом и погрузили в кисетный шов. Мобилизованный тонкокишечный трансплантат провели через «окно» в брыжейке позади и переместили выше поперечно-ободочной кишки.
Сформировали эзофагоеюноанастомоз с антирефлюксным клапанным механизмом, на примере и по принципу, изложенному в описании работы (патент РФ на изобретения №2474392).
Затем, отступя 3,0 см от сформированного эзофагоеюноанастомоза, создали резервуар путем продольного рассечения протяженностью 5,0 см противобрыжеечной стенки кишки и растягивания разреза нитями держалками в стороны за середины противоположных краев до поперечного состояния разреза и ушивали стенку кишки отдельными узловыми швами однорядно, затем сформировали угол и клапан для порционной эвакуации содержимого из резервуара: на 6,0 см ниже линии полученных швов тощую кишку сгибали вправо и сшивали между собой околобрыжеечные стороны полученного угла кишки на протяжении 1,5 см отдельными узловыми серозно-мышечно-подслизистыми швами, затем отрезок кишки повернули против часовой стрелки на 90 градусов и ушили несколькими стежками между собой левые околобрыжеечные края кишки на протяжении 1,0 см серозно-мышечно-подслизистыми швами напротив и параллельно шву, сформированному в углу на правой стенке кишки, после чего завершили восстановление непрерывности пищеварительного тракта двухрядным еюнодуоденоанастомозом конец в конец.
Через контрапертуру в правом подреберье поставлен дренаж в подпеченочное пространство. Проведен назоинтестинальный зонд для энтерального питания ниже еюноеюноанастомоза. Контроль гемостаза - сухо. Счет салфеток - 5 штук (верно). Рана ушита послойно наглухо. Спирт на кожу. Асептическая повязка. Объем кровопотери во время операции: около 150,0 мл. Макропрепарат:
1. Лимфоузлы ретропанкреатодуоденальные.
2. Лимфоузлы наддиафрагмальные.
3. Линия отсечения пищевода.
4. Желудок, сальники.
5. Желчный пузырь.
Послеоперационный диагноз: с-г желудка T3NxM0 после хирургического лечения, 2 кл.гр.
Осложнений в ближайшем и отдаленном послеоперационном периоде не было.
На контрольной рентгенограмме с пероральным приемом водорастворимого контраста (на 5-е сутки) отмечена хорошая проходимость трансплантата и состоятельность сформированных соустий. Контраст порциями поступает из пищевода в резервуар, откуда эвакуируется дробно через сформированный клапан, ретроградного движения контраста не отмечено.
Спустя 6 месяцев после операции выполнена рентгенография трансплантата с бариевой взвесью в объеме 200,0 мл. При рентгеноскопии отмечается порционное поступление контраста в резервуар, где идет его накопление до объема 180 мл, затем контраст дробно, порциями по 40-50 мл поступает ниже через сформированный клапан, затем порционно - в двенадцатиперстную кишку. Рефлюкса контраста в резервуар нет. Больной за прошедшие полгода набрал 8 кг, восстановилась дооперационная масса тела. Явления демпинг-синдрома отсутствуют.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАМЕЩЕНИЯ ЖЕЛУДКА ПОСЛЕ ГАСТРЭКТОМИИ | 2011 |
|
RU2474392C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ НЕПРЕРЫВНОСТИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПОСЛЕ ГАСТРЭКТОМИИ | 2020 |
|
RU2735811C1 |
| СПОСОБ ПРОФИЛАКТИКИ ДЕМПИНГ-СИНДРОМА ПОСЛЕ ГАСТРЭКТОМИИ | 1999 |
|
RU2148959C1 |
| СПОСОБ ФОРМИРОВАНИЯ АНТИРЕФЛЮКСНОГО КЛАПАНА НА ИНТЕРПОНИРОВАННОМ СЕГМЕНТЕ ТОЩЕЙ КИШКИ ПОСЛЕ ГАСТРЭКТОМИИ | 2019 |
|
RU2712042C1 |
| СПОСОБ ФОРМИРОВАНИЯ ИСКУССТВЕННОГО ЖЕЛУДКА | 2010 |
|
RU2445018C2 |
| СПОСОБ ПЕРВИЧНОЙ ЕЮНОГАСТРОПЛАСТИКИ ПОСЛЕ ГАСТРЭКТОМИИ | 1999 |
|
RU2189789C2 |
| СПОСОБ РЕДУОДЕНИЗАЦИИ С СОЗДАНИЕМ КИШЕЧНОГО РЕЗЕРВУАРА ПРИ БОЛЕЗНЯХ ОПЕРИРОВАННОГО ЖЕЛУДКА ПОСЛЕ ГАСТРЭКТОМИИ В ПЕТЛЕВОЙ РЕКОНСТРУКЦИИ ПО БРАУНУ | 2023 |
|
RU2801773C1 |
| СПОСОБ ЕЮНОГАСТРОПЛАСТИКИ С ФОРМИРОВАНИЕМ СИММЕТРИЧНОГО ИЗОПЕРИСТАЛЬТИЧЕСКОГО РЕЗЕРВУАРА | 2019 |
|
RU2712064C1 |
| СПОСОБ РЕДУОДЕНИЗАЦИИ С ФОРМИРОВАНИЕМ АНТИРЕФЛЮКСНОГО КЛАПАНА ПРИ БОЛЕЗНЯХ ОПЕРИРОВАННОГО ЖЕЛУДКА ПОСЛЕ ГАСТРЭКТОМИИ В ПЕТЛЕВОЙ РЕКОНСТРУКЦИИ ПО БРАУНУ | 2023 |
|
RU2801772C1 |
| СПОСОБ ЕЮНОГАСТРОПЛАСТИКИ ПРИ ГАСТРЭКТОМИИ | 1994 |
|
RU2121304C1 |
Изобретение относится к хирургии и может быть применимо для восстановления непрерывности пищеварительного тракта после гастрэктомии. Выкраивают фрагмент кишки длиной 30,0 см на сосудистой ножке. Непрерывность тощей кишки восстанавливают анастомозом конец в конец. Формируют эзофагоеюноанастомоз. Отступя 3,0 см от эзофагоеюноанастомоза продольно рассекают протяженностью 5,0 см противобрыжеечную стенку кишки, растягивают разрез нитями-держалками в стороны за середины противоположных краев до поперечного состояния разреза, ушивают стенку кишки отдельными узловыми швами однорядно. На 6,0 см ниже линии полученных швов тощую кишку сгибают вправо и сшивают между собой околобрыжеечные стороны полученного угла кишки на протяжении 1,5 см отдельными узловыми серозно-мышечно-подслизистыми швами. Затем отрезок кишки поворачивают против часовой стрелки на 90 градусов и ушивают несколькими стежками между собой левые околобрыжеечные края кишки на протяжении 1,0 см серозно-мышечно-подслизистыми швами напротив и параллельно шву, сформированному в углу на правой стенке кишки. Завершают восстановление непрерывности пищеварительного тракта двухрядным еюнодуоденоанастомозом конец в конец. Способ позволяет создать новый орган, замещающий желудок, обеспечивающий выполнение пищеварительной, резервуарной, клапанно-эвакуаторной функций. 4 ил., 1 пр.
Способ восстановления непрерывности пищеварительного тракта после гастрэктомии, включающий выкраивание и перемещение трансплантата тощей кишки в окне брыжейки позади поперечно-ободочной кишки, наложение трех дигестивных соустий: эзофагоеюноанастомоза, межкишечного еюноеюноанастомоза и еюнодуоденоанастомоза, отличающийся тем, что выкраивают фрагмент кишки длиной 30,0 см на сосудистой ножке; непрерывность тощей кишки восстанавливают анастомозом конец в конец, формируют эзофагоеюноанастомоз, отступя 3,0 см от которого создают резервуар путем продольного рассечения протяженностью 5,0 см противобрыжеечной стенки кишки и растягивания разреза нитями держалками в стороны за середины противоположных краев до поперечного состояния разреза и ушивают стенку кишки отдельными узловыми швами однорядно, затем формируют угол и клапан для порционной эвакуации содержимого из резервуара: на 6,0 см ниже линии полученных швов тощую кишку сгибают вправо и сшивают между собой околобрыжеечные стороны полученного угла кишки на протяжении 1,5 см отдельными узловыми серозно-мышечно-подслизистыми швами, затем отрезок кишки поворачивают против часовой стрелки на 90 градусов и ушивают несколькими стежками между собой левые околобрыжеечные края кишки на протяжении 1,0 см серозно-мышечно-подслизистыми швами напротив и параллельно шву, сформированному в углу на правой стенке кишки, после чего завершают восстановление непрерывности пищеварительного тракта двухрядным еюнодуоденоанастомозом конец в конец.
| СПОСОБ ЗАМЕЩЕНИЯ ЖЕЛУДКА ПОСЛЕ ГАСТРЭКТОМИИ | 2011 |
|
RU2474392C1 |
| СПОСОБ ПРОФИЛАКТИКИ ДЕМПИНГ-СИНДРОМА ПОСЛЕ ГАСТРЭКТОМИИ | 1999 |
|
RU2148959C1 |
| ПОЛЯКОВ М.А | |||
| О комбинированных гастрэктомиях с формированием искусственного желудка по новой методике | |||
| Вестник хирургии, 1984(3) т.32 | |||
| DONG JIN KIM et al | |||
| Near-Total Gastrectomy Preserving the Lower Esophageal Sphincter Followed by Jejunal Pouch Interposition as a Treatment for Upper Gastric Cancer | |||
| J Korean Surg Soc | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| HUNT CJ | |||
| Construction of food pouch from segment of jejunum as substitute for stomach in total gastrectomy | |||
| AMA Arch Surg | |||
| Приспособление для отвешивания жидкости без предварительного определения веса тары | 1925 |
|
SU1952A1 |
Авторы
Даты
2018-06-01—Публикация
2016-12-07—Подача