Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно, к хирургии и может быть использовано в лечении болезней оперированного желудка.
Уровень техники
Патологические синдромы пищеварения после гастрэктомии (ГЭ) известны давно, и тенденции к снижению по данным современной литературы не прослеживаются, составляя в среднем 40-60% [Чайка А.В., Хомяков В.М., Рябов А.Б. Функциональные последствия операций по поводу злокачественных опухолей желудка: профилактика, диагностика и лечение пострезекционных нарушений. Рос журнал гастроэнтерол гепатол колопроктол. 2018. 28 (3). С. 4-17]. Известно более 70 вариантов восстановления пищеварительного тракта после ГЭ и резекции желудка, что свидетельствует о неудовлетворенности хирургов функциональными результатами существующих операций. Наибольшей критике подвергается петлевая реконструкция по Брауну, при которой не только выключается из пассажа пищи двенадцатиперстная кишка (ДПК), но и не менее 50 см тощей кишки, что приводит к таким патологическим состояниям, как: демпинг-синдром (ДС), агастральная астения, кахексия и др. [Ян Цинь Еюногастропластика как способ реконструкции пищеварительного тракта после гастрэктомии: дис. канд. мед. наук 12.10.17 Хирургия. Москва 2015 г. – 154 с]. Прогрессирующие формы болезней оперированного желудка (БОЖ), являются показанием к реконструктивной операции, успех которой не гарантирован. Существующие способы повторных вмешательств после ГЭ, в своем большинстве заключаются в переводе Брауновской петли в Ру [Гибадулин Н.В., Гибадулин И.О. Реконструкция пищеводно-кишечных и желудочно-кишечных анастомозов по Ру как метод хирургической коррекции постгастрезекционных и постгастрэктомических синдромов. Хирургия им. Н.И. Пирогова. 2011. (11). С.32-36]. Недостатком данного способа является низкая эффективность лечения и профилактики ДС, который был зафиксирован автором у 12,5% больных после повторной операции в отдаленном периоде. В любой петлевой реконструкции после ГЭ заложены патогенетические предпосылки к развитию ДС - выключение ДПК из пассажа пищи [Davis JL, Ripley RT. Postgastrectomy Syndromes and Nutritional Considerations Following Gastric Surgery. Surg Clin North Am. 2017 Apr;97(2):277-293. doi: 10.1016/j.suc.2016.11.005. PMID: 28325187].
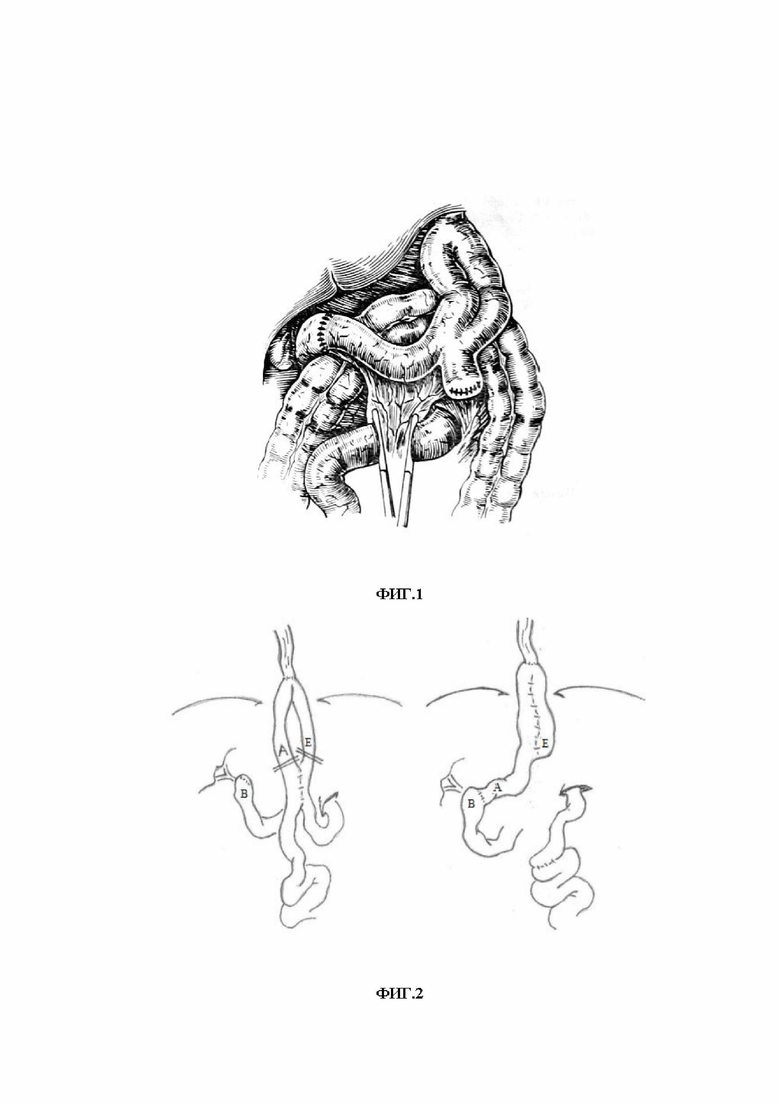
Из уровня техники известен способ редуоденизации при болезнях оперированного желудка после гастрэктомии в петлевой реконструкции по Брауну (Захаров Е.И. Еюногастропластика при болезнях оперированного желудка / Е.И. Захаров, А.Е. Захаров // – М.: Медицина. – 1970. – 232 с.). Способ включает транспозицию отводящей петли в культю ДПК после ранее перенесенной ГЭ с реконструкцией по Брауну. После мобилизации пересекают приводящую кишку ниже Брауновского соустья, прилежащий к анастомозу конец ушивают наглухо. Затем отводящую кишечную петлю пересекают ниже межкишечного анастомоза на таком уровне, чтобы без натяжения сформировать анастомоз с культей ДПК (фиг.1). Далее восстанавливают непрерывность кишечника соединяя между собой приводящий и отводящий отдел.
Однако известный способ характеризуется низкой эффективностью лечения демпинг-синдрома (ДС) в связи с отсутствием кишечного резервуара, который необходим для обеспечения физиологического варианта гастропластики. Основными принципами данной гастропластики являются редуоденизация – восстановление дуоденального пассажа, и резервуарность - создание кишечного резервуара [Lehnert T., Buhl K. Techniques of reconstruction after total gastrectomy for cancer. British journal of surgery. 2004. Т. 91. – №. 5. P. 528-539]. Автором известного способа было отмечено, что после проведенной реконструкции в отдаленном периоде у 10,1% пациентов развился ДС тяжелой и средне-тяжелой формы.
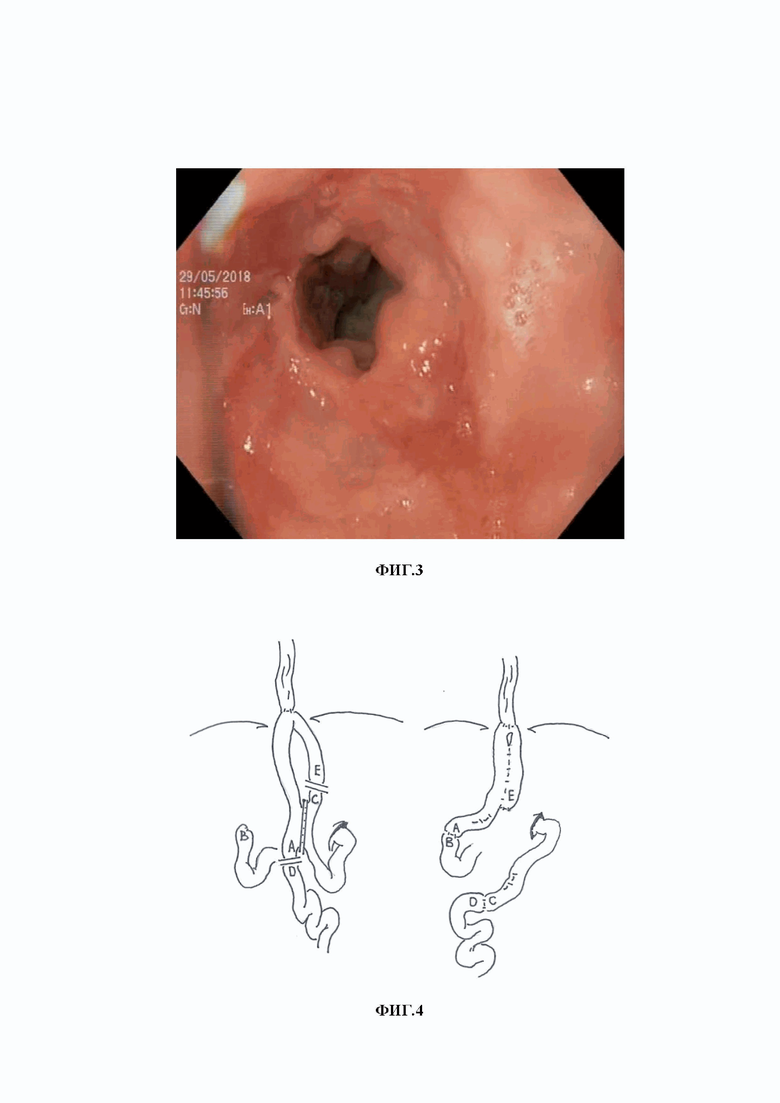
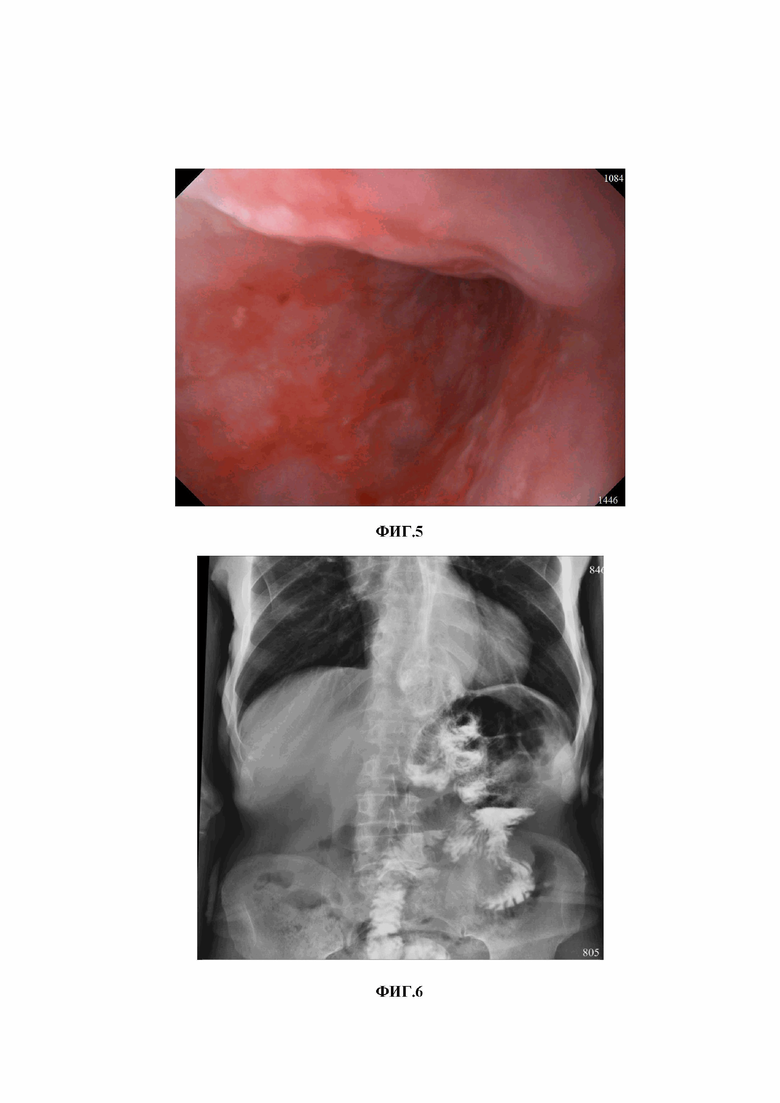
Наиболее близким к заявленному изобретению является способ редуоденизации при болезнях оперированного желудка после гастрэктомии в петлевой реконструкции по Брауну, выполненный в НМИЦ хирургии имени А.В. Вишневского в 2015 году [Козлов В.А. Повторные реконструкции пищеварительного тракта после операций на желудке. дис. канд. мед. наук 12.10.17. Москва. 2019 г. 174 с.]. Способ основан на выполнении транспозиции отводящей петли в культю ДПК с формированием довольно емкого изоантиперистальтического резервуара после ГЭ с соустьем по Брауну (фиг.2). Приводящую и отводящую петли тонкой кишки отсекали выше межкишечного соустья, не разобщая последний. Отводящую и приводящую петлю соединяли между собой анастомозом по типу «бок в бок», дистальный конец отводящей петли анастомозировали с нисходящей частью ДПК. Однако формирование резервуара по описанному способу требует высокой мобилизации эзофагоеюноанастомоз (ЭЕА) для создания резервуара на всем протяжении приводящей и отводящей петли кишки. Этот факт не только усложняет операцию, но и создает высокий риск повреждения пищевода при выделении ЭЕА, так как резервуар начинают формировать с просвета пищеводно-тонкокишечного соустья. В отдаленном периоде через 2,5 года у пациента, которому была проведена реконструкция данным способом, при контрольном ФГДС был выявлен заброс желчи в резервуар и эрозивный эзофагит (фиг.3).
Технической проблемой, решаемой изобретением, является разработка способа повторной реконструкции пищеварительного тракта при болезнях оперированного желудка с восстановлением естественного пассажа пищи и формированием кишечного резервуара после ранее перенесенной ГЭ с реконструкцией на петле по Брауну, лишенное вышеперечисленных недостатков.
Раскрытие сущности изобретения
Техническим результатом, на достижение которого направлено заявленное изобретение, является хирургическое лечение тяжелых форм БОЖ за счет повторной реконструкции пищеварительного тракта после ГЭ с восстановлением естественного пассажа пищи и созданием кишечного резервуара.
Заявляемое изобретение уменьшает клинические проявления БОЖ и устраняет развитие их тяжелых форм после ГЭ путем восстановления пассажа пищи по ДПК; создает условия для депонирования пищи в кишечном резервуаре, замедляя ее пассаж в ДПК и по кишечнику, и обратному забросу желчи в пищевод. Изобретение также направлено на возможную профилактику интраоперационных осложнений, связанных с ятрогенной перфорацией пищеводно-тонкокишечного анастомоза при мобилизации его из средостения.
Технический результат достигается при использовании способа редуоденизации, включающего создание кишечного резервуара после гастрэктомии в петлевой реконструкции по Брауну, при этом выполняют разобщение межкишечного соустья, отводящую петлю ЭЕА пересекают на расстоянии 25 см дистальнее от него, и соединяют с культей ДПК двухрядным анастомозом конец в конец, приводящую петлю пересекают ниже ЭЕА на расстояние 15 см, и на протяжении 10 см соединяют с отводящей кишкой однорядным непрерывным швом бок в бок, формируя изоантиперистальтический кишечный резервуар, после чего восстанавливают непрерывность тонкой кишки, соединяя приводящий и отводящий ее отдел соустьем конец в конец без выделения пищеводно-тонкокишечного соустья.
Изоантиперистальтический кишечный резервуар формируют длиной 12 см, располагая его на 5 см ниже ЭЕА. При осуществлении заявленного способа выполняют разобщение межкишечного соустья, тем самым дополнительно включают в пассаж пищи 15 см тощей кишки, ранее выключенной из пищеварения. Кроме того, нет необходимости высокой мобилизации пищеводного анастомоза, предотвращая ее возможное повреждения, при выделении из средостения.
Краткое описание чертежей
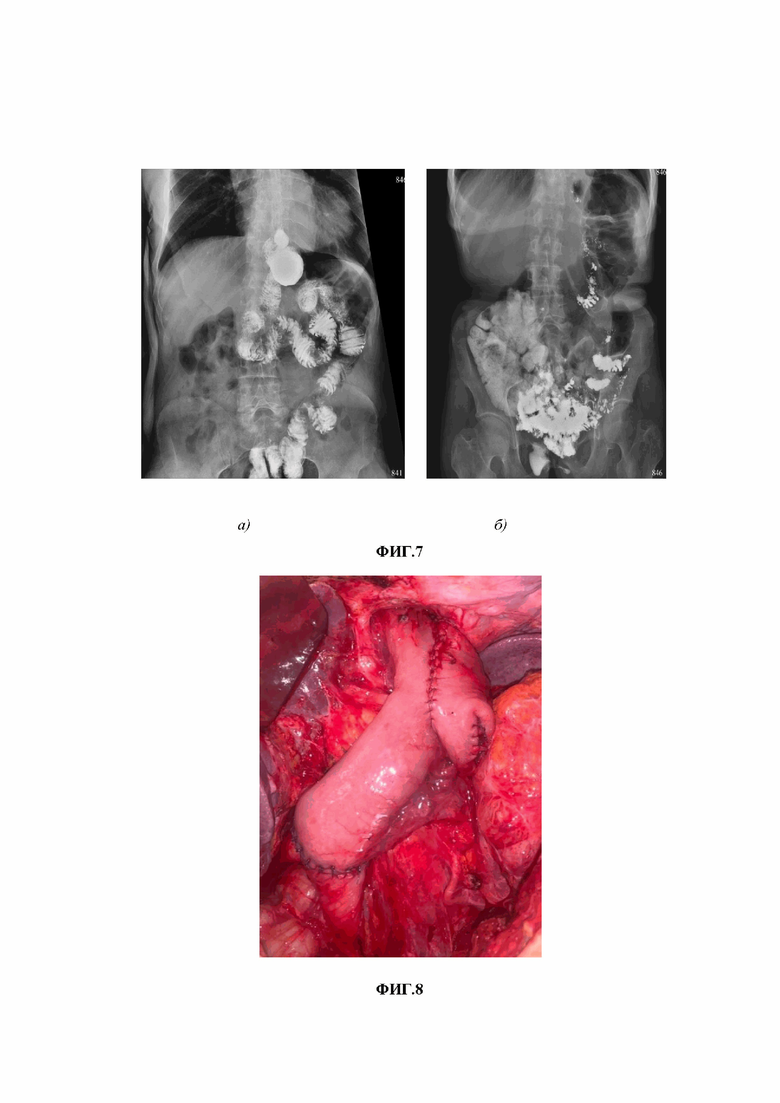
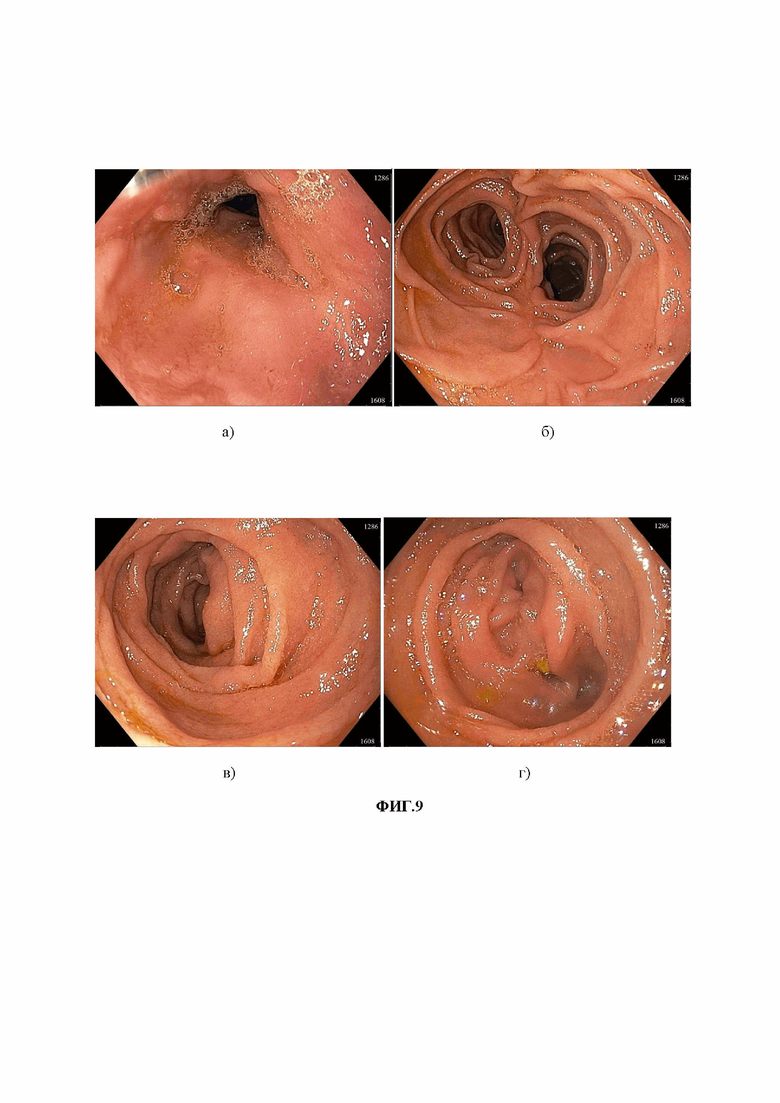
Изобретение поясняется чертежами, где на фиг.1 представлено изображение варианта реконструкции по Е.И. Захарову; на фиг. 2 представлена схема транспозиции отводящей петли в культю ДПК и формированием кишечного резервуара по способу-прототипу: А) – отводящая петля ЭЕА; B) – культя ДПК; Е) – приводящая петля; на фиг.3 представлена эндоскопическое исследование больного через 3 года после транспозиции отводящей петли в культю ДПК и формированием кишечного резервуара по способу-прототипу; на фиг.4 представлена схема реконструкции после ГЭ по Брауну с редуоденизацией и формированием кишечного резервуара по заявленному способу, где: А) – отводящая петля ЭЕА; В) – культя ДПК; С) – дистальный отдел приводящей петли; D) – дистальный отдел отводящей петли; E) – приводящая петля; на фиг.5 – результаты эндоскопического исследования больного Б. до реконструктивной операции (фото пищевода с множественными линейными эрозиями); на фиг. 6 – результаты рентгенологического исследования больного Б. до реконструктивной операции; на фиг. 7 – результаты рентгенологического исследования больного Б. в отдаленные сроки после реконструктивной операции: а) – после перорального приема сульфата бария; б) - через 2,5 часа; на фиг. 8 - интраоперационная фотография завершенной реконструкции с редуоденизацией и формированием кишечного резервуара; на фиг. 9 – результаты эндоскопического исследования в отдаленном периоде: а) – пищевод; б) – кишечный резервуар; в) - отводящая петля ниже резервуара; г) – дуоденальный анастомоз.
Осуществление изобретения
Способ осуществляют следующим образом.
Из срединного доступа выполняют лапаротомию с иссечением послеоперационного рубца, далее мобилизуют отводящую и приводящую петли тонкой кишки эзофагоеюноанастомоза с межкишечным Брауновским соустьем. После чего осуществляют разобщение межкишечного (Брауновского) анастомоза линейным сшивающим аппаратом, механический шов дополнительно перитонизируют непрерывным серо-серозным швом. Приводящую петлю пересекают сшивающим аппаратом на 15 см от пищеводно-тонкокишечного анастомоза. Линию механического шва ушивают отдельными серо-серозными швами. Дистальный отдел бывшей приводящей петли перемещают ниже брыжейки поперечной ободочной кишки в ортотопическое положение. Выполняют мобилизацию культи ДПК, на протяжении 1,5-2 см, освобождая ее от окружающих тканей для последующего беспрепятственного формирования концевого двухрядного еюнодуоденоанастомоза. После чего на расстоянии 25 см от пищеводно-тонкокишечного анастомоза линейным аппаратом пересекают отводящую петлю с сохранением питающей ножки тонкокишечного сегмента с таким расчетом, чтобы можно было без натяжения анастомозировать его с культей ДПК. Обычно это сегмент кишки, питающийся от 3-ей кишечной артерии. Сосудистая архитектоника в этой зоне, как правило, представлена одинарной или двойной дугой и расположена дистальней по ходу верхней брыжейной артерии. Брыжейка этого участка кишки находится в средней части брюшной полости, подвижна и имеет достаточную длину, и, как правило, именно этот отдел тонкой кишки используют для создания Брауновской петли. При оценке кровообращения ориентируются на макроскопические критерии жизнеспособности трансплантата — цвет, тургор, перистальтическую активность и пульсацию краевых артерий. Даже локальный венозный стаз расценивают как признак сомнительной жизнеспособности. Далее восстанавливают целостность тонкого кишечника путем формирования однорядного анастомоза между приводящим и отводящим отделом, отдельными узловыми швами. После чего соединяют конец дистальной части отводящей петли с культей ДПК отдельными узловыми швами, двухрядно. Затем приступают к созданию резервуара, сшивая между собой приводящую и отводящую части. Предварительно накладывают три наводящих отдельных узловых шва. Первый шов накладывают, отступив 2 см от культи бывшей приводящей петли тонкой кишки по брыжеечному краю, соединяют ее с отводящей петлей в средней трети также по брыжеечному краю. Второй шов формируют выше на 5 см, а третий так же отступив 5 см от второго, при этом выделение пищевода и ЭЕА не требуется. Важным в данном способе является формирование резервуара не выше 5 см от ЭЕА. После чего вскрывают просвет кишки продольно, отступив 0,5 см от ее брыжеечного края, на протяжении 12 см, затем непрерывным швом формируют заднюю и переднюю стенку резервуара, соединяя приводящий и отводящий отдел интерпонированного сегмента. Таким образом, нет необходимости дополнительной мобилизации ЭЕА и разделения плотных рубцовых сращений в средостении при ранее высоко сформированном соустье. Такой способ позволяет избежать нежелательного ятрогенного повреждения ЭЕА. Этот факт упрощает реконструкцию, но в то же время позволяет реализовать основные принципы физиологической гастропластики: резервуарность и редуоденизацию. Окончательный вид реконструкции представлен на фиг. 4.
Заявленным способом было оперировано 5 пациентов. Средний возраст составил 61,5 лет. Все пациенты в раннем послеоперационном периоде проходили комплекс обследования, оставались под наблюдением в отдаленном периоде.
Клинические примеры:
Пример №1. Больной Б. 69 лет. В 2017 году больной перенес ГЭ с реконструкцией на петле по Брауну по поводу рака желудка IА рT1N0M0. Практически сразу после операции его начала беспокоить выраженная слабость после приема пищи, потливость. Появился частый жидкий стул после каждого приема пищи, лечился консервативно у гастроэнтеролога по месту жительства, соблюдал диеты. Однако, несмотря на выполнение рекомендаций гастроэнтеролога, в течение последнего года отметил прогрессивное снижение массы тела, нарастание слабости. По данным МСКТ, признаков прогрессирования и рецидива онкопроцесса не выявлено.
23.08.2018 больной госпитализирован в НМИЦ хирургии имени А.В. Вишневского для реконструктивной операции с жалобами на слабость после приема пищи, головокружение, тошноту, диарею до 5-6 раз в сутки, снижение массы тела на 41 кг после операции. При поступлении: ИМТ – 17,3, вес – 46 кг, белок – 60,1 г/л, альбумин – 32,8 г/л, гемоглобин 117 г/л, лимфоциты 1,021*109/л, глюкоза 7,65 ммоль/л.
По данным ФГДС имеются множественные эрозии пищевода, ЭЕА проходим (фиг.5). По данным рентгенографии органов брюшной полости после приема перорального контраста сульфата бария, он практически заполняет начальные отделы тонкой кишки (фиг.6). Выставлен диагноз: Тяжелый демпинг-синдром. Эрозивный эзофагит. Состояние после гастрэктомии от 2017 г. 27.08.2018 в НМИЦ выполнена редуоденизация отводящей петли ЭЕА с формированием резервуара вышеописанным способом. Послеоперационный период протекал удовлетворительно, больной выписан на 10-е сутки после операции.
При контрольном рентгенологическом исследовании с контрастом при выписке от 5.09.18: Пищевод и ЭЕА проходимы, не деформированы, эвакуация не нарушена. При первом глотке отмечается равномерное контрастирование резервуара, после происходит порционная эвакуация контраста в ДПК и нижележащие отделы кишки.
Через 3,5 года после операции чувствует себя хорошо, диету и режим питания соблюдает. Аппетит хороший, прибавил в весе на 12 кг с момента операции. Стул оформленный регулярный, 1-2 раза в день. ИМТ – 21,8, вес 58 кг, белок – 65,2 г/л, альбумин – 37,38 г/л, гемоглобин 129 г/л, лимфоциты 1,246*109/л, глюкоза 4,79 ммоль/л. По данным МСКТ органов брюшной полости от 06.02.2022 данных за рецидив, прогрессирование онкологического заболевания нет. При ФГДС от 13.02.2022 аппарат свободно проходим через ЭЕА, резервуар на 50 см от резцов, в просвете его помарки прозрачной желчи. Резервуар хорошо расправляется воздухом, еюнодуоденоанастомоз проходим, шириной до 3 см, ДПК без особенностей. При рентгенологическом исследовании с контрастом от 08.02.2022: пищевод проходим, не деформирован. Эзофагоеюноанастомоз смыкается, заброса контраста в пищевод нет. Резервуар заполняется туго, после происходит порционная эвакуация в ДПК и нижележащие отделы кишечника (фиг.7а). Через час контраст в петлях тонкой кишки и помарки контраста в резервуаре. Через два часа контраст в петлях подвздошной кишки и в следовом количестве в куполе слепой кишки (фиг.7б).
Пример №2. Больная К. 66 лет. Из анамнеза в июле 2019 года перенесла ГЭ с реконструкцией на петле по Брауну по поводу рака желудка IIIA T4bN0M0, 3 курса химиотерапии капецитабином. После операции отметила появление слабости после приема пищи, быструю утомляемость, частый жидкий стул. Данные жалобы связывала с химиотерапией, однако после ее завершения жалобы сохранились, кроме того, больная потеряла в весе 20 кг, и присоединилась постоянная изжога. По данным МСКТ признаков прогрессирования и рецидива онкопроцесса не выявлено.
19.11.2020 больная госпитализирована в НМИЦ хирургии имени А.В. Вишневского для реконструктивной операции с жалобами на выраженную слабость, нарастающую после приема пищи, диарею до 4 раз в сутки, изжогу, снижение массы тела на 25 кг с момента операции. При поступлении: ИМТ – 16,1, вес – 43 кг, белок – 51,4 г/л, альбумин – 28,4 г/л, гемоглобин 99 г/л, лимфоциты 0,951*109/л, глюкоза 9,24 ммоль/л.
При ФГДС ЭЕА расположен на 37 см от резцов, пищевод в этой зоне отечный, слизистая его гиперемирована. В отводящей и приводящей петле ЭЕА желчь. Установлен зонд для питания в отводящую петлю, для энтерального питания с целью предоперационной подготовке. Выставлен диагноз: Тяжелый демпинг-синдром. Катаральный эзофагит. Прогрессирующая астения, кахексия. Состояние после гастрэктомии от 2019 г. В НМИЦ 2.12.2020 выполнена редуоденизация отводящей петли ЭЕА, с формированием резервуара по заявляемой методике (фиг 8). Послеоперационный период протекал удовлетворительно, больная выписана на 6-е сутки после операции.
При контрольном рентгенологическом исследовании с контрастом при выписке от 8.12.20: Пищевод и ЭЕА проходимы, не деформированы, эвакуация не нарушена. При первом глотке отмечается заполнение контрастом резервуара, после прослеживается порционная его эвакуация в ДПК и нижележащие отделы кишки.
Через 2 года и 2 месяца после операции чувствует себя хорошо, строго соблюдает диету и режим питания. При погрешности отмечает эпизоды легкой слабости, которая не влияет на привычный ритм жизни. Больная не работает ввиду пенсионного возраста. Прибавил в весе на 8 кг с момента операции. Стул оформленный регулярный, 1-2 раза в день. ИМТ – 19,2, вес 51 кг, белок – 60,1 г/л, альбумин – 35,2 г/л, гемоглобин 115 г/л, лимфоциты 1,101*109/л, глюкоза 3,46 ммоль/л. По данным МСКТ органов брюшной полости от 01.02.2023 данных за рецидив, прогрессирование онкологического заболевания нет. При ФГДС от 22.02.2023 пищеводе не изменен (фиг. 9а) аппарат свободно проходим через ЭЕА, резервуар на 40 см от резцов, хорошо расправляется воздухом, в просвете желчи нет, ширина резервуара 5 см (фиг. 9б), отводящая петля расправляется воздухом хорошо (фиг. 9в) еюнодуоденоанастомоз проходим (фиг. 9г), ДПК без особенностей. При рентгенологическом исследовании с пероральным приемом сульфата бария от 27.02.2023: пищевод проходим, не деформирован. Эзофагоеюноанастомоз смыкается, заброса контраста в пищевод нет. После заполнения контрастом резервуара происходит порционная его эвакуация в ДПК и нижележащие отделы кишечника. Через 2 часа контраст в дистальных отделах подвздошной кишки.
У всех больных, оставшихся под наблюдением в отдаленном периоде, отмечается замедление пассажа пищи по кишечнику благодаря кишечному резервуару и ДПК. Время пассажа бария по кишечнику приближаются к физиологической норме, а антропометрические и лабораторные показатели пациентов в отдаленном периоде свидетельствуют об улучшении питательного статуса.
Таким образом, предлагаемый способ редуоденизации с формированием кишечного резервуара при болезнях оперированного желудка после гастрэктомии по Брауну позволяет предотвратить и устранить ускоренный пассаж пищи по кишечнику, обеспечив порционную его эвакуацию, что в свою очередь предотвращает развитие тяжелых форм ДС и РЭ.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РЕДУОДЕНИЗАЦИИ С ФОРМИРОВАНИЕМ АНТИРЕФЛЮКСНОГО КЛАПАНА ПРИ БОЛЕЗНЯХ ОПЕРИРОВАННОГО ЖЕЛУДКА ПОСЛЕ ГАСТРЭКТОМИИ В ПЕТЛЕВОЙ РЕКОНСТРУКЦИИ ПО БРАУНУ | 2023 |
|
RU2801772C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ НЕПРЕРЫВНОСТИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПОСЛЕ ГАСТРЭКТОМИИ | 2020 |
|
RU2735811C1 |
| СПОСОБ РЕКОНСТРУКЦИИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПОСЛЕ ПАНКРЕАТОДУОДЕНАЛЬНОЙ РЕЗЕКЦИИ И ЭКСТИРПАЦИИ ЖЕЛУДКА С ВОССТАНОВЛЕНИЕМ ФИЗИОЛОГИЧЕСКОЙ И АНАТОМИЧЕСКОЙ ЦЕЛОСТНОСТИ | 2016 |
|
RU2636881C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПЕПТИЧЕСКИХ ЯЗВ ГАСТРОЭНТЕРОАНАСТОМОЗА ПОСЛЕ РЕЗЕКЦИИ ЖЕЛУДКА ПО БИЛЬРОТ-II | 2004 |
|
RU2278620C1 |
| СПОСОБ ЭЗОФАГОПЛАСТИКИ КОМБИНИРОВАННЫМ ВИСЦЕРАЛЬНЫМ ТРАНСПЛАНТАТОМ ПОСЛЕ СУБТОТАЛЬНОЙ ЭЗОФАГЭКТОМИИ ПРИ СОЧЕТАННЫХ ПОРАЖЕНИЯХ ПИЩЕВОДА И ЖЕЛУДКА | 2021 |
|
RU2770554C1 |
| СПОСОБ ФОРМИРОВАНИЯ АРЕФЛЮКСНОГО ПИЩЕВОДНО-ТОНКОКИШЕЧНОГО АНАСТОМОЗА | 2009 |
|
RU2437623C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПОСЛЕ ГАСТРЭКТОМИИ | 2000 |
|
RU2200478C2 |
| СПОСОБ ФОРМИРОВАНИЯ ИСКУССТВЕННОГО ЖЕЛУДКА | 2010 |
|
RU2445018C2 |
| СПОСОБ ЕЮНОГАСТРОПЛАСТИКИ С ФОРМИРОВАНИЕМ СИММЕТРИЧНОГО ИЗОПЕРИСТАЛЬТИЧЕСКОГО РЕЗЕРВУАРА | 2019 |
|
RU2712064C1 |
| СПОСОБ ФОРМИРОВАНИЯ АНТИРЕФЛЮКСНОГО КЛАПАНА НА ИНТЕРПОНИРОВАННОМ СЕГМЕНТЕ ТОЩЕЙ КИШКИ ПОСЛЕ ГАСТРЭКТОМИИ | 2019 |
|
RU2712042C1 |
Изобретение относится к медицине, а именно к абдоминальной хирургии. Выполняют разобщение межкишечного соустья, отводящую петлю эзофагоеюноанастомоз (ЭЕА) пересекают на расстоянии 25 см дистальнее от него и соединяют с культей ДПК двухрядным анастомозом конец в конец, приводящую петлю пересекают ниже ЭЕА на расстоянии 15 см и на протяжении 10 см соединяют с отводящей кишкой однорядным непрерывным швом бок в бок, формируя изоантиперистальтический кишечный резервуар, после чего восстанавливают непрерывность тонкой кишки, соединяя приводящий и отводящий ее отдел соустьем конец в конец, не выделяя пищеводно-тонкокишечное соустье. Способ направлен на уменьшение клинических проявлений БОЖ, создание условий для депонирования пищи в кишечном резервуаре, замедляя ее пассаж в ДПК и по кишечнику, и обратного заброса желчи в пищевод. 1 з.п. ф-лы, 9 ил., 2 пр.
1. Способ редуоденизации, включающий создание кишечного резервуара после гастрэктомии при петлевой реконструкции по Брауну, отличающийся тем, что выполняют разобщение межкишечного соустья, отводящую петлю эзофагоеюноанастомоз (ЭЕА) пересекают на расстоянии 25 см дистальнее от него и соединяют с культей ДПК двухрядным анастомозом конец в конец, приводящую петлю пересекают ниже ЭЕА на расстоянии 15 см и на протяжении 10 см соединяют с отводящей кишкой однорядным непрерывным швом бок в бок, формируя изоантиперистальтический кишечный резервуар, после чего восстанавливают непрерывность тонкой кишки, соединяя приводящий и отводящий ее отдел соустьем конец в конец, не выделяя пищеводно-тонкокишечное соустье.
2. Способ по п.1, отличающийся тем, что изоантиперистальтический кишечный резервуар формируют длиной 12 см на 5 см ниже ЭЕА.
| Козлов В.А | |||
| Повторные реконструкции пищеварительного тракта после операций на желудке | |||
| Дис | |||
| канд | |||
| мед | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Москва | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПОСЛЕ ГАСТРЭКТОМИИ | 2000 |
|
RU2200478C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ НЕПРЕРЫВНОСТИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПОСЛЕ ГАСТРЭКТОМИИ | 2016 |
|
RU2655980C1 |
| Lehnert T., Buhl K | |||
| Techniques of reconstruction after total gastrectomy for cancer | |||
| British journal of surgery, 2004, Т | |||
| Огнетушитель | 0 |
|
SU91A1 |
| P | |||
| Картинодержатель для рассматривания стереоскопических снимков | 1920 |
|
SU528A1 |
Авторы
Даты
2023-08-15—Публикация
2023-04-26—Подача