Изобретение относится к фармакологии, а именно к биологически активным веществам, влияющим на углеводный и липидный метаболизм, и может быть использовано в лечении сахарного диабета 2 типа (СД 2).
Сахарный диабет 2-ого типа (СД 2) - заболевание, характеризующееся резистентностью к инсулину, недостаточной утилизацией глюкозы и увеличением глюконеогенеза. В результате развивается гипергликемия и гиперлипидемия, которые, в свою очередь, вызывают диабетические осложнения, такие как потеря зрения, почечная и сердечная недостаточность.
Применение существующих антидиабетических препаратов осложнено риском развития гипогликемии, увеличением массы тела и неблагоприятными эффектами со стороны желудочно-кишечного тракта. Монотерапия эффективна лишь непродолжительное время и в дальнейшем не способна поддерживать стабильный уровень глюкозы, что создает необходимость применения комбинированной пероральной сахароснижающей терапии уже на ранних этапах заболевания [1].
Клеточная АМФ-активируемая протеинкиназа (АМРК) играет ключевую роль в регуляции энергетического гомеостаза клетки, участвует в регуляции метаболизма глюкозы и липидов и поэтому рассматривается как перспективная терапевтическая мишень для лечения СД 2, ожирения, метаболического синдрома и опухолевых заболеваний. Также показано, что AMPK является важным модулятором процесса старения, что реализуется через взаимодействие с mTOR (мишень рапамицина у млекопитающих) и сиртуинами [2].
При СД 2 основными инсулинорезистентностными органами являются печень, мышцы и жировая ткань. В печени AMPK контролирует гомеостаз глюкозы главным образом через ингибирование экспрессии генов глюконеогенеза. Кроме того, активация AMPK увеличивает фосфорилирование GSK3β (киназы гликогенсинтазы типа 3β), и, таким образом, снижает транскрипционную активность CRE (цАМФ-зависимых элементов ДНК) и экспрессию гена PEPCK-C в печени, подавляя глюконеогенез. AMPK также уменьшает печеночный липогенез. Активация AMPK миоцитов увеличивает окисление жирных кислот за счет уменьшения концентрации малонил-КоА-редуктазы путем ингибирования АСС и активации MCD. Повышенное окисление жирных кислот в митохондриях препятствует депонированию липидов и повышает чувствительность мышц к инсулину. Хроническая активация мышечной AMPK стимулирует окисление липидов и образование АТФ путем активации транскрипции митохондриальных ферментов β-окисления жирных кислот через коактиватор PPAR (PGC-1α).
Известен активатор AMPK AICAR (5-аминоимидазол-4-карбоксамид-рибонуклеотид, экспериментальный активатор AMPK). Его однократное введение в течение 24 повышает чувствительность к инсулину мышечной ткани, печени и организма в целом. Хроническая активация AMPK увеличивает уровни GLUT4, глюкокиназы и содержание гликогена в скелетных мышцах [3]. Таким образом, фармакологическая активация AMPK в печени и мышцах обладает широким спектром метаболических эффектов с высоким антидиабетогенным потенциалом.
В настоящее время ведется активная разработка лекарственных средств данного класса, однако ни одно из них до сих пор не дошло до стадии клинических испытаний [4].
Ингибирование протеин-тирозинфосфатазы типа 1B (PTP1B) также является перспективным направлением поиска новых лекарственных средств для терапии СД 2. Из всех протеинфосфатаз именно PTP1B играет ключевую роль в процессе дефосфорилирования рецептора инсулина и, соответственно, в модуляции инсулиновой сигнализации [4]. В настоящее время большинство исследований в данном направлении ведется на уровне молекулярного конструирования и синтеза высокоселективных, доступных для перорального приема ингибиторов, изучения зависимости между химической структурой, физико-химическими свойствами и функциональной активностью полученных соединений [5].
Среди потенциальных ингибиторов PTP1B выделяют соединение JTT-551-4-(5-(трет-бутил)тиазол-2-ил)-3-((4-(4-((4-(гептан-4-ил)фенокси)метил)фенил)тиазол-2-ил)метил)бутановая кислота, которое находится на стадии доклинического изучения антидиабетических свойств. Так, при пероральном введении JTT-551 у мышей с генетической моделью ожирения линии ob/ob и с сахарным диабетом линии db/db улучшался метаболизм глюкозы, предположительно, благодаря усилению инсулиновой сигнализации [6]. При хроническом введении JTT-551 у мышей с ожирением, индуцированным высококалорийной диетой, происходило снижение веса и нормализация метаболизма липидов и глюкозы [7].
Известен также NSC-87877 (натрия 8-гидрокси-7-((6-сульфонафтален-2-ил)диазенил)хинолин-5-сульфонат) - перспективный ингибитор PTP1B, активный в условиях in vitro и в клеточных культурах [9].
Не описаны соединения, обладающих активностью относительно обоих ферментов. В то же время такая стратегия представляется крайне привлекательной. Одновременное ингибирование PTP1B и активирование AMPK обладает синергетическим антидиабетогенным действием, позволяя как увеличить чувствительность периферических тканей к инсулину, так и усилить захват и утилизацию глюкозы, а также нормализовать метаболизм липидов за счет плейотропного влияния каскада AMPK на обменные процессы. В совокупности это будет способствовать сохранению функциональной массы β-клеток поджелудочной железы за счет снижения нагрузки и устранения повреждающих факторов.
Техническим результатом изобретения является одновременное повышение уровня активности фермента AMPK и ингибирование активности фермента PTP1B.
Технический результат достигается 2-[(1,1'-бифенил)-4ил]имидазо[2,1-а]-изохинолином формулы I:
Известно, что соединение I обладает контрацептивным действием [8]. Оно способно прерывать беременность [9, 10]. Один из методов получения описан в работе [11].
Ниже приведены примеры исследования АМРК-активирующих и PTP1B-ингибирующих свойств соединения формулы I.
Пример 1. Определение активности AMPK соединения I
Использовались следующие материалы и оборудование: AMPK (A1/B1/G1) Kinase Enzyme System (Promega #V1921, США); ADP-Glo™ Kinase Assay (Promega #V9101, США). Планшет 96-луночный белый (ThermoScientific NUNC #165306, США). Термошейкер для планшетов PST-60HL (Biosan, Латвия). Микропланшетный ридер Infinite М 200 PRO (Tecan, Австрия).
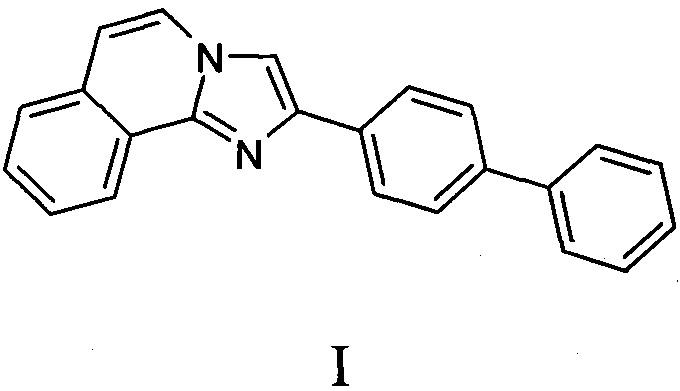
Реакционная смесь содержала 50 нг AMPK (A1/B1/G1), 100 мкМ АТФ, 100 мкМ АМФ, 0.2 мг/мл SAMStide (HMRSAMSGLHLVKRR), полученного из мышиной ацетил-коэнзим Акарбоксилазы α (аминокислоты 73-85) в конечном объеме 25 мкл. Реакционный буферный раствор: 40 мМ Трис (pH 7.5), 20 мМ MgCl2, 0.1 мг/мл БСА, 50 мМ ДТТ. Инкубация: 60 мин при 25°C. Детекция: измерение люминесценции, время интегрирования 500 мс. Исследуемое вещество вносилось в реакционную смесь в реакционном буферном растворе, содержащем 1,25% ДМСО и исследовалось в конечной концентрации 100 мкМ в двух повторениях в соответствии с СОП и руководством производителя реактивов [12]. Активность фермента рассчитывалась по отношению к отрицательному контролю - 100 мкМ АМФ, вызывающему максимальное АМФ-индуцированное активирование согласно предварительным исследованиям. В качестве вещества сравнения использовали N1-(β-D-рибофуранозил)-5-амино-4-карбоксамидоимидазол (AICAR, Sigma, США) [13].
На фиг. 1 приведен график, показывающий влияние соединения формулы I на активность AMPK. По оси ординат - активирование в %, по оси абсцисс - десятичный логарифм молярной концентрации соединения.
Пример 2. Определение активности PTP1B соединения I
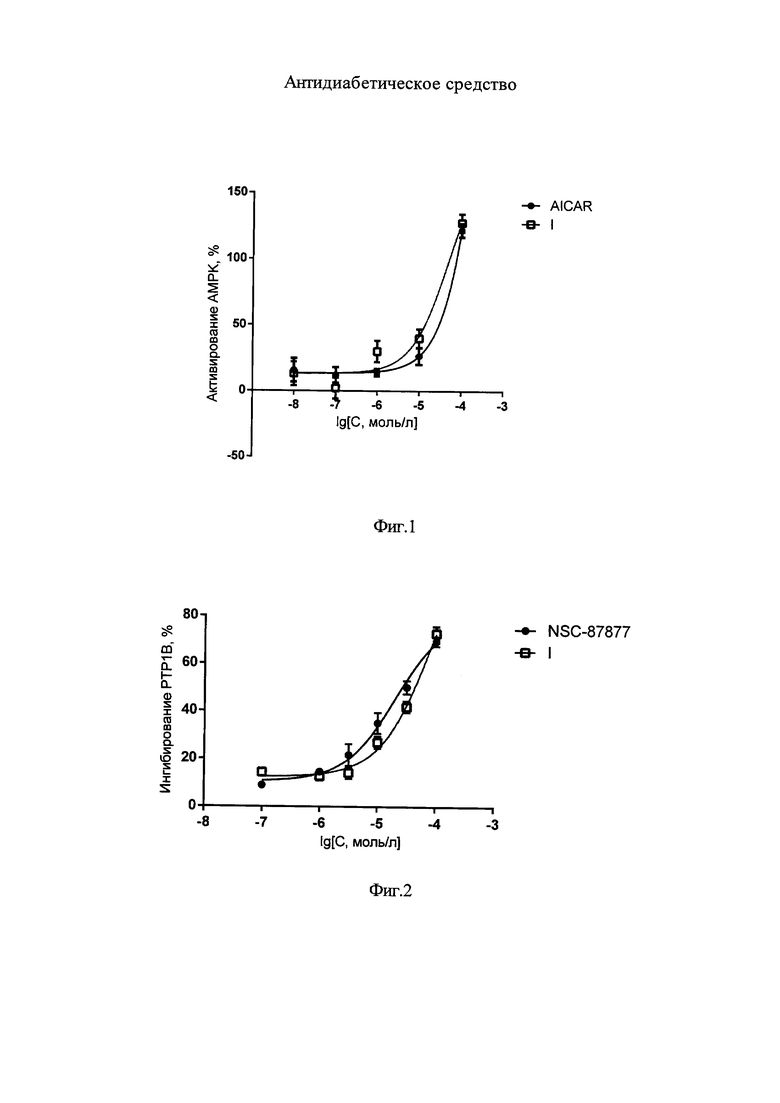
Оценку способности соединения I ингибировать PTP1B проводили по методу, описанному в работе [14]. Растворы исследуемого соединения, субстрата n-нитрофенилфосфата и фермента PTP1B готовили extempore в свежеприготовленном рабочем буфере (4,7 г/л Трис-HCl, 2,4 г/л Трис-OH, 8,7 г/л NaCl; pH 7,5), в который также добавляли раствор 1,4-дитиотреитоила в конечной концентрации 3 ммоль/л и 0.1 мг/мл БСА. При необходимости исследуемые вещества растворяли в 10%-ном ДМСО в PTB1B-рабочем буфере (не более 1% ДМСО в конечной концентрации). Смесь 10 мкл раствора исследуемого соединения в конечной концентрации 100 мкмоль/л, 50 мкл 1.2 мкг/мл раствора PTP1B (конечная концентрация 7.9 нмоль/л) преинкубировали в термошейкере при 30°C 10 мин. Затем для инициирования реакции добавляли 40 мкл субстрата реакции - n-нитрофенилфосфата в конечной концентрации 2 ммоль/л (Sigma, США). Далее до повторной инкубации измеряли оптическую плотность реакционной смеси при длине волны 405 нм на микропланшетном ридере (Infinite М200, Tecan, Австрия). Затем реакционная смесь перемешивалась и инкубировалась в термошейкере 20 мин при 30°C. Повторное измерение оптической плотности реакционной смеси проводили при длине волны 405 нм на микропланшетном ридере (Infinite М 200, Tecan, Австрия) и оценивали активность фермента по количеству образовавшегося n-нитрофенола. В качестве вещества сравнения использовали ингибитор NSC-87877 (Sigma, США) [15].
На фиг. 2 приведен график, показывающий влияние соединения формулы I на активность PTP1B. По оси ординат - ингибирование в %, по оси абсцисс - десятичный логарифм молярной концентрации соединения.
В табл. 1 приведены АМРК-активирующее и PTP1B-ингибирующие свойства соединения I, а также мишень-специфических соединений сравнения, использовавшихся в качестве контроля.

* Статистически значимо отличается от отрицательного контроля по непарному критерию Манна-Уитни (p<0,05).
Приведенные данные показывают, что заявленное соединение статистически значимо активирует AMPK. В концентрации 100 мкМ оно увеличивает активность этого фермента более чем на 127% относительно базового уровня. Параметр EC50 при этом составляет 47, 42 мкМ. Представленный технический результат по параметру увеличения уровня активности фермента AMPK превосходит стандартное вещество сравнения AICAR. Также заявленное соединение в концентрации 100 мкМ ингибирует активность фермента PTP1B на 66%, что сравнимо с активностью вещества сравнения NSC-87877 - селективного ингибитора PTP1B.
Таким образом, заявленное соединение обладает бивалентной активностью, сравнимой или превосходящей мишень-специфические вещества сравнения.
Литература
1. Mohler M.L. и др. Recent and emerging anti-diabetes targets // Med. Res. Rev. 2009. T. 29. №1. C. 125-195.
2. Zhang B.B., Zhou G., Li С. AMPK: An Emerging Drug Target for Diabetes and the Metabolic Syndrome // Cell Metab. 2009. T. 9. №5. C. 407-416.
3. Yu X. и др. Leptinomimetic effects of the AMP kinase activator AICAR in leptin-resistant rats: Prevention of diabetes and ectopic lipid deposition // Diabetologia. 2004. T. 47. №11. C. 2012-2021.
4. Tamrakar A.K., Maurya C.K., Rai A.K. PTP1B inhibitors for type 2 diabetes treatment: a patent review (2011-2014) // Expert Opin. Ther. Pat. 2014. T. 24. №10. C. 1101-1115.
5. Combs A.P. Recent advances in the discovery of competitive protein tyrosine phosphatase 1B inhibitors for the treatment of diabetes, obesity, and cancer // J. Med. Chem. 2010. T. 53. №6. C. 2333-2344.
6. Fukuda S. и др. Pharmacological profiles of a novel protein tyrosine phosphatase 1B inhibitor, JTT-551 // Diabetes, Obes. Metab. 2010. T. 12. №4. C. 299-306.
7. Ito M. и др. Pharmacological Effects of JTT-551, a Novel Protein Tyrosine Phosphatase 1B Inhibitor, in Diet-Induced Obesity Mice // 2014. T. 2014.
8. Guzzi U., Omodei-Sale A., Galiani G., Ger. Offen DE 2943286 A1, 19800514 (1980).
9. Toja E., Omodei-Sale A., Favara D., Cattaneo C., Gallico L., Galiani G., Arzneimittel-Forschung (1983), 33 (9), 1222.
10. Hu Yongzhou., Lin Kang, Wu Yijin, Zhou Huijun, Fang Ruiying, Zhejiang YikeDaxueXuebau (1991), 20 (6), 251.
11. Ito Suketaka, KakehiAkkikazu, Miwa Toshikazu, Heterocycles (1991), 32 (12), 2373.
12. Promega. Technical Manual TM 313 ADP-Glo™ Kinase Assay // 2015. C. 1-21.
13. Corton J.M. и др. 5-aminoimidazole-4-carboxamide ribonucleoside. A specific method for activating AMP-activated protein kinase in intact cells? // Eur. J. Biochem. 1995. T. 229. №2. C. 558-565.
14. Lubben Т. и др. In vitro enzymatic assays of protein tyrosine phosphatase 1B. // Curr. Protoc. Pharmacol. 2001. T. Chapter 3. C. Unit 3.8.
15. Song M. и др. NSC-87877, inhibitor of SHP-1/2 PTPs, inhibits dual-specificity phosphatase 26 (DUSP26) // Biochem. Biophys. Res. Commun. 2009. T. 381. №4. C. 491-495.
| название | год | авторы | номер документа |
|---|---|---|---|
| Гидробромид 4'-(2,3-дигидро-9Н-имидазо[1,2-а]бензимидазол-9-ил-метил)бифенил-2-карбонитрил, проявляющий свойства активатора АМФ-активируемой протеинкиназы (АМРК) | 2017 |
|
RU2650877C1 |
| Бромиды производных бензимидазолия в качестве ингибиторов протеин-тирозинфосфатазы типа 1В (РТР1В) | 2018 |
|
RU2652112C1 |
| ГЕРОПРОТЕКТОР ДЛЯ МОДЕЛЬНЫХ ЖИВОТНЫХ | 2016 |
|
RU2639500C1 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ТИЕНОПИРИДОНА В КАЧЕСТВЕ АКТИВАТОРОВ АМФК И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, КОТОРЫЕ ИХ СОДЕРЖАТ | 2006 |
|
RU2416409C2 |
| Способ прогнозирования прогрессирующего течения ранних форм неалкогольной жировой болезни печени | 2020 |
|
RU2768466C1 |
| Способ прогнозирования риска развития синдрома диабетической стопы у жителей Центральной России с сахарным диабетом 2 типа на основе генотипирования полиморфизма rs3810252 гена DNAJB1 | 2024 |
|
RU2833772C1 |
| ПРИМЕНЕНИЕ ТЕТРААЦЕТИЛИРОВАННОГО 5-АМИНО-4-КАРБАМОИЛИМИДАЗОЛИЛ-1-β-D-РИБОФУРАНОЗИДА В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ Cδ | 2019 |
|
RU2712150C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ТЕРАПИИ МЕТОТРЕКСАТОМ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ | 2020 |
|
RU2753793C1 |
| Способ прогнозирования риска развития синдрома диабетической стопы у жителей Центральной России с сахарным диабетом 2 типа на основе генотипирования полиморфизма rs7517862 гена ATF6 | 2023 |
|
RU2811753C1 |
| Способ прогнозирования риска развития диабетической дистальной полинейропатии у жителей Центральной России с сахарным диабетом 2 типа на основе генотипирования полиморфизма rs12542298 гена HSF1 | 2024 |
|
RU2828572C1 |
Изобретение относится к медицине, а именно к фармакологии, и касается применения 2-[(1,1'-бифенил)-4-ил]имидазо[2,1-а]изохинолина формулы I:
в качестве соединения, проявляющего одновременно АМРК-активирующее и PTP1B-ингибирующее действие. 1 з.п. ф-лы, 2 ил., 2 пр., 1 табл.
1. Применение 2-[(1,1'-бифенил)-4-ил]имидазо[2,1-а]изохинолина формулы I:
в качестве активатора АМФ-активируемой протеинкиназы (АМРК) и ингибитора протеин-тирозинфосфатазы типа 1В (РТР1В).
2. Применение 2-[(1,1'-бифенил)-4-ил]имидазо[2,1-а]изохинолина по п. 1 для изготовления фармацевтических композиций.
Авторы
Даты
2018-06-15—Публикация
2017-06-07—Подача