Изобретение относится к рекомбинантным белкам, кодирующим последовательности антигенных эпитопов белков Core, Small Envelope, NS2A и preM вируса Зика, и комплексному антигену, содержащему указанные белки и используемому в качестве компонента иммуноферментной тест-системы для выявления суммарных антител классов G и М к вирусу Зика, и может быть использовано в медицинской вирусологии при разработке и производстве медицинского изделия в виде набора реагентов для двухстадийного твердофазного непрямого иммуноферментного анализа (ИФА).
Семейство флавивирусов (Flaviviridae), к которому относится вирус Зика, объединяет в своем составе 60 известных на конец 2016 года видов.
Семейство подразделяется на 4 рода: флавивирусы (Flavivirus), пестивирусы (Pestivirus), гепацивирусы (Hepacivirus) и пегивирусы (Pegivirus). Геном флавивирусов представлен одноцепочечной инфекционной РНК, которая имеет размеры от 9500 до 12500 нуклеотидов. Геном вируса Зика представлен одноцепочечной РНК позитивной полярности длиной около 10800 и.о., имеющей одну рамку считывания, кодирующую один полипротеин. Полипротеин подвергается процессингу при воздействии на него вирусных и клеточных протеаз с образованием индивидуальных структурных и неструктурных вирусных белков: капсидный (С), предшественник мембранного белка (ргМ), который позднее, в процессе созревания, процессируется в мембранный (М); поверхностный, или оболочечный (Е), и неструктурные белки NS1, NS2A, NS2B, NS3, NS4A, NS4B и NS5. 5'- и 3'-нетранслируемые районы молекулы геномной РНК весьма вариабельны, и они имеют длину около 130 и 400-700 н.о. соответственно.
Патогенен для человека, относится ко II группе патогенности.
Инфицирование вирусом Зика у человека вызывает формирование IgG и IgM антител. Данные по взаимосвязи этой инфекции с микроцефалией предполагают, что вирус способен, в отличие от других флавивирусов, преодолевать плацентарный барьер и инфицировать эмбрион человека.
Граждане РФ могут заразиться при поездках в эндемичные по заболеванию страны. ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора в соответствии с приказом Роспотребнадзора от 17.03.2008 г. № 88 «О мерах по совершенствованию мониторинга за возбудителями инфекционных и паразитарных болезней» осуществляет индикацию и идентификацию возбудителей опасных вирусных инфекций. В настоящее время лабораторно подтверждены 18 случаев завоза лихорадки Зика на территорию России. Зарегистрированные в России ПЦР-наборы не всегда могут выявить больного из-за короткого периода нахождения вируса в крови и моче, и 5 случаев из 18 были выявлены серологическими методами с использованием зарубежных ИФА-наборов. Особую важность имеет подтверждение диагноза у супружеских пар из-за длительного до 6 месяцев нахождения вируса Зика в сперме и угрозе микроцефалии у плода в случае попадания вируса в организм матери.
Существующие данные говорят об относительно невысокой генетической изменчивости вируса Зика.
Известен способ использования антигена на основе рекомбинантного неструктурного белка (NS1) вируса Зика для проведения ИФА с целью выявления специфических антител классов M и G (например, ИФА-тест-система «Anti-Zika Virus ELISA (IgM)», кат. № EI 2668-9601 M, пр-во «Euroimmune», Germany).
Однако в связи с высоким перекрестной реактивностью между антителами против флавивирусов (Vorou R. Letter to the editor: diagnostic challenges to be considered regarding Zika virus in the context of the presence of the vector Aedes albopictus in Europe // Euro Surveill. 2016; 21(10):30161. http://dx.doi.org/DOI:10.2807/1560-7917. ES.2016.21.10.30161) антиген на основе рекомбинантного неструктурного белка (NS1) вируса Зика не обеспечивает высокую специфичность ИФА-наборов, в которых он используется (Huzly D, Hanselmann I, Schmidt-Chanasit J, Panning M. High specificity of a novel Zika virus ELISA in European patients after exposure to different flaviviruses // Euro Surveill. 2016; 21(16):pii=30203. DOI: http://dx.doi.org/10.2807/1560-7917.ES.2016.21.16.30203). Проверка специфичности набора при определении антител класса M к вирусу Зика показала, что один образец из 52 оказался ложноположительным и 2 показали пограничные результаты. Следует заметить, что для оценки кросс-реактивности были использованы сыворотки пациентов, содержащих антитела только к 4 флавивирусам - клещевого энцефалита, денге, желтой лихорадки, гепатита С. Кроме этого, сыворотки для анализа разводились 1:100, что ведет к потере чувствительности набора. Расширенные испытания на более чем 400 сыворотках (100 положительных) показали, что чувствительность набора при определении специфических антител класса G составляет 91%, а специфичность - 88.1%. Чувствительность набора при определении специфических антител класса М составляет 89%, а специфичность - 92,3% (Hueston L. EVALUATION OF EUROIMMUN ZIKA VIRUS IGG AND IGM ELISA KITS.ARBOVIRUS EMERGING DISEASES UNIT, PATHOLOGY WEST-ICPMR WESTMEAD NSW 2145, http://www.nrl.gov.au/CA25782200833499/All/48AD4B84457AEC0ACA257F37001CDCE9/$file/Linda%20Hueston%20(2).pdf).
Наиболее близким аналогом (прототипом) является способ использования в ИФА тест-системе нативного антигена вируса Зика, который нарабатывается на культуре клеток Vero, CDC, кат № AV0002 or AV0003. Кроме того, в указанной тест-системе используется рекомбинантный антиген (вирусоподобные частицы Zika COS-1 Recombinant Antigen, CDC, кат № AV0005) для проведения ИФА с целью выявления специфических антител классов M и G (ИФА-тест-система «Zika MAC-ELISA», пр-во Centers for Disease Control and Prevention, США, https://www.cdc.gov/zika/pdfs/zika-mac-elisa-instructions-for-use.pdf).
Однако в тест-системе-прототипе метод постановки реакции и учета результатов сложны и неудобны для использования. Исследуемый образец (сыворотка крови, плазма, СМЖ) разводятся в 400 раз и наносится одновременно в 4 лунки: 1) в лунку с вирусом Зика, наработанным на культуре клеток Vero, 2) в лунку с рекомбинантным антигеном COS-1, содержащим фрагменты белков вируса Зика (вирусоподобными частицами, состоящими из фрагментов белков вируса Зика), 3) в лунку с контролем - лизатом клеток Vero, 4) в лунку с контролем - нормальным рекомбинантным антигеном COS-1, не содержащим антигенов вируса Зика. Проба считается положительной при определенной комбинации показателей оптической плотности в каждой из 4-х лунок, задействованных в исследовании образца. Следует отметить, что образец при проведении анализа разводится 1:400, что ведет к снижению чувствительности набора. Чувствительность и специфичность ИФА-набора Zika MAC-ELISA невысока: в рекомендациях к набору («Fact Sheet for Healthcare Providers: Interpreting Zika MAC-ELISA Test Results», Updated: December 6, 2016, https://www.cdc.gov/zika/pdfs/interpreting-zika-mac-elisa-results.pdf) разработчики указывают, что положительные и сомнительные результаты Зика MAC-ELISA не являются окончательными для диагностики лихорадки Зика. Ложные положительные результаты могут возникать при обследовании некоторых пациентов с недавно перенесенной флавивирусной инфекцией, например лихорадкой денге. У пациентов, которые были вакцинированы против желтой лихорадки или Японского энцефалита, ИФА-набор также может выявлять ложноположительный результат.На основании результатов анализов антител ИФА-набором нельзя точно определить, какие из флавивирусов вызвали заболевание у пациента (https://www.cdc.gov/zika/pdfs/interpreting-zika-mac-elisa-results.pdf).
Техническим результатом заявляемого изобретения является повышение чувствительности и точности ИФА анализа за счет получения рекомбинантных белков, строго специфичных для вируса Зика, в которых отсутствуют линейные антигенные эпитопы других флавивирусов, а последовательности, кодирующие эти белки, не имеют антигенного перекреста со всеми известными флавивирусами.
Указанный технический результат достигается получением:
- рекомбинантного белка (Z1), содержащего антигенные эпитопы белка Core вируса Зика, характеризующегося следующей аминокислотной последовательностью 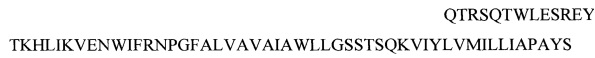
(SEQ ID NO: 1) и используемого в качестве первого компонента для получения комплексного антигена вируса Зика;
- рекомбинантного белка (Z2), содержащего антигенные эпитопы белка Small Envelope вируса Зика, характеризующегося следующей аминокислотной последовательностью 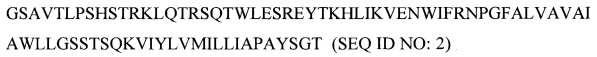
и используемого в качестве второго компонента для получения комплексного антигена вируса Зика;
- рекомбинантного белка (Z3), содержащего антигенные эпитопы белков NS2A вируса Зика, характеризующегося следующей аминокислотной последовательностью 
и используемого в качестве третьего компонента для получения комплексного антигена вируса Зика;
- рекомбинантного белка (Z4), содержащего антигенные эпитопы белка preM вируса Зика, характеризующегося следующей аминокислотной последовательностью 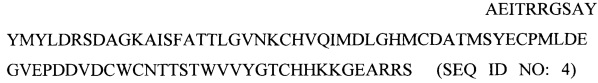
и используемого в качестве четвертого компонента для получения комплексного антигена вируса Зика.
Указанный технический результат достигается также получением комплексного антигена, используемого в качестве компонента иммуноферментной тест-системы для выявления антител классов G и М к вирусу Зика, характеризующегося тем, что он содержит рекомбинантные белки Z1, Z2, Z3, Z4 по п.п. 1-4 формулы изобретения, смешанные соответственно в соотношении 1:3:2:2.
Смесь 4-х рекомбинантных белков Z1, Z2, Z3 и Z4 использована как реагент набора для выявления суммарных антител к вирусу Зика в качестве комплексного антигена, иммобилизованного на иммуносорбенте и помеченного биотином для использования в качестве конъюгата для варианта двустадийного сэндвич-ИФА.
Пример 1. Получение рекомбинантных белков Z1, Z2, Z3 и Z4 вируса Зика
Для экспрессии белков генные конструкты лигировали с бактериальным вектором рЕТ21а (Novagen). Правильность всех конструктов подтверждали секвенированием ДНК. Все гены, кодирующие специфические фрагменты белков Z1, Z2, Z3 и Z4 вируса Зика, экспресировали в Е.coli (штамм М 15). Клетки выращивали при 37°С в среде LB (Луриа-Бертани) до OD600=0,5. Анализ клонов проводили с помощью метода ПЦР. Клетки, экспрессирующие белки Z1, Z2, Z3 и Z4 соотвественно Core, Small Envelope, NS2A и preM вируса Зика, ресуспендировали в 5 мл/г буфера, содержащего (50 мМ NaH2PO4, 300 мМ NaCI рН 8,0), 0,1М PMSF в спирте, 0,2 мг/мл лизоцима (Sigma-Aldrich, St. Louis, МО, USA) и инкубировали в течение 30 мин при 4°С. Клетки лизировали обработкой ультразвуком. Нерастворимые фрагменты клеток осаждали при 6000×g и 4°С в течение 30 мин. Растворимые белки лизатов E.coli, содержащие белки Z1, Z2, Z3 и Z4 вируса Зика, собирали путем центрифугирования при 6000×g с охлаждением в течение 30 мин. Осадки, содержащие белки Z1, Z2, Z3 и Z4, растворяли буфером, содержащим 8 М мочевину и 100 мМ NaH2PO4, на 2 молекулы H2O. Все белки чистили на колонке с Ni-NTA Superflow (QIAGEN), буфером 20 мМ Tris (основание) pH 7,6. Элюция проводилась 0,1 М имидазолом в 20 мМ Tris (основание) pH 7,6 Концентрации белков определяли по методу Лоури. Идентичность белков подтверждали электрофорезом в полиакриламидном геле.
В рекомбинантных белках Z1, Z2, Z3 и Z4 отсутствуют линейные антигенные эпитопы других флавивирусов. Белки не имеют антигенного перекреста со всеми известными флавивирусами.
Z1 - белок, копирующий последовательность белка Core вируса Зика (ВЗ). Поскольку Core имеет большую гомологию с аналогичным вирусом денге, сделано четыре линкера GGGSG в оригинальный Core для устранения гомологии;
Z2 - белок, копирующий последовательность белка Small Envelope ВЗ наименее гомологичную такой у клещевого энцефалита (ВКЭ) и денге;
Z3 - белок, копирующий последовательность белка NS2A ВЗ наименее гомологичную такой у ВКЭ и денге;
Z4 - белок, копирующий последовательность белка preM Peptide ВЗ наименее гомологичную такой у ВКЭ и денге.
Молекулярный вес каждой белковой конструкции 45-55 кДа.
Полученные белки Z1, Z2, Z3 и Z4 - компоненты комплексного антигена вируса Зика характеризуются следующими аминокислотными последовательностями (таблица 1).

Все белки несут на С-конце двойной повтор шаперона SlyD E.coli. Шапероны - технические участки усиливающие продукцию белка штаммом-продуцентом E. coli. Димеры разделены линкерной последовательностью. Ниже приведена последовательность домена SlyD-SlyD:

HMLAGQNLKFNVEVVAIREATEEELAHGHVHGAHDHHHDHDHDGSGGSGGTGGAGGAGGTGGSTSGS.
Пример 2. Получение комплексного антигена вируса Зика и набора реагентов «Вектор ИФА Зика-АТ скрин» для выявления антител классов G и M к вирусу Зика
На основе комплексного антигена из 4 рекомбинантных белков Z1, Z2, Z3 и Z4, смешанных в соотношении 1:3:2:2, создан иммуносорбент - основной компонент набора реагентов.
Набор реагентов «Вектор ИФА Зика-АТ скрин» включает в себя:
• Иммуносорбент - планшет разборный (12 восьмилуночных стрипов) с иммобилизованным на внутренней поверхности лунок комплексным антигеном вируса Зика (смесью белков Z1, Z2, Z3 и Z4);
• К+ контрольный положительный образец, 0.25 мл;
• К- контрольный отрицательный образец, 0.5 мл;
• РК-1 - Конъюгат 1 - смесь биотинилированных рекомбинантных антигенов и синтетических пептидов, мимикрирующих консервативные иммунодоминантные антигенные детерминанты эктодомена белков оболочки (envelop) и неструктурных белков (NS) вируса Зика;
• РК-2-А - Конъюгат 2 компонент А, 50-х кратный концентрат - наноструктурированый (ядро/оболочка) конъюгат рекомбинантного Core-фрагмента стрептавидина с гетерополимером пероксидазы хрена (СПХ);
• РК-2-Б - Конъюгат 2 компонент Б - раствор для разведения СПХ;
• ТМБ - Раствор хромогена;
• ФСБ-Т - Концентрат промывочного раствора 25-кратный (фосфатно-солевой буферный раствор с добавлением твина);
• Стоп-реагент, 1М раствор серной кислоты.
Пример 3. Проверка антигенных свойств заявляемого комплексного антигена
Заявляемый комплексный антиген выявляет специфические антитела к вирусу Зика в сыворотках больных людей. Для проверки качества заявляемого комплексного антигена были использованы сыворотки крови и плазмы людей, которым был лабораторно с использованием зарегистрированных в установленном порядке ПЦР-наборов подтвержден диагноз «лихорадка Зика». Сыворотки крови или плазма были получены от больных в различные сроки после появления клинических признаков заболевания. Из указанных образцов была составлена сероконверсионная панель. Наличие в образцах специфических к вирусу Зика антител классов G и М подтверждено в ИФА с применением наборов реагентов «Anti-Zika Virus ELISA (IgG)» и «Anti-Zika Virus ELISA (IgМ)» фирмы Euroimmun AG, ФРГ.
Кроме образцов содержащих антитела к вирусу Зика, в панель вошли также образцы, не содержащие антитела к вирусу Зика. Это были образцы сыворотки крови от привитых против желтой лихорадки и клещевого энцефалита, а также от реконвалесцентов и больных лихорадкой Западного Нила, лихорадкой денге и гепатитом С.
С использованием положительных и отрицательных образцов была сформирована «Рабочая панель сывороток и плазмы, содержащих и не содержащих суммарные антитела к вирусу Зика «РП АТ(+/-)Зика», аттестованная в ОБТК заявителя. Данные по образцам этой панели приведены ниже в таблице 2.
Таблица 2
Оценка специфичности комплексного антигена с использованием «Рабочей панели сывороток и плазмы, содержащих и не содержащих суммарные антитела к вирусу Зика»
п/п
(ОП, IgM / IgG))
2 мес с начала заболевания
17 сут с начала заболевания
16 сут с начала заболевания
15 сут с начала заболевания
3 мес с начала заболевания
18 сут с начала заболевания
8 сут с начала заболевания
7 сут с начала заболевания
В результате проведенного исследования было показано, что все образцы, полученные от больных лихорадкой Зика, определялись как положительные и при постановке ИФА с использованием наборов «Anti-Zika Virus ELISA (IgG)», «Anti-Zika Virus ELISA (IgМ)» фирмы Euroimmun AG, ФРГ и при постановке ИФА с использованием в качестве комплексного антигена смеси 4 рекомбинантных белков Z1, Z2, Z3 и Z4 в соотношении 1:3:2:2.
В целях аттестации разрабатываемого набора разработан весь комплекс научно-технической документации. Набор получил название «Вектор ИФА Зика-АТ скрин».
Пример 4. Аналитические и диагностические характеристики набора реагентов
1. Нижний порог обнаружения аналита. Набор реагентов выявляет антитела классов G и М к вирусу Зика в контрольных образцах № 1-№ 4 рабочей панели образцов предприятия «РП АТ(+/-)Зика». При титровании не менее чем до 1:10 положительный образец № 1 «РП АТ(+/-)Зика» или аналогичный по содержанию антител показывает положительный результат.
2. Специфичность. Антитела классов G и М к вирусу Зика не выявляются в контрольных образцах №5-№8 РП АТ(+/-)Зика».
3. Воспроизводимость. Установлена исследованием коэффициента вариации оптических плотностей (ОП) одного и того же положительного образца. Коэффициент вариации не более 10 %.
Пример 5. Проведение иммуноферментного анализа
Во все лунки иммуносорбента вносят по 20 мкл контрольных и 20 мкл предназначенных для исследования образцов по схеме внесения. Затем во все лунки контрольных образцов и предназначенных для исследования образцов вносят по 80 мкл раствора конъюгата 1 (РК-1). Все лунки иммуносорбента заклеивают пленкой. Иммуносорбент инкубируют 45 мин в термостате при температуре (42±2)°С. По окончании инкубации содержимое лунок собирают в сосуд с дезинфицирующим раствором. Планшет промывают 7 раз, заполняя лунки иммуносорбента объемом 300 мкл, не допуская переливания промывочного раствора через края лунок. Время между заполнением и удалением из лунок раствора должно быть не менее 45 секунд. Затем во все лунки иммуносорбента вносят по 100 мкл рабочего раствора конъюгата 2 (РК-2). Все лунки иммуносорбента заклеивают пленкой и проводят инкубацию при температуре (42±2)°С в течение 20 мин. Затем во все лунки иммуносорбента вносят по 100 мкл рабочего раствора хромогена. Защищенный от света иммуносорбент инкубируют 15 мин в термостате при температуре (42±2)°С.
Время между остановкой реакции и регистрацией результата не должно превышать 15 мин.
Результаты ИФА регистрируют с помощью планшетного ридера, измеряя оптическую плотность (ОП) с фильтром 450 нм. Результаты анализа учитывают при соблюдении следующих условий:
- каждое значение ОП в лунке с К+ более 0,500 о.е.;
- каждое значение ОП в лунках с К- (ОП К-) менее 0,200 о.е.
Значение критической оптической плотности (ОПкрит.) для каждого варианта конъюгата рассчитывают по формуле:
ОПкрит. = ОП (К-)ср. + 0,2 (1), где ОП (К-)ср. - среднее значение всех (ОП К-).
Образец считается положительным если:
ОП образца равна или более ОПкрит (ОПобразца ≥ ОПкрит.);
Образец считается отрицательным если:
ОП образца менее ОПкрит (ОПобразца < ОПкрит)
Определение выполнения критерия «нижний порог обнаружения»
Во всех лунках с К+ оптическая плотность превышает ОПкрит. Это значит, что при титровании 1:10 положительный образец № 1 «РП АТ(+/-)Зика» показывает положительный результат.
Определение специфичности
Во всех лунках с К- и отрицательными образцами «РП АТ(+/-)Зика» оптическая плотность ниже ОПкрит. Во всех лунках с К+ и положительными образцами «РП АТ(+/-)Зика» оптическая плотность превышает ОПкрит.
ОПкрит.= ОП (К-)ср.+ 0,2.
Определение воспроизводимости
По величине коэффициента вариации (CV, %) значений оптической плотности в восьми лунках с К+ делается заключение о воспроизводимости результатов, полученных с использованием серии набора. CV рассчитывается по формуле:
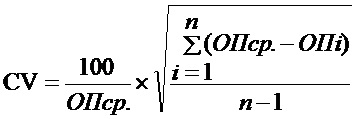
где ОПi - оптическая плотность (ОП, о.е.) в каждой лунке с К+;
ОПср. - среднее арифметическое значение ОП всех восьми повторов анализа К+.
Пример 6. Использование набора реагентов «Вектор ИФА Эбола-АТ» в клинической практике
1) Выявление антител в сыворотках крови больных лихорадкой Зика. Набор использован для подтверждения диагноза у больных, вернувшихся из поездок в эндемичные по лихорадке Зика страны. Клинические образцы (сыворотка крови, моча) исследовали на содержание РНК вируса Зика методом ОТ-ПЦР. У всех больных секвенированием фрагментов генома вируса была определена нуклеотидная последовательность, которая более чем на 98% совпадала с последовательностями вируса Зика из базы данных GenBank. С сыворотками крови от больных с лабораторно подтвержденным методом ОТ-ПЦР диагнозом «лихорадка Зика» проводили постановку ИФА с использование набора реагентов «Вектор ИФА Эбола-АТ». Результаты приведены в таблице 3.
Из приведенных в таблице 3 данных видно, что набор реагентов «Вектор ИФА Эбола-АТ» выявляет антитела к вирусу Зика в крови больных с лабораторно подтвержденным диагнозом «лихорадка Зика». Набор выявляет динамику нарастания антител в сыворотках крови больных, начиная с 4-го дня от появления клинических признаков заболевания. Антитела к вирусу Зика могут выявляться в сыворотке крови больных на протяжении как минимум 1,5 месяцев.
Таблица 3
Выявление специфических антител у больных лихорадкой Зика, определенное с применением набора «Вектор ИФА Зика-АТ скрин»
2) Выявление антител в сыворотках крови больных с неустановленным диагнозом. С помощью набора реагентов «Вектор-ПЦРрв-Зика» было проведено ретроспективное изучение 54 клинических образцов, полученных в период с 2012 по 2015 годы от больных с предварительным диагнозом «лихорадка невыясненной этиологии», вернувшихся из зарубежных поездок. Все образцы были отрицательны на содержание маркеров вирусов денге, желтой лихорадки, чикунгунья. В 4 образцах методом ПЦР была выявлена РНК вируса Зика.
Сыворотки крови от этих 4-х больных были исследованы методом ИФА на наличие антител к вирусу Зика с использованием набора реагентов «Вектор ИФА Эбола-АТ». Результаты исследования приведены в таблице 4.
Таблица 4
Выявление специфических антител у больных с диагнозом «лихорадка невыясненной этиологии», определенное с применением набора «Вектор ИФА Зика-АТ скрин»
(ОП, IgM / IgG))
Набор реагентов «Вектор ИФА Эбола-АТ» был использован для изучения 18 образцов сывороток крови, полученных в поздние сроки от начала клинических проявлений инфекционного заболевания, от больных с предварительным диагнозом «лихорадка невыясненной этиологии», вернувшихся из зарубежных поездок. В 1 сыворотке крови методом ИФА с использованием набора реагентов «Вектор ИФА Эбола-АТ» были обнаружены антитела к вирусу Зика (ОП=2,233). Больной вернулся из Доминиканской Республики, эндемичной по заболеванию лихорадкой Зика. Проверка сыворотки крови с использованием «Anti-Zika Virus ELISA (IgG)» и «Anti-Zika Virus ELISA (IgМ) фирмы Euroimmun AG, ФРГ подтвердило наличие в ней антител класса G (ОП=0,959) класса М (ОП=1,671) к вирусу Зика.
Таким образом, набор реагентов «Вектор ИФА Эбола-АТ», включающий заявляемый комплексный антиген, содержащий рекомбинантные белки Z1, Z2, Z3, Z4, может быть использован как для выявления ранних антител к вирусу Зика в крови больных, так и для определения поздних антител с целью подтверждения диагноза «лихорадка Зика» с более высокой точностью и чувствительностью.
ПРИЛОЖЕНИЕ
Перечень последовательностей

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения антигена вируса Зика, обладающего иммуногенными и антигенными свойствами | 2019 |
|
RU2717993C1 |
| Плазмидная генетическая конструкция pVEAL3-10H10ch, штамм рекомбинантной клеточной линии CHO-K1-10H10ch и химерное антитело 10H10ch против вируса клещевого энцефалита, продуцируемое указанным штаммом клеточной линии CHO-K1-10H10ch | 2022 |
|
RU2800471C1 |
| ЧЕТЫРЕХВАЛЕНТНАЯ ВЕКТОРНАЯ ВАКЦИНА И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ ДЛЯ ПРОФИЛАКТИКИ ЛИХОРАДКИ ДЕНГЕ | 2023 |
|
RU2812251C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ТРЕХ ГИБРИДНЫХ БЕЛКОВ ОБОЛОЧКИ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ОПРЕДЕЛЯЮЩИХ ПРИНАДЛЕЖНОСТЬ К СИБИРСКОМУ (DBD2-D3S), ЕВРОПЕЙСКОМУ (DBD2-D3E) И ДАЛЬНЕВОСТОЧНОМУ (DBD2-D3D) ПОДТИПАМ ВИРУСА; РЕКОМБИНАНТНЫЕ ПЛАЗМИДЫ pDBD2-D3S, pDBD2-D3E И pDBD2-D3D; ШТАММЫ-ПРОДУЦЕНТЫ Escherichia coli M15 [pREP4]; ХИМЕРНЫЕ БЕЛКИ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2560588C1 |
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита на основе рекомбинантного вируса рода Flavivirus | 2022 |
|
RU2795800C1 |
| Рекомбинантная плазмида pHis6-flagG-protE, обеспечивающая синтез рекомбинантного химерного белка, включающего эпитопы гликопротеина Е вируса клещевого энцефалита и флагеллин G S.typhii и используемого в качестве основы для вакцины против вируса клещевого энцефалита | 2018 |
|
RU2702716C2 |
| НАБОР АНТИГЕНОВ ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ГЕПАТИТА C "ДС-HCV-АНТИГЕНЫ" | 2004 |
|
RU2262704C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО Mus musculus L. 5Н6 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ДЛЯ ВЫЯВЛЕНИЯ ГЛИКОПРОТЕИНА Е ВИРУСА ЗАПАДНОГО НИЛА, МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА 5Н6, ПРОДУЦИРУЕМЫЕ УКАЗАННЫМ ШТАММОМ ГИБРИДНЫХ КЛЕТОК, И ИММУНОФЕРМЕНТНЫЙ НАБОР ДЛЯ ВЫЯВЛЕНИЯ ГЛИКОПРОТЕИНА Е ВИРУСА ЗАПАДНОГО НИЛА С ИСПОЛЬЗОВАНИЕМ УКАЗАННЫХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2015 |
|
RU2595429C1 |
| Рекомбинантная плазмидная ДНК pET160-E3-YFV, экспрессирующая аналог третьего домена поверхностного белка Е вируса желтой лихорадки (ВЖЛ) в бактериальной системе E. coli, используемого для выявления специфических антител ВЖЛ | 2022 |
|
RU2798563C1 |
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита, на основе мРНК | 2024 |
|
RU2823754C1 |
Изобретение касается рекомбинантных белков, содержащих антигенные эпитопы белков Core, Small Envelope, NS2A и preM вируса Зика, и комплексного антигена, содержащего указанные белки. Получены: рекомбинантный белок (Z1), содержащий антигенные эпитопы белка Core вируса Зика, характеризующийся аминокислотной последовательностью (SEQ ID NO: 1) и используемый в качестве первого компонента для получения комплексного антигена вируса Зика; рекомбинантный белок (Z2), содержащий антигенные эпитопы белка Small Envelope вируса Зика, характеризующийся аминокислотной последовательностью (SEQ ID NO: 2) и используемый в качестве второго компонента для получения комплексного антигена вируса Зика. Рекомбинантный белок (Z3), содержащий антигенные эпитопы белков NS2A вируса Зика, характеризующийся аминокислотной последовательностью (SEQ ID NO: 3), применяется в качестве третьего компонента для получения комплексного антигена вируса Зика, а рекомбинантный белок (Z4), содержащий антигенные эпитопы белка preM вируса Зика, характеризующийся аминокислотной последовательностью (SEQ ID NO: 4), применяется в качестве четвертого компонента для получения комплексного антигена вируса Зика. Комплексный антиген может быть использован в качестве компонента иммуноферментной тест-системы для выявления антител классов G и M к вирусу Зика и содержит рекомбинантные белки Z1, Z2, Z3, Z4, смешанные соответственно в соотношении 1:3:2:2. В полученных и применяемых белках отсутствуют линейные антигенные эпитопы других флавивирусов, а последовательности, кодирующие эти белки, не имеют антигенного перекреста со всеми известными флавивирусами, что позволяет при их использовании осуществить более чувствительный и точный ИФА анализ. Изобретение может быть использовано в медицинской вирусологии. 5 н.п. ф-лы, 4 табл., 6 пр.
1. Рекомбинантный белок (Z1), содержащий антигенные эпитопы белка Core вируса Зика и характеризующийся следующей аминокислотной последовательностью:
QTRSQTWLESREYTKHLIKVENWIFRNPGFALVAVAIAWLLGSSTSQKVIYLVMILLIAPAYS (SEQ ID NO: 1), и используемый в качестве компонента для получения комплексного антигена вируса Зика.
2. Рекомбинантный белок (Z2), содержащий антигенные эпитопы белка Small Envelope вируса Зика и характеризующийся следующей аминокислотной последовательностью: GSAVTLPSHSTRKLQTRSQTWLESREYTKHLIKVENWIFRNPGFALVAVAIAWLLGSSTSQKVIYLVMILLIAPAYSGT (SEQ ID NO: 2), и используемый в качестве компонента для получения комплексного антигена вируса Зика.
3. Применение рекомбинантного белка (Z3), содержащего антигенные эпитопы белков NS2A вируса Зика и характеризующегося следующей аминокислотной последовательностью: GSTDHMDHFSLGVLVILLMVQEGLKXRMTTKIIMSTSMAVLVVMILGGFSMSDLAKLVILMGATFAEMNTGGDVAHLALVAAFKVRPALLVSFIFRANWTPRESMLLALASCLLQTAISALEGDLMVLINGFALAWLAIRAMAVPRTDNIALPILAALTPLARGTLLVAWRAGLATCGGIMLLSLKGKGSVKKNLPFVMALGLTAVRVVDPINVVGLLLLT (SEQ ID NO: 3), в качестве компонента для получения комплексного антигена вируса Зика.
4. Применение рекомбинантного белка (Z4), содержащего антигенные эпитопы белка preM вируса Зика и характеризующегося следующей аминокислотной последовательностью: AEITRRGSAYYMYLDRSDAGKAISFATTLGVNKCHVQIMDLGHMCDATMSYECPMLDEGVEPDDVDCWCNTTSTWVVYGTCHHKKGEARRS (SEQ ID NO: 4), в качестве компонента для получения комплексного антигена вируса Зика.
5. Комплексный антиген, используемый в качестве компонента иммуноферментной тест-системы для выявления антител классов G и М к вирусу Зика, характеризующийся тем, что он содержит рекомбинантные белки Z1, Z2, Z3, Z4 по пп. 1-4, смешанные соответственно в соотношении 1:3:2:2.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Membrane glycoprotein precursor M [Zika virus], NCBI Reference Sequence: YP_009227197.1, 05.02.2016; | |||
| US 9638692 B2, 02.05.2017 | |||
| LAURA MASAMI SUMITA et al | |||
| Detection of human anti-zika virus igg by elisa using an antigen from in vitro infected vero cells: preliminary results, Rev | |||
| Inst | |||
| Med | |||
| Trop | |||
| Sao Paulo, 2016, Vol.58, No.89, pp.1-8 | |||
| ЕРШОВА И.Б | |||
| и др., Инфекция, вызванная вирусом Зика, Актуальная Инфектология, 2016, No.2(11), стр.67-70. | |||
Авторы
Даты
2018-07-11—Публикация
2017-06-01—Подача