Область техники
Группа изобретений относится к области биотехнологии, иммунологии и вирусологии. Предложенное иммунобиологическое средство может применяться для профилактики заболеваний, вызываемых вирусом клещевого энцефалита.
Уровень техники
Вирус клещевого энцефалита (ВКЭ) является представителем семейства Flaviviridae, рода Flavivirus. Род Flavivirus включает более 60 вирусов, в том числе вирус желтой лихорадки, передающихся членистоногими (комарам, клещами) и относящимися к экологической группе арбовирусов.
ВКЭ основной вирусный возбудитель у человека такого заболевания, как клещевой энцефалит, переносчиками которого являются клещи. Инфицирование ВКЭ часто имеет неврологические проявления, такие как менингит, энцефалит и менингоэнцефалит, что приводит к пожизненным неврологическим осложнениям и может привести к летальному исходу. Заболеваемость и смертность от клещевого энцефалита варьирует в зависимости от подтипа вируса. На сегодняшний день выделяют 3 варианта вируса - европейский, сибирский и дальневосточный. ВКЭ европейского генотипа связан с неврологическими последствиями у 10% пациентов с уровнем смертности 0,5–2%. У пациентов, зараженных сибирским генотипом, развиваются длительные инфекции с уровнем смертности 2–3%. Тогда как дальневосточный генотип связан с высокой частотой неврологических осложнений, и до 40% случаев заканчиваются летальным исходом.
ВКЭ является эндемичным для Северной Евразии, и, по оценкам, ежегодно регистрируется не менее 10 000 клинических случаев, при этом, возможно, занижение данных. Вирус обычно передается клещами семейства Ixodideae, но заражение ВКЭ также может произойти при употреблении непастеризованных зараженных молочных продуктов. Несмотря на наличие эффективных вакцин для профилактики, заболеваемость клещевым энцефалитом растет, поскольку охват вакцинацией недостаточен для многих групп риска. Еще одним важным фактором роста КЭ является глобальное изменение климата, увеличение численности клещей и расширение их ареалов. Поэтому вполне вероятно, что в ближайшие десятилетия мы будем наблюдать дальнейшее появление ВКЭ, что требует разработки вакцинных препаратов в дополнение к доступной в настоящее время паллиативной помощи.
Для России клещевой энцефалит является значимым природно-очаговым заболеванием. На территории РФ циркулируют наиболее вирулентные генотипы вируса. Ежегодно тысячи людей заболевают после укуса клеща, а для сотен из них заболевание имеет тяжелые исходы - инвалидизация или смерть.
Наиболее эффективным способом специфической профилактики КЭ является вакцинация, которая в десятки раз снижает вероятность заболевания, предотвращает развитие тяжелых форм и осложнений.
На территории Российской Федерации для иммунизации населения против вируса КЭ используют четыре типа инактивированных вакцин: вакцина клещевого энцефалита, (Предприятие по производству бактерийных и вирусных препаратов ФГБУ «ИПВЭ им. М.П. Чумакова РАМН, Россия»); Энцевир (ФГУП «НПО «Микроген», Россия); ФСМЕ-Иммун (Baxter, Австрия); Энцепур (Novartis, Германия).
Среди направлений по разработке вакцин можно выделить производство ослабленных или инактивированных вакцин (например, US 8241638; RU 2070929) и конструирование рекомбинантных вирусов, содержащих клонированные гены наиболее распространенных флавивирусов (например, US 8227587; RU 2208635, RU 2136312).
Большой интерес вызывает использование генома живой аттенуированной вакцины 17D в качестве генетической основы для вакцин против других вирусов, таких как вирус Западного Нила, вирус японского энцефалита, вирус клещевого энцефалита (tick-borneencephalitisvirus (TBEV)), вирус Зика и вирус денге (например, US6962708, US6696281).
С 2012 года были одобрены для использования две вакцины на основе 17D-204 (технология ChimeriVax): Imojev ™ и Dengvaxia® для профилактики японского энцефалита (JE) и денге, соответственно.
Флавивирусы - оболочечные вирусы, нуклеокапсид которых окружен липидной мембраной и белковой оболочкой. Геном - одноцепочечная РНК положительной полярности, кодирующая три структурных белка (С, Е и prM) и семь неструктурных (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5); структурные белки входят в состав вириона, тогда как неструктурные экспрессируются в клетке хозяина и осуществляют репликацию вирусной РНК (В. D. Lindenbachetal., in: Fields Virology, 6thed., editedby D.M. Knipe& P.M. Howley, Lippincott Williams &Wilkins, 2013, Philadelphia, USA, pp. 712-746).
Imojev™ (или JE-CV) представляет собой живую аттенуированную вакцину против вируса японского энцефалита и содержит гены белков prM и E вируса вируса японского энцефалита живого аттенуированного вакцинного штамма SA14-14-2 в скелете вакцинного штамма YFV 17D-204 [1-3]. Dengvaxia® - это живая аттенуированная химерная вакцина, которая защищает от заболевания вызываемого всеми четырьмя серотипами вируса денге. Геном этой живой аттенуированной вакцины представляет собой остов 17D, в котором prM и E YFV заменены на таковые четырех серотипов вируса денге. Вакцина лицензирована как трехдозовая с ревакцинациями через шесть и 12 месяцев примерно в 20 странах [4, 5].
Одним из подходов создания кандидатных вакцин на основе вакцинных штаммов YFV является простой и универсальный метод обратной генетики ISA (infectious-subgenomic-amplicons), который позволяет “оживлять” РНК-содержащие вирусы из геномной кДНК без необходимости клонирования, размножения кДНК в бактериях или транскрипции РНК invitro. Трансфекция клеток эукариот перекрывающимися двухцепочечными фрагментами ДНК, покрывающими весь геном РНК-вируса, обеспечивает рекомбинацию и синтез копии кДНК полного вирусного генома. Полные геномы амплифицированы с помощью ПЦР в трех фрагментах ДНК размером примерно 4 т.п.н., каждый с перекрывающимися областями 70–100 п.н. Первый и последний фрагменты фланкированы соответственно на 5’ и 3’ концах промотором цитомегаловируса человека (pCMV) и рибозимом гепатита дельта, за которым следует сигнал полиаденилирования вируса обезьяны 40 (HDR / SV40pA).
За ближайший аналог может быть принят документ US6962708, из которого известен химерный живой инфекционный аттенуированный вирус, содержащий вирус желтой лихорадки, в котором нуклеотидная последовательность белка prM-E либо делетирована, либо укорочена, либо мутирована, так что функциональный белок prM-E не экспрессируется и интегрируется в геном вируса желтой лихорадки, нуклеотидная последовательность, кодирующая белок prM-E второго, отличного от флавивируса, так что экспрессируется белок prM-E второго флавивируса.
Таким образом, существует потребность в создании нового рекомбинантного флавивируса, который возможно использовать в качестве средства профилактики заболеваний, вызываемых вирусом клещевого энцефалита.
Раскрытие сущности изобретения
Технической задачей заявленной группы изобретение является расширение арсенала рекомбинантных вирусов рода Flavivirus для профилактики заболеваний, вызываемых вирусом клещевого энцефалита (ВКЭ).
Технический результат заключается в создании рекомбинантного вируса рода Flavivirus, который может быть использован для индукции специфического иммунитета против заболеваний, вызываемых вирусом клещевого энцефалита.
Указанный технический результат достигается тем, что создано иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита на основе рекомбинантного вируса рода Flavivirus, полученного с применением методов генной инженерии, обратной генетики и синтеза генов denovo, и представляющий собой векторный вирус рода Flavivirus, в котором часть капсидного (C) белка, премембранный (prM) и оболочечный (E) белки замещены на часть капсидного (C) белка, премембранный (prM) и оболочечный (E) белки другого вируса рода Flavivirus. Первый векторный рода Flavivirus представляет собой вирус желтой лихорадки, а именно штамм YF17DD-UN. Второй векторный вирус рода Flavivirus представляет собой вирус клещевого энцефалита, а именно штамм 493. Кроме того, указанный технический результат достигается тем, что рекомбинантный вирус рода Flavivirus представляет собой рекомбинантный вирус YF17DD-UN/TBE493.
Также указанный технический результат достигается тем, что иммунобиологическое средство применятся для получения вакцин для профилактики клещевого энцефалита.
Краткое описание фигур
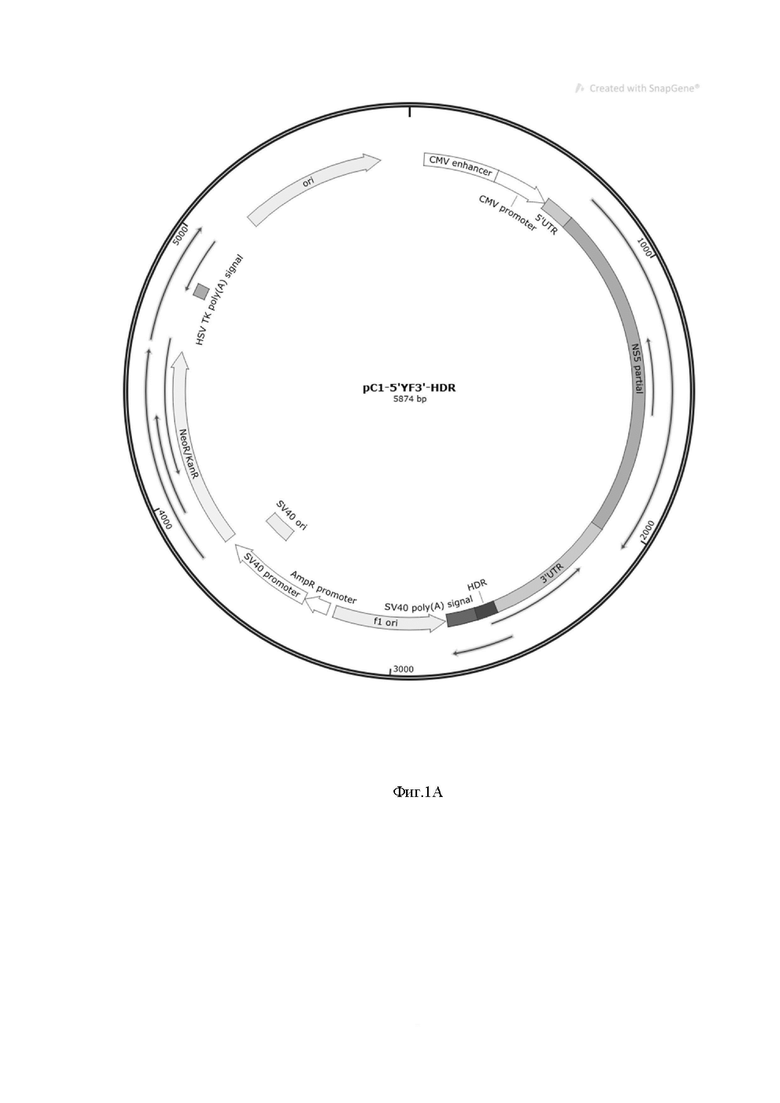
На фиг.1А представлена плазмида pEGFP-C1, в составе которой находятся регуляторные сигналы для транскрипции (pCMV-промотор и HDR / SV40pA), 5’ и 3’ концевые участки YF.
На фиг.1Б представлена плазмида pBADmini, в состав которой включены часть 3’ конца pCMV-промотора, 5’URT вируса желтой лихорадки, гены структурных белков cor, PreM и E, и гены неструктурных белков NS1-NS3.
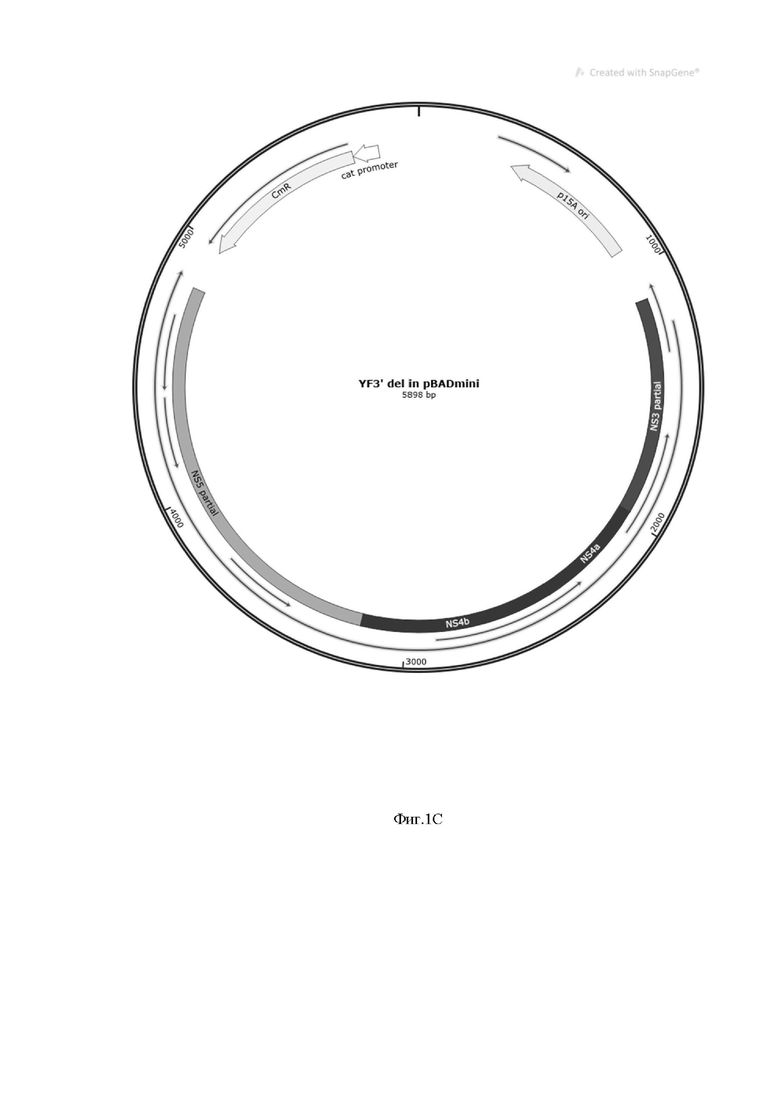
На фиг. 1С представлена плазмида pBADmini, в состав которой включены гены неструктурных белков вируса желтой лихорадки NS3-NS5.
На фиг.2 представлена схема создания синтетического рекомбинантного вируса YF17DD-UN/TBE493
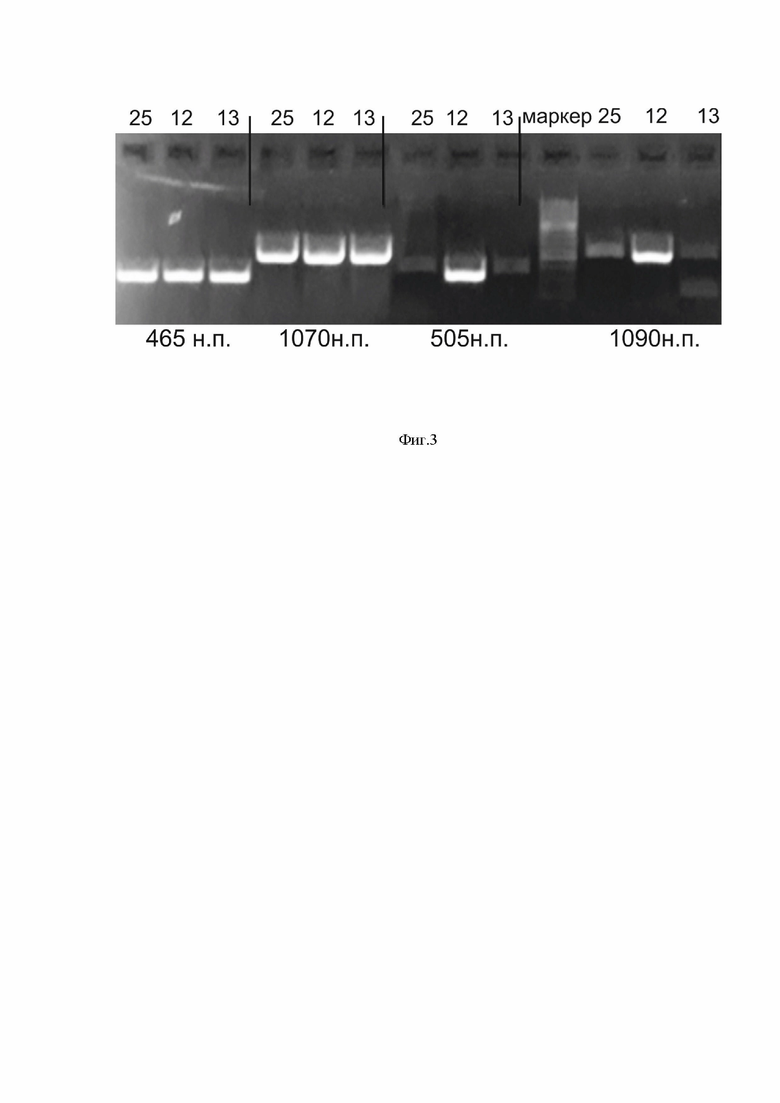
На фиг.3 представлена электрофореграмма выделенных плазмидных препаратов, несущих вставки YF17DD-UN.
На фиг.4 представлены результаты регистрации накопления специфического продукта амплификации путем измерения интенсивности флуоресцентного сигнала ОТ-ПЦР-РВ.
Ось ординат – относительная флуоресценция (RFU)для каждого цикла и каждого цикла амплификации
Ось абсцисс – количество циклов амплификации
─Δ─ - ген NS5 синтетического векторного арбовируса группы BYF17DD-UN,
─○─ - ген Е штамма 493 вируса клещевого энцефалита.
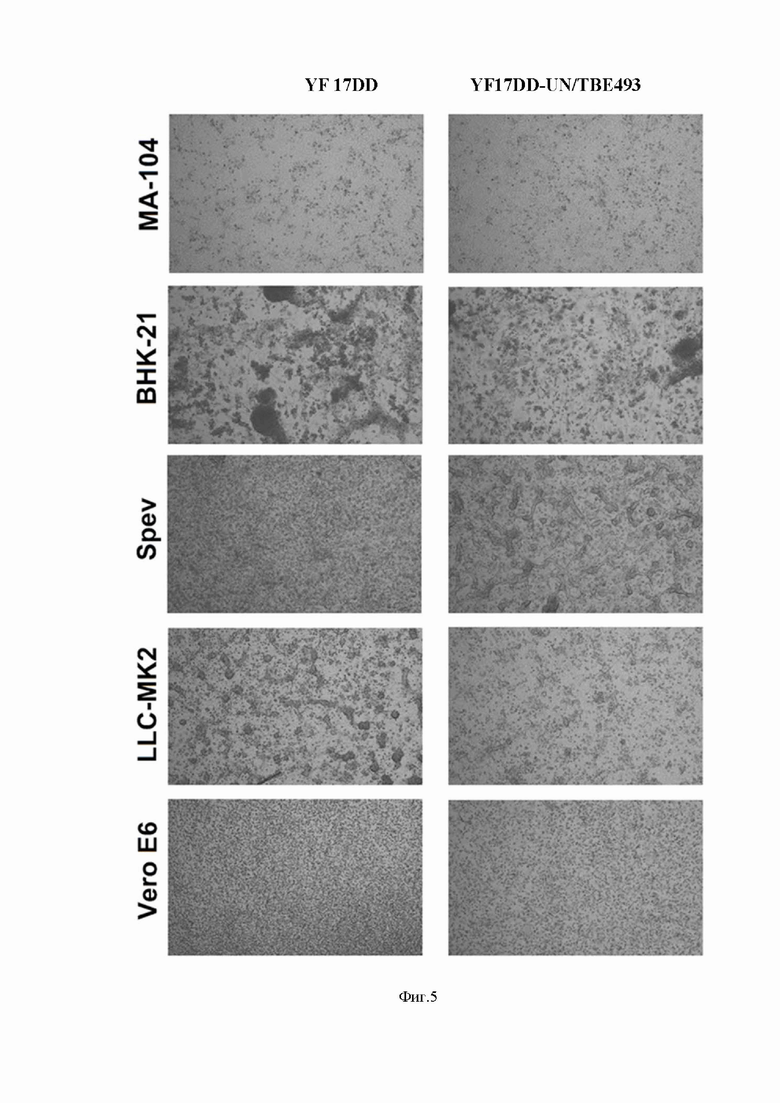
На фиг.5 представлены результаты морфологических изменений клеток в процессе репликации вирусов.
На фиг.6 представлена характеристика исследуемых вирусов в БОЕ. Клетки Vero E6 инфицированы, а затем окрашены кристаллическим фиолетовым.
На фиг.7 представлена кинетика репликации двух исследуемых вирусов на пяти различных клеточных линиях. Показаны изменения Ct в процессе инфекции.
Ось ординат – количество циклов амплификации
Ось абсцисс – время культивирования
─●─ - YF17DD-UN
─■─ - YF/TBEV
─▲─ - TBEV
Осуществление изобретения
Авторами изобретения было выбрано два типа вируса – вирус желтой лихорадки штамм YF17DD-UN и вирус клещевого энцефалита штамм 493 TBEV. Геном вируса желтой лихорадки представляет собой одиночную цепь положительно-смысловой РНК, длиной приблизительно 10 800 нуклеотидов, включая 5 'и 3' нетранслируемые (UTR) области. Вирусная частица состоит из белка C, который окружает геном, и белков M и E. Белок E является основным иммуногеном. Благодаря своей генетической стабильности, геном вакцинных штаммов YF17DD и YF17D вируса желтой лихорадки может быть использован для разработки кандидатных вакцин против различных патогенов, как относящихся к арбовирусам группы В, так и неродственных им патогенов. Одним из подходов создания кандидатных вакцин на основе вакцинных штаммов вируса желтой лихорадки является простой и универсальный метод обратной генетики ISA (infectious-subgenomic-amplicons), который позволяет “оживлять” РНК-вирусов из материала геномной кДНК без необходимости клонирования, размножения кДНК в бактериях или транскрипции РНК invitro. Трансфекция клеток эукариот перекрывающимися двухцепочечными фрагментами ДНК, покрывающими весь геном РНК-вируса, обеспечивает рекомбинацию и синтез копии кДНК полного вирусного генома. Полные геномы амплифицируют с помощью ПЦР в трех фрагментах ДНК размером примерно 4 т.п.н., каждый с перекрывающимися областями 70–100 п.н. Первый и последний фрагменты фланкируют соответственно на 5’ и 3’ концах промотором цитомегаловируса человека (pCMV) и рибозимом гепатита дельта, за которым следует сигнал полиаденилирования вируса обезьяны 40 (HDR / SV40pA).
Клещевой энцефалит (КЭ) — это заболевание, вызываемое вирусом клещевого энцефалита (ВКЭ) распространено в лесных районах Европы и северо-восточной Азии. Заболевание человека связано с инфицированием при укусе клеща (в основном рода Ixodes) одним из трех подтипов ВКЭ, а именно европейским, сибирским или дальневосточным. Инфекция европейским подтипом обычно протекает легкой форме, со смертностью <2%. При инфицировании сибирским подтипом вируса заболевание также может протекать в легкой форме КЭ, связанной с непаралитической фебрильной формой энцефалита. Считается, что инфекция дальневосточный подтип вызывает наиболее тяжелые формы КЭ. Однако важно отметить, что как легкие, так и тяжелые случаи КЭ могут быть связаны с инфекцией любым из подтипов. Клещевой энцефалит представляет собой растущую проблему для здоровья людей в Евразии по причине продолжающегося распространения заболевания в новые эндемические очаги. Ежегодно в Российской Федерации регистрируется около 3000 случаев клещевого энцефалита, общий уровень смертности от КЭ в России составляет ~2%. Основным способом профилактики заболевания в эндемичных регионах является вакцинация. Создание живой рекомбинантной вакцины на основе штамма YF17DD-UN вируса желтой лихорадки, содержащей антигены PreM, E и часть C вируса клещевого энцефалита штамма 493 КЭ, относящегося к европейскому подтипу позволит уменьшить количество ревакцинаций необходимых для получения высокого уровня защитных антител.
С целью получения инфекционной копии векторного вируса рода Flavivirus, которая в дальнейшем была использована для создания конструкции вируса YF17DD-UN/TBE493 последовательность штамма YF17DD-UN была синтезирована denovo. В ходе работы было определено, что для успешного проведения трансфекции и последующей генерации вируса требуется три ампликона. Для получения стабильных конструкций, необходимых для последующей работы по созданию рекомбинантной конструкции YF17DD-UN/TBE493 все три фрагмента были заклонированы в низкокопийной плазмиде pBad 33 mini. Полученные конструкции были проверены с помощью секвенирования по Сенгеру, а также высокопроизводительного секвенирования. Схемы плазмид представлены на фиг. 1А, 1Б, 1С.
Трансфекция и последующие пассажи на клеточной линии VeroE6 показали, что “оживление” вируса YF17DD-UN прошло успешно, как с использованием классического подхода ISA, так и с использованием заклонированных в плазмиды частей вируса YF17DD-UN/TBE493. На клеточной линии наблюдалось развитие ЦПД. Репликация вируса была подтверждена с помощью одноэтапного анализа РНК методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме “реального времени”.
При создании конструкции YF17DD-UN/TBE493 (фиг.2) штамм YF17DD-UN выступил в качестве каркасного вируса, в котором структурные гены PreM, E и часть C были заменены аналогичными генами штамма 493 TBEV, относящегося к европейскому генотипу вируса клещевого энцефалита. Для работы была использована одна из трех конструкций, в которой находится 5’-часть YF17DD-UN, содержащая структурные гены для замены. На выбранных стыках между генами находятся сайты протеолиза и множественное выравнивание последовательностей вирусов рода Flavivirus показывает, что данные участки достаточно консервативны. При анализе последовательностей YF17DD-UN и TBEV штамм 493 были определены характерные области на стыке генов, регулирующие процесс сборки и протеолитической обработки зрелого полипротеина.
После выбора конкретных мест соединения вирусов, был разработан дизайн праймеров, который позволил провести сборку вируса по методу Гибсона (Gibson Assembly) с последующей трансформацией в бактериальные клетки. С помощью секвенирования по Сенгеру в отобранных клонах были проверены и подтверждены межгенные соединения двух вирусов.
Дальнейшая трансфекция и последующий пассаж на клеточной линии Vero E6 показали, что создание конструкции YF17DD-UN/TBE493 и “оживление” вируса YF17DD-UN/TBE493 прошли успешно. На клеточной линии наблюдалось развитие ЦПД. Репликация вируса YF17DD-UN/TBE493 была подтверждена с помощью RT-PCR и ИФА. Оценку способности вируса YF17DD-UN/TBE493 стимулировать образование вируснейтрализующих антител против клещевого энцефалита проводили с использованием модельных животных. Было установлено, что сыворотка от иммунизированных животных специфически нейтрализует вирус КЭ штамм Абсеттаров в разведении от 1/20 до 1/40, что позволяет сделать вывод о появлении у животных вируснейтрализующих антител.
Рекомбинантный вирус YF17DD-UN/TBE493 может быть использован для профилактики против клещевого энцефалита. Осуществление изобретения подтверждается следующими примерами.
Пример 1. Выбор клонов несущих вставки YF17DD-UN осуществляли по результатам оценки размера полученных продуктов ПЦР, олигнуклеотиды подбирались на внутренние части вставок. Выбранные клоны (отмечены на фиг. 3) были в дальнейшем использованы для трансфекции клеток Vero E6.Полный геном YFV, фланкированный на 5’ конце промотором цитомегаловируса человека (pCMV) и на 3’ конце рибозимом гепатита дельта, за которым следует сигнал полиаденилирования вируса обезьяны 40 (HDR / SV40pA), был синтезирован denovo (Евроген) и амплифицирован с помощью ПЦР в три перекрывающихся фрагмента ДНК размером 5800, 3688 и 5784 пар оснований.
Сборка фрагментов ДНК в инфекционный клон производилась с помощью набора Gibson Assembly Ultra Master Mixkit (Codex DNA). Условия проведения реакции согласно рекомендации производителя. Трансформация клеток E.сoli проводилась стандартным химическим методом [6]. Наращивание клеток E.coli после трансформации проводилось в жидкой среде 2YT, а также на твердой среде 2YTс добавлением 2% агар. При отборе клонов наличие вставок в векторах подтверждали ПЦР с детекцией продуктов амплификации с помощью электрофореза в агарозном геле либо ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме “реального времени” с использованием термоциклера Quantstudio 5 (Thermofisher, США).
Генерацию областей cor/PreM/E TBE493 проводили с помощью ПЦР-амплификации. Для амплификации области cor/PreM/E размером 2040 пар оснований получали кДНК с помощью набора реагентов SuperScript™ III ReverseTranscriptase (Thermofisher). Ампликоны получали с помощью набора 2X Platinum SuperFi Green Master Mix (Thermo Fisher Scientific). Амплификация нуклеиновых кислот проводилась на приборах miniAmp (Thermofisher) и Т100 (Biorad). Продукты амлификации детектировали с помощью электрофореза в агарозном геле.
Подбор олигонуклеотидных праймеров для конструирования кДНК инфекционных клонов проводился с помощью программы Snap Gene (Version 5.0).
Пример 2.Репликацию вируса YF17DD-UN/TBE493 в культуре клеток Vero E6 оценивали с помощью ОТ-ПЦР-РВ. Геном-мишенью для ОТ-ПЦР-РВ были гены NS5 YF17DD-UN и Е ген TBE493. Экстракцию РНК осуществляли с помощью реагента для выделения суммарной РНК Extract RNA (Евроген).Для тестирования вирус содержащей жидкости использовали OneTube RT-PCRmix и OneTube RT-PCR TaqMan (Евроген) в соответствии с инструкцией. Общий объем реакционной смеси - 25 мкл. Амплификацию проводили с использованием прибора Quant Studio 5 (Applied Biosystems), задавали следующую программу амплификации: 500C - 30 мин, 950C – 5 мин (прогрев); 950C – 10 с / 600C – 20 с (детекция) / 720С - 30 с - 35 циклов. Подбор олигонуклеотидов проводился с помощью программы SnapGene (Version 5.0). Регистрация накопления специфического продукта амплификации путем измерения интенсивности флуоресцентного сигнала ОТ-ПЦР-РВ позволяет сделать вывод об активной репликации вируса YF17DD-UN/TBE493(фиг.4).
Пример 3.Продукциюбелков-антигенов 493 вируса клещевого энцефалита штаммом YF17DD-UN/TBE493 оценивали с помощью ИФА. Для проведения ИФА лунки планшетов сенсибилизировали в объеме 100 мкл на лунку иммуноглобулинами против вируса клещевого энцефалита (Ig TBEV) и контрольным – против вируса Синдбис (Sindbisvirus(SINV), род Alphavirus), разведенными в 0,05 М карбонатно-бикарбонатном буфере с рН 9,6. Положительным контролем служил сахарозо-ацетоновый антиген (САА) вируса TBEV, отрицательным – САА, приготовленный из мозга неинфицированных мышей (САА N). Результаты представлены в таблице 1.
Таблица 1. Результаты ИФА для 4 клонов YF17DD-UN/TBE493
Из представленных результатов видно, что в образцах клон 1, клон 4 и клон 12 выявляется антиген вируса TBEV (ячейки таблицы, выделенные серым цветом).
Пример 4.Для оценки биологических свойств вируса YF17DD-UN/TBE493 , была исследована кинетика его репликации в сравнении с вакцинным штаммом YF 17DD. Для этого использовали пять различных клеточных культур - Vero E6, BHK-21, MA-104, Spev и LLC-MK2. Эксперимент длился в течение 4 дней, с ежедневным отбором проб для определения титра вируса (БОЕ/мл) и ПЦР. Было обнаружено, что пермессивность всех используемых клеток аналогична как для YF 17DD, так и для вируса YF17DD-UN/TBE493. При их репликации на клетках развивался выраженные ЦПД. Менее восприимчивыми к инфекции двумя вирусами оказались клетки МА-104, в которых не развивался полный СРЕ. Для всех остальных культур клеток, титры вирусов в ходе эксперимента составляли более 106БОЕ/мл(фиг.5).
При анализе титра вирусов с помощью определения БОЕ было выяснено, что оба вируса на всех исследуемых клетках приводят к образованию небольших бляшек. В целом, средний диаметр бляшки не превышал 1.5 мм.
Исследование репликации двух вирусов была проанализировано с помощью ОТ-ПЦР-РВ. Аналогичным образом, менее чувствительными к инфекции оказались клетки MA-104 (фиг. 6). Пик репликации вируса приходился на второй день инфекции (48 ч.) и выходил на плато для вируса YF 17DD. Репликации вируса YF17DD-UN/TBE493 снижалась на третий день инфекции (72 ч.) практически на всех исследуемых клетках с выходом на плато. Тем не менее, уровень РНК TBEV (пунктирная линия на фиг. 6) вируса YF17DD-UN/TBE493, был аналогичен уровню РНК YF вируса 17DD.
Полученные данные свидетельствуют про сохранение фенотипических свойств для вируса YF17DD-UN/TBE493, которые аналогичны вакцинному штамму YF17DD.
Пример 5. Оценку способности вируса YF17DD-UN/TBE493 нейтрализовать вирус клещевого энцефалита проводили с помощью реакции нейтрализации с использованием иммунных асцитных жидкостей TBEV и YF.
Реакция нейтрализации в отношении 1 клона YF17DD-UN/TBE493 была выполнена в перевиваемой культуре клеток Vero E6. Источником заражения клеток служила вируссодержащая культуральная жидкость, собранная после развития ЦПД в матрасах, в которых нарабатывался 1 клон вируса YF17DD-UN/TBE493. В лунки 96-луночного планшета вносили 10-кратные разведения (разведения от нативного до 10 -7) в поддерживающей среде (DMEM, 1% ЭТС) по 100 мкл (Таблица 2).
Таблица 2. Схема внесения разведений вирусной суспензии.
После этого к раститрованному вирусу YF17DD-UN/TBE493 добавляли иммунные асцитные жидкости вируса клещевого энцефалита и вируса желтой лихорадки. Иммунная асцитная жидкость вируса клещевого энцефалита получена при иммунизации штаммом 4072 вируса клещевого энцефалита, сибирский геновариант. Иммунная асцитная жидкость вируса желтой лихорадки получена при иммунизации штаммом Дакар, вакцинный штамм в разведениях 1:40 и 1:80. В лунки с контрольным (сравнительным) титрованием – 4 вертикальных ряда (№ 9 – 12) – так же вносили поддерживающую среду (Таблица 3).
Таблица 3. Схема внесения иммунных асцитных жидкостей вируса клещевого энцефалита и вируса желтой лихорадки
TBEV
1:40
TBEV
1:80
YFV
1:40
YFV
1:80
(контрольное титрование)
Инкубацию планшета проводили в термостате с 5% содержанием СО2 при +37 0С в течение 1 часа. Затем содержимое лунок планшета переносили в планшет с монослоем клеток Vero E6. Инкубацию планшетов проводили в термостате с 5% содержанием СО2 при +370С.
Учет реакции проводили ежедневно в течение 7 дней, наблюдая за развитием ЦПД вируса на клетки, просматривая лунки планшетов под инвертированным микроскопом. Титр вируса оценивали в lg ТЦИД50. Было установлено, что титр вируса в контрольном титровании составил 5,5 lg ТЦИД50 (Таблица 4).
Таблица 4. Результаты реакции нейтрализации с иммунными асцитными жидкостями TBEV и YFV против вируса YF17DD-UN/TBE493
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
*+ - степень ЦПД от одного креста (единичный очаг развития вируса) до 4-х крестов (100% ЦПД) все клетки мертвы, нейтрализующей активности нет.
В реакции нейтрализации установлено, что иммунная асцитная жидкость TBEV (сибирский генотип) специфически нейтрализует вирус YF17DD-UN/TBE493. Индекс нейтрализации вируса клещевого энцефалита составил более 5,0 lg, что указывает на высокую специфичность иммунной асцитной жидкости к поверхностному гликопротеину Е вируса YF17DD-UN/TBE493. Иммунная асцитная жидкость вируса желтой лихорадки не обладает нейтрализующей активностью против вируса YF17DD-UN/TBE493.
Способность иммунной асцитной жидкости, полученной при иммунизации мышей штаммом 4072 вируса клещевого энцефалита, сибирский геновариант, нейтрализовать вирус YF17DD-UN/TBE493, содержащий белки-антигены европейского генотипа вируса клещевого энцефалита указывает на наличие перекрестного иммунитета к разным генотипам вируса клещевого энцефалита, а также дает возможность использовать вирус YF17DD-UN/TBE493 в качестве универсальной вакцины как против европейского, так и сибирского и дальневосточного генотипов вируса клещевого энцефалита.
Пример 6. Оценку способности вируса YF17DD-UN/TBE493 стимулировать образование вируснейтрализующих антител против клещевого энцефалита проводили с использованием модельных животных (фиг.7).
Предварительно самок BalbC иммунизировали 1Х10^7 БОЕ на животное вирусом YF17DD-UN/TBE493. Сыворотку для исследования в реакции нейтрализации собирали через 4 недели после иммунизации.
Реакцию нейтрализации проводили микрометодом в 96-луночных планшетах (Costar, США) на перевиваемой культуре клеток SPEV, выращенной на среде 199 с добавлением 5% эмбриональной телячьей сыворотки. Поддерживающая среда содержала 1% сыворотки. При постановке реакции нейтрализации использовали разведение вирусной суспензии, содержащее 100 ТЦИД50 в 100 мкл.
Для проведения реакции нейтрализации штамм вируса клещевого энцефалита Абсеттаров накопили, пулировали и заморозили при -70 0С. Определение lg ТЦИД50 пула вируса проводили методом конечных разведений, для чего вирус титровали на клетках SPEV от 10-3 до 10-11. Подсчет lg ТЦИД50 делали по методике Рида и Менча.
Из сывороток, готовили разведения от 1:10 до 1:1280 и вносили по 100 мкл в лунки 96-ти луночного планшета. К разведениям сывороток добавляли по 100 мкл вируссодержащей суспензии и инкубировали смесь в течение часа при 37 0С. Затем смесь переносили в 96-ти луночный планшет с монослоем клеток SPEV. Через 7 дней реакцию учитывали, просматривая лунки планшета в микроскоп. Если в сыворотке крови есть нейтрализующие вирус антитела, вирус не будет вызывать ЦПД клеток. Титром сыворотки (последним нейтрализующим разведением) считали разведение, при котором обеспечивается 100% защита клеток (нет ЦПД).
РН против 10 ТЦИД50 штамма КЭ Абсеттаров
В реакции нейтрализации установлено, что сыворотка от иммунизированных животных специфически нейтрализует вирус КЭ штамм Абсеттаров в разведении от 1/20 до 1/40, что позволяет сделать вывод о появлении у животных вируснейтрализующих антител.
Таким образом, можно сделать вывод, что разработанное иммунобиологическое средство может быть использовано для индукции специфического иммунитета против заболеваний, вызываемых вирусом клещевого энцефалита.
Литература
1. Appaiahgari M.B., Vrati S. Clinical development of IMOJEV ®-a recombinant Japanese encephalitis chimeric vaccine (JE-CV) Expert Opin. Biol. Ther. 2012;12:1251–1263. doi: 10.1517/14712598.2012.704908.
2. Chokephaibulkit K., Houillon G., Feroldi E., Bouckenooghe A. Safety and immunogenicity of a live attenuated Japanese encephalitis chimeric virus vaccine (IMOJEV®) in children. ExpertRev. Vaccines. 2016;15:153–166. doi: 10.1586/14760584.2016.1123097.
3. Halstead S.B., Thomas S.J. New Japanese encephalitis vaccines: Alternatives to production in mouse brain. ExpertRev. Vaccines. 2011;10:355–364. doi: 10.1586/erv.11.7
4. Thomas S.J., Yoon I.K. A review of Dengvaxia®: Development to deployment. Hum. Vaccin. Immunother. 2019;15:2295–2314. doi: 10.1080/21645515.2019.1658503.
5. Guy B., Noriega F., Ochiai R.L., L′azou M., Delore V., Skipetrova A., Verdier F., Coudeville L., Savarino S., Jackson N. A recombinant live attenuated tetravalent vaccine for the prevention of dengue. ExpertRev. Vaccines. 2017;16:1–13. doi: 10.1080/14760584.2017.1335201
6. «Методы генетической инженерии. Молекулярное клонирование» Маниатис Т., Фрич Э., Сэмбрук Д., 480 с. Издано: (1984).
| название | год | авторы | номер документа |
|---|---|---|---|
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита, на основе мРНК | 2024 |
|
RU2823754C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ТРЕХ ГИБРИДНЫХ БЕЛКОВ ОБОЛОЧКИ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ОПРЕДЕЛЯЮЩИХ ПРИНАДЛЕЖНОСТЬ К СИБИРСКОМУ (DBD2-D3S), ЕВРОПЕЙСКОМУ (DBD2-D3E) И ДАЛЬНЕВОСТОЧНОМУ (DBD2-D3D) ПОДТИПАМ ВИРУСА; РЕКОМБИНАНТНЫЕ ПЛАЗМИДЫ pDBD2-D3S, pDBD2-D3E И pDBD2-D3D; ШТАММЫ-ПРОДУЦЕНТЫ Escherichia coli M15 [pREP4]; ХИМЕРНЫЕ БЕЛКИ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2560588C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PC-NS3, ОБЕСПЕЧИВАЮЩАЯ ИНТЕГРАЦИЮ КОМПЛЕКСА ГЕНОВ C, PRM, E, NS1, NS2A, NS2B, NS3 ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА (ВКЭ) В ГЕНОМ ВИРУСА ОСПОВАКЦИНЫ (ВОВ) И РЕКОМБИНАНТНЫЙ ШТАММ ВИРУСА ОСПОВАКЦИНЫ, ЭКСПРЕССИРУЮЩИЙ В КЛЕТКАХ ИММУНИЗИРОВАННОГО ОРГАНИЗМА КОМПЛЕКС ГЕНОВ C, PRM, E, NS1, NS2A, NS2B, NS3 ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1995 |
|
RU2112038C1 |
| ФЛАВИВИРУС С ДВУХКОМПОНЕНТНЫМ ГЕНОМОМ И ЕГО ИСПОЛЬЗОВАНИЕ | 2008 |
|
RU2527891C2 |
| Способ выявления вируса клещевого энцефалита методом ОТ-ПЦР в реальном времени | 2019 |
|
RU2744187C1 |
| Рекомбинантная плазмида pHis6-flagG-protE, обеспечивающая синтез рекомбинантного химерного белка, включающего эпитопы гликопротеина Е вируса клещевого энцефалита и флагеллин G S.typhii и используемого в качестве основы для вакцины против вируса клещевого энцефалита | 2018 |
|
RU2702716C2 |
| ИНФЕКЦИОННЫЕ КЛОНЫ ПОЛНОМЕРНОЙ кДНК КЛЕЩЕВОГО ФЛАВИВИРУСА | 2001 |
|
RU2288266C2 |
| ХИМЕРНЫЕ ФЛАВИВИРУСНЫЕ ВАКЦИНЫ | 1998 |
|
RU2209082C2 |
| Плазмидная генетическая конструкция pVEAL3-10H10ch, штамм рекомбинантной клеточной линии CHO-K1-10H10ch и химерное антитело 10H10ch против вируса клещевого энцефалита, продуцируемое указанным штаммом клеточной линии CHO-K1-10H10ch | 2022 |
|
RU2800471C1 |
| Рекомбинантная плазмидная ДНК pET160-E3-YFV, экспрессирующая аналог третьего домена поверхностного белка Е вируса желтой лихорадки (ВЖЛ) в бактериальной системе E. coli, используемого для выявления специфических антител ВЖЛ | 2022 |
|
RU2798563C1 |



Группа изобретений относится к области биотехнологии, иммунологии и вирусологии. Создано иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита на основе рекомбинантного вируса рода Flavivirus, полученного с применением методов генной инженерии, обратной генетики и синтеза генов de novo и представляющего собой векторный вирус желтой лихорадки, в котором часть капсидного (C) белка, премембранный (prM) и оболочечный (E) белки замещены на часть капсидного (C) белка, премембранный (prM) и оболочечный (E) белки 493 штамма вируса клещевого энцефалита. Первый векторный вирус может представлять собой вирус желтой лихорадки, а именно штамм YF17DD-UN. Кроме того, рекомбинантный вирус может представлять собой вирус YF17DD-UN/TBE493. Группа изобретений расширяет арсенал средств для индукции специфического иммунитета против заболеваний, вызываемых вирусом клещевого энцефалита. 2 н. и 3 з.п. ф-лы, 7 ил., 4 табл., 6 пр.
1. Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита на основе рекомбинантного вируса рода Flavivirus, полученного с применением методов генной инженерии, обратной генетики и синтеза генов de novo и представляющего собой векторный вирус желтой лихорадки, в котором часть капсидного (C) белка, премембранный (prM) и оболочечный (E) белки замещены на часть капсидного (C) белка, премембранный (prM) и оболочечный (E) белки 493 штамма вируса клещевого энцефалита.
2. Иммунобиологическое средство по п.1, в котором векторный вирус рода Flavivirus представляет вирус желтой лихорадки, полученный с помощью обратной генетики и синтеза генов de novo.
3. Иммунобиологическое средство по любому из пп.1, 2, в котором вирус желтой лихорадки представляет собой YF17DD-UN.
4. Иммунобиологическое средство по любому из пп.1-3, которое представляет собой рекомбинантный вирус YF17DD-UN/TBE493.
5. Применение иммунобиологического средства по любому из пп.1-4 для получения вакцин для профилактики клещевого энцефалита.
| WO 2001060847 A2, 23.08.2001 | |||
| ПЕЧЬ ОТОПИТЕЛЬНО-ВАРОЧНАЯ | 2004 |
|
RU2282790C2 |
| WO 2009114207 A2, 17.09.2009 | |||
| EP 3723796 A1, 21.10.2020 | |||
| CN 103088038 A, 08.05.2013 | |||
| RU 2007143529 A, 10.06.2009 | |||
| Основы доказательной медицины | |||
| Учебное пособие для системы послевузовского и дополнительного образования врачей | |||
| / Под общей редакцией академика РАМН, профессора Р.Г | |||
| Оганова | |||
| - | |||
Авторы
Даты
2023-05-11—Публикация
2022-09-08—Подача