Изобретение относится к генетическим конструкциям, экспрессирующим вирусные белки и может быть использовано в биотехнологии, генетической инженерии и медицинской диагностике вируса желтой лихорадки.
Областью применения рекомбинантного аналога третьего домена белка Е ВЖЛ (rE3-YFV) является создание таких серологических тестов, как иммуноферментный анализ (ИФА), иммуноблот-анализ и иммунохроматографический анализ (ИХА), которым становится возможным выявление специфических антител (IgM/IgG) к ВЖЛ и оценка эффективности вакцинации.
Желтая лихорадка (ЖЛ) - природно-очаговая арбовирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя. По данным ВОЗ за 2016-2022 гг. случаи ЖЛ регистрируются в 14 странах (Ангола, Венесуэла, Гана, Демократическая Республика Конго, Камерун, Кот-д'Ивуар, Нигер, Нигерия, Республика Конго, Центральноафриканская Республика, Чад, Уганда, Бразилия и Республика Суринам), а также встречаются завозные случаи ЖЛ - в Китае (11 случаев), Кении (2) и Нидерландах (1) [1-3].
Обнаружение антител, обладающих нейтрализующей активностью против вируса, может быть использовано для подтверждения флавивирусной инфекции или для оценки протективных свойств вакцины. Однако, флавивирусные инфекции человека вызывают выработку перекрестно реагирующих антител, что часто делает серологический анализ некорректным. Действительно, серологическая диагностика флавивирусной инфекции может быть затруднена из-за наличия в анамнезе пациента контакта с другими флавивирусами особенно в регионах, где совместно циркулируют несколько антигенно родственных флавивирусов.
В связи с возрастающим туристическим потоком в страны, эндемичные по ЖЛ, обнаружением на территории южных регионов Российской Федерации устойчивых популяций комаров видов Ае. aegypti и Ае. albopictus [5-6], являющихся основными переносчиками вируса желтой лихорадки, и тем, что в медицинских учреждениях нашей страны есть возможность получить живую аттенуированную вакцину от желтой лихорадки, но нет возможности оценки ее эффективности, в связи с чем актуальна задача, касающаяся разработки надежных и экономически доступных диагностических тест-систем для лабораторной индикации вируса и изучения его возможного распространения на территории России.
На начало 2022 года зарегистрированные коммерческие наборы (таблица 1) для выявления специфических антител к вирусу желтой лихорадки (ВЖЛ) производятся шестью иностранными компаниями: «Euroimmun» (Германия), «Alpha Diagnostic (США), «MyBioSource» (США), «Creative Diagnostics)) (США), «Abbexa» (Великобритания), National Institute of Health (Перу) (табл.1). Из всех выпускаемых данными производителями диагностических наборов, только у компании «Euroimmun» (Германия) имеется регистрация за рубежом (10 тест-систем) и в РФ (6 тест-систем) [4]. Тесты этой компании основаны на методе непрямой иммунофлуоресценции антител и одним таким набором можно проанализировать до 10 образцов. Тесты представляют собой биочипы, покрытые зафиксированными на реакционных полях инфицированными и неинфицированными клетками ВЖЛ. В случае положительной реакции, специфические антитела класса IgG и IgM будут связываться с вирусными антигенами. На следующем этапе, прикрепленные антитела окрашиваются антителами против антител человека, меченными флуоресцеином, и становятся видимыми с помощью флуоресцентного микроскопа.
Недостатками этих тестов является необходимость квалифицированного персонала для интерпретации результатов, небольшое количество одновременно анализируемых проб и высокая стоимость по сравнению с другими методами диагностики ВЖЛ.
Известна иммунохимическая тест-система для диагностики ВЖЛ (патент Китая №203191383, МПК G01N 33/558, опубл. 11.09.2013 г.)[18], которая выполнена в виде магнитной тест-полоски. Тест включает пластину, нитроцеллюлозную пленку и магнитный комплекс. Прокладки для образцов, абсорбирующие прокладки и линии обнаружения, содержащие антитела к вирусу желтой лихорадки, которые объединяют частицы для маркировки антител к вирусу желтой лихорадки. Линия контроля качества, содержащая анти-антитело, может специфически связываться с антителом к вирусу желтой лихорадки. Тест-полоска имеет простую конструкцию и удобна в применении, но обладает недостаточной специфичностью.
Наиболее близким аналогом (прототипом) является способ количественного определения антигена вируса желтой лихорадки в композиции, содержащей антиген вируса желтой лихорадки (фрагменты структурных белков вируса желтой лихорадки: белок С, белок М или белок Е), методом иммуноферментного анализа "двойной сэндвич (патент ЕА №38215, МПК G01N 33/569, опубл. 26.07.2021 г.). Однако такое тестирование также обладает недостаточной специфичностью.
Техническим результатом предлагаемого изобретения является повышение специфичности диагностических средств ВЖЛ за счет обеспечения возможности использования в диагностических средствах аналога третьего домена поверхностного белка Е вируса желтой лихорадки (ВЖЛ) для выявления специфических антител ВЖЛ.
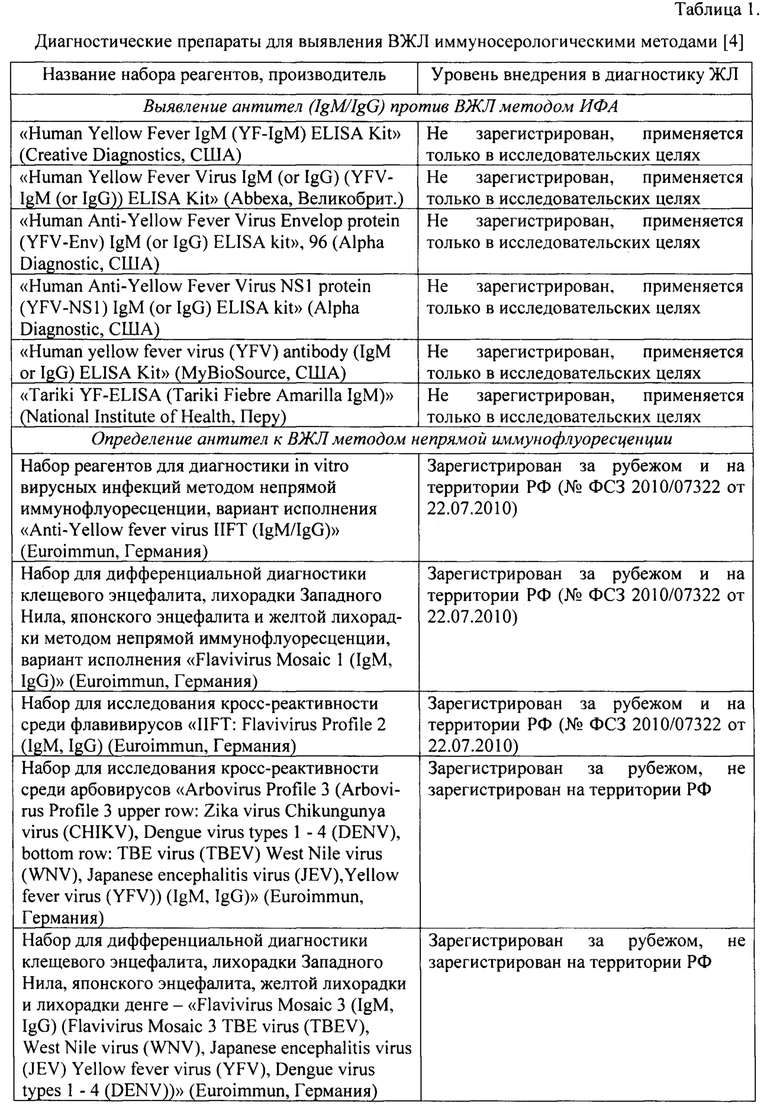
Указанный технический результат достигается созданием рекомбинантной плазмидной ДНК pET160-E3-YFV, экспрессирующей аналог третьего домена поверхностного белка Е вируса желтой лихорадки (ВЖЛ) в бактериальной системе Е. Coli, используемого для выявления специфических антител ВЖЛ, представленная на физической и генетической карте на фиг.1, имеющая нуклеотидную последовательность SEQ ID No.: 1, размер 6319 п.н., молекулярную массу 23,5 кДа и содержащая следующие основные элементы:
- Т7 промотр, имеющий координаты от 21 до 40 п.н. и обеспечивающий высокий уровень индуцируемой ИПТГ экспрессии рекомбинантного белка в штаммах Е. coli, экспрессирующих РНК-полимеразу Т7;
- Iac-оператор, имеющий координаты от 40 до 64 п.н. и являющийся сайтом связывания lac-репрессора, который снижает базальную экспрессию рекомбинантного белка;
- старт-кодон ATG, имеющий координаты от 109 до 111 п.н. и являющийся местом инициации транскрипции;
- N-концевой 6xHis-TpaKT, имеющий координаты от 112 до 129 п.н. и обеспечивающий обнаружение рекомбинантного белка с помощью антител Anti-HlsG и очистку его на металло-хелатирующей смоле;
- целевую вставку E3-YFV, имеющую координаты от 241 до 721 п.н., представляющая собой фрагмент гена третьего домена белка Е вируса желтой лихорадки, обеспечивающего экспрессию рекомбинантного аналога третьего домена белка Е вируса желтой лихорадки, который имеет аминокислотную последовательность SEQ ID No.: 2;
- Т7 область терминации транскрипции, имеющая координаты от 786 до 914 п.н. и являющаяся последовательностью бактериофага Т7, которая обеспечивает эффективную терминацию транскрипции;
- ген устойчивости к ампициллину (bla), имеющий координаты от 1318 до 2178 п.н. и являющийся селективным маркером;
- точку начала репликации плазмидной ДНК pBR322 ori в E.coli, имеющую координаты от 2323 до 2996 п.н.;
- lad ORE, имеющий координаты от 4870 до 5961 п.н. и обеспечивающий кодирование lac-репрессора, который связывается с промотором T7lac для блокирования базальной транскрипции интересующего гена и с промотором lacUV5 в хромосоме хозяина для подавления транскрипции РНК-полимеразы Т7.
В составе вирусного генома флавивирусов имеется 3 гена, кодирующие белки, которые способны индуцировать иммунный ответ в организме - Е, NS1 и NS3. За основу для разработки иммунологического диагностикума, направленного на выявления антител к флавивирусам можно использовать Е и NS1 белки, так как именно эти белки содержат эпитопы, распознающиеся нейтрализующими антителами [7].
Хорошо известно, что вирусы семейства Flaviviridae проявляют высокую гомологию по аминокислотному составу белка NS1 [8]. Несмотря на это, большинство ИФА тест-систем направленных на выявление антител IgM и IgG флавивирусов производится именно на основе флавивирусного NS 1 белка или на натуральном антигене, что повышает уровень сероконверсии между антителами к разным флавивирусам и осложняет диагностирование заболевания.
Белок Е флавивирусов состоит из трех отдельных доменов, которые соединены короткими гибкими шарнирными областями. Первый домен является центральным доменом, соединяющим два других домена. Второй домен представляет собой удлиненную структуру, которая обеспечивает димеризацию белков Е в зрелом вирионе [9]. Домен III принимает иммуноглобулин-подобную складку на С-конце, является частью белка Е, которая выступает дальше всего от поверхности зрелого вириона и содержит сайты связывания для клеточных факторов, участвующих в прикреплении и проникновении вируса в клетку [10].
Согласно литературным данным, все три домена белка Е распознаются нейтрализующими антителами с варьирующей активностью [11]. Показано, что третий домен белка Е ВЖЛ имеет особенности аминокислотного состава, которые отличают его от аналогичных белковых структур других флавивирусов [12]. Эти различия являются уникальными для ВЖЛ и представляют собой типоспецифичные эпитопы нейтрализации для различных флавивирусов, и поэтому данный участок белка предлагается использовать для специфической серодиагностики ВЖЛ.
Областью применения рекомбинантного аналога третьего домена белка Е ВЖЛ (rE3-YFV) является разработка таких серологических тестов, как иммуноферментный анализ (ИФА), иммуноблот-анализ и иммунохроматографический анализ (ИХА), которым становится возможным выявление специфических антител (IgM/IgG) к ВЖЛ и оценка эффективности вакцинации.
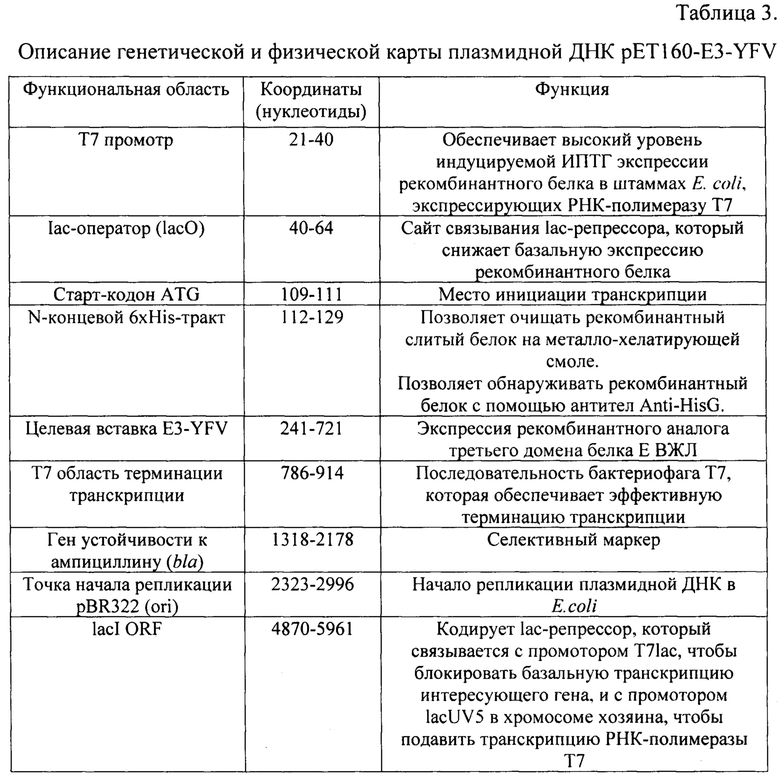
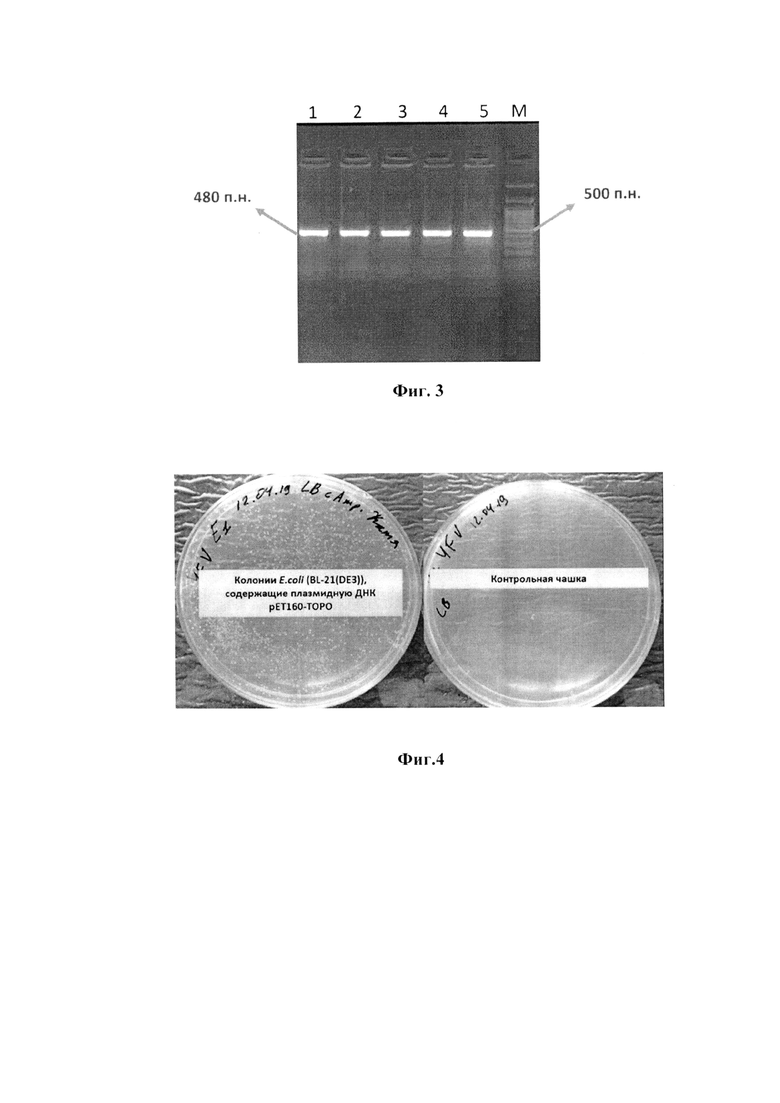
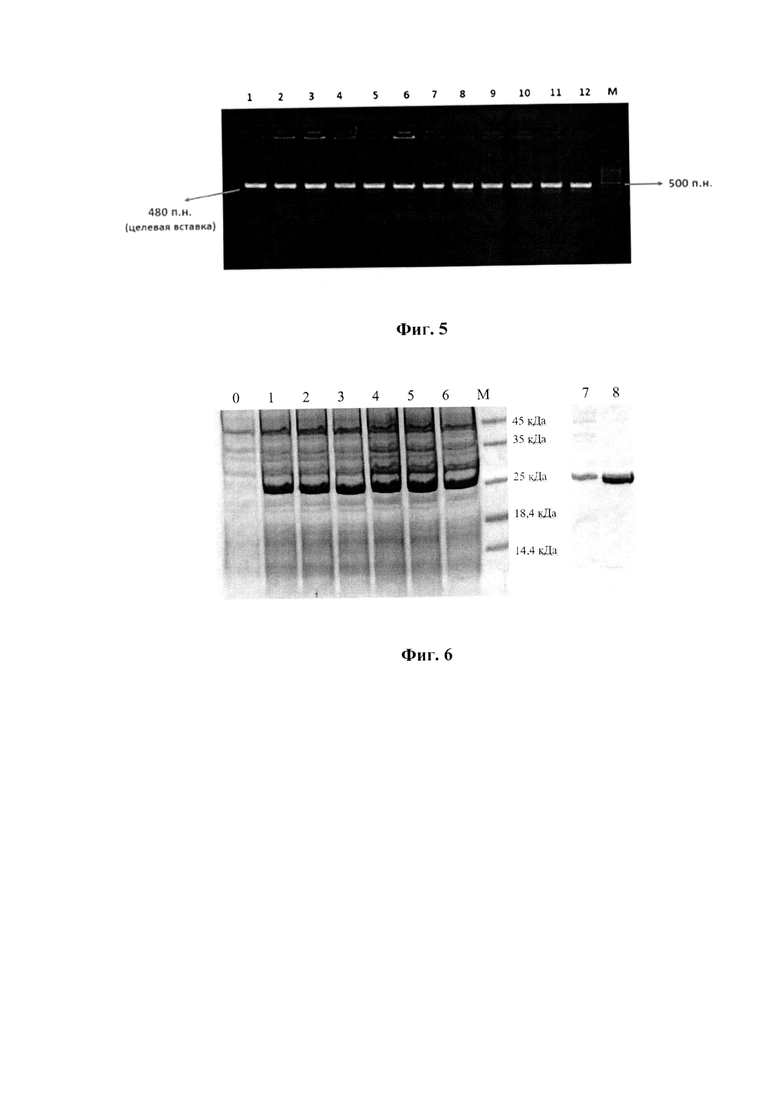
Заявляемое изобретение поясняется следующими графическими материалами. На фиг.1 представлена полная физическая карта плазмидной ДНК pET160-E3-YFV, а на фиг.2 - упрощенная схема плазмидной ДНК pET160-E3-YFV с указанием наиболее значимых для работы функциональных областей. На фиг.3. изображена электрофореграмма ПЦР-продуктов гена Е белка ВЖЛ. На фиг.4. представлены чашки Петри с питательной средой LB и ампициллином. На фиг.5. приведена электрофореграмма ПЦР-продуктов гена Е белка ВЖЛ после клонирования в плазмиду рЕТ160 и трансформации E.coli штамма BL-21(DE3). На фиг.6. представлена электрофореграмма лизатов клеток E.coli BL-21 (DE3) и очищенного рекомбинантного белка в 15% ПААГ-электрофорезе с SDS. На фиг.7 приведены результаты выявления очищенного антигена методом вестерн-блоттинга. На фиг.8 получены результаты ИФА для определения чувствительности рекомбинантного белка гЕ3-YFV к антителам разных флавивирусов или отсутствие таковых. Пример 1. Описание генетической конструкции, технологии ее получения,
физическая и генетическая карта конструкции. Получение целевого фрагмента гена третьего домена белка Е ВЖЛ. В работе использовали вакцинный штамм 17D ВЖЛ, который нарабатывали на клеточной культуре Aedes albopictus С6/36, полученной из Коллекции культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора [13]. Выделение суммарных нуклеиновых кислот и постановка реакции обратной транскрипции производились с использованием коммерческих наборов «РИБО-преп» и «Реверта-100-L» (ФГУН ЦНИИЭ Роспотребнадзора, Россия) согласно инструкциям производителя. Дизайн олигонуклеотидных праймеров осуществляли при помощи программы PerlPrimer v. 1.1.21 [14], используя известные нуклеотидные последовательности геномов ВЖЛ, доступные в базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank). Перечень используемых в работе праймеров и условия их использования представлены в таблице 2.

Для визуализации результатов ПЦР использовался метод гель-электрофореза в 2% агарозном геле. Для наблюдения за электрофорезом в пробу добавляют краситель, который передвигается со скоростью несколько большей, чем скорость движения наиболее подвижных макромолекул. Также добавляли ДНК-маркер (100+ bp DNA Ladder, Evrogen, Россия) для сопоставления размеров ампликонов. Гель-электрофорез проводили в течении 30 минут при постоянном напряжении 5 В/см в буфере 1х ТАЕ, затем визуализировали результаты в трансиллюминаторе. Полученные ампликоны вырезались скальпелем и элюировались с помощью набора для элюции ДНК из агарозного геля BioSilica (Новосибирск, Россия), согласно инструкции производителя. На фиг.3. представлена электрофореграмма ПЦР-продуктов гена Е белка ВЖЛ (где: 1-5 - номера проб, содержащих инактивированный 17D вакцинный штамм ВЖЛ, выращенный на культуре клеток С6/36; М -маркер длин ДНК (100+ bp DNA Ladder, Evrogen, Россия). Примечание: п.н. -пар нуклеотидов
Клонирование целевого фрагмента гена белка Е в плазмидную ДНК рЕТ160-ТОРО и получение рекомбинантной плазмидной ДНК рЕТ160-Е3-YFV. Для клонирования использовали 2 мкл свеженаработанного очищенного ампликона и 0,5 мкл вектора рЕТ160-ТОРО по инструкции производителя («Thermo Fisher Scientific)), США).
Клонирование целевого фрагмента в плазмидную ДНК происходило за счет работы топоизомеразы I, которая связывается с дуплексной ДНК в определенных местах и расщепляет фосфодиэфирный остов после 5'-СССТТ в одной цепи [15].
В результате генно-инженерных манипуляций была получена гибридная плазмида pET160-E3-YFV, кодирующая ген аналога третьего домена белка Е ВЖЛ длинною 221 а.о. (с шестью остатками гистидина, что обеспечивает последующее выделение целевого белка на Ni-хелатном носителе и остатками полилинкера плазмиды) под контролем промотора фага Т7.
На фиг.1 приведена полная физическая карта плазмидной ДНК рЕТ160-E3-YFV, а на фиг.2 - упрощенная схема плазмидной ДНК pET160-E3-YFV с указанием наиболее значимых для работы функциональных областей. В таблице 3 представлено описание генетической и физической карты плазмидной ДНК pET160-E3-YFV.
Пример 2. Получение штамма-продуцента рекомбинантного белка гЕ3-YFV
Трансформация и отбор клонов, содержащих гибридную плазмиду pET160-E3-YFV. Гибридной плазмидой методом «теплового шока» трансформировали компетентные клетки Е. coli штамма BL21(DE3) («Thermo Fisher Scientific)), США) и засевали на чашки Петри с агаризованной средой LB («AppliChem», Германия) с ампициллином в концентрации 100 мкг/мл в качестве селективного маркера. Отрицательным контролем служили нетрансформированные клетки Е. coli штамма BL21(DE3). На фиг.4. представлены чашки Петри с питательной средой LB и ампициллином.
Из выросших клонов были произвольно отобраны 12 клонов и с помощью ПЦР были отобраны клоны, плазмиды которых содержали целевую вставку. Электрофореграмма ПЦР-продуктов гена Е белка ВЖЛ после клонирования в плазмиду рЕТ160 и трансформации E.coli штамма BL-21(DE3) (где: 1-12-номера клонов; М-маркер длин ДНК (100+ bp DNA Ladder, Evrogen, Россия) представлена на фиг.5.
Выделение плазмидной ДНК осуществляли с использованием «Набора diaGene для выделения плазмидной ДНК из бактерий» («ДИАЭМ», Россия). Анализ вставок проводили с праймерами, комплементарными плазмидной ДНК с обоих концов от вставки (табл.2). Продукты амплификации секвенировали по обеим цепям модифицированным методом Сэнгера на основе капиллярного электрофореза на автоматическом секвенаторе 3130x1 GeneticAnalyzer («Applied Biosystems», США). Полученные нуклеотидные последовательности анализировали с использованием пакета программ UniproUGENE v. 1.30 [16] и MEGA7 [17]. Нуклеотидная последовательность целевой вставки и плазмидной ДНК SEQ ID NO: 1 представлены на фиг.9. Жирным шрифтом выделена целевая вставка, а наклонным шрифтом обозначен старт-кодон.
Пример 3. Наработка и очистка рекомбинантного белка гЕ3-YFV
Штамм Е. Coli BL21(DE3), трансформированный плазмидной ДНК рЕТ160-Е3, культивировали в 100 мл жидкой питательной среды LB с добавлением ампициллина (100 мкг/мл) при 37°С, после чего добавляли индуктор Lac-оперона ИПТГ в различных концентрациях (0,1 мМ, 1 мМ и 10 мМ) и культивировали при разных температурах (25°С, 30°С и 37°С при покачивании на 180 об/мин) с отбором проб в трех временных точках: до индукции, через 5 и 18 часов после добавления ИПТГ. Выбор клонов-продуцентов проводили по наличию экспрессируемого белка методом электрофореза в 15% ПААГ (фиг.6) с SDS. В серии экспериментов показано, что максимальная продукция рекомбинантного белка происходит на 18 час инкубации при температуре 25°С после добавления индуктора в конечной концентрации 1 мМ/мл.
Очистку рекомбинантного белка гЕ3-YFV проводили металл-хелатной аффинной хроматографией с использованием сорбента Ni-IMAC сефарозы (GE Helthcare, США). Для получения клеточных лизатов биомассу (500 мл) осаждали при помощи центрифугирования при 6000g в течение 10 мин при +4°С, с последующим ресуспендированием в лизирующем буфере (30 мМ NaH2PO4, 20 мМ имидазола, 500 мМ NaCl, 8 М мочевины, 0,1% Triton X100, рН 7,4), дезинтегрировали при помощи ультразвука в течение 10 циклов по 90 с с перерывом 3 мин на льду. Клеточный лизат очищался от дебриса при помощи центрифугирования при 15 000g в течение 25 мин при +4°С. Связывание рекомбинантного белка с колонкой происходило при скорости 1,5 мл/мин. Далее следовала промывка колонки от несвязавшихся белков пятью объемами колонки при скорости потока промывочного буфера (30 мМ NaH2PO4, 40 мМ имидазола, 500 мМ NaCl, 8 М мочевины, рН 7,4) 2 мл/мин. Белки элюировали при помощи трех объемов колонки при скорости потока элюирующего буфера (30 мМ NaH2PO4, 500 мМ имидазола, 500 мМ NaCl, 8 М мочевины, рН 7,4) 1 мл/мин. Фракции собирали по 5 мл, концентрацию проверяли при помощи NanoPhotometer NP80 (Implen, Германия).
Чистоту очищенного рекомбинантного белка оценивали в 15% ПААГ с SDS. Электрофореграмма лизатов клеток E.coli BL-21 (DE3) и очищенного рекомбинантного белка в 15% ПААГ-электрофорезе с SDS приведена на фиг.6, где: 0-до индукции ИШТ; 1- инкубация при 25°С при различных условиях; 1-3 инкубация в течении 5 ч после добавления ИПТГ в концентрациях 0,1 мМ, 1 мМ и 10 мМ, соответственно; 4-6 инкубация в течении 18 ч после добавления ИПТГ в концентрациях 0,1 мМ, 1 мМ и 10 мМ, соответственно); 7-спустя 18 часов после добавления ИПТГ (1 мМ/мл); 8 - очищенный рекомбинантный белок; М - маркер. Стрелкой обозначено положение рекомбинантного белка Е ВЖЛ.
Молекулярная масса полученного рекомбинантного белка совпала с теоретическими расчетами (23,5 кДа). Аминокислотная последовательность SEQ ID NO: 2 рекомбинантного белка rE3-YFV представлена на фиг.10.
Пример 4. Подтверждение свойств экспрессируемого белка rE3-YFV
Для определения специфичности взаимодействия полученного рекомбинантного антигена rE3-YFV и антител к ВЖЛ, а также отсутствие таковой к антителам других флавивирусов нами был проведен ряд экспериментов с использованием вестерн-блот анализа и ИФА. Для анализов использовали сыворотки крови людей, вакцинированных против ВЖЛ и вируса клещевого энцефалита (ВКЭ), больных или переболевших вирусами гепатита С (ВГС) или лихорадки денге (ВЛД). В работе также использовались сыворотки крови людей, у которых отсутствуют антитела к ВЖЛ, ВЛД, ВКЭ и ВГС. Присутствие или отсутствие антител в используемых сыворотках было подтверждено коммерческими тест-системами - «Human Yellow FeverVirusIgG (YFV-IgG)» (Abbexa, UK), «Dengue fever rapid diagnostictest (Dengue Duo)» (SD BIOLINE, South Korea), «ВектоВКЭ-IgG» и «Бест анти-ВГС» (ВекторБЕСТ, Россия).
Вестер-блотт анализ проводили по следующей схеме. Предварительно выполняли электрофоретическое разделение белка в денатурирующих условиях в 12% ПААГ. Далее выполняли перенос белков из геля на нитроцеллюлозную мембрану с использованием спиртового Tris-HCl буфера (рН 8) и камеру для полусухого переноса. Результат переноса детектировали окраской мембраны пунцовым S. Блоттинг осуществляли в вакуум-системе SNAPID (Millipore, США). Блокировку мембраны проводили 1% раствором бычего сывороточного альбумина (BSA) в фосфатно-солевом буфере с добавлением 0,1% твином 20 (ФСБ-Т). После выполняли последовательные инкубации с сыворотками и конъюгатом антител против иммуноглобулинов человека с щелочной фосфотазой (Sigma, США). После инкубаций мембрану отмывали раствором ФСБ-Т. Хромогенную реакцию выполняли готовым субстратом BCIP/NBT (Sigma, США). Реакцию останавливали отмывкой дистиллированной водой. Полученные после анализа мембраны высушивали. Далее проводили оцифровку результатов блота в гель-документирующей системе iBright CL750 (ThermoFisher Scientific, США). Обработку полученных изображений выполняли в специализированном ПО InvitrogeniBright Analysis Software (ThermoFisher Scientific, США).
Исследование в вестерн-блот анализе показало специфичное взаимодействие образца сыворотки крови, содержащей антитела к ВЖЛ с иммобилизованным на нитрацеллюлозной мембране рекомбинантным антигеном ВЖЛ. Окрашивание происходило в зоне соответствия молекулярной массы и отсутствовало в двух контрольных полосках нитроцеллюлозных мембранах, обработанных сыворотками крови, не содержащих антитела к ВЖЛ.
Результаты выявления очищенного антигена методом вестерн-блоттинга представлены на фиг.7, где: дорожка №1 - обработанная сывороткой, содержащей антитела к вирусу денге; №2 - сывороткой, не содержащей антитела к ВЖЛ, ВГЭ, ВГС, вирусу денге; №3 - сывороткой крови с антителами к ВЖЛ. Стрелкой обозначено положение рекомбинантного белка ЕВЖЛ.
Твердофазный ИФА проводили в две стадии. Исследуемые образцы (в разведении 1:100) инкубировали с антигеном, сорбированным на полистироловые планшеты (в разведениях от 1:50 до 1.500) и, после пятикратной отмывки от не связавшегося с антигеном материала, :проводили последующую инкубацию с конъюгатом против IgG человека. Затем после второй пятикратной отмывки от конъюгата, не образовавшего иммунные комплексы, производили визуализацию результатов ИФА путем добавления раствора хромогена. После внесения стоп-реагента, учитывали результаты реакции на планшетном ридере MultiscanGO (ThermoFisherScientific, США) при длине волны 450 нм с референс волной при 630 нм. Результаты ИФА для определения чувствительности рекомбинантного гЕ3-YFV к антителам разных флавивирусов или отсутствие таковых представлены на фиг.8.
Специфичность и чувствительность полученного рекомбинантного белка rE3-YFV подтверждена иммунологическими методами, в результате чего было показано, что рекомбинантный аналог белка Е позволяет выявлять специфические антитела к ВЖЛ в сыворотках вакцинированных людей, т.е. обладает антигенными свойствами. Показано, что полученный рекомбинантный антиген не имеет перекрестных реакций с другими флавивирусами (ВКЭ, ВГС и ВЛД).
Источники научно-технической и патентной информации
1. WHO [Электронный ресурс]. URL: https://www.who.int/emergencies/disease-outbreak-news/item/yellow-fever-west-and-central-africa (Дата обращения 29.09.2022)
2. WHO [Электронный ресурс]. URL: https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON361_(Дата обращения 29.09.2022)
3. WHO [Электронный ресурс]. URL: https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON367 (Дата обращения 29.09.2022)
4. Кривошеина Е.И., Карташов М.Ю., Найденова Е.В. Современные лабораторные методы выявления возбудителя желтой лихорадки. Проблемы особо опасных инфекций. 2021;(2):24-32. dohl0.21055/0370-1069-2021-2-24-32
5. Ganushkina L.A., Dremova V.P. [Mosquitoes Aedes aegypti L. and Aedes albopictus skuse - a new biological threat to the southern Russia]. Meditsinskaya Parazitologiya i Parazitarnye Bolezni [Medical Parasitology and Parasitic Diseases]. 2012;3:49-55.
6. Kovalenko I.S., Yakunin S.N., Abibulaev D.E., Vladychak V.V., Boroday N.V., Smelyansky V.P., Fomina V.K., Zinich L.S., Tikhonov S.N. Reporting of Aedes (Stegomyia) albopictus (Skuse, 1895) in the Territory of Crimea. Problems of Particularly Dangerous Infections. 2020;(2): 135-137. (In Russ.) DOI:10.21055/0370-1069-2020-2-135-137
7. Monath T.P. Yellow fever: an update. Lancet Infect. Dis. 2001; 1(1):11-20. DOI: 10.1016/S1473-3099(01)00016-0.
8. Modhiran N., Song H., Liu L., Bletchly C. et al. A broadly protective antibody that targets the flavivirus NS1 protein. Science. 2021 Jan 8;371(6525): 190-194. doi: 10.1126/science.abb9425.
9. Heinz F.X., Stiasny K., Puschner-Auer G. et al. Structural changes and functional control of the tick-borne encephalitis virus glycoprotein E by the heterodimeric association with protein prM // Virology. 1994. Vol.
10. Chavez J.H. et al. Domain III peptides from flavivirus envelope protein are useful antigens for serologic diagnosis and targets for immunization // Biologicals. 2010. Vol.38. P. 613-618. DOI: 10.1016/i.biologicals.2010.07.004
11. Monath T.P. Yellow fever: an update. Lancet Infect. Dis. 2001; 1(1):11-20. DOI: 10.1016/S 1473-3099(01)00016-0.
12. David E. Volk et al. Structure of yellow fever virus envelope protein domain III // Virology. 2009. - Vol.394. P. 12-18. DOI: 10.1016/j.virol.2009.09.001
13. Радаева И.Ф., Нечаева Е.А., Дроздов И.Г. Коллекция культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. - Новосибирск: Изд-во «ЦЭРИС», 2009. -291 с.
14. Marshall O.J. PerlPrimer: cross-platform, graphical primer design for standard, bisulphite and real-time PCR // Bioinformatics. - 2004. 20(15). - P. 2471-2472. DOI: 10.1093/bioinformatics/bth254
15. Shuman S. Recombination mediated by vaccinia virus DNA topoisomerase I in Escherichia coli is sequence specific. Proc Natl Acad Sci USA. 1991 Nov 15;88(22):10104-8. doi: 10.1073/pnas.88.22.10104.
16. Okonechnikov K, Golosova O, Fursov M, the UGENE team. Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics 2012 28: 1166-1167. DOI: 10.1093/bioinformatics/bts091.
17. Kumar S, Stecher G, and Tamura K MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets (2016) Mol. Biol. Evol. 33(7): 1870-1874 DOI:10.1093/molbev/msw054.
18. Патент Китая №203191383, МПК G01N 33/558, опубл. 11.09.2013 г. (прототип).
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="pET160-E3-YFV.xml"
softwareName="WIPO Sequence" softwareVersion="2.2.0"
productionDate="2022-10-16">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2022-10-16</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>1</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2022-10-16</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Федеральное бюджетное учреждение
науки «Государственный научный центр вирусологии и биотехнологии
«Вектор» Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор»
Роспотребнадзора)</ApplicantName>
<ApplicantNameLatin>State Research Center of Virology and
Biotechnology "Vector"</ApplicantNameLatin>
<InventionTitle languageCode="ru">Рекомбинантная плазмидная ДНК
pET160-E3-YFV, экспрессирующая аналог третьего домена поверхностного
белка E вируса желтой лихорадки (ВЖЛ) в бактериальной системе E.
Coli, используемого для выявления специфических антител
ВЖЛ</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>6319</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..6319</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>agatctcgatcccgcgaaattaatacgactcactataggggaattgtga
gcggataacaattcccctctagaaataattttgtttaactttaagaaggagatatacatatgcatcatca
ccatcaccatggtgctggtggctgttgtcctggctgttgcggtggcggcgaaaacctgtattttcaggga
attatcacaagtttgtacaaaaaagcaggctccgcggccgcccccttcaccgccgccactatcagagtac
tggccctgggaaaccaggaaggctccttgaaaacagctcttactggcgcaatgagggttacaaaggacac
aaatgacaacaacctttacaaactacatggtggacatgtttcttgcagagtgaaattgtcagctttgaca
ctcaaggggacatcctacaaaatatgcactgacaaaatgttttttgtcaagaacccaactgacactggcc
atggcactgttgtaatgcaggtgaaagtgtcaaaaggagccccctgcaggattccagtgatagtagctga
tgatcttacagcggcaatcaataaaggcattttggttacagttaaccccatcgcctcaaccaatgatgat
gaagtgctgattgaggtgaacccaccttttggagacagctacattatcgttgggagaggagattcacgtc
tcacttaccagtggcacaaagagggaagctcaataggaaagaagggtgggcgcgccgacccagctttctt
gtacaaagtggtgataattaattaagatcagatccggctgctaacaaagcccgaaaggaagctgagttgg
ctgctgccaccgctgagcaataactagcataaccccttggggcctctaaacgggtcttgaggggtttttt
gctgaaaggaggaactatatccggatatcccgcaagaggcccggcagtaccggcataaccaagcctatgc
ctacagcatccagggtgacggtgccgaggatgacgatgagcgcattgttagatttcatacacggtgcctg
actgcgttagcaatttaactgtgataaactaccgcattaaagctagcttatcgatgataagctgtcaaac
atgagaattaattcttgaagacgaaagggcctcgtgatacgcctatttttataggttaatgtcatgataa
taatggtttcttagacgtcaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttattttt
ctaaatacattcaaatatgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaa
aggaagagtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttcctg
tttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgggtgcacgagtgggtta
catcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatg
agcacttttaaagttctgctatgtggcgcggtattatcccgtgttgacgccgggcaagagcaactcggtc
gccgcatacactattctcagaatgacttggttgagtactcaccagtcacagaaaagcatcttacggatgg
catgacagtaagagaattatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctg
acaacgatcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttg
atcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgcagcaat
ggcaacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaatagac
tggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggctggtttattgctg
ataaatctggagccggtgagcgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctc
ccgtatcgtagttatctacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgag
ataggtgcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagattgatt
taaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatccc
ttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcct
ttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccgg
atcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgtcct
tctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgcta
atcctgttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagt
taccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgac
ctacaccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcg
gacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcct
ggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcagg
ggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggcctttt
gctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctg
ataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcctgat
gcggtattttctccttacgcatctgtgcggtatttcacaccgcatatatggtgcactctcagtacaatct
gctctgatgccgcatagttaagccagtatacactccgctatcgctacgtgactgggtcatggctgcgccc
cgacacccgccaacacccgctgacgcgccctgacgggcttgtctgctcccggcatccgcttacagacaag
ctgtgaccgtctccgggagctgcatgtgtcagaggttttcaccgtcatcaccgaaacgcgcgaggcagct
gcggtaaagctcatcagcgtggtcgtgaagcgattcacagatgtctgcctgttcatccgcgtccagctcg
ttgagtttctccagaagcgttaatgtctggcttctgataaagcgggccatgttaagggcggttttttcct
gtttggtcactgatgcctccgtgtaagggggatttctgttcatgggggtaatgataccgatgaaacgaga
gaggatgctcacgatacgggttactgatgatgaacatgcccggttactggaacgttgtgagggtaaacaa
ctggcggtatggatgcggcgggaccagagaaaaatcactcagggtcaatgccagcgcttcgttaatacag
atgtaggtgttccacagggtagccagcagcatcctgcgatgcagatccggaacataatggtgcagggcgc
tgacttccgcgtttccagactttacgaaacacggaaaccgaagaccattcatgttgttgctcaggtcgca
gacgttttgcagcagcagtcgcttcacgttcgctcgcgtatcggtgattcattctgctaaccagtaaggc
aaccccgccagcctagccgggtcctcaacgacaggagcacgatcatgcgcacccgtggccaggacccaac
gctgcccgagatgcgccgcgtgcggctgctggagatggcggacgcgatggatatgttctgccaagggttg
gtttgcgcattcacagttctccgcaagaattgattggctccaattcttggagtggtgaatccgttagcga
ggtgccgccggcttccattcaggtcgaggtggcccggctccatgcaccgcgacgcaacgcggggaggcag
acaaggtatagggcggcgcctacaatccatgccaacccgttccatgtgctcgccgaggcggcataaatcg
ccgtgacgatcagcggtccagtgatcgaagttaggctggtaagagccgcgagcgatccttgaagctgtcc
ctgatggtcgtcatctacctgcctggacagcatggcctgcaacgcgggcatcccgatgccgccggaagcg
agaagaatcataatggggaaggccatccagcctcgcgtcgcgaacgccagcaagacgtagcccagcgcgt
cggccgccatgccggcgataatggcctgcttctcgccgaaacgtttggtggcgggaccagtgacgaaggc
ttgagcgagggcgtgcaagattccgaataccgcaagcgacaggccgatcatcgtcgcgctccagcgaaag
cggtcctcgccgaaaatgacccagagcgctgccggcacctgtcctacgagttgcatgataaagaagacag
tcataagtgcggcgacgatagtcatgccccgcgcccaccggaaggagctgactgggttgaaggctctcaa
gggcatcggtcgagatcccggtgcctaatgagtgagctaacttacattaattgcgttgcgctcactgccc
gctttccagtcgggaaacctgtcgtgccagctgcattaatgaatcggccaacgcgcggggagaggcggtt
tgcgtattgggcgccagggtggtttttcttttcaccagtgagacgggcaacagctgattgcccttcaccg
cctggccctgagagagttgcagcaagcggtccacgctggtttgccccagcaggcgaaaatcctgtttgat
ggtggttaacggcgggatataacatgagctgtcttcggtatcgtcgtatcccactaccgagatatccgca
ccaacgcgcagcccggactcggtaatggcgcgcattgcgcccagcgccatctgatcgttggcaaccagca
tcgcagtgggaacgatgccctcattcagcatttgcatggtttgttgaaaaccggacatggcactccagtc
gccttcccgttccgctatcggctgaatttgattgcgagtgagatatttatgccagccagccagacgcaga
cgcgccgagacagaacttaatgggcccgctaacagcgcgatttgctggtgacccaatgcgaccagatgct
ccacgcccagtcgcgtaccgtcttcatgggagaaaataatactgttgatgggtgtctggtcagagacatc
aagaaataacgccggaacattagtgcaggcagcttccacagcaatggcatcctggtcatccagcggatag
ttaatgatcagcccactgacgcgttgcgcgagaagattgtgcaccgccgctttacaggcttcgacgccgc
ttcgttctaccatcgacaccaccacgctggcacccagttgatcggcgcgagatttaatcgccgcgacaat
ttgcgacggcgcgtgcagggccagactggaggtggcaacgccaatcagcaacgactgtttgcccgccagt
tgttgtgccacgcggttgggaatgtaattcagctccgccatcgccgcttccactttttcccgcgttttcg
cagaaacgtggctggcctggttcaccacgcgggaaacggtctgataagagacaccggcatactctgcgac
atcgtataacgttactggtttcacattcaccaccctgaattgactctcttccgggcgctatcatgccata
ccgcgaaaggttttgcgccattcgatggtgtccgggatctcgacgctctcccttatgcgactcctgcatt
aggaagcagcccagtagtaggttgaggccgttgagcaccgccgccgcaaggaatggtgcatgcaaggaga
tggcgcccaacagtcccccggccacggggcctgccaccatacccacgccgaaacaagcgctcatgagccc
gaagtggcgagcccgatcttccccatcggtgatgtcggcgatataggcgccagcaaccgcacctgtggcg
ccggtgatgccggccacgatgcgtccggcgtagaggatcg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>221</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..221</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MHHHHHHGAGGCCPGCCGGGENLYFQGIITSLYKKAGSAAAPFTAATIR
VLALGNQEGSLKTALTGAMRVTKDTNDNNLYKLHGGHVSCRVKLSALTLKGTSYKICTDKMFFVKNPTDT
GHGTVVMQVKVSKGAPCRIPVIVADDLTAAINKGILVTVNPIASTNDDEVLIEVNPPFGDSYIIVGRGDS
RLTYQWHKEGSSIGKKGGRADPAFLYKVVIIN</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---



Изобретение относится к биотехнологии. Предложена рекомбинантная плазмидная ДНК pET160-E3-YFV, экспрессирующая аналог третьего домена поверхностного белка Е вируса желтой лихорадки (ВЖЛ) в бактериальной системе Е. coli, используемого для выявления специфических антител ВЖЛ, представленная на физической и генетической карте на фиг.1, имеющая нуклеотидную последовательность SEQ ID No.: 1, размер 6319 п. н., молекулярную массу 23,5 кДа. Указанная плазмидная ДНК содержит Т7 промотр, Iac-оператор, старт-кодон ATG, N-концевой 6xHis-тракт, целевую вставку E3-YFV, представляющую собой фрагмент гена третьего домена белка Е вируса желтой лихорадки, обеспечивающего экспрессию рекомбинантного аналога третьего домена белка Е вируса желтой лихорадки, который имеет аминокислотную последовательность SEQ ID No.: 2, Т7 область терминации транскрипции, ген устойчивости к ампициллину (bla), точку начала репликации плазмидной ДНК pBR322 ori в E. coli, lacI ORF. Изобретение обеспечивает повышение специфичности диагностических средств ВЖЛ за счет обеспечения возможности использования в диагностических средствах аналога третьего домена поверхностного белка Е ВЖЛ для выявления специфических антител ВЖЛ. 10 ил., 3 табл., 4 пр.
Рекомбинантная плазмидная ДНК pET160-E3-YFV, экспрессирующая аналог третьего домена поверхностного белка Е вируса желтой лихорадки (ВЖЛ) в бактериальной системе Е. coli, используемого для выявления специфических антител ВЖЛ, представленная на физической и генетической карте на фиг.1, имеющая нуклеотидную последовательность SEQ ID No.: 1, размер 6319 п. н., молекулярную массу 23,5 кДа и содержащая следующие основные элементы:
- Т7 промотр, имеющий координаты от 21 до 40 п. н. и обеспечивающий высокий уровень индуцируемой ИПТГ экспрессии рекомбинантного белка в штаммах Е. coli, экспрессирующих РНК-полимеразу Т7;
- Iac-оператор, имеющий координаты от 40 до 64 п. н. и являющийся сайтом связывания lac-репрессора, который снижает базальную экспрессию рекомбинантного белка;
- старт-кодон ATG, имеющий координаты от 109 до 111 п. н. и являющийся местом инициации транскрипции;
- N-концевой 6xHis-Tpaкт, имеющий координаты от 112 до 129 п. н. и обеспечивающий обнаружение рекомбинантного белка с помощью антител Anti-HisG и очистку его на металлохелатирующей смоле;
- целевую вставку E3-YFV, имеющую координаты от 241 до 721 п. н., представляющую собой фрагмент гена третьего домена белка Е вируса желтой лихорадки, обеспечивающего экспрессию рекомбинантного аналога третьего домена белка Е вируса желтой лихорадки, который имеет аминокислотную последовательность SEQ ID No.: 2;
- Т7 область терминации транскрипции, имеющую координаты от 786 до 914 п. н. и являющуюся последовательностью бактериофага Т7, которая обеспечивает эффективную терминацию транскрипции;
- ген устойчивости к ампициллину (bla), имеющий координаты от 1318 до 2178 п. н. и являющийся селективным маркером;
- точку начала репликации плазмидной ДНК pBR322 ori в E. coli, имеющую координаты от 2323 до 2996 п. н.;
- lacl ORF, имеющий координаты от 4870 до 5961 п. н. и обеспечивающий кодирование lac-репрессора, который связывается с промотором T7lac для блокирования базальной транскрипции интересующего гена и с промотором lacUV5 в хромосоме хозяина для подавления транскрипции РНК-полимеразы Т7.
| КРИВОШЕИНА Е.И | |||
| И ДР | |||
| Получение и диагностическая значимость рекомбинантного белка Е вируса желтой лихорадки | |||
| VI Международная конференция молодых ученых: биофизиков, биотехнологов, молекулярных биологов и вирусологов | |||
| Сборник тезисов | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| С | |||
| Облицовка комнатных печей | 1918 |
|
SU100A1 |
| КРИВОШЕИНА Е.И | |||
| И ДР | |||
| Современные лабораторные методы выявления возбудителя желтой лихорадки | |||
Авторы
Даты
2023-06-23—Публикация
2022-11-08—Подача