Область техники, к которой относится изобретение
Настоящее изобретение относится к способам ингибирования резорбции кости и/или активности остеокластов в течение продолжительных периодов времени с применением аминокислотных последовательностей, которые направлены против Лиганда Рецептора-Активатора Ядерного фактора Каппа B (RANK-L). Более конкретно, в настоящем изобретении предлагаются полипептиды, направленные против RANK-L, в конкретных дозовых интервалах для ингибирования RANK-L-опосредованной резорбции кости или активности остеокластов.
Предшествующий уровень техники
Ремоделирование (обновление) кости является процессом, с помощью которого скелет взрослого непрерывно резорбируется (удаляется) и формируется (замещается). Костное ремоделирование включает в себя синтез костного матрикса с помощью остеобластов и его резорбцию клетками остеокластов. Остеокласты, выделенные из гематопоэтических клеток, представляют собой уникальные формы тканевых макрофагов, которые обладают способностью резорбции костной ткани. Остеобласты представляют собой специализированные фибробласты, которые обладают способностью секретировать костный коллаген. Существует тонкая координация среди активностей этих костных клеток, которая связывает процессы образования кости и резорбции кости.
Ремоделирование кости контролируется с помощью баланса между RANK-L/RANK и OPG, который является ложным рецептором RANK-L. RANK-L и его рецептор RANK являются существенными для развития и активации остеокластов. Секретируемый белок OPG является эффективным ингибитором созревания и активации остеокластов. При нормальном костном гомеостазе RANK-L и OPG участвуют в цитокиновой оси, которая жестко контролирует образование остеокластов из моноцитарных предшественников. RANK-L, экспрессированный остаобластами и стромальными клетками костного мозга, связывается со своим функциональным рецептором RANK для стимуляции дифференцировки остеокластов из клеток-предшественников и пролиферации и активности зрелых остеокластов. OPG, который экспрессируется остеобластами, стромальными клетками, дендритными клетками и мегакариоцитами, ограничивает данный процесс, действуя как растворимый ложный рецептор для RANK-L.
Молекула семейства TNF, RANK-L, кодируется единственным геном (rankl), который находится на хромосоме 13q14 человека. мРНК RANK-L высоко экспрессируется в кости и в костном мозге, а также в лимфоидных тканях (лимфатические узлы, тимус, селезенка, фетальная печень и пейеровы бляшки) (Anderson et al. 1997, Nature 390: 175-179; Wong et al. 1997, J. Biol. Chem. 272: 25190-25194; Lacey et al. 1998, Cell 93: 165-176; Yasuda et al. 1998, Proc. Natl. Acad. Sci. USA 95: 3597-3602). Альтернативный сплайсинг мРНК RANK-L обеспечивает возможность экспрессии в виде трансмембранного гликопротеина типа II длиной 316 или 270 аминокислот или в виде растворимого лиганда длиной 243 аминокислоты (Kong et al. 1999, Nature 397: 315-323; Nagai et al. 2000, Biochem Biophys. Res. Commun. 269: 532-536). Кроме того, RANK-L может высвобождаться из мембрано-связанного состояния с помощью металлопротеиназ, в том числе TNF-альфа конвертазы (Lum et al. 1999, J. Biol. Chem. 274: 13613-13618). Все четыре изоформы RANK-L ассоциированы в тримерные молекулы, способные к передаче сигналов остеокластогенеза.
RANK (рецептор-активатор NFкаппаB; также известный как TRANCE-R, ODAR, или TNFRSF11A), экспрессированный на преостеокластах, представляет собой единственный рецептор для RANK-L на этих клетках (Li et al. 2000, Proc. Natl. Acad. Sci. USA 97: 1566-1571). За активацией RANK с помощью RANK-L следует его взаимодействием с членами семейства TNF-рецептор-ассоциированных белков (TRAF), активация ядерного фактора (NF)-каппа B и c-Fos, JNK, c-src, и серин/треониновой киназы Akt/PKB (Anderson et al. 1997, Nature 390: 175-179; Hsu et al. 1999, Proc. Acad. Sci. USA 96: 3540-3545).
OPG (остеопротегерин; «протектор кости»; также известный как фактор, ингибирующий остеокластогенез (OCIF)), представляет собой растворимый 110-кДа, дисульфидосвязанный гомодимерный гликопротеин, продуцируемый и высвобождаемый активированными остеобластами (Simonet et al. 1997, Cell 89: 309-319). Он гомологичен членам семейства TNF-рецепторов, функционирует в качестве ложного рецептора для RANK-L и конкурирует с RANK за связывание с RANK-L. Следовательно, OPG представляет собой эффективный ингибитор созревания и активации остеокластов (Simonet et al. 1997, Cell 89: 309-319; Lacey et al. 1998, Cell 93: 165-176; Kong et al. 1999, Nature 397: 315-323), с уменьшением, таким образом, резорбции.
Более подробный обзор системы OPG/RANK-L/RANK как медиатора формирования и деструкции кости представлен в Khosla (2001 Endocrinology 142: 5050-5055), Holstead Jones et al. (2002, Ann. Rheum. Dis. 61 (Suppl II): ii32-ii39), Bezerra et al. (2005, Brazilian J. Med. Biol. Res. 38: 161-170) и McClung (2006, Current Osteoporosis Reports 4: 28-33).
Некоторые костные нарушения происходят, когда имеется дисбаланс между компонентами резорбции и формирования активности костного ремоделирования (разобщенность костного гомеостаза). Дисбаланс между активностями остеокластов и остеобластов может возникать в результате широкого спектра гормональных изменений или пертурбаций факторов воспаления и роста, таких как, например, изменение баланса между OPG и RANK-L. Когда резорбция кости идет быстрее, чем формирование кости, то с течением времени происходит чистая потеря костной массы. Это, очевидно, в результате может привести к низкой плотности костной массы (остеопении) или остеопорозу. Когда формирование кости превышает резорбцию, то происходит чистое увеличение костной массы (остеопетроз).
Избыточная потеря костной массы или деструкция, вызванная более высоким уровнем RANK-L, более низким OPG или и тем и другим имеет место при многих болезненных состояниях, включая остеопороз в период постменопаузы (Eghbali-Fatourechi et al. 2003, Journal of Clinical Investigation 111: 1221-1230; Tsangari et al. 2004, Bone 35: 334-342; Abdallah et al. 2005, Calcified Tissue International 76: 90-97).
В течении более чем десяти лет доступны фармакологические агенты для уменьшения риска переломов. Антикатаболические лекарственные средства (эстрогены, бисфосфонаты, кальцитонин и селективные модуляторы эстрогенных рецепторов) уменьшают резорбцию кости, в то время как анаболические агенты, такие как рекомбинантный человеческий гормон паращитовидной железы (РТН), увеличивает формирование кости и размер кости. Бифосфонатный класс лекарственный средств является одним из наиболее часто используемых для лечения остеопороза. Хотя данный класс лекарственных средств, как правило, достаточно безопасен, пероральное введение этих препаратов является сложным и ассоциировано с побочными эффектами со стороны желудочно-кишечного тракта у небольшого количества пациентов в клинической практике. В клинических испытаниях сейчас исследуется внутривенное введение бисфосфонатов с увеличенными интервалами.
Недавнее обнаружение системы OPG/RANK-L/RANK как главных регулирующих факторов в патогенезе костных заболеваний и нарушений типа остеопороза обеспечивает уникальные мишени для терапевтических агентов. У лабораторных животных и у людей введение форм OPG значительно ингибировало активность остеокластов и улучшало прочность кости (Bekker et al. 2001, J. Bone Miner. Res. 16: 348-360; Campagnuolo et al. 2002, Arthritis Rheum. 46: 1926-1936; Bezerra et al. 2005, Brazilian J. Med. Biol. Res. 38: 161-170; McClung 2006, Current Osteoporosis Reports 4: 28-33). В ранних исследованиях на человеке полноразмерное человеческое антитело против RANK-L («Denosumab») уменьшало обновление кости и улучшало плотность кости (Body et al. 2003, Cancer 97: 887-892; Bekker et al. 2004, J. Bone Miner. Res. 19: 1059-1066; McClung 2006, Current Osteoporosis Reports 4: 28-33; Lewiecki 2006, Expert Opin. Biol. Ther. 6: 1041-1050; McClung et al. 2006, N. Engl. J. Med. 354: 821-831). Однако такие полные антитела сталкиваются с недостатками полноразмерных антител, такими как высокая стоимость получения, низкая стабильность и их большой размер, который, например, затрудняет их доступ к определенным скрытым эпитопам.
Сущность изобретения
Заявитель обнаружил, что введение человеческим субъектам полипептидов, описанных в данном документе, которые специфично связываются с RANKL (также обозначен в данном документе как «полипептид(ы) по изобретению»), обеспечивает неожиданно устойчивый продолжительный эффект в отношении резорбции кости и/или активности остеокластов у человеческих субъектов, что наблюдалось посредством изменений в соответствующих биомаркерах (таких как CTX-1, NTX-1 TRACP5b, PINP, и/или BAP). Например, изменение в одном или в нескольких маркерах костного метаболизма и/или костного гомеостаза может быть измерено в течение, по меньшей мере, 30 дней после введения. Изменение в одном или в нескольких маркерах костного метаболизма и/или костного гомеостаза может проявляться в течение более продолжительных периодов времени, как, например, по меньшей мере, в течение 60 дней, по меньшей мере, в течение 90 дней, по меньшей мере, в течение 120 дней, по меньшей мере, в течение 150 дней, по меньшей мере, в течение 180 дней, по меньшей мере, в течение 210 дней, по меньшей мере, в течение 240 дней, по меньшей мере, в течение 270 дней, по меньшей мере, в течение 300 дней, по меньшей мере, в течение 330 дней, или, по меньшей мере, в течение 360 дней. Данный эффект достигается быстро, что видно по уменьшению количества наблюдаемых биомаркеров, в некоторых воплощениях, через 8 часов после введения полипептида, который специфично связывается с RANKL.
Неожиданно устойчивый продолжительный эффект в отношении RANK-L-опосредованной резорбции кости и активности остеокластов главным образом был вызван гораздо более высокой эффективностью (IC50) полипептида по изобретению in vivo, чем было спрогнозировано на основании известного уровня техники и доклинической информации. Благодаря этой повышенной эффективности полипептида по изобретению наблюдали неожиданный устойчивый и продолжительный эффект в отношении RANK-L-опосредованной резорбции кости и активности остеокластов у человеческих субъектов по сравнению с тем, который оценивали на основе доклинического моделирования. Как следствие требуется вводить меньше терапевтических молекул (т.е. более низкая доза) или необходимо применять менее частое дозирование терапевтической молекулы для того чтобы получить такой же эффект в отношении RANK-L-опосредованной резорбции кости и активности остеокластов (наблюдаемого посредством изменений в соответствующих биомаркерах, таких как CTX-1, NTX-1, TRACP5b, PINP, и/или BAP).
Таким образом, изобретение относится к применению полипептидов, описанных в данном документе, для ингибирования резорбции кости и/или активности остеокластов у субъекта в течение неожиданно продолжительных периодов времени, конкретно принимая во внимание вводимые дозы. Изобретение также предусматривает менее частое введение и/или введение субъекту более низкой дозы полипептидов, описанных в данном документе, с поддержанием при этом эффективного ингибирования резорбции кости и/или активности остеокластов у субъекта в течение неожиданно продолжительных периодов времени, особенно принимая во внимание вводимые дозы. Конкретно, в изобретении предлагаются фармакологически активные агенты, композиции, способы и/или режимы дозирования, которые имеют некоторые преимущества по сравнению с агентами, композициями, способами и/или режимами дозирования, которые используются в настоящее время и/или известны в данной области, включая способность менее частого введения или введения более низких доз с получением эквивалентных эффектов в отношении ингибирования RANK-L-опосредованнной резорбции кости и/или активности остеокластов.
Согласно одному аспекту изобретения предлагаются способы ингибирования резорбции кости или активности остеокластов у субъекта. Способы включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANK-L) (также обозначаемого как «полипептид по изобретению»). Количество вводимого полипептида является эффективным для изменения одного или нескольких маркеров костного метаболизма и/или костного гомеостаза в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 10 мг/кг. В некоторых воплощениях маркеры костного метаболизма выбраны из перекрестно-связывающего телопептида коллагена I типа (CTX-1), N-концевого телопептида коллагена I типа (NTX-1), тартрат-устойчивой изоформы 5b кислой фосфатазы (TRACP5b), N-концевого пропептида проколлагена I типа (P1NP) и специфичной для кости щелочной фосфатазы (BAP). В некоторых воплощениях, один или несколько из CTX-1, NTX-1, TRACP5b, P1NP и BAP измеряют с использованием тИФА, специфичного для CTX-1, NTX-1, или TRACP5b; радиоиммуноанализа, специфичного для P1NP, или иммуноферментного анализа, специфичного для BAP, соответственно.
Согласно другому аспекту изобретения предлагаются способы ингибирования резорбции кости или активности остеокластов у субъекта. Способы включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANK-L) (полипептида по изобретению). Количество вводимого полипептида является эффективным для снижения сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,003 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,003 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 150 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 150 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 150 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 180 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 180 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 10 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 180 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 180 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 210 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 210 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 10 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 210 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 210 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 270 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 270 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 10 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 270 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 270 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В некоторых воплощениях, СТХ-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение от около 30 дней до около 3 месяцев после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, от около 30 дней до около 3 месяцев после введения. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, от около 1 мг/кг до около 1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 150 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 150 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 150 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 180 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 180 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 180 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение от около 3 дней до около 6 месяцев после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, от около 3 дней до около 6 месяцев после введения. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 3 месяцев после введения, и полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 3 месяцев после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение от около 6 месяцев до около 1 года после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 45% в течение, по меньшей мере, от около 6 месяцев до около 1 года после введения. В некоторых воплощениях полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В некоторых воплощениях полипептид вводят в количестве от около 1 мг/кг до около 3 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 6 месяцев после введения, и полипептид вводят в количестве от около 1 мг/кг до около 3 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 3 месяцев после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 50% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения, как, например, в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение, по меньшей мере, 120 дней после введения, в течение, по меньшей мере, 150 дней после введения, в течение, по меньшей мере, 180 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе. Соответственно изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 50%, по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1 на уровне, по меньшей мере, 50% в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение, по меньшей мере, 120 дней после введения, в течение, по меньшей мере, 150 дней после введения, в течение, по меньшей мере, 180 дней после введения, в течение периода времени, который является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе.
В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 60% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения, как, например, в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение, по меньшей мере, 120 дней после введения, в течение, по меньшей мере, 150 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе. Соответственно изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1 на уровне, по меньшей мере, 60% в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение, по меньшей мере, 120 дней после введения, в течение, по меньшей мере, 150 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе.
В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения, как, например, в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение, по меньшей мере, 120 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе. Соответственно изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1 на уровне, по меньшей мере, 70% в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение, по меньшей мере, 120 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, СТХ-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения, как, например, в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе. Соответственно изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1 на уровне, по меньшей мере, 80% в течение, по меньшей мере, 60 дней после введения, в течение, по меньшей мере, 90 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, CTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг. В других воплощениях, СТХ-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения, и где количество вводимого полипептида составляет менее чем или равно около 0,003 мг/кг каждый месяц. Таким образом, в изобретении также предлагается полипептид по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где полипептид вводят в количестве, составляющем менее чем или равном 0,003 мг/кг каждый месяц, и где сывороточный уровень CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается на уровне, по меньшей мере, 30% в течение около 60 дней после введения.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, около 150 дней после введения, и где количество вводимого полипептида составляет менее чем или равно около 0,01 мг/кг каждый месяц. Таким образом, в изобретении также предлагается полипептид по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где полипептид вводят в количестве, составляющем менее чем или равном 0,01 мг/кг каждый месяц, и где сывороточный уровень CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается на уровне, по меньшей мере, 30% в течение около 150 дней после введения.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, около 90 дней после введения, и где количество вводимого полипептида составляет менее чем или равно около 0,03 мг/кг каждый месяц. Таким образом, в изобретении также предлагается полипептид по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где полипептид вводят в количестве, составляющем менее чем или равном 0,03 мг/кг каждый месяц, и где сывороточный уровень CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается на уровне, по меньшей мере, 30% в течение около 90 дней после введения.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, около 210 дней после введения, и где количество вводимого полипептида составляет менее чем или равно около 0,1 мг/кг каждый месяц. Таким образом, в изобретении также предлагается полипептид по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где полипептид вводят в количестве, составляющем менее чем или равном около 0,1 мг/кг каждый месяц, и где сывороточный уровень CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается на уровне, по меньшей мере, 30% в течение около 210 дней после введения.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, около 210 дней после введения, и где количество вводимого полипептида составляет менее чем или равно около 0,3 мг/кг каждый месяц. Таким образом, в изобретении также предлагается полипептид по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где полипептид вводят в количестве, составляющем менее чем или равное около 0,3 мг/кг каждый месяц, и где сывороточный уровень CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается на уровне 30% в течение около 210 дней после введения.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, около 270 дней после введения, и где количество вводимого полипептида составляет менее чем или равно около 1 мг/кг каждый месяц. Таким образом, в изобретении также предлагается полипептид по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где полипептид вводят в количестве, составляющем менее чем или равном около 1 мг/кг каждый месяц, и где сывороточный уровень CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается на уровне, по меньшей мере, 30% в течение около 270 дней после введения.
В некоторых воплощениях количество введенного полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30% в течение 8 часов после введения.
В некоторых воплощениях количество введенного полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 45% в течение 8 часов после введения.
В некоторых воплощениях количество введенного полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 70% в течение 8 часов после введения.
В некоторых воплощениях полипептид вводят в виде однократной дозы.
В некоторых воплощениях, полипептид вводят подкожно.
В некоторых воплощениях у субъекта ингибируется резорбция кости, что определяется с помощью тИФА для CTX-1.
В некоторых воплощениях субъект имеет остеопороз, например, субъект, который является человеком, как например женщиной и, в некоторых конкретных воплощениях женщиной в постменопаузный период.
Согласно другому аспекту изобретения предлагаются способы ингибирования резорбции кости или активности остеокластов у субъекта. Способы включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANK-L) (полипептид по изобретению). Количество вводимого полипептида является эффективным при снижении уровня N-концевого телопептида коллагена I типа (NTX-1), по меньшей мере, на 30%, что определяется в виде соотношения NTX-1 к креатинину в моче по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня N-концевого телопептида коллагена I типа (NTX-1) в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания N-концевого телопептида коллагена I типа (NTX-1) в моче на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 180 дней (или 6 месяцев) после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 180 дней (или 6 месяцев) после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 180 дней (или 6 месяцев) после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 10 месяцев после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 10 месяцев после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 10 месяцев после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 12 месяцев (или около 360 дней) после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 12 месяцев (или 360 дней) после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 12 месяцев (или около 360 дней) после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
Количество вводимого полипептида является эффективным при снижении уровня N-концевого телопептида коллагена I типа (NTX-1), по меньшей мере, на 45%, что определяется в виде соотношения NTX-1 к креатинину в моче по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0.1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение от около 30 дней до 3 месяцев после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, от около 30 дней до 3 месяцев после введения. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 150 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 150 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 150 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение от около 3 месяцев до около 6 месяцев после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, от около 3 дней до 6 месяцев после введения. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 3 месяцев после введения, и полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 3 месяцев после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 180 дней (или 6 месяцев) после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 180 дней (или 6 месяцев) после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 180 дней (или 6 месяцев) после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 210 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 210 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 210 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение от около 6 месяцев до около 1 года после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 45% в течение, по меньшей мере, от около 6 месяцев до 1 года после введения. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 3 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 6 месяцев после введения, и полипептид вводят в количестве от около 1 мг/кг до около 3 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 6 месяцев после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях количество вводимого полипептида является эффективным при снижении уровня N-концевого телопептида коллагена I типа (NTX-1), по меньшей мере, на 70%, что определяется в виде соотношения NTX-1 к креатинину в моче по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях, CTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения, как, например, в течение, по меньшей мере, 120 дней после введения, в течение, по меньшей мере, 150 дней после введения, в течение, по меньшей мере, 180 дней после введения, в течение периода времени, который является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе. Соответственно изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 20%, по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня CTX-1 на уровне, по меньшей мере, 20% в течение, по меньшей мере, 90 дней после введения, в течение, по меньшей мере, 120 дней после введения, в течение, по меньшей мере, 150 дней после введения, в течение, по меньшей мере, 180 дней после введения, в течение времени, которое является промежуточным по отношению к этим или длиннее, как описано в другом месте в данном документе и как показано в примерах и фигурах, представленных в данном документе.
В некоторых воплощениях количество вводимого полипептида является эффективным при снижении уровня N-концевого телопептида коллагена I типа (NTX-1), по меньшей мере, на 20%, что определяется в виде соотношения NTX-1 к креатинину в моче по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня N-концевого телопептида коллагена I типа (NTX-1) в моче, по меньшей мере, на 200% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания N-концевого телопептида коллагена I типа (NTX-1) в моче на уровне, по меньшей мере, 20% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 20% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 20% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 20% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 180 дней (или 6 месяцев) после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 20% в течение, по меньшей мере, около 180 дней (или 6 месяцев) после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение около 180 дней (или 6 месяцев) после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 10 месяцев после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 20% в течение, по меньшей мере, около 10 месяцев после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение около 10 месяцев после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 12 месяцев (или около 360 дней) после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 20% в течение, по меньшей мере, около 12 месяцев (или 360 дней) после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В других воплощениях, NTX-1 уменьшается, по меньшей мере, на 20% по сравнению с уровнем до лечения или нормальным уровнем в течение около 12 месяцев (или около 360 дней) после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях количество вводимого полипептида является эффективным при снижении уровня N-концевого телопептида коллагена I типа (NTX-1), по меньшей мере, на 80%, что определяется в виде соотношения NTX-1 к креатинину в моче по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 80% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 80% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 80% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 1 мг/кг.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение от около 30 дней до 3 месяцев после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания NTX-1 в моче на уровне, по меньшей мере, 80% в течение, по меньшей мере, от около 30 дней до 3 месяцев после введения. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг. В некоторых воплощениях, NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее от около 0,3 мг/кг до около 1 мг/кг.
В некоторых воплощениях соотношение NTX-1 к креатинину в моче субъекта определяют с помощью тИФА для NTX-1.
В некоторых воплощениях количество введенного полипептида является эффективным при снижении уровня NTX-1 в моче, по меньшей мере, на 30% в течение 8 часов после введения.
В некоторых воплощениях количество введенного полипептида является эффективным при снижении уровня NTX-1 в моче, по меньшей мере, на 45% в течение 8 часов после введения.
В некоторых воплощениях количество введенного полипептида является эффективным при снижении уровня NTX-1 в моче, по меньшей мере, на 70% в течение 8 часов после введения.
В некоторых воплощениях полипептид вводят в виде однократной дозы.
В некоторых воплощениях, полипептид вводят подкожно.
В некоторых воплощениях субъект имеет остеопороз, например, субъектом является человек, как например женщина и, в некоторых конкретных воплощениях женщина в постменопаузный период.
Согласно другому аспекту изобретения предлагаются способы ингибирования резорбции кости или активности остеокластов у субъекта. Способы включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANK-L) (полипептида по изобретению). Количество вводимого полипептида является эффективным при снижении уровня в сыворотке тартрат-устойчивой кислой фосфатазы изоформы 5b (TRACP5b), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня TRACP5b, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня TRACP5b, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня TRACP5b, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня TRACP5b, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг. В других воплощениях, TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным для уменьшения сывороточного уровня тартрат-устойчивой кислой фосфатазы изоформы 5b (TRACP5b), по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня TRACP5b, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, TRACP5b уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня TRACP5b, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг. В других воплощениях, TRACP5b уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня TRACP5b, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,3 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг. В других воплощениях, TRACP5b уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,3 мг/кг.
В некоторых воплощениях полипептид вводят в виде однократной дозы.
В некоторых воплощениях, полипептид вводят подкожно.
В некоторых воплощениях у субъекта ингибируется резорбция кости, что определяется с помощью тИФА для TRACP5b.
В некоторых воплощениях субъект имеет остеопороз, например, субъектом является человек, как например женщина и, в некоторых конкретных воплощениях женщина в постменопаузный период.
Согласно другому аспекту изобретения предлагаются способы ингибирования резорбции кости или активности остеокластов у субъекта. Способы включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANK-L) (полипептид по изобретению). Количество вводимого полипептида является эффективным для уменьшения уровня в сыворотке N-концевого пропептида проколлагена I типа (P1NP), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,003 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,003 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,003 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 60 дней после введения, и полипептид вводят в количестве менее чем или равном 0,003 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 30% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,01 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным для уменьшения сывороточного уровня N-концевого пропептида проколлагена I типа (P1NP), по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,03 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,03 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 45% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
Согласно другому аспекту изобретения количество вводимого полипептида является эффективным для уменьшения сывороточного уровня N-концевого пропептида проколлагена I типа (P1NP), по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Таким образом, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 30 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,1 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 60 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 60 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 30 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 90 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 90 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 90 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 120 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем, и для поддержания сывороточного уровня P1NP, на уровне, по меньшей мере, 70% в течение, по меньшей мере, около 120 дней после введения. В некоторых воплощениях, полипептид вводят в количестве, по меньшей мере, 0,01 мг/кг. В некоторых воплощениях, полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг. В других воплощениях, P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем в течение около 120 дней после введения, и полипептид вводят в количестве менее чем или равном 0,1 мг/кг.
В некоторых воплощениях полипептид вводят в виде однократной дозы.
В некоторых воплощениях, полипептид вводят подкожно.
В некоторых воплощениях у субъекта ингибируется резорбция кости, что определяется с помощью радиоиммуноанализа для P1NP.
В некоторых воплощениях субъект имеет остеопороз, например, субъектом является человек, как например женщина и, в некоторых конкретных воплощениях женщина в постменопаузный период.
Способ по настоящему изобретению может использоваться для предотвращения и/или лечения заболеваний у субъектов, которые страдают костными заболеваниями и/или нарушениями, такими как, например, остеопороз, включающий, в частности, первичный остеопороз, эндокринный остеопороз (включающий, в частности, гипертиреоз, гиперпаратиреоз, синдром Иценко-Кушинга, и акромегалию), наследственные и врожденные формы остеопороза (включающие, в частности, несовершенный остеогенез, гомоцистинурию, синдром Менкеса, синдром Райли-Дея), остеопороз, вызванный иммобилизацией конечностей, остеопороз, индуцированный глюкокортикоидами и пост-менопаузный остеопороз.
В некоторых воплощениях полипептид по изобретению включает один или несколько одиночных вариабельных доменов иммуноглобулина, которые специфично связываются с RANKL. В некоторых воплощениях полипептид по изобретению имеет кажущуюся KD для связывания с рекомбинантным растворимым RANKL (sRANKL) 0,01-0,05 нМ, предпочтительно около 0,04 нМ, как определено с помощью «Biacore». В некоторых воплощениях одиночные вариабельные домены иммуноглобулинов включают или состоят из одного или нескольких VHH-доменов, одного или нескольких гуманизированных VHH-доменов и/или одного или нескольких верблюдизированных (camelized) VH-доменов. В некоторых воплощениях полипептид включает одно или несколько доменных антител, которые специфично связываются с RANKL, одну или несколько аминокислотных последовательностей, которые специфично связываются с RANKL, и которые подходят для применения в качестве доменного антитела, одно или несколько однодоменных антител, которые специфично связываются с RANKL, одну или несколько аминокислотных последовательностей, которые специфично связываются с RANKL, и которые подходят для применения в качестве однодоменного антитела, или одно или несколько «dAb», которые специфично связываются с RANKL.
В некоторых воплощениях полипептид представляет собой мультивалентную конструкцию, включающую два или большее количество одиночных вариабельных доменов иммуноглобулина, которые специфично связываются с RANKL. В некоторых воплощениях мультивалентная конструкция включает два или большее количество одиночных вариабельных доменов иммуноглобулина, которые специфично связываются с RANKL.
Предпочтительные полипептиды по изобретению представляют собой мультивалентные конструкции, которые включают или состоят из одного или нескольких одиночных вариабельных доменов иммуноглобулина, каждый из которых состоит из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в которых: CDR1 состоит из SYPMG (SEQ ID NO: 1), CDR2 состоит из SITGSGGSTYYADSVKG (SEQ ID NO: 2) и CDR3 состоит из YIRPDTYLSRDYRKY (SEQ ID NO: 3).
В некоторых воплощениях полипептид представляет собой мультивалентную конструкцию, которая включает SEQ ID NO: 755 из US 2010/0104568 (EVQLVESGGGLVQPGGSLRLSCAASGFTFSSYPMGWFRQAPGKGREFVSSITGSGGSTYYADSVKGRFTISRDNAKNTLYLQMNSLRPEDTAVYYCAAYIRPDTYLSRDYRKYDYWGQGTLVTVSS; SEQ ID NO: 10).
В некоторых воплощениях полипептид представляет собой мультивалентную конструкцию, включающую или состоящую из двух или более одиночных вариабельных доменов иммуноглобулина, как определено выше. В некоторых воплощениях мультивалентная конструкция включает или состоит из двух иммуноглобулиновых одиночных вариабельных доменов, как определено выше.
В некоторых воплощениях, мультивалентная конструкция дополнительно включает, по меньшей мере, один компонент, увеличивающий период полужизни. В некоторых воплощениях, по меньшей мере, один компонент, увеличивающий период полужизни, специфично связывается с сывороточным белком. В некоторых воплощениях сывороточный белок представляет собой сывороточный альбумин и, конкретно, человеческий сывороточный альбумин, тироксинсвязывающий белок, (человеческий) трансферрин, фибриноген, иммуноглобулин, такой как IgG, IgE или IgM, или один из сывороточных белков, перечисленных в WO 04/003019.
В некоторых воплощениях, по меньшей мере, один компонент, увеличивающий период полужизни, включает или состоит из одиночного вариабельного домена иммуноглобулина. В некоторых воплощениях одиночный вариабельный домен иммуноглобулина включает или состоит из VHH-домена, гуманизированного VHH-домена или верблюдизированного VH-домена. В некоторых воплощениях, по меньшей мере, один компонент, увеличивающий период полужизни, включает доменное антитело, аминокислотную последовательность, которая подходит для применения в качестве доменного антитела, однодоменное антитело, аминокислотную последовательность, которая подходит для применения в качестве о дно доменного антитела, или «dAb».
Предпочтительный одиночный вариабельный домен иммуноглобулина, который связывается с сывороточным альбумином, включает или состоит из SEQ ID NO: 791 из US 2010/0104568 (SEQ ID NO: 14).
В некоторых воплощениях полипептид представляет собой мультивалентную конструкцию, которая включает SEQ ID NO: 759 из US 2010/0104568


В некоторых воплощениях полипептид по изобретению перекрестно блокирует связывание SEQ ID NO: 755 из US 2010/0104568 (SEQ ID NO: 10) или SEQ ID NO: 759 из US 2010/0104568 (SEQ ID NO: 12) с RANKL. В некоторых воплощениях полипептид по изобретению перекрестно блокирует связывание RANKL с помощью SEQ ID NO: 755 из US 2010/0104568 (SEQ ID NO: 10) или SEQ ID NO: 759 из US 2010/0104568 (SEQ ID NO: 12).
В некоторых воплощениях, по меньшей мере, один компонент, увеличивающий период полужизни, включает одну или несколько молекул полиэтиленгликоля.
В предпочтительном аспекте полипептид по изобретению представляет собой SEQ ID NO: 12. Соответственно, изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,003 мг/кг до около 0,01 мг/кг каждый месяц, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,003 мг/кг до около 0,01 мг/кг каждый месяц, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждый месяц, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждый месяц, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждый месяц, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждый месяц, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые два месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые два месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые два месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые два месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые два месяца, где уровень СТХ-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые два месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые три месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые три месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые три месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые три месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые три месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые три месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые четыре месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждые четыре месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые четыре месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые четыре месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые четыре месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые четыре месяца, где уровень CTX-1 в сыворотке уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждый месяц, где уровень NTX-1, определенный как соотношение NTX-1 к креатину в моче, уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждый месяц, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждый месяц, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,01 мг/кг до около 0,03 мг/кг каждый месяц, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждый месяц, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждый месяц, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые два месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые два месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые два месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые два месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,3 мг/кг до около 1 мг/кг каждые два месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг каждые два месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые три месяца, где уровень NTX-1 в моче в сыворотке уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые три месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые три месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые три месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,3 мг/кг до около 1 мг/кг каждые три месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг каждые три месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые четыре месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,03 мг/кг до около 0,1 мг/кг каждые четыре месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 30%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые четыре месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 0,1 мг/кг до около 0,3 мг/кг каждые четыре месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 45%.
В другом предпочтительном аспекте изобретение относится к способу ингибирования резорбции кости и/или активности остеокластов у субъекта, причем указанный способ включает введение субъекту полипептида, содержащего SEQ ID NO: 12, в количестве от около 1 мг/кг до около 3 мг/кг каждые четыре месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%. Таким образом, изобретение также относится к полипептиду, содержащему SEQ ID NO: 12, для ингибирования резорбции кости и/или активности остеокластов, где полипептид вводят в количестве от около 1 мг/кг до около 3 мг/кг каждые четыре месяца, где уровень NTX-1 в моче уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или нормальным уровнем и поддерживается (на протяжении периода обработки) на уровне, по меньшей мере, 70%.
Подробное описание изобретения
Способы изобретения
Заявитель обнаружил, что введение человеческим субъектам полипептидов, описанных в данном документе, которые специфично связываются с RANKL, обеспечивает неожиданно устойчивый продолжительный эффект в отношении резорбции кости и/или активности остеокластов у человеческих субъектов, что наблюдалось посредством изменений в соответствующих биомаркерах (таких как CTX-1, NTX-1 TRACP5b и PINP). Таким образом, изобретение относится к применению полипептидов, описанных в данном документе, для ингибирования резорбции кости и/или активности остеокластов у субъекта в течение неожиданно продолжительных периодов времени, особенно принимая во внимание вводимые дозы. Изобретение также предусматривает менее частое введение и/или введение субъекту более низкой дозы полипептидов, описанных в данном документе, с сохранением при этом эффективного ингибирования резорбции кости и/или активности остеокластов у субъекта в течение неожиданно продолжительных периодов времени, особенно принимая во внимание вводимые дозы.
Для измерения костного метаболизма доступны различные маркеры. В предпочтительных воплощениях маркеры костного метаболизма выбраны из C-концевого телопептида коллагена I типа (также обозначаемого как перекрестно-связывающий телопептид коллагена I типа) (CTX-1), N-концевого телопептида коллагена I типа (NTX-1) и/или, предпочтительно, соотношения NTX-1/креатинин (например, в моче), тартрат-устойчивой кислой фосфатазы изоформы 5b (TRACP5b), N-концевого пропептида проколлагена I типа (P1NP) и специфичной для кости щелочной фосфатазы (BAP). Эти маркеры могут измеряться с использованием стандартных методов, известных и используемых специалистами в данной области, таких как различные анализы на основе иммунологии, включающие твердофазные иммуноферментные анализы (тИФА; также известный как ELISA), радиоиммунные анализы или иммуноферментометрические анализы. Также могут использоваться анализы на основе химических, колориметрических и ферментных методов, если это удобно.
Например, в некоторых воплощениях один или несколько из CTX-1, NTX-1 и TRACP5b могут быть измерены с использованием анализа тИФА, специфичного для CTX-1, NTX-1, или TRACP5b; P1NP может быть измерен с использованием радиоиммуноанализа, специфичного для P1NP; BAP может быть измерен с использованием иммуноферментометрического анализа, специфичного для ВАР; и/или креатинин может быть измерен с использованием колориметрического анализа (такого как улучшенный анализ Джэффи (Jaffe)).
Перекрестно-связывающий телопептид коллагена типа 1 (CTX-1) представляет собой продукт деградации кости, высвобождающийся в результате активности остеокластов. Доза, приводящая к клинически значимому уменьшению, т.е. ниже 70% от исходного значения (т.е. более чем 30%-уменьшение по сравнению с уровнем до лечения или нормальным уровнем), CTX-1 считается биологически активной. Это основано на наименьшем значимом изменении, полученном из данных, опубликованных Christgau et al. 2000, Bone 26: 505-511). Доза, приводящая к клинически значимому уменьшению CTX-1, считается биологически активной.
Сывороточный уровень CTX-1 может быть определен с помощью любого способа, описанного в данном документе и/или известного в данной области. Методы тИФА могут включать набор тИФА для C-телопептида коллагена типа 1 (CTX-1) («Biocomare»; Южный Сан-Франциско, Калифорния, США), набор тИФА для C-телопептида коллагена типа 1 (antibodies on line.com) и «CROSSLAPS®» тИФА (Кат. № AC-02F1; «Immunodiagnosticsystems Inc.», Болдон, Тайн-энд-Уир, Великобритания).
N-концевой телопептид коллагена типа 1 (NTX-1) представляет собой продукт деградации коллагена I типа, который является главным органическим компонентом внеклеточного матрикса. Таким образом, NTX-1 рассматривается в качестве биомаркера для резорбции кости в результате активности остеокластов. Так как концентрация NTX-1 в моче варьирует в зависимости от объема мочи, то для коррекции этой вариации определяли соотношение NTX-1 к креатинину в моче. Уровень NTX-1 в моче может быть определен с помощью любого способа, описанного в данном документе и/или как известного в данной области. Методы тИФА могут включать набор тИФА для перекрестно-связанного телопептида коллагена I типа (NTXI) («Biocomare»; Южный Сан-Франциско, Калифорния, США) и тИФА «OSTEOMARK» для NTx мочи (Кат no. 9006; «Inverness Medical», «Wampole Laboratories», Принстон, Нью-Джерси, США). Тест использует моноклональное антитело и метод тИФА со считыванием данных с помощью спектрометрии. Уровень креатинина может быть определен, например, с использованием аналитического набора реактивов «EnzyChrom™ Creatine Assay Kit» («BioAssay Systems», Хейворд, Калифорния, США), аналитического набора реагентов «Creatinine Assay Kit» («Cell Biolabs», Сан-Диего, Калифорния, США) или с помощью теста на креатинин (Кат. No. 03039070; «Siemens Medical Solutions Diagnostics», Бреда, Нидерланды). Уровень NTx в моче нормализовали по отношению к кретинину мочи. Результаты тИФА выражены в нМ эквивалентов костного коллагена (нМ BCE) на мМ креатинина.
Тартрат-устойчивая кислая фосфатаза (TRACP5b) является ферментом, выделенным из остеокластов, и представляет собой показатель количества остеокластов, и, таким образом, рассматривается в качестве биомаркера резорбции кости. Сывороточный уровень TRACP5b может быть определен с помощью любого способа, описанного в данном документе и/или известного в данной области. Методы тИФА могут включать набор тИФА «Human TartRate Resistant ACID Phosphatase 5b» («Life Sciences Advanced Technologies, Inc.», Санкт-Петербург, Флорида, США), «Tartrate-resistant acid phosphatase-5b» («Pacific Biomarkers, Inc.», Сиэтл, Вашингтон, США), и «BONETRAP® Assay ELISA» (Кат. № AC-20F1; «Immunodiagnostic Systems Inc.», Болдон, Тайн-энд-Уир, Великобритания).
N-концевой пропептид проколлагена типа 1 (P1NP) высвобождается при внеклеточном процессировании из вновь синтезированного препроколлагена перед его включением в коллаген в кости, и рассматривается в качестве биомаркера остеогенеза. Сывороточный уровень P1NP может быть определен с помощью любого способа, описанного в данном документе и/или известного в данной области. Аналитические методы могут включать конкурентный анализ РИА («UNIQ™ P1NP RIA»; Кат. № Q67034; «Orion Diagnostica Оу», Эспо, Финляндия), анализ IDS-iSYS Интактного N-концевого пропептида проколлагена I типа (Интактный PINP) («Immunodiagnostic Systems Inc.», Болдон, Тайн-энд-Уир, Великобритания), или набор тИФА для N-концевого пропептида проколлагена I (PINP) («Uscn Life Science Inc.», Ухань, Китай).
Специфичная для кости щелочная фосфатаза (BAP) представляет собой фермент, который служит в качестве биомаркера активного остеогенеза. Сывороточный уровень BAP может быть определен с помощью любого способа, описанного в данном документе и/или известного в данной области. Аналитические методы могут включать набор тИФА для костной щелочной фосфатазы («antibodies-online Inc». Атланта, Джорджия, США), или Иммуноферментометрический анализ «OSTASE® BAP» (Кат. № AC-20F1; «Immunodiagnostic Systems Inc.», Болдон, Тайн-энд-Уир, Великобритания).
Типичные способы для ингибирования резорбции кости или активности остеокластов у субъекта включают введение субъекту полипептида, как описано в данном документе, который специфично связывается с RANKL, где количество вводимого полипептида эффективно для изменения одного или нескольких маркеров костного метаболизма и/или костного гомеостаза, как, например, для уменьшения перекрестно-связывающего телопептида коллагена I типа (CTX-1), сывороточного уровня N-концевого пропептида проколлагена типа 1 (P1NP) и/или уровня NTX-1 в моче, по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, более предпочтительно, по меньшей мере, на 55%, более предпочтительно, по меньшей мере, на 60%, более предпочтительно, по меньшей мере, на 65%, более предпочтительно, по меньшей мере, на 70%, как, например, по меньшей мере, на 75%, или даже по меньшей мере, на 80%, по сравнению с уровнем до лечения или с нормальным уровнем, в течение, по меньшей мере, около 30 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1, и/или P1NP и/или уровня NTX-1 (как определено с помощью соотношения NTX-1 к креатинину в моче) по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, более предпочтительно, по меньшей мере, на 55%, более предпочтительно, по меньшей мере, на 60%, более предпочтительно, по меньшей мере, на 65%, более предпочтительно, по меньшей мере, на 70%, как, например, по меньшей мере, на 75%, или даже, по меньшей мере, на 80%, по сравнению с уровнем до лечения или с нормальным уровнем, в течение, по меньшей мере, около 30 дней после введения. Например, количество вводимого полипептида эффективно для изменения одного или нескольких маркеров костного метаболизма и/или костного гомеостаза, как, например, для уменьшения сывороточного уровня CTX-1 и/или P1NP, и/или уровня NTX-1 в моче по меньшей мере, на 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 59%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, или 80%.
В другом аспекте количество вводимого полипептида является эффективным при снижении сывороточного уровня тартрат-устойчивой кислой фосфатазы (TRACP5b), по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, как, например, по меньшей мере, на 55%, или, по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида является эффективным при снижении сывороточного уровня тартрат-устойчивой кислой фосфатазы (TRACP5b), по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, как, например, по меньшей мере, на 55%, или по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения, например, количество вводимого полипептида эффективно для изменения TRACP5b, по меньшей мере, на 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 59%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59% или 60%.
В некоторых воплощениях предлагаются способы ингибирования у субъекта резорбции кости или активности остеокластов, которые включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANKL), где количество вводимого полипептида эффективно для изменения одного или нескольких маркеров костного метаболизма и/или костного гомеостаза в течение, по меньшей мере, 30 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для изменения одного или нескольких маркеров костного метаболизма и/или костного гомеостаза в течение, по меньшей мере, 30 дней. Изменение одного или нескольких маркеров костного метаболизма и/или костного гомеостаза может сохраняться в течение более продолжительных периодов времени, таких как, по меньшей мере, 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 180 дней, по меньшей мере, 210 дней, по меньшей мере, 240 дней, по меньшей мере, 270 дней, по меньшей мере, 300 дней, по меньшей мере, 330 дней, или по меньшей мере, 360 дней; например, (включительно) 30-60 дней, 60-90 дней, 90-120 дней, 120-150 дней, 150-180 дней, 180-210 дней, 210-240 дней, 240-270 дней, 270-300 дней, 300-330 дней, 330-360 дней, 30-90 дней, 60-120 дней, 90-150 дней, 120-180 дней, 150-210 дней, 180-240 дней, 210-270 дней, 240-300 дней, 300-360 дней, 30-120 дней, 60-150 дней, 90-180 дней, 120-210 дней, 150-240 дней, 180-270 дней, 210-300 дней, 240-330 дней, 270-360 дней, 30-150 дней, 60-180 дней, 90-210 дней, 120-240 дней, 150-270 дней, 180-300 дней, 210-330 дней, 240-360 дней, 30-180 дней, 60-210 дней, 90-240 дней, 120-270 дней, 150-300 дней, 180-330 дней, 210-360 дней, 30-210 дней, 60-240 дней, 90-270 дней, 120-300 дней, 150-330 дней, 180-360 дней, 30-240 дней, 60-270 дней, 90-300 дней, 120-330 дней, 150-360 дней, 30-270 дней, 60-300 дней, 90-330 дней, 120-360 дней, 30-300 дней, 60-330 дней, 90-360 дней, 30-330 дней, 60-360 дней, and 30-360 дней; или в течение по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев; например, 30 дней-3 месяцев, 1-3 месяцев, 2-4 месяцев, 3-5 месяцев, 4-6 месяцев, 5-7 месяцев, 6-8 месяцев, 7-9 месяцев, 8-10 месяцев, 9-11 месяцев, 10-12 месяцев, 1-4 месяцев, 2-5 месяцев, 3-6 месяцев, 4-7 месяцев, 5-8 месяцев, 6-9 месяцев, 7-10 месяцев, 8-11 месяцев, 9-12 месяцев, 1-5 месяцев, 2-6 месяцев, 3-7 месяцев, 4-8 месяцев, 5-9 месяцев, 6-10 месяцев, 7-11 месяцев, 8-12 месяцев, 1-6 месяцев, 2-7 месяцев, 3-8 месяцев, 4-9 месяцев, 5-10 месяцев, 6-11 месяцев, 7-12 месяцев, 1-7 месяцев, 2-8 месяцев, 3-9 месяцев, 4-10 месяцев, 5-11 месяцев, 6-12 месяцев, 1-8 месяцев, 2-9 месяцев, 3-10 месяцев, 4-11 месяцев, 5-12 месяцев, 1-9 месяцев, 2-10 месяцев, 3-11 месяцев, 4-12 месяцев, 1-10 месяцев, 2-11 месяцев, 3-12 месяцев, 1-11 месяцев, 2-12 месяцев, или 1-12 месяцев.
В других воплощениях предлагаются способы ингибирования у субъекта резорбции кости или активности остеокластов, которые включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANKL), где количество вводимого полипептида эффективно для уменьшения сывороточного уровня перекрестно связывающего телопептида коллагена I типа (CTX-1) в течение, по меньшей мере, 30 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня CTX-1 в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень CTX-1 уменьшается по сравнению с уровнем до лечения или с нормальным уровнем на 30%-80% или более, как, например, по меньшей мере, на 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47, 48, 59, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, или 80%. Уменьшение сывороточного уровня CTX-1 может сохраняться в течение более продолжительных периодов времени, таких как, по меньшей мере, 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 180 дней, по меньшей мере, 210 дней, по меньшей мере, 240 дней, по меньшей мере, 270 дней, по меньшей мере, 300 дней, по меньшей мере, 330 дней, или по меньшей мере, 360 дней; например, (включительно) 30-60 дней, 60-90 дней, 90-120 дней, 120-150 дней, 150-180 дней, 180-210 дней, 210-240 дней, 240-270 дней, 270-300 дней, 300-330 дней, 330-360 дней, 30-90 дней, 60-120 дней, 90-150 дней, 120-180 дней, 150-210 дней, 180-240 дней, 210-270 дней, 240-300 дней, 300-360 дней, 30-120 дней, 60-150 дней, 90-180 дней, 120-210 дней, 150-240 дней, 180-270 дней, 210-300 дней, 240-330 дней, 270-360 дней, 30-150 дней, 60-180 дней, 90-210 дней, 120-240 дней, 150-270 дней, 180-300 дней, 210-330 дней, 240-360 дней, 30-180 дней, 60-210 дней, 90-240 дней, 120-270 дней, 150-300 дней, 180-330 дней, 210-360 дней, 30-210 дней, 60-240 дней, 90-270 дней, 120-300 дней, 150-330 дней, 180-360 дней, 30-240 дней, 60-270 дней, 90-300 дней, 120-330 дней, 150-360 дней, 30-270 дней, 60-300 дней, 90-330 дней, 120-360 дней, 30-300 дней, 60-330 дней, 90-360 дней, 30-330 дней, 60-360 дней, and 30-360 дней; или for по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 or 12 месяцев; например, 30 дней-3 месяцев, 1-3 месяцев, 2-4 месяцев, 3-5 месяцев, 4-6 месяцев, 5-7 месяцев, 6-8 месяцев, 7-9 месяцев, 8-10 месяцев, 9-11 месяцев, 10-12 месяцев, 1-4 месяцев, 2-5 месяцев, 3-6 месяцев, 4-7 месяцев, 5-8 месяцев, 6-9 месяцев, 7-10 месяцев, 8-11 месяцев, 9-12 месяцев, 1-5 месяцев, 2-6 месяцев, 3-7 месяцев, 4-8 месяцев, 5-9 месяцев, 6-10 месяцев, 7-11 месяцев, 8-12 месяцев, 1-6 месяцев, 2-7 месяцев, 3-8 месяцев, 4-9 месяцев, 5-10 месяцев, 6-11 месяцев, 7-12 месяцев, 1-7 месяцев, 2-8 месяцев, 3-9 месяцев, 4-10 месяцев, 5-11 месяцев, 6-12 месяцев, 1-8 месяцев, 2-9 месяцев, 3-10 месяцев, 4-11 месяцев, 5-12 месяцев, 1-9 месяцев, 2-10 месяцев, 3-11 месяцев, 4-12 месяцев, 1-10 месяцев, 2-11 месяцев, 3-12 месяцев, 1-11 месяцев, 2-12 месяцев, или 1-12 месяцев.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180, 210, 240, 270 или 280 дней после введения.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 40% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180, 210, 240 или 270 дней после введения.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180 или 190 дней после введения.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 50% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150 или 180 дней после введения.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 60% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120 или 150 дней после введения.
В некоторых воплощениях СТХ-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90 или 120 дней после введения.
В некоторых воплощениях CTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60 или 90 дней после введения.
В других воплощениях предлагаются способы ингибирования у субъекта резорбции кости или активности остеокластов, которые включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANKL), где количество вводимого полипептида эффективно для уменьшения уровня N-концевого телопептида коллагена I типа (NTX-1) в течение, по меньшей мере, 30 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения уровня NTX-1 в моче в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях уровень NTX-1 уменьшается по сравнению с уровнем до лечения или с нормальным уровнем на 30%-80% или более, как, например, по меньшей мере, на 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47, 48, 59, 51, 52, 53, 54, 55, 56, 57, 58, 59, 50, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, или 80%. Уменьшение уровня NTX-1 может сохраняться в течение более продолжительных периодов времени, таких как, по меньшей мере, 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 180 дней, по меньшей мере, 210 дней, по меньшей мере, 240 дней, по меньшей мере, 270 дней, по меньшей мере, 300 дней, по меньшей мере, 330 дней, или по меньшей мере, 360 дней; например, (включительно) 30-60 дней, 60-90 дней, 90-120 дней, 120-150 дней, 150-180 дней, 180-210 дней, 210-240 дней, 240-270 дней, 270-300 дней, 300-330 дней, 330-360 дней, 30-90 дней, 60-120 дней, 90-150 дней, 120-180 дней, 150-210 дней, 180-240 дней, 210-270 дней, 240-300 дней, 300-360 дней, 30-120 дней, 60-150 дней, 90-180 дней, 120-210 дней, 150-240 дней, 180-270 дней, 210-300 дней, 240-330 дней, 270-360 дней, 30-150 дней, 60-180 дней, 90-210 дней, 120-240 дней, 150-270 дней, 180-300 дней, 210-330 дней, 240-360 дней, 30-180 дней, 60-210 дней, 90-240 дней, 120-270 дней, 150-300 дней, 180-330 дней, 210-360 дней, 30-210 дней, 60-240 дней, 90-270 дней, 120-300 дней, 150-330 дней, 180-360 дней, 30-240 дней, 60-270 дней, 90-300 дней, 120-330 дней, 150-360 дней, 30-270 дней, 60-300 дней, 90-330 дней, 120-360 дней, 30-300 дней, 60-330 дней, 90-360 дней, 30-330 дней, 60-360 дней, and 30-360 дней; или for по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 or 12 месяцев; например, 30 дней-3 месяцев, 1-3 месяцев, 2-4 месяцев, 3-5 месяцев, 4-6 месяцев, 5-7 месяцев, 6-8 месяцев, 7-9 месяцев, 8-10 месяцев, 9-11 месяцев, 10-12 месяцев, 1-4 месяцев, 2-5 месяцев, 3-6 месяцев, 4-7 месяцев, 5-8 месяцев, 6-9 месяцев, 7-10 месяцев, 8-11 месяцев, 9-12 месяцев, 1-5 месяцев, 2-6 месяцев, 3-7 месяцев, 4-8 месяцев, 5-9 месяцев, 6-10 месяцев, 7-11 месяцев, 8-12 месяцев, 1-6 месяцев, 2-7 месяцев, 3-8 месяцев, 4-9 месяцев, 5-10 месяцев, 6-11 месяцев, 7-12 месяцев, 1-7 месяцев, 2-8 месяцев, 3-9 месяцев, 4-10 месяцев, 5-11 месяцев, 6-12 месяцев, 1-8 месяцев, 2-9 месяцев, 3-10 месяцев, 4-11 месяцев, 5-12 месяцев, 1-9 месяцев, 2-10 месяцев, 3-11 месяцев, 4-12 месяцев, 1-10 месяцев, 2-11 месяцев, 3-12 месяцев, 1-11 месяцев, 2-12 месяцев, или 1-12 месяцев.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180, 210, 240,270, 300, 330 или 360 дней после введения.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 40% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180,210,240, 270, 300, 330 или 360 дней после введения.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150,180,210,240 или 250 дней после введения.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 50% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180, 210 или 240 дней после введения.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 60% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180 или 210 дней после введения.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150 или 180 дней после введения.
В некоторых воплощениях NTX-1 уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60 или 90 дней после введения.
В других воплощениях предлагаются способы ингибирования у субъекта резорбции кости или активности остеокластов, которые включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANKL), где количество вводимого полипептида эффективно для уменьшения сывороточного уровня тартрат-устойчивой кислой фосфатазы (TRACP5b) в течение, по меньшей мере, 30 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня TRACP5b в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень TRACP5b уменьшается по сравнению с уровнем до лечения или с нормальным уровнем на 30%-80% или более, как, например, по меньшей мере, на 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47, 48, 59, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60%. Уменьшение сывороточного уровня TRACP5b может сохраняться в течение более продолжительных периодов времени, таких как, по меньшей мере, 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 180 дней, по меньшей мере, 210 дней; например (включительно) 30-60 дней, 60-90 дней, 90-120 дней, 120-150 дней, 150-180 дней, 180-210 дней, 30-90 дней, 60-120 дней, 90-150 дней, 120-180 дней, 30-120 дней, 60-150 дней, 90-180 дней, 120-210 дней, 30-150 дней, 60-180 дней, 90-210 дней, 30-180 дней, 60-210 дней, 30-210 дней; или for по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев; for example 30 дней-3 месяцев, 1-3 месяцев, 2-4 месяцев, 3-5 месяцев, 4-6 месяцев, 5-7 месяцев, 1-4 месяцев, 2-5 месяцев, 3-6 месяцев, 4-7 месяцев, 1-5 месяцев, 2-6 месяцев, 3-7 месяцев, 1-6 месяцев, 2-7 месяцев или 1-7 месяцев.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180, 210 дней после введения.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 40% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150 дней после введения.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150 дней после введения.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 50% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60 дней после введения.
В некоторых воплощениях TRACP5b уменьшается, по меньшей мере, на 60% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30 дней после введения.
В других воплощениях предлагаются способы ингибирования у субъекта резорбции кости или активности остеокластов, которые включают введение субъекту полипептида, который специфично связывается с Лигандом Рецептора Активатора Ядерного Фактора каппа B (RANKL), где количество вводимого полипептида эффективно для уменьшения сывороточного уровня N-концевого пропептида проколлагена типа 1 (P1NP) в течение, по меньшей мере, 30 дней после введения. Соответственно, изобретение также относится к полипептиду по изобретению для ингибирования RANK-L-опосредованной резорбции кости и/или активности остеокластов, где количество вводимого полипептида эффективно для уменьшения сывороточного уровня P1NP в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень P1NP уменьшается по сравнению с уровнем до лечения или с нормальным уровнем на 30%-80% или более, как, например, по меньшей мере, на 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47, 48, 59, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, или 80%. Уменьшение сывороточного уровня P1NP может сохраняться в течение более продолжительных периодов времени, таких как, по меньшей мере, 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 180 дней, по меньшей мере, 210 дней, по меньшей мере, 240 дней, по меньшей мере, 270 дней, по меньшей мере, 300 дней, по меньшей мере, 330 дней, или по меньшей мере, 360 дней; например, (включительно) 30-60 дней, 60-90 дней, 90-120 дней, 120-150 дней, 150-180 дней, 180-210 дней, 210-240 дней, 240-270 дней, 270-300 дней, 300-330 дней, 330-360 дней, 30-90 дней, 60-120 дней, 90-150 дней, 120-180 дней, 150-210 дней, 180-240 дней, 210-270 дней, 240-300 дней, 300-360 дней, 30-120 дней, 60-150 дней, 90-180 дней, 120-210 дней, 150-240 дней, 180-270 дней, 210-300 дней, 240-330 дней, 270-360 дней, 30-150 дней, 60-180 дней, 90-210 дней, 120-240 дней, 150-270 дней, 180-300 дней, 210-330 дней, 240-360 дней, 30-180 дней, 60-210 дней, 90-240 дней, 120-270 дней, 150-300 дней, 180-330 дней, 210-360 дней, 30-210 дней, 60-240 дней, 90-270 дней, 120-300 дней, 150-330 дней, 180-360 дней, 30-240 дней, 60-270 дней, 90-300 дней, 120-330 дней, 150-360 дней, 30-270 дней, 60-300 дней, 90-330 дней, 120-360 дней, 30-300 дней, 60-330 дней, 90-360 дней, 30-330 дней, 60-360 дней, and 30-360 дней; или for по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 or 12 месяцев; например, 30 дней-3 месяцев, 1-3 месяцев, 2-4 месяцев, 3-5 месяцев, 4-6 месяцев, 5-7 месяцев, 6-8 месяцев, 7-9 месяцев, 8-10 месяцев, 9-11 месяцев, 10-12 месяцев, 1-4 месяцев, 2-5 месяцев, 3-6 месяцев, 4-7 месяцев, 5-8 месяцев, 6-9 месяцев, 7-10 месяцев, 8-11 месяцев, 9-12 месяцев, 1-5 месяцев, 2-6 месяцев, 3-7 месяцев, 4-8 месяцев, 5-9 месяцев, 6-10 месяцев, 7-11 месяцев, 8-12 месяцев, 1-6 месяцев, 2-7 месяцев, 3-8 месяцев, 4-9 месяцев, 5-10 месяцев, 6-11 месяцев, 7-12 месяцев, 1-7 месяцев, 2-8 месяцев, 3-9 месяцев, 4-10 месяцев, 5-11 месяцев, 6-12 месяцев, 1-8 месяцев, 2-9 месяцев, 3-10 месяцев, 4-11 месяцев, 5-12 месяцев, 1-9 месяцев, 2-10 месяцев, 3-11 месяцев, 4-12 месяцев, 1-10 месяцев, 2-11 месяцев, 3-12 месяцев, 1-11 месяцев, 2-12 месяцев, или 1-12 месяцев.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 30% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180, 210, 240, 270 или 300 дней после введения.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 40% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180, 210, 240 или 270 дней после введения.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 45% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180 или 210 дней после введения.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 50% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180 или 210 дней после введения.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 60% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150, 180 или 210 дней после введения.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 70% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90, 120, 150 или 180 дней после введения.
В некоторых воплощениях P1NP уменьшается, по меньшей мере, на 80% по сравнению с уровнем до лечения или с нормальным уровнем в течение до 30, 60, 90 или 120 дней после введения.
В некоторых воплощениях уменьшения CTX-1 и/или NTX-1 достигают через 8 часов после введения полипептида, как, например, через 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 часа после введения полипептида.
В некоторых воплощениях уменьшения TRACP5b достигают через 2 дня после введения полипептида, как, например, через 3, 4 или 5 дней после введения полипептида.
В некоторых воплощениях для получения неожиданно долгих и продолжительных эффектов, описанных в данном документе, полипептид, который специфично связывается с RANKL, вводят в количестве от около 0,001 мг/кг до около 10 мг/кг. В некоторых воплощениях, интервалы доз включают (включая значения границ каждого интервала) 0,003-10 мг/кг, как, например, 0,003-3 мг/кг, 0,003-1 мг/кг, 0,003-0,3 мг/кг, 0,003-0,1 мг/кг, 0,003-0,03 мг/кг, 0,003-0,01 мг/кг, 0,01-10 мг/кг, 0,01-3 мг/кг, 0,01-1 мг/кг, 0,01-0,3 мг/кг, 0,01-0,1 мг/кг, 0,01-0,03 мг/кг, 0,03-10 мг/кг, 0,03-3 мг/кг, 0,03-1 мг/кг, 0,03-0,3 мг/кг, 0,03-0,1 мг/кг, 0,1-10 мг/кг, 0,1-3 мг/кг, 0,1-1 мг/кг, 0,1-0,3 мг/кг, 0,3-10 мг/кг, 0,3-3 мг/кг, 0,3-1 мг/кг, 1-10 мг/кг, 1-3 мг/кг, и 3-10 мг/кг. В некоторых воплощениях конкретные дозы включают 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мг/кг.
Целевая доза может быть удобным образом представлена в однократной дозе или в виде дискретных доз, вводимых через соответствующие интервалы, например, в виде ежемесячных доз, например, доза раз в месяц (Q1M), доза раз в два месяца (Q2M), доза раз в три месяца (Q3M) или раз в четыре месяца (Q4M), и т.д..
В предпочтительном аспекте полипептид по изобретению вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг каждый месяц.
В другом предпочтительном аспекте полипептид по изобретению вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг каждые два месяца.
В другом предпочтительном аспекте полипептид по изобретению вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг каждые три месяца.
В другом предпочтительном аспекте полипептид по изобретению вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг каждые три месяца.
Предпочтительно полипептид по изобретению представляет собой SEQ ID NO: 12.
Предлагаются способы для ингибирования у субъекта резорбции кости и/или активности остеокластов, причем способы включают введение субъекту полипептида по изобретению в количестве около 0,003 мг/кг, где уровень CTX-1 в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения.
В другом аспекте полипептид по изобретению вводят в количестве от около 0,01 мг/кг до 0,03 мг/кг, где уровень CTX-1 в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень CTX-1 уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45%, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 60% или даже, по меньшей мере, 70% или более, по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень СТХ-1 в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, или, по меньшей мере, 120 дней после введения. В другом конкретном аспекте, уровень CTX-1 в сыворотке уменьшается на 45% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 45% в течение периода, по меньшей мере, до 60 дней после введения.
В другом конкретном аспекте полипептид по изобретению вводят в количестве от около 0,1 мг/кг до 1 мг/кг или более, где уровень CTX-1 в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень CTX-1 уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45%, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 60%, по меньшей мере, 70% или даже, по меньшей мере, 80% или более, по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень CTX-1 в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 210 дней или даже, по меньшей мере, 270 дней после введения. В другом конкретном аспекте, уровень CTX-1 в сыворотке уменьшается на 45% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 45% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, или, по меньшей мере, 120 дней или даже, по меньшей мере, 150 дней после введения.
Предлагаются способы для ингибирования у субъекта резорбции кости и/или активности остеокластов, причем способы включают введение субъекту полипептида по изобретению в количестве от около 0,01 мг/кг до 0,03 мг/кг, где уровень NTX-1 в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях уровень NTX-1 уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45%, по меньшей мере, 50%, или даже, по меньшей мере, 60% или более, по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень NTX-1 в моче уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней или, по меньшей мере, 90 дней после введения. В другом конкретном аспекте, уровень NTX-1 в моче уменьшается на 45% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 45% в течение периода, по меньшей мере, до 60 дней после введения.
В другом конкретном аспекте полипептид по изобретению вводят в количестве от около 0,1 мг/кг до 1 мг/кг или более, где уровень NTX-1 в моче уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях уровень NTX-1 в моче уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45%, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 60% или даже, по меньшей мере, 70% или более, по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень NTX-1 в моче уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 210 дней или даже, по меньшей мере, 270 дней после введения. В другом конкретном аспекте, уровень NTX-1 в моче уменьшается на 45% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 45% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, или, по меньшей мере, 120 дней или даже, по меньшей мере, 150 дней после введения.
Предлагаются способы для ингибирования у субъекта резорбции кости и/или активности остеокластов, причем способы включают введение субъекту полипептида по изобретению в количестве около 0,003 мг/кг, где уровень TRACP5b в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30%.
В другом конкретном аспекте полипептид по изобретению вводят в количестве от около 0,01 мг/кг до 0,03 мг/кг, где уровень TRACP5b в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В конкретном аспекте, уровень TRACP5b в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней после введения.
В другом конкретном аспекте полипептид по изобретению вводят в количестве около 0,1 мг/кг или более, где уровень TRACP5b в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень TRACP5b уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45% по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень TRACP5b в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней или, по меньшей мере, 90 дней после введения.
В другом конкретном аспекте полипептид по изобретению вводят в количестве от около 0,3 мг/кг до 1 мг/кг или более, где уровень TRACP5b в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень TRACP5b уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45%, по меньшей мере, 50%, или даже, по меньшей мере, 60% или более, по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень TRACP5b в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, или даже, по меньшей мере, 120 дней после введения. В другом конкретном аспекте, уровень TRACP5b в сыворотке уменьшается на 45% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 45% в течение периода, по меньшей мере, до 60 дней или даже, по меньшей мере, 90 дней после введения.
Предлагаются способы для ингибирования у субъекта резорбции кости и/или активности остеокластов, причем способы включают введение субъекту полипептида по изобретению в количестве от около 0,003 мг/кг до 0,01 мг/кг, где уровень P1NP в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень P1NP уменьшается и поддерживается на уровне, по меньшей мере, 40% по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень P1NP в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней или даже, по меньшей мере, 90 дней после введения.
В другом конкретном аспекте полипептид по изобретению вводят в количестве около 0,03 мг/кг, где уровень P1NP в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень P1NP уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45% или более по сравнению с уровнем до лечения или с нормальным уровнем. В другом конкретном аспекте, уровень P1NP в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, или, по меньшей мере, 120 дней или даже, по меньшей мере, 150 дней после введения. В другом конкретном аспекте, уровень P1NP в сыворотке уменьшается на 45% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 45% в течение периода, по меньшей мере, до 60 дней или даже, по меньшей мере, 90 дней после введения.
В другом конкретном аспекте полипептид по изобретению вводят в количестве от около 0,1 мг/кг до 1 мг/кг или более, где уровень P1NP в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение, по меньшей мере, 30 дней после введения. В некоторых воплощениях сывороточный уровень P1NP уменьшается и поддерживается на уровне, по меньшей мере, 40%, как, например, по меньшей мере, 45%, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 60%, по меньшей мере, 70% или даже, по меньшей мере, 80% или более, по сравнению с уровнем до лечения или с нормальным уровнем. В конкретном аспекте, уровень P1NP в сыворотке уменьшается на 30% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 30% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, по меньшей мере, 120 дней, по меньшей мере, 150 дней, по меньшей мере, 210 дней или даже, по меньшей мере, 270 дней после введения. В другом конкретном аспекте, уровень P1NP в сыворотке уменьшается на 45% по сравнению с уровнем до лечения или с нормальным уровнем, и поддерживается на уровне, по меньшей мере, 45% в течение периода, по меньшей мере, до 60 дней, по меньшей мере, 90 дней, или, по меньшей мере, 120 дней или даже, по меньшей мере, 150 дней после введения.
В предпочтительном аспекте полипептид по изобретению представляет собой SEQ ID NO: 12.
Полипептид по изобретению
Одиночный вариабельный домен иммуноглобулина
До тех пор, пока не указано иначе термин «последовательность иммуноглобулина» - где-либо использованная в данном документе, относится к «тяжелоцепочечному» антителу, или к обычному 4-цепочечному антителу, то есть используется в качестве общего термина, включающего как полноразмерное антитело, так и его индивидуальные цепи, а также все его части, домены или фрагменты (включающие, но не ограничивающиеся этим, антигенсвязывающие домены или фрагменты, такие как домены VHH или VH/VL, соответственно). Кроме того, термин «последовательность» при использовании в данном документе (например, в выражениях типа «последовательность иммуноглобулина», «последовательность антитела», «последовательность вариабельного домена», «VHH-последовательность» или «белковая последовательность»), следует, как правило, понимать как включающий соответствующую аминокислотную последовательность, а также последовательность нуклеиновых кислот или нуклеотидную последовательности, кодирующую ее, пока из контекста не следует более ограниченная интерпретация.
Термин «одиночный вариабельный домен иммуноглобулина» взаимозаменяем с термином «одиночный вариабельный домен», и определяет молекулы, где антигенсвязывающий сайт присутствует на одиночном иммуноглобулиновом домене, и собственно образован им. Это помещает одиночные вариабельные домены иммуноглобулинов отдельно от «обычных» иммуноглобулинов или их фрагментов, где два иммуноглобулиновых домена, а именно два вариабельных домена, взаимодействуют с образованием антигенсвязывающего сайта. Как правило, в обычных иммуноглобулинах, вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) взаимодействуют с образованием антигенсвязывающего сайта. В этом случае, гипервариабельные участки (или участки, определяющие комплементарность (CDR)) обоих доменов, VH и VL, будут вносить вклад в антигенсвязывающий сайт, т.е. все 6 CDR будут вовлечены в образование антигенсвязывающего сайта. В отличие от этого, сайт связывания одиночного вариабельного домена образован одиночным VH- или VL-доменом. Следовательно, антигенсвязывающий сайт одиночного вариабельного домена образован не более чем тремя CDR.
Следовательно, термин «одиночный вариабельный домен иммуноглобулина» и «одиночный вариабельный домен» не включают обычных иммуноглобулинов или их фрагменты, которые требуют взаимодействия, по меньшей мере, двух вариабельных доменов для образования антигенсвязывающего сайта. Однако эти термины включают фрагменты обычных иммуноглобулинов, где антигенсвязывающий сайт образуется одиночным вариабельным доменом.
Как правило, одиночные вариабельные домены будут представлять собой аминокислотные последовательности, которые, по существу, состоят из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно); или любого подходящего фрагмента такой аминокислотной последовательности (которая таким образом содержит, по меньшей мере, некоторые из аминокислотных остатков, которые образуют, по меньшей мере, один из CDR). Такие одиночные вариабельные домены и фрагменты являются наиболее предпочтительными, так что они включают характерную для иммуноглобулинов укладку цепи или способны к образованию при подходящих условиях характерной для иммуноглобулинов укладки цепи. Как таковой, одиночный вариабельный домен может, например, включать последовательность вариабельного домена легкой цепи (например, VL-последовательность) или ее подходящий фрагмент; или последовательность вариабельного домена тяжелой цепи (например, VH-последовательность или VHH-последовательность) или ее подходящий фрагмент; при условии, что она способна образовывать одиночный антигенсвязывающий элемент (т.е. функциональный антигенсвязывающий элемент, который по существу состоит из одиночного вариабельного домена, такого, что одиночный антигенсвязывающий домен не нуждается во взаимодействии с другим вариабельным доменом для образования функционального антигенсвязывающего элемента, как, например, в случае для вариабельных доменов, которые, например, присутствуют в обычных антителах и scFv фрагментах, которые нуждаются во взаимодействии с другим вариабельным доменом, например, посредством VH/VL взаимодействия - с образованием функционального антигенсвязывающего домена).
В одном воплощении изобретения одиночные вариабельные домены иммуноглобулина представляют собой последовательности вариабельных доменов легких цепей (например, VL-последовательность), или последовательности вариабельных доменов тяжелой цепи (например, VH-последовательность); более конкретно, иммуноглобулиновые одиночные вариабельные домены могут представлять собой последовательности вариабельных доменов тяжелой цепи, которые выделены из обычного черех-цепочечного антитела, или последовательности вариабельных доменов тяжелых цепей, которые выделены их тяжелоцепочечного антитела.
Например, одиночный вариабельный домен или одиночный вариабельный домен иммуноглобулина (или аминокислотная последовательность, которая подходит для применения в качестве одиночного вариабельного домена иммуноглобулина) может представлять собой (одно-)доменное антитело (или аминокислотную последовательность, которая подходит для применения в качестве (одно-)доменного антитела), «dAb» или dAb (или аминокислотную последовательность, которая подходит для применения в качестве dAb) или Нанотело (Nanobody) (как определено в данном документе и включающее, в частности, VHH-последовательность); другие одиночные вариабельные домены, или любой подходящий фрагмент любого и них. Для общего описания (одно-)доменных антител дается ссылка на предыдущие публикации в данной области, процитированные в данном документе, а также на EP 0368684. Для термина «dAb» дается ссылка, например, на Ward et al. (1989, Nature 341 (6242): 544-6), to Holt et al. (2003, Trends Biotechnol. 21 (11): 484-490); а также, например, WO 04/068820, WO 06/030220, WO 06/003388 и другие опубликованные патентные заявки Domantis Ltd. Следует также заметить, что хотя в контексте настоящего изобретения это менее предпочтительно, так как их происхождение отлично от млекопитающих, одиночные вариабельные домены могут быть выделены из определенных видов акул (например, так называемые «IgNAR-домены», см. Например, WO 05/18629).
В частности, одиночный вариабельный домен иммуноглобулина может представлять собой Нанотело (как определено в данном документе) или его подходящий фрагмент. [Примечание: «Nanobody®», «Nanobodies®» и «Nanoclone®» представляют собой зарегистрированные торговые марки «Ablynx N.V.»]. Для общего описания Нанотел дается ссылка на следующее описание ниже, а также на предыдущие публикации в данной области, цитированные в данном документе, такие как, например, описанные в WO 08/020079 (стр. 16).
Можно считать, но не следует ограничиваться только этим, что аминокислотная последовательность и структура иммуноглобулиновой последовательности, одиночного вариабельного домена иммуноглобулина и, конкретно, Нанотела, состоит из каркасных участков или «FR», которые известны в данной области и обозначены в данном документе как «Каркасный участок 1» или «FR1»; как «Каркасный участок 2» или «FR2»; как «Каркасный участок 3» или «FR3»; и как «Каркасный участок 4» или «FR4», соответственно; которые прерываются тремя гипервариабельными участками, или «CDR», которые обозначаются в данной области как «Гипервариабельный участок 1» или «CDR1»; как «Гипервариабельный участок 2» или «CDR2»; и как «Гипервариабельный участок 3» или «CDR3», соответственно.
Общее количество аминокислотных остатков в одиночном вариабельном домене иммуноглобулина и, конкретно, в Нанотеле может соответствовать участку 110-120, предпочтительно 112-115, и наиболее предпочтительно 113. Однако следует заметить, что части, фрагменты, аналоги или производные (как дополнительно описано в данном документе) одиночного вариабельного домена иммуноглобулина и, конкретно, Нанотела особо не ограничены по их длине и/или размеру при условии, что такие части, фрагменты, аналоги или производные удовлетворяют дополнительным требованиям, приведенным в данном документе, а также предпочтительно подходят для целей, описанных в данном документе.
Для дополнительного описания VHH и Нанотел дается ссылка на обзорную статью Muyldermans (2001, Reviews in Molecular Biotechnology 74: 277-302); а также на следующие патентные заявки, которые упомянуты, как основные предшествующие публикации в данной области: WO 94/04678, WO 95/04079 и WO 96/34103 Vrije Universiteit Brussel; WO 94/25591, WO 99/37681, WO 00/40968, WO 00/43507, WO 00/65057, WO 01/40310, WO 01/44301, EP 1134231 и WO 02/48193 Unilever; WO 97/49805, WO 01/21817, WO 03/035694, WO 03/054016 и WO 03/055527 Vlaams Instituut voor Biotechnologie (VIB); WO 03/050531 Algonomics N.V. и Ablynx N.V.; WO 01/90190 Национальный Совет Канады по Научным Исследованиям; WO 03/025020 (=EP 1433793) Институт Антител; а также WO 04/041867, WO 04/041862, WO 04/041865, WO 04/041863, WO 04/062551, WO 05/044858, WO 06/40153, WO 06/079372, WO 06/122786, WO 06/122787 и WO 06/122825 Ablynx N.V. и дополнительно опубликованные патентные заявки Ablynx N.V. Ссылка также дается на дополнительные предшествующие публикации в данной области, упомянутые в этих заявках, и конкретно, на список публикаций, упомянутых на страницах 41-43 международной заявки WO 06/040153, который вместе с другими публикациями включен в данный документ с помощью ссылки. Как описано в этих публикациях, Нанотела (конкретно VHH-последовательности и конкретно гуманизированные Нанотела) могут, в частности, характеризоваться присутствием одного или нескольких маркерных остатков (hallmark residues) в одной или в нескольких каркасных последовательностях. Дополнительное описание Нанотел, включая гуманизацию и/или верблюдизацию Нанотел, а также другие модификации, части или фрагменты, производные или «гибридные Нанотел», мультивалентные конструкции (включающие некоторые неограничивающие примеры линкерных последовательностей) и различные модификации для повышения периода полужизни Нанотел и их получение можно обнаружить, например, в WO 08/101985 и WO 08/142164.
Таким образом, Нанотело может дополнительно определяться как аминокислотная последовательность, описанная в WO 08/142164 (стр. 30, строка 5 - стр. 31, строка 7 и стр. 108, строка 26 - стр. 140, строка 15).
Таким образом, в по смыслу настоящего изобретения термин «одиночный вариабельный домен иммуноглобулина» или «одиночный вариабельный домен» включает полипептиды, которые произошли из источника с происхождением, отличным от человеческого, предпочтительно из верблюдовых, предпочтительно из верблюжьего антитела, содержащего только тяжелую цепь. Он могут быть гуманизированными, как описано ранее. Кроме того, термин включает полипептиды, выделенные из источников, отличных от верблюдовых, например, из мыши или человека, и которые были верблюдизированны (camelized), как описано ранее.
Термин «одиночный вариабельный домен иммуноглобулина» охватывает иммуноглобулиновые последовательности различного происхождения, включающего мышиные, крысиные, кроличьи, ослиные, человеческие и верблюжьи иммуноглобулиновые последовательности. Он также включает полностью человеческие, гуманизированные или химерные иммуноглобулиновые последовательности. Например, он включает верблюжьи иммуноглобулиновые последовательности и гуманизированные иммуноглобулиновые последовательности или верблюдизированные последовательности иммуноглобулиновых одиночных вариабельных доменов, например, верблюдизированное dAb, как описано в Ward et al (см. Например, WO 94/04678 и Davies and Riechmann (1994, FEBS 339: 285-290; 1995, Biotechnol. 13: 475-479; 1996, Prot. Eng. 9: 531-537).
Однако следует заметить, что изобретение не ограничивается ни происхождением иммуноглобулиновых последовательностей, использованным в настоящем изобретении (или нуклеотидных последовательностей, использованных для их экспрессии), ни пути, с помощью которого иммуноглобулиновую последовательность или нуклеотидную последовательность генерируют или получают (или генерировали или получали). Таким образом, иммуноглобулиновые последовательности по изобретению могут быть природными аминокислотными последовательностями (из любых подходящих видов) или синтетическими и полусинтетическими аминокислотными последовательностями. В конкретном частном аспекте изобретения иммуноглобулиновая последовательность является природной иммуноглобулиновой последовательностью (из любых подходящих видов) или синтетической или полусинтетической иммуноглобулиновой последовательностью, включая в частности «гуманизированные» (как определено в данном документе) иммуноглобулиновые последовательности (такие как частично или полностью гуманизированные мышиные или кроличьи иммуноглобулиновые последовательности, и конкретно частично или полностью гуманизированные VHH-последовательности или Нанотела), «верблюдизированные» (как определено в данном документе) иммуноглобулиновые последовательности, а также иммуноглобулиновые последовательности, которые были получены с помощью способов, таких как «созревание аффинности» (например, начиная с синтетической, случайной или естественной иммуноглобулиновой последовательности), прививка CDR», перестройка поверхности антитела (veneering), комбинирование фрагментов, выделенных из различных иммуноглобулиновых последовательностей, ПЦР-сборка с использованием перекрывающихся праймеров, и с помощью аналогичных хорошо известных специалисту методов для конструирования иммуноглобулиновых последовательностей, или любой комбинации вышеописанного. Ссылка дается, например, на стандартные руководства, а также на дополнительное описание и упомянутые в данном документе данные, известные из предшествующих публикаций.
Аналогично, нуклеотидные последовательности, используемые в изобретении, могут быть природными последовательностями или синтетическими или полусинтетическими последовательностями, и могут, например, быть последовательностями, которые выделены с помощью ПЦР из подходящей естественной матрицы (например, ДНК или РНК, выделенные из клетки), нуклеотидными последовательностями, которые выделены из библиотеки (а конкретнее из экспрессирующей библиотеки), нуклеотидными последовательностями, которые получены с помощью введения мутаций в природную нуклеотидную последовательность (с использованием подходящих по существу известных методов, таких как ПЦР с ошибочным спариванием), нуклеотидными последовательностями, которые получены с помощью ПЦР с использованием перекрывающихся праймеров, или нуклеотидными последовательностями, которые получены с использованием известных по существу методов ДНК-синтеза.
Одиночные вариабельные домены иммуноглобулина (и полипептиды, включающие их), которые направлены против RANKL, описаны в US 2010/0104568 и WO 08/142164.
Например, предпочтительные одиночные вариабельные домены иммуноглобулина и/или Нанотела против RANK-L могут состоять из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в которых:
- CDR1 выбран из группы, состоящей из:
a) аминокислотной последовательности SEQ ID NO: 1 (SEQ ID NO: 200 US 2010/0104568);
b) аминокислотных последовательностей, которые имеют, по меньшей мере, 80% идентичности по аминокислотам с аминокислотной последовательностью SEQ ID NO: 1 (SEQ ID NO: 200 US 2010/0104568);
c) аминокислотных последовательностей, которые имеют 3, 2 или 1 аминокислотное отличие от аминокислотной последовательности SEQ ID NO: 1 (SEQ ID NO: 200 US 2010/0104568);
и/или
- CDR2 выбран из группы, состоящей из:
d) аминокислотной последовательности SEQ ID NO: 2 (SEQ ID NO: 324 US 2010/0104568);
e) аминокислотных последовательностей, которые имеют, по меньшей мере, 80% идентичности по аминокислотам с аминокислотной последовательностью SEQ ID NO: 2 (SEQ ID NO: 324 US 2010/0104568);
f) аминокислотных последовательностей, которые имеют 3, 2 или 1 аминокислотное отличие от аминокислотной последовательности SEQ ID NO: 2 (SEQ ID NO: 324 US 2010/0104568);
и/или
- CDR3 выбран из группы, состоящей из:
g) аминокислотной последовательности SEQ ID NO: 3 (SEQ ID NO: 448 US 2010/0104568);
h) аминокислотных последовательностей, которые имеют, по меньшей мере, 80% идентичности по аминокислотам с аминокислотной последовательностью SEQ ID NO: 3 (SEQ ID NO: 448 US 2010/0104568);
i) аминокислотных последовательностей, которые имеют 3, 2 или 1 аминокислотное отличие от аминокислотной последовательности SEQ ID NO: 3 (SEQ ID NO: 448 US 2010/0104568);
Когда одиночный вариабельный домен иммуноглобулина и/или Нанотело содержит одну или несколько аминокислотных последовательностей согласно b) и/или c):
i) любая аминокислотная замена в такой аминокислотной последовательности согласно b) и/или c), является предпочтительно консервативной, по сравнению с соответствующей аминокислотной последовательностью согласно a) (как определено в данном документе);
и/или
ii) аминокислотная последовательность согласно b) и/или c) предпочтительно содержит только аминокислотные замены и не содержит аминокислотных делеций или вставок, по сравнению с соответствующей аминокислотной последовательностью согласно a);
и/или
iii) аминокислотная последовательность согласно b) и/или c) может быть аминокислотной последовательностью, которая выделена из аминокислотной последовательности согласно a) посредством «созревания аффинности» с использованием одного или нескольких по существу известных способов «созревания аффинности».
Аналогично когда иммуноглобулиновый одиночный вариабельный домен и/или Нанотело содержит одну или несколько аминокислотных последовательностей согласно e) и/или f):
i) любая аминокислотная замена в такой аминокислотной последовательности согласно e) и/или f), является предпочтительно консервативной, по сравнению с соответствующей аминокислотной последовательностью согласно d) (как определено в данном документе);
и/или
ii) аминокислотная последовательность согласно e) и/или f) предпочтительно содержит только аминокислотные замены и не содержит аминокислотных делеций или вставок, по сравнению с соответствующей аминокислотной последовательностью согласно d);
и/или
iii) аминокислотная последовательность согласно e) и/или f) может быть аминокислотной последовательностью, которая выделена из аминокислотной последовательности согласно в) посредством «созревания аффинности» с использованием одного или нескольких по существу известных методов «созревания аффинности».
Аналогично когда иммуноглобулиновый одиночный вариабельный домен и/или Нанотело содержит одну или несколько аминокислотных последовательностей согласно h) и/или i):
i) любая аминокислотная замена в такой аминокислотной последовательности согласно h) и/или i), предпочтительной является консервативной, по сравнению с соответствующей аминокислотной последовательностью согласно g) (как определено в данном документе);
и/или
ii) аминокислотная последовательность согласно h) и/или i) предпочтительно содержит только аминокислотные замены и не содержит аминокислотных делеций или вставок, по сравнению с соответствующей аминокислотной последовательностью согласно g);
и/или
iii) аминокислотная последовательность согласно h) и/или i) может быть аминокислотной последовательностью, которая выделена из аминокислотной последовательности согласно g) посредством «созревания аффинности» с использованием одного или нескольких по существу известных методов «созревания аффинности».
В одном предпочтительном частном аспекте иммуноглобулиновый одиночный вариабельный домен и/или Нанотело может по существу состоять из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в которых CDR-последовательности указанного одиночного вариабельного домена иммуноглобулина и/или Нанотела имеют, по меньшей мере, 70% идентичности по аминокислотам, предпочтительно, по меньшей мере, 80% идентичности по аминокислотам, более предпочтительно, по меньшей мере, 90% идентичности по аминокислотам, как, например, 95% идентичности по аминокислотам или более, или даже по существу 100% идентичности по аминокислотам с CDR-последовательностями аминокислотной последовательности SEQ ID NO: 4 (SEQ ID NO: 572 US 2010/0104568). Степень идентичности по аминокислотам может, например, определяться путем определения степени идентичности по аминокислотам (так, как описано в данном документе) между указанной аминокислотной последовательностью и SEQ ID NO: 4 (SEQ ID NO: 572 US 2010/0104568), в которой не учитываются аминокислотные остатки, которые образуют каркасные участки.
В другом предпочтительном частном аспекте CDR-последовательности имеют более чем 80%, предпочтительно более чем 90%, более предпочтительно более чем 95%, как, например, 99% или более идентичности последовательности с SEQ ID NO: 1, SEQ ID NO: 2 и/или SEQ ID NO: 3 (SEQ ID NO: 200, SEQ ID NO: 324 и/или SEQ ID NO: 448 из US 2010/0104568).
В частности, такой одиночный вариабельный домен иммуноглобулина может быть таким, что CDR1 выбирают из SEQ ID NO: 1; и/или CDR2 выбирают из SEQ ID NO: 2; и/или CDR3 выбирают из SEQ ID NO: 3. Более предпочтительно, одиночный вариабельный домен иммуноглобулина, используемый в полипептиде по изобретению, может по существу состоять из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в которых:
a) CDR1 выбирают из SEQ ID NO: 1;
b) CDR2 выбирают из SEQ ID NO: 2;
c) CDR3 выбирают из SEQ ID NO: 3;
Предпочтительные вариабельные домены иммуноглобулина для применения в способе по изобретению включают SEQ ID NO: 4 (SEQ ID NO: 572 US 2010/0104568) и/или одиночные вариабельные домены иммуноглобулина и/или Нанотела, выбранные из группы, состоящей из аминокислотных последовательностей, которые идентичны более чем 80%, предпочтительно более чем 90%, более предпочтительно более чем 95%, как, например, 99% или более с последовательностью с SEQ ID NO: 4.
Гуманизированные одиночные вариабельные домены иммуноглобулина и/или Нанотела могут быть аминокислотными последовательностями, которые являются такими, как в основном определено для одиночных вариабельных доменов иммуноглобулина и/или Нанотел в предыдущих абзацах, но в которых присутствует, по меньшей мере, один аминокислотный остаток (а конкретнее, по меньшей мере, один из каркасных остатков), который представляет собой и/или соответствует гуманизирующей замене. Некоторые предпочтительные частные гуманизирующие замены (и их подходящие комбинации) станут понятны специалисту в данной области на основе данного описания. Дополнительно или альтернативно другие потенциально применяемые гуманизирующие замены могут устанавливаться путем сравнения последовательности каркасных участков природной VHH-последовательности с соответствующей каркасной последовательностью одной или нескольких близко родственных человеческих VH-последовательностей, после чего определенные, таким образом, одна или несколько из потенциально пригодных гуманизирующих замен (или их комбинации) могут вводиться в указанную VHH-последовательность (любым по существу известным способом, как дополнительно описано в данном документе), и полученные гуманизированные VHH-последовательности могут тестироваться на аффинность к мишени, на стабильность, на ослабление и уровень экспрессии и на другие целевые свойства. Таким образом, посредством ограниченного применения метода проб и ошибок другие подходящие гуманизирующие замены (или их подходящие комбинации) могут быть определены специалистом. Также на основании вышеописанного (каркасные участки) иммуноглобулиновых одиночных вариабельных доменов и/или Нанотел могут быть частично гуманизированы или полностью гуманизированы.
Таким образом, в одном частном, но не ограничивающем, аспекте одиночный вариабельный домен иммуноглобулина и/или Нанотело может быть гуманизированным одиночным вариабельным доменом иммуноглобулина и/или Нанотелом, и состоять из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), где CDR1-CDR3 определены в данном документе, и где указанный гуманизированный одиночный вариабельный домен иммуноглобулина и/или Нанотело включает, по меньшей мере, одну гуманизирующую замену (как определено в данном документе), и, конкретно, по меньшей мере, одну гуманизирующую замену, по меньшей мере, в одной из каркасных последовательностей (как определено в данном документе).
Некоторые особенно предпочтительные гуманизированные одиночные вариабельные домены иммуноглобулина и/или Нанотела представляют собой гуманизированные варианты Нанотела SEQ ID NO: 4 (SEQ ID NO: 572 US 2010/0104568).
Некоторые предпочтительные, но не ограничивающие, примеры таких гуманизированных вариантов представляют собой Нанотела SEQ ID NO: 5-11 (SEQ ID NO: 750-756 US 2010/0104568). Таким образом, изобретение также относится к гуманизированному Нанотелу с аминокислотной последовательностью, которая выбрана из группы, состоящей из SEQ ID NO: 5-11, или из группы, состоящей из аминокислотных последовательностей, которые имеют более чем 80%, предпочтительно, более чем 90%, более предпочтительно, более чем 95%, как например 99% или более идентичности последовательности с, по меньшей мере, одной из аминокислотных последовательностей SEQ ID NO: 5-11 (где аминокислотные последовательности, которые выбраны из последней группы аминокислотных последовательностей, могут содержать большее количество или меньшее количество гуманизирующих замен по сравнению с соответствующей последовательностью SEQ ID NO: 5-11, при условии, что они сохраняют, по меньшей мере, одну из гуманизирующих замен, присутствующих в соответствующей последовательности SEQ ID NO: 5-11), где SEQ ID NO: 10 является особенно предпочтительной.
Конкретно, одиночные вариабельные домены иммуноглобулина, используемые в способе по изобретению, могут представлять собой:
- аминокислотные последовательности, которые направлены против (как определено в данном документе) RANK-L и имеют, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, как, например, 90% или 95% или более идентичности последовательности с аминокислотными последовательностями SEQ ID NO: 4-11 (SEQ ID NO: 572 и 750-756 US 2010/0104568). Эти аминокислотные последовательности могут дополнительно быть такими, что они нейтрализуют связывание RANK с RANK-L; и/или конкурируют с RANK за связывание с RANK-L; и/или направлены против сайта взаимодействия на RANK-L (такого как сайт связывания RANK или OPG);
- аминокислотные последовательности, которые перекрестно блокируют связывание, по меньшей мере, одной из аминокислотных последовательностей SEQ ID NO: 4-11 (SEQ ID NO: 572 и 750-756 US 2010/0104568) с RANK-L и/или которые конкурируют, по меньшей мере, с одной из аминокислотных последовательностей SEQ ID NO: 4-11 (SEQ ID NO: 572 и 750-756 US 2010/0104568) за связывание с RANK-L. Наконец, эти аминокислотные последовательности дополнительно могут нейтрализовать связывание родственного лиганда с RANK-L; и/или конкурировать с родственным лигандом за связывание с RANK-L; и/или могут быть направлены против участка взаимодействия (как определено в данном документе) на RANK-L (таким как сайт связывания RANK или OPG); аминокислотные последовательности могут быть такими, как описано далее в данном документе (и могут, например, быть Нанотелами); а также полипептиды по изобретению, которые включают одну или несколько из таких аминокислотных последовательностей (которые могут быть такими, как описано далее в данном документе, и могут, например, быть биспецифичными и/или бипаратопными полипептидами, как описано в данном документе), и нуклеотидные последовательности, которые кодируют такие аминокислотные последовательности и полипептиды. Такие аминокислотные последовательности и полипептиды не включают никаких естественных лигандов.
Согласно частному, но предпочтительному аспекту изобретения (CDR-последовательности, присутствующие в) иммуноглобулиновом одиночном вариабельном домене и/или в Нанотеле, такие, что:
- иммуноглобулиновый одиночный вариабельный домен и/или Нанотело могут связываться с RANK-L с константой диссоциации (KD) 10-5-10-12 моль/литр или менее, и предпочтительно, 10-7-10-12 моль/литр или менее, и более предпочтительно, 10-8-10-12 моль/литр (т.е. с константой ассоциации (KA) 105-1012 литр/моль или более и предпочтительно, 107-1012 литр/моль или более и более предпочтительно, 108-1012 литр/моль);
и/или такие как:
- иммуноглобулиновый одиночный вариабельный домен и/или Нанотело могут связываться с RANK-L со значением kon от 102 М-1с-1 до около 107 М-1с-1, предпочтительно от 103 М-1с-1 до 107 М-1с-1, более предпочтительно от 104 М-1с-1 до 107 М-1с-1, как например от 105 М-1с-1 до 107 М-1с-1;
и/или такие как:
- иммуноглобулиновый одиночный вариабельный домен и/или Нанотело может связываться с RANK-L со значением kof от 1 с-1 (t1/2=0.69 с) до 10-6 с-1 (с получением близкого необратимого комплекса с t1/2 множества дней), предпочтительно от 10-2 с-1 до 10-6 с-1, более предпочтительно от 10-3 с-1 до 10-6 с-1, как, например, от 10-4 с-1 до 10-6 с-1.
Предпочтительно, если (CDR-последовательности, присутствующие в) иммуноглобулиновом одиночном вариабельном домене и/или в Нанотеле, такие, что: моновалентный одиночный вариабельный домен иммуноглобулина и/или Нанотело по изобретению (или полипептид, который содержит только один одиночный вариабельный домен иммуноглобулина или Нанотело по изобретению) предпочтительно такие, что они связываются с RANK-L с аффинностью менее чем 500 нМ, предпочтительно, менее чем 200 нМ, более предпочтительно, менее чем 10 нМ, как, например, менее чем 500 пМ.
Полипептид по изобретению
Одиночные вариабельные домены иммуноглобулина и Нанотела для применения в способе изобретения предпочтительно находятся в по существу изолированной форме, или в виде части полипептида (именуемого в данном документе как «полипептид изобретения»), которые могут включать или фактически состоять из одного или большего количества одиночных вариабельных доменов иммуноглобулина и/или Нанотел, и которые необязательно могут дополнительно включать один или большее количество дополнительных аминокислотных последовательностей (все необязательно связаны через один или большее количество подходящих линкеров). Термин «одиночный вариабельный домен иммуноглобулина» также может охватывать такой полипептид по изобретению. Например, и без ограничения перечисленным, один или большее количество одиночных вариабельных доменов иммуноглобулина и/или Нанотел могут быть использованы в качестве связывающей единицы в таком полипептиде, который необязательно может содержать одну или большее количество дополнительных аминокислотных последовательностей, которые могут служить связующей единицей, с тем, чтобы обеспечить моновалентный, мультивалентный или мультиспецифичный полипептид изобретения, соответственно, все, как описано в данном документе. Такие полипептиды также могут быть по существу в изолированном виде.
В общем, полипептиды, которые включают или фактически состоят из одного одиночного вариабельного домена иммуноглобулина или Нанотела, будут упоминаться в данном документе как «моновалентные» полипептиды или как «моновалентные конструкции». Полипептиды, которые включают или фактически состоят из двух или большего количества одиночных вариабельных доменов иммуноглобулина и/или Нанотел будут упоминаться в данном документе как «мультивалентные» белки или полипептиды, или как «мультивалентные конструкции».
Согласно одному конкретному, но неограничивающему аспекту, полипептид изобретения содержит или фактически состоит, по меньшей мере, из двух одиночных вариабельных доменов иммуноглобулина и/или Нанотел, таких как два или три одиночных вариабельных домена иммуноглобулина и/или Нанотела. Как дополнительно описано в данном документе, такие мультивалентные конструкции могут дать определенные преимущества по сравнению с полипептидом, включающим или фактически состоящим из одного одиночного вариабельного домена иммуноглобулина или Нанотела, такие как значительно улучшенная авидность к RANK-L. Такие мультивалентные конструкции будут очевидны специалистам на основании описания данного документа; некоторые предпочтительные, но неограничивающие, примеры таких мультивалентных конструкций представляют собой конструкции с SEQ ID NO: 625, 631, 637, 640-645, 649, 655, 661, 667, 673, 676-681, 685, 691, 761, 772 и 766, из US 2010/0104568 (бивалентные) и SEQ ID NO: 697, 703, 709, 712-717, 721, 727, и 759 из US 2010/0104568 (тривалентные).
Согласно другому конкретному, но неограничивающему аспекту, полипептид изобретения включает или фактически состоит из, по меньшей мере, одного одиночного вариабельного домена иммуноглобулина и/или Нанотела и, по меньшей мере, одной другой связывающей единицы (т.е. направленный против другого эпитопа, антигена, мишени, белка или полипептида), которая предпочтительно также является одиночным вариабельным доменом иммуноглобулина и/или Нанотелом. Такие полипептиды также упоминаются в данном документе как «мультивалентные полипептиды» или как «мультиспецифичные конструкции», и они могут дать определенные преимущества, по сравнению с соответствующими моновалентными одиночными вариабельными доменами иммуноглобулина и/или Нанотелами (как будет ясно из дальнейшего обсуждения в данном документе некоторых предпочтительных, неограничивающих мультиспецифичных конструкций). Такие мультиспецифичные конструкции будут очевидны специалисту в данной области на основании описания в данном документе; некоторые предпочтительные, но неограничивающие примеры таких мультиспецифичных Нанотел-конструкций представляют собой конструкции SEQ ID NO: 697, 703, 709, 712-717, 721,727, и 759 из US 2010/0104568.
В другом аспекте полипептид изобретения может включать или фактически состоять из одного или нескольких одиночных вариабельных доменов иммуноглобулина и необязательно дополнительно включать одну или несколько других групп, остатков, составляющих или связывающих единиц. Как будет очевидно специалисту из дальнейшего описания данного документа, такие дополнительные группы, остатки, составляющие, связывающие единицы или аминокислотные последовательности могут давать или могут не давать дополнительную функциональность одиночному вариабельному домену иммуноглобулина (и/или полипептиду, в котором он присутствует) и могут модифицировать или могут не модифицировать свойства вариабельного домена иммуноглобулина.
Например, такие дополнительные группы, остатки, составляющие или связывающие единицы, могут быть одним или несколькими дополнительными аминокислотными остатками, так что соединение или конструкция является (химерным) белком или (химерным) полипептидом. В предпочтительном, но неограничивающем аспекте, указанные одна или большее количество групп, остатков, составляющих или связывающих единиц, являются иммуноглобулиновыми последовательностями. Еще более предпочтительно, если указанные одна или большее количество других групп, остатков, составляющих или связывающих единиц, выбираются из группы, состоящей из доменных антител, аминокислотных последовательностей, которые подходят для применения в качестве доменного антитела, однодоменных антител, аминокислотных последовательностей, которые подходят для применения в качестве однодоменного антитела, «dAb», аминокислотных последовательностей, которые подходят для применения в качестве dAb, или Нанотел.
В ином случае такие группы, остатки, составляющие или связывающие единицы могут, например, быть химическими группами, остатками, составляющими, которые могут или не могут сами по себе быть биологически и/или фармакологически активными. Например, и без ограничения, такие группы могут быть связаны с одним или большим количеством полипептидов изобретения с тем чтобы получить «производное» одиночного вариабельного домена иммуноглобулина или полипептида изобретения.
Как дополнительно описано в данном документе, полипептид изобретения может содержать два или большее количество одиночных вариабельных доменов иммуноглобулина, которые направлены против RANK-L. Как правило, такие полипептиды будут связывать RANK-L с повышенной авидностью по сравнению с одним одиночным вариабельным доменом иммуноглобулина. Такой полипептид может, например, включать два одиночных вариабельных доменов иммуноглобулина, которые направлены против одной и той же антигенной детерминанты, эпитопа, части, домена, субъединицы или конформации (где применимо) RANK-L (которая может быть участком взаимодействия или может не быть участком взаимодействия); или включать, по меньшей мере, один «первый» одиночный вариабельный домен иммуноглобулина, который направлен против первой антигенной детерминанты, эпитопа, части, домена, субъединицы или конформации (где применимо) RANK-L (которая может быть участком взаимодействия или может не быть участком взаимодействия); и, по меньшей мере, одного «второго» одиночного вариабельного домена иммуноглобулина, который направлен против второй антигенной детерминанты, эпитопа, части, домена, субъединицы или конформации (где применимо), отличных от первой (и которая опять же может быть участком взаимодействия или может не быть участком взаимодействия). Предпочтительно, в таких «бипаратопных» полипептидах изобретения, по меньшей мере, один иммуноглобулиновый одиночный вариабельный домен направлен против участка взаимодействия (определенного в данном документе), хотя изобретение в его самом широком смысле не ограничено этим. Примеры полипептидов изобретения дополнительно описаны, например, в WO 08/142164.
Таким образом, в одном определенном аспекте, полипептид изобретения может включать два или большее количество одиночных вариабельных доменов иммуноглобулина, которые направлены против участка связывания RANK на RANK-L; или включать, по меньшей мере, один «первый» одиночный вариабельный домен иммуноглобулина, который направлен против участка связывания для RANK на RANK-L; и, по меньшей мере, одного «второй» одиночный вариабельный домен иммуноглобулина, который направлен против второй антигенной детерминанты, эпитопа, части, домена, субъединицы или конформации, отличной от первой, и которая не связывает участок связывания RANK на RANK-L.
Также в рамках изобретения полипептид изобретения может связывать две или три субъединицы RANK-L. В предпочтительном, неограничивающем аспекте, полипептиды изобретения связывают две или три субъединицы тримера RANK-L.
В частности, согласно этому предпочтительному воплощению, изобретение относится к полипептиду, который включает или фактически состоит из двух или большего количества одиночных вариабельных доменов иммуноглобулина и/или Нанотел, каждое из которых направлено против эпитопов на RANK-L (и в частности на тримере RANK-L) которые лежат в и/или образуют часть рецепторного участка(ов) связывания тримера RANK-L, где указанные одиночные вариабельные домен иммуноглобулина и/или Нанотела связаны друг с другом таким образом, что полипептид способен одновременно связывать два или большее количество участков связывания на одном тримере RANK-L (другими словами, способен к внутримолекулярному связыванию, по меньшей мере, двух сайтов связывания рецептора на тримере RANK-L). В этом воплощении две или большее количество одиночных вариабельных доменов иммуноглобулина и/или Нанотел предпочтительно являются теми, что определены выше, и наиболее предпочтительно являются Нанотелами (так что полипептид является мультивалентной конструкцией из Нанотел). Также в этом воплощении, два или большее количество одиночных вариабельных доменов иммуноглобулина и/или Нанотел могут быть одинаковыми или различными; и могут быть направлены против различных эпитопов в пределах сайта(ов) связывания рецептора на RANK, но предпочтительно направлены против одного и того же эпитопа. Некоторые предпочтительные, но неограничивающие конструкции этого воплощения изобретения представляют собой SEQ ID NO: 625, 631, 637, 640-645, 649, 655, 661, 667, 673, 676-681, 685, 691, 697, 703, 709, 712-717, 721, 727, 759, 761, 772 и 766 из US 2010/0104568.
В соединениях или конструкциях, описанных выше, один или несколько одиночных вариабельных доменов иммуноглобулина и одна или большее количество групп, остатков, составляющих или связывающих единиц, могут быть соединены напрямую друг с другом и/или через один или большее количество подходящих линкеров или спейсеров. Например, если одна или несколько групп, остатков, составляющих или связывающих единиц являются аминокислотными последовательностями, линкеры также могут быть аминокислотными последовательностями, так что полученное в результате соединение или конструкция является (химерным) белком или (химерным) полипептидом.
В конкретном воплощении изобретения, два или большее количество одиночных вариабельных доменов иммуноглобулина и/или Нанотел будут, как правило, связаны через один или несколько линкеров, где линкеры таковы, что каждый одиночный вариабельный домен иммуноглобулина и/или Нанотело могут связывать различные сайты связывания с рецептором на одном и том же тримере RANK-L. Подходящие линкеры будут, помимо прочего, зависеть от (дистанции между) эпитопами на тримере RANK-L, с которым связываются одиночные вариабельные домены иммуноглобулина, и будут очевидны специалисту на основании описания данного документа, необязательно после проведения немногочисленных рутинных экспериментов. Например, если два или большее количество одиночных вариабельных домена иммуноглобулина являются (одно)доменными антителами или Нанотелами, подходящие линкеры могут быть выбраны из линкеров, описанных в данном документе, при этом длина линкера такова, что два или большее количество (одно)доменных антител или Нанотел могут каждое связываться с различными сайтами связывания рецептора на одном и том же тримере RANK-L.
Более предпочтительно, в этом предпочтительном аспекте, если линкер или спейсер является аминокислотной последовательностью, которая предпочтительно имеет длину от 1 вплоть до 50 или большего количества аминокислот, более предпочтительно от 5 до 30 аминокислот, например, от 9 до 20 аминокислот. В одном предпочтительно, но неограничивающем воплощении, линкер фактически состоит из остатков глицина и серина (что дополнительно будет описано ниже). Например, один подходящий линкер является GS9-nmncepoM, описанным в US 2010/0104568, который содержит 9 аминокислотных остатков, GS15-линкером, описанным в US 2010/0104568, который содержит 15 аминокислотных остатков, GS20-линкером, описанным в US 2010/0104568, который содержит 20 аминокислотных остатков и GS30-линкером, описанным в US 2010/0104568, который содержит 30 аминокислотных остатков, или любым другим линкером, известным в данной области, таким как, например, изображенные в таблице A-1.

В другом воплощении, по меньшей мере, два одиночных вариабельных домена иммуноглобулина и/или Нанотела против RANK-L связаны друг с другом через другую составляющую (необязательно через один или два линкера), таких как другой белок или полипептид. В этом воплощении, ожидаемо иметь предпочтительную дистанцию (т.е. как упомянуто выше) между N-концом и С-концом, по меньшей мере, двух анти-RANKL одиночных вариабельных доменов иммуноглобулина и/или Нанотел, например, так что белок или полипептид могут все еще подвергаться внутримолекулярному связыванию (как описано в данном документе) с тримером RANK-L. В этом воплощении, по меньшей мере, два одиночных вариабельных домена иммуноглобулина и/или Нанотела могут быть связаны напрямую с другой составляющей, или с помощью подходящего линкера или спейсера, более того, при условии, что предпочтительная дистанция и/или искомое внутримолекулярное связывание все еще могут быть достигнуты. Свойство может быть любым подходящим свойством, которое не уменьшает (слишком сильно) связывание полипептида с RANK-L и/или дополнительные искомые биологические или фармакологические свойства полипептида. Таким образом, составляющая может быть фактически неактивной или может быть биологически активной, и, таким образом, может улучшать или не улучшать искомые свойства полипептида и/или может придавать одно или несколько дополнительных искомых свойств полипептиду. Например, и без ограничения перечисленным, составляющая может улучшать период полужизни полипептида, и/или может снижать его иммуногенность или улучшать любое другое искомое свойство. В одном предпочтительном воплощении, составляющая может быть другими одиночными вариабельными доменами иммуноглобулина и/или Нанотелом (включая, без ограничения перечисленным, третьи одиночные вариабельные домены иммуноглобулина и/или Нанотела против RANK-L, хотя это не является необходимым и, как правило, менее предпочтительно), и в частности, другими одиночными вариабельными доменами иммуноглобулина и/или Нанотелами, которые улучшают период полужизни полипептида, такие как одиночные вариабельные домены иммуноглобулина и/или Нанотела, которые направлены против сывороточного белка, например, против человеческого сывороточного альбумина. Некоторые неограничивающие примеры таких конструкций являются конструкциями с SEQ ID NO: 697, 703, 709, 712-717, 721, 717 и 759 из US 2010/0104568.
В одном специфическом аспекте изобретения полипептид может иметь увеличенный период полужизни по сравнению с соответствующим полипептидом изобретения. Некоторые предпочтительные, но неограничивающие примеры таких полипептидов станут очевидны специалистам на основании дальнейшего описания в данном документе, и, например, включают полипептиды изобретения, которые были химически модифицированы для увеличения их периода полужизни (например, посредством ПЕГилирования); полипептиды изобретения, которые включают, по меньшей мере, один дополнительный участок связывания для связывания сывороточного белка (такого как сывороточный альбумин); или полипептидов изобретения, которые включают, по меньшей мере, один одиночный вариабельный домен иммуноглобулина, который связан, по меньшей мере, с одной составляющей (и в частности, по меньшей мере, одной аминокислотной последовательностью), которая повышает период полужизни одиночного вариабельного домена иммуноглобулина по изобретению. Примеры полипептидов изобретения, которые включают такие увеличивающие период полужизни составляющие, будут очевидны специалистам на основании дальнейшего описания в данном документе; и, например, включают, без ограничения перечисленным, полипептиды, в которых один или несколько одиночных вариабельных доменов иммуноглобулина подходящим образом связаны с одним или несколькими сывороточными белками или их фрагментами (такими как (человеческий) сывороточный альбумин или его подходящие фрагменты) или с одним или несколькими связывающими единицами, которые могут связывать сывороточные белки (такие как, например, доменные антитела, аминокислотные последовательности, которые подходят для применения в качестве доменных антител, однодоменные антитела, аминокислотные последовательности, которые подходят для применения в качестве однодоменных антител, «dAb», аминокислотные последовательности, которые подходят для применения в качестве dAb, или Нанотела, которые могут связывать сывороточные белки, такие как сывороточный альбумин (такие как человеческий сывороточный альбумин), сывороточные иммуноглобулины, такие как IgG, или трансферрин; см. дальнейшее описание и ссылки, упомянутые в данном документе); полипептиды, в которых одиночный вариабельный домен иммуноглобулина связан с Fc-частью (такой как человеческий Fc) или его подходящей частью или фрагментом; или полипептиды, в которых один или несколько одиночных вариабельных доменов иммуноглобулина подходят для связи с одним или несколькими малыми белками или полипептидами, которые могут связывать сывороточные белки (такие как, без ограничения перечисленным, белки или пептиды, описанные в WO 91/01743, WO 01/45746, WO 02/076489. Также дается ссылка на dAb, описанные в WO 03/002609 и WO 04/003019 и в Harmsen et al. (Vaccine 23: 4926-42, 2005); to EP 0368684, as well as to WO 08/028977, WO 08/043821, WO 08/043822 от Ablynx N.V. и WO 08/068280.
В общем, одиночные вариабельные домены иммуноглобулина и/или Нанотела, используемые в способе изобретения (или включающие их соединения, конструкции или полипептиды) с увеличенным периодом полужизни, предпочтительно имеют период полужизни, который, по меньшей мере, в 1,5 раза, предпочтительно, по меньшей мере, в 2 раза, например, по меньшей мере, в 5 раз, например, по меньшей мере, в 10 раз или больше, чем в 20 раз, длительней, чем период полужизни соответствующих одиночных вариабельных доменов иммуноглобулина и/или Нанотел самих по себе. Например, одиночные вариабельные домены иммуноглобулина и/или Нанотела, соединения, конструкции или полипептиды, используемые в способе изобретения, могут иметь период полужизни, который повышен более чем на 1 час, предпочтительно, более чем на 2 часа, более предпочтительно, более чем на 6 часов, например, более чем на 12 часов, или более чем на 24, 48 или 72 часа, по сравнению с соответствующим одиночным вариабельным доменом иммуноглобулинов и/или Нанотелом самим по себе.
В предпочтительном, но неограничивающем аспекте изобретения, такие одиночные вариабельные домены иммуноглобулина и/или Нанотела, соединения, конструкции или полипептиды, используемые в способе изобретения, демонстрируют период полужизни в сыворотке человека, по меньшей мере, около 12 часов, предпочтительно, по меньшей мере, 24 часа, более предпочтительно, по меньшей мере, 48 часов, еще более предпочтительно, по меньшей мере, 72 часа или более. Например, соединения или полипептиды, используемые в способе изобретения, могут иметь период полужизни, по меньшей мере, 5 дней (например, около 5-10 дней), предпочтительно, по меньшей мере, 9 дней (например, около 9-14 дней), более предпочтительно, по меньшей мере, 10 дней (например, около 10-15 дней), или, по меньшей мере, около 11 дней (например, около 11-16 дней), более предпочтительно, по меньшей мере, около 12 дней (например, около 12-18 дней или больше), или больше чем 14 дней (например, около 14-19 дней).
Предпочтительный полипептид изобретения включает один или несколько одиночных вариабельных доменов иммуноглобулина против RANK-L, например, в соответствии с SEQ ID NO: 4-11, в частности с SEQ ID NO: 10, в комбинации, по меньшей мере, с одним связывающим доменом или пептидом, подходящим для увеличения периода полужизни в сыворотке (предпочтительно T1/2β) конструкции. В этих конструкциях, «домен или пептид, связывающий сывороточный альбумин» может быть любым подходящим пептидом или доменом, связывающим сывороточный альбумин, способный увеличить период полужизни (предпочтительно T1/2β) конструкции (по сравнению с такой же конструкцией без пептида или домена, связывающего сывороточный альбумин). В частности, полипептидная последовательность, подходящая для увеличения периода полужизни сывороточного альбумина является полипептидной последовательностью, способной связывать сывороточный альбумин с большим периодом полужизни в сыворотке, таким как сывороточный альбумин, трансферрин, IgG и т.п., в частности, сывороточный альбумин. Полипептидные последовательности, способные связывать сывороточный альбумин, уже были описаны и могут быть, в частности, пептидами, связывающими сывороточный альбумин, раскрытыми в WO 08/068280 заявителем (и в частности WO 09/127691 и WO 2011/095545, оба от заявителя), или одиночными вариабельными доменами иммуноглобулина, связывающими сывороточный альбумин (такими как Нанотело, связывающее сывороточный альбумин; например, A1b-1 или гуманизированная версия A1b-1 такая как A1b-8, ссылкой для которых являются, например, WO 06/122787 и таблица A-2).

Предпочтительные одиночные вариабельные домены иммуноглобулина, которые связывают сывороточный альбумин, включают SEQ ID NO: 13-15. В некоторых воплощениях, одиночный вариабельный домен иммуноглобулина включает или состоит из SEQ ID NO: 14 (SEQ ID NO: 791 из US 2010/0104568).
Таким образом, в одном воплощении, изобретение относится к мультивалентной мультиспецифичной конструкции, содержащей два или большее количество одиночных вариабельных доменов иммуноглобулина и/или Нанотел, каждое из которых направлено против эпитопов на RANK-L (например, на тримере RANK-L), которые лежат в и/или образуют часть сайта связывания рецептора, и которые связаны друг с другом, по меньшей мере, через одиночный вариабельный домен иммуноглобулина и/или Нанотело, которые обеспечивают увеличенный период полужизни (и необязательно через один или большее количество подходящих линкеров), так что указанный полипептид, при связывании с тримером RANK-L, способен ингибировать и снижать связывание рецептора RANK и/или передачу сигнала, который опосредуется указанным тримером RANK-L. Такой полипептид может быть таким, что каждый из указанных двух или нескольких одиночных вариабельных доменов иммуноглобулина и/или Нанотел может связаться с различными сайтами связывания рецептора на тримере RANK-L.
В частности, в этом воплощении, полипептид может содержать тривалентное биспецифическое Нанотело, которое содержит два Нанотела, каждое из которых направлено против эпитопов на RANK-L (и в частности, на тримере RANK-L), которые находятся в пределах и/или образуют часть сайта связывания рецептора, в котором указанные Нанотела связаны друг с другом через третье Нанотело, которое обеспечивает увеличенный период полужизни (например, Нанотело, которое направлено на сывороточный белок, такой как сывороточный альбумин человека), в котором каждое из впервые упомянутых двух Нанотел могут напрямую связаться с указанным третьим Нанотелом или через один или через несколько подходящих линкеров, так что указанный полипептид, при связывании с тримером RANK-L, способен ингибировать и снижать связывание рецептора RANK и/или передачу сигнала, который опосредуется указанным тримером RANK-L. Такой полипептид может быть таким, что каждое из указанных впервые упомянутых двух наноантител могли связывать различные сайты связывания с рецептором на тримере RANK-L. С другой стороны, особенно предпочтительное Нанотело используемое в данном воплощении изобретения представлено в SEQ ID NO: 4 (SEQ ID NO: 572 из US 2010/0104568), а также его гуманизированный или иной вариант (такие как, например, SEQ ID NO: 10 (SEQ ID NO: 755 из US 2010/0104568)); и Нанотела, направленные против человеческого сывороточного альбумина, описанные в данном документе. Предпочтительной, но не ограничивающей конструкцией согласно этому воплощению изобретения является SEQ ID NO: 12 (SEQ ID NO: 759 из US 2010/0104568).
Другие полипептиды согласно этому предпочтительному аспекту изобретения могут, например, быть выбраны из группы, состоящей из полипептидов, которые имеют более чем 80%, предпочтительно более чем 90%, более предпочтительно более чем 95%, например, 99% или большую «идентичность последовательности» (как определено в данном документе), с полипептидом SEQ ID NO: 12 (SEQ ID NO: 759 из US 2010/0104568), где Нанотела включены в указанные полипептиды предпочтительно как определено в данном документе далее.
Полипептиды (изобретения) вводимые в способе изобретения, т.е., которые специфически связывают RANKL, в некоторых воплощениях имеют кажущееся значение KD связывания с рекомбинантным растворимым RANKL (sRANKL), определенное в анализе «Biacore», равное 0,005-0,1 нМ, например, 0,005-0,05 нМ, 0,01-0,1 нМ, 0,01-0,05 нМ, включая значения в концах диапазонов, такие как 0,005 нМ, 0,006 нМ, 0,007 нМ, 0,008 нМ, 0,009 нМ, 0,01 нМ, 0,011 нМ, 0,012 нМ, 0,013 нМ, 0,014 нМ, 0,015 нМ, 0,016 нМ, 0,017 нМ, 0,018 нМ, 0,019 нМ, 0,02 нМ, 0,021 нМ, 0,022 нМ, 0,023 нМ, 0,024 нМ, 0,025 нМ, 0,026 нМ, 0,027 нМ, 0,028 нМ, 0,029 нМ, 0,03 нМ, 0,031 нМ, 0,032 нМ, 0,033 нМ, 0,034 нМ, 0,035 нМ, 0,036 нМ, 0,037 нМ, 0,038 нМ, 0,039 нМ, 0,04 нМ, 0,041 нМ, 0,042 нМ, 0,043 нМ, 0,044 нМ, 0,045 нМ, 0,046 нМ, 0,047 нМ, 0,048 нМ, 0,049 нМ, 0,05 нМ, 0,06 нМ, 0,07 нМ, 0,08 нМ, 0,09 нМ или 0,1 нМ, а предпочтительно около 0,04 нМ.
Значения EC50 связывания Нанотел изобретения (и полипептидов, включающих их) с RANK-L, например, в тИФА или FACS составляет предпочтительно от 1 μМ до 1 пМ, более предпочтительно от 1 нМ до 1 пМ, и более предпочтительно от 100 пМ до 1 пМ. Значения IC50 для связывания Нанотел изобретения (и полипептидов, включающих их) с RANK-L, например, в «AlphaScreen®», «NF-kappaB assay» или «TRAP assay» составляет предпочтительно от 1 μМ до 1 пМ, более предпочтительно от 1 нМ до 1 пМ, и более предпочтительно от 100 пМ до 1 пМ (как описано в WO 2008/142164).
В другом аспекте настоящего изобретения полипептиды изобретения, предпочтительно направлены против эпитопа на RANK-L, который перекрывается с эпитопом денозумаба или эпитопом SEQ ID NO: 755 из US 2010/0104568. Связывание аминокислотных последовательностей и полипептидов изобретения с эпитопом на RANK-L, который перекрывается с эпитопом денозумаба или эпитопом SEQ ID NO: 755 of US 2010/0104568 может ингибировать и/или предотвращать связывание денозумаба или SEQ ID NO: 755 из US 2010/0104568 с RANK-L. Полипептиды изобретения, следовательно, могут действовать как конкурирующий или как неконкурирующий ингибитор связывания денозумаба или SEQ ID NO: 755 of US 2010/0104568 с RANK-L (например, в тИФА, в «AlphaScreen® assay», в «TRAP assay» и/или в «NFkappaB assay»).
Дополнительные воплощения полипептидов, которые применимы в способах, описанных в данном документе, описаны в WO 08/142164, US 2010/0104568 A1 и US 2011/0002929 A1.
Хотя применение одиночных вариабельных доменов иммуноглобулина, и, в частности, Нанотел, определенных в данном документе и полипептидов изобретения является наиболее предпочтительным, ясно, что на основании описания в данном документе, специалист также способен разработать и/или получить, в аналогичной манере другие полипептиды и, в частности, (одно) доменные антитела против RANK-L, а также полипептиды, содержащие такие (одно)доменные антитела, которые могут быть использованы в способах изобретения.
Например, для специалистов будет ясно, что возможно «привить» один или несколько CDR, упомянутых выше в отношении Нанотел, в такие (одно)доменные антитела или другие белковые каркасы, включая, без ограничения, человеческие каркасы или неиммуноглобулиновые каркасы. Подходящие каркасы и методы для такого прививания CDR ясны для специалиста и хорошо известны в данной области, см. Например, US 7,180,370, WO 01/27160, EP 0605522, EP 0460167, US 7,054,297, Nicaise et al. (2004, Protein Science 13: 1882-1891), Ewert et al. (2004, Methods 34 (2): 184-199), Kettleborough et al. (1991, Protein Eng. 4 (7): 773-783), O'Brien and Jones (2003, Methods Mol. Biol. 207: 81-100), Skerra J. (2000 Mol. Recognit. 13: 167-187), and Saerens et al. (2005, J. Mol. Biol. 352 (3): 597-607), и дополнительные ссылки, процитированные в данных документах. Например, методы, известные per se, для прививания мышиных или крысиных CDR в человеческие остовы или каркасы, могут быть также для получения химерных белков, содержащих один или несколько CDR Нанотел, описанных в данном документе, и одну или несколько человеческих каркасных участков или последовательностей.
В общем, в этом аспекте изобретения, полипептиды, использованные в способе изобретения, могут быть любым полипептидом, который содержит, по меньшей мере, один участок аминокислотных остатков, в котором указанный участок аминокислотных остатков имеет аминокислотную последовательность, которая соответствует последовательности, по меньшей мере, одной из CDR-последовательностей, описанных в данном документе. Такой полипептид может иметь или может не иметь характерную для иммуноглобулинов укладку цепи. Например, и без ограничений, такой полипептид может быть подходящим фрагментом иммуноглобулиновой последовательности, которая содержит, по меньшей мере, одну такую CDR-последовательность, но которая не достаточно большая, чтобы образовать (полную) укладку цепи иммуноглобулинов (ссылка снова сделана, например, на «фрагменты Экспедит», описанные в WO 03/050531). В ином случае, такой полипептид может быть подходящим «белковым каркасом», который содержит, по меньшей мере, один участок аминокислотных остатков, который соответствует такой CDR-последовательности (т.е. как часть его антигенсвязывающего сайта). Подходящие каркасы для презентирования аминокислотных последовательностей будут ясны специалистам в данной области, и, например, содержат, без ограничения, связывающие каркасы, основанные на или полученные из иммуноглобулинов (т.е. отличные от иммуноглобулиновых последовательностей, уже описанных в данном документе), белковые каркасы, полученные из доменов белка A (такие как «Affibodies™»), тендамистат, фибронектин, липокалин, CTLA-4, T-клеточные рецепторы, сконструированные анкириновые повторы, авимеры, и PDZ-домены (Binz et al. 2005, Nat. Biotech, 23: 1257), и связывающие составляющие, основанные на ДНК или РНК, включая, без ограничения перечисленным, ДНК- или РНК-аптамеры (Ulrich et al. 2006, Comb. Chem. High Throughput Screen 9 (8): 619-32).
Одиночные вариабельные домены иммуноглобулинов, Нанотела, полипептиды и нуклеиновые кислоты, использованные в способе изобретения, могут быть получены способом, известным per se, что ясно специалисту в данной области из дальнейшего описания. Например, одиночные вариабельные домены иммуноглобулина, Нанотела и полипептиды изобретения могут быть получены любым способом, известным per se, для получения антител и в частности, для получения фрагментов антител (включая, без ограничения перечисленным, (одно)доменные антитела и ScFv-фрагменты). Некоторые предпочтительные, но не ограничивающие способы получения одиночных вариабельных доменов иммуноглобулина, Нанотел, полипептидов и нуклеиновых кислот включают способы и методы, описанные в данном документе.
Как будет ясно специалисту, некий особенной пригодный способ получения одиночных вариабельных доменов иммуноглобулина, Нанотела и/или полипептида изобретения в целом включает стадии:
i) экспрессии, в подходящей клетке-хозяине или организме-хозяине (также называемом в данном документе «хозяином по изобретению») или в другой подходящей системе экспрессии, нуклеиновой кислоты, которая кодирует указанные одиночные вариабельные домены иммуноглобулинов, Нанотело или полипептид по изобретению, необязательно с последующим:
ii) выделением и/или очисткой иммуноглобулиновых одиночных вариабельных доменов, Нанотела или полипептида по изобретению, полученных таким образом.
В частности, такой способ может включать стадии:
i) культивирования и/или поддержания хозяина в условиях, которые таковы, что в них указанных хозяин экспрессирует и/или продуцирует, по меньшей мере, один одиночный вариабельный домен иммуноглобулина, Нанотело и/или полипептид по изобретению; необязательно с последующим:
ii) выделением и/или очисткой одиночных вариабельных доменов иммуноглобулина, Нанотела или полипептида по изобретению, полученных таким образом.
Согласно одному предпочтительному, но неограничивающему воплощению, полипептид изобретения продуцируется в клетке бактерии, в частности в такой клетке бактерии, которая подходит для крупномасштабного фармацевтического производства. Согласно другому, предпочтительному, но не ограничивающему воплощению, полипептид изобретения вырабатывается в клетке дрожжей, в частности такой клетке дрожжей, которая подходит для крупномасштабного фармацевтического производства. Согласно еще одному предпочтительному, но неограничивающему воплощению, полипептид изобретения вырабатывается в клетке млекопитающего, в частности в клетке человека или в линии клеток человека, а более предпочтительно в клетке человека или в клетках из линии клеток человека, которая подходит для крупномасштабного фармацевтического производства.
Для производства в промышленном масштабе, предпочтительные гетерологичные хозяева для (промышленной) выработки Нанотел или содержащих Нанотела белковых терапевтических средств включают штаммы Е.coli, Pichia pastoris, S.cerevisiae, которые подходят для крупномасштабной экспрессии/производства/ферментации, и в частности для крупномасштабной фармацевтической экспрессии/производства/ферментации. Подходящие примеры таких штаммов будут ясны специалисту.
В ином случае, для крупномасштабной экспрессии/производства/ферментации, и в частности для крупномасштабной фармацевтической экспрессии/производства/ферментации могут быть использованы клеточные линии млекопитающих, особенно клетки яичника китайского хомяка (CHO).
В дальнейшем полипептид изобретения может быть выделен из клетки-хозяина/организма/хозяина и/или из среды, в которой указанные клетка-хозяин или организм-хозяин культивировались, методами выделения и/или очистки белков известных per se, таких как методы (препаративной) хроматографии и/или электрофореза, методы дифференциальной преципитации, метода основанные на аффинности (например, с помощью специфической, расщепляемой аминокислотной последовательности, объединенной с полипептидом изобретения) и/или препаративными иммунологическими методами (например, с помощью антител против выделяемой аминокислотной последовательности).
В общем, для фармацевтического применения, полипептиды изобретения могут быть приготовлены в виде фармацевтического препарата или композиции, содержащей, по меньшей мере, один полипептид по изобретению и, по меньшей мере, один фармацевтически приемлемый носитель, разбавитель или наполнитель и/или адъювант, и необязательно один или несколько дополнительный фармацевтически активных полипептидов и/или соединений.
Таким образом, в дополнительном аспекте, изобретение относится к фармацевтической композиции, которая содержит, по меньшей мере, один полипептид изобретения и, по меньшей мере, один подходящий носитель, разбавитель или наполнитель (т.е. подходящий для фармацевтического применения) и необязательно один или большее количество дополнительных активных веществ, которые затем вводятся субъекту (например, человеку, такому как пациент с остеопорозом, например, женщине в постменопаузе) ингибирует резорбцию кости и/или активность остеокластов в течение длительных периодов времени и/или является эффективным при изменении одного или большего количества маркеров метаболизма кости и/или гомеостаза кости, например, для снижения сывороточного уровня перекрестно-связанного телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, более предпочтительно, по меньшей мере, на 55%, более предпочтительно, по меньшей мере, на 60%, более предпочтительно, по меньшей мере, на 65%, более предпочтительно, по меньшей мере, на 70%, например, по меньшей мере, 75%, или даже, по меньшей мере, 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения, например от 30 дней до 3 месяцев, от 3 месяцев до 6 месяцев, или от 6 месяцев до 1 года.
В целом полипептиды изобретения могут быть приготовлены и введены любым подходящим способом, известным per se, для чего дается ссылка, например, на общий предшествующий уровень техники, процитированный выше (и в частности на WO 04/041862, WO 04/041863, WO 04/041865, WO 04/041867, WO 08/020079 и WO 2011/026945) а также на стандартные руководства, такие как Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing Company, USA (1990) или Remington, the Science and Practice of Pharmacy, 21st Edition, Lippincott Williams and Wilkins (2005); или the Handbook of Therapeutic Antibodies (S. Dubel, Ed.), Wiley, Weinheim, 2007 (см. Например, страницы 252-255).
Например, полипептиды изобретения могут быть приготовлены и введены любым способом, известным per se, для обычных антител или фрагментов антител (включая scFv и диатела) и другие фармацевтически активные белки. Такие составы и способы для приготовления того же будут ясны специалисту, и, например, включают препараты, подходящие для парентерального введения (например, внутривенного, интраперитонеального, подкожного внутримышечного, внутрипросветного, внутриартериального или интратекального введения).
Препараты для парентерального введения могут быть, например, стерильными растворами, суспензиями, дисперсиями или эмульсиями, которые подходят для инфузии или инъекции. Подходящие носители или разбавители для таких препаратов, например, включают, без ограничения, стерильную воду и водные буферы и растворы, такие как физиологический фосфатно-солевой буферный раствор, растворы Рингера, раствор декстрозы, и раствор Хэнка; масла с водой; глицерин; этанол, гликоли, такие как полипропиленгликоль, или также минеральные масла, животные жиры и растительные масла, например, арахисовое масло, соевое масло, а также их подходящие смеси. Как правило, водные растворы или суспензии будут предпочтительными.
Полипептиды изобретения также могут быть введены подкожно, внутривенно или внутрибрюшинно инфузией или инъекцией. Растворы полипептидов изобретения или их соли могут быть приготовлены в воде, необязательно смешаны с нетоксичным поверхностно-активным веществом и/или одним или несколькими буферными компонентами. Дисперсии также могут быть приготовлены в глицерине, жидких полиэтиленгликолях, триацетине, и их смесях, и в маслах. В обычных условиях хранения и применения эти препараты могут содержать консервант для предотвращения роста микроорганизмов.
Фармацевтические лекарственные формы, подходящие для инъекции или инфузии, могут включать стерильные водные растворы, или стерильные порошки, включающие активный ингредиент, который адаптирован для немедленного приготовления стерильных инъецируемых или инфузируемых растворов или дисперсий, необязательно инкапсулированных в липосомы. Во всех случаях, окончательная лекарственная форма должна быть стерильной, жидкой, и стабильной в условиях производства и хранения. Жидкий носитель или наполнитель может быть растворителем или жидкой дисперсионной средой, включающей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкие полиэтиленгликоли, и т.п.) растительные масла, нетоксичные сложные эфиры глицерина и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, получением липосом, поддержанием требуемого размера частиц в случае дисперсий или путем применения поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть обусловлено различными антибактериальными и противогрибковыми агентами, например, парабенами, хлоробутанолом, фенолом, сорбиновой кислотой, тимеросалом, и т.п. Во многих случаях предпочтительно будет включить изотонические агенты, например, сахара, буферы или хлорид натрия. Пролонгированное поглощение инъецируемых композиций может обусловлено применением в композициях агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Изобретение, однако, также охватывает продукты, получаемые дополнительным процессированием жидкого состава, например, в замороженный, лиофилизированный или высушенный распылением продукт. При восстановлении эти твердые продукты могут становиться жидкими составами, как описано в данном документе (но без ограничения перечисленным). В наиболее широком смысле, следовательно, термин «состав» охватывает как жидкие, так и твердые составы. Однако твердые составы понимаются как полученные из жидких составов (например, путем замораживания, лиофилизации или распылительной сушки), и поэтому имеют характеристики, которые определяются признаками, указанными в данном документе для жидких составов. Изобретение не исключает восстановление, которое приводит к композиции, которая отклоняется от оригинальной композиции, например, перед лиофилизацией или распылительной сушкой.
Стерильные инъецируемые растворы готовят путем включения полипептидов изобретения в требуемом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, как требуется, с последующей стерилизацией фильтрованием. В случае стерильных порошков, для приготовления стерильных инъецируемых растворов, предпочтительными способами приготовления являются методы вакуумной сушки и лиофилизации, которые дают порошок активного ингредиента плюс дополнительный искомый ингредиент, присутствующий в предшествующих растворах, стерилизованных фильтрованием.
Предпочтительный состав для парентерального введения полипептидов, иммуноглобулиновых одиночных вариабельных доменов и/или Нанотел, описанных в данном документе, описан в WO 2011/026945.
В общем, концентрация полипептидов изобретения в жидкой композиции, такой как инъецируемый или инфузируемый состав, или лосьон, будет составлять от около 0,1-25 масс %, предпочтительно от около 0,5-10 масс %, хотя количества не ограничены этими диапазонами могут быть выше или ниже массовых процентов, в зависимости от необходимости более высокой или более низкой доз, которые могут быть введены в подходящем объеме. Концентрация в полужидкой или полутвердой композиции, такой как гель или порошок, будет около 0,1-5 масс.%, предпочтительно около 0,5-2, масс.%.
Как продемонстрировано в данном документе в рабочих примерах, были использованы концентрации 0,5 мг/мл, 2,17 мг/мл, 6,5 мг/мл, 21,7 мг/мл и 65 мг/мл. Ожидается, что другие концентрации, имеющие значения между этими концентрациями (и также вне этих значений, т.е. выше или ниже этих значений), таким образом, также могут быть использованы. Например, могут быть использованы концентрации 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 или 70 мг/кг.
Для получения неожиданного пролонгированного и устойчивого эффектов, описанных в данном документе, полипептид изобретения вводят в количестве от около 0,003 мг/кг до около 10 мг/кг. Примерные диапазоны доз (с учетом значений на концах каждого диапазона) включают 0,003-10 мг/кг, например 0,003-3 мг/кг, 0,003-1 мг/кг, 0,003-0,3 мг/кг, 0,003-0,1 мг/кг, 0,003-0,03 мг/кг, 0,003-0,01 мг/кг, 0,01-10 мг/кг, 0,01-3 мг/кг, 0,01-1 мг/кг, 0,01-0,3 мг/кг, 0,01 -0,1 мг/кг, 0,01-0,03 мг/кг, 0,03-10 мг/кг, 0,03-3 мг/кг, 0,03-1 мг/кг, 0,03-0,3 мг/кг, 0,03-0,1 мг/кг, 0,1-10 мг/кг, 0,1-3 мг/кг, 0,1-1 мг/кг, 0,1-0,3 мг/кг, 0,3-10 мг/кг, 0,3-3 мг/кг, 0,3-1 мг/кг, 1-10 мг/кг, 1-3 мг/кг, и 3-10 мг/кг. Примерные дозы включают 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мг/кг.
Необходимые модификации в данных диапазонах дозировок могут быть определены любым специалистом в данной области путем проведения рутинных экспериментов, описанных в данном документе. См. Remington's Pharmaceutical Sciences (Martin, E.W., ed. 4), Mack Publishing Co., Easton, PA. Дозировка также может быть скорректирована лечащим врачом в случае любого осложнения.
Терапевтические применения
Изобретение, таким образом, относится к способу приготовления и/или лечения, по меньшей мере, одного костного заболевания и/или нарушения, где указанный способ включает введение субъекту, нуждающемуся в этом, фармацевтически активного количества полипептида изобретения, и/или содержащей его фармацевтической композиции. Более конкретно, изобретение относится к полипептидам, описанным в данном документе, для применения при лечении костных заболеваний и/или нарушений.
Способы и режимы дозирования по настоящему изобретению могут быть использованы для профилактики и лечения костных заболеваний и/или нарушений. В контексте настоящего изобретения, термин «предотвращение и/или лечение» включает не только предотвращение и/или лечение заболевания, но также, в общем, включает предотвращение возникновения заболевания, замедление или обращение прогресса заболевание, предотвращение или замедление возникновения одного или нескольких симптомов, ассоциированных с заболеванием, снижение и/или облегчение одного или нескольких симптомов, ассоциированных с заболеванием, снижение тяжести и/или длительности заболевания и/или любых симптомов, ассоциированных с ними, предотвращение, снижение или обращение любого физиологического поражения, вызванного заболеванием, и, в общем, любое фармакологическое действие, которое приносит пользу подвергаемому лечению пациенту.
Изобретение относится к способу предотвращения и/или лечения, по меньшей мере, одного заболевания и/или нарушения, которое ассоциировано с RANK-L, с его биологической или фармакологической активностью, и/или с биологическими путями, или сигнальными путями, в которые вовлечен RANK-L, указанный способ включает введение нуждающемуся в этом субъекту, фармацевтически активного количества полипептида изобретения, и/или фармацевтической композиции, включающей его. В частности, изобретение относится к способу предотвращения и/или лечения, по меньшей мере, одного заболевания и/или нарушения, которое может быть подвергнуто лечению модуляцией RANK-L, его биологической или фармакологической активности, и/или биологических путей или сигнальных путей, в которые вовлечен RANK-L, указанный способ включает введение нуждающемуся в этом субъекту, фармацевтически активного количества полипептида изобретения, и/или фармацевтической композиции, включающей его. В частности, указанное фармацевтически эффективное количество может быть количеством, которое эффективно при изменении одного или нескольких маркеров метаболизма кости и/или гомеостаза кости, как например:
- для снижения сывороточных уровней перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, более предпочтительно, по меньшей мере, на 55%, более предпочтительно, по меньшей мере, на 60%, более предпочтительно, по меньшей мере, на 65%, более предпочтительно, по меньшей мере, на 10%, более предпочтительно, по меньшей мере, на 75%, более предпочтительно, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения;
- для снижения уровней N-концевого телопептида коллагена 1 типа (NTX-1), определенных как соотношение NTX-1 к креатинину в моче, по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, более предпочтительно, по меньшей мере, на 55%, более предпочтительно, по меньшей мере, на 60%, более предпочтительно, по меньшей мере, на 65%, более предпочтительно, по меньшей мере, на 70%, более предпочтительно, по меньшей мере, на 75%, более предпочтительно, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения;
- для снижения сывороточных уровней тартрат-устойчивой кислой фосфатазы изоформы 5b (TRACP5b), по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, более предпочтительно, по меньшей мере, на 55%, более предпочтительно, по меньшей мере, на 60%, более предпочтительно, по меньшей мере, на 65%, более предпочтительно, по меньшей мере, на 70%, более предпочтительно, по меньшей мере, на 15%, более предпочтительно, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения;
- для снижения сывороточных уровней N-концевого пропептида коллагена 1 типа (P1NP), по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 35%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 45%, более предпочтительно, по меньшей мере, на 50%, более предпочтительно, по меньшей мере, на 55%, более предпочтительно, по меньшей мере, на 60%, более предпочтительно, по меньшей мере, на 65%, более предпочтительно, по меньшей мере, на 70%, более предпочтительно, по меньшей мере, на 75%, более предпочтительно, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30 дней после введения;
Подвергаемый обработке субъект может быть человеком. Как будет ясно специалисту, субъект, подвергаемый лечению, будет в частности персоной, страдающей от, или имеющей риск возникновения заболевания и/или нарушения, упомянутых в данном документе. Например, субъект может быть персоной, страдающей от, или имеющей риск развития остеопороза, и в частности, может быть женщиной, более конкретно женщиной в пост-менопаузе.
Способы и режимы дозирования по настоящему изобретению могут быть использованы для профилактики и лечения заболеваний и/или нарушений с низкими дозами и/или менее частым дозированием, чем с другими терапевтическими средствами. В общем, «костные заболевания и/или нарушения» могут быть определены как заболевания и/или нарушения, которые могут быть предотвращены и/или подвергнуты лечению, соответственно, подходящим введением субъекту, нуждающемуся в этом (т.е. имеющему заболевание и/или нарушение или, по меньшей мере, один их симптом и/или риск привлечения или развития заболевания и/или нарушения) любым из числа полипептида изобретения или включающей его композиции (и в частности, его фармацевтически активного количества), и/или известного активного компонента против RANK-L или биологического пути или механизма, в которые вовлечен RANK-L (и в частности, его фармацевтически активное количество).
Заболевания и/или нарушения костей охватывают заболевания и/или нарушения, ассоциированные с регуляцией образования и резорбции кости. Заболевания и/или нарушения костей, характеризующиеся общей потерей костной массы (резорбция кости превышает образование кости) также относятся к остеопенным нарушениям, включая остеопению, остеопороз и остеолиз, и характеризуются избыточным и/или нежелательным проведением сигналов, опосредованным RANK-L. Способы и режимы дозирования изобретения модулируют, и в частности, ингибируют и/или предотвращают на длительные периоды времени и/или при более низких доза и/или при менее частом введении доз, связывание RANK-L с RANK, действуя в качестве антагониста, а будут, в общем, использоваться для профилактики и/или лечения заболеваний кости и/или нарушений, характеризующихся чистой потерей костной массы.
Примеры таких заболеваний и/или нарушений костей будут ясны специалисту на основании описания данного документа, и, например, включают следующие заболевания и/или нарушения: остеопороз (McClung 2006, Current Osteoporosis Reports 4: 28-33), включая, без ограничения перечисленным, первичный остеопороз, эндокринный остеопороз (включая, без ограничения перечисленным, гипертиреоз, гиперпаратиреоз (Anandarajah and Schwarz 2006, J. Cell Biochem. 97: 226-232), синдром Кушлинга и акромегалию), наследственные и врожденные формы остеопороза (включая, без ограничения перечисленным незавершенный остеогенез, гомоцистинурию, синдром Менкеса, синдром Райли-Дея), остеопороз из-за иммобилизации конечностей, остеопороз, индуцированный глюкокортикоидами (Locklin et al. 2001, Bone 28 (Suppl.): S80; McClung 2006, Current Osteoporosis Reports 4: 28-33; Anandarajah and Schwarz 2006, J. Cell Biochem. 97: 226-232) и постменопаузный остеопороз (McClung 2006, Current Osteoporosis Reports 4: 28-33).
Также в рамки настоящего изобретения входят профилактика и/или лечение с помощью способов и режимов дозирования по изобретению, других заболеваний и/или нарушений, ассоциированных с дисбалансом в пути RANK-L/RANK/OPG. Такие заболевания и/или нарушения включают, без ограничения, остеопороз.
Соответственно, некоторые воплощения настоящего изобретения обеспечивают применение полипептидов, которые направлены против RANK-L, в частности против человеческого RANK-L, для неожиданно длительного ингибирования резорбции костей и/или активности остеокластов у субъекта. В частности, некоторые воплощения настоящего изобретения обеспечивают применение таких полипептидов для профилактического, терапевтического и/или диагностического применения у людей, и особенно для неожиданно длительного ингибирования резорбции кости и/или активности остеокластов у субъекта.
Более конкретно, в некоторых воплощениях настоящего изобретения предлагается применение таких полипептидов для предотвращения, профилактики, лечения, облегчения и/или диагностики одного или нескольких заболеваний, нарушений или состояний, ассоциированных с RANKL и/или опосредованное RANKL (таких как заболевания, нарушения и состояния, упомянутые в данном документе), у людей, и особенно неожиданной длительное ингибирование резорбции кости и/или активности остеокластов у субъекта, например, для лечения или профилактики остеопороза.
В некоторых воплощениях настоящего изобретения предлагаются такие полипептиды для применения при приготовлении фармацевтических композиций для профилактики и/или лечения одного или нескольких заболеваний, нарушений или состояний, ассоциированных с и/или опосредованных RANK-L (таких как заболевания, нарушения и состояния, упомянутые в данном документе) у людей.
В другом аспекте изобретение относится к полипептиду изобретения для профилактики и/или лечения, по меньшей мере, одного заболевания и/или нарушения кости; и/или для применения одного или нескольких способов лечения, упомянутых в данном документе.
В другом аспекте изобретение относится к применению полипептида изобретения при приготовлении фармацевтической композиции для профилактики и/или лечения, по меньшей мере, одного заболевания и/или нарушения костей; и/или для применения одного или нескольких способов лечения, упомянутых в данном документе.
В частности, полипептид изобретения может быть использован в комбинации с другими фармацевтически активными соединениями или компонентами, которые являются или могут быть использованы для профилактики и/или лечения заболеваний и/или нарушений, процитированных в данном документе, в результате чего может быть получен или не может быть получен синергичный эффект. Примеры таких соединений и компонентов, а также путей, способов и фармацевтических составов или композиций для введения будут ясны для клинического врача.
В частности, фармацевтическая композиция изобретения может содержать один или большее количество полипептидов изобретения и, по меньшей мере, один дополнительный терапевтический агент, выбранный из костного морфогенного фактора, трансформирующего фактора роста β (TGF-β), ингибитора интерлейкина-1 (IL-1), IL-1ra, Kineret™, ингибитора TNFα, а растворимого рецептора TNFα, Enbrel™, анти-TNFα антитела, Remicade™, D2E7 антитела, паратироидного гормона, аналога паратироидного гормона, белка, родственного паратироидному гормону, аналога белка, родственного паратироидному гормону, простагландина, бисфосфата, алендроната, фторида, кальция, нестероидного противовоспалительного лекарственного средства (NSAID), ингибитора COX-2, Celebrex™, Vioxx™, иммуносупрессанта, метотрексата, лефлуномида, ингибитора сериновых протеаз, секреторного лейкоцитарногой ингибитора протеазы (SLPI), ингибитора IL-6, антитела или Нанотела против IL-6, ингибитора IL-8, антитела или Нанотела против IL-8, ингибитора IL-18, IL-18-связывающего белка, антитела или Нанотела против IL-18, модулятора интерлейкин-конвертирующего фермента (ICE), фактора роста фибробластов (FGF), модулятора FGF, антагониста PAF, фактора роста кератиноцитов (KGF), KGF-родственной молекулы, модулятора KGF, модулятора матричной металлопротеазы (MMP), модулятора синтазы оксида азота (NOS), модулятора глюкокортикоидного рецептора, модулятора глутаматного рецептора, модулятора уровней липополисахаридов (LPS), норадреналина, миметика норадреналина, и модулятора норадреналина, например, в US 2004/00335353
Если два или большее количество веществ или компонентов используются как часть комбинированного режима лечения, они могут быть введены тем же путем введения или через другие пути введения, по существу в один период времени же время или в разные периоды времени (например, по существу одновременно, последовательно, или в соответствии с альтернативным режимом). Если вещества или компоненты вводятся одновременно через тот же путь введения, они могут быть введены в виде различных фармацевтических составов или композиций или как часть комбинированного фармацевтического состава или композиции, как будет ясно специалисту.
Также, если два или большее количество активных веществ или компонентов используются как часть комбинированного режима лечения, каждое из веществ или компонентов могут быть введены в том же количестве и в соответствии с тем же режимом, что и используемый когда соединение или компонент используется сам по себе, и такое комбинированное применение может приводить или может не приводить к синергичному эффекту. Однако если комбинированное применение двух или большего количества активных веществ приводит к синергичному эффекту, то также может быть возможно снижение количества одного, нескольких или всех вводимых веществ или компонентов, с достижением при этом искомого терапевтического действия. Это может быть, например, полезно при избежании, ограничении или снижении нежелательных побочных эффектов, которые ассоциированы с применением одного или большего количества веществ или компонентов, если они используются в их обычных количествах, с получением при этом искомого фармацевтического или терапевтического эффекта.
Определения
Если не указано или не определено иное, все используемые термины имеют их обычное значение в данной области, которое будет ясно специалисту. Источниками могут служить, например, стандартные руководства, такие как Sambrook et al, «Molecular Cloning: A Laboratory Manual» (2nd. Ed.), Vols. 1-3, Cold Spring Harbor Laboratory Press (1989); F. Ausubel et al, eds., «Current protocols in molecular biology», Green Publishing and Wiley Interscience, New York (1987); Lewin, «Genes II», John Wiley & Sons, New York, N.Y., (1985); Old et al., Principles of Gene Manipulation: An Introduction to Genetic Engineering», 2nd edition, University of California Press, Berkeley, CA (1981); Roitt et al., «Immunology» (6th. Ed.), Mosby/Elsevier, Edinburgh (2001); Roitt et al., Roitt's Essential Immunology, 10th Ed. Blackwell Publishing, UK (2001); и Janeway et al., «Immunobiology» (6th Ed.), Garland Science Publishing/Churchill Livingstone, New York (2005), а также общий уровень техники, процитированный в данном документе.
Если не указано иное, все способы, стадии, методы и манипуляции, которые конкретно подробно не описаны, могут быть осуществлены и были осуществлены способом, известным per se, и также ясны специалистам. Опять же, источниками могут служить, например, стандартные руководства и общий уровень техники, упомянутый в данном документе, и дополнительные источники, процитированные в них; а также, например, обзоры: Presta (2006, Adv. Drug Deliv. Rev. 58 (5-6): 640-56); Levin and Weiss (2006, Mol. Biosyst. 2 (1): 49-57); Irving et al. (2001, J. Immunol. Methods, 248 (1-2): 31-45); Schmitz et al. (2000, Placenta, 21 Suppl. A: S106-12), Gonzales et al. (2005, Tumour Biol. 26 (1): 31-43), которые описывают методы белковой инженерии, такие как созревание аффинности и другие методы для улучшения специфичности и других искомых свойств белков, таких как иммуноглобулины.
Нуклеиновая последовательность или аминокислотная последовательность считается «по существу изолированной (формой)» - например, по сравнению с его естественным биологическим источником и/или реакционной средой или средой культивирования из которой она была получена - если она была отделена, по меньшей мере, от одного компонента, с которым она как правило ассоциирована в указанном источнике или среде, такой как другая нуклеиновая кислота, другой белок/полипептид, другой биологический компонент или макромолекула, или, по меньшей мере, один контаминант, примесь или второстепенный компонент. В частности, нуклеотидная последовательность или аминокислотная последовательно считается «по существу изолированной» если она была очищена, по меньшей мере, в 2 раза, предпочтительно, по меньшей мере, в 10 раз, более предпочтительно, по меньшей мере, в 100 раз, и вплоть до 1000 раз и больше. Нуклеотидная или аминокислотная последовательность, которая является «по существу изолированной формой» предпочтительно является практически гомогенной, как определено с помощью подходящего метода, такого как подходящий хроматографический метод, такой как электрофорез в полиакриламидном геле.
Если указано, что нуклеотидная последовательность или аминокислотная последовательность «включает» другую нуклеотидную последовательность или аминокислотную последовательность, соответственно, или «по существу состоит из» другой нуклеотидной последовательности или аминокислотной последовательности, то это может означать, что последняя нуклеотидная последовательность или аминокислотная последовательность была включена в первую нуклеотидную последовательность или аминокислотную последовательность, соответственно, но чаще, это, в общем, обозначает, что в первую нуклеотидную последовательность или аминокислотную последовательность включен участок нуклеотидов или аминокислотных остатков, соответственно, которые имеют такую же аминокислотную последовательность или аминокислотную последовательность, соответственно, что и последняя последовательность, вне зависимости от того, как первая последовательность была создана или получена (что может быть осуществлено, например, любым подходящим способом, описанным в данном документе). В качестве неограничивающего примера: если указано Нанотело или полипептид по изобретению как содержащие CDR-последовательность, то это может означать, что указанная CDR-последовательность была включена в Нанотело или полипептид изобретения, но чаще это в общем означает, что Нанотело или полипептид изобретения содержат в своей последовательности участок аминокислотных остатков с такой же аминокислотной последовательностью, что и указанная CDR-последовательность, вне зависимости от того, как указанное Нанотело или полипептид изобретения были созданы или получены. Также следует отметить, что если последняя аминокислотная последовательность имеет специфическую биологическую или структурную функцию, то она фактически имеет ту же самую, похожую или эквивалентную биологическую или структурную функцию в первой аминокислотной последовательности (другими словами, первая аминокислотная последовательность предпочтительно такая, что последняя последовательность способна осуществлять фактически ту же самую, похожую или аналогичную биологическую или структурную функцию). Например, если указано, что Нанотело или полипептид изобретения включают CDR-последовательность или каркасную последовательность, соответственно, CDR-последовательность и каркас предпочтительно способны, в указанном Нанотеле или полипептиде, функционировать как CDR-последовательность или каркасная последовательность, соответственно. Также, если указано, что нуклеотидная последовательность включает другую нуклеотидную последовательность, первая нуклеотидная последовательность предпочтительно такова, что при экспрессии в экспрессируемый продукт (например, полипептид), аминокислотная последовательность, кодируемая последней нуклеотидной последовательностью образует часть указанного экспрессируемого продукта (другими словами, последняя нуклеотидная последовательность находится в одной рамке считывания с первой, большей нуклеотидной последовательностью).
Под «по существу состоит из» означает, что первая упомянутая нуклеотидная последовательность аминокислотная последовательность точно такая же как вторая последовательность, или соответствует второй последовательности, которая имеет ограниченное количество нуклеотидных или аминокислотных остатков, как, например, (кодирующие) 1-20 аминокислотных остатков, например, (кодирующие) 1-10 аминокислотных остатков, и предпочтительно (кодирующие) 1-6 аминокислотных остатков, как, например, (кодирующие) 1, 2, 3, 4, 5 или 6 аминокислотных остатков, добавленные к N-концу, к C-концу или к обоим N- и C-концам нуклеотидной или аминокислотной последовательности.
Аминокислотная последовательность (такая как Нанотело, антитело, полипептид изобретения, или в общем, антигенсвязывающий белок или полипептид или их фрагмент), которая может (специфически) связывать, которая имеет аффинность для и/или которая имеет специфичность к специфической антигенной детерминанте, эпитопу, антигену или белку (или, по меньшей мере, к одной части, фрагменту или эпитопу) указана как «против» или «направленная против» указанной антигенной детерминанты, эпитопа, антигена или белка.
Термин «специфичность» относится к множеству различных типов антигенов или антигенных детерминант, с которым конкретная антигенсвязывающая молекула или антигенсвязывающий белок (такой как Нанотело или полипептид изобретения) может связываться. Специфичность антигенсвязывающего белка может быть определена на основании аффинности и/или авидности. Аффинность, представленная константой равновесия диссоциации антигена с антигенсвязывающим белком (KD), является мерой силы связывания между антигенной детерминантой и антигенсвязывающим сайтом на антигенсвязывающем белке: чем меньше значение KD, тем сильнее сила связывания между антигенной детерминантой и антигенсвязывающей молекулой (в ином случае аффинность также может быть выражена как константа аффинности (KA), которая равна 1/KD). Как будет ясно специалисту (например, на основании дальнейшего описания в данном документе, аффинность может быть определена способом, известным per se, в зависимости от конкретного представляющего интерес антигена. Авидность является мерой силы связывания между антигенсвязывающей молекулой или антигенсвязывающим белком (таким как Нанотело или полипептид изобретения) и соответствующим антигеном. Авидность имеет отношение как аффинности между антигенной детерминантой и ее антигенсвязывающим сайтом на антигенсвязывающей молекуле и количеством соответствующих сайтов связывания, присутствующих на антигенсвязывающей молекуле. Как правило, антигенсвязывающие белки (такие как аминокислотные последовательности, Нанотела и/или полипептиды изобретения) будут связывать их антиген с константой диссоциации (KD) 10-5-10-12 моль/литр или меньше, предпочтительно 10-7-10-12 моль/литр или меньше, более предпочтительно 10-8-10-12 моль/литр (т.е. с константой ассоциации (KA) 105-1012 литров/моль или больше, предпочтительно 107-1012 литров/моль или больше, более предпочтительно 108-1012 литров/моль). Любое значение KD больше чем 104 моль/литр (или любое значение KA меньше чем 104 М-1) литров/моль, в общем, считается показателем неспецифического связывания. Предпочтительно, моновалентная иммуноглобулиновая последовательность изобретения будет связываться с искомым антигеном с аффинностью меньше, чем 500 нМ, предпочтительно, меньше чем 200 нМ, более предпочтительно меньше чем 10 нМ, например, меньше чем 500 пМ. Специфическое связывание антигенсвязывающего белка с антигеном или антигенной детерминантой может быть определено любым подходящим способом, известным per se, включая, например, анализ Скэтчарда и/или анализы конкурентного связывания, такие как радиоиммуноанализы (РИА), ферментные иммуноанализы и сендвич-конкурентные анализы, и их различные варианты, известные per se в данной области; а также другие методы, упомянутые в данном документе.
Константа диссоциации может быть истинной или кажущейся константой диссоциации, что очевидно специалистам. Способы определения константы диссоциации очевидны специалистам, и, например, включают методы, упомянутые в данном документе. В этом отношении, также очевидно, что может быть невозможно измерить константы диссоциации больше чем 10-4 моль/литр или 10-3 моль/литр (например, 10-2 моль/литр). В ином случае, как очевидно специалистам, (истинная или кажущаяся) константа диссоциации может быть рассчитана на основании (истинной или кажущейся) константы ассоциации (KA), посредством отношения [KD=1/KA].
Аффинность обозначает силу или стабильность молекулярного взаимодействия. Аффинность, как правило, дается в виде KD, или константы диссоциации, которая имеет единицы моль/литр (или M). Аффинность также может быть выражена как константа ассоциации, KA, которая равна 1/KD и имеет единицы (моль/литр)-1 (или М-1). В настоящем описании, стабильность взаимодействия между двумя молекулами (такими как Нанотело или полипептид изобретения и их предполагаемая мишень), будут главным образом, выражены по показателю значения KD их взаимодействия; причем специалисту ясно, что в свете взаимодействия KA=1/KD, определение силы молекулярного взаимодействия по его значению KD также может быть использовано для расчета соответствующего значения KA. Значение KD характеризует силу молекулярного взаимодействия также в термодинамическом смысле, поскольку оно связано со свободной энергией (DG) связывания хорошо известным соотношением DG=RT.ln(KD) (эквивалентно DG=-RT.ln(KA)), где K равно газовой константе, T равно абсолютной температуре, a ln обозначает натуральный логарифм.
KD для биологических взаимодействий, которые считаются значимыми (например, специфичными), как правило, находятся в диапазоне 10-10 М (0,1 нМ)-10-5 М (10000 нМ). Чем сильнее взаимодействие, тем ниже его KD. Ко также может быть выражено как соотношение константы скорости диссоциации комплекса, обозначенной как k0ff, к скорости ассоциации, обозначенной как kon (так что KD=k0ff/kon и KA=kon/k0ff). Скорость диссоциации koff имеет единицы с-1 (где с является обозначением в системе СИ для секунды). Скорость ассоциации kon имеет единицы M-1с-1. Скорость ассоциации может варьировать между 102 M-1с-1 и около 107 M-1с-1, приближение к ограниченной диффузией константе скорости ассоциации для биомолекулярных взаимодействий. Скорость диссоциации связана с периодом полужизни для данного молекулярного взаимодействия уравнением t1/2=ln(2)/koff. Скорость диссоциации варьирует между 0-6 с-1 (почти необратимый комплекс с t1/2 равным множеству дней) и 1 с-1 (t1/2=0,69 с).
Аффинность молекулярного взаимодействия между двумя молекулами может быть измерено различными способами, известными per se, такими как хорошо известный биосенсорный метод поверхностного плазмонного резонанса (см. Например, Ober et al. 2001, Intern. Immunology 13: 1551-1559) при котором одна молекула иммобилизуется на чип биосенсора, а другая молекула проходит над иммобилизованной молекулой в потоке, позволяя осуществить измерение kon, koff и, следовательно, значения KD (или KA). Например, это может быть осуществлено с помощью хорошо известных приборов «BIACORE».
Также для специалиста в данной области будет ясно, что измеренный KD может соответствовать кажущемуся KD, если процесс измерения как-либо влияет на присущую аффинность связывания скрытых молекул, например, артефактами, родственными с покрытию на биосенсоре одной молекулы. Также кажущийся KD может быть измерена, если одна молекула содержит более одного участка распознавания для других молекул. В таких ситуациях на измерение аффинности может оказать влияние авидность взаимодействия между двумя молекулами.
Другой подход, который может быть использован для оценки аффинности, является 2-стадийный тИФА (твердофазный иммуноферментный анализ) по Friguet et al. (1985, J. Immunol. Methods, 77: 305-19). Этот способ устанавливает измерение равновесия связывания в фазе раствора и позволяет избежать возможных артефактов, связанных с абсорбцией одной или нескольких молекул на подложке, такой как пластик.
Однако, точное измерение KD может быть достаточно трудоемким и, как следствие, часто для оценки силы связывания двух молекул определяются кажущиеся значения KD. Следует отметить, что поскольку все измерения проводились в одинаковых условиях (например, при сохранении неизменных условий анализа) измерения кажущегося значения KD может быть использовано в качестве аппроксимации истинного KD и поэтому в настоящем документе к KD и кажущемуся KD следует относиться с равной важностью и значимостью.
И наконец, следует отметить, что во многих ситуациях опытный ученый может составить себе мнение, насколько удобно определять аффинность связывания относительно некоторой эталонной молекулы. Например, для оценки силы связывания между молекулами A и B, можно использовать, например, использовать эталонную молекулу C, которая как известно, связывает B и соответствующим образом метит флуорофорной или хромофорной группой или другой химической составляющей, такой как биотин, для простой детекции в тИФА или FACS (сортировка флюоресцентно-активированных клеток) или в другом формате (флуорофор для детекции флуоресценции, хромофор для детекции поглощения света, биотин для стрептавидин-опосредованной детекции в тИФА). Как правило, эталонную молекулу C поддерживают в фиксированной концентрации, а концентрация A различна для данной концентрации или количества B. В результате получается значение IC50, соответствующее концентрации A, при которой сигнал, измеренный для C в отсутствии A снижен в два раза. При условии, что KD ref, KD эталонной молекулы известно, как и общая концентрация cref эталонной молекулы, кажущееся значение KD для взаимодействия A-B может быть получено из следующей формулы: KD=IC50/(1+cref/KD ref). Обратите внимание, что, если cref<<KD ref, KD≈IC50. IC50. Если измерение IC50 проведено в одинаковых условиях (например, при сохранении фиксированного значения IC50), для связывающих агентов, которые сравниваются, или стабильность молекулярного взаимодействия может быть оценена по IC50 и это измерение можно считать как эквивалент для KD или кажущегося KD на протяжении всего этого текста.
Период полужизни соединения или полипептида изобретения в целом может быть определено как время, необходимое для сывороточной концентрации соединения или полипептида, для снижения на 50%, in vivo, например, из-за деградации соединений соединения или полипептида и/или клиренса или секвестрации соединения или полипептида естественными механизмами. In vivo период полужизни соединения или полипептида изобретения может быть определен любым способом, известным per se, например фармакокинетическим анализом. Подходящие методы ясны специалистам в данной области, и могут, например, в целом включать стадии соответствующего введения теплокровному животному (т.е. человеку или другому подходящему млекопитающему, такому как мышь, кролик, крыса, свинья, собака или примат, например, обезьяны рода Macaca (такие как, в частности, яванские макаки (Macaca fascicularis) и/или макаки-резус (Macaca mulatta)) и бабуины (Papio ursinus)) подходящей дозы соединения или полипептида изобретения; сбора образцов крови или других образцов из указанного животного; определения уровня или концентрации соединения или полипептида изобретения в указанном образце крови; и расчета из (диаграммы) данных, полученных таким образом, времени, за которое уровень или концентрация соединения или полипептида изобретения снизилась на 50% по сравнению с изначальным уровнем на основании дозировки. Дается ссылка, например, на Экспериментальную Часть ниже, а также на стандартные руководства, такие как Kenneth, A et al: Chemical Stability of Pharmaceuticals: A Handbook for Pharmacists and Peters et al, Pharmacokinete analysis: A Practical Approach (1996). Также дается ссылка на «Pharmacokinetics», М Gibaldi & D Perron, published by Marcel Dekker, 2nd Rev. edition (1982).
Как также будет ясно специалисту (см. Например, страницы 6 и 7 из WO 04/003019 и дальнейшие ссылки, процитированные в этом документе), период полужизни может быть выражен с помощью параметров, таких как t1/2-альфа, t1/2-бета и площадь под кривой (AUC). В настоящем описании «увеличение периода полужизни» относится к увеличению любого одного их этих параметров, например, любых двух параметров, или особенно всех трех этих параметров. При использовании в данном документе «увеличение периода полужизни» или «увеличенный период полужизни» в частности относится к увеличению в t1/2-бета, либо с увеличением, либо без увеличения в t1/2-альфа и/или AUC, либо к увеличению и в том, и в другом.
Для сравнения двух или большего количества нуклеотидных последовательностей, процент «идентичности последовательностей» между первой нуклеотидной последовательностью и второй нуклеотидной последовательностью определен в WO 08/142164 на страницах 58-60 в пунктах e) и g).
Для сравнения двух или большего количества аминокислотных последовательностей, процент «идентичности последовательностей» между первой аминокислотной последовательностью и второй аминокислотной последовательностью определен в WO 08/142164 на страницах 58-60, в пунктах f), g) и h.
Термин «антигенная детерминанта» относится к эпитопу на антигене, распознаваемому антигенсвязывающей молекулой (такой как Нанотело или полипептид изобретения), а более конкретно антигенсвязывающим сайтом указанной молекулы. Термины «антигенная детерминанта» и «эпитоп» также могут быть использованы взаимозаменяемо в данном документе.
Термины «перекрестный блок», «перекрестно блокированный» и «перекрестное блокирование» используются взаимозаменяемо в данном документе и имеют значения, описанные в WO 08/142164 на страницах 69-72, в пункте s).
Аминокислотные остатки Нанотела пронумерованы в соответствии с общей нумерацией для VH-доменов, данные Kabat et al. ("Sequence of proteins of immunological interest», US Public Health Services, NIH Bethesda, MD, Publication No. 91), в применении к VHH-доменов из верблюдовых в статье Riechmann and Muyldermans (2000, J. Immunol. Methods 240 (1-2): 185-195 (см. например, фигуру 2 данной публикации)); или упомянуты в данном документе. Согласно этой нумерации FR1 Нанотела включает аминокислотные остатки в положениях 1-30, CDR1 Нанотела включает аминокислотные остатки в положениях 31-35, FR2 Нанотела включает аминокислотные остатки в положениях 36-49, CDR2 Нанотела включает аминокислотные остатки в положениях 50-65, FR3 Нанотела включает аминокислотные остатки в положениях 66-94, CDR3 Нанотела включает аминокислотные остатки в положениях 95-102, a FR4 Нанотела включает аминокислотные остатки в положениях 103-113. [В этом отношении следует отметить, что - как хорошо известно в данной области для VH-доменов и для VHH-доменов - общее количество аминокислотных остатков в каждом из CDR может варьировать и может не соответствовать общему количеству аминокислот, указанных в нумерации по Kabat (то есть, одна или большее количество положений по нумерации Kabat может быть не занято в фактической последовательности, или фактическая последовательность может содержать больше аминокислотных остатков, чем количество, разрешенное нумерацией по Kabat). Это означает, что, в общем, нумерация по Kabat может соответствовать или не соответствовать фактической нумерации аминокислотных остатков в фактической последовательности. В общем, однако, можно сказать, что в соответствии с нумерацией по Kabat и безотносительно нумерации аминокислотных остатков в CDR, положение 1 согласно нумерации Kabat соответствует началу FR1 и наоборот, положение 36 согласно нумерации Kabat соответствует началу FR2 и наоборот,
Если заявляется, что полипептид изобретения снижает уровни маркера (такого как, например, CTX-1, NTX-1, TRACP5b or P1NP) «по меньшей мере на x%» или снижает уровни маркера «по меньшей мере на x% по сравнению с уровнем до лечения или нормальным уровнем», то это означает, что введение полипептида изобретения субъекту приводит к снижению уровней указанного маркера на x% по сравнению с уровнем до лечения или нормальным уровнем. Это означает, что уровни маркера в обработанном субъекте будут на x% ниже по сравнению с уровнями маркера перед лечением или по сравнению с нормальными уровнями маркера. Таким образом, если уровни маркера перед лечением или нормальные уровни маркера приняты за 100%, то уровни маркера в обработанных субъектах (сниженные уровни маркера) будут равны 100%-x% от уровней перед лечением или нормальными уровнями маркера. Эти уровни маркера в обработанном субъекте, следовательно, также считаются «100%-x% от исходного уровня». Например, если сказано, что полипептид изобретения «снижает сывороточные уровни CTX-1, по меньшей мере, на 30%» или «снижает сывороточные уровни CTX-1, по меньшей мере, на 30% по сравнению с уровнем до лечения или нормальным уровнем, то сывороточные уровни CTX-1 в обрабатываемом субъекте будет на 30% ниже по сравнению с уровнями CTX-1 перед лечением или по сравнению с нормальными уровнями CTX-1. Таким образом, если уровни CTX-1 перед лечением или нормальными уровнями CTX-1 приняты за 100%, то уровни CTX-1 в обработанном субъекте (сниженные уровни CTX-1) будут составлять 70% (100%-30%) от уровней CTX-1 перед лечением или нормальными уровнями CTX-1. Эти уровни CTX-1 в обработанном субъекте, следовательно, также считаются «70% от исходного уровня».
Если заявляется, что полипептид изобретения поддерживает уровни маркера (такого как CTX-1, NTX-1, TRACP5b или P1NP) «по меньшей мере, на x%», то это означает, что сниженные уровни маркера поддерживаются на x% ниже по сравнению с уровнями маркера до лечения или по сравнению с нормальными уровнями маркера. Соответственно, уровни маркера поддерживаются на «100%-x% от исходного уровня». Например, если заявляется, что полипептид изобретения поддерживает сывороточные уровни CTX-1 «по меньшей мере, на 30% то это означает, что сниженные уровни сывороточного CTX-1 поддерживаются на 30% ниже по сравнению с уровнями CTX-1 перед лечением или по сравнению с нормальными уровнями CTX-1. Соответственно, уровни CTX-1 поддерживаются при «70% от исходного уровня».
Фигуры, и Экспериментальная Часть/Примеры даны только для дополнительной иллюстрации изобретения и не должны интерпретироваться или толковаться как ограничивающие объем изобретения и/или прилагаемой формулы изобретения каким-либо образом, если явно не указано иное.
Теперь изобретение будет дополнительно описано с помощью представленных ниже неограничивающих примеров и фигур:
Краткое описание фигур
Фигура 1. Открытая двухкамерная фармакокинетическая модель с линейным и нелинейным клиренсом из центральной камеры. CLNON-RANKL является линейным не опосредованным RANKL клиренсом, Vc - объем центральной камеры, Vt - объем периферической камеры, CLd - межкамерный поток, и CLRANKL является нелинейным RANKL-опосредованным клиренсом (Vmax - максимальная скорость метаболизма, а Km - концентрация ALX-0141 соответствующая 50% Vmax). Константа скорость абсорбции и биодоступность после п.к. введения представлены ka и F, соответственно.
Фигура 2. Открытая однокамерная фармакокинетическая модель с параллельной абсорбцией первого порядка из п.к. пространства и линейным и нелинейным клиренсом из центральной камеры. CLNON-RANKL/F является нелинейным не опосредованным RANKL клиренсом, скорректированным для п.к. биодоступности, V/F - объем центральной камеры, скорректированной для п.к. биодоступности, F1 является фракцией дозы, абсорбированной с ka1, F2 является фракцией дозы, абсорбированной с ka2 с ka1 и ka2 являющихся соответствующими быстрой и медленной константами скорости абсорбции первого порядка, a CL CLRANKL/F является нелинейным RANKL-опосредованным клиренсом, скорректированным для п.к. биодоступности (Vmax - максимальная скорость метаболизма и Km - концентрация ALX-0141, соответствующая 50% Vmax).
Фигура 3. Фармакокинетика. Геометрическое среднее концентрации в плазме относительно временных профилей ALX-0141. (a) Линейный масштаб; (b) полулогарифмический масштаб.
Фигура 4. Фармакодинамика - изменения в сывороточном CTX-1. Быстрое снижение сывороточного уровня CTX-1 наблюдалось в пределах 8 часов после введения дозы у обработанных ALX-0141 субъектов. Показан дозозависимый, длительный ингибирующий эффект ALX-0141 на сывороточный уровень CTX-1 (% от исходного уровня). Значения являются средними ± SEM, n=11 для плацебо, n=6 для каждой группы обработки ALX-0141.
Фигура 5. Фармакодинаминка - изменения NTX-1/креатинина в моче. Быстрое снижение уровня NTX-1/креатинина в моче наблюдали в пределах 8 часов после введения дозы ALX-0141 обрабатываемым субъектам. Показан дозозависимый, длительный ингибирующий эффект ALX-0141 на уровень NTX-1/креатинина в моче (% от исходного уровня). Значения являются средними ± SEM, n=11 для плацебо, n=6 для каждой группы обработки ALX-0141.
Фигура 6. Арифметическое среднее сывороточной концентрации CTX-1 (% от исходного уровня) после п.к. введения дозы с ALX-0141 или плацебо здоровым женщинам-волонтерам в постменопаузе.
Фигура 7. Арифметическое среднее соотношении NTX-1/Креатинина в моче (% от исходного уровня) после п.к. введения дозы с ALX-0141 или плацебо здоровым женщинам-волонтерам в постменопаузе.
Фигура 8. Арифметическое среднее сывороточной концентрации TRACP5b (% от исходного уровня) после п.к. введения дозы с ALX-0141 или плацебо здоровым женщинам-волонтерам в постменопаузе.
Фигура 9. Арифметическое среднее сывороточной концентрации P1NP (% от исходного уровня) после п.к. введения дозы с ALX-0141 или плацебо здоровым женщинам-волонтерам в постменопаузе.
Фигура 10. Арифметическое среднее сывороточной концентрации ВАР (% от исходного уровня) после п.к. введения дозы с ALX-0141 или плацебо здоровым женщинам-волонтерам в постменопаузе.
Фигура 11. Наблюдаемые (указаны линии с точками данных) и симуляционные на основе модели (светлые линии, точки данных не указаны) профили концентрации ALX-0141 в плазме от времени у здоровых женщин в постменопаузе после одиночного п.к. введения дозы ALX-0141 (a) 0,003, (b) 0,01, (c) 0,03, (d) 0,1, (e) 0,3, и (f) 1 мг/кг.
Фигура 12. Наблюдаемые (указаны линии с точками данных) и симуляционные на основе модели (светлые линии, точки данных не указаны) профили сывороточного CTX-1 от времени у здоровых женщин в постменопаузе после одиночного п.к. введения дозы ALX-0141 (a) 0,003, (b) 0,01, (c) 0,03, (d) 0,1, (e) 0,3, и (f) 1 мг/кг.
Примеры
Перечень сокращений:


Пример 1. Токсикологические исследования ALX-0141
При исследовании токсичности одиночной дозы, ALX-0141 вводили самцам и самкам яванского макака в виде одиночных п.к. доз 0, 0,02, 2, 20 и 50 мг ALX-0141/кг массы тела и одиночной в.в. болюсной дозы 20 мг/кг. Последовательность ALX-0141 изображена как SEQ ID NO: 12 (SEQ ID NO: 759 в US 2010/0104568).
Образцы крови для фармакокинетического (ФК) анализа, анализа антител против лекарственного средства (ADA), и фармакодинамического (ФД) анализа собирали из всех животных перед введением дозы и в выбранные временные точки после введения дозы. Образцы анализировали для ФК, ФД и ADA целей с использованием утвержденных способов, за исключением определения CTX-1, для которого использовали коммерческий набор на человека, который был проверен на перекрестную реактивность с CTX-1 яванского макака.
При исследовании токсичности многократного применения препарата, ALX-0141 вводили самцам и самкам яванского макака в виде п.к. доз 0, 0,02, 2, 20 и 50 мг ALX-0141/кг массы тела 6 раз в течение 2 недель (дни тестирования 1, 3, 5, 8, 10 и 12).
Токсикокинетические образцы забирались вплоть до 15 дня исследования (т.е. 14 дней после введения первой дозы). Три группы (0,2 и 50 мг/кг) включали период восстановления, когда дополнительно обрабатывали по 2 животного каждого пола, и осуществляли сбор образцов в течение 99 дней (т.е. вплоть до 98 дня после введения дозы).
Образцы крови для ФК, ADA и ФД собирали из всех животных перед введением дозы и в выбранные моменты времени после введения дозы. Образцы анализировали для ФК, ADA и ФД с использованием утвержденных способов, за исключением определения CTX-1, для которого использовали коммерческий набор на человека, который, как было показано имеет перекрестную реактивность с CTX-1 яванского макака.
Пример 2. Преклинические данные
Фармакокинетическое (ФК) и фармакодинамическое (ФД) моделирование осуществляли на данных, полученных при исследовании токсичности одиночной дозы ALX-0141 в яванском макаке, как описано в Примере 1. Данные 2-недельного исследования токсичности с повторной дозой использовали для проверки того, будут ли данные по одиночной дозе точно прогнозировать фармакокинетику повторной дозы (т.е. для проверки зависимости от времени ФК ALX-0141).
Фармакокинетическое моделирование концентраций ALX-0141 в плазме яванского макака
Нелинейное фармакокинетическое поведение ALX-0141 в яванском макаке было зарегистрировано аппроксимацией данных к открытой двухкамерной фармакокинетической модели с линейным и нелинейным клиренсом из центрального компартмента и абсорбции первого порядка (п.к. введение). Структурная модель изображена на фигуре 1.
Механизм линейного клиренса по всей видимости связан с ненасыщаемым, и не опосредуемым RANKL удалением ALX-0141 и соответствует медленной и неспецифической протеолитической деградации ALX-0141. Нелинейный и RANKL-опосредованный процесс клиренса является насыщаемым механизмом клиренса; наиболее вероятно представляющий связывание ALX-0141 с мембраносвязанным RANKL и последующей интернализацией и клиренсом.
Все доступные данные об индивидуальной концентрации в плазме после однократной п.к. и в.в. доз ALX-0141 были согласованы одновременно с моделью (WinNonlin Professional Software Version 5.1 («Pharsight Corporation», Маунтин-Вью, Калифорния, США) с использованием итеративного пересчета весов (1/ŷ*ŷ), где ŷ является спрогнозированной концентрацией в плазме.
Предполагаемые ФК-параметры ALX-0141 в яванском макаке оценили с достаточной точностью и перечислили в таблице B-1.
Открытая двухкамерная фармакокинетическая модель с параллельным линейным не опосредованным RANKL клиренсом (CLNON-RANKL) и нелинейным насыщаемым RANKL-опосредованным клиренсом (CLRANKL) из центрального компартмента и адсорбцией первого порядка (п.к. введение) использовали для адекватного описания нелинейной ФК ALX-0141 в яванском макаке.
При низких концентрациях ALX-0141 (C<<<Km) вклад CLRANKL преобладает, тогда как при более высоких, RANKL-насыщающих концентрациях в плазме, общее значение CL главным образом регулируется CLNON-RANKL.
Предполагаемые значения CLRANKL и CLNON-RANKL указывают на то, что клиренс через RANKL-опосредованный компонент происходит более эффективно (около 5,6 раз) по сравнению с нелинейным RANKL-опосредованным путем. RANKL-опосредованный клиренс является однако, легко насыщаемым, на что указывает низкое значение Km (0.149 μг/мл; 3,6 нМ) пути CLRANKL.
Предполагаемый объем распределения в стационарном состоянии, позволяет предположить, что ALX-0141 распределяется вне центральной камеры в интерстициальное пространство ткани.
При концентрациях ALX-0141, которые насыщают RANKL-опосредованный путь, предполагаемый период полужизни ALX-0141 составлял 8,5 дней, т.е. схожий с тем, что сообщался для сывороточного альбумина яванского макака.
Заметная роль нелинейного RANKL-опосредованного компонента ALX-0141 в общем клиренсе объясняет более чем дозопропорциональное увеличение в экспозиции (значения Cmax и AUC) на более низких уровнях доз. При более высоких уровнях доз увеличение дозопропорционально, поскольку общий клиренс продиктован главным образом линейным не опосредованным RANKL путем.
ALX-0141 демонстрирует времязависимую фармакокинетику, поскольку фармакокинетика многократного применения лекарственного средства может быть адекватно спрогнозирована на основании данных по одиночной дозе. В обезьянах (одиночная доза) п.к. абсолютная биодоступность ALX-0141 бала практически полной (96%).
Полумеханистическое моделирование ФК/ФД (концентрации ALX-0141 в плазме яванского макака и сывороточные концентрации CTX-1).
Считается что эффект введения ALX-0141 на сывороточные уровни CTX-1 имеет непрямой характер, поскольку нет прямой связи между взаимодействием между достигнутыми концентрациями ALX-0141 в плазме и эффектом на уровни CTX-1. Поэтому модель непрямого ответа была использована для описания фармакологического эффекта в.в. и п.к. введенного ALX-0141 на физиологический оборот сывороточного CTX-1.
Модель является аналогичной той, что ранее использовалась для анти-RANKL моноклонального антитела, деносумаба (Peterson М., Stouch В., Chen D. et al. 2004, А PK/PD Model Developed in cynomolgus Monkeys Predicts Concentrations and Effects of AMG 162, A Fully Human Monoclonal Antibody Against RANKL, in Healthy Postmenopausal Women. AAPS Annual Meeting, Baltimore, MD, November 7-11, 2004; Реферат) и описывает ответ на лекарственное средство, который приводит к ингибированию выработки сывороточного CTX-1. В этой непрямой модели ответа, скорость изменения CTX-1 (Ответ, R) описывается посредством:
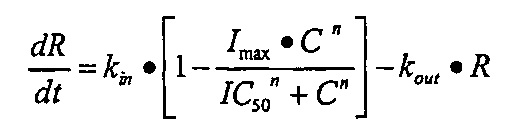
Где kin, скорость синтеза нулевого порядка; R, сыворочный уровень CTX-1, Imax, максимальное ингибирование (1<Imax<0); C, концентрация ALX-0141; n, форм-фактор соотношения концентрация-ответ; и kout, константа скорости выведения сывороточного CTX-1 первого порядка.
Все доступные индивидуальные данные по сывороточному CTX-1, полученные после одиночного в.в. и п.к. введения дозы были одновременно подогнаны к модели WinNonlin Professional Software Version 5.1, «Pharsight Corporation», Маунтин-Вью, Калифорния, США) используя фармакокинетическую функцию в качестве вводной функции для ФК/ФД модели непрямого ответа.
Фармакодинамический эффект в.в. и п.к. введенного ALX-0141 на физиологический оборот сывороточного CTX-1 у обезьян был адекватно зарегистрирован с помощью полумеханистической ФК/ФД модели (модель непрямого ответа).
ФК/ФД-моделирование указывает на то, что ALX-0141 был потенциальным ингибитором выработки сывороточного CTX-1 у яванского макака (IC50 прибл. 22 нг/мл или 0,54 нМ). Кроме того, ALX-0141 был способен почти полностью ингибировать выработку сывороточного CTX-1 (Imax≈73%).
Пример 3. Масштабирование до человека: симуляция ФК/ФД ALX-0141 на людях
ФК/ФД-модель, разработанная для описания временного профиля концентраций ALX-0141 и соответствующих сывороточных уровней CTX-1 у яванского макака был масштабирована до человека для того, чтобы помочь в подборе дозы первого исследования на человеке. Схожий подход ранее был удачно использован для симуляции ФК/ФД денозумаба у человека, на основании данных, полученных на яванском макаке (Peterson М., Stouch В., Chen D. et al. 2004, A PK/PD Model Developed in cynomolgus Monkeys Predicts Concentrations and Effects of AMG 162, A Fully Human Monoclonal Antibody Against RANKL, in Healthy Postmenopausal Women. AAPS Annual Meeting, Baltimore, MD, November 7-11, 2004; Abstract).
С этой целью, предполагаемое значение CLNON-RANKL, объемы распределения (Vc и Vt), и константа скорости абсорбции (ka) в яванском макаке были масштабированы до человека с помощью стандартных аллометрических уравнений (Boxenbaum Н. 1984, Interspecies Pharmacokinetic Scaling and the Evolutionary-Comparative Pardigm. Drug Metab. Rev. 15 (5&6): 1071-1121). Предполагалось, что для CLRANKL, значение Km схоже у яванского макака и человека, тогда как значение Vmax у человека приняли как равное одной трети от значения у яванского макака, поскольку скорость метаболизма для обновления кости в три раза медленнее у человека (FDA. 1994, Guidelines for preclinical and clinical evaluation of agents used in the prevention or treatment of postmenopausal osteoporosis).
Поскольку биодоступность не может быть масштабирована, прогнозы не могут быть осуществлены с помощью двух приемлемых значений F, 0,8 и 1,0. ФК-параметры, использованные для симуляции профилей зависимости концентрации ALX-0141 в плазме от времени, перечислены в таблице B-2.
Для симуляции временного профиля концентраций ALX-0141 у людей после п.к. введения, масштабированные фармакокинетические параметры объединяли с ранее описанной открытой двухкамерной фармакокинетической моделью с параллельным линейным не опосредованным RANKL клиренсом (CLNON-RANKL) и нелинейным RANKL-опосредованным клиренсом (CLRANKL) из центральной камеры и адсорбцией первого порядка (п.к. введение).
Спрогнозированные концентрации ALX-0141 у человека были последовательно использованы в качестве входящей функции для ФК/ФД модели непрямого ответа (ингибирование синтеза) для прогноза временного профиля сывороточного CTX-1 у человека.
Исходное значение сывороточного CTX-1 (R0) и константа скорости элиминации первого порядка (kout) были взяты из литературы (Glover S.J., Garnero P., Naylor К., Rogers A. and Eastell R. 2008, Establishing a reference range for bone turnover markers in young, healthy women. Bone 42: 623-630; Holford N, Pillai G, Kaila N, Collins W, Roy S, Cremers S, Trechsel U, Bouisset F, Steimer J-L. June 2006, PKPD model for cathepsin К inhibition with balicatib and changes in bone turnover biomarkers, in particular NTx. PAGE (Population Approach Group Europe), Bruges (B), 14-16). Предполагалось, что значение максимального эффекта (Imax) и концентрация ALX-0141 схожи между яванскими макаками и людьми, тогда как концентрации, соответствующие половине максимального эффекта (IC50) были взяты в шесть раз ниже у людей относительно обезьян. Последнее связано с эффективной концентрацией, которая в три раза ниже у людей по сравнению с обезьянами, из-за различий в скорости метаболизма при ремоделировании кости (в три раза медленнее у людей по сравнению с обезьянами) (FDA 1994, Guidelines for preclinical and clinical evaluation of agents used in the prevention or treatment of postmenopausal osteoporosis), в комбинации с 2-кратной более высокой аффинностью связывания ALX-0141 с человеческим RANKL относительно RANKL яванского макака.
В таблице B-3 перечислены ФД-параметры, использованные для симуляции профилей ALX-0141 сывороточных концентраций CTX-1 в зависимости от времени.
Симулированные ФД-профили указывают на дозозависимую супрессию сывороточного CTX-1 после одиночной п.к. дозы ALX-0141, в соответствии с моделью непрямого ответа, описывающей ингибирование синтеза сывороточного CTX-1. На основании этой модели, супрессия сывороточного CTX-1 будет зависеть от дозы ALX-0141. Максимальная степень ингибирования сывороточного CTX-1 будет расти с введением дозы вплоть до значения максимального эффекта (Imax); дополнительный рост дозы, как ожидалось, не приведет к дальнейшему росту эффекта, но будет пролонгировать время возвращения к исходному уровню.
Пример 4. Клинические данные
4.1 Методология
4.1.1 Дизайн
Двойное слепое, плацебо-контролируемое исследование I фазы с однократной нарастающей дозой было осуществлено в 1 когорте 2 здоровых женщин в постменопаузе, получающих одиночную подкожную (п.к.) дозу ALX-0141 0,003 мг/кг или плацебо (1 настоящий лекарственный препарат и 1 плацебо) и 5 когорт из 8 здоровых женщин в постменопаузе, получающих одиночные п.к. дозы ALX-0141 0,01, 0,03, 0,1, 0,3 и 1 мг/кг или плацебо (6 настоящих препаратов и 2 плацебо для каждой когорты). Для расчета тайминга образцов днем обработки был День 1.
Образцы плазмы собирали перед введением дозы, на 8, 12, 24, 48, 72, 96, 120 и 144 час после введения дозы, в Дни 14, 30, 60 и при контрольном обследовании (День 90) и, если применимо, дополнительно при ежемесячных визитах контрольного обследования для количественной оценки уровней лекарственного средства и биомаркера CTX-1.
4.1.2 Процедуры и оценки


4.1.3 Субъекты
Всего в данное исследование были зачислены 42 субъекта. Все субъекты были здоровыми волонтерами-женщинами в постменомпаузе. Популяция женщин в постменопаузе является предполагаемой целевой популяцией для этого типа лечения.
Основные критерии включения
Возраст: максимум 80 лет, включительно
Индекс Массы Тела (BMI): 18-36 кг/м2, включительно
Пол: женщины
Субъекты: здоровые волонтеры-женщины в постменопаузе
Лекарственная Терапия Исследования
1. Активное вещество: ALX-0141, тримерная конструкция 41 кДа, имеющая два структурных элемента-Нанотела, нацеленных на RANKL, соединенных с Нанотелом, нацеленным на человеческий сывороточный альбумин (ЧСА).
Активность: анти-RANKL (анти-лиганд рецептора-активатора ядерного фактора каппа-B)
Симптом: Потеря костной массы
Крепость: 0,65 мг/мл (Когорта 1), 2,17 мг/мл (Когорта 2), 6,5 мг/мл (Когорта 3)
: 21,7 мг/мл (Когорта 4) и 65 мг/мл (Когорты 5 и 6)
Лекарственная форма: п.к. инъекция
2. Плацебо: Визуально соответствующее лечение
Критерии оценки
PK: Концентрации ALX-0141 в плазме, ФК-параметры
PD: Концентрации P1NP, CTX-1, BAP и TRACP5b в сыворотке и концентрации креатинина, CTX-1 и NTX-1 в моче
Безопасность: AE, локальная переносимость, основные показатели жизнедеятельности, 12-электродная ЭКГ, клинические лабораторные анализы, врачебный осмотр, иммуногенность, 25-гидроксивитамин D в сыворотке, иммунофенотипирование WBC
4.1.4 Анализы
ФД-эффект ALX-0141 был изучен путем измерения концентраций в сыворотке CTX-1, TRACP5b, P1NP и BAP и соотношений концентраций NTX-1/креатинин в моче. CTX-1, TRACP5b и NTX-1 вовлечены в резорбцию кости, тогда как P1NP и BAP вовлечены в костеобразование.
Были использованы тесты на биомаркеры:
CTX-1 «Serum CROSSLAPS® ELISA» (кат. № AC-02F1; «Immunodiagnostic Systems Inc.», Болдон, Тайн-энд-Уир, Великобритания)
NTX-1 тИФА для определения NTX в моче «OSTEOMARK» (кат. №9006; «Inverness Medical» («Wampole Laboratories»), Принстон, Нью-Джерси)
TRACP5b тИФА «BONETRAP®» (кат. № SB-TR201A; «Immunodiagnostic Systems Inc.», Болдон, Тайн-энд-Уир, Великобритания)
P1NP «UNIQ™ P1NP RIA» (кат. № Q67034; «Orion Diagnostica Oy», Эспо, Финляндия)
BAP Иммуноферментный тест «OSTASE® BAP Immunoenzymetric Assay» (cat. № AC-20F1; «Immunodiagnostic Systems Inc.», Болдон, Тайн-энд-Уир, Великобритания)
Креатинин тест на креатинин (кат. No. 03039070; «Siemens Medical Solutions Diagnostics», Бреда, Нидерланды).
4.1.5 Статистика
Концентрации в плазме ALX-0141 и сывороточные уровни CTX-1 моделировали нелинейным моделированием со смешанными эффектами с помощью «NONMEM». Межиндивидуальная вариабельность (IIV) была установлена для каждого структурного параметра и была рассчитана как квадратный корень из дисперсии для соответствующего параметра x100. Экспоненциальная модель ошибок (добавка в логарифмической шкале) предполагалось для остаточной изменчивости. Использованным в пределах «NONMEM» способом оценки был «FOCEI».
Для данного популяционного анализа были использованы данные 31 волонтера-женщины в постменопаузе.
4.2 Фармакокинетика
4.2.1 Данные о концентрации в плазме
Измерения концентраций ALX-0141 осуществляли с помощью валидированного тИФА способа. Профили геометрического среднего в зависимости концентрации ALX-0141 в плазме от времени обработки (линейная и полулогарифмическая шкала) представлены на фигуре 3.
После п.к. введения 0,003 мг/кг ALX-0141 (n=1), измеряемые уровни ALX-0141 в плазме наблюдали, начиная с 48 часов после введения дозы. В среднем, при уровне дозы 0,01 мг/кг, ALX-0141 был измеряемым в плазме в пределах 24 часов. При уровнях доз ALX-0141 от 0,03 мг/кг вплоть до 1 мг/кг, ALX-0141 был измеряемым в плазме в пределах 8 часов. Было обнаружено, что геометрические средние концентрации ALX-0141 в плазме постепенно растут с максимальными средними концентрациями в плазме, достигаемыми между 3 и 6 днями после введения дозы при уровнях доз в диапазоне от 0,003 мг/кг до 0,03 мг/кг и между 1,5 и 2 днями при более высоких уровнях доз (0,1 мг/кг и 1 мг/кг). Средние концентрации ALX-0141 в плазме растут с увеличением дозы. После достижения пика концентрации в плазме, средние концентрации в плазме снижаются очень постепенно. В среднем, при наиболее высоких уровнях доз, средние концентрации ALX-0141 в плазме были все еще ниже LLOQ (0,0102 μг/мл) вплоть до Дня 60 (0,1 мг/кг и 0,3 мг/кг) или Дня 90 (1 мг/кг). При более низких уровнях доз, концентрации ALX-0141 в плазме были измеряемыми вплоть до Дня 7 (0,003 мг/кг, n=1), Дня 14 (0,01 мг/кг) или Дня 30 (0,03 мг/кг).
4.2.1 Фармакинетические параметры в плазме
Сводка ФК-параметров ALX-0141 в плазме представлена в таблице B-4.
Медианное значение tmax находится в диапазоне между 1,5 и 6 днями после введения дозы и имеет тенденцию к укорочению (1,5-2 дня) при более высоких уровнях дозы, в диапазоне от 0,1 мг/кг до 1 мг/кг по сравнению с более низкими уровнями дозы в диапазоне от 0,003 мг/кг до 0,03 мг/кг (3-6 дней). Геометрическое среднее значение периода полужизни можно рассчитать надежно для более высоких групп дозирования (0,1 мг/кг, 0,3 мг/кг и 1 мг/кг ALX-0141) и оно составило от 12,0 до 20,6 дней. После п.к. введения одиночной дозы ALX-0141, значения Cmax, AUC0-last и AUC0-inf увеличивались с ростом доз. Сверх диапазона доз 0,1 мг/кг, вплоть до 1 мг/кг, значения Cmax и AUC растут пропорциональным от дозы образом, тогда как более низкие дозы в диапазоне от 0,01 мг/кг до 0,1 мг/кг, судя по всему, Cmax and AUC0-last растут несколько более чем пропорционально от дозы.
4.2.3 Фармакокинетический анализ
У здоровых женщин в постменопаузе, фармакокинетика ALX-0141 адекватно характеризуется открытой однокамерной моделью с двумя скоростями абсорбции первого порядка из подкожного компартмента, и линейным (не связанной с мишенью) и нелинейным (связанной с мишенью) клиренсом из центральной камеры. Структурная модель изображена на фигуре 2 и оценки ФК-параметров перечислены в таблице B-5.
Путь, опосредованный мишенью, прибл. в 4 раза более эффективен, чем путь не опосредованный RANKL, но легко насыщается.
Масса тела была определяющей ковариатой объема распределения.
По всем структурным параметрам конечную ФК-модель оценили с хорошей точностью (25,2% или меньшей). Межиндивидульная вариабельность (IIV) была от низкой до умеренной для V (22,2%) и для F1 (36,5%). Большая межиндивидуальная вариабельность была выявлена для ka1 и ka2 (170 и 144%, соответственно), для CL (53%) и для Km (135%). Стандартное отклонение для остаточной ошибки оценили как равное 0,11 с хорошей точностью (13,7%).
4.3 Фармакодинамика
ФД-эффекты ALX-0141 изучили путем измерения сывороточных концентраций CTX-1, TRACP5b, P1NP и BAP, и соотношений NTX-1/креатинин в моче, которые вовлечены в резорбцию кости и/или образование кости. Средние сывороточные концентрации CTX-1, TRACP5b, P1NP и BAP выраженные как процент от исходного уровня представлены на фигурах 4 и 6 (CTX-1), фигуре 8 (TRACP5b), фигуре 9 (P1NP) и фигуре 10 (BAP). Средняя соотношения концентраций NTX-1/креатинина в моче представлены на фигурах 5 и 7. Сводка ФД-параметров представлена в таблице B-6.
4.3.1 CTX-1
CTX-1 является продуктом деградации кости, высвобожденном в результате активности остеокластов, и рассматривается как биомаркер резорбции кости. Средние сывороточные концентрации CTX-1 (как % от исходного уровня) после п.к. введения дозы ALX-0141 или плацебо в женщинах-волонтерах в постменопаузе представлены на фигурах 4 и 6. Изменения CTX-1 относительно исходного уровня показаны в таблице B-7.
После п.к. введения дозы ALX-0141 наблюдали быстрое снижение CTX-1 в пределах 8 часов после введения дозы (первый временная точка взятия образца) для всех 6 протестированных уровней доз. Средние наиболее низкие значения сывороточных концентраций CTX-1 после обработки ALX-0141 (активная обработка) варьировали между 8,8% (0,3 мг/кг, N=6) и 50,7% (0,003 мг/кг, n=1) исходного уровня по всем исследованным уровням доз, и снижались при увеличении дозы (фигура 6). Однако, почти максимальный эффект, по всей видимости, достигается при уровне дозы 0,1 мг/кг или выше. В данном исследовании уровень дозы 0,003 мг/кг может рассматриваться как BED. При трех наиболее низких уровнях доз, сывороточные концентрации CTX-1 начинают расти после достижения низшего значения и перед Днем 90, тогда как при трех наиболее высоких уровнях доз средние сывороточные концентрации CTX-1 остаются на низком уровне близком к низшему уровню вплоть до Дня 90 (0,1 мг/кг, 0,3 мг/кг, 1 мг/кг), а после начинают постепенно расти. Обработанный ALX-0141 субъект в Когорте 1 (0,003 мг/кг) демонстрирует сывороточную концентрацию CTX-1 близкую к исходному уровню на 60 день, т.е. в пределах -30% границы исходного уровня. Средние значения CTX-1 для других групп доз ALX-0141 не достигали 70% предела исходного уровня в пределах изначально спланированных 90 дней наблюдения. Низкие уровни CTX-1, которые сохранялись в течение более чем 90 дней почти во всех ALX-0141-обработанных субъектов и продолжались в течение примерно 1 года в нескольких субъектах, обработанных 0,01 мг/кг или большим количеством, что указывает на длительный ФД-эффект после одиночной п.к. инъекции ALX-0141.
4.3.2 NTX-1
NTX-1 является продуктом деградации коллагена I типа, который является неотъемлемым основным компонентом внеклеточного матрикса. Таким образом, NTX-1 рассматривается в качестве биомаркера для резорбции кости как результат активности остеокластов. Так как концентрация NTX-1 в моче варьируется в зависимости от субъема мочи, то для коррекции этой вариации определяли соотношение NTX-1 к креатинину в моче. Средние соотношения концентраций NTX-1/креатинина в моче (как % от исходного уровня) после п.к. введения дозы ALX-0141 или плацебо в женщинах-волонтерах в постменопаузе представлены в фигурах 5 и 7. Изменения соотношения NTX-1/креатина относительно исходного уровня показаны в таблице B-8.
При п.к. введении дозы ALX-0141, быстрое снижение соотношений концентраций NTX-1/креатинниа наблюдали с низшим уровнем на День 4 (0,003 мг/кг, n=1), День 6 (0,3 мг/кг, n=6), День 14 (0,01 мг/кг [n=6] и 0,03 мг/кг [n=6]) и День 60 (0,1 мг/кг [n=6] и 1 мг/кг [n=6]). Средние значения низшего уровня для соотношений NTX-1/креатинина в моче варьируют между 64,8% (0,003 мг/кг, n=1) и 16,1% (1 мг/кг, n=6) исходного уровня по всему исследованному диапазону доз и снижаются при увеличении доз. После обработки 0,01 мг/кг и 0,03 мг/кг средние соотношения концентраций NTX-1/креатинин остаются низкими вплоть до Дня 30 и начинают расти после и составляли примерно 70% от исходного уровня на День 120. После обработки 0,1 мг/кг, 0,3 мг/кг или 1 мг/кг соотношения NTX-1/креатинин в моче остаются низкими вплоть до Дня 60 (0,1 мг/кг) или Дня 90 (0,3 мг/кг и 1 мг/кг). После этого уровни NTX-1/креатинин начинают расти снова, но все еще остаются намного ниже исходного уровня на День 120. Двадцать два субъекта имели их соотношения NTX-1/креатинин все еще ниже 80% исходного уровня в момент проведения последнего индивидуального контрольного наблюдения. В группе обработанной плацебо, уровни соотношений NTX-1/креатинин остаются близкими к исходному уровню (80-120%) в течение всего исследуемого периода.
4.3.3 TRACP5b
TRACP5b является ферментом, полученным из остеокластов и является показателем количества остеокластов, и следовательно, рассматривается как биомаркер резорбции кости. Арифметическое среднее сывороточной концентрации TRACP5b (как процент исходного уровня) после п.к. введения дозы ALX-0141 или плацебо волонтерам-женщинам в постменопаузе показано на фигуре 8. Сывороточные концентрации TRACP5b демонстрируют схожий профиль с сывороточными уровнями CTX-1.
При п.к. введении дозы ALX-0141, сывороточные концентрации TRACP5b начинают расти в пределах 2-4 дней после введения дозы. Почти максимальный эффект достигался после примерно 14 дней с низшим уровнем, достигнутым на День 30 (0,003 мг/кг, 0,01 мг/кг, 0,03 мг/кг, 0,1 мг/кг и 1 мг/кг) или на День 60 (0,3 мг/кг). Средние низшие значения для TRACP5b варьируют между 70,1% (0,003 мг/кг, n=1) и 39,1% (0,3 мг/кг, n=6) исходного уровня по всему исследованному диапазону доз и снижались при росте доз. До Дня 60 (0,003 мг/кг, 0,01 мг/кг, 0,03 мг/кг и 0,1 мг/кг) и Дня 90 (0,3 мг/кг и 1 мг/кг), сывороточные концентрации TRACP5b едва изменились и были близки к уровням которые уже были достигнуты на День 14. После этого уровни TRACP5b постепенно росли и вернулись, по меньшей мере, до 80% от уровня исходного уровня в момент последнего контрольного обследования всех субъектов (причина для использования 80% заключается в том что у обработанных плацебо субъектов, наиболее низкие значения почти не достигали значений ниже 80%; это говорит о том, что снижение ≤20% находится в пределах нормальных вариаций с течением времени). Наиболее сильное снижение сывороточных концентраций TRACP5b достигалось при 0,3 мг/кг и 1 мг/кг ALX-0141. Снижение уровней TRACP5b не наблюдалось у субъектов, обработанных плацебо. Хотя сывороточные концентрации TRACP5b демонстрируют схожий профиль при сравнении с сывороточными концентрациями CTX-1, на основании сравнения индивидуальных концентраций TRACP5b и CTX-1 не было никаких указаний, что концентрации TRACP5b напрямую влияют на сывороточные концентрации CTX-1.
4.3.4 P1NP
P1NP высвобождается при внеклеточном процессировании вновь синтезированного препроколлагена перед включением коллагена в кость и считается биомаркером костеобразования. Арифметическое среднее сывороточной концентрации P1NP (как процент исходного уровня) после п.к. введения дозы ALX-0141 или плацебо волонтерам-женщинам в постменопаузе показано на фигуре 9.
После п.к. введения ALX-0141 сывороточные уровни P1NP начинают снижаться между Днями 14 и 30 вплоть до Дня 60 по всему исследованному диапазону доз. Низшие значения достигались между Днем 60 и 150. В целом, чем выше доза обработки, тем сильнее снижение концентраций P1NP в плазме и тем длиннее период снижения концентраций P1NP в плазме. Однако, почти максимальный эффект по всей видимости достигается при уровне дозы 0,1 мг/кг ALX-0141. Средние низшие значения для P1NP варьировали между 60,4% (0,01 мг/кг n=6) и 21,2% (1 мг/кг, на основании n=5) от исходного уровня по всем исследованным уровням доз. У большинства субъектов сывороточные концентрации P1NP не возвращались к 80% от исходного уровня в момент последнего визита контрольного обследования (причина для использования 80% заключается в том, что у обработанных плацебо субъектов, наиболее низкие значения почти не достигали значений ниже 80%; это говорит о том, что снижение ≤20% находится в пределах нормальных вариаций с течением времени). Эти данные подтверждают, что воздействие на P1NP сильно задерживается по сравнению с CTX-1 и TRACP5b. Эффект на P1NP не наблюдался у субъектов обработанных плацебо.
4.3.5 BAP
BAP является ферментом, который служит в качестве биомаркера активного костеобразования. Арифметическое среднее сывороточной концентрации BAP (как процент исходного уровня) после п.к. введения дозы ALX-0141 или плацебо волонтерам-женщинам в постменопаузе показано на фигуре 10.
После обработки 0,003 мг/кг ALX-0141 (n=1) отсутствовало четкое изменение от исходного уровня и сывороточные концентрации BAP имели тенденцию к росту у субъектов, подвергнутых обработке плацебо. После обработки 0,01 мг/кг-1 мг/кг ALX-0141, сывороточные концентрации BAP имели тенденцию к снижению после Дня 30. Это снижение сывороточных уровней BAP было менее выраженным, чем снижение сывороточных уровней P1NP. Низший уровень был достигнут на День 60 после обработки 0,01 мг/кг и 0,03 мг/кг, и на День 90 после обработки 0,1 мг/кг, 0,3 мг/кг и 1 мг/кг. Средние низшие значения для BAp варьируют между 85,3% (0,003 мг/кг, n=1) и 58,3% (1 мг/кг, n=6) исходного уровня по всему исследованному диапазону доз и снижались при росте доз. После обработки 0,01 мг/кг и 0,03 мг/кг ALX-0141, сывороточные уровни BAP имели тенденцию к росту после Дня 60, и были близки к уровням исходного уровня на День 90. После обработки 0,1 мг/кг, 0,3 мг/кг и 1 мг/кг, сывороточные концентрации BAp оставались низкими (0,1 мг/кг и 0,3 мг/кг) или были все еще пониженными (1 мг/кг) на День 20. Сывороточные концентрации BAP в последние визиты контрольного обследования варьировали среди субъектов, при этом у большинства субъектов демонстрируемые уровни BAP вернулись, по меньшей мере, к 80% от исходного уровня. Эти данные подтверждают, что подобно P1NP, эффект на BAP сильно задерживается по сравнению с эффектом CTX-1 и TRACP5b.
4.3.6 Заключение
Однократные п.к. введения ALX-0141 на уровнях доз в диапазоне от 0,003 мг/кг до 1 мг/кг, приводит к быстрому снижению сывороточных концентраций CTX-1 и TRACP5b, а также в соотношений концентраций NTX-1/креатин в моче, что позволяет предположить снижение резорбции кости. Ингибирующий эффект имел тенденцию к дозозависимости и был длительным.
(Почти) максимальный ингибирующий эффект, по-видимому, достигался при 0,1 мг/кг ALX-0141 для CTX-1 и при 0,3 мг/кг ALX-0141 для сывороточных концентраций TRACP5b и соотношений концентраций NTX-1/креатинин.
Однократные п.к. введения ALX-0141 на уровнях доз в диапазоне от 0,003 мг/кг до 1 мг/кг ALX-014 привели к постепенному снижению сывороточных концентраций P1NP, что указывает на тенденцию к уменьшению костеобразования. Ингибирующий эффект имел тенденцию к дозозависимости, с низшим уровнем достигаемым примерно со Дня 90 по День 150. Максимальный ингибирующий эффект, по-видимому, достигался при 0,1 мг/кг для сывороточных концентраций P1NP.
Подобно профилю P1NP, но в меньшей степени, тенденция к дозозависимости, постепенное снижение сывороточных концентраций ВАР, как представляется, происходит при наивысших протестированных уровнях доз (0,1 мг/кг, 0,3 мг/кг и 1 мг/кг ALX-0141).
В целом, наиболее низкая введенная доза (0,003 мг/кг), по-видимому, является биологически эффективной, тогда как биологический эффект 0,1 мг/кг, как представляется, близок к эффекту 0,3 мг/кг и 1 мг/кг. Следовательно, уровень дозы 0,003 мг/кг может рассматриваться как BED. В соответствии с ожидаемыми эффектами антирезорбционных агентов, ALX-0141 демонстрирует сильный ингибирующий эффект на маркеры резорбции кости и умеренный эффект на уменьшение маркеров костеобразования.
4.3.7 Фармакодинамический анализ
Непрямая ФК/ФД модель ингибирования выработки сывороточного CTX-1 отражала наблюдаемые временные профили сывороточного CTX-1 адекватно.
В этой непрямой модели ответа, скорость изменения CTX-1 (Ответ, R) описывается посредством:
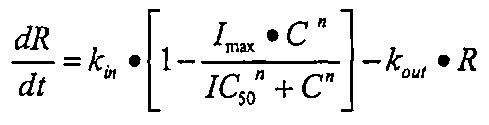
Где kin, скорость синтеза нулевого порядка; R, сыворочный уровень CTX-1, Imax, максимальное ингибирование (1<Imax<0); C, концентрация ALX-0141; n, форм-фактор соотношения концетрация-ответ; и kout, константа скорости выведения сывороточного CTX-1 первого порядка.
В целом все структурные параметры конечной модели ФК/ФД оценивали с точностью <88% (см. таблицу B-9). Межиндивидуальная вариабельность (IIV) была от низкой до умеренной для Imax (6,4%), для исходного уровня (22,1%) и для kin (46,4%). Остаточная вариабельность по оценке, составляла 32,1% с хорошей точностью (12,1%).
ALX-0141 был определен как мощный ингибитор выработки сывороточного CTX-1, доказательством чего является его низкое значение IC50 равное 0,674 нг/мл или 16,4 пМ.
Уровень дозы был идентифицирован как определяющая ковариата на скорости выработки нулевого порядка ответа (сывороточный CTX-1).
Предиктивная эффективность моделей была подтверждена «Visual Predictive Checks».
4.4. Обсуждение
Клиническая фармакокинетика ALX-0141 была достаточно хорошо спрогнозирована на основании преклинических данных на обезьянах, аллометрически масштабирована, и объединена с разумными допущениями относительно различий в ремоделировании кости (см. фигуру 11).
Неожиданно оказалось, что наблюдаемые профили зависимости сывороточного CTX-1 от времени у женщин в постменопаузе оказались значительно более устойчивыми у людей, чем те, что были спрогнозированы на основании преклинической информации (см. фигуру 12).
Это расхождение между наблюдаемыми профилями зависимости CTX-1 от времени и профилями полученными симуляциями на основе модели было связано, по оценкам, в более чем с 5,4 кратной мощностью ALX-0141 in vivo (IC50 0,674 нг/мл или 16,4 пМ) (см. таблицу B-9) относительно того, что ожидалось на основании преклинических данных (3.7 нг/мл или 89 пМ) (см. таблицу B-3).
4.5. Заключение
Однократные п.к. введение ALX-0141 вплоть до 1 мг/кг было безопасно и хорошо переносилось здоровыми женщинами в постменопаузе. Никаких смертей или связанных с обработкой серьезных нежелательных явлений (СНЯ) не происходило и максимальная переносимая доза (МПД) не была достигнута.
Наблюдалось дозозависимое увеличение в экспозиции (Cmax и AUC). ФК-модель является нелинейной, из-за насыщаемого мишень зависимого CL-компонента. Сывороточный период полужизни между 12,0 и 20,6 днями наблюдали для когорт 0,1-1 мг/кг.
ALX-0141 демонстрирует статистически значимую супрессию биомаркеров резорбции кости: сывороточного CTX-1 и NTX-1/креатинин в моче. Этот эффект является неожиданно пролонгированным и устойчивым по сравнению с тем что был спрогнозирован на основе преклинической информации.
Длительность ингибирования биомаркеров после одиночной п.к. инъекции ALX-0141 росла с дозой, достигая максимальной длительности 360 дней после введения дозы 1 мг/кг.
Термины и выражения, которые были использованы, используются в качестве терминов описания, а не ограничения, и нет намерения в применении таких терминов и выражений для исключения каких-либо эквивалентов признаков, продемонстрированных и описанных или их частей, при этом признается, что различные модификации возможны в пределах объема притязаний изобретения.
Все источники, описанные в данном документе, включены ссылкой, в частности для изложения того, что упоминается выше, включая специфические полипептиды и свойства полипептидов, которые пригодны в способах, описанных в данном документе.
Таблицы







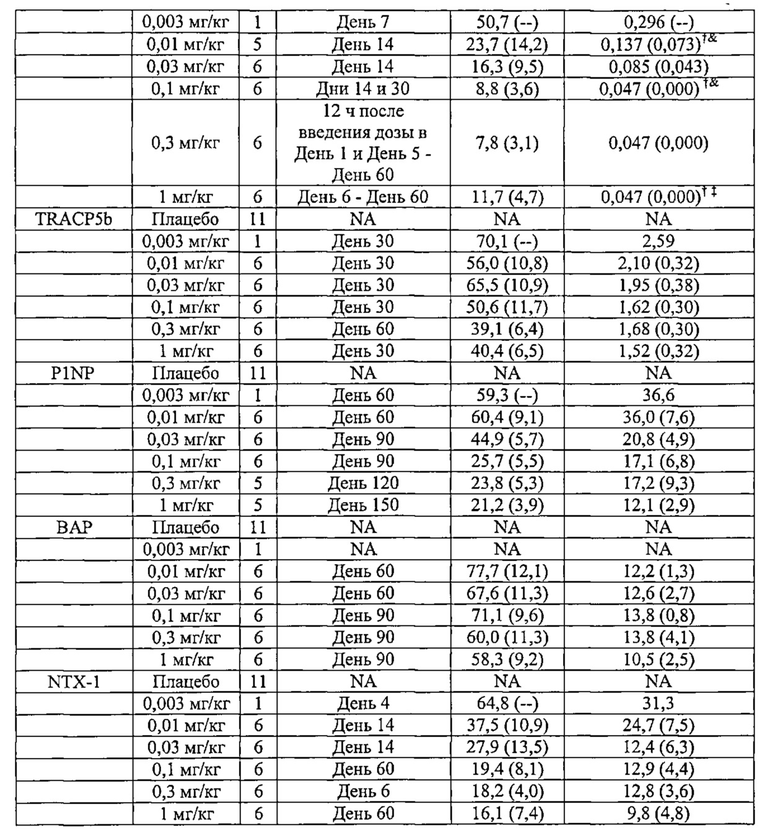
Для всех данных представлено арифметическое среднее (SD), за исключением когорты 0,003 мг/кг, поскольку для этой когорты N=1.
NA, не применимо.
$ Дается только тогда, когда самый низкий уровень ниже предварительно определенного порогового значения: 70% исходного уровня для CTX-1, 80% исходного уровня для других ФД-параметров.
* Наиболее низкое среднее значение по сравнению с исходным уровнем. Результаты обработанных плацебо субъектов из всех обработанных групп были объединены. За исключение сывороточных концентраций СЕЧ-1 и группы с дозой 0,003 мг/кг, эта таблица представляет только средние наиболее низкие уровни, основанные на N≥5.
# уровни CTX-1: нг/мл; TRACP5b: мЕд./мл; P1NP и BAP: μг/л; соотношения NTX-1/креатинина: μмоль/моль




Аспекты изобретения
Аспект A-1: Способ ингибирования резорбции кости или активности остеокластов у субъекта, включающий введению субъекту полипептида, который специфически связывает лиганд рецептора-активатора ядерного фактора каппа-B (RANKL), где количество введенного полипептида является эффективным при изменении одного или нескольких маркеров метаболизма кости и/или гомеостаза кости в течение, по меньшей мере, 30 дней после введения.
Аспект A-2: Способ по аспекту A-1, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 10 мг/кг.
Аспект a-3: Способ по любому из Аспектов A-1 и A-2, в котором маркеры костного метаболизма выбирают из кросс-связывающего телопептида коллагена I типа (CTX-1), N-концевого телопептида коллагена I типа (NTX-1), тартрат-устойчивой изоформы 5b кислой фосфатазы (TRACP5b), N-концевого пропептида проколлагена I типа (P1NP) и костной щелочной фосфатазы (BAP).
Аспект A-4: Способ по Аспекту A-3, в котором один или несколько из числа CTX-1, NTX-1, TRACP5b, P1NP и BAP измеряют с использованием анализа тИФА, специфичного для CTX-1, NTX-1, или TRACP5b; радиоиммуноанализа, специфичного для P1NP, или иммуноферментного анализа, специфичного для BAP, соответственно.
Аспект A-5: Способ по любому из Аспектов A-1-А-4, в котором полипептид содержит один или несколько одиночных вариабельных доменов иммуноглобулина, которые специфически связывают RANKL.
Аспект A-6: Способ по любому из Аспектов A-1-A-5, в котором полипептид имеет кажущийся KD для связывания рекомбинантного растворимого RANKL (sRANKL) 0,01-0,05 нМ, предпочтительно 0,04 нМ, определенное с помощью «Biacore».
Аспект A-7: Способ по любому из Аспектов A-1-A-6, в котором иммуноглобулиновый(ые) одиночный(ые) вариабельный(ые) домен(ы) включает(ют) или состоит(ят) из одного или нескольких VHH-доменов, одного или нескольких гуманизированных VHH-доменов, и/или одного или нескольких верблюдизированных VH-доменов.
Аспект A-8: Способ по любому из аспектов A-1-A-7, в котором полипептид включает один или несколько доменных антител, которые специфически связывают RANKL, одну или несколько аминокислотных последовательностей, которые специфически связывают RANKL, которые подходят для применения в качестве доменного антитела, одного или нескольких однодоменных антител, которые специфически связывают RANKL, одной или нескольких аминокислотных последовательностей, которые специфически связывают RANKL, которые подходят для применения в качестве однодоменного антитела, или одного или нескольких «dAb», которые специфически связывают RANKL.
Аспект A-9: Способ по любому из Аспектов A-1-A-8, в котором полипептид является мультивалентной конструкцией, содержащим два или несколько одиночных вариабельных доменов иммуноглобулина, которые специфически связывают RANKL.
Аспект A-10: Способ по Аспекту A-9, в котором мультивалентная конструкция содержит два одиночных вариабельных домена иммуноглобулина, которые специфически связывают RANKL.
Аспект A-11: Способ по любому из аспектов A-5-A-10, в котором вариабельный домен иммуноглобулина по существу состоит из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в котором CDR1 выбирают из SEQ ID NO: 1, CDR2 выбирают из SEQ ID NO: 2, a CDR3 выбирают из SEQ ID NO: 3.
Аспект A-12: Способ по любому из Аспектов A-5-A-11, в котором мультивалентная конструкция включает или состоит из SEQ ID NO: 10 или SEQ ID NO: 12.
Аспект A-13: Способ по любому из аспектов A-5-A-12, в котором мультивалентная конструкция дополнительно включает, по меньшей мере, одну составляющую для удлинения периода полужизни.
Аспект A-14: Способ по Аспекту A-13, в котором, по меньшей мере, одна составляющая для удлинения периода полужизни специфически связывает сывороточный белок.
Аспект A-15: Способ по Аспекту A-14, в котором сывороточный белок является сывороточным альбумином, и в частности человеческим сывороточным альбумином, тироксинсвязывающим белком, (человеческим) трансферрином, фибриногеном, иммуноглобулином, таким как IgG, IgE или IgM, или одни из сывороточных белков, перечисленных в WO 04/003019.
Аспект A-16: Способ по любому из Аспектов A-13-A-15, в котором, по меньшей мере, одна составляющая для удлинения периода полужизни включает или состоит из иммуноглобулинового одиночного вариабельного домена.
Аспект A-17: Способ по Аспекту A-16, в котором одиночный вариабельный домен иммуноглобулина включает или состоит из VHH-домена, гуманизированного VHH-домена, или верблюдизированного VH-домена.
Аспект A-18: Способ по любому из Аспектов A-16 или A-17, в котором одиночный вариабельный домен иммуноглобулина включает или состоит из SEQ ID NO: 14.
Аспект A-19: Способ по любому из Аспектов A-13-A-16, в котором, по меньшей мере, одна составляющая, удлиняющая период полужизни, включает доменное антитело, аминокислотную последовательность, которая подходит для применения в качестве доменного антитела, однодоменное антитело, аминокислотную последовательность, которая подходит для применения в качестве однодоменного антитела, или «dAb».
Аспект A-20: Способ по Аспекту A-13, в котором, по меньшей мере, одна составляющая, удлиняющая период полужизни, включает одну или несколько молекул полиэтиленгликоля.
Аспект A-21: Способ по любому из Аспектов A-5-A-11, в котором полипептид перекрестно блокирует связывание SEQ ID NO: 10 или SEQ ID NO: 12 с RANKL.
Аспект A-22: Способ по любому из Аспектов A-5-A-11, в котором полипептид перекрестно блокирован от связывания с RANKL посредством SEQ ID NO: 10 или SEQ ID NO: 12.
Аспект A-23: Способ по любому из Аспектов A-1-A-22, в котором полипептид вводят в виде одиночной дозы.
Аспект A-24: Способ по любому из Аспектов A-11-A-23, в котором полипептид вводят подкожно.
Аспект A-25: Способ по любому из Аспектов A-1-A-24, в котором субъект имеет остеопороз.
Аспект B-1: Способ по любому из Аспектов A-1-A-25, в котором маркер костного метаболизма является перекрестно-связанным телопептидом коллагена I типа (CTX-1).
Аспект B-2: Способ по Аспекту B-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней CTX-1, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60, 90 120, 150, 180, 210 или 270 дней после введения.
Аспект B-3: Способ по Аспекту B-2, в котором полипептид вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг.
Аспект B-4: Способ по Аспекту B-3, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект B-5: Способ по Аспекту B-2, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг.
Аспект B-6: Способ по Аспекту B-5, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-7: Способ по Аспекту B-6, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект B-8: Способ по Аспекту B-7, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект B-9: Способ по Аспекту B-2, в котором полипептид вводят в количестве от около 0, 0,1 мг/кг до около 1 мг/кг.
Аспект B-10: Способ по Аспекту B-9, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 150 дней после введения.
Аспект B-11: Способ по Аспекту B-10, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 180 дней после введения.
Аспект B-12: Способ по Аспекту B-11, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 210 дней после введения.
Аспект B-13: Способ по Аспекту B-12, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 270 дней после введения.
Аспект B-14: Способ по Аспекту B-1, в котором количество введенного полипептида является эффективным при снижении сывороточного уровня перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем в течение, по меньшей мере, 30, 60, 90, 120, 150 или 180 дней, и/или от 30 дней до 3 месяцев, от 3 месяцев до 6 месяцев, или 6 месяцев до 1 года после введения.
Аспект B-15: Способ по Аспекту B-14, в котором полипептид вводят в количестве меньшем или равном 0,03 мг/кг.
Аспект B-16: Способ по Аспекту B-14, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг.
Аспект B-17: Способ по Аспекту B-16, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг.
Аспект B-18: Способ по любому из Аспектов B-15-B-17, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект B-19: Способ по любому из Аспектов B-16-B-17, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-20: Способ по Аспекту B-14, в котором полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг.
Аспект B-21: Способ по Аспекту B-14, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 0,3 мг/кг.
Аспект B-22: Способ по любому из Аспектов B-20-B-21, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект B-23: Способ по любому из Аспектов B-20-B-21, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, от около 30 дней до 3 месяцев после введения.
Аспект B-24: Способ по Аспекту B-14, в котором полипептид вводят в количестве от около 0, 0,1 мг/кг до около 1 мг/кг.
Аспект B-25: Способ по Аспекту B-24, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект B-26: Способ по Аспекту B-14, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг.
Аспект B-27: Способ по Аспекту B-14, в котором полипептид вводят в количестве меньшем или равном 0,3 мг/кг.
Аспект B-28: Способ согласно любому из Аспектов B-26-B-27, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, от около 3 месяцев до 6 месяцев после введения.
Аспект B-29: Способ по Аспекту B-14, в котором полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг.
Аспект B-30: Способ по Аспекту B-14, в котором полипептид вводят в количестве от около 1 мг/кг до около 3 мг/кг.
Аспект B-31: Способ по Аспекту B-14, в котором полипептид вводят в количестве меньшем или равном 1 мг/кг.
Аспект B-32: Способ согласно любому из Аспектов B-29, B-30 и B-31, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 150 дней после введения.
Аспект B-33: Способ по Аспекту B-32, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 180 дней (или 6 месяцев) после введения.
Аспект B-34: Способ по любому из Аспектов B-29, B-30 и B-31, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, от около 6 месяцев до 1 года после введения.
Аспект B-35: Способ по Аспекту B-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней CTX-1, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60, 90 или 120 дней после введения.
Аспект B-36: Способ по Аспекту B-35, в котором полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг.
Аспект B-37: Способ по Аспекту B-36, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект B-38: Способ по Аспекту B-35, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект B-39: Способ по Аспекту B-38, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-40: Способ по Аспекту B-39, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект B-41: Способ по Аспекту B-40, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект B-42: Способ по Аспекту B-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней CTX-1, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60 или 90 дней после введения.
Аспект B-43: Способ по Аспекту B-42, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект B-44: Способ по Аспекту B-42, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг.
Аспект B-45: Способ по любому из Аспектов B-43-B-44, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-46: Способ по Аспекту B-45, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект B-47: Способ по любому из Аспектов B-1-B-46, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней перекрестно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 45% в течение 8 часов после введения.
Аспект B-48: Способ по любому из Аспектов B-1-B-47, в котором у субъекта ингибируется резорбция кости ингибируется как определено тИФА для CTX-1.
Аспект B-49: Способ по любому из Аспектов B-1-B-48, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 50%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект B-50: Способ по любому из Аспектов B-1-B-49, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 50%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-51: Способ по любому из Аспектов B-1-B-50, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 50%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект B-52: Способ по любому из Аспектов B-1-B-51, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 50%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект B-53: Способ по любому из Аспектов B-1-B-52, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 50%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 150 дней после введения.
Аспект B-54: Способ по любому из Аспектов B-1-B-53, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 50%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 180 дней после введения.
Аспект B-55: Способ по любому из Аспектов B-1-B-54, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект B-56: Способ по любому из Аспектов B-1-B-55, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-57: Способ по любому из Аспектов B-1-B-56, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект B-58: Способ по любому из Аспектов B-1-B-57, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект B-59: Способ по любому из Аспектов B-1-B-58, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 60%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 150 дней после введения.
Аспект B-60: Способ по любому из Аспектов B-1-B-59, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект B-61: Способ по любому из Аспектов B-1-B-60, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-62: Способ по любому из Аспектов B-1-B-61, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект B-63: Способ по любому из Аспектов B-1-B-62, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект B-64: Способ по любому из Аспектов B-1-B-63, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект B-65: Способ по любому из Аспектов B-1-B-64, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект B-66: Способ по любому из Аспектов B-1-B-65, в котором сывороточные уровни CTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект C-1: Способ по любому из Аспектов A-1-A-25, в котором маркер костного метаболизма является N-концевым телопептидом коллагена I типа (NTX-1).
Аспект C-2: Способ по Аспекту C1, в котором количество введенного полипептида является эффективным при снижении NTX-1, по меньшей мере, на 30%, определенном как соотношение NTX-1 к креатинину в моче, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30, 60, 90, 120 или 180 дней, или, по меньшей мере, 10 месяцев или, по меньшей мере, 12 месяцев после введения.
Аспект C-3: Способ по Аспекту C-2, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг.
Аспект C-4: Способ по Аспекту C-3, в котором уровни NTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект C-5: Способ по Аспекту C-4, в котором уровни NTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект C-6: Способ по Аспекту C-2, в котором полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг.
Аспект C-7: Способ по Аспекту C-6, в котором уровни NTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект C-8: Способ по Аспекту C-2, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект C-9: Способ по Аспекту C-8, в котором уровни NTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект C-10: Способ по Аспекту C-2, в котором полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг.
Аспект C-11: Способ по Аспекту C-10, в котором уровни NTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 180 дней (или 6 месяцев) после введения.
Аспект C-12: Способ по Аспекту C-10, в котором уровни NTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 10 месяцев после введения.
Аспект C-13: Способ по Аспекту C-10, в котором уровни NTX-1 снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 1 года (12 месяцев; 360 дней) после введения.
Аспект C-14: Способ по Аспекту C1, в котором количество введенного полипептида является эффективным при снижении NTX-1, по меньшей мере, на 45%, определенном как соотношение NTX-1 к креатинину в моче, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30, 60, 90, 120, 180 или 210 дней, и/или от 30 дней до 3 месяцев, от 3 месяцев до 6 месяцев, или от 6 месяцев до 1 года после введения.
Аспект C-15: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг.
Аспект C-16: Способ по Аспекту C-15, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг.
Аспект C-17: Способ по любому из аспектов Аспекту C-15 и C-16, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 60 дней после введения.
Аспект C-18: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг.
Аспект C-19: Способ по Аспекту C-18, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект C-20: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг.
Аспект C-21: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 0,3 мг/кг.
Аспект C-22: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг.
Аспект C-23: Способ по Аспекту C-14, в котором полипептид вводят в количестве меньшем или равном 0,03 мг/кг.
Аспект C-24: Способ по любому из аспектов Аспекту C-20, C-21, C-22 и C-23, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, от 30 дней до 3 месяцев после введения.
Аспект C-25: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект C-26: Способ по Аспекту C-25, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект C-27: Способ по Аспекту C-26, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект C-28: Способ по Аспекту C-27, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 150 дней после введения.
Аспект C-29: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг.
Аспект C-30: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг.
Аспект C-31: Способ по Аспекту C-14, в котором полипептид вводят в количестве меньшем или равном 0,3 мг/кг.
Аспект C-32: Способ по любому из аспектов Аспекту C-29, C-30 и C-31, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, от 3 месяцев до 6 месяцев после введения.
Аспект C-33: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг.
Аспект C-34: Способ по Аспекту C-14, в котором полипептид вводят в количестве от около 1 мг/кг до около 3 мг/кг.
Аспект C-35: Способ по Аспекту C-14, в котором полипептид вводят в количестве меньшем или равном 1 мг/кг.
Аспект C-36: Способ по любому из аспектов Аспекту C-33, C-34 и C-35, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 180 дней (или 6 месяцев) после введения.
Аспект C-37: Способ по любому из аспектов Аспекту C-33, C-34 и C-35, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 210 дней после введения.
Аспект C-38: Способ по любому из аспектов Аспекту C-33, C-34 и C-35, в котором уровни NTX-1 снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, от около 6 месяцев до 1 года после введения.
Аспект C-39: Способ по Аспекту C-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней NTX-1, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60, 90 или 120 дней после введения.
Аспект C-40: Способ по Аспекту C-39, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект C-41: Способ по Аспекту C-40, в котором уровни NTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект C-42: Способ по Аспекту C-39, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг.
Аспект C-43: Способ по Аспекту C-42, в котором уровни NTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект C-44: Способ по Аспекту C-43, в котором уровни NTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект C-45: Способ по Аспекту C-39, в котором полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг.
Аспект C-46: Способ по Аспекту C-45, в котором уровни NTX-1 снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект C-47: Способ по Аспекту C-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней NTX-1, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60 или 90 дней после введения.
Аспект C-48: Способ по Аспекту C-47, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг.
Аспект C-49: Способ по Аспекту C-47, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг.
Аспект C-50: Способ по Аспекту C-47, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект C-51: Способ по любому из аспектов Аспекту C-48 и C-49, в котором уровни NTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30 дней после введения.
Аспект C-52: Способ по любому из аспектов Аспекту C-49 и C-50, в котором уровни NTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, от около 30 дней до 30 месяцев после введения.
Аспект C-53: Способ по Аспекту C-47, в котором полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг.
Аспект C-54: Способ по Аспекту C-53, в котором уровни NTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект C-55: Способ по Аспекту C-54, в котором уровни NTX-1 снижены, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект C-56: Способ по любому из аспектов Аспекту C-1-C-55, в котором уровни NTX-1 снижены, по меньшей мере, на 20%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 90 дней после введения.
Аспект C-57: Способ по любому из аспектов Аспекту C-1-C-56, в котором уровни NTX-1 снижены, по меньшей мере, на 20%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 120 дней после введения.
Аспект C-58: Способ по любому из аспектов Аспекту C-1-C-57, в котором уровни NTX-1 снижены, по меньшей мере, на 20%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 150 дней после введения.
Аспект C-59: Способ по любому из аспектов Аспекту C-1-C-58, в котором уровни NTX-1 снижены, по меньшей мере, на 20%о, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 180 дней после введения.
Аспект C-60: Способ по любому из аспектов Аспекту C-1-C-59, в котором количество введенного полипептида является эффективным при снижении в моче уровней NTX-1, по меньшей мере, на 45% в течение 8 часов после введения.
Аспект C-61: Способ по любому из аспектов Аспекту C-1-C-60, в котором соотношение NTX-1 к креатинину в моче у субъекта определяется тИФА для NTX-1.
Способ по аспектам C-1-C-61, может быть в частности способом по любому из Аспектов B-1-B-66.
Аспект D-1: Способ по любому из Аспектов A-1-A-25, в котором маркером костного метаболизма является тартрат-устойчивой изоформой 5b кислой фосфатазы (TRACP5b)
Аспект D-2: Способ по Аспекту D-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней TRACP5b, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60, 90 или 120 дней после введения.
Аспект D-3: Способ по Аспекту D-2, в котором полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг.
Аспект D-4: Способ по Аспекту D-7, в котором сывороточные уровни TRACP5b снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект D-5: Способ по Аспекту D-4, в котором сывороточные уровни TRACP5b снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект D-6: Способ по Аспекту D-2, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект D-7: Способ по Аспекту D-6, в котором сывороточные уровни TRACP5b снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект D-8: Способ по Аспекту D-2, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг.
Аспект D-9: Способ по Аспекту D-8, в котором сывороточные уровни TRACP5b снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект D-10: Способ по Аспекту D-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней TRACP5b, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60 или 90 дней после введения.
Аспект D-11: Способ по Аспекту D-10, в котором полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг.
Аспект D-12: Способ по Аспекту D-11, в котором сывороточные уровни TRACP5b снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект D-13: Способ по Аспекту D-10, в котором полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг.
Аспект D-14: Способ по Аспекту D-13, в котором сывороточные уровни TRACP5b снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект D-15: Способ по Аспекту D-14, в котором сывороточные уровни TRACP5b снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Способ по аспектам D-1-D-15 может быть в частности способом по любому из Аспектов B-1-B-66 и/или C-1-C-61.
Аспект E-1: Способ по любому из Аспектов A-1-A-25, в котором маркер костного метаболизма является N-концевым пропептидом коллагена I типа (P1NP).
Аспект E-2: Способ по Аспекту E-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней P1NP, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60, 90 или 120 дней после введения.
Аспект E-3: Способ по Аспекту E-2, в котором полипептид вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг.
Аспект E-4: Способ по Аспекту E-3, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект E-5: Способ по Аспекту E-4, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект E-6: Способ по Аспекту E-5, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект E-7: Способ по Аспекту E-2, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг.
Аспект E-8: Способ по Аспекту E-7, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 120 дней после введения.
Аспект E-9: Способ по Аспекту E-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней P1NP, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60 или 90 дней после введения.
Аспект E-10: Способ по Аспекту E-9, в котором полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг.
Аспект E-11: Способ по Аспекту E-10, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект E-12: Способ по Аспекту E-11, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект E-13: Способ по Аспекту E-12, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Аспект E-14: Способ по Аспекту E-1, в котором количество введенного полипептида является эффективным при снижении сывороточных уровней P1NP, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, около 30, 60 или 90 дней после введения.
Аспект E-15: Способ по Аспекту E-14, в котором полипептид вводят в количестве от около 0,01 мг/кг до около 1 мг/кг.
Аспект E-16: Способ по Аспекту E-15, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30 дней после введения.
Аспект E-17: Способ по Аспекту E-16, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 60 дней после введения.
Аспект E-18: Способ по Аспекту E-17, в котором сывороточные уровни P1NP снижены, по меньшей мере, на 70%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
Способ по аспектам E-1-E-18 может быть, в частности, способом по любому из Аспектов B-1-B-66, C-1-C-61 и/или D-1-D-15.






















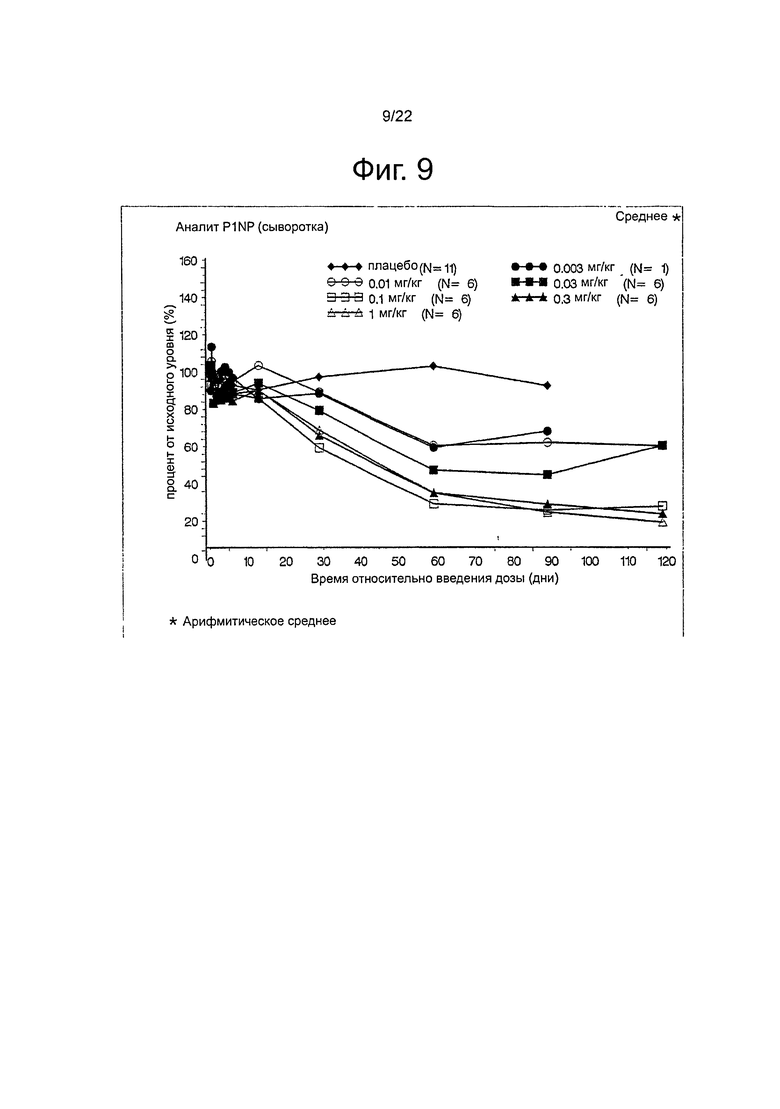





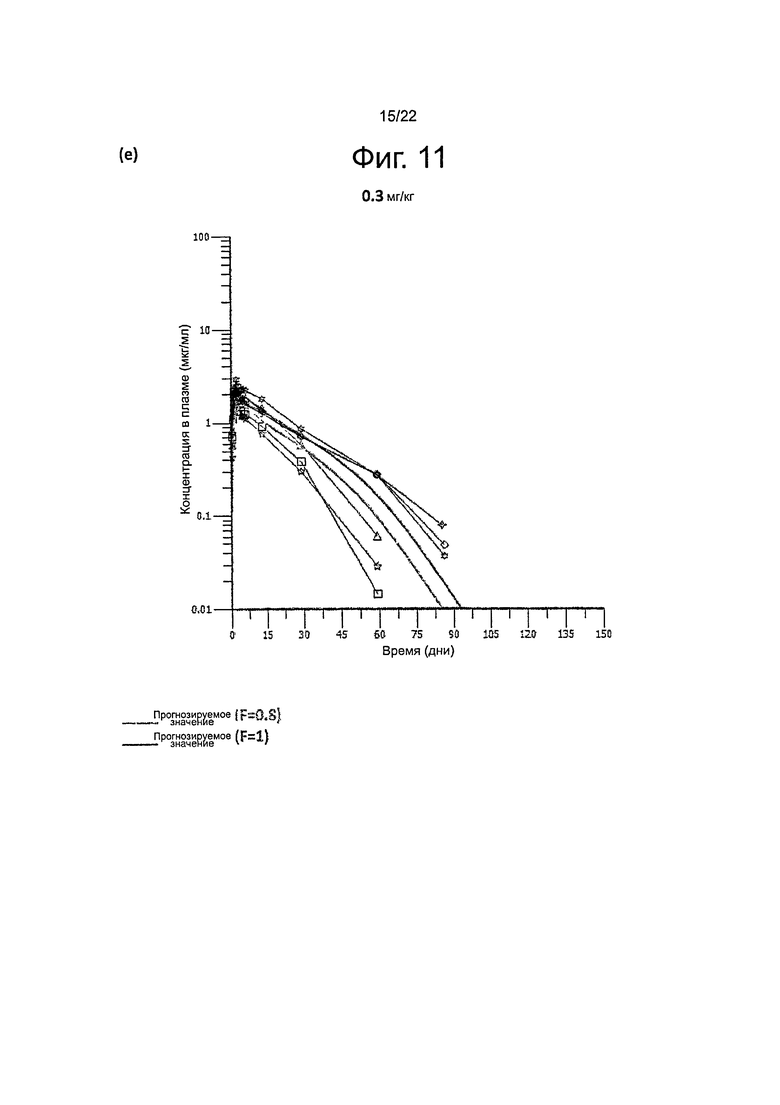

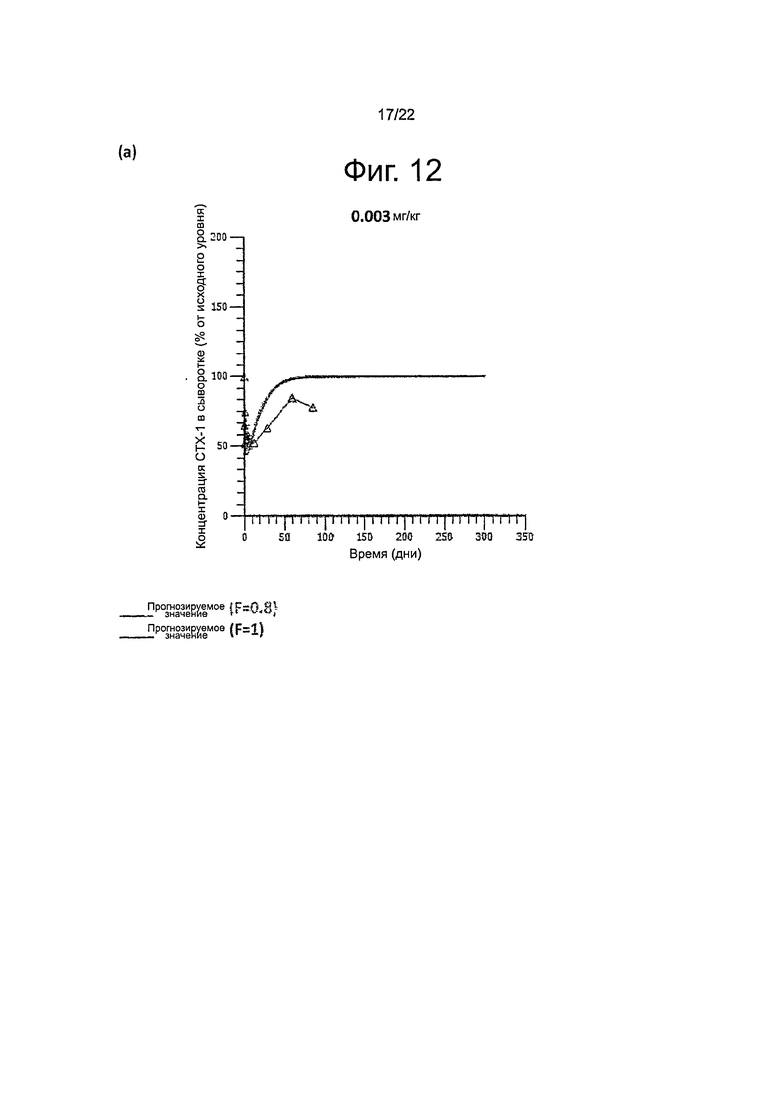

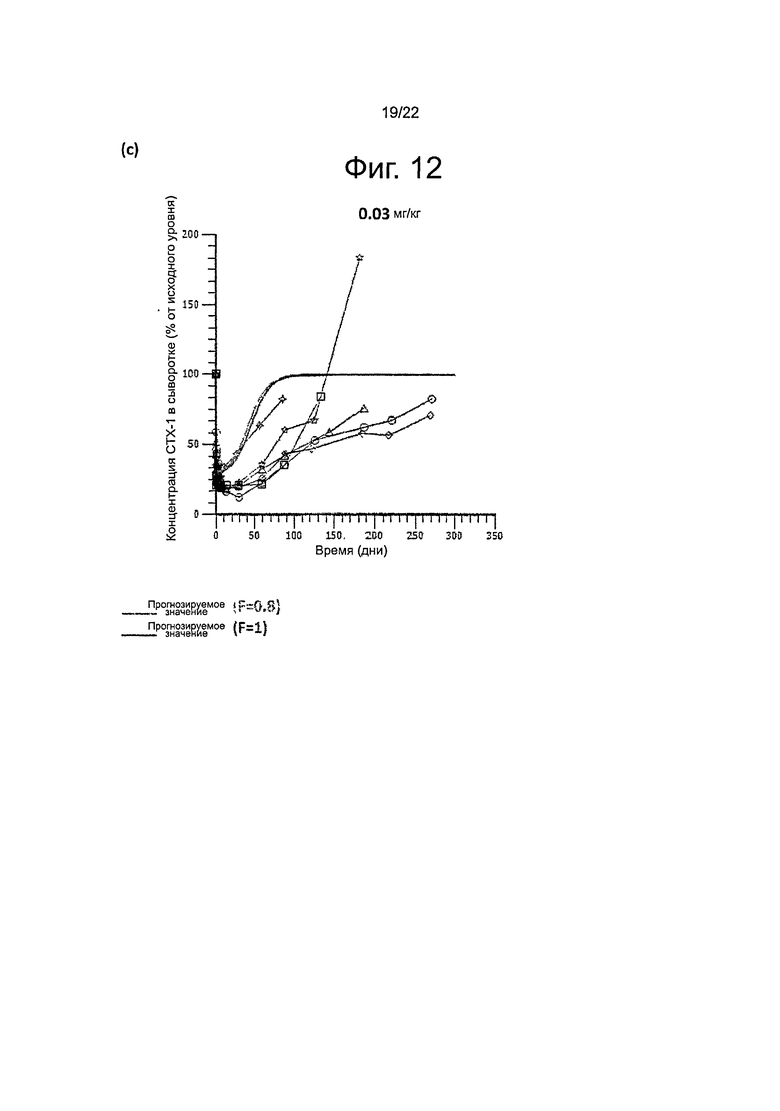

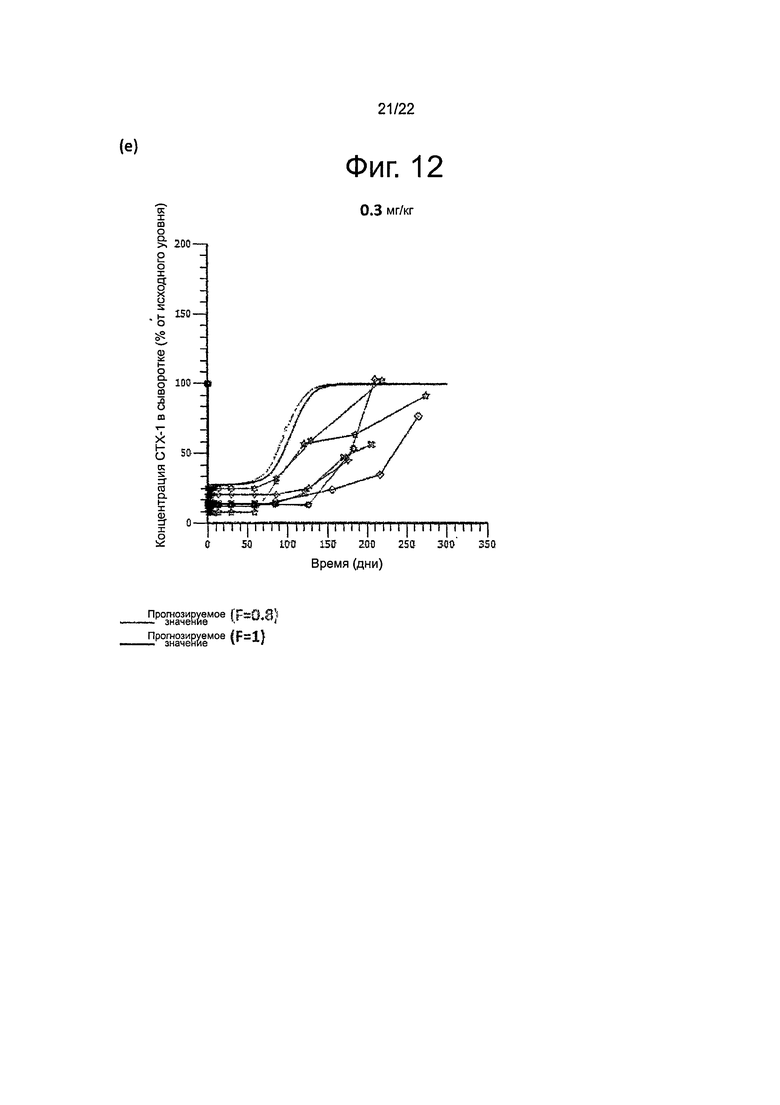

Изобретение относится к биотехнологии. Описан способ ингибирования резорбции кости у субъекта, включающий введение субъекту полипептида, который специфически связывает лиганд рецептора активатора ядерного фактора каппа-B (RANK-L) и который содержит два или большее количество одиночных вариабельных доменов иммуноглобулина, которые специфически связывают RANK-L и которые по существу состоят из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в котором CDR1 выбирают из SEQ ID NO: 1, CDR2 выбирают из SEQ ID NO: 2, а CDR3 выбирают из SEQ ID NO: 3, где количество введенного полипептида является эффективным для изменения одного или нескольких маркеров метаболизма кости и/или гомеостаза кости выбранного из перекрёстно связывающего телопептида коллагена I типа (CTX-1) и N-концевого телопептида коллагена I типа (NTX-1) в течение, по меньшей мере, 30 дней после введения. Также описан способ ингибирования активности остеокластов у субъекта, включающий введение субъекту полипептида, который специфически связывает лиганд рецептора активатора ядерного фактора каппа-B (RANK-L) и который содержит два или большее количество одиночных вариабельных доменов иммуноглобулина, которые специфически связывают RANK-L и которые по существу состоят из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в котором CDR1 выбирают из SEQ ID NO: 1, CDR2 выбирают из SEQ ID NO: 2, а CDR3 выбирают из SEQ ID NO: 3, где количество введенного полипептида является эффективным для изменения одного или нескольких маркеров метаболизма кости и/или гомеостаза кости выбранного из перекрёстно связывающего телопептида коллагена I типа (CTX-1) и N-концевого телопептида коллагена I типа (NTX-1) в течение, по меньшей мере, 30 дней после введения. Описанные способы позволяют вводить субъекту полипептиды против RANK-L менее часто и/или в более низкой дозе, при этом поддерживая эффективное ингибирование резорбции кости и/или активности остеокластов в субъекте в течение неожиданно длительных периодов времени, особенно в свете введенных доз. 2 н. и 4 з.п. ф-лы, 12 ил., 11 табл., 4 пр.
1. Способ ингибирования резорбции кости у субъекта, включающий введение субъекту полипептида, который специфически связывает лиганд рецептора активатора ядерного фактора каппа-B (RANK-L) и который содержит два или большее количество одиночных вариабельных доменов иммуноглобулина, которые специфически связывают RANK-L и которые по существу состоят из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в котором CDR1 выбирают из SEQ ID NO: 1, CDR2 выбирают из SEQ ID NO: 2, а CDR3 выбирают из SEQ ID NO: 3, где количество введенного полипептида является эффективным для изменения одного или нескольких маркеров метаболизма кости и/или гомеостаза кости выбранного из перекрёстно связывающего телопептида коллагена I типа (CTX-1) и N-концевого телопептида коллагена I типа (NTX-1) в течение, по меньшей мере, 30 дней после введения, где
полипептид вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг, а сывороточные уровни CTX-1 снижаются на 30% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а сывороточные уровни CTX-1 снижаются на 30% в течение, по меньшей мере, около 120 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются на 30% в течение, по меньшей мере, около 270 дней после введения;
полипептид вводят в количестве меньше или равном 0,03 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг, предпочтительно в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 60 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 0,3 мг/кг, предпочтительно в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 30 дней до 3 месяцев, предпочтительно в течение, по меньшей мере, 90 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 120 дней после введения;
полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве меньше или равном 0,3 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, предпочтительно в количестве от около 1 мг/кг до около 3 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от 6 месяцев до 1 года после введения;
полипептид вводят в количестве меньше или равном 1 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение около 6 месяцев после введения;
полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, около 120 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 60 дней после введения;
полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 90 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 120 дней после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 180 дней (или 6 месяцев), предпочтительно, по меньшей мере, 10 месяцев или даже 12 месяцев после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг, предпочтительно в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, 60 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг, предпочтительно от 0,01 мг/кг до около 0,3 мг/кг, или от 0,03 мг/кг до около 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 30 дней до 3 месяцев после введения;
полипептид вводят в количестве меньше или равном 0,03 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 30 дней до 3 месяцев после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 150 дней после введения;
полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве меньше или равном 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, предпочтительно в количестве от около 1 мг/кг до около 3 мг/кг и уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от 6 месяцев до 1 года после введения;
полипептид вводят в количестве меньше или равном 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, 180 дней (или 6 месяцев) после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, 30 дней после введения;
полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, 90 дней после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, 120 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, предпочтительно от 0,3 мг/кг до около 3 мг/кг, более предпочтительно от 0,3 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 80% в течение, по меньшей мере, около 30 дней (до 3 месяцев) после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
2. Способ ингибирования активности остеокластов у субъекта, включающий введение субъекту полипептида, который специфически связывает лиганд рецептора активатора ядерного фактора каппа-B (RANK-L) и который содержит два или большее количество одиночных вариабельных доменов иммуноглобулина, которые специфически связывают RANK-L и которые по существу состоят из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), в котором CDR1 выбирают из SEQ ID NO: 1, CDR2 выбирают из SEQ ID NO: 2, а CDR3 выбирают из SEQ ID NO: 3, где количество введенного полипептида является эффективным для изменения одного или нескольких маркеров метаболизма кости и/или гомеостаза кости выбранного из перекрёстно связывающего телопептида коллагена I типа (CTX-1) и N-концевого телопептида коллагена I типа (NTX-1) в течение, по меньшей мере, 30 дней после введения, где
полипептид вводят в количестве от около 0,003 мг/кг до около 0,03 мг/кг, а сывороточные уровни CTX-1 снижаются на 30% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а сывороточные уровни CTX-1 снижаются на 30% в течение, по меньшей мере, около 120 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются на 30% в течение, по меньшей мере, около 270 дней после введения;
полипептид вводят в количестве меньше или равном 0,03 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг, предпочтительно в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 60 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 0,3 мг/кг, предпочтительно в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 30 дней до 3 месяцев, предпочтительно в течение, по меньшей мере, 90 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 120 дней после введения;
полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве меньше или равном 0,3 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, предпочтительно в количестве от около 1 мг/кг до около 3 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от 6 месяцев до 1 года после введения;
полипептид вводят в количестве меньше или равном 1 мг/кг и сывороточные уровни CTX-1 снижаются, по меньшей мере, на 45% в течение около 6 месяцев после введения;
полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а сывороточные уровни CTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, около 120 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 60 дней после введения;
полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 90 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 120 дней после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 30% в течение, по меньшей мере, 180 дней (или 6 месяцев), предпочтительно, по меньшей мере, 10 месяцев или даже 12 месяцев после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг, предпочтительно в количестве от около 0,01 мг/кг до около 0,1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, около 30 дней после введения;
полипептид вводят в количестве от около 0,03 мг/кг до около 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, 60 дней после введения;
полипептид вводят в количестве от около 0,01 мг/кг до около 3 мг/кг, предпочтительно от 0,01 мг/кг до около 0,3 мг/кг, или от 0,03 мг/кг до около 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 30 дней до 3 месяцев после введения;
полипептид вводят в количестве меньше или равном 0,03 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 30 дней до 3 месяцев после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 150 дней после введения;
полипептид вводят в количестве от около 0,3 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве меньше или равном 0,3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от около 3 месяцев до 6 месяцев после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, предпочтительно в количестве от около 1 мг/кг до около 3 мг/кг, и уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, от 6 месяцев до 1 года после введения;
полипептид вводят в количестве меньше или равном 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 45% в течение, по меньшей мере, 180 дней (или 6 месяцев) после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, 30 дней после введения;
полипептид вводят в количестве от около 0,3 мг/кг до около 3 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, 90 дней после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 70% в течение, по меньшей мере, 120 дней после введения;
полипептид вводят в количестве от около 0,1 мг/кг до около 1 мг/кг, предпочтительно от 0,3 мг/кг до около 3 мг/кг, более предпочтительно от 0,3 мг/кг до около 1 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 80% в течение, по меньшей мере, около 30 дней (до 3 месяцев) после введения;
полипептид вводят в количестве от около 1 мг/кг до около 10 мг/кг, а уровни NTX-1 снижаются, по меньшей мере, на 80%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 90 дней после введения.
3. Способ по любому из пп. 1 или 2, где полипептид содержит или состоит из SEQ ID NO: 10 или SEQ ID NO: 12.
4. Способ по любому из пп. 1-3, где полипептид вводят подкожно.
5. Способ по любому из пп. 1-4, где субъект имеет остеопороз.
6. Способ по любому из пп. 1-5, в котором количество вводимого полипептида является эффективным при снижении сывороточных уровней перекрёстно-связывающего телопептида коллагена I типа (CTX-1), по меньшей мере, на 30%, по сравнению с уровнем до лечения или нормальным уровнем, в течение, по меньшей мере, 30, 60, 90, 120, 150, 180, 210 или 270 дней после введения.
| WO 2011026945 A1, 10.03.2011 | |||
| ИСПОЛЬЗОВАНИЕ БИСФОСФОНАТОВ ДЛЯ ИНГИБИРОВАНИЯ РЕЗОРБЦИИ КОСТИ, ВОЗНИКАЮЩЕЙ ВСЛЕДСТВИЕ ИМПЛАНТАЦИИ ОРТОПЕДИЧЕСКИХ ПРОТЕЗОВ | 1995 |
|
RU2161032C2 |
Авторы
Даты
2018-07-18—Публикация
2012-05-29—Подача