Изобретение относится к медицине.
Известны средства, которые применяют в лечении хронического атрофического гастрита (ХАТ), а именно:
1. Плантаглюцид - препарат растительного происхождения, полученный из подорожника большого. Обладает противовоспалительным (Hussan F., Mansor A.S., Hassan S.N., Tengku Nor Effendy Kamaruddin TN, Budin S.B., Othman F. Anti-Inflammatory Property of Plantago major Leaf Extract Reduces the Inflammatory Reaction in Experimental Acetaminophen-Induced Liver Injury // Evid Based Complement Alternat Med. 2015; 2015:347861. doi: 10.1155/2015/347861;  I.,
I.,  H., Erten R.,
H., Erten R.,  A.C., Cengiz N., Yilmaz O. Hepatoprotective and anti-inflammatory activities of Plantago major L. Indian Journal of Pharmacology. 2009; 41(3): 120-124. doi: 10.4103/0253-7613.55211), спазмолитическим, обволакивающим действием, способствует регенерации тканей и активирует желудочную секрецию (Samuelsen А.В. The traditional uses, chemical constituents and biological activities of Plantago major. Journal of Ethnopharmacology. 2000;71(1-2):1-21. doi: 10.1016/s0378-8741(00)00212-9; Zubair M., Nybom H., Lindholm C., Rumpunen K. Major polyphenols in aerial organs of greater plantain (Plantago major L.), and effects of drying temperature on polyphenol contents in the leaves. Scientia Horticulturae. 2011; 128(4):523-529. doi: 10.1016/j.scienta. 2011.03.00).
A.C., Cengiz N., Yilmaz O. Hepatoprotective and anti-inflammatory activities of Plantago major L. Indian Journal of Pharmacology. 2009; 41(3): 120-124. doi: 10.4103/0253-7613.55211), спазмолитическим, обволакивающим действием, способствует регенерации тканей и активирует желудочную секрецию (Samuelsen А.В. The traditional uses, chemical constituents and biological activities of Plantago major. Journal of Ethnopharmacology. 2000;71(1-2):1-21. doi: 10.1016/s0378-8741(00)00212-9; Zubair M., Nybom H., Lindholm C., Rumpunen K. Major polyphenols in aerial organs of greater plantain (Plantago major L.), and effects of drying temperature on polyphenol contents in the leaves. Scientia Horticulturae. 2011; 128(4):523-529. doi: 10.1016/j.scienta. 2011.03.00).
Однако имеются сведения о его недостаточном противовоспалительном эффекте, и, кроме того, несмотря на улучшение клинической симптоматики болезни, гистологически, наоборот, отмечается усиление воспалительного процесса (Khalifeh MS, Hananeh W, Al-Rukibat R, Okour О, Boumezrag A. Clinical and histopathological evaluation of MDP / collagen induced arthritis rat model (MCIA) after treatment with Urtica dioica, plantago major and Hypericum perforatum L herbal mixture // Exp Anim. 2008 Apr; 57(2):101-10).
2. Солкосерил - репарант животного происхождения. Он улучшает транспорт кислорода и глюкозы к клеткам, находящимся в условиях гипоксии, повышает синтез внутриклеточного АТФ и способствует увеличению дозы аэробного гликолиза и окислительного фосфорилирования, активизирует репаративные и регенеративные процессы в тканях, стимулирует пролиферацию фибробластов и синтез коллагена стенки сосудов (https://health.mail.ru/drug/solcoseryl_1/).
Однако противовоспалительное действие солкосерила незначительно (Lalabonova Н., Daskalov Н. Clinical assessment of the therapeutic effect of low-level laser therapy on chronic recurrent aphthous stomatitis // Biotechnol Biotechnol Equip. 2014 Sep 3;28(5):929-933). Это приводит к отсутствию стойкого лечебного эффекта.
3. Рибоксин (инозин) - относится к группе лекарственных средств, регулирующих метаболические процессы (https://health.mail.ru/drug/riboxin/). Препарат является предшественником для синтеза пуриновых нуклеотидов: аденозинтрифосфата и гуанозинтрифосфата, которые обеспечивают антигипоксический и цитопротекторный эффект (Gallo  FJ,
FJ,  Morujo Suarez AJ,
Morujo Suarez AJ,  Fernandez FP. Ultrastructural study of the kidney subjected to warm ischemia and perfused with inosine // Arch Esp Urol. 2013 Dec; 66(10):945-55; Szabo G., Stumpf N., Radovits T., Sonnenberg K., Gero D., Hagl S., Szabo C., Bahrle S. Effects of inosine on reperfusion injury after heart transplantation. Eur J Cardiothorac Surg. 2006;30:96-102; Veres G., Radovits T., Seres L., Horkay F., Karck M., Szabo G. Effects of inosine on reperfusion injury after cardiopulmonary bypass. J Cardiothorac Surg. 2010;5:106), что способствует восстановлению слизистой оболочки желудка (Korepanov A.M., Nazarov A.M., Nikitin E.N., Bazhenov E.L. Riboxine effectiveness in combined treatment of chronic atrophic gastritis // Klin Med (Mosk). 1999;77(9):28-30).
Fernandez FP. Ultrastructural study of the kidney subjected to warm ischemia and perfused with inosine // Arch Esp Urol. 2013 Dec; 66(10):945-55; Szabo G., Stumpf N., Radovits T., Sonnenberg K., Gero D., Hagl S., Szabo C., Bahrle S. Effects of inosine on reperfusion injury after heart transplantation. Eur J Cardiothorac Surg. 2006;30:96-102; Veres G., Radovits T., Seres L., Horkay F., Karck M., Szabo G. Effects of inosine on reperfusion injury after cardiopulmonary bypass. J Cardiothorac Surg. 2010;5:106), что способствует восстановлению слизистой оболочки желудка (Korepanov A.M., Nazarov A.M., Nikitin E.N., Bazhenov E.L. Riboxine effectiveness in combined treatment of chronic atrophic gastritis // Klin Med (Mosk). 1999;77(9):28-30).
Из указанных выше лекарственных средств наиболее близок к заявляемому средству по достигаемому эффекту рибоксин, активным компонентом которого является инозин. Однако, несмотря на то, что он ослабляет выработку медиаторов воспаления ( G, Kuhel DG,
G, Kuhel DG,  ZH, Mabley JG, Stachlewitz RF,
ZH, Mabley JG, Stachlewitz RF,  L, Lohinai Z, Southan GJ, Salzman AL,
L, Lohinai Z, Southan GJ, Salzman AL,  C. Inosine inhibits inflammatory cytokine production by a posttranscriptional mechanism and protects against endotoxin-induced shock // J Immunol. 2000 Jan 15; 164(2): 1013-9;
C. Inosine inhibits inflammatory cytokine production by a posttranscriptional mechanism and protects against endotoxin-induced shock // J Immunol. 2000 Jan 15; 164(2): 1013-9;  G, Sitkovsky MV,
G, Sitkovsky MV,  С Trends Pharmacol Sci. Immunomodulatory and neuroprotective effects of inosine // 2004 Mar; 25(3):152-157), этот препарат не обеспечивает достаточный противовоспалительный эффект.
С Trends Pharmacol Sci. Immunomodulatory and neuroprotective effects of inosine // 2004 Mar; 25(3):152-157), этот препарат не обеспечивает достаточный противовоспалительный эффект.
А-фетопротеин (α-фетопротеин, АФП) применяют в составе комплексной терапии неспецифического язвенного колита, что позволяет снизить дозы глюкокортикостероидов (http://mymedlife.ru/content/alfa-fetoprotein). В составе комплексной терапии аутоиммунного тиреоидита (болезни Хашимото) препарат способствует снижению уровня антител против тиреоглобулина, восстанавливает исходно сниженный уровень Т-клеток (CD3+), увеличивает содержание CD8+ Т-лимфоцитов, повышает исходно сниженный уровень IgA и IgM, увеличивает продукцию эндогенного тироксина и трийодтиронина (http://ru-transferfactor.ru/alfa-fetoprotein). При применении в составе комплексной терапии хронических окклюзионных заболеваний сосудов АФП способствует улучшению внутрисосудистой и тканевой гемоперфузии и стимуляции заживления трофических язв (http://mymedlife.ru/content/alfa-fetoprotein). Использование АФП у больных хроническими окклюзионными заболеваниями сосудов при эндопротезировании снижает количество осложнений в послеоперационном периоде (http://www.piluli.ru/product/Alfa-fetoprotein).
Данные по АФП противоречивы.
В работе 70-х годов отмечается, что АФП подавляет наработку антител и созревание цитотоксических Т-лимфоцитов (Peck АВ, Murgita RA, Wigzell Н Cellular and genetic restrictions in the immunoregulatory activity of alpha-fetoprotein. II. Alpha-fetoprotein-induced suppression of cytotoxic T lymphocyte development // J Exp Med. 1978 Aug 1;148(2):360-72), в работе 80-x годов отмечается, что АФП, в зависимости от концентрации, снижает пролиферативный ответ лимфоцитов на митоген (Culture conditions modify the effects exerted by human fetal alpha-fetoprotein (AFP) on some lymphocyte functions in vitro.  M,
M,  L. Exp Pathol. 1981; 20(4):233-8.) - таким образом, данные работы свидетельствует о противовоспалительном действии АФП.
L. Exp Pathol. 1981; 20(4):233-8.) - таким образом, данные работы свидетельствует о противовоспалительном действии АФП.
Наряду с этим более поздние исследования показали, что АФП повышает функциональную (пролиферативную и цитотоксическую) активность мононуклеарных лейкоцитов периферической крови человека, при этом данные изучения иммунофенотипа свидетельствуют о формировании в культурах субпопуляций цитотоксических лимфоцитов, NK- и NKT-клеток (Получение активированных лимфоцитов из мононуклеарных лейкоцитов периферической крови человека при воздействии альфа-фетопротеина / Черешнев В.А., Лебединская О.В., Ахматова Н.К., Родионов С.Ю., Лебединская Е.А., Гаврилова Т.Е., Карамзин A.M., Киселевский М.В. // Сибирский онкологический журнал. - 2005. - №1. - с. 40-46), которые являются потенциальными продуцентами провоспалительных цитокинов, вследствие чего АФП будет способствовать обострению воспалительного процесса (Роль цитокинов в патогенезе злокачественных новообразований / Соснина А.В., Великая Н.В., Аутеншлюс А.И. - Новосибирск: Вектор-Бест, 2013. - 80 с.).
Также показана способность АФП повышать пролиферативную активность мононуклеарных лейкоцитов (Влияние препарата «Профеталь» на функциональную активность мононуклеарных лейкоцитов и дендридных клеток человека. Черешнев В.А., Лебединская О.В., Родионов С.Ю., Ахматова Н.К., Шубина И.Ж., Лебединская Е.А., Гаврилова Т.Е., Киселевский М.В. Медицинская иммунология. - 2005. - №5-6, - с. 525-534; Влияние препарата «Профеталь» на дифференцировку и функциональную активность мононуклеарных лейкоцитов человека. Лебединская О.В., Велижева Н.П., Доненко Ф.В., Черешнев В.А., Родионов С.Ю., Ахматова Н.К., Шубина И.Ж., Лебединская Е.А., Киселевсеий М.В. Клеточные технологии в биологии и медицине. - 2006. - №2. - с. 108-116).
Сведения и работы, приведенные в двух предшествующих абзацах, показывают, что АФП обладает провоспалительным действием.
Таким образом, сведения, содержащиеся в уровне техники, показывают наличие у АФП как противовоспалительного, так и провоспалительного действия. В этой связи применение АФП в качестве средства для лечения ХАГ, не является очевидным, и АФП в таком качестве никогда не использовался.
Раскрытие изобретения
В качестве средства для лечения хронического атрофического гастрита предлагается использовать α-фетопротеин (АФП), выделенный из пуповинной крови.
Техническим результатом предлагаемого изобретения является свойство АФП, выделенного из пуповинной крови, ликвидировать признаки ХАГ, а именно: значительно уменьшать дилятацию венозных сосудов, нормализовать состояние сосудов микроциркуляторного русла, ликвидировать явления агрегации эритроцитов в сосудах, устранять отек и инфильтрацию клеточными элементами собственной пластинки слизистой желудка (преимущественно за счет уменьшения количества нейтрофилов и лимфоцитов); восстанавливать слизистую оболочку желудка (наблюдается увеличение размеров желез и уменьшение расстояния между ними, снижение выраженности признаков склеротических изменений, приобретение эпителием желез более высокоспециализированного строения, обусловленного восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту в фундальном отделе, и ликвидацией очагов кишечной метаплазии в пилорическом отделе).
Перечень фигур иллюстративного материала
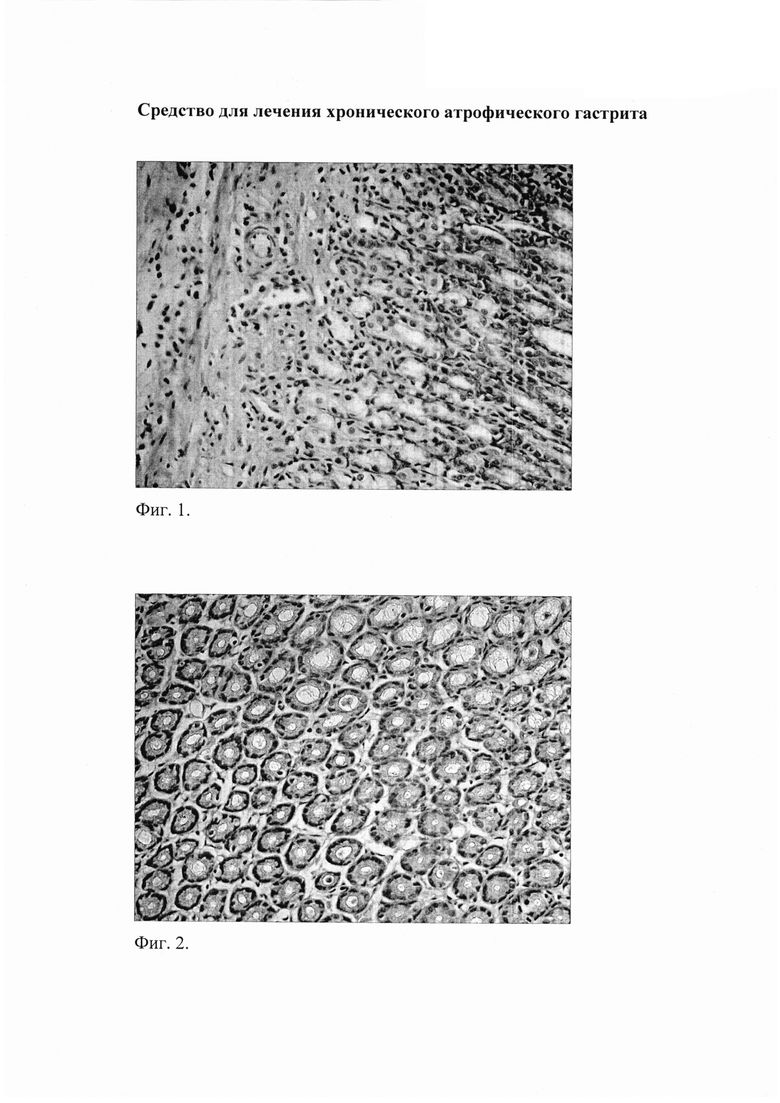
Фиг. 1. Слизистая фундального отдела желудка через 8 недель после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: инфильтрация слизистой нейтрофильно-лейкоцитарными и макрофагальными элементами; атрофия желез. Окр. гематоксилином и эозином, ув. 400.
Фиг. 2. Слизистая фундального отдела желудка через 8 недель после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: атрофия желез, развитие склеротических изменений. Окр. гематоксилином и эозином, ув. 400.
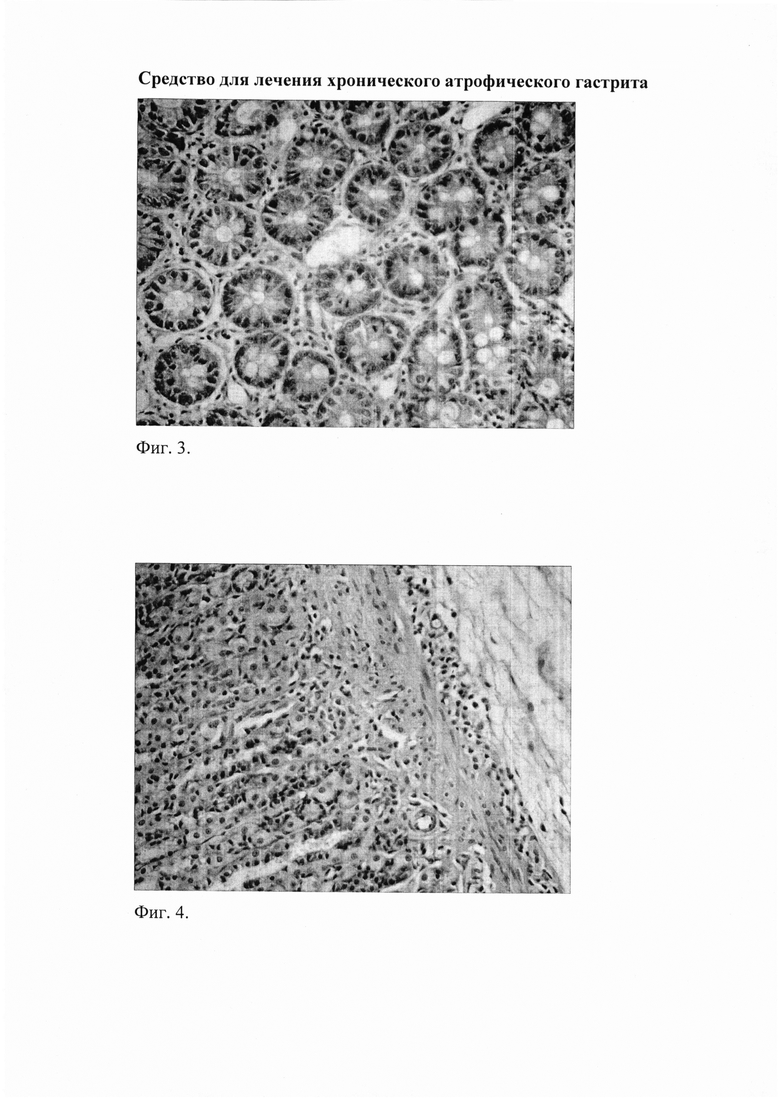
Фиг. 3. Слизистая пилорического отдела желудка через 8 недель после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: наличие очагов кишечной метаплазии. Окр. гематоксилином и эозином, ув. 400.
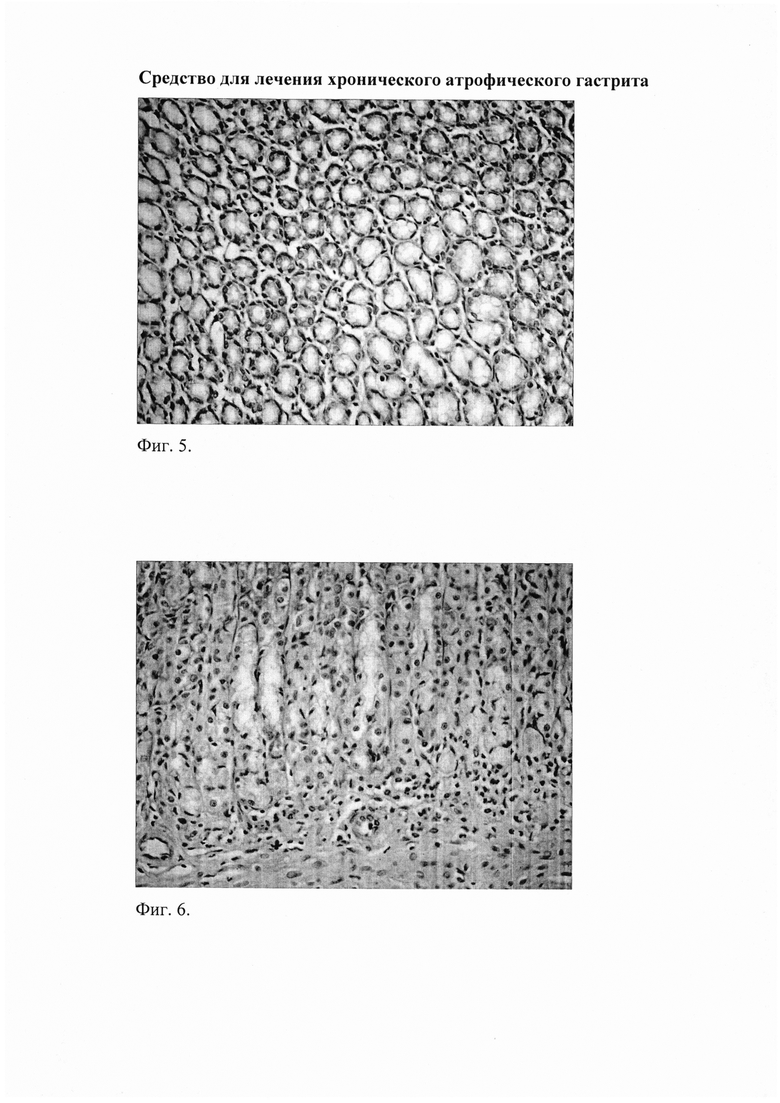
Фиг. 4. Слизистая фундального отдела желудка через 4 недели после окончания введения рибоксина у животных с воспроизведенным ХАГ: снижение инфильтрации слизистой нейтрофильно-лейкоцитарными и макрофагальными элементами. Окр. гематоксилином и эозином, ув. 400.
Фиг. 5. Слизистая фундального отдела желудка через 4 недели после окончания введения рибоксина у животных с воспроизведенным ХАГ: уменьшение атрофии желез и склеротических изменений. Окр. гематоксилином и эозином, ув. 400.
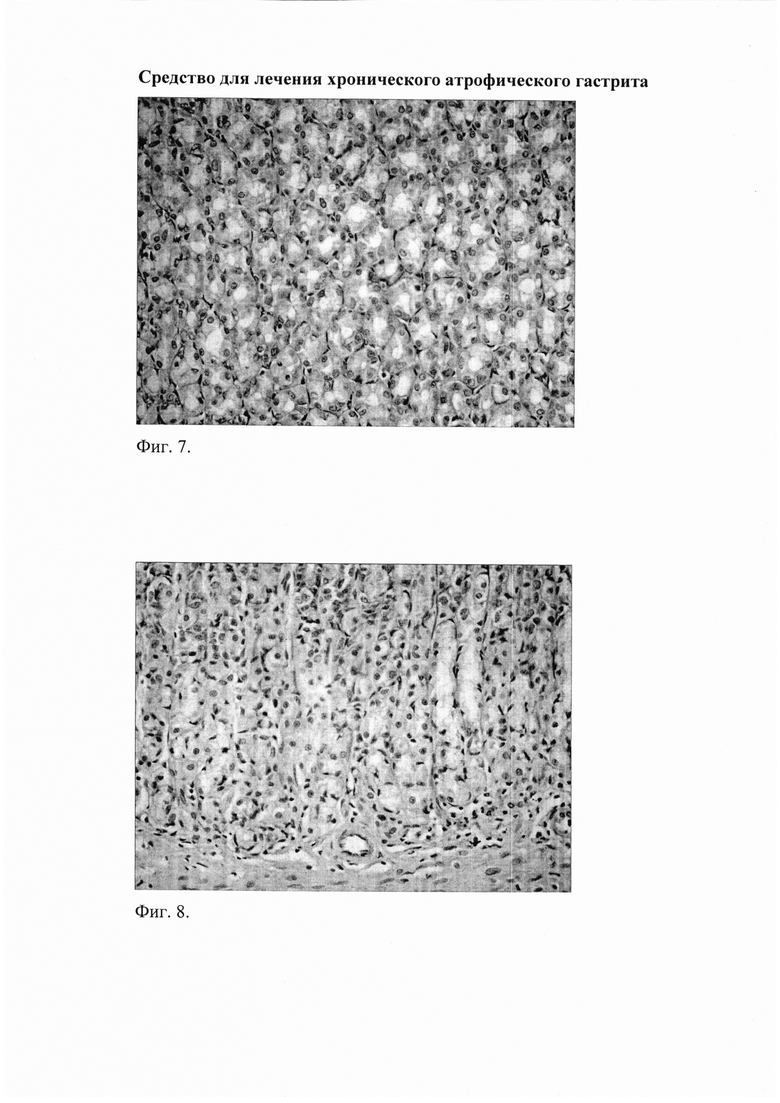
Фиг. 6. Слизистая фундального отдела желудка через 2 недели после окончания введения АФП у животных с воспроизведенным ХАТ: снижение инфильтрации слизистой нейтрофильно-лейкоцитарными и макрофагальными элементами. Окр. гематоксилином и эозином, ув. 400.
Фиг. 7. Слизистая фундального отдела желудка через 2 недели после окончания введения АФП у животных с воспроизведенным ХАГ: выраженное уменьшение атрофии желез и склеротических изменений. Окр. гематоксилином и эозином, ув. 400.
Фиг. 8. Слизистая фундального отдела желудка через 4 недели после окончания введения АФП у животных с воспроизведенным ХАГ: отсутствие инфильтрации слизистой нейтрофильно-лейкоцитарными и макрофагальными элементами, ликвидация признаков атрофии слизистой. Окр. гематоксилином и эозином, ув. 400.
Фиг. 9. Слизистая фундального отдела желудка через 4 недели после окончания введения АФП у животных с воспроизведенным ХАГ: отсутствие атрофии желез и склеротических изменений. Окр. гематоксилином и эозином, ув. 400.
Обоснование изобретения
Было проведено исследование терапевтического эффекта АФП, выделенного из пуповинной крови, при ХАГ.
Материал и методы исследования
Эксперимент проведен на 30 половозрелых крысах-самцах Wistar с исходной массой тела 180-220 г. Для получения модели ХАГ 24-м экспериментальным животным ежедневно один раз в день в течение 8 недель внутрижелудочно вводили 0,2 мл 2%-го раствора салицилата натрия в 30% растворе спирта, кроме того, крысы содержались на альтернативном посту (2 дня - кормление, 1 сутки - отсутствие кормления) со свободным доступом к воде (далее - животные с воспроизведенным ХАГ) (Shao ХН, Yang YP, Dai J, Wu JF, Bo AH. Effects of He-Ne laser irradiation on chronic atrophic gastritis in rats World J Gastroenterol. 2005 Jul 7; 11(25):3958-61).
Всего было 30 животных, которые были поделены на 5 групп по 6 животных в каждой группе.
Группа 1 - интактные животные («Инт»).
Группа 2 («ХАГ 8», где цифра «8» обозначает 8 недель внутрижелудочного введения 0,2 мл 2%-го раствора салицилата натрия в 30% растворе спирта и содержания на альтернативном посту со свободным доступом к воде) - животные с воспроизведенным ХАГ.
Группа 3 («ХАГ 8+Р 4», где «Р 4» обозначает 4 недели введения рибоксина - животные с воспроизведенным ХАГ, которым в последующие 4 недели ежедневно один раз в сутки вводили раствор рибоксина в дозе 20 мг/кг веса животного. Животные выводились из эксперимента через 12 недель от начала эксперимента.
Группа 4 («ХАГ 8+АФП 2», где «АФП 2» означает 2 недели введения АФП) - животные с воспроизведенным ХАГ, которым в течение последующих двух недель ежедневно вводили 0,2 мл водно-масляной эмульсии α-фетопротеина, содержащих АФП в дозе 15 мкг/кг. Животные выводились из эксперимента через 10 недель от его начала.
Группа 5 («ХАГ 8+АФП 4», где «АФП 4» означает 4 недели введения АФП) - животные с воспроизведенным ХАГ, которым в течение последующих четырех недель ежедневно вводили 0,2 мл водно-масляной эмульсии α-фетопротеина, содержащих АФП в дозе 15 мкг/кг. Животные выводились из эксперимента через 12 недель от его начала.
Желудок животных фиксировали в 12% формалине. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Морфология слизистой желудка оценивалась при обзорной микроскопии после окраски срезов гематоксилином Эрлиха и эозином. Муцин выявляли муцикармином с последующей докраской ядер гематоксилином Эрлиха. Кислые муцины выявляли альциановым синим при pH 1,0 с последующей докраской ядер кармалюмом Майера.
Оценивались основные признаки ХАГ, предложенные Сиднейской системой классификации хронического гастрита (Genta RM, Dixon MF. The Sydney system revised. Am J Gastroenterol 1995; 90:1039-41; Филипенко П.С., Великородный Г.Г. Морфологическая классификация хронического гастрита (Адаптированный вариант) // Успехи современного естествознания. - 2009. - №7. - С. 107-109), а именно: выраженность атрофии желудочных желез, которая определяет стадию хронического гастрита; лимфоплазмоцитарная и нейтрофильная инфильтрация, которые определяют степень хронического гастрита; а также признаки, не входящие в вышеуказанную классификацию, но отмечающиеся при ХАГ: содержание муцина и кислых муцинов (Mandal РК, Chakrabarti S, Ray A, Chattopadhyay В, Das S Mucin histochemistry of stomach in metaplasia and adenocarcinoma: An observation Indian J Med Paediatr Oncol. 2013 Oct; 34(4):229-33. doi: 10.4103/0971-5851.125232).
Определение относительной площади, занимаемой железами желудка, а также клеточными элементами инфильтратов, проводилось с помощью морфометрического комплекса на базе микроскопа Micros МС 300А, цифровой камеры СХ 13 с («Baumer Electric GmbH», Германия) и программного обеспечения ImageJ 1.42g (Национальный институт здоровья, США). Для каждой группы оценивалось по 48 изображений.
Статистическую обработку результатов исследования проводили с использованием программного пакета для статистической обработки SPSS v 13.0 for Windows. Для сравнения независимых групп использовали критерий Крускала-Уоллиса с последующим межгрупповым сравнением с помощью критерия Манна-Уитни. Различия между значениями сравниваемых параметров расценивали как статистически значимые при p<0,05. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
Результаты исследования
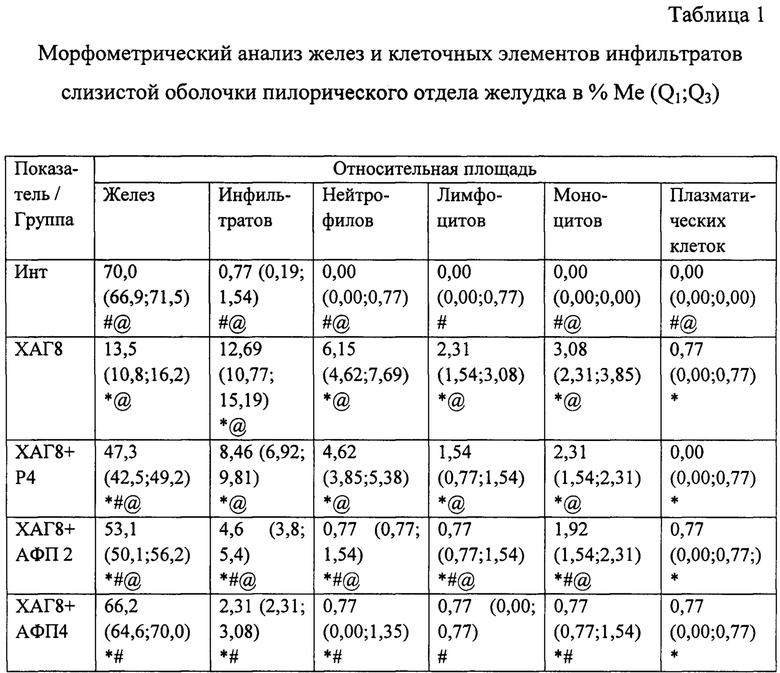
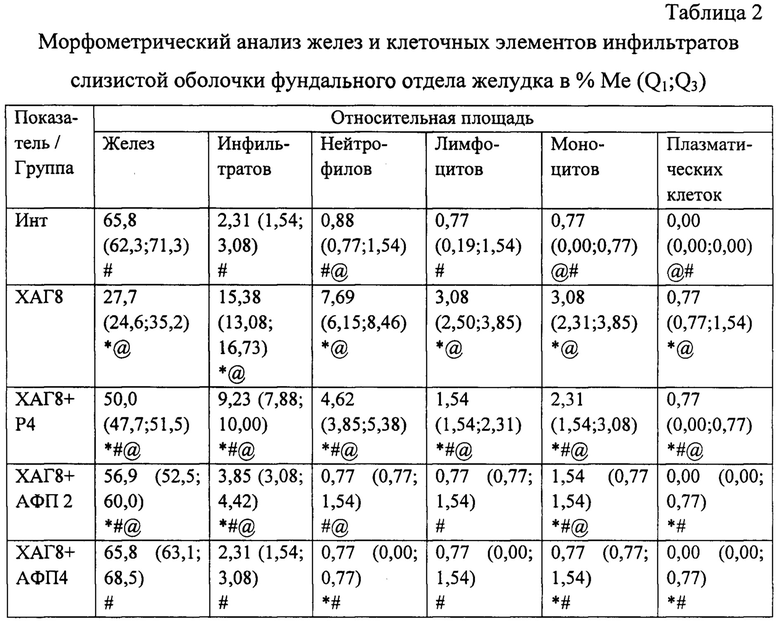
При морфологическом исследовании срезов желудка через 8 недель от начала введения салицилата натрия на фоне содержания животных на альтернативном посту (группа «ХАГ 8») были отмечены признаки, характерные для ХАГ, а именно: наблюдалось истончение слизистой оболочки желудка, уменьшение желез в размерах с увеличением расстояния между ними, развитие склеротических изменений (фиг. 2), отмечались явления отека и инфильтрации слизистой желудка как нейтрофильно-лейкоцитарными, так и макрофагальными элементами (фиг. 1), наблюдалась выраженная дилятация вен и микроциркуляторных сосудов с агрегацией эритроцитов в них, увеличение количества клеток, секретирующих слизь. Существенно увеличилась выработка кислых муцинов (сиаломуцина и сульфомуцина). При этом выраженность инфильтрации возросла по сравнению с интактными животными в пилорическом отделе в 16,5 раза (таблица 1), в фундальном - в 6,7 раза (таблица 2). Соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 2,7:1:1,3:0,3, в фундальном отделе - 2,5:1:1:0. Морфологическое изучение срезов пилорического отдела желудка позволило выявить, дополнительно к описанным выше изменениям, наличие очагов кишечной метаплазии с бокаловидными клетками (фиг. 3).
Применение рибоксина (группа «ХАГ 8+Р 4») вызвало некоторое уменьшение признаков ХАГ. Так, выраженность инфильтрации собственной пластинки слизистой желудка снизилась в пилорическом отделе в 1,5 раза (таблица 1), в фундальном в 1,7 раза (фиг. 4; таблица 2). При этом соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты, в пилорическом отделе составило 3:1:1,5:0, в фундальном отделе - 3:1:1,5:0,5. Значительно уменьшились отек собственной пластинки слизистой желудка и дилятация вен, диаметр сосудов микроциркуляторного русла нормализовался, исчезла агрегация эритроцитов. Кроме того, отмечалось восстановление слизистой оболочки желудка, о чем свидетельствовало увеличение относительной площади желез в фундальном отделе на 22,3%, в пилорическом - на 33,8%, а также уменьшение склеротических изменений (фиг. 5). При применении рибоксина в пилорическом отделе желудка достоверно увеличилась секреция муцина на фоне уменьшения его кислых фракций, а также уменьшение муцина и кислых муцинов в фундальном отделе. Отсутствовали очаги кишечной метаплазии в пилорическом отделе.
При применении АФП в течение 2 недель (группа «ХАГ 8+АФП 2») отмечалось выраженное уменьшение признаков ХАГ: отсутствовали отек и инфильтрация клеточными элементами собственной пластинки слизистой желудка (преимущественно за счет уменьшения количества нейтрофилов и лимфоцитов) (фиг. 6), значительно уменьшилась дилятация венозных сосудов, отсутствовало расширение сосудов микроциркуляторного русла, а также явления агрегации эритроцитов в них. При этом выраженность инфильтрации по сравнению с группой «ХАГ 8» снизилась в пилорическом отделе в 2,8 раза (таблица 1), в фундальном - в 4 раза (таблица 2). Соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 1:1:2,5:1, в фундальном отделе - 1:1:2:0. Кроме того, отмечались признаки восстановления слизистой оболочки желудка и выраженное уменьшение склеротических изменений (фиг. 7). Отсутствовали признаки кишечной метаплазии, увеличился размер желез, уменьшилось расстояние между ними, эпителий желез приобрел более высокоспециализированное строение, что было обусловлено восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту, и уменьшением количества клеток, секретирующих кислые муцины. При этом отмечалось более выраженное, по сравнению с группой «ХАГ 8+Р 4» восстановление слизистой оболочки желудка, о чем свидетельствовало увеличение относительной площади желез в пилорическом отделе на 39,6%, и в фундальном на 29,2% по сравнению с группой «ХАГ 2».
При морфологическом исследовании препаратов желудка через 4 недели после начала применения АФП (группа «ХАГ 8+АФП 4») отмечалось дальнейшее уменьшение признаков ХАГ. Так, в фундальном отделе полностью отсутствовала воспалительная инфильтрация, количество лейкоцитов в слизистой желудка соответствовало данному показателю у интактных животных (фиг. 8; таблица 2); в пилорическом отделе инфильтрация уменьшилась в 2 раза по сравнению с группой «ХАГ 8+АФП 2» (таблица 1). Соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 1:1:1:1. Отсутствовала дилятация венозных сосудов и сосудов микроциркуляторного русла, а также агрегация эритроцитов в них. Полностью отсутствовали признаки атрофии слизистой фундального отдела желудка (фиг. 9). Относительная площадь желез достоверно не отличалась от аналогичного показателя у интактных животных. В пилорическом отделе отсутствовали очаги кишечной метаплазии и практически полностью восстановились железистые структуры (различие относительной площади желез между группами «ХАГ 8+АФП 4» и «Инт» составило 3,9%). Отмечались лишь незначительные признаки склеротических изменений.
Таким образом, вышеизложенное подтверждает, что АФП, выделенный из пуповинной крови, оказывает значительное терапевтическое воздействие при ХАГ, а именно: снижает выраженность воспалительного компонента ХАГ и восстанавливает слизистую оболочку желудка.
Примечание:
* - достоверные отличия по сравнению с группой Инт при р<0,05;
# - достоверные отличия по сравнению с группой ХАГ8 при р<0,05;
@ - достоверные отличия по сравнению с группой ХАГ8+АФП4 при р<0,05.
Примечание:
* - достоверные отличия по сравнению с группой Инт при p<0,05;
# - достоверные отличия по сравнению с группой ХАГ8 при p<0,05;
@ - достоверные отличия по сравнению с группой ХАГ8+АФП4 при p<0,05.
| название | год | авторы | номер документа |
|---|---|---|---|
| Липосомальное средство для лечения хронического атрофического гастрита | 2019 |
|
RU2724021C1 |
| Средство для лечения хронического атрофического гастрита | 2016 |
|
RU2623866C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХИМИЧЕСКОГО ГАСТРИТА | 2010 |
|
RU2442227C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХИМИЧЕСКОГО ГАСТРИТА В ЭКСПЕРИМЕНТЕ | 2009 |
|
RU2395125C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГАСТРОПАТИИ | 2009 |
|
RU2424578C1 |
| Способ моделирования химического гастрита у лабораторных крыс | 2024 |
|
RU2824614C1 |
| СПОСОБ ЛЕЧЕНИЯ ХИМИЧЕСКОГО ОЖОГА ПИЩЕВОДА И ЖЕЛУДКА В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2557136C1 |
| Способ оценки атрофии желез антрального отдела желудка | 2021 |
|
RU2776978C1 |
| СПОСОБ АНТИХЕЛИКОБАКТЕРНОЙ ТЕРАПИИ | 2005 |
|
RU2277931C1 |
| Средство, содержащее Fc фрагменты иммуноглобулина класса G, для лечения аутоиммунного гастрита | 2022 |
|
RU2818531C1 |

Изобретение относится к фармацевтической промышленности, а именно средству для лечения хронического атрофического гастрита (ХАГ). Средство для лечения хронического атрофического гастрита представляет собой α-фетопротеин, выделенный из пуповинной крови. Вышеописанное средство позволяет ликвидировать признаки ХАГ. 9 ил., 2 табл.
Средство для лечения хронического атрофического гастрита, характеризующееся тем, что оно представляет собой α-фетопротеин, выделенный из пуповинной крови.
| Haskό G | |||
| et al | |||
| Inosine inhibits inflammatory cytokine production by a posttranscriptional mechanism and protects against endotoxin-induced shock // J Immunol | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Haskό G | |||
| et al | |||
| Immunomodulatory and neuroprotective effects of inosine // J Immunol | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Разделяющая система призм для дальномеров | 1935 |
|
SU43745A1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО АТРОФИЧЕСКОГО ГАСТРИТА | 2002 |
|
RU2219940C1 |
Авторы
Даты
2018-07-23—Публикация
2017-03-07—Подача