Изобретение относится к новым биологически активным соединениям, в частности к пептидам с нейропротекторной и нормализующей активностью, конкретно – гексапептиду (1) формулы Thr-Gly-Glu-Hse-His-Arg-NH2. Предложено применение гексапептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 в качестве нейропротекторного средства, направленного на профилактику и лечение болезни Паркинсона. Предложен новый состав фармацевтической композиции на основе указанного гексапептида (2,5 г/л): консервант в виде нипагина (1,0 г/л), хлорида натрия (10,0 г/л) и вода дистиллированная - остальное. Состав высокоэффективен в низких дозах и прост в применении: используется в виде капель в нос. Предлагаемая фармацевтическая композиция может найти применение в медицине.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к медицине, а именно к разработке и применению нового нейропротекторного средства. Может быть использовано для внедрения нейропротекции, являющейся особым направлением терапии нейродегенеративных заболеваний. Нейродегенеративные заболевания мозга становятся одной из самых значимых проблем современного человека. Согласно данным, приведенным в докладе Европейского Совета по Мозгу (Europia Brain Council) за 2011 г., финансовые потери Европы, вызванные болезнями мозга, превышают более чем 800 млд евро в год (Smith, 2011). Актуальность разработки препарата определяется тем, что заболевания центральной нервной системы являются одной из ведущих причин заболеваемости, смертности и инвалидизации в России и других странах. Используемые в настоящее время стандартные схемы лечения нейродегенеративных заболеваний не лечат причины самого заболевания, а лишь предлагают препараты, уменьшающие проявление их отрицательной симптоматики, которые улучшают качество жизни и увеличивают время жизни больного. Многие использующиеся для этого препараты имеют очень узкий интервал между эффективной терапевтической и токсической дозами.
Болезнь Паркинсона (БП) является вторым по распространенности, после болезни Альцгеймера, нейродегенеративным заболеванием. В среднем в мире имеется 200-300 больных БП на 100.000 населения. Основным патогенетическим звеном БП является нейродегенерация дофаминергических нейронов в компактной части черной субстанции, приводящая к дефициту дофамина (ДА) в стриатуме, следствием чего развиваются гиперактивация холинергических нейронов и двигательные дисфункции (Угрюмов 2014). Ключевым звеном патогенеза БП является гибель ДА-ергической нигростриатной системы, однако причина этого заболевания остается неизвестной. При БП наблюдается одновременная разрегулированность многих нейромедиаторных систем и нарушены балансы провоспалительных цитокинов, нейротрофических факторов, нейростероидов и основных нейротрансмиттеров. Множество работ, проведенных на экспериментальных моделях, свидетельствуют о том, начало дегенерации нейронов происходит с нарушения нормальной работы пресинаптической терминали, затем идет дегенерация самого аксона и только, в последнюю очередь, погибает тело нейрона. В патогенезе болезни Паркинсона происходят многие дисфункции, связанные с изменением структуры α-синуклеина, его накоплением и агрегацией в нейронах с образованием телец Леви, с нарушениями в убиквитин-протеасомном пути в митохондриях и с активацией микроглии, приводящей к окислительному стрессу, эксайтотоксичности и апоптической гибели клеток. В качестве причины гибели ДА-ергических нейронов рассматриваются окислительный стресс, митохондриальная дисфункция, нарушения протеолиза поврежденных белков и еще целый ряд возможных факторов. Соответственно с развивающейся патологией, в терапии БП используется заместительная терапия, заключающаяся в применении метаболического предшественника ДА - леводопы, агонистов ДА рецепторов и холинолитические препараты. Однако можно отметить, что большинство противопаркинсонических препаратов имеют много побочных эффектов, они обладают ограниченной эффективностью и их продолжительное применение завершается развитием медикаментозных дискинезий. (Миронов и др. 2012). Существующая терапия БП направлена на преодоление последствий, вызванных нейродегенерацией ДА нейронов, а не на саму причину заболевания. В этой связи особую значимость приобретает разработка нетоксичных и высокоэффективных препаратов нейропротекторного действия, направленных на профилактику и лечение БП за счет преодоления нейродегенерации ДА нейронов. В случае болезни Паркинсона развивается каскад патологических изменений, приводящих к необратимому повреждению нервной ткани и массовой гибели нейронов по механизму некроза и апоптоза. Нейропротекция направлена на прерывание отсроченных механизмов смерти клеток – оксидантного стресса, дисбаланса цитокинов, локального воспаления, трофической дисфункции и апоптоза. Тесная взаимосвязь всех механизмов гибели нервной ткани позволяет использовать модулирующее влияние через системы регуляторов, особое место среди которых занимают регуляторные пептиды.
Новым направлением в области создания эффективных и безопасных лекарственных средств для лечения нейродегенеративных и цереброваскулярных заболеваний, является создание нейропротекторов на основе эндогенных регуляторных пептидов. В отличие от большинства лекарственных средств, применяемых в настоящее время для профилактики и лечения БП, заявляемая фармацевтическая композиция на основе пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 обладает комплексным нейропротекторным действием, влияя на ряд узловых патогенетических механизмов паркинсонизма.
Аналогами предлагаемой новой фармацевтической композиции на основе пептида являются препараты заместительной терапии БП, такие как леводопа, агонисты ДА рецепторов и холинолитические препараты. К сожалению, ни один из применяемых методов заместительной терапии не обладает установленной способностью не только достигать ремиссии нейродегенеративного процесса, но и существенно влиять на скорость его развития, эти препараты лишь помогают облегчить некоторые симптомы заболевания. Все используемые препараты, используемые в терапии БП, имеют отличный от заявляемого изобретения механизм действия и помимо недостаточной терапевтической эффективности, обладают серьезными побочными эффектами и весьма дорогостоящие. Кроме того, по сравнению с используемыми в настоящее время препаратами заявляемый пептид проявляет свое действие в гораздо меньших дозах.
В качестве прототипа заявляемого пептида можно рассматривать гексапептид общей формулы (Thr-Gly-Glu-Asn-His-Arg) обладающий противоопухолевой, протекторной и нормализующей активностью (Патент Российской Федерации на изобретение № 2213747 11 марта 1999 г.). Однако возможность использовать его в качестве основы лекарственного препарата нейропротекторного действия ограничивается его быстрой биодеградацией в тканях организма и низкой нейропротекторной активностью. Наиболее близким прототипом является гексапептид общей формулы Thr-Gly-Glu-Asn-His-Arg-NH2, обладающий нейропротекторной, ноотропной и психотропной активностью на моделях болезни Альцгеймера, ишимического инсульта и тревожных растройств (Патент Российской Федерации на изобретение № 2557003 от 22 06 2015 г. и патент Российской Федерации на изобретение № 2580311 от 14 марта 2016). К недостатку выбранных прототипов следует отнести их недостаточную устойчивость к гидролизу в физиологических условиях, что существенно ограничивает их использование в виде водных растворов лекарственных препаратов. При нейтральных pH-растворов, остаток аспарагина в пептиде Thr-Gly-Glu-Asn-His-Arg-NH2 гидролизуется до остатка аспарагиновой кислоты. Причиной такой нестабильности является то, что остаток гистидина, находящийся рядом с остатком аспарагина в пептидной цепи, резко увеличивает скорость гидролиза амидной группы аспарагина (Robinson et al, 2001). Проведенный ранее анализ возможности модификации строения пептида Thr-Gly-Glu-Asn-His-Arg без потери его физиологической активности не дал желаемого результата. Показано, что даже однократные замены аминокислотных остатков приводят к потере физиологической активности (Костанян и др., 2000).
Заявляемое изобретение решает задачу профилактики и лечения болезни Паркинсона. Поставленная задача и технический результат достигаются тем, что гексапептид (1) формулы: Thr-Gly-Glu-Hse-His-Arg-NH2. применяется в качестве нейропротекторного средства. Основанием для решения задачи и достижения технического результата, достигаемого при реализации изобретения является обнаружение нейропротекторного и нормализующего лечебного действия пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2, что определяет возможность его использования в низких дозах в качестве нейропротекторного средства. Фармацевтическая композиция на основе заявляемого пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 отличается хорошей переносимостью, удобной для применения лекарственной формой и отсутствием нежелательных побочных эффектов, характерных для известных препаратов для лечения болезни Паркинсона. Используя экспериментальную модель БП, основанную на введении мышам токсина МФТП, нами впервые было показано, что применение пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 приводит к восстановлению нарушенной нигростриатной дофаминовой системы головного мозга.
В состав фармацевтической композиции с нейропротекторным и нормализующим действием входят: гексапептид (1) Thr-Gly-Glu-Hse-His-Arg-NH2 в качестве активного вещества, добавочные компоненты – нипагин и хлорид натрия при следующем соотношении компонентов, г/л:
Гексапептид (1) Thr-Gly-Glu-Hse-His-Arg-NH2 – 2,5;
Нипагин (консервирующее вещество) - 1,00;
Хлорид натрия (создает в получаемом растворе осмотическое давление близкое к таковым показателям плазмы крови) - 10,00;
Вода дистиллированная – остальное.
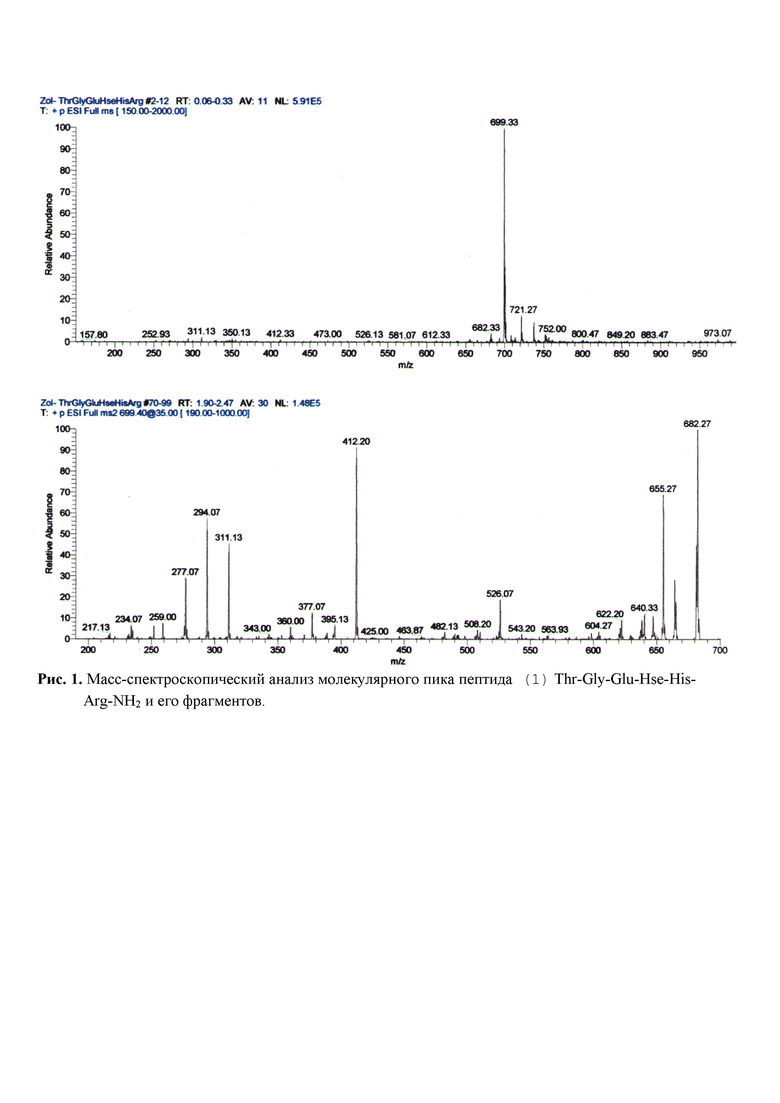
Пептид (1) Thr-Gly-Glu-Hse-His-Arg-NH2 синтезировали классическим твердофазным методом с использованием Boc/Bzl-методологии и схемы неполного блокирования боковых функций аминокислот. В синтезе применяли сополимер стирола с 1%-дивинилбензола, модифицированный п-метилбензгидриламинной якорной группой (MBHA-resin), к которому первоначально присоединяли производное аргинина Boc-Arg(Tos)-OH. Для введения остатка гомосерина использовали Boc-L-Hse(Bzl)-OH. После завершения синтеза, пептиды отщепляли от полимерной подложки безводным HF с добавкой 10% по объему м-крезола. Пептиды очищали с помощью препаративной ВЭЖХ на колонке Phenomenex Synergy Hydro-RP RP (50 x 250мм). Идентичность полученных препаратов оценивали масс-спектрометрически, а также с помощью аминокислотного анализа. Пептид имеет следующие свойства: молекулярная масса 798 Да; изоэлектрическая точка 7,80; рН стабильность в интервале рН от 2.0 до 9,0; термостабильность в интервале температур от 0°С до +60°С; гомогенность 99%; растворимость в воде и физиологическом растворе, неиммуногенный, нетоксичный. Строение пептида подтверждается масс-спектроскопическим анализом молекулярного пика пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 и его фрагментов (Рис. 1). В результате масс-спектроскопического анализа найдены: исходный пептид - пик 699 Da, фрагменты y2 - (His-Arg-NH2) c MW 311,13; y3 - (Hse-His-Arg-NH2) c MW 412.20; b5 - (Thr-Gly-Glu-Hse-His) c MW 526,07. Приведенные на спектрах данные подтверждают строение заявленного нейропротекторного пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2.
Изобретение иллюстрируют рисунки и таблицы.
Рис. 1. Масс-спектроскопический анализ молекулярного пика пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 и его фрагментов.
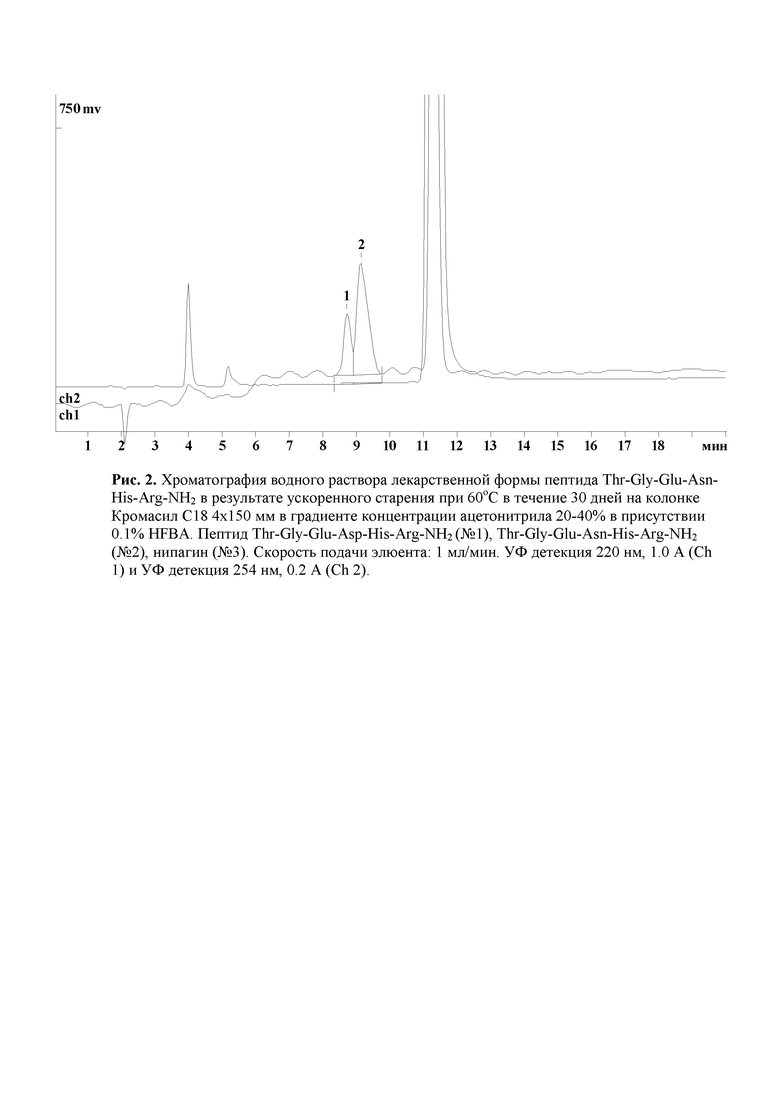
Рис. 2. Хроматография водного раствора лекарственной формы пептида Thr-Gly-Glu-Asn-His-Arg-NH2 в результате ускоренного старения при 60оС в течение 30 дней на колонке Кромасил С18 4х150 мм в градиенте концентрации ацетонитрила 20-40% в присутствии 0.1% HFBA.
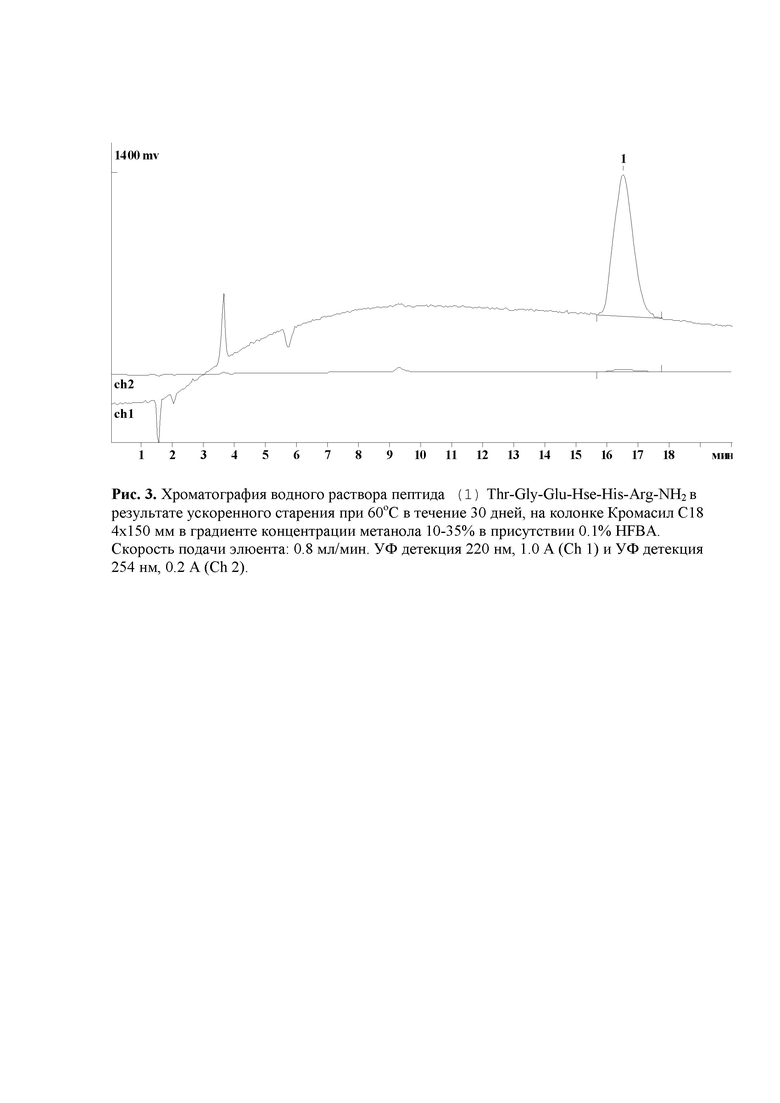
Рис. 3. Хроматография водного раствора пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 в результате ускоренного старения при 60оС в течение 30 дней, на колонке Кромасил С18 4х150 мм в градиенте концентрации метанола 10-35% в присутствии 0.1% HFBA.
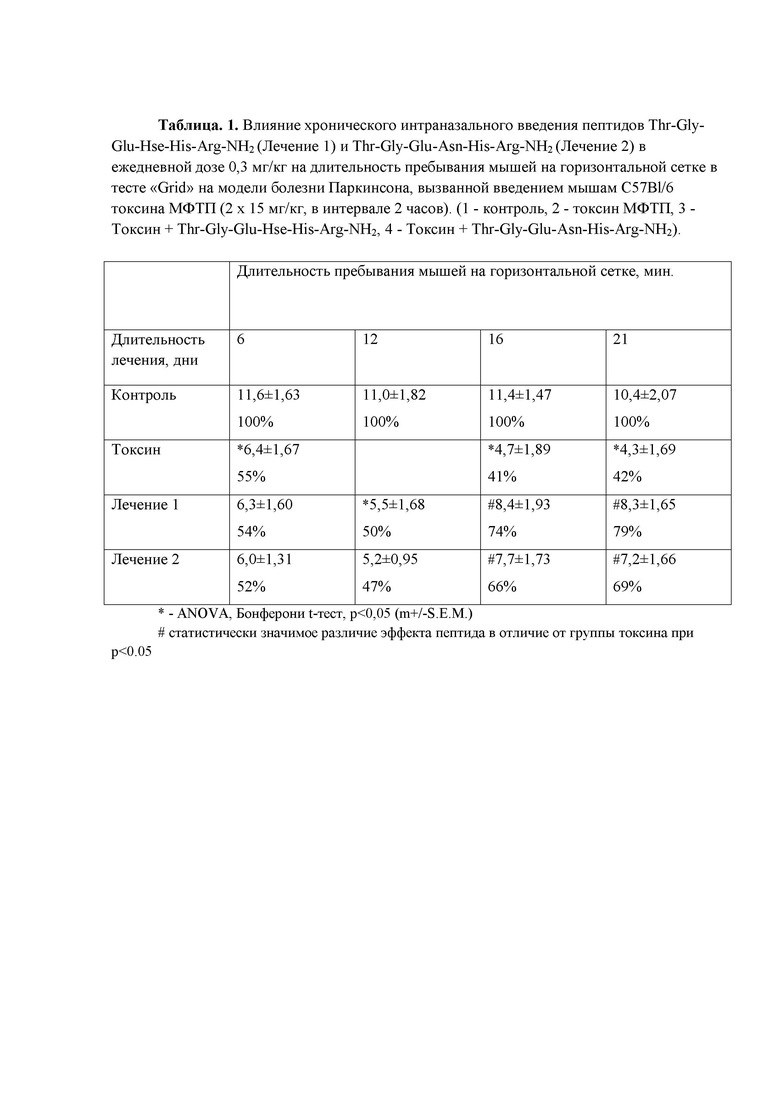
Таблица 1. Влияние хронического интраназального введения пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 в ежедневной дозе 0,3 мг/кг на длительность пребывания мышей на горизонтальной сетке в тесте «Grid» на модели болезни Паркинсона, вызванной введением мышам C57Bl/6 токсина МФТП (2х15 мг/кг, в интервале 2 часов)(см. в конце описания).
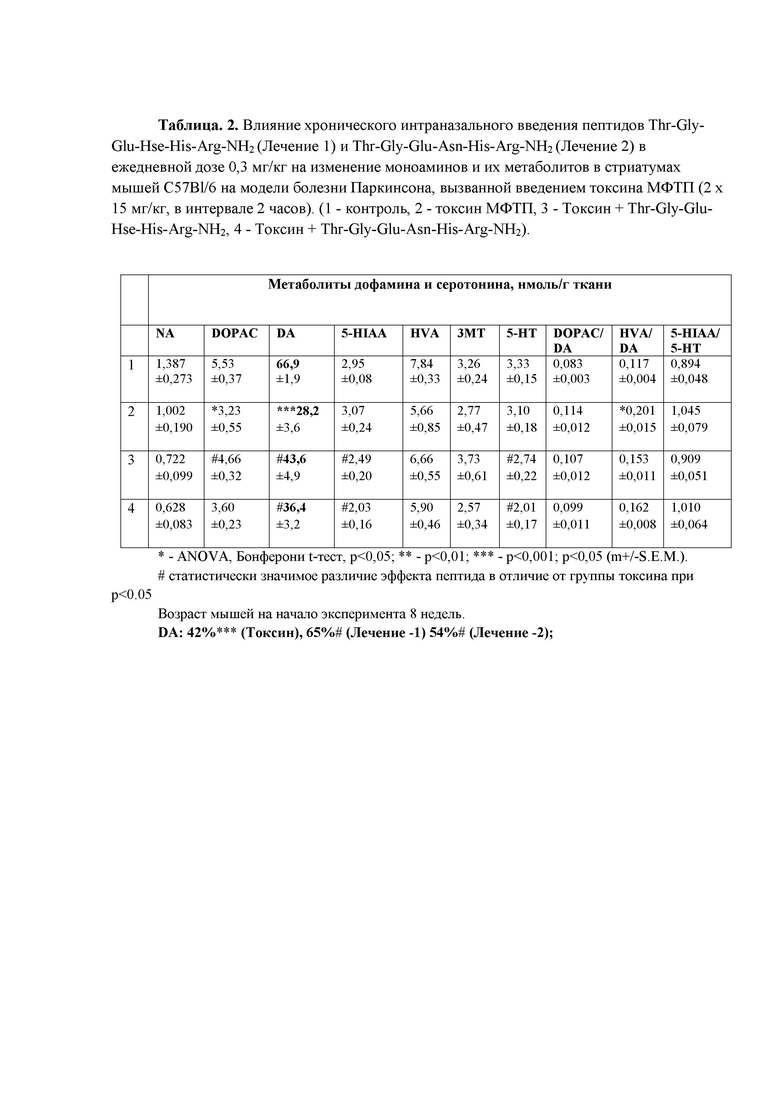
Таблица 2. Влияние хронического интраназального введения пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 в ежедневной дозе 0,3 мг/кг на изменение моноаминов и их метаболитов в стриатумах мышей C57Bl/6 на модели болезни Паркинсона, вызванной введением токсина МФТП (см. в конце описания).
Изобретение иллюстрируют примеры.
Пример 1. Сравнительное изучение ускоренного старения водного раствора лекарственной формы пептида Thr-Gly-Glu-Asn-His-Arg-NH2 и пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2, при0оС в течение 30 дней.
Проведен анализ лекарственной формы пептида Thr-Gly-Glu-Asn-His-Arg-NH2, полученного после ускоренного старения водного раствора при 60оС в течение 30 дней. Для этого 0.5 мл исследуемого раствора лекарственной формы пептида Thr-Gly-Glu-Asn-His-Arg-NH2 лиофильно высушен в среднестенной пробирке для ПЦР объемом 1,5 мл. Полученный осадок экстрагировался 2 порциями метанола по 1 мл. Метанол удален при уменьшенном давлении, полученный осадок растворен в 0.5 мл воды и использован для хроматографического анализа. Хроматографический анализ лекарственной формы пептида Thr-Gly-Glu-Asn-His-Arg-NH2 на колонке Кромасил С18 4х150 мм в градиенте концентрации ацетонитрила 20-40% в присутствии 0.1% HFBA (рис.2).
Строение пептидов провели с помощью масс-спектрометрического анализа. Масс-спектры пептидов и их фрагментов получали на масс-спектрометре ионного циклотронного резонанса с преобразованием Фурье (FT ICR MS) Apex Ultra, производства Bruker Daltonik. Образец разбавлялся раствором, состоящим из смеси СH3CN - H2O (1:1), содержащей 0.1% муравьиную кислоту, в соотношении 1 к 100. Измерение спектров пептидов производили в режиме положительных ионов в диапазоне m/z от 200 до 2000.
Показано, что пептид, выделенный из хроматографического пика № 2, является исходным пептидом Thr-Gly-Glu-Asn-His-Arg-NH2 с MW 712.33, а пептид выделенный из хроматографического пика № 1 имеет строение Thr-Gly-Glu-Asp-His-Arg-NH2 и MW 713.32. В продуктах фрагментации пептида Thr-Gly-Glu-Asn-His-Arg-NH2 обнаружены фрагменты y2- (His-Arg-NH2) c MW 311,16 и y3 (Asn-His-Arg-NH2) c MW 425.24. В продуктах фрагментации пептида Thr-Gly-Glu-Asp-His-Arg-NH2 обнаружены фрагменты y2- (His-Arg-NH2) c MW 311,16 и y3 (Asp-His-Arg-NH2) c MW 426.23. Таким образом, было показано, что в условиях ускоренного старения при 60оС в течение 30 дней происходит гидролиз амидной группировки аспарагина до аспарагиновой кислоты. Пептид Thr-Gly-Glu-Asn-His-Arg-NH2 частично превращается в пептид Thr-Gly-Glu-Asp-His-Arg-NH2. Степень такого превращения в условиях ускоренного старения составляет 26%. Из результатов ускоренного старения пептида Thr-Gly-Glu-Asn-His-Arg-NH2 при 60оС в течение 30 дней следует, что водные растворы пептида не будут обладать необходимой двухлетней устойчивостью при 20оС.
Проведен анализ пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2, полученного после ускоренного старения водного раствора при 60оС в течение 30 дней (рис. 3). Из результатов ускоренного старения пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 при 60оС в течение 30 дней можно сделать вывод о том, что водные растворы этого пептида будут обладать необходимой двухлетней устойчивостью при 20оС. Таким образом, предложенный нейропротекторный пептид Thr-Gly-Glu-Hse-His-Arg-NH2 свободен от основного недостатка нейропротекторного пептида Thr-Gly-Glu-Asn-His-Arg-NH2, который связан с его недостаточной гидролитической устойчивостью при хранении в виде водных растворов.
Пример 2. Сравнительное изучение нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 на поведение мышей инбредной линии C57Bl/6 в тесте «Grid» на модели болезни Паркинсона, вызванной введением токсина МФТП.
Опыты проведены на мышах-самцах линии C57BL/6 массой тела 20 – 22 г (питомник РАМН “Столбовая”), содержавшихся в условиях лабораторного вивария при 12-часовом световом режиме со свободным доступом к воде и стандартному корму. До проведения поведенческих тестов животные выдерживались в условиях вивария в течение 2 недель. Исследование поведенческой активности животных проводили с использованием «Grid» теста, на модели болезни Паркинсона, вызванной введением токсина МФТП (Tillerson and Miller, 2003). Животных разделили на четыре статистически одинаковые группы по 8 животных в каждой: «Контроль», «Токсин», «Лечение 1» и «Лечение 2». Животным из групп «Токсин», «Лечение 1» и «Лечение 2» двукратно внутрибрюшинно вводили токсин МФТП в дозе 15 мг/кг, с интервалом 2 часа, в объёме 200 мкл. Животным из группы «Контроль» по той же схеме вводили 0.9% NaCl в объёме 200 мкл. Сравнение нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 (Лечение 1) и Thr-Gly-Glu-Asn-His-Arg-NH2 (Лечение 2) проводилось при их трехнедельном хроническом интраназальном применении в ежесуточной дозе пептидов в дозе 300 мкг/кг. В результате на МФТП-модели БП установлены закономерности влияния пептидов на нормализацию локомоторных дисфункций. Пептиды Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 растворяли в 0,9 % NaCl и вводили интраназально в объеме 12 мкл в две ноздри, поровну, за один час до помещения животных в «Grid» тест. Животным группы «Контроль» и «Токсин», вводили 0,9 % NaCl в том же объеме. Поведенческие эксперименты в «Grid» тест проводили с использование модифицированной решетки, представляющей открытую камеру с размером 55 см х 8 см х 5 см. Нижняя часть камеры закрыта стальной сеткой размером ячеек 0.8 см х 0.8 см (Kim et al, 2010). Животные помещались в среднюю часть камеры, после чего камера переворачивалась в горизонтальное положение. Измерялось время нахождения животных на решетке за время ограниченное 15 минутами. Эти поведенческие тесты проводили многократно с интервалами около недели. Результаты хронического интраназального введения пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 на длительность пребывания мышей на горизонтальной сетке в тесте «Grid» на модели болезни Паркинсона приведены в таблице 1. Показан положительный поведенческий эффект в результате введения нейропротекторных пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2, который развивается в течение 3 недель. Найдено, что через одну неделю после введения токсина МФТП животные из групп «Лечение 1» и «Лечение 2» движутся по горизонтальной решетке в течение времени, близким к времени нахождения на ней животных из группы «Токсин», составляющим 55% от контрольной группы. Через три недели введения пептидов, животные из групп «Лечение 1» и «Лечение 2» движутся по горизонтальной решетке в течение времени, приближающимся к времени нахождения на ней животных из группы «Контроль», составляя 79% и 69% для групп «Лечение 1» и «Лечение 2», соответственно.
Таким образом, при сопоставлении нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 при хроническом интраназальном введении этих пептидов мышам инбредной линии С57Bl/6 показано наличие у этих пептидов нормализующей нейропротекторной активности. Однако, если при хроническом трех недельном интраназальном введении пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 в дозе 300 мкг/кг наблюдается значительное восстановление нарушенных поведенческих функций животных на модели болезни Паркинсона в «Grid» тесте, то применение пептида Thr-Gly-Glu-Asn-His-Arg-NH2 приводит к восстановлению поведенческих функций в меньшей степени, чем при введении пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2. Таким образом, в этом поведенческом тесте пептид (1) Thr-Gly-Glu-Hse-His-Arg-NH2 обладает большей нейропротекторной активностью, чем известный пептид Thr-Gly-Glu-Asn-His-Arg-NH2
Пример 3. Сравнительное изучение нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 на изменение моноаминов и их метаболитов в стриатумах мышей C57Bl/6 на модели болезни Паркинсона, вызванной введением токсина МФТП.
Опыты проведены на мышах-самцах линии C57BL/6 массой тела 20 – 22 г (питомник РАМН “Столбовая”), содержавшихся в условиях лабораторного вивария при 12-часовом световом режиме со свободным доступом к воде и стандартному корму. До проведения поведенческих тестов животные выдерживались в условиях вивария в течение 2 недель. Исследование нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 проводили на модели болезни Паркинсона, вызванной введением токсина МФТП. Животных разделили на четыре статистически одинаковые группы (n = 8 в каждой): «Контроль», «Токсин», «Лечение 1» и «Лечение 2». Животным из групп «Токсин», «Лечение 1» и «Лечение 2» двукратно внутрибрюшинно вводили токсин МФТП в дозе 15 мг/кг, с интервалом 2 часа, в объёме 200 мкл. Животным из группы «Контроль» по той же схеме вводили 0.9% NaCl в объёме 200 мкл. Сравнение нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 (Лечение 1) и Thr-Gly-Glu-Asn-His-Arg-NH2 (Лечение 2) проводилось при их трехнедельном хроническом интраназальном применении в ежесуточной дозе в дозе 300 мкг/кг с использованием МФТП-модели БП. В результате на МФТП-модели БП установлены закономерности влияния пептидов на нормализацию моноаминов и их метаболитов в стриатумах мышей C57Bl/6. Пептиды Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 растворяли в 0,9 % NaCl и вводили интраназально в объеме 12 мкл в две ноздри, поровну за один час до помещения животных в «Grid» тест. Животным группы «Контроль» и «Токсин», вводили 0,9 % NaCl в том же объеме.
Животных декапитировали через 1 ч после завершения эксперимента «Grid» тест. Стриатумы извлекали на льду, замораживали в жидком азоте и взвешивали. Перед экспериментами по определению содержания нейротрансмиттеров пробы размельчали в ручном гомогенизаторе (тефлон-стекло) в 40 объемах 0,1 н. HClO4 с добавлением диоксибензиламина (0,5 нмоль/мл) в качестве внутреннего стандарта. Пробы центрифугировали при 10000g в течение 15 мин. Изучаемые вещества разделяли на обращенно-фазной колонке ReproSil-Pur, ODS-3, 4 ґ 100 мм, диаметр пор 3 мкм (Dr. Majsch GMBH, “Элсико”, Москва). Насос PM-80 (BAS, США), скорость элюции подвижной фазы 1 мл/мин, при давлении 200 атм. Мобильная фаза: 0,1 M цитратно-фосфатный буфер, содержащий 1,1 мМ октансульфоновой кислоты, 0,1 мМ ЭДТА и 9 % ацетонитрила (pH 3,0). Измерение проводили на стеклоугольном электроде (+ 0,85 В) против электрода сравнения Ag/AgCl. Результаты экспериментов по изучению поведения и анализа моноаминов анализировали с помощью SigmaPlot v.12 (Systat Software Inc., San Jose, CA, USA). В случае нормального распределения использовали однофакторный дисперсионный анализ с последующим тестом Бонферони.
Через три недели после введения МФТП в контрольной группе наблюдалось снижение содержания ДА стриатуме на 58 %. Для сравнительного изучения нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 использована экспериментальная модель паркинсонизма, реализуемая при введении умеренных доз нейротоксина МФТП молодым самцам мышей линии С57ВL/6. Выбор животных связан с тем, что наиболее часто используются в МФТП-моделях и позволяет анализировать как стадию нейродегенерации, так и восстановления нигростриатной системы. Необходимо отметить особенность этих моделей, заключающаяся в том, что в них происходит зависимое от дозы введенного токсина спонтанное восстановление нигростриатной системы за 2-3 месяца (Fornai et al, 2000). Поэтому, абсолютная величина снижения уровня дофамина в стриатуме под действием МФТП не является однозначной характеристикой этой модели. Уровень дофамина в стриатуме зависит не только от использованной дозы МФТП, но и от времени, прошедшего после введения токсина. Так, например, использование дозы 2 х 15 мг/кг приводит через неделю к снижению уровня дофамина в стриатуме на 75%, но уже через 30 дней снижение составляет менее 40% от контрольного. При этом происходит практически полное восстановление уровня везикулярного транспортера моноаминов 2 типа (ВМАТ2) и тирозинкиназы (Tillerson and Miller, 2003).
Помимо ДА, в стриатуме во всех группах были проанализированы моноамины – норадреналин (NA) и серотонин (5-HT), а также, метаболиты дофамина – DOPAC и HVA, а также метаболит серотонина - 5-HIAA. В стриатуме животных из группы «Токсин» не было обнаружено достоверных изменений в уровне серотонина, однако, наблюдалось снижение уровня норадреналина на 28% (Табл. 2). Можно предположить, что уменьшение концентрации норадреналина в стриатуме является показателем нарушения NA-ергической иннервации стриатума на ранней стадии развития патологического процесса в нигростриатной системе. Важным функциональным показателем при анализе состояния нигростриатной ДА-ергической системы является соотношение метаболит/медиатор, который в литературе рассматривается как показатель оборота ДА, включающего в себя синтез, распад, выделение и обратный захват ДА. Увеличение соотношения DOPAC/DA и HVA/DA в стриатуме может интерпретироваться как компенсаторное усиление дофаминовой нейротрансмиссии на поздней досимптомной стадии, в то время как известно, что на симптомной стадии данное соотношения значительно снижается.
Из приведенных в таблице 2 данных следует, что в результате введения нейроактивных пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2, на модели МФТП-индуцированного паркинсонизма в течение 3 недель развивается положительный нейропротекторный эффект, выраженный в восстановлении уровня дофамина в стриатумах, что является отражением восстановительного процесса в нигростриатной системе. Восстановление в нигростриатной системе на модели МФТП-индуцированного паркинсонизма подтверждается также данными приведенными в «Grid» тесте для этих пептидов. Так как известно, что повреждения в дофаминовой нигростриатной системе начинаются с гибели аксонов ДА-нейронов, то можно предположить, что под действием нейроактивного пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2, на модели МФТП-индуцированного паркинсонизма, усиливается регенерация (обратное отрастание) поврежденных ДА-ергических волокон из компактной части черной субстанции. На модели МФТП-индуцированного паркинсонизма показано, что развитие нейропротекторного эффекта под действием нейроактивного пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 происходит в течение 2-3 недель, что позволяет предположить участие аксоногенеза в реализации этого эффекта.
Таким образом, при сопоставлении нейропротекторной активности пептидов Thr-Gly-Glu-Hse-His-Arg-NH2 и Thr-Gly-Glu-Asn-His-Arg-NH2 на модели болезни Паркинсона показано, что в результате хронического трех недельного интраназального введения пептида Thr-Gly-Glu-Hse-His-Arg-NH2 в дозе 300 мкг/кг наблюдается значительное восстановление уровня дофамина и его метаболитов в стриатумах мышей C57Bl/6. При сравнении показано, что пептид Thr-Gly-Glu-Asn-His-Arg-NH2 обладает меньшей нейропротекторной активностью на модели болезни Паркинсона, чем пептид (1) Thr-Gly-Glu-Hse-His-Arg-NH2, и его применение приводит к восстановлению уровня дофамина и его метаболитов в стриатумах мышей C57Bl/6 в меньшей степени. Таким образом, по способности к восстановлению уровня дофамина и его метаболитов в стриатумах мышей C57Bl/6 в этом поведенческом тесте, пептид (1) Thr-Gly-Glu-Hse-His-Arg-NH2 обладает большей нейропротекторной активностью, чем известный пептид Thr-Gly-Glu-Asn-His-Arg-NH2
Таким образом, впервые показано, что в результате хронического трех недельного интраназального введения пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 в дозе 300 мкг/кг наблюдается как восстановление нарушенных поведенческих функций животных, так и достоверное восстановление уровня дофамина в стриатумах головного мозга. Такой положительный нейропротекторный эффект инновационного пептида (1) Thr-Gly-Glu-Hse-His-Arg-NH2 получен впервые в мире. Полученные результаты свидетельствуют о перспективности пептида HLDF-6-амида с точки зрения создания на его основе нейропротекторного, высокоэффективного и нетоксичного лекарственного средства для лечения болезни Паркинсона.
Литература
1. Smith K. Trillion-dollar brain drain. Nature, 2011 478, (7367), 15.
2. Монография: Нейродегенеративные заболевания: от генома до целостного организма / под ред. М.В. Угрюмова. – М.: в 2-х томах - М., Научный мир, (2014). ISBN 978-591522-400-0.
3. Миронов А.Н. Бунятян Н.Д., Васильев А.Н. (2012) Руководство по проведению доклинических исследований лекарственных средств, Ч.1. Москва: Гриф и К.
4. Robinson N.E., Robinson A.B., Merrifeld R.B. Mass spectrometric evaluation of syntheticpeptides as primary structure models for peptide and protein deamidation. J. Peptide Res. 2001, 57, 483-493.
5. Костанян И.А., Астапова М.В., Наволоцкая Е.В., Лепихова Т.Н., Драницина С.М., Телегин Г.Б., Родионов И.Л., Байдакова Л.К., Золотарев Ю.А., Молотковская И.М., Либкин В.М., Биологически активный фрагмент фактора дифференцировки клеток линии LH–60. Идентификация и свойства. Биоорган. химия, 2000, 26(7), 505-511.
6. Fornai F, Battaglia G, Gesi M, Giorgi FS, Orzi F, Nicoletti F, Ruggieri S. Time-course and dose-response study on the effects of chronic L-DOPA administration on striatal dopamine levels and dopamine transporter following MPTP toxicity. Brain Res 2000, 887:110.
7. Tillerson J.L., Miller G.W. Grid performance test to measure behavioral impairment in the MPTP-treated-mouse model of parkinsonism. J. Neuroscience Methods 2003, 123 189-200.
8. Kim S. T., Son H. J., Choi J. H., Ji I. J., Hwang O. Vertical grid test and modified horizontal grid test are sensitive methods for evaluating motor dysfunctions in the MPTP mouse model of Parkinson's disease, 2010, Brain Research 1306, 176–183.
9. Богачук А.П., Сторожева З.И., Золотарев Ю.А., Ковалев Г.И., Азев В.Н., Липкин В.М. «Пептид, обладающий нейропротекторной и ноотропной активностью, и фармацевтическая композиция на его основе», патент Российской Федерации № 2557003, дата регистрации 22 июня 2015 г.
10. Золотарев Ю.А., Ковалёв Г.И., Дадаян А.К., Кост Н.В., Соколов О.Ю., Богачук А.П., Липкин В.М. Анксиолитическое средство и фармацевтическая композиция анксиолитического действия. Патент Российской Федерации № 2580311, 14 марта 2016. Опубл. 10.04.2016. Бюл. №10.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД, ОБЛАДАЮЩИЙ НЕЙРОПРОТЕКТОРНОЙ И НООТРОПНОЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2014 |
|
RU2557003C2 |
| АНКСИОЛИТИЧЕСКОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНКСИОЛИТИЧЕСКОГО ДЕЙСТВИЯ | 2014 |
|
RU2580311C1 |
| ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2755997C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЛЕЧЕНИЯ ОЖОГОВЫХ ПОРАЖЕНИЙ КОЖИ | 2018 |
|
RU2704621C1 |
| Способ ранней доклинической диагностики болезни Паркинсона по концентрации катехоламинов в слезной жидкости пациента | 2019 |
|
RU2775261C2 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ - АНАЛОГИ GRF ИЛИ ИХ НЕТОКСИЧНЫЕ СОЛИ | 1990 |
|
RU2096416C1 |
| Средство, снижающее относительное содержание низкодифференцированных и повышающее относительное содержание высокодифференцированных клеток в инвазивной карциноме молочной железы неспецифического типа | 2022 |
|
RU2786528C1 |
| Фармацевтическая композиция на основе альфа-метил-п-тирозина и способ ранней диагностики болезни Паркинсона | 2019 |
|
RU2719575C1 |
| СРЕДСТВА, ПУТИ ПРИМЕНЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ СИНУКЛЕОПАТИИ | 2016 |
|
RU2765303C2 |
| Лактоферрин, используемый при диагностике или прогнозировании болезни Альцгеймера или диагностике болезни Паркинсона | 2016 |
|
RU2745602C2 |
Изобретение относится к новым биологически активным соединениям, конкретно к пептидам с нейропротекторной и нормализующей активностью. Предложен гексапептид (1) формулы Thr-Gly-Glu-Hse-His-Arg-NH2 в качестве нейропротекторного и нормализующего средства. Предложен новый состав фармацевтической композиции на основе пептида, содержащей в качестве активного вещества гексапептид (2,5 г/л), консервант в виде нипагина (1,0 г/л), хлорид натрия (10,0 г/л) и воду дистиллированную - остальное. Пептид обладает высокой нейропротекторной активностью и может использоваться для получения высокоэффективного и нетоксичного лекарственного средства, которое используется в виде капель в нос, и предназначено для профилактики или лечения болезни Паркинсона. 2 н.п. ф-лы, 3 ил., 2 табл., 3 пр.
1. Пептид (1) формулы Thr-Gly-Glu-Hse-His-Arg-NH2, обладающий нейропротекторной и нормализующей активностью.
2. Фармацевтическая композиция на основе пептида для профилактики и лечения первичного паркинсонизма, высокоэффективная в низких дозах и используемая в виде капель в нос, состава:
гексапептид (1) Thr-Gly-Glu-Hse-His-Arg-NH2 – 2,5 г/л;
нипагин (консервирующее вещество) - 1,00 г/л;
хлорид натрия (создает в получаемом растворе осмотическое давление, близкое к таковым показателям плазмы крови) - 10,00 г/л;
вода дистиллированная – остальное.
| АНКСИОЛИТИЧЕСКОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНКСИОЛИТИЧЕСКОГО ДЕЙСТВИЯ | 2014 |
|
RU2580311C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ НЕЙРОПРОТЕКТОРНОЙ И НООТРОПНОЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2014 |
|
RU2557003C2 |
| ПЕПТИД, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ, ПРОТЕКТОРНОЙ И НОРМАЛИЗУЮЩЕЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2213747C2 |
Авторы
Даты
2018-07-26—Публикация
2017-08-01—Подача