Область техники, к которой относится изобретение
Настоящее изобретение относится к генной терапии, более конкретно, к олигонуклеотидам для введения изменений в последовательность молекулы целевой РНК, присутствующей в живой клетке.
Уровень техники
Причиной многих генетических заболеваний являются мутации в геноме. Было обнаружено, что за счет мутаций осуществляются модификации генома различного типа: делеции одной или нескольких пар оснований, одно или более ошибочных спариваний оснований в последовательности гена, вставка (инсерция) одного или нескольких нуклеотидов или реитерация триплетных повторов и отсутствие или дупликация целого гена или его части.
Генетические заболевания, вызываемые ошибочными спариваниями, делецией или инсерцией одной или более пар оснований, включают муковисцидоз (кистозный фиброз), мышечную дистрофию, серповидноклеточную анемию, гемофилию, β-талассемию, синдром ломкой Х-хромосомы (синдром Мартина-Белл).
Репарацию РНК можно применять для исправления генетических дефектов на уровне РНК.
Олигонуклеотиды и их комплексы применялись в качестве терапевтических молекул для восстановления ДНК-модификаций (ДНК-репарации) (I Papaioannou, JP Simons, JS Owen Oligonucleotide-directed gene-editing technology: mechanisms and future prospects Expert Opin. Biol. Ther. (2012) 12(3): 329-342). Эти олигомеры могут содержать РНК- и/или ДНК-нуклеотиды. Они применяются для осуществления сайт-специфической репарации дефектной ДНК. Предполагалось, что репарация осуществляется путем активации механизмов репарации эндогенной ДНК после узнавания введенного ошибочного спаривания оснований.
Триплекс-формирующие олигонуклеотиды также применялись для таргетирования генов (направленного воздействия на гены) в качестве специфических в отношении последовательностей инструментов. Триплекс-формирующие олигонуклеотиды с высокой аффинностью связываются с большой бороздкой двухцепочечной (двойной) спирали ДНК. Благодаря этому свойству триплекс-формирующие олигонуклеотиды были предложены в качестве средства для сайт-специфической коррекции генов-мишеней (Knauert et al., Hum Mol Genet. (2001) 10, 2243-2251; Richardson et al, Drug Target (2002) 10, 133-134; Thoung et al., (1993) Angewandte Chemie. Intl. Ed. Eng., 32, 666-690.). Современные методы репарации генов-мишеней не очень эффективны, и/или не доказано, что они работают в живых клетках in situ, что оставляет возможность существования другого механизма репарации дефектов генов.
Сообщалось о репарации дефектных генов на уровне РНК. Специфичную репарацию мРНК с помощью комплекса дуплексных олигонуклеотидов применяли, например, для вставки нуклеотидов в AF508 CFTR мРНК in vitro. Предполагаемый механизм этого процесса включает расщепление, опосредуемое РНКазой Н, с последующей репарацией РНК. (PC Zamecnik, МК Raychowdhury, DR Tabatadze, HF Cantiello Reversal of cystic fibrosis phenotype in a cultured AF508 cystic fibrosis transmembrane conductance 10 regulator cell line by oligonucleotide insertion Proc Natl Acad Sci 2004 101(21) 8150- 8155; Международная заявка WO 2005094370, Oligonucleotide complex compositions and methods of use as gene alteration tools).
Описание изобретения
Настоящее изобретение относится к способу репарации гена-мишени в живых (живых) клетках, более предпочтительно, в живых клетках многоклеточного организма (in vivo). Более конкретно, в настоящем изобретении рассматривается введение изменений целевой РНК in vivo в живых клетках многоклеточного организма, более конкретно, в живых клетках животного, более конкретно, млекопитающего, в особенности человека. Несмотря на то, что имеются более ранние сообщения о репарации генов в живых клетках, заявители полагают, что в настоящем изобретении впервые раскрывается возможность введения изменений в молекуле целевой РНК в живой клетке in vivo, изменяя тем самым фенотип этого организма, с применением олигонуклеотидов, предпочтительно, одноцепочечных олигонуклеотидов, более предпочтительно, одноцепочечных олигорибонуклеотидов, еще более предпочтительно, химически модифицированных одноцепочечных олигорибонуклеотидов. Неожиданно оказалось, что олигонуклеотиды по настоящему изобретению можно вводить in vivo без утраты активности и в таких количествах, которые позволяют практически исправить болезненный фенотип организма субъекта. Данное изобретение иллюстрируется на примере введения в легкое особи (организма), страдающей муковисцидозом, химически модифицированного олигорибонуклеотида, который способен восстанавливать последовательность РНК, кодирующую CFTR, тем самым исправляя функцию белка CFTR и восстанавливая CF фенотип, или по меньшей мере улучшая состояние организма. Следовательно, настоящее изобретение относится к олигонуклеотиду, предпочтительно, одноцепочечному антисмысловому олигонуклеотиду; к композиции, содержащей такой олигонуклеотид; к фармацевтической композиции, содержащей такой олигонуклеотид и фармацевтически приемлемый носитель; к применению и к способам применения такого олигонуклеотида или композиции для in vivo или in vitro репарации РНК и/или введения изменений (модификации) в последовательность молекулы целевой РНК; такой олигонуклеотид или такую композицию для применения с целью лечения или предупреждения заболевания, связанного с (генетическим) нарушением или с генетической мутацией, включающего введение такого олигонуклеотида или композиции субъекту, предпочтительно, человеку; и к способу лечения или предупреждения заболевания, связанного с (генетическим) нарушением или с генетической мутацией, включающему введение такого олигонуклеотида или композиции субъекту, предпочтительно, человеку. При введении такого, предпочтительно, одноцепочечного антисмыслового, олигонуклеотида в клетку, предпочтительно, клетку млекопитающего, более предпочтительно, в клетку человека, этот олигонуклеотид направляется в то место РНК или ее предшественника или матрицы, где требуется репарация РНК, и, вероятно, служит в качестве лидирующей (ведущей) цепи для репарации РНК. Конкретный механизм репарации неизвестен, но олигонуклеотид по настоящему изобретению, предпочтительно, одноцепочечная молекула для репарации, предпочтительно, не допускает участия РНКазы Н в процессе репарации. Изменение, опосредуемое в целевой РНК, может происходить непосредственно на уровне РНК или опосредованно с использованием ДНК, которая затем транскрибируется в РНК, или ее предшественник. Олигонуклеотиды по настоящему описанию, как правило, называются олигонуклеотидами по изобретению и могут применяться во всех вариантах настоящего изобретения.
Все варианты настоящего изобретения могут осуществляться (в случае способа или применения) или могут применяться (в случае соединения или композиции) in vitro, in vivo или ex vivo.
Предмет и способы по настоящему изобретению удобно применять для лечения муковисцидоза, предпочтительно, с использованием репарации мутации дельтаР508 в экзоне 10 белка CFTR (трансмембранного регулятора муковисцидоза). Механизм действия типичного олигонуклеотида по изобретению, молекулы, показанной SEQ ID NO: 1, представлен на фигурах 1-3 и 7А. Активность типичного олигонуклеотида по изобретению, молекулы, представленной SEQ ID NO: 1, по сравнению с ранее описанной двухцепочечной (двунитевой) молекулой (Zamecnik et al, см. выше), иллюстрируется на фигуре 4. На фигуре показано, что представленный в настоящем описании одноцепочечный антисмысловой олигонуклеотид (AON) по меньше мере проявляет такую же активность, и по-видимому, является более активным, в процессе репарации CFTR по сравнению с ранее описанной двухцепочечной молекулой (PC Zamecnik, МК Raychowdhury, DR Tabatadze, HF Cantiello Reversal of cystic fibrosis phenotype in a cultured ΔF508 cystic fibrosis transmembrane conductance regulator cell line by oligonucleotide insertion Proc Natl Acad Sci 2004 101(21) 8150-8155; W 02005094370, Oligonucleotide complex compositions and methods of use as gene alteration tools). Активность олигонуклеотида SEQ ID NO: 1 определяли, применяя сравнительный анализ, описанный в статье Zamecnik et al, см. выше, в частности, см. Фиг. 4 на стр. 8153.
Предмет и способы по настоящему изобретению удобно применять для введения изменения в другую молекулу целевой РНК и/или для лечения других заболеваний, связанных с (генетическими) нарушениями, такими, но без ограничения, как альбинизм, дефицит альфа-1-антитрипсина, болезнь Альцгеймера, боковой (латеральный) амиотрофический склероз, астма, β-талассемия, ЦАДАСИЛ (Cadasil)-синдром, болезнь Шарко-Мари-Тута (Charcot-Marie-Tooth), хроническая обструктивная болезнь легких (ХОБЛ, COPD), дистальная спинальная мышечная атрофия (DSMA), мышечная дистрофия Дюшенна/Беккера, дистрофический буллезный эпидермолиз, буллезный эпидермолиз, болезнь Фабри, семейный аденоматоз, полипоз, галактоземия, болезнь Гоше, дефицит глюкозо-6-фосфатдегидрогеназы, гемофилия, врожденный гемохроматоз, синдром Хантера, болезнь Хантингтона, синдром (Гертруды) Гурлер (болезнь Шейе), воспалительные заболевания кишечника (ВБК, IBD), врожденный синдром массивной агглютинации (полиагглютинации), синдром Леша-Нихена, синдром Линча, синдром Марфана, мукополисахаридоз, мышечная дистрофия, миотоническая дистрофия типа I и II, болезнь Ниманна-Пика типа А, В и С, NY-ESO-1 опосредованный рак, болезнь Паркинсона, синдром Пейтца-Егерса, фенилкетонурия, болезнь Помпе, первичная цилиарная дискинезия, легочная гипертензия, пигментная дистрофия сетчатки, болезнь Сандхоффа, синдром тяжелого комбинированного иммунодефицита (ТКИД, SCID), серповидноклеточная анемия, спинальная мышечная атрофия, болезнь Штаргардта, болезнь Тея-Сакса, Х-сцепленный иммунодефицит (синдром ломкой Х-хромосомы), различные формы рака (например, рак молочной железы или рак яичника, связанный с мутацией в генах BRCA1 и 2) и т.п.
Согласно одному предпочтительному варианту изобретения изменение в целевой последовательности РНК включает инсерцию одного или более нуклеотидов в целевую РНК. Согласно более предпочтительному варианту инсерция одного или более нуклеотидов приводит к инсерции по меньшей мере одной аминокислотной последовательности в полипептидной последовательности, кодируемой целевой РНК-последовательностью. Согласно наиболее предпочтительному варианту инсерция аминокислотной последовательности приводит к восстановлению кодируемого полипептида до полипептида с нормальной функцией в многоклеточном организме. Соответственно, наиболее предпочтительными вариантами изобретения являются такие варианты, в которых целевая РНК-последовательность в многоклеточном организме связана с нарушением, вызванным нарушением функции целевой РНК-последовательности, а генетическое нарушение выбрано из группы нарушений, вызванных отсутствием одного или более нуклеотидов в целевой РНК-последовательности по сравнению с целевыми РНК-последовательностями с нормальной функцией. Предпочтительными последовательностями по изобретению являются такие целевые РНК-последовательности, в которых отсутствует по меньшей мере часть кодона, которая восстанавливается посредством (введения изменения в РНК-последовательности с помощью олигонуклеотида по изобретению.
В настоящем изобретении показано, что репарацию РНК можно проводить in vivo посредством системного введения олигонуклеотида по изобретению. В зависимости от ткани или органа, связанных с нарушением, или, в более общем смысле, в которых нужно выполнить изменения в целевой РНК, для того, чтобы оптимизировать доставку олигонуклеотида по изобретению, следует специально подобрать способ введения. При нарушениях работы легких и других заболеваниях дыхательных путей олигонуклеотиды по изобретению можно удобно вводить непосредственно в легкие, например, с помощью ингаляции. Или же, в зависимости от нарушения и/или ткани-мишени олигонуклеотид по изобретению удобно вводить местно (например, на кожу) или системно, например, интрадермально, подкожно, внутримышечно, внутривенно, перорально, ректально, интракраниально и т.п..
Олигонуклеотиды по изобретению могут содержать ДНК- или РНК-нуклеотиды; для более высокой стабильности эти нуклеотиды могут представлять собой модифицированные ДНК- или РНК-нуклеотиды, по описанию в другом месте настоящей заявки. Олигонуклеотид по изобретению может содержать, например, инозин и/или может содержать модифицированные нуклеотиды, включающие фрагменты, выбранные из группы, состоящей из 2'-О-алкилрибозы, 2'-O-метилрибозы, 2'-фторрибозы, фосфоротиоата, метилфосфоната, РМО (ФМО), 5-метил-dC, 2-амино-dA, С5-пиримидина. Примером такого предпочтительного стабилизированного нуклеотида является нуклеотид, стабилизированный 2'-O-метильной группой, другим примером является замкнутая (закрытая, "запертая") нуклеиновая кислота (LNA, ЗНК) и/или пептид(о)-нуклеиновая кислота (PNA, ПНК). Другие способы повышения стабильности могут включать, например, фосфоротиоатные связи между нуклеотидами. Олигонуклеотиды по изобретению можно получать любым методом, известным из уровня техники. Специалист в данной области техники знает, как синтезировать олигонуклеотиды по изобретению.
Исходя из этого олигонуклеотид по изобретению, предпочтительно, модифицируют химическими методами с тем, чтобы он был устойчив к действию эндонуклеаз и РНКазы Н, и с тем, чтобы инициировать (РНК) связывание и устойчивость дуплекса. Конкретные свойства выбранной химической группы, по меньшей мере частично, влияют на доставку олигонуклеотида по настоящему изобретению к мишени: способ введения, биологическую стабильность, биораспределение, внутритканевое распределение и клеточное поглощение и миграцию. Кроме того, можно осуществить дальнейшую оптимизацию химической структуры олигонуклеотида с целью повысить аффинность и устойчивость (стабильность) связывания, повысить активность, безопасность и/или снизить стоимость изделий, уменьшая время или совершенствуя методику синтеза или процессов очистки. Многие химические модификации обычно доступны и/или коммерчески доступны для специалиста в данной области техники (такие как 2-О-метил РНК и 5-замещенные пиримидины и 2,6-диаминопурины).
Олигонуклеотид по изобретению может иметь по меньшей мере один скелет и/или модификацию сахара и/или одну модификацию основания.
Модификация основания включает модифицированный вариант натуральных пуриновых и пиримидиновых оснований (в частности, аденина, урацила, гуанина, цитозина и тимина), такой как гипоксантин, оротовая кислота, агматидин, лизидин, 2-тиопиримидин (например, 2-тиоурацил, 2-тиотимин), G-clamp нуклеотид и его производные, 5-замещенный пиримидин (например, 5-галогенурацил, 5-пропинилурацил, 5-пропинилцитозин, 5-аминометилурацил, 5-гидроксиметилурацил, 5-аминометилцитозин, 5-гидроксиметилцитозин, Super Т), 7-дезазагуанин, 7-дезазааденин, 7-аза-2,6-диаминопурин, 8-аза-7-дезазагуанин, 8-аза-7-дезазааденин, 8-аза-7-дезаза-2,6-диаминопурин, Super G, Super А и N4-этилцитозин или их производные; N2-циклопентилгуанин (cPent-G), N2-циклопентил-2-аминопурин (cPent-AP) и N2-пропил-2-аминопурин (Pr-АР) или их производные; и вырожденные или стандартные основания, такие как 2,6-дифтортолуол, или отсутствующие основания, такие как АР-сайты (например, 1-дезоксирибоза, 1,2-дидезоксирибоза, 1-дезокси-2-O-метилрибоза; или производные пирролидина, в которых атом кислорода в цикле замещен на азот (азарибоза)). Примеры производных Super A, Super G и Super Т можно найти в патенте США №6,683,173 (Epoch Biosciences), который включен в настоящее изобретение посредством отсылки. Было показано, что cPent-G, cPent-AP и Pr-АР ослабляют иммуностимулирующие эффекты при включении в киРНК (Peacock Н. et al. J. Am. Chem. Soc. 2011, 133, 9200).
Модификация сахаров включает модифицированный вариант рибозильного фрагмента, в частности 2'-O-модифицированную РНК, например, 2'-O-алкил или 2'-O-(замещенный)алкил, например, 2'-O-метил, 2'-O-(2-цианоэтил), 2'-O-(2-метокси)этил (2'-МОЕ), 2'-O-(2-тиометил)этил, 2'-О-бутирил, 2'-О-пропаргил, 2'-O-аллил, 2'-O-(2-амино)пропил, 2'-O-(2-(диметиламино)пропил), 2'-O-(2-амино)этил, 2'-O-(2-(диметиламино)этил); 2'-дезокси (ДНК); 2'-O-(галогеналкокси)метил (Arai K. et al. Bioorg. Med. Chem. 2011, 27, 6285), например, 2'-O-(2-хлорэтокси)метил (MCEM), 2'-O-(2,2-дихлорэтокси)метил (DCEM); 2'-O-алкоксикарбонил, например, 2'-O-[2-(метоксикарбонил)этил] (МОСЕ), 2-O-[2-(N,N-метилкарбамоил)этил] (MCE), 2'-О-[2-(N,N-диметилкарбамоил)этил] (DCME); 2'-галоид, например, 2'-F, FANA (2'-F арабинозил нуклеиновая кислота); модификации сахаров по атомам углерода и азота; 3'-О-алкил, например, 3'-О-метил, 3'-О-бутирил, 3'-О-пропаргил; и их производные. Другие модификации включают "мостиковую" или "бициклическую" нуклеиновую кислоту (BNA), например, замкнутую (закрытую) нуклеиновую кислоту (LNA, ЗНК), ксило-LNA, α-L-LNA, β-D-LNA, cEt (2'-O4'-С пространственно затрудненный этил) LNA, cMOEt (2'-O,4'-С пространственно затрудненный метоксиэтил) LNA, нуклеиновую кислоту с этиленовым мостиком (ENA), трицикло ДНК; незапертую (разомкнутую) нуклеиновую кислоту (UNA); циклогексенил-нуклеиновую кислоту (CeNA), альтрит-нуклеиновую кислоту (ANA), гексит-нуклеиновую кислоту (HNA), фторированную HNA (F-HNA), пиранозил-РНК (p-RNA, п-РНК), 3'-дезоксипиранозил-ДНК (p-DNA); морфолино (РМО), катионную морфолино (PMOPlus), РМО-Х; и их производные. Настоящее изобретение охватывает также введение нескольких (более одной) разных модификаций сахаров в олигонуклеотид по настоящему изобретению. BNA производные описаны, например в Международной заявке WO 2011/097641, которая во всей полноте включена в настоящее изобретение посредством отсылки. Примеры РМО-Х описаны в Международной заявке WO 2011150408, которая во всей полноте включена в настоящее изобретение посредством отсылки.
Модификация скелета включает модифицированный вариант фосфодиэфира, такой как фосфоротиоат (PS), хирально чистый фосфоротиоат, фосфородитиоат (PS2), фосфоноацетат (РАСЕ), фосфоноацетамид (РАСА), тиофосфоноацетат, тиофосфоноацетамид, пролекарство фосфоротиоата, Н-фосфонат, метилфосфонат, метилфосфонотиоат, метилфосфат, метилфосфоротиоат, этилфосфат, этилфаосфоротиоат, боранофосфат, боранофосфоротиоат, метил боранофосфат, метил боранофосфонат, метил боранофосфоротиоат и их производные. Другие модификации включают фосфорамидит, фосфорамидат, N3'→Р5' фосфорамидат, фосфор диамидат, фосфоротиодиамидат, сульфамат, диметиленсульфоксид, сульфонат, триазол, оксалил, карбамат, метиленимино (MMI) и тиоацетамидо-нуклеиновую кислоту (TANA); и их производные. Настоящее изобретение охватывает также введение нескольких (более одной) разных модификаций скелета в олигонуклеотид по настоящему изобретению.
Другие химические модификации олигонуклеотида по настоящему изобретению включают пептидо-нуклеиновые кислоты (PNA, ПНК), PNA (ПНК), модифицированные борным кластером, пирролидин оксипептидо-нуклеиновую кислоту (POPNA), гликоль- или глицерин-нуклеиновую кислоту (GNA), треозо-нуклеиновую кислоту (TNA), ациклический треонин-нуклеиновую кислоту (aTNA), морфолино-олигонуклеотид (РМО, РМО-Х), катионные морфолино-олигомеры (PMOPlus), олигонуклеотиды с интегрированными (объединенными) основаниями и скелетами (ONIBs), пирролидин-амид олигонуклеотиды (POMs) и их производные.
Олигонуклеотид по изобретению содержит последовательность, комплементарную целевой РНК, которая подлежит репарации (восстановлению, исправлению) и, предпочтительно, кодирует последовательность полипептида дикого типа. Соответственно, вследствие вырождения кодонов, олигонуклеотид может содержать один или более вырожденных комплементарных кодонов. Комплементарные нуклеотиды могут находиться по обеим сторонам сайта, которые подлежит репарации, т.е. последовательность, фланкирующая последовательность, подлежащую изменению, предпочтительно находится на 3', 5' или как на 3', так и на 5'стороне от последовательности, подлежащей изменению. В результате спаривания оснований этих комплементарных последовательностей репарация РНК активируется.
Последовательность целевой РНК, предпочтительно, отличается от восстановленной (исправленной) последовательности или последовательности дикого типа. Неисправленная целевая РНК, предпочтительно, представляет собой мутированную последовательность. Предпочтительно, мутация представляет собой замену, делецию или инсерцию (вставку) нормальной последовательности дикого типа. Исправленная нацеленная РНК, предпочтительно, представляет собой последовательность гена дикого типа или другую заданную эталонную последовательность.
Протяженность олигонуклеотида по изобретению, предпочтительно, составляет от 15 до 100 нуклеотидов и, предпочтительно, по меньшей мере 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или по меньшей мере 40 нуклеотидов, из которых по меньшей мере 10 нуклеотидов комплементарны целевой последовательности РНК. В качестве матрицы (или индуктора, индуцирующего фактора) репарации можно применять другие нуклеотиды. Спаривание оснований с целевой мРНК-последовательностью преимущественно осуществляется в клетке. Клетка может являться клеткой млекопитающего и может находиться в клеточной культуре (in vitro) или в организме (внутри тела) (in vivo).
Настоящее изобретение, предпочтительно, относится к способу лечения муковисцидоза, при этом генетическое нарушение, предпочтительно, представляет собой мутацию дельтаF508, а последовательность, подлежащая изменению, предпочтительно, представляет собой (пре)мРНК белка CFTR, содержащая (укрывающая) мутацию дельтаF508. Предмет и способы по настоящему изобретению, предпочтительно, применяются для репарации РНК пациентов с мутацией ΔF508 в белке трансмембранном регуляторе муковисцидоза (CFTR). Введение 5'-UUU-3' или 5'-CUU-3' вместо трех удаленных (делетированных) нуклеотидов дает исправленную РНК, которая восстанавливает отсутствующую аминокислоту фенилаланин (F или Phe) в белковой последовательности и, следовательно, приводит к образованию белка дикого типа.
РНК CFTR AF508 может быть восстановлена, например, посредством контактирования с и/или трансфекции клеток, предпочтительно, клеток млекопитающих, более предпочтительно, человеческих клеток, in vitro или in vivo, олигонуклеотидом по изобретению.
Предпочтительный олигонуклеотид по изобретению является комплементарным последовательности, имеющей идентичность по меньшей мере 75%, 80%, 85%, 90%, 95%, 99% или 100% нуклеотидам 16-30 и 34-48 последовательности SEQ ID NO: 6, а изменение в последовательности, предпочтительно, выбрано из 5'-UUU-3' и 5'-CUU-3', предпочтительно, 5'-CUU-3'. Более предпочтительный олигонуклеотид по изобретению представляет собой олигонуклеотид, содержащий или состоящий из SEQ ID NO: 1 или SEQ ID NO: 3, предпочтительно, SEQ ID NO: 1; или олигонуклеотид, содержащий или состоящий из укороченного варианта SEQ ID NO: 1 или SEQ ID NO: 3, предпочтительно, SEQ ID NO: 1. В таком укороченном варианте отсутствует (удалено) несколько нуклеотидов, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 нуклеотидов на 3' и/или 5' конце SEQ ID NO: 1 или SEQ ID NO: 3. Предпочтительный вариант олигонуклеотида по изобретению содержит нуклеотиды с 7 до 29 последовательности SEQ ID NO: 1 или SEQ ID NO: 3, предпочтительно, SEQ 15 ID NO: 1.
SEQ ID NO: 1; 5'-AUCAUAGGAAACACCAAAGAUGAUAUUUUCUUU-3' (CAPS нуклеотиды, предпочтительно, означают РНК, модифицированную группой 2'-O-Ме).
SEQ ID NO: 3; 5'-AUCAUAGGAAACACCAAAAAUGAUAUUUUCUUU-3' (CAPS нуклеотиды, предпочтительно, означают РНК, модифицированную группой 2'-O-Ме).
Другой предпочтительный олигонуклеотид по изобретению включает олигонуклеотид, содержащий олигонуклеотид или состоящий из олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 до SEQ ID NO: 24, или олигонуклеотид, содержащий укороченный вариант или состоящий из укороченного варианта олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 до SEQ ID NO: 24. В таком укороченном варианте отсутствует (удалено) несколько нуклеотидов, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 нуклеотидов на 3' и/или 5' конце последовательностей от SEQ ID NO: 16 до SEQ ID NO: 24. Такие олигонуклеотиды удобно применять для осуществления изменений в последовательности молекулы целевой РНК, например, посредством мутации сдвига рамки-инсерции 1 или 2 пар оснований в удаляемый кодон для фенилаланина (для иллюстрации), инсерции в рамке считывания нуклеозидного триплета, образующего кодон для фенилаланина в аминокислотном положении 508 белка CFTR, инсерции в рамке считывания нуклеозидного триплета, образующего кодон для лейцина в аминокислотном положении 508 или другом аминокислотном положении белка CFTR, или для вставки стоп-кодона в последовательность, кодирующую CFTR. Способ действия этих приведенных в качестве примера олигонуклеотидов с последовательностями SEQ ID NO: 16-24 показан на Фиг. 7b-8f.
Предпочтительно, в олигонуклеотиде по изобретению несколько, а именно, 1, 2, 3, 4, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов содержат модификацию, описанную выше, или комбинации модификаций, причем предпочтительными являются 2'-O-Ме-модифицированные нуклеотиды. Можно также добавлять к последовательностям другие описанные ранее признаки, повышающие устойчивость, такие как LNA (ЗНК)- или PNA (ПНК)-нуклеотиды или фосфоротиоатные связи между некоторыми или всеми нуклеотидами. Или же вместо РНК-нуклеотидов можно использовать ДНК-нуклеотиды. В одной антисмысловой молекуле могут комбинироваться все или некоторые описанные модификации.
Вышеописанные модификации могли бы усилить всасывание в эпителиальных клетках. Или же молекулу можно сделать короче посредством удаления нескольких, например, 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12 нуклеотидов на 3' и/или 5' конце для усиления всасывания в клетки.
Для применения in vivo олигонуклеотид по изобретению может быть заключен для доставки (введения) в липосому, полисому (полирибосому) или наночастицу или другую подходящую частицу, такую как вирусная частица. Или же в комбинации с носителями молекулы для репарации могут находится в комплексе с полиэтиленимином (ПЭИ, PEI) и/или полиэтиленгликолем (ПЭГ, PEG). Олигонуклеотиды по изобретению можно синтезировать внутри клетки, даже in vivo, например, заражая клетки вирусом или вирусоподобной частицей, кодирующей олигонуклеотид. Или же живые клетки можно трансфецировать - in vitro или in vivo - с помощью (вирусной) ДНК или плазмиды и т.п. После заражения (инфицирования) или трансфекции живой клетки олигонуклеотид по изобретению синтезируется внутри живой клетки посредством обычной транскрипции и/или репликации.
Таким образом, олигонуклеотид по изобретению можно доставлять, как таковой, непосредственно в клетку, ткань или орган многоклеточного организма. Олигонуклеотид по изобретению можно также вводить опосредованно любым подходящим способом, известным из уровня техники. Олигонуклеотид по изобретению можно доставлять, например, в клетку, ткань или орган многоклеточного организма в виде вектора или экспрессионного вектора, при этом вектор или экспрессионный вектор содержит молекулу нуклеиновой кислоты, кодирующую олигонуклеотид. Предпочтительно, экспрессионный вектор вводится в клетку, ткань или орган многоклеточного организма с применением носителя для доставки генов. Согласно одному варианту в изобретении предусматривается вирусный вектор, содержащий экспрессионную кассету (кассету экспрессии) или транскрипционную кассету, которая управляет экспрессией или транскрипцией олигонуклеотида по изобретению. Предпочтительным носителем для доставки является вирусный вектор, такой как аденоассоциированный вирусный вектор (AAV), или ретровирусный вектор, такой как лентивирусный вектор и т.п.
Один вариант изобретения относится к применению вектора, содержащего молекулу нуклеиновой кислоты по определению выше, причем этот вектор применим для генной терапии. Векторы, которые применимы для генной терапии, описаны в статьях Anderson 1998, Nature 392: 25-30; Walther and Stein, 2000, Drugs 60: 249-71; Kay et al, 2001, Nat. Med. 7: 33-40; Russell, 2000, J. Gen. Virol. 81: 2573-604; Amado and Chen, 1999, Science 285: 674-6; Federico, 1999, Curr. Opin. Biotechnol.10: 448-53; Vigna and Naldini, 2000, J. Gene Med. 2: 308-16; Marin et al, 1997, Mol. Med. Today 3: 396 - 15 403; Peng and Russell, 1999, Curr. Opin. Biotechnol. 10: 454-7; Sommerfelt, 1999, J. Gen. Virol. 80: 3049-64; Reiser, 2000, Gene Ther. 7: 910-3; и цитируемых в них ссылочных материалах.
Вектор, особенно подходящий для генной терапии, включает аденовирусный и аденоассоциированный вирусный (AAV) вектор. Эти векторы заражают большое число типов пролиферирующих и не пролиферирующих клеток. Помимо этого, аденовирусные векторы обладают способностью к высокоуровневой экспрессии трансгенов. Однако, ввиду эписом(аль)ного характера аденовирусных и AAV векторов после входа в клетку эти вирусные векторы лучше всего подходят для терапевтического применения, требующего только транзиторной экспрессии трансгена (Russell, 2000, J. Gen. Virol. 81: 2573-2604; Goncalves, 2005, Virol J. 2(1):43), указанной выше. Предпочтительные аденовирусные векторы модифицируют с целью уменьшить реакцию организма, обсуждаемую в обзоре Russell (2000, см. выше).
Предпочтительным ретровирусным вектором для применения по настоящему изобретению является экспрессионная конструкция на основе лентивируса. Лентивирусные векторы обладают уникальной способностью заражать не пролиферирующие клетки (Amado and Chen, 1999 Science 285: 674-6). Способы создания и применения экспрессионных конструкций на основе лентивируса описаны в патентах США №№6,165,782, 6,207,455, 6,218,181, 6,277,633 и 6,323,031 и в статьях Federico (1999, Curr Opin Biotechnol 10: 448-53) и Vigna et al. (2000, J Gene Med 2000; 2: 308-16).
Обычно векторы для генной терапии рассматриваются как экспрессионные векторы, описанные выше, в том смысле, что они содержат молекулу нуклеиновой кислоты, кодирующую экспрессирующийся олигонуклеотид по изобретению, при этом указанная молекула нуклеиновой кислоты функционально связана с соответствующими регуляторными последовательностями. Такая регуляторная последовательность содержит по меньшей мере промоторную последовательность. Подходящие промоторы для экспрессии нуклеотидной последовательности, кодирующие полипептид из векторов для генной терапии, включают, например, промежуточный промотор ранних генов цитомегаловируса (CMV), промоторы длинных концевых повторов (LTRs) вируса, например, такие как ранний промотор длинных концевых повторов вируса мышиного лейкоза Молони (MMLV), вируса саркомы Рауса или HTLV-1, вируса зеленой мартышки 40 (SV 40) и тимидинкиназный промотор вируса простого герпеса.
Многие лекарственные средства для введения в легкие можно вводить через дыхательные пути. Одно такое лекарственное средство могло бы содержать молекулу для РНК-репарации, например, олигонуклеотид по изобретению. Для доставки олигонуклеотида по изобретению в аэрозоле в эпителиальные клетки дыхательных путей, предпочтительно, применяют ингалятор. Или же можно применять композицию для ингаляции в сухом порошке. Применение одноцепочечных (однонитевых) олигонуклеотидов по изобретению в системе доставки в дыхательные пути уменьшает вероятность разрыва молекулы за счет усилия сдвига при введении.
При многих заболеваниях повышается вязкость слизистого слоя, что приводит к уменьшению всасывания лекарственных средств через легкие. Одним таким заболеванием является хронический бронхит, другим примером такого заболевания является муковисцидоз. Имеются различные формы нормализаторов слизи, такие как ДНКазы, гипертонический солевой раствор или маннит, который продается под названием Бронхитол/Bronchitol. Когда нормализаторы слизи применяются в комбинации с соединениями для репарации РНК, такими как олигонуклеотиды по изобретению, они могут повышать эффективность таких лекарственных средств. Следовательно, введение олигонуклеотида по изобретению субъекту, предпочтительно человеку, предпочтительно объединяется с нормализаторами слизи, предпочтительно с нормализаторами слизи, описанными в настоящей заявке. Помимо этого, введение олигонуклеотидов по изобретению можно комбинировать с введением малой молекулы для лечения CF, такого как усилители (действия), например Калидеко/Kalydeco (ивакафтор/ivacaftor; VX-770), корректирующие соединения, например VX-809 (лумакафтор/Lumacaftor) и/или VX-661.
С целью эффективной доставки молекул для РНК репарации в эпителиальные клетки, например, легкого или кишечника, в качестве альтернативы или в комбинации с нормализаторами слизи можно осуществлять доставку в слизь проникающих частиц или наночастиц. Соответственно, при введении олигонуклеотида по настоящему изобретению субъекту, предпочтительно, человеку, применяют, предпочтительно, доставку в слизь проникающих частиц или наночастиц.
Хронические и острые легочные инфекции часто обнаруживаются у пациентов с такими заболеваниями, как муковисцидоз. Лечение антибиотиками уменьшает бактериальные инфекции и ослабляет их симптомы, такие как повышение вязкости слизи и/или образование биопленки. Применение антибиотиков в комплексе с молекулами РНК-репарации могло бы повысить эффективность репарации РНК благодаря более легкому доступу молекул для репарации к клеткам-мишеням. Поэтому введение олигонуклеотида по изобретению субъекту, предпочтительно, человеку, предпочтительно, комбинируют с лечением антибиотиками для уменьшения бактериальных инфекций и ослабления их симптомов, таких как повышение вязкости слизи и/или образование биопленки. Антибиотики можно применять системно или локально, или и тем и другим способом.
Например, для применения у больных муковисцидозом олигонуклеотиды по изобретению, или упакованные олигонуклеотиды или находящиеся в комплексе олигонуклеотиды по изобретению можно комбинировать с нормализаторами слизи, такими как ДНКаза, маннит или гипертонический солевой раствор, и/или антибиотиками и/или малой молекулой для лечения CF, таким как усилители (действия), например, Калидеко (ивакафтор; VX-770), или корректирующими соединениями, например VX-809 (лумакафтор) и/или VX-661.
С целью облегчения доступа к клеткам-мишеням для промывания легких перед введением олигонуклеотидов по изобретению можно применять бронхоальвеолярный лаваж (BAL).
Для доставки олигонуклеотидов по изобретению к эпителиальным клеткам кишечника можно применять капсулу с замедленным высвобождением (англ. термин «time-release capcule»). Репарация CFTR в этих клетках могла бы повысить всасывание питательных веществ. Это лечение можно комбинировать с применением препаратов панкреатических ферментов биологического или синтетического происхождения, таких как Панкрелипаза или Креон/Creon, которые имеются в продаже и обычно применяются для того, чтобы способствовать пищеварению у CF пациентов.
Согласно всем вариантам настоящего изобретения олигонуклеотиды по изобретению могут находиться в композиции с гипертоническим солевым раствором, т.е. в композиции, содержащей олигонуклеотид по изобретению, а также содержащей 2%-9% солевого раствора, предпочтительно, 3%-8% солевого раствора, более предпочтительно, 4%-8% солевого раствора, более предпочтительно, 5%-8% солевого раствора, более предпочтительно, 6%-8% солевого раствора (например, 6.1%, 6.2%, 6.3%, 6.4%, 6.5%, 6.6%, 6.7%, 6.8%, 6.9%, 7.0%, 7.1%, 7.2%, 7.3%, 7.4%, 7.5%, 7.6%, 7.7%, 7.8%, 7.9% или 8.0%)), более предпочтительно, 6%-7% солевого раствора, еще более предпочтительно, около 7% солевого раствора, наиболее предпочтительно, 7% солевого раствора. Процентное содержание солевого раствора в данном контексте определяется как вес солевого раствора/общий объем композиции, т.е. 7% солевого раствора соответствует 70 граммам солевого раствора/литр композиции. Предпочтительно, гипертонической солевой раствор по существу представляет собой раствор NaCl.
Согласно некоторым вариантам настоящего изобретения олигонуклеотид и/или композицию по изобретению можно вводить любым способом, известным специалисту в данной области техники, включая, но без ограничения, введение в легкие, предпочтительно, через (верхние) дыхательные пути, и системное введение, предпочтительно, внутривенное, внутримышечное, интрадермальное или подкожное введение.
Специалист в данной области техники поймет, что описанные выше в данной заявке способы доставки, носители и комбинации для введения можно также комбинировать в способах и при применении согласно настоящему изобретению, например, олигонуклеотид по настоящему изобретению и/или композиция, содержащая такой олигонуклеотид, может находится в комплексе с соединением для доставки по настоящей заявке, может быть упакован(а) (заключена) в носитель для доставки по настоящей заявке и/или может быть упакован(а) в капсулу с замедленным высвобождением.
Предпочтительным способом доставки является доставка в форме вирусной частицы или последовательности вирусной нуклеиновой кислоты, кодирующей олигонуклеотид по изобретению, причем этот олигонуклеотид экспрессируется в результате инфицирования живой клетки вирусной частицей или трансфекции живой клетки при использовании вирусной нуклеиновой кислоты; предпочтительно, как описано ранее в настоящей заявке.
Доставку олигонуклеотида по настоящему изобретению можно осуществлять в легкое, предпочтительно, через (верхние) дыхательные пути, и/или в кишечник. Введение можно сочетать с введением нормализаторов слизи, предпочтительно описанных в настоящей заявке, и/или с лечением антибиотиками, предпочтительно, как описано в настоящей заявке, и/или можно комбинировать с введением препаратов панкреатических ферментов, предпочтительно, описанных в настоящей заявке, и/или можно сочетать с бронхоальвеолярным лаважем для облегчения доступа к клеткам-мишеням.
Специалист в данной области техники понимает, что можно объединять два или более олигонуклеотидов по изобретению. Специалист в данной области техники понимает, что когда в данном контексте говорится об олигонуклеотиде по настоящему изобретению, то в способах и применении по изобретению можно, предпочтительно, взаимозаменяемо, использовать композицию или фармацевтическую композицию по настоящему изобретению.
В одном аспекте настоящего изобретения предусматривается применение олигонуклеотида для введения изменений в последовательность молекулы целевой РНК, находящейся в живой клетке, включающее стадию предоставления олигонуклеотида в живую клетку в условиях, способствующих всасыванию живой клеткой указанного олигонуклеотида, причем указанный олигонуклеотид содержит последовательность, которая по меньшей мере частично комплементарна молекуле целевой РНК, так что в указанной живой клетке происходит гибридизация олигонуклеотида с целевой РНК, или ее предшественником, или ее матрицей, в результате этого в указанной живой клетке происходят биохимические процессы, вследствие которых различие между последовательностью олигонуклеотида и последовательностью целевой РНК копируется в молекуле РНК, либо непосредственно, либо с использованием ее предшественника или ее матрицы, что приводит к изменению последовательности указанной целевой РНК.
Согласно вариантам этого аспекта, олигонуклеотид, предпочтительно, представляет собой олигонуклеотид, описанный выше в настоящей заявке.
Согласно вариантам этого аспекта, олигонуклеотид, предпочтительно, представляет собой олигорибонуклеотид.
Согласно вариантам этого аспекта, олигонуклеотид, предпочтительно, предоставляется в живую клетку в виде одноцепочечного олигонуклеотида.
Согласно вариантам этого аспекта, живая клетка, предпочтительно, представляет собой часть многоклеточного организма.
Согласно вариантам этого аспекта, живая клетка, предпочтительно, представляет собой животную клетку, более предпочтительно, человеческую клетку.
Согласно вариантам этого аспекта, предпочтительно, изменение в последовательности указанной целевой РНК вызывает изменение фенотипа клетки.
Согласно вариантам этого аспекта, предпочтительно, изменение в указанной целевой РНК подтверждено посредством определения последовательности указанной целевой РНК, или ее предшественника или ее матрицы.
Согласно вариантам этого аспекта, предпочтительно, изменение в указанной целевой РНК подтверждено посредством определения последовательности полипептидного продукта или нуклеотидной последовательности, кодирующей указанный полипептид, кодируемый указанной целевой РНК.
Согласно вариантам этого аспекта, предпочтительно, изменение в указанной целевой РНК подтверждено посредством определения фенотипического изменения в указанной живой клетке или в указанном организме, содержащем указанную клетку.
Согласно вариантам этого аспекта, предпочтительно, изменение представляет собой уменьшение интенсивности нарушения, причинно связанного с последовательностью целевой РНК до введения изменения.
Согласно вариантам этого аспекта, предпочтительно, нарушение представляет собой генетическое нарушение.
Согласно вариантам этого аспекта, предпочтительно, протяженность олигонуклеотида по данному аспекту составляет 15-100 нуклеотидов. Более предпочтительно, протяженность олигонуклеотида составляет от 20 до 50, более предпочтительно, от 25 до 45 нуклеотидов, более предпочтительно, от 27 до 35 нуклеотидов.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид содержит инозин и/или содержит модифицированные нуклеотиды, включающие фрагменты, выбранные из группы, состоящей из 2'-O-алкилрибозы, 2'-фторрибозы, РМО (ФМО), 5-метил-dC, 2-амино-dA, С5-пиримидина, и/или содержит модифицированные межнуклеозидные связи, выбранные из группы, состоящей из фосфоротиоатных связей, метилфосфонатных связей.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид содержит РНК, ДНК, ПНК (PNA) и/или ЗНК (LNA).
Согласно вариантам этого аспекта, предпочтительно, все нуклеозиды в олигонуклеотиде представляют собой 2'-O алкилрибонуклеозиды, более предпочтительно, 2'-O метилрибонуклеозиды.
Согласно вариантам этого аспекта, предпочтительно, все нуклеозиды представляют собой рибонуклеозиды.
Согласно вариантам этого аспекта, предпочтительно, изменение последовательности целевой РНК включает инсерцию или замену одного или более нуклеозидов.
Согласно вариантам этого аспекта, предпочтительно, целевая РНК кодирует человеческий CFTR, и изменение приводит в результате к созданию или восстановлению нуклеозидного триплета, кодирующего фенилаланин в аминокислотном положении 508 белка CFTR.
Согласно вариантам этого аспекта, предпочтительно, изменение включает инсерцию нуклеозидного триплета, выбранного из группы, состоящей из 5'-UUU-3' и 5'-CUU-3'.
Согласно вариантам этого аспекта, предпочтительно, последовательность олигонуклеотида комплементарна последовательности, имеющей идентичность по меньшей мере 75%, 80%, 85%, 90%, 95% или 99% нуклеотидам 16-30 и 34-48 последовательности SEQ ID NO: 6, а изменение представляет собой инсерцию нуклеозидного триплета, выбранного из группы, состоящей из 5'-UUU-3' и 5'-CUU-3'.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид содержит нуклеотиды или состоит из нуклеотидов 7-29, предпочтительно, содержит нуклеотиды или состоит из нуклеотидов 1-33, последовательности SEQ ID NO: 1 или SEQ ID NO: 3, предпочтительно, SEQ ID NO: 1. Другие предпочтительные олигонуклеотиды включают олигонуклеотид, содержащий олигонуклеотид или состоящий из олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 до SEQ ID NO: 24, или олигонуклеотид, содержащий укороченный вариант олигонуклеотида или состоящий из укороченного варианта олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 to SEQ ID NO: 24. В таком укороченном варианте удалено несколько, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 нуклеотидов на 3' и/или 5' конце последовательностей от SEQ ID NO: 16 до SEQ ID NO: 24.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид предоставляется в виде олигонуклеотида, заключенного в носитель, предпочтительно, в липосому, полисому или наночастицу, и/или олигонуклеотид находится в комплексе с соединением для доставки, предпочтительно полиэтиленимином (PEI, ПЭИ), полиэтиленгликолем (PEG, ПЭГ), и/или он связан со стерином (стеролом), предпочтительно, с холестерином (холестеролом).
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид предоставляется в респираторный тракт или легкие, предпочтительно через дыхательные пути, в сухом составе или в аэрозоле, предпочтительно с помощью ингалятора, и предпочтительно олигонуклеотид предоставляется вместе с медиатором трансфекции и/или лекарственным средством для лечения муковисцидоза, известным специалисту в данной области техники, предпочтительно, ДНКазой, маннитом (предпочтительно, бронхитолом) и/или малой молекулой для лечения CF, предпочтительно, Калидеко (ивакафтором; VX-770), VX-809 (лумакафтором) и/или VX-661.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид предусматривается в гипертоническом солевом растворе, предпочтительно с концентрацией солевого раствора между 2%-9%, предпочтительно 3%-8%, более предпочтительно, 4%-8%, более предпочтительно, 5%-8%, более предпочтительно, 6%-8%, более предпочтительно, 6%-7%, еще более предпочтительно, с концентрацией солевого раствора 7%, причем гипертонический солевой раствор, предпочтительно, представляет собой физиологически и фармацевтически приемлемый раствор.
Согласно вариантам этого аспекта, предпочтительно, гипертонический солевой раствор представляет собой по существу раствор NaCl.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид вводят в частице, проникающей в слизь, предпочтительно в наночастице, проникающей в слизь.
Согласно вариантам этого аспекта, предпочтительно, введение олигонуклеотида комбинируют с лечением антибиотиками для уменьшения бактериальных инфекций и ослабления их симптомов, таких как увеличение вязкости слизи и/или образование биопленки.
Согласно вариантам этого аспекта, предпочтительно, перед введением олигонуклеотида по изобретению проводят бронхоальвеолярный лаваж (BAL).
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид вводят в капсуле с замедленным высвобождением с целью содействовать доставке в клетки кишечника.
Согласно вариантам этого аспекта, предпочтительно, введение олигонуклеотида комбинируют с введением композиции биологического или синтетического панкреатического фермента, такой как панкрелипаза или Креон.
В другом аспекте настоящего изобретения предусматривается олигонуклеотид для применения при лечении человеческого организма или организма животного, при этом указанный олигонуклеотид способен вводить изменение в последовательность молекулы целевой РНК в живой клетке указанного человеческого организма или организма животного, предоставляя олигонуклеотид в живую клетку в условиях, способствующих всасыванию живой клеткой указанного олигонуклеотида, причем указанный олигонуклеотид содержит последовательность, которая по меньшей мере частично комплементарна молекуле целевой РНК, так что в указанной живой клетке происходит гибридизация олигонуклеотида с целевой РНК, или ее предшественником, или ее матрицей, в результате этого в указанной живой клетке происходят биохимические процессы, вследствие которых различие между последовательностью олигонуклеотида и последовательностью целевой РНК копируется в молекуле РНК, либо непосредственно, либо с использованием ее предшественника или ее матрицы, что приводит к изменению последовательности указанной целевой РНК.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид представляет собой олигонуклеотид, описанный ранее в настоящей заявке.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид представляет собой олигорибонуклеотид.
Согласно вариантам этого аспекта, предпочтительно, изменение в последовательности целевой РНК вызывает изменение фенотипа клетки.
Согласно вариантам этого аспекта, предпочтительно, изменение в указанной целевой РНК подтверждено посредством определения последовательности указанной целевой РНК, или ее предшественника или ее матрицы.
Согласно вариантам этого аспекта, предпочтительно, изменение в указанной целевой РНК подтверждено посредством определения последовательности полипептидного продукта, кодируемого указанной целевой РНК.
Согласно вариантам этого аспекта, предпочтительно, изменение в указанной целевой РНК подтверждено посредством определения фенотипического изменения в указанной живой клетке или в указанном организме, содержащем указанную клетку.
Согласно вариантам этого аспекта, предпочтительно, фенотипическое изменение представляет собой уменьшение интенсивности нарушения, обусловленного последовательностью целевой РНК до введения изменения.
Согласно вариантам этого аспекта, предпочтительно, нарушение представляет собой генетическое нарушение.
Согласно вариантам этого аспекта, предпочтительно, протяженность олигонуклеотида по данному аспекту составляет 15-100 нуклеотидов.
Согласно вариантам этого аспекта, предпочтительно, протяженность олигонуклеотида составляет от 20 до 50, более предпочтительно, от 25 до 45 нуклеотидов, более предпочтительно, от 27 до 35 нуклеотидов.
Согласно вариантам этого аспекта, предпочтительно, олигорибонуклеотид содержит инозин и/или содержит модифицированные нуклеотиды, включающие фрагменты, выбранные из группы, состоящей из 2'-О-алкилрибозы, 2'-фторрибозы, РМО (ФМО), 5-метил-dC, 2-амино-dA, С5-пиримидина, и/или содержит модифицированные межнуклеозидные связи, выбранные из группы, состоящей из фосфоротиоатных связей, метилфосфонатных связей.
Согласно вариантам этого аспекта, предпочтительно, все нуклеозиды в олигонуклеотиде представляют собой 2'-O-алкилрибонуклеозиды, более предпочтительно, 2'-O-метилрибонуклеозиды.
Согласно вариантам этого аспекта, предпочтительно, все нуклеозиды представляют собой рибонуклеозиды.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид содержит РНК, ДНК, ПНК (PNA) и/или ЗНК (LNA).
Согласно всем вариантам изобретения олигонуклеотиды по изобретению, как правило, вводятся в дозах в интервале от 1 мкг до 1000 мг, более предпочтительно, от 10 мкг до 100 мг, еще более предпочтительно, от 100 мкг до 10 мг и, наиболее предпочтительно, от 500 мкг до 5 мг, в зависимости от клетки (ткани), подлежащей обработке (лечению), массы (веса) тела, способа и/или области введения (местное vs. системного), области введения (интраперитонеальное (внутрибрюшинное), внутримышечное, легочное и т.д.), нарушения, подлежащего лечению, применяемой схемы приема лекарств (разовое или повторное, болюсное или постоянное введение дозы) и т.п. Специалист в данной области техники может установить оптимальную дозу методом проб и ошибок.
Согласно вариантам этого аспекта, предпочтительно, изменение в последовательности молекулы целевой РНК включает инсерцию или замену одного или более нуклеозидов.
Согласно вариантам этого аспекта, предпочтительно, целевая РНК кодирует человеческий белок CFTR, а изменение приводит к образованию или восстановлению нуклеозидного триплета, кодирующего фенилаланин в аминокислотном положении 508 белка CFTR.
Согласно вариантам этого аспекта, предпочтительно, изменение включает инсерцию нуклеозидного триплета, выбранного из группы, состоящей из 5'-UUU-3' и 5'-CUU-3'.
Согласно вариантам этого аспекта, предпочтительно, последовательность олигонуклеотида комплементарна последовательности, имеющей идентичность по меньшей мере 75%, 80%, 85%, 90%, 95% или 99% нуклеотидам 16-30 и 34-48 последовательности SEQ ID NO: 6, а изменение представляет собой инсерцию нуклеозидного триплета, выбранного из группы, состоящей из 5'-UUU-3' и 5'-CUU-3'.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид содержит нуклеотиды или состоит из нуклеотидов 7-29, предпочтительно, содержит нуклеотиды или состоит из нуклеотидов 1-33, последовательности SEQ ID NO: 1 или SEQ ID NO: 3, предпочтительно, SEQ ID NO: 1. Другой предпочтительный олигонуклеотид включает олигонуклеотид, содержащий олигонуклеотид или состоящий из олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 до SEQ ID NO: 24, или олигонуклеотид, содержащий укороченный вариант олигонуклеотида или состоящий из укороченного варианта олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 to SEQ ID NO: 24. В таком укороченном варианте удалено несколько, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 нуклеотидов на 3' и/или 5' конце последовательностей от SEQ ID NO: 16 до SEQ ID NO: 24.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид предоставляется в носителе, предпочтительно в липосоме, полисоме или наночастице, и/или олигонуклеотид находится в комплексе с соединением для доставки, предпочтительно, полиэтиленимином (PEI, ПЭИ), полиэтиленгликолем (PEG, ПЭГ), и/или он связан со стеролом, предпочтительно с холестеролом.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид предоставляется в нижние дыхательные пути или легкие, предпочтительно, через верхние дыхательные пути, в сухом составе или в аэрозоле, предпочтительно с помощью ингалятора, и, предпочтительно, олигонуклеотид предоставляется вместе с медиатором трансфекции и/или лекарственным средством для лечения муковисцидоза, известным специалисту в данной области техники, предпочтительно, ДНКазой, маннитом (предпочтительно, бронхитолом) и/или малой молекулой для лечения CF, предпочтительно, Калидеко (ивакафтором; VX-770), VX-809 (лумакафтором) и/или VX-661.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид предоставляется в гипертоническом солевом растворе, предпочтительно с концентрацией солевого раствора между 2%-9%, предпочтительно 3%-8%, более предпочтительно, 4%-8%, более предпочтительно, 5%-8%, более предпочтительно, 6%-8%, более предпочтительно, 6%-7%, еще более предпочтительно, с концентрацией солевого раствора 7%, причем гипертонический солевой раствор, предпочтительно, представляет собой физиологически и фармацевтически приемлемый раствор.
Согласно вариантам этого аспекта, предпочтительно, гипертонический солевой раствор представляет собой по существу раствор NaCl.
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид вводят в частице, проникающей в слизь, предпочтительно в наночастице, проникающей в слизь.
Согласно вариантам этого аспекта, предпочтительно, введение олигонуклеотида комбинируют с лечением антибиотиками для уменьшения бактериальных инфекций и ослабления их симптомов, таких как увеличение вязкости слизи и/или образование биопленки.
Согласно вариантам этого аспекта, предпочтительно, перед введением олигонуклеотида по изобретению проводят бронхоальвеолярный лаваж (BAL).
Согласно вариантам этого аспекта, предпочтительно, олигонуклеотид вводят в капсуле с замедленным высвобождением с целью содействовать доставке в клетки кишечника.
Согласно вариантам этого аспекта, предпочтительно, введение олигонуклеотида комбинируют с введением композиции биологического или синтетического панкреатического фермента, такой как Панкрелипаза или Креон.
В другом аспекте настоящего изобретения предусматривается фармацевтическая композиция, содержащая олигонуклеотид по определению в предыдущем аспекте настоящего изобретения, фармацевтически приемлемый носитель и/или гипертонический физиологически и фармацевтически приемлемый солевой раствор, предпочтительно, с концентрацией солевого раствора между 2%-9%, предпочтительно 3%-8%, более предпочтительно, 4%-8%, более предпочтительно, 5%-8%, более предпочтительно, 6%-8%, более предпочтительно, 6%-7%, еще более предпочтительно, с концентрацией солевого раствора 7%.
Согласно вариантам этого аспекта, предпочтительно, гипертонический солевой раствор представляет собой по существу раствор NaCl.
Согласно вариантам этого аспекта, предпочтительно, фармацевтическая композиция содержит также медиатор трансфекции.
Согласно вариантам этого аспекта, предпочтительно, фармацевтическая композиция содержит лекарственное средство против муковисцидоза, известное специалистам в данной области техники, предпочтительно, ДНКазу, маннит и/или малую молекулу для лечения CF, предпочтительно, Калидеко (ивакафтор; VX-770), VX-809 (лумакафтор) и/или VX-661.
В другом аспекте настоящего изобретения предусматривается олигонуклеотид по изобретению по определению в различных аспектах и вариантах данной заявки и/или фармацевтическая композиция, содержащая такой олигонуклеотид. Предпочтительно, такой олигонуклеотид или такая композиция по изобретению представляет собой одноцепочечный олигорибонуклеотид или фармацевтическую композицию, содержащую одноцепочечный олигорибонуклеотид, комплементарный последовательности, имеющей идентичность по меньшей мере 75%, 80%, 85%, 90%, 95% или 99% нуклеотидам 16-30 и 34-48 последовательности SEQ ID NO: 6. Более предпочтительно, такой олигонуклеотид или такая композиция по изобретению представляет собой одноцепочечный олигорибонуклеотид, или фармацевтическую композицию, содержащую одноцепочечный олигорибонуклеотид, который содержит нуклеотиды 7-29, предпочтительно, содержит нуклеотиды или состоит из нуклеотидов 1-33, последовательности SEQ ID NO: 1 или SEQ ID NO: 3, предпочтительно, SEQ ID NO: 1. Другой предпочтительный олигонуклеотид включает олигонуклеотид, содержащий олигонуклеотид или состоящий из олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 до SEQ ID NO: 24, или олигонуклеотид, содержащий укороченный вариант олигонуклеотида или состоящий из укороченного варианта олигонуклеотида с последовательностью, выбранной из группы от SEQ ID NO: 16 до SEQ ID NO: 24. В таком укороченном варианте удалено несколько, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 нуклеотидов на 3' и/или 5' конце последовательностей от SEQ ID NO: 16 до SEQ ID NO: 24.
Согласно всем вариантам настоящего изобретения можно применять эксципиент, который (также) содействует повышению стабильности, растворимости, всасывания (поглощения), активности, улучшению фармакокинетических и фармакодинамических свойств и доставке олигонуклеотида по изобретению в клетку, в частности, эксципиенты, способные образовывать комплексы, везикулы, наночастицы, микрочастицы, нанотрубки, наногели, гидрогели, полоксамеры или плюроники, полимерсомы, коллоидные частицы, микропузырьки, мицеллы, липоплексы и/или липосомы, которые доставляют соединение, вещества и/или олигонуклеотид(ы), образующие комплексы с везикулами или липосомами или заключенные в везикулы или липосомы, через клеточную мембрану. Примеры наночастиц включают наночастицы золота, магнитные наночастицы, наночастицы оксида кремния, липидные наночастицы, углеводные частицы (частицы сахаров), белковые наночастицы и пептидные наночастицы. Другую группу наночастиц составляют полимерные наночастицы. Многие из этих полимерных веществ известны из уровня техники. Соответствующие вещества включают, например, полиэтиленимин (PEI, ПЭИ), ExGen 500, полипропиленимин (PPI), поли(2-гидроксипропиленимин) (рНР), производные декстрана (например, поликатионы, такие как диэтиламиноэтил-(DEAE)-декстран, который также известен как трансфекционный реагент для трансфекции ДНК, который может объединяться с бутилцианоакрилатом (РВСА) и гексилцианоакрилатом (РНСА) для приготовления карионных наночастиц, которые могут доставлять указанное соединение через клеточные мембраны в клетки), бутилцианоакрилат (РВСА), гексилцианоакрилат (РНСА), сополимер молочной и гликолевой кислот (PLGA), полиамины (например, спермин, спермидин, путресцин, кадаверин), хитозан, полиамидоамины (РАМАМ), полиэфирамин, поливиниловый эфир, поливинилпирролидон (PVP), полиэтиленгликоль (PEG, ПЭГ), циклодекстрины, гиалуроновую кислоту, коломиновую кислоту и их производные, дендримеры (например, полиамидоамин), липиды {например, 1,2-диолеил-3-диметиламмонийпропан (DODAP), диолеилдиметиламмония хлорид (DODAC), производные фосфатидилхолина [например, 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC)], производные лизофосфатидилхолдина [например, 1-стеароил-2-лизо-sn-глицеро-3-фосфохолин (S-LysoPC)], сфингомиелин, 2-{3-[бис-(3-аминопропил)-амино]-пропиламино}-N-дитетрадецил-карбамоил метилацетамид (RPR209120), производные фосфоглицерина [например, 1,2-дипальмитоил-sn-глицеро-3-фосфоглицерина натриевую соль (DPPG-Na), производные фосфатидной кислоты [1,2-дистеароил-sn-глицеро-3-фосфатидной кислоты натриевую соль (DSPA), производные фосфатидилэтаноламина [например, диолеил-J-R-фосфатидилэтаноламин (DOPE), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), 2-дифитаноил-sn-глицеро-3-фосфоэтаноламин (DPhyPE)], N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмоний (DOTAP), 1,3-диолеилокси-2-(6-карбоксиспермил)-пропиламид (DOSPER), (1,2-димиристилоксипропил-3-диметилгидроксиэтиламмоний (DMRIE), (N1-холестерилоксикарбонил)-3,7-диазанонан-1,9-диамин (CD AN), диметилдиоктадециламмония бромид (DDAB), 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолин (РОРС), (b-L-Аргинил-2,3-L-диаминопропионовой кислоты-N-пальмитил-N-олеиламида тригидрохлорид (AtuFECTOl), производные N,N-диметил-3-аминопропана [например, 1,2-дистеароилокси-N,N-диметил-3-аминопропан (DSDMA), 1,2-диолеилокси-N,N-диметил-3-аминопропан (DoDMA), 2,2-дилинолеил-N,N-диметил-3-аминопропан (DLinDMA), 2,2-дилинолеил-4-диметиламинометил [1,3]-диоксолан (DLin-K-DMA), производные фосфатидилсерина [1,2-диолеил-sn-глицеро-3-фосфо-L-серина натриевую соль (DOPS)], холестерин, синтетические амфифильные вещества (SAINT-18), липофектин, белки (например, альбумин, желатины, ателоколаген) пептиды (например, PepFects, NickFects, полиаргинин, полилизин, CADY, MPG), их комбинации и/или вирусные капсидные белки, обладающие способностью к самосборке в частицы, которые могут доставлять указанное соединение или олигонуклеотид в клетку. Липофектин является примером липосомного трансфекционного агента. Он состоит по меньшей мере из двух липидных компонентов, катионного липида N-[1-(2,3-диолеилокси)пропил]-N,N,N-триэтиламмония хлорида (DOTMA) (ср. с DOTAP, который является солью метансульфокислоты) и нейтрального липида диолеилфосфатидилэтаноламина (DOPE). Нейтральный компонент опосредует внутриклеточное высвобождение. В дополнение к этим материалам наночастиц, в качестве альтернативы, катионный пептид протамин дает возможность готовить препараты олигонуклеотидов в виде коллоидных систем. Эта коллоидная система из наночастиц может образовывать так называемые "proticles", которые можно получать простым методом самосборки для того, чтобы упаковать и опосредовать высвобождение соединения по настоящему изобретению внутри клетки. Специалист в данной области техники может выбрать и адаптировать любые из вышеприведенных или других имеющихся или не имеющихся в продаже альтернативных эксципиентов и систем доставки.
В настоящем изобретении предусматривается также способ предупреждения или лечения заболевания, связанного с (генетическим) нарушением или связанного с (генетической) мутацией у субъекта, включающий введение олигонуклеотида по изобретению или композиции по изобретению субъекту, предпочтительно, человеку.
(Генетическое) нарушение, (генетическая) мутация, олигонуклеотид, композиция и введение, предпочтительно, представляют собой такие нарушения, мутацию, олигонуклеотид, композицию и введение, которые описаны ранее в данной заявке.
В описании изобретения слово "генетическое(ая)" написано в скобках, чтобы показать, что мутации в молекуле целевой РНК не обязательно являются результатом генетического кодирования. Они могут появляться в результате (некорректного) "кодирования" РНК, аберрантного пред-РНК сплайсинга или процессинга, или действия любого другого (неизвестного) механизма.
В данном документе и в Формуле изобретения глагол "содержать", и его формы, образованные при спряжении, применяется как открытый, не ограничительный глагол и означает, что объекты, указанные после этого слова, включены, но объекты, конкретно не указанные, не исключены. Кроме того, ссылка на элемент в единственном числе не исключает возможности того, что имеется более одного элемента, если из контекста точно не следует, что имеется один и только один элемент. Таким образом, элемент в единственном числе (при отсутствии четкого утверждения, что имеется один и только один элемент) означает "по меньшей мере один". Слова "около" или "примерно", применяемые вместе с численной величиной (например, около 10), предпочтительно, означают, что эта величина может представлять собой данную величину (например, 10) плюс или минус 0.1% от этой величины.
Сведения о последовательности, предусматриваемые в данной заявке, не должны быть настолько узкоспецифическими, чтобы потребовалось включение ошибочно определенных нуклеотидов. Специалист в данной области способен идентифицировать такие ошибочно определенные нуклеотиды и знает, как исправить такие ошибки. В случае ошибок предпочтение должно отдаваться последовательностям геномной ДНК, мРНК и полинуклеотида белка трансмембранного регулятора муковисцидоза (CFTR).
Все цитируемые в настоящем изобретении патенты и ссылочные материалы тем самым вводятся в данное изобретение в качестве отсылки во всей полноте.
Настоящее изобретение далее описывается с помощью приведенных ниже примеров, которые не следует рассматривать как ограничивающие объем изобретения.
Если не указано иначе, в случае применения данного изобретения на практике применяются обычные методы молекулярной биологии, микробиологии и/или биохимии. Такие методы описаны в книгах: Sambrook et al. (1989) Molecular Cloning, A Laboratory Manual (2nd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press; в Sambrook and Russell (2001) Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, NY; в Volumes 1 and 2 Ausubel et al. (1994) Current Protocols in Molecular Biology, Current Protocols, USA; и в Volumes I и II Brown (1998) Molecular Biology LabFax, Second Edition, Academic Press (UK); Oligonucleotide Synthesis (N. Gait editor); Nucleic Acid 30 Hybridization (Hames and Higgins, eds.).
Пример 1
In vivo оценка QR-010
Фенотип при муковисцидозе (CF, кистозном фиброзе) обусловлен отсутствием функционального CFTR белка, приводящим к снижению оттока ионов хлорида. CFTR также является негативным регулятором натриевого канала ENaC. Отсутствие CFTR стимулирует ENaC, что приводит к повышенному всасыванию (гиперабсорбции) ионов натрия, дополнительно нарушая осмотический баланс и ухудшая CF фенотип. Репарация CFTR повышает транспорт ионов хлорида и дополнительно приводит к снижению повышенного всасывания ионов натрия.
Эффективность агента в отношении CFTR можно количественно определять, определяя разности назальных потенциалов (NPD) на мышиной модели муковисцидоза (Leal et al, 2006, Lab animals 40: 43-52). Измерение значений NPD является способом измерения тока для стимуляции назального эпителия животных и человека. В данном контексте по кривой (следам, отпечаткам), образованной в процессе измерения, определяли транспорт (ионов) натрия, рассчитывая разность между начальным током и током после добавления блокатора ENaC. Для определения активности CFTR определяли разность показаний до и после нанесения буфера с отрицательным ионом (анионом) хлора (хлоридом-минус) и/или форсколина.
Снижение потенциала указывает на эффективность лечения вследствие снижения ENaC гиперактивности, наблюдаемой при CF. Натрий переносится с помощью ENaC, который регулируется посредством CFTR. Вследствие отсутствия функционального CFTR при CF не происходит понижающей регуляции ENaC, что приводит к повышенному всасыванию (гиперабсорбции) ионов натрия, а это, в свою очередь, ухудшает CF фенотип.
Повышение потенциала в результате стимулирования форсколином также указывает на эффективность лечения. Как правило, у CF мышей не наблюдался ни CFTR отклик на хлорид-минус ион, ни CFTR отклик, стимулированный форсколином; если после лечения можно было наблюдать статистически значимое изменение (поправку) стимулируемого форсколином CFTR отклика, этот результат являлся показателем эффективного лечения.
Коротко говоря, восемь мышей CF-dF508 лечили с помощью QR-010 от компании ProQR Therapeutics (олигонуклеотида с последовательностью, показанной в SEQ ID NO: 1). Мышам многократно вводили интраназально 40 мкг QR-010, растворенного в 2 мкл воды. Перед лечением в день 0 у мышей проводили измерение NPD, олигонуклеотид вводили на 2, 4 и 7 день и после лечения измеряли NPD на 9 день. Затем трем мышам вводили дозы лекарства на 10, 13 и 15 день и проводили измерение на 17 день.
Измерения NPD проводили по методике, описанной в статье Leal et al, 2006, Lab animals 40: 43-52, с некоторыми модификациями и используя высокоимпендансный (>1.0 Е+12 Q) вольтметр (Knick Portamesss 913, Elektronische Mebgerate, Berlin, Germany) с памятью данных. Коротко говоря, мышей клали на спину на нагревательный столик (грелку), а лапы и хвост освобождали. Внутривенный катетер с крыльями (0.719 мм, Insyte-Wt, Becton Dickinson, UT, USA) заполняли разбавленной электродной пастой (Signa [Parker Labs, Fairfield, NJ, USA] паста/KCl 1 моль/л 1:1 об/об) и вводили подкожно в заднюю лапу, служащую в качестве моста для соединения с эталонным Ag/AgCl электродом (SLE Instruments, South Croydon, UK). Двухпросветный катетер (внешний диаметр [OD] 0.3 мм) помещали в носовой проход, причем один просвет применяли для перфузии изотонических буферных солевых растворов, а другой служил в качестве измерительного электрода. Его сопротивление было <1.0 Е+6 Q. Язык животного отводили в сторону, а заостренный кончик фильтровальной бумаги помещали в рот примерно на 1 см ближе к горлу, чтобы впитывать избыток жидкости из ротовой полости. Избыточную жидкость, вытекающую из перфузированной ноздри, промокали фильтровальной бумагой, помещенной на кончик носа, таким образом в другую ноздрю раствор не попадал. Обычно в течение 5 минут после введения лекарств нагревательный столик осторожно наклоняли под углом примерно 30 градусов, при этом голова животного была направлена вниз, и с помощью перистальтического насоса (PI, Amersham Biosciences, Roosendaal, The Netherlands) начинали назальную перфузию со скоростью 15 мл/мин. Перед началом перфузии измеряли базовое значение назальной PD до момента получения устойчивого значения. Растворы меняли только после стабилизации напряжения. Базовый изотонический солевой раствор состоял из (ммоли/л): Na+ 140, Cl- 120, К+ 5.2, НСО3- 25, HPO42- 2.4, H2PO4- 0.4, Са2+ 1.2 и Mg2+ 1.2. Не содержащий хлорид-иона раствор для определения оттока (иона) хлорида из назального эпителия готовили, заменяя NaCl и CaCl2 на эквимолярное количество глюконата, a MgCl2 на MgSO4. Осмолярность составляла was 275 мОсм/л и рН 7.4. Начальное значение NPD определяется главным образом током (ионов) натрия, генерируемым с помощью ENaC. Этот канал блокировали амилоридом, чтобы снизить потенциал до нуля. Добавляли буфер, не содержащий хлорид-иона, для измерения хлорид-иона, транспортируемого CFTR, а для активации CFTR применяли форсколин. В конце эксперимента вводили фиксированную дозу налоксона (4 мг), конкурентного антагониста морфина (опиоидных препаратов), и атипамезол, медетомидин-специфический антидот (5-кратная доза медетомидина), и животное оставляли в темной комнате на нагревательном столике до полного восстановления нормального состояния, которое обычно наступало через 3-4 часа.
Результаты измерений NPD показаны на фиг. 5 и 6.
На Фиг. 5 четко показано, что перенос (транспорт) иона натрия у CF мышей меняется в результате лечения олигонуклеотидом QR-010 (р=0.0002; n=8), сдвигаясь к уровням дикого типа. Эти результаты являются конкретным свидетельством того, что активность CFTR восстанавливается после лечения с помощью QR-010.
На Фиг. 6 четко показано, что стимулируемый форсколином CFTR отклик повышается после 3 доз QR-010 (р=0.019; n=8), с дальнейшим повышением после 6 доз QR-010 (р=0.11, n=3). Как правило, у CF мышей отсутствует стимулируемый форсколином CFTR отклик; однако, после лечения наблюдалась коррекция стимулируемого форсколином CFTR отклика. Этот результат является конкретным свидетельством того, что активность CFTR восстанавливается после лечения с помощью QR-010.
В целом данный эксперимент четко демонстрирует, что олигонуклеотид по настоящему изобретению, такой как QR-010, позволяет эффективно исправлять генные дефекты.
Пример 2
Активность олигонуклеотидов, показанных в SEQ ID NO: 51. 56. 61 и 66, при восстановлении последовательности РНК, кодирующей CFTR дикого типа.
Олигонуклеотиды, показанные в SEQ ID NO: 51, 56, 61 и 66, проверяли на их активность при восстановлении последовательности РНК, кодирующей CFTR дикого типа в первичных клетках легочного эпителия, полученных от пациентов, несущих целевую мутацию по меньшей мере в одном аллеле. Клетки культивировали методами, известными специалисту в данной области техники, в подходящей среде. Олигонуклеотиды по изобретению вводили в клетки с помощью трансфекции. Трансфекцию осуществляли методами, известными специалисту в данной области техники, при использовании трансфекционного реагента липофектамина, с концентрациями в интервале от 1 до 500 нМ. К клеткам в соответствующей среде добавляли комплекс олигонуклеотид-трансфекционный реагент и после инкубации в течение 24 часов отмывали от клеток.
Активность олигонуклеотидов при восстановлении (исправлении) последовательности РНК, кодирующей CFTR дикого типа, определяли после 1-4 дней культивирования клеток после трансфекции. Клетки собирали и активность олигонуклеотидов оценивали на молекулярном уровне, применяя РНК репарацию в качестве первичного (исходного) показания. Репарацию РНК определяли методами секвенирования и/или количественной ПЦР (Q-PCR). РНК очищали от клеток методом, известным специалисту в данной области техники. Затем часть CFTR РНК, в которой находится мутация, амплифицировали методом ПЦР с обратной транскрипцией (RT-PCR). Продукты RT-PCR секвенировали с целью определить, что мутация исправлена, как показано на Фиг. 9a-d.
Описание чертежей
Фиг. 1 - частичные последовательности дикого типа (WT) и AF508 (Mut) CFTR РНК, прилегающие к сайту делеции. Три нуклеотида, удаленные в мутантной последовательности, показаны жирным шрифтом в последовательности WT.
Фиг. 2 - схематическое изображение РНК-редактирования мутантной AF508 CFTR РНК с использованием олигонуклеотида с SEQ ID NO: 1. Молекула восстановленной (в результате репарации) РНК (RS) содержит инсерцию 3 нуклеотидов, делающую последовательность РНК идентичной дикого типа CFTR РНК.
Фиг. 3 - частичные последовательности РНК и белка дикого типа, мутантные и исправленные (восстановленные) молекулы. В мутантной последовательности белка отсутствует фенилаланин в положении 508. Результатом репарации РНК является инсерция фенилаланина, образуется последовательность белка дикого типа.
Фиг. 4 - активность одноцепочечного олигонуклеотида в клеточных культурах, экспрессирующих эндогенный AF508 мутантный CFTR. Сравниваются одноцепочечный олигонуклеотид и описанный ранее дуплексный олигонуклеотид. Активность измеряют, определяя активность CFTR в регуляции транспорта хлорид-ионов.
Фиг. 5 - активность ENaC, показанная как потенциал (мВ) для мыши дикого типа (WT), CF мыши (CF) и CF мыши, пролеченной олигонуклеотидом QR-010 (CF-пролеченная). ** Р<0.01; ns = незначимое. Столбцы показаны со стандартной ошибкой среднего (SEM); значения р получали с помощью двухвыборочного критерия для независимых выборок.
Фиг. 6 - стимулируемый форсколином CFTR отклик, показанный как относительное содержание в процентах для мыши дикого типа (Wild type), непролеченной CF мыши (CF), CF мыши, пролеченной 3 дозами QR-010 (CF 3D), и CF мыши, пролеченной 6 дозами QR-010 (CF 6D). Результаты для мыши дикого типа взяты за 100%.
Фиг. 7a - изображена репарация CFTR дельта F508 мутации в целевой РНК с помощью олигонуклеотида 010g (SEQ ID NO: 1); показана часть РНК, прилегающая к сайту делеции. Инсерция тринуклеозида CUU, приводящая в результате к появлению фенилаланина (F) в положении 508 (UUU), показана жирным шрифтом.
Фиг. 7b - показана инсерция двух нуклеозидов в положение 508 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 16; показана часть РНК, прилегающая к сайту делеции. Показана инсерция двух нуклеозидов CU в положение 508, вызывающая сдвиг рамки в кодирующей последовательности.
Фиг. 7c - показана инсерция одного нуклеозида в положение 508 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 17; показана часть РНК, прилегающая к сайту делеции. Показана инсерция нуклеозида С в положение 508, вызывающая сдвиг рамки в кодирующей последовательности, в конечном счете образуя стоп-кодон в положении 512.
Фиг. 7d - показана инсерция одного нуклеозида в положение 508 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 18; показана часть РНК, прилегающая к сайту делеции. Показана инсерция нуклеозида С в положение 508, вызывающая сдвиг рамки в кодирующей последовательности, в конечном счете образуя стоп-кодон в положении 512.
Фиг. 8 - показаны различные инсерции в положение 508 в целевой WT CFTR РНК.
Фиг. 8a - показана инсерция стоп-кодона в положение 508 (ATCATCTGATTTGGTGTT; SEQ ID NO: 33) целевой WT CFTR РНК с помощью олигонуклеотида с последовательностью SEQ ID NO: 19; показана часть РНК, прилегающая к положению 508. Инсерция стоп-кодона вызывает прекращение трансляции после I 507.
Фиг. 8b - показана инсерция двух нуклеозидов в положение 508 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 20; показана часть РНК, прилегающая к положению 508. Показана инсерция двух нуклеозидов GA в положение 508, вызывающая сдвиг рамки в кодирующей последовательности.
Фиг. 8c - показана инсерция одного нуклеозида в положение 508 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 21; показана часть РНК, прилегающая к положению 508. Показана инсерция нуклеозида А в положение 508, вызывающая сдвиг рамки в кодирующей последовательности, в конечном счете создавая стоп-кодон в положении 513.
Фиг. 8d - показана инсерция ко дона лейцина (ATCATCCTCTTTGGTGTT; SEQ ID NO: 40) в положение 508 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 22; показана часть РНК, прилегающая к положению 508. Показана инсерция кодона лейцина и полученный в результате полипептид.
Фиг. 8e - показана инсерция стоп-кодона посередине в экзоне 10 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 23; показана часть РНК, прилегающая к положению 508. Инсерция стоп-кодона вызывает прекращение трансляции после аминокислоты в положении F 494.
Фиг. 8f - показано введение кодона лейцина (CUU) в экзон 10 целевой РНК дельта F508 CFTR с помощью олигонуклеотида с последовательностью SEQ ID NO: 24. Показано введение кодона лейцина и полученный в результате полипептид.
Фиг. 9a - показано исправление CFTR R117H мутации в целевой РНК с помощью CFTR-R117 олигонуклеотида (SEQ ID NO: 51); показана часть РНК, прилегающая к сайту мутации. Замена "А" на "G" трансформирует САС кодон (His) в CGC кодон (Arg) и показана жирным шрифтом.
Фиг. 9b - показано исправление мутации CFTR G542X в целевой РНК с помощью CFTR-G542 олигонуклеотида (SEQ ID NO: 56); показана часть РНК, прилегающая к сайту мутации. Замена "U" на "G" трансформирует кодон UGA (Стоп-кодон) в кодон GGA (Gly) и показана жирным шрифтом.
Фиг. 9c - показано исправление мутации CFTR W1282X в целевой РНК с помощью CFTR-W1282 олигонуклеотида (SEQ ID NO: 61); показана часть РНК, прилегающая к сайту мутации. Замена "А" на "G" трансформирует кодон UGA (Стоп-кодон) в кодон UGG (Тгур) и показана жирным шрифтом.
Фиг. 9d - показано исправление мутации CFTR N1303K в целевой РНК с помощью CFTR-N1303 олигонуклеотида (SEQ ID NO: 66); показана часть РНК, прилегающая к сайту мутации. Замена "G" на "С" трансформирует кодон AAG (Lys) в кодон AAC (Asn) и показана жирным шрифтом.















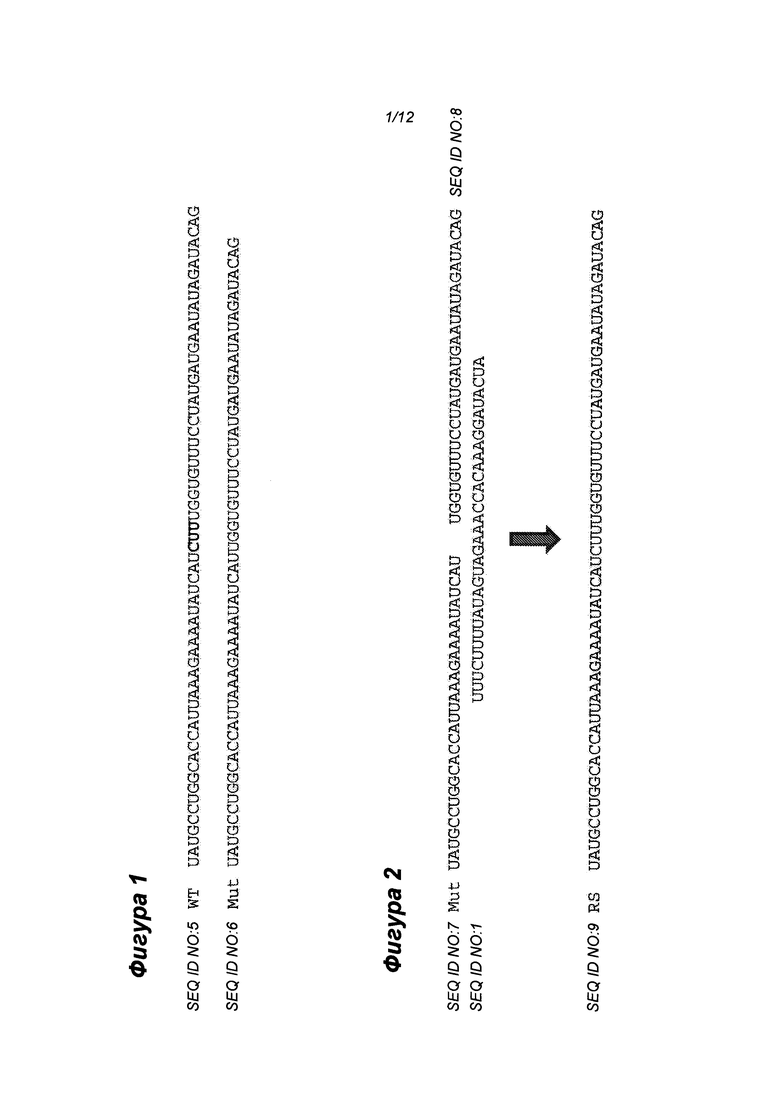
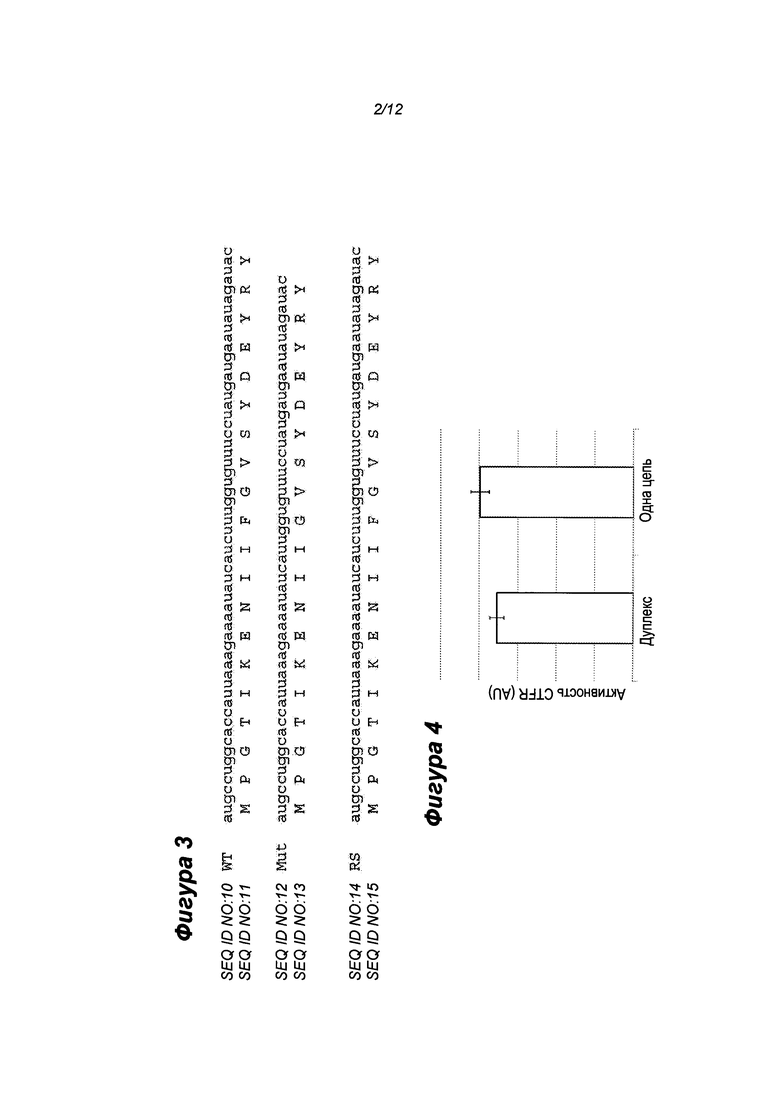
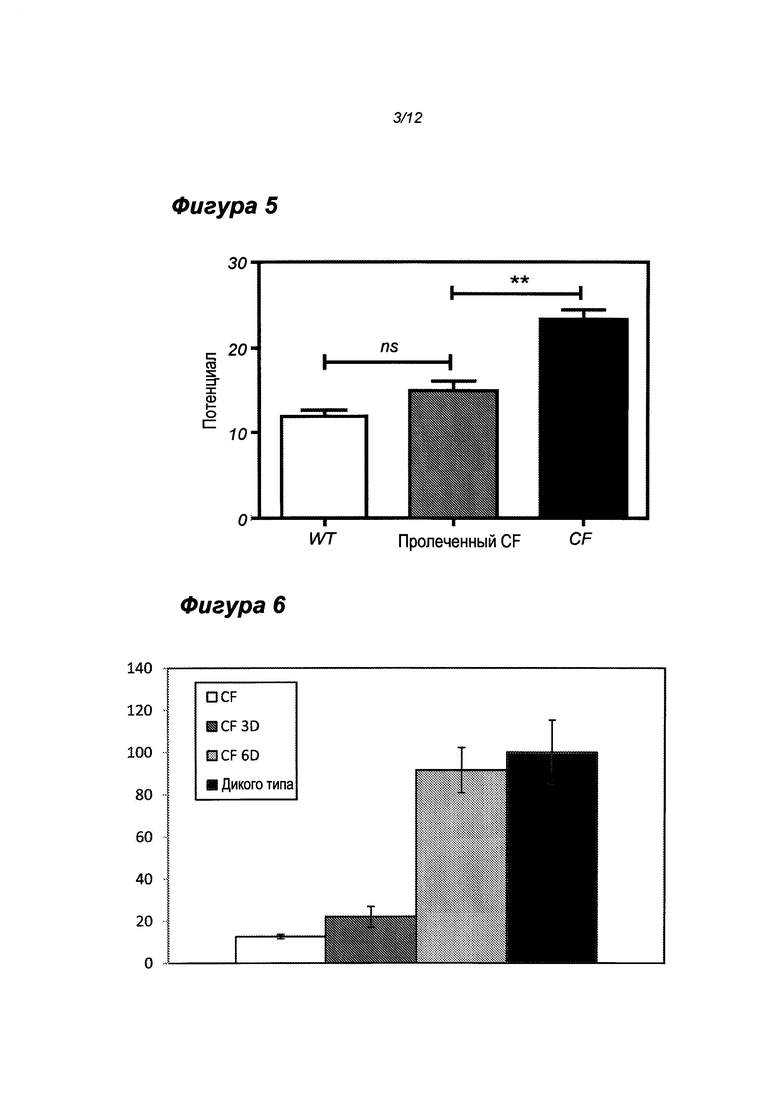






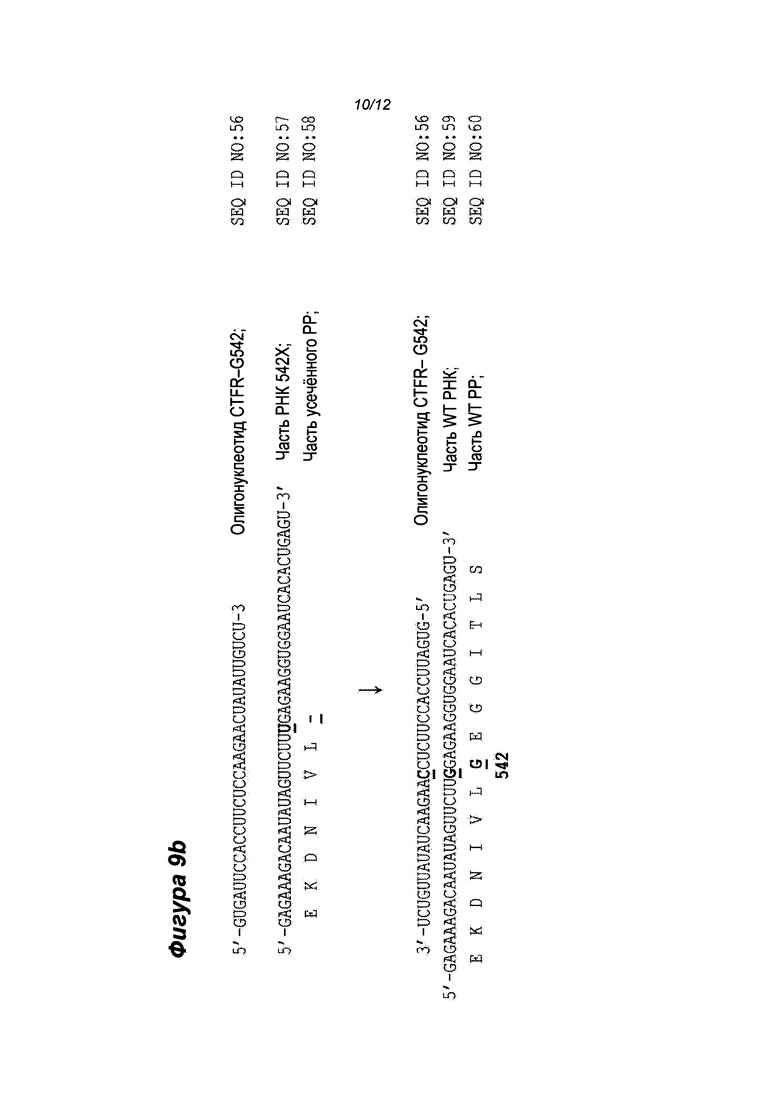

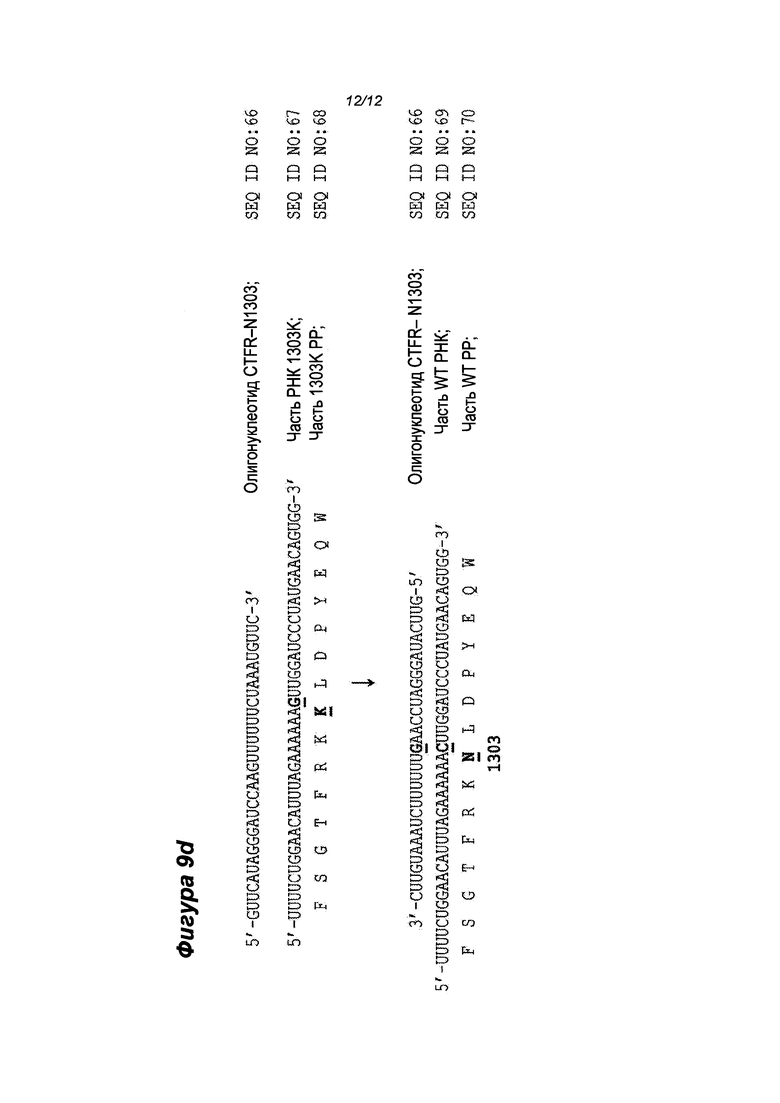
Изобретение относится к области биохимии, в частности к одноцепочечному олигонуклеотиду, где все нуклеозиды олигонуклеотида представляют собой 2'-O-алкилрибонуклеозиды, а также к применению вышеуказанного олигонуклеотида в лечении муковисцидоза человеческого организма или организма животного. Также раскрыт комплекс для лечения муковисцидоза человеческого организма или организма животного, содержащий вышеуказанный олигонуклеотид. Изобретение также относится к фармацевтической композиции для лечения муковисцидоза, содержащей вышеуказанный олигонуклеотид. Изобретение позволяет эффективно осуществлять лечение муковисцидоза. 4 н. и 15 з.п. ф-лы, 9 ил., 2 пр.
1. Применение одноцепочечного олигонуклеотида, где все нуклеозиды олигонуклеотида представляют собой 2'-O-алкилрибонуклеозиды, для лечения муковисцидоза у человека, нуждающегося в этом, путем нацеливания молекулы целевой РНК, находящейся в живой клетке указанного человека, включающее стадию предоставления олигонуклеотида в живую клетку в одноцепочечной форме в условиях, способствующих всасыванию живой клеткой указанного олигонуклеотида, причем указанный олигонуклеотид содержит последовательность, которая по меньшей мере частично комплементарна последовательности, которая по меньшей мере на 75%, 80%, 85%, 90% или 99% идентична нуклеотидам 16-30 и 34-48 последовательности SEQ ID NO: 5, причем олигонуклеотид содержит нуклеотиды или состоит из нуклеотидов 7-29 или нуклеотидов 1-33 последовательности SEQ ID NO: 1.
2. Применение по п. 1, где протяженность олигонуклеотида составляет 15-100 нуклеотидов.
3. Применение по п. 2, где протяженность олигонуклеотида составляет от 20 до 50 нуклеотидов, более предпочтительно от 25 до 45 нуклеотидов, более предпочтительно от 27 до 35 нуклеотидов.
4. Применение по любому из пп. 1-3, где олигонуклеотид содержит инозин и/или содержит модифицированные нуклеотиды, предпочтительно выбранные из группы, состоящей из РМО (ФМО), 5-метил-dC, 2-амино-dA, С5-пиримидина, и/или модифицированные межнуклеозидные связи, выбранные из группы, состоящей из фосфоротиоатных связей и метилфосфонатных связей.
5. Применение по любому из пп. 1-4, где все нуклеозиды олигонуклеотида представляют собой 2'-O-метилрибонуклеозиды.
6. Применение по п. 1, где олигонуклеотид предоставляется в носителе, предпочтительно в липосоме, полисоме или наночастице, и/или где олигонуклеотид находится в комплексе с соединением для доставки, предпочтительно с полиэтиленимином, полиэтиленгликолем, и/или связан со стеролом, предпочтительно с холестеролом.
7. Применение по п. 1, где олигонуклеотид предоставляется в легкие, предпочтительно через дыхательные пути, в сухом составе или в аэрозоле, предпочтительно с помощью ингалятора, и предпочтительно олигонуклеотид предоставляется вместе с медиатором трансфекции и/или лекарственным средством для лечения муковисцидоза, известным специалисту в данной области техники, предпочтительно ДНКазой, маннитом и/или малой молекулой для лечения муковисцидоза, предпочтительно Калидеко (ивакафтор; VX-770), VX-809 (лумакафтор) и/или VX-661.
8. Применение по п. 1, где олигонуклеотид предоставляется в гипертоническом солевом растворе, предпочтительно с концентрацией солевого раствора между 2-9%, предпочтительно 3-8%, более предпочтительно 4-8%, более предпочтительно 5-8%, более предпочтительно 6-8%, более предпочтительно 6-7%, еще более предпочтительно с концентрацией солевого раствора около 7%, причем гипертонический солевой раствор, предпочтительно, представляет собой физиологически и фармацевтически приемлемый раствор.
9. Одноцепочечный олигонуклеотид, где все нуклеозиды олигонуклеотида представляют собой 2'-O-алкилрибонуклеозиды, для применения в лечении муковисцидоза человеческого организма или организма животного, причем указанный олигонуклеотид комплементарен последовательности, которая по меньшей мере на 75%, 80%, 85%, 90% или 99% идентична нуклеотидам 16-30 и 34-48 последовательности SEQ ID NO: 5, причем олигонуклеотид содержит нуклеотиды или состоит из нуклеотидов 7-29 или нуклеотидов 1-33 последовательности SEQ ID NO: 1.
10. Олигонуклеотид по п. 9, протяженность которого составляет 15-100 нуклеотидов.
11. Олигонуклеотид по п. 10, протяженность которого составляет от 20 до 50, более предпочтительно от 25 до 45 нуклеотидов, более предпочтительно от 27 до 35 нуклеотидов.
12. Олигонуклеотид по любому из пп. 9-11, где олигонуклеотид содержит инозин и/или содержит модифицированные нуклеотиды, предпочтительно выбранные из группы, состоящей из РМО (ФМО), 5-метил-dC, 2-амино-dA, С5-пиримидина, и/или модифицированные межнуклеозидные связи, выбранные из группы, состоящей из фосфоротиоатных связей и метилфосфонатных связей.
13. Олигонуклеотид по любому из пп. 9-11, в котором все нуклеозиды олигонуклеотида представляют собой 2'-O метилрибонуклеозиды.
14. Олигонуклеотид по п. 9, где олигонуклеотид предоставляется в носителе, предпочтительно в липосоме, полисоме или наночастице, и/или олигонуклеотид связан со стеролом, предпочтительно с холестеролом.
15. Олигонуклеотид по п. 9, где олигонуклеотид предоставляется в респираторный тракт или легкое, предпочтительно через дыхательные пути, в сухом составе или в аэрозоле, предпочтительно с помощью ингалятора, и предпочтительно олигонуклеотид предоставляется вместе с медиатором трансфекции и/или лекарственным средством для лечения муковисцидоза, известным специалисту в данной области техники, предпочтительно, ДНКазой, маннитом и/или малой молекулой для лечения муковисцидоза, предпочтительно, Калидеко (ивакафтор; VX-770), VX-809 (лумакафтор) и/или VX-661.
16. Олигонуклеотид по п. 15, где олигонуклеотид предоставляется в гипертоническом солевом растворе, предпочтительно с концентрацией соли между 2-9%, предпочтительно 3-8%, более предпочтительно 4-8%, более предпочтительно 5-8%, более предпочтительно 6-8%, более предпочтительно 6-7%, еще более предпочтительно с концентрацией солевого раствора около 7%, причем гипертонический солевой раствор, предпочтительно, представляет собой физиологически и фармацевтически приемлемый раствор.
17. Комплекс для лечения муковисцидоза человеческого организма или организма животного, содержащий олигонуклеотид по п. 9, который находится в комплексе с соединением для доставки.
18. Комплекс по п. 17, в котором соединение для доставки представляет собой полиэтиленимин или полиэтиленгликоль.
19. Фармацевтическая композиция для лечения муковисцидоза, содержащая олигонуклеотид по любому из пп. 9-13, фармацевтически приемлемый носитель и/или гипертонический физиологически и фармацевтически приемлемый солевой раствор, предпочтительно с концентрацией солевого раствора между 2-9%, предпочтительно 3-8%, более предпочтительно 4-8%, более предпочтительно 5-8%, более предпочтительно 6-8%, более предпочтительно 6-7%, еще более предпочтительно с концентрацией солевого раствора около 7%.
| US2008287379 A1, 20.11.2008 | |||
| FRIEDMAN K.J | |||
| et al., Correction of Aberrant Splicing of the Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) Gene by Antisense Oligonucleotides, THE JOURNAL OF BIOLOGICAL CHEMISTRY, 1999, Vol | |||
| ТЕЛЕФОННЫЙ АППАРАТ, ОТЗЫВАЮЩИЙСЯ ТОЛЬКО НА ВХОДЯЩИЕ ТОКИ | 1920 |
|
SU274A1 |
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| ДВОЙНОЕ АВТОМОБИЛЬНОЕ КОЛЕСО С ЗАЦЕПАМИ | 1933 |
|
SU36193A1 |
| SHEN Y | |||
| et al., RNA-driven genetic changes in bacteria and in human cells, Mutation Research, 2011, Vol.717, pp | |||
| Огнетушитель | 0 |
|
SU91A1 |
| GONCZ K.K | |||
| et al., Expression of DeltaF508 CFTR in normal mouse lung after site-specific modification of CFTR sequences by SFHR, Gene Ther., 2001, Vol.8, N.12, pp.961-965 | |||
| RU94046360 A1, 10.06.1997. | |||
Авторы
Даты
2018-08-01—Публикация
2013-07-12—Подача