Изобретение относится к фармакологии, конкретно к противоопухолевым препаратам, и может быть использовано для направленной доставки активного вещества к опухолевым клеткам-мишеням и способам их получения.
Метаболические изменения - одна из отличительных черт опухоли. Одной из основных метаболических характеристик опухолевых клеток является высокий уровень гликолиза даже в присутствии кислорода, известный как аэробный гликолиз или эффект Варбурга [1, 2]. Однако на протяжении многих десятилетий биоэнергетический метаболизм опухоли получал лишь незначительное внимание, поскольку считалось, что любое вмешательство в обмен углеводов также оказывает значительное токсическое воздействие на здоровые клетки. При этом, такой универсальный механизм воздействия является главным преимуществом ингибиторов гликолиза по сравнению с химиопрепаратами, так как к этим ингибиторам чувствительны все типы опухолей и, главное, в силу механизма действия невозможно формирование резистентности.
В свою очередь благодаря открытию множества ингибиторов гликолиза впоследствии был проведен ряд доклинических исследований оценивающих возможность их применения [3, 4]. Несмотря на успешные доклинические испытаний, многие новые противоопухолевые средства, относящиеся к ингибиторам гликолиза, потерпели неудачу в I или II фазе клинических исследований, продемонстрировав системную токсичность [5]
Одним из подходов для снижения системного токсического действия и увеличения терапевтического индекса является адресная доставка лекарств с помощью липосом [6]. Известно множество технологий получения липосомальных форм препаратов [7]. Препараты, инкапсулированные в липосомы, относительно успешны в достижении первичных опухолей и их метастазов после внутривенной инъекции людям и демонстрируют большую терапевтическую эффективность относительно нелипосомальных форм препаратов, при снижении побочных эффектов препарата.
Один из главных недостатков использования липосом в качестве систем доставки связан с быстрым удалением их из кровообращения ретикулоэндотелиальной системой, главным образом, за счет захвата липосом купферовыми клетками печени и фиксированными макрофагами селезенки [8]. Для снижения взаимодействия с клетками ретикулоэндотелиальной системы липосомы можно модифицироать полимерами. Наиболее распространенным для этих целей является полиэтиленгликоль. Однако такой подход снижения процесса опсонизации правомерен для всех клеток. Низкая эффективность внутриклеточной разгрузки обусловлена жесткостью липидного бислоя (температура его фазового перехода превышает 60°С) и затрудненным слиянием с клеточными мембранами. В результате этого снижается адресность доставки к клеткам-мишеням, что приводит к уменьшении соответственно терапевтического индекса по сравнению с немодифицированными липосомами. Также для модифицированных липосом установлен факт ослабления антитоксического эффекта липосом [9]. Другой способ снижения опсонизации заключается в использовании липосом с меньшим диаметром [8].
Особенностью применения технологии является подбор технических параметров инкапсулирования для получения препарата, обладающего заданными свойствами.
Известна липосомальная форма препарата доксорубицина для лечения рака под торговой маркой «Myocet» (TEVA B.V., Netherlands) и «Caelyx/Doxil» (Schering-Plough, Madison NJ, USA). Недостатком «Myocet» как и «Doxil» является ограниченная область применения. «Myocet» применяться для лечения метастатической формы рака молочной железы в сочетании с циклофосфамидом, и при этом он не одобрен FDA для использования в США. «Doxil» применим только для саркомы Капоши и имеет ряд токсических эффектов нехарактерных для других форм препарата доксорубицина [9].
Монойодацетат является классическим ингибитором гликолиза, действуя главным образом на глицеральдегид-3-фосфатдегидрогеназу, а также на 6-фосфоглюконатдегидрогеназу, являющуюся основным компонентом окислительного сегмента пентозофосфатного пути. Противоопухолевая активность монойодацетата была показана на асцитной опухоли у мышей [10] и культуре клеток [11]. Однако использование в самостоятельной форме монойодацетата является весьма опасным.
Новая техническая задача - получение препарата, обладающего низкой кардиотоксичностью, за счет наиболее оптимальных параметров инкапсулирования для получения препарата, обладающего заданными свойствами.
Новый технический результат - снижение осложнений, обусловленных кардиотоксичностью препарата и повышение терапевтического индекса.
Для достижения нового технического результата в способе получения противоопухолевого липосомального препарата, включающем получение липосом с последующим инкапсулированием в них вещества, обладающего противооухолевым действием, для получения липосом используют 1,2-дипальмитоил-глицеро-3-фосфохолин и холестерол при молярном соотношении 9:0,2, соответственно, липиды растворяют в хлороформе, после чего, на роторном испарителе при 56°С формируют липидную пленку, далее получают эмульсию полых липосом, липидную пленку гидратируют физиологическим раствором, для введения протвоопухолевого вещества, при этом липосомы получают путем многократной экструзии суспензии эмульсии полых липосом вместе с монойдацетатом через поликарбонатные фильтры с размером пор 100 нм под давлением аргона при 3-10 МПа, при температуре 50-60°С, также соотношение количества эмульсии полых липосом и монойодацета подбирают таким образом, чтобы полученные липосомы содержали 95-98% противоопухолевого средства, после этого очищают липосомы путем диализа от невключенного препарата, при этом, при концентрации липидов 8-10 мг/мл при 98% включении используют молярное соотношение количества эмульсии полых липосом и монойодацетата 3:1, соответственно.
Способ осуществляют следующим образом.
Для получения липосом используют 1,2-дипальмитоил-глицеро-3-фосфохолин и холестерол при молярном соотношении 9:0,2, соответственно, липиды растворяют в хлороформе, после чего на роторном испарителе при 56°С формируют липидную пленку, далее получают эмульсию полых липосом, липидную пленку гидратируют физиологическим раствором, для введения противоопухолевого вещества, при этом липосомы получают путем многократной экструзии суспензии эмульсии полых липосом вместе с монойдацетатом через поликарбонатные фильтры с размером пор 100 нм под давлением аргона при 3-10 МПа, при температуре 50-60°С, также соотношение количества эмульсии полых липосом и монойодацета подбирают таким образом, чтобы полученные липосомы содержали 95-98% противоопухолевого средства, после этого очищают липосомы от невключенного препарата путем диализа. При концентрации липидов 8-10 мг/мл при 98% включении необходимо использовать молярное соотношение количества эмульсии полых липосом и монойодацетата 3:1, соответственно.
Холестерин в составе липосом придает им устойчивость к липопротеинам крови, при этом столь низкие концентрации в составе липосом обеспечивают относительно низкую температуру фазового перехода. Это позволяет получать липосомы при низких температурах (50-60°С). Низкотемпературный режим получения препаратов в липосомальной форме несет на себе две функции. Во-первых, снижает вероятность окисления липидов. Этому также способствует использование инертного газа аргона. Во-вторых, такой режим не вызывает разрушение и/или какие-либо изменения встраиваемого препарата.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение липосомального противоопухолевого препарата, Для получения липосом использовали 1,2-дипальмитоил-глицеро-3-фосфохолин и холестерол (молярное соотношение 9:0,2). Липиды растворяли в хлороформе, после чего на роторном испарителе при 56°С формировали липидную пленку. Для получения эмульсии полых липосом липидную пленку гидратировали физиологическим раствором. Липосомы получали путем многократной (11-12 циклов) экструзии суспензии эмульсии полых липосом вместе с монойдацетатом через поликарбонатные фильтры с размером пор 100 нм под давлением аргона при 3-10 МПа и при температуре 50-60°С. Соотношение количества эмульсии полых липосом и монойодацета подбиралось таким образом, чтобы в конечном счете липосомы были с 95-98% включением препарата. Очистку липосом от невключенного препарата проводили путем диализа. При концентрации липидов например, 8-10 мг/мл при 98% включении использовали молярное соотношение количества эмульсии полых липосом и монойодацетата 3:1, соответственно.
Противоопухолевая активность липосомной формы монойодацетата в отношении экспериментальных опухолей у животных.
Для оценки фармакологического действия липосомного препарата были проведены эксперименты на мышах линии C57BL/6j на модели карциномы легких Льюис.
Для перевивки эпидермоидной карциномы Льюис (LLC) всем животным единовременно инокулировали в мышцу бедра по 1,5 млн. опухолевых клеток LLC в 0,2 мл 0,9% NaCl. Использовали четвертый пассаж после разморозки с метастазированием в легкие в 100% случаев. В качестве препарата сравнения был использован метоктрексат. Препараты вводили внутрибрюшинно в течение 3 дней в самостоятельной форме в максимально переносимой дозе (метотрексат 2 мг/кг в сутки, монойодацетат 6 мг/кг в сутки). Липосомные формы метотрексата и монойодацетата, полученные согласно предлагаемому способу, вводили опытным животным внутривенно в дозах, соответствующих максимально переносимой. Лечение животных начинали с шестых суток от момента инокуляции опухолевых клеток. Контрольные животные получали физиологический раствор или пустые липосомы в том же объеме, что и опытные группы. Животных выводили из опыта на 21-е сутки эксперимента при токсической дозе золетила (VIRBAC, Франция). Торможение роста опухоли (ТРО) вычисляли по формулам: TPOv=(Sк-Soп)×100% / Sк, где Sк - средний объем опухоли в контрольной группе; Soп - средний объем опухоли в опытной группе. Уровень торможения метастазов (ТМ) в легких рассчитывали по формуле ТМ=(Мк-Моп)×100% / Мк, где Мк - средняя масса метастазов в легких контрольной группы; Моп - средняя масса метастазов в легких опытной группы [12].
Обработку полученных результатов проводили с использованием непараметрических критериев Вилкоксона-Манна-Уитни. Различия считали достоверными при Р<0,05.
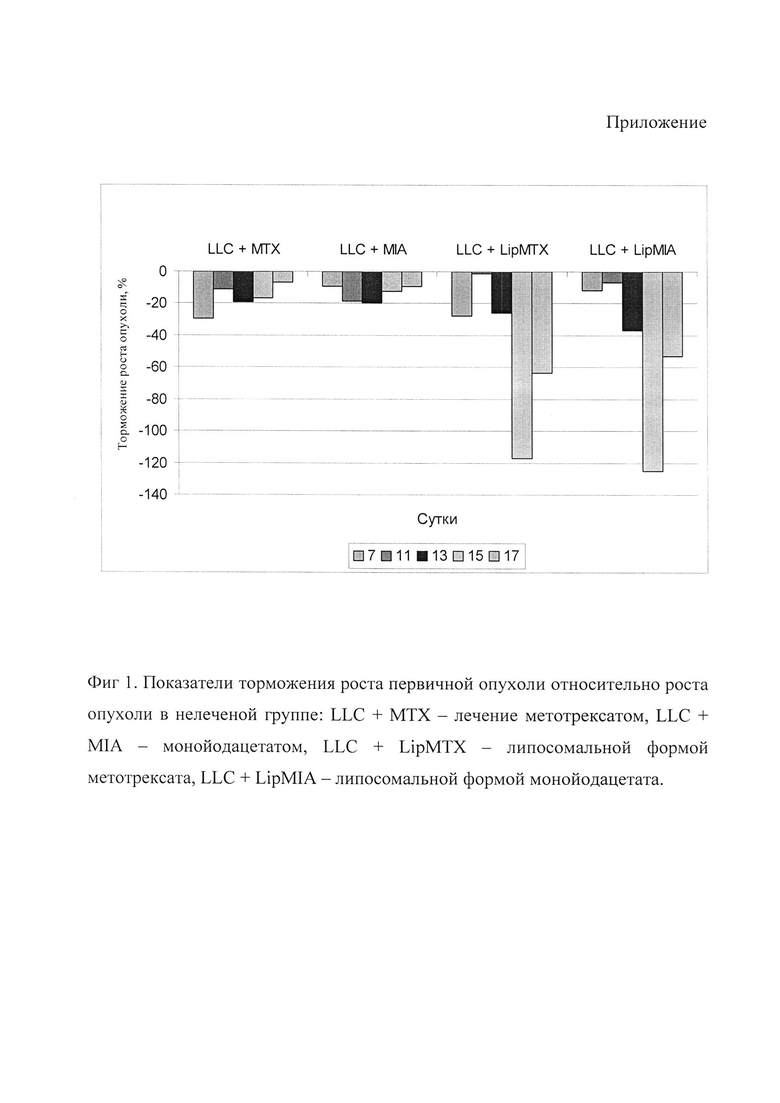
Для оценки фармакологического действия препарата был предварительно проведен поиск максимальной переносимой дозы (МПД) животными для метотрексата и монойодоацетата. Оказалось, что в случае монойодацетата МПД для животных с привитой опухолью вдвое меньше таковой у интактных мышей линии C57BL/6j и составила 9 мг/кг. При введении животным 18 мг/кг монойодацетата (МПД для интактных) животным на фоне опухолевого процесса летальность увеличивалась до 100%. Такая модификация переносимости токсической дозы опухолевым процессом является нормальной. Однако такая ситуация говорит, что использование в самостоятельной форме монойодацетата является весьма опасным. При испольлзовании липосомальной формы монойодацета в дозах 18 мг/кг и даже при 54 мг/кг (ЛД50 для интактных) на животных с привитой опухолью не было зафиксировано гибели животного. Это говорит о значительном снижении системной токсичности препарата в липосомальной форме. В случае же химиопрепарата метотрексата наблюдалась иная картина. В самостоятельной форме метотрексат оказывал меньшее токсическое действие и, в конечном счете, смертность у животных не превышала порог 5%. Липосомальная форма метотрексата усиливала гепатотоксическое действие химиопрепарата и летальность увеличивалась до 20%. При этом у половины выживших животных в печени наблюдались мелкоочаговые склеротические образования. Такие эффекты действия этих препаратов связаны с изменением фармакокинетики и биораспределения препаратов в липосамальной форме. Липосомы распределяются главным образом в опухолевом очаге, печени, селезенке и легких. Так как ключевыми объектами токсического действия для монойодоацетата являются эритроциты и сердце, то протекция сердечно-сосудистого компонента оказала значительный вклад в снижение токсичности. В случае же с метотрексатом был получен обратный эффект, так как препарат концентрировался, в частности, в печени, в результате чего повышался его гепатотоксический эффект. Таким образом, липосомальная форма монойодацетата значительно снижает системную токсичность препарата.
Результаты эксперимента о противоопухолевом действии препарата приведены на фиг. 1 и в табл.1. Как видно из результатов, действие липосомальной формы монойодацета было сопоставимо с таковым действием метотрексата, и торможение роста первичной опухоли значительно увеличивалось по сравнению с показателями самостоятельной формы монойодацетата. Однако терапия монойодацетата, инкапсулированного в липосомы в МПД, не имела антиметастатического эффекта.
Таким образом, предлагаемый противоопухолевый препарат перспективен для использования в лечении онкологических патологий. Применение препарата снижает осложнения, обусловленные кардиотоксичностью препарата и повышает терапевтический индекс.
Источники информации
1. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011; 144(5):646-674.
2. Warburg O. On the origin of cancer cells. Science. 1956; 123(3191): 309-314.
3. The sweet trap in tumors: aerobic glycolysis and potential targets for therapy Li Yu, Xun Chen, Liantang Wang, and Shangwu Chen.
4. Anticancer Targets in the Glycolytic Metabolism of Tumors: A Comprehensive Review Paolo E. Porporato, Suveera Dhup, Rajesh K. Dadhich, Tamara Copetti, and Pierre Sonveaux
5. Drug discovery strategies in the field of tumor energy metabolism: Limitations by metabolic flexibility and metabolic resistance to chemotherapy. Amoedo N.D., Obre E., Rossignol R.
6. Cancer drug delivery in the nano era: An overview and perspectives (Review). Li Z, Tan S, Li S, Shen Q3, Wang K.
7. Liposome: classification, preparation, and applications //A. Akbarzadeh, R. Rezaei-Sadabady, S. Davaran, et al.
8. Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential. Maria Laura Immordino, Franco Dosio, and Luigi Cattel.
9. From Conventional to Stealth Liposomes: a New Frontier in Cancer Chemotherapy// L. CATTEL - M. CERUTI - F. DOSIO.
10. Antitumor Activities of Iodoacetate and Dimethylsulphoxide Against Solid Ehrlich Carcinoma Growth in Mice Fahim, F.A.; Esmat, A.Y.; Mady, E.A.; Ibrahim, E.K. (2003).
11. Differential killing and radio-modifying effects of iodoacetate in mammalian normal and cancer cells. Yadav U, Anjaria KB, Nairy R, Shirsath KB, Desai UN, Chaurasia RK, Bhat NN, Sapra BK.
12. Трещалина E.M., Жукова O.C., Герасимова Г.К., Андронова Н.В., Гарин A.M. Методические указания по изучению противоопухолевой активности фармакологических веществ // Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова. - М.: Гриф и К. 2012. С. 640-654.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ В ПЕРИТОНЕАЛЬНОМ ДИАЛИЗЕ | 2013 |
|
RU2609860C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2005 |
|
RU2574926C2 |
| СРЕДСТВО, УЛУЧШАЮЩЕЕ ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ОКСАЛИПЛАТИН, И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО | 2009 |
|
RU2492863C2 |
| ЛИПОСОМА, ИМЕЮЩАЯ ВНУТРЕННЮЮ ВОДНУЮ ФАЗУ, СОДЕРЖАЩУЮ СОЛЬ СУЛЬФОБУТИЛОВОГО ЭФИРА ЦИКЛОДЕКСТРИНА | 2010 |
|
RU2575793C2 |
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ОЛИГОПЕПТИДНОГО ПРЕПАРАТА ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2561582C2 |
| БИНАРНАЯ ИММУНОЛИПОСОМАЛЬНАЯ НАНОСИСТЕМА АДРЕСНОЙ ДОСТАВКИ К КОННЕКСИН-43 ПОЛОЖИТЕЛЬНЫМ ОПУХОЛЕВЫМ КЛЕТКАМ | 2009 |
|
RU2422154C2 |
| Однослойные липосомы, содержащие микафунгин | 2024 |
|
RU2835492C1 |
| ЛИПОСОМАЛЬНЫЕ ПРОТИВООПУХОЛЕВЫЕ КОМПОЗИЦИИ | 2017 |
|
RU2756837C2 |
| Способ лечения онкологических заболеваний с помощью инъекций лекарственного препарата | 2018 |
|
RU2706427C1 |

Группа изобретений относится к области фармацевтической промышленности, а именно к способу получения противоопухолевого липосомального препарата для лечения карциномы легких и к препарату, полученному этим способом. Согласно предложенному способу липиды, представляющие собой 1,2-дипальмитоил-глицеро-3-фосфохолин и холестерол, взятые при молярном соотношении 9:0,2 соответственно, растворяют в хлороформе; затем на роторном испарителе при 56°С формируют липидную пленку, которую далее гидратируют физиологическим раствором с получением эмульсии полых липосом; после этого осуществляют инкапсуляцию противоопухолевого вещества, представляющего собой монойодацетат, в липосомы путем 11-12-кратной экструзии эмульсии полых липосом вместе с монойодацетатом через поликарбонатные фильтры с размером пор 100 нм под давлением аргона при 3-10 МПа и при температуре 50-60°С, причем молярное соотношение количества эмульсии полых липосом и монойодацета составляет 3:1; после этого очищают липосомы от неинкапсулированного монойодацетата путем диализа. Группа изобретений обеспечивает снижение осложнений, обусловленных кардиотоксичностью препарата, и повышение терапевтического индекса. 2 н.п. ф-лы, 1ил., 1 табл., 1 пр.
1. Способ получения противоопухолевого липосомального препарата для лечения карциномы легких, характеризующийся тем, что липиды, представляющие собой 1,2-дипальмитоил-глицеро-3-фосфохолин и холестерол, взятые при молярном соотношении 9:0,2 соответственно, растворяют в хлороформе; затем на роторном испарителе при 56°С формируют липидную пленку; после этого указанную липидную пленку гидратируют физиологическим раствором с получением эмульсии полых липосом; далее осуществляют инкапсуляцию противоопухолевого вещества, представляющего собой монойодацетат, в липосомы путем 11-12-кратной экструзии эмульсии полых липосом вместе с монойодацетатом через поликарбонатные фильтры с размером пор 100 нм под давлением аргона при 3-10 МПа и при температуре 50-60°С, причем молярное соотношение количества эмульсии полых липосом и монойодацета составляет 3:1; после этого очищают липосомы от неинкапсулированного монойодацетата путем диализа.
2. Противоопухолевый липосомальный препарат для лечения карциномы легких, полученный способом по п.1.
| Ручной штамповальный прибор | 1930 |
|
SU23079A1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2514000C1 |
| Fahim F.A | |||
| et al | |||
| Antitumor activities of iodoacetate and dimethylsulphoxide against solid Ehrlich carcinoma growth in mice / Biological Research, 2003, v.36, N 2, pp.253-262 | |||
| Torchilin V.P | |||
| Recent advances with liposomes as pharmaceutical carriers / Nature Reviews Drug Discovery, 2005, v.4, pp.145-160. | |||
Авторы
Даты
2018-08-03—Публикация
2017-09-05—Подача