Введение
Регуляция многих физиологических явлений, включая чувство голода, стрессовые реакции и репродуктивные механизмы, зависит от гормонального равновесия. Гормональное равновесие может изменяться в ответ на внешние и внутренние раздражители. Например, секреция гормонов передней доли гипофиза регулируется преимущественно гипоталамусом, который располагается в мозгу как раз над гипофизом. Известно, что нейроны гипоталамуса производят и выделяют пептидные факторы, которые стимулируют или подавляют секрецию определенных гормонов специфической группой клеток гипофиза.
Разнообразные выделяемые гипоталамусом пептиды играют важную роль в регуляции секреции различных гормонов передней доли гипофиза, например, гормона роста (GH), адренокортикотропного гормона (АСТН), тиреотропного гормона (TSH), лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH). Однако регуляция высвобождения пролактина передней долей гипофиза более сложная: она включает стимулирующие факторы, исходящие как из гипоталамуса, так и из промежуточной доли гипофиза (см. Laudon et al. (1990) Endocrinology 126:3185-3192; Ben-Jonathan and Hnasko (2001) Endocr. Rev. 22:724-763). Роль промежуточной доли гипофиза в регуляции секреции пролактина хорошо изучена и отражена в литературе. Промежуточная и задняя доли гипофиза необходимы для усиления секреции пролактина, происходящего в ответ на кормление грудью и эстрадиол, однако исходящие из промежуточной доли гипофиза факторы, вызывающие высвобождение пролактина, еще не достаточно охарактеризованы (Alien et al. (1995) Endocrinology 136:3093-3099).
Показано, что высвобождение пролактина связано с гипофизарным рецептором, подобным рецептору кальцитонина (CRLR) (Meeran et al. 1997. J. Clin. Endocrinol. Metab. 82:95-100), хотя в мозге локализация экспрессии пептида, связанного с геном кальцитонина (CGRP), и места связывания CGRP не перекрываются (Kruger 1988. Brain Res. 463:223-244). Кальцитонин. который первоначально был выделен как полипептидный гормон, нужный для регуляции обмена кальция, принадлежит к группе пептидных гормонов, включающей αCGRP, βCGRP, адреномедуллин (ADM) и амилин (Eto (2001) Peprides 22:1693-1711). Эти тканеспецифичные пептиды являются важными эндо- и нейрокринными интегрирующими факторами для поддержания гомеостаза в сосудистой и дыхательной системах.
Биологическое действие этих пептидов опосредуется связыванием с двумя близко родственными рецепторами, сопряженными с G-белками, типа II (GPCR), рецептором кальцитонина и CRLR (Christopoulos et al. (1999) Mol. Pharmacol. 56:235-242; Poyner et al. (2002) Pharmacol. Rev. 54:233-246). Хотя рецептор кальцитонина является основным посредником для действия кальцитонина, он также связывает амилин. Недавно проведенные исследования с использованием клонирования и функционального подхода показали, что CGRP, ADM и в меньшей степени амилин взаимодействуют с различными сочетаниями CRLR и трех белков, модифицирующих активность рецептора, (RAMP) (см. McLatchie et al. (1998) Nature 393:333-339).
Во многих клетках экспрессируются различные RAMP. Для функционирования рецепторов пептида, связанного с геном кальцитонина, (CGRP) и адреномедуллина (ADM) требуется совместная экспрессия рецептора, подобного рецептору кальцитонина, (CRLR) и белков, модифицирующих активность рецептора, (RAMP). Для должного нацеливания на клеточной поверхности и фармакологических свойств рецепторов как CGRP, так и ADM существенно образование гетеродимеров RAMP и CRLR. В семейство RAMP входит три белка (RAMP1, -2 и -3), у которых аминокислотные последовательности идентичны менее чем на 30%, но топологически они одинаковы. Эти белки имеют небольшие размеры (предсказанные размеры: Mr 14,000-17,000), находятся внутри клеточной мембраны, и содержат большой (~100 аминокислотных остатков) внеклеточный N-конец, один трансмембранный домен и очень короткий внутриклеточный домен (10 аминокислотных остатков). Совместная экспрессия RAMP1 и CRLR приводит к образованию рецептора CGRP, a RAMP2 и RAMP3 способствуют экспрессии рецептора ADM. Когда имеет место совместная экспрессия рецептора кальцитонина и RAMP1, обеспечивается рецептор CGRP/амилина, а совместная экспрессия рецептора кальцитонина и RAMP3 обеспечитвает рецептор амилина.
Исследования с использованием мутантных мышей, дефицитных по aCGRP, ADM или амилину, показали, что CRLR может играть важную роль в морфогенезе сердечнососудистой системы, в передаче нервных импульсов в сенсорной системе, в воспалительных реакциях, в поведении, связанном с восприятием боли и в гомеостазе глюкозы. Таким образом, физиологические функции пептидов этого семейства определяются специфичностью связывания рецепторов и тканевой спецификой экспрессии различных лигандов.
Пептидные гормоны представляют большой интерес для использования в клинической практике и совершенствования методов лечения, включая лечение гипертензии и поддержание гомеостаза в сердечно-сосудистой систенме. Кроме того, весьма интересно идентифицировать фактор высвобождения пролактина. Хотя пролактин играет важную роль в беременности и лактации у млекопитающих и участвует в развитии молочных желез и стимуляции образования молока, специфический гормон, являющийся рилизинг-фактором для пролактина, до сих пор не установлен.
Родственные публикации
Hay and Smith (2001) Trends Pharmacol. Sci. 22:57-59; и Shindo et al. (2001) Circulation 104:1964-197 обсуждают важность адреномедуллина в сосудистой системе. Роль CGRP рассматривается в работах Zhang et al. (2001) Pain 89:265-273; Salmon et al. (1999) Neuroreport 10:849-854; Salmon et al. (2001) Nat. Neurosci. 4:357-358. Роль амилина обсуждается в работе Mulder et al. (2000) Am. J. Physiol. Endocrinol. Metab. 278:E684-691.
GenBank entry AF529213.
Раскрытие изобретения
Настоящим изобретением предлагаются аналоги длительно действующих пептидов, обеспечивающие биологические активности интермедина или адреномедулллина, включая функционирование в роли лиганда рецептора, подобного рецептору кальцитонина, причем эти аналоги обладают существенно более длительным периодом полужизни in vivo по сравнению с природными полипептидами. Аналоги пептидов по данному изобретению обеспечивают эффективность in vivo, которая длится по меньшей мере вдвое больше, чем природных пептидов и может быть больше в 5, 10, 20 и более раз. Повышенная активность in vivo может быть измерена in vivo или in vitro путем определения стабильности полипептида, продолжительности его физиологического эффекта и проч.
В некоторых воплощениях настоящего изобретения аналоги длительно действующих пептидов включают биологически активные полипептиды интермедии или адреномедуллин с модифицированным N-концом. N-концевые модификации, представляющие интерес в контексте данного изобретения, включают конъюгацию с жирными кислотами, обычно содержащими 4-30 атомов углерода, которые могут быть насыщенными или ненасыщенными. Жирные кислоты, представляющие интерес в контексте данного изобретения, включают (приведенные примеры не являются ограничивающими) пальмитиновую, стеариновую, арахидовую, лауриловую, миристиновую, миристолеиновую, пальмитолеиновую, сапиеновую, олеиновую, линолевую, а-линоленовую, арахидоновую, эйкозапентаеновую, эруковую, докозагексаеновую кислоты и др. В других воплощениях настоящего изобретения указанные полипетиды модифицируют путем пэгилирования, гликозилирования, конъюгации с крупными белками (например, альбумином), или конъюгации с полимерами в сочетании с модификациями аминокислот, например применением D-аминокислот или β-аминокислот для увеличения биологического периода полужизни.
Аналоги по данному изобретению представляют собой длительно действующие аналоги агонистов рецепторов CLR/RAMP. Эти аналоги могут иметь ограниченное влияние на частоту сердечных сокращений, в то же время значительно влияя на кровяное давление. Компартментализация длительно действующих пептидов в сыворотке крови эффективно сокращала долю агонистов, доступную в данный момент времени для стимуляции клеток, тем самым сглаживая эффекты введенных пептидов и исключая нежелательные побочные эффекты.
Краткое описание иллюстраций
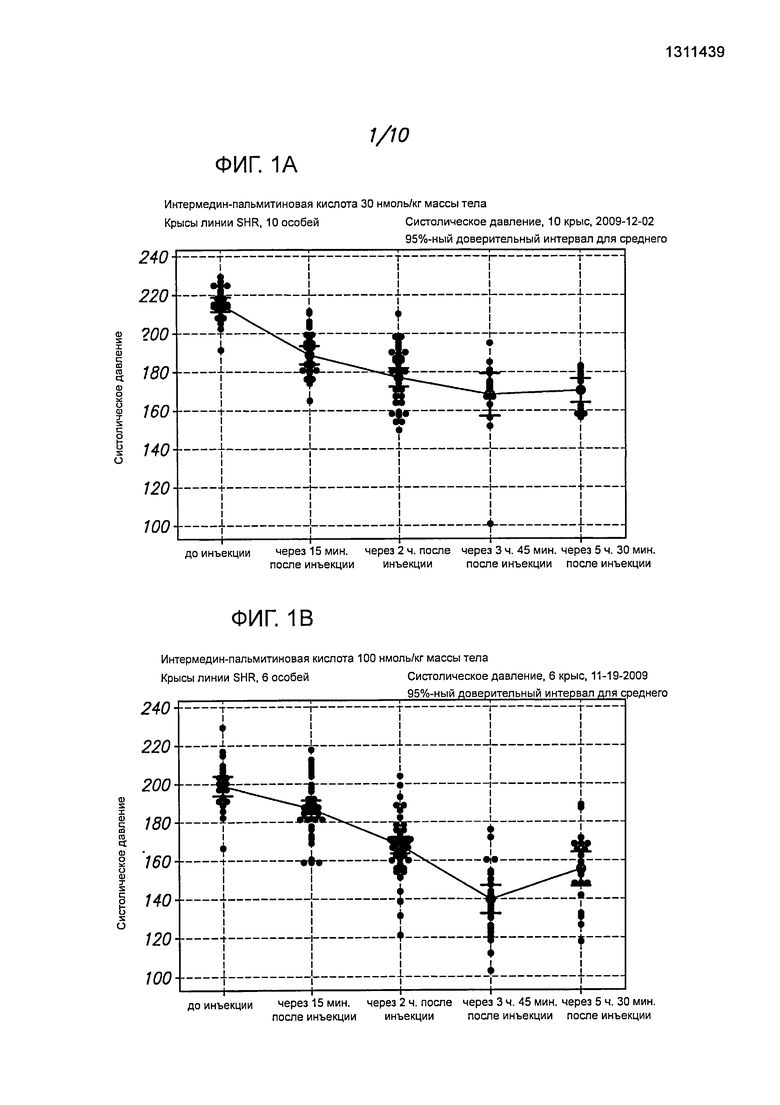
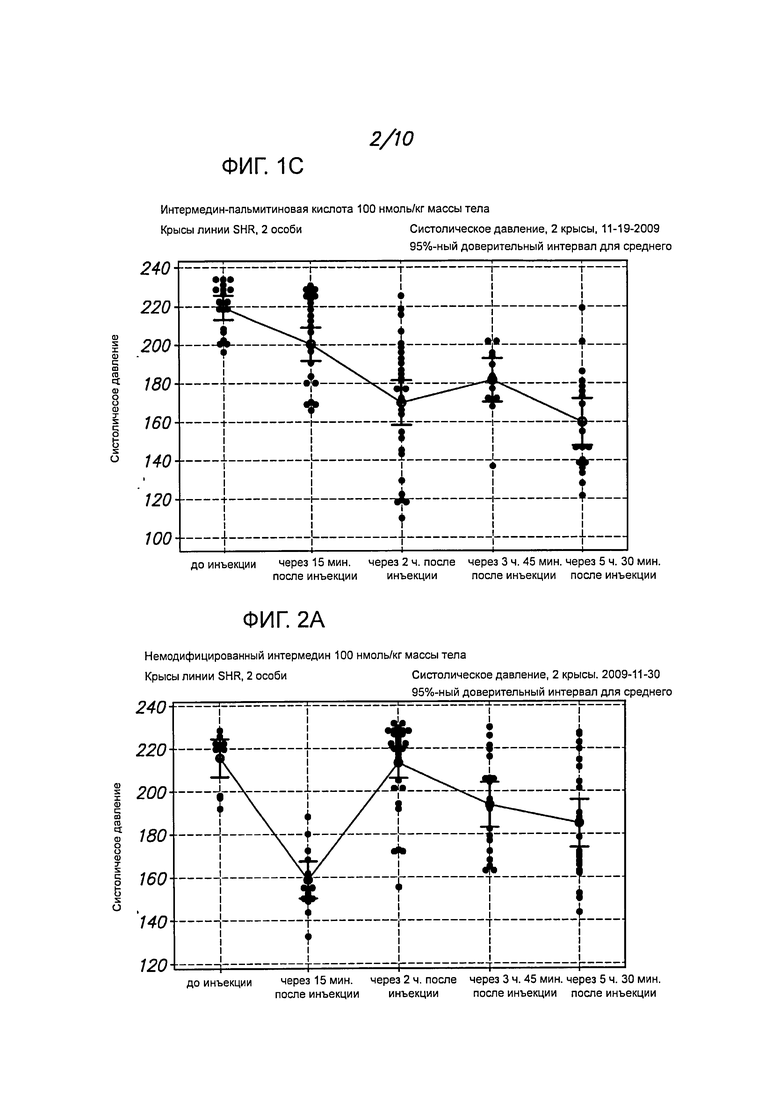
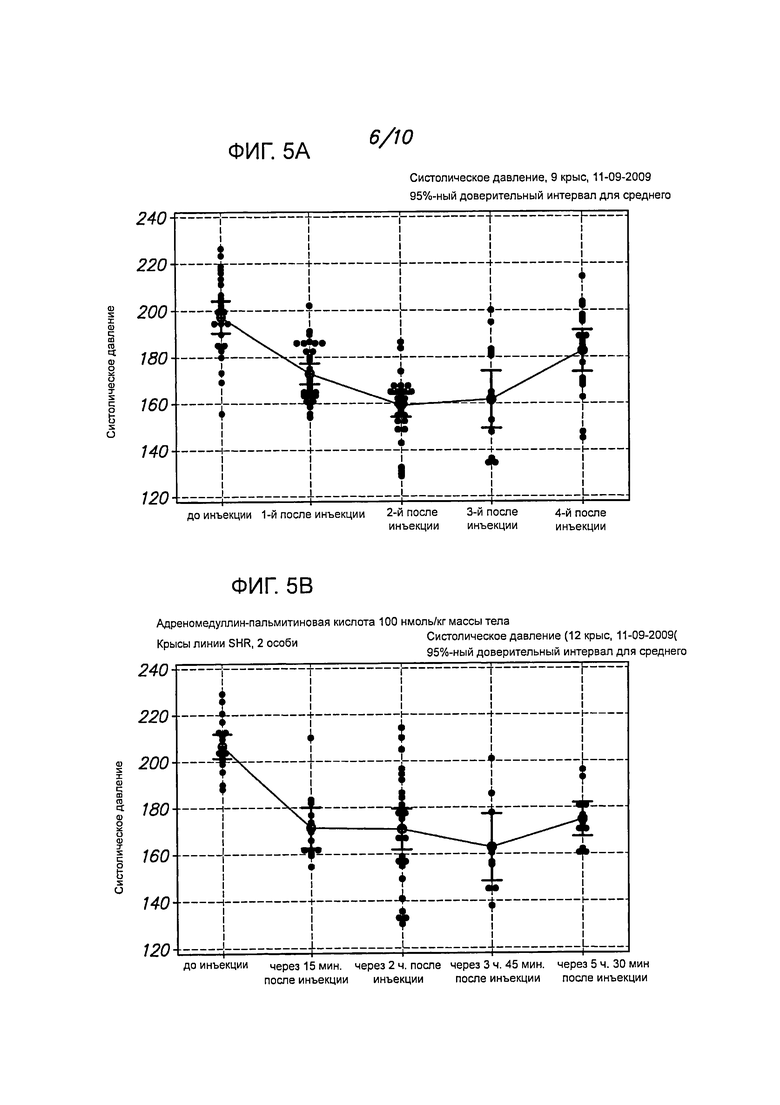
На фигурах 1А-1С представлены примеры определения кровяного давления у крыс линии SHR после введения длительно действующего интермединового пептида (интермедина, модифицированного пальмитиновой кислотой, IMD-PA), А. 30 нмоль/кг массы тела; В/С, 100 нмоль/кг массы тела.
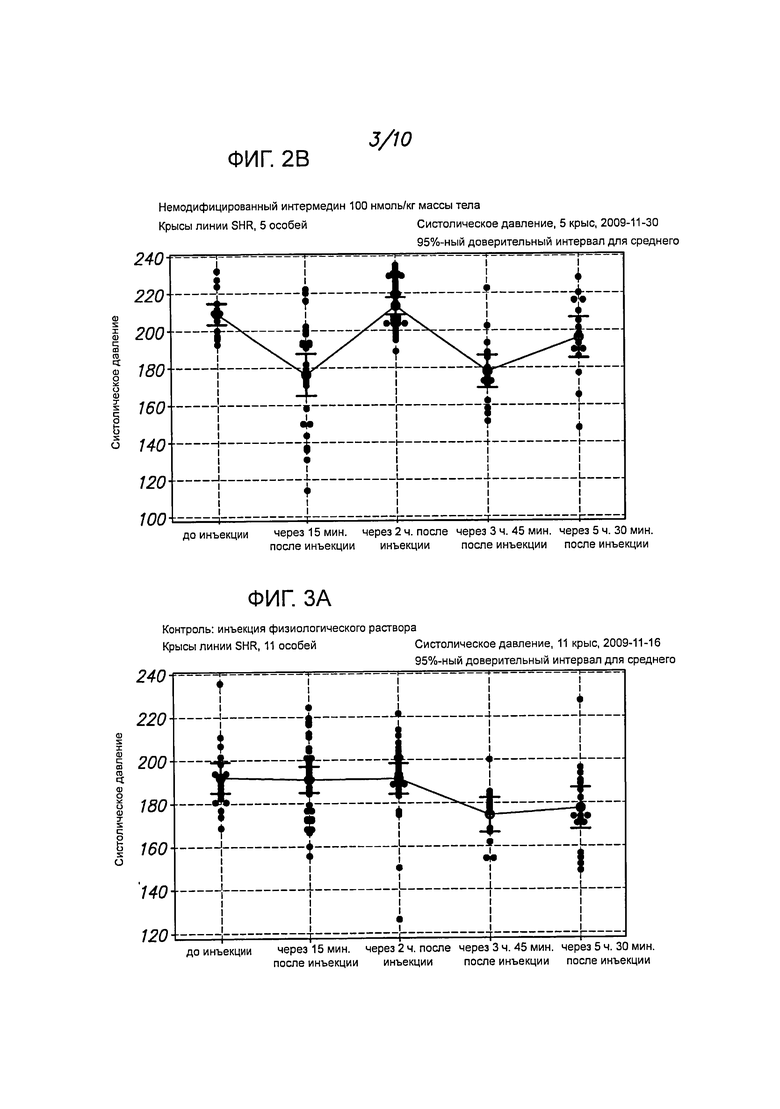
На фигурах 2А-2В представлены примеры определения кровяного давления у крыс линии SHR после введения немодифицированного интермедина (IMD, 100 нмоль/кг массы тела). Гипотензивный эффект пептида IMD-PA in vivo длился более 5 часов, тогда как немодифицированный IMD действовал менее 1 часа.
На фигурах 3А-3В представлены результаты определения кровяного давления после введения PBS у контрольных особей.
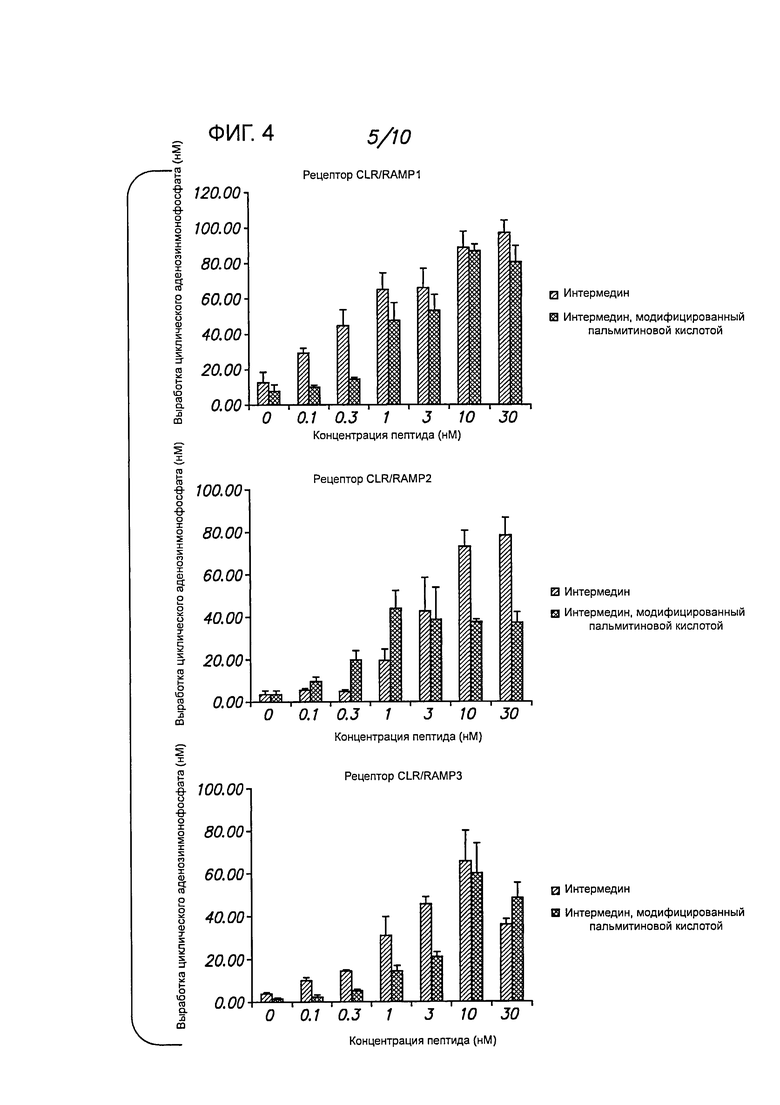
Фигура 4 демонстрирует стимулирующий эффект IMD и IMD-PA в клетках 293Т, в которых экспрессируются три различных рецептора (CLR/RAMP1, CLR/RAMP2 и CLR/RAMP3).
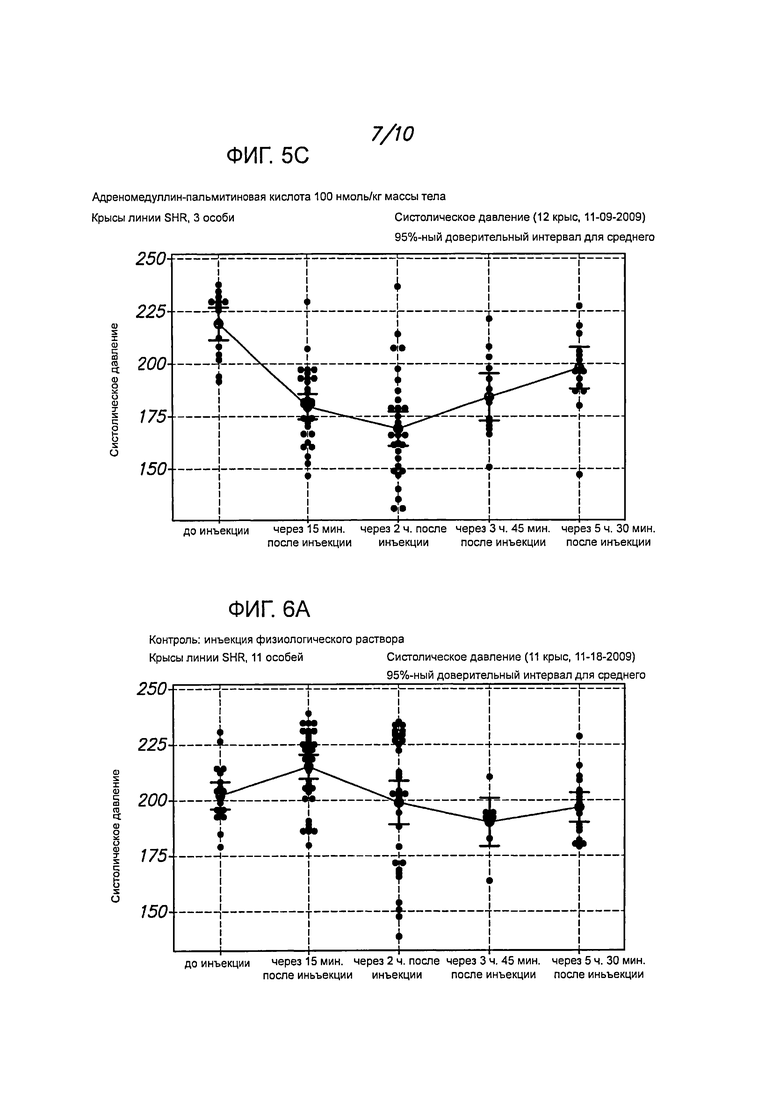
На фигурах 5А-5С представлены примеры определения систолического давления у крыс линии SHR после инъекции длительно действующего адреномедуллинового пептида (адреномедуллин, модифицированный пальмитиновой кислотой - ADM-PA, 100 нмоль/кг массы тела). Гипотензивный эффект этого пептида in vivo продолжался более 5 часов. А гипотензивный эффект немодифицированного адреномедуллина обычно длится менее 1,5 часа.
На фигурах 6А-6В представлены примеры определения систолического давления у крыс SHR после инъекции физиологического раствора (контроль).
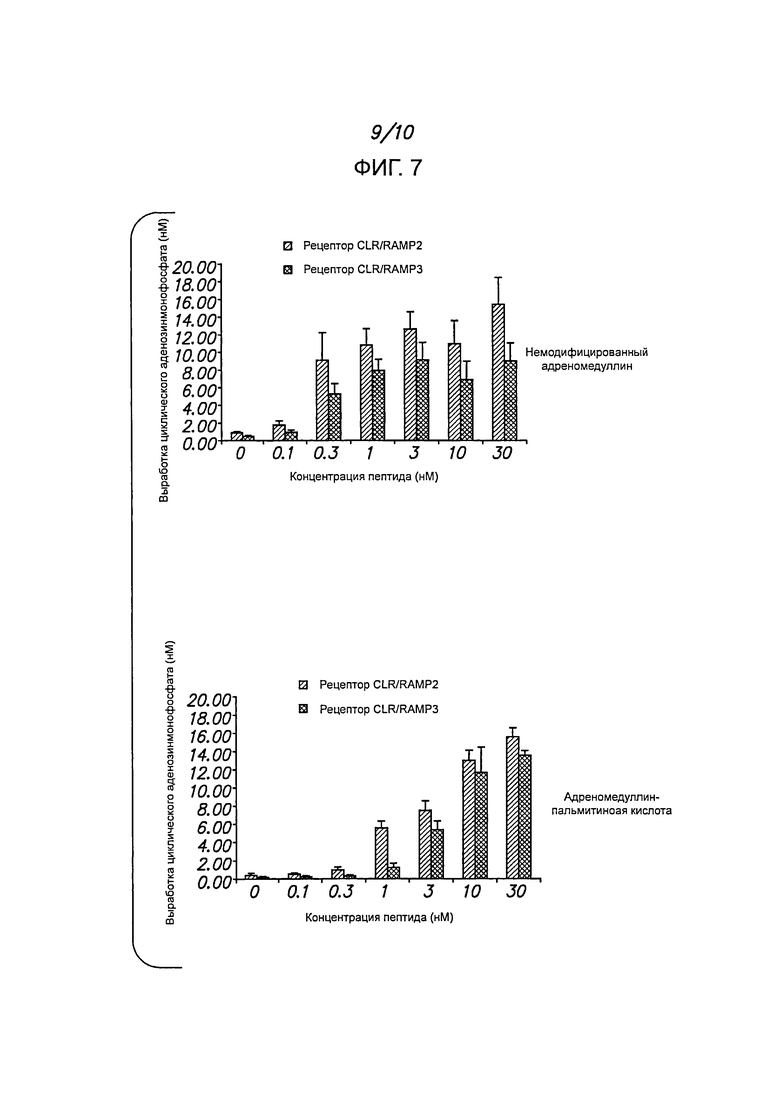
Фигура 7 демонстрирует стимулирующий эффект ADM и ADM-PA в клетках 293Т, в которых экспрессируются рекомбинантные рецепторы 1 (CLR/RAMP2) и 2 (CLR/RAMP3) адреномедуллина. Хотя in vitro стимулирующий эффект пептида ADM-PA слабее, чем немодифицированного ADM, зато in vivo первый из этих пептидов значительно дольше остается эффективным.
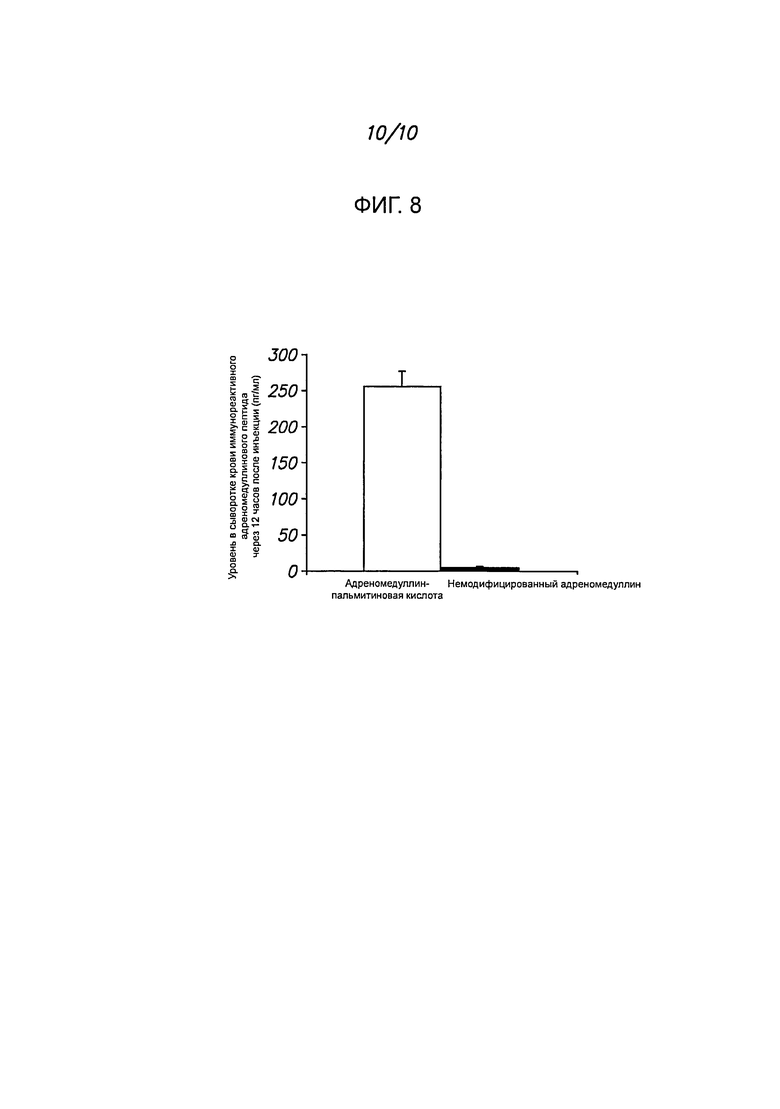
Фигура 8 показывает, что in vivo через 12 часов после инъекции пептида уровень иммунореактивного ADM-PA держится значительно более высоким, чем пептида ADM.
Описание конкретных воплощений
Данным изобретением предлагаются новые полипептидные аналоги интермедина или адреномедуллина, являющиеся членами кальцитонинового семейства пептидных гормонов.
Интермедии является лигандом рецептора, подобного рецептору кальцитонина. В гене интермедина человека открытая рамка считывания кодирует 148 аминокислот, причем 24 аминокислотных остатка с N-конца - это сигнальный пептид для секреции; зрелый амидированный пептид показан в SEQ ID NO:1 и SEQ ID NO:2. Зрелые интермединовые пептиды человека включают (перечисленные здесь примеры не являются ограничивающими) пептид из 40 аминокислотных остатков (короткий интермедии, IMDS), обозначенный SEQ ID NO:3, который соответствует аминокислотным остаткам 8-47 зрелого белка; и зрелый пептид из 47 аминокислотных остатков (длинный интермедии, IMDL), обозначенный SEQ ID NO:4. Интермединовый пептид может быть замещен концевым остатком лизина для облегчения модификации. Например, представляет интерес интермединовый пептид, обозначенный SEQ ID NO:7: K(мод)GCVLGTCQVQNLSHRLWQLMGPAGRQDSAPVDPSSPHSY, в котором концевой лизин модифицирован, например присоединением липида или другой группы.
Адреномедуллин является лигандом рецептора, подобного рецептору кальцитонина. Ген ADM кодирует препрогормон, который в результате посттрансляционной модификации превращается в два биологически активных пептида - адреномедуллин и N-концевой (20) пептид проадреномедуллина (РАМР). Адреномедуллин состоит из 52 аминокислотных остатков, содержит одну внутримолекулярную дисульфидную связь и в некоторой степени гомологичен пептиду, связанному с геном кальцитонина (CGRP). Предшественник, называемый препроадреномедуллином, состоит из 185 аминокислотных остатков. См. Genbank NM_p01124 (эта ссылка включена в настоящий документ путем отсылки). Полипептид-предшественник (SEQ ID NO:5) имеет следующую аминокислотную последовательность: MKLVSVALMYLGSLAFLGADTARLDVASEFRKKWNKWALSRGKRELRMSSSYPTGLADVKAGPAQTLIRPQDMKGASRSPEDSSPDAARIRVKRYRQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGYGRRRRRSLPEAGPGRTLVSSKPQAHGAPAPPSGSAPHFL.
Для целей настоящего изобретения термин «адреномедуллиновый пептид» может относиться к любому активному пептиду, происходящему из пептида - предшественника адреномедуллина (если не оговорено иного). Особый интерес представляют пептиды, обладающие гипотензивным эффектом. Указанный активный пептид включает (приведенный здесь пример не является ограничивющим) адреномедуллиновй пептид с аминокислотной последовательностью (SEQ ID NO:6)
K(мод)GCRFGTCTVQKLAHGQIYQFTDKDKDKDNVAPRSKISPQGY, где лизин в положении 1 модифицирован, например путем присоединения липида или иной группировки.
В некоторых воплощениях данного изобретения один или более интермедии и адреномедуллин модифицированы способами по данному изобретению, чтобы получить долгоживущий аналог.
В некоторых воплощениях настоящего изобретения аналоги включают биологически активные полипептиды, модифицированные HaN-конце, как показано в формуле I. В других воплощениях данного изобретения эти полипептиды могут быть модифицированы путем пэгилирования, гликозилирования, конъюгации с крупными белками (например, альбумином) или конъюгации с полимерами в сочетании с модификациями аминокислот, например, можно использовать D-изомеры аминокислот или β-аминокислоты для увеличения биологического периода полужизни.
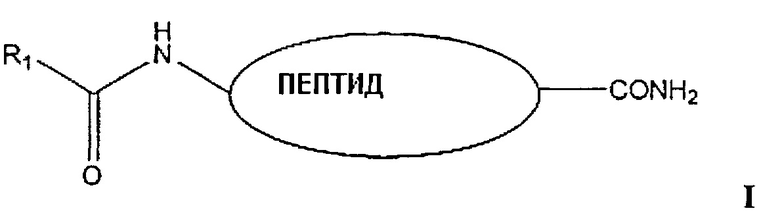
(где R1 представляет линейный или разветвленный С3-С100-алкил, предпочтительно С4-С30-алкил, при необходимости замещенный галогеном, гидроксилом, алкокси-группой, аминогруппой, алкиламино- или диалкиламиногруппой, сульфатом или фосфатом, который может быть насыщенным, или мононенасыщенным, или диненасыщенным, например 18:0, 24:0 и 24:1. Жирные кислоты, представляющие интерес, включают (перечисленные здесь примеры не являются ограничивающими) пальмитиновую, стеариновую, арахидовую, лауриловую, миристиновую, миристолеиновую, пальмитолеиновую, сапиеновую, олеиновую, линолевую, α-линоленовую, арахидоновую, эйкозапентаеновую, эруковую, докозагексаеновую кислоты и др.
Аналоги по данному изобретению обеспечивают эффективность in vivo, которая держится по меньшей мере вдвое дольше, чем у природных пептидов; она может быть в 5, 10, 20 или более раз дольше. Увеличение активности in vivo или in vitro можно измерить, определяя стабильность полипептида, продолжительность физиологического эффекта и т.п. Особый интерес представляет гипотензивный эффект: единичная доза аналога пептида эффективно снижает систолическое давление на по меньшей мере 10%, причем кровяное давление держится на пониженном уровне в течение по меньшей мере около одного часа, по меньшей мере около 2 часов, по меньшей мере около 3 часов, по меньшей мере около 4 часов или более.
Интермедины и адреномедуллины являются лигандами рецепторов CLR/RAMP, которые в результате связывания с ними активируются. Активация интермедином приводит к высвобождению пролактина, регуляции высвобождения гормона роста, а в сосудистой системе его эффекты включают снижение кровяного давления и расширение сосудов. Таким образом, интермединовый сигнал, опосредуемый CRLR, предназначен для регуляции процессов, связанных с расширением периферических сосудов. В сосудистой системе активация адреномедуллином приводит к эффектам, включающим снижение кровяного давления и расширение сосудов. Таким образом, адреномедуллиновый сигнал, опосредуемый CRLR, предназначен для регуляции процессов, связанных с расширением периферических сосудов.
Для модификации способами по данному изобретению можно использовать природные интермедии, адреномедуллин или их варианты. Пептиды, представляющие интерес, включают фрагменты, состоящие из по меньшей мере 12 смежных аминокислотных остатков, чаще по меньшей мере из 20 смежных аминокислотных остатков, и могут содержать 30, 35, 40 или более аминокислотных остатков, вплоть до пептида полной длины, и могут быть даже длиннее, включая другие аминокислотные последовательности, присутствующие в белке-предшественнике. Возможны также делеции аминокислотных остатков протяженностью от одного остатка до 10; возможны дополнительные делеции 10-15 или более аминокислотных остатков. На N-конце возможны меньшие делеции - от 1 до 5 аминокислотных остатков. Пептиды, представляющие интерес для терапевтических целей, могут включать весь или почти весь предлагаемый пептид или могут содержать его фрагменты, сохраняющие биологическую активность интермедина.
Последовательность полипептида может быть изменена целенаправленным образом способами, известными в данной области техники. Как правило, нужный полипептид в основном сходен с предлагаемыми в настоящем документе аминокислотными последовательностями, т.е. отличается по меньшей мере одним аминокислотным остатком, может отличаться по меньшей мере двумя аминокислотными остатками, но не более чем примерно 10 аминокислотными остатками. Изменения аминокислотной последовательности могут заключаться в заменах, вставках или делециях. Для определения ключевых аминокислотных остатков можно использовать сканирующий мутагенез, благодаря которому систематически встраивается аланин или другие аминокислотные остатки. Замены консервативных аминокислотных остатков обычно включают замены в пределах следующих групп: (глицин, аланин); (валин, изолейцин, лейцин); (аспарагиновая кислота, глутаминовая кислота); (аспарагин, глутамин); (серин, треонин); (лизин, аргинин) или (фенилаланин, тирозин).
Интерес представляют модификации, которые не влияют на первичную последовательность; они включают образование химических производных полипептидов, например ацетилированием или карбоксилированием. Сюда также относится модификация гликозилирования, например изменение локализации присоединенных к полипептиду остатков Сахаров в процессе его синтеза и процессинга или на более поздних этапах процессинга, например, путем воздействия на полипептид ферментов, влияющих на гликозилирование, - таких, как ферменты гликозилирования и дегликозилирования у млекопитающих. Сюда также относятся аминокислотные последовательности, содержащие фосфорилированные аминокислотные остатки, например фосфотирозин, фосфосерин или фосфотреонин.
Предлагаемое изобретение включает также полипептиды, модифицированные с использованием обычных молекулярно-биологических методов и химического синтеза таким образом, что увеличивается их устойчивость к протеолитическому расщеплению или оптимизируется растворимость, или они становятся более пригодными в качестве терапевтического агента. Например, остов полипептида может быть замкнут в кольцо для увеличения стабильности (см. Friedler et al. (2000) J. Biol. Chem. 275:23783-23789). Аналоги таких полипептидов включают такие молекулы, которые содержат аминокислотные остатки, отличные от природных L-аминокислот, например D-аминокислоты или не встречающиеся в природе синтетические аминокислоты.
Предлагаемые пептиды могут быть получены путем синтеза in vitro с использованием обычных методов, известных в данной области техники. В продаже имеется различное оборудование для синтеза, например автоматический синтезатор производства фирм Applied Biosystems, Inc. (Фостер-Сити, шт. Калифорния, США), Beckman и др. С помощью синтезаторов можно заменить природные аминокислоты на не встречающиеся в природе. Конкретная аминокислотная последовательность и специфика получения определяются соображениями удобства, экономичности, требованиями чистоты и проч.
При желании в процессе синтеза или экспрессии пептида в него могут быть внедрены различные группы, которые обеспечивают связывание с другими молекулами или с какой-либо поверхностью. Так, из цистеина можно сделать тиоэфиры, гистидин использовать для связывания с комплексами, содержащими ионы металлов, из карбоксильных групп можно образовать амиды или сложные эфиры, из аминогрупп - амиды и проч.
Предлагаемые полипептиды можно также выделить и очистить стандартными методами синтеза с использованием рекомбинантных молекул. Получают лизат организма, осуществляющего экспрессию нужного вещества, и этот лизат подвергают очистке с помощью высокоэффективной жидкостной хроматографии, эксклюзионной хроматографии, гель-электрофореза, аффинной хроматографии или иных методов очистки. Используемые композиции в большинстве своем содержат по меньшей мере 20% по массе желаемого продукта, чаще по меньшей мере около 75% по массе, предпочтительно по меньшей мере около 95% по массе, а для терапевтических целей, как правило, по меньшей мере около 99,5% по массе - в зависимости от загрязнений, обусловленных методом получения продукта и его очистки. Обычно долю в процентах рассчитывают относительно суммарного количества белка.
Применение интермедина/адреномедуллина
В свете фармакологической активности интермедина и адреномедуллина очевидны многочисленные клинические показания, которые включают, например (приведенные примеры не являются ограничивающими) гипертензию, в частности гипертензию при беременности, легочную артериальную гипертензию, гипертензию, связанную с диабетом, и др.; бронхолегочную дисплазию, заживление ран и проч. Например, клинические показания к применению интермедина и адреномедуллина можно использовать, в частности, для лечения гипертензии. Аналоги по данному изобретению обеспечивают снижение кровяного давления, например систолического давления - по меньшей мере на около 5%, по меньшей мере на около 10%, по меньшей мере на около 15%, по меньшей мере на около 20% или более, причем на частоте сердечных сокращений это не сказывается.
Такое заболевание, как гипертензия, без лечения сильно повышает риск атеросклеротических изменений в сердечно-сосудистой системе. Среди взрослых американцев, по некоторым оценкам, каждый четвертый страдает гипертензией. Это состояние встречается у больных диабетом вдвое чаще, чем у остальных людей. Заболеваемость гипертензией увеличивается с возрастом.
Диагноз «гипертензия» нельзя ставить на основании однократного измерения кровяного давления. Первоначальные данные о повышенных значениях должны быть подтверждены по меньшей мере двумя последовательными определениями, сделанными врачом в течение одной недели или более; диагноз «гипертензия» ставится, если среднее диастолическое давление оказывается не менее 90 мм рт.ст., систолическое давление - не менее 140 мм рт.ст. Особенно внимательно следует диагностировать гипертензию у индивидов с диабетом, так как у них кровяное давление больше варьирует и гораздо выше вероятность изолированной систолической гипертензии. У этих пациентов рекомендуется добиваться кровяного давления менее 130/85 мм рт.ст.
Для того, чтобы контролировать повышенное кровяное давление нужны не только определенные изменения питания, но и лечение фармакологическими средствами. Для снижения кровяного давления можно вводить индивиду пептиды, предлагаемые в данном изобретении. Вторичным эффектом ослабления гипертензии становится сокращение отеков и объема воспалительного экссудата.
Фармацевтические композиции, содержащие аналоги интермедина или адреномедуллина, полезны в качестве кардиопротекторов, например для облегчения ишемического поражения или сокращения обширности инфаркта миокарда вследствие ишемии сердечной мышцы. Насущной задачей современной кардиологии является разработка новых терапевтических агентов, способных ограничить степень поражения сердечной мышцы, т.е. обширность инфаркта миокарда вследствие острой ишемии сердечной мышцы. Представляет значительный интерес также дополнительная защита миокарда, которую можно было бы сочетать с тромболитической терапией или применять в отдельности, поскольку ретроспективные эпидемиологические исследования показали, что смертность в течение первого года после перенесенного инфаркта миокарда связана, по всей видимости, с изначальными размерами инфарктной зоны.
Ишемия миокарда является результатом нарушения равновесия между снабжением сердечной мышцы кислородом и ее потребностями в нем; она включает вазоспастическую дисфункцию миокарда и дисфункцию при физической нагрузке. Ишемию при физической нагрузке, как правило, относят на счет наличия критического атеросклеротического сужения крупных коронарных сосудов, приводящего к ослаблению субэндокардиального кровотока. Вазоспастическая ишемия связана с очаговым спазмом, возникновение которого не связано с физической нагрузкой или стрессом. Спазм - это, скорее, резкое возрастание сосудистого тонуса.
Соединения по данному изобретению обычно можно вводить пациентам. нуждающимся в кардиопротективной терапии, перорально или парентерально. Дозировка должна быть такой, чтобы гарантировать максимальную терапевтическую реакцию до тех пор, пока не наступит улучшение, а затем поддерживать минимально эффективный уровень, приносящий облегчение. Таким образом, дозировка, вообще говоря, нужна такая, которая терапевтически эффективна в смысле обеспечения кардиопротективного действия, т.е. ослабления ишемического поражения или обширности инфаркта миокарда вследствие ишемии сердечной мышцы. Представляется вероятным также, что пептиды по данному изобретению будут полезны в качестве лекарственной формы для инъекций, которую можно вводить при неотложных состояниях у больных с ишемией миокарда, и др.
Интермединовые или адреномедуллиновые пептиды и их производные также находят применение для уменьшения отеков, например при ревматоидном артрите, в случае вторичного отека при опухолях мозга или лучевой терапии при лечении рака, при инсульте, травме головы или повреждении спинного мозга, при послеоперационных отеках, астме и других заболеваниях дыхательной системы, при кистозном отеке макулы.
Препараты
Соединения по данному изобретению можно включать в различные препараты для терапевтического введения. В частности, агенты, влияющие на активность интермедина или адреномедуллина, или интермединовые или адреномедуллиновые полипептиды и их аналоги включаются в состав препаратов для введения пациентам с целью лечения дисфункции интермедина или адреномедуллина, когда активность того или другого неприемлемо высокая или низкая. Более конкретно, соединения по данному изобретению можно включать в различные фармацевтические композиции, сочетая их с подходящими фармацевтически приемлемыми носителями или разбавителями; они могут входить в состав препаратов в твердой, полужидкой, жидкой или газообразной форме, например таблеток, капсул, порошков, гранул, мазей, растворов, суппозиториев, инъекционных препаратов, вдыхаемых препаратов, гелей, микросфер и аэрозолей. Введение соединений по данному изобретению может осуществляться различными путями, включая пероральный, буккальный, ректальный, парентеральный внутрибрюшинный, интрадермальный, трансдермальный, интратрахеальный и проч. Будучи введен в организм, активный агент может действовать системно или же локализованно при использовании имплантируемого средства, удерживающего дозу активного вещества в месте имплантации.
В составе фармацевтических лекарственных форм соединения по данному изобретению могут присутствовать в виде фармацевтически приемлемых солей, они могут использоваться сами по себе или в подходящей связи или комбинации с другими фармацевтически активными веществами. Ниже обсуждаются способы и эксипиенты, приведенные только в качестве примеров, никак не ограничивающих объем изобретения.
В препаратах для перорального введения в форме таблеток, порошков, гранул или капсул соединения по данному изобретению могут использоваться сами по себе или в сочетании с подходящими дополнительными компонентами, например с такими обычными ингредиентами, как лактоза, манит, кукурузный или картофельный крахмал; со связующими агентами, например кристаллической целлюлозой, производными целлюлозы, аравийской камедью, кукурузным крахмалом или желатином; с дезинтегрирующими агентами, например кукурузным или картофельным крахмалом или натриевой солью карбоксиметилцеллюлозы; с агентами, улучшающими скольжениен, например тальком или стеаратом магния; а также, по желанию, с разбавителями, забуферивающими агентами, увлажняющими агентами, консервантами и ароматизаторами.
Соединения по данному изобретению могут быть включены в состав препаратов для введения путем инъекций; при этом их растворяют, суспендируют или эмульгируют в водном или неводном растворителе, например в растительном или других подобных маслах, синтетических глицеридах алифатических кислот, сложных эфирах высших алифатических кислот или пропиленгликоле; по желанию могут быть добавлены такие компоненты, как солюбилизирующие агенты, агенты, обеспечивающие нужное осмотическое давление, суспендирующие агенты, эмульгирующие агенты, стабилизирующие агенты и консерванты.
Соединения по данному изобретению могут использоваться в составе аэрозолей для введения путем вдыхания. Соединения по данному изобретению могут входить в состав такого препарата вместе с подходящим сжатым пропеллентом, например дихлордифторметаном, пропаном, азотом и проч.
Также соединения по данному изобретению можно включать в состав суппозиториев, смешивая их с различными основами, например с эмульгирующими основами или водорастворимыми основами. Соединения по данному изобретению могут вводиться пациенту ректально в составе суппозитория. Такой суппозиторий может содержать такие носители, как кокосовое масло, карбовакс и политиленгликоли, которые плавятся при температуре тела, но отвердевают при комнатной температуре.
Возможно получение таких единичных лекарственных формы для перорального или ректального введения, как сиропы, эликсиры и суспензии, в случае которых каждая единица дозирования, например чайная ложка, столовая ложка, таблетка или суппозиторий, содержит заранее определенное количество композиции, включающей одно или более соединений по данному изобретению. Аналогично, единичные лекарственные формы для введения путем инъекций, в том числе внутривенного, могут содержать соединение по данному изобретению в составе композиции в виде раствора в стерильной воде, физиологическом растворе или ином фармацевтически приемлемом носителе.
Имплантируемые средства с пролонгированным высвобождением лекарственного вещества хорошо известны в данной области техники. Имплантируемые препараты могут быть в форме микросфер, таблеток или стержней и др., из биоразлагаемых или не биоразлагаемых полимеров. Например, полимеры молочной кислоты и/или гликолевой кислоты образуют постепенно распадающийся материал, хорошо переносимый организмом. Имплантируемый препарат помещается поблизости от места инфекции, так что локальная концентрация активного агента там выше, чем в других участках организма.
Термин «единичная лекарственная форма» в настоящем документе употребляется применительно к физически дискретным единицам, пригодным в качестве вместилища отдельных доз для пациента (человека или животного), причем каждая такая единица содержит заранее определенное количество соединений по данному изобретению, рассчитанное так, чтобы оно было достаточным для возникновения желаемого эффекта, и фармацевтически приемлемый разбавитель, носитель или средство доставки. Характеристика новых единичных лекарственных форм по данному изобретению зависит от конкретного соединения, присутствующего в препарате, его фармакодинамики и запланированного эффекта в организме пациента.
Фармацевтически приемлемые эксипиенты - средства доставки, дополнительные ингредиенты, носители или разбавители - вполне доступны для массового использования. Также доступны фармацевтически приемлемые вспомогательные ингредиенты, например забуферивающие агенты, вещества, обеспечивающие нужное осмотическое давление, стабилизирующие агенты, увлажняющие агенты и проч.
В случае системного введения разовая доза составляет, как правило, от 0,1 мкг до 100 мг на 1 кг массы тела пациента. Режим приема может быть, например, такой: по одной обычной таблетке 2-6 раз в день либо по одной капсуле или таблетке с медленным высвобождением один раз в день, причем содержание активного ингредиента тогда пропорционально выше. Эффект медленного высвобождения достигается с помощью материала капсулы, растворяющегося при разных значениях рН, за счет осмотического давления или любым другим способом контролируемого высвобождения.
Для специалистов в данной области техники ценно то, что дозировка может изменяться в зависимости от конкретного соединения, выраженности симптомов и восприимчивости индивида к побочным эффектам. Среди соединений по данному изобретению одни действуют более мощно, чем другие. Определение предпочтительной дозировки для конкретного соединения по данному изобретению не должно затруднить специалистов в данной области техники, располагающих для этого различными средствами. Предпочтительным средством представляется измерение физиологического эффекта взятого соединения.
Для доставки белков in vivo и in vitro можно использовать липосомы. Для нужд данного изобретения липосомы можно получать любым из различных обычно применяемых для получения липосом методов. Такие методы, включая воздействие ультразвуком, хелатный диализ (удаление детергента диализом), гомогенизацию, впрыскивание растворителя вместе с экструзией, замораживанием-оттаиванием, микроэмульгированием и др., хорошо известны специалистам в данной области техники. Эти методы, а также другие обсуждаются, например, в патенте США №4,728,578, заявке на патент Великобритании 2193095 А, патенте США №4,728,575, патенте США №4,737,323, международной заявке PCT/US85/01161, в работах Mayer et al., Biochimica et Biophysica Acta, Vol.858, pp.161-168 (1986), Hope et al., Biochimica et Biophysica Acta, Vol.812, pp.55-65 (1985),в патенте США №4,533,254, в работах Mahew et al., Methods In Enzymology, Vol.149, pp.64-77 (1987), Mahew et al., Biochimica et Biophysica Acta, Vol.75, pp.169-174 (1984), Cheng et al., Investigative Radiology, Vol.22, pp.47-55 (1987). Для получения липосомных конструкций можно применять систему без растворителя, подобную описанной в международной заявке PCT/US85/01161.
Материалы, используемые для получения липосом в данном изобретении включают любые подходящие для создания липосом материалы или их комбинации, известные специалистам в данной области техники, липиды используются природного происхождения либо синтетические. Такие материалы включают (перечисленное здесь не ограничивает объем изобретения) липиды, например холестерин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилглицерин, фосфатидную кислоту, фосфатидилинозит, лизолипиды, жирные кислоты, сфингомиелин, гнликосфинголипиды, глюколипиды, гликолипиды, сульфатиды, липиды с присоединенными амидной связью, эфирной или сложноэфирной связью жирными кислотами, полимеризующиеся липиды и их комбинации. Как известно специалистам в данной области техники, липосомы можно синтезировать обычно используемыми для этой цели методами в отсутствие или в присутствии включаемого в них гликолипида, сложного углевода, белка или синтетического полимера. Поверхность липосомы тоже можно модифицировать полимером, например полиэтиленгликолем (PEG), применяя известные специалистам в данной области техники методы. Можно использовать липиды любого типа, нужно только, чтобы этот липид или комбинация липидов и вещества, включенные в липидный матрикс, в физиологических условиях образовывали двойной слой. Как известно специалистам в данной области техники, состав липосом можно варьировать для того, чтобы влиять на их распределение в организме и выведение.
В липосомных структурах обычно двуслойная мембрана ограничивает некоторый объем, заполненный водной фазой, и создает барьер проницаемости между этим объемом и окружающим раствором. Липиды, диспергированные в водной фазе, спонтанно образуют двойные слои таким образом, что углеводородные хвосты молекул направлены внутрь слоя, а полярные головы обращены наружу, взаимодействуя с водой. Обычно достаточно просто хорошо встряхнуть смесь липидов и водного раствора, чтобы сформировались многослойные везикулы (MLV), в которых много двойных липидных слоев образуют структуру наподобие луковицы диаметром 1-10 мкм (1000-10000 нм). Воздействие ультразвука или применение других методов приводит к образованию из таких структур однослойных везикул (UV) со средним диаметром около 30-300 нм. Однако, если, например, нужно, чтобы липидные везикулы максимально долго находились в кровотоке, оптимальным считается диаметр 50-200 нм. Реальный равновесный диамер определяется в основном природой взятого фосфолипида и количеством включенных в везикулу других липидов, например холестерина. Стандартные методы образования липосом хорошо известны в данной области техники; например, методы производства липосом в коммерческих целях описаны в патентах США №№4,753,788 и 4,935,171.
Полимеризованные липосомы представляют собой образующиеся путем самосборки агрегаты липидных молекул; они описаны, например, в патентах США №№5,512,294, 6,132,764, и заявке на патент США №20020071843. В полимеризуемых липидах группы гидрофобных хвостов модифицированы группами, способными обеспечить полимеризацию, например диацетиленовой группой, которая необратимо образует поперечные сшивки, т.е. происходит полимеризация, при воздействии ультрафиолетового излучения или иных воздействиях, вызывающих возникновение радикалов, анионов или катионов; в то же время распределение функциональных групп на поверхности липосомы сохраняется. Образующаяся в результате полимеризованная липосомная частица стабилизируется, т.е. предотвращается ее слияние с клеточными мембранами или с другими липосомами, а также ферментативное расщепление. Размеры полимеризованных липосом можно регулировать путем экструзии или с помощью других методов, известных специалистам в данной области техники. Полимеризованные липосомы могут состоять из полимеризованных липидов, но также могут включать насыщенные и неалкиновые ненасыщенные липиды. Полимеризованные липосомы могут состоять из смеси липидов, что обеспечивает наличие различных функциональных групп на гидрофильной поверхности. Например, некоторые группы гидрофильной головы молекулы могут нести функциональные поверхностные группы: биотин, амины, цианогруппу, карбоновые кислоты, изотиоцианаты, тиолы, дисульфиды, альфа-галокарбонильные соединения, альфа, бета-ненасыщенные карбонильные соединения и алкилгидразины. Эти группы можно использовать для присоединения нуклеотидных последовательностей.
Для применения в описанных выше лекарственных составах интермедии или адреномедуллин или их производные можно, синтезировав, хранить в твердом виде - в форме лиофилизованного порошка, который непосредственно перед использованием разводят в фармацевтически приемлемой жидкости. Такая форма предпочтительна, так как специалистам в данной области известно, что лиофилизованные препараты, как правило, сохраняют фармацевтическую активность лучше, чем жидкие.
Также интермедии или адреномедуллин и их аналоги можно применять местно накожно и в аэрозольной форме.
Или же пептиды по данному изобретению могут входить в состав жидких препаратов, например содержащих буферный раствор в концентрации от около 1 мМ до около 50 мМ для поддержания нужного рН; анион в указанном буферном растворе можно выбирать из группы, состоящей из ацетата, фосфата, карбоната, сукцината, цитрата, бората, тартрата, фумарата и лактата; также содержащих спирт, который может быть выбран из группы, состоящей из маннита, сорбита, рибита, арабита, ксилита, инозита, галактитола, метанола, этанола и глицерина. Другие дополнительные ингредиенты могут включать аминокислоты, например метионин, аргинин, лизин, глутаминовую кислоту, цистеин, глутатион и проч., которые присутствуют обычно в концентрации от около 1 мМ до около 100 мМ. При необходимости в состав препарата включают также различные сахара, например глюкозу, сахарозу, лактозу, фруктозу, трегалозу, маннозу и проч. Дополнительные сахара присутствуют обычно в концентрации от около 1% до около 10%.
Эксперименты
Приведенные ниже примеры имеют целью предоставить специалистам в данной области техники полное описание осуществления и применения изобретения и не ограничивают объем того, что авторы считают своим изобретением; эти примеры вовсе не означают, что были осуществлены только описанные в них эксперименты и что эти эксперименты исчерпывают все возможности. Авторы изобретения старались гарантировать точность использованных численных значений (например, количество, температура и проч.), но следует учитывать возможность возникновения некоторых погрешностей и отклонений экспериментальных данных. Если не указано иного, то доли приведены как отношение по массе, молекулярная масса представляет среднюю молекулярную массу, температура дается в градусах Цельсия, давление атомосферное или близкое к нему.
Пример 1
Модификация интермедина
Пептиды были получены с помощью автоматического пептидного синтезатора производства компании Applied Biosystems на биотехнологической базе белков и нуклеиновых кислот (PAN Facility) Станфордского университета стандартным твердофазным методом с использованием защитных групп Fmoc (Fields GB, Noble RL. Solid phase peptide synthesis utilizing 9-fluorenylmethoxycarbonyl amino acids. Int J Pept Protein Res 35: 161-214, 1990). Модифицированные пептиды получали путем введения остатка лизина, присоединенного к защищенной Fmoc [С16]пальмитиновой кислоте (Lys(PAL)) в процессе пептидного синтеза. Чистоту определяли путем высокоэффективной жидкостной хроматографии на обращенной фазе, после чего продукт характеризовали путем масс-спектрометрии с ионизацией распылением в электрическом поле.
Биологическая активность in vivo нативного (немодифицированного) и модифицированного интермедина представлена на фигурах 1-4. Интермединовые пептиды растворяли в физиологическом растворе, содержащем 10-20% диметилсульфоксида (DMSO), в концентрации 10 микромолей на 1 л. Перед инъекцией аликвоты пептидов растворяли в забуференном фосфатом физиологическом растворе (PBS) до конечного объема 100 мкл. У неанестезированных крыс линии со спонтанной гипертензией (SHR) возрастом 9-16 недель, приученных к процедуре эксперимента, определяли кровяное давление. Измерения систолического давления проводили непрямым методом при помощи программируемой неинвазивной системы с использованием хвостовой манжеты (Kent Scientific Corporation). После подсоединения датчика давления животных не тревожили в течение 10 минут, после чего измеряли базовый уровень давления, что занимало 15-20 минут. Затем крысам вводили путем внутрибрюшинной инъекции различные дозы пептидов либо физиологический раствор с 10% DMSO. Регистрировали значения кровяного давления и частоту сердечных сокращений в течение 20-40 минут с интервалом 30 секунд. Изменения кровяного давления рассчитывали как среднее измерений, сделанных за данный промежуток времени. У контрольных особей базальный уровень кровяного давления сравним с таковым у крыс, получавших интермединовый пептид.
Как показано на фигурах 1А-1С, когда крысам вводили интермедии, модифицированный пальмитиновой кислотой (IMD-PA), и потом определяли кровяное давление в зависимости от времени, то отмечалось значительное и длительное понижение систолического давления. Гипотензивный эффект этого пептида in vivo держался на протяжении более пяти часов, тогда как немодифицированный интермедин понижал давление менее чем на 1 час. Результаты с немодифицированным пептидом представлены на фигуре 2, данные, полученные у контрольных особей, которым вводили PBS, - на фигуре 3.
Пример 2
Модификация адреномедуллина
Пептиды были получены с помощью автоматического пептидного синтезатора производства компании Applied Biosystems на биотехнологической базе белков и нуклеиновых кислот (PAN Facility) Станфордского университета стандартным твердофазным методом с использованием защитных групп Fmoc (Fields GB, Noble RL. Solid phase peptide synthesis utilizing 9-fluorenylmethoxycarbonyl amino acids. Int J Pept Protein Res 35: 161-214, 1990). Модифицированные пептиды получали путем введения остатка лизина, присоединенного к защищенной Fmoc [С16]пальмитиновой кислоте (Lys(PAL)) в процессе пептидного синтеза. Чистоту определяли путем высокоэффективной жидкостной хроматографии на обращенной фазе, после чего продукт характеризовали путем масс-спектрометрии с ионизацией распылением в электрическом поле.
Биологическая активность адреномедуллина in vitro. Типичная иллюстрация стимулирующего эффекта адреномодуллина (ADM) и модифицированного адреномедуллина (ADM-PA) представлена на фигуре 7.
Биологическая активность аналога адреномедуллина in vivo. Адреномедуллиновые пептиды растворяли в физиологическом растворе, содержащем 10-20% диметилсульфоксида (DMSO), в концентрации 10 микромолей на 1 л. Перед инъекцией аликвоты пептидов растворяли в забуференном фосфатом физиологическом растворе (PBS) до конечного объема 200 мкл. У неанестезированных крыс линии со спонтанной гипертензией (SHR) возрастом 9-16 недель, приученных к процедуре эксперимента, определяли кровяное давление. Измерения систолического давления проводили непрямым методом при помощи программируемой неинвазивной системы с использованием хвостовой манжеты (Kent Scientific Corporation). После подсоединения датчика давления животных не тревожили в течение 10 минут, после чего измеряли базовый уровень давления, что занимало 10-15 минут. Затем крысам вводили путем внутрибрюшинной инъекции различные дозы пептидов либо физиологический раствор с 10% DMSO. Регистрировали значения кровяного давления и частоту сердечных сокращений в течение 20-40 минут с интервалом 20 секунд. Изменения кровяного давления рассчитывали как среднее измерений, сделанных за данный промежуток времени.
Полученные данные показывают динамику систолического давления у крыс линии SHR после введения пептида ADM-PA либо физиологического раствора. (См. Roh et al. Mol Endocrinol. 2005 Nov; 19(11):2824-38). Как демонстрируют фигуры 5А-5С, когда крысам вводят 100 нмоль/кг массы тела модифицированного адреномедуллина (ADM-PA) и измеряют кровяное давление в зависимости от времени, отмечается значительное и длительное снижение систолического давления. Период полужизни пептида ADM-PA гораздо больше, чем у ADM, как свидетельствуют результаты определения иммунореактивного ADM путем твердофазного иммуноферментного анализа (ELISA) (фигура 8).
Все публикации и патентные заявки, цитируемые в настоящем описании включаются в него путем отсылки, как если бы о каждой отдельной публикации или патентной заявке особо и в отдельности указывалось бы, что она включается в настоящий документ путем отсылки.
В настоящем документе данное изобретение описано на примере конкретных воплощений, которые автор данного изобретения находит или полагает содержащими предпочтительные варианты практического осуществления изобретения. Для специалистов в данной области техники в свете настоящего описания ясно, что в конкретных воплощениях, приведенных в качестве примера, возможны многочисленные модификации и изменения, не отклоняющиеся от задуманного автором объема изобретения. Кроме того, благодаря рассмотрению биологической функциональной эквивалентности возможны изменения в белковой структуре без качественного или количественного влияния на биологическое действие. Все такие изменения входят в объем прилагаемой формулы изобретения.





Настоящее изобретение относится к области биотехнологии, конкретно к длительно действующим аналогам–агонистам рецепторов, подобных рецептору кальцитонина (CLR) и белков, модифицирующих активность рецептора (RAMPs). Изобретение позволяет получить конъюгат адреномедуллинового или интермединового пептида с органической жирной кислотой, имеющий продолжительный период полужизни in vivo и способный оказывать противогипертоническое и кардиопротективное действие на эндотелиальные клетки. Полученный конъюгат или его фармацевтически приемлемую соль используют в составе фармацевтической композиции для снижения кровяного давления в периферических сосудах у индивида. 6 н. и 3 з.п. ф-лы, 8 ил., 2 пр.
1. Длительно действующий конъюгат, который представляет собой агонист рецептора, образованного рецептором, подобным рецептору кальцитонина (CLR), и белками, модифицирующими активность рецептора (RAMPS), где конъюгат имеет структуру: 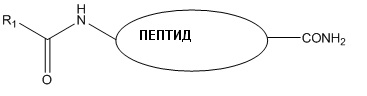
где пептид является интермединовым или адреномедуллиновым пептидом, имеющим последовательность, представленную в SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:7 или SEQ ID NO:6, соответственно,
где R1 выбирают из пальмитата, стеарата, арахидовой кислоты, лауриловой кислоты, миристиновой кислоты, миристолеиновой кислоты, пальмитолеиновой кислоты, сапиеновой кислоты, олеиновой кислоты, линолевой кислоты, альфа-линоленовой кислоты, арахидоновой кислоты, эйкозапентаеновой кислоты, эруковой кислоты и докозагексаеновой кислоты,
где конъюгат имеет время полужизни в сыворотке крови более 1,5 часов.
2. Конъюгат по п.1, где пептид имеет последовательность, представленную в SEQ ID NO:7, и R1 является пальмитатом.
3. Конъюгат по п.1, где пептид имеет последовательность, представленную в SEQ ID NO:6, и R1 является пальмитатом.
4. Фармацевтическая композиция, имеющая противогипертоническое действие и содержащая терапевтически эффективную дозу конъюгата по любому из пп. 1-3 и фармацевтически приемлемый эксципиент.
5. Фармацевтическая композиция, имеющая защищающее эндотелиальные клетки действие и содержащая терапевтически эффективную дозу конъюгата по любому из пп. 1-3 и фармацевтически приемлемый эксципиент.
6. Фармацевтическая композиция, имеющая кардиопротективное действие и содержащая терапевтически эффективную дозу конъюгата по любому из пп. 1-3 и фармацевтически приемлемый эксципиент.
7. Применение фармацевтической композиции по пп.4-6 в создании медикамента для доставки длительно действующего агониста рецептора CLR/RAMP животному-хозяину, в течение продолжительного периода времени.
8. Применение фармацевтической композиции по п.4 в создании медикамента для снижения кровяного давления в периферических сосудах у индивида, в котором пептид поступает в организм через промежутки времени, большие, чем раз в четыре часа.
9. Применение по п.8, в котором пептид поступает в организм через промежутки времени большие, чем раз в 12 часов или в течение продолжительного периода времени.
| WU R | |||
| et al., Human vasoactive adrenomedullin and its binding protein rescue experimental animalsfrom shock, Peptides J., 2008, v | |||
| Солесос | 1922 |
|
SU29A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Кухонный очаг из глиняных и т.п. звеньев | 1919 |
|
SU1223A1 |
| US 2008207501 A1, 28.08.2008 | |||
| US 2010048871 A1, 25.02.2010 | |||
| MEERAN K | |||
| et al., Circulating adrenomedullin does not regulate systematic blood pressure but increases plasms prolactin after intervenous infusion in humans: a pharmokinetic study, J.Clin | |||
| End.& Met., 1997, v | |||
| Машина для разделения сыпучих материалов и размещения их в приемники | 0 |
|
SU82A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| FRANKEL A.E | |||
| et al., Characterization of diphtheria fusion proteins targeted to the human interleukin-3 receptor, Protein Engineering, 2000, v | |||
| Насос | 1917 |
|
SU13A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| ПОДОГРЕВАТЕЛЬ ДЛЯ ИСПОЛЬЗОВАНИЯ ТЕПЛОТЫ ВЫХЛОПНЫХ ГАЗОВ ДЛЯ НАГРЕВА ВОДЫ | 1924 |
|
SU575A1 |
| EA 200701704 B1, 28.04.2009. | |||
Авторы
Даты
2018-08-23—Публикация
2012-04-05—Подача