Изобретение относится к области молекулярной биологии и медицине, и может быть использовано в клинической диагностике для детекции ДНК-мишеней.
Уровень техники
Полимеразная цепная реакция (ПЦР) с детекцией продуктов амплификации в режиме реального времени (Real-Time) за счет возможности проведения количественных оценок, высокой специфичности и чувствительности является одной из широко используемых технологий для решения различных генодиагностических задач. Распространенные схемы детекции на основе Real-Time ПЦР, такие как TaqMan, Molecular Beacon, имеют существенные ограничения по степени мультиплексирования: один канал детектирующего амплификатора - одна мишень, т.е., как правило, одновременно может быть определено не более шести искомых последовательностей (по числу каналов амплификатора). Перспективным направлением развития технологии ПЦР является разработка подходов, позволяющих повысить степень мультиплексирования диагностического теста.
Существует ряд способов для специфического определения искомой последовательности ДНК с использованием зондов, имеющих некомплементарный последовательности-мишени 5'-сегмент и комплементарный последовательности 3'-сегмент, обеспечивающий специфичность.
Например, в патенте US 5691142 описывается способ, в котором используется зонд с 5'-сегментом, некомплементарным последовательности-мишени и примыкающий к нему праймер со стороны 5'-сегмента вплотную к 3'-сегменту, в результате чего образуется структура, расщепляемая Taq-полимеразой. После отщепления высвободившийся 5'-сегмент гибридизуется с олигонуклеотидом (также входит в состав реакционной смеси), имеющим шпилечную структуру, с образованием структуры, расщепляемой за счет экзонуклеазной активности Taq-полимеразы. По накоплению расщепленного шпилечного олигонуклеотида определяется положительный сигнал. Недостатком способа является низкая эффективность амплификации сигнала.
В патенте US 7381532 описывается способ, в котором также образуется расщепляемая структура в результате взаимодействия праймера и зонда с 5'-сегментом, некомплементарным последовательности-мишени. По наличию сигнала от высвободившегося 5'-сегмента судят о наличии искомой последовательности, при этом детекцию осуществляют за счет системы FRET с двумя метками или же за счет дальнейшей амплификации.
В патенте US 6893819 описывается способ, в котором осуществляется расщепление зонда(-ов) в процессе полимеризации ДНК с высвобождением некомплементарного последовательности-мишени 5'-сегмента. Недостатком способа является линейное нарастание сигнала, что может в ряде случаев затруднить дифференциацию сигнала от фона.
В случае использования зондов даже с одной флуоресцентной меткой можно добиться дифференциации множества мишеней за счет анализа кривой плавления, тогда как классические схемы детекции, такие как TaqMan™, позволяют определить с использованием одной флуоресцентной метки лишь одну мишень.
В заявке US 2008241838 описан способ, в котором осуществляется расщепление зонда в процессе полимеризации ДНК с высвобождением некомплементарного последовательности-мишени 5'-сегмента, несущего флуоресцентную метку. Высвобожденный 5'-сегмент затем гибридизуется с "захватывающим" зондом. Для данного способа требуется, чтобы "захватывающий" зонд имел меньшую длину по сравнению с расщепляемым зондом и был иммобилизован на твердой фазе. Перечисленные ограничения необходимы для снижения вероятности гибридизации нерасщепленного исходного зонда с "захватывающим". Недостатками способа являются необходимость детекции на твердой фазе, что делает невозможным его использование в однофазных системах, таких как ПЦР с детекцией продуктов амплификации в режиме реального времени.
В патенте RU 2566562 описан способ (прототип), для которого реакционная ПЦР смесь в качестве специфических компонентов на одну мишень содержит:
- расщепляемый мишень-специфичный зонд, включающий, помимо специфичного 3'-сегмента, некомплементарный последовательности-мишени 5'-сегмент без флуоресцентных меток;
- сигнальный зонд, имеющий комплементарный участок с 5'-сегментом расщепляемого мишень-специфичного зонда, несущий гаситель на 5'-конце и флуорофор во внутреннем положении;
- пару праймеров.
В процессе прохождения ПЦР происходит расщепление мишень-специфичного зонда с высвобождением 5'-сегмента, который гибридизуется на сигнальный зонд, а затем удлиняется на нем за счет полимеразы с образованием дуплекса. При образовании дуплекса одноцепочечный сигнальный зонд расправляется, что приводит к повышению флуоресценции в результате пространственного удаления флуорофора и гасителя, входящих в его состав.
Описан и другой вариант реализации способа, наиболее близкий к заявляемому изобретению, заключающийся в ином расположении меток при том же составе олигонуклеотидов: расщепляемый мишень-специфичный зонд на 5'-конце несет флуорофор, сигнальный зонд несет на 3'-конце гаситель флуоресценции. В процессе прохождения ПЦР происходит расщепление мишень-специфичного зонда с высвобождением 5'-сегмента, несущего флуорофор, который гибридизуется на сигнальный зонд, а затем удлиняется на нем за счет полимеразы с образованием дуплекса, обладающего большей температурой плавления по сравнению с дуплексом мишень-специфичный зонд/сигнальный зонд, что исключает возможность появления ложноположительных результатов. При образовании дуплекса флуорофор высвобожденного 5'-сегмента и гаситель флуоресценции, входящий в состав сигнального зонда, сближаются, что приводит к понижению флуоресценции, регистрируемому детектирующим амплификатором.
После ПЦР проводится плавление продуктов реакции. По наличию дуплекса с определенной температурой плавления можно судить о присутствии соответствующей мишени. Температура плавления соответствующего дуплекса задается размером сигнального зонда, последовательность которого подбирается разработчиком для каждой мишени индивидуально. Степень мультиплексирования (количество детектируемых мишеней в одной пробирке) зависит от количества каналов амплификатора и от количества дуплексов, различающихся по температуре плавления, на каждый канал.
Недостатком способа является энзиматический этап образования дуплекса, так как ограничивает диапазон допустимых температур плавления дуплексов и усложняет в целом систему за счет необходимости оптимизации реакции образования дуплекса в рамках основного протокола ПЦР. Однако, данный способ коммерциализирован компанией Seegene, Южная Корея и на его основе разработана линейка мультиплексных тестов для выявления ряда инфекционных заболеваний человека.
На основе ПЦР в реальном времени разработано и реализуется на рынке множество тестов в мультиплексном формате.
Интерес к мультиплексному анализу обусловлен несколькими факторами - это снижение трудозатрат, увеличение скорости выполнения анализа, экономия реактивов, экономия биоматериала, экономия приборного времени.
Рост интереса к мультиплексному формату можно наблюдать по растущему числу публикаций на тему мультиплексной ПЦР и по увеличению количества выпускаемых тестов в мультиплексном формате на основе ПЦР в реальном времени в линейках производителей тест-систем.
Степень мультиплексирования диагностического теста на основе ПЦР в реальном времени может быть повышена за счет увеличения числа каналов детекции амплификатора, однако эта технология достигла потолка; так, современные амплификаторы имеют не более 7 каналов и существенного увеличения их числа не ожидается.
Таким образом, перспективным направлением развития технологии ПЦР является разработка подходов, позволяющих повысить степень мультиплексирования диагностического теста в рамках ограниченного числа каналов детекции, то есть позволяющих определять в одном канале две мишени и более.
Раскрытие изобретения
Задачей, на решение которой направлено заявляемое изобретение, является разработка способа специфической идентификации последовательностей ДНК, в том числе для определения нуклеотидных полиморфизмов, на основе ПЦР с детекцией продуктов амплификации в режиме реального времени, позволяющего идентифицировать более одной мишени в одном канале амплификатора с флуоресцентной детекцией. Разрабатываемый способ представляет собой мультиплексный дуплекс-опосредованный анализ на основе расщепляемых зондов (МДА).
Другой задачей, на решение которой направлено заявляемое изобретение является разработка набора на основе МДА для выявления одной или нескольких искомых последовательностей ДНК.
Поставленная задача решается за счет реализации МДА, заключающегося в использовании мишень-специфичного зонда, который расщепляется в процессе ПЦР в присутствии искомой последовательности ДНК (мишени) с высвобождением 5'-сегмента, образующего детектируемые дуплексы на этапе плавления с сигнальным зондом. Каждой мишени соответствует дуплекс с определенной температурой плавления, детектируемый в определенном канале амплификатора, за счет чего и осуществляется дифференциация мишеней. В МДА сокращается количество этапов генерации сигнала по сравнению с прототипной технологией РТОСЕ, что позволяет упростить оптимизацию системы и достичь более высокой степени мультиплексирования за счет расширения диапазона температур плавления для дуплексов.
Более конкретно, решение поставленной задачи осуществляется за счет разработки способа специфической идентификации, по меньшей мере, одной последовательности ДНК, включающего следующие этапы:
а) проведение полимеразной цепной реакции (ПЦР), для которой реакционная смесь включает
термостабильный фермент, обладающий 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью,
а также, для выявления каждой из идентифицируемых последовательностей ДНК, т.е. в качестве специфических компонентов на одну мишень (в качественном отношении), включает, по меньшей мере,
одну пару праймеров,
один олигонуклеотидный мишень-специфичный зонд, имеющий
3'-сегмент, комплементарный идентифицируемому участку ДНК и содержащий метку, и
5'-сегмент, некомплементарный идентифицируемой последовательности ДНК, последовательность которого выбирается так, чтобы дуплекс, который он образует с сигнальным зондом, имел заданную температуру плавления, и содержащий метку,
один олигонуклеотидный сигнальный зонд, комплементарный 5'-сегменту мишень-специфичного зонда и содержащий метку, идентичную или близкую по спектрам поглощения и испускания метке, содержащейся на 3'-сегменте мишень-специфичного зонда;
при этом в процессе прохождения ПЦР мишень-специфичный зонд, при гибридизации с идентифицируемой последовательностью ДНК, расщепляется указанным ферментом с высвобождением 5'-сегмента и разобщением входящих в состав мишень-специфичного зонда меток, а 5'-сегмент, в свою очередь, гибридизуется с сигнальным зондом, образуя с ним дуплекс;
б) проведение плавления реакционной смеси в диапазоне температур, включающем температуру плавления дуплекса, образуемого 5'-сегментом мишень-специфичного зонда и сигнальным зондом, подразумевающее пошаговое изменение температуры реакционной смеси со считыванием флуоресцентного сигнала на каждом шаге, при этом сигнал при плавлении дуплекса генерируется за счет разобщения меток, имеющих перекрывающиеся спектры поглощения и испускания, входящих в состав отщепленного 5'-сегмента мишень-специфичного зонда и сигнального зонда, а нерасщепленный мишень-специфичный зонд образует недетектируемый дуплекс с сигнальным зондом, при плавлении которого сигнал не генерируется, за счет присутствия в его составе двух взаимодействующих меток с перекрывающимися спектрами поглощения и испускания; при этом дифференциация дуплексов, соответствующих идентифицируемым различающимся участкам последовательностей ДНК, осуществляется по двум параметрам - канал детекции и/или температура плавления;
при этом возможны следующие варианты сочетания меток мишень-специфичного и сигнального зондов для каждой из идентифицируемых различающихся последовательностей ДНК:
1) 3'-сегмент мишень-специфичного зонда и сигнальный зонд в качестве метки несут в своем составе гаситель флуоресценции или репортерный флуорофор, а 5'-сегмент мишень-специфичного зонда - флуорофор, для которого спектр испускания перекрывается со спектром поглощения, этого гасителя флуоресценции или репортерного флуорофора,
2) 3'-сегмент мишень-специфичного зонда и сигнальный зонд несут в своем составе флуорофор, а 5'-сегмент мишень-специфичного зонда - гаситель флуоресценции или репортерный флуорофор, для которых спектр поглощения перекрывает спектр испускания этого флуорофора.
В некоторых вариантах воплощения изобретения осуществляют определение от 1 до 10 идентифицируемых последовательностей ДНК в одном канале амплификатора.
В некоторых вариантах воплощения изобретения проведение плавления реакционной смеси осуществляют с шагом от 0,01 до 1°С.
В некоторых частных вариантах воплощения изобретения проведение плавления реакционной смеси осуществляют с шагом 0,5°С.
В частных вариантах воплощения изобретения проведение плавления реакционной смеси осуществляют в диапазоне температур от 0°С до 100°С.
В некоторых вариантах воплощения изобретения температура плавления дуплекса, образуемого 5'-сегментом мишень-специфичного зонда и сигнальным зондом, по меньшей мере, для одной из идентифицируемых последовательностей ДНК, ниже температуры плавления праймеров, входящих в реакционную смесь.
В некоторых вариантах воплощения изобретения в качестве флуорофора или репортерного флуорофора используют, по меньшей мере, один из красителей карбоксифлуоресцеин (FAM), 6-карбоксиродамин (R6G), карбокси-Х-родамин (ROX), тетраметилкарбоксиродамин (TAMRA), 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин (6-JOE), тиадикарбоцианин, Су5™.
В некоторых вариантах воплощения изобретения в качестве гасителя флуоресценции используют гаситель флуоресценции серии BHQ и/или RTQ.
В частных вариантах воплощения изобретения в качестве термостабильного фермента, обладающего 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, используют Taq ДНК полимеразу.
В некоторых частных вариантах воплощения изобретения сигнальный зонд иммобилизован на твердую фазу.
В некоторых вариантах воплощения изобретения, при осуществлении идентификации, по меньшей мере, двух различающихся последовательностей ДНК, реакционная смесь включает, по меньшей мере, два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК, но содержат одинаковые флуорофоры, и
5'-сегменты которых различаются по температуре плавления, но содержат при этом одинаковые гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания вышеуказанного флуорофора,
два сигнальных зонда, содержащих флуорофоры, идентичные или близкие по спектрам поглощения и испускания флуорофорам 3'-сегментов мишень-специфичных зондов,
при этом дуплексы, образуемые сигнальными зондами и соответствующими комплементарными им 5'-сегментами мишень-специфичных зондов, имеют разную температуру плавления, по которой осуществляют дифференциацию различающихся идентифицируемых последовательностей ДНК.
В некоторых вариантах воплощения изобретения, при осуществлении идентификации, по меньшей мере, двух различающихся последовательностей ДНК реакционная смесь включает, по меньшей мере,
два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК и содержат при этом разные флуорофоры, и
5'-сегменты которых уникальны по последовательности, то есть способны образовать дуплексы только с соответствующими комплементарными им сигнальными зондами, но одинаковы по температуре плавления и содержат при этом разные гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания флуорофора 3'-сегмента этого же мишень-специфичного зонда,
два сигнальных зонда, содержащих флуорофоры, идентичные или близкие по спектрам поглощения и испускания флуорофорам 3'-сегментов соответствующих комплементарных им мишень-специфичных зондов;
при этом дуплексы, образуемые сигнальными зондами и соответствующими комплементарными им 5'-сегментами мишень-специфичных зондов, имеют одинаковую температуру плавления, а дифференциацию различающихся идентифицируемых последовательностей ДНК осуществляют за счет их детекции в различных каналах амплификатора.
В частных вариантах воплощения изобретения осуществляют специфическую идентификацию, по меньшей мере, одного полиморфизма в последовательности ДНК; в таких вариантах воплощения 3'-сегмент мишень-специфичного олигонуклеотидного зонда состоит из
аллель-детектирующего 5'-фрагмента (S), несущего метку, участок гибридизации которого содержит анализируемый полиморфный сайт, и последовательность которого комплементарна одному аллельному варианту, подлежащему специфической идентификации и
3'-фрагмента (D), последовательность которого комплементарна участку ДНК, прилегающему к сайту, содержащему идентифицируемый полиморфизм,
соединенных линкером, состоящим из, по меньшей мере, 1-10 нуклеозидмонофосфатов, обеспечивающих раздельную гибридизацию двух фрагментов,
при этом по длине 3'-сегмент совпадает с участком гибридизации указанной последовательности ДНК, выбранным для идентификации в нем полиморфизма,
при этом мишень-специфичный олигонуклеотидный зонд, в случае полной комплементарности его 3'-сегмента и указанной последовательности ДНК, в том числе в части 5'-фрагмента (S), соответствующего искомому аллельному варианту полиморфизма, расщепляется указанным ферментом с высвобождением 5'-сегмента и разобщением входящих в состав мишень-специфичного зонда меток, что в дальнейшем обеспечивает генерацию сигнала на этапе плавления;
напротив, в случае неполной комплементарности 3'-сегмента мишень-специфичного олигонуклеотидного зонда в части 5'-фрагмента (S) и указанной последовательности ДНК, мишень-специфичный зонд расщепляется указанным ферментом по линкеру L с высвобождением 5'-сегмента, связанного с 5'-фрагментом (S), без разобщения меток, входящих в состав мишень-специфичного зонда, что в дальнейшем на этапе плавления не приводит к генерации сигнала,
при этом возможны следующие варианты сочетания меток:
1) 5'-фрагмент (S) 3'-сегмента мишень-специфичного зонда и сигнальный зонд в качестве метки несут в своем составе гаситель флуоресценции или репортерный флуорофор, а 5'-сегмент мишень-специфичного зонда - флуорофор, для которого спектр испускания перекрывает спектр поглощения гасителя флуоресценции или репортерного флуорофора,
2) 5'-фрагмент (S) 3'-сегмента мишень-специфичного зонда и сигнальный зонд несут в своем составе флуорофор, а 5'-сегмент мишень-специфичного зонда - гаситель флуоресценции или репортерный флуорофор, для которых спектр поглощения перекрывает спектр испускания этого флуорофора.
В некоторых вариантах воплощения изобретения, при осуществлении идентификации, по меньшей мере, двух полиморфизмов в последовательности ДНК, по одному аллелю для каждого полиморфизма, реакционная смесь включает, по меньшей мере,
два различающихся мишень-специфичных зонда,
5'-фрагменты (S) 3'-сегментов каждого из которых комплементарны одному из аллелей, подлежащих специфической идентификации, но содержат одинаковые флуорофоры, и
5'-сегменты которых различаются по температуре плавления, но содержат при этом одинаковые гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания вышеуказанного флуорофора,
два сигнальных зонда, содержащих флуорофоры, идентичные или близкие по спектрам поглощения и испускания флуорофорам 5'-фрагментов (S) 3'-сегментов мишень-специфичных зондов,
при этом дуплексы, образуемые сигнальными зондами и соответствующими комплементарными им 5'-сегментами мишень-специфичных зондов, имеют разную температуру плавления, по которой осуществляют дифференциацию различающихся идентифицируемых полиморфизмов в последовательности ДНК.
В некоторых вариантах воплощения изобретения, при осуществлении идентификации, по меньшей мере, двух полиморфизмов в последовательности ДНК, по одному аллелю для каждого полиморфизма, реакционная смесь включает, по меньшей мере,
два различающихся мишень-специфичных зонда,
5'-фрагменты (S) 3'-сегментов каждого из которых комплементарны одному из аллелей, подлежащих специфической идентификации и содержат при этом разные флуорофоры, и
5'-сегменты которых уникальны по последовательности, то есть способны образовать дуплексы только с соответствующими комплементарными им сигнальными зондами, но одинаковы по температуре плавления и содержат при этом разные гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания флуорофора 3'-сегмента этого же мишень-специфичного зонда,
два сигнальных зонда, содержащих флуорофоры, идентичные или близкие по спектрам поглощения и испускания флуорофорам 5'-фрагментов (S) 3'-сегментов соответствующих комплементарных им мишень-специфичных зондов;
при этом дуплексы, образуемые сигнальными зондами и соответствующими комплементарными им 5'-сегментами мишень-специфичных зондов, имеют одинаковую температуру плавления, а дифференциацию различающихся идентифицируемых полиморфизмов в последовательности ДНК осуществляют за счет их детекции в различных каналах амплификатора.
В некоторых вариантах воплощения изобретения, при осуществлении идентификации, по меньшей мере двух аллельных вариантов одного полиморфизма в последовательности ДНК, реакционная смесь включает, по меньшей мере,
два различающихся мишень-специфичных зонда,
5'-фрагменты (S) 3'-сегментов каждого из которых комплементарны одному из идентифицируемых аллельных вариантов и содержат при этом одинаковые флуорофоры, а 3'-фрагменты (D) - идентичны по последовательности, и
5'-сегменты различаются температуре плавления, но содержат при этом одинаковые гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания вышеуказанного флуорофора, при этом дифференциацию аллельных вариантов осуществляют за счет их детекции в различных каналах амплификатора.
В некоторых вариантах воплощения изобретения, при осуществлении идентификации, по меньшей мере двух аллельных вариантов одного полиморфизма в последовательности ДНК, реакционная смесь включает, по меньшей мере,
два различающихся мишень-специфичных зонда,
5'-фрагменты (S) 3'-сегменты каждого из которых комплементарны одному из идентифицируемых аллельных вариантов и содержат при этом разные флуорофоры, а 3'-фрагменты (D) - идентичны по последовательности, и
5'-сегменты которых уникальны по последовательности, то есть способны образовать дуплексы только с соответствующими комплементарными им сигнальными зондами, но одинаковы по температуре плавления и содержат при этом разные гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания флуорофора 3'-сегмента этого же мишень-специфичного зонда, при этом по температурам плавления дуплексов осуществляют дифференциацию аллельных вариантов в одном канале амплификатора.
В частных вариантах воплощения линкер L в составе мишень-специфичного зонда состоит из 4-10 инозинмонофосфатов.
Решение поставленной задачи также осуществляется за счет разработки оригинальных зондов для специфической идентификации последовательностей ДНК при проведении полимеразной цепной реакции (ПЦР). Для этого предложена пара зондов, состоящая из
олигонуклеотидного мишень-специфичного зонда, имеющего
3'-сегмент, комплементарный идентифицируемому участку последовательности ДНК и содержащий метку, и
5'-сегмент, некомплементарный идентифицируемой последовательности ДНК, последовательность которого выбирается так, чтобы дуплекс, который он образует с сигнальным зондом в процессе ПЦР, имел заданную температуру плавления, и содержащий метку, и
олигонуклеотидного сигнального зонда, комплементарного 5'-сегменту мишень-специфичного зонда и содержащего метку, идентичную или близкую по спектрам поглощения и испускания метке, содержащейся на 3'-сегменте мишень-специфичного зонда;
выполненных таким образом, что
в процессе прохождения ПЦР мишень-специфичный зонд, при гибридизации с идентифицируемой последовательностью ДНК, расщепляется термостабильным ферментом, обладающим 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, с высвобождением 5'-сегмента и разобщением входящих в состав мишень-специфичного зонда меток, а 5'-сегмент, в свою очередь, гибридизуется с сигнальным зондом, образуя с ним дуплекс;
при этом возможны следующие варианты сочетания меток мишень-специфичного и сигнального зондов для каждой из идентифицируемых различающихся последовательностей ДНК:
1) 3'-сегмент мишень-специфичного зонда и сигнальный зонд в качестве метки несут в своем составе гаситель флуоресценции или репортерный флуорофор, а 5'-сегмент мишень-специфичного зонда - флуорофор, для которого спектр испускания перекрывает спектр поглощения, соответственно, этого гасителя флуоресценции или репортерного флуорофора,
2) 3'-сегмент мишень-специфичного зонда и сигнальный зонд несут в своем составе флуорофор, а 5'-сегмент мишень-специфичного зонда - гаситель флуоресценции или репортерный флуорофор, для которых спектр поглощения перекрывает спектр испускания этого флуорофора.
В некоторых вариантах воплощения изобретения пара зондов для специфической идентификации последовательностей ДНК в процессе ПЦР характеризуется тем, что температура плавления дуплекса, образуемого 5'-сегментом мишень-специфичного зонда и сигнальным зондом, по меньшей мере, для одной из идентифицируемых последовательностей ДНК, ниже температуры плавления праймеров, используемых для проведения ПЦР.
В некоторых частных вариантах воплощения сигнальный зонд иммобилизован на твердую фазу.
В частных вариантах воплощения, когда пара зондов применяется для идентификации одного или более полиморфизмов в последовательности ДНК, зонды характеризуются тем, что
3'-сегмент мишень-специфичного олигонуклеотидного зонда состоит из
аллель-детектирующего 5'-фрагмента (S), несущего метку, участок гибридизации которого содержит анализируемый полиморфный сайт, и последовательность которого комплементарна одному аллельному варианту, подлежащему специфической идентификации и
3'-фрагмента (D), последовательность которого комплементарна участку ДНК, прилегающему к сайту, содержащему идентифицируемый полиморфизм,
соединенных линкером, состоящим из, по меньшей мере, 1-10 нуклеозидмонофосфатов, обеспечивающих раздельную гибридизацию двух фрагментов,
при этом по длине 3'-сегмент совпадает с участком гибридизации на идентифицируемой указанной последовательности ДНК, выбранным для идентификации в нем полиморфизма,
при этом мишень-специфичный олигонуклеотидный зонд, в случае полной комплементарности его 3'-сегмента и указанной последовательности ДНК, в том числе в части 5'-фрагмента (S), соответствующего искомому аллельному варианту полиморфизма, расщепляется ферментом, обладающим 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, с высвобождением 5'-сегмента и разобщением входящих в состав мишень-специфичного зонда меток, что в дальнейшем обеспечивает генерацию сигнала на этапе плавления;
напротив, в случае неполной комплементарности 3'-сегмента мишень-специфичного олигонуклеотидного зонда в части 5'-фрагмента (S) и указанной последовательности ДНК, мишень-специфичный зонд расщепляется ферментом, обладающим 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, по линкеру L с высвобождением 5'-сегмента, связанного с 5'-фрагментом (S), без разобщения меток, входящих в состав мишень-специфичного зонда, что в дальнейшем на этапе плавления не приводит к генерации сигнала,
при этом возможны следующие варианты сочетания меток:
1) 5'-фрагмент (S) 3'-сегмента мишень-специфичного зонда и сигнальный зонд в качестве метки несут в своем составе гаситель флуоресценции или репортерный флуорофор, а 5'-сегмент мишень-специфичного зонда - флуорофор, для которого спектр испускания перекрывает спектр поглощения, соответственно, этого гасителя флуоресценции или репортерного флуорофора,
2) 5'-фрагмент (S) 3'-сегмента мишень-специфичного зонда и сигнальный зонд несут в своем составе флуорофор, а 5'-сегмент мишень-специфичного зонда - гаситель флуоресценции или репортерный флуорофор, для которых спектр поглощения перекрывает спектр испускания этого флуорофора.
Решение поставленной задачи также осуществляется за счет разработки набора для специфической идентификации, по меньшей мере, одной последовательности ДНК в образце способом, описанным выше; при этом набор включает, по меньшей мере, термостабильный фермент, обладающий 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью,
а также, для выявления каждой из идентифицируемых последовательностей ДНК, по меньшей мере,
одну пару праймеров,
один мишень-специфичный олигонуклеотидный зонд, имеющий
3'-сегмент, комплементарный идентифицируемому участку последовательности ДНК и содержащий метку, и
5'-сегмент, некомплементарный идентифицируемой последовательности ДНК, последовательность которого выбирается так, чтобы дуплекс, который он образует с сигнальным зондом, имел заданную температуру плавления, и содержащий метку,
один олигонуклеотидный сигнальный зонд, комплементарный 5'-сегменту мишень-специфичного зонда и содержащий метку, идентичную или близкую по спектрам поглощения и испускания метке, содержащейся на 3'-сегменте мишень-специфичного зонда;
при этом зонды выполнены таким образом, что в процессе прохождения ПЦР мишень-специфичный зонд, при гибридизации с идентифицируемой последовательностью ДНК, способен расщепляться указанным ферментом с высвобождением 5'-сегмента и разобщением входящих в состав мишень-специфичного зонда меток, а 5'-сегмент, в свою очередь, гибридизующегося с сигнальным зондом, образуя с ним дуплекс;
при этом возможны следующие варианты сочетания меток мишень-специфичного и сигнального зондов для каждой из идентифицируемых различающихся последовательностей ДНК:
1) 3'-сегмент мишень-специфичного зонда и сигнальный зонд в качестве метки несут в своем составе гаситель флуоресценции или репортерный флуорофор, а 5'-сегмент мишень-специфичного зонда - флуорофор, для которого спектр испускания перекрывает спектр поглощения, этого гасителя флуоресценции или репортерного флуорофора,
2) 3'-сегмент мишень-специфичного зонда и сигнальный зонд несут в своем составе флуорофор, а 5'-сегмент мишень-специфичного зонда - гаситель флуоресценции или репортерный флуорофор, для которых спектр поглощения перекрывает спектр испускания этого флуорофора.
Предложенный набор характеризуется тем, что при плавлении реакционной смеси, получаемой в результате смешивания компонентов набора, без предварительного проведения ПЦР, дуплексы не детектируются. В частных случаях, эта характеристика набора может быть использована для идентификации набора по изобретению.
В некоторых вариантах воплощения набор включает, по меньшей мере, два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК, но содержат одинаковые флуорофоры, и
5'-сегменты которых содержат одинаковые гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания вышеуказанного флуорофора, но различаются по температуре плавления так, чтобы обеспечить возможность осуществить дифференциацию различающихся идентифицируемых последовательностей ДНК по температуре плавления.
В некоторых вариантах воплощения набор включает, по меньшей мере, два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК и содержат при этом разные флуорофоры так, чтобы обеспечить возможность дифференциации различающихся идентифицируемых последовательностей ДНК по спектрам испускания флуорофоров, и
5'-сегменты которых уникальны по последовательности, то есть способны образовать дуплексы только с соответствующими комплементарными им сигнальными зондами, но одинаковы по температуре плавления и содержат при этом разные гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания флуорофора 3'-сегмента этого же мишень-специфичного зонда.
При осуществлении настоящего изобретения достигаются следующие технические результаты:
- МДА позволяет специфично определять последовательности ДНК, в том числе в мультиплексном формате, с возможностью определения более чем одной мишени в одном канале амплификатора;
- отсутствие необходимости в проведении стадии энзиматического образования дуплекса;
- для МДА достигается высокая степень мультиплексирования за счет широкого диапазона температур плавления для дуплексов, образуемых сигнальными зондами и отщепляемыми 5'-сегментами мишень-специфичных зондов, что обеспечивает более высокую степень мультиплексирования по сравнению с прототипной технологией; такое существенное расширение диапазона температур плавления возможно благодаря тому, что при проведении МДА можно использовать дуплексы с температурой плавления существенно ниже температуры плавления праймеров, с достижением высокой чувствительности и специфичности метода;
- МДА позволяет определять различные полиморфизмы в ДНК, в том числе однонуклеотидные полиморфизмы, делеции и инсерции, при этом для проведения такого анализа не требуется введение в систему дополнительного зонда (в отличие от способа-протитипа);
- возможность реализации способа в двух форматах: без иммобилизации сигнального зонда или с его иммобилизацией на твердую фазу;
- разработан набор для проведения специфической идентификации последовательностей ДНК, в том числе для определения нуклеотидных полиморфизмов.
Подробное раскрытие изобретения
Настоящее изобретение является новым способом специфического определения нуклеотидных последовательностей ДНК, в том числе в мультиплексном формате с последующей реализацией в виде набора.
ДНК, пригодной для проведения анализа с помощью МДА, является образец ДНК, полученный путем экстракции из разнообразного биологического материала, в том числе, но не ограничиваясь, из мазков, слюны, мочи, сыворотки крови, плазмы крови, тканей органов. Для экстракции ДНК могут быть использованы различные методы, в том числе, но не ограничиваясь, на основе спиртового осаждения, на основе сорбции, на основе температурного лизиса, позволяющие получить матрицу, пригодную для ПЦР, кроме того матрица ДНК для проведения анализа может быть получена в результате реакции обратной транскрипции с матрицы РНК, которая может быть также экстрагирована из разнообразного биологического материала, в том числе перечисленными выше методами; или ДНК для анализа может быть получена любыми другими доступными методами.
Краткое описание рисунков
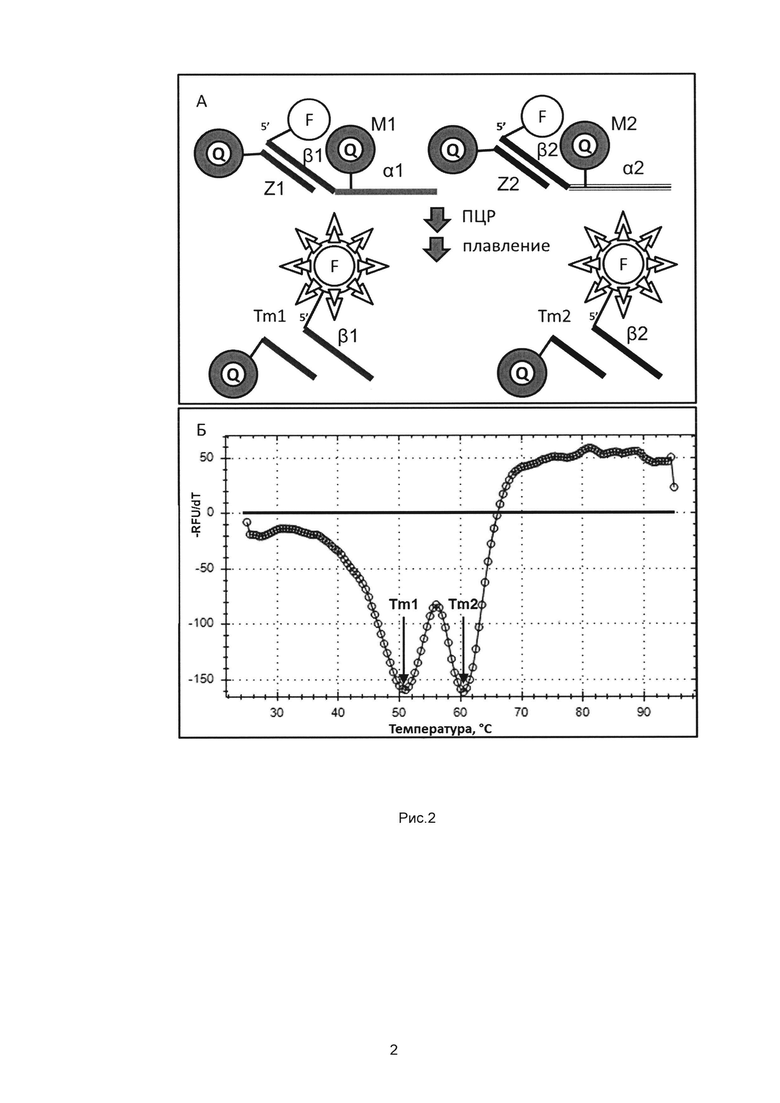
Рис. 1. - Принцип мультиплексного дуплекс-опосредованного анализа на основе расщепляемых зондов (МДА) на примере одного из вариантов сочетания меток.
А - Состав системы МДА:
(1) - расщепляемый мишень-специфичный зонд, включающий, помимо специфичного 3'-сегмента (α), несущего гаситель (Q), некомплементарный ДНК-мишени 5'-сегмент (β), несущий флуорофор (F),
(2) - сигнальный зонд, комплементарный β и несущий в своем составе гаситель Q,
(3) - пара праймеров, ограничивающих амплифицируемый фрагмент, в рамках которого гибридизуется мишень-специфичный зонд.
Б - Расщепление мишень-специфичного зонда с разобщением флуорофора (F) и гасителя (Q) в его составе за счет экзонуклеазной активности Taq полимеразы.
В - Плавление продуктов реакции - ступенчатый нагрев реакционной смеси с 25°С до 95°С:
(4) - дуплекс, образуемый в результате расщепления мишень-специфичного зонда, дает флуоресцентный сигнал после его плавления,
(5) - дуплекс, образуемый нерасщепленным мишень-специфичным зондом и сигнальным зондом, не дает сигнала после его плавления.
Рис. 2. - Дифференциация двух мишеней в одном канале детектирующего амплификатора.
А - МДА для двух мишеней подразумевает использование двух расщепляемых зондов (М1) и (М2), включающих различные специфичные 3'-сегменты (α1 и α2, соответственно) и некомплементарные ДНК-мишени 5'-сегменты (β1 и β2, соответственно), а также двух сигнальных зондов (Z1) и (Z2). В случае присутствия в анализируемом образце обеих мишеней образуются соответствующие им детектируемые дуплексы с различными температурами плавления (Tm1 и Tm2).
Б - График отрицательной производной флуоресценции по температуре кривой плавления для образца, содержащего две анализируемые мишени. Каждой из мишеней соответствует дуплекс с определенной температурой плавления (Tm1 и Tm2, соответственно). Приведен пример одновременного качественного определения ДНК Mycoplasma hominis (Mh) и Mycoplasma genitalium (Mg).
Рис. 3. - Принцип дифференциации мишеней по температуре плавления дуплексов и флуорофору.
А - дифференциация 30 мишеней по 6 температурам плавления дуплексов (Т1-Т6) и 5 флуорофорам (F1-F5).
Б - график кривых плавления после математической обработки, пример дифференциации 6 мишеней по температурам плавления дуплексов (Т1-Т6) в канале флуорофора F1.
Комбинирование 5 флуорофоров (F1-F5) и 6 температур плавления дуплексов (Т1-Т6) позволяет дифференцировать 30 мишеней в одной пробирке.
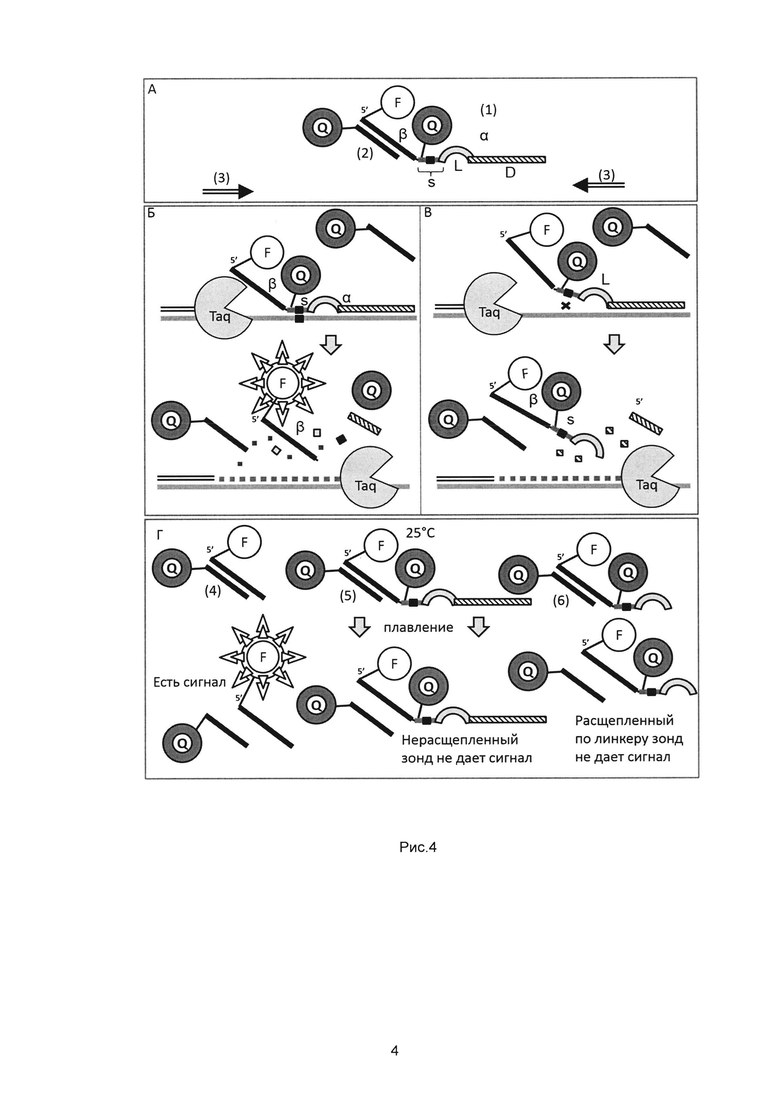
Рис. 4. - Принципиальная схема определения полиморфизмов на основе МДА на примере одного из вариантов сочетания меток.
А - Состав системы для определения полиморфизмов на основе МДА
(1) - расщепляемый мишень-специфичный зонд, включающий, помимо специфичного 3'-сегмента (α), некомплементарный последовательности-мишени 5'-сегмент (β), несущий флуорофор F; 3'-сегмент (α) разбит на аллель-детектирующий фрагмент (S), несущий гаситель флуоресценции Q и 3'-фрагмент (D), соединенные через линкер из нуклеозидмонофосфатов (L); в пределах фрагмента S черным квадратом отмечен полиморфный сайт,
(2) - сигнальный зонд, комплементарный β и несущий в своем составе гаситель Q,
(3) - пара праймеров, ограничивающих амплифицируемый фрагмент, в рамках которого гибридизуется мишень-специфичный зонд.
Б - Расщепление мишень-специфичного зонда с разобщением флуорофора (F) и гасителя (Q) в его составе при полной комплементарности аллель-детектирующего фрагмента (S) и матрицы (ДНК-мишени) за счет экзонуклеазной активности Taq полимеразы;
В - Расщепление мишень-специфичного зонда по линкеру (L) без разобщения флуорофора (F) и гасителя (Q) в его составе при наличии мисматча между аллель-детектирующим фрагментом (S) и матрицей (ДНК-мишенью) за счет экзонуклеазной активности Taq полимеразы;
Г - Плавление продуктов реакции - ступенчатый нагрев реакционной смеси с 25°С до 95°С:
(4) - дуплекс, образуемый в случае варианта Б, дает флуоресцентный сигнал,
(5) - дуплекс, образуемый нерасщепленным мишень-специфичным зондом и сигнальным зондом, не дает сигнал,
(6) - дуплекс, образуемый в случае варианта В, не дает флуоресцентный сигнал.
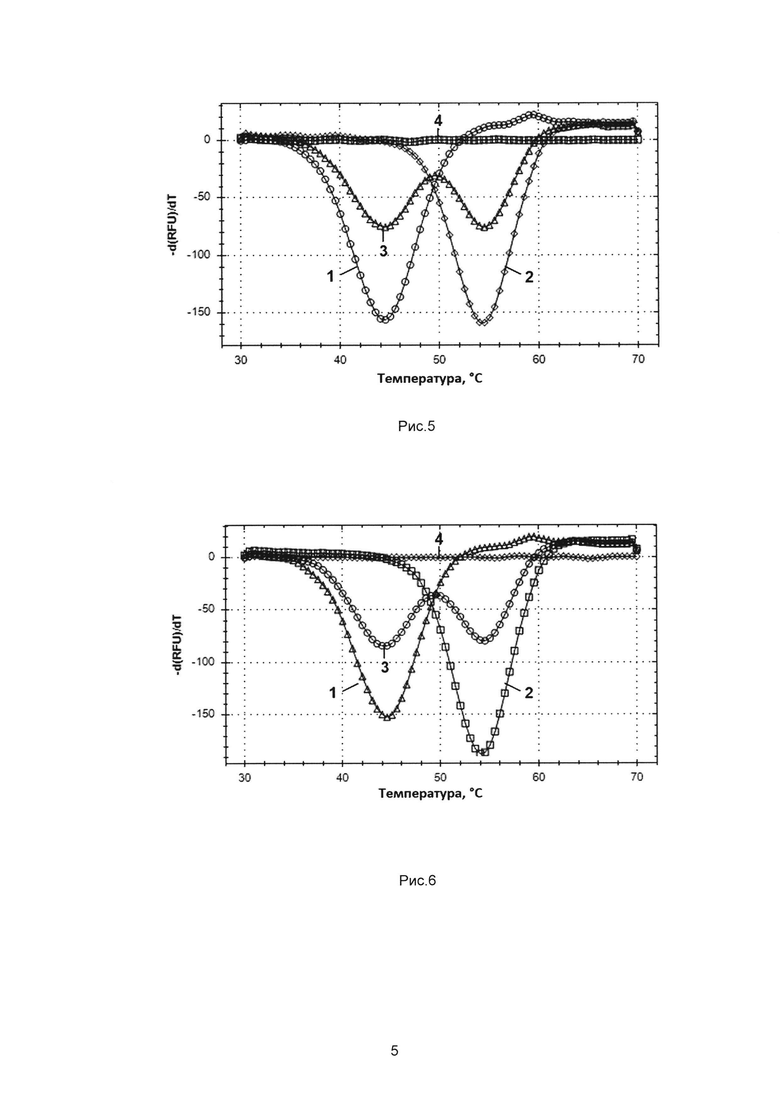
Рис. 5. - результаты МДА по выявлению ДНК Neisseria gonorrhoeae (NG) и Trichomonas vaginalis (TV) в следующих образцах:
1 - положительный образец на NG,
2 - положительный образец на TV,
3 - положительный образец на NG и TV,
4 - отрицательный контрольный образец.
Рис. 6. - результаты МДА по определению полиморфизма RS9939609 (Т/А), расположенного в гене FTO человека в следующих образцах:
1 - гомозигота дикого типа (W/W),
2 - мутантная гомозигота (ММ),
3 - гетерозигота W/M,
4 - отрицательный контрольный образец.
Предлагаемый способ специфической идентификации последовательностей ДНК-мишеней - мультиплексный дуплекс-опосредованный анализ (МДА) осуществляют посредством проведения полимеразной цепной реакции с детекцией результатов в реальном времени в присутствии мишень-специфичных зондов, имеющих некомплементарные последовательности ДНК-мишени 5'-сегменты, и соответствующих им сигнальных зондов, комплементарных 5'-сегментам (Рис. 1А). Мишень-специфичный зонд в 5'-сегменте и 3'-сегменте несет по одной метке, сигнальный зонд имеет в своем составе одну метку. В процессе прохождения ПЦР в присутствии искомой последовательности ДНК-мишени специфичный зонд расщепляется за счет 5'→3' экзонуклеазной активности ДНК-полимеразы с высвобождением 5'-сегмента (Рис. 1Б). После ПЦР проводится плавление продуктов реакции, при этом детекция осуществляется за счет сближения или разобщения меток, входящих в состав 5'-сегмента мишень-специфичного зонда и сигнального зонда. Нерасщепленный мишень-специфичный зонд, за счет присутствия в его составе двух взаимодействующих меток (и расположенных так, чтобы обеспечивалось это взаимодействие), не образует детектируемых дуплексов с сигнальным зондом (Рис. 1В (5)). По наличию дуплекса, образуемого высвобожденным 5'-сегментом и сигнальным зондом, с определенной температурой плавления (предварительно задается в процессе разработки с использованием методов и приемов, хорошо известных специалистам в данной области), можно судить о присутствии соответствующей мишени. Степень мультиплексирования (количество детектируемых мишеней в одной пробирке) зависит от количества каналов используемого амплификатора и от количества дуплексов, различающихся по температуре плавления, на каждый канал амплификатора. Количество дуплексов на канал зависит от подобранных базовых искусственных олигонуклеотидов - пар отщепляемых 5'-сегментов и сигнальных зондов к ним, при этом (в рамках одного канала) указанные пары должны отличаться по температурам образуемых ими дуплексов не менее чем на 4°С, более предпочтительно, не менее чем на 5°С для надежной дифференциации мишеней. Например, для 5-ти канального амплификатора в одной пробирке может быть определено 30 мишеней, при условии определения 6-ти мишеней в одном канале (Рис. 3). Использование изобретения позволяет с высокой специфичностью и чувствительностью детектировать разнообразные нуклеотидные последовательности в мультиплексном формате даже в случае использования амплификатора с флуоресцентной детекцией, имеющего всего один флуоресцентный канал.
Реакционная смесь для ПЦР в качестве специфических компонентов на одну мишень содержит:
- расщепляемый мишень-специфичный зонд (Рис. 1А (1)), включающий, помимо специфичного 3'-сегмента (Рис. 1А α), некомплементарный последовательности-мишени 5'-сегмент (Рис. 1А β), при этом оба сегмента несут метку;
- сигнальный зонд, комплементарный негибридизующимуся на матрицу 5'-сегменту расщепляемого мишень-специфичного зонда, несущий метку и блокированный с 3'-конца (Рис. 1А (2));
- пару праймеров, ограничивающих амплифицируемый фрагмент, в рамках которого гибридизуется мишень-специфичный зонд (Рис. 1А (3)).
Предпочтительно, зонды и праймеры представляют собой молекулы одноцепочечных дезоксирибо(олиго)нуклеотидов. Зонды и праймеры, используемые в данном изобретении, преимущественно, содержат модифицированные или немодифицированные нуклеозидмонофосфаты. В некоторых случаях зонды и праймеры также могут включать и рибонуклеотиды.
В мишень-специфичном и сигнальном зондах (в случае введения внутренней метки (поскольку метки необязательно располагаются на конце зондов)) блокировка от удлинения 3'-конца может быть достигнута традиционными методами. Например, блокирование можно осуществить путем добавления к 3'-гидроксильной группе последнего нуклеотида химической группировки, такой как биотин, фосфатная группа, алкильная группа, ненуклеотидный линкер, фосфоротионат или алкандиол. Альтернативно, блокирование может быть выполнено посредством удаления 3'-гидроксильной группы последнего нуклеотида или путем использования нуклеотида, лишенного 3'-гидроксильной группы, такого как дидезоксинуклеотид.
В зондах возможны следующие сочетания меток:
1. мишень-специфичный зонд в 5'-сегменте несет флуорофор, а в 3'-сегменте - гаситель флуоресценции, спектр поглощения которого перекрывает спектр испускания этого флуорофора, при этом расстояние между метками должно быть таким, чтобы обеспечивалось гашение флуоресценции; в состав сигнального зонда входит гаситель флуоресценции, спектр поглощения которого также перекрывает спектр испускания этого флуорофора (во всей системе гаситель флуоресценции может быть заменен на репортерный флуорофор);
2. мишень-специфичный зонд в 5'-сегменте несет гаситель флуоресценции, а в 3'-сегменте - флуорофор, для которого спектр испускания перекрывает спектр поглощения этого гасителя флуоресценции, при этом расстояние между метками должно быть таким, чтобы обеспечивалось гашение флуоресценции; в состав сигнального зонда входит флуорофор, для которого спектр испускания также перекрывает спектр поглощения этого гасителя флуоресценции (во всей системе гаситель флуоресценции может быть заменен на репортерный флуорофор).
На примере первого сочетания меток (мишень-специфичный зонд в 5'-сегменте несет флуорофор, а в 3'-сегменте - гаситель флуоресценции, в состав сигнального зонда входит гаситель флуоресценции) рассмотрим принцип работы МДА.
На первом этапе, в процессе прохождения полимеразной цепной реакции происходит амплификация фрагмента, ограниченного праймерами (Рис. 1А (3)), при этом мишень-специфичный зонд (Рис. 1А (1)), в случае присутствия в образце ДНК-мишени, гибридизуется в рамках ампликона и расщепляется на матрице за счет экзонуклеазной активности фермента, в результате чего негибридизующийся на матрицу 5'-сегмент вместе с флуорофором отщепляется, при этом флуорофор и гаситель 3'-сегмента разобщаются (Рис. 1Б). Для проведения реакции подходит любой термостабильный фермент, обладающий 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной (flap-эндонуклеазной) активностью, например, Taq ДНК полимераза.
На втором этапе проводится плавление дуплексов (Рис. 1В), образуемых отщепленным 5'-сегментом мишень-специфичного зонда и сигнальным зондом. При 25°С все дуплексы находятся в гибридизованном состоянии, таким образом, флуорофор и гаситель пространственно сближены, поэтому величина регистрируемого флуоресцентного сигнала минимальна. Начиная с 25°С, температуру реакционной смеси повышают до 95°С. При постепенном нагревании реакционной смеси дуплексы разрушаются за счет разделения цепей, при этом флуорофор и гаситель также разобщаются, что приводит к повышению флуоресценции, в случае, если мишень-специфичный зонд гибридизовался на матрицу (в случае присутствия в образце ДНК-мишени) (рис. 1В (4) внизу)), которую фиксирует амплификатор с детектирующей системой в режиме реального времени. Нерасщепленный мишень-специфичный зонд, за счет присутствия в его составе и флуорофора, и гасителя не образует детектируемых дуплексов с сигнальным зондом (рис. 1В (5) внизу). Плавление может проводиться и в обратном направлении, т.е. с понижением температуры до 25°С, начиная с 95°С, при этом конечный результат будет тем же. В результате обработки кривых плавления с помощью программного обеспечения амплификатора, производится построение графиков зависимости производной флуоресценции от температуры, определяются температуры плавления (Tm) дуплексов. Tm дуплекса зависит от длины и последовательности сигнального зонда, которая, в свою очередь, задается разработчиком. В одном канале амплификатора может быть определено несколько мишеней - по числу различаемых по Tm дуплексов (Рис. 2А). Дискриминация мишеней осуществляется за счет использования систем с различными по длине и последовательности сигнальными зондами (комплементарными негибридизующимся на матрицу 5'-сегментам расщепляемых зондов), и, следовательно, отличающимися по Tm образуемых ими дуплексов (Рис. 2Б). Поскольку детектируемый дуплекс образуется только в случае расщепления мишень-специфичного зонда на матрице, его выявление свидетельствует о присутствии в образце искомой последовательности ДНК. Таким образом, каждой мишени соответствует комбинация флуорофора и дуплекса с определенной температурой плавления (Рис. 4). На Рис. 2Б приведен пример с определением двух ДНК-мишеней в одном канале, дискриминация которых осуществляется за счет различающихся по последовательности 5'-сегментов мишень-специфичных зондов (Рис. 2А β1 и β2) и, соответственно, по температуре плавления образуемых с сигнальными зондами дуплексов (Рис. 2 Tm1 и Tm2).
Принцип дифференциации мишеней по температуре плавления дуплексов и флуорофору приведен на Рис. 3А. В качестве примера приведена дифференциация 30 мишеней по 6 температурам плавления дуплексов (Т1-Т6) и 5 флуорофорам (F1-F5) (Рис. 3А), а также график кривых плавления после математической обработки демонстрирующий дифференциацию 6 мишеней по температурам плавления дуплексов (Т1-Т6) в канале флуорофора F1 (Рис. 3Б).
Заявляемое изобретение может быть реализовано, в том числе на твердой фазе, в таком случае, сигнальный зонд должен быть иммобилизован на твердую фазу.
Принцип МДА подходит для определения однонуклеотидных полиморфизмов, инсерций и делеций. Для этого требуются следующие модификации структуры мишень-специфичного зонда: во-первых, 3'-сегмент необходимо разбить на аллель-детектирующий фрагмент (S) и 3'-фрагмент (D), при этом соединить их через линкер из нуклеозидмонофосфатов (L), во-вторых, метку ввести в пределах фрагмента S (Рис. 4А). Аллель-детектирующий фрагмент располагается с 5'-конца 3'-сегмента мишень-специфичного зонда и подбирается так чтобы искомый полиморфизм находился в пределах участка его гибридизации, за ним с 3'-конца следует линкер, из 3-10 нуклеозидмонофосфатов, например, пяти инозинмонофосфатов, который далее соединяется с 3'-фрагментом, обеспечивающим надежную гибридизацию зонда на матрице. Известно, что инозинмонофосфат образует относительно слабые связи с другими основаниями по сравнению с каноническими уотсон-криковскими взаимодействиями. Предположительно, в условиях гибридизации инозиновый линкер образует пузырьковую структуру, таким образом обеспечивая лучшее функциональное разделение двух фрагментов 3'-сегмента мишень-специфичного зонда. Фрагменты S и D подбираются таким образом, чтобы температура отжига S-фрагмента была на 15-20°С ниже температуры отжига D-фрагмента. Более длинный D-фрагмент инициирует гибридизацию зонда в условиях проведения ПЦР и обеспечивает точное позиционирование аллель-детектирующего фрагмента напротив участка его гибридизации. Специфичность выявления полиморфизма определяется коротким S-фрагментом, можно подобрать условия, при которых его гибридизация в условиях ПЦР происходит только с целевой последовательностью без мисматчей. При полном соответствии аллель-детектирующего фрагмента и матрицы в условиях ПЦР происходит его гибридизация, с последующим отщеплением 5'-сегмента мишень-специфичного зонда с разобщением флуорофора и гасителя (Рис 4Б) и образованием детектируемого дуплекса на этапе плавления (Рис. 4Г). Напротив, при не полном соответствии аллель-детектирующего фрагмента и матрицы в условиях ПЦР не происходит его гибридизация, зонд при этом расщепляется без разобщения флуорофора и гасителя (Рис. 4В), соответственно, детектируемый на этапе плавления дуплекс не образуется (Рис. 4Г). Нерасщепленный мишень-специфичный также не дает детектируемого на этапе плавления дуплекса (Рис. 4Г).
В предлагаемом способе принципиально изменена схема определения однонуклеотидных и других полиморфизмов относительно прототипной технологии. В МДА дифференциация аллельных вариантов реализуется на принципе гибридизации, тогда как в прототипном способе - на принципе специфического удлинения олигонуклеотида на матрице. Для специфического удлинения олигонуклеотида на матрице в прототипном способе предложено использовать технологию PNA-Mediated PCR Clamping, что подразумевает введение в систему дополнительного зонда на основе PNA - пептидо-нуклеиновой кислоты, блокирующего неспецифическую амплификацию при наличии мисматча на 3'-конце отщепляемого 5'-сегмента мишень-специфичного зонда. Использование дополнительного зонда приводит к усложнению и удорожанию прототипного решения для определения полиморфизмов.
Таким образом, предлагаемое решение отличается от прототипа оригинальным расположением флуоресцентных меток в составе расщепляемого зонда и отсутствием этапа энзиматического образования дуплекса, что значительно упрощает анализ и повышает его эффективность за счет исключения кинетики реакции образования дуплекса. Кроме того, предлагаемая схема детекции позволяет подбирать дуплексы в широком диапазоне температур, начиная с 35°С, тогда как в прототипной технологии температура плавления дуплекса ограничена снизу температурой плавления отщепляемого сегмента. Расширение диапазона температур плавления дуплексов для предлагаемого решения позволяет увеличить степень мультиплексирования по сравнению с прототипной технологией в 1,5-2 раза. Так, при проведении ПЦР, температура отжига праймеров (Tm) обычно лежит в диапазоне 55-65°С, соответственно, для реализации прототипной технологии отщепляемый сегмент мишень-специфичного зонда должен иметь температуру плавления в указанных пределах, чтобы было обеспечено его удлинение на сигнальном зонде в условиях проведения ПЦР. Образуемый дуплекс всегда имеет большую температуру плавления по сравнению с отщепляемым сегментом, за счет его энзиматического образования. Отличие температуры плавления отщепляемого сегмента и образуемого дуплекса должно быть не менее 4°С, более предпочтительно, не менее 5°С для надежной дифференциации сигнала от дуплекса, образуемого нерасщепленным мишень-специфичным зондом и сигнальным зондом (особенно важно для вариантов реализации технологии с меченым отщепляемым сегментом). В итоге, для прототипной технологии диапазон образуемых дуплексов ограничен снизу Tm+5, где Tm - температура плавления праймеров, а для предлагаемого решения такого ограничения нет
В прототипной технологии во время проведения ПЦР отщепляются 5'-сегменты мишень-специфичных зондов, что приводит к образованию большого числа праймирующих одноцепочечных олигонуклеотидов с высокой температурой плавления (не ниже Tm праймеров), которые, в свою очередь, могут неспецифично гибридизоваться и удлиняться в условиях ПЦР с мишень-специфичными праймерами и между собой. Увеличение числа праймирующих олигонуклеотидов с высокими Tm в процессе ПЦР существенно усложняет оптимизацию реакции за счет необходимости исключения интерференции отщепляемых сегментов и мишень-специфичных систем. Напротив, при реализации предлагаемого решения можно подобрать последовательности сигнальных зондов/отщепляемых 5'-сегментов с температурами плавления значительно ниже Tm отжига праймеров, а это существенно снижает вероятность неспецифической гибридизации и удлинения образующихся в процессе реакции одноцепочечных праймирующих олигонуклеотидов, что может обеспечить более высокую чувствительность предлагаемого решения относительно прототипной технологии.
В другом аспекте данного изобретения предложен набор для специфического определения последовательностей ДНК. В состав набора в качестве специфических компонентов на одну мишень входят:
- расщепляемый мишень-специфичный зонд (Рис. 1А (1)), включающий, помимо специфичного 3'-сегмента (Рис. 1 α), некомплементарный последовательности-мишени 5'-сегмент (Рис. 1 β), при этом оба сегмента несут метку;
- сигнальный зонд, комплементарный негибридизующимуся на матрицу 5'-сегменту расщепляемого мишень-специфичного зонда, несущий метку и блокированный с 3'-конца (Рис. 1А (2));
- пара праймеров, ограничивающих амплифицируемый фрагмент, в рамках которого гибридизуется мишень-специфичный зонд (Рис. 1А (3))
в необходимых для проведения анализа количествах.
Каждый набор, в зависимости от количества различных мишеней, для определения которых он предназначен, содержит необходимое количество различных специфических компонентов.
Помимо этого, в набор также входят неспецифические компоненты, необходимые для проведения анализа, состав которых понятен для специалистов в данной области, и может различаться в зависимости от особенностей проведения анализа. К таким компонентам набора относятся, в частности, но не ограничиваясь, термостабильная ДНК-полимераза, обладающая 5'→3' экзонуклеазной активностью, дезоксирибонуклеотид-трифосфаты (dATP, dGTP, dCTP, dTTP), ионы Mg2+, буферный раствор, обеспечивающий необходимые условия реакции и др.
Набор обладает следующим свойством: без предварительного проведения ПЦР не детектируются дуплексы, соответствующие ДНК-мишеням, так как нерасщепленный мишень-специфичный зонд образует недетектируемый дуплекс с сигнальным зондом, при плавлении которого сигнал не генерируется, за счет присутствия в его составе двух взаимодействующих меток с перекрывающимися спектрами поглощения и испускания.
Поскольку набор по данному изобретению составлен для осуществления описанного выше способа детекции по настоящему изобретению (МДА), общее для них описание опущено, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Термины и определения
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Под ДНК-мишенью (идентифицируемой ДНК, искомой ДНК, определяемой ДНК, ДНК-матрицей) в данном документе подразумевается ДНК или фрагмент ДНК, который выявляют (стремятся выявить) в исследуемом образце.
В качестве флуорофора, репортерного флуорофора или гасителя флуоресценции в данном изобретении могут быть использованы, но не ограничиваясь ими, различные флуоресцентные красители, такие как: Cy2™ (506), YO-PR0™-1 (509), YOYO™-1 (509), кальцеин (517), FITC (флуоресцеинизотиоцианат) (518), FluorX™ (519), Alexa™ (520), родамин 110 (520), Oregon Green™ (орегон зеленый) 500 (522), Oregon Green™ 488 (524), RiboGreen™ (525), Rhodamine Green™ (родаминовый зеленый) (527), родамин 123 (529), Magnesium Green™ (531), Calcium Green™ (533), TO-PR0™-1 (533), TOTOI (533), JOE (2',7'-диметокси-4',5'-дихлорофлуоресцеин) (548), BODIPY530/550 (550), Dil (565), BODIPY TMR (568), BODIPY558/568 (568), BODIPY564/570 (570), Cy3™ (570), Alexa™ 546 (570), TRITC (тетраметилродамин-изотиоцианат) (572), Magnesium Orange™ (575), фикоэритрин R&B (575), родамин-фаллоидин (575), Calcium Orange™ (576), пиронин У (580), родамин В (580), TAMRA (тетраметилродамин) (582), Rhodamine Red™ (родамин красный) (590), Cy3.5™ (596), ROX (6-карбокси-Х-родамин) (608), Calcium Crimson™ (615), Alexa™ 594 (615), техасский красный (615), нильский красный (628), YO-PR0™-3 (631), YOYO™-3 (631), R-фикоцианин (642), С-фикоцианин (648), TO-PR0™-3 (660), ТОТО3 (660), DiD DilC(5) (665), Сy5™ (670), тиадикарбоцианин (671) и Сy5.5 (694), HEX (556), ТЕТ (536), Biosearch Blue (447), CAL Fluor Gold 540 (544), CAL Fluor Orange 560 (559), CAL Fluor Red 590 (591), CAL Fluor Red 610 (610), CAL Fluor Red 635 (637), РАМ (карбоксифлуоресцеин) (520), флуоресцеин (520), флуоресцеин-С3 (520), Pulsar 650 (566), Quasar 570 (667), Quasar 670 (705) и Quasar 705 (610). Числа в скобках представляют собой длину волны, соответствующую максимуму излучения, в нанометрах. Подходящие пары флуорофор-гаситель описаны в ряде публикаций, которые указаны ниже: Pesce et al., editors, Fluorescence Spectroscopy (Marcel Dekker, New York, 1971); White et al., Fluorescence Analysis: A Practical Approach (Marcel Dekker, New York, 1970); Berlman, Handbook of Fluorescence Spectra of Aromatic Molecules, 2nd Edition (Academic Press, New York, 1971); Griffiths, Color and Constitution of Organic Molecules (Academic Press, New York, 1976); Bishop, editor, Indicators (Pergamon Press, Oxford, 1972); Haugland, Handbook of Fluorescent Probes and Research Chemicals (Molecular Probes, Eugene, 1992); Pringsheim, Pluorescence and Phosphorescence (Interscience Publishers, New York, 1949); Haugland, R.P., Handbook of Fluorescent Probes and Research Chemicals, 6th Edition, Molecular Probes, Eugene, Oreg., 1996; патенты США №№3996345 и 43517.
Стоит отметить, что в настоящем изобретении может быть использована нефлуоресцентная "темновая" молекула-гаситель, способная гасить флуоресценцию в широком диапазоне длин волн или на конкретной длине волны. Примерами таких гасителей являются BHQ (Black Hole Quencher 1) и DABCYL (4-((4-(диметиламино)фенил)-азо) бензойная кислота). Термин "репортерный флуорофор" в данном описании используется для FRET-меток (Fluorescence Resonance Energy Transfer), используемых в качестве акцептора в парах донор-акцептор, для которого флуоресценция может измеряться отдельно на соответствующей длине волны. Если измерение флуоресценции не осуществляется на длине волны акцептора, то репортерный флуорофор можно считать гасителем. Например, в качестве флуорофора используют флуоресцентный краситель, а в качестве гасителя - родаминовый краситель.
Меченые олигонуклеотидные зонды синтезируют путем химического присоединения флуорофора (гасителя или репортерного флуорофора) к олигонуклеотидам, последовательности которых подобраны в соответствии с требованиями метода. При создании зонда по данному изобретению флуоресцентная метка может присоединяться как к крайним, так и к внутренним сайтам сигнального зонда и сегментам мишень-специфичного зонда. Для идентификации полиморфизмов в последовательности ДНК флуоресцентная метка 3'-сегмента мишень-специфичного олигонуклеотидного зонда присоединяется к аллель-детектирующему фрагменту (S) (см. Рис. 4). При этом расстояние между метками, входящими в сегменты одного мишень-специфичного зонда, а также расстояние между метками дуплекса, образуемого 5'-сегментом мишень-специфичного зонда и сигнальным зондом, должно быть таким, чтобы обеспечивалось гашение флуоресценции.
Подходящей ДНК-полимеразой, обладающей 5'→3' экзонуклеазной активностью, в данном изобретении является термостабильная ДНК-полимераза, полученная из ряда бактериальных видов, включая Thermus aquaticus (Taq), Thermus thermophilus (Tth), Thermus filiformis, Thermus flavus, Thermococcus literalis, Thermus antranikianii, Thermus caldophilus, Thermus chliarophilus, Thermus igniterrae, Thermus lacteus, Thermus oshimai, Thermus ruber, Thermus rubens, Thermus scotoductus, Thermus silvanus, Thermus species Z05, Thermus species sps 17, Thermus thermophilus, Thermotoga maritime, Thermotoga neapolitana, Thermosipho africanus, Thermococcus litoralis, Thermococcus barossi, Thermococcus gorgonarius, Thermotoga maritima, Thermotoga neapolitana, Thermosiphoafricanus, Pyrococcus woesei, Pyrococcus horikoshii, Pyrococcus abyssi, Pyrodictium occultum, Aquifex pyrophilus и Aquifex aeolieus. Наиболее предпочтительно, чтобы для реализации данного изобретения использовалась Taq полимераза.
Под реакционной смесью в контексте данного изобретения понимают совокупность компонентов реакции, необходимых для проведения МДА, как в виде отдельных компонентов набора, так и в виде смеси, полученной в результате объединения компонентов набора.
Нижеследующие примеры приведены в целях иллюстрирования способа согласно настоящему изобретению и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Примеры
ПРИМЕР 1
Оценка применимости мультиплексного дуплекс-опосредованного анализа на основе расщепляемых зондов (МДА). Оценку проводили в отношении того, позволяет ли новый подход, во-первых, обеспечить специфичный хорошо детектируемый сигнал от мишени и во-вторых, возможно ли в одном канале одновременно выявлять и дифференцировать как минимум 2 мишени. Для МДА проверялось два варианта сочетания меток в зондах:
1. мишень-специфичный зонд в 5'-сегменте несет флуорофор, а в 3'-сегменте - гаситель флуоресценции, в состав сигнального зонда входит гаситель флуоресценции;
2. мишень-специфичный зонд в 5'-сегменте несет гаситель флуоресценции, а в 3'-сегменте флуорофор, в состав сигнального зонда входит флуорофор.
Пример 1.1.
Одновременное выявление ДНК Neisseria gonorrhoeae (NG) и Trichomonas vaginalis (TV) с использованием амплификатора, имеющего один канал для флуоресцентной детекции. На первом этапе была проведена ПЦР. Реакционная смесь объемом 30 мкл содержала 50 mM Tris-SO4, рН 8,0; 10 mM (NH4)2SO4; 3,5 mM MgCl2; 30 mM KCl; 0,01% Tween-20; по 0,25 mM каждого dNTP; по 3 рМ праймеров NG-F (5'-GTATGGTTTCAAGACGCTTCAC-3'), NG-R (5'-AGCCATGAATGAACAGCTTGA-3'), TV-F (5'-TCCTTCCTAGCTAATTTCCGT-3'), TV-R (5'-СAAGAATGGTGTAACTCGАССТ-3'), по 3 рМ мишень-специфичных зондов NG-Z (5'-ROX-TCGACTACACTCGTTTTT(T-BHQ2)CCTTGCAGTTAGGCTTCTCCGTCT-3'), TV-Z (5'-ROX-ACTCTACGACTCGTCATCGTTTA(T-BHQ2)GGTCGCCCTCGGAGTCTTTGAATCG-3', по 3 рМ сигнальных зондов ZS2 5'-ACGAGTGTAGTCGA-BHQ2-3' ZS3 5'-CGATGACGAGTCGTAGAGT-BHQ2-3'; 2,5 e.a. ДНК-полимеразы в комплексе с антителами к ее активному центру (TaqAB полимераза производства ООО «Компания Алкор-Био») и 5 мкл ДНК, экстрагированной из клинического образца с помощью набора «Экстра-ДНК-Био» производства ООО «Компания Алкор-Био».
В последовательностях зондов курсивом выделены участки мишень-специфичных зондов, с которыми гибридизуются сигнальные зонды; жирным шрифтом выделены мишень-специфичные 3'-сегменты, гибридизующиеся с целевой ДНК.
Реакцию проводили с использованием амплификатора с флуоресцентной детекцией CFX-96, Bio-Rad. Параметры циклирования: «горячий старт» в течение 3 мин при 94°С; 45 циклов в режиме 94°С в течение 10 сек., 60°С в течение 20 сек.
На втором этапе было проведено плавление дуплексов в диапазоне 25-95°С с шагом 0,5°С и продолжительностью прогрева на каждом шаге 10 сек. Считывание флуоресценции проводили по каналу ROX.
В результате обработки кривых плавления с помощью программного обеспечения амплификатора, производилось построение графиков зависимости производной флуоресценции от температуры с последующим определением температур плавления дуплексов. Мишени NG соответствовал дуплекс с температурой плавления 51°С (Tm1), а мишени TV дуплекс с температурой плавления 60°С (Tm2) (Рис. 5).
Выявление ДНК NG и TV проводили на выборке из 315 клинических образцов, пример полученных графиков плавления для образца, несущего ДНК NG и TV, приведен на Рис. 2Б.
Из приведенных данных на Рис. 5 следует, что при наличии в образце одной мишени TV или NG регистрируется только соответствующий пик, а при отсутствии в образце искомой ДНК (отрицательный контроль) никаких пиков не регистрируется; все это свидетельствует о специфичности сигнала. При наличии в образце ДНК и TV, и NG регистрируется два хорошо различимых пика, соответствующих искомым мишеням, что подтверждает возможность одновременной детекции двух мишеней в одном канале амплификатора. Кроме того, показана принципиальная возможность использования дуплексов с температурой плавления существенно ниже температуры плавления праймеров: в приведенном примере температура плавления праймеров около 60°С, тогда как температура плавления дуплекса для NG на ~15°С ниже. Последнее указывает на расширение диапазона температур плавления для дуплексов по сравнению с прототипной технологией.
Пример 1.2.
Отличается от 1.1. тем что был использован второй вариант сочетания меток в зондах, соответственно, были использованы следующие зонды:
NG-Z 5'-BHQ2-GACTACACTCGTGTTTT(T-ROX)CCTTGCAGTTAGGCTTCTCCGTCT-3',
TV-Z 5'-BHQ2-GATCGACTCGTCACGTTTA(T-ROX)GGTCGCCCTCGGAGTCTTTGAATCG-3',
ZS2 5'-CACGAGTGTAGTC-ROX-3',
ZS3 5'-CGTGACGAGTCGATC-ROX-3'.
В последовательностях зондов курсивом выделены участки мишень-специфичных зондов, с которыми гибридизуются сигнальные зонды; жирным шрифтом выделены мишень-специфичные 3'-сегменты, гибридизующиеся с целевой ДНК.
Полученные результаты полностью совпали с данными, полученными в эксперименте, описанному в Примере 1.1., что подтверждает взаимозаменяемость двух вариантов сочетания меток в зондах.
ПРИМЕР 2
Оценка применимости МДА для определения полиморфизмов (рис. 4) на примере RS9939609 (Т/А), расположенного в гене FTO человека (рис. 6). В анализ были взяты 4 образца: гомозигота дикого типа (Т/T), мутантная гомозигота (А/А), гетерозигота (Т/А) и отрицательный контроль. Реакционная смесь объемом 30 мкл содержала 50 мМ Tris-SO4, рН 8,0; 10 мМ (NH4)2SO4; 3,5 мМ MgCl2; 30 мМ KCl; 0,01% Tween-20; по 0,25 мМ каждого dNTP; по 3 пкМ праймеров FTO-F (5'-CATCAGTTATGCATTTAGAATGTCTG-3'), FTO-R (5'-CCTCCATTTCTGACTGTTAC-3'), по 3 пкМ аллель-специфичных зондов FTO-W (5'-ROX-TCGACTACACTCGTTTTTGCATCACAAAATTCIIIIITCTAGGTTCCTTGCGACT-3'), FTO-M (5'-ROX-GATCGACTCGTCACGTTTGAATTTAGTGATGCAIIIIIATAGTCTCTGTTACTCTAAAGTTTTAA-3', по 3 пкМ сигнальных зондов ZS2 5'-CACGAGTGTAGTC-BHQ2-3' ZS3 5'-CGTGACGAGTCGATC-BHQ2-3'; 2,5 e.a. ДНК-полимеразы в комплексе с антителами к ее активному центру (Taq АВ полимераза производства ООО «Компания Алкор-Био») и 5 мкл ДНК, экстрагированной из клинического образца с помощью набора «Экстра-ДНК-Био» производства ООО «Компания Алкор-Био». Реакцию проводили с использованием амплификатора с флуоресцентной детекцией CFX-96, Bio-Rad. Параметры циклирования: «горячий старт» в течение 3 мин при 94°С; 45 циклов в режиме 94°С в течение 10 сек., 60°С в течение 20 сек. На втором этапе было проведено плавление дуплексов в диапазоне 25-95°С с шагом 0,5°С и продолжительностью прогрева на каждом шаге 10 сек. Считывание флуоресценции проводили по каналу ROX. В последовательностях зондов курсивом выделены участки мишень-специфичных зондов, с которыми гибридизуются сигнальные зонды; жирным шрифтом выделены 3'-фрагменты (D), аллель-детектирующие фрагменты (S) выделены подчеркиванием, в рамках S черным фоном отмечен полиморфный сайт, линкер - 5 инозинмонофосфатов (I).
В результате обработки кривых плавления с помощью программного обеспечения амплификатора производилось построение графиков зависимости производной флуоресценции от температуры с последующим определением температур плавления дуплексов. Аллелю дикого типа (W) соответствует дуплекс с температурой плавления 44,5°С, а мутантному аллелю (М) - дуплекс с температурой плавления 54,5°С (рис. 6).
Из приведенных данных на Рис. 6 следует, что при наличии в образце гомозиготы (W или М) регистрируется только соответствующий пик, а при отсутствии в образце искомой ДНК (отрицательный контроль) никаких пиков не регистрируется; все это свидетельствует о специфичности сигнала. При наличии в образце гетерозиготы (W/M) в образце регистрируется два хорошо различимых пика, соответствующих искомым аллельным вариантам. Таким образом, МДА подходит для определения полиморфизмов.
Несмотря на то что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.


Предложенная группа изобретений относится к области молекулярной биологии и медицины. Предложены способ и набор для специфической идентификации по меньшей мере одной последовательности ДНК в образце путем проведения полимеразной цепной реакции (ПЦР), включающие одну пару праймеров, специфичных для этой последовательности ДНК, и пару зондов, в которой один представляет собой олигонуклеотидный мишень-специфичный зонд, имеющий 3'-сегмент, комплементарный идентифицируемому участку последовательности ДНК и содержащий метку, и 5'-сегмент, некомплементарный идентифицируемой последовательности ДНК и содержащий метку, а другой - олигонуклеотидный сигнальный зонд, комплементарный 5'-сегменту мишень-специфичного зонда и содержащий метку. Предложенная группа изобретений позволяет специфично определять последовательности ДНК с высокой чувствительностью и специфичностью. 2 н. и 26 з.п. ф-лы, 6 ил., 2 пр.
1. Способ специфической идентификации по меньшей мере одной последовательности ДНК в образце, включающий следующие этапы:
а) проведение полимеразной цепной реакции (ПЦР), для которой реакционная смесь включает
термостабильный фермент, обладающий 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью,
а также для выявления каждой из идентифицируемых последовательностей ДНК включает по меньшей мере
одну пару праймеров, специфичных для этой последовательности ДНК, и пару зондов, в которой
один представляет собой олигонуклеотидный мишень-специфичный зонд, имеющий
3'-сегмент, комплементарный идентифицируемому участку ДНК и содержащий метку, и
5'-сегмент, некомплементарный идентифицируемой последовательности ДНК, последовательность которого выбирается так, чтобы дуплекс, который он образует с сигнальным зондом в процессе ПЦР, имел заданную температуру плавления, и содержащий метку,
а другой - олигонуклеотидный сигнальный зонд, комплементарный 5'-сегменту мишень-специфичного зонда и содержащий метку, идентичную или близкую по спектрам поглощения и испускания метке, содержащейся на 3'-сегменте мишень-специфичного зонда;
при этом в процессе прохождения ПЦР мишень-специфичный зонд, при гибридизации с идентифицируемой последовательностью ДНК, расщепляется указанным ферментом с высвобождением 5'-сегмента и разобщением входящих в состав мишень-специфичного зонда меток, а 5'-сегмент, в свою очередь, гибридизуется с сигнальным зондом, образуя с ним дуплекс;
б) проведение плавления реакционной смеси в диапазоне температур, включающем температуру плавления дуплекса, образуемого 5'-сегментом мишень-специфичного зонда и сигнальным зондом, подразумевающее пошаговое изменение температуры реакционной смеси со считыванием флуоресцентного сигнала на каждом шаге, при этом сигнал при плавлении дуплекса генерируется за счет разобщения меток, имеющих перекрывающиеся спектры поглощения и испускания, входящих в состав отщепленного 5'-сегмента мишень-специфичного зонда и сигнального зонда, а нерасщепленный мишень-специфичный зонд образует недетектируемый дуплекс с сигнальным зондом, при плавлении которого сигнал не генерируется, за счет присутствия в его составе двух взаимодействующих меток с перекрывающимися спектрами поглощения и испускания; при этом дифференциация дуплексов, соответствующих идентифицируемым различающимся участкам последовательностей ДНК, осуществляется по двум параметрам - канал детекции и/или температура плавления;
при этом варианты сочетания меток мишень-специфичного и сигнального зондов для каждой из идентифицируемых различающихся последовательностей ДНК выбирают из следующих двух вариантов:
1) 3'-сегмент мишень-специфичного зонда и сигнальный зонд в качестве метки несут в своем составе гаситель флуоресценции или репортерный флуорофор, а 5'-сегмент мишень-специфичного зонда - флуорофор, для которого спектр испускания перекрывается со спектром поглощения, этого гасителя флуоресценции или репортерного флуорофора,
2) 3'-сегмент мишень-специфичного зонда и сигнальный зонд несут в своем составе флуорофор, а 5'-сегмент мишень-специфичного зонда - гаситель флуоресценции или репортерный флуорофор, для которых спектр поглощения перекрывает спектр испускания этого флуорофора.
2. Способ по п. 1, в котором осуществляют определение от 1 до 10 идентифицируемых последовательностей ДНК в одном канале детекции амплификатора.
3. Способ по п. 2, в котором осуществляют определение от 1 до 10 идентифицируемых последовательностей ДНК в каждом канале детекции амплификатора.
4. Способ по п. 1, в котором проведение плавления реакционной смеси осуществляют с шагом от 0,01 до 1°С.
5. Способ по п. 1, в котором проведение плавления реакционной смеси осуществляют с шагом 0,5°С.
6. Способ по п. 1, в котором проведение плавления реакционной смеси осуществляют в диапазоне температур от 0°С до 100°С.
7. Способ по п. 8, в котором температура плавления дуплекса, образуемого 5'-сегментом мишень-специфичного зонда и сигнальным зондом, по меньшей мере для одной из идентифицируемых последовательностей ДНК, ниже температуры плавления праймеров, входящих в реакционную смесь.
8. Способ по п. 1, в котором в качестве флуорофора или репортерного флуорофора используют по меньшей мере один из красителей карбоксифлуоресцеин (FAM), 6-карбоксиродамин (R6G), карбокси-Х-родамин (ROX), тетраметилкарбоксиродамин (TAMRA), 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин (6-JOE), тиадикарбоцианин, Су5™.
9. Способ по п. 1, в котором в качестве гасителя флуоресценции используют гаситель флуоресценции серии BHQ и/или RTQ.
10. Способ по п. 1, в котором в качестве термостабильного фермента, обладающего 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, используют Taq ДНК полимеразу.
11. Способ по п. 1, в котором сигнальный зонд иммобилизован на твердую фазу.
12. Способ по любому из пп. 1-11, в котором осуществляют идентификацию по меньшей мере двух различающихся последовательностей ДНК, при этом реакционная смесь включает по меньшей мере
два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК, но содержат одинаковые флуорофоры, и
5'-сегменты которых различаются по температуре плавления, но содержат при этом одинаковые гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания вышеуказанного флуорофора,
два сигнальных зонда, содержащих флуорофоры, идентичные или близкие по спектрам поглощения и испускания флуорофорам 3'-сегментов мишень-специфичных зондов,
при этом дуплексы, образуемые сигнальными зондами и соответствующими комплементарными им 5'-сегментами мишень-специфичных зондов, имеют разную температуру плавления, по которой осуществляют дифференциацию различающихся идентифицируемых последовательностей ДНК.
13. Способ по любому из пп. 1-11, в котором осуществляют идентификацию по меньшей мере двух различающихся последовательностей ДНК, при этом реакционная смесь включает по меньшей мере
два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК и содержат при этом разные флуорофоры, и
5'-сегменты которых уникальны по последовательности, то есть способны образовать дуплексы только с соответствующими комплементарными им сигнальными зондами, но одинаковы по температуре плавления и содержат при этом разные гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания флуорофора 3'-сегмента этого же мишень-специфичного зонда,
два сигнальных зонда, содержащих флуорофоры, идентичные или близкие по спектрам поглощения и испускания флуорофорам 3'-сегментов соответствующих комплементарных им мишень-специфичных зондов;
при этом дуплексы, образуемые сигнальными зондами и соответствующими комплементарными им 5'-сегментами мишень-специфичных зондов, имеют одинаковую температуру плавления, а дифференциацию различающихся идентифицируемых последовательностей ДНК осуществляют за счет их детекции в различных каналах амплификатора.
14. Набор для специфической идентификации по меньшей мере одной последовательности ДНК в образце способом по п. 1 путем проведения полимеразной цепной реакции (ПЦР), включающий по меньшей мере
одну пару зондов, в которой
один представляет собой мишень-специфичный олигонуклеотидный зонд, имеющий
3'-сегмент, комплементарный идентифицируемому участку последовательности ДНК и содержащий метку, и
5'-сегмент, некомплементарный идентифицируемой последовательности ДНК, последовательность которого выбирается так, чтобы дуплекс, который он образует с сигнальным зондом в процессе ПЦР, имел заданную температуру плавления, и содержащий метку,
а другой - олигонуклеотидный сигнальный зонд, комплементарный 5'-сегменту мишень-специфичного зонда и содержащий метку, идентичную или близкую по спектрам поглощения и испускания метке, содержащейся на 3'-сегменте мишень-специфичного зонда;
выполненных таким образом, что в процессе прохождения ПЦР мишень-специфичный зонд, при гибридизации с идентифицируемой последовательностью ДНК, расщепляется термостабильным ферментом, обладающим 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, с высвобождением 5'-сегмента и разобщением входящих в состав мишень-специфичного зонда меток, а 5'-сегмент, в свою очередь, гибридизуется с сигнальным зондом, образуя с ним дуплекс;
при этом варианты сочетания меток мишень-специфичного и сигнального зондов для каждой из идентифицируемых различающихся последовательностей ДНК выбирают из следующих двух вариантов:
1) 3'-сегмент мишень-специфичного зонда и сигнальный зонд в качестве метки несут в своем составе гаситель флуоресценции или репортерный флуорофор, а 5'-сегмент мишень-специфичного зонда - флуорофор, для которого спектр испускания перекрывает спектр поглощения, этого гасителя флуоресценции или репортерного флуорофора,
2) 3'-сегмент мишень-специфичного зонда и сигнальный зонд несут в своем составе флуорофор, а 5'-сегмент мишень-специфичного зонда - гаситель флуоресценции или репортерный флуорофор, для которых спектр поглощения перекрывает спектр испускания этого флуорофора.
15. Набор по п. 14, включающий по меньшей мере одну пару зондов для выявления каждой из идентифицируемых различающихся последовательностей ДНК.
16. Набор по п. 15, дополнительно включающий термостабильный фермент, обладающий 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, и для каждой из идентифицируемых различающихся последовательностей ДНК по меньшей мере одну пару праймеров, специфичных для этой последовательности ДНК.
17. Набор по п. 16, в котором термостабильный фермент, обладающий 5'→3' ДНК полимеразной и 5'→3' экзонуклеазной активностью, представляет собой Taq ДНК полимеразу.
18. Набор по п. 14, предназначенный для определения от 1 до 10 идентифицируемых последовательностей ДНК в одном канале детекции амплификатора.
19. Набор по п. 18, предназначенный для определения от 1 до 10 идентифицируемых последовательностей ДНК в каждом канале детекции амплификатора.
20. Набор по п. 14, в котором флуорофор или репортерный флуорофор выбран из карбоксифлуоресцеина (FAM), 6-карбоксиродамина (R6G), карбокси-Х-родамина (ROX), тетраметилкарбоксиродамина (TAMRA), 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеина (6-JOE), тиадикарбоцианина, Су5™.
21. Набор по п. 14, в котором гаситель флуоресценции выбран из гасителей серии BHQ и/или RTQ.
22. Набор по п. 21, в котором гаситель флуоресценции выбран из BHQ-1, BHQ-2, BHQ-3.
23. Набор по п. 14, в котором по меньшей мере для одной из идентифицируемых последовательностей ДНК зонды выполнены таким образом, что температура плавления дуплекса, образуемого 5'-сегментом мишень-специфичного зонда и сигнальным зондом, ниже температуры плавления праймеров, специфичных для этой последовательности ДНК.
24. Набор по п. 14, в котором сигнальный зонд иммобилизован на твердую фазу.
25. Набор по любому из пп. 14-23, включающий каждый из компонентов в необходимых для проведения анализа количествах.
26. Набор по п. 14, характеризующийся тем, что при плавлении реакционной смеси, получаемой в результате смешивания компонентов набора, в диапазоне температур, включающем температуру плавления дуплекса входящих в набор мишень-специфичного и сигнального зондов, без предварительного проведения ПЦР, указанные дуплексы не детектируются.
27. Набор по любому из пп. 14-25, включающий по меньшей мере два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК, но содержат одинаковые флуорофоры, и
5'-сегменты которых содержат одинаковые гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания вышеуказанного флуорофора, но различаются по температуре плавления так, чтобы обеспечить возможность осуществить дифференциацию различающихся идентифицируемых последовательностей ДНК по температуре плавления.
28. Набор по любому из пп. 14-25, включающий по меньшей мере два различающихся мишень-специфичных зонда,
3'-сегменты каждого из которых комплементарны одной из идентифицируемых последовательностей ДНК и содержат при этом разные флуорофоры так, чтобы обеспечить возможность дифференциации различающихся идентифицируемых последовательностей ДНК по спектрам испускания флуорофоров, и
5'-сегменты которых уникальны по последовательности, то есть способны образовать дуплексы только с соответствующими комплементарными им сигнальными зондами, но одинаковы по температуре плавления и содержат при этом разные гаситель флуоресценции или репортерный флуорофор, спектр поглощения которых перекрывает спектр испускания флуорофора 3'-сегмента этого же мишень-специфичного зонда.
| ОПРЕДЕЛЕНИЕ ЦЕЛЕВЫХ НУКЛЕИНОВОКИСЛОТНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ПУТЕМ РАСЩЕПЛЕНИЯ ЗОНДИРУЮЩЕГО ОЛИГОНУКЛЕОТИДА И ГИБРИДИЗАЦИИ | 2012 |
|
RU2588457C2 |
| ДИСКРИМИНИРУЮЩИЙ МИШЕНЬ ЗОНД, СПОСОБ ЕГО КОНСТРУИРОВАНИЯ И СПОСОБ ДЕТЕКЦИИ НУКЛЕИНОВОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ-МИШЕНИ (ВАРИАНТЫ) | 2010 |
|
RU2542478C2 |
| СПОСОБ ДЕТЕКТИРОВАНИЯ ПРИСУТСТВИЯ МИШЕНЕВОЙ ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВОЙ КИСЛОТЫ, СПОСОБ ДЕТЕКТИРОВАНИЯ АМПЛИФИКАЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ, СПОСОБ ОПРЕДЕЛЕНИЯ СВОЙСТВ ПОСЛЕДОВАТЕЛЬНОСТИ, СПОСОБ ДЕТЕКТИРОВАНИЯ ПОЛИМОРФИЗМОВ И/ИЛИ АЛЛЕЛЬНОЙ ВАРИАЦИИ, НАБОР | 1999 |
|
RU2199588C2 |
| ДЕТЕКЦИЯ НУКЛЕИНОВОКИСЛОТНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ-МИШЕНЕЙ В АНАЛИЗЕ С РАСЩЕПЛЕНИЕМ И УДЛИНЕНИЕМ РТО | 2012 |
|
RU2566562C2 |
| WO 2012140224 A1, 18.10.2012. | |||
Авторы
Даты
2018-09-03—Публикация
2017-01-25—Подача