ОБЛАСТЬ ТЕХНИКИ
[001] Изобретение в целом относится к композициям и способам иммунотерапии рака и, в частности, иммуногенным гликоконъюгатам, способным вызывать противораковые иммунные ответы.
УРОВЕНЬ ТЕХНИКИ
[002] Применение синтетических углеводных конъюгатов для выработки антител впервые продемонстрировали Гебель (Goebel) и Эйвери (Avery) в 1929 году. (Goebel, W.F., and Avery, О.Т., J. Exp. Med., 1929, 50, 521; Avery, О.Т., and Goebel, W.F., J. Exp. Med., 1929, 50, 533.) Углеводы были связаны с белками-носителями через гликозиды фенилдиазония. Иммунизация кроликов синтетическими антигенами приводила к выработке поликлональных антител. Другие исследователи (Allen, P.Z., and Goldstein, I.J., Biochemistry, 1967, 6, 3029; Rude, E., and Delius, M.M., Carbohydr. Res., 1968, 8, 219; Himmelspach, K., et al., Eur. J. Immunol., 1971, 1, 106; Fielder, R.J., et al., J. Immunol., 1970, 105, 265) разработали аналогичные способы конъюгации углеводов с белками-носителями.
[003] Гликоконъюгаты можно применять в активной иммунотерапии, полученной в результате вакцинации для специфического нацеливания на известные целевые агенты на опухолевых клетках. Ответ на углеводные антигены обычно не вовлекает T-клетки, которая могла бы способствовать отторжению опухоли организмом. Поскольку предполагается, что возможность полного отторжения опухоли в результате вакцинации конъюгатом маловероятна, такое лечение будет повышать иммунный надзор и может снижать повторное появление новых опухолевых колоний. (Dennis, J., Oxford Glycosystems Glyconews Second, 1992; Lloyd, K.О., in Specific Immunotherapy of Cancer with Vaccines, 1993, New York Academy of Sciences, 50-58). Тоёкуни (Toyokuni) и Сингхал (Singhal) описали синтетический гликоконъюгат (Toyokuni, Т., et al., J. Am. Chem. Soc., 1994, 116, 395), который приводил к появлению титра IgG на детектируемом уровне, что является существенным, поскольку IgG-ответ в основном связан с вовлечением клеток T-хелперов.
[004] Углеводный антиген Globo Н (Fucα1→2 GalB1→3 GalNAcβ1→3 Galα1→4 Galβ1→4 Glc) впервые выделен в виде церамид-связанного гликолипида и идентифицирован в 1984 году Хакомори (Hakomori) др. в клетках рака молочной железы MCF-7. (Bremer Е G, et al. (1984) J Biol Chem 259: 14773-14777). Дальнейшие исследования с использованием моноклональных антител к Globo Н показали, что Globo Н присутствует при многих других видах рака, включая рак предстательной железы, желудка, поджелудочной железы, легких, яичников и рак толстой кишки, и имеет лишь минимальный уровень экспрессии на люминальной поверхности нормальной секреторной ткани, которая не является легкодоступной для иммунной системы. (Ragupathi G, et al. (1997) Angew Chem Int Ed 36: 125-128). Кроме того, было установлено, что сыворотка пациента с раком молочной железы содержит высокий уровень антител к Globo Н. (Gilewski Т et al. (2001) Proc Natl Acad Sci USA 98: 3270-3275; Huang C-Y, et al. (2006) Proc Natl Acad Sci USA 103: 15-20; Wang C-C, et al. (2008) Proc Natl Acad Sci USA 105(33): 11661-11666). Пациенты с опухолями, положительными по Globo Н, показывали более короткий период выживаемости по сравнению с пациентами с опухолями, отрицательными по Globo Н. (Chang, Y-J, et al. (2007) Proc Natl Acad Sci USA 104(25): 10299-10304). Эти данные указывают на то, что Globo Н, гексасахаридный эпитоп, является представляющим интерес опухолевым маркером и подходящей мишенью для создания вакцины против рака.
[005] Было показано, что вакцина с синтетическим Globo Н в сочетании с иммунологическим адъювантом стимулирует образование в основном антител IgM и в меньшей степени антител IgG у пациентов с раком предстательной железы и метастатическим раком молочной железы. В I фазе клинических испытаний вакцина также продемонстрировала минимальную токсичность, сопровождающуюся временными местными кожными реакциями в месте вакцинации. (Gilewski Т et al. (2001) Proc Natl Acad Sci USA 98: 3270-3275; Ragupathi G, et al. (1997) Angew Chem Int Ed 36: 125-128; Slovin S F et al. (1997) Proc Natl Acad Sci USA 96: 5710-5715). У некоторых пациентов наблюдали легкие гриппоподобные симптомы, которые вероятно связаны с побочным эффектом QS-21. Сообщалось, что пятивалентная вакцина, содержащая пять углеводных антигенов, ассоцированных с раком предстательной железы и раком молочной железы - Globo-H, GM2, STn, TF и Tn-конъюгированых с белком-носителем KLH, модифицированным малеимидом, приводит к выработке антител к Globo H с более высокими титрами IgG, чем IgM в сыворотке крови, по данным ИФА-анализа. (Zhu J. et al. (2009) J. Am. Chem. Soc. 131(26): 9298-9303).
[006] Известно, что KLH содержит гликозилированные полипептидные субъединицы, которые собираются с образованием декамерных (10-мерных), дидекамерных (20-мерных) и более крупных частиц. Эти мультимерные структуры были охарактеризованы способами ультрацентрифугирования, в результате чего получены коэффициенты седиментации 11-19S для диссоциированных субъединиц и 92-107S для дидекамерных мультимеров. Также известно, что на распределение по размерам гемоцианинов моллюска, включая KLH, могут влиять различные факторы. Указанные факторы включают в себя ионную силу, pH, температуру, pO2 и наличие определенных двухвалентных катионов, особенно кальция и магния. Авторы настоящего изобретения разработали композицию с повышенной эффективностью, которая преимущественно состоит из димеров и тримеров KLH, связанных со множеством единиц Globo H.
[007] Несмотря на то, что уже были разработаны вакцины для получения гуморального иммунного ответа против Globo H, противораковая эффективность указанных вакцин не удовлетворительна из-за низкой антигенности Globo H. Существует потребность в новой вакцине, способной вызывать высокие уровни иммунных ответов, нацеленных на Globo Н.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[008] Настоящее изобретение в целом охватывает терапевтические и/или профилактические композиции, содержащие Globo Н, а также иммунотерапевтические средства, вакцины, дозированные формы, наборы и способы получения, и их применение.
[009] В одном варианте реализации, настоящее изобретение охватывает выделенный терапевтический конъюгат, содержащий группу Globo Н, связанную с субъединицой гемоцианина фиссуреллы (KLH). В некоторых вариантах реализации указанная связь представляет собой ковалентную связь.
[010] В другом варианте реализации изобретение охватывает выделенный терапевтический конъюгат, содержащий группу Globo Н, ковалентно связанную с субъединицей гемоцианина фиссуреллы (KLH), где KLH представляет собой дериватизированный KLH. В контексте настоящего описания термин "ковалентно связанный", относящийся к Globo-H и KLH, означает: Globo-H непосредственно ковалентно связан с KLH, или Globo-H ковалентно связан с дериватизированным KLH (как изложено в настоящем описании), или Globo-H ковалентно связан с KLH через линкерную группу (как изложено в настоящем описании), или Globo-H ковалентно связан с KLH и через линкерную группу и дериватизированный KLH.
[011] В некоторых иллюстративных вариантах реализации дериватизированный KLH согласно настоящему изобретению имеет следующую структуру:
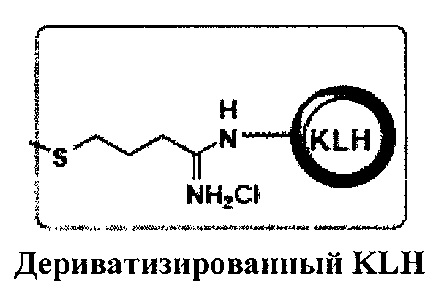 .
.
[012] В другом варианте реализации, настоящее изобретение охватывает выделенный терапевтический конъюгат, содержащий группу Globo H, ковалентно связанную с субъединицей гемоцианина фиссуреллы (KLH) через молекулу линкера.
[013] В предпочтительном варианте реализации группы Globo H связаны с остатком лизина остатка субъединицы KLH.
[014] В одном варианте реализации существует в общей сложности точно или приблизительно 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160 суммарное число остатков лизина в расчете на субъединицу KLH, которые доступны для связывания или фактически непосредственно или опосредованно связаны с группой Globo H.
[015] В другом варианте реализации изобретение охватывает выделенный терапевтический конъюгат, содержащий группу Globo Н, ковалентно связанную с субъединицей гемоцианина фиссуреллы (KLH) через 4-(4-N-малеимидометил)-циклогексан-1-карбоксилгидразидную (MMCCH) линкерную группу. Линкер ММССН согласно настоящему изобретению имеет следующую структуру:
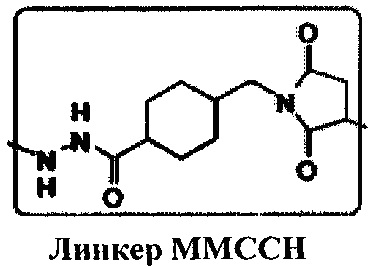 .
.
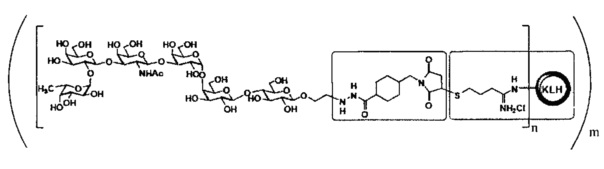
[016] В другом иллюстративном варианте реализации изобретение охватывает выделенный терапевтический конъюгат, имеющий следующую общую структуру:
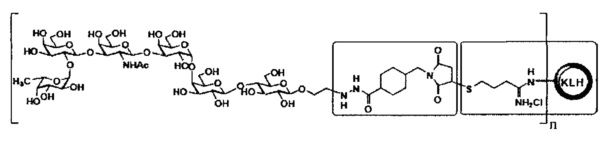 ,
,
где n представляет собой целое число приблизительно от 1 приблизительно до 160. В некоторых вариантах реализации мономер KLH может содержать приблизительно от 1 приблизительно до 160 единиц Globo Н. Специалисту в данной области техники будет понятно, что структуры представлены в виде иминиевой гидрохлоридной соли, но могут также существовать или сосуществовать в виде имина. Соответственно, настоящее изобретение охватывает как имин, так и их соли, включая иминиевую гидрохлоридную соли. В некоторых вариантах реализации мономер KLH может содержать приблизительно от 1 приблизительно до 125 единиц Globo H. В некоторых вариантах реализации мономерный остаток KLH может содержать приблизительно от 1 приблизительно до 100 единиц Globo H. В некоторых вариантах реализации мономерный остаток KLH может содержать приблизительно от 1 приблизительно до 75 единиц Globo H. В некоторых вариантах реализации мономерный остаток KLH может содержать приблизительно от 1 приблизительно до 50 единиц Globo Н. В некоторых вариантах реализации мономерный остаток KLH может содержать приблизительно от 1 приблизительно до 25 единиц Globo H. В некоторых вариантах реализации мономерный остаток KLH может содержать приблизительно от 1 приблизительно до 10 единиц Globo H.
[017] В некоторых вариантах реализации группы Globo Н ковалентно связаны с группами KLH через остатки основных аминокислот. В некоторых вариантах реализации указанные остатки основных аминокислот представляют собой аргинин, лизин, гистидин или их комбинацию.
[018] В другом варианте реализации группы Globo H связаны с лизиновыми сайтами конъюгации на мономере субъединицы KLH.
[019] В другом варианте реализации существует точно или приблизительно 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109 или 110 лизиновых сайтов конъюгации на каждом мономере субъединицы KLH, которые доступны для связывания или фактически связаны с группой Globo H. В другом варианте реализации существует 62, 66, 67, 68, 70, 72, 76, 86, 87, 88, 90, 92, 93, 100 таких лизиновых сайтов конъюгации на каждой субъединице KLH.
[020] В некоторых вариантах реализации терапевтических композиций, содержащих смесь субъединиц (например, KLH1 и KLH2 или их вариантов), суммарное число доступных лизинов (для обеих субъединиц), как подсчитано вместе для разных видов субъединиц, составляет или может составлять точно или приблизительно 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 или 310. В таких вариантах реализации существует или может существовать точно или приблизительно 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160 лизиновых сайтов конъюгации вместе для разных субъединиц (например, KLH1 и KLH2 или их вариантов). В таких других вариантах реализации существует 136, 137, 141, 140, 143, 147 или 155 лизиновых сайтов конъюгации.
[021] В другом иллюстративном варианте реализации изобретение охватывает выделенный терапевтический конъюгат, имеющий следующую общую структуру:
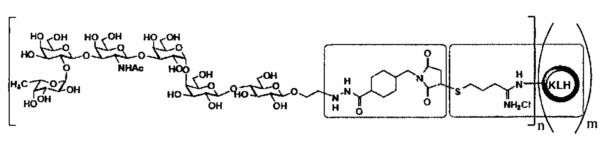 ,
,
где n независимо представляет собой целое число приблизительно от 1 приблизительно до 3000, и m независимо представляет собой целое число приблизительно от 1 приблизительно до 20. В некоторых вариантах реализации, когда m больше 1, единицы KLH могут агрегировать с образованием мультимерных структур. В некоторых вариантах реализации агрегирование означает ковалентную связь. В некоторых других вариантах реализации агрегирование не означает ковалентную связь (например, агрегирование формируется посредством Н-связей или гидрофобных взаимодействий). В некоторых вариантах реализации мономерный остаток KLH (т.е., когда m=1) может содержать приблизительно от 1 приблизительно до 160 групп Globo H. В некоторых вариантах реализации димерный остаток KLH (т.е., когда m=2) может содержать приблизительно от 1 приблизительно до 300 групп Globo H. В некоторых вариантах реализации тримерный остаток KLH (т.е., когда m=3) может содержать приблизительно от 1 приблизительно до 450 групп Globo Н. В некоторых вариантах реализации тетрамерный остаток KLH (т.е., когда m=4) может содержать приблизительно от 1 приблизительно до 600 групп Globo Н. В некоторых вариантах реализации пентамерный остаток KLH (т.е., когда m=5) может содержать приблизительно от 1 приблизительно до 750 групп Globo H.
[022] В другом иллюстративном варианте реализации изобретение охватывает выделенный терапевтический конъюгат, имеющий следующую общую структуру:
 ,
,
где n независимо представляет собой целое число приблизительно от 1 приблизительно до 150, и m независимо представляет собой целое число приблизительно от 1 приблизительно до 20.
[023] В других вариантах реализации изобретение охватывает выделенный терапевтический конъюгат, имеющий следующую общую структуру:
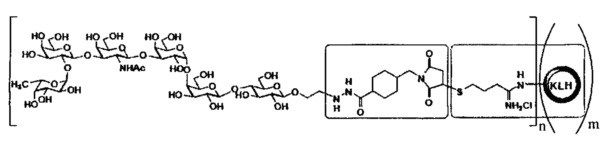 ,
,
где n независимо представляет собой целое число приблизительно от 1 приблизительно до 160, и где m независимо представляет собой целое число приблизительно от 1 приблизительно до 20. В некоторых вариантах реализации m представляет собой целое число приблизительно от 1 приблизительно до 5. В некоторых вариантах реализации m представляет собой целое число приблизительно от 1 приблизительно до 3. В некоторых вариантах реализации m равно 1. В некоторых вариантах реализации m равно 2. В некоторых вариантах реализации m представляет собой 3. В некоторых вариантах реализации m равно 4. В некоторых вариантах реализации m равно 5. В некоторых вариантах реализации m равно 6. В некоторых вариантах реализации m равно 7. В некоторых вариантах реализации m равно8. В некоторых вариантах реализации m равно 9. В некоторых вариантах реализации m равно 10. В некоторых вариантах реализации m равно 11. В некоторых вариантах реализации m равно 12. В некоторых вариантах реализации m равно 13. В некоторых вариантах реализации m равно 14. В некоторых вариантах реализации m равно 15. В некоторых вариантах реализации m равно 16. В некоторых вариантах реализации m равно 17. В некоторых вариантах реализации m равно 18. В некоторых вариантах реализации m равно 19. В некоторых вариантах реализации m равно 20. В некоторых вариантах реализации для любого из вышеупомянутых вариантов, когда m равно от 1 до 20, каждое n равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91,92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160, соответственно.
[024] В некоторых вариантах реализации более чем одна единица Globo H прикреплена к каждому мономеру KLH. В некоторых иллюстративных вариантах реализации более чем одна единица Globo H прикреплена к каждой единице KLH через линкер. В других иллюстративных вариантах реализации более чем одна единица Globo H прикреплена к каждой единице KLH через линкер и прикреплена к дериватизированному остатку KLH.
[025] В другом варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 1. В другом варианте реализации отношение числа единиц Globo H к числу субъединиц KLH составляет по меньшей мере 10. В другом варианте реализации отношение числа единиц Globo Н к числу KLH составляет по меньшей мере 25. В другом варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 50. В еще одном варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 100. В еще одном варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 150. В еще другом варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 500. В еще одном варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 750. В еще одном другом варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 1000. В еще одном другом варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 1500. В еще одном другом варианте реализации отношение числа единиц Globo Н к числу субъединиц KLH составляет по меньшей мере 2000.
[026] В различных вариантах реализации изобретение охватывает одиночные мономеры KLH или несколько субъединиц KLH (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20), к каждой из которых прикреплено несколько единиц Globo Н. В некоторых вариантах реализации отношение числа единиц Globo Н к числу KLH является одинаковым. В других вариантах реализации отношение числа единиц Globo Н к числу KLH является разным.
[027] Другой вариант реализации изобретения охватывает композицию, содержащую по меньшей мере две единицы KLH. Например, дериватизированные единицы KLH в форме димера. В другом варианте реализации указанные по меньшей мере две единицы KLH являются одинаковыми. В другом варианте реализации указанные по меньшей мере две единицы KLH являются разными. В еще одном варианте реализации указанные по меньшей мере две единицы KLH имеют одинаковое отношение числа единиц Globo Н к числу субъединиц KLH. В еще одном варианте реализации указанные по меньшей мере две единицы KLH имеют разное отношение числа единиц Globo Н к числу субъединиц KLH.
[028] Другой вариант реализации изобретения охватывает терапевтическую композицию, содержащую по меньшей мере три единицы KLH, например, дериватизированные единицы KLH в форме тримера. В некоторых вариантах реализации указанные по меньшей мере три единицы KLH являются одинаковыми. В другом варианте реализации указанные по меньшей мере три единицы KLH не являются одинаковыми. В еще одном варианте реализации указанные по меньшей мере три единицы KLH имеют одинаковое отношение числа единиц Globo Н к числу субъединиц KLH. В еще одном варианте реализации указанные по меньшей мере три единицы KLH имеют разное отношение числа единиц Globo Н к числу субъединиц KLH.
[029] Другой вариант реализации изобретения охватывает терапевтическую композицию, содержащую по меньшей мере четыре единицы KLH, например, дериватизированные единицы KLH в форме тетрамера. В некоторых вариантах реализации указанные по меньшей мере четыре единицы KLH являются одинаковыми. В другом варианте реализации указанные по меньшей мере четыре единицы KLH не являются одинаковыми. В еще одном варианте реализации указанные по меньшей мере четыре единицы KLH имеют одинаковое отношение числа единиц Globo Н к числу субъединиц KLH. В еще одном варианте реализации указанные по меньшей мере четыре единицы KLH имеют разное отношение числа Globo Н к числу субъединиц KLH.
[030] Другой вариант реализации изобретения охватывает терапевтическую композицию, содержащую по меньшей мере пять единиц KLH, например, дериватизированные единицы KLH в форме пентамера. В некоторых вариантах реализации указанные по меньшей мере пять единиц KLH являются одинаковыми. В другом варианте реализации указанные по меньшей мере пять единиц KLH не являются одинаковыми. В еще одном варианте реализации указанные по меньшей мере пять единиц KLH имеют одинаковое отношение числа Globo Н к числу субъединиц KLH. В еще одном варианте реализации указанные по меньшей мере пять единиц KLH имеют разное отношение числа Globo Н к числу субъединиц KLH.
[031] Другой вариант реализации изобретения охватывает терапевтическую композицию, содержащую по меньшей мере шесть единиц KLH, например, дериватизированные группы KLH в форме гексамера. В некоторых вариантах реализации указанные по меньшей мере шесть единиц KLH являются одинаковыми. В другом варианте реализации указанные по меньшей мере шесть единиц KLH не являются одинаковыми. В еще одном варианте реализации указанные по меньшей мере шесть единиц KLH имеют одинаковое отношение числа Globo Н к числу субъединиц KLH. В еще одном варианте реализации указанные по меньшей мере шесть единиц KLH имеют разное отношение числа Globo Н к числу субъединиц KLH.
[032] В одном варианте реализации единица Globo Н содержит (Fucα1→2 Galβ1→3 GalNAcβ1→3 Galα1→4 Galβ1→4 Glc). В еще одном варианте реализации субъединица KLH представляет собой KLH-1 или KLH-2 или их комбинацию. В контексте настоящего описания термин "KLH" относится к KLH-1, KLH-2, и/или их комбинации.
[033] В другом варианте реализации субъединица KLH по меньшей мере на 99% идентична соответствующей встречающейся в природе субъединице KLH.
[034] В другом варианте реализации субъединица KLH по меньшей мере на 95% идентична соответствующей встречающейся в природе субъединице KLH.
[035] В другом варианте реализации субъединица KLH по меньшей мере на 90% идентична соответствующей встречающейся в природе субъединице KLH.
[036] В другом варианте реализации субъединица KLH по меньшей мере на 80% идентична соответствующей встречающейся в природе субъединице KLH.
[037] В другом варианте реализации остаток субъединицы KLH по меньшей мере на 70% идентична соответствующей встречающейся в природе субъединице KLH.
[038] В другом варианте реализации остаток субъединицы KLH по меньшей мере на 60% идентична соответствующей встречающейся в природе субъединице KLH.
[039] В другом варианте реализации группа Globo Н ковалентно связана с субъединицей гемоцианина фиссуреллы (KLH) через линкер. В еще одном варианте реализации группа Globo Н ковалентно связана с субъединицей гемоцианина фиссуреллы (KLH) через 4-(4-N-малеимидометил)-циклогексан-1-карбоксилгидразидную (MMCCH) линкерную группу. В еще одном другом варианте реализации группа Globo Н ковалентно связана с дериватизированной субъединицей гемоцианина фиссуреллы (KLH) и связана через 4-(4-N-малеимидометил)-циклогексан-1-карбоксилгидразидную (MMCCH) группу линкер.
[040] В другом варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов на основе мономера KLH, имеющего молекулярную массу приблизительно от 350 кДа приблизительно до 400 кДа, по меньшей мере или приблизительно 150. В другом варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов по меньшей мере или приблизительно 100. В еще одном варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов по меньшей мере или приблизительно 75. В еще одном варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов по меньшей мере или приблизительно 50. В еще одном варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов по меньшей мере или приблизительно 25. В еще одном другом варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов по меньшей мере или приблизительно 15. В еще одном другом варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов по меньшей мере или приблизительно 5. В еще одном другом варианте реализации выделенный терапевтический конъюгат имеет отношение эпитопов по меньшей мере или приблизительно 1.
[041] Другой вариант реализации изобретения охватывает фармацевтическую композицию, содержащую субъединицы KLH, где каждая субъединица KLH содержит одну или более группу Globo Н, ковалентно связанную с субъединицей гемоцианина фиссуреллы (KLH). В некоторых вариантах реализации фармацевтическая композиция содержит димеры по меньшей мере двух субъединиц KLH, где каждая субъединица KLH содержит одну или более группу Globo Н, ковалентно связанную с субъединицей KLH. В некоторых вариантах реализации фармацевтическая композиция содержит тримеры по меньшей мере трех субъединиц KLH, где каждая субъединица KLH содержит одну или более группу Globo Н, ковалентно связанную с субъединицей KLH. В некоторых вариантах реализации фармацевтическая композиция содержит по меньшей мере четыре субъединицы KLH, где каждая субъединица KLH содержит одну или более группу Globo Н, ковалентно связанную с субъединицей KLH. В некоторых вариантах реализации фармацевтическая композиция содержит смесь субъединиц KLH (например, мономеры, димеры, тримеры, тетрамеры, пентамеры и т.д.), где каждая субъединица KLH содержит несколько групп Globo Н, ковалентно связанных с субъединицей KLH.
[042] В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей мономеры, димеры, тримеры, тетрамеры или пентамеры, или их комбинации субъединиц KLH, где каждый KLH содержит один или более групп Globo Н, ковалентно связанных с субъединицей гемоцианина фиссуреллы (KLH).
[043] В одном варианте реализации настоящего изобретения отношения эпитопов терапевтических конъюгатов в композиции находятся в диапазоне приблизительно от 1 до 3000. В еще одном варианте реализации отношения эпитопов терапевтических конъюгатов в композиции находятся в диапазоне приблизительно от 75 до 2000. В еще одном другом варианте реализации отношения эпитопов терапевтических конъюгатов в композиции находятся в диапазоне приблизительно от 100 до 1000. В еще одном варианте реализации среднее отношение эпитопов терапевтических конъюгатов в композиции находится в диапазоне приблизительно от 150 до 500.
[044] В другом варианте реализации приблизительно от 1% до 99% терапевтических конъюгатов в композиции представляют собой мономеры KLH. В еще одном варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции представляют собой димеры KLH. В еще одном другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции представляют собой тримеры KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции представляют собой тетрамеры KLH. В еще одном варианте реализации приблизительно от 1% до 99% терапевтических конъюгатов в композиции представляют собой пентамеры KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 6 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 7 субъединиц. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 8 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 9 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 10 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 11 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 12 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 13 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 14 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 15 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 16 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 17 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 18 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 19 субъединиц KLH. В еще другом варианте реализации приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 20 субъединиц KLH. В еще одном другом варианте реализации приблизительно от 1% до 99% терапевтических конъюгатов в композиции представляют собой мономеры, димеры, тримеры, тетрамеры или их комбинации. В еще одном другом варианте реализации приблизительно 99% терапевтических конъюгатов в композиции представляют собой мономеры, димеры, тримеры, тетрамеры или их комбинации.
[045] В другом варианте реализации фармацевтическая композиция содержит адъювант включая, без ограничения, адъювант Фрейнда, молекулы Toll-подобного рецептора, ЛПС, липопротеины, липопептиды, флагеллин, двухцепочечную РНК, вирусную ДНК, неметилированные CpG-островки, левамизол, бациллу Кальметта-Герена, изопринозин, задаксин, антагонисты PD-1, антитела PD-1, антагонисты CTLA, антитела CTLA, интерлейкин, цитокины, GM-CSF, гликолипид, соль на основе алюминия, фосфат алюминия, квасцы, гидроксид алюминия, липосомы, агонисты TLR2, липопептид, наночастицы, монофосфорил-липид A, сапонин OPT-821, QS-21 сапонин, наноэмульсии масло в воде, и бактериеподобные частицы.
[046] В другом варианте реализации указанная фармацевтическая композиция содержит цитокин, выбранный из группы, состоящей из IL-2, IL-12, IL-18, IL-2, IFN-γ, TNF, IL-4, IL-10, IL-13, IL-21, GM-CSF и TGF-β. В еще одном варианте реализации указанная фармацевтическая композиция содержит хемокин.
[047] В еще одном варианте реализации указанный терапевтический агент вводят в виде фармацевтической композиции.
[048] В еще одном другом варианте реализации указанная фармацевтическая композиция содержит моноклональные антитела, химиотерапевтические вещества, гормональные терапевтические агенты, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические агенты, противоопухолевые агенты, противопролиферативные агенты, агенты против mTOR, агенты против Her2, агенты против EGFR, ингибиторы пренилпротеинтрансферазы, ингибиторы редуктазы ГМГ-KoA, азотистые иприты, нитрозомочевины, ингибиторы ангиогенеза, бевацизумаб, ингибиторы клеточной пролиферации и сигнальных путей выживания, агенты, вызывающие апоптоз, агенты, которые нарушают контрольные точки клеточного цикла, агенты, которые взаимодействуют с рецепторными тирозинкиназами (RTK), ингибиторы интегрина, НПВС, агонисты PPAR, ингибиторы множественной лекарственной устойчивости (MDR), противорвотные агенты, агенты, подходящие для лечения анемии, агенты, подходящие для лечения нейтропении, средства повышающие иммунитет, бисфосфонаты, ингибиторы ароматазы, агенты, индуцирующие терминальную дифференцировку опухолевых клеток, ингибиторы γ-секретазы, противораковые вакцины (например, активная иммунотерапия), терапевтические средства на основе моноклональных антител (например, пассивная иммунотерапия), и любые их комбинации.
[049] В другом варианте реализации терапевтические композиции согласно настоящему изобретению могут дополнительно содержать ингибиторы PD-1/PD-L1 (иммунопрепараты цитотоксических T-лимфоцитов (ЦТЛ)), иммунопрепараты CTLA-4, ингибиторы CDK4/6 (таргет-терапия), ингибиторы PI3K (таргет-терапия), ингибиторы mTOR (таргет-терапия), ингибиторы АКТ (таргет-терапия), ингибиторы Pan-Her (таргет-терапия). Также данные ингибиторы могут быть модифицированы для получения соответствующего моноклонального антитела. Такие антитела могут быть включены в терапевтические композиции согласно настоящему изобретению.
[050] В другом варианте реализации указанная фармацевтическая композиция содержит фармацевтически приемлемый носитель. В еще одном варианте реализации фармацевтическая композиция представляет собой вакцину против рака. В еще одном другом варианте реализации фармацевтическая композиция приготовлена для подкожного введения. В еще одном другом варианте реализации фармацевтическая композиция приготовлена для внутримышечного введения. В еще одном другом варианте реализации фармацевтическая композиция приготовлена для внутриартериального введения. В еще одном другом варианте реализации фармацевтическая композиция приготовлена для внутривенного введения.
[051] Другой вариант реализации изобретения охватывает способ лечения пациента, нуждающегося в этом, включающий введение указанному пациенту терапевтически эффективного количества терапевтической композиции, содержащей Globo H и KLH. В одном варианте реализации у пациента был диагностирован рак или подозревается рак. В другом варианте реализации рак представляет собой рак эпителия. В еще одном варианте реализации рак представляет собой рак молочной железы. В еще одном другом варианте реализации терапевтически эффективное количество группы Globo-H в фармацевтической/терапевтической композиции могут находиться в диапазоне приблизительно от 0,001 мкг/кг приблизительно до 250 мг/кг. В еще одном варианте реализации терапевтически эффективное количество группы Globo-H в фармацевтической/терапевтической композиции составляет приблизительно от 10 мкг/кг приблизительно до 50 мкг/кг одного терапевтического конъюгата на дозу. В еще одном варианте реализации терапевтически эффективное количество группы Globo-H в фармацевтической/терапевтической композиции составляет приблизительно от 0,10 мкг/кг приблизительно до 0,75 мкг/кг одного терапевтического конъюгата на дозу.
[052] В еще одном другом варианте реализации терапевтически эффективное количество комплекса Globo-H-KLH в указанной терапевтической композиции может находятся в диапазоне приблизительно от 0,001 мкг/кг приблизительно до 250 мг/кг. В еще одном варианте реализации терапевтически эффективное количество комплекса Globo-H-KLH в терапевтической композиции составляет приблизительно от 10 мкг/кг приблизительно до 50 мкг/кг одного терапевтического конъюгата на дозу. В еще одном варианте реализации терапевтически эффективное количество комплекса Globo-H-KLH в терапевтической композиции составляет приблизительно от 0,60 мкг/кг приблизительно до 4,50 мкг/кг одного терапевтического конъюгата на дозу.
[053] В еще одном другом варианте реализации способ способствует увеличению выживаемости без прогрессирования заболевания по сравнению с контролем плацебо приблизительно или по меньшей мере на 1 неделю. В еще одном другом варианте реализации способ способствует увеличению выживаемости без прогрессирования заболевания по сравнению с контролем плацебо приблизительно или по меньшей мере на 2 недели. В еще одном другом варианте реализации способ способствует увеличению выживаемости без прогрессирования заболевания по сравнению с контролем плацебо приблизительно или по меньшей мере на 1 месяц. В еще одном другом варианте реализации способ способствует увеличению выживаемости без прогрессирования заболевания по сравнению с контролем плацебо приблизительно или по меньшей мере на 3 месяца. В еще одном другом варианте реализации способ способствует увеличению выживаемости без прогрессирования заболевания по сравнению с контролем плацебо приблизительно или по меньшей мере на 6 месяцев. В еще другом варианте реализации способ способствует увеличению выживаемости или общей выживаемости по сравнению с контролем плацебо приблизительно или по меньшей мере на 12 месяцев.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[054] Более полное понимание изобретения можно получить исходя из прилагаемых чертежей при рассмотрении в сочетании с последующим подробным описанием. Варианты реализации, проиллюстрированные на чертежах, предназначены только для иллюстрации изобретения и не должны рассматриваться как ограничивающие изобретение представленными вариантами реализации.
[055] На Фигуре 1A показана химическая структура Globo Н, а также несколько примеров аналогов Globo Н. Glc обозначает глюкозу, Gal обозначает галактозу, GalNAc обозначает N-ацетилгалактозамин и Fuc обозначает фукозу. На фигуре 1B показана иллюстративная субъединица Globo H-KLH, конъюгированная через ликер ММССН.
[056] На Фигуре 2A показан иллюстративный путь синтеза конъюгата Globo H-KLH. На фигуре 2B показаны Globo H-KLH димеры и тримеры согласно настоящему изобретению по сравнению с конъюгатами Globo H, описанными в Slovin et al (1999), Proc Natl Acad Sci USA 96: 5710-5 and Gilewski et al (2001), Proc Natl Acad Sci USA 98: 3270-5.
[057] На Фигуре 3 показан результат спектрометрии многоуглового лазерного рассеяния (MALS) природного KLH (8,3 МДа).
[058] На Фигуре 4 показан результат гель-проникающей хроматографии природного KLH (8,3 МДа).
[059] На Фигуре 5 показана хронологическая экспансия популяций B/CD3+T/CD4+T/CD8+T-клеток у крыс Льюиса, иммунизированных с помощью гликоконъюгата Globo H-KLH согласно настоящему изобретению. На диаграммах A-D представлены популяции В-клеток, CD3 Т-клеток, CD4 Т-клеток и CD8 Т-клеток, соответственно. Данные представлены как процент числа клеток в указанной группе, нормированный к проценту числа клеток группе ФСБ. Множественные сравнения анализированы с применением двухфакторного дисперсионного анализа с последующим апостериорным тестом Бонферрони. *, p<0,05, **, p<0,01, и ***, p<0,001 по сравнению с ФСБ.
[060] На Фигуре 6 показаны хронологические изменения в обратных титрах (reciprocal titers) (A) IgM и (В) IgG антител в крови крыс Льюиса, иммунизированных с помощью гликоконъюгата (Globo H-KLH) согласно настоящему изобретению.
[061] На Фигуре 7 показаны титры антител IgM у мышей в ответ на гликоконъюгат (Globo H-KLH) согласно настоящему изобретению.
[062] На Фигуре 8 проиллюстрирована иммуногенность C57BL/6 мышей, которых иммунизировали ФСБ, только адъювантом, или Globo H-KLH + адъювант на 0, 5 и 10 день. Сыворотку отбирали на 14 день для определения выработки антител IgG и IgM к Globo Н посредством ИФА-анализа.
[063] На Фигуре 9 проиллюстрирована комплементзависимая цитотоксичность, где Globo Н(+) или Globo Н(-)клетки TOV21G высевали в 96-луночный планшет. Добавляли сыворотки к Globo Н или контрольные сыворотки в разведении 1:50 или 1:100. Затем в планшет добавляли/не добавляли комплимент. Комплементзависимую цитотоксичность (CDC) определяли посредством ЛДГ-анализа.
[064] На Фигуре 10 проиллюстрирована цитотоксичность Globo Н(+) или Globo Н(-) клеток TOV21G, которые высевали в 96-луночный планшет. Добавляли сыворотки к Globo Н или контрольные сыворотки в разведении 1:50 или 1:100. В качестве эффекторных клеток использовали NK-клетки человека, выделенные из мононуклеарных клеток периферической крови (МКПК) и активированные с помощью антител к CD3. Затем эффекторные клетки добавляли или не добавляли для реакции антителозависимой клеточноопосредованной цитотоксичности (ADCC) при отношении эпитопов, составляющем 4:1, 2:1 или 1:1. Цитотоксичность нормализовали с контрольной сывороткой, не являющейся мышиной, для каждых клеток в различном отношении эпитопов.
[065] На Фигуре 11 показаны облученные мыши с диабетом без ожирения с тяжелым комбинированным иммунодефицитом (NOD-SCID), которым в 0 день внутрибрюшинно вводили 1×106 Globo H-положительных TOV21G клеток. У мышей C57BL/6 раздельно отбирали антисыворотки после 3 вакцинаций для 3 различных обработок (ФСБ, только адъювант и Globo H-KLH/адъювант). Каждой мыши NOD-SCID внутрибрюшинно вводили 200 мкл вышеупомянутой антисыворотки в 0, 2, 4, 6, 9, 11, 13 и 16 день. Изображения опухоли получали с помощью системы визуализации IVIS на 3, 7 и 9 день.
[066] На Фигуре 12 проиллюстрирован рост опухоли LLC1 (клеточной линии карциномы легких) у мышей C57BL/6, иммунизированных Globo H-KLH, которых подкожно вакцинировали с помощью ФСБ, только адъювант или Globo H-KLH/адъюванта на 0, 5 и 11 день. Каждой мыши на 16 день подкожно вводили 1×105 клеток LLC1. Затем подкожно проводили обработку на 29 и 34 день. Размеры опухоли контролировали на 16, 21, 25, 29, 32, 34, 37 день.
[067] На Фигуре 13 показана сводная таблица идентификации пептидов.
[068] На Фигуре 14 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 1 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[069] На Фигуре 15 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 2 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[070] На Фигуре 16 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 3 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[071] На Фигуре 17 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 4 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[072] На Фигуре 18 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 1 (2-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[073] На Фигуре 19 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 2 (2-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[074] На Фигуре 20 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 3 (2-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[075] На Фигуре 21 проиллюстрированы детали идентификации Globo-H-конъюгированных пептидов для образца 4 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[076] На Фигуре 22 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 1 (1-й ЖХ-МС/МС) для KLH1 (а) и KLH2 (b).
[077] На Фигуре 23 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 2 (1-й ЖХ-МС/МС) для KLH1 (а) и KLH2 (b).
[078] На Фигуре 24 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 3 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[079] На Фигуре 25 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 4 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[080] На Фигуре 26 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 1 (2-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[081] На Фигуре 27 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 2 (2-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[082] На Фигуре 28 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 3 (2-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[083] На Фигуре 29 проиллюстрированы детали идентификации ММССН-конъюгированных пептидов для образца 4 (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b).
[084] На Фигуре 30 показана сводная таблица идентификации Globo-H-конъюгированных лизинов для (1-й ЖХ-МС/МС) для KLH1 (a) и KLH2 (b) и (2-й ЖХ-МС/МС) для KLH1 (с) и KLH2 (d).
[085] На Фигуре 31 показана сводная таблица идентификации ММССН-конъюгированных лизинов для (1-й ЖХ-МС/МС) для KLH1 (а) и KLH2 (b) и (2-й ЖХ-МС/МС) для KLH1 (с) и KLH2 (d).
[086] На Фигуре 32 проиллюстрирована сводная таблица анализа конъюгации Globo-H для первого (а) и второго запуска (b) ЖХ-МС/МС.
[087] На Фигуре 33(a) проиллюстрирована химическая формула: C(56) H(91) N(5) O(33) S(1), моноизотопная добавочная молекулярная масса: 1393,5317 Да. На фигуре 33(b) проиллюстрирована химическая формула: 1. C(18) H(28) N(4) O(4) S(1), моноизотопная добавочная молекулярная масса: 396,1831 Да; 2. Химическая формула: С(24) Н(38) N(4) O(9) S(1), моноизотопная добавочная молекулярная масса: 558,2360 Да; 3. Химическая формула: С(30) Н(48) N(4) O(14) S(1), моноизотопная добавочная молекулярная масса: 720,2888 Да; 4. Химическая формула: С(36) Н(58) N(4) O(19) S(1), моноизотопная добавочная молекулярная масса: 882,3416 Да; 5. Химическая формула: C(44) H(71) N(5) O(24) S(1), моноизотопная добавочная молекулярная масса: 1085,4210 Да.
[088] На Фигуре 34(a) проиллюстрирована химическая структура производного ММССН. Химическая формула: С(16) Н(24) N(4) O(3) S(1), моноизотопная добавочная молекулярная масса: 352,1569 Да. На фигуре 34(b) проиллюстрировано дезамидированное производное ММССН, Химическая формула: С(16) Н(22) N(2) O(4) S(1), моноизотопная добавочная молекулярная масса: 338,1300 Да.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[089] Если не указано иное, в практике настоящего изобретения будут применяться обычные методы молекулярной биологии, микробиологии и иммунологии, которые известны специалистам в данной области техники. Такие методы подробно описаны в литературе. См., например, Molecular Cloning A Laboratory Manual, 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press, 1989); DNA Cloning, Volumes I and II (D.N. Glover ed., 1985); Culture Of Animal Cells (R.I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); трактат, Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J.H. Miller and M.P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods In Enzymology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Antibodies: A Laboratory Manual, by Harlow and Lanes (Cold Spring Harbor Laboratory Press, 1988); и Handbook Of Experimental Immunology, Volumes I-IV (D.M. Weir and С.C. Blackwell, eds., 1986).
[090] Формы единственного числа при использовании в сочетании с термином "содержащий" в формуле изобретения и/или спецификация могут означать "один", но это также соответствует значению "один или более", "по меньшей мере один" и "один или больше одного".
[091] В данной заявке термин "приблизительно" используется для указания того, что значение включает, например, изменение ошибки, свойственной измерительному устройству, причем способ используется для определения значения, или изменения, которое существует между испытуемыми объектами. Обычно данный термин предназначен для охвата приблизительно или менее 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% вариабельности в зависимости от обстоятельств.
[092] В контексте настоящего описания термин "алкил" относится к линейному или разветвленному одновалентному углеводороду, содержащему, если не указано иное, 1-20 атомов углерода, например, C1-C8 или C1-C4, который может быть замещенным или незамещенным. Примеры алкилов включают, но не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил.
[093] Использование термина "или" в формуле изобретения используется для обозначения "и/или", если явно не указано, что он относится только к альтернативным вариантам или альтернативные варианты являются взаимоисключающими, хотя описание поддерживает определение, которое относится только к альтернативным вариантам и "и/или".
[094] Применяемые в настоящем описании и формуле изобретения слова "состоящий из" (и любая форма слова состоящий из, например, "состоит из" и "состоять"), "имеющий" (и любая форма слова имеющий, например, "имеет" и "иметь"), "включающий" (и любая форма слова включающий, например, "включает" и "включать") или "содержащий" (и любая форма слова содержащий, например, "содержит" и "содержать") являются исчерпывающими или неисчерпывающими и не исключают дополнительные, неуказанные элементы или стадии способа. Предполагается, что любой вариант реализации, описанный в данном документе, может выполняться в отношении любого способа или композиции согласно настоящему изобретению, и наоборот. Кроме того, композиции согласно настоящему изобретению можно использовать для достижения способов согласно настоящему изобретению.
[095] "Лечение" или "лечить" относится к введению терапевтической композиции субъекту с целью лечения, облегчения, снятия, снижения, устранения, предотвращения или улучшения расстройства, симптомов расстройства, болезненного состояния вторичного к расстройству, или предрасположенности к расстройству.
[096] Термин "эффективное количество" означает количество терапевтической композиции, которое способно оказывать желаемый результат с медицинской точки зрения при лечении субъекта, как это описано в данном документе. Желаемый результат с медицинской точки зрения может быть объективным (т.е. измеримый с помощью какого-либо теста или маркера) или субъективным (т.е. субъект подает признаки или чувствует эффект).
[097] "Заболевание, поддающееся лечению терапевтической композицией" в контексте настоящего описания, означает любые процедуры, состояния, расстройства, недомогания и/или заболевания, которые можно лечить с помощью введения терапевтических композиций, раскрытых в настоящем документе.
[098] "Пролиферативное расстройство" представляет собой расстройство, при котором слишком большое количество клеток определенного типа приводят к ухудшению здоровья. Пролиферативное расстройство может быть доброкачественными и злокачественными. Пролиферативное расстройство может включать, например, рак.
[099] "Рак", который можно лечить с помощью терапевтических композиций, раскрытых в данном документе, представляет собой аномальный рост клеток. Раковые клетки утратили нормальные механизмы контроля и, таким образом, способны постоянно делиться, вторгаться в соседние ткани, мигрировать в отдаленные части тела, и способствовать росту новых кровеносных сосудов, из которых клетки получают питательные вещества. В контексте настоящего описания, рак может быть злокачественным или доброкачественным. Рак может развиваться из любой ткани организма. Поскольку клетки растут и размножаются, они образуют массу ткани, называемую опухолью. Термин «опухоль» относится к аномальному росту или массе. Опухоли могут быть раковыми (злокачественными) или нераковыми (доброкачественными). Раковые опухоли могут вторгаться в соседние ткани и распространяется по всему телу (метастазировать). Доброкачественные опухоли, однако, как правило, не проникают в соседние ткани и не распространяются по всему телу. Рак может быть подразделятся на рак крови и кроветворных тканей (лейкозы и лимфомы) и "солидные" опухоли. "Солидные" опухоли могут представлять собой карциномы и саркомы.
[0100] Раки, которые можно лечить с помощью терапевтических композиций согласно настоящему изобретению включают раки, классифицируемые по месту, включая рак ротовой полости и глотки (губы, языка, слюнных желез, дна ротовой полости, десен и других частей полости рта, носоглотки, миндалин, ротоглотки, гортаноглотки, других частей рта/глотки); раки пищеварительной системы (пищевода, желудка; тонкого кишечника; ободочной и прямой кишки; ануса, анального канала и аноректума; печени; внутрипеченочных желчных протоков; желчного пузыря, других желчевыводящих путей; поджелудочной железы; забрюшинного пространства; брюшины, сальника и брыжейки; других частей пищеварительной системы); раки дыхательной системы (носовой полости, среднего уха, и придаточных пазух носа; гортани; легких и бронхов; плевры; трахеи, средостения, и других частей дыхательной системы); раки мезотелиомы; костей и суставов; и мягких тканей, включая сердце; раки кожи, включая меланомы и другие неэпителиальные раки кожи; саркому Капоши и рак молочной железы; рак женской половой системы (шейки матки; тела матки; матки, яичников; влагалища; вульвы, а также других частей женских половых органов); рак мужской половой системы (предстательной железы; яичка; пениса, а также других частей мужских половых органов); рак мочевыводящей системы (мочевого пузыря; почки и почечной лоханки; мочеточников; и других частей мочевыводящей системы); раки глаза и орбиты; раки мозга и нервной системы (головного мозга, и других частей нервной системы); раки эндокринной системы (щитовидной железы и других частей эндокринной системы, включая тимус); лимфомы (болезнь Ходжкина и неходжкинскую лимфому), множественную миелому и лейкозы (лимфобластный лейкоз; миелоидный лейкоз; моноцитарный лейкоз и другие лейкозы).
[0101] Другие виды рака, классифицированные по гистологическому типу, которые могут являться подходящими мишенями для терапевтических композиций, в соответствии с настоящим изобретением включают, но не ограничиваются, злокачественные новообразования; карциному, БДУ (без дополнительных уточнений); карциному, недифференцированную, БДУ; гигантоклеточную и веретеноклеточную карциному; мелкоклеточную карциному, БДУ; папиллярную карциному, БДУ; плоскоклеточную карциному, БДУ; лимфоэпителиальную карциному; базальноклеточную карциному, БДУ; пиломатриксную карциному; переходноклеточную карциному, БДУ; папиллярную переходноклеточную карциному; аденокарциному, БДУ; злокачественную гастриному; холангиокарциному; гепатоклеточную карциному, БДУ; сочетание гепатоклеточной карциномы и холангиокарциномы; трабекулярную аденокарциному; аденокистозную карциному; аденокарциному в аденоматозном полипе; семейный аденоматозный полипоз; солидную карциному, БДУ; злокачественные карциноидные опухоли; бронхиолоальвеолярную аденокарциному; папиллярную аденокарциному, БДУ; хромофобную карциному; ацидофильную карциному; оксифильную аденокарциному; базофильную карциному; светлоклеточную аденокарциному, БДУ; зернистоклеточную карциному; фолликулярную аденокарциному, БДУ; папиллярную и фолликулярную аденокарциному; неинкапсулированную склерозирующую карциному; адренокортикальную карциному; эндометриоидную карциному; карциному из придатков кожи; апокринную аденокарциному; сальную аденокарциному; аденокарциному серных желез; мукоэпидермоидную карциному; цистаденокарциному, БДУ; папиллярную цистаденокарциному, БДУ; папиллярную серозную цистаденокарциному; муцинозную цистаденокарциному, БДУ; муцинозную аденокарциному; перстневидноклеточную карциному; инфильтрирующую протоковую карциному; медуллярную карциному, БДУ; лобулярную карциному; воспалительную карциному; болезнь Педжета молочной железы; ацинарноклеточную карциному; аденосквамозную карциному; аденокарциному с плоскоклеточной метаплазией; злокачественную тимому; злокачественную стромальную опухоль яичников; злокачественную текому; злокачественную гранулезоклеточную опухоль; злокачественную андробластому; карциному из клеток Сертоли; злокачественную опухоль из клеток Лейдига; злокачественную опухоль из жировых клеток; злокачественную параганглиому; злокачественную экстрамамиллярную параганглиому; феохромоцитому; гломангиосаркому; злокачественную меланому, БДУ; беспигментную меланому; поверхностную распространяющуюся меланому; злокачественную меланому в гигантском пигментном невусе; эпителиоидноклеточную меланому; злокачественный голубой невус; саркому, БДУ; фибросаркому, БДУ; злокачественную фиброзную гистиоцитому; миксосаркому; липосаркому, БДУ; лейомиосаркому, БДУ; рабдомиосаркому, БДУ; эмбриональную рабдомиосаркому; альвеолярную рабдомиосаркому; стромальную саркому, БДУ; злокачественные смешанные опухоли, БДУ; смешанную опухоль Мюллера; нефробластому; гепатобластому; карциносаркому, БДУ; злокачественную мезенхимому; злокачественную опухоль Бреннера; злокачественные филлоидные опухоли; синовиальную саркому, БДУ; злокачественную мезотелиому; дисгерминому; эмбриональную карциному, БДУ; злокачественную тератому, БДУ; злокачественную струму яичника; хориокарциному; злокачественную мезонефрому; гемангиосаркому; злокачественную гемангиоэндотелиому; саркому Капоши; злокачественную гемангиоперицитому; лимфангиосаркому; остеосаркому, БДУ; юкстакортикальную остеосаркому; хондросаркому, БДУ; злокачественную хондробластому; мезенхимальную хондросаркому; гигантоклеточную опухоль кости; саркому Юинга; злокачественную одонтогенную опухоль; амелобластическую одонтосаркому; злокачественную амелобластому; амелобластическую фибросаркому; злокачественную пинеалому; хордому; злокачественную глиому; эпендимому, БДУ; астроцитому, БДУ; протоплазматическую астроцитому; фибриллярную астроцитому; астробластому; глиобластому, БДУ; олигодендроглиому, БДУ; олигодендробластому; примитивные нейроэктодермальные опухоли; опухоль мозжечка, БДУ; ганглионейробластому; нейробластому, БДУ; ретинобластому, БДУ; ольфакторную нейрогенную опухоль; злокачественную менингиому; неврофибросаркому; злокачественную неврилеммому; злокачественную зернистоклеточную опухоль; злокачественную лимфому, БДУ; болезнь Ходжкина, БДУ; парагранулема Ходжкина; БДУ; злокачественную мелкоклеточную лимфоцитарную лимфому; злокачественную диффузную крупноклеточную лимфому; злокачественную фолликулярную лимфому, БДУ; фунгоидную гранулему; другие специфические неходжкинские лимфомы; злокачественный гистиоцитоз; множественную миелому; тучноклеточную саркому; иммунопролиферативную болезнь тонкого кишечника; лейкоз, БДУ; лимфолейкоз, БДУ; плазмоклеточный лейкоз, эритролейкоз; лейкоз с лимфосаркоматозными клетками (Lymphosarcoma cell leukemia); миелоидный лейкоз, БДУ; базофильный лейкоз; эозинофильный лейкоз; моноцитарные лейкоз, БДУ; тучноклеточный лейкоз; мегакариобластный лейкоз; миелоидную саркому; и волосатоклеточный лейкоз.
[0102] "Рак эпителия" в контексте настоящего описания относится к раку(ам), который развивается из эпителия или смежных тканей кожи, полых внутренних органов и других органов. Рак эпителия включает рак молочной железы, рак легких, рак печени, рак слизистой оболочки щеки, рак желудка, рак толстой кишки, рак носоглотки, рак кожи, рак почки, опухоль головного мозга, рак предстательной железы, рак яичников, рак шейки матки, рак эндометрия, рак кишечника, рак поджелудочной железы и рак мочевого пузыря, но не ограничиваются ими.
[0103] "Пациент" или "субъект" в контексте настоящего описания относится к млекопитающему с диагнозом или с подозрением на наличие или развитие пролиферативного заболевания, такого как рак. Примерами пациентов могут быть люди, обезьяны, собаки, свиньи, крупный рогатый скот, кошки, лошади, козы, овцы, грызуны и другие млекопитающие, которые могут принести пользу в изучении пролиферативных заболеваний, таких как рак.
[0104] В контексте настоящего описания "по существу очищенный" или "по существу выделенный" относится к молекуле (например, соединению) в состоянии, в котором она по существу отделена от всех других молекул, обычно связанных с ней в ее нативном состоянии. Предпочтительно, по существу очищенные молекулы являются преобладающим частицами, присутствующими в препарате. В частности, по существу очищенная молекула может быть более чем на 60% свободной, предпочтительно на 75% свободной, более предпочтительно на 90% свободной, и наиболее предпочтительно на 95% свободной от других молекул (исключая растворитель), присутствующих в природной смеси. Термин "по существу очищенный" или "по существу выделенный" не предназначен для молекул или веществ, присутствующих в их нативном состоянии. В некоторых вариантах реализации термин "по существу очищенный" или "по существу выделенный" включает очистку одной единицы KLH от другой единицы KLH (например, по существу очистку или по существу выделение димера KLH от тримера KLH). В другом варианте реализации термин "по существу очищенный" или "по существу выделенный" не включает в себя очистку одной единицы KLH от другой единицы KLH (например, димеры KLH и тримеры KLH включены в по существу очищенную или по существу выделенную композицию), но примеси по существу удалены.
[0105] "Введение" в контексте настоящего описания относится к снабжению пациента терапевтической композицией согласно настоящему изобретению. В качестве примера, а не ограничения, введение композиции, например, путем инъекции, можно осуществлять путем внутривенной (в/в) инъекции, подкожной (п/к) инъекции, внутрикожной (в/к) инъекции, внутрибрюшинной (в/б) инъекции или внутримышечной (в/м) инъекции. Можно применять один или несколько таких путей. Парентеральное введение можно осуществлять, например, путем болюсной инъекции или путем постепенной перфузии в течение длительного времени. Альтернативно или одновременно введение можно осуществлять пероральным путем. Кроме того, введение также можно осуществлять хирургическим депонированием болюса или размещением медицинского устройства.
[0106] Термин "пациент, нуждающийся в этом" в контексте настоящего описания относится к пациенту с диагнозом или с подозрением на наличие пролиферативного расстройства. В одном варианте реализации пациент имеет рак или у него может развиться рак.
[0107] В контексте настоящего описания термин "антиген" определен как любое вещество, способное вызывать иммунный ответ с помощью или без помощи белка-носителя, и/или адъюванта. Предпочтительно антиген, входящий в состав композиций согласно настоящему изобретению, включает в себя углевод, и более предпочтительно гликановый антиген, и наиболее предпочтительно группу Globo Н.
[0108] В контексте настоящего описания термин "иммуногенность" относится к способности иммуногена, антигена или вакцины стимулировать иммунный ответ.
[0109] В контексте настоящего описания термин "иммунотерапия" относится к совокупности стратегий лечения, основанных на концепции модуляции иммунной системы для достижения профилактической и/или терапевтической цели.
[0110] В контексте настоящего описания термин "эпитоп" определен как части молекулы антигена, которые контактируют с антигенсвязывающим сайтом антитела или T-клеточного рецептора.
[0111] "Терапевтические композиции" согласно настоящему изобретению предпочтительно включают в себя "терапевтические конъюгаты" и/или "терапевтические антитела". Терапевтические конъюгаты включают по меньшей мере один антиген, связанный с носителем. Предпочтительно, связь терапевтического конъюгата является ковалентной. В одном варианте реализации терапевтического конъюгата, антиген представляет собой гликан, такой как группа Globo Н, и носитель представляет собой KLH и/или субъединицу KLH. В данном качестве термин терапевтический конъюгат охватывает одну или более субъединиц KLH, связанных с одной или более группами Globo Н. В одном варианте реализации термин терапевтический конъюгат охватывает одну или более единицу KLH, связанную приблизительно или по меньшей мере с 1, 10, 102 или 103 группами Globo H. В другом варианте реализации термин терапевтический конъюгат охватывает одну или более единицу KLH, связанную приблизительно с 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160 или более группами Globo H. Другой вариант реализации охватывает выделенные димеры, тримеры, тетрамеры, пентамеры или гексамеры групп Globo H, связанных с субъединицами KLH, или их комбинации.
[0112] В одном варианте реализации терапевтический конъюгат представляет собой: Fucα(1→2)Galβ(1→3)GalNAcβ(1→3)Galα(1→4)Galβ(1→4)Gluβ(1-O-этилгидразил-1-карбонил-циклогексил-4-(метил-N-малеимидо)-3-(тиобутилимидил)-гемоцианин фиссуреллы (KLH) также упоминаемый как OPT-822.
[0113] "Терапевтические антитела" определены как антитела (как дополнительно определено ниже), которые специфически связываются с терапевтическими конъюгатами согласно настоящему изобретению и предпочтительно с частью остатка Globo H терапевтических конъюгатов.
[0114] В контексте настоящего описания термин "вакцина" относится к терапевтической композиции, содержащей терапевтический конъюгат, который используется для выработки иммунитета против заболевания, связанного с антигеном. Противораковые вакцины предназначены для повышения естественной способность организма защищать себя посредством иммунной системы от опасностей, связанных с поврежденными или аномальными клетками, такими как раковые клетки. Защитный иммунный ответ представляет собой такой ответ, который уменьшает тяжесть заболевания, включая, но не ограничиваясь, предотвращением заболевания, задержкой начала заболевания, снижением тяжести симптомов, снижением заболеваемости и отложенной смертностью. Предпочтительно, вакцина способна активировать как гуморальный иммунный ответ (например, стимуляцию продукции антител B-лимфоцитами) так и клеточный иммунный ответ (например, иммунный ответ, опосредованный T-лимфоцитами и/или другими клетками, такими как NK-клетки и макрофаги). Разработаны стандартные анализы для определения иммунного ответа, такие как твердофазный иммуноферментный анализ (ИФА), проточная цитометрия, анализ клеточной пролиферации, CTL анализ и ADCC/CDC анализ.
[0115] В контексте настоящего описания термин «гликан» относится к полисахариду или олигосахариду. В настоящем документе термин «гликан» также используется для обозначения углеводной части гликоконъюгата, такого как гликопротеин, гликолипид, гликопептид, гликопротеом (glycoproteome), пептидогликан, липополисахарид или протеогликан. Гликаны обычно имеют только O-гликозидные связи между моносахаридами. Например, целлюлоза является гликаном (или более конкретно глюканом), состоящим из β-1,4-связанной D-глюкозы, и хитин является гликаном, состоящим из β-1,4-связанного N-ацетил-D-глюкозамина. Гликаны могут представлять собой гомо- или гетерополимеры из моносахаридных остатков, и могут быть линейным или разветвленным. Гликаны могут быть прикреплены к белкам, как в гликопротеинах и протеогликанах. Они обычно находятся на внешней поверхности клеток. O- и N-связанные гликаны широко распространены у эукариот, но их также можно обнаружить, хотя реже, у прокариот. N-связанные гликаны прикрепляются к R-группе азота (N) аспарагина в сиквоне. Сиквон представляет собой последовательность Asn-X-Ser или Asn-X-Thr, где X обозначает любую аминокислоту, кроме пралине. Предпочтительным гликаном является группа Globo H.
[0116] Globo Н представляет собой гексасахарид, который является членом семейства антигенных углеводов, которые имеют высокий уровень экспрессии при различных типах рака, особенно рака молочной железы, предстательной железы, поджелудочной железы, желудка, яичников, толстой кишки и легких. В иллюстративных вариантах реализации некоторые пациенты не демонстрируют наличие антител к Globo H на каком либо уровне в нулевой момент времени, и после иммунизации терапевтической композицией согласно настоящему изобретению обнаруживают высокие титры. В других иллюстративных вариантах реализации некоторые пациенты демонстрируют наличие антител к Globo Н на каком-либо уровне в нулевой момент времени, и после иммунизации терапевтической композицией согласно настоящему изобретению обнаруживают высокие титры. В некоторых вариантах реализации антитела к Globo Н экспрессируются на поверхности раковых клеток виде гликолипида и, возможно, в виде гликопротеина. В других вариантах реализации в сыворотке пациентов с раком молочной железы содержатся антитела к эпитопу Globo Н на высоком уровне. В некоторых вариантах реализации в иммуиогистохимических исследованиях данный эпитоп также является мишенью для моноклональных антител Mbr1, VK9 и к SSEA-3. Хотя некоторые нормальные ткани также взаимодействуют с Mbr1, включая нормальные ткани молочной железы, поджелудочной железы, тонкого кишечника и ткань предстательной железы, антиген в этих тканях преимущественно локализован на границах секреции, где доступ иммунной системы ограничен.
[0117] "Группа Globo Н" определен в настоящем документе как гликан (т.е. молекула, содержащая сахарные остатки), который представляет собой Globo Н, или фрагмент, или его аналог. Globo Н представляет собой гликан, содержащий гексасахаридный эпитоп (Fucα1→2 Galβ1→3 GalNAcβ1→3 Galα1→4 Galβ1→4 Glc), и необязательно несахарный остаток. Его фрагмент представляет собой гликан, содержащий фрагмент гексасахаридного эпитопа и, если применимо, несахарный остаток. Данные олигосахариды можно получить обычными способами. (См., Huang et al., Proc. Natl. Acad. Sci. USA 103: 15-20 (2006)). При необходимости они могут быть связаны с несахарным остатком. Заявка на патент США №12/485546 относится к способу получения антитела, специфичного к Globo H или его фрагменту, путем введения иммунной композиции, описанной выше, млекопитающему, не являющемуся человеком (например, мыши, кролику, козе, овце или лошади), и к выделению из млекопитающего антитела, которое связывается с Globo H или его фрагментом.
[0118] Аналоги Globo H можно получить с помощью гликанов, иммобилизованных на твердой подложке (glycan microarray), и они включают раскрытые в Wang et al., Proc Natl Acad Sci USA. 2008 August 19; 105(33): 11661-11666 и показаны на фигуре 1.
[0119] Аналоги Globo H предпочтительно связываются с антителами VK-9, Mbr1 и к SSEA-3. Предпочтительно аналоги Globo Н связываются с конкретной константой диссоциации (KD,surf). Изотерму Ленгмюра можно использовать для анализа кривых связывания для получения констант диссоциации на поверхности (KD,surf). В условиях равновесия во время инкубации среднюю флуоресценцию повторных пятен (Fobs) можно описать:
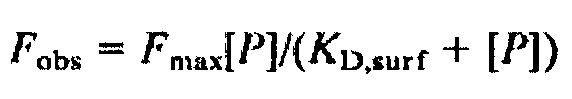 ,
,
где Fmax представляет собой максимальную интенсивность флуоресценции, мера количества активных углеводов на поверхности, [P] представляет собой общую концентрацию антител, и KD,surf представляет собой равновесную константу диссоциации для углеводов на поверхности и антител. Как описано в Wang et al., в некоторых вариантах реализации предпочтительные (KD,surf) аналоги Globo H составляют, по меньшей мере, приблизительно или точно 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5 или 1,6 нМ по отношению к антителам VK-9, Mbr1 и к SSEA-3, описанным в Wang et al.
[0120] "Гемоцианин фиссуреллы" (KLH) представляет собой большой, мультисубъединичный, переносящий кислород металлопротеин, обнаруженный в гемолимфе фиссуреллы Megathura crenulata. KLH (Keyhole Limpet Hemocyanin) представляет собой гетерогенный гликозилированный белок, состоящий из субъединиц с молекулярной массой приблизительно от 350000 приблизительно до 390000 в агрегатах с молекулярной массой приблизительно от 400 кДа (например, мономер KLH) приблизительно до 8000 кДа (например, а дидекамер KLH). Каждый домен субъединицы KLH содержит два атома меди, которые вместе связывают одну молекулу кислорода. Когда кислород связан с гемоцианином, молекула приобретет характерный прозрачный опалесцирующий синий цвет. В некоторых вариантах реализации белок KLH является сильным иммуногеном, при этом безопасным для человека. В некоторых вариантах реализации KLH можно выделять из гемолимфы Megathura crenulata путем серии стадий, которые обычно включают в себя осаждение сульфатом аммония и диализ, и могут включать хроматографическую очистку для получения высокой чистоты. В некоторых вариантах реализации очистка KLH также может включать в себя удаление эндотоксина, но данная стадия может не требоваться, так как эндотоксин может служить в качестве адъюванта при введении для выработки антител. Предпочтительно высокое качество препарата KLH с четким опалесцирующим синим цветом является лучшим показателем растворимости KLH. В некоторых вариантах реализации мономерные единицы KLH собираются в больший мультимер (декамер или дидекамер) с общей молекулярной массой приблизительно от 4000 кДа в 8000 кДа. "Единица гемоцианина фиссуреллы" или "единица KLH" определен в настоящем документе как белок KLH1 (SEQ ID №: 1) или KLH2 (SEQ ID №2), или белок по существу идентичный им, или их смесь. По существу идентичный в данном контексте означает, что каждый остаток KLH имеет аминокислотную последовательность по меньшей мере, приблизительно или точно на: 100, 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 89, 88, 87, 86, 85, 84, 83, 82, 81, 80, 79, 78, 77, 76 или 75 процентов идентичную природной последовательности дикого типа KLH. В некоторых вариантах реализации KLH согласно настоящему изобретению повышает иммуногенную активность, в частности, повышает противоопухолевую активность. В некоторых вариантах реализации KLH в композиции согласно настоящему изобретению содержит интактную, недеградированную субъединицу молекулярной массой приблизительно 400000. В других вариантах реализации KLH согласно настоящему изобретению содержит мультимеры KLH более высокого порядка.
[0121] В некоторых вариантах реализации мультимеры KLH более высокого порядка имеют молекулярные массы приблизительно 8-10 миллионов с коэффициентами седиментации около 92-107S. Количество присутствующих мультимеров KLH более высокого порядка определяют на основе анализов седиментационного равновесия и/или скорости седиментации при ультрацентрифутировании. В других вариантах реализации KLH согласно настоящему изобретению демонстрирует повышенную иммуногенную активностью, в частности, повышенную противоопухолевую активность. Повышенную иммуногенную активность видно, например, но не ограничиваясь, (а) при инъекции KLH (без адъюванта), (b) при применении KLH в качестве адъюванта, (с) при применении KLH используется в качестве носителя иммуногена для гаптенов или слабо иммуногенных антигенов и (d) при применении KLH в качестве противоопухолевого агента. Композиция KLH согласно настоящему изобретению проявляет повышенную противоопухолевую активность при многих видах опухолей, включая, но не ограничиваясь, опухолями мочевого пузыря, молочной железы, яичников и т.д. В некоторых вариантах реализации две единицы KLH могут образовывать димер посредством ковалентной связи между мономерами KLH. Не желая быть связанными какой-либо конкретной теорией, авторы полагают, что ковалентная связь между единицами KLH осуществляется через дисульфидную связь. В некоторых вариантах реализации две или более единицы KLH могут образовывать димер, тример, тетрамер, пентамер и т.д. посредством ковалентной связи между мономерами, димерами, тримерами KLH, и т.д. Не желая быть связанными какой-либо конкретной теорией, авторы полагают, что ковалентная связь между единицами KLH осуществляется через дисульфидную связь.
[0122] Существует множество способов для связывания единицы KLH с антигеном, включая непосредственную конъюгацию и конъюгацию с бифункциональной линкерной группой, такой как 4-(4-Н-малеимидометил)-циклогексан-1-карбоксилгидразид (ММССН). Такие способы конъюгации раскрыты в патенте США №6544952. В некоторых вариантах реализации для получения терапевтических конъюгатов согласно настоящему изобретению, например, аллилгликозид Globo Н преобразуют в альдегид путем озонолиза, и альдегидную группу присоединяют к NH-группам на сшивающем агенте ММССН с получением Globo Н-ММССН; белок-носитель, KLH подвергают тиолированию с получением KLH-SH; и сульфгидрильные группы на тиолированном KLH затем присоединяют к малеимидным группам на ММССН с получением конъюгатов Globo H-KLH.
[0123] В одном варианте реализации аллилгликозид Globo Н получают с помощью химического синтеза. Также применяют тиолирующий реагент, 2-иминотиолан и KLH чистоты, советующей современной надлежащей производственной практике (cGMP), и линкер 4-(4-N-малеимидометил)-циклогексан-1-карбоксилгидразид (ММССН). В некоторых вариантах реализации проводят следующие стадии: 1) преобразование аллилгликозида Globo Н в альдегид Globo Н; 2) присоединение альдегида Globo Н к ММССН с получением Globo Н-ММССН, раздельно; 3) химическое тиолирование KLH; 4) присоединение Globo Н-ММССН к тиолированному KLH; и 5) очистка конъюгата Globo H-KLH (OPT-822). См., например, Фигуру 2a.
[0124] В некоторых вариантах реализации во время конъюгации белковой части Globo H с группой KLH, в некоторых вариантах реализации белок KLH показывает снижение молекулярной массы по сравнению с интактной молекулой, предпочтительно из-за диссоциации субъединицы Globo H. В других вариантах реализации способы конъюгации, раскрытые в настоящем документе, приводят к диссоциации субъединицы KLH, о которой ранее не сообщалось. Не желая быть связанными какой-либо конкретной теорией, авторы полагают, что высокий уровень гликозилирования конъюгатов единиц Globo Н и единиц субъединиц KLH согласно настоящему изобретению приводит к образованию водородной связи между единицами Globo H. Таким образом, в некоторых вариантах реализации силы Ван-дер-Ваальса и гидрофобные взаимодействия между субъединицами KLH вытесняются посредством образования водородных связей Globo H, и это приводит к разделению субъединиц KLH. После конъюгации субъединицы KLH из конъюгата единиц Globo Н и субъединиц KLH предпочтительно агрегируют с получением новых мономеров, димеров, тримеров, тетрамеров, пентамеров или гексамеров или любой их комбинации. Полученные терапевтические конъюгаты Globo Н и субъединиц KLH имеют неожиданно большое отношение эпитопов, что приводит к неожиданно высоким иммуногенным свойствам. В некоторых вариантах реализации единицы Globo Н связаны с лизинами на KLH1 и KLH2. В других вариантах реализации единицы Globo Н не связаны с лизинами на KLH1 и KLH2. В некоторых вариантах реализации в анализе пептидного картирования обнаружено, что сохраняются Globo H-конъюгированные лизиновые сайты, из этого можно предположить, что композиция Globo H-KLH является уникальной по своей структуре.
[0125] В одном варианте реализации терапевтические композиции согласно настоящему изобретению включают одну или более субъединицу KLH, где по меньшей мере одна такая субъединица конъюгирована по меньшей мере, приблизительно или точно 1, 10, 102 или 103 разе: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160 или более единицами Globo H.
[0126] Авторы изобретения с помощью масс-спектрометрического анализа установили, что единицы Globo H конъюгированы с KLH через остатки лизина. В некоторых вариантах реализации в силу вышесказанного предпочтительно, чтобы единицы Globo Н были конъюгированы с остатками лизина.
[0127] В одном варианте реализации существует в общей сложности точно или приблизительно 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160 суммарное число остатков лизина в расчете на субъединицу KLH. В другом варианте реализации существует точно или приблизительно 150 или 156 остатков лизина в расчете на субъединицу KLH. В другом варианте реализации существует точно или приблизительно 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109 или 110 лизиновых сайтов конъюгации на каждой субъединице KLH, которые доступны для связывания или фактически связаны с единицей Globo H. В другом варианте реализации существует 62, 66, 67, 68, 70, 72, 76, 86, 87, 88, 90, 92, 93, 100 таких лизиновых сайтов конъюгации на каждой субъединице KLH. Лизиновые сайты конъюгации представляют собой такие остатки лизина в KLH, которые доступны для связывания или фактически связаны с единицей Globo Н и/или с линкером с единицей Globo Н, например, таким как линкер MMCCH.
[0128] В некоторых терапевтических вариантах реализации, содержащих смесь субъединиц (например, KLH1 и KLH2 или их вариантов), суммарное число доступных лизинов (для обеих субъединиц), как подсчитано вместе для разных видов субъединиц, составляет или может составлять точно или приблизительно 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 или 310. В таких вариантах реализации существует или может существовать точно или приблизительно 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160 лизиновых сайтов конъюгации вместе для разных субъединиц (например, KLH1 и KLH2 или их вариантов). В таких других вариантах реализации существует 136, 137, 141, 140, 143, 147 или 155 лизиновых сайтов конъюгации.
[0129] В наиболее предпочтительном варианте реализации существуют 136, 137, 140, 141, 143, 147 или 155 лизиновых сайтов конъюгации среди суммарного числа 306 остатков лизина в KLH1/KLH2.
[0130] В некоторых вариантах реализации терапевтические композиции согласно настоящему изобретению содержат смесь конъюгатов субъединицы KLH- Globo H, причем такие конъюгаты остаются мономерами или образуют димеры, тримеры, тетрамеры, пентамеры или гексамеры, или любую их комбинацию. В другом варианте реализации терапевтические композиции согласно настоящему изобретению включают выделенные мономеры, димеры, тримеры или тетрамеры конъюгата субъединицы KLH cGlobo H, или их комбинации. В еще одном варианте реализации терапевтические композиции согласно настоящему изобретению включают только димеры и тримеры конъюгата субъединицы KLH с Globo H.
[0131] В другом варианте реализации терапевтические композиции содержат по меньшей мере две субъединицы KLH, где каждая из двух субъединиц KLH связана с различными гликанами. Другие опухолеассоциированные гликановые антигены, которые могут быть связаны с субъединицами KLH, могут включать, но не ограничиваются, GM2, GD2, GD3, фукозил, GM1, sTn, сиалил-Льюисх, Льюисх, сиалил-Льюиса, Льюиса, sTn, TF, полисиаловую кислоту, Lewisy, муцины, антиген T, и тому подобное. В некоторых вариантах реализации только по меньшей мере или приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 процентов субъединиц KLH в терапевтической композиции связаны с единицей Globo Н, в то время как остальные субъединицы KLH в указанной терапевтической композиции связаны с другими опухолеассоциированными гликановыми антигенами.
[0132] В контексте настоящего описания "отношение эпитопов", относящиеся к терапевтическим конъюгатам, описанным в данном документе, относится, например, к отношению эпитопов антигенов к молекулам-носителям в терапевтическом конъюгате. Предпочтительно, оно относится к отношению числа единиц Globo Н к числу единиц KLH. Еще более предпочтительно отношение эпитопов терапевтического конъюгата рассчитывают с помощью следующей формулы = (фактическая масса единицы Globo Н/молекулярная масса единицы Globo H)/(фактическая масса единицы KLH/молекулярная масса единицы KLH). Специалисты в данной области техники могут легко определить отношения эпитопов. Предпочтительно, массу Globo Н определяют, например, с помощью высокоэффективной анионообменной хроматографии с импульсным амперометрическим обнаружением (НРАЕС-PAD).
[0133] Предпочтительно, отношения эпитопов терапевтических конъюгатов согласно настоящему изобретению составляют приблизительно, по меньшей мере или точно: 1,10, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1025, 1050, 1075, 1100, 1125, 1150, 1175, 1200, 1225, 1250, 1275, 1300, 1325, 1350, 1375, 1400, 1425, 1450, 1475, 1500, 1525, 1550, 1575, 1600, 1625, 1650, 1675, 1700, 1725, 1750, 1775, 1800, 1825, 1850, 1875, 1900, 1925, 1950, 1975, 2000, 2025, 2050, 2075, 2100, 2125, 2150, 2175, 2200, 2225, 2250, 2275, 2300, 2325, 2350, 2375, 2400, 2425, 2450, 2475, 2500, 2525, 2550, 2575, 2600, 2625, 2650, 2675, 2700, 2725, 2750, 2775, 2800, 2825, 2850, 2875, 2900, 2925, 2950, 2975 или 3000.
[0134] В одном варианте реализации терапевтические композиции согласно настоящему изобретению содержат смесь терапевтических конъюгатов, имеющих диапазон отношений эпитопов. В одном варианте реализации диапазон, среднее или медианное значение отношений эпитопов терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 10 приблизительно до 3200, приблизительно от 800 приблизительно до 2500, приблизительно от 1000 приблизительно до 2000, приблизительно от 1250 приблизительно до 1750 или приблизительно от 1400 приблизительно до 1600. В другом варианте реализации диапазон, среднее или медианное значение отношений эпитопов терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 10 приблизительно до 150, приблизительно от 40 приблизительно до 125, приблизительно от 50 приблизительно до 100, приблизительно от 62 приблизительно до 87 или приблизительно от 70 приблизительно до 80. В другом варианте реализации диапазон, среднее или медианное значение отношений эпитопов терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 20 приблизительно до 300, приблизительно от 80 приблизительно до 250, приблизительно от 100 приблизительно до 200, приблизительно от 125 приблизительно до 175 или приблизительно от 140 приблизительно до 160. В другом варианте реализации диапазон, среднее или медианное значение отношений эпитопов терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 30 приблизительно до 450, приблизительно от 120 приблизительно до 375, приблизительно от 150 приблизительно до 300, приблизительно от 185 приблизительно до 260 или приблизительно от 210 приблизительно до 240. В некоторых фармацевтических композициях по меньшей мере или приблизительно 30, 40, 50, 60, 70, 80, 90, 95, 98, 99, или 100% терапевтических конъюгатов существуют в виде мономеров, или димеров, тримеров, тетрамеров, пентамеров, или их комбинации.
АНТИТЕЛА К ТЕРАПЕВТИЧЕСКИМ КОНЪЮГАТАМ
[0135] В некоторых иллюстративных вариантах реализации изобретение также охватывает выделенные терапевтические антитела, которые специфически аффинно связываются с терапевтическими конъюгатами, описанным в настоящем документе, а также применение указанных антител при лечении и/или диагностики пролиферативного заболевания.
[0136] В контексте настоящего описания термины "антитело" и "антитела" (иммуноглобулины) охватывают моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), которые получены по меньшей мере из двух интактных антител, антитела человека, гуманизированные антитела, верблюжьи антитела (camelised antibodies), химерные антитела, одноцепочечные Fvs (scFv), одноцепочечные антитела, однодоменные антитела, доменные антитела, Fab-фрагменты, F(ab')2-фрагменты, фрагменты антител, которые проявляют требуемую биологическую активность, Fvs (sdFv) с дисульфидными связями, и антиидиотипические (анти-Id) антитела (включая, например, анти-Id антитела к антителам согласно настоящему изобретению), интратела и эпитопсвязывающие фрагменты любых из указанных выше. В частности, антитела включают молекулы иммуноглобулина и иммунологически активные фрагменты молекул иммуноглобулинов, т.е., молекулы, которые содержат антигенсвязывающий сайт молекул иммуноглобулина, могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
[0137] "Аффинность" антитела в отношении эпитопа, например, например, единицы Globo Н терапевтического конъюгата, применяемого для лечения(й), описанных в настоящем документе, является широко распространенным термином в данной области техники и означает степень, или силу связывания антитела с эпитопом. Аффинность можно измерить и/или выразить несколькими способами, известными в данной области техники, включая, но не ограничиваясь, равновесную константу диссоциации (KD или Kd), кажущуюся равновесную константу диссоциации  , и IC50 (количество, необходимое для 50%-ного ингибирования в конкурентном анализе). Подразумевается, что для целей настоящего изобретения, аффинность представляет собой среднюю аффинность данной популяции антител, которые связываются с эпитопом. Значения
, и IC50 (количество, необходимое для 50%-ного ингибирования в конкурентном анализе). Подразумевается, что для целей настоящего изобретения, аффинность представляет собой среднюю аффинность данной популяции антител, которые связываются с эпитопом. Значения  , приведенные в настоящем документе в терминах мг IgG на мл или мг/мл, показывают мг Ig на мл сыворотки, а также в плазмы. Когда аффинность антител использует в качестве основы для проведения методов лечения, описанных настоящем документе, или для выбора способов лечения, описанных настоящем документе, аффинность антител можно измерять до и/или во время лечения, и врач-клиницист может использовать полученные значения для оценки того, является ли больной человек подходящим кандидатом для лечения.
, приведенные в настоящем документе в терминах мг IgG на мл или мг/мл, показывают мг Ig на мл сыворотки, а также в плазмы. Когда аффинность антител использует в качестве основы для проведения методов лечения, описанных настоящем документе, или для выбора способов лечения, описанных настоящем документе, аффинность антител можно измерять до и/или во время лечения, и врач-клиницист может использовать полученные значения для оценки того, является ли больной человек подходящим кандидатом для лечения.
[0138] В контексте настоящего описания термин "специфическое связывание" относится к взаимодействию между связывающимися парами (например, антитело и антиген). В различных случаях специфическое связывание может быть выражено с помощью констаны аффинности по меньшей мере или приблизительно 10-6 моль/литр, приблизительно 10-7 моль/литр, или приблизительно 10-8 моль/литр, или менее.
БИОЛОГИЧЕСКИЕ СПОСОБЫ АНАЛИЗА
[0139] В одном варианте реализации терапевтические композиции, содержащие терапевтические конъюгаты согласно настоящему изобретению, при введении пациенту способны индуцировать титры антител к Globo H по меньшей мере или приблизительно в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 50, 100, 250, 500, 1000, 1500, 2000, 2500, 3000, 4000, или 5000 раз больше, чем те же титры антител к Globo H до введения (т.е., базовый титр до обработки) в этом же эксперименте. В некоторых вариантах реализации антитела к Globo Н представляют собой антитела IgM. В другом варианте реализации антитела к Globo Н представляют собой антитела IgG.
[0140] Терапевтические композиции согласно настоящему изобретению способны вызывать гуморальный и клеточный ответ у субъекта. В некоторых вариантах реализации композиция вакцины согласно настоящему изобретению вызывает выработку антител IgG и IgM, специфичных к Globo H, и экспансию B-клеток и T-клеток (например, CD3+T-клеток, CD4+T-клеток и/или CD8+T-клеток). Как правило, данные иммунные ответы хронологически происходят после введения. В конкретном примере после введения образование B-клеток проявляется приблизительно на 3, 4, 5, 6, 7, 8, 9, 10, 20, 30 или 60 день, с последующим образованием IgG и IgM антител приблизительно на 10, 20, 30, 60 или 90 день, с последующим образованием T-клеток приблизительно на 24, 30, 40, 50, 60, 90, 120, 150 или 180 день. Композиция вакцины согласно настоящему изобретению потенциально обеспечивает долгосрочный иммунологический защитный эффект, который может предотвратить рост небольших количеств раковых клеток, тем самым являясь идеальной композицией для достижения стабилизации заболевания и улучшения выживаемости при минимальном остаточном заболевании.
[0141] "Антителозависимая клеточноопосредованная цитотоксичность" и "ADCC" относится к клеточноопосредованной реакции, в которой неспецифические цитотоксические клетки (например, клетки натуральные киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. В одном варианте реализации такие клетки являются клетками человека. Не желая быть связанными каким-либо конкретным механизмом действия, авторы полагают, что данные цитотоксические клетки, которые опосредуют ADCC, как правило, экспрессируют Fc-рецепторы (FcR). Основные клетки для опосредования ADCC, NK-клетки, экспрессируют FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII, FcγRIII и/или FcγRIV. Экспрессия FcR на гематопоэтических клетках изложена в Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-92 (1991). Для оценки ADCC активности молекулы, можно провести ADCC анализ in vitro, например, как описано в патентах США №5500362 или 5821337. Подходящие эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (МКПК) и натуральные киллеры (NK). Альтернативно или дополнительно, ADCC активность терапевтических конъюгатов согласно настоящему изобретению можно оценить in vivo, например, на животной модели, такой как раскрыта в Clynes et al., Proc. Natl. Acad. Sci. (USA), 95: 652-656 (1998).
[0142] "Комплементзависимая цитотоксичность" или "CDC" относится к способности терапевтического конъюгата инициировать активацию комплемента и лизировать мишень в присутствии комплемента. Путь активации комплемента начинается со связывания первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе с распознанным антигеном. Для оценки активации комплемента, можно проводить CDC-анализ, например, как описано в Gazzano-Santaro et al., J. Immunol. Methods, 202: 163 (1996).
[0143] В другом варианте реализации терапевтические композиции, содержащие терапевтические конъюгаты согласно настоящему изобретению, при введении пациенту способны индуцировать образование у пациента/субъекта иммунной сыворотки к Globo Н, которая специфически связывается с Globo H-положительными раковыми клеточными линиями, например, клетками MCF-7.
КОМБИНАЦИИ
[0144] Терапевтические композиции могут содержать и другие противораковые/противопролиферативные лекарственные средства, а также адъюванты и другие иммуномодулирующие молекулы, такие как цитокины или хемокины. Все эти агенты могут поставляться в наборе вместе в отдельных емкостях или одной емкости. Агенты можно объединять в момент введения или по меньшей мере или приблизительно за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 минуты, часы или дни до введения.
[0145] Адъюванты представляют собой фармакологические или иммунологические агенты, которые изменяют действие других агентов. Они могут быть неорганическим или органическим химическим веществом, макромолекулой или целыми раковыми клетками или их частями, которые усиливают иммунный ответ на данный антиген. Адъюванты включают полный и неполный адъювант Фрейнда, молекулы Toll-подобного рецептора и его миметики, ЛПС, липопротеины, липопептиды, флагеллин, двухцепочечную РНК, неметилированные CpG-островки, левамизол, бациллу Кальметта-Герена, октреотид, изопринозин и задаксин, различные формы ДНК и РНК, классически высвобождаемые бактериями и вирусами, антагонисты PD-1 и антагонисты CTLA. В одном варианте реализации адъювант представляет собой сапониновый адъювант.
[0146] В определенном варианте реализации сапониновый адъювант представляет собой сапонин OPT-821, который является по существу чистым. В других вариантах реализации сапонин OPT-821 представляет собой его биологически активные фрагменты. Адъювант может также включать нечистые формы сапонинов OPT-821. Очищенные сапонины OPT-821 обладают повышенным адъювантным эффектом при введении с вакциной, описанной в настоящем документе, или в смеси с другими по существу чистыми сапониновыми или не сапониновыми адъювантами.
[0147] Сапонины OPT-821 представляют собой встречающиеся в природе гликозиды, экстрагированные с высокой чистотой из коры дерева Quillaja saponaria Molina, путем высокоэффективной жидкостной хроматографии (ВЭЖХ), жидкостной хроматографии низкого давления на силикагеле, и хроматографии за счет гидрофильного взаимодействия (HILIC), как описано, например, в патенте США №5057540 и патенте США №6524584, содержание которых включено посредством ссылки в полном объеме. Анализ с помощью высокоэффективной жидкостной хроматографии показал, что OPT-821 представляют собой смесь структурно родственных изомерных соединений. Различные очищенные изомерные соединения сапонинов OPT-821 были идентифицированы и раскрыты в настоящем документе.
[0148] В некоторых вариантах реализации сапонин OPT-821 содержит по меньшей мере одно выделенное соединение формулы I, как показано ниже:
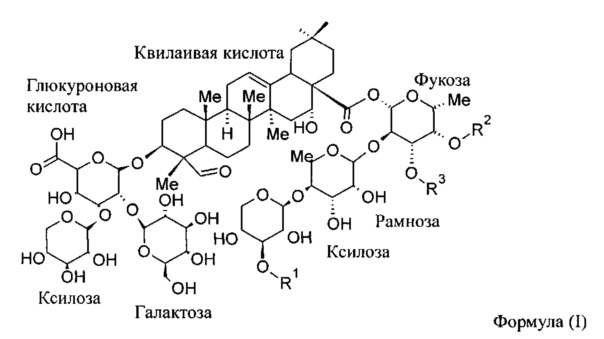 ,
,
где
R1 представляет собой β-D-апиозу или β-D-ксилозу; и
R2 и R3 представляют собой независимо H, алкил,
(ацильный остаток жирной кислоты для соединения 1989), или
(ацильный остаток жирной кислоты для соединения 1857),
[0149] Сапонин OPT-821 может также содержать выделенное соединение формулы I, где
(i) R1 представляет собой β-D-апиозу, R2 представляет собой ацильный остаток жирной кислоты для соединения 1989, изображенный выше, и R3 представляет собой Н (1989 соединение V1A);
(ii) (ii) R1 представляет собой β-D-апиозу, R2 представляет собой H, и R3 представляет собой ацильный остаток жирной кислоты для соединения 1989, изображенный выше (1989 соединение V1B);
(iii) (iii) R1 представляет собой β-D-ксилозу, R2 представляет собой ацильный остаток жирной кислоты для соединения 1989, изображенный выше, и R3 представляет собой Н (1989 соединение V2A); или
(iv) (iv) R1 представляет собой β-D-ксилозу, R2 представляет собой H, и R3 представляет собой ацильный остаток жирной кислоты для соединения 1989, изображенный выше (1989 соединение V2B). В совокупности 1989 соединение V1A, 1989 соединение V1B, 1989 соединение V2A и 1989 соединение V2B называются "смесь соединений 1989."
[0150] В таблице 1 приведены функциональные группы соединений 1989 и мольный % каждого соединения 1857 в смеси соединений 1857.
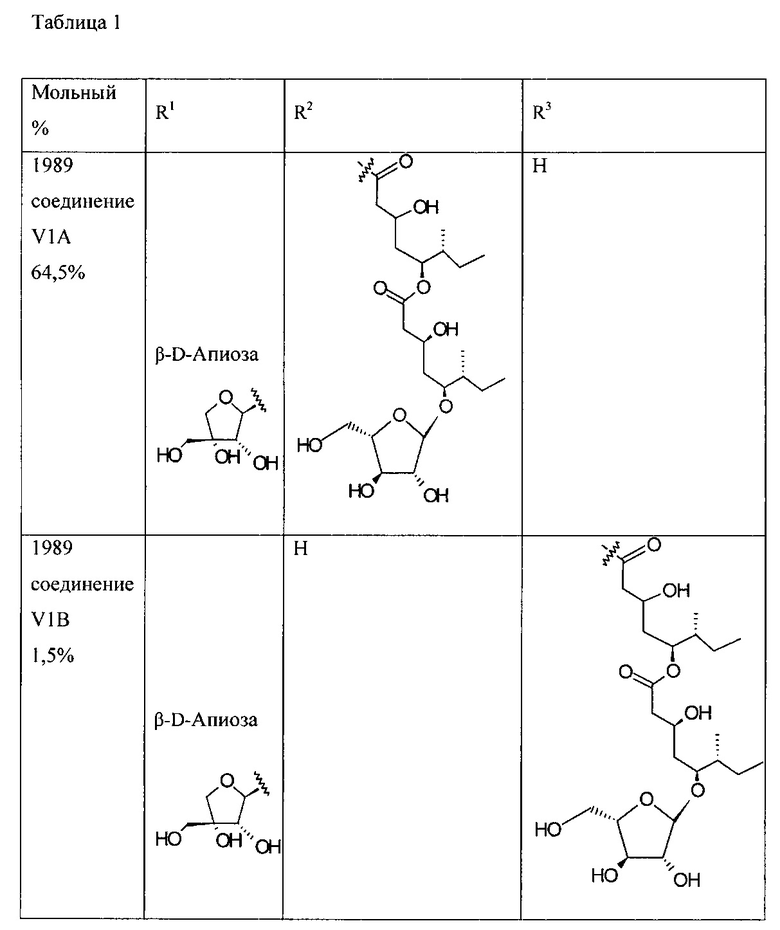
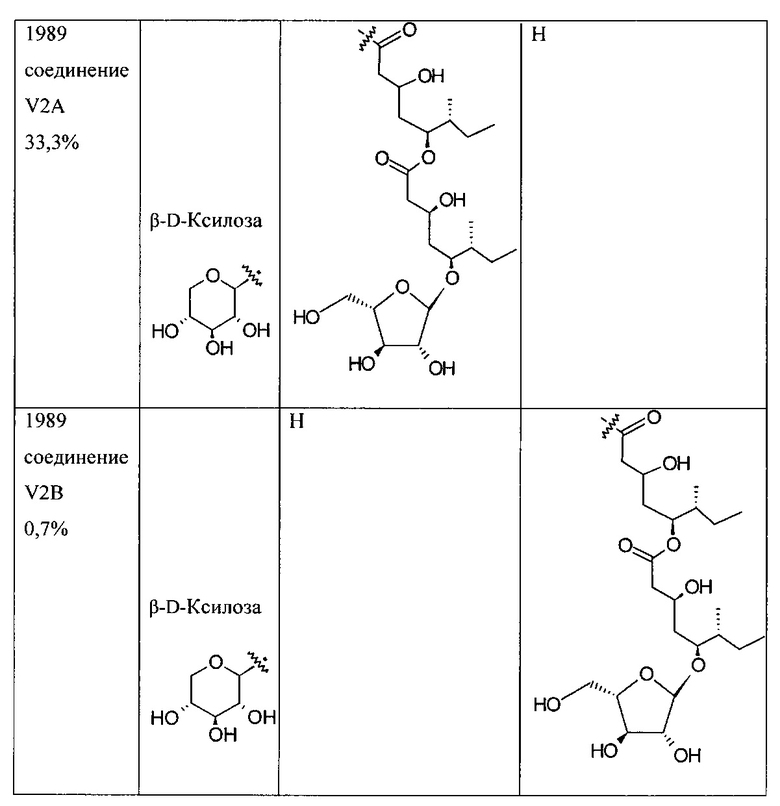
[0151] Сапонин OPT-821 может содержать выделенное соединение формулы I, где:
(i) R1 представляет собой β-D-апиозу, R2 представляет собой ацильный остаток жирной кислоты для соединения 1857, изображенный выше, и R3 представляет собой H (1857 соединение V1A);
(ii) R1 представляет собой β-D-апиозу, R2 представляет собой H, и R3 представляет собой ацильный остаток жирной кислоты для соединения 1857, изображенный выше (1857 соединение V1B);
(iii) R1 представляет собой β-D-ксилозу, R2 представляет собой ацильный остаток жирной кислоты для соединения 1857, изображенный выше, и R3 представляет собой Н (1857 соединение V2A); или
(iv) R1 представляет собой β-D-ксилозу, R2 представляет собой H, и R3 представляет собой ацильный остаток жирной кислоты для соединения 1857, изображенный выше (1857 соединение V2B). В совокупности 1857 соединение V1A, 1857 соединение V1B, 1857 соединение V2A и 1857 соединение V2B называются "смесь соединений 1857."
[0152] В таблице 2 приведены функциональные группы соединений 1857 и мольный % каждого соединения 1857 в смеси соединений 1857. ВЭЖХ.
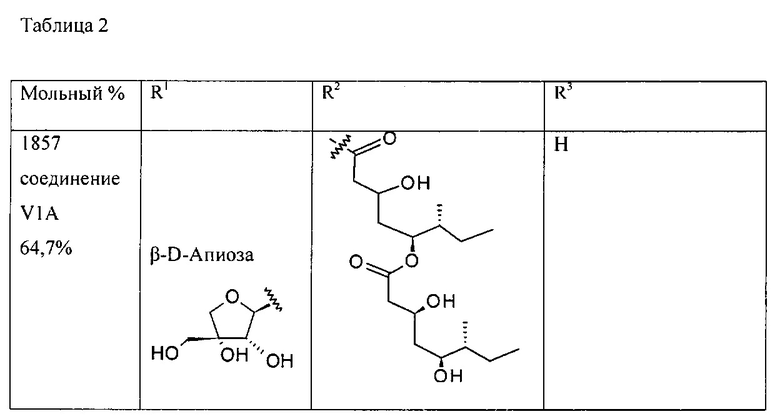
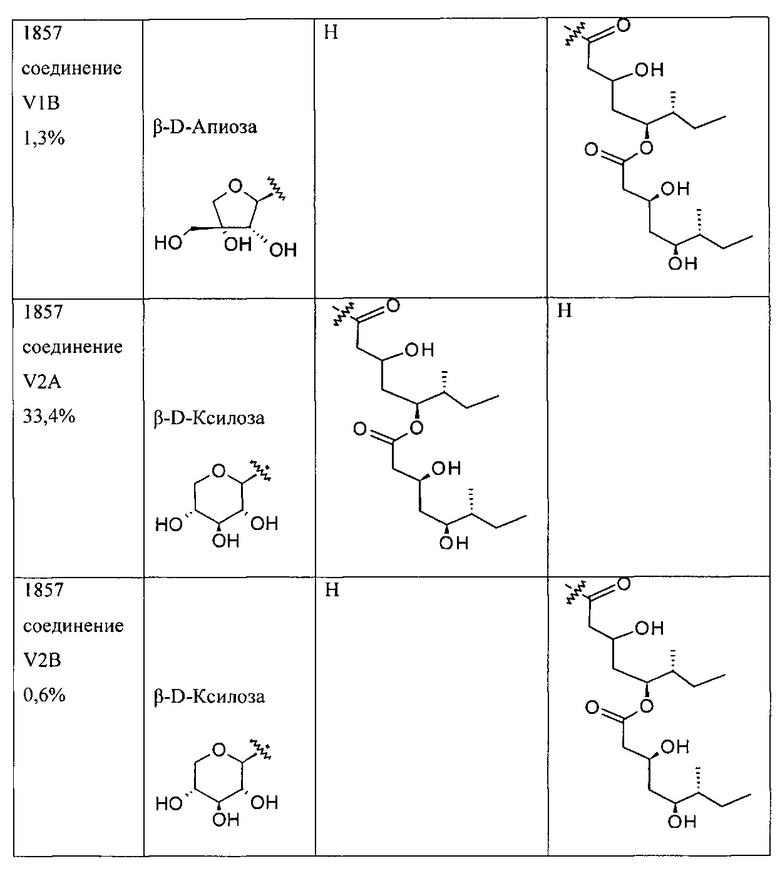
[0153] Сапонин OPT-821 содержит одно или более из следующих соединений:
(i) 1857 соединение V1A; (ii) 1857 соединение V1B;
(ii) 1857 соединение V2A;
(iii) 1857 соединение V2B;
(iv) 1989 соединение V1A;
(v) 1989 соединение V1B;
(vi) 1989 соединение V2A; или
(vii) 1989 соединение V2B.
[0154] Процентное соотношение смеси соединений 1857 и смеси соединений 1989 в сапонине OPT-821 может варьировать следующим:
(i) OPT-821 содержит приблизительно от 1 мольного % приблизительно до 15 мольных % смеси соединений 1857; и
(ii) OPT-821 содержит приблизительно от 85 мольных % приблизительно до 99 мольных % смеси соединений 1989.
[0155] Все мольные % могут изменяться с шагом 0,1% (например, приблизительно от 87% приблизительно до 90%, приблизительно от 90,5% приблизительно до 97%, приблизительно от 3,5% приблизительно до 11%, приблизительно от 10% приблизительно до 14%).
[0156] Смесь соединений 1989 может содержать приблизительно 60-70 мольных % 1989 соединения V1A; приблизительно 1-5 мольных % 1989 соединения V1B; приблизительно 30-40 мольных % 1989 соединения V2A; и приблизительно 0,1-3 мольных % 1989 соединения V2B. Все мольные % могут изменяться с шагом 0,1% (например, 65%, 2,5%, 35,6%).
[0157] Смесь соединений 1857 может содержать приблизительно 60-70 мольных % 1857 соединения V1A; приблизительно 1-5 мольных % 1857 соединения V1B; приблизительно 30-40 мольных % 1857 соединения V2A; и, приблизительно 0,1-3 мольных % 1857 соединения V2B. Все мольные % могут изменяться с шагом 0,1% (например, 65%, 2,5%, 35,6%).
[0158] В другом варианте реализации по существу чистый OPT-821 выделяли из неочищенного экстракта Quillaja saponaria, где указанный OPT-821 характеризуется одиночным основным пиком, который включает 90% или более от общей площади всех пиков на хроматограмме, без учета пиков растворителя, при обращенно-фазовом ВЭЖХ-анализе на колонке Symmetry С18 с размером частиц 5 мкм, размером пор  , внутренним диаметром (ID) 4,6 мм × 25 см длиной (L) с программой элюирования с соотношением подвижных фаз A:B от 95%: 5% до 75%: 25% за 11 минут, где подвижная фаза A представляет собой дистиллированную воду с 0,1% трифторуксусной кислоты, и подвижная фаза B представляет собой ацетонитрил с 0,1% трифторуксусной кислоты, при скорости потока 1 мл/мин.
, внутренним диаметром (ID) 4,6 мм × 25 см длиной (L) с программой элюирования с соотношением подвижных фаз A:B от 95%: 5% до 75%: 25% за 11 минут, где подвижная фаза A представляет собой дистиллированную воду с 0,1% трифторуксусной кислоты, и подвижная фаза B представляет собой ацетонитрил с 0,1% трифторуксусной кислоты, при скорости потока 1 мл/мин.
[0159] В одном варианте реализации фармацевтическая композиция содержит соединение формулы (I)
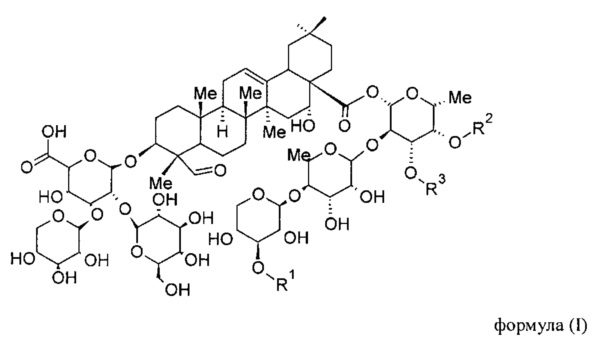 ,
,
где,
R1 представляет собой β-D-апиозу или β-D-ксилозу; и
R2 и R3 представляют собой независимо Н, алкил, или
 (ацильный остаток жирной кислоты для соединения 1857),
(ацильный остаток жирной кислоты для соединения 1857),
и фармацевтически приемлемый носитель.
[0160] Вакцина может содержать углеводный антиген или его иммуногенный фрагмент и сапонин OPT-821. В еще другом варианте реализации вакцина содержит углеводный антиген или его иммуногенный фрагмент; белок-носитель и сапонин OPT-821. В другом варианте реализации вакцина содержит углеводный антиген, выбранный из Globo Н, KLH, и сапонина OPT-821. Неограничивающие примеры белка-носителя включают в себя KLH.
[0161] В контексте настоящего описания термин "цитокин" относится к любому из множества небольших, секретируемых белков, которые регулируют интенсивность и продолжительность иммунного ответа путем воздействия на процесс дифференцировки иммунных клеток, обычно включающий изменения в экспрессии генов, с помощью которых клетка-предшественник становится особым специализированным типом клеток. Цитокины имеют различные названия, такие как лимфокины, интерлейкины и хемокины в зависимости от их предполагаемой функции, секреторной клетки, или мишени для воздействия. Например, некоторые распространенные интерлейкины включают, но не ограничиваются ими, IL-2, IL-12, IL-18, IL-2, IFN-γ, TNF, IL-4, IL-10, IL-13, IL-21, GM-CSF и TGF-β.
[0162] В контексте настоящего описания термин "хемокин" относится к любому из различных небольших хемотаксических цитокинов, высвобождаемых в месте инфекции, которые обеспечивают средство для мобилизации и активации лимфоцитов. Хемокины привлекают лейкоциты к месту инфекции. Хемокины сохраняют остатки цистеина, которые позволяют распределить их по четырем группам. Группы с типичными хемокинами представляют собой С-С хемокины (хемокин, экспрессируемый и секретируемый T-клетками при активации (RANTES), MCP-1, MIP-1α и MIP-1β), C-X-C хемокины (IL-8), С хемокины (лимфотактин) и CXXXC хемокины (фракталкин).
[0163] Терапевтические композиции согласно настоящему изобретению могут дополнительно содержать ингибиторы PD-1/PD-L1 (иммунопрепараты цитотоксических Т-лимфоцитов (ЦТЛ)), иммунопрепараты CTLA-4, ингибиторы CDK4/6 (таргет-терапия), ингибиторы PI3K (таргет-терапия), ингибиторы mTOR (таргет-терапия), ингибиторы AKT (таргет-терапия), ингибиторы Pan-Her (таргет-терапия). Также данные ингибиторы могут быть модифицированы для получения соответствующего моноклонального антитела. Такие антитела могут быть включены в терапевтические композиции согласно настоящему изобретению.
[0164] Терапевтические композиции могут содержать другие противораковые/противопролиферативные или химиотерапевтические агенты. В некоторых вариантах реализации примеры таких агентов можно найти в Cancer Principles and Practice of Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Такие противораковые агенты включают, но не ограничиваются ими, следующие: гормональные терапевтические агенты (например, селективные модуляторы эстрогеновых рецепторов, модуляторы андрогенных рецепторов), моноклональные антитела, химиотерапевтические вещества, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические агенты, противоопухолевые агенты, противопролиферативные агенты, ингибиторы пренилпротеинтрансферазы, ингибиторы редуктазы ГМГ-КоА, азотистые иприты, нитрозомочевины, ингибиторы ангиогенеза (например, бевацизумаб), ингибиторы клеточной пролиферации и сигнальных путей выживания, агенты, вызывающие апоптоз, агенты, которые нарушают контрольные точки клеточного цикла, агенты, которые взаимодействуют с рецепторными тирозинкиназами (RTK), ингибиторы мишени рапамицина у млекопитающих (mTOR), ингибиторы рецептора эпидермального фактора роста человека 2 типа (HER2), ингибиторы рецептора эпидермального фактора роста (EGFR), ингибиторы интегрина, НПВС, агонисты PPAR, ингибиторы множественной лекарственной устойчивости (MDR), противорвотные агенты, агенты, подходящие для лечения анемии, агенты, подходящие для лечения нейтропении, средства повышающие иммунитет, бисфосфонаты, ингибиторы ароматазы, агенты, индуцирующие терминальную дифференцировку опухолевых клеток, ингибиторы γ-секретазы, противораковые вакцины, и любые их комбинации.
СОСТАВЫ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
[0165] Терапевтические композиции (также называемые здесь фармацевтические композиции) обычно содержат фармацевтически приемлемый носитель. В контексте настоящего описания выражение "фармацевтически приемлемый носитель" включает в себя растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, задерживающие всасывание, и тому подобные, совместимые с фармацевтическим введением. В композиции также могут быть включены дополнительные активные соединения. Фармацевтическая композиция изготовлена таким образом, чтобы быть совместимой с предполагаемым путем введения. Примеры путей введения включают парентеральный, например, внутривенное, внутрикожное, подкожное, внутримышечное, внутриартериальное, пероральное (например, ингаляции), трансдермальное (местное), трансмукозальное и ректальное введение. Растворы или суспензии, используемые для парентерального, внутрикожного или подкожного применения, могут содержать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, фосфатно-солевой буферный раствор, трис-буферный солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетатный, цитратный, или фосфатный буфер, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. pH можно регулировать с помощью кислот или оснований, таких как соляная кислота или гидроксид натрия. Препарат для парентерального введения может быть заключен в ампулы, одноразовые шприцы или флаконы, содержащие несколько доз, изготовленные из стекла или пластика.
[0166] Фармацевтические композиции, пригодные для применения в виде инъекций, включают стерильные водные растворы (в случае растворимости в воде) или дисперсии и стерильные порошки для приготовления для немедленного применения стерильных инъекционных растворов или дисперсий. Подходящие носители для внутривенного введения включают физиологический раствор, бактериостатическую воду, Cremophor EL® (BASF, Парсиппани, Нью-Джерси) или фосфатно-солевой буферный раствор (ФСБ). Во всех случаях композиция должна быть стерильной и жидкой до такой степени, что ее можно вводить с помощью шприца. Композиция должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носителем может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии, и путем применения поверхностно-активных веществ. Предотвращение воздействия микроорганизмов можно достигнуть с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и тому подобных. Во многих случаях будет предпочтительно включение в композиции изотонических агентов, например, сахаров, многоатомных спиртов, таких как маннит, сорбит или хлорид натрия. Пролонгированное всасывание инъекционных композиций можно осуществлять путем включения в композицию агента, который задерживает всасывание, например, моностеарат алюминия и желатин.
[0167] Стерильные инъекционные растворы можно приготовить путем введения активного соединения в требуемом количестве в подходящий растворитель с одним или комбинацией перечисленных выше ингредиентов, как это необходимо, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают путем включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов, способы приготовления включают вакуумную сушку и лиофилизацию, при которых образуется порошок активного ингредиента с любым дополнительным необходимым ингредиентом из предварительно стерилизованного фильтрацией раствора.
[0168] Пероральные композиции обычно включают в себя инертный разбавитель или съедобный носитель. Для целей перорального терапевтического введения активное соединение может быть включено со вспомогательными веществами и применяться в виде таблеток, пастилок, или капсул, например, желатиновых капсул. Пероральные композиции также можно получить с применением жидкого носителя для использования в качестве жидкости для ополаскивания полости рта. В качестве части композиции можно включать фармацевтически совместимые связывающие агенты или адъювантные материалы. Таблетки, пилюли, капсулы, пастилки и тому подобное могут содержать любые из следующих ингредиентов или соединений подобной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовую камедь или желатин; вспомогательное вещество, такое как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель (Primogel) или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или стеротес (Sterotes); скользящее вещество, такое как коллоидный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или вкусовой агент, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор.
[0169] Для введения путем ингаляции соединения доставляются в виде аэрозольного спрея из находящейся под давлением емкости или дозатора, которые содержат подходящий пропеллент, например, газ, такой как диоксид углерода, или из небулайзера.
[0170] Системное введение также можно осуществлять трансмукозально или трансдермально. В композиции для трансмукозального или трансдермального введения применяют подходящие пенетранты для проникновения через барьер. Такие пенетранты широко известны в данной области техники и включают, например, вещества для трансмукозального введения, детергенты, соли желчных кислот и производные фузидовой кислоты. Трансмукозальное введение можно осуществлять путем применения назальных спреев или суппозиториев. Для трансдермального введения активные соединения изготавливают в виде мазей, бальзамов, гелей или кремов широко известных в данной области техники. Соединения также можно приготовить в форме суппозиториев (например, с традиционными основами для суппозиториев, такими как масло какао и другие глицериды) или удерживаемых клизм для ректальной доставки.
[0171] В соответствии с воплощениями, активные соединения готовят с носителями, которые будут защищать соединение от быстрого выведения из организма, например, составы с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно применять биоразлагаемые, биосовместимые полимеры, например, этиленвинилацетат, полиангидриды, полигликолевую кислоту, коллаген, полиортоэфиры и полимолочную кислоту. Способы получения таких составов будут очевидны специалистам в данной области техники. Материалы также могут быть получены на коммерческой основе. Липосомальные суспензии (включая, направленные на инфицированные клетки липосомы с моноклональными антителами к клеточно-специфичным антигенам) также можно использовать в качестве фармацевтически приемлемых носителей. Их можно приготовить в соответствии со способами, известными специалистам в данной области техники, например, как описано в патенте США №4522811, который включен в данное описание посредством ссылки.
[0172] Целесообразно готовить пероральные или парентеральные композиции в дозированной лекарственной форме для простоты введения и однородности дозировки. Дозированная лекарственная форма в контексте настоящего описания относится к физически дискретным единицам, пригодным в качестве единичных доз для субъекта, подлежащего лечению; каждая единица содержит предварительно заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем.
ДОЗЫ
[0173] Токсичность и терапевтическую эффективность таких терапевтических композиций можно определить с помощью стандартных фармацевтических процедур на клеточных культурах или на подопытных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (терапевтически эффективной дозы для 50% популяции). Соотношение доз с токсическим и терапевтическим эффектами представляет собой терапевтический индекс, который можно выразить как отношение LD50/ED50. Предпочтительны терапевтические композиции, которые обладают высокими терапевтическими индексами. Так как могут применяться соединения, которые проявляют токсические побочные эффекты, необходимо принять меры для разработки системы доставки, которая доставляет такие соединения к месту воздействия для того, чтобы свести к минимуму возможность повреждения неинфицированных клеток и тем самым уменьшить побочные эффекты.
[0174] Данные, полученные из анализов на клеточных культурах и исследований на животных, можно использовать для определения диапазона доз для применения людьми. Дозы таких соединений предпочтительно лежат в пределах диапазона циркулирующих в крови концентраций, которые включают ED50 с небольшой токсичностью или с отсутствием токсичности. Доза может варьировать в пределах данного диапазона в зависимости от применяемой лекарственной формы и пути введения. Для любого соединения, применяемого в способе настоящего раскрытия, терапевтически эффективную дозу первоначально можно оценить из анализов на клеточных культурах. Дозу можно установить на животных моделях для достижения диапазона циркулирующих концентраций в плазме, который включает IC50 (т.е. концентрацию тестируемого соединения, при которой достигается полумаксимальное ингибирование симптомов), определенную на культуре клеток. Такие данные можно использовать для более точного определения доз для людей. Уровни в плазме можно измерять, например, с помощью высокоэффективной жидкостной хроматографии.
[0175] В некоторых вариантах реализации терапевтически эффективное количество терапевтической композиции (т.е. эффективная доза) может находиться в диапазоне приблизительно от 0,001 мкг/кг приблизительно до 250 г/кг, 0,01 мкг/кг до 10 г/кг, или 0,1 мкг/кг до 1 г/кг, или приблизительно или по меньшей мере: 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009; 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09; 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 125, 150, 175, 200, 225 или 250 грамм или микрограмм на килограмм массы тела пациента, или в других диапазонах, которые очевидны и понятны специалистам в данной области без проведения лишних экспериментов. Специалисту в данной области будет очевидно, что некоторые факторы могут оказывать влияние на дозировку и время, необходимые для эффективного лечения субъекта, включая, но не ограничиваясь, тяжестью заболевания или расстройства, предыдущим лечением, общим состоянием здоровья или возрастом субъекта, и наличием других заболеваний.
[0176] В других вариантах реализации терапевтически эффективное количество остатка Globo-H в терапевтической композиции (т.е., эффективная доза) может находятся в диапазоне приблизительно от 0,001 мкг/кг приблизительно до 250 г/кг, 0,01 мкг/кг до 10 г/кг, или 0,1 мкг/кг до 1 г/кг, или приблизительно или по меньшей мере: 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009; 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09; 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 125, 150, 175, 200, 225, или 250 грамм или микрограмм на килограмм массы тела пациента, или в других диапазонах, которые очевидны и понятны специалистам в данной области без проведения лишних экспериментов. Специалисту в данной области будет очевидно, что некоторые факторы могут оказывать влияние на дозировку и время, необходимые для эффективного лечения субъекта, включая, но не ограничиваясь, тяжестью заболевания или расстройства, предыдущим лечением, общим состоянием здоровья или возрастом субъекта, и наличием других заболеваний.
[0177] В некоторых вариантах реализации терапевтические композиции, описанные в настоящем документе, содержат или ассоциированы с по меньшей мере одним терапевтическим конъюгатом или терапевтическим антителом, при этом каждый по меньшей мере один терапевтический конъюгат или терапевтическое антитело присутствует в однократной дозе в концентрации приблизительно, по меньшей мере или более: 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99 раз по 10-9, 10-8, 10-710-710-610-510-410-310-210-1 молярных концентраций на дозу. Предпочтительно терапевтический конъюгат присутствует в однократной дозе в концентрации приблизительно от: 1-100, 2-60, 3-50, 4-40, 5-30, 6-20, 7-15, 8-10, 2-18, 3-16, 4-14, 5-12, 6-10 или 7-8 мкМ.
[0178] В некоторых вариантах реализации терапевтические композиции, описанные в настоящем документе, содержат или ассоциированы с по меньшей мере одним терапевтическим конъюгатом или терапевтическим антителом, при этом каждый по меньшей мере один терапевтический конъюгат или терапевтическое антитело присутствует в однократной дозе в концентрации приблизительно, по меньшей мере или более: 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99 раз по 10-3, 10-2, 10-1 или 10 микрограмм. В некоторых вариантах реализации приблизительно или по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150 или более микрограмм одного терапевтического конъюгата или терапевтического антитела включено в дозу.
[0179] В некоторых вариантах реализации терапевтические композиции, описанные в настоящем документе, вводят в дозе приблизительно, или по меньшей мере, или более: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 раз в день, неделю или месяц в течение периода приблизительно, или по меньшей мере, или более: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 дней, недель, месяцев или лет.
НАБОРЫ
[0180] Согласно другому аспекту один или более наборов деталей могут быть предусмотрены специалистом в данной области техники, наборы деталей для выполнения по меньшей мере одного из способов, раскрытых в данном документе, наборы деталей, содержащих один или более терапевтических конъюгатов, противораковых/противопролиферативных агентов, адъюванты, цитокинов и/или хемокинов. Терапевтические композиции, содержащие отдельно или в комбинации эффективное количество терапевтических композиций, раскрытых в данном документе, в соответствии с по меньшей мере одним из указанных выше способов. Указанные агенты могут поставляться в одной емкости или в разных емкостях в наборе.
[0181] Также наборы могут содержать условные обозначения биологического действия или других соединений, понятных специалисту в данной области при чтении настоящего описания. Набор также может содержать по меньшей мере одну композицию, содержащую эффективное количество терапевтических композиций, раскрытых в настоящем документе. Терапевтические композиции из наборов для выполнения по меньшей мере одного способа, раскрытого в настоящем документе, в соответствии с процедурой, понятной специалисту в данной области.
[0182] Настоящее описание также включает способы лечения пролиферативных заболеваний с применением терапевтических композиций, описанных в настоящем документе. В одном варианте реализации способы включают лечение рака, например, рака молочной железы. Обычно способы включают предоставление терапевтических композиций, описанных в настоящем документе, пациенту, нуждающемуся в этом, в количестве, эффективном для лечения пролиферативного расстройства.
[0183] В некоторых вариантах реализации терапевтические композиции согласно настоящему изобретению вводят субъекту, нуждающемуся в этом (например, с раком, таким как рак молочной железы), в способе, который в среднем увеличивает выживаемость без прогрессирования заболевания или общую выживаемость по сравнению с контрольным плацебо, например, плацебо в виде фосфатно-солевого буферного раствора, приблизительно или по меньшей мере на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 дней, недель, месяцев или лет.
[0184] В некоторых вариантах реализации терапевтические композиции вводят подкожно на 0-2, 6, 14 и 26 неделю при отсутствии неприемлемой токсичности или прогрессирования заболевания.
[0185] В некоторых вариантах реализации терапевтические композиции согласно настоящему изобретению вводят субъекту, нуждающемуся в этом (например, с раком, таким как рак молочной железы), в способе, который в среднем сокращает объем опухоли у пациента в относительно контрольного плацебо, например, плацебо в виде фосфатно-солевого буферного раствора, приблизительно или по меньшей мере на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или более процентов в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 дней, недель, месяцев или лет.
[0186] В некоторых вариантах реализации объемы опухолей могут быть точно измерены при помощи компьютерной томографии по меньшей мере в одном измерении (должен быть записан наибольший диаметр в плоскости измерения) с минимальным размером 10 мм (толщина срезов компьютерной томографии рекомендуется от 2,5 мм до 5 мм).
СПОСОБЫ СИНТЕЗА КОМПОЗИЦИЙ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
[0187] Гексасахаридную часть Globo H терапевтических композиций согласно настоящему изобретению химически синтезируют как аллилгликозид, и затем подготавливают для конъюгации с KLH.
[0188] В одном иллюстративном варианте реализации химический синтез Globo Н включает в себя следующие основные стадии:
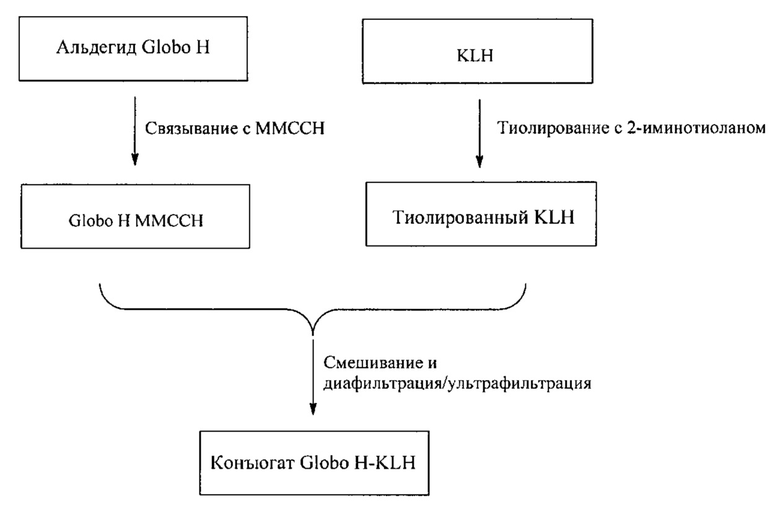
[0189] KLH обрабатывали 2-иминотиоланом в водном буфере. Тиолированный KLH отделяли от непрореагировавшего 2-иминотиолана с помощью гель-фильтрационной колонки Sephadex G-15. Тиолированный KLH хранили в атмосфере инертного газа (азота или аргона) и сразу же использовали для конъюгации с Globo HMMCCH.
ПРИМЕРЫ
[0190] Пример 1: Получение гликоконъюгата согласно изобретению (Globo H-KLH)
[0191] Аллилгликозид Globo Н (коммерчески доступный) превращали в альдегид путем озонолиза. Альдегид Globo Н подвергали взаимодействию с M2C2H (линкер) и NaCNBH3 с получением Globo H-MMCCH. Смесь очищали на колонке для получения Globo H-ММССН. Наличие во фракции Globo H-ММССН подтверждали при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ) и затем объединяли вместе. KLH растворяли в буфере для тиолирования и в реакционную смесь порциями добавляли 2-иминотиолан. Реакционную смесь инкубировали до завершения реакции, а затем KLH-SH очищали на колонке. Globo Н-ММССН и KLH-SH объединяли 2. Реакционную смесь перемешивали до завершения реакции. Затем очищали Globo H-KLH с получением конечного продукта.
[0192] Пример 2: Анализ массового отношения Globo Н к KLH в гликоконъюгате
[0193] Массовое отношение Globo Н к KLH в полученном гликоконъюгате подтверждали с помощью высокоэффективной анионообменной хроматографии с импульсным амперометрическим обнаружением (HPAEC-PAD). Результаты представлены в таблице 3.
[0194] Таблица 3: Массовое отношение Globo Н к KLH в гликоконъюгате
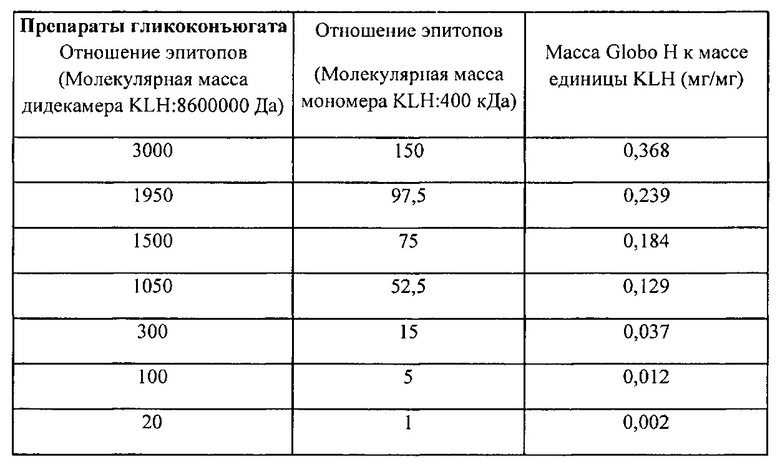
[0195] Пример 3: Анализ отношения эпитопов Globo Н к KLH в гликоконъюгате
[0196] Молекулярная масса дидекамера KLH (природной агрегатной формы) составляет приблизительно 7,5 МДа ~ 8,6 МДа, как описано в литературе, например, в Micron 30 (1999) 597-623. Посредством гель-проникающей хроматографии и спектрометрии многоуглового лазерного рассеяния (MALS) подтвердили, что нативный KLH имеет молекулярную массу около 8,6 МДа (см., фиг. 3 и 4). Гликоконъюгаты настоящего изобретения (образец №5, массовое отношение Globo Н к KLH составляет 0,17:1) анализировали при помощи гель-проникающей хроматографии. Результаты показали, что гликоконъюгаты согласно настоящему изобретению имеют меньшую массу в молекулярной массе по сравнению с природными агрегированными дидекамерами KLH. См., фиг. 4. Массовые отношения затем вычисляли, как показано в таблице 4.
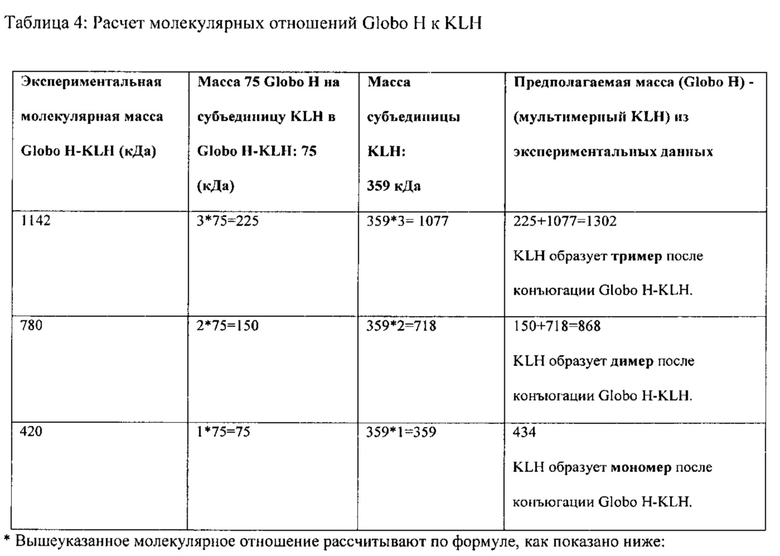
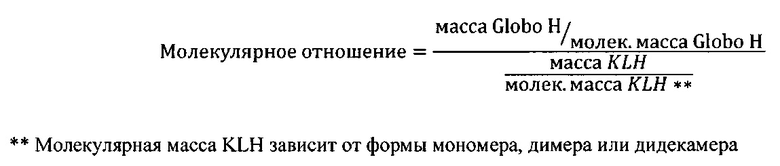
[0197] С учетом вышеизложенного, было сделано заключение, что в гликоконъюгате согласно настоящему изобретению мономерные единицы KLH образовывали мономеры, димеры и/или тримеры после конъюгации с Globo Н.
[0198] Пример 4: Получение вакцинных композиций и иммунизация крыс
[0199] Различные образцы гликоконъюгатов (Globo H-KLH), приготовленные, как в примере 1, хранили при 4°C, и смешали с сапониновым адъювантом в ламинарном шкафу. Полученные вакцинные композиции помещали на лед и транспортировали в виварий для последующей иммунизации.
[0200] Три группы крыс Льюиса иммунизировали различными вакцинными композициями, как показано в таблице 5.
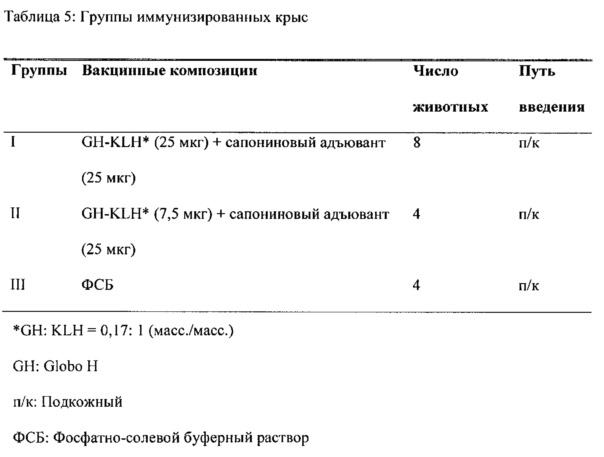
[0201] Крыс иммунизировали на 0, 7, 14 и 21 день. Мононуклеарные клетки периферической крови (МКПК) и плазму отбирали на 0, 3, 10, 17, 24 и 31 день. Селезенку, лимфатические узлы и перитонеальный смыв собирали на день 31.
[0202] Пример 5: Анализы индукции гуморального и клеточного иммунного ответа у крыс
Пример 5.1 Анализ субпопуляций иммунных эффекторных клеток с помощью проточной цитометрии
[0203] Мононуклеарные клетки периферической крови (МКПК) выделяли из животных, а затем идентифицировали различные субпопуляции иммунных эффекторных клеток в МКПК с помощью проточной цитометрии с применением специфических антител к различным клеточным маркерам. МКПК, выделенные из иммунизированных крыс на 0, 3, 10, 17, 24 и 31 день, окрашивали различными флуоресцентными (FITC)-меченными антителами и помещали на лед на 30 минут. После инкубации клетки промывали промывочным буфером (1% бычьего сывороточного альбумина (Sigma) и 0,1% NaN3 (Sigma) в фосфатно-солевом буферном растворе (UniRegion Biotech)) и центрифугировали при 350 g в течение 5 минут. Клетки ресуспендировали в промывочном буфере для определения флуоресценции с помощью цитофлуориметра FACS Canto (BD Bioscience). Данные анализировали с помощью программного обеспечения BD FACSDiva (BD Bioscience). Результаты показали, что у крыс, иммунизированных гликоконъюгатом согласно настоящему изобретению, существенно увеличились T-клетки, B-клетки, CD4+ T-клетки и CD8+ T-клетки по сравнению с контрольной группой ФСБ. В частности, популяция B-клеток впервые появлялась на 3-й день и последующие CD3+ T, CD4+ T и CD8+ T-клетки появлялись на 24-й день. См. фиг. 5(A)-(D).
Пример 5.2 Исследование Globo H-специфичных антител посредством ИФА анализа
[0204] Выработку Globo H-специфичных антител в плазме иммунизированных крыс определяли с помощью ИФА анализа. Результаты показали, что титры Globo H-специфического IgG начали расти на 10 день и достигли максимума на 17 день после иммунизации. Аналогичные картины наблюдали при выработке Globo H-специфического антитела IgM. См. фиг. 5(A)-(B). У крыс, обработанных ФСБ, или только KLH с адъювантом (данные не показаны), отсутствовал Globo H-специфический ответ с участием антител IgG и IgM.
[0205] Таким образом, иммунизированные крысы начинали вырабатывать В-клетки на 3-й день, с последующей продукцией антител IgM и IgG к Globo Н, которая появлялась на 10-й день, и последующее CD3+ T, CD4+ T и CD8+ T-клетки появлялись на 24-й день. Гликоконъюгат (Globo H-KLH) согласно настоящему изобретению является эффективным для индукции как гуморального, так и клеточного ответа.
[0206] Пример 6: Иммунизация мышей и исследование антител посредством ИФА анализа
[0207] Различные образцы гликоконъюгатов (Globo H-KLH) хранили при 4°C и смешали с сапониновым адъювантом в ламинарном шкафу. Полученные вакцинные композиции помещали на лед и транспортировали в виварий для последующей иммунизации.
[0208] Приблизительно восьми недельные мыши Balb/c путем подкожной инъекции получали Globo H-KLH с различными отношениями углеводов к белкам (Globo H: KLH) один раз в неделю в течение четырех недель (0, 7, 14 и 21 день). Образцы крови без антикоагулянта отбирали из ретроорбитальной или лицевой вены в день перед иммунизацией или 0 день, и через три дня после каждой вакцинации (10, 17 и 24 день). Затем образцы центрифугировали для отделения сыворотки и эритроцитов. Сыворотку отбирали и хранили при -20°C, впоследствии анализировали при помощи ИФА анализа. Для статистического анализа применяли критерий Манна-Уитни.
[0209] Как показано на фиг. 6, гликоконъюгат (Globo H-KLH) в сочетании с сапониновым адъювантом в соответствии с настоящим изобретением продемонстрировал на животной модели значительную индукцию ответа Globo H-специфических антител IgM по сравнению с контрольной группой ФСБ. В частности, гликоконъюгат с массовым отношением 0,17: 1 (Globo Н: KLH) индуцировал больший титр антител, чем гликоконъюгат с массовым отношением 0,07: 1 (Globo Н: KLH).
[0210] Таким образом, гликоконъюгаты (Globo H-KLH) в сочетании с подходящим адъювантом в соответствии с настоящим изобретением, как было показано, на животной модели вызывали неожиданно высокий гуморальный и клеточный иммунный ответ, в частности, размножение В-клеток и Т-клеток, включая ЦТЛ, и IgM и IgG ответы, которые имеют важное значение в иммунотерапии рака.
[0211] Пример 7: Исследование иммуногенности на мышах Globo Н-KLH в присутствии или в отсутствии адъювантной вакцины
[0212] Продемонстрировали способность композиции Globo Н согласно настоящему изобретению в паре с адъювантом вызвать иммунный ответ у мышей. Количество Globo-H специфических антител, индуцированных иммунотерапевтическим препаратом, количественно оценивали с помощью ИФА и FACS анализов.
[0213] Группы 6-недельных самок мышей C57BL/6 подкожно иммунизировали Globo Н-KLH и адъювантом. Уровни доз Globo Н-KLH составляли эквивалент количества Globo-H (в мкг) в Globo H-KLH. Каждая инъекция включала диапазон доз, эквивалентных от 0,6 мкг до 5,0 мкг Globo-H в Globo H-KLH и 20 мкг адъюванта. Иммунизацию проводили на 0, 8 и14 день, и сыворотку собирали в 0 день (перед инъекцией) и 24 день для сравнительного анализа при помощи ИФА и FACS. Серологические ответы измеряли при помощи ИФА для определения титра антител к церамиду Globo Н, и при помощи FACS для определения реактивности клеточной поверхности Globo H-положительных клеток MCF-7.
[0214] На протяжении иммунизации после вакцинации не наблюдалось изменение поведения, аппетита, общего вида и груминга. Через десять дней после третьей иммунизации собирали сыворотку для определения посредством ИФА титров антител IgG и IgM к Globo Н, используя титр ≥8 раз значений пред обработкой в качестве критерия для положительного ответа. Как показано на фигуре 2, у мышей отсутствовал ответ, которые получали только Globo Н, конъюгат Globo H-KLH или только адъювант. В отличие от этого, 14/15 мышей, обработанных Globo H-KLH + адъювант, продемонстрировали ответ со значительными титрами IgG к Globo Н, которые по-видимому не зависят от дозы Globo H-KLH от 0,6 до 5 мкг. Средние титры IgG для каждой дозы возрастали от 13 до 17,5 раз по сравнению со значением перед обработкой. Как и IgM к Globo Н, одна из 15 мышей показала 8-кратное увеличение титра после иммунизации с адъювантом + Globo Н-KLH. Однако, у 5/15 был титр IgM ≥4 раза чем в сыворотке перед иммунизацией и в общей сложности у 6/15 был титр ≥2 раза. Средние титры IgM для каждой дозы возрастали в 2,5 раза по сравнению со значением перед обработкой.
[0215] Связывающую способность иммунных сывороток с Globo H-экспрессирующей клеточной линией рака молочной железы MCF-7 определяли при помощи FACS-анализа при разведении сыворотки 1:25. В данном анализе значение после обработки на 30% выше значения перед обработкой (т.е. ≥1,3-кратное увеличение) рассматривалось как положительное. Как показано на фигуре 3, иммунные сыворотки от всех обработанных групп адъювант + Globo H-KLH содержали антитела IgM, которые реагировали с клетками MCF-7, которые варьировали от 5~6 раз по сравнению базовыми значениями перед обработкой. Кроме того, иммунная сыворотка от трех пятых мышей, обработанных 0,6 мкг или 2 мкг Globo H-KLH + адъювант, и две пятых мышей, обработанных 5 мкг Globo H-KLH + адъювант, продемонстрировали антитела IgG, которые могут связываться с клетками MCF-7. Средние связывающие способности увеличились от 1,3 до 2,0 раз по сравнению со значением перед обработкой.
[0216] Вакцинация Globo H-KLH и адъювантом продемонстрировала индукцию как ответов IgG и IgM к Globo Н у самок мышей C57BL/6. Иммунная сыворотка обладала способностью связывания с Globo H-экспрессирующими клетками рака молочной железы MCF-7
[0217] Пример 8: ЖХ-МС/МС анализ сайтов конъюгации Globo Н на KLH
[0218] С применением расщепления несколькими ферментами и ЖХ-МС/МС идентифицировали сайты конъюгации Globo Н в четырех образцах KLH. Четыре образца KLH, конъюгированных с Globo Н, сначала расщепляли четырьмя разными ферментами, а затем анализировали с помощью ЖХ-МС/МС и поиском в базе данных Mascot. Были выявлены два типа производных: производное Globo Н (Globo Н + MMCCH) и производное MMCCH (только MMCCH). Производное Globo Н и его формы с потерей нейтральных частиц учитывали при идентификации сайта конъюгации Globo Н. Формы MMCCH и его дезамидированную форму учитывали при идентификации сайта конъюгации ММССН. Учитывали только пептиды с высоким качеством МС/МС спектра и индексом Mascot. При анализе конъюгации Globo Н наблюдали 31 и 28 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822-13001-DP (образец 1); наблюдали 19 и 21 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822- 13002-DP (образец 2); наблюдали 10 и 11 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822-13003-DP (образец 3); наблюдали 18 и 19 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822-13004-DS (образец 4). При анализе конъюгации ММССН наблюдали 155 и 141 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822-13001-DP (образец 1); наблюдали 143 и 137 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822-13002-DP (образец 2); наблюдали 147 и 143 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822-13003-DP (образец 3); наблюдали 140 и 136 конъюгированных лизинов в двух повторных ЖХ-МС/МС анализах OPT-822-13004-DS (образец 4).
[0219] Пример 8. Материалы и методы:
[0220] В данном разделе используются следующие сокращения: K = лизин; ЖХ-МС/МС = жидкостная хроматография с тандемной масс-спектрометрией; ДТТ = дитиотреитол; IAM = йодацетамид; ACN = ацетонитрил; FA = муравьиная кислота; Glu-C = эндопротеиназа Glu-C; ABC = бикарбонат аммония; RT = комнатная температура; MW = молекулярная масса.
[0221] Четыре образца KLH, образцы 1-4, для замены буфера сначала обрабатывали в 50 мМ буферном растворе бикарбоната аммония на центрифужных фильтрах Amicon Ultra, отсекающих 100 кДа, и проводили денатурирацию 6 М мочевиной. Затем образцы восстанавливали 10 мМ ДТТ при 37°C в течение 1 ч, алкилировали с помощью 50 мМ IAM в течение 30 мин в темноте при комнатной температуре и гасили 50 мМ ДТТ при комнатной температуре в течение в мин. Полученные белки разбавляли до концентрации 1 М мочевины и подвергали расщеплению в растворе несколькими ферментами, как описано в следующем разделе.
[0222] Расщепление в растворе различными ферментами проводили при следующих условиях: (1) расщепление трипсином при 37°C в течение 24 ч (белок: фермент = 40:1) (2) расщепление Glu-C при 37°C в течение 24 ч (белок: фермент = 25:1); (3) расщепление химотрипсином при комнатной температуре в течение 24 ч (белок: фермент = 25:1); (4) расщепление термолизином при 37°C в течение 24 ч (белок: фермент = 25:1).
[0223] Реакции расщепления останавливали путем добавления муравьиной кислоты и все четыре расщепленные образца подвергали ЖХ-МС/МС анализу.
[0224] Образцы анализировали при помощи масс-спектрометра Q Exactive (Thermo Scientific) в сочетании с системой Ultimate 3000 RSLC (Dionex). Разделение посредством жидкостной хроматографии проводили с применением колонки C 18 (Acclaim PepMap RSLC, 75 мкм × 150 мм, 2 мкм,  ) с градиентом, как показано ниже:
) с градиентом, как показано ниже:
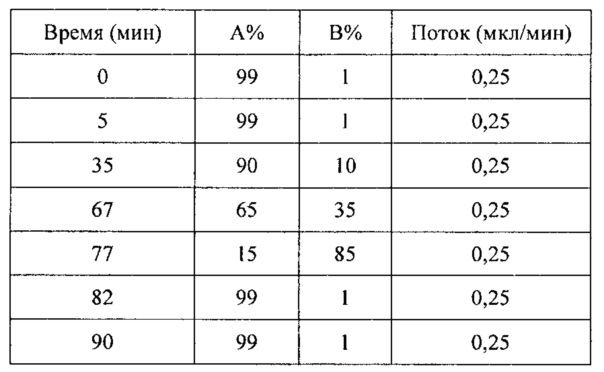
Подвижная фаза A: 5% ацетонитрил/0,1% муравьиная кислота
Подвижная фаза B: 95% ацетонитрил/0,1% муравьиная кислота
[0225] Источник СИД устанавливали на 45 эВ. Полное МС сканирование проводили в диапазоне m/z 350-2000, и десять наиболее интенсивных ионов из МС сканирования подвергали фрагментации для МС/МС спектров. Исходные данные преобразовывали в списки пиков при помощи Proteome Discoverer 1.4 для поиска в базе данных Mascot.
[0226] Поиск в базе данных проводили в Mascot версии 2.4.1 и Thermo Proteome Discoverer версии 1.4 относительно KLH1 и KLH2 [KLH1, EMBL номер доступа CAG28307.1; KLH2, EMBL номер доступа CAG28308.1. Использовали следующие параметры: ферменты: трипсин, Glu-C, химотрипсин и термолизин в соответствии с методом расщепления; фиксированная модификация: карбамидометил (С).
[0227] Изменяемые модификации для производных ММССН (только ММССН): дезамидирование (NQ), окисление (М), dK_MMCCH-1 (K), dK_MMCCH-2 (K).
[0228] Изменяемые модификации для производных Globo Н (Globo Н+ММССН): дезамидирование (NQ), окисление (М), Globo_H_MMCCH (К), dK_MMCCH_NL997 (К), dK_MMCCH_NL835 (К), dK_MMCCH_NL673 (К), dK_MMCCH_NL511 (К), dK_MMCCH_NL308 (К), дезамидирование (NQ), окисление (М), допустимое отклонение массы пептида:±10 ppm; допустимое отклонение массы фрагмента: ±0,05 Да; максимальное число пропущенных расщеплений: 5; тип прибора: ESI-TRAP; минимально допустимое число ионов:13.
[0229] "dK_MMCCH-1" в параметрах поиска указывает на MMCCH-конъюгированный лизин с добавочной молекулярной массой 352,1569 Да.
[0230] "dK_MMCCH-2" в параметрах поиска указывает на дезамидированную форму MMCCH-конъюгированного лизина с добавочной молекулярной массой 338,1300 Да.
[0231] "Globo_H_MMCCH (K)" в параметрах поиска указывает на Globo H-конъюгированный лизин с добавочной молекулярной массой 1393,5317 Да.
[0232] "dK_MMCCH_NL997" в параметрах поиска указывает на форму с потерей нейтральных частиц Globo H-конъюгированного лизина с добавочной молекулярной массой 396,1831 Да.
[0233] "dK_MMCCH_NL835" в параметрах поиска указывает на форму с потерей нейтральных частиц Globo H-конъюгированного лизина с добавочной молекулярной массой 558,2360 Да.
[0234] "dK_MMCCH_NL673" в параметрах поиска указывает на форму с потерей нейтральных частиц Globo H-конъюгированного лизина с добавочной молекулярной массой 720,2888 Да.
[0235] "dK_MMCCH_NL511" в параметрах поиска указывает на форму с потерей нейтральных частиц Globo H-конъюгированного лизина с добавочной молекулярной массой 882,3416 Да.
[0236] "dK_MMCCH_NL308" в параметрах поиска указывает на форму с потерей нейтральных частиц Globo H-конъюгированного лизина с добавочной молекулярной массой 1085,4210 Да.
[0237] "Добавочная молекулярная масса" означает дополнительную молекулярную массу по сравнению с интактным остатком лизина.
[0238] Пример 8: Результаты
[0239] Методы на основе ЖХ-МС/МС являются средствами для идентификации белков и определения модификации аминокислот. Подробную информацию о пептидных последовательностях и сайтах модификации можно получить путем интерпретации ионов фрагментов, полученных из МС/МС спектров. Mascot представляет собой поисковую систему и хорошо принимается его вероятностный алгоритм оценивания. В данном исследовании индекс Mascot был принят в качестве эталона степени достоверности для секвенирования белков и идентификации сайта конъюгации Globo Н или ММССН. Для глубокого анализа распределения сайтов конъюгации Globo Н или ММССН в образцах 1-4, данные образцы расщепляли с несколькими ферментами с последующим ЖХ-МС/МС анализом.
[0240] Предполагаемая химическая структура для производного Globo Н (Globo Н+ММССН) показана на фигуре 33A, и среди результатов можно наблюдать соответствующую добавочную молекулярную массу 1393,53 Да на лизин-содержащих пептидах. К тому же, лабильные полисахариды имеют тенденцию отваливаться через потерю нейтральных частиц во время ионизации электрораспылением в ЖХ-МС анализе. Таким образом, добавочную молекулярную массу 396,18 Да, 558,24 Да, 720,29 Да, 882,34 Да и 1085,42 Да, возникшую в результате потерю нейтральных частиц, также можно наблюдать для гликоконъюгированных пептидов, как показано на фигуре 33B. Были рассмотрены все производные формы для идентификации сайтов конъюгации Globo Н.
[0241] В дополнение к этому, производное ММССН также наблюдали (только ММССН) в данных Globo H-конъюгированных KLH образцах. Предполагаемая химическая структура для производного ММССН и его дезамидированной формы показана на фигуре 34А и 34B, и среди результатов можно наблюдать соответствующую добавочную молекулярную массу 352,16 Да и 338,13 Да соответственно на лизин-содержащих пептидах. Были рассмотрены обе производные формы для идентификации сайтов конъюгации ММССН. Превращение производного Globo Н в ММССН не ясно, но это предположительно происходит в процессе обработки образца.
[0242] Массу с точностью ±10 ppm для предшественника иона и ±0,05 Да для иона фрагмента использовали в качестве критериев для идентификации белков и интерпретации спектров. Производное Globo Н, а также его форму с потерей нейтральных частиц, выбрали в качестве изменяемой модификации для идентификации сайта конъюгации Globo Н, и производное ММССН, а также его дезамидированную форму, выбрали в качестве изменяемой модификации для идентификации сайта конъюгации ММССН. Поиск по базе данных выполняли относительно последовательности KLH1 и KLH2, предоставленных заказчиком. В отчет были включены только пептиды с высоким качеством МС/МС спектра (число ионов ≥13, p<0,05).
[0243] Для демонстрации воспроизводимости результата дважды проводили ЖХ-МС/МС анализ с последующим индивидуальным поиском в базе данных Mascot для идентификации обоих сайтов конъюгации Globo Н и ММССН, как представлено на фигуре 17.
[0244] При анализе сайта конъюгации Globo Н, были найдены 31 и 28 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 1; были найдены 19 и 21 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 2; были найдены 10 и 11 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 3; были найдены 18 и 19 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 4. Идентификационные данные приведены на фигурах 14-21. В MMCCH-анализе конъюгации, были найдены 155 и 141 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 1; были найдены 143 и 137 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 2; были найдены 147 и 143 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 3; были найдены 140 и 136 лизинов соответственно в 1-м ЖХ-МС/МС и 2-м ЖХ-МС/МС для образца 4. Идентификационные данные приведены на фигурах 22-29.
[0245] Сайты конъюгации Globo Н из экспериментов с несколькими ферментами приведены на фигуре 30 и сайты конъюгации ММССН приведены на фигуре 31. Итоговые результаты анализа сайтов конъюгации для Globo H-конъюгированных образцов приведены на фигуре 32.
[0246] Пример 8. Выводы:
[0247] Масс-спектрометрические сигналы производного Globo H-конъюгированных пептидов были ниже, чем у MMCCH-конъюгированных пептидов из-за форм с множественной с потерей нейтральных частиц и низкой эффективности ионизации полисахарида, которые усложняют непосредственную идентификацию Globo Н-конъюгации. Именно поэтому число идентифицированных пептидов выше при анализе MMCCH-конъюгации. Таким образом, результаты ММССН можно использовать для отображения Globo Н-конъюгации.
[0248] Анализ сайтов конъюгации свидетельствует о существовании 155, 143, 147 и 140 лизиновых сайтов конъюгации идентифицированы среди суммарного числа 306 остатков лизина в KLH1/KLH2 для образцов 1-4, соответственно. При повторном анализе идентифицированы 141, 137, 143 и 136 сайтов конъюгации для образцов 1-4, соответственно.
[0249] Если не указано иное, все технические и научные термины и любые сокращения, применяемые в настоящем документе, имеют те же значения, которые обычно понятны специалисту в данной области техники в области настоящего изобретения. Хотя любые композиции, способы, наборы и средства для передачи информации, подобные или эквивалентные описанным в настоящем документе, можно использовать для реализации настоящего изобретения, предпочтительные композиции, способы, наборы и средства для передачи информации описаны в настоящем документе.
[0250] Все ссылки, приведенные в настоящем документе, включены в документ в качестве ссылки в полном объеме, установленном законом. Обсуждение данных ссылок предназначено только для обобщения утверждений, сделанных их авторами. Нет допущений, что любая ссылка (или часть какой-либо ссылки) является предшествующим уровнем техники. Заявители оставляют за собой право оспорить точность и актуальность любой цитируемой ссылки.

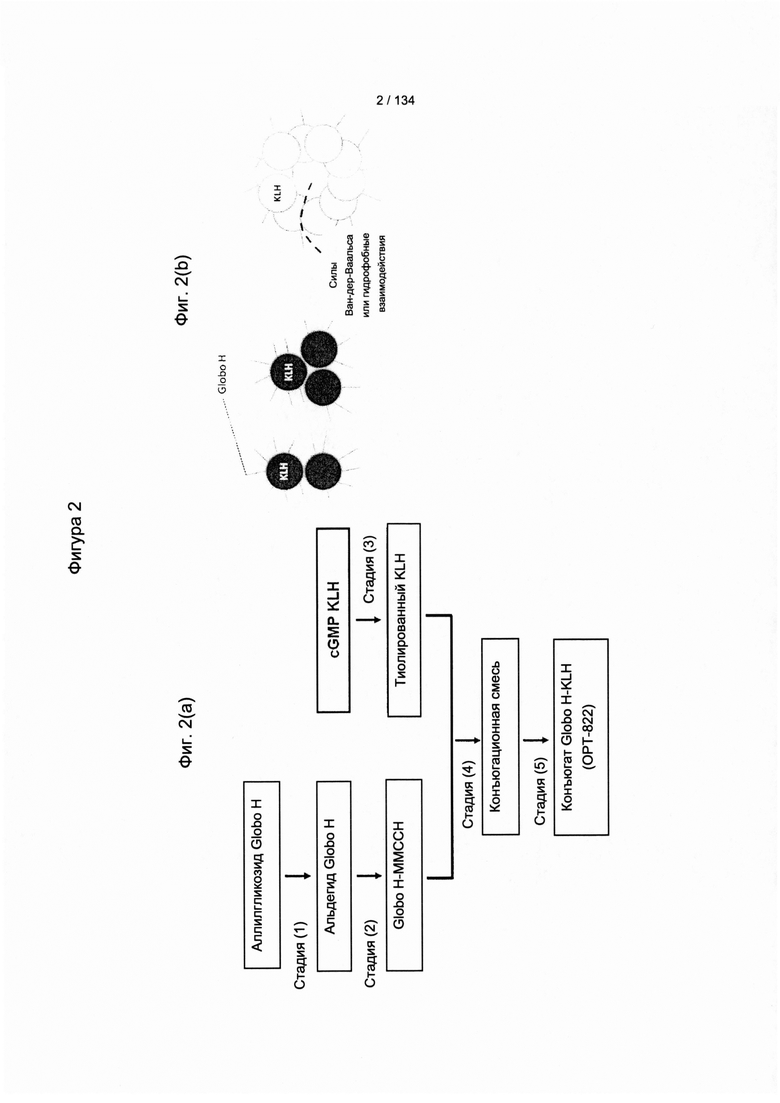
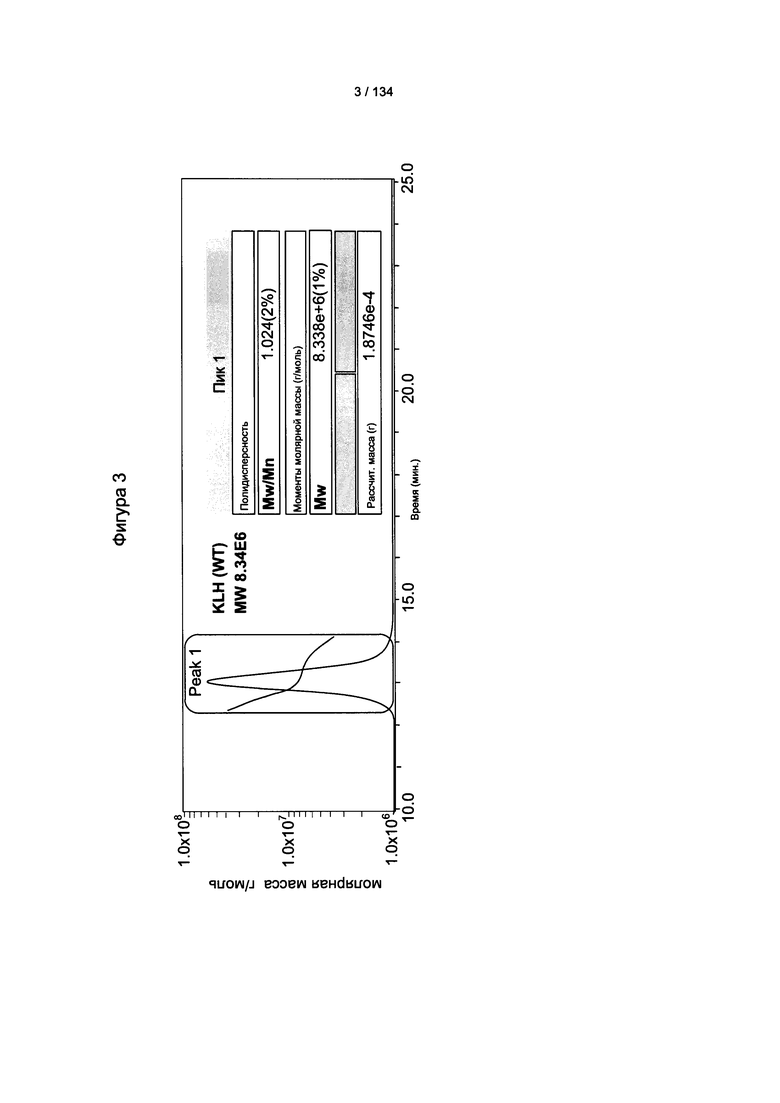
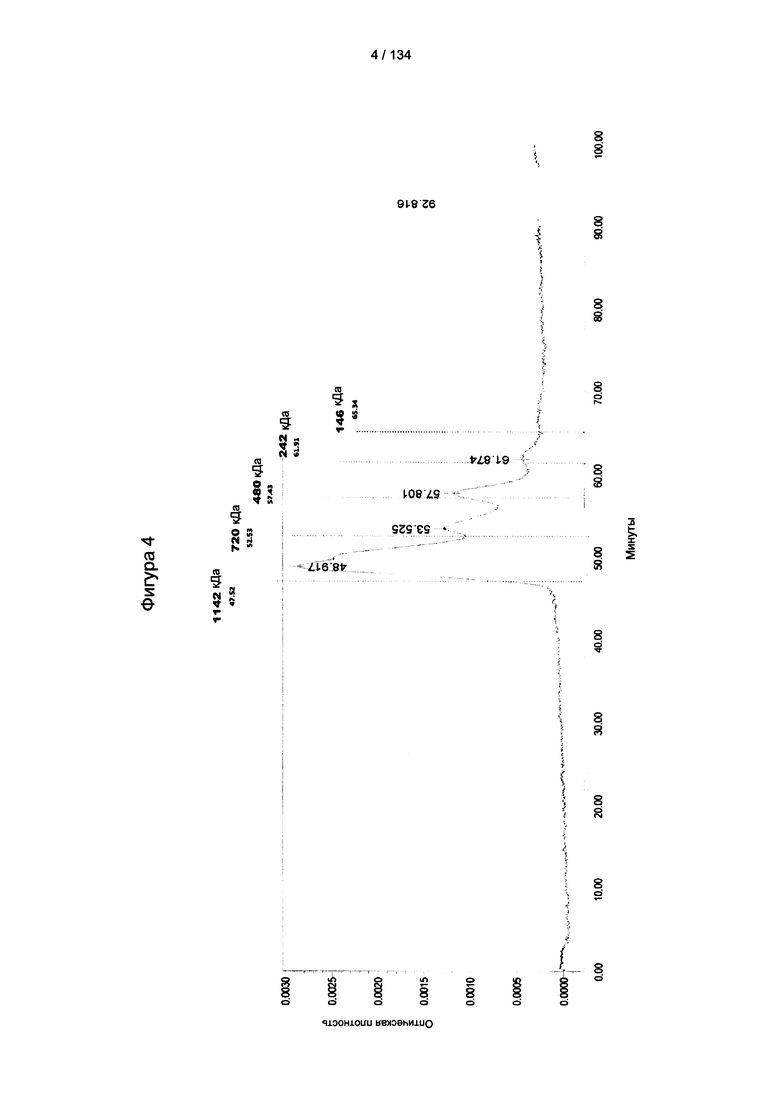
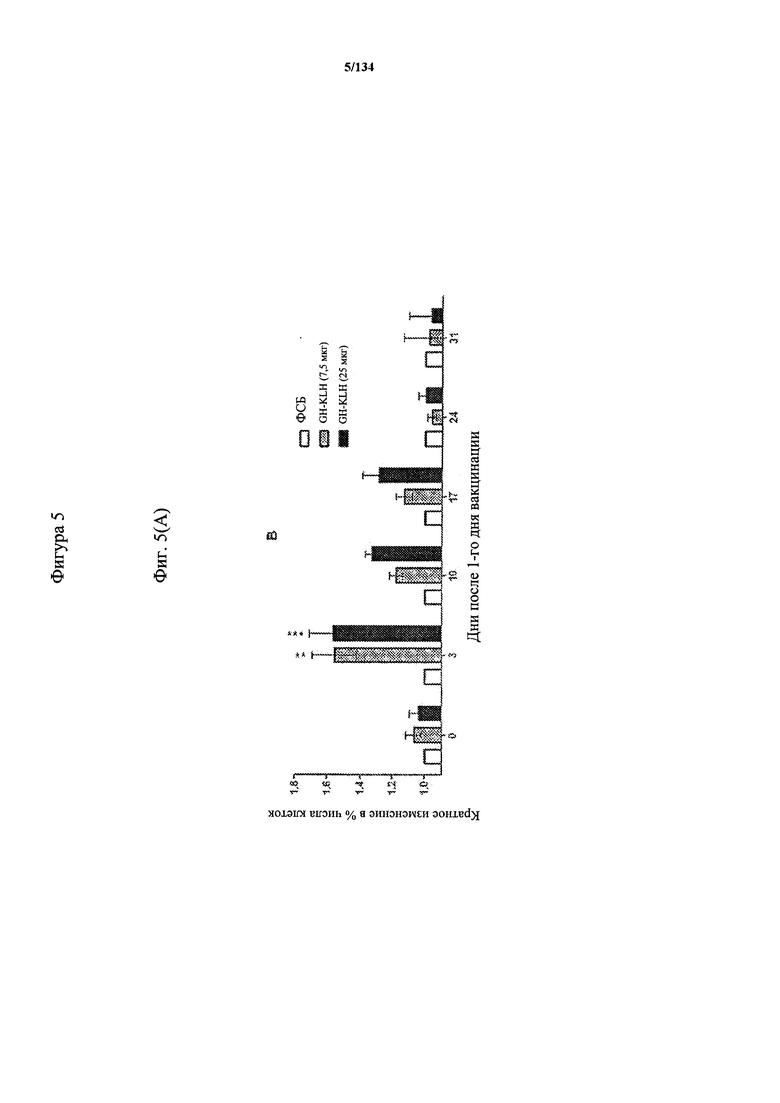

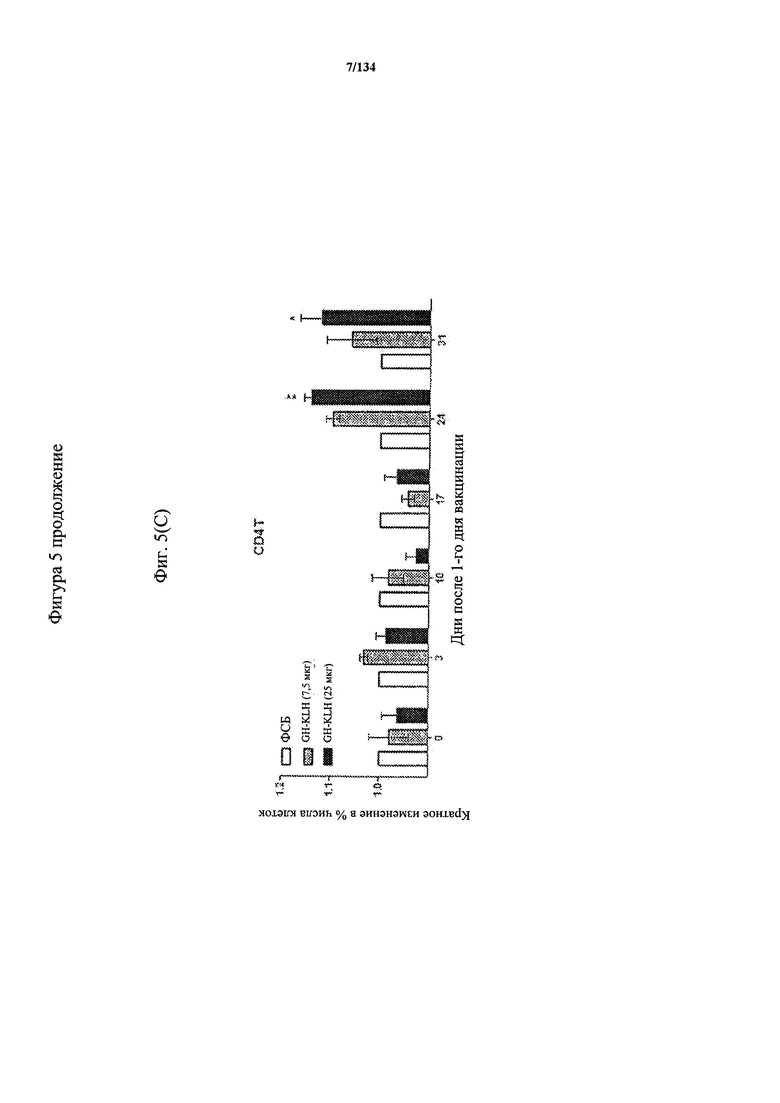
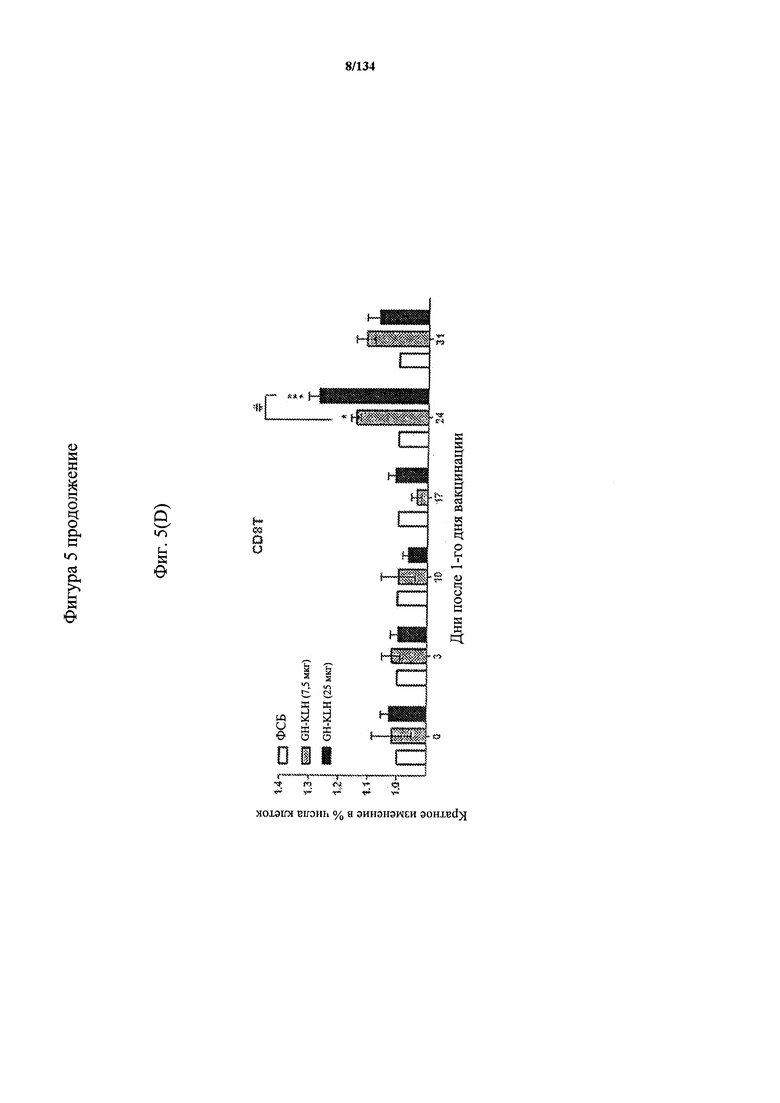
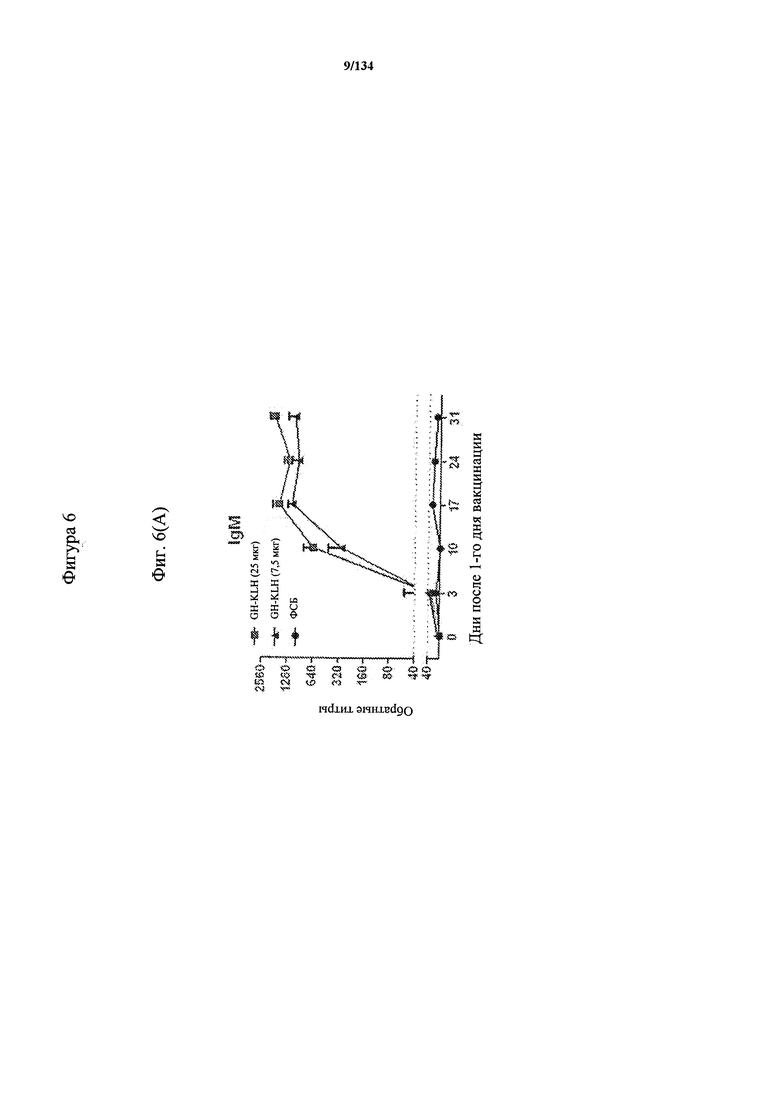
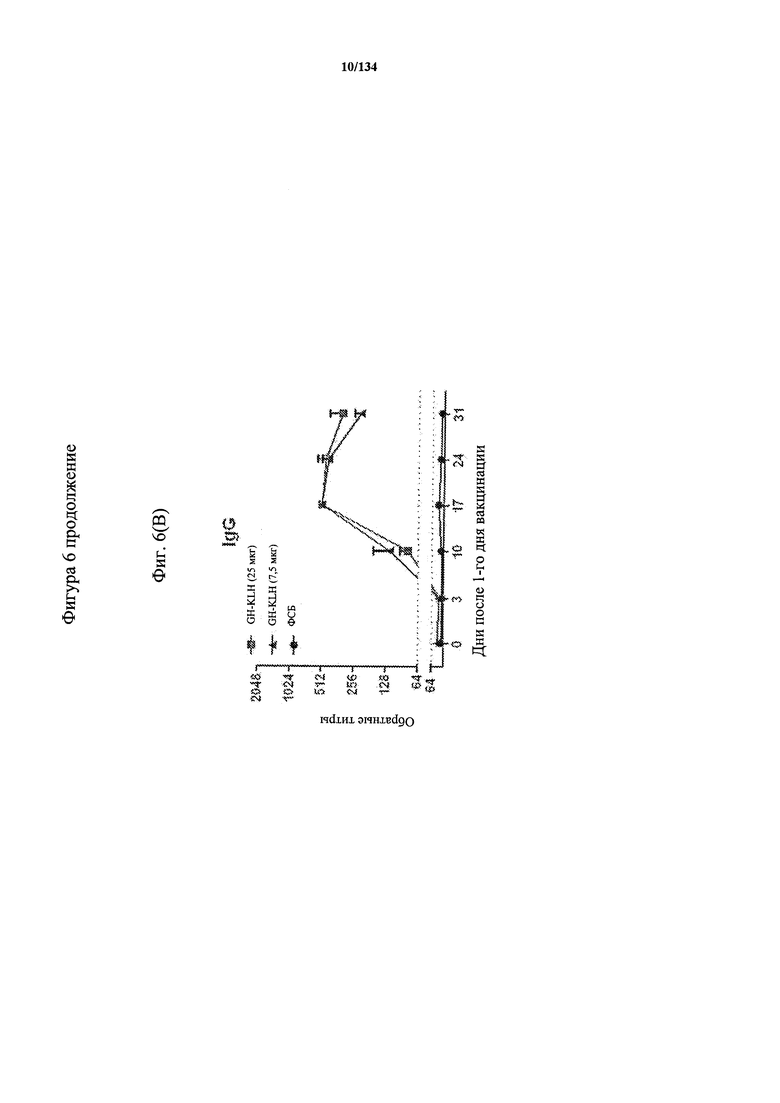
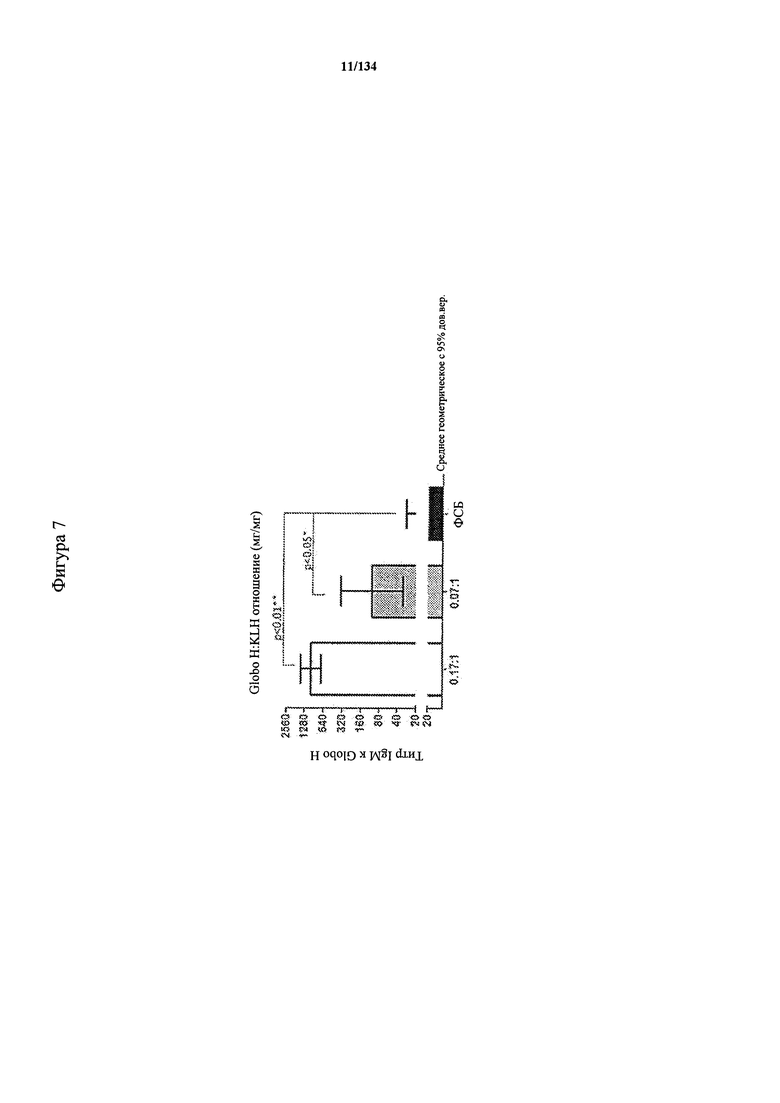
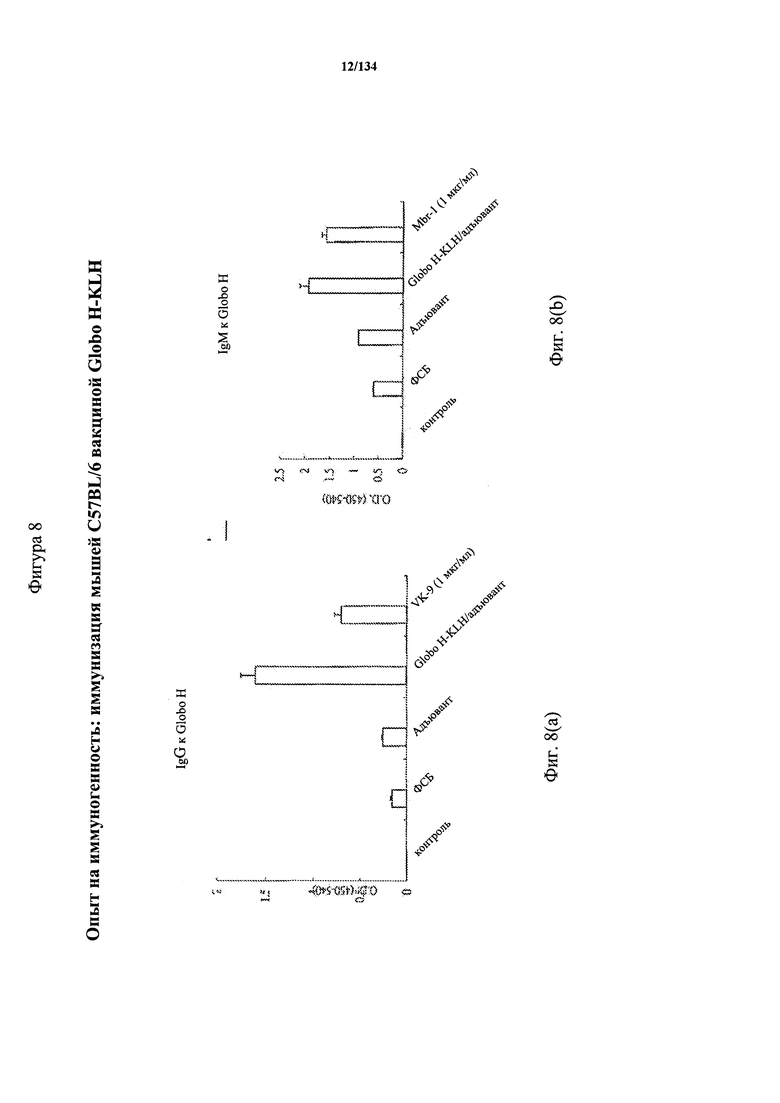
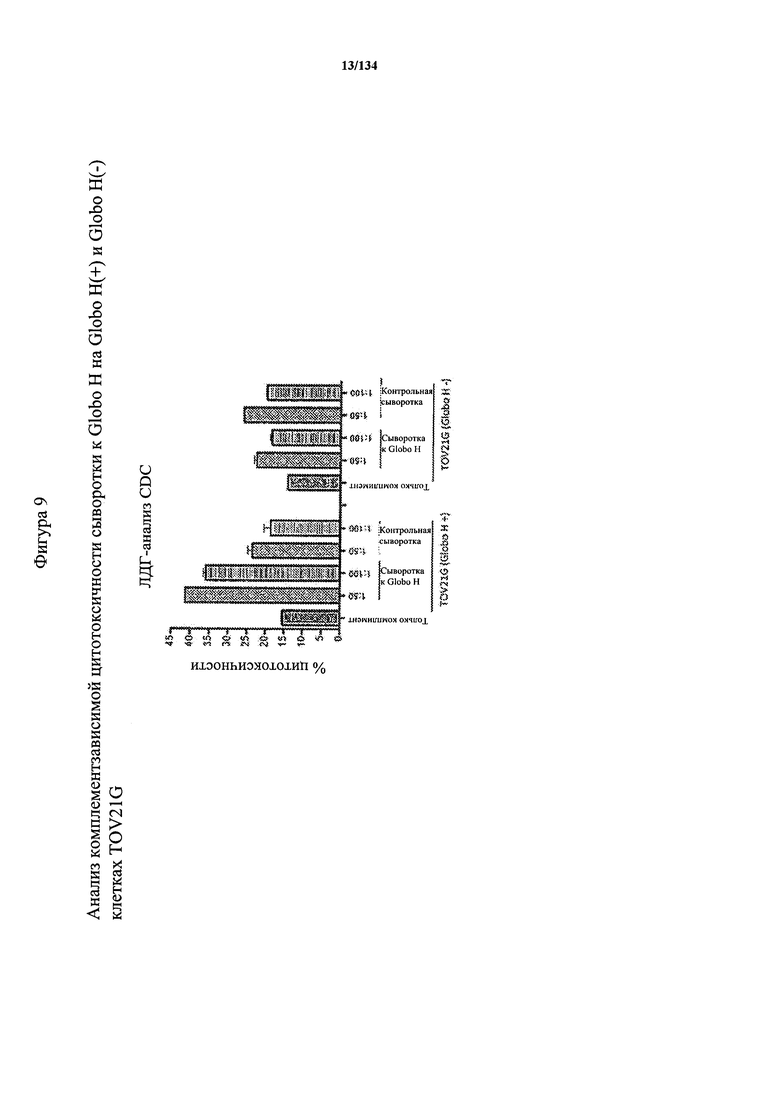
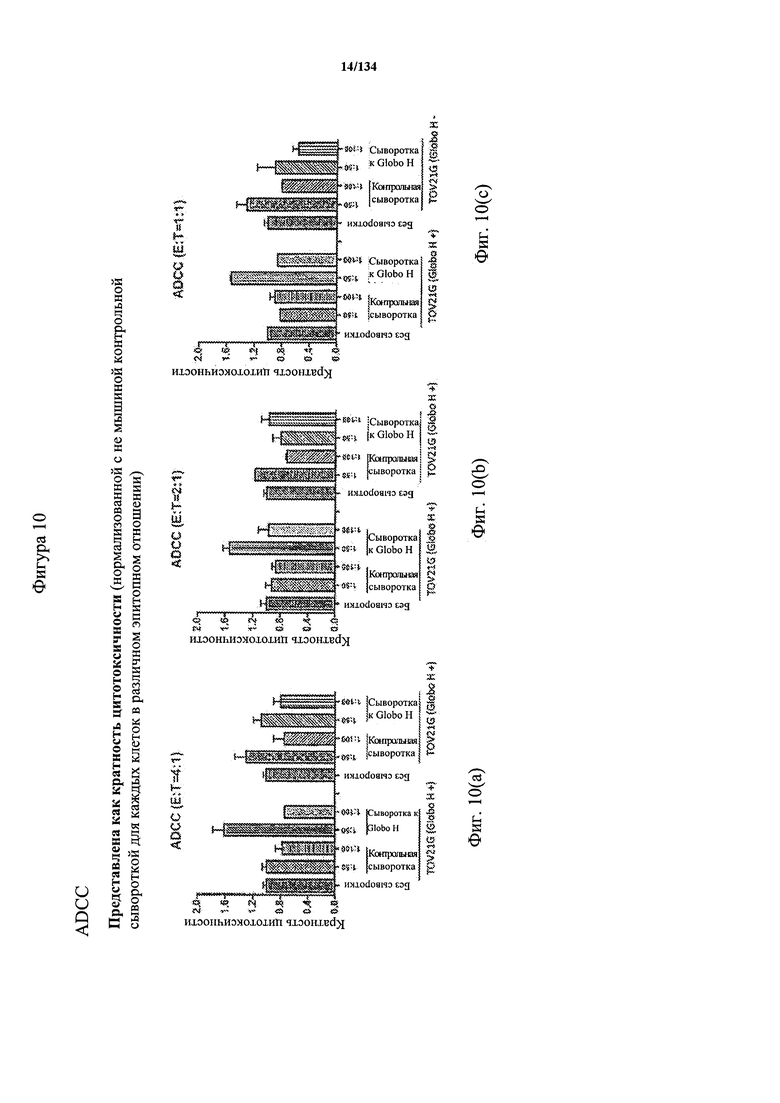

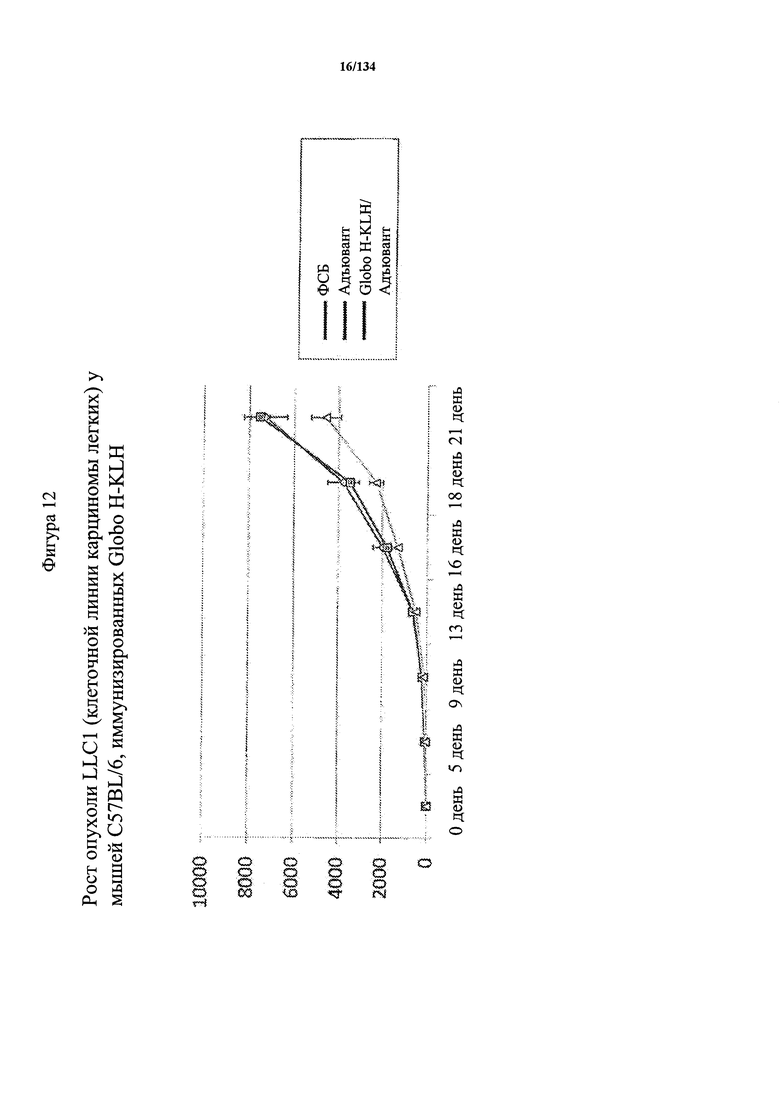
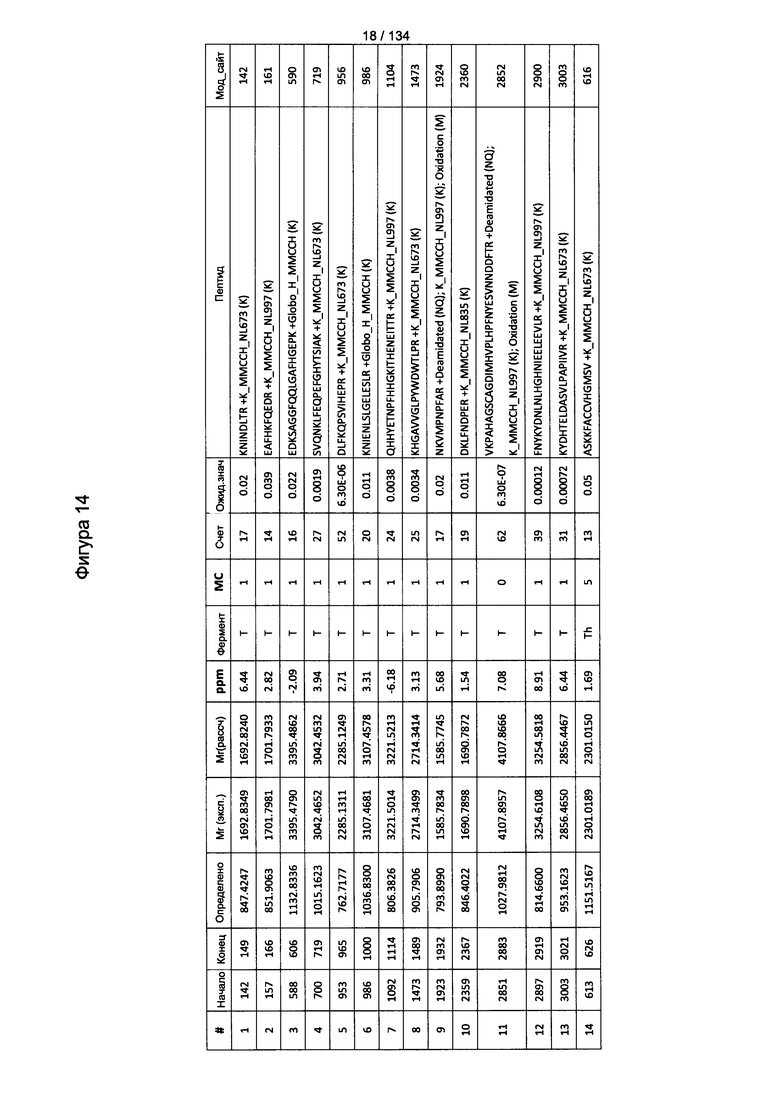
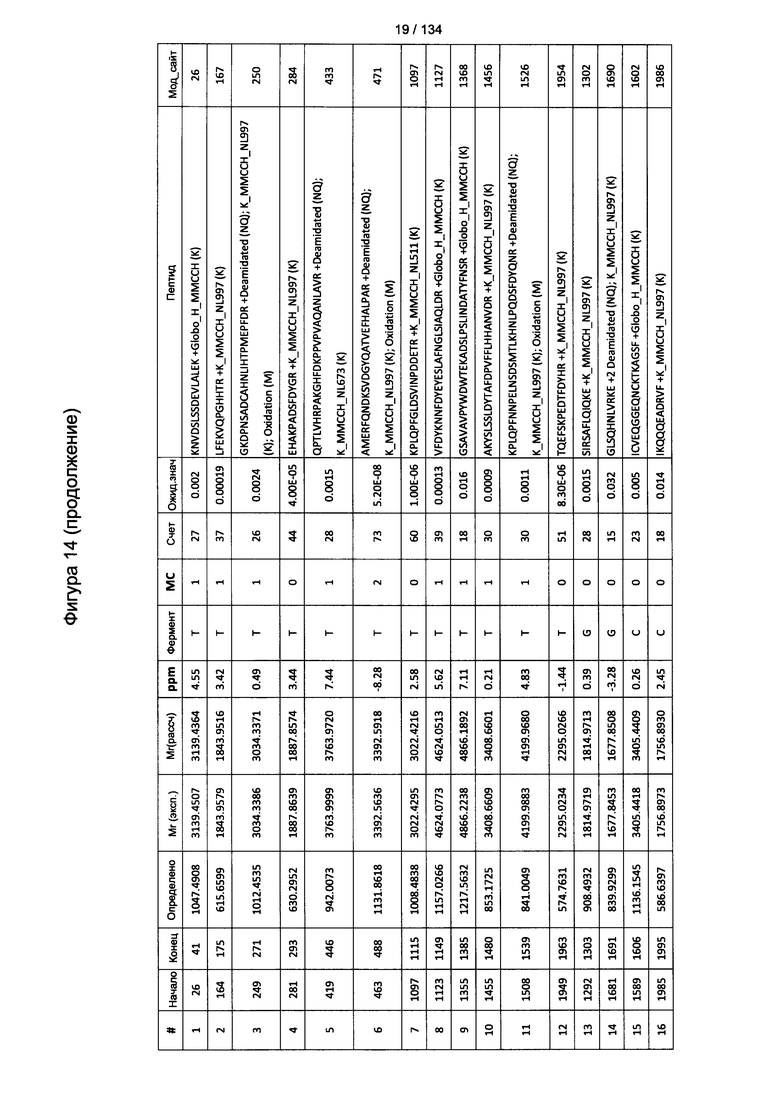

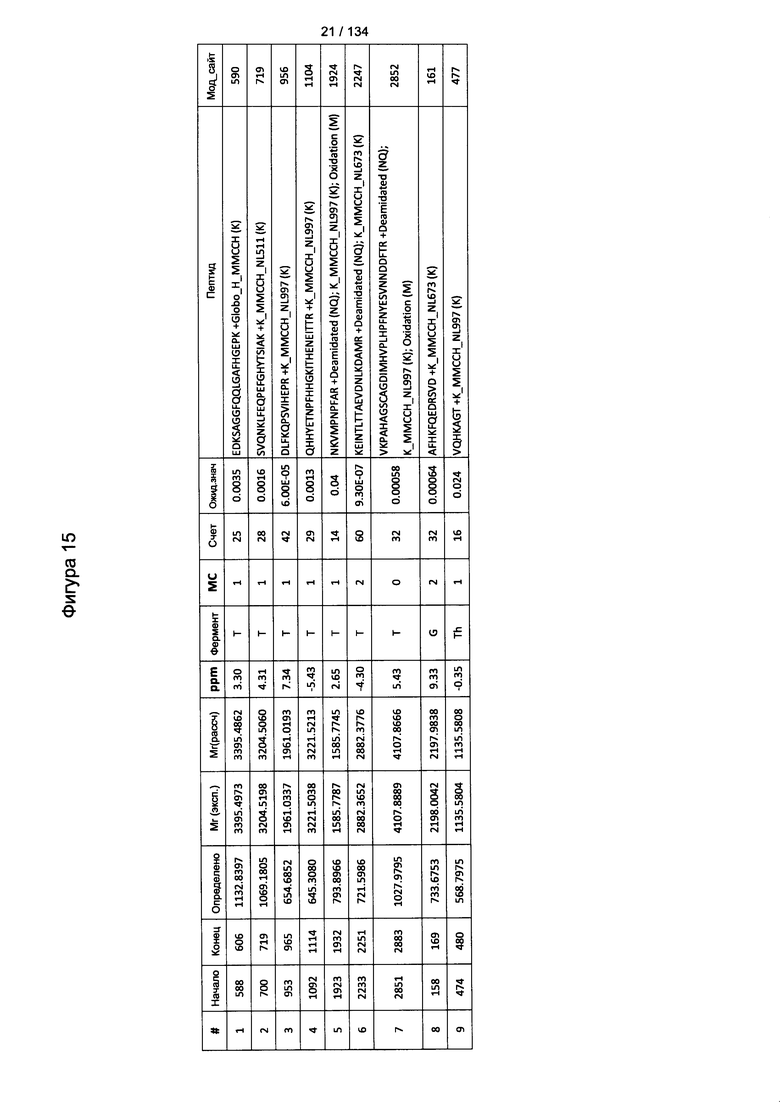
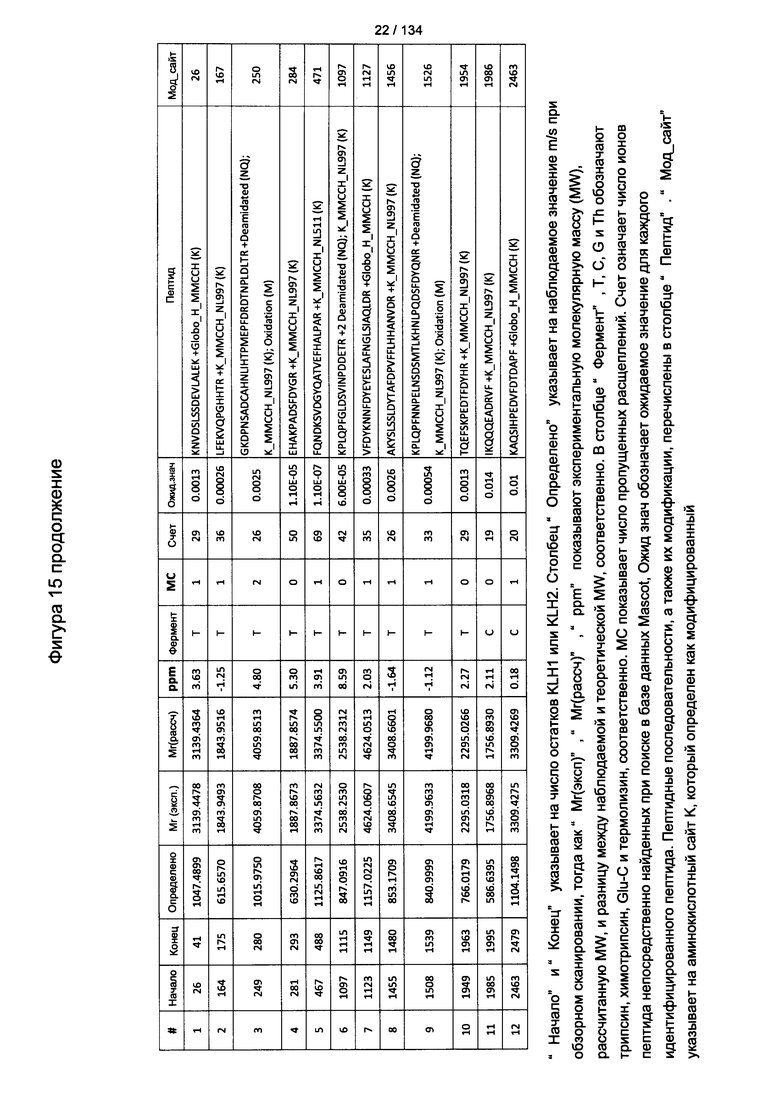

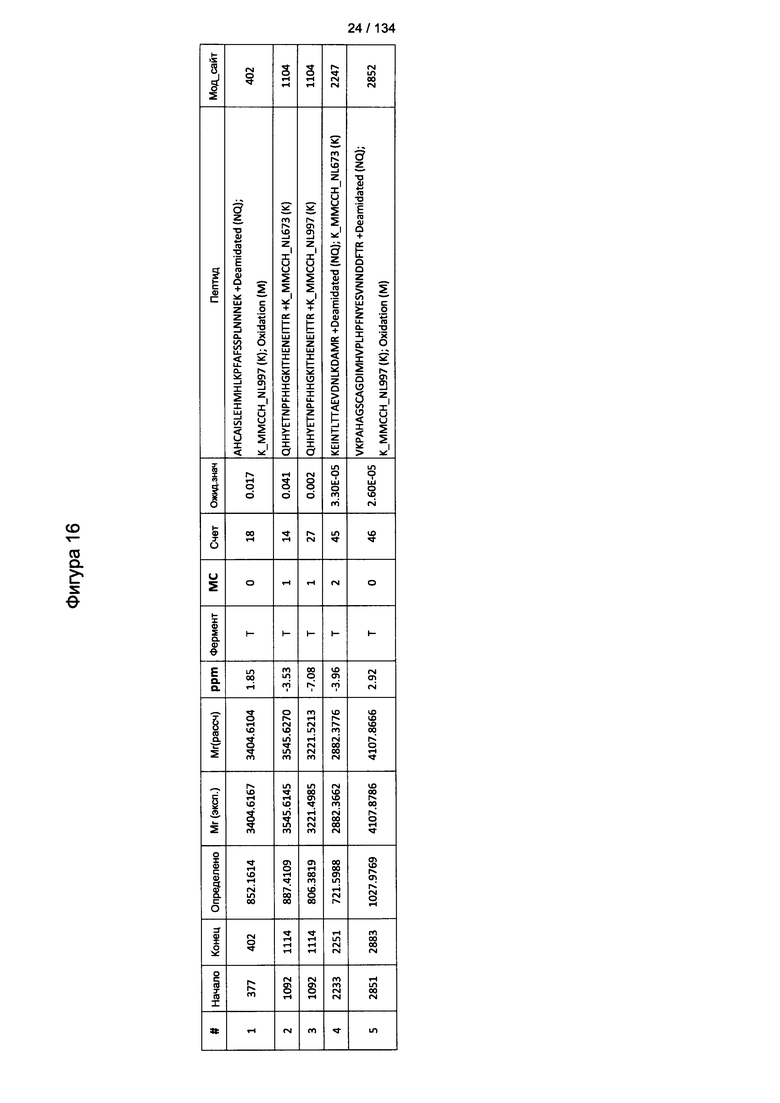
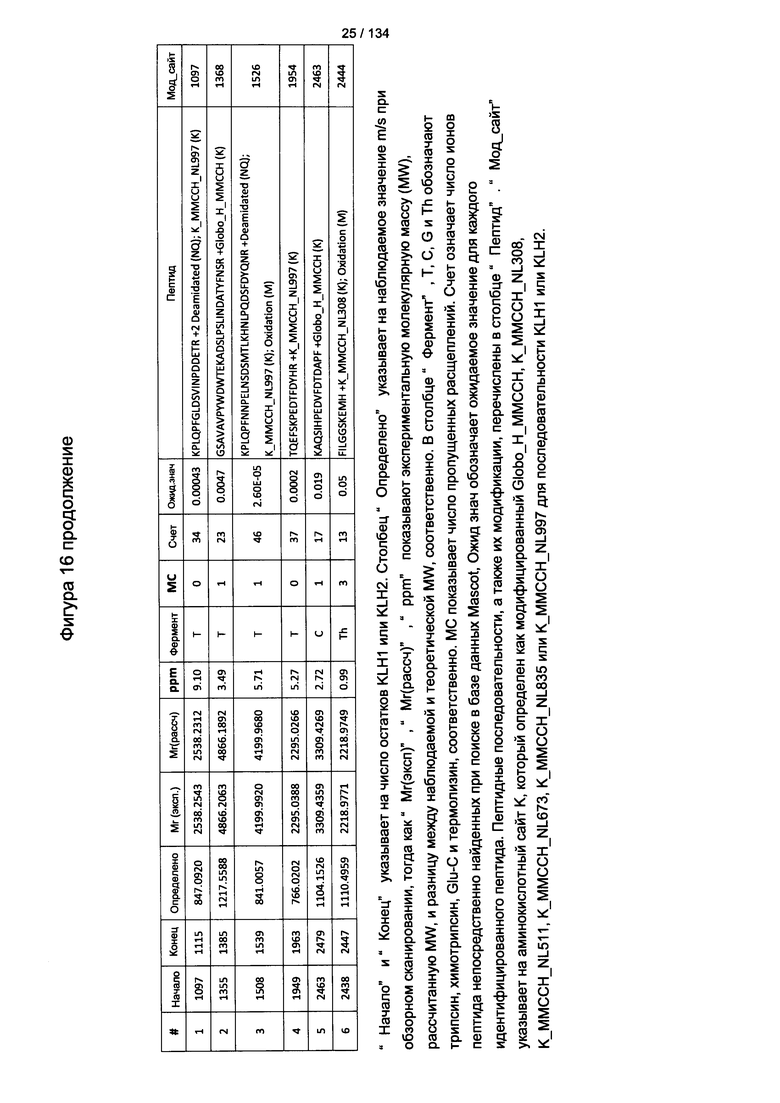
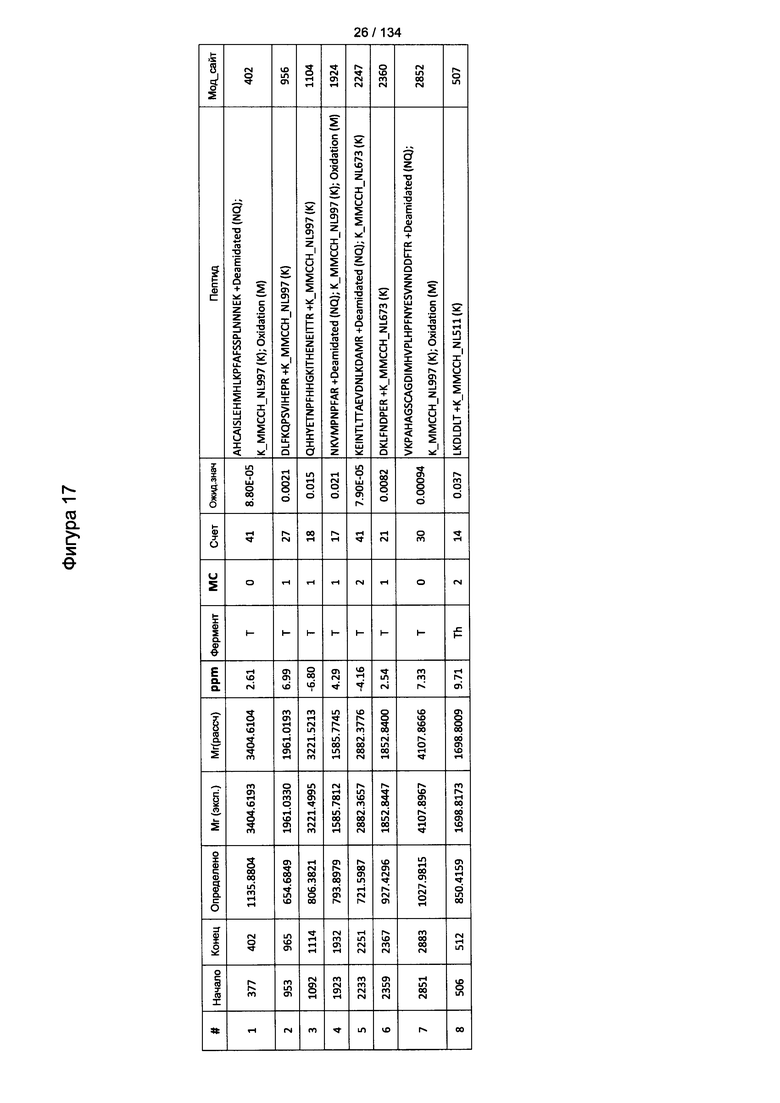
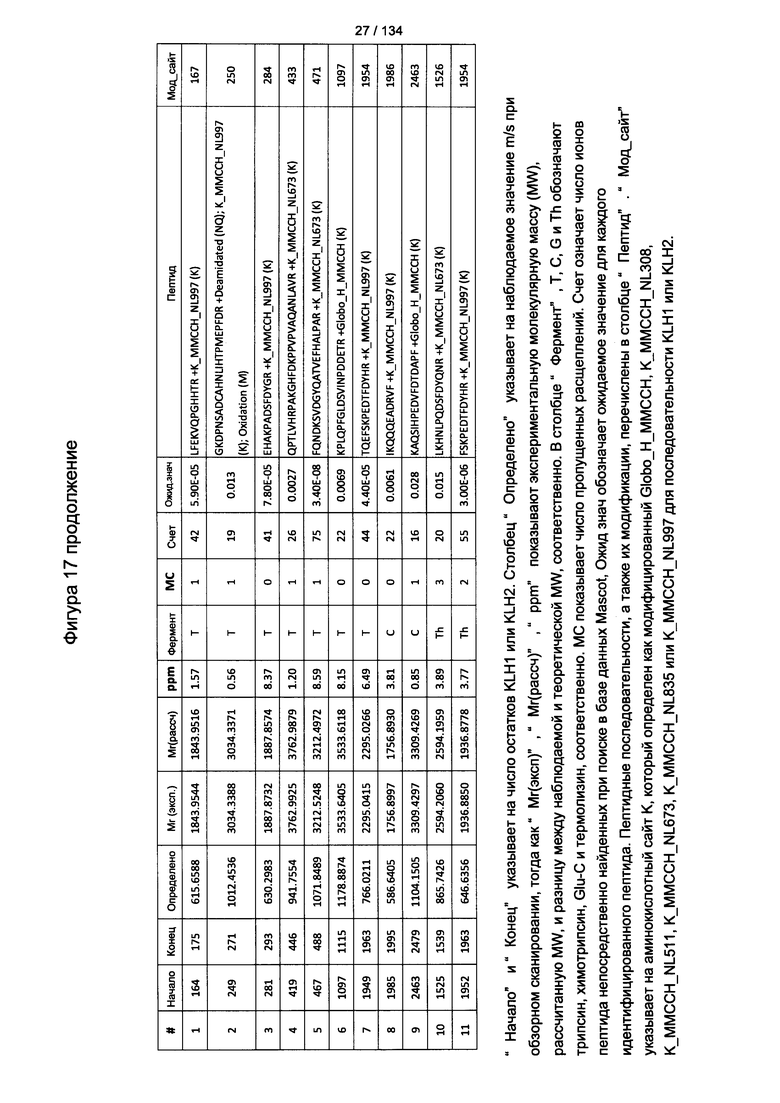
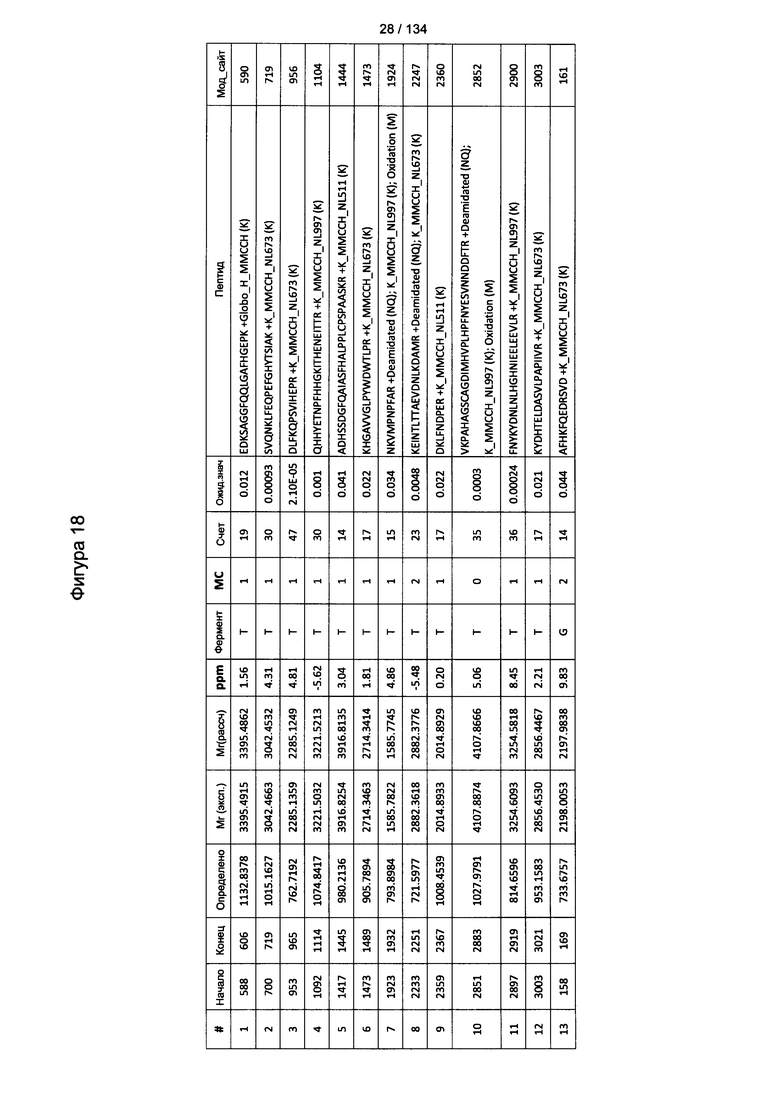
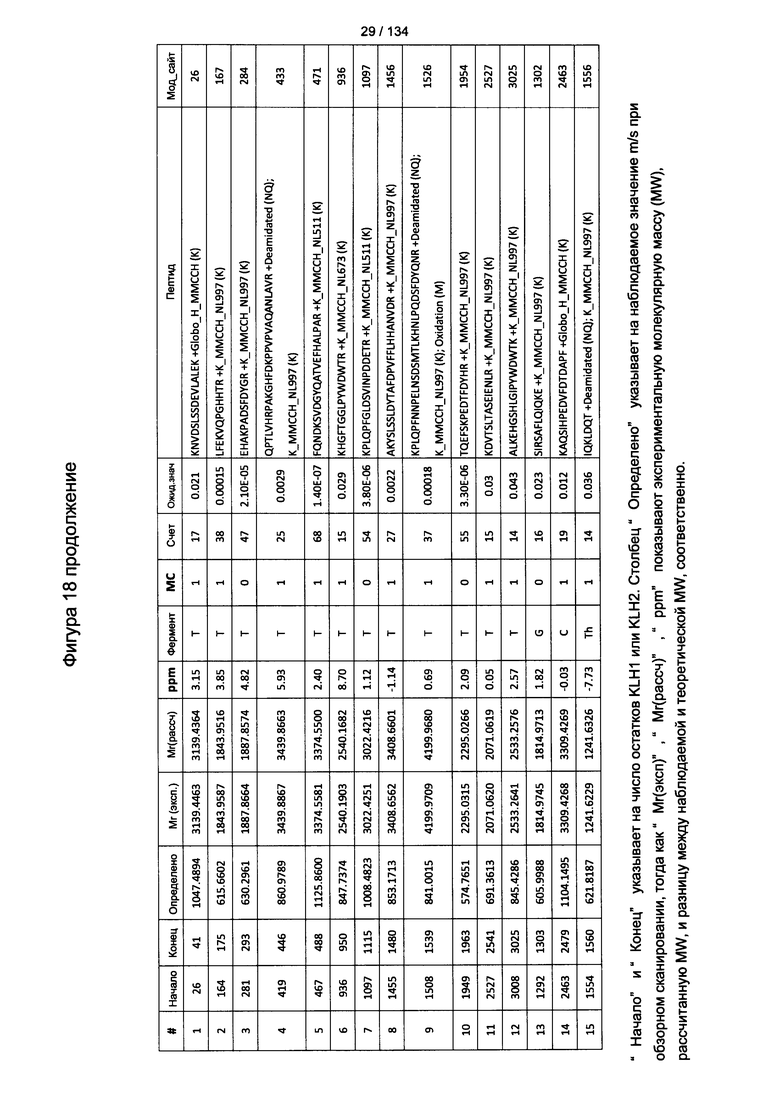

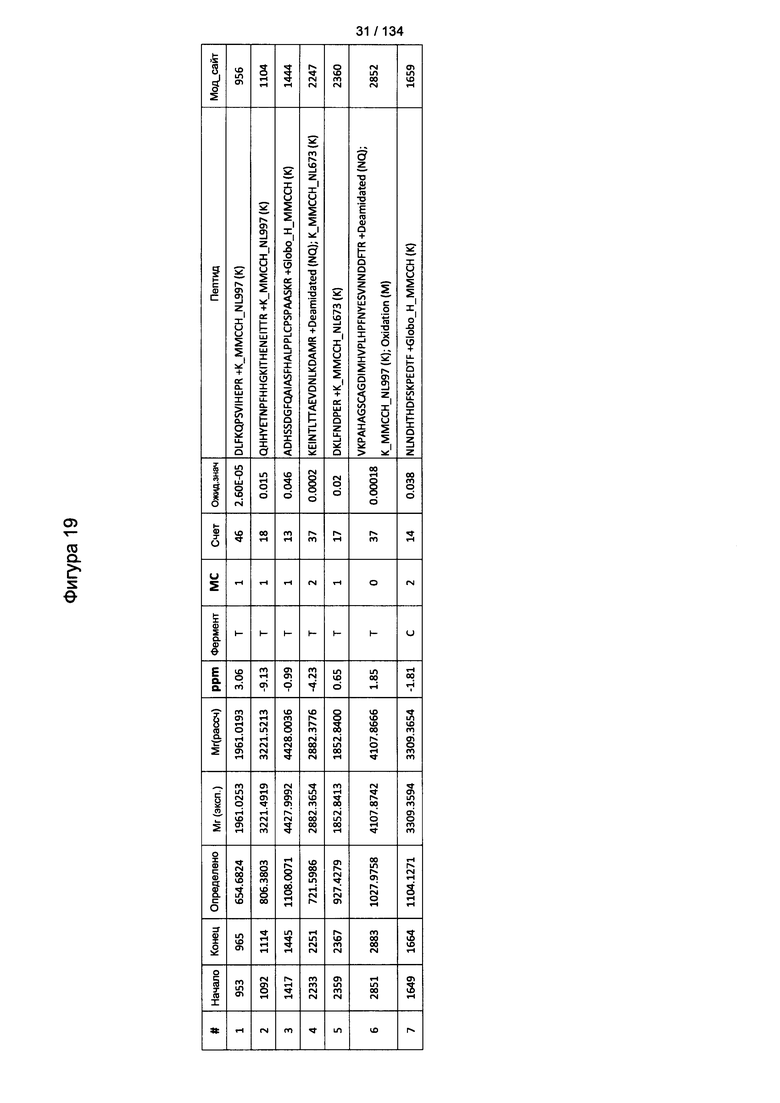
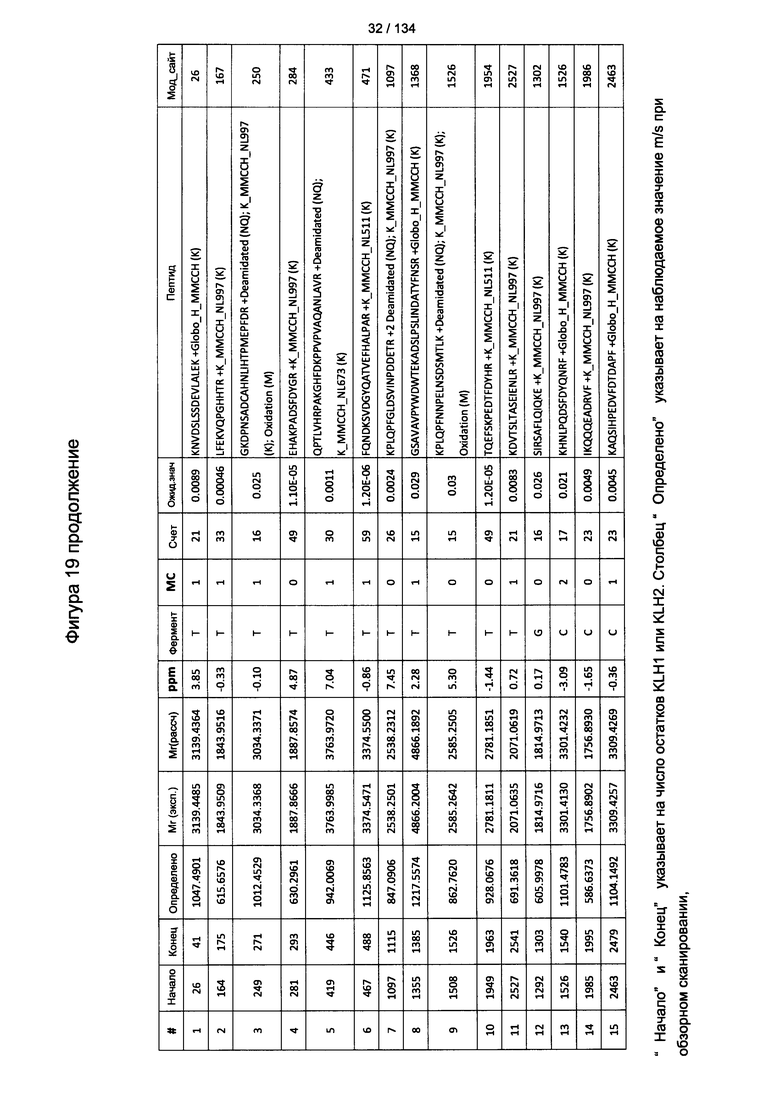

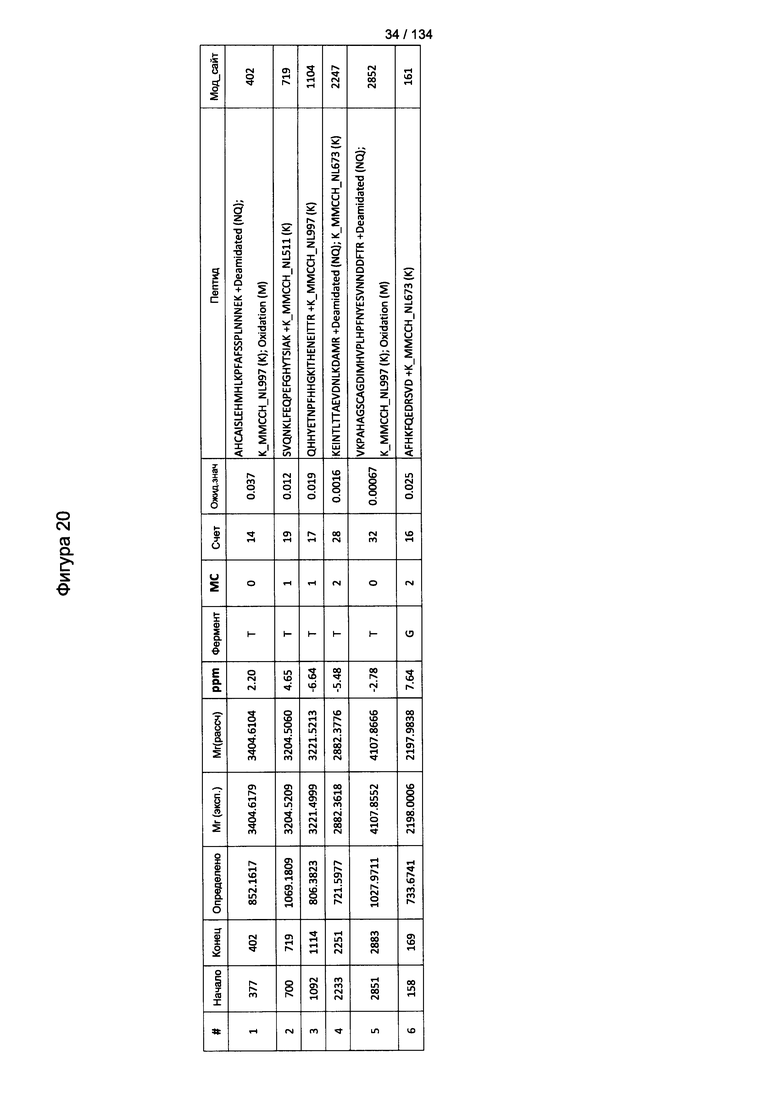
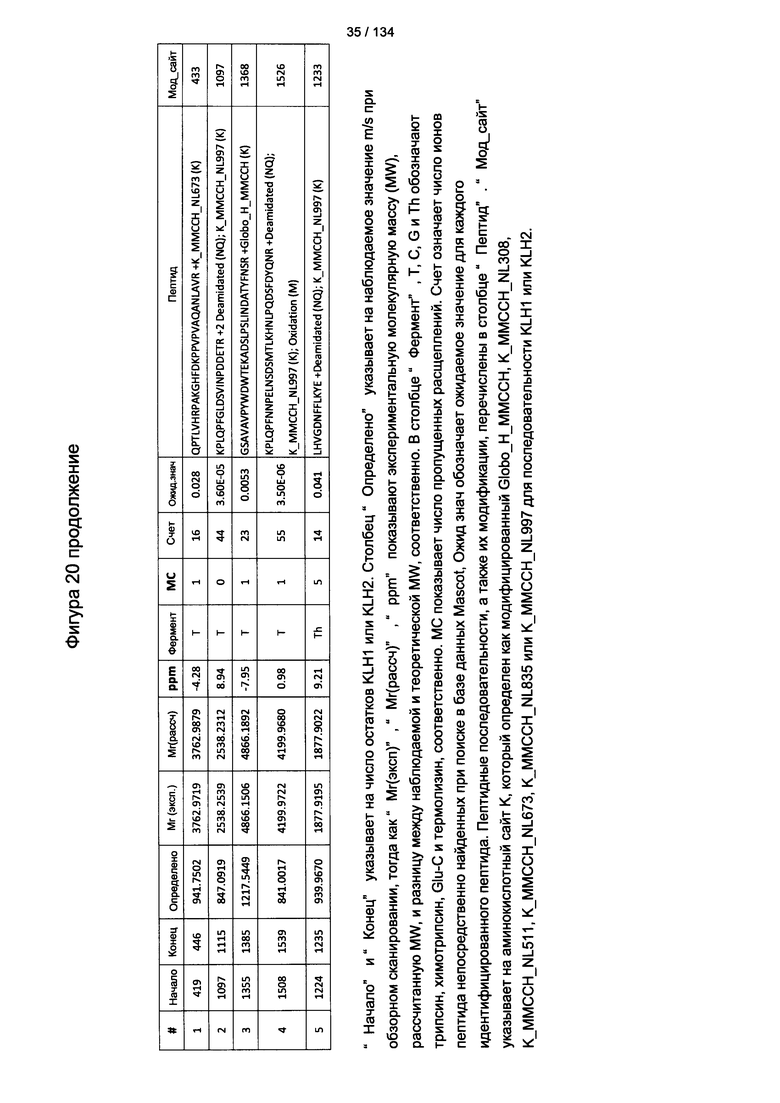
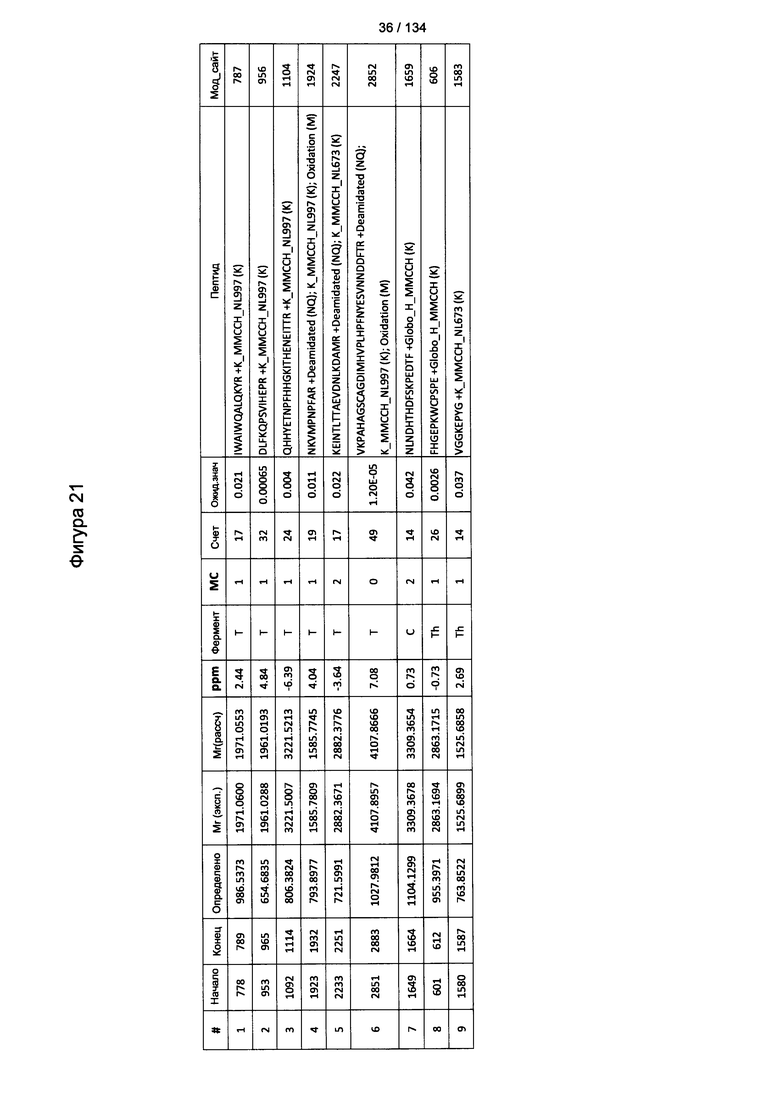
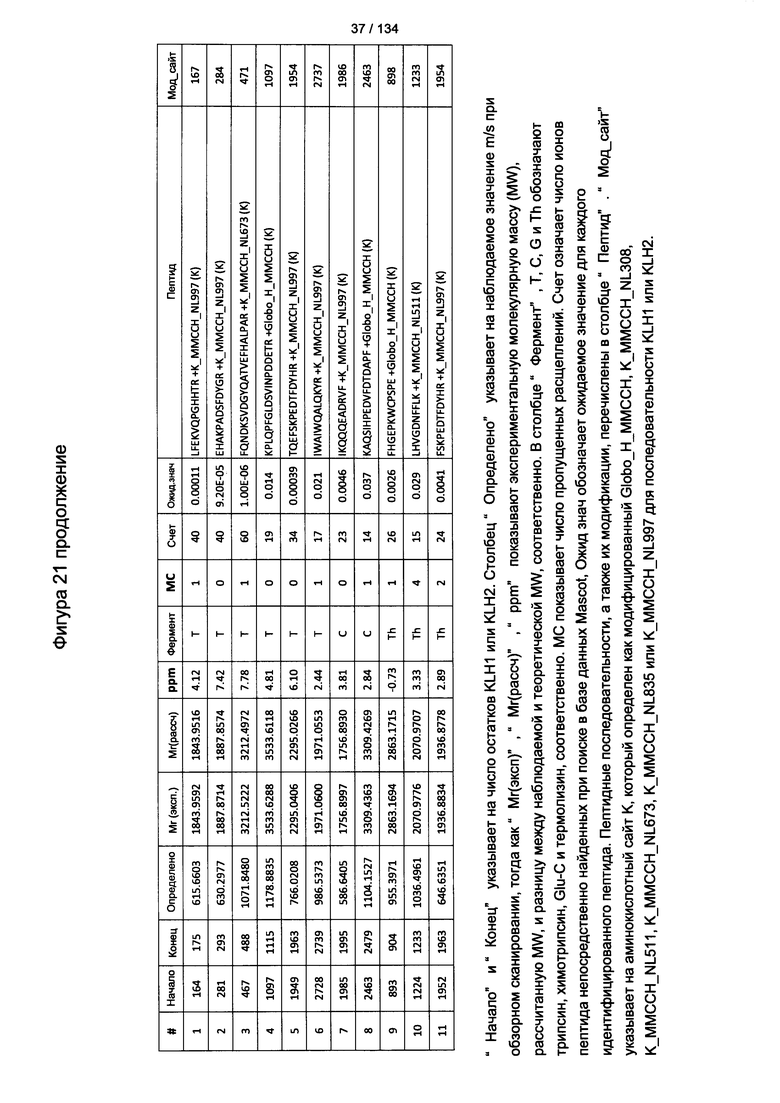
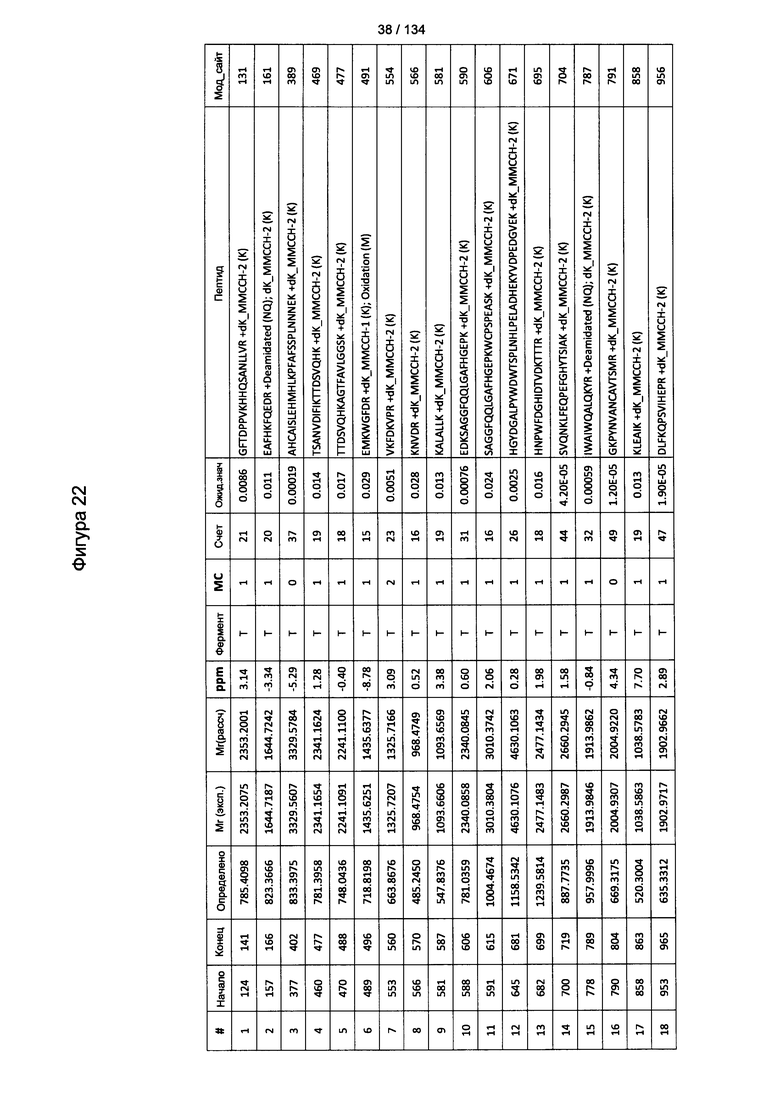
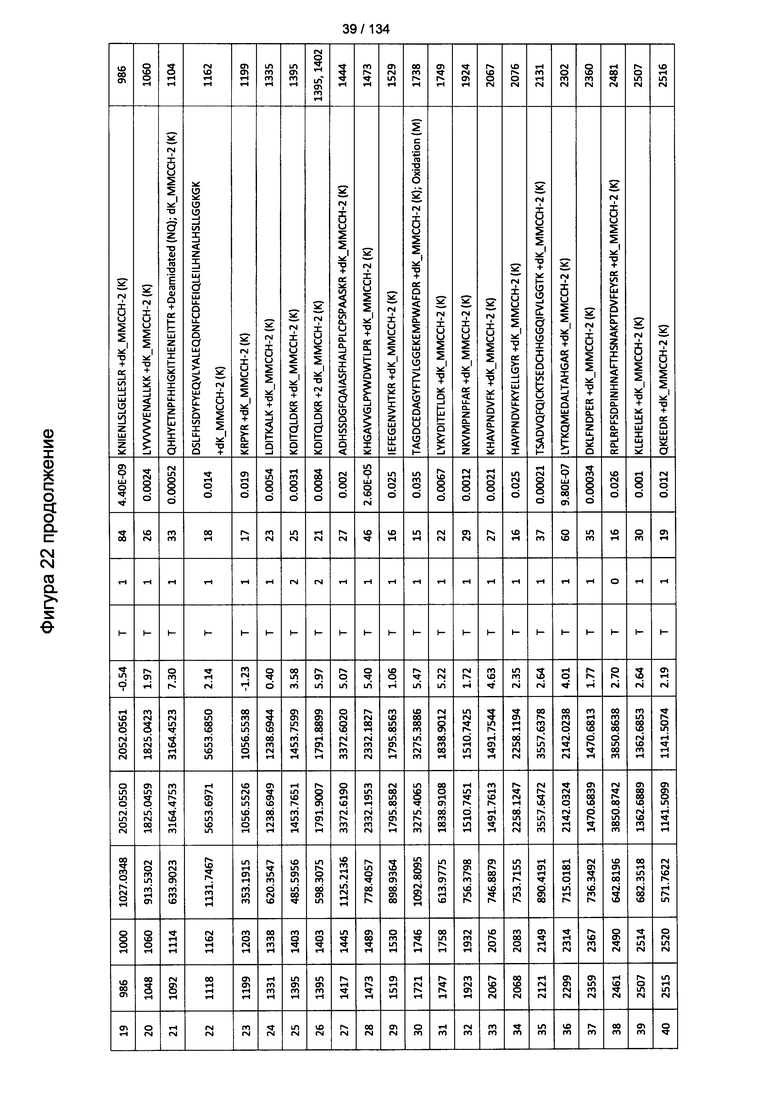
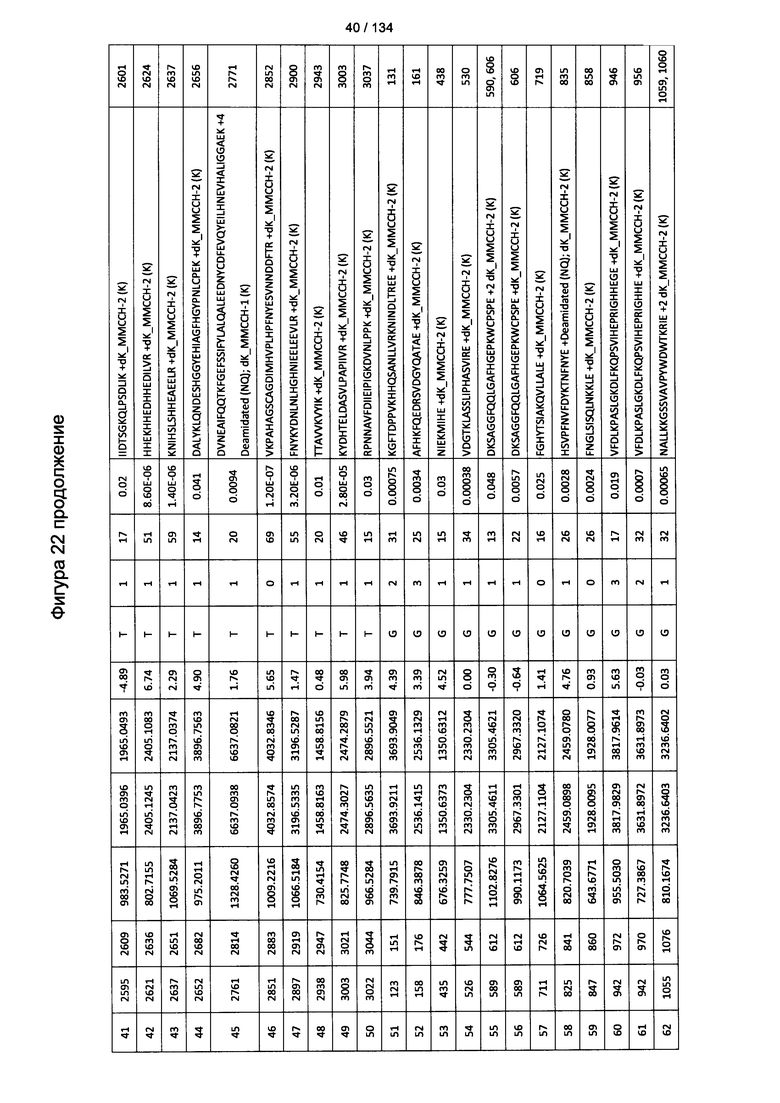
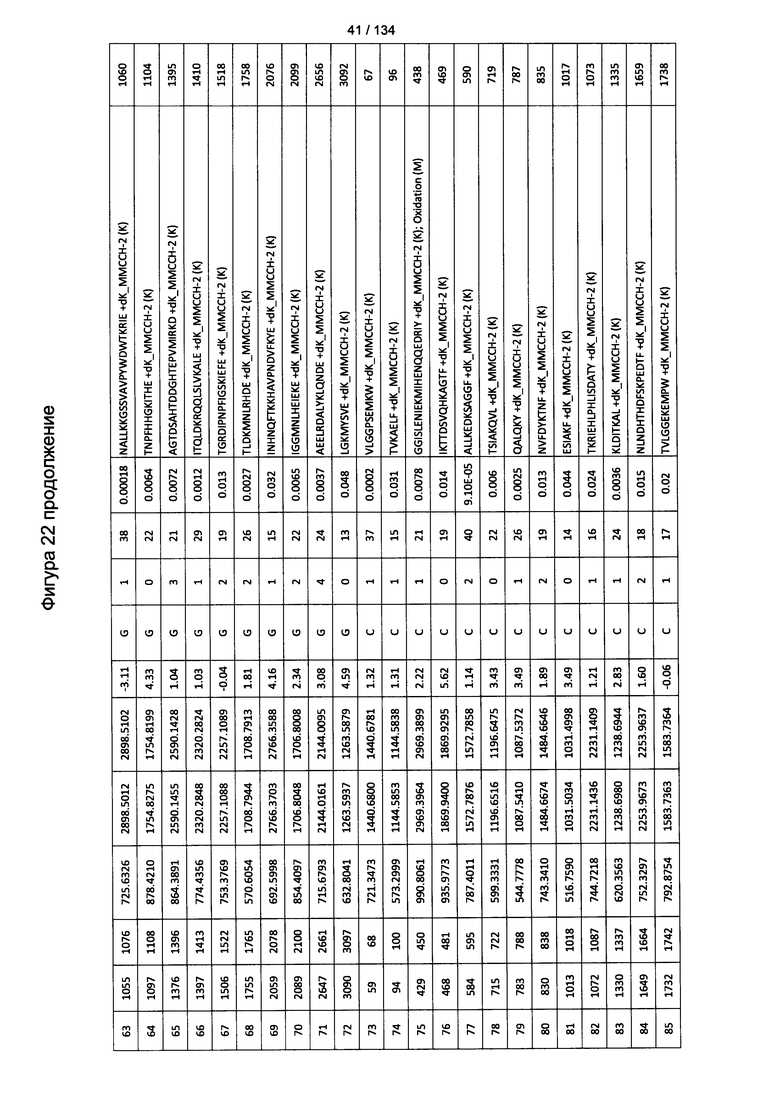
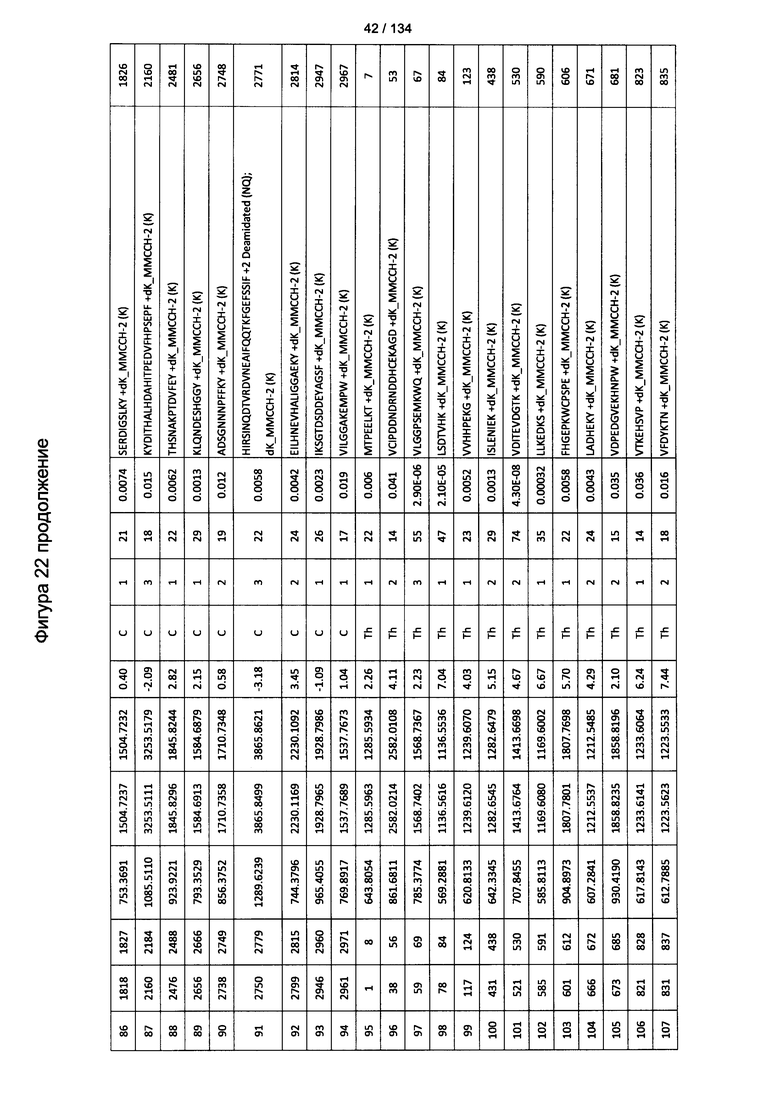
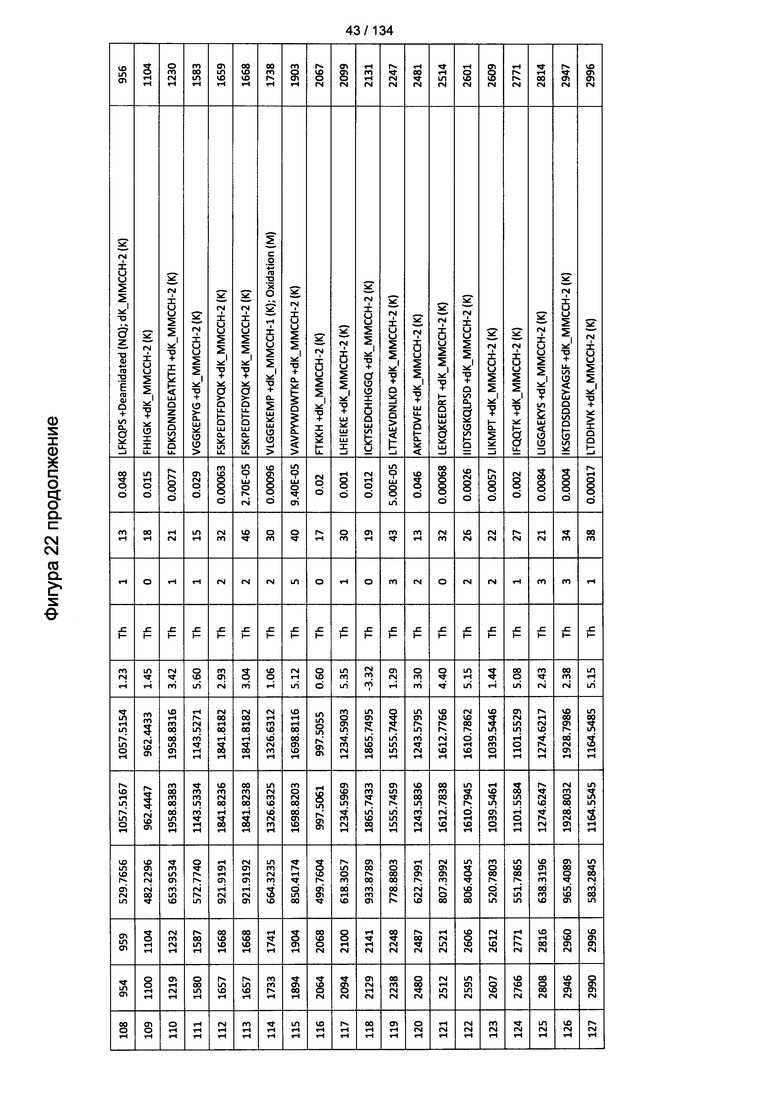
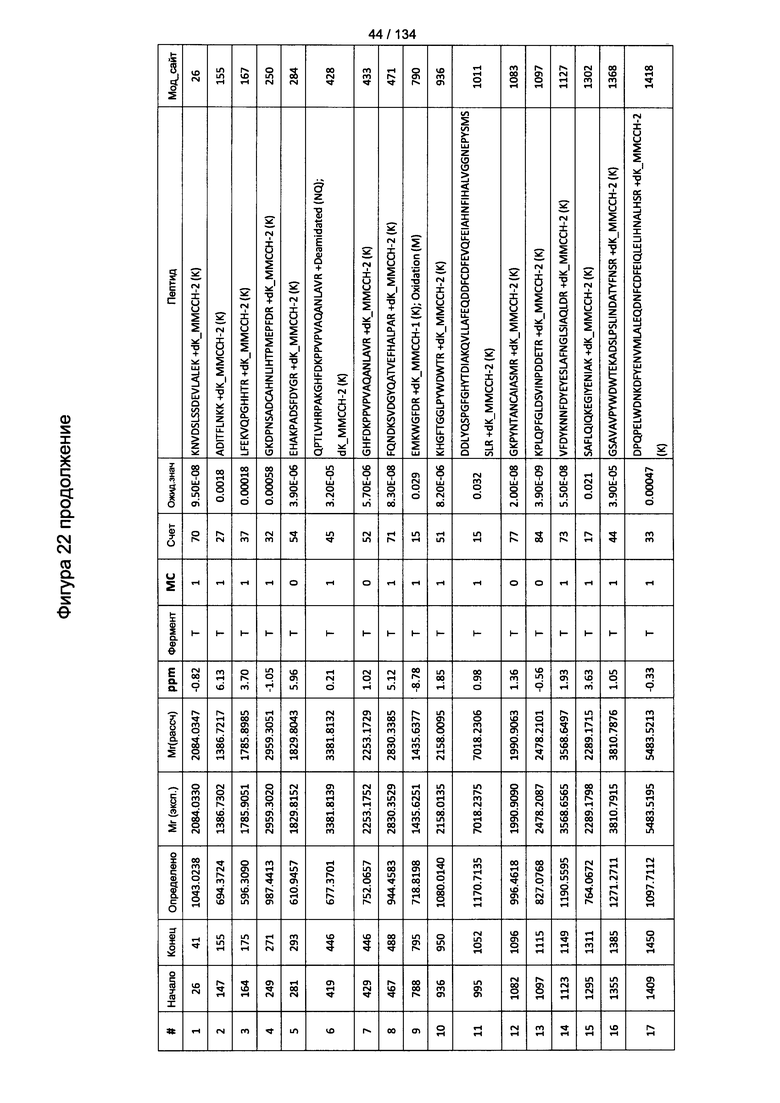
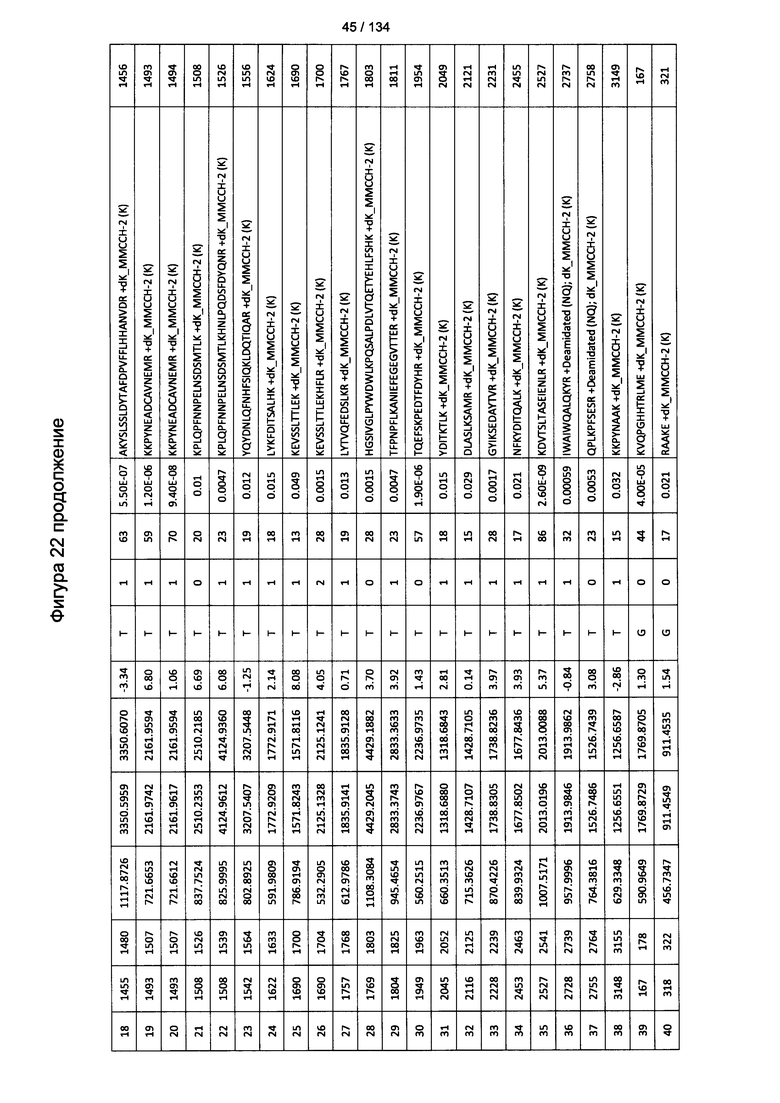
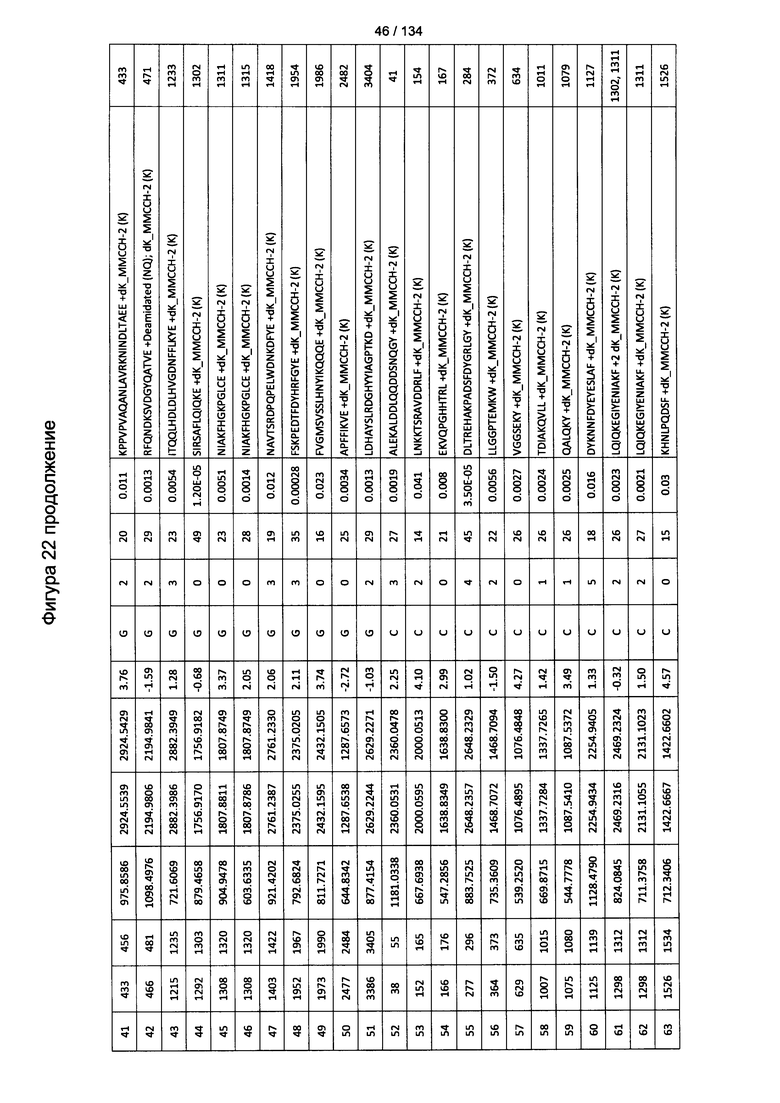
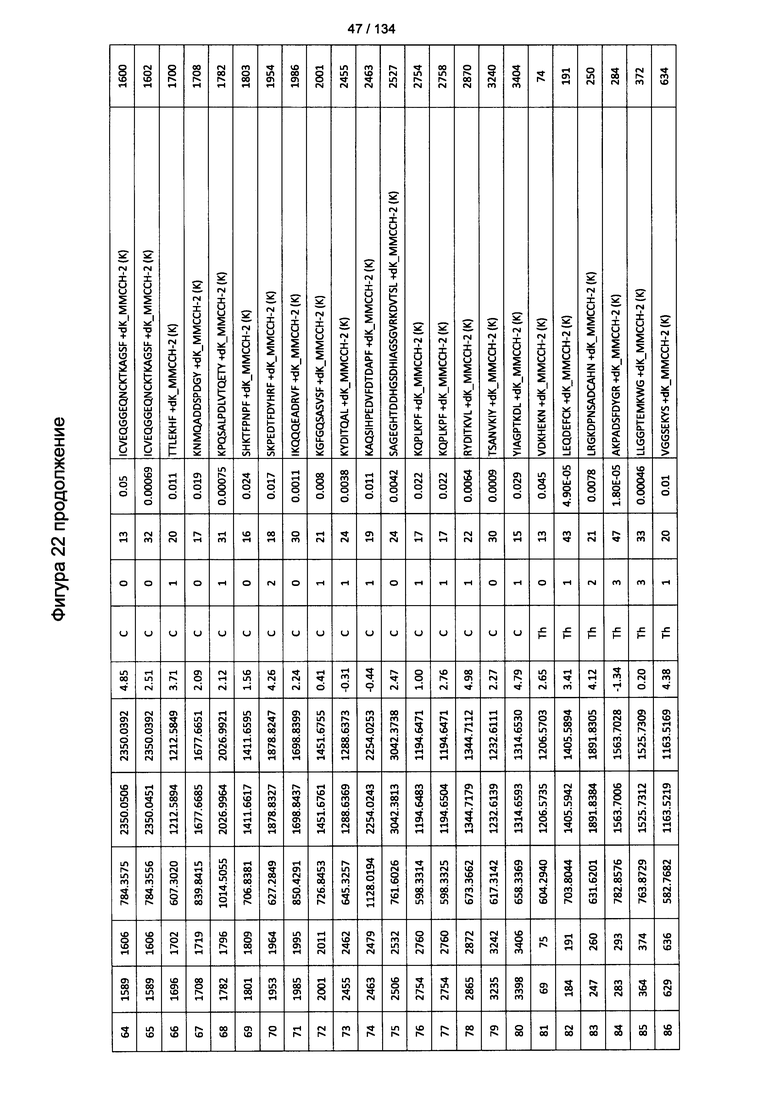
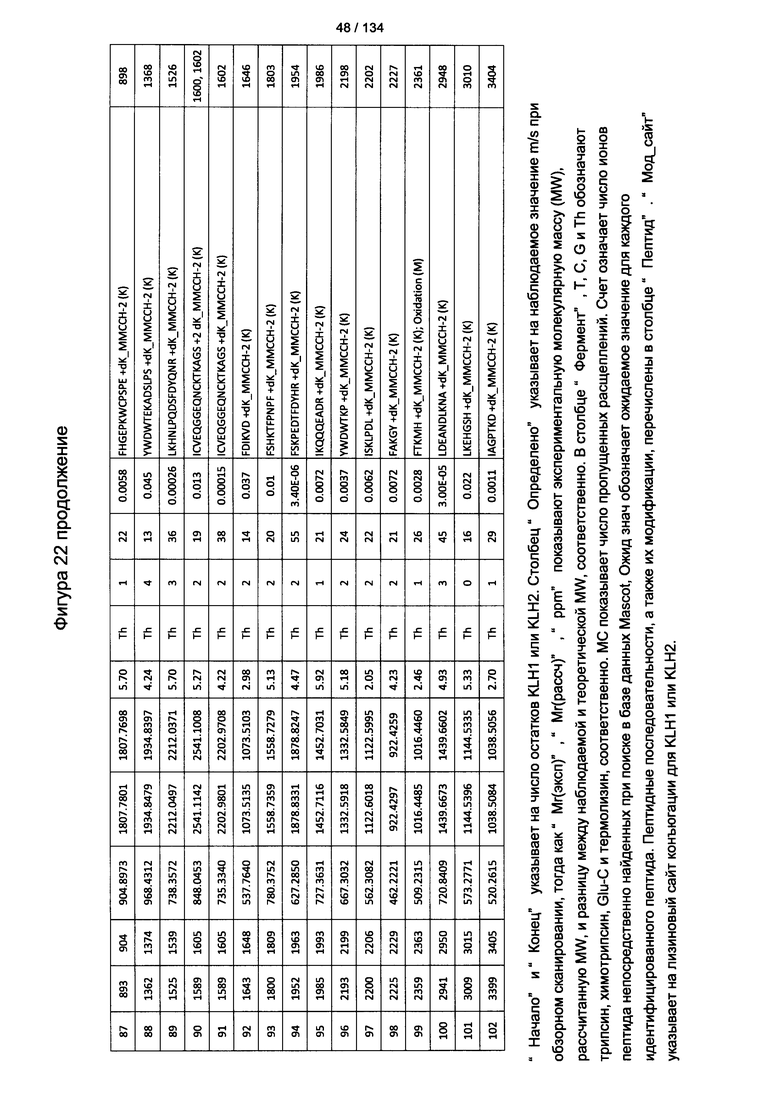
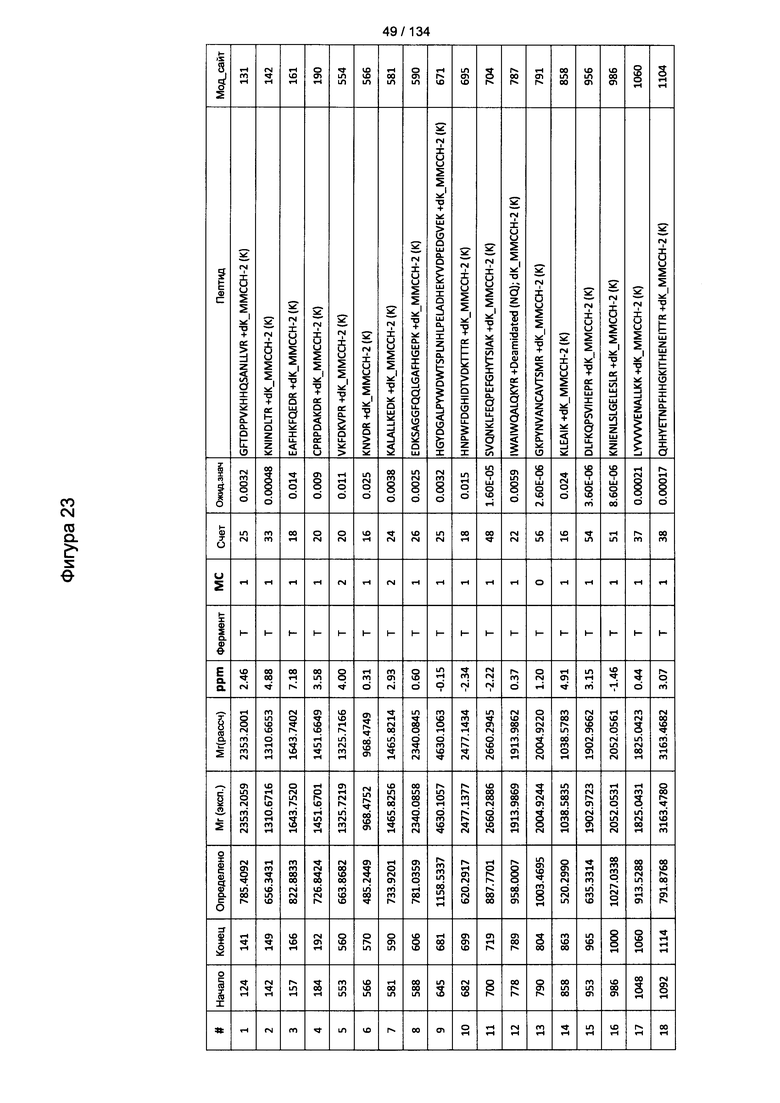
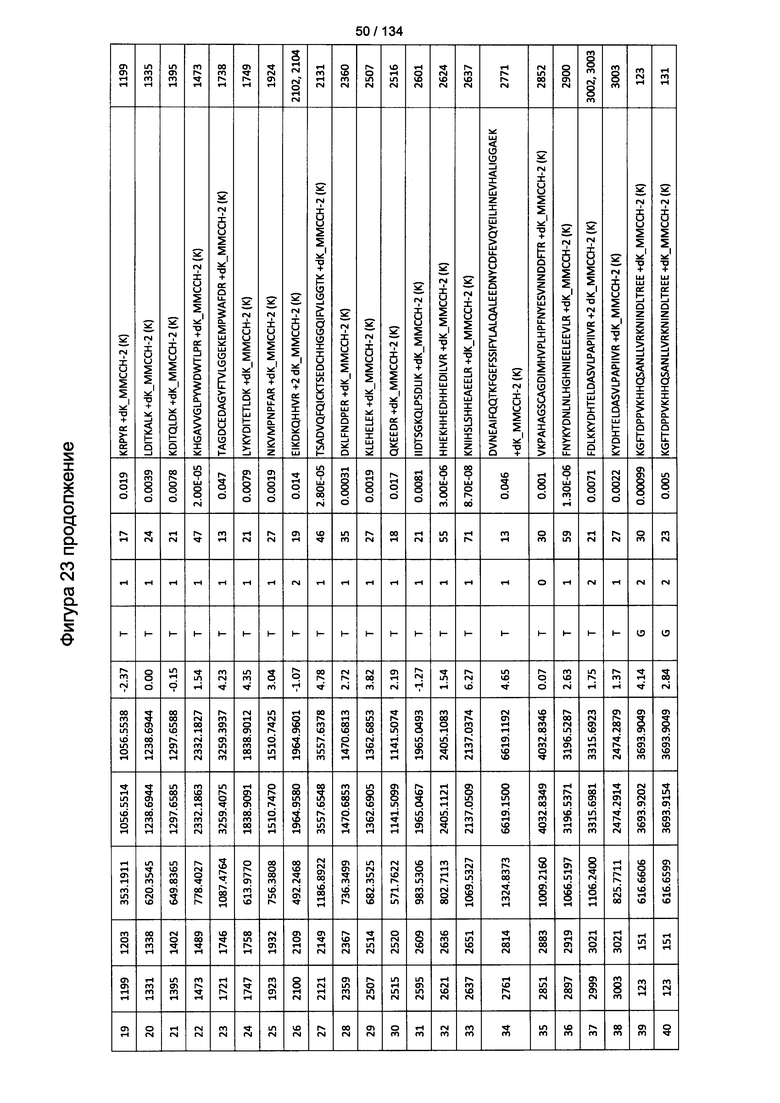
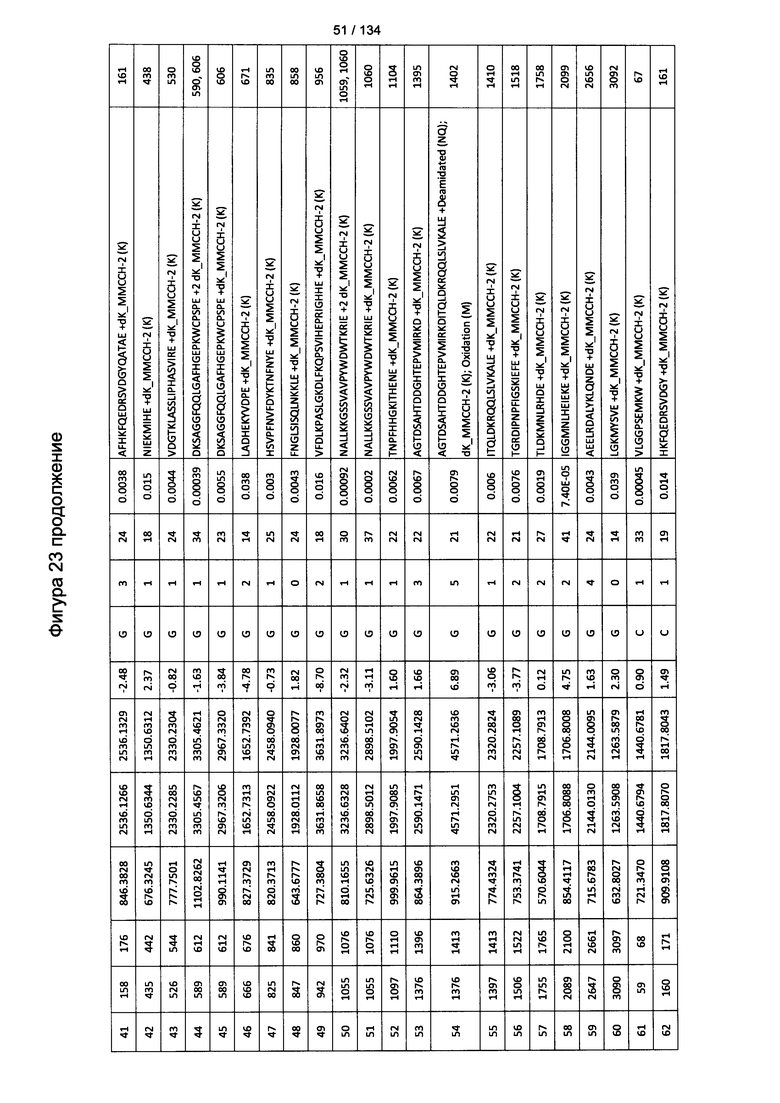
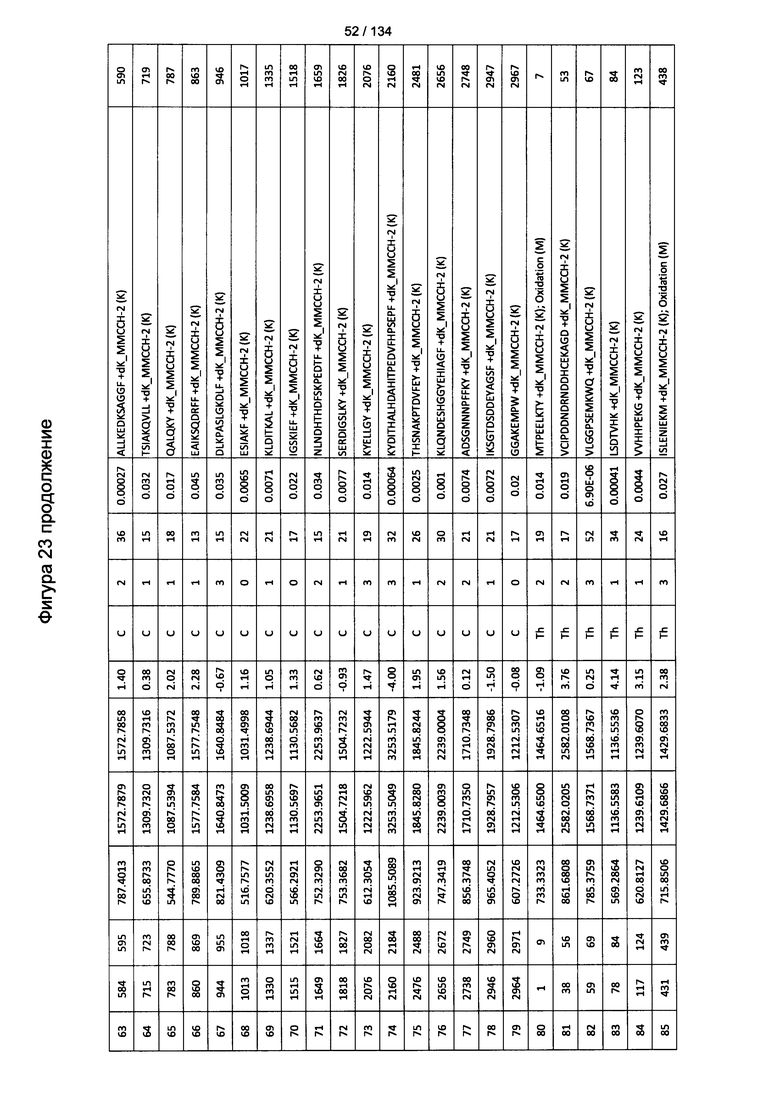
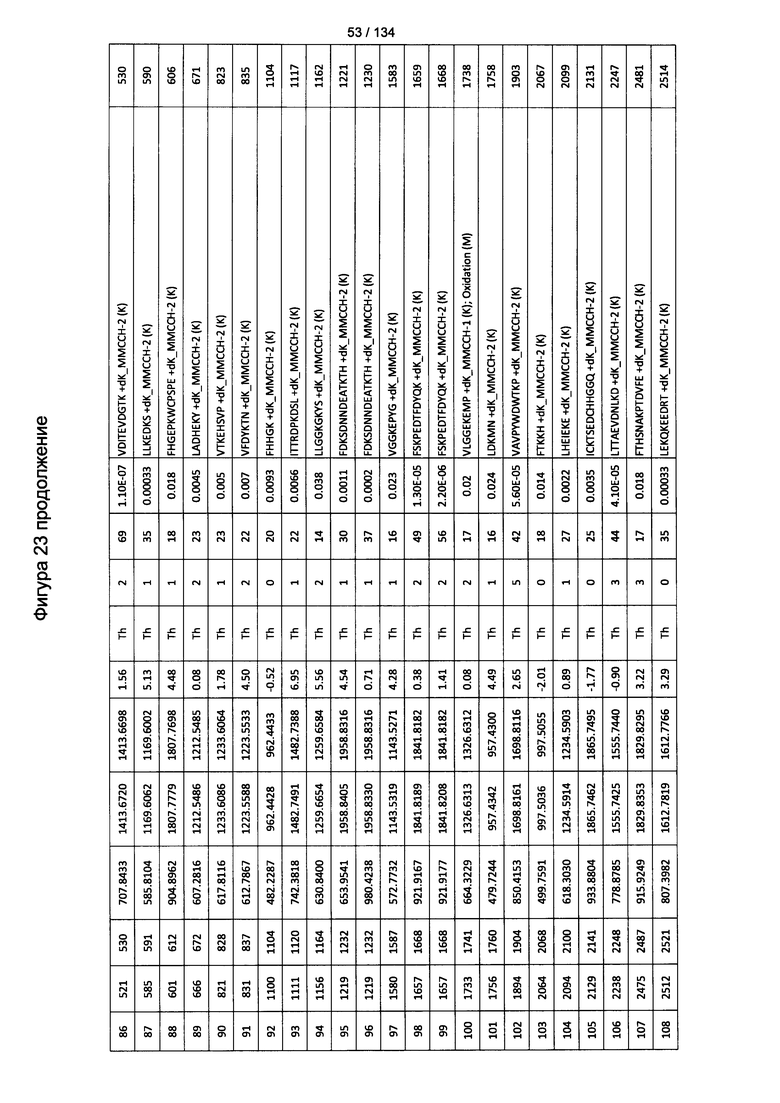
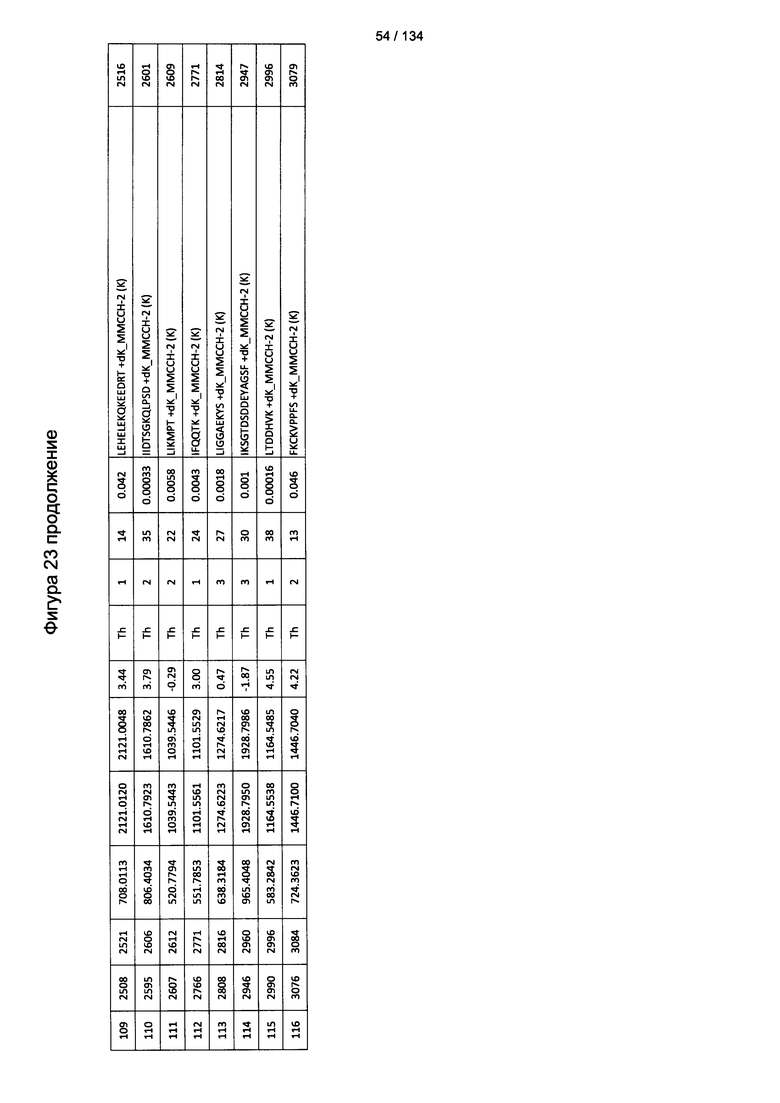
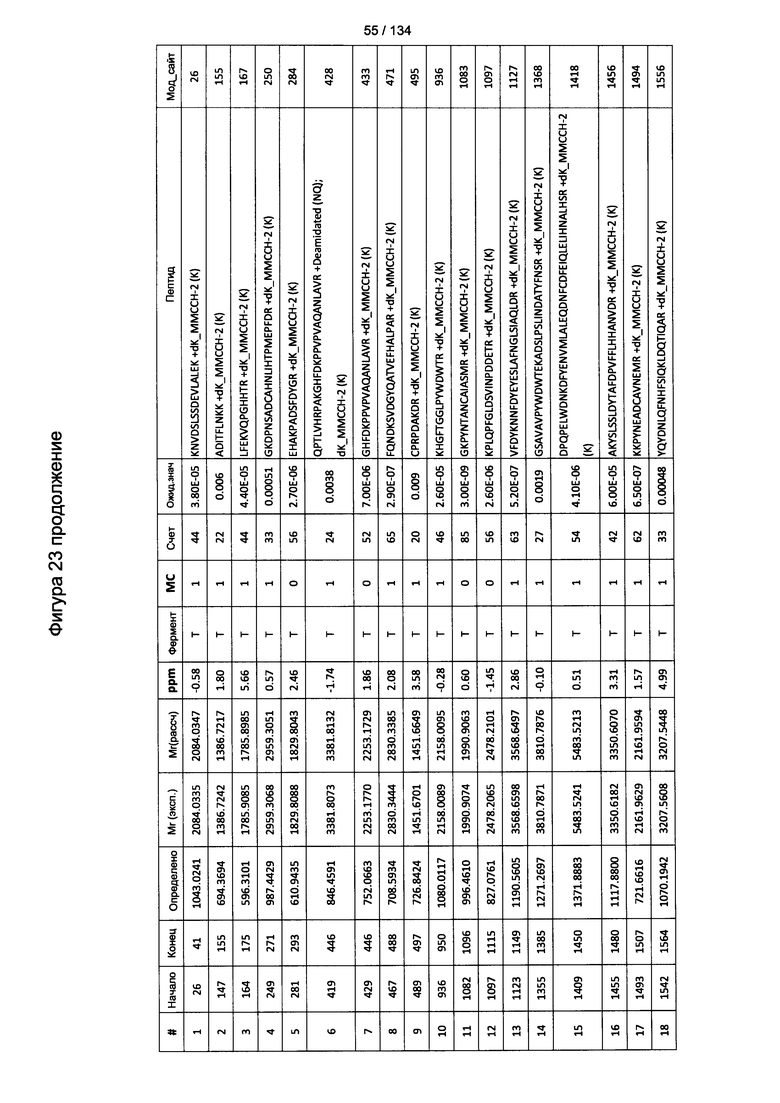
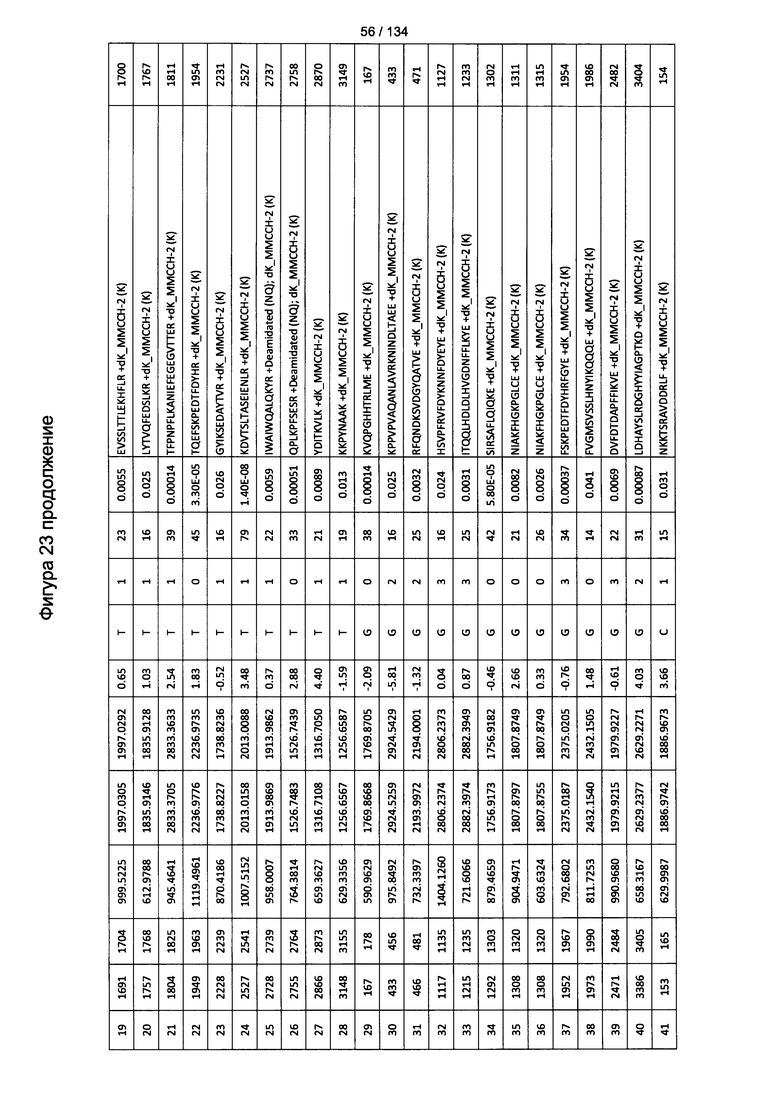
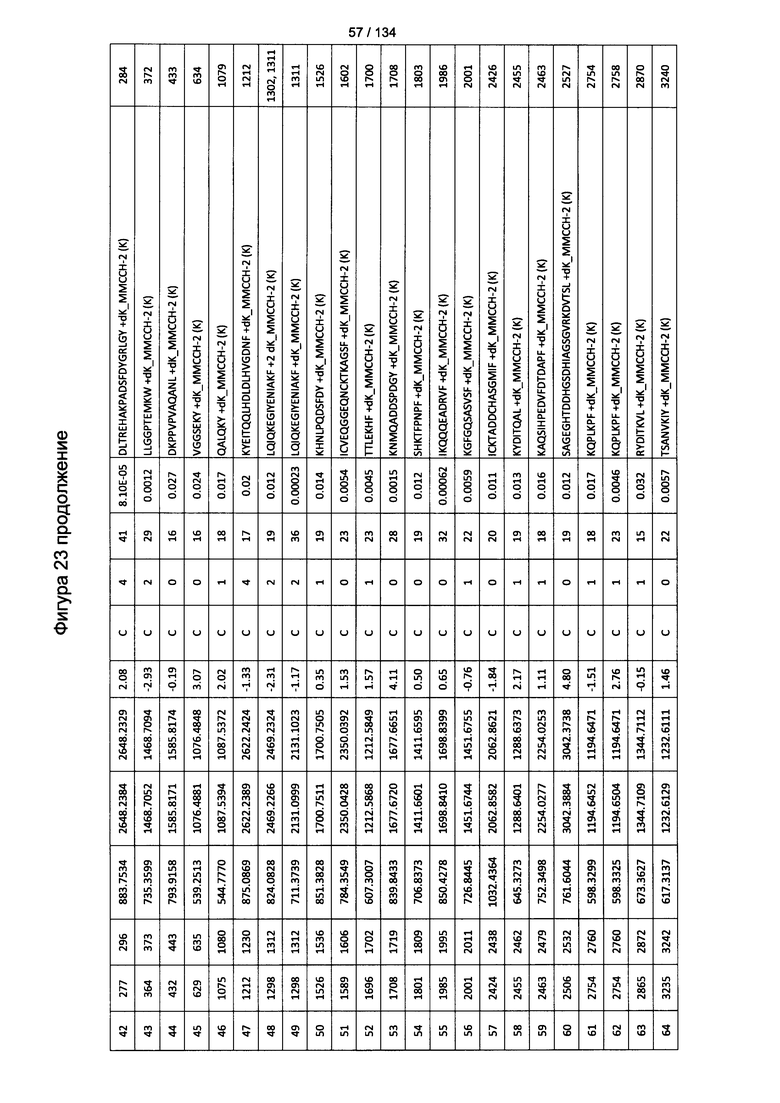
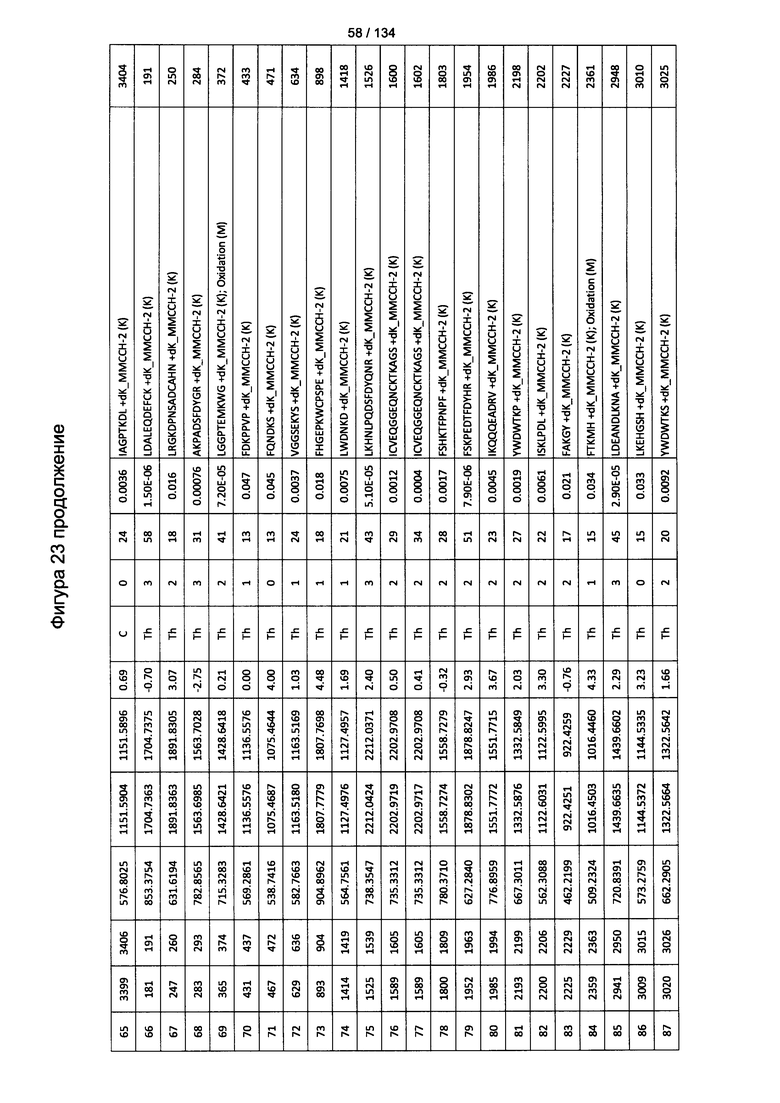

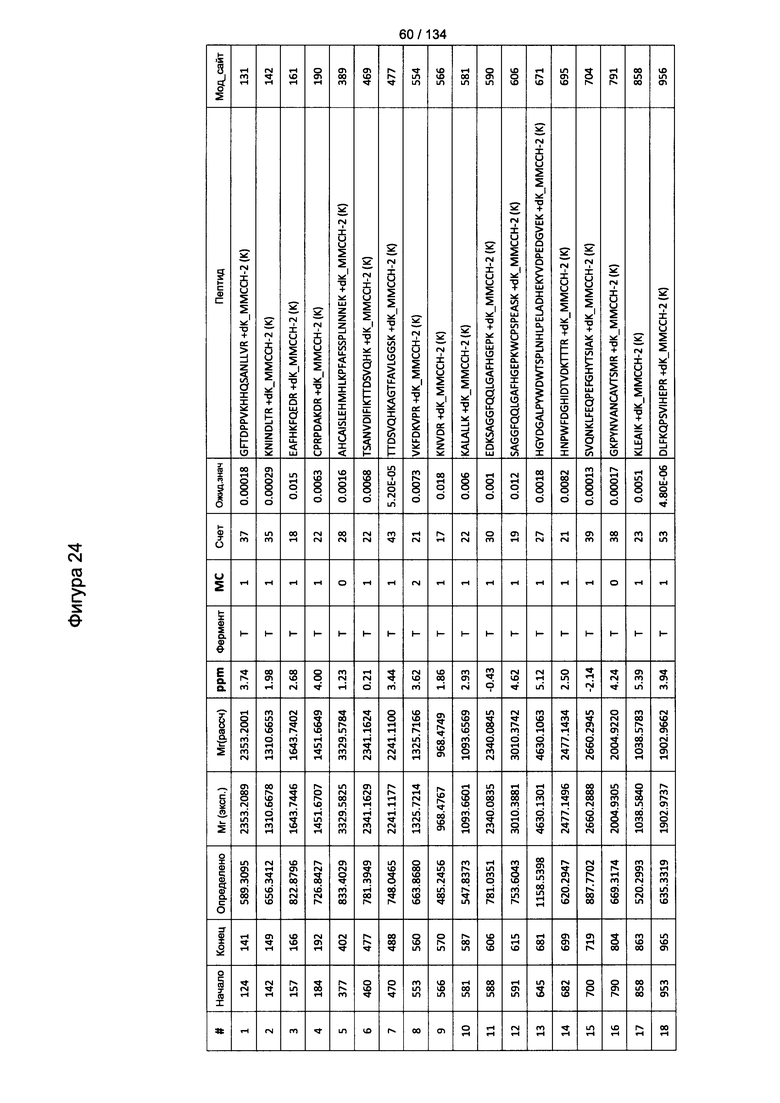
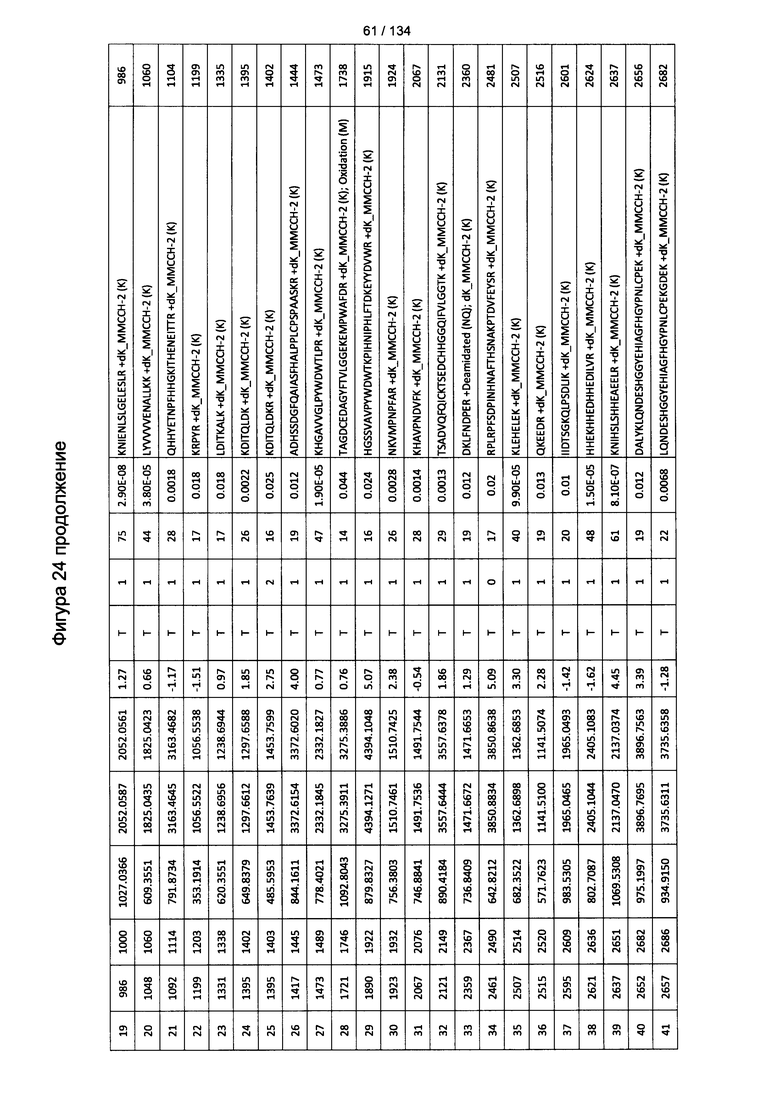
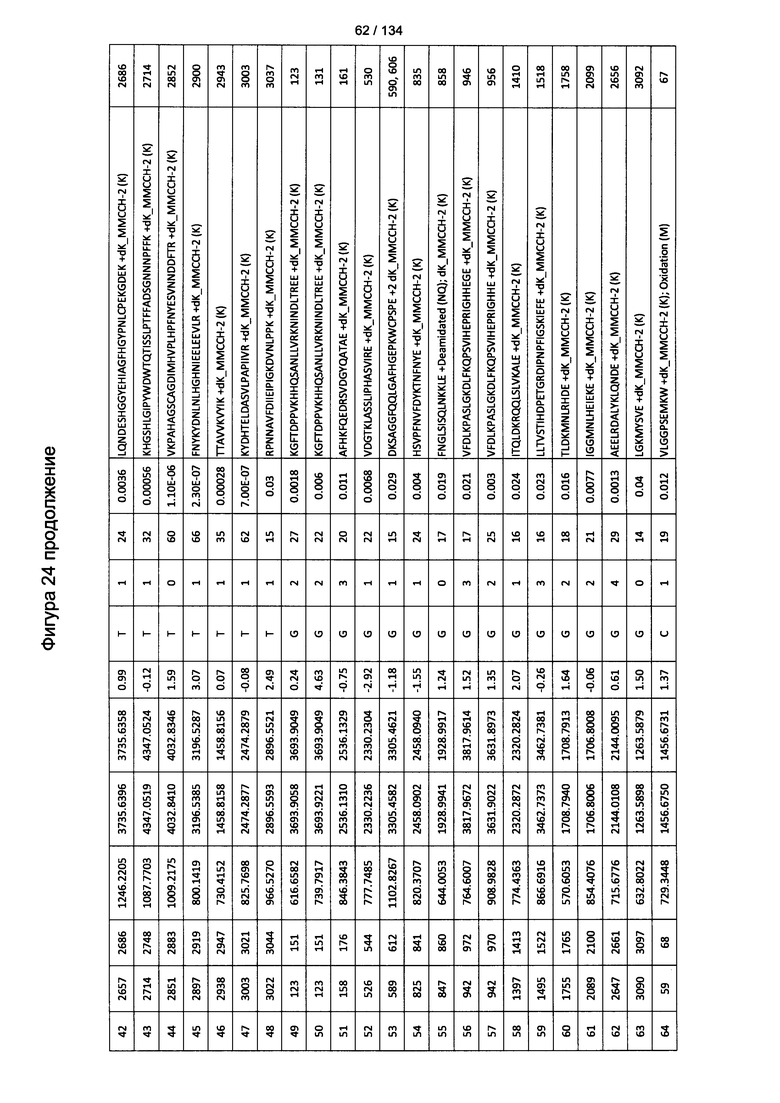
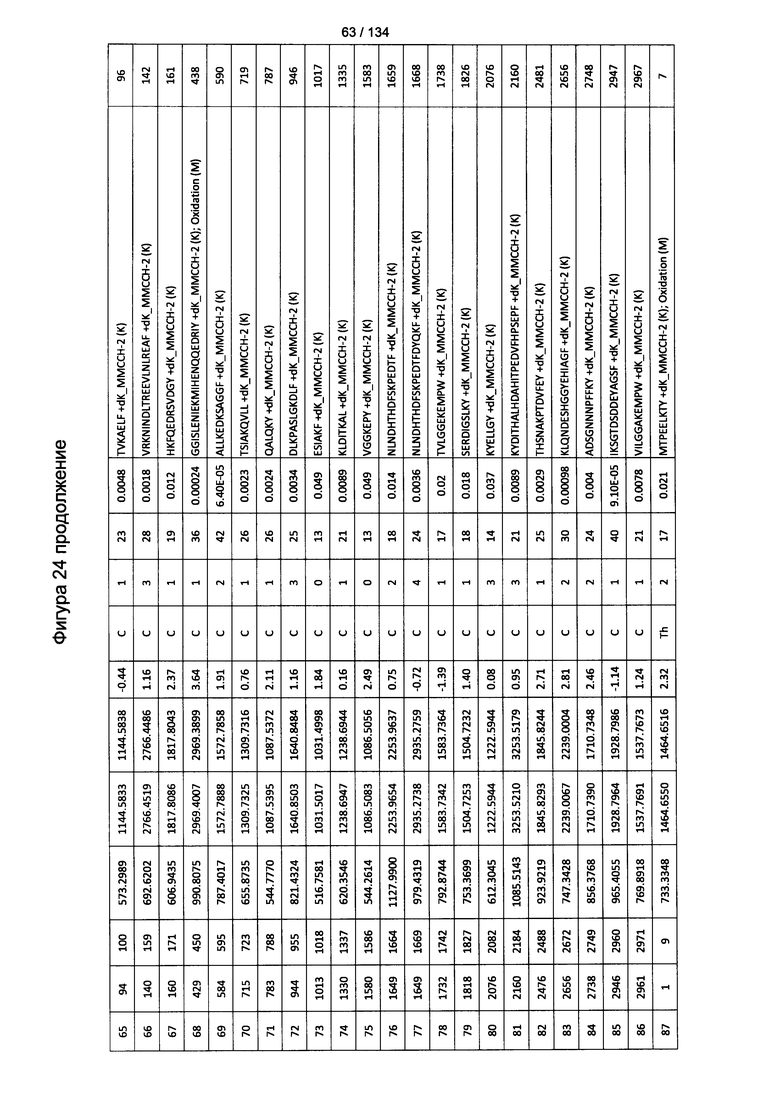
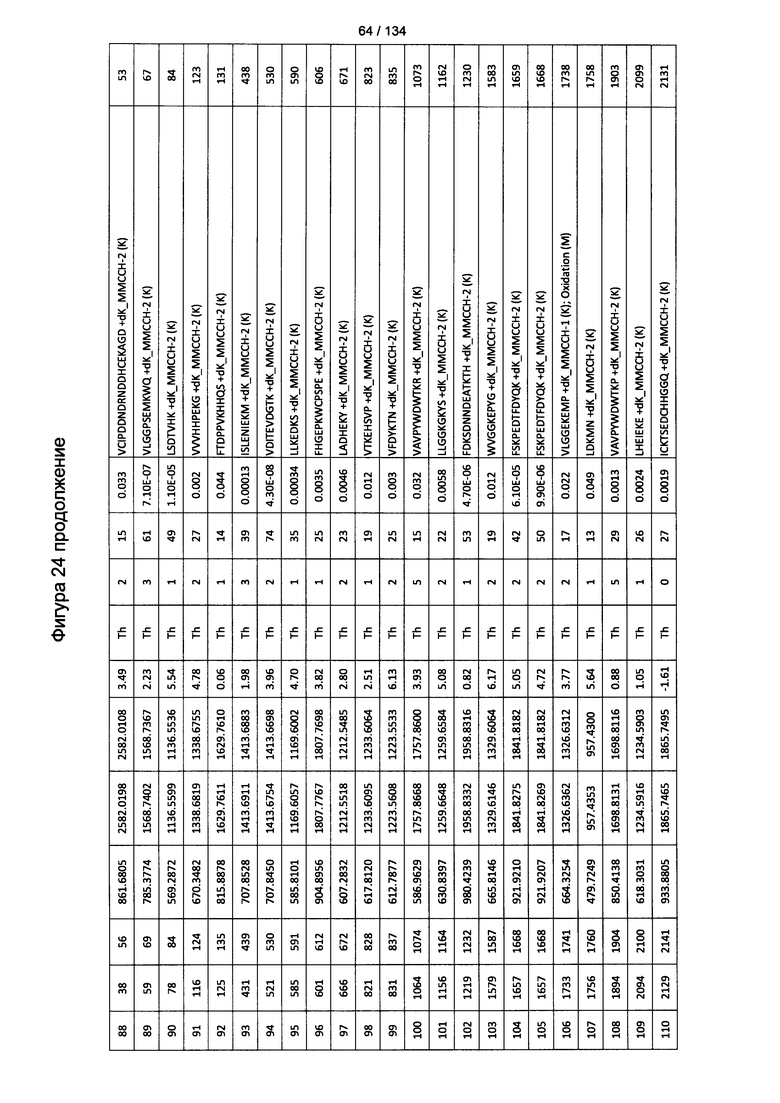
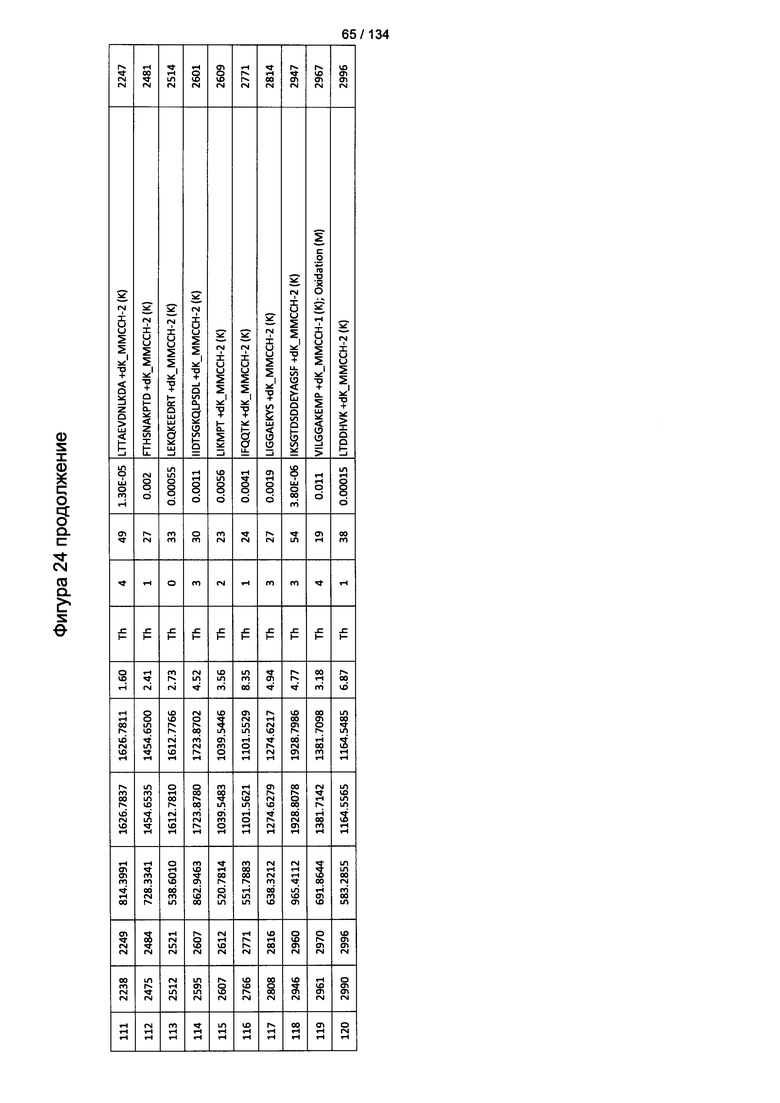
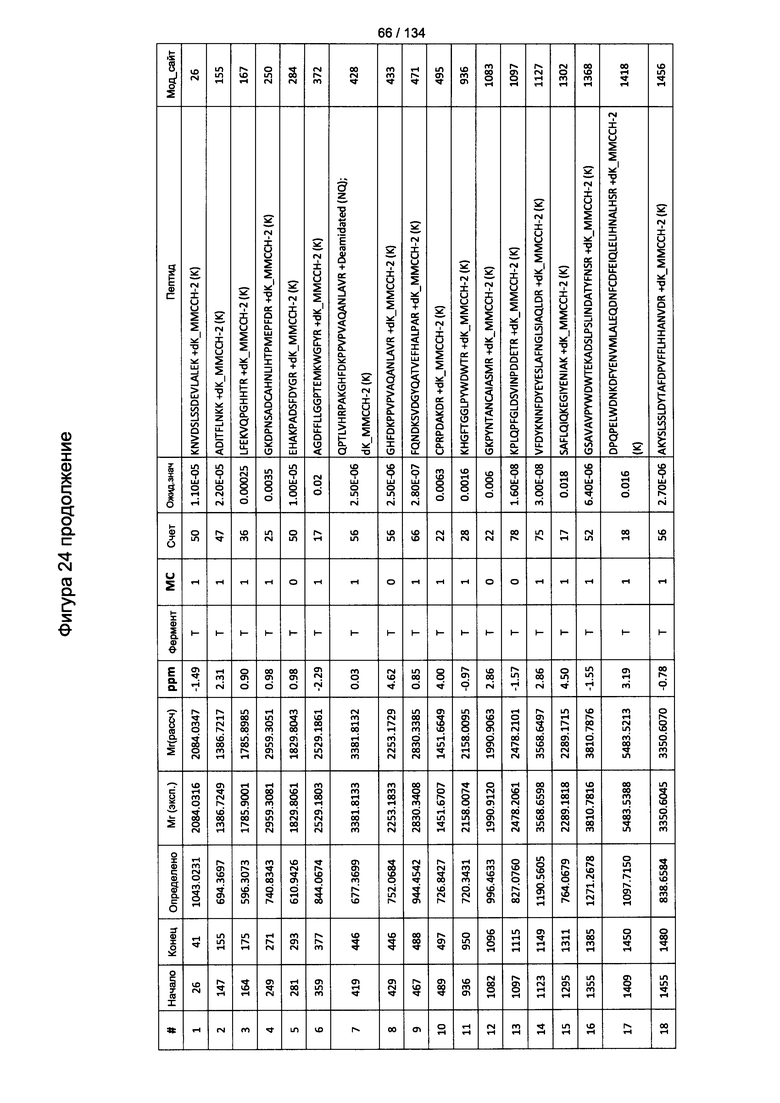
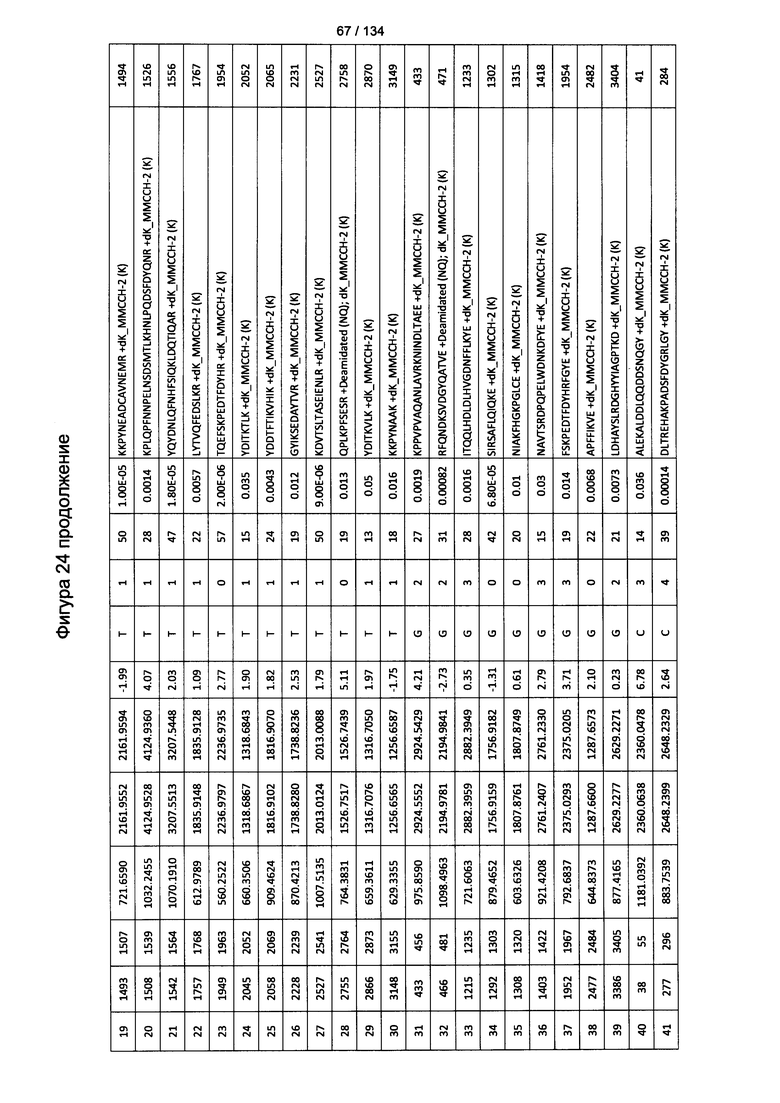
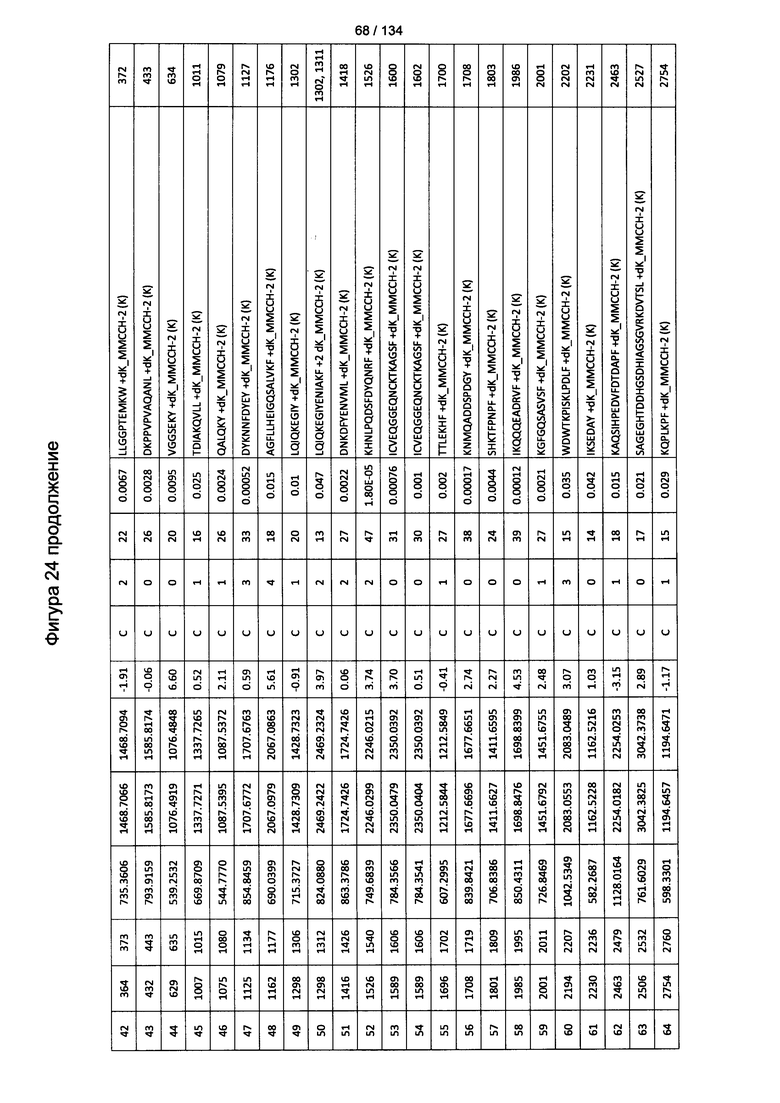
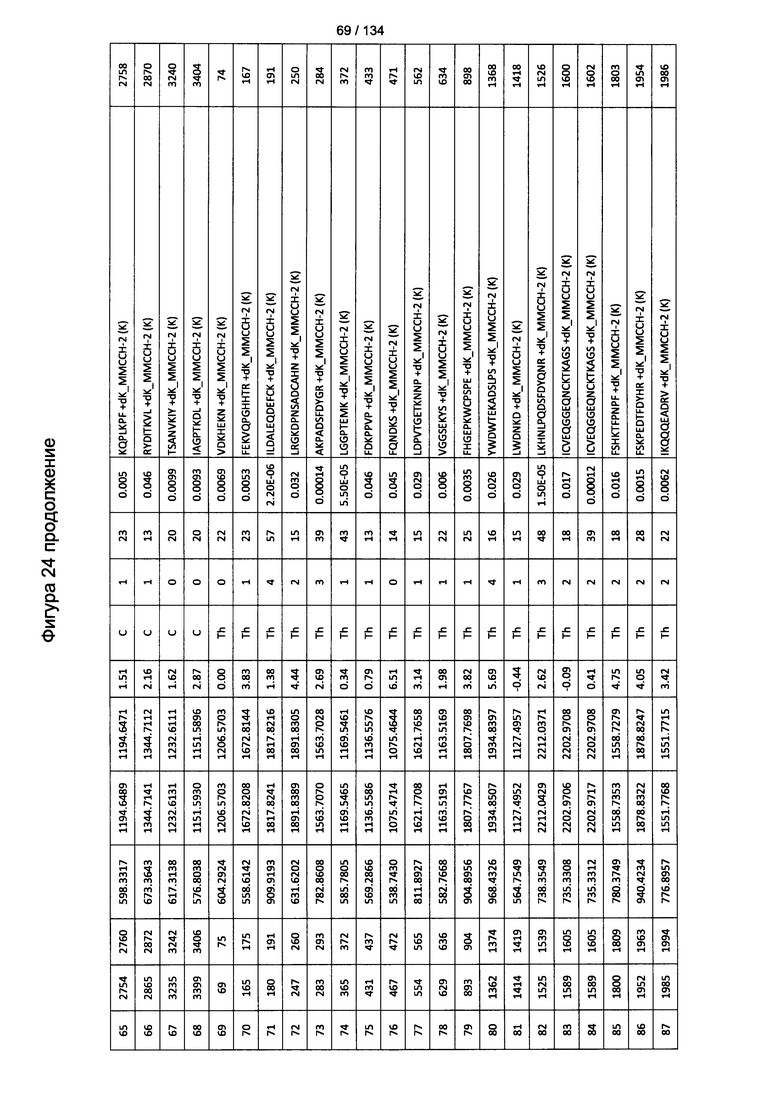
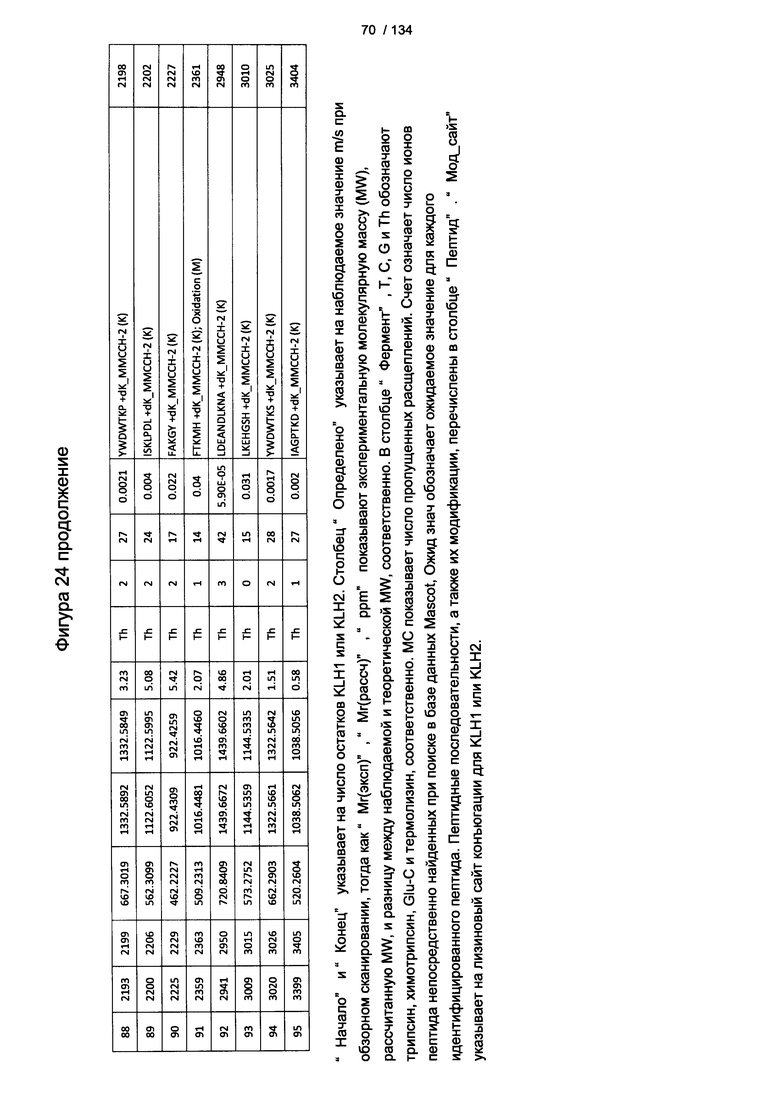
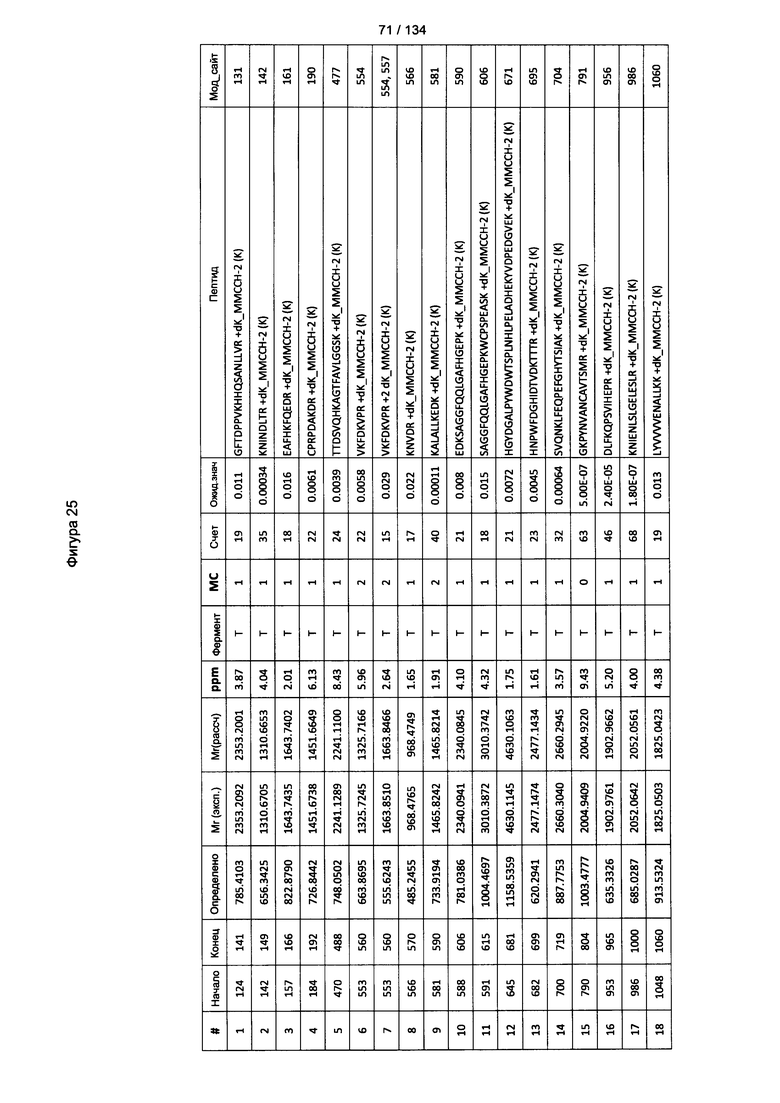
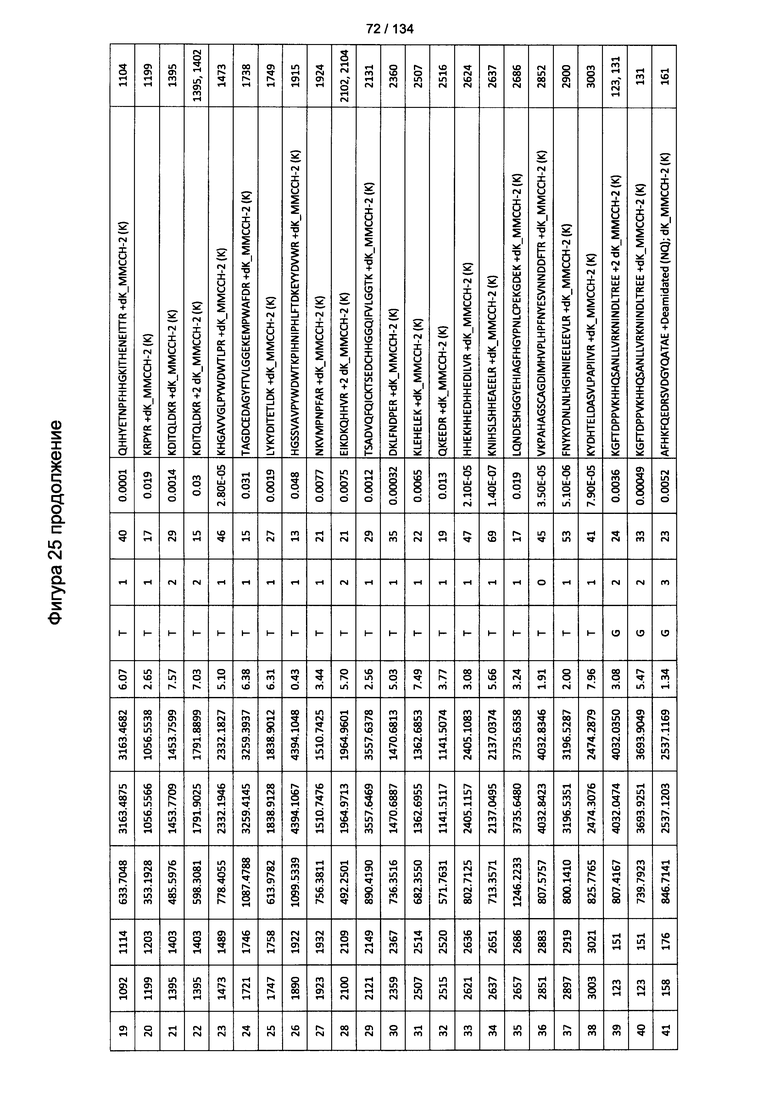
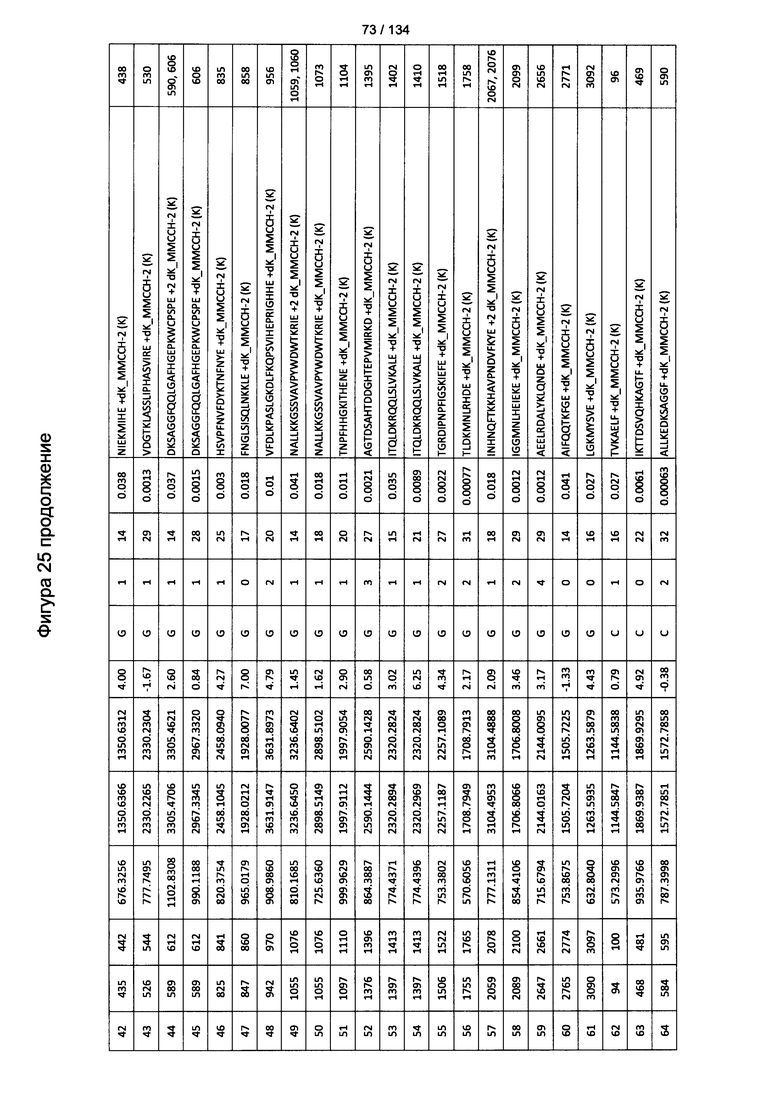
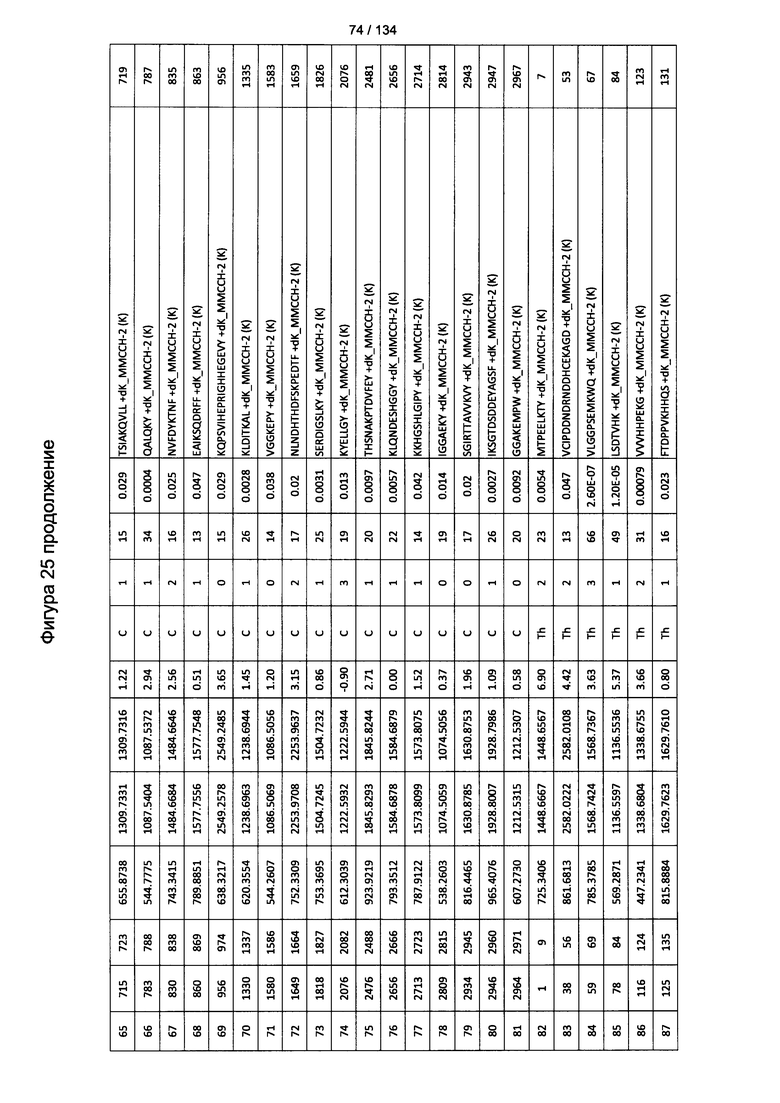
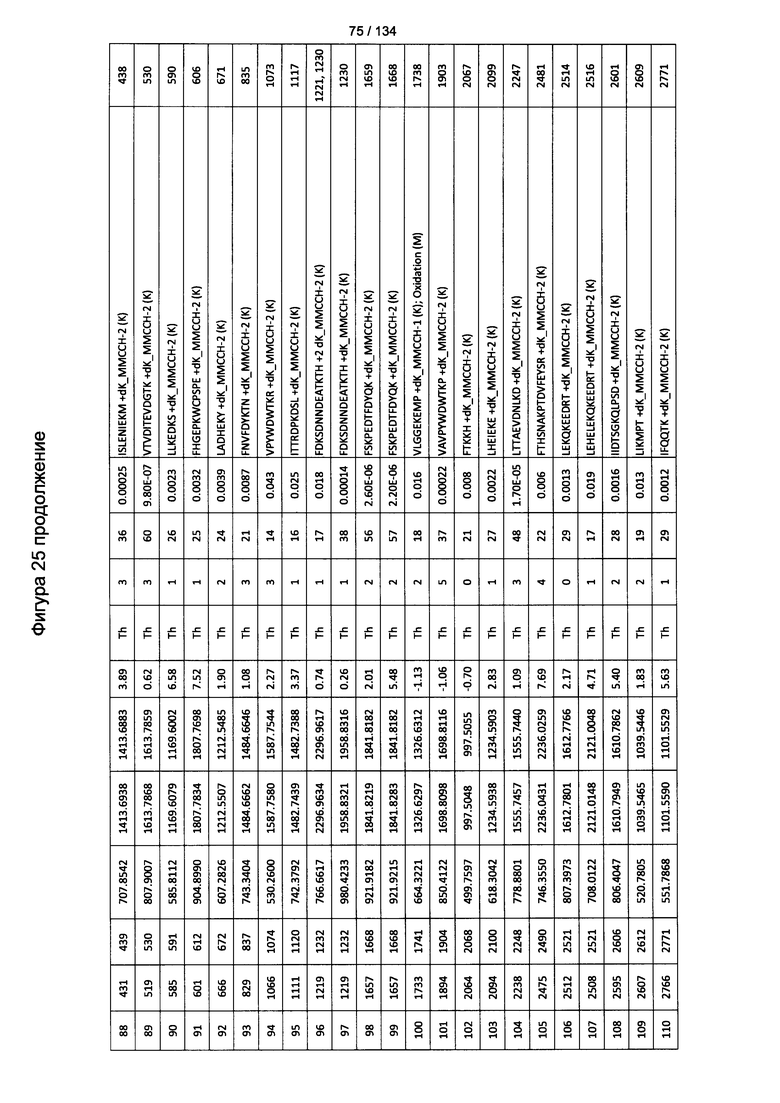
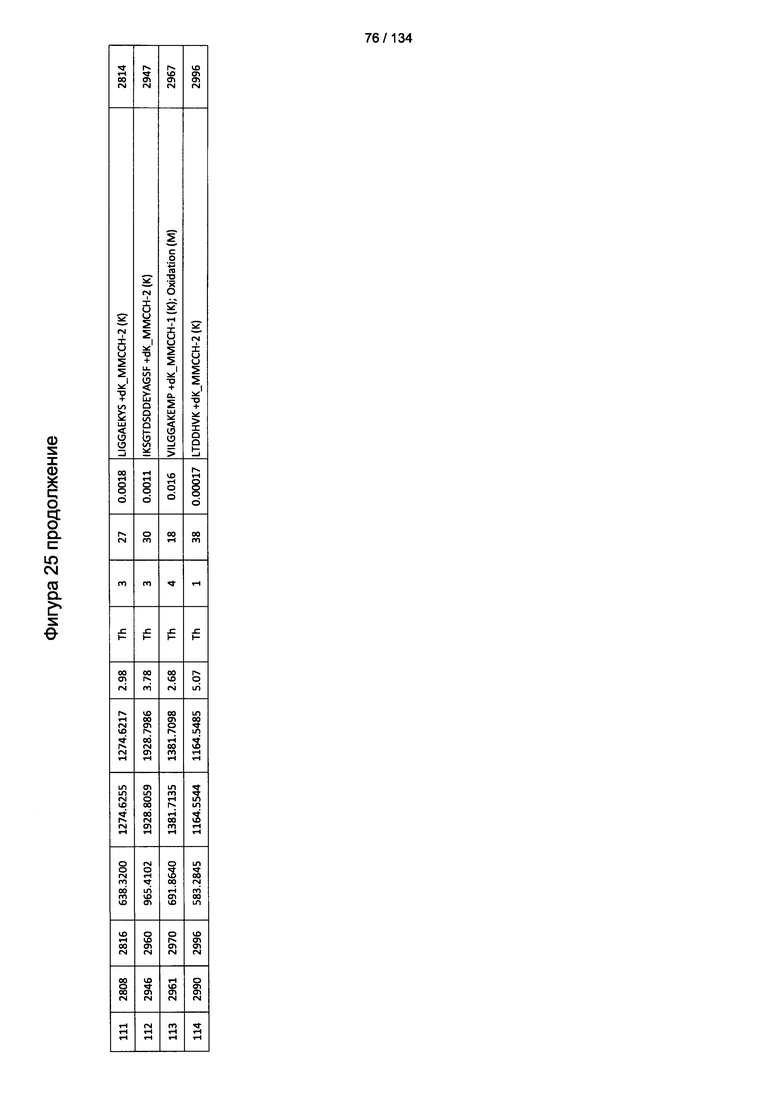
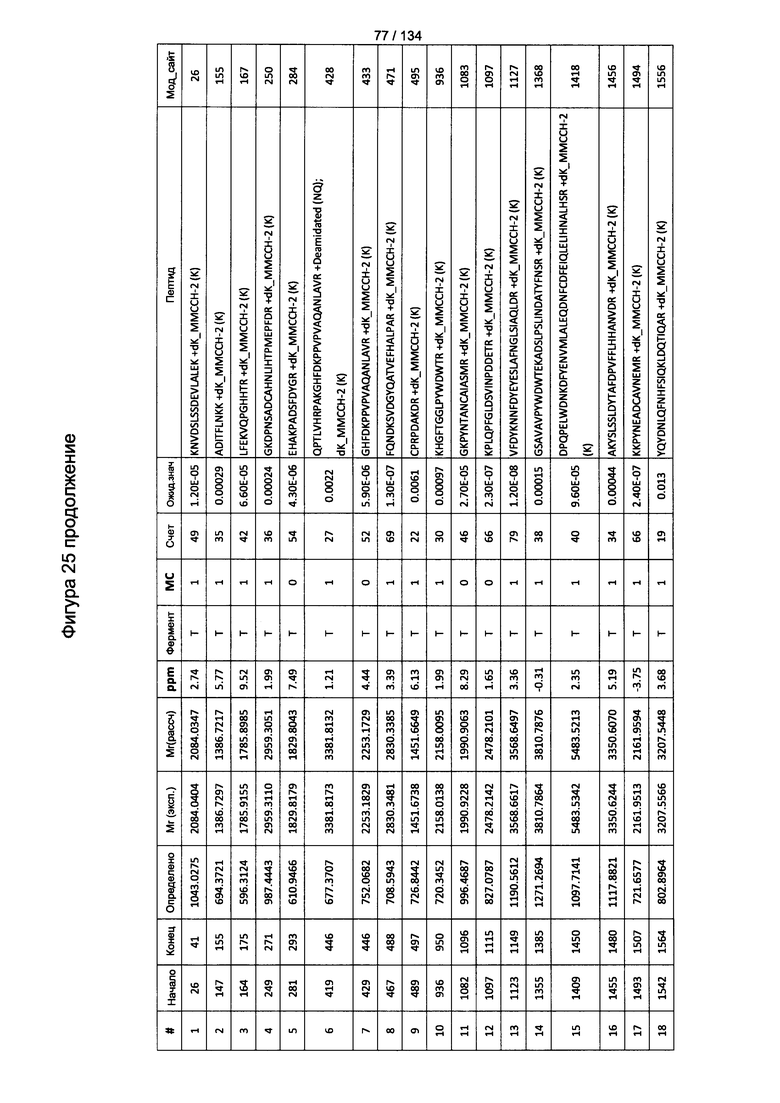
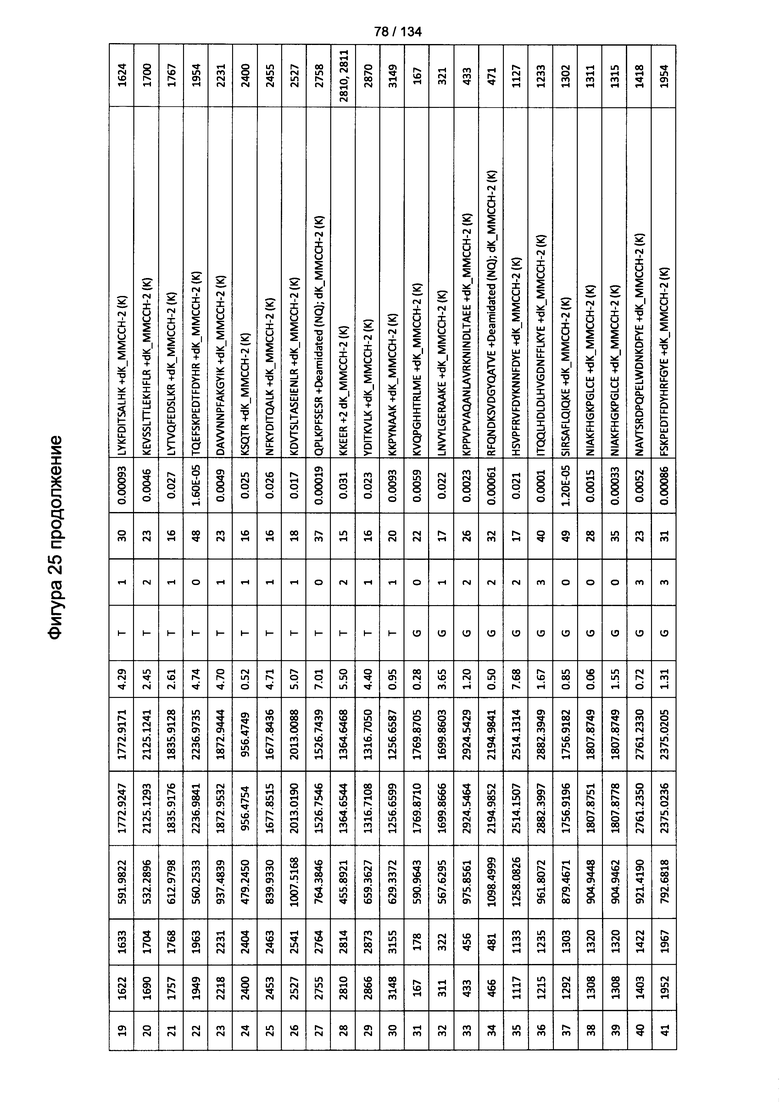
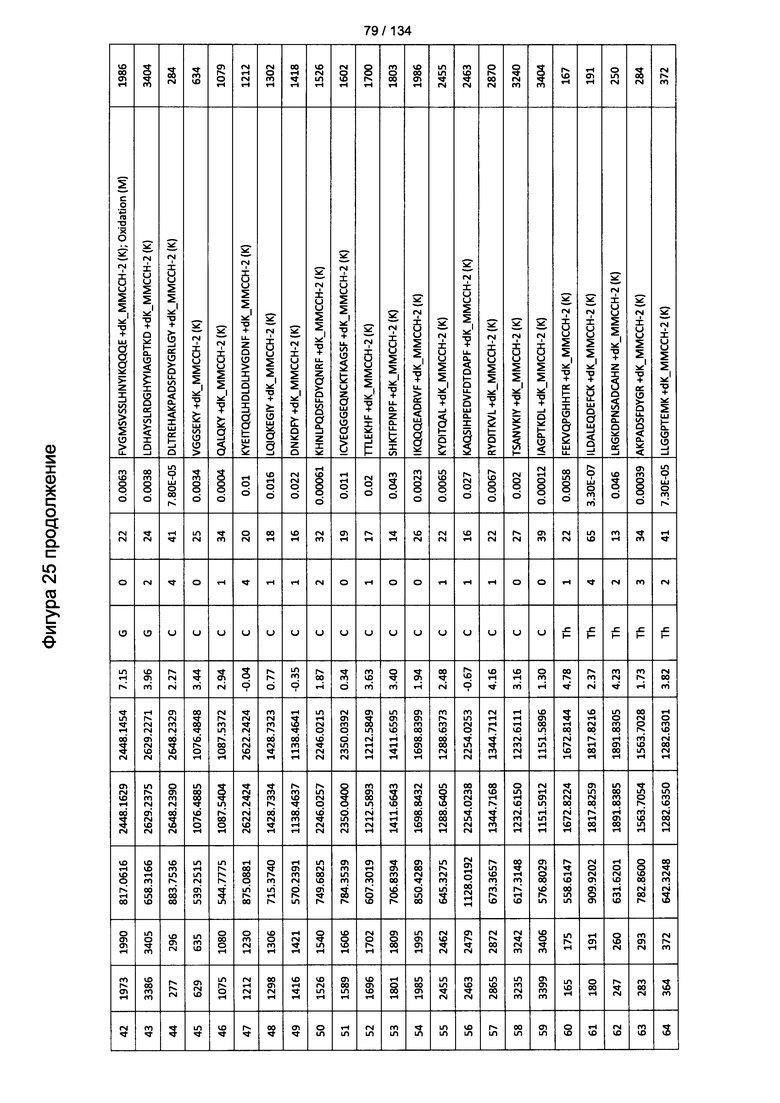
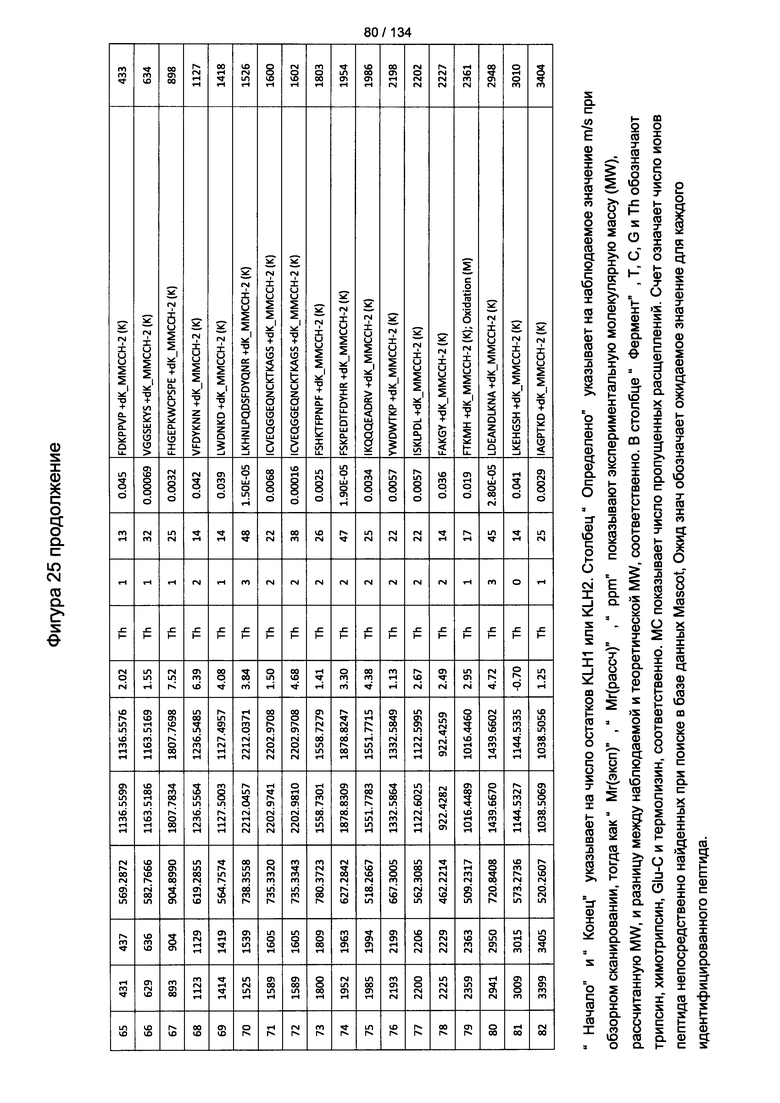

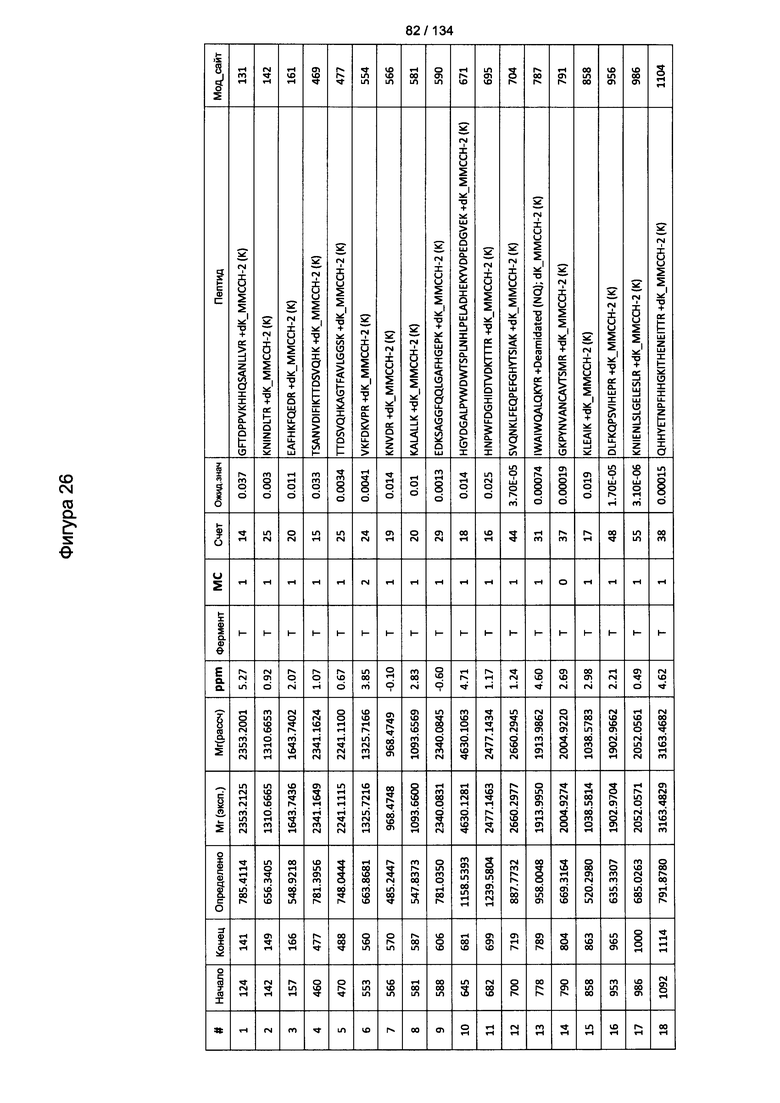
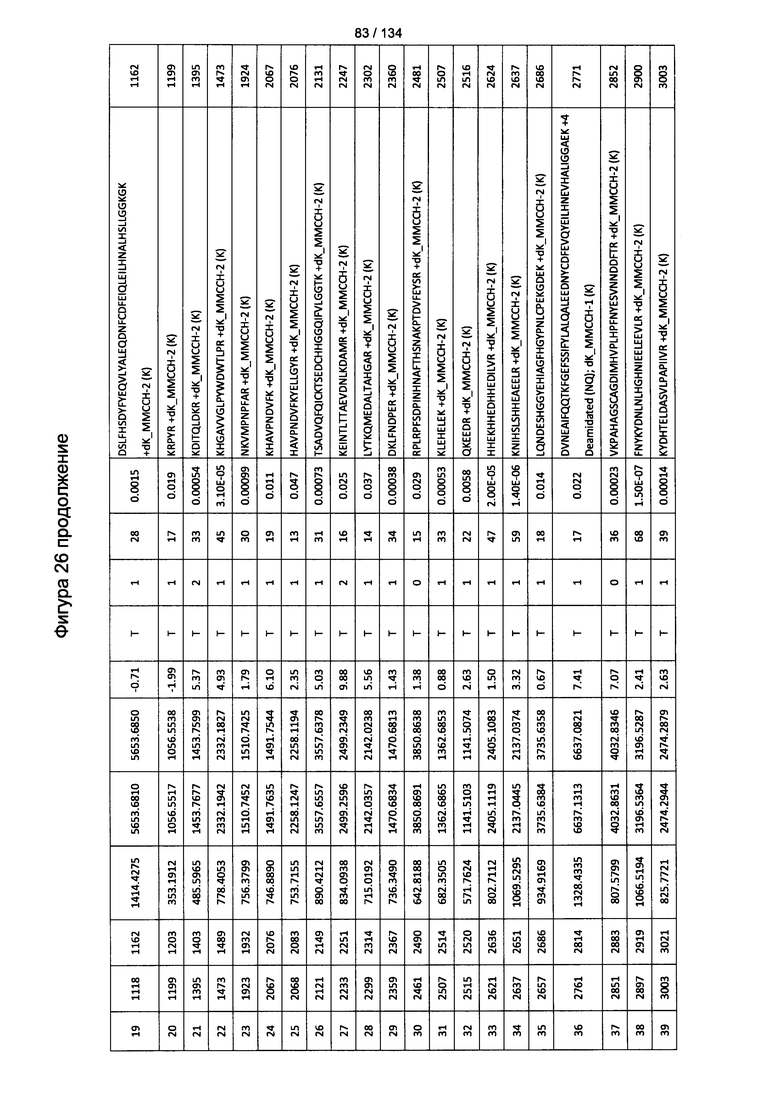
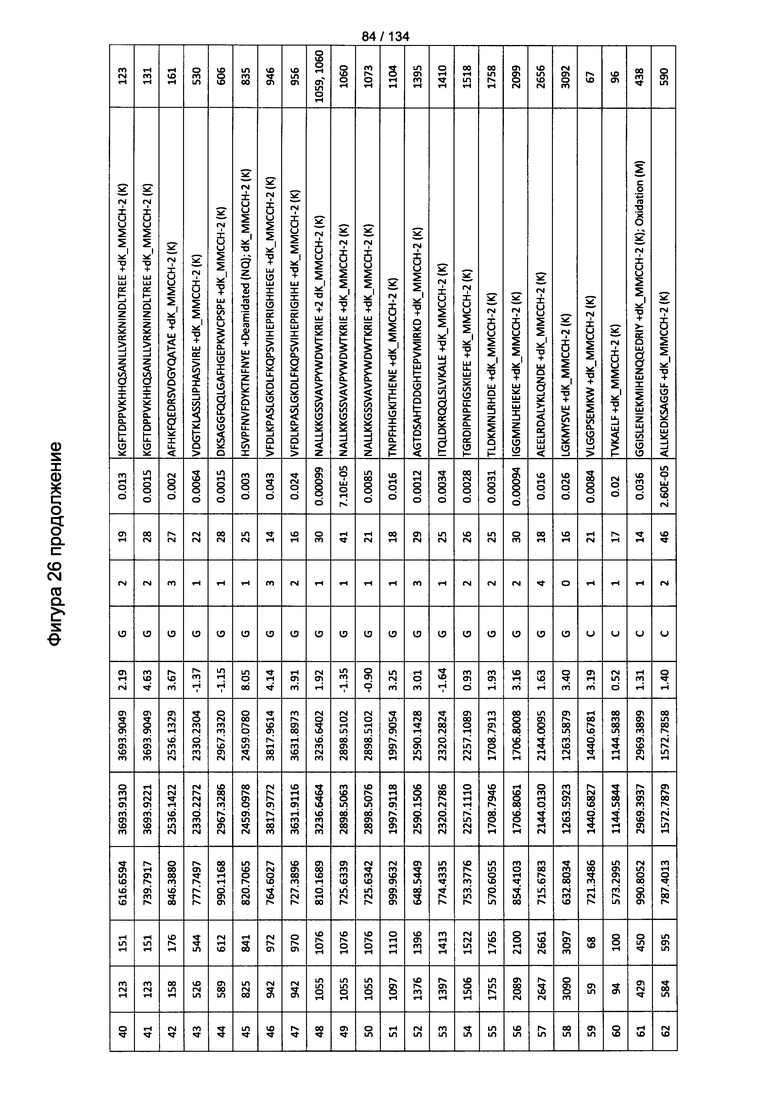
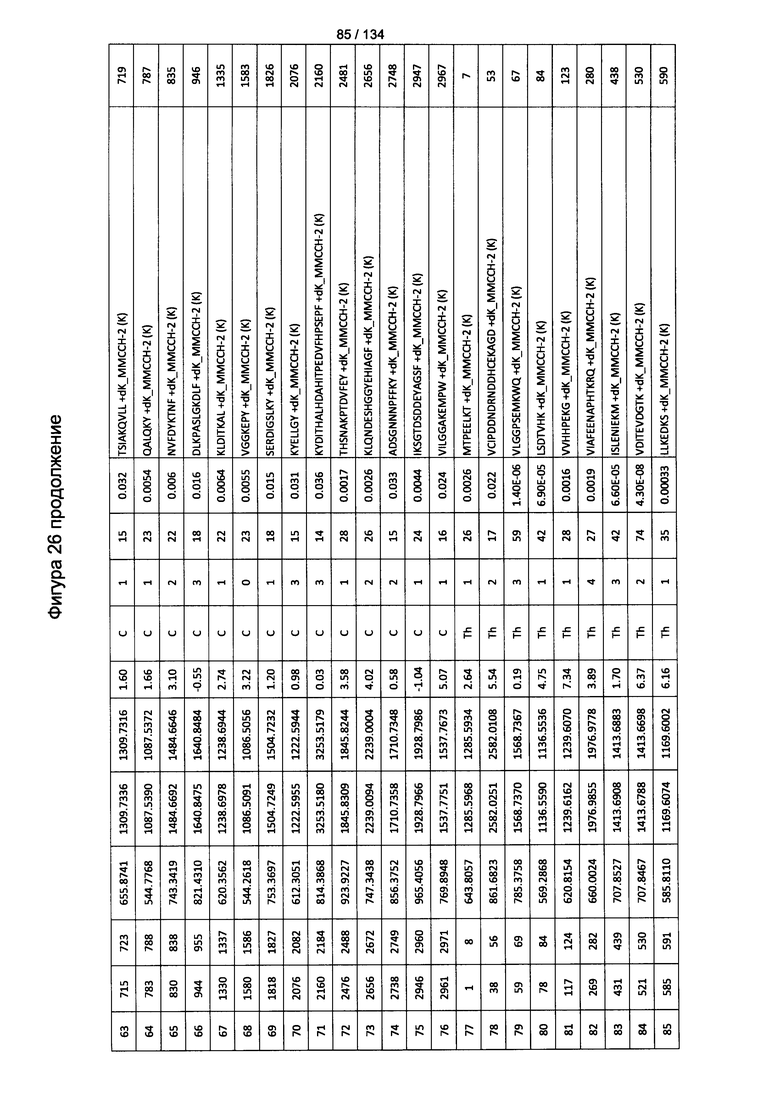
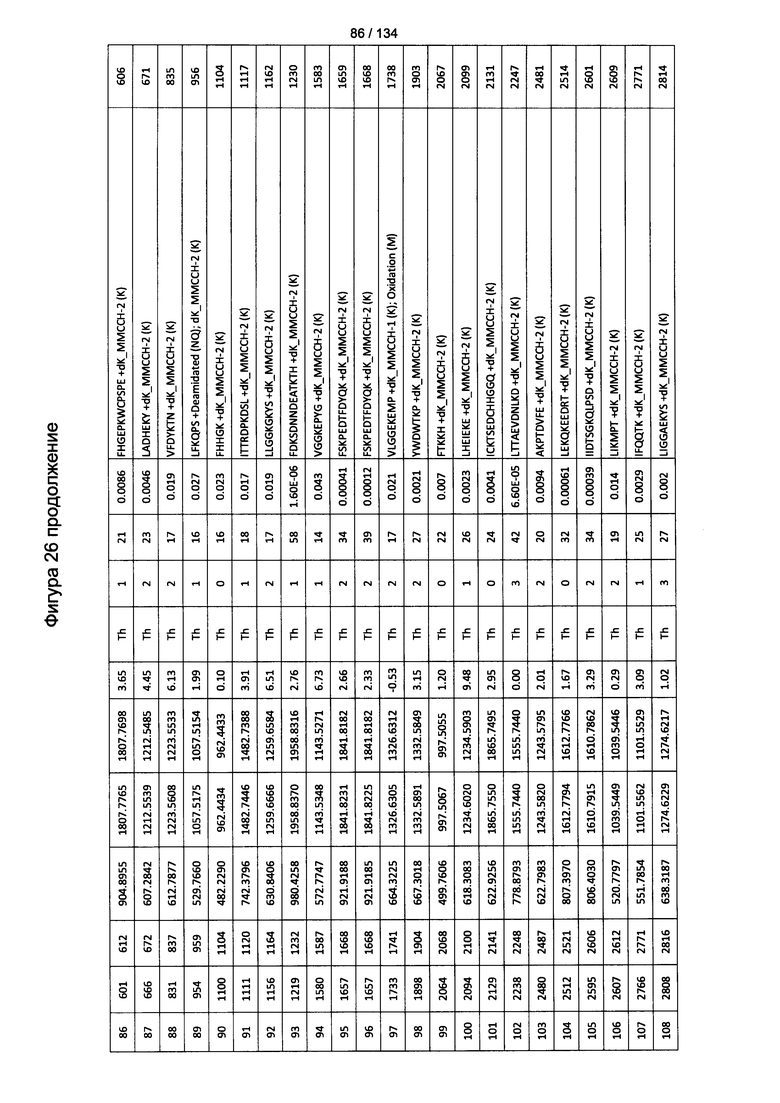

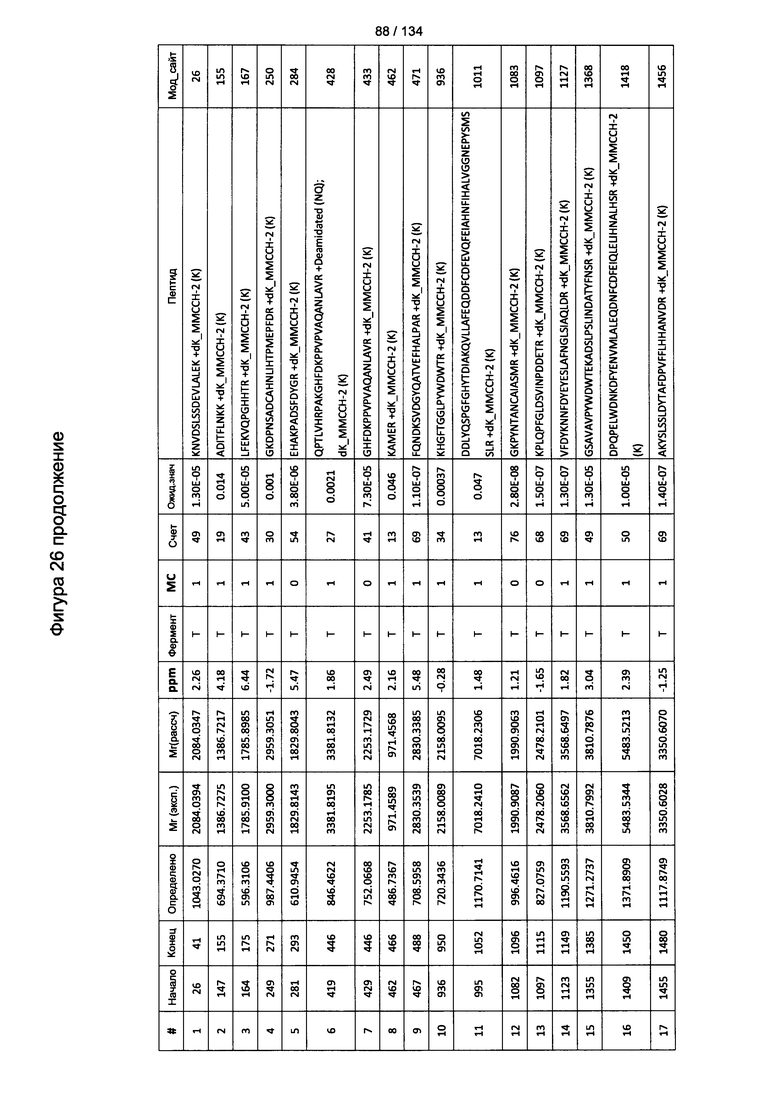
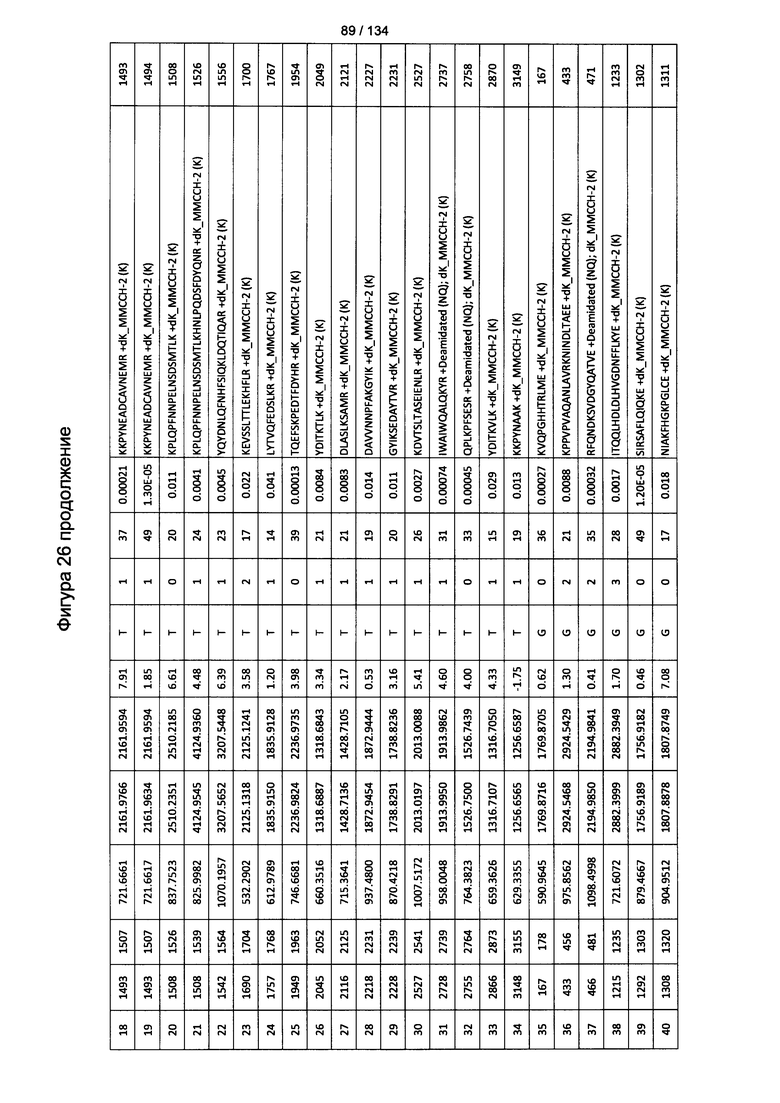
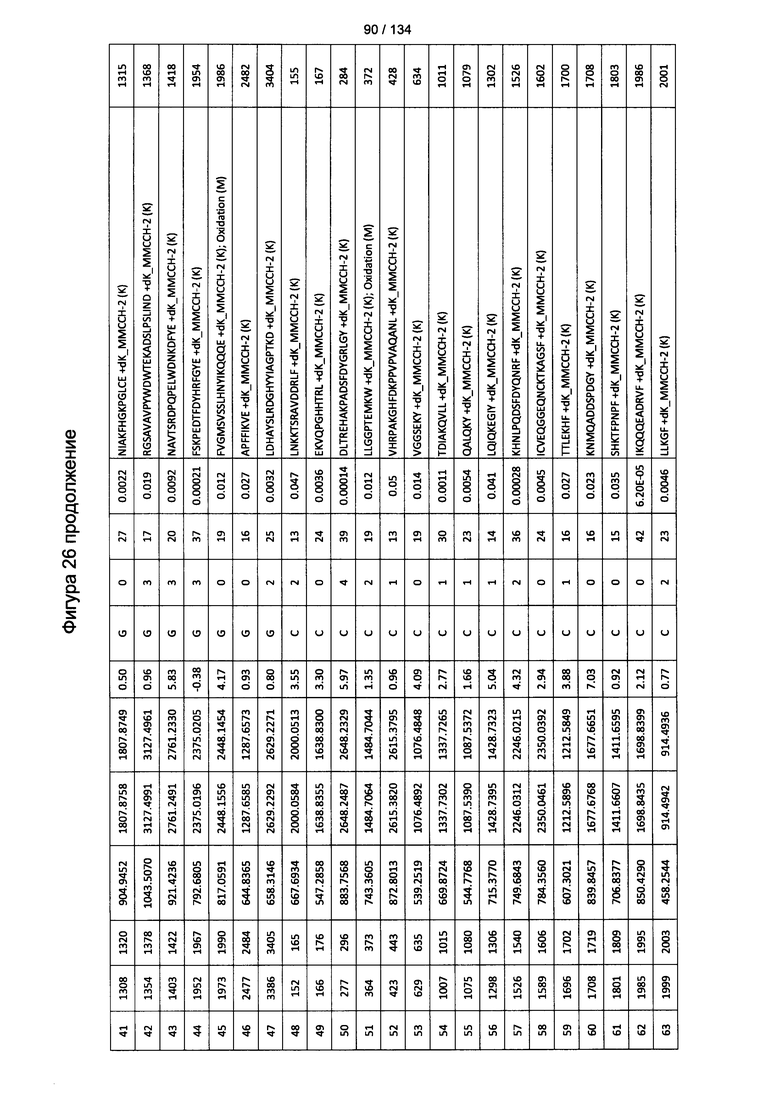
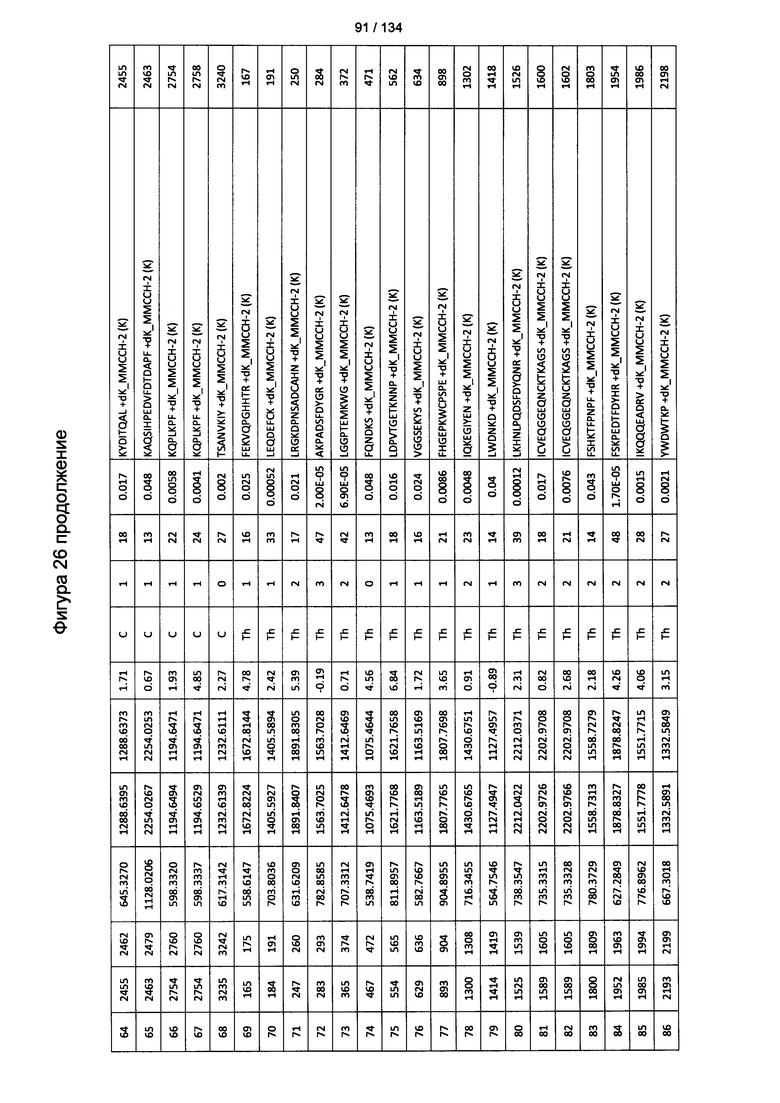

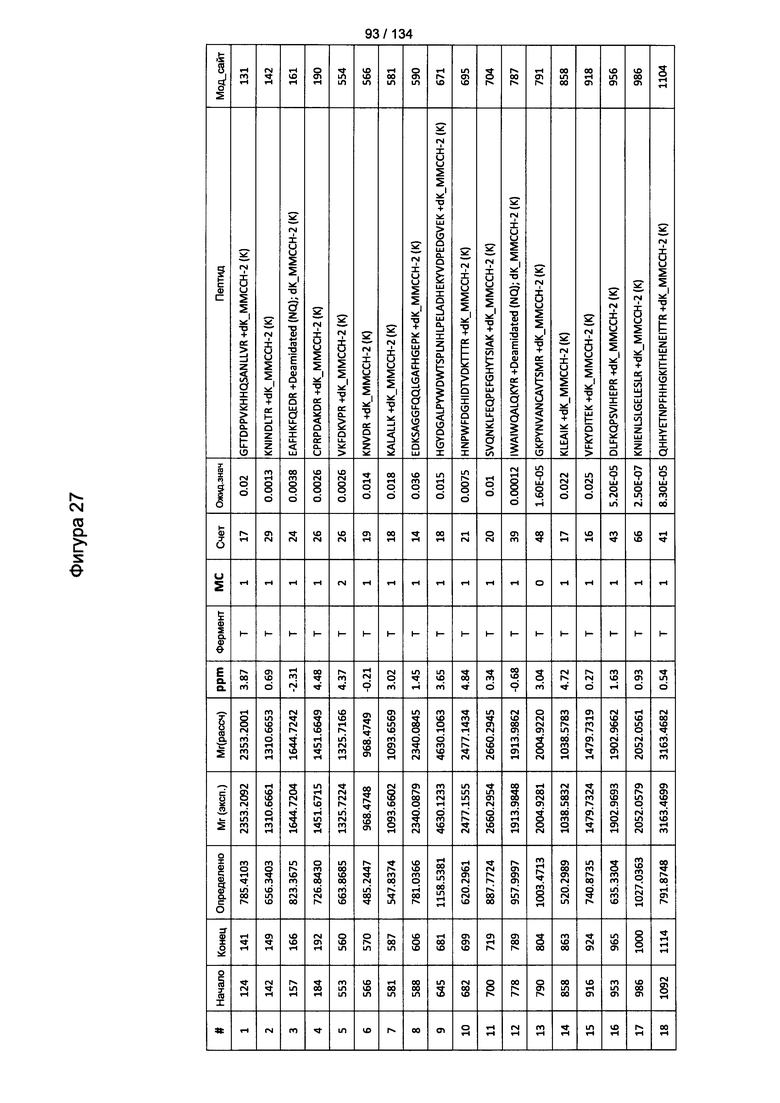
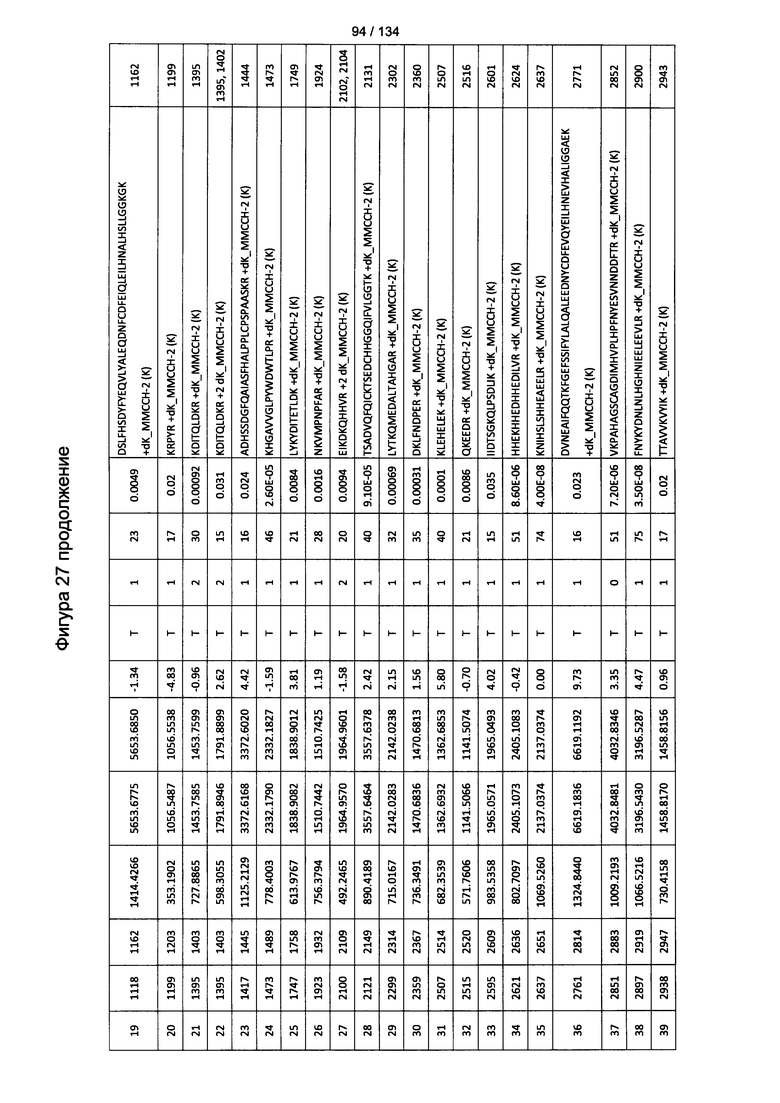
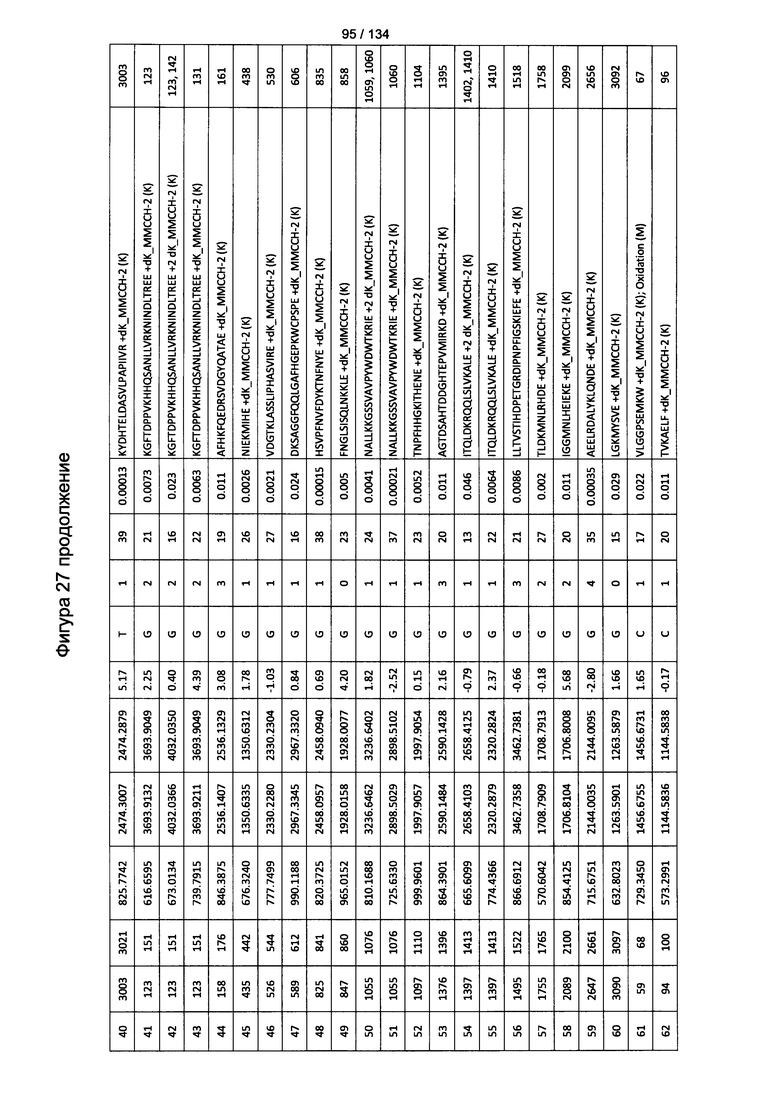
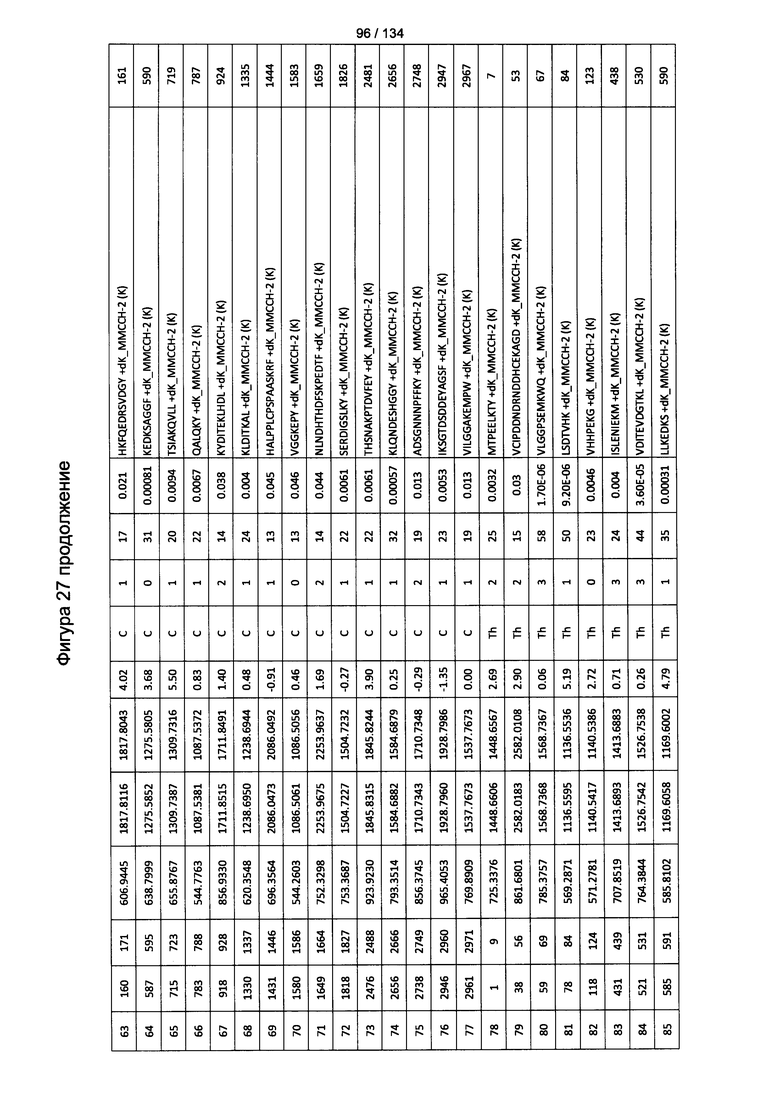
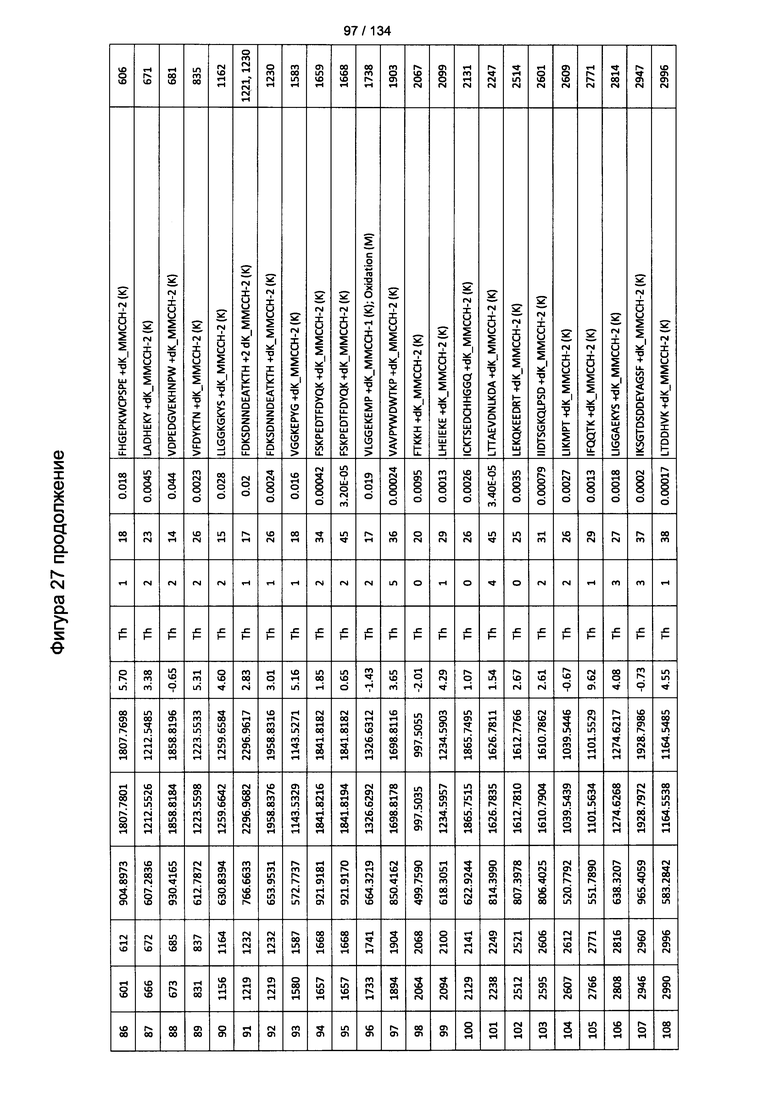
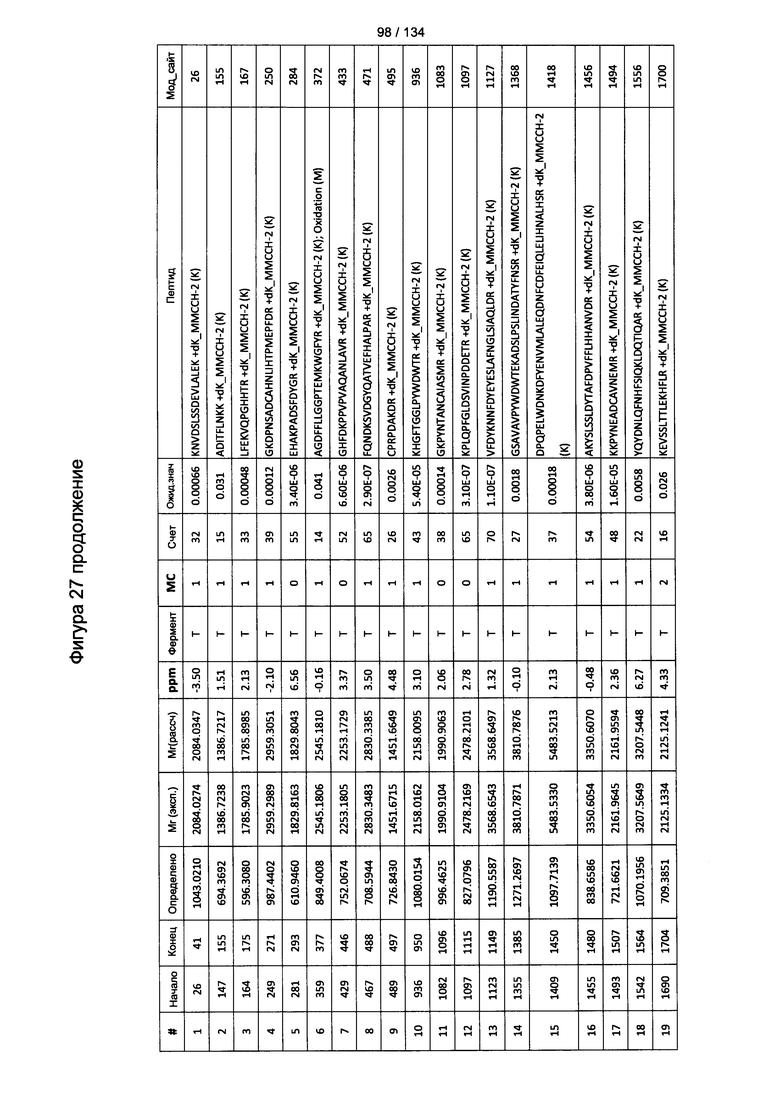
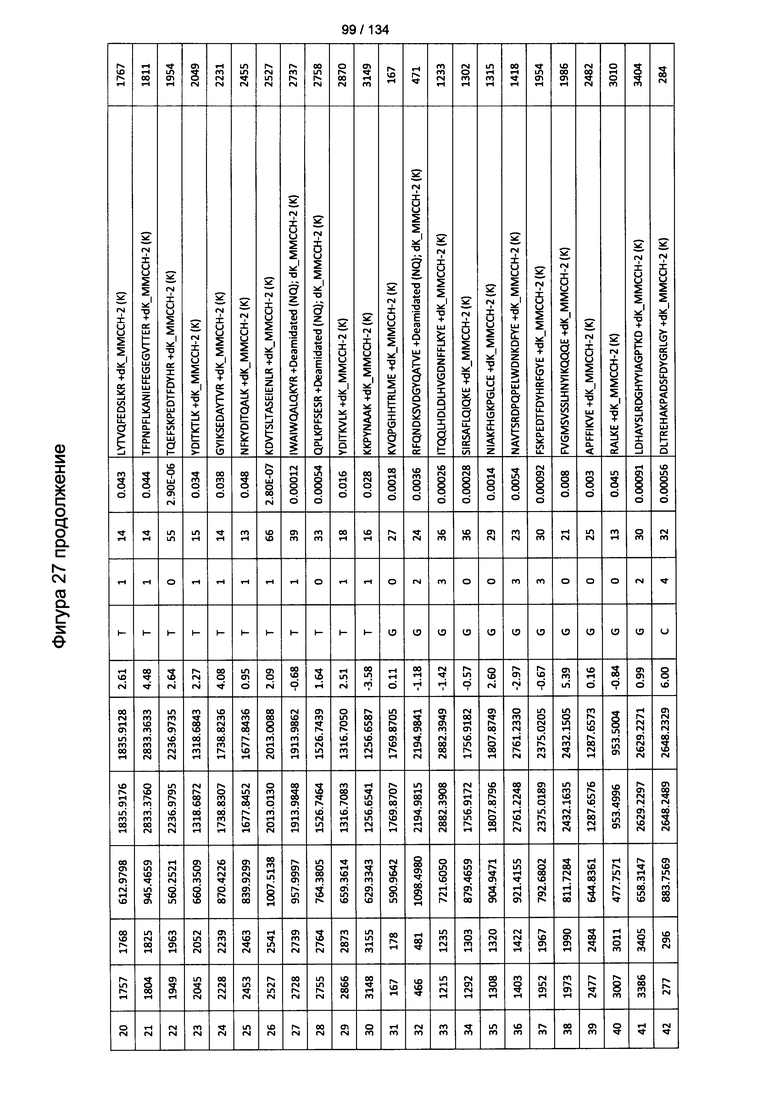
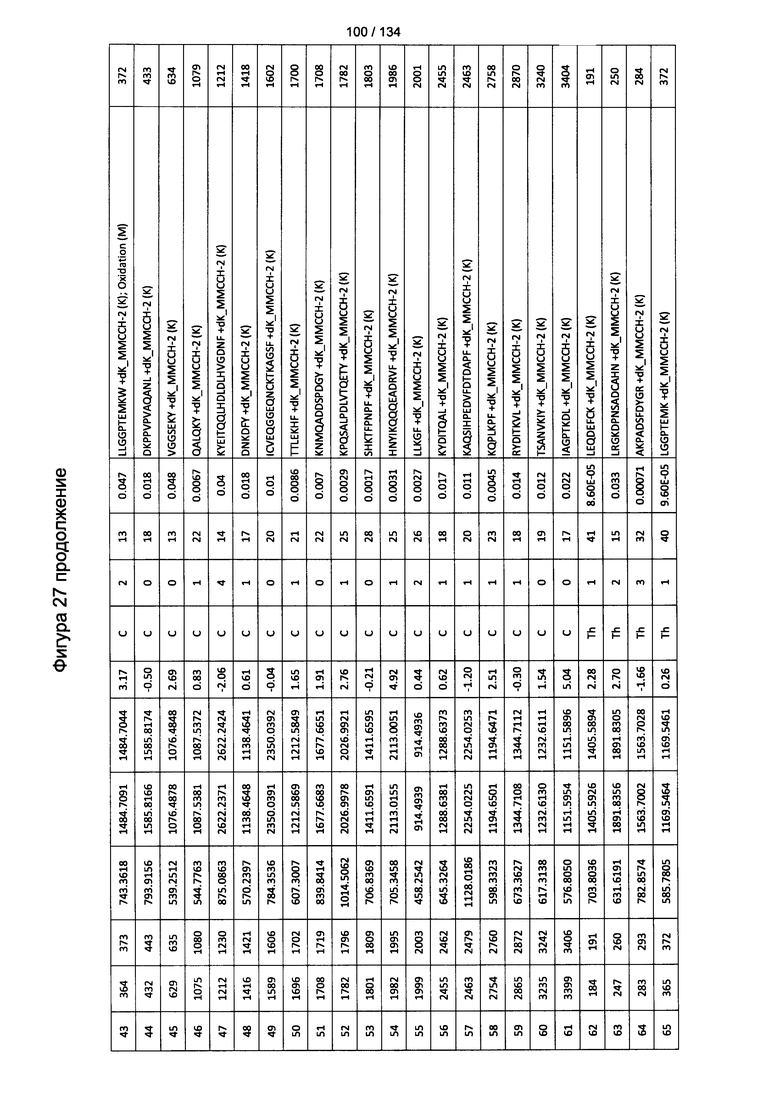
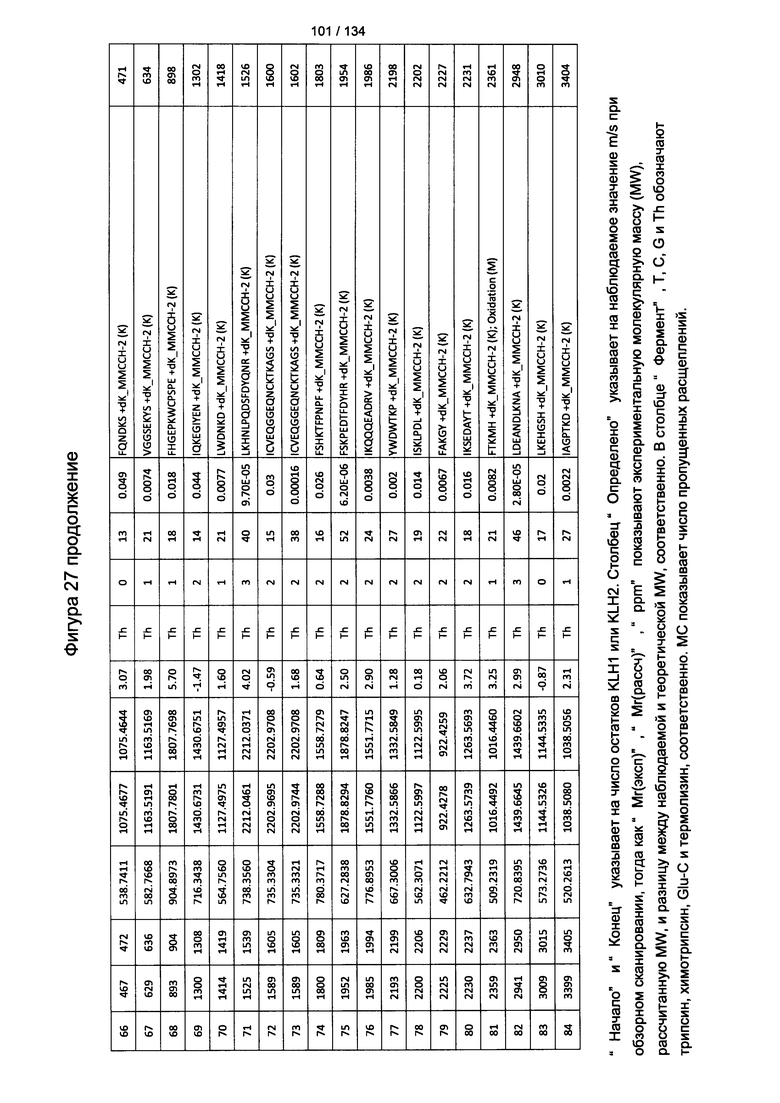

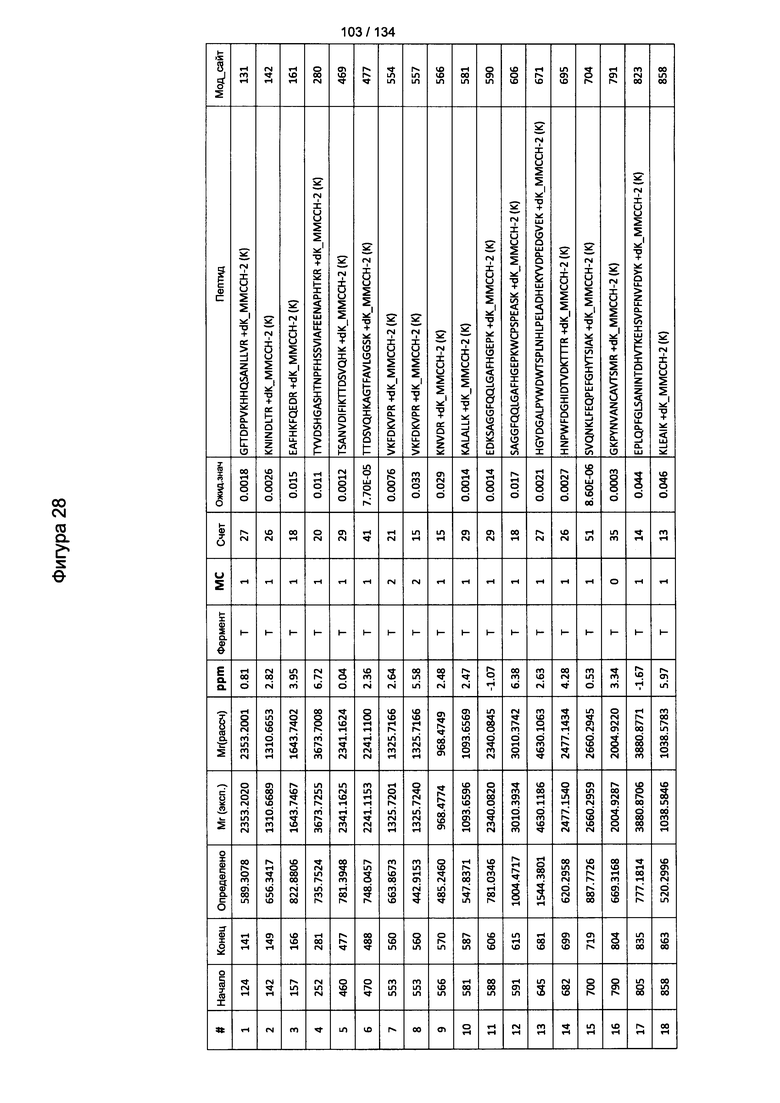
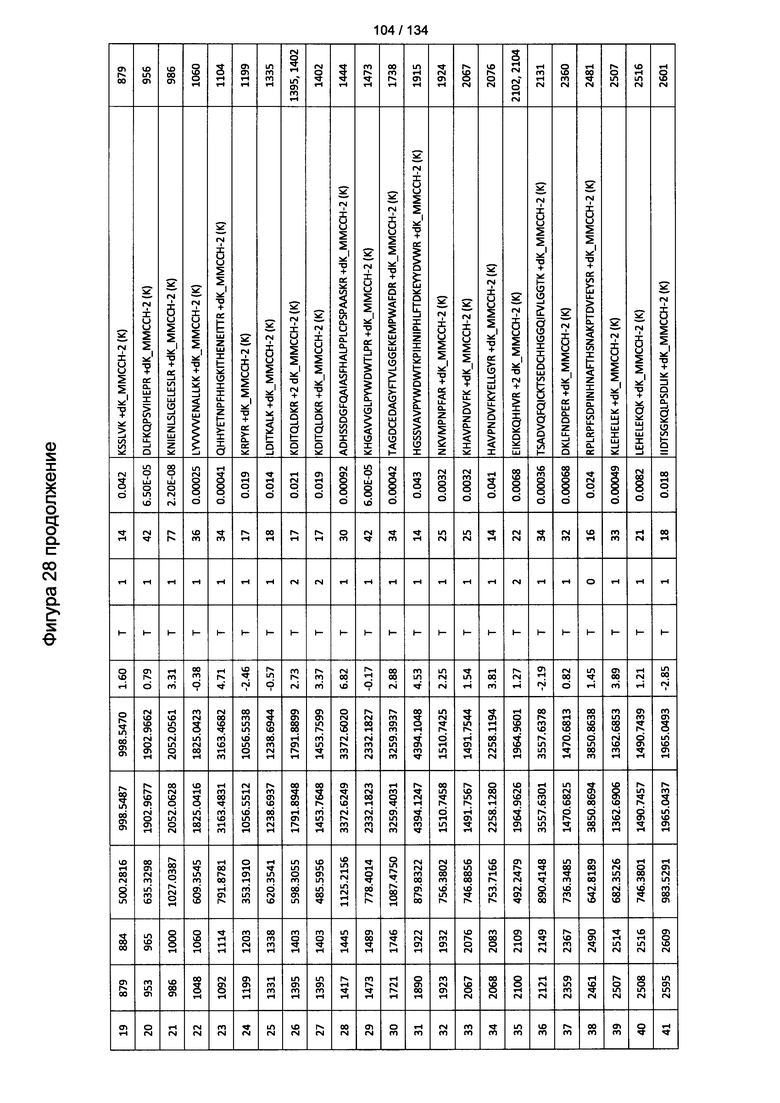
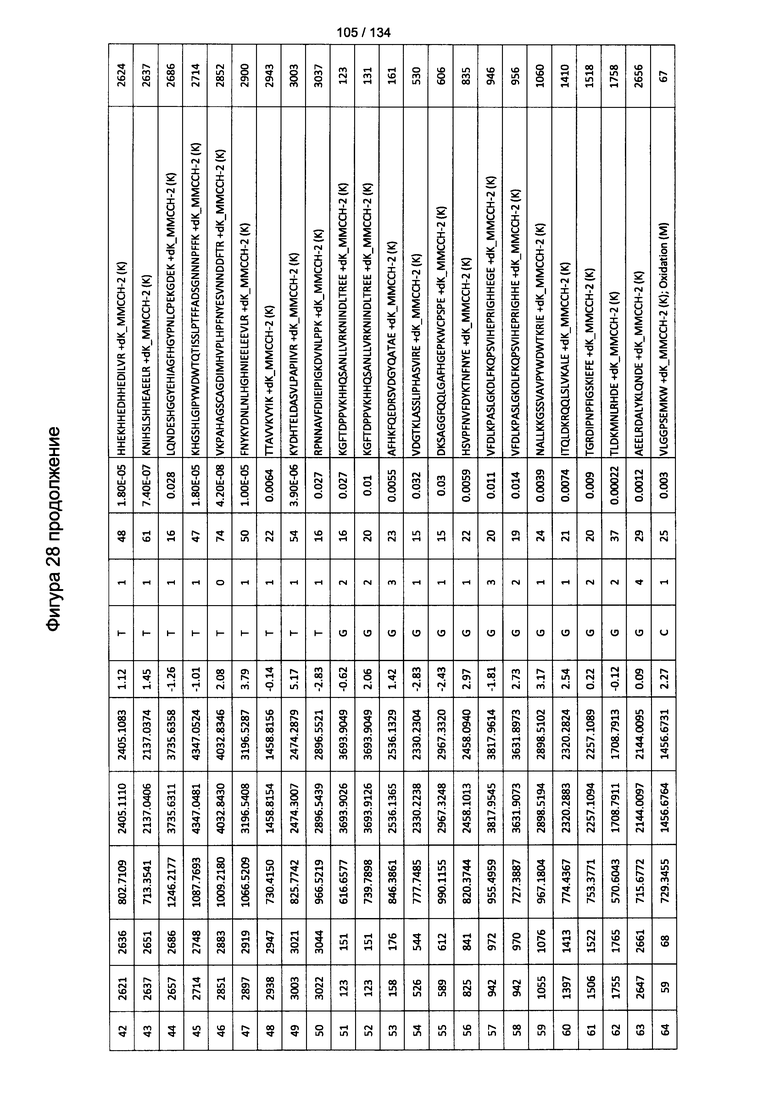
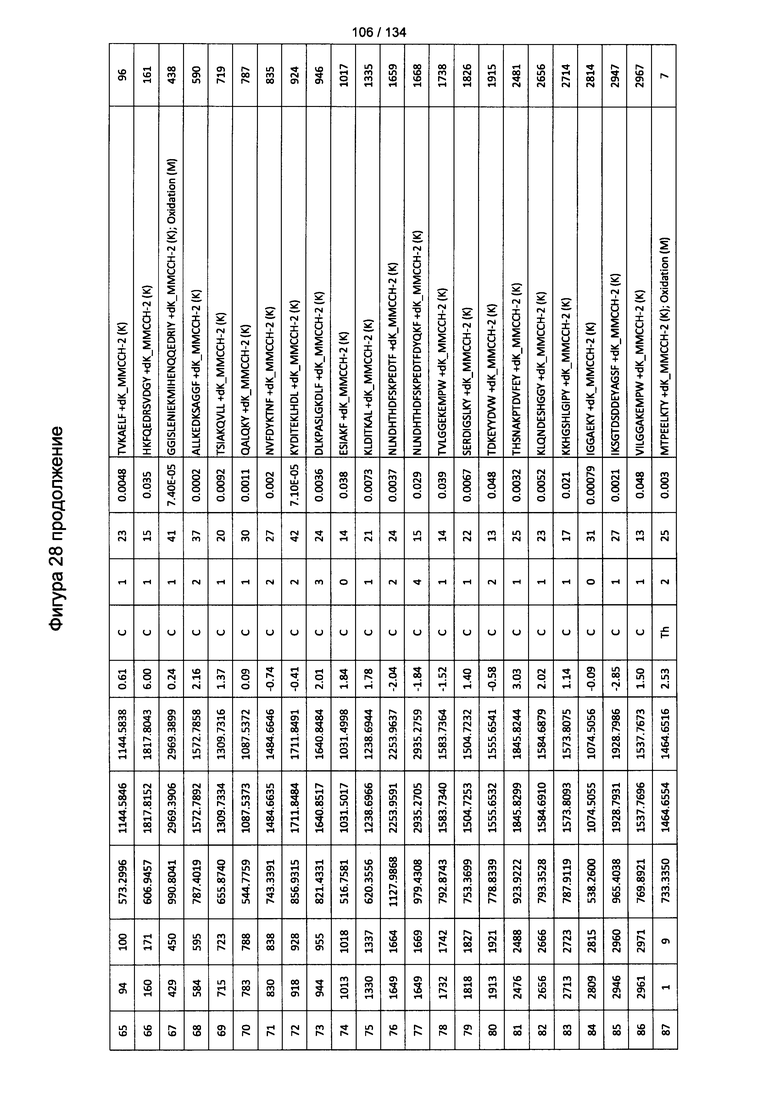
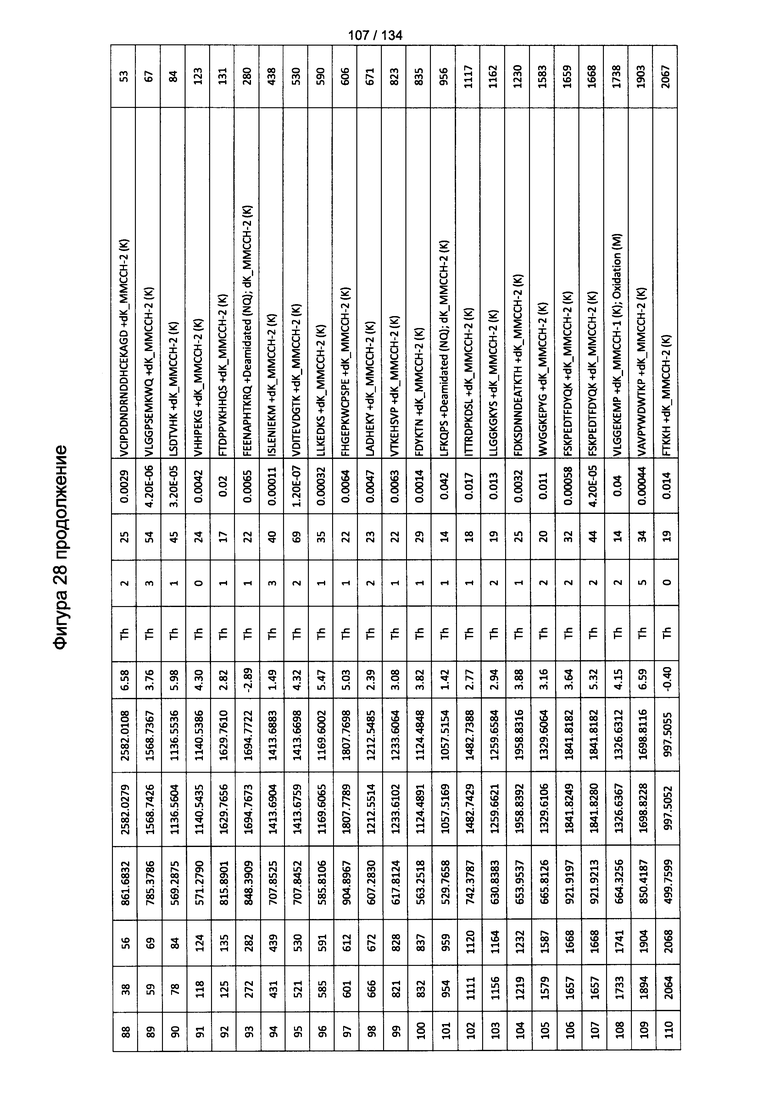
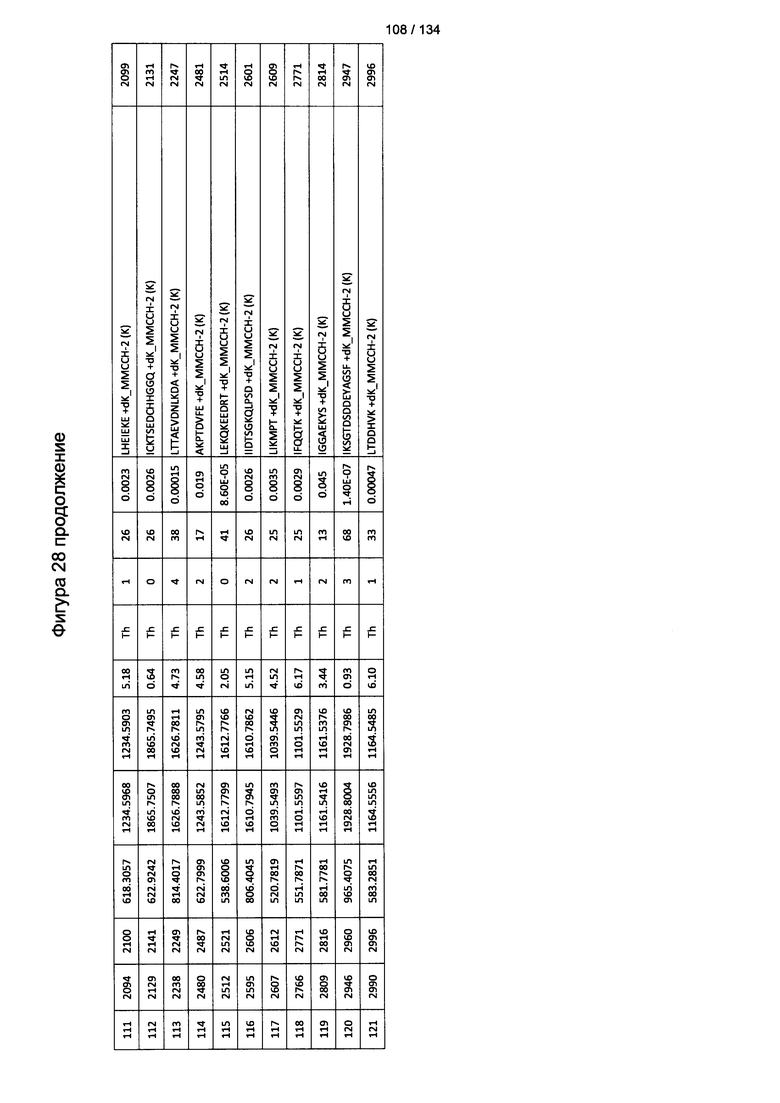
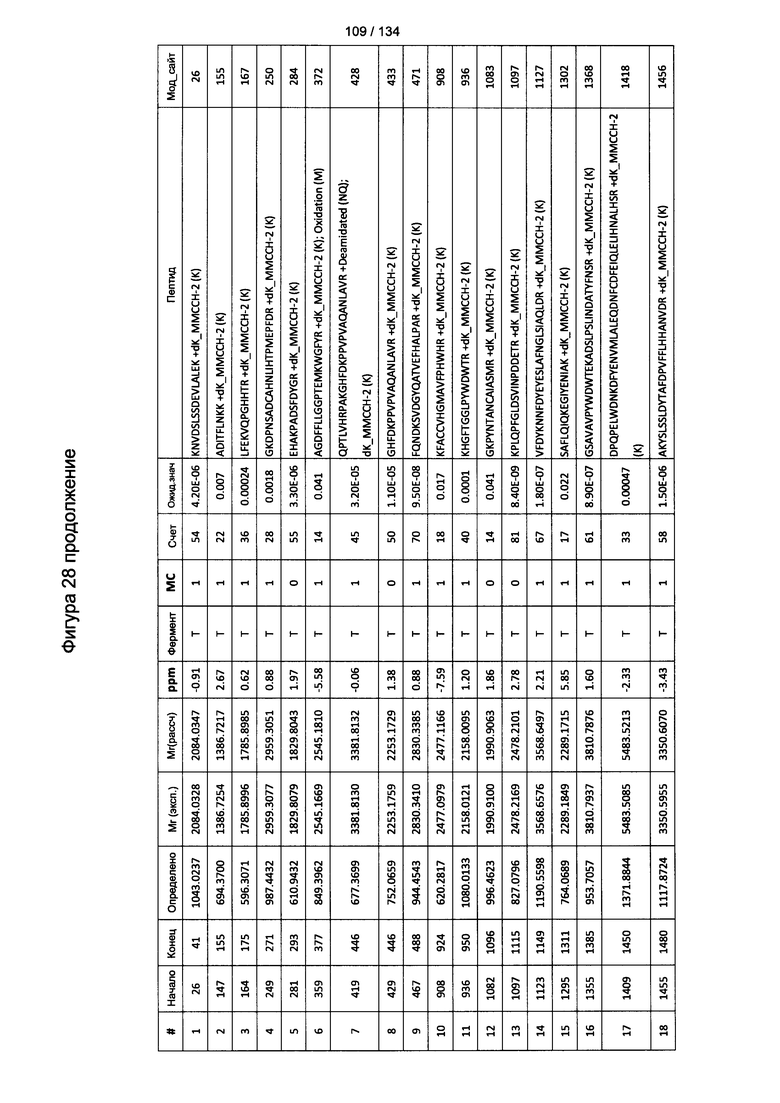
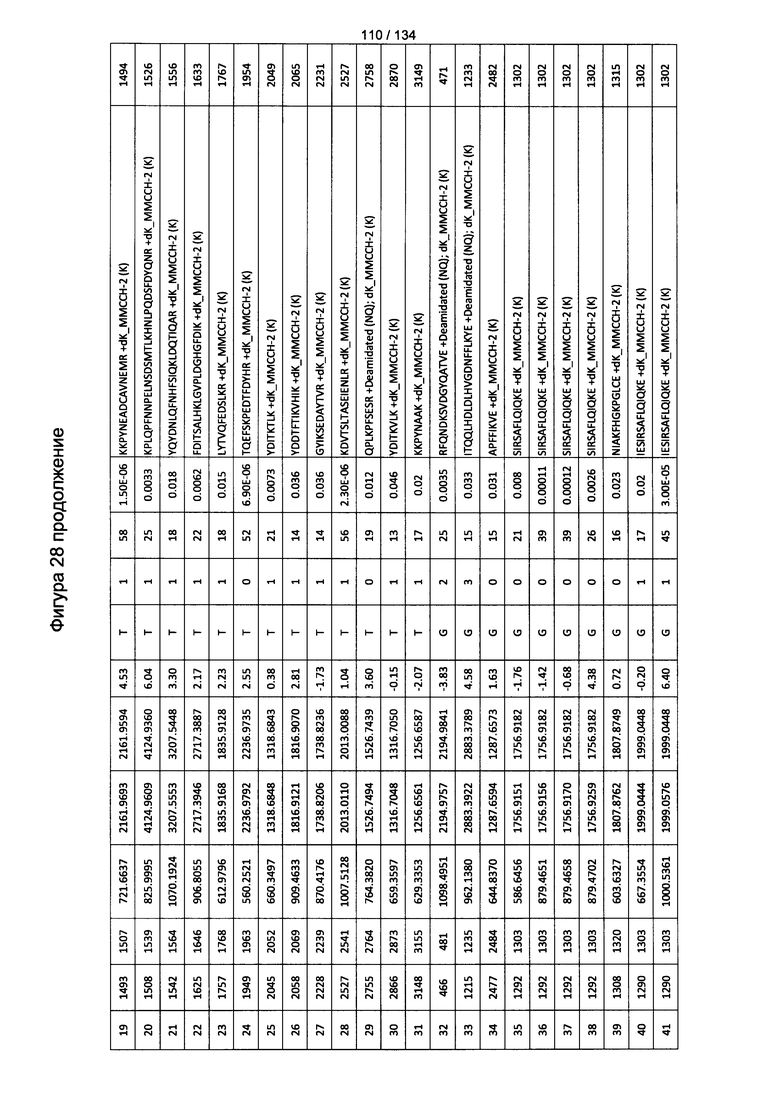
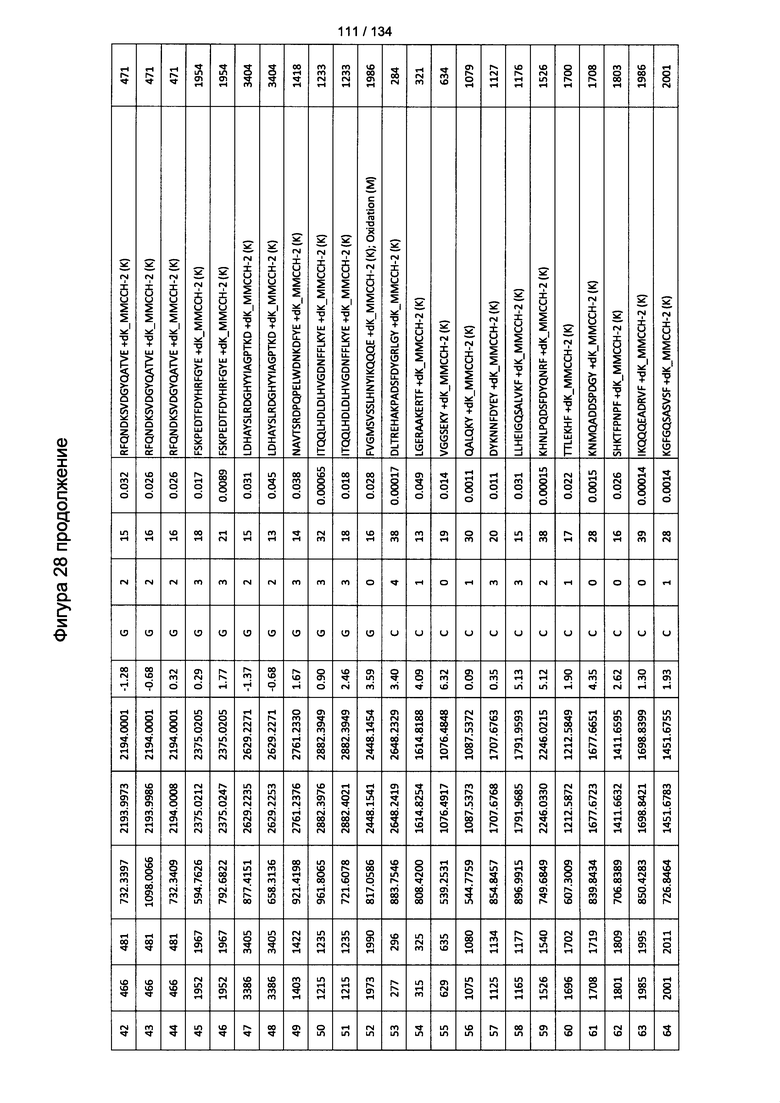


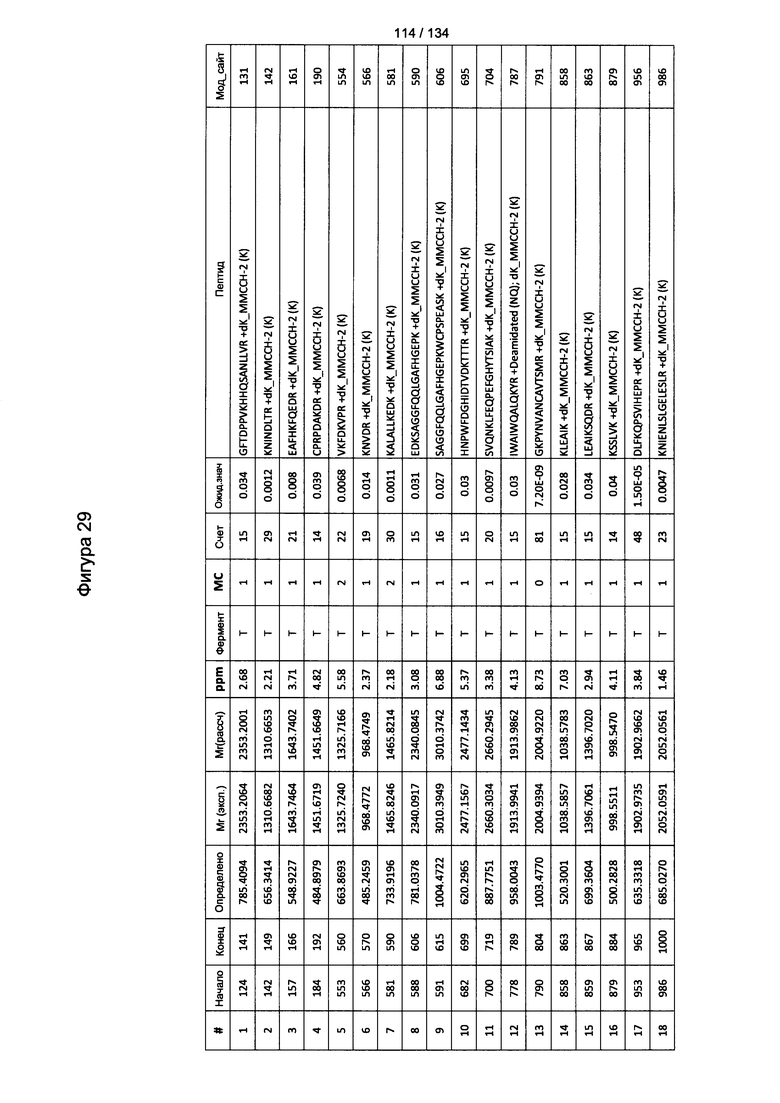
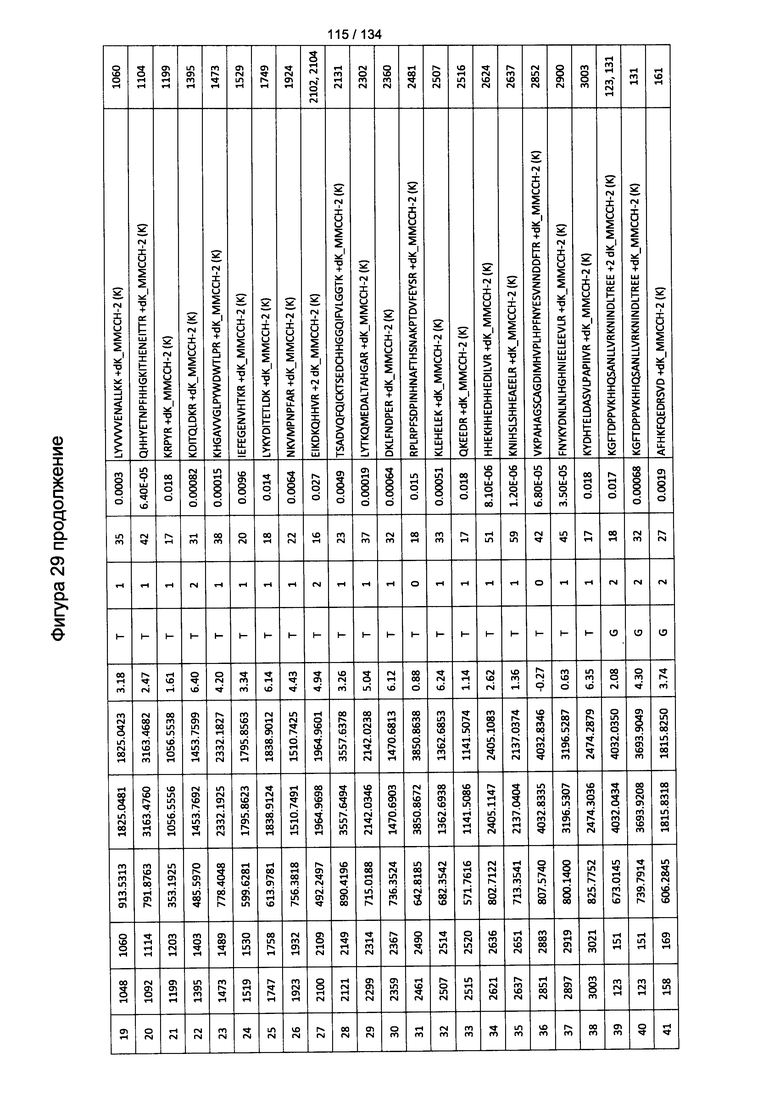
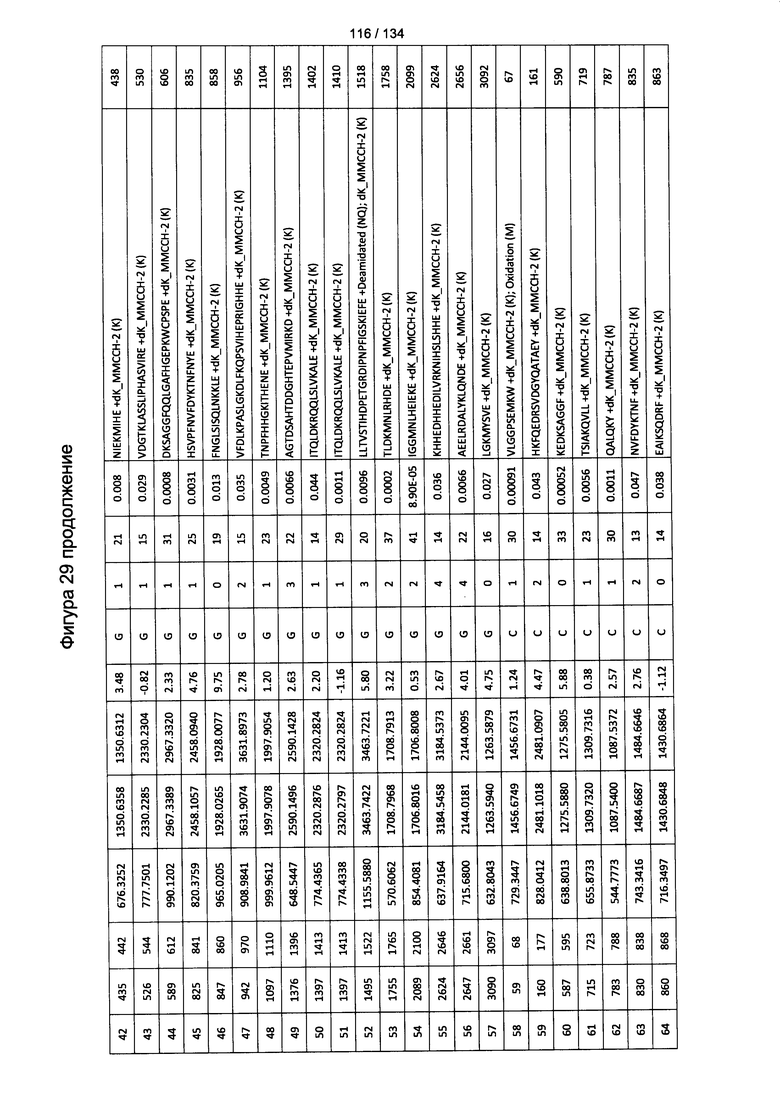
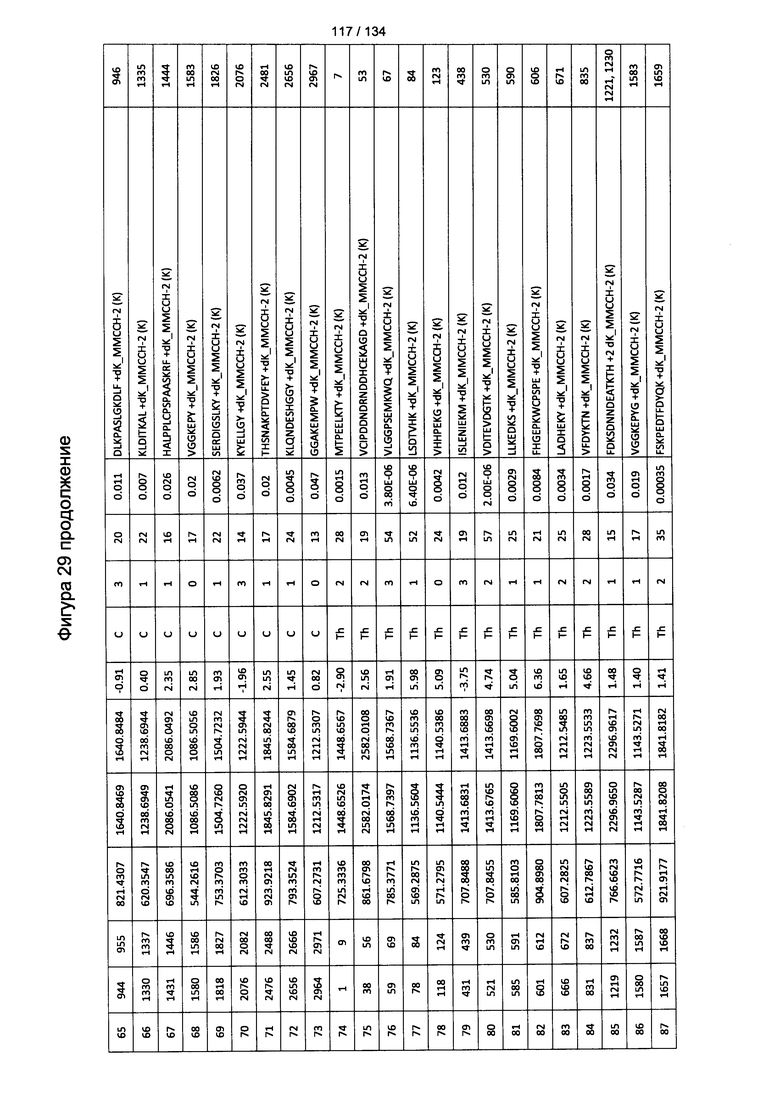
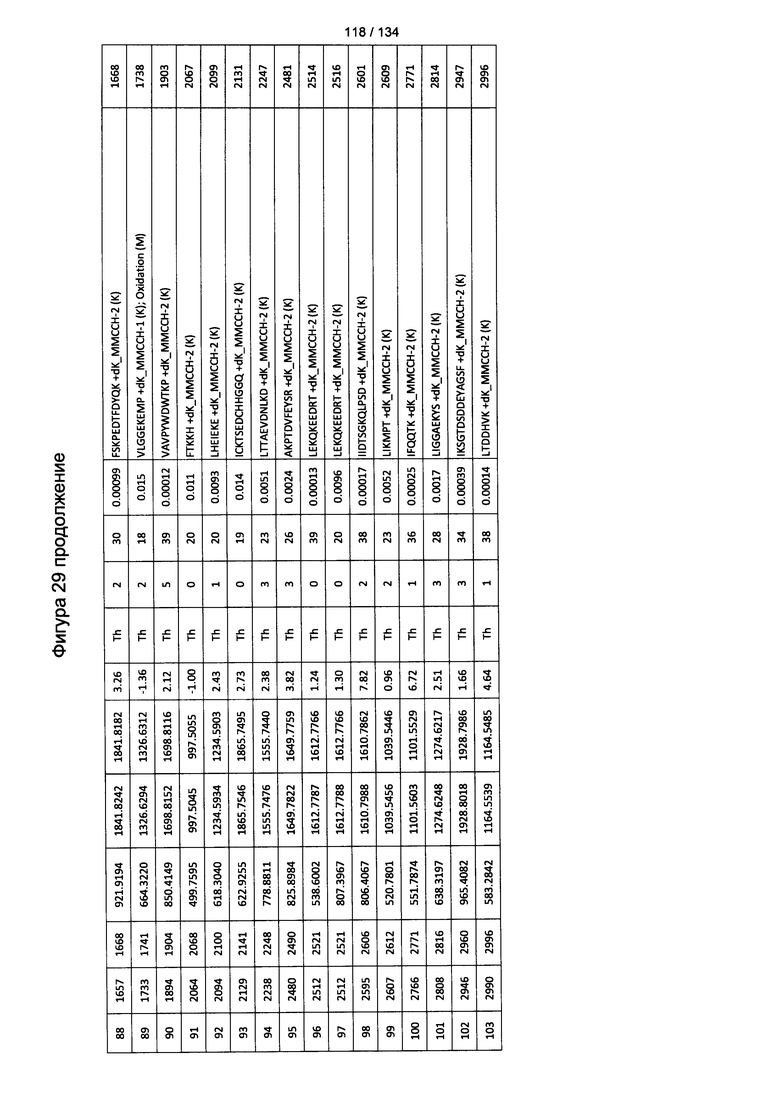
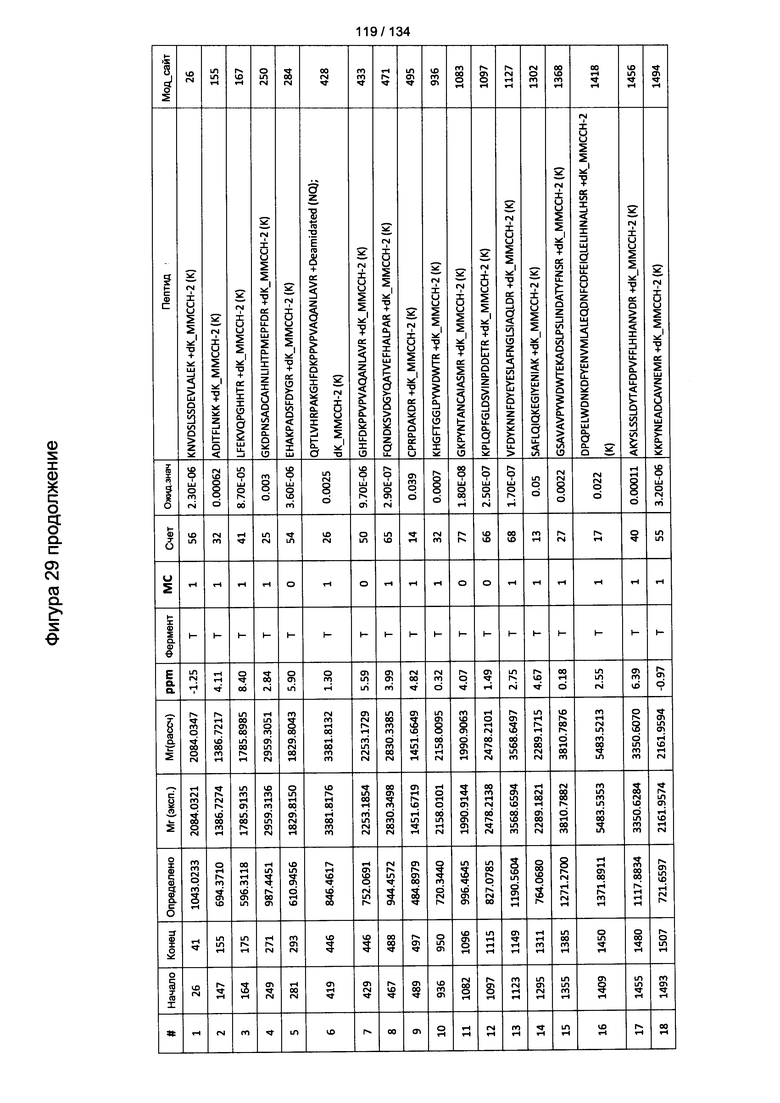
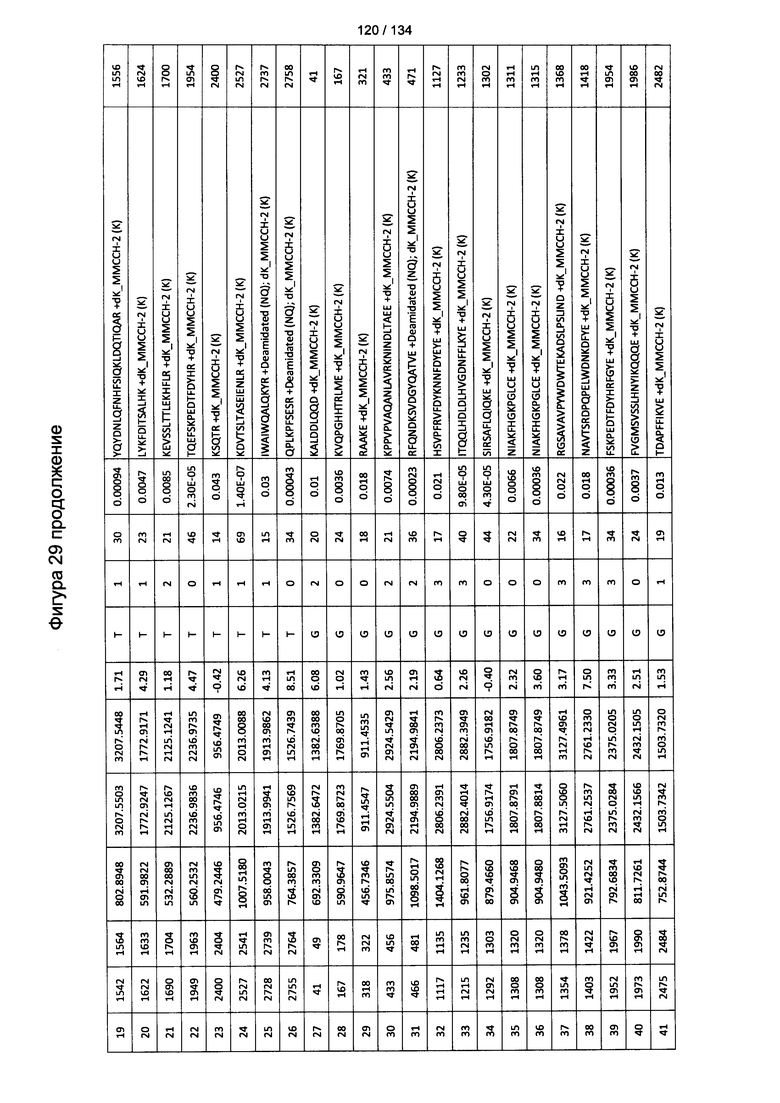
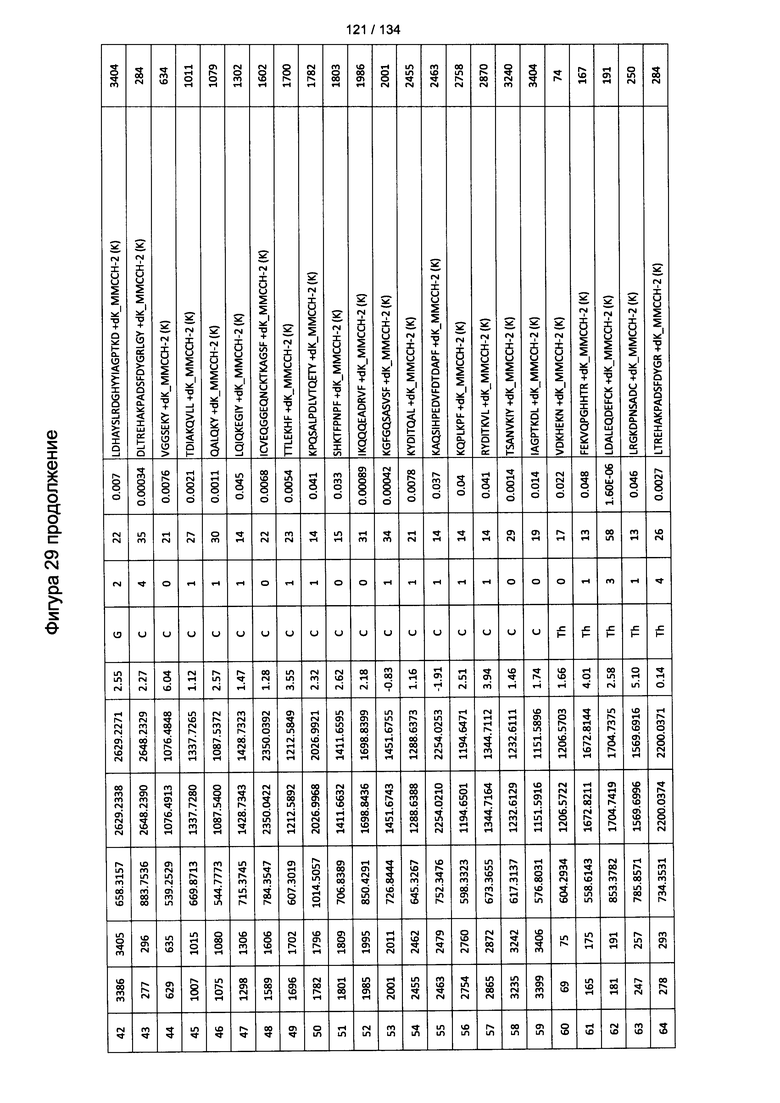
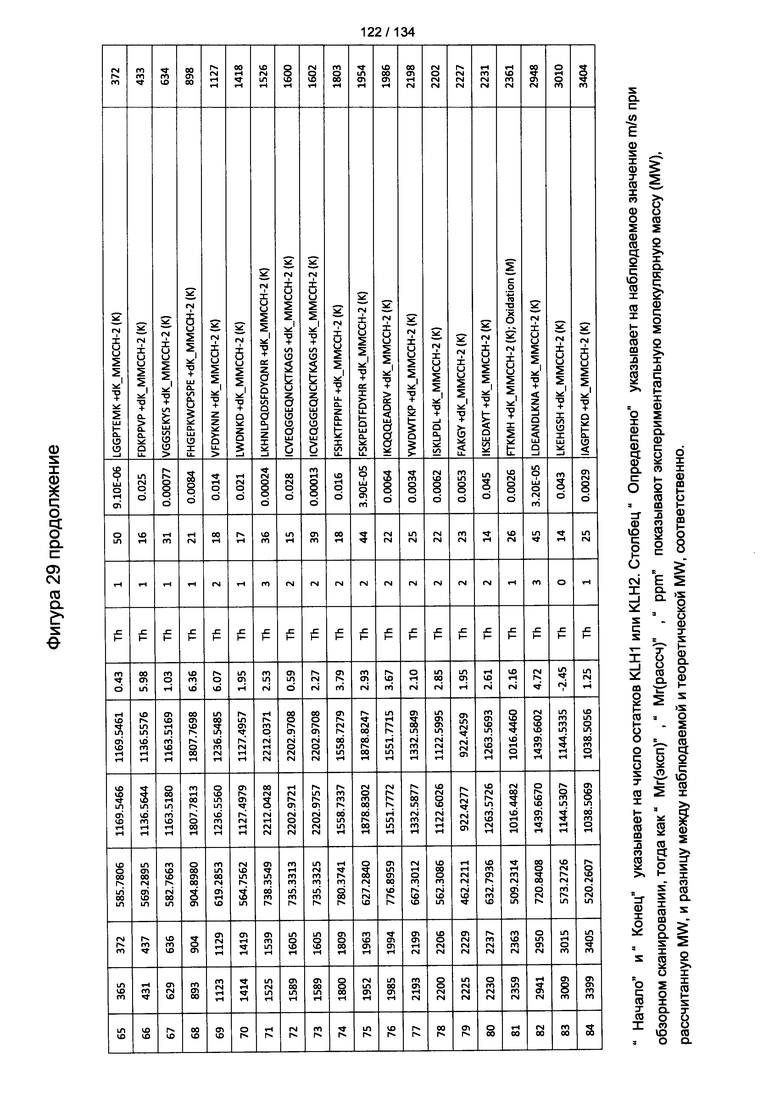

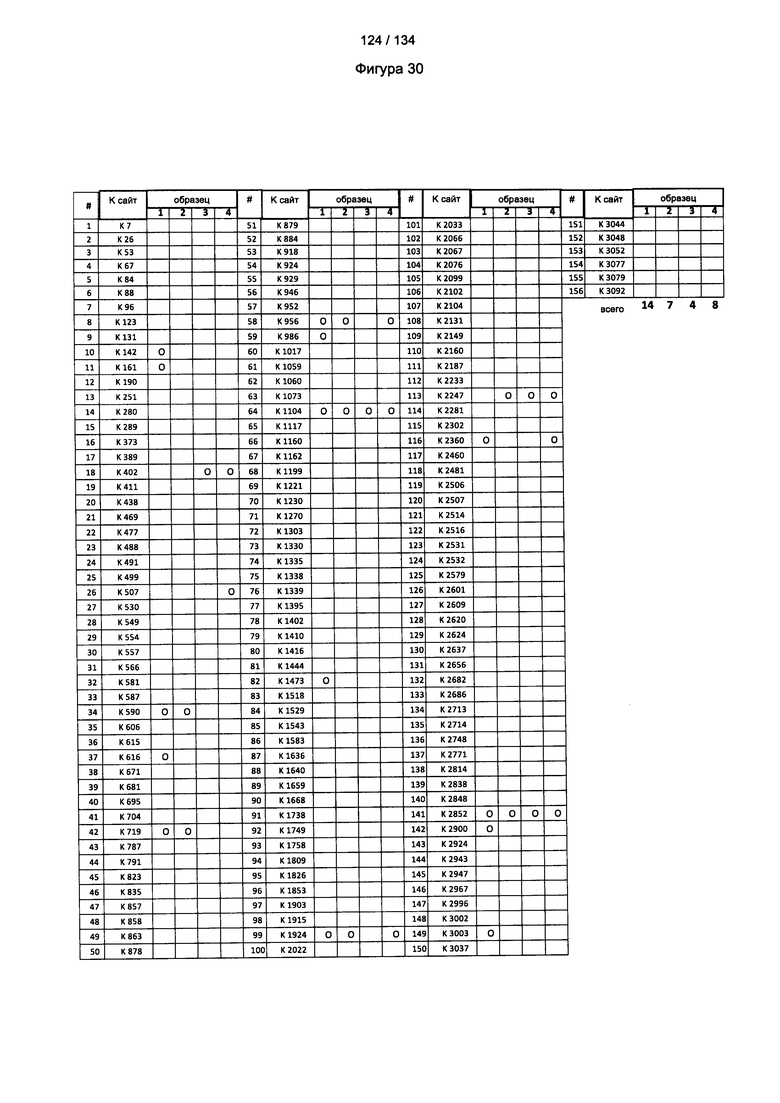
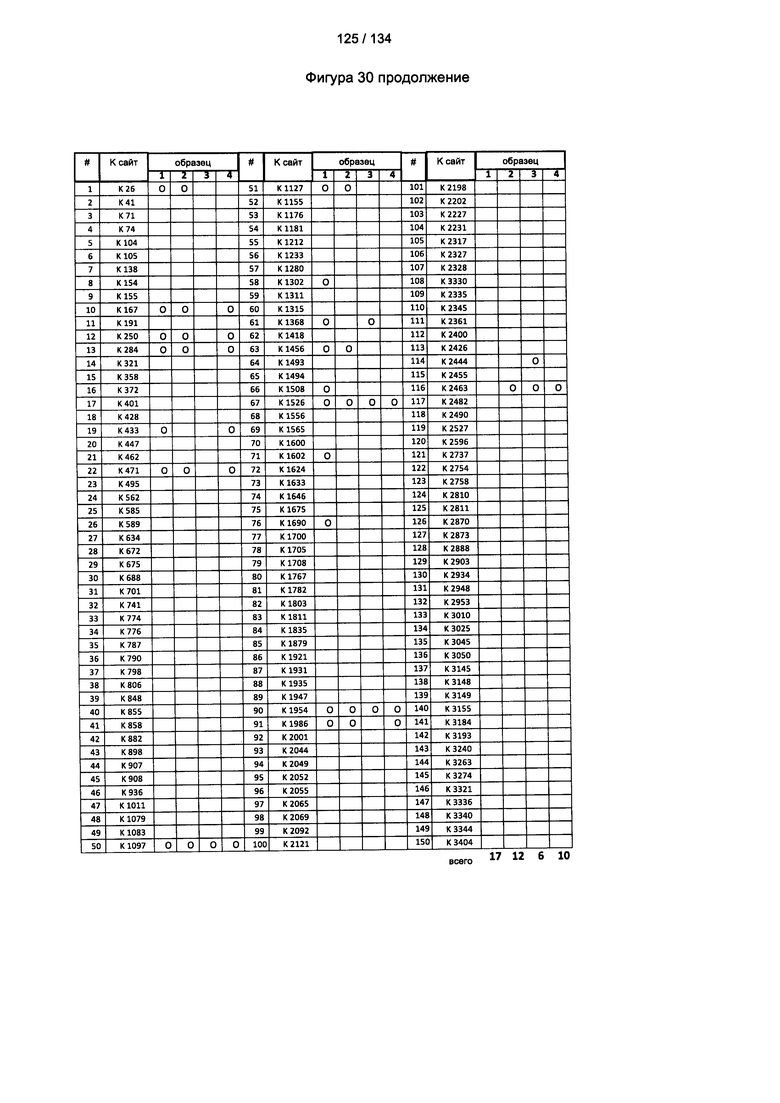
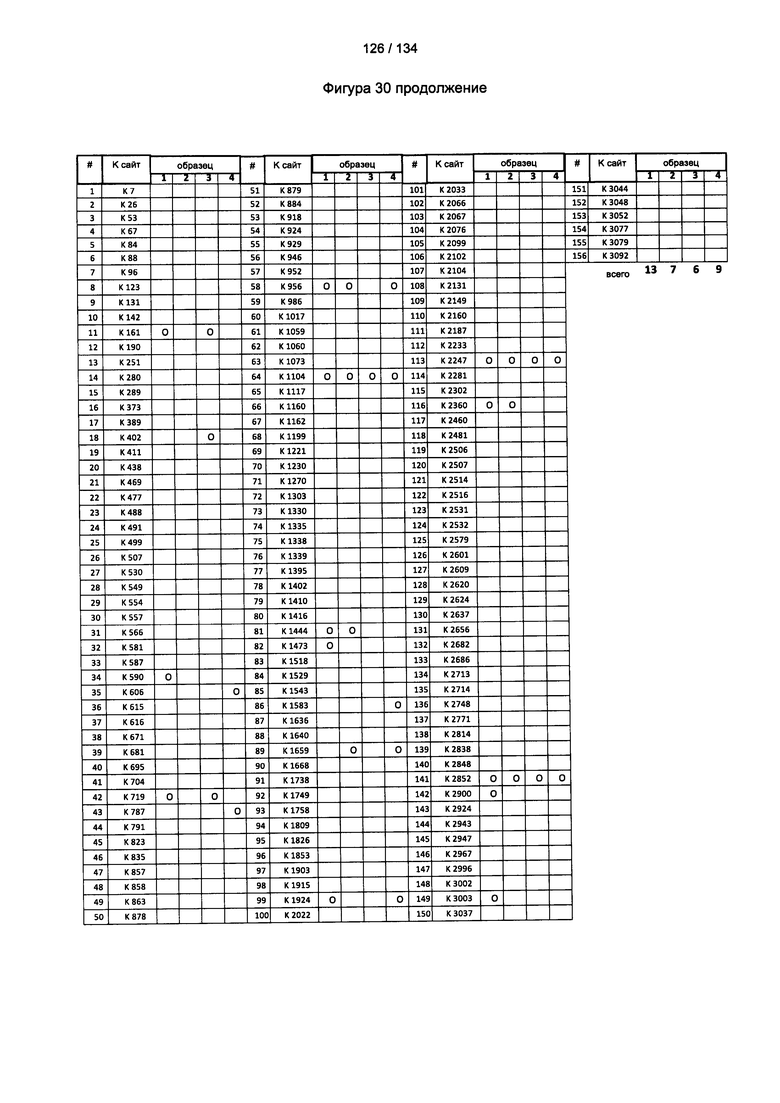
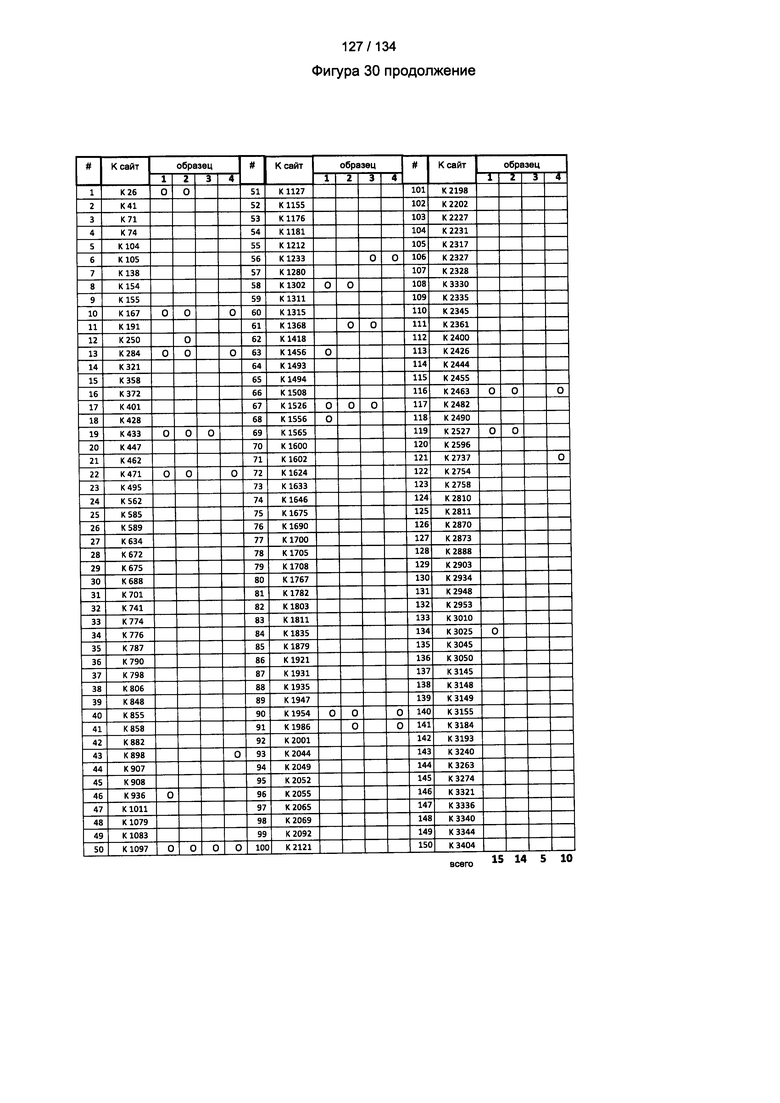
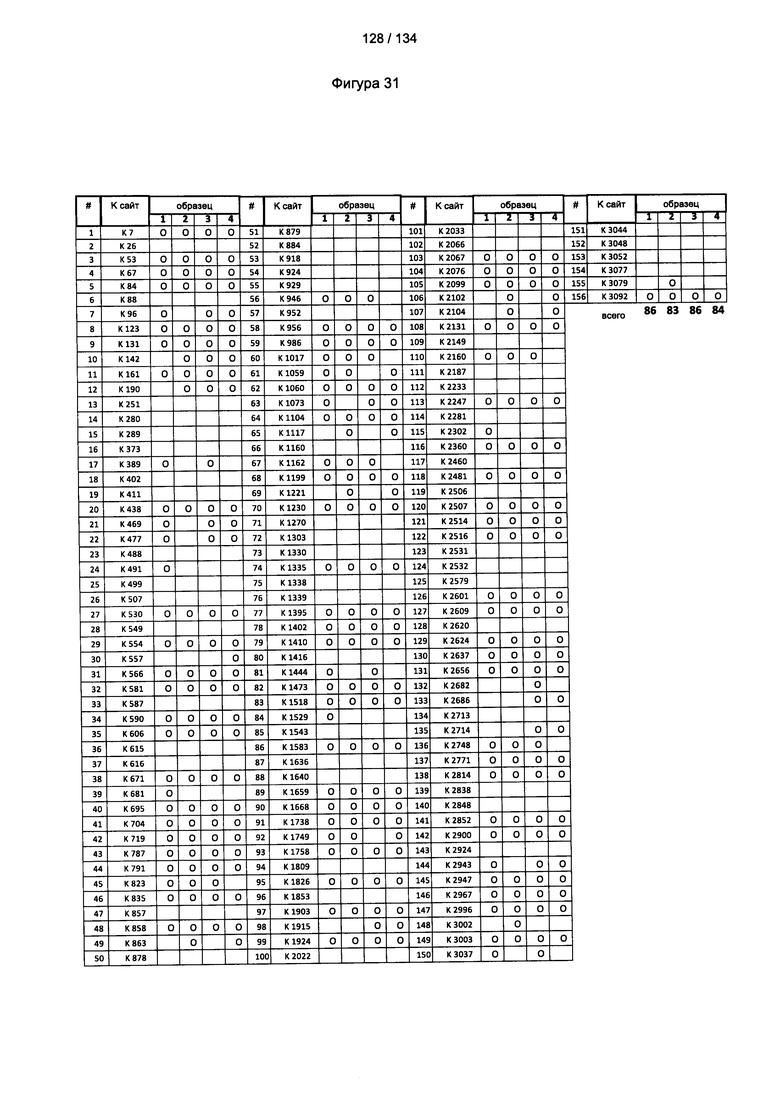
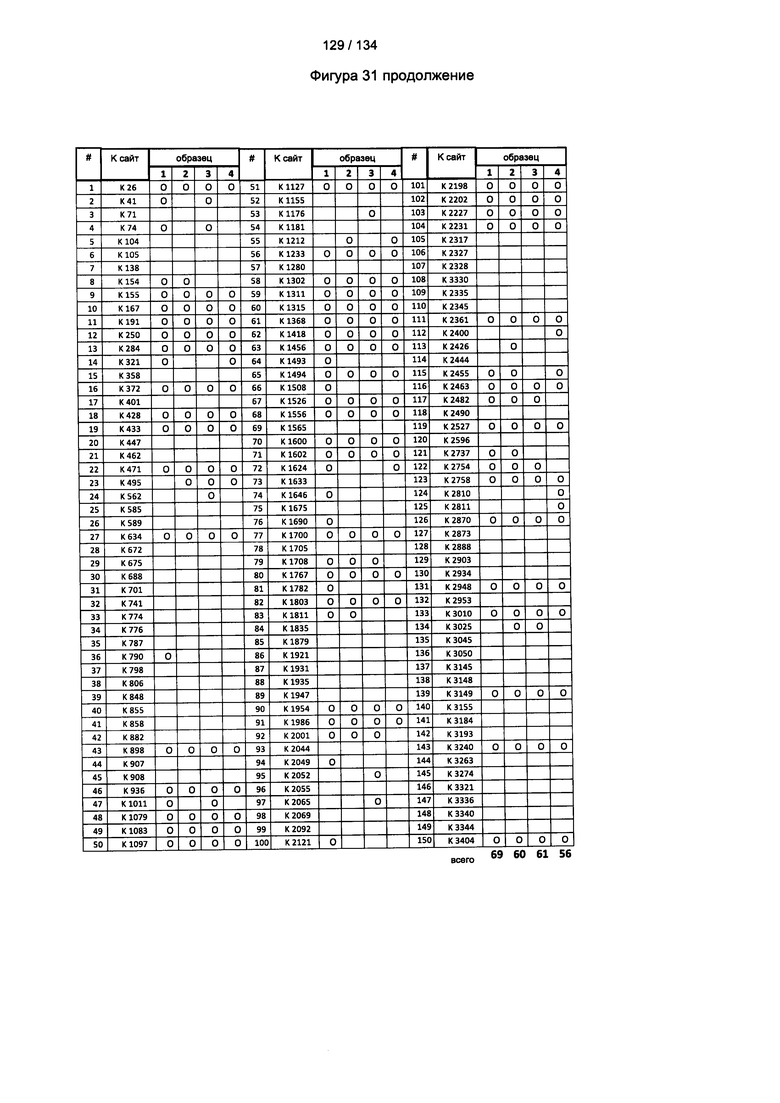
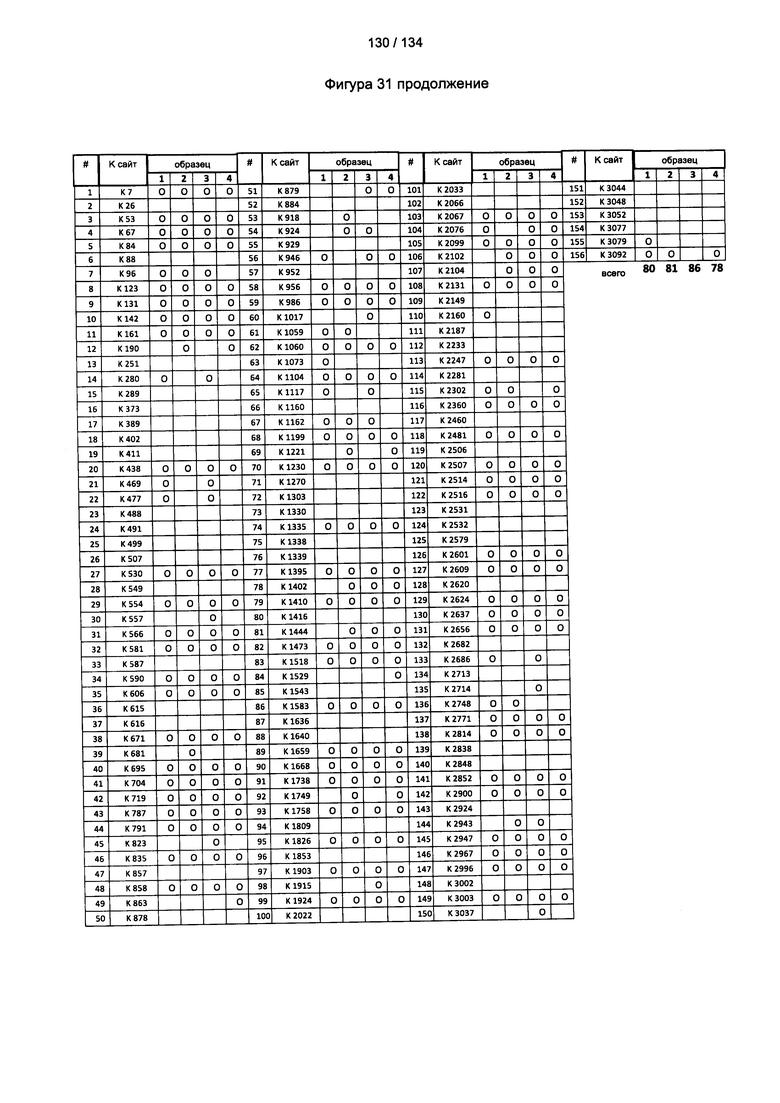
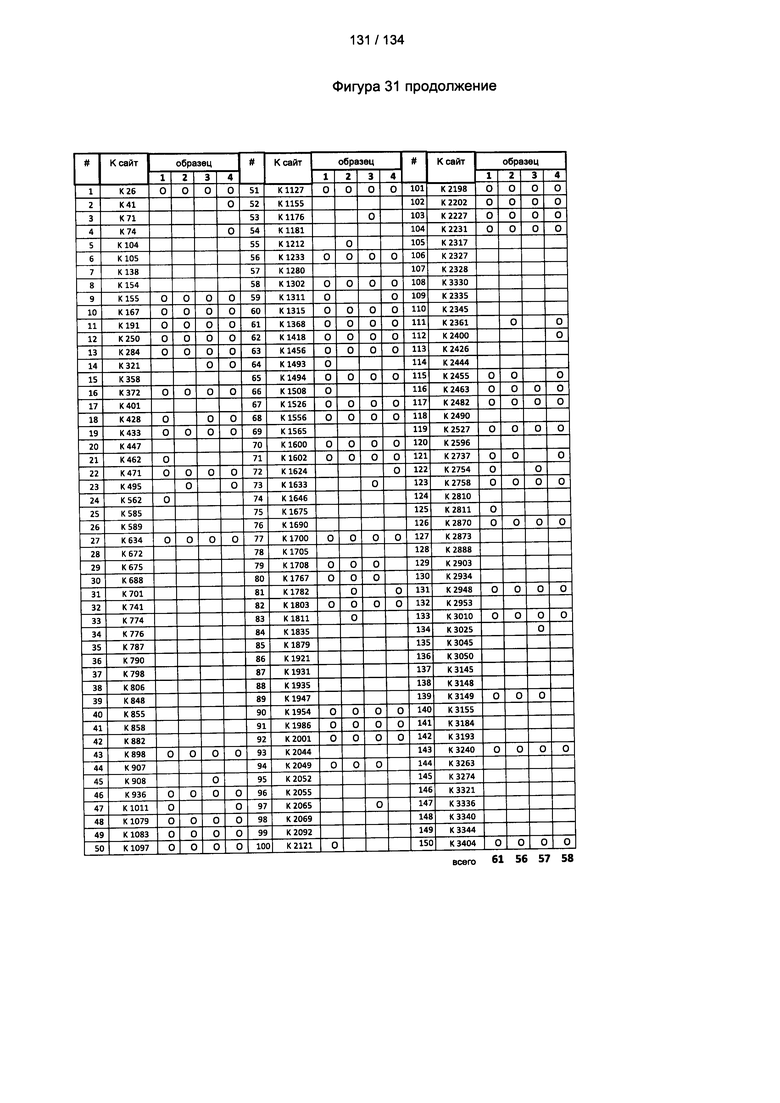
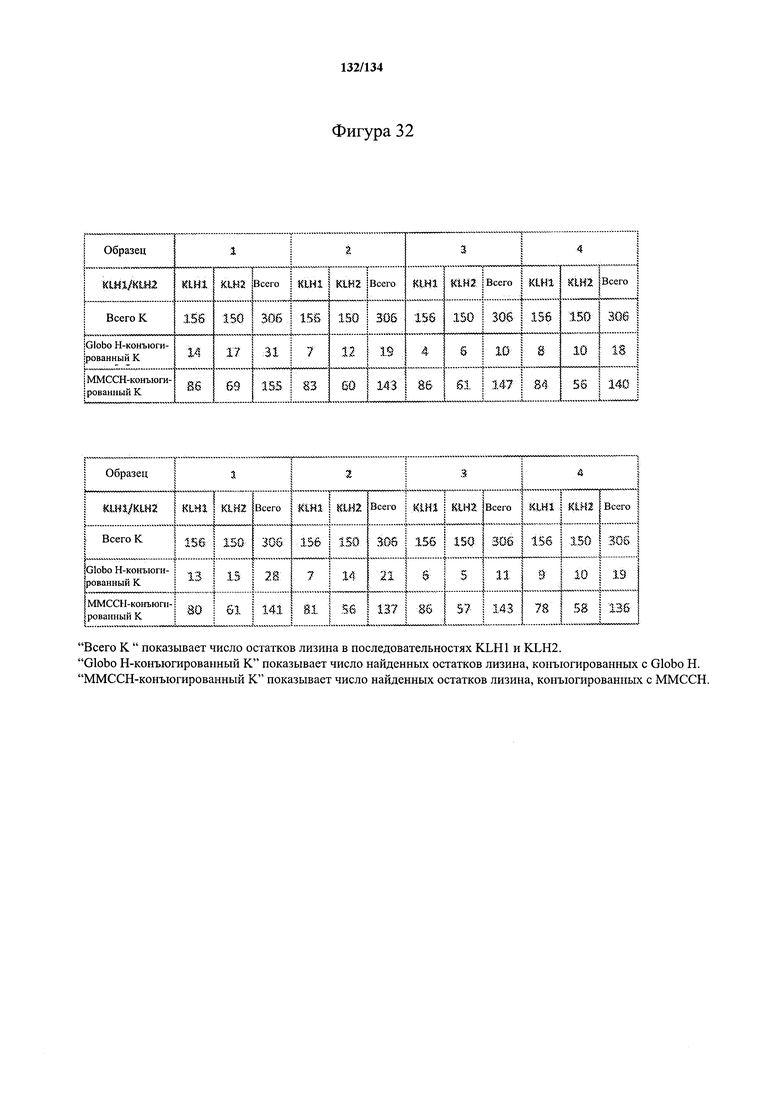

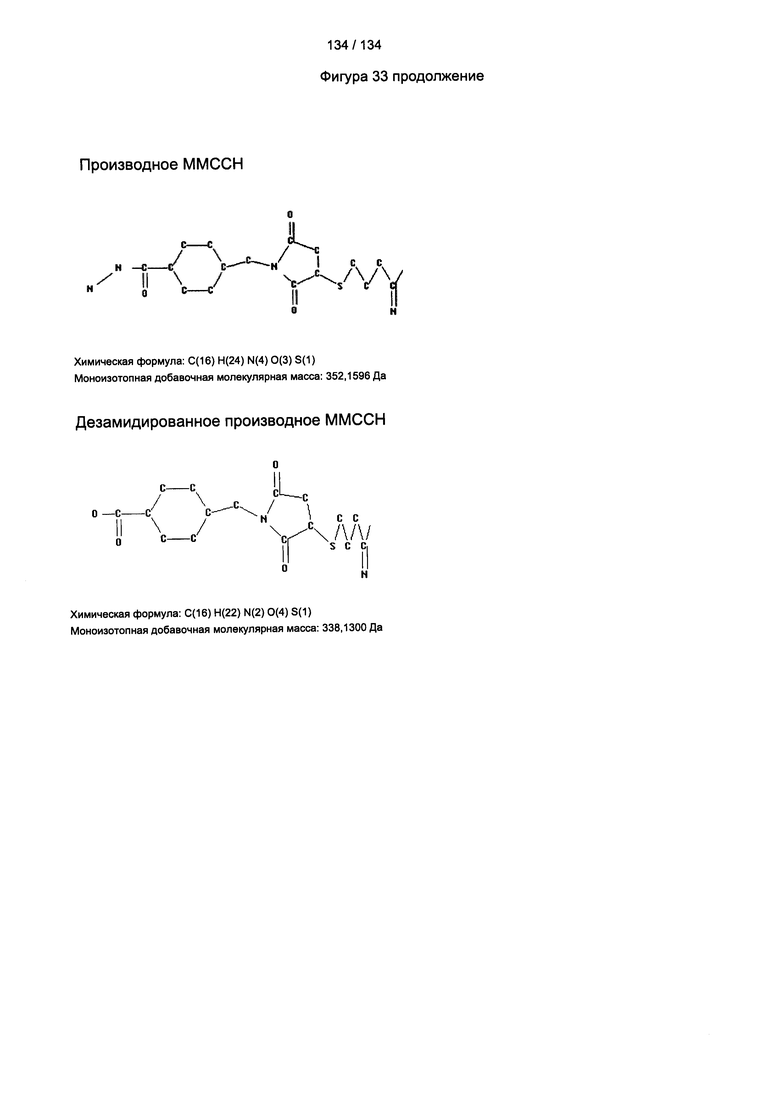
Изобретение относится к применимому в медицине соединению формулы
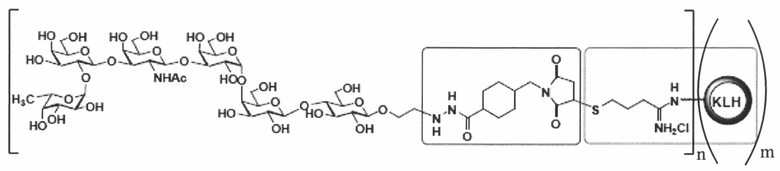 I,
I,
где n - целое число от 1 до 1500, m - целое число от 1 до 10, каждая из единиц Globo Н (Fucα1→2 Galβ1→3 GalNAcβ 1→3 Galα1→4 Galβ1→4 Glc) ковалентно связана с субъединицей гемоцианина фиссуреллы (KLH) через остатки основных аминокислот, выбранные из аргинина, лизина, гистидина и их комбинации, посредством изображенного линкера, причем отношение эпитопов к молекулам-носителям находится в диапазоне от 750 до 3000. Предложены новые соединения, а также фармацевтические композиции на их основе, эффективные для лечения рака и создания моноклональных антител в терапевтических или диагностических целях. 5 н. и 40 з.п. ф-лы, 5 табл., 8 пр., 33 ил.
1. Соединение, имеющее структуру:
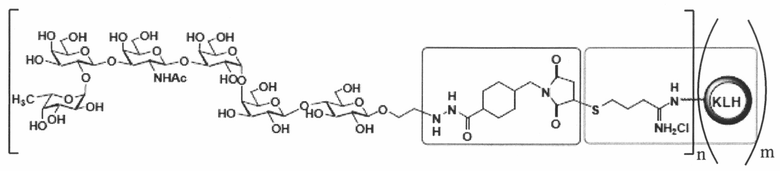 I,
I,
где
n независимо представляет собой целое число от 1 до 1500,
m независимо представляет собой целое число от 1 до 10, и
где каждая из единиц Globo Н (Fucα1→2 Galβ1→3 GalNAcβ 1→3 Galα1→4 Galβ1→4 Glc) ковалентно связана с субъединицей гемоцианина фиссуреллы (KLH) через остатки основных аминокислот, при этом указанные остатки выбраны из группы, состоящей из аргинина, лизина, гистидина и их комбинаций, посредством линкера, как изображено на указанной структуре,
при этом указанное соединение имеет отношение эпитопов в диапазоне от 750 до 3000,
при этом до конъюгации с единицей Globo Н тиолированный KLH хранили в атмосфере инертного газа.
2. Соединение по п. 1, отличающееся тем, что m представляет собой 1 и n представляет собой от 1 до 150.
3. Соединение по п. 1, отличающееся тем, что m представляет собой 2 и n представляет собой от 1 до 300.
4. Соединение по п. 1, отличающееся тем, что m представляет собой 3 и n представляет собой от 1 до 450.
5. Соединение по п. 1, отличающееся тем, что m представляет собой 4 и n представляет собой от 1 до 600.
6. Соединение по п. 1, отличающееся тем, что m представляет собой 5 и n представляет собой от 1 до 750.
7. Фармацевтическая композиция для лечения рака, содержащая: соединение, имеющее структуру:
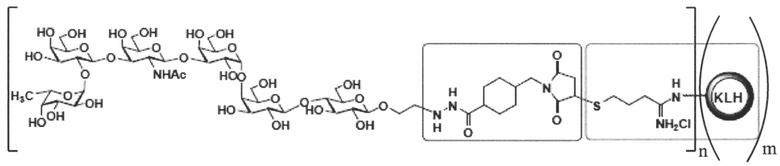 I,
I,
где n независимо представляет собой целое число от 1 до 1500, и где m независимо представляет собой целое число от 1 до 10, и фармацевтически приемлемый носитель,
где каждая из единиц Globo Н (Fucα1→2 Galβ1→3 GalNAcβ 1→3 Galα1→4 Galβ1→4 Glc) ковалентно связана с субъединицей гемоцианина фиссуреллы (KLH) через остатки основных аминокислот, при этом указанные остатки выбраны из группы, состоящей из аргинина, лизина, гистидина и их комбинаций, посредством линкера, как изображено на указанной структуре,
при этом указанное соединение имеет отношение эпитопов в диапазоне от 750 до 3000,
при этом до конъюгации с единицей Globo Н тиолированный KLH хранили в атмосфере инертного газа.
8. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 1 и n представляет собой от 1 до 150.
9. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 2 и n представляет собой от 1 до 300.
10. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 3 и n представляет собой от 1 до 450.
11. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 4 и n представляет собой от 1 до 600.
12. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 5 и n представляет собой от 1 до 750.
13. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 6 и n представляет собой от 1 до 900.
14. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 7 и n представляет собой от 1 до 1050.
15. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 8 и n представляет собой от 1 до 1200.
16. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 9 и n представляет собой от 1 до 1350.
17. Фармацевтическая композиция по п. 7, отличающаяся тем, что m представляет собой 10 и n представляет собой от 1 до 1500.
18. Фармацевтическая композиция по п. 7, отличающаяся тем, что от 1% до 99% соединений в указанной композиции представляют собой мономеры.
19. Фармацевтическая композиция по п. 7, отличающаяся тем, что от 1% до 99% соединений в указанной композиции представляют собой димеры.
20. Фармацевтическая композиция по п. 7, отличающаяся тем, что от 1% до 99% соединений в указанной композиции представляют собой тримеры.
21. Фармацевтическая композиция по п. 7, отличающаяся тем, что от 1% до 99% соединений в указанной композиции представляют собой тетрамеры.
22. Фармацевтическая композиция по п. 7, отличающаяся тем, что от 1% до 99% соединений в указанной композиции представляют собой пентамеры.
23. Фармацевтическая композиция по п. 7, дополнительно содержащая адъювант, где указанный адъювант представляет собой полный и неполный адъювант Фрейнда, молекулы Toll-подобного рецептора, ЛПС, липопротеины, липопептиды, флагеллин, двухцепочечную РНК, вирусную ДНК, неметилированные CpG-островки, левамизол, бациллу Кальметта-Герена, изопринозин, задаксин, антагонисты PD-1, антитела к PD-1, антагонисты CTLA, антитела к CTLA, интерлейкин, цитокины, GM-CSF, гликолипид, соль на основе алюминия, фосфат алюминия, квасцы, гидроксид алюминия, липосомы, агонисты TLR2, липопептид, наночастицы, монофосфорил-липид А, сапонин OBI-821, наноэмульсии масло в воде, и бактериеподобные частицы.
24. Фармацевтическая композиция по п. 7, дополнительно содержащая цитокин, выбранный из группы, состоящей из IL-2, IL-12, IL-18, IL-2, IFN-y, TNF, IL-4, IL-10, IL-13, IL-21, GM-CSF и TGF-β.
25. Фармацевтическая композиция по п. 7, дополнительно содержащая хемокин.
26. Фармацевтическая композиция по п. 7, дополнительно содержащая агент, выбранный из группы, состоящей из гормональных терапевтических агентов (например, селективных модуляторов рецептора эстрогенов, модуляторов рецепторов андрогенов), терапии моноклональными антителами, химиотерапии, модуляторов ретиноидных рецепторов, цитотоксических/цитостатических агентов, противоопухолевых агентов, противопролиферативных агентов, ингибиторов пренилпротеинтрансферазы, ингибиторов редуктазы ГМГ-КоА, азотистых ипритов, нитрозомочевины, ингибиторов ангиогенеза (например, бевацизумаба), ингибиторов клеточной пролиферации и сигнальных путей выживания, агентов, вызывающих апоптоз, агентов, которые нарушают контрольные точки клеточного цикла, агентов, которые взаимодействуют с рецепторными тирозинкиназами (RTK), ингибиторов мишени рапамицина у млекопитающих (mTOR), ингибиторов рецептора эпидермального фактора роста человека 2 типа (HER2), ингибиторов рецептора эпидермального фактора роста (EGFR), ингибиторов интегрина, НПВС, агонистов PPAR, ингибиторов множественной лекарственной устойчивости (MDR), противорвотных агентов, агентов, подходящих для лечения анемии, агентов, подходящих для лечения нейтропении, лекарственных средств, повышающих иммунитет, бисфосфонатов, ингибиторов ароматазы, агентов, индуцирующих терминальную дифференцировку опухолевых клеток, ингибиторов γ-секретазы, противораковых вакцин, ингибиторов PD-1/PD-L1 (иммунопрепаратов цитотоксических Т-лимфоцитов (ЦТЛ)), иммунопрепаратов CTLA-4, ингибиторов CDK4/6 (целевая терапия), ингибиторов PI3K (целевая терапия), ингибиторов mTOR (целевая терапия), ингибиторов АКТ (целевая терапия), ингибиторов Pan-Неr (целевая терапия), и любых их комбинаций.
27. Фармацевтическая композиция по п. 7, отличающаяся тем, что указанная фармацевтическая композиция представляет собой противораковую вакцину.
28. Фармацевтическая композиция по п. 7, приготовленная для подкожного введения, внутривенного введения или внутримышечного введения.
29. Фармацевтическая композиция для лечения рака, содержащая соединение, имеющее структуру
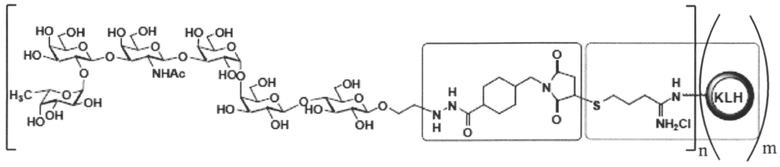 I,
I,
и фармацевтически приемлемый носитель, при этом
множество единиц Globo Н (Fucα1→2 Galβ1→3 GalNAcβ1→3 Galα1→4 Galβ1→4 Glc) ковалентно связаны с одной или более субъединицей гемоцианина фиссуреллы (KLH), где от 1% до 99% субъединиц KLH в композиции представляют собой мономеры, димеры, тримеры, тетрамеры, пентамеры, или их комбинации,
где каждая из единиц Globo Н ковалентно связана с субъединицей KLH через остатки основных аминокислот, при этом указанные остатки выбраны из группы, состоящей из аргинина, лизина, гистидина и их комбинаций, посредством линкера, как изображено на указанной структуре,
при этом указанное соединение имеет отношение эпитопов в диапазоне от 750 до 3000,
при этом до конъюгации с единицей Globo Н тиолированный KLH хранили в атмосфере инертного газа.
30. Фармацевтическая композиция по п. 29, дополнительно содержащая адъювант, где указанный адъювант представляет собой полный и неполный адъювант Фрейнда, молекулы Toll-подобного рецептора, ЛПС, липопротеины, липопептиды, флагеллин, двухцепочечную РНК, вирусную ДНК, неметилированные CpG-островки, левамизол, бациллу Кальметта-Герена, изопринозин, задаксин, антагонисты PD-1, антитела к PD-1, антагонисты CTLA, антитела к CTLA, интерлейкин, цитокины, GM-CSF, гликолипид, соль на основе алюминия, фосфат алюминия, квасцы, гидроксид алюминия, липосомы, агонисты TLR2, липопептид, наночастицы, монофосфорил-липид А, сапонин OBI-821, наноэмульсии масло в воде, и бактериеподобные частицы.
31. Фармацевтическая композиция по п. 29, дополнительно содержащая цитокин, выбранный из группы, состоящей из IL-2, IL-12, IL-18, IL-2, IFN-y, TNF, IL-4, IL-10, IL-13, IL-21, GM-CSF и TGF-β.
32. Фармацевтическая композиция по п. 29, дополнительно содержащая хемокин.
33. Фармацевтическая композиция по п. 29, дополнительно содержащая агент, выбранный из группы, состоящей из гормональных терапевтических агентов (например, селективных модуляторов рецептора эстрогенов, модуляторов рецепторов андрогенов), терапии моноклональными антителами, химиотерапии, модуляторов ретиноидных рецепторов, цитотоксических/цитостатических агентов, противоопухолевых агентов, противопролиферативных агентов, ингибиторов пренилпротеинтрансферазы, ингибиторов редуктазы ГМГ-КоА, азотистых ипритов, нитрозомочевины, ингибиторов ангиогенеза (например, бевацизумаба), ингибиторов клеточной пролиферации и сигнальных путей выживания, агентов, вызывающих апоптоз, агентов, которые нарушают контрольные точки клеточного цикла, агентов, которые взаимодействуют с рецепторными тирозинкиназами (RTK), ингибиторов мишени рапамицина у млекопитающих (mTOR), ингибиторов рецептора эпидермального фактора роста человека 2 типа (HER2), ингибиторов рецептора эпидермального фактора роста (EGFR), ингибиторов интегрина, НПВС, агонистов PPAR, ингибиторов множественной лекарственной устойчивости (MDR), противорвотных агентов, агентов, подходящих для лечения анемии, агентов, подходящих для лечения нейтропении, лекарственных средств, повышающих иммунитет, бисфосфонатов, ингибиторов ароматазы, агентов, индуцирующих терминальную дифференцировку опухолевых клеток, ингибиторов γ-секретазы, противораковых вакцин, ингибиторов PD-1/PD-L1 (иммунопрепаратов цитотоксических Т-лимфоцитов (ЦТЛ)), иммунопрепаратов CTLA-4, ингибиторов CDK4/6 (целевая терапия), ингибиторов PI3K (целевая терапия), ингибиторов mTOR (целевая терапия), ингибиторов АКТ (целевая терапия), ингибиторов Pan-Неr (целевая терапия), и любых их комбинаций.
34. Фармацевтическая композиция по п. 29, отличающаяся тем, что указанная фармацевтическая композиция представляет собой противораковую вакцину.
35. Фармацевтическая композиция по п. 29, приготовленная для подкожного введения, внутривенного введения или внутримышечного введения.
36. Способ лечения рака у пациента, нуждающегося в этом, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции по п. 7 или 29.
37. Способ по п. 36, отличающийся тем, что указанный рак представляет собой рак яичника.
38. Способ по п. 36, отличающийся тем, что указанный рак представляет собой рак эпителия.
39. Способ по п. 38, отличающийся тем, что указанный рак эпителия представляет собой рак молочной железы, рак легкого, рак печени, рак слизистой оболочки щеки, рак желудка, рак толстой кишки, рак носоглотки, рак кожи, рак почек, опухоль головного мозга, рак предстательной железы, рак яичника, рак шейки матки, рак эндометрия, рак кишечника, рак поджелудочной железы или рак мочевого пузыря.
40. Способ по п. 36, отличающийся тем, что указанный рак представляет собой рак молочной железы.
41. Способ по п. 36, отличающийся тем, что терапевтически эффективное количество Globo-H в указанной композиции составляет от 0,01 мкг/кг до 250 мг/кг.
42. Способ по п. 36, отличающийся тем, что терапевтически эффективное количество Globo-H в указанной композиции составляет от 0,10 мкг/кг до 0,75 мкг/кг.
43. Способ по п. 36, отличающийся тем, что терапевтически эффективное количество комплекса Globo-H-KLH в указанной композиции составляет от 0,01 мкг/кг до 250 мг/кг.
44. Способ по п. 36, отличающийся тем, что терапевтически эффективное количество комплекса Globo-H-KLH в указанной композиции составляет от 0,60 мкг/кг до 4,50 мкг/кг.
45. Способ индукции антител у животного или человека для создания моноклональных антител для терапевтического или диагностического применения, включающий введение указанному животному или человеку эффективного количества соединения по любому из пп. 1-6 или фармацевтической композиции по пп. 7-35.
| US 20130095173 A1, 18.04.2013 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ МЕХАНИЗМА ИЗМЕНЕНИЯ ВЕРТЕБРО-БАЗИЛЯРНОГО КРОВОТОКА У ДЕТЕЙ | 2003 |
|
RU2263465C2 |
| АНТИТЕЛА - АНТАГОНИСТЫ ИНТЕРЛЕЙКИНА-17 (ИЛ-17) ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2430110C2 |
| US 20100166790 A1, 01.07.2010 | |||
| US 20100286035 A1, 11.11.2010 | |||
| US 20120321583 A1, 20.12.2012 | |||
| Speed MA et al, Protein Science, 1995, vol | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Makimoto H et al, Cancer Research, 1996, vol | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| Hirano F et al, Cancer Res., 2005, 65 (3), 1089-1096. | |||
Авторы
Даты
2018-09-06—Публикация
2014-09-15—Подача