Область техники
Настоящее раскрытие относится к варианту человеческого интерлейкина-2 (IL-2) или его производному, имеющему одну или более аминокислотных мутаций. В частности, вариант человеческого IL-2 или его производное обладает улучшенной стабильностью и улучшенными свойствами в качестве иммунотерапевтического агента. Настоящее раскрытие также относится к иммуноконъюгату, содержащему вариант человеческого IL-2 или его производное, кодирующим их полинуклеотидным молекулам, векторам, клеткам-хозяевам и способам их получения, а также относится к фармацевтической композиции, содержащей вариант IL-2 или его производное или иммуноконъюгат, а также относится к способу лечения и его фармацевтическому применению.
Уровень техники
Человеческий интерлейкин-2 (IL-2), также известный как фактор роста Т-клеток (TCGF), состоит из 133 аминокислот с молекулярной массой примерно 15 кДа, и ген расположен на хромосоме 4 (4q27), включая последовательность всего 7 т.п.н. В 1976 и 1977 годах Doris Morgan, Francis Ruscetti, Robert Gallo и Steven Gillis, Kendal Smith и др., соответственно, обнаружили, что среда для культивирования активированных Т-клеток может способствовать пролиферации Т-клеток. После этого стимулирующий фактор, содержащийся в среде для культивирования, был очищен и идентифицирован как единственный белок, а именно IL-2.
Более ранние эксперименты на клетках in vitro показали, что Т-клетки могут секретировать IL-2 и экспрессировать рецептор IL-2 (IL-2R) на поверхности клетки, как только они активируются посредством TCR и CD28. Связывание IL-2 с его рецептором может инициировать пролиферацию Т-клеток и вынуждать Т-клетки функционировать. В этой модели IL-2 является молекулой, которая играет центральную роль в Т-клеточном иммунном ответе. Однако в последующих экспериментах in vivo было обнаружено, что у животных развивается аутоиммунитет, когда IL-2 или его рецептор нокаутированы. Последующие эксперименты показали, что IL-2 может не только активировать эффекторные клетки (такие как Т-клетки и NK-клетки), но также активирует регуляторные Т-клетки (Treg), тем самым подавляя чрезмерный аутоиммунитет.
IL-2 действует через IL-2R. IL-2R состоит из трех субъединиц: IL-2Rα (т.е. CD25), IL-2Rβ (т.е. CD122) и IL-2Rγ (т.е. CD132). Три субъединицы могут образовывать три формы рецептора: рецептор с высокой аффинностью связывания включает все три субъединицы IL-2Rα/β/γ, рецептор со средней аффинностью связывания включает IL-2Rβ/γ, а рецептор с низкой аффинностью связывания представляет собой IL-2Rα. Среди них IL-2Rβ и IL-2Rγ необходимы IL-2 для активации нижестоящих сигнальных путей. Как только IL-2 связывается с IL-2Rβ и с IL-2Rγ, две субъединицы рецептора образуют гетеродимер, который, в свою очередь, фосфорилирует внутриклеточный STAT5 и проникает в ядро, вызывая соответствующую транскрипцию и экспрессию гена. IL-2Rα не является необходимым для передачи сигнала, но может способствовать связыванию IL-2 с IL-2Rβ и IL-2Rγ- IL-2Rγ экспрессируется во всех иммунных клетках; IL-2Rβ экспрессируется в CD8+T-клетках, NK-клетках и Treg, и уровень экспрессии IL-2Rβ будет увеличиваться при активации Т-клеток; IL-2Rα постоянно экспрессируется на высоком уровне в Treg и временно экспрессируется в активированных CD8+Т-клетках, а затем уровень экспрессии будет подавляться.
IL-2 в основном синтезируется активированными Т-клетками, особенно CD4+ хелперными Т-клетками. IL-2 стимулирует пролиферацию и дифференцировку Т-клеток, индуцирует образование цитотоксических Т-лимфоцитов (CTL) и дифференцировку лимфоцитов периферической крови в цитотоксические клетки и клетки-киллеры, активируемые лимфоцитарным фактором (LAK), способствует экспрессии цитокинов и цитолизу молекул Т-клетками, способствует пролиферации и дифференцировке В-клеток и синтезу иммуноглобулина посредством В-клеток, а также стимулирует продукцию, пролиферацию и активацию естественных киллеров (NK).
Способность IL-2 увеличивать популяцию лимфоцитов in vivo и улучшать эффекторные функции этих клеток обеспечивает IL-2 противоопухолевые эффекты. Иммунотерапия посредством IL-2 становится вариантом лечения пациентов с определенными метастатическими формами рака. В настоящее время высокие дозы IL-2 одобрены для лечения метастатической почечно-клеточной карциномы и злокачественной меланомы.
Существующие исследования вариантов IL-2 показали, что варианты IL-2 с мутациями по меньшей мере в четырех положениях из положения 38, 42, 45, 62 и 68 обладают пониженным стимулирующим действием на Treg (WO2012062228); варианты IL-2, имеющие мутации в положениях 72, 42 и 45, снижают или устраняют аффинность связывания с рецептором IL-2 с высокой аффинностью связывания, но все же сохраняют аффинность связывания с рецептором IL-2 со средней аффинностью связывания (CN201280017730.1); мутации в положениях 91 и 126 позволяют IL-2 связываться с CD25 (IL2Rα), но не активируют IL-2R на Treg (US8906356); IL-2R, содержащие по меньшей мере одну мутацию Е15, Н16, Q22, D84, N88 или Е95, используют для лечения болезни «трансплантат против хозяина» у субъектов (US9732134); варианты IL-2, содержащие по меньшей мере R38W, могут снижать проницаемость сосудов и могут использоваться для лечения солидных опухолей (US7371371; US7514073; US8124066; US7803361); слитый белок, образованный слиянием варианта IL-2 с Fc, используется для лечения заболевания, IL-2 имеет мутацию N88R (WO2016014428); hIL-2-N88R может избирательно активировать Т-клетки вместо естественных клеток-киллеров и может уменьшать образование метастазов в легких (WO 99/60128); IL-2, имеющий мутацию(и) в положении 20, 88 или 126, может быть использован для получения лекарственного средства для лечения и/или предотвращения аутоиммунного заболевания (WO2009135615); химерный полипептид, содержащий цитокин, связан с лигандом, нацеленным на белок на поверхности иммунных клеток, где цитокин может быть вариантом IL-2 (WO2017136818) и т.д.
Однако в данной области все еще существует потребность в вариантах IL-2 с более высокой стабильностью. В данной области существует актуальная проблема обеспечения таких вариантов IL-2 и их производных для повышения терапевтической эффективности IL-2.
Краткое описание изобретения
В настоящем раскрытии предложен вариант IL-2 или его производное, имеющие одну или более аминокислотных мутаций, и конъюгат варианта IL-2 или его производного, кодирующий полипептид, и молекула нуклеиновой кислоты, вектор, клетка-хозяин, фармацевтическая композиция, фармацевтическое применение и способ лечения.
В первом аспекте в настоящем раскрытии предложен вариант IL-2 или его производное, имеющие одну или более аминокислотных мутаций в положении(ях) 11, 26, 27, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 70, 71, 72, 78, 82, 88, 132. В настоящем раскрытии мутация представлена в форме «аЬс», где а представляет собой тип аминокислоты до мутации, b представляет собой положение мутации, и с представляет собой тип аминокислоты после мутации. Например, N26S относится к мутации аспарагина (N) до серина (S) в положении 26; N26 означает, что аспарагин (N) в положении 26 мутирован; 26S означает, что аминокислота в положении 26 мутирована до серина (S).
В частности, вариант IL-2 или его производное, предусмотренное настоящим раскрытием, содержит одну или более аминокислотных мутаций или любую их комбинацию в следующих положениях: 26, 29, 30, 71, 11, 132, 70, 82, 27 и 78. В некоторых вариантах реализации аминокислоты до мутации (например, в человеческом IL-2 дикого типа) представляют собой: аспарагин (N) в положении 26, аспарагин (N) в положении 29, аспарагин (N) в положении 30, аспарагин (N) в положении 71, глутамин (Q) в положении 11, лейцин (L) в положении 132, лейцин (L) в положении 70, пролин (Р) в положении 82, глицин (G) в положении 27 и фенилаланин (F) в положении 78. В некоторых вариантах реализации аминокислотная мутация(и) варианта IL-2 или его производного представляет собой любую одну или любую комбинацию, выбранную из следующих мутаций: мутация до Gin (Q) в положении 26, мутация до серина (S) в положении 29, мутация до Ser (S) в положении 30, мутация до Gln (Q) в положении 71, мутация до Cys (С) в положении 11, 132, 70, 82, 27 или 78.
В некоторых конкретных вариантах реализации вариант IL-2 или его производное содержит первый тип мутации, и первый тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из (1)-(7), или их комбинации:
(1) N26Q,
(2) N29S,
(3) N30S,
(4) N71Q,
(5) Q11C и L132C,
(6) L70C и Р82С, и
(7) G27C и F78C.
В некоторых конкретных вариантах реализации вариант IL-2 или его производное, описанное выше, имеет повышенную стабильность, например, повышенную стабильность к дезаминированию и/или термическую стабильность; в частности, первый тип мутации, предусмотренный настоящим раскрытием, придает повышенную стабильность варианту IL-2 или его производному по сравнению с IL-2 дикого типа; при этом стабильность включает, но не ограничивается этим, повышенную стабильность к дезаминированию и/или термическую стабильность.
С другой стороны, вариант IL-2 или его производное, предусмотренное настоящим раскрытием, дополнительно содержит одну или более аминокислотных мутаций в следующих положениях или их комбинацию: 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45 и 72. В некоторых вариантах реализации аминокислоты до мутации (например, в человеческом IL-2 дикого типа) представляют собой: аспарагин (N) в положении 29, аспарагин (N) в положении 30, тирозин (Y) в положении 31, лизин (K) в позиции 32, аспарагин (N) в положении 33, пролин (Р) в положении 34, лизин (K) в положении 35, лейцин (L) в положении 36, треонин (Т) в положении 37, аргинин (R) в положении 38, метионин (М) в положении 39, лейцин (L) в положении 40, треонин (Т) в положении 41, фенилаланин (F) в положении 42, лизин (K) в положении 43, фенилаланин (F) в положении 44, тирозин (Y) в положении 45, лейцин (L) в положении 72.
В некоторых конкретных вариантах реализации вариант IL-2 или его производное дополнительно содержит второй тип мутации, и второй тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из (8)-(11), или комбинации (8)-(10):
(8) F42A,
(9) Y45A,
(10) L72G, и
(11) NNYKNPKLTRMLTFK в положениях 29-44 мутированы до QSMHIDATL.
В некоторых вариантах реализации второй тип мутации может устранять или снижать аффинность IL-2 к рецептору с высокой аффинностью (IL-2Rα/β/γ) и сохранять аффинность IL-2 к рецептору со средней аффинностью (IL-2Rβ/γ); второй тип мутации может сохранять влияние IL-2 на индукцию пролиферации и активации эффекторных клеток (таких как NK- и Т-клетки), но снижать влияние IL-2 на индукцию пролиферации и активации Treg-клеток.
В третьем аспекте, вариант IL-2 или его производное, предусмотренное настоящим раскрытием, содержит одну или более аминокислотных мутаций или любую их комбинацию в следующих положениях: 20, 88 и 126. В некоторых вариантах реализации аминокислоты до мутации (например, в человеческом IL-2 дикого типа) представляют собой: аспарагиновую кислоту (D) в положении 20, аспарагин (N) в положении 88 и глутамин (Q) в положении 126. В некоторых вариантах реализации вариант IL-2 или его производное включает любую следующую аминокислоту или любую их комбинацию после мутации: аланин (А), или гистидин (Н), или изолейцин (I), или метионин (М), или глутаминовую кислоту (Е) или серии (S), или валин (V), или триптофан (W) в положении 20; аланин (А), или аргинин (R), или глутаминовую кислоту (Е), или лейцин (L), или фенилаланин (F), или глицин (G), или изолейцин (I), или метионин (М), или серии (S), или Y, или валин (V) в положении 88; аспарагин (N), или лейцин (L), или Р, или фенилаланин (F), или глицин (G), или изолейцин (I), или метионин (М), или аргинин (R), или серии (S), или треонин (Т), или тирозин (Y), или валин (V) в положении 126.
В некоторых конкретных вариантах реализации вариант IL-2 или его производное дополнительно содержит третий тип мутации, который представляет собой любую мутацию, выбранную из группы, состоящей из (12)-(14), или их комбинации:
(12) N88 мутирован до A, R, Е, L, F, G, I, М, S, Y, V или D,
(13) D20 мутирована до А, Н, I, М, Е, S, V, W или Y, (2)
(14) Q126 мутирован до N, L, Р, F, G, I, М, R, S, Т, Y или V.
В некоторых вариантах реализации третий тип мутации может снижать аффинность IL-2 как к рецептору с высокой аффинностью (IL-2Rα/β/γ), так и к рецептору со средней аффинностью (IL-2Rβ/γ), а аффинность к рецептору с высокой аффинностью снижается больше, чем к рецептору со средней аффинностью; третий тип мутации может сохранять влияние IL-2 на индукцию пролиферации и активации Treg, но устранять или уменьшать влияние IL-2 на индукцию пролиферации и активации эффекторных клеток (таких как NK и Т-клетки).
В некоторых вариантах реализации вариант IL-2 или его производное содержит первый тип мутации и второй тип мутации или содержит первый тип мутации и второй тип мутации, как описано выше.
В некоторых вариантах реализации первый тип мутации в варианте IL-2 или его производном выбран из любого из (15)-(17) или представляет собой любой из (15)-(17) в комбинации с любым из (5)-(7), как описано выше:
(15) N26Q и N29S,
(16) N26Q, N29S и N71Q, и
(17) N26Q и N30S;
Второй тип мутации выбран из любого из (18)-(20) и (11):
(18) F42A и Y45A,
(19) F42A и L72G, и
(20) Y45A и L72G;
Третий тип мутации представляет собой N88R или N88G или N88I или N88D. В некоторых вариантах реализации вариант IL-2 или его производное содержит мутации, как показано в любом из пунктов (21)-(29):
(21) N26Q, N29S, F42A, N71Q и L72G,
(22) N26Q, N29S и N88R,
(23) N26Q, N29S, F42A и L72G,
(24) N26Q, N30S, F42A и L72G,
(25) Q11C, N26Q, N30S, F42A, L72G и L132C,
(26) N26Q, N30S, F42A, L70C, L72G и Р82С,
(27) N26Q, G27C, N30S, F42A, L72G и F78C,
(28) N29S, F42A и L72G, и
(29) Q11C, N NYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL, и L132C.
В дополнение к описанным выше (1)-(29) в настоящем раскрытии дополнительно предложен следующий вариант IL-2, который включает любую комбинацию положения(й) мутации и типа(ов) мутации, как показано в (1)-(20), включающий, но не ограничиваясь, следующие (30)-(208):
(30) N26Q/Q11C/L132C;
(31) N26Q/L70C/P82C;
(32) N26Q/G27C/F78C;
(33) N26Q/NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL;
(34) N26Q/F42A/Y45A;
(35) N26Q/F42A/L72G;
(36) N26Q/Y45A/L72G;
(37) N26Q/F42A/Y45A/L72G;
(38) Q11C/N30S/L132C;
(39) N30S/L70C/P82C;
(40) G27C/N30S/F78C;
(41) N30S/F42A/Y45A;
(42) N30S/F42A/L72G;
(43) N30S/Y45A/L72G;
(44) N30S/F42A/Y45A/L72G;
(45) N29S/N30S/F42A/L72G;
(46) Q11C/F42A/Y45A;
(47) Q11C/F42A/L72G/L132C;
(48) Q11C/Y45A/L72G/L132C;
(49) Q11C/F42A/Y45A/L72G/L132C;
(50) Q11C/N29S/F42A/L72G/L132C;
(51) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/L70C/P82C;
(52) F42A/Y45A/L70C/P82C;
(53) F42A/L70C/L72G/P82C;
(54) Y45A/L70C/L72G/P82C;
(55) F42A/Y45A/L70C/L72G/P82C;
(56) N29S/F42A/L70C/L72G/P82C;
(57) G27C/NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/F78C;
(58) G27C/F42A/Y45A/F78C;
(59) G27C/F42A/L72G/F78C;
(60) G27C/Y45A/L72G/F78C;
(61) G27C/F42A/Y45A/L72G/F78C;
(62) G27C/N29S/F42A/L72G/F78C;
(63) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/Y45A;
(64) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/L72G;
(65) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/Y45A/ L72G;
(66) N26Q/N30S/Q11C/L132C;
(67) N26Q/N30S/L70C/P82C;
(68) N26Q/G27C/N30S/F78C;
(69) N26Q/N30S/F42A/Y45A;
(70) N26Q/N30S/F42A/L72G;
(71) N26Q/N30S/Y45A/L72G;
(72) N26Q/N30S/F42A/Y45A/L72G;
(73) N26Q/N29S/N30S/F42A/L72G;
(74) N26Q/N29S/N30S;
(75) N26Q/N29S/Q11C/L132C;
(76) N26Q/N29S/L70C/P82C;
(77) N26Q/N29S/G27C/F78C;
(78) N26Q/N29S/F42A/Y45A;
(79) N26Q/N29S/Y45A/L72G;
(80) N26Q/N29S/F42A/Y45A/L72G;
(81) Q11C/N29S/N30S/L132C;
(82) N29S/N30S/L70C/P82C;
(83) G27C/N29S/N30S/F78C;
(84) N29S/N30S/F42A/Y45A;
(85) N29S/N30S/F42A/L72G;
(86) N29S/N30S/Y45A/L72G;
(87) N29S/N30S/F42A/Y45A/L72G;
(88) Q11C/N29S/F42A/Y45A/L132C;
(89) Q11C/N29S/F42A/L72G/L132C;
(90) Q11C/N29S/Y45A/L72G/L132C;
(91) Q11C/N29S/F42A/Y45A/L72G/L132C;
(92) N29S/F42A/Y45A/L70C/P82C;
(93) N29S/F42A/L70C/L72G/P82C;
(94) N29S/Y45A/L70C/L72G/P82C;
(95) N29S/F42A/Y45A/L70C/L72G/P82C;
(96) G27C/N29S/F78C/F42A/Y45A;
(97) G27C/N29S/F78C/F42A/L72G;
(98) G27C/N29S/F78C/Y45A/L72G;
(99) G27C/N29S/F78C/F42A/Y45A/L72G;
(100) N29S/F42A/Y45A;
(101) N29S/F42A/L72G;
(102) N29S/Y45A/L72G;
(103) N29S/F42A/Y45A/L72G;
(104) Q11C/N29S/L132C;
(105) N29S/L70C/P82C;
(106) G27C/N29S/F78C;
(107) N29S/N30S;
(108) N26Q/N29S;
(109) N26Q/N71Q;
(110) N30S/N71Q;
(111) Q11C/N71Q/L132C;
(112) L70C/N71Q/P82C;
(113) G27C/N71Q/F78C;
(114) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/N71Q;
(115) F42A/Y45A/N71Q;
(116) F42A/N71Q/L72G;
(117) Y45A/N71Q/L72G;
(118) N26Q/N30S/F42A/N71Q/L72G;
(119) Q11C/N26Q/N30S/F42A/N71Q/L72G/L132C;
(120) N26Q/N30S/F42A/L70C/N71Q/L72G/P82C;
(121) N26Q/G27C/N30S/F42A/N71Q/L72G/F78C;
(122) N29S/F42A/N71Q/L72G;
(123) N26Q/N30S/N71Q;
(124) N26Q/Q11C/N71Q/L132C;
(125) N26Q/L70C/N71Q/P82C;
(126) N26Q/G27C/N71Q/F78C;
(127) N26Q/NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/N71Q;
(128) N26Q/F42A/Y45A/N71Q;
(129) N26Q/F42A/N71Q/L72G;
(130) N26Q/Y45A/N71Q/L72G;
(131) N26Q/F42A/Y45A/N71Q/L72G;
(132) Q11C/N30S/N71Q/L132C;
(133) N30S/L70C/N71Q/P82C;
(134) G27C/N30S/N71Q/F78C;
(135) N30S/F42A/Y45A/N71Q;
(136) N30S/F42A/N71Q/L72G;
(137) N30S/Y45A/N71Q/L72G;
(138) N30S/F42A/Y45A/N71Q/L72G;
(139) N29S/N30S/F42A/N71Q/L72G;
(140) Q11C/F42A/Y45A/N71Q;
(141) Q11C/F42A/N71Q/L72G/L132C;
(142) Q11C/Y45A/N71Q/L72G/L132C;
(143) Q11C/F42A/Y45A/N71Q/L72G/L132C;
(144) Q11C/N29S/F42A/N71Q/L72G/L132C;
(145) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/L70C/ N71Q/P82C;
(146) F42A/Y45A/L70C/N71Q/P82C;
(147) F42A/L70C/N71Q/L72G/P82C;
(148) Y45A/L70C/N71Q/L72G/P82C;
(149) F42A/Y45A/L70C/N71Q/L72G/P82C;
(150) N29S/F42A/L70C/N71Q/L72G/P82C;
(151) G27C/NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/ N71Q/F78C;
(152) G27C/F42A/Y45A/N71Q/F78C;
(153) G27C/F42A/N71Q/L72G/F78C;
(154) G27C/Y45A/N71Q/L72G/F78C;
(155) G27C/F42A/Y45A/N71Q/L72G/F78C;
(156) G27C/N29S/F42A/N71Q/L72G/F78C;
(157) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/ Y45A/N71Q;
(158) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/ N71Q/L72G;
(159) NNYKN PKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL/Y45A/ N71Q/L72G;
(160) N26Q/N30S/Q11C/N71Q/L132C;
(161) N26Q/N30S/L70C/N71Q/P82C;
(162) N26Q/G27C/N30S/N71Q/F78C;
(163) N26Q/N30S/F42A/Y45A/N71Q;
(164) N26Q/N30S/F42A/N71Q/L72G;
(165) N26Q/N30S/Y45A/N71Q/L72G;
(166) N26Q/N30S/F42A/Y45A/N71Q/L72G;
(167) N26Q/N29S/N30S/F42A/N71Q/L72G;
(168) N26Q/N29S/N30S/N71Q;
(169) N26Q/N29S/Q11C/N71Q/L132C;
(170) N26Q/N29S/L70C/N71Q/P82C;
(171) N26Q/N29S/G27C/N71Q/F78C;
(172) N26Q/N29S/F42A/Y45A/N71Q;
(173) N26Q/N29S/Y45A/N71Q/L72G;
(174) N26Q/N29S/F42A/Y45A/N71Q/L72G;
(175) Q11C/N29S/N30S/N71Q/L132C;
(176) N29S/N30S/L70C/N71Q/P82C;
(177) G27C/N29S/N30S/N71Q/F78C;
(178) N29S/N30S/F42A/Y45A/N71Q;
(179) N29S/N30S/F42A/N71Q/L72G;
(180) N29S/N30S/Y45A/N71Q/L72G;
(181) N29S/N30S/F42A/Y45A/N71Q/L72G;
(182) Q11C/N29S/F42A/Y45A/N71Q/L132C;
(183) Q11C/N29S/F42A/N71Q/L72G/L132C;
(184) Q11C/N29S/Y45A/N71Q/L72G/L132C;
(185) Q11C/N29S/F42A/Y45A/N71Q/L72G/L132C;
(186) N29S/F42A/Y45A/L70C/N71Q/P82C;
(187) N29S/F42A/L70C/N71Q/L72G/P82C;
(188) N29S/Y45A/L70C/N71Q/L72G/P82C;
(189) N29S/F42A/Y45A/L70C/N71Q/L72G/P82C;
(190) G27C/N29S/F78C/F42A/Y45A/N71Q;
(191) G27C/N29S/F78C/F42A/N71Q/L72G;
(192) G27C/N29S/F78C/Y45A/N71Q/L72G;
(193) G27C/N29S/F78C/F42A/Y45A/N71Q/L72G;
(194) N29S/F42A/Y45A/N71Q;
(195) N29S/F42A/N71Q/L72G;
(196) N29S/Y45A/N71Q/L72G;
(197) N29S/F42A/Y45A/N71Q/L72G;
(198) Q11C/N29S/N71Q/L132C;
(199) N29S/L70C/N71Q/P82C;
(200) G27C/N29S/N71Q/F78C;
(201) N29S/N30S/N71Q;
(202) N26Q/N29S/N71Q;
(203) N26Q/N88R;
(204) N29S/N88R;
(205) N30S/N88R;
(206) N26Q/N88R/Q11C/L132C;
(207) N29S/N88R/L70C/P82C; и
(208) N30S/N88R/G27C/F78C; где «/» означает, что мутации одновременно присутствуют в одном варианте IL-2. В некоторых вариантах реализации мутации, описанные выше, относятся к IL-2 дикого типа, и аминокислотная последовательность IL-2 дикого типа представлена в SEQ ID NO 2. Нумерация положений мутации отсчитывается от аминокислоты А во втором положении в соответствии с аминокислотной последовательностью, как показано в SEQ ID NO 2.
В некоторых вариантах реализации вариант IL-2 или его производное содержит аминокислоты, как показано в любой последовательности, выбранной из группы, состоящей из SEQ ID NO 4, SEQ ID NO 6, SEQ ID NO 8, SEQ ID NO 10, SEQ ID NO 12, SEQ ID NO 14, SEQ ID NO 16, SEQ ID NO 18, SEQ ID NO 20, SEQ ID NO 22, SEQ ID NO 24, SEQ ID NO 26, SEQ ID NO 28, SEQ ID NO 30, SEQ ID NO 32, SEQ ID NO 34, SEQ ID NO 36 и SEQ ID NO 41. Аминокислотные последовательности полипептидов и соответствующие нуклеотидные последовательности показаны в Таблице 1 (подчеркивание представляет аминокислотную мутацию):

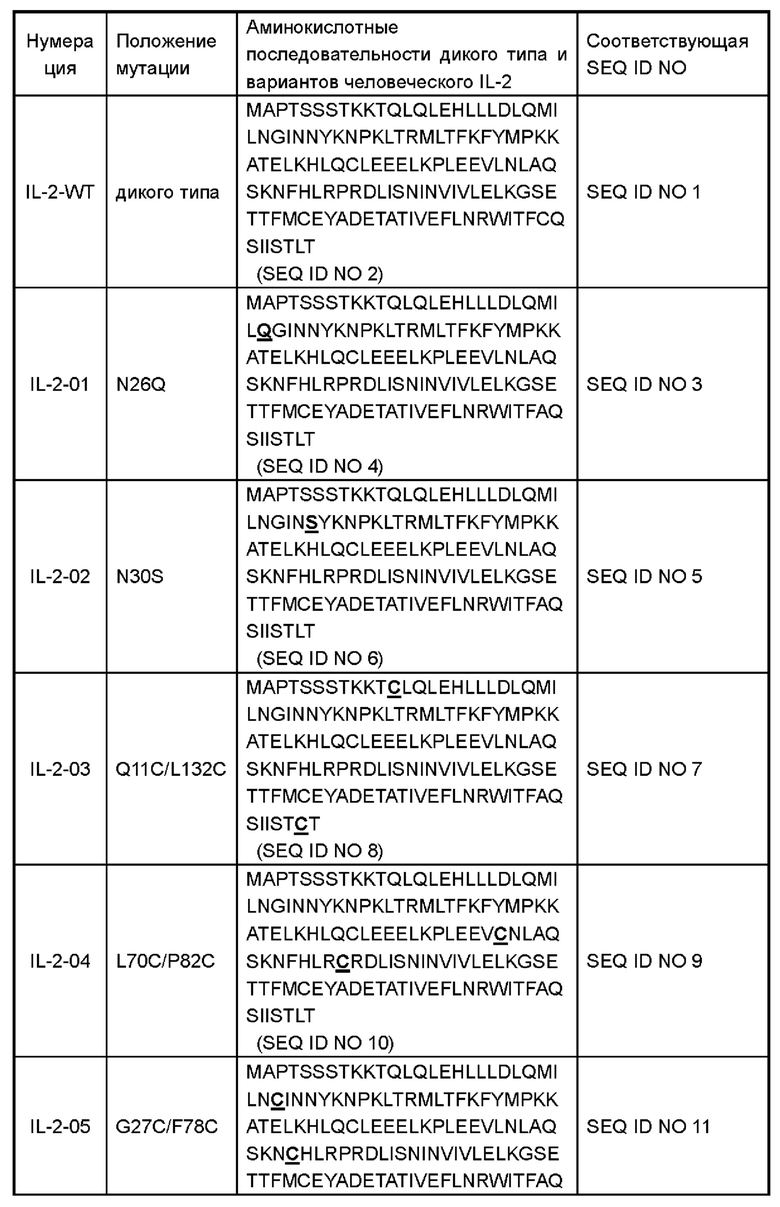
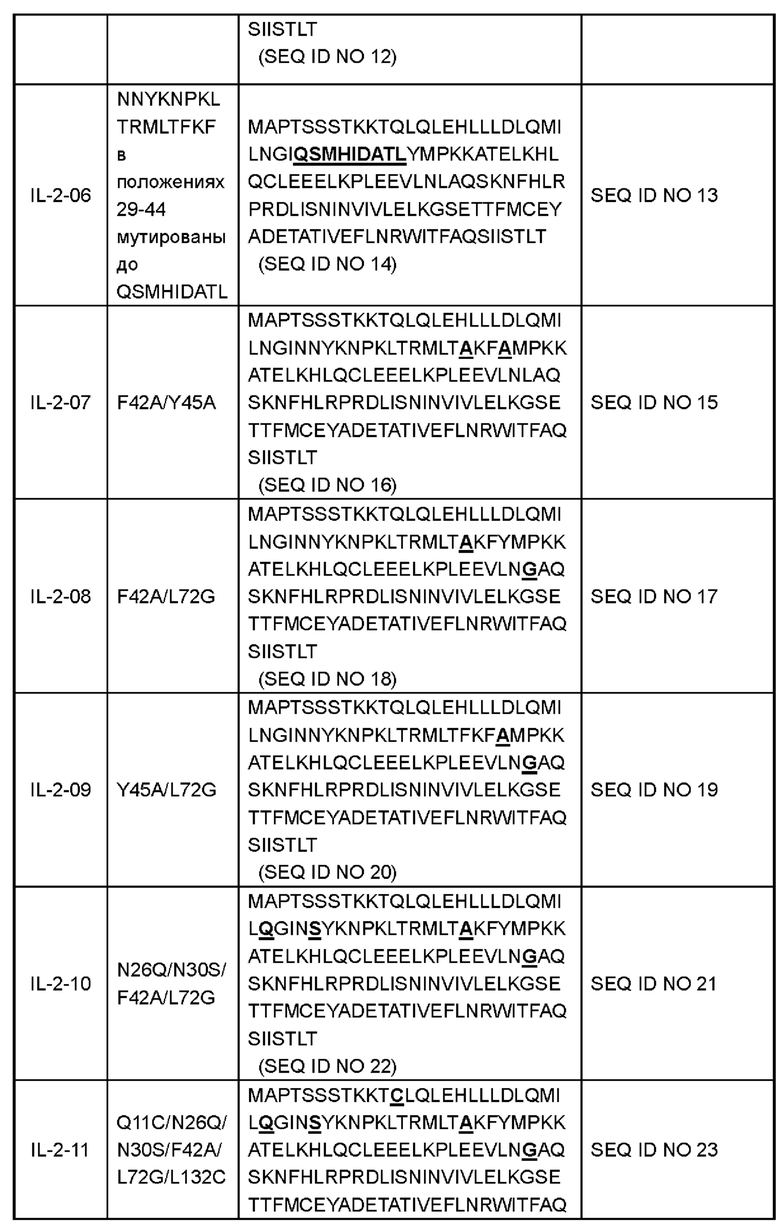
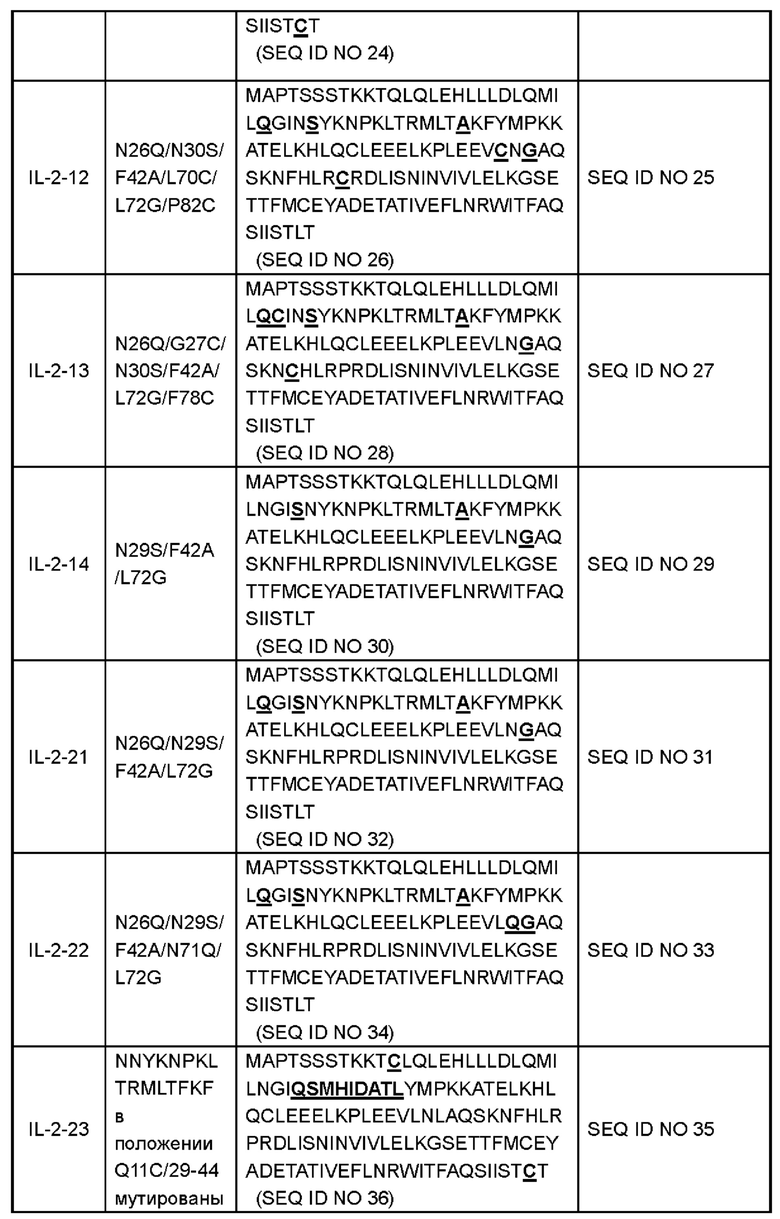
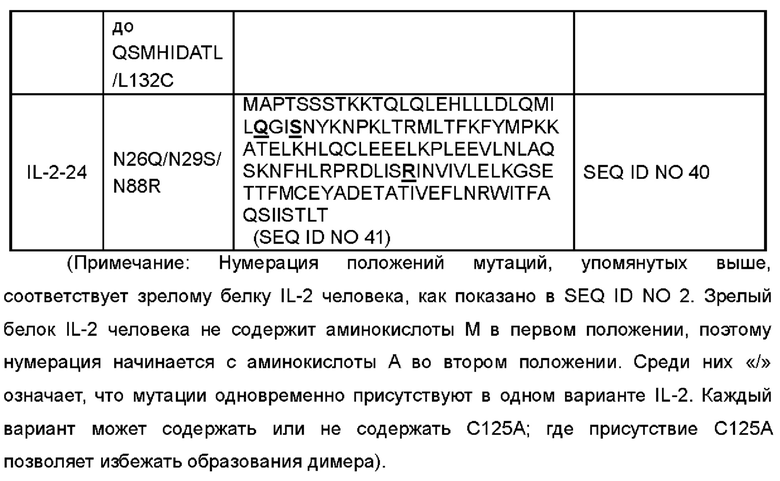
В некоторых вариантах реализации производное варианта IL-2 включает полноразмерный или частичный белок варианта IL-2 в настоящем раскрытии; или включает мутированные белки, функциональные производные, функциональные фрагменты, биологически активные пептиды, слитые белки, изоформы или их соли, полученные путем дополнительной мутации на основе варианта IL-2 в настоящем раскрытии. Например, слитый белок, содержащий вариант IL-2, мономер или димер или тример или полимер варианта IL-2, различные формы модификации варианта IL-2 (такие как ПЭГилирование, пегилирование, гликозилирование, конъюгация с альбумином или слияние, Fc-слияние или конъюгация, гидроксиэтилирование, отсутствие О-гликозилирования и т.д.) и гомологи варианта IL-2 у различных видов. Модификация IL-2 не оказывает неблагоприятного воздействия на иммуногенность, связанную с лечением.
В некоторых вариантах реализации вариант IL-2 или его производное является ПЭГилированным (который может быть обозначен как ПЭГ-IL-2), например, моно- или ди-ПЭГилированным вариантом IL-2 или его производным. Вариант ПЭГ-IL-2 или его производное содержит связывающую группу SC-ПЭГ. В других вариантах реализации вариант ПЭГ-IL-2 или его производное содержит связывающую группу метокси-ПЭГ-альдегид (mПЭГ-ALD). В некоторых вариантах реализации средняя молекулярная масса фрагмента ПЭГ находится в диапазоне от примерно 5 кДа до примерно 50 кДа, в частности 5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 кДа; или от примерно 5 кДа до примерно 40 кДа, или от примерно 10 кДа до примерно 30 кДа, или от примерно 10 кДа до примерно 30 кДа, или от примерно 15 кДа до примерно 20 кДа. В некоторых вариантах реализации связывающая группа mПЭГ-ALD включает молекулу полиэтиленгликоля (ПЭГ), имеющую среднюю молекулярную массу, выбранную из группы, состоящей из примерно 5 кДа, примерно 12 кДа и примерно 20 кДа. В некоторых вариантах реализации альдегидная группа в mПЭГ-ALD может представлять собой ацетальдегид, пропионовый альдегид, бутиральдегид или тому подобное. В одном варианте реализации вариант IL-2 или его производное имеет увеличенный период полужизни в сыворотке по сравнению с периодом полужизни IL-2 дикого типа или его производного.
Когда вариант IL-2 или его производное содержит второй тип мутации, в некоторых вариантах реализации вариант IL-2 или его производное может инициировать один или более клеточных ответов, выбранных из группы, состоящей из: пролиферации активированных Т-лимфоцитов, дифференцировки активированных Т-лимфоцитов, активности цитотоксических Т-клеток (CTL), пролиферации активированных В-клеток, дифференцировки активированных В-клеток, пролиферации естественных киллеров (NK) клеток, дифференцировки NK-клеток, секреции цитокинов активированными Т-клетками или NK-клетками и противоопухолевой цитотоксичности клеток-киллеров (LAK), активированных NK/лимфоцитами. В некоторых вариантах реализации вариант IL-2 или его производное обладает пониженной способностью индуцировать передачу сигнала IL-2 в регуляторных Т-клетках по сравнению с таковой для полипептида IL-2 дикого типа. В одном варианте реализации вариант IL-2 или его производное индуцирует меньшую вызванную активацией гибель клеток (AICD) в Т-клетках, чем IL-2 дикого типа или его производное. В некоторых конкретных вариантах реализации вариант IL-2 или его производное обладает пониженной токсичностью in vivo по сравнению с токсичностью IL-2 дикого типа или его производного.
Когда вариант IL-2 или его производное содержит третий тип мутации, в некоторых вариантах реализации вариант IL-2 или его производное может снижать аффинность IL-2 к обоим рецепторам с высокой аффинностью (IL-2Rα/β/γ) и рецепторам со средней аффинностью (IL-2Rβ/γ), однако снижение аффинности к рецептору с высокой аффинностью больше, чем к рецептору со средней аффинностью. В некоторых вариантах реализации вариант IL-2 или его производное может сохранять действие IL-2 на индукцию пролиферации и активацию Treg, но устранять или уменьшать действие IL-2 на индукцию пролиферации и активацию эффекторных клеток (таких как NK и Т-клетки).
В другом аспекте в настоящем раскрытии предложен конъюгат, в котором вариант IL-2 или его производное непосредственно связано или косвенно связано с модулем, не являющимся IL-2, через линкер. В некоторых вариантах реализации конъюгат представляет собой иммуноконъюгат, где модуль, не являющийся IL-2, представляет собой антигенсвязывающий модуль. В некоторых вариантах реализации антигенсвязывающий модуль нацелен на антигены, присутствующие на опухолевых клетках или в окружающей среде опухолевых клеток.
В некоторых вариантах реализации вариант IL-2 связан по меньшей мере с одним модулем, не являющимся IL-2. В некоторых вариантах реализации вариант IL-2 и модуль, не являющийся IL-2, образуют слитый белок, что означает, что вариант IL-2 имеет общую пептидную связь с модулем, не являющимся IL-2. В некоторых вариантах реализации вариант IL-2 связан по меньшей мере с одним модулем, не являющимся IL-2, таким как первый модуль, не являющийся IL-2, и второй модуль, не являющийся IL-2. В некоторых вариантах реализации модуль, не являющийся IL-2 представляет собой антигенсвязывающий модуль. В некоторых вариантах реализации вариант IL-2 имеет общую пептидную связь с первым антигенсвязывающим модулем на амино- или карбоксильном конце, а второй антигенсвязывающий модуль имеет общую пептидную связь на амино или карбоксильном конце со следующими: i) IL-2 вариант; или ii) первый антигенсвязывающий модуль. В некоторых конкретных вариантах реализации вариант IL-2 имеет общую пептидную связь с первым модулем, не являющимся IL-2, на карбоксильном конце и имеет общую пептидную связь со вторым модулем, не являющимся IL-2, на амино-конце. В некоторых вариантах реализации модуль, не являющийся IL-2, представляет собой антигенсвязывающий модуль. Антигенсвязывающий модуль может представлять собой антитело или антигенсвязывающий фрагмент, содержащий, но не ограничиваясь ими, молекулы иммуноглобулина (например, иммуноглобулиноподобные молекулы IgG (например, lgG1)), антитела или их антигенсвязывающие фрагменты. В некоторых конкретных вариантах реализации антитело или его антигенсвязывающий фрагмент выбран из: полипептидного комплекса, содержащего вариабельную область тяжелой цепи антитела и вариабельную область легкой цепи антитела, Fab, Fv, sFv, F(ab') 2, линейное антитело, одноцепочечное антитело, scFv, sdAb, sdFv, нанотело, пептидное антитело пептитело, доменное антитело и мультиспецифическое антитело (биспецифическое антитело, диатело, триатело и тетратело, тандемное два-scFv, тандемное три-scFv). В случае, когда вариант IL-2 связан более чем с одним антигенсвязывающим модулем (например, с первым и вторым антигенсвязывающим модулем), каждый антигенсвязывающий модуль может быть независимо выбран из различных форм антител и антигенсвязывающих фрагментов, например, первый антигенсвязывающий модуль может представлять собой молекулу Fab, а второй антигенсвязывающий модуль может представлять собой молекулу scFv, или каждый из первого и второго антигенсвязывающих модулей представляет собой молекулу scFv, или каждый из первого и второго антигенсвязывающих модулей представляет собой молекулу Fab. В некоторых вариантах реализации, в случае, когда вариант IL-2 связан с более чем одним антигенсвязывающим модулем (например, с первым и вторым антигенсвязывающим модулем), антиген, на который нацелен каждый антигенсвязывающий модуль, может быть выбран независимо, например, первый и второй антигенсвязывающий модуль направлены против разных антигенов или против одного и того же антигена.
В некоторых вариантах реализации антиген, связанный антигенсвязывающим модулем, может быть выбран из группы, состоящей из: домена А1 тенасцина С (TNC А1), домена А2 тенасцина С (TNC А2), экстрадомена фибронектина (дополнительный домен В) (EDB), карциноэмбрионального антигена (СЕА) и ассоциированного с меланомой хондроитинсульфатного протеогликана (MCSP). В некоторых вариантах реализации опухолевые антигены включают, но не ограничиваются ими, MAGE, MART-1/Melan-A, gp100, дипептидилпептидазу IV (DPPIV), связывающий аденозиндезаминазу белок (ADAbp), циклофилин b, антиген, связанный с толстой кишкой (CRC)-C017-1A/GA733, карциноэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и САР-2, etv6, aml1, простата-специфический антиген (PSA) и его иммуногенные эпитопы PSA-1, PSA-2 и PSA-3, простата-специфический мембранный антиген (PSMA), Т-клеточный рецептор/CD3-дзета-цепь, семейство опухолевых антигенов MAGE (например, MAGE-A1, MAGE-А2, MAGE-А3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Хр3 (MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), семейство опухолевых антигенов GAGE (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназу, p53, семейство MUC, HER2/neu, p21ras, RCAS1, α-фетопротеин, Е-кадгерин, α-катенин, β-катенин и γ-катенин. P120ctn, gp100Pmel117, PRAME, NY-ESO-1, cdc27, белок аденоматозного полипоза coli (АРС), фодрин, коннексин 37, идиотип lg, р15, gp75, ганглиозиды GM2 и GD2, вирусные продукты (такие как белок вируса папилломы человека), семейство опухолевых антигенов Smad, lmp-1, Р1А, EBV-кодируемый ядерный антиген (EBNA)-1, гликогенфосфорилаза мозга, SSX-1, SSX-2 (HOM-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и CT-7 и c-erbB-2. В некоторых вариантах реализации неограничивающие примеры вирусных антигенов включают гемагглютинин вируса гриппа, LMP-1 вируса Эпштейна-Барра, гликопротеин Е2 вируса гепатита С, gp160 ВИЧ и gp120 ВИЧ. В некоторых вариантах реализации неограничивающие примеры антигенов ЕСМ включают синдекан, гепараназу, интегрин, остеопонтин, link, кадгерин, ламинин, ламинин EGF-типа, лектин, фибронектин, notch, тенасцин и матриксин.
В некоторых вариантах реализации вариант IL-2 или его производное, содержащее антигенсвязывающий модуль, описанный выше, содержит второй тип мутации, но не содержит третий тип мутации.
В некоторых вариантах реализации предложен способ повышения стабильности IL-2 или его производного или конъюгата, при этом способ включает введение мутации(ий) в IL-2, или его производное, или конъюгат, при этом указанная мутация(и) является/являются любой из 1)-7) или их комбинации:
1) N26Q,
2) N29S,
3) N30S,
4) N71Q,
5) Q11C и L132C,
6) L70C и Р82С, и
7) G27C и F78C.
В другом аспекте в настоящем раскрытии предложена фармацевтическая композиция, которая включает вариант IL-2 или его производное или иммуноконъюгат, описанный выше, необязательно включает фармацевтически приемлемый разбавитель, носитель или вспомогательное вещество. Фармацевтическая композиция может представлять собой лиофилизированный препарат или раствор для инъекций.
В некоторых конкретных вариантах реализации фармацевтическая композиция может содержать от 0,01 мас. % до 99 мас. % варианта IL-2 или его производного или иммуноконъюгата в однократной дозе; или количество варианта IL-2 или его производного или иммуноконъюгата, содержащееся в однократной дозе фармацевтической композиции, составляет 0,1-2000 мг (например, 1-1000 мг).
В другом аспекте в настоящем раскрытии предложена нуклеиновая кислота, кодирующая вариант IL-2 или его производное, описанное выше. Нуклеиновая кислота включает полинуклеотид, показанный в любой из последовательностей, выбранных из группы, состоящей из SEQ ID NO 3, SEQ ID NO 5, SEQ ID NO 7, SEQ ID NO 9, SEQ ID NO 11, SEQ ID NO 13, SEQ ID NO 15, SEQ ID NO 17, SEQ ID NO 19, SEQ ID NO 21, SEQ ID NO 23, SEQ ID NO 25, SEQ ID NO 27, SEQ ID NO 29, SEQ ID NO 31, SEQ ID NO 33, SEQ ID NO 35 и SEQ ID NO 40.
В некоторых вариантах реализации предложен экспрессионный вектор, содержащий нуклеиновую кислоту, кодирующую вариант IL-2 или его производное, описанное выше.
В другом аспекте предложена клетка-хозяин, экспрессирующая вектор, описанный выше. Клетка-хозяин может представлять собой прокариотическую или эукариотическую клетку. В некоторых конкретных вариантах реализации клетка-хозяин представляет собой клетку бактерии, дрожжей или млекопитающих; особенно Pichia pastoris или Saccharomyces cerevisiae.
В некоторых вариантах реализации клетка-хозяин содержит (например, была трансформирована или трансфицирована) вектор, содержащий полинуклеотид, кодирующий аминокислотную последовательность варианта IL-2 или его производного, или иммуноконъюгата, описанного выше. Клетка-хозяин включает прокариотический микроорганизм (такой как Escherichia coii) или различные эукариотические клетки (такие как клетки яичника китайского хомячка (СНО), клетки эмбриональной почки человека (НЕК) или лимфоциты (такие как клетки Y0, NS0, Sp20), клетки насекомых, так далее.) В некоторых вариантах реализации можно применять клетки-хозяева, экспрессирующие гликозилированные полипептиды, которые происходят из многоклеточных организмов (например, беспозвоночных и позвоночных), таких как клетки растений и насекомых. Клетки позвоночных также можно использовать в качестве клеток-хозяев, например, линии клеток млекопитающих, поддерживаемые в суспензии, линии CV1 почек обезьяны (COS-7), линии эмбриональных клеток почки человека (клетки 293 или 293Т), клетки почек детенышей хомяков (BHK), мышиные клетки Сертоли (клетки ТМ4), клетки почек обезьян (CV1), клетки почек африканских зеленых мартышек (VERO-76), клетки рака шейки матки (HELA), клетки почек собак (MDCK), гепатоциты крысы линии Buffalo (BRL3A), клетки легких человека (W138), гепатоциты человека (Hep G2), опухолевые клетки молочной железы мыши (ММТ060562), клетки TRI (например, описанные в Mather et al., Annals N.Y Acad Sci 383, 44-68 (1982)), клетки MRC5 и клетки FS4, клетки яичника китайского хомячка (СНО), линии клеток миеломы, такие как YO, NS0, Р3Х63 и Sp2/0, и клетки, содержащиеся в трансгенных животных, трансгенных растениях или культивируемых растениях или тканях животных.
В другом аспекте в настоящем изобретении предложено применение варианта IL-2 или его производного, иммуноконъюгата или фармацевтической композиции, содержащей то же, что описано выше, для получения лекарственного средства.
Вариант IL-2 или его производное будут применять для лечения пролиферативного заболевания, иммунного заболевания, для регулирования опосредованного Т-клетками иммунного ответа, для стимуляции иммунной системы у индивидуума и для получения соответствующего лекарственного средства, когда он содержит второй тип мутации. Пролиферативное заболевание может представлять собой опухоль или рак (например, метастатическую опухоль или рак), а также может представлять собой солидную опухоль (например, метастатическую почечно-клеточную карциному и злокачественную меланому). В некоторых вариантах реализации вариант IL-2 или его производное или его иммуноконъюгат согласно настоящему раскрытию можно применять для лечения заболеваний или состояний, при которых будет полезна стимуляция иммунной системы у хозяина, особенно состояний, при которых усиление клеточного иммунного ответа является желательным; такие состояния включают недостаточный или дефектный иммунный ответ хозяина. В некоторых вариантах реализации заболевания или состояния, при которых следует вводить вариант IL-2 или его производное или его иммуноконъюгат, относятся к опухолям или инфекциям, причем клеточный иммунный ответ является ключевым механизмом специфического иммунитета для этих опухолей или инфекций, таких как рак (например, почечно-клеточная карцинома или меланома), иммунодефицит (например, у ВИЧ-инфицированных пациентов, пациентов с ослабленным иммунитетом), хронические инфекции и тому подобное. В некоторых вариантах реализации усиленный клеточный иммунный ответ может включать любое одно или более из следующего: общее повышение иммунной функции, усиление функции Т-клеток, усиление функции В-клеток, восстановление функции лимфоцитов, повышенную экспрессию рецептора IL-2, усиление Т-клеточных ответов, повышенную активность естественных клеток-киллеров или повышенную активность активированных лимфокинами клеток-киллеров (LAK) и тому подобное. В некоторых вариантах реализации заболевание, которое лечат вариантом IL-2 или его производным или его иммуноконъюгатом согласно настоящему раскрытию, представляет собой пролиферативное расстройство, такое как рак. Неограничивающие примеры рака включают рак мочевого пузыря, рак мозга, рак головы и шеи, рак поджелудочной железы, рак легких, рак молочной железы, рак яичников, рак матки, рак шейки матки, рак эндометрия, рак пищевода, рак толстой кишки, коло ректальный рак, рак прямой кишки, рак желудка, рак простаты, рак крови, рак кожи, плоскоклеточный рак, рак костей и рак почек. Другие расстройства пролиферации клеток, которые можно лечить с помощью варианта IL-2 или его производного согласно настоящему раскрытию, включают, но не ограничиваются ими, новообразования, расположенные в следующих областях: брюшная полость, кость, грудь, пищеварительная система, печень, поджелудочная железа, брюшина, эндокринные железы (надпочечники, паращитовидные железы, гипофиз, яички, яичники, тимус, щитовидная железа), глаза, голова и шея, нервная система (центральная и периферическая), лимфатическая система, таз, кожа, мягкие ткани, селезенка, грудная клетка и мочеполовая система. Расстройства дополнительно включают предраковые состояния или поражения и метастазы рака. В некоторых вариантах реализации рак выбран из группы, состоящей из почечно-клеточной карциномы, рака кожи, рака легких, колоректального рака, рака груди, рака мозга, рака головы и шеи. Аналогичным образом, другие расстройства пролиферации клеток также можно лечить с помощью варианта IL-2 или его производного согласно настоящему раскрытию, включая, но не ограничиваясь ими: гипергаммаглобулинемию, лимфопролиферативные расстройства, парапротеинемии, пурпуру, саркоидоз, синдром Сезари, макроглобулинемию Вальденстрема, болезнь Гоше, гистиоцитоз; и любые заболевания, связанные с пролиферацией клеток, расположенных в системе органов, перечисленных выше, кроме неоплазии. В других вариантах реализации заболевание включает аутоиммунитет, отторжение трансплантата, посттравматический иммунный ответ и инфекционное заболевание (например, ВИЧ).
Вариант IL-2 или его производное будут применять для лечения аутоиммунного заболевания или облегчения/лечения/предотвращения аутоиммунной реакции, вызванной трансплантацией органа, если он содержит мутации третьего типа. Аутоиммунное заболевание может быть выбрано из группы, состоящей из: сахарного диабета I типа, ревматоидного артрита, множественного склероза, хронического гастрита, болезни Крона, Базедовой болезни, болезни Бехтерева, псориаза, миастении гравис, аутоиммунного гепатита, APECED, синдрома Чарга-Стросса, язвенного колита, гломерулонефрита, синдрома Гийена-Барре, тиреоидита Хашимото, склеротического лишая, системной красной волчанки, PANDAS, ревматической лихорадки, саркоидоза, синдрома Шегрена, синдрома ригидного человека, склеродермии, гранулематоза Вегенера, витилиго, аутоиммунной энтеропатии, геморрагического синдрома легких и нефрита (синдрома Гудпасчера), дерматомиозита, полимиозита, аутоиммунной аллергии и астмы. В некоторых вариантах реализации вариант IL-2 или его производное можно применять в комбинации с иммунодепрессантом. В некоторых вариантах реализации иммунодепрессант выбран из группы, состоящей из: глюкокортикоидов, включая декортин и преднизол; азатиоприна; циклоспорина А; микофенолята мофетила; такролимуса; анти-Т-лимфоцитарного глобулина, анти-CD3 антитела, включая муромонаб; анти-CD25 антитела, включая базиликсимаб и даклизумаб; анти-TNF-α антитела, включая инфликсимаб и адалимумаб; азатиоприна; метотрексата; циклоспорина; сиролимуса; эверолимуса; финголимода; CellCept; кишечнорастворимого майфортика натрия (майфортик); и циклофосфамида.
В некоторых вариантах реализации вариант IL-2 или его производное или его иммуноконъюгат согласно настоящему раскрытию не может способствовать полному излечению заболевания, а может вылечить его только частично. В некоторых вариантах реализации физиологические изменения, которые имеют некоторые преимущества, также считаются терапевтически благоприятными. Таким образом, в некоторых вариантах реализации количество варианта IL-2 или его производного, его иммуноконъюгата, которое обеспечивает физиологическое изменение, рассматривается как «эффективное количество» или «терапевтически эффективное количество». Субъект, пациент или индивидуум, нуждающиеся в лечении, обычно представляет собой млекопитающее, а точнее человека.
В некоторых вариантах реализации предложен способ введения субъекту варианта IL-2 или его производного или его иммуноконъюгата согласно настоящему раскрытию, в котором вариант IL-2 или его производное или его иммуноконъюгат вводят по меньшей мере два раза в день, по меньшей мере один раз в день, по меньшей мере один раз в 48 часов, по меньшей мере один раз в 72 часа, по меньшей мере один раз в неделю, по меньшей мере один раз в 2 недели, по меньшей мере один раз в месяц, по меньшей мере один раз в 2 месяца или по меньшей мере один раз в 3 месяца. IL-2 можно вводить любым эффективным путем, например с помощью парентеральной инъекции, включая подкожную инъекцию варианта IL-2 или его производного или его иммуноконъюгата.
В дополнительном аспекте в настоящем раскрытии предложен способ получения варианта IL-2, или его производного, или его иммуноконъюгата, который включает введение мутации(ий) варианта IL-2, описанного выше, в человеческий IL-2 дикого типа, или с применением последовательности нуклеиновой кислоты, описанной выше, или с применением экспрессионного вектора, описанного выше, или с применением клетки-хозяина, описанной выше. Способ получения варианта IL-2 в WO2012/107417 полностью включен в настоящее описание.
Краткое описание графических материалов
На Фигурах 1A-1F показаны экспериментальные результаты термостабильности для IL-2 дикого типа (WT) и его вариантов IL-2-01, IL-2-02, IL-2-03, IL-2-04 и IL-2-05 соответственно.
На Фигуре 2 показана аффинность IL-2 дикого типа (WT) и его вариантов IL-2-01, IL-2-02, IL-2-03, IL-2-04, IL-2-05, IL-2-06, IL-2-07, IL-2-08, IL-2-09 и IL-2-13 в отношении IL-2Rα, обнаруженная с помощью эксперимента ELISA.
Фигуры 3А-3С представляют собой результаты испытаний, которые демонстрируют пролиферацию клеток CTLL2, стимулированную посредством IL-2-10, IL-2-22, IL-2-23 и ПЭГилированным IL-2-10, ПЭГилированным IL-2-22 и ПЭГилированным IL-2-23, обнаруженные с помощью экспериментов ELISA.
Фигуры 4А-4С представляют собой результаты испытаний, которые демонстрируют пролиферацию клеток Мо7е, стимулированную посредством IL-2-10, IL-2-22, IL-2-23 и ПЭГилированным IL-2-10, ПЭГилированным IL-2-22 и ПЭГилированным IL-2-23, обнаруженные с помощью экспериментов ELISA.
На Фигуре 5 показаны экспериментальные результаты фосфорилирования STAT5 в клетках CTLL2 для IL-2-01, IL-2-02, IL-2-07, IL-2-08 и IL-2-09, обнаруженные с помощью проточной цитометрии.
На Фигурах 6А-6С показаны экспериментальные результаты фосфорилирования STAT5 в регуляторных Т-клетках периферической крови человека Treg (Фигура 6А), в CD8+T клетках (Фигура 6В) и в NK-клетках (Фигура 6С), стимулированных посредством IL-2-10, IL-2-22, IL-2-23 и ПЭГилированного IL-2-10, ПЭГилированного IL-2-22 и ПЭГилированного IL-2-23, соответственно.
Фигуры 7A-7D представляют собой экспериментальные результаты, показывающие влияние ПЭГ-IL-2-22 на количество мышиных NK-клеток (Фигура 7А), CD8+T клеток (Фигура 7В), CD4+T клеток (Фигура 7С) и Treg клеток (Фигура 7D) соответственно.
Фигуры 8А-8С представляют собой экспериментальные результаты, показывающие влияние ПЭГ-IL-2-24 на количество мышиных CD8+T клеток (Фигура 8А), CD4+T клеток (Фигура 8В) и Treg клеток (Фигура 8С) соответственно; на Фигурах 8D-8F показано соответствующее процентное соотношение CD8+T клеток к CD3+T клеткам (Фигура 8D), процентное соотношение CD4+T клеток к CD3+T клеткам (Фигура 8Е) и процентное соотношение Treg клеток к CD4+T клеткам (Фигура 8F) соответственно.
Фигура 9 представляет собой график, показывающий результаты противоопухолевого действия ПЭГ-IL-2-22 на модели рака толстой кишки мыши СТ26.
Фиг. 10 представляет собой график, показывающий результаты противоопухолевого эффекта ПЭГ-IL-2-22 на модели мыши NCG, с подкожно трансплантированной меланомой человека А375, смешанной с РВМС человека.
Подробное описание изобретения
Для более легкого понимания настоящего раскрытия некоторые технические и научные термины конкретно определены ниже. Если в настоящем документе не указано иное, все другие технические и научные термины, используемые в настоящем документе, имеют значение, обычно понимаемое специалистом в данной области техники, к которой относится это раскрытие.
Используемые в описании трехбуквенный код и однобуквенный код для аминокислот соответствуют описанию в J. Biol. Chem, 243, р3558 (1968).
Терминология
«Интерлейкин-2» или «IL-2» относится к любому природному IL-2 из любых источников позвоночных, включая млекопитающих, таких как приматы (такие как человек) и грызуны (такие как мыши и крысы). Термин охватывает непроцессированный IL-2, а также любые процессированные формы IL-2, полученные из клетки. Термин также охватывает встречающиеся в природе варианты IL-2, такие как варианты сплайсинга или аллельные варианты. Примерная аминокислотная последовательность человеческого IL-2 дикого типа представлена в SEQ ID NO 2. Непроцессированный человеческий IL-2 дополнительно содержит сигнальный пептид из 20 аминокислот на N-конце (как показано в SEQ ID NO 272 в WO2012107417), и сигнальный пептид отсутствует в зрелых молекулах IL-2.
«Аминокислотная мутация» относится к замене, делеции, вставке, модификации аминокислот и любой их комбинации для получения конечной конструкции, благодаря чему конечная конструкция обладает желаемыми характеристиками, такими как повышенная стабильность. Делеция и вставка аминокислотной последовательности включают делецию и вставку аминокислоты (аминокислот) на амино- и/или карбоксильном конце. Примером делеции на конце является делеция остатка аланина в первом положении полноразмерного человеческого IL-2. Предпочтительной аминокислотной мутацией является замена аминокислоты. Например, чтобы изменить аффинность связывания полипептидов IL-2, неконсервативная аминокислота (аминокислоты) может быть заменена (т.е. одна аминокислота может быть заменена другой аминокислотой, имеющей другую структуру и/или химические свойства). Предпочтительная замена аминокислоты включает замену гидрофобной аминокислоты на гидрофобную аминокислоту. Замена аминокислоты включает замену не встречающихся в природе аминокислот или производных 20 встречающихся в природе стандартных аминокислот (например, 4-гидроксипролин, 3-метилгистидин, орнитин, гомосерин, 5-гидроксилизин). Аминокислотные мутации могут быть получены с применением генетических или химических способов, известных в данной области техники, включая такие способы, как сайт-направленный мутагенез, ПЦР, синтез генов и химическая модификация.
«IL-2 дикого типа» является аналогичным варианту полипептида IL-2 в других отношениях, кроме того, что он представляет собой форму IL-2, имеющую аминокислоту дикого типа в каждом положении, соответствующем таковому у варианта полипептида IL-2. Например, если вариант IL-2 представляет собой полноразмерный IL-2 (т.е. IL-2, который не слит или не конъюгирован с какой-либо другой молекулой), то форма этого варианта дикого типа представляет собой полноразмерный природный IL-2. Если вариант IL-2 представляет собой слияние IL-2 с другим кодирующим полипептидом (таким как цепь антитела) ниже IL-2, то форма дикого типа такого варианта IL-2 представляет собой IL-2, имеющий аминокислотную последовательность IL-2 дикого типа, слитую с тем же нижележащим полипептидом. Кроме того, если вариант IL-2 представляет собой усеченную форму IL-2 (последовательность, в которой мутация(и) или модификация(и) осуществлены в неусеченной части IL-2), тогда форма дикого типа такого варианта IL-2 аналогичным образом представляет собой усеченный IL-2, имеющий последовательность дикого типа. Чтобы сравнить аффинность связывания рецептора IL-2 или биологическую активность между различными формами вариантов IL-2 и соответствующими формами IL-2 дикого типа, термин «дикий тип» охватывает встречающийся в природе IL-2, природный IL-2, форму IL-2, содержащую одну или более аминокислотных мутаций, которые не влияют на связывание с рецептором IL-2, например, замену аланина на цистеин в положении, соответствующем остатку 125 человеческого IL-2 (С125А). В некоторых вариантах реализации IL-2 дикого типа содержит аминокислотную последовательность, показанную в SEQ ID NO 2.
«Производные» предназначены для широкого толкования, включая любые продукты, родственные IL-2. Производное относится к гомологам, фрагментам или усеченным фрагментам человеческого и нечеловеческого IL-2, слитым белкам (таким как слитые с сигнальным пептидом или слитые с другими активными или неактивными ингредиентами, активными ингредиентами, такими как антитела или антигенсвязывающие фрагменты), но не ограничиваясь ими, их модифицированным формам (такие как пегилированные, гликозилированные, конъюгированные/слитые с альбумином, конъюгированные и/или слитые с Fc, гидроксиэтилированные и т.д.) и консервативно модифицированным белкам.
«CD25» или «альфа-субъединица рецептора IL-2» относится к любому природному CD25 из любых источников, относящихся к позвоночным, включая млекопитающих, таких как приматы (например, человек) и грызуны (например, мыши и крысы), включает «полноразмерные» непроцессированные CD25 и любые процессированные формы CD25, полученные из клеток, также включают встречающиеся в природе варианты CD25, такие как варианты сплайсинга или аллельные варианты. В некоторых вариантах реализации CD25 представляет собой CD25 человека, и примерная последовательность показана в SEQ ID NO 37.
«Рецептор IL-2 с высокой аффинностью» относится к гетеротримерной форме рецептора IL-2, которая состоит из γ-субъединицы рецептора (также известной как γ-субъединица универсального цитокинового рецептора, ус или CD132), β-субъединицы рецептора (также известной как CD122 или р70) и альфа-субъединицы рецептора (также известной как CD25 или р55). Напротив, «рецептор IL-2 со средней аффинностью» относится к рецептору IL-2, который включает только субъединицу γ и субъединицу β, но без субъединицы а (см., например, Olejniczak and Kasprzak, MedSci Monit 14, RA179-189 (2008)).
«Аффинность» относится к общей силе всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, рецептором) и связывающимся с ней партнером (например, лигандом). Если не указано иное, «аффинность связывания» в настоящей заявке относится к внутренней аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, рецептором и лигандом). Аффинность молекулы X к ее партнеру Y обычно можно выразить как константу диссоциации (KD), которая представляет собой отношение константы скорости диссоциации и ассоциации (Кдиссоциации и Кассоциации, соответственно). Таким образом, аффинности будут одинаковыми, пока соотношение констант скорости остается неизменным, однако константы скорости могут быть разными. Аффинность можно измерить обычными способами в данной области техники, включая способы, описанные в настоящей заявке.
«Регуляторная Т-клетка», или «Трегуляторная клетка», или «Тгед» относится к специализированному типу CD4+Т-клеток, который может подавлять ответ других Т-клеток. Treg характеризуются экспрессией α-субъединицы рецептора IL-2 (CD25) и фактора транскрипции forkhead box Р3 (FOXP3) и играют ключевую роль в индукции и поддержании периферической аутотолерантности к антигенам (включая те антигены, которые экспрессируются опухолями). IL-2 необходим для достижения функции, развития и индукции ингибирующих характеристик Treg.
«Эффекторная клетка» относится к популяции лимфоцитов, которые опосредуют цитотоксические эффекты IL-2. Эффекторные клетки включают эффекторные Т-клетки, такие как цитотоксические Т-клетки CD8+, NK-клетки, лимфокин-активированные киллеры (LAK) и макрофаги/моноциты.
«Антигенсвязывающий модуль» относится к молекуле полипептида, которая специфически связывается с антигенной детерминантой. В некоторых вариантах реализации антигенсвязывающий модуль может направлять конъюгированный фрагмент (например, цитокин (IL-2 или его варианты) и/или другой антигенсвязывающий модуль) к сайту-мишени, например к опухолевой клетке определенного типа или строме опухоли, имеющей специфическую антигенную детерминанту. Антигенсвязывающий модуль включает антитело и его антигенные фрагменты. Предпочтительный антигенсвязывающий модуль включает антигенсвязывающий домен антитела, который включает вариабельную область тяжелой цепи антитела и вариабельную область легкой цепи антитела. Антигенсвязывающий модуль может содержать константную область антитела. Как известно в данной области техники, доступная константная область тяжелой цепи относится к любому из следующих пяти изотипов: α, δ, ε, γ или μ. Доступная константная область легкой цепи относится к любому из следующих двух изотипов: к и λ. IL-2 или его вариант могут быть связаны с одним или более антигенсвязывающими модулями через одну или более линкерных последовательностей с образованием «иммуноконъюгата».
«Специфическое связывание» означает, что связывание является селективным для антигена и может отличаться от нежелательного или неспецифического взаимодействия. Способность антигенсвязывающего модуля связываться со специфической антигенной детерминантой может быть достигнута с помощью твердофазного иммуноферментного анализа (ELISA) или других способов, хорошо известных специалистам в данной области, таких как измерение с помощью технологии поверхностного плазмонного резонанса (анализ на приборе BIAcore) (Liljeblad et al., Glyco J17, 323-329 (2000)) и традиционные анализы связывания (Heeley, Endocr Res 28, 217-229 (2002)).
«Антитело» используется в настоящей заявке в самом широком смысле и охватывает различные структуры антител, если они проявляют желаемую антигенсвязывающую активность. Антитела относятся к моноклональным антителам, поликлональным антителам, мультиспецифическим антителам (например, биспецифическим антителам) и антигенсвязывающим фрагментам, но не ограничиваются ими. Антитела могут включать мышиные антитела, человеческие антитела, гуманизированные антитела, химерные антитела и антитела верблюдовых. В качестве примера антитело может представлять собой иммуноглобулин, который представляет собой структуру тетра-пептидной цепи, образованной двумя идентичными тяжелыми цепями и двумя идентичными легкими цепями, соединенными межцепочечной дисульфидной связью(ями). Аминокислотный состав и последовательность константной области тяжелой цепи иммуноглобулина различаются, что приводит к разной антигенности. Соответственно, иммуноглобулины можно разделить на пять категорий или изотипов иммуноглобулинов, а именно IgM, IgD, IgG, IgA и IgE. Соответствующие тяжелые цепи представляют собой μ-цепь, δ-цепь, γ-цепь, α-цепь и ε-цепь. Один и тот же тип lg можно разделить на разные подклассы в соответствии с различием в аминокислотном составе в шарнирной области и в соответствии с количеством и положением дисульфидных связей тяжелой цепи. Например, IgG можно разделить на lgG1, lgG2, lgG3 и lgG4. Легкую цепь можно разделить на каппа-цепь или лямбда-цепь в зависимости от различия в константной области. Каждый из пяти типов lg может иметь каппа-цепь или лямбда-цепь.
«Антигенсвязывающий фрагмент» относится к фрагментам Fab, фрагментам Fab', фрагментам F(ab')2, одноцепочечному Fv (т.е. sFv), нанотелам (т.е. VHH) и домену VH/VL, обладающим антигенсвязывающей активностью. Фрагмент Fv содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи антитела, но не включает константную область; фрагмент Fv представляет собой наименьший антигенсвязывающий фрагмент, содержащий все антигенсвязывающие сайты. Обычно антитело Fv также содержит полипептидный линкер между доменами VH и VL и может образовывать структуру, необходимую для связывания антигена. Различные линкеры можно применять для соединения вариабельных областей двух антител с образованием единой полипептидной цепи, которая называется одноцепочечным антителом или одноцепочечным Fv (sFv).
«Консервативная модификация» относится к аминокислотным и нуклеотидным последовательностям. Для конкретной нуклеотидной последовательности консервативная модификация относится к тем нуклеиновым кислотам, которые кодируют одинаковые или по существу одинаковые аминокислотные последовательности; или в случае, когда нуклеотид не кодирует аминокислотную последовательность, он относится по существу к таким же нуклеотидным последовательностям. Для аминокислотной последовательности «консервативная модификация» относится к замене аминокислот в белке другими аминокислотами с аналогичными характеристиками (такими как заряд, размер боковой цепи, гидрофобность/гидрофильность, конформация и жесткость основной цепи и т.д.), при этом частые изменения могут быть осуществлены без изменения биологической активности белка. В целом, специалисты в данной области техники понимают, что простая замена аминокислоты в несущественной области полипептида по существу не меняет биологическую активность (см., например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., Page 224, (4th edition)).
«ПЭГилирование» относится к присоединению по меньшей мере одной молекулы ПЭГ к другой молекуле (например, терапевтическому белку). Например, Адаген (ПЭГилированный состав аденозиндезаминазы) был одобрен для лечения тяжелого комбинированного иммунодефицита. Было показано, что связь с полиэтиленгликолем может предотвращать протеолиз (см., например, Sada et al., (1991) J. Fermentation Bioengineering 71: 137-139). В наиболее распространенной форме ПЭГ представляет собой линейный или разветвленный простой полиэфир, присоединенный к гидроксильной группе на одном конце, и имеет следующую общую структуру: НО-(CH2CH2O)n-СН2СН2-ОН. Чтобы связать ПЭГ с молекулами (полипептидами, полисахаридами, полинуклеотидами и небольшими органическими молекулами), ПЭГ можно активировать путем получения некоторых или двух производных ПЭГ, несущих функциональные группы на конце(ах). Обычным способом конъюгирования ПЭГ с белком является активация функциональной группы (групп), несущей ПЭГ, при этом функциональная группа подходит для взаимодействия с лизином и N-концевыми аминокислотными группами. В частности, общей реакционноспособной группой, участвующей в конъюгации, является α- или ε-аминогруппа лизина. Взаимодействие между ПЭГилированным линкером и белком может привести к присоединению фрагмента ПЭГ в основном в следующих положениях: альфа-аминогруппа на N-конце белка, эпсилон-аминогруппа на боковой цепи остатка лизина или имидазолил на боковой цепи остатка гистидина. Поскольку большинство рекомбинантных белков имеют одну α и множество ε аминогрупп и имидазольных групп, многие изомеры положения могут быть получены в соответствии с химическими свойствами связывающей группы.
«Вектор», «экспрессионный вектор» и «экспрессионная конструкция» являются синонимами и относятся к молекуле ДНК, которую применяют для введения определенного гена, функционально связанного с ДНК, и для направления экспрессии в клетках-мишенях, включая вектор, который служит в качестве автономно реплицирующейся структуры нуклеиновой кислоты, и вектор, введенный в геном клетки-хозяина, в которую введен вектор. Экспрессионный вектор в настоящей заявке содержит кассету экспрессии, которая обеспечивает транскрипцию большого количества стабильной мРНК. Как только экспрессионный вектор находится в клетке-мишени, кодируемая геном молекула рибонуклеиновой кислоты или белок образуется через систему транскрипции и/или трансляции клетки.
«Клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первоначально трансформированные клетки и потомство, полученное от них (независимо от количества пассажей). Потомство может не быть в точности таким же, как родительская клетка с точки зрения содержания нуклеиновых кислот, но может содержать мутацию (и). Мутированное потомство, полученное путем скрининга или отбора, имеющее ту же функцию или биологическую активность, что и функция или биологическая активность исходных трансформированных клеток, включены в настоящую заявку.
«Введение», «дозирование» и «лечение» применительно к животному, человеку, экспериментальному субъекту, клетке, ткани, органу или биологической жидкости относятся к приведению экзогенного фармацевтического, терапевтического, диагностического агента или композиции в контакт с животным, человеком, субъектом, клеткой, тканью, органом или биологической жидкостью. «Введение», «дозирование» и «лечение» могут, например, относиться к терапевтическим, фармакокинетическим, диагностическим, исследовательским и экспериментальным способам. Обработка клетки включает приведение реагента в контакт с клеткой, а также приведение реагента в контакт с жидкостью, при этом жидкость находится в контакте с клеткой. «Введение», «дозирование» и «лечение» также означают обработку in vitro или ex vivo, например, клетки, реагентом, диагностической, связывающей композицией или другой клеткой. «Введение» или «лечение» при применении к человеку, ветеринарному или исследовательскому объекту, относится к терапевтическому лечению, профилактическим или превентивным мерам, исследовательским и диагностическим применениям.
В настоящей заявке термин «лечить» означает введение внутрь или извне терапевтического агента, такого как любой из вариантов IL-2 и его производных, или композиции, содержащей варианты и их производные согласно настоящему раскрытию, субъекту, которому поставлен диагноз, который имеет предрасположенность к одному или более симптомам заболевания, в отношении которых терапевтическое средство обладает известной терапевтической активностью. Обычно агент вводят в количестве, эффективно облегчающем один или более симптомов заболевания у субъекта или популяции, подлежащей лечению, либо путем индукции регресса либо ингибирования прогрессирования такого симптома(ов) в любой клинически измеряемой степени.
Количество терапевтического агента, которое является эффективным для облегчения какого-либо конкретного симптома заболевания (также называемое «терапевтически эффективное количество»), может варьироваться в зависимости от различных факторов, таких как состояние болезни, возраст и масса тела субъекта, а также способность лекарственного средства вызывать у субъекта желаемую эффективность. Наличие облегчения симптома заболевания можно оценить с помощью любого клинического измерения, обычно используемого врачами или другими квалифицированными специалистами в области медицинских услуг для оценки степени тяжести или статуса прогрессирования этого симптома. Хотя вариант реализации настоящего раскрытия (например, способ лечения или промышленное изделие) может быть неэффективным для облегчения симптома(ов) целевого заболевания у каждого пациента, он должен ослаблять симптом(ы) целевого заболевания у статистически значимого количества субъектов, как определено любыми статистическими критериями, известными в данной области техники, такими как t-критерий Стьюдента, критерий хи-квадрат, U-критерий по Манну и Уитни, критерий Крускала-Уоллиса (Н-критерий), критерий Джонкхира-Терпстра и критерий Вилкоксона.
«Эффективное количество» включает количество, достаточное для улучшения или предотвращения симптома или признака медицинского состояния. Эффективное количество также означает количество, достаточное для обеспечения возможности или облегчения диагностики. Эффективное количество для конкретного субъекта или ветеринарного субъекта может варьироваться в зависимости от факторов, таких как состояние, подлежащее лечению, общее состояние здоровья субъекта, способ и доза введения, а также тяжесть побочных эффектов. Эффективным количеством может быть максимальная доза или протокол дозирования, позволяющий избежать значительных побочных или токсических эффектов.
Примеры
В дальнейшем настоящее раскрытие дополнительно описывается со ссылкой на следующие примеры. Однако объем настоящего раскрытия не ограничивается примерами.
Пример 1: Конструирование и экспрессия IL-2 дикого типа и его варианта
1. Синтез гена и конструирование рекомбинантного экспрессионного вектора
Синтезировали нуклеотидную последовательность человеческого IL-2 дикого типа, сайт рестрикции Nde I был введен на 5'-конце, а сайт рестрикции BamH I был введен на 3'-конце, нуклеотидная последовательность показана в SEQ ID NO 1 (сайты рестрикции Nde I и BamH I выделены курсивом). Аминокислотная последовательность IL-2 дикого типа представлена в SEQ ID NO 2.
>Нуклеотидная последовательность IL-2 дикого типа
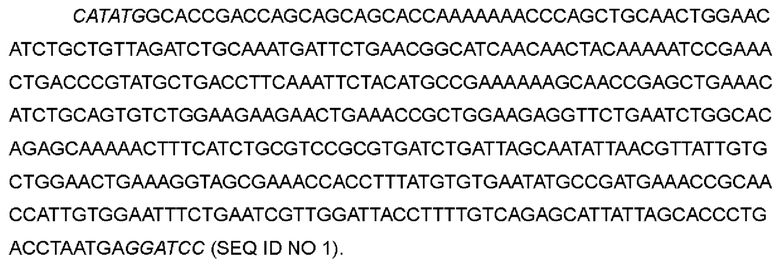
>Аминокислотная последовательность IL-2 дикого типа

После синтеза нуклеотидную последовательность IL-2 связывали с экспрессионным вектором Е, coli рЕТ-9а (Novagen, кат. номер 69431-3) через два сайта рестрикции, Nde I и BamH I, для получения экспрессионного вектора IL-2 дикого типа.
2. Введение аминокислотной мутации(ий), описанной в настоящем раскрытии, в аминокислотную последовательность IL-2 дикого типа.
В одном варианте аспарагин в положении 26 был заменен глутамином, а кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG с получением варианта IL-2-01.
Причем выделенная курсивом часть представляет собой участок рестрикции, а подчеркнутая часть представляет собой участок мутации, следующие последовательности указаны аналогичным образом.
>Нуклеотидная последовательность IL-2-01:
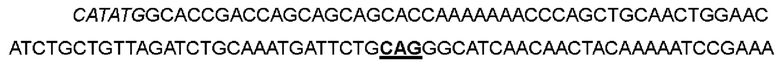
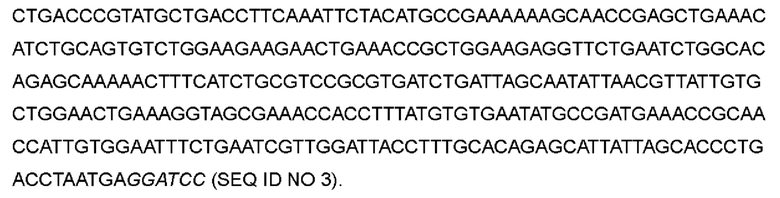
>Аминокислотная последовательность IL-2-01:

В одном варианте аспарагин в положении 30 был заменен серином, а кодон ААС в положениях 88-90 соответствующей нуклеотидной последовательности был мутирован до AGC с получением варианта IL-2-02.
>Нуклеотидная последовательность IL-2-02:
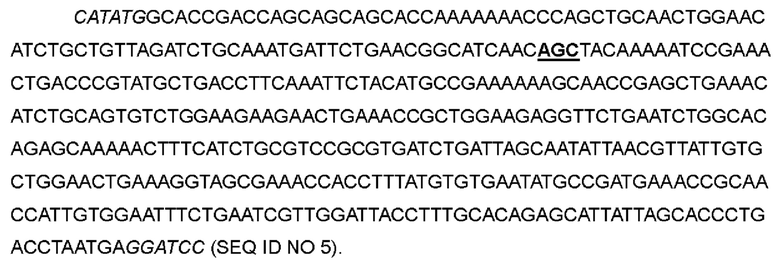
>Аминокислотная последовательность IL-2-02:

В одном варианте глутамин в положении 11 был заменен цистеином; кодон CAG в положениях 31-33 соответствующей нуклеотидной последовательности был мутирован до TGT; лейцин в положении 132 был заменен цистеином; кодон CTG в положениях 394-396 соответствующей нуклеотидной последовательности был мутирован до TGT, с получением варианта IL-2-03.
>Нуклеотидная последовательность IL-2-03:

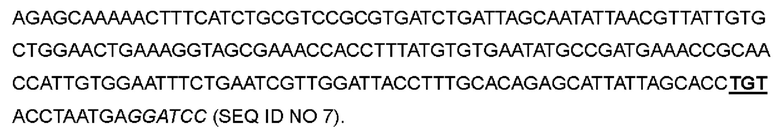
>Аминокислотная последовательность IL-2-03:

В одном варианте лейцин в положении 70 был заменен цистеином; кодон CTG в положениях 208-210 соответствующей нуклеотидной последовательности был мутирован до TGT; пролин в положении 82 был заменен цистеином; кодон CCG в положениях 244-246 соответствующей нуклеотидной последовательности был мутирован до TGT, с получением варианта IL-2-04.
>Нуклеотидная последовательность IL-2-04:
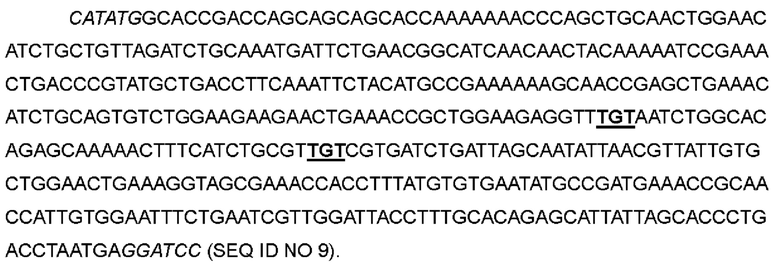
>Аминокислотная последовательность IL-2-04:

В одном варианте глицин в положении 27 был заменен цистеином; кодон GGC в положениях 79-81 соответствующей нуклеотидной последовательности был мутирован до TGT; фенилаланин в положении 78 был заменен цистеином; кодон ТТТ в положениях 232-234 соответствующей нуклеотидной последовательности был мутирован до TGT, с получением варианта IL-2-05.
>Нуклеотидная последовательность IL-2-05:
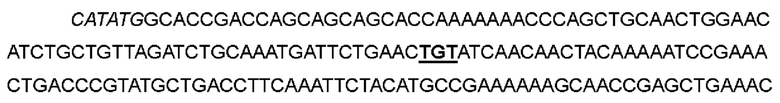
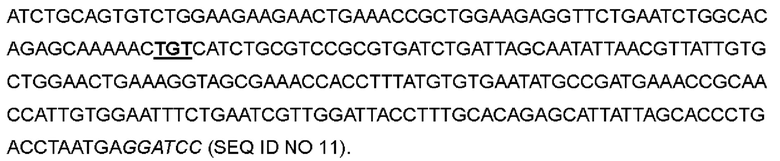
>Аминокислотная последовательность IL-2-05:

В одном варианте пептид в положениях 29-44 был заменен на QSMHIDATL; кодон AACAACTACAAAAATCCGAAACTGACCCGTATGCTGACCTTCAAATTC в положениях 85-132 соответствующей нуклеотидной последовательности был мутирован до CAG AG CATGC ATATTG ATG CAACCCTG с получением варианта IL-2-06.
>Нуклеотидная последовательность IL-2-06:
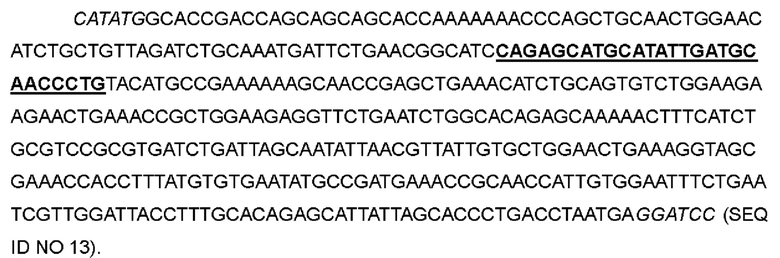
>Аминокислотная последовательность IL-2-06:

В одном варианте фенилаланин в положении 42 был заменен на аланин; кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; тирозин в положении 45 был заменен на аланин; кодон ТАС в положениях 133-135 соответствующей нуклеотидной последовательности был мутирован до GCA, с получением варианта IL-2-07.
>Нуклеотидная последовательность IL-2-07:
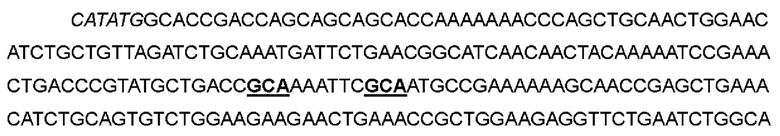

>Аминокислотная последовательность IL-2-07:

В одном варианте фенилаланин в положении 42 был заменен на аланин; кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; лейцин в положении 72 был заменен на глицин; кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC, с получением варианта IL-2-08.
>Нуклеотидная последовательность IL-2-08:
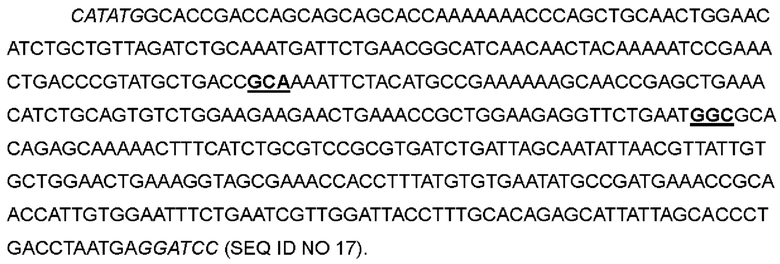
>Аминокислотная последовательность IL-2-08:

В одном варианте тирозин в положении 45 был заменен на аланин; кодон ТАС в положениях 133-135 соответствующей нуклеотидной последовательности был мутирован до GCA; лейцин в положении 72 был заменен на глицин; кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC, с получением варианта IL-2-09.
>Нуклеотидная последовательность IL-2-09:


>Аминокислотная последовательность IL-2-09:

В одном варианте аспарагин в положении 26 был заменен на глутамин; кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG; аспарагин в положении 30 был заменен на серии; кодон ААС в положениях 88-90 соответствующей нуклеотидной последовательности был мутирован до AGC; фенилаланин в положении 42 был заменен на аланин; кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; лейцин в положении 72 был заменен на глицин; кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC, с получением варианта IL-2-10.
>Нуклеотидная последовательность IL-2-10:
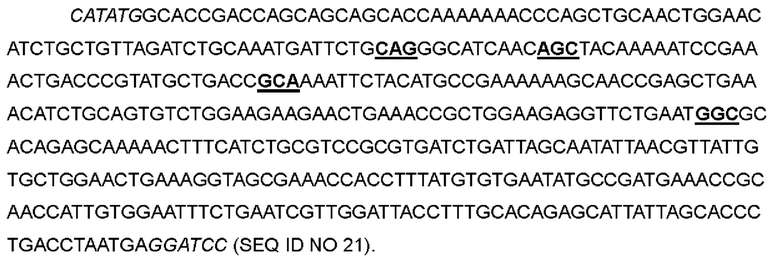
>Аминокислотная последовательность IL-2-10:

В одном варианте глутамин в положении 11 был заменен на цистеин, и кодон CAG в положениях 31-33 соответствующей нуклеотидной последовательности был мутирован до TGT; аспарагин в положении 26 был заменен на глутамин, кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG; аспарагин в положении 30 был заменен на серии, и кодон ААС в положениях 88-90 соответствующей нуклеотидной последовательности был мутирован до AGC; фенилаланин в положении 42 был заменен на аланин, и кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; лейцин в положении 72 был заменен на глицин; кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC; лейцин в положении 132 был заменен на цистеин, и кодон CTG в положениях 394-396 соответствующей нуклеотидной последовательности был мутирован до TGT, с получением варианта IL-2-11.
>Нуклеотидная последовательность IL-2-11:
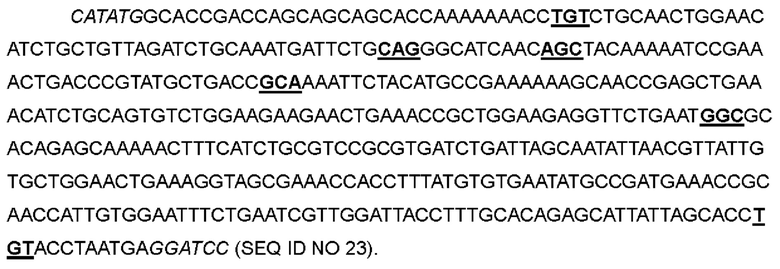
>Аминокислотная последовательность IL-2-11:

В одном варианте аспарагин в положении 26 был заменен на глутамин, и кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG; аспарагин в положении 30 был заменен на серии, кодон ААС в положениях 88-90 соответствующей нуклеотидной последовательности был мутирован до AGC; фенилаланин в положении 42 был заменен на аланин, и кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; лейцин в положении 70 был заменен на цистеин, и кодон CTG в положениях 208-210 соответствующей нуклеотидной последовательности был мутирован до TGT; лейцин в положении 72 был заменен на глицин; кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC; пролин в положении 82 был заменен на цистеин, кодон CCG в положениях 244-246 соответствующей нуклеотидной последовательности был мутирован до TGT, с получением варианта IL-2-12.
>Нуклеотидная последовательность IL-2-12:

>Аминокислотная последовательность IL-2-12:

В одном варианте аспарагин в положении 26 был заменен на глутамин, и кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG; глицин в положении 27 был заменен на цистеин, кодон GGC в положениях 79-81 соответствующей нуклеотидной последовательности был мутирован до TGT; аспарагин в положении 30 был заменен на серии, и кодон ААС в положениях 88-90 соответствующей нуклеотидной последовательности был мутирован до AGC; фенилаланин в положении 42 был заменен на аланин, и кодон ТТС в положениях 124-126 соответствующего нуклеозида был мутирован до GCA; лейцин в положении 72 был заменен на глицин, и кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC; фенилаланин в положении 78 был заменен на цистеин, и кодон ТТТ в положениях 232-234 соответствующей нуклеотидной последовательности был мутирован до TGT, с получением варианта IL-2-13.
>Нуклеотидная последовательность IL-2-13:

>Аминокислотная последовательность IL-2-13:

В одном варианте аспарагин в положении 29 был заменен на серии, и кодон ААС в положениях 85-87 соответствующей нуклеотидной последовательности был заменен на AGC; фенилаланин в положении 42 был заменен на аланин, кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; лейцин в положении 72 был заменен на глицин, и кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC, с получением варианта IL-2-14.
>Нуклеотидная последовательность IL-2-14:

>Аминокислотная последовательность IL-2-14:

В одном варианте аспарагин в положении 26 был заменен на глутамин, и кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG; аспарагин в положении 29 был заменен на серии, кодон ААС в положениях 85-87 соответствующей нуклеотидной последовательности был мутирован до AGC; фенилаланин в положении 42 был заменен на аланин, и кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; лейцин в положении 72 был заменен на глицин, и кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC, с получением варианта IL-2-21.
>Нуклеотидная последовательность IL-2-21:

>Аминокислотная последовательность IL-2-21:

В одном варианте аспарагин в положении 26 был заменен на глутамин, и кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG; аспарагин в положении 29 был заменен на серии, кодон ААС в положениях 85-87 соответствующей нуклеотидной последовательности был мутирован до AGC; фенилаланин в положении 42 был заменен на аланин, и кодон ТТС в положениях 124-126 соответствующей нуклеотидной последовательности был мутирован до GCA; аспарагин в положении 71 был заменен на глутамин, и кодон ААТ в положениях 211-213 соответствующей нуклеотидной последовательности был мутирован до CAG. Лейцин в положении 72 был заменен на глицин, и кодон CTG в положениях 214-216 соответствующей нуклеотидной последовательности был мутирован до GGC, с получением варианта IL-2-22.
>Нуклеотидная последовательность IL-2-22:

>Аминокислотная последовательность IL-2-22:

В одном варианте глутамин в положении 11 был заменен на цистеин, и кодон CAG в положениях 31-33 соответствующей нуклеотидной последовательности был мутирован до TGT; пептид в положениях 29-44 был заменен на QSMHIDATL, кодон AACAACTACAAAAATCCGAAACTGACCCGTATGCTGACCTTCAAATTC в положениях 85-132 соответствующей нуклеотидной последовательности был мутирован до CAGAGCATGCATATTGATGCAACCCTG; лейцин в положении 132 был заменен на цистеин, и кодон CTG в положениях 394-396 соответствующей нуклеотидной последовательности был мутирован до TGT, с получением варианта IL-2-23.
>Нуклеотидная последовательность IL-2-23:

>Аминокислотная последовательность IL-2-23:

В одном варианте аспарагин в положении 26 был заменен на глутамин, и кодон ААС в положениях 76-78 соответствующей нуклеотидной последовательности был мутирован до CAG; аспарагин в положении 29 был заменен на серии, кодон ААС в положениях 85-87 соответствующей нуклеотидной последовательности был мутирован до AGC; аспарагин в положении 88 был заменен на аргинин, и кодон ААТ в положениях 262-264 соответствующей нуклеотидной последовательности был мутирован до CGT, с получением варианта IL-2-24.
>Нуклеотидная последовательность IL-2-24:
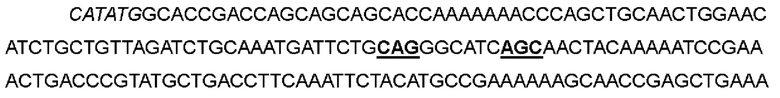

>Аминокислотная последовательность IL-2-24:

После синтеза последовательность гена каждого из вышеуказанных вариантов связывали с рЕТ-9а через два сайта рестрикции, Nde I и BamH I, с получением рекомбинантного экспрессионного вектора для каждого варианта IL-2.
3. Рекомбинантная экспрессия и получение IL-2 дикого типа и его варианта
Рекомбинантный экспрессионный вектор трансформировали в штамм BL21 (DE3) (Novagen, кат. номер 69450-3) для получения рекомбинантных бактерий для IL-2 дикого типа и его варианта, и рекомбинантные бактерии высевали на чашки LBc устойчивостью к Kan, для скрининга.
Отдельную колонию отбирали с помощью скрининга Kan и переносили в 10 мл среды LB, культивировали при 37°C, 220 об/мин до достижения OD600 1,2 плюс/минус 0,2, добавляли 50% глицерин до конечной концентрации 10% и частично упаковали в пробирки для криоконсервации (1 мл/пробирка) и хранили при -80°C.
Пробирку с замороженным глицерином брали и помещали на водяную баню при 37°C, инокулировали в 1 л среды LB, культивировали при 37°C, 220 об/мин до достижения OD600 от 0,6 до 1,0, добавляли 1М IPTG для получения конечной концентрации 1 мМ, индуцировали и культивировали при 37°C, 220 об/мин в течение 4 часов. После завершения индукции бактерии собирали.
Бактериальные клетки разрушали, тельца включения денатурировали, ренатурировали и очищали, целевой белок (IL-2 дикого типа и его варианты) получали путем тестирования.
Пример 2: Получение ПЭГилированного IL-2 и его варианта
Брали белок IL-2 в буферной системе 10 мМ уксусно-ацетатно-натриевого буфера рН 5,0 с концентрацией белка 2 мг/мл; в раствор белка IL-2 добавляли мПЭГ-бутиральдегид 20 кДа в воде, количество вещества мПЭГ-бутиральдегида в 1-2 раза превышало количество белка; в реакционную систему добавляли водный раствор цианоборгидрида натрия, количество вещества цианоборгидрида натрия в 50-100 раз превышало количество белка; реакцию проводили при 25°C в течение примерно 15-20 часов при перемешивании, добавляли водный раствор глицина для остановки реакции. Конечная концентрация глицина составляла 30 мМ. После реакции раствор ПЭГ-модификации очищали с помощью высокоэффективной жидкостной хроматографии с обращенной фазой для отделения примесей (таких как ди-/мульти-модифицированный и голый белок) от моно-ПЭГ-модифицированного IL-2. Целевой компонент собирали, буфер заменяли, и проводили анализ активности и связывающей способности.
Путем тестирования были получены ПЭГилированный IL-2 и его вариант.
Пример 3: Исследование стабильности IL-2 и его варианта 1. Химическая стабильность IL-2 дикого типа и его варианта Образец IL-2 дикого типа (буферная система: 10 мМ Трис-HCl, 50 мг/мл маннита, 0,18 мг/мл SDS, рН 8,5) инкубировали при 40°C в течение 30 дней для исследования стабильности, образец отбирали для анализа деградации с помощью пептидного картирования с применением жидкостной МС.
Метод обнаружения: отбирали образец 0,5 мл, добавляли 0,5 мл денатурирующего раствора (8 моль/л гидрохлорида гуанидина, 0,2 моль/л трис-HCl, рН 9,0), добавляли 8 мкл 1 моль/л DTT (дитиотреитол) и хорошо перемешивали, инкубировали на водяной бане при 25°C в течение 1 часа. Затем добавляли 35 мкл 0,5 моль/л IAC и инкубировали на водяной бане при 25°C в течение 1 часа. Образец растворяли в буфере для гидролиза (2 моль/л мочевины, 50 ммоль/л Tris-HCl, рН 8,3) путем замены буфера через колонку PD-10. После замены буфера к 0,5 мл образца добавляли 12,5 мкг трипсина и инкубировали на водяной бане при 25°C в течение 18 часов, добавляли соляную кислоту для остановки реакции, и осуществляли пептидное картирование с применением жидкостной МС.
См. Таблицу 2, в которой приведены результаты тестирования пептидного картирования с применением жидкостной МС. После хранения в течение 30 дней, в отношении рестрикциоиного фрагмента 9-32, включающего N26 и N29 (т.е. пептидный фрагмент аминокислот в положении 9-32), были обнаружены три фрагмента со значительным увеличением дезаминирования (т.е. 9-32А, 9-32В, 9-32С). В процессе изучения вариантов была исследована стабильность двух вариантов IL-2-08 (F42A/L72G) и IL-2-22 (N26Q/N29S/F42A/N71Q/L72G), и были отобраны образцы для обнаружения деградации. Способ представлял собой такой же, как и для IL-2 дикого типа. Результаты представлены в Таблице 2.
Результаты экспериментов показывают, что три фрагмента со значительным увеличением дезаминирования могут быть обнаружены на пептидном фрагменте 9-32 как IL-2-08, так и IL-2 дикого типа, с аналогичным увеличением дезаминирования, что указывает на то, что мутация F42A/L72G не влияет на дезаминирование пептидного фрагмента 9-32. С другой стороны, мутации N26 и N29 как в IL-2-22, так и в IL-2-24, снижали дезаминирование фрагментов в этих двух положениях. Через 30 дней было обнаружено, что увеличение количества дезаминированных фрагментов составило менее 0,5% (не показано в таблице), что указывает на то, что N26Q и N29S могут повышать стабильность IL-2.
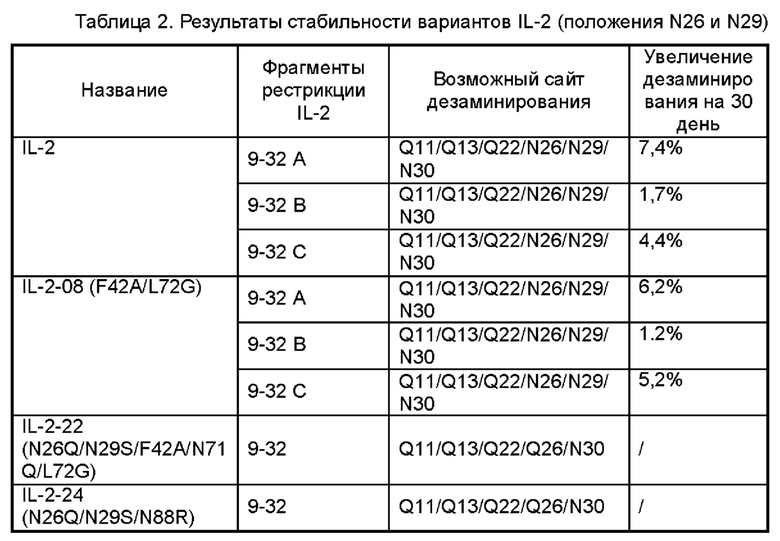
Кроме того, в IL-2-08 (F42A/L72G) четыре фрагмента со значительным увеличением дезаминирования (т.е. 55-76А, 55-76В, 55-76С, 55-76D) были обнаружены в рестрикционной последовательности 55-76. Исследовали действие мутации N71 в Q, а именно IL-2-22 (N26Q/N29S/F42A/N71Q/L72G); и результаты стабильности показаны в Таблице 3. Мутация в положении N71 снижает количество дезаминированных фрагментов в рестрикционной последовательности 55-76, снижает увеличение дезаминирования, значительно улучшает дезаминирование и стабилизирует белок; тем самым дизайн оправдывает ожидания.
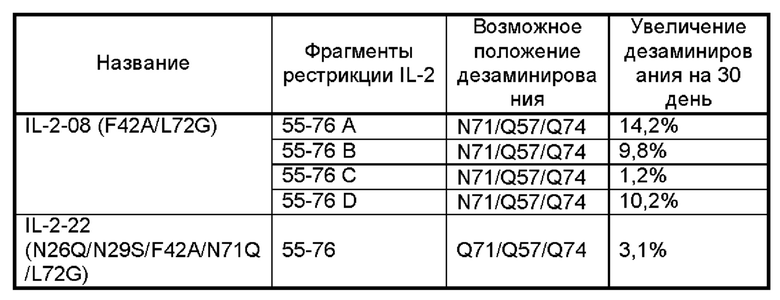
2. Термостабильность IL-2 дикого типа и его варианта
Стабильность образца IL-2 с концентрацией 1 мг/мл (буферная система представляла собой буфер 10 мМ уксусная кислота-ацетат натрия, рН 4,5, 10% трегалозы) изучали с помощью прибора Uncle (Unchained labs). Температуру образца повышали с 25°C до 95°C со скоростью 0,3°C/мин. В то же время триптофан в образце возбуждали на длине волны 266 нм, и наблюдали эмиссию образца на длине волны 300-400 нм. Температуру плавления (Tm) рассчитывали по следующей формуле, где λ - длина волны (300-400 нм), I (λ) - интенсивность излучения на этой длине волны, и ВСМ - барицентрическое среднее значение, длина волны которого оценивается на основании интенсивности света.
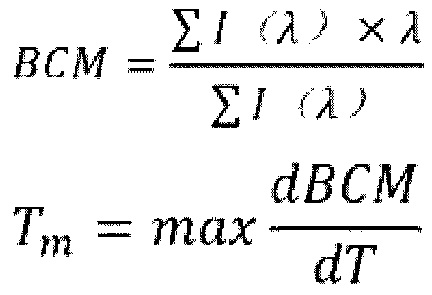
При повышении температуры параметры ВСМ образца изменяются, отражая изменение конформации белка. Для IL-2 дикого типа существуют две температуры плавления, что указывает на то, что IL-2 проходит две стадии, прежде чем полностью развернется. Энергия, необходимая для первой стадии разворачивания, ниже, чем для второй стадии. Хотя мутации N26Q и N30S в основном не влияют на первую температуру плавления, но значительно увеличивают вторую температуру плавления; в то время как IL-2-03, IL-2-04 и IL-2-05 не имеют первой температуры плавления, а вторая температура плавления также значительно выше, чем у дикого типа.
Результаты испытаний на термостабильность варианта IL-2 показаны на Фигурах 1A-1F и в Таблице 4. Экспериментальные результаты показывают, что мутации N26Q, N30S, Q11C/L132C, L70C/P82C и G27C/F78C улучшают термостабильность IL-2.
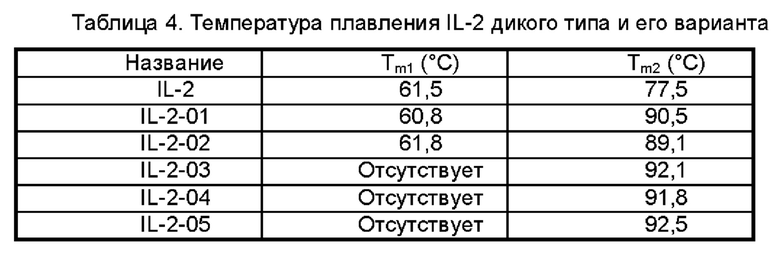
Пример 4: Определение аффинности связывания варианта IL-2 с рецептором интерлейкина 2 альфа (IL-2Rα)
ELISA использовали для определения свойств связывания IL-2 и его варианта с IL-2Rα. Рекомбинантный белок IL-2Rα с гистидиновой меткой покрывали, и добавляли IL-2, затем активность связывания антитела с антигеном определяли путем добавления поликлонального антитела против IL-2, конъюгированного с HRP, и субстрата HRPTMB.
96-луночный микротитровальный планшет покрывали 2 мкг/мл рекомбинантного белка IL-2Rα с гистидиновой меткой (SinoBiological, кат. номер 10165-Н08Н) и инкубировали в течение ночи при 4°C. Планшет промывали промывочным раствором трижды по 250 мкл на лунку. При каждой промывке планшет встряхивали в течение 10 секунд, чтобы обеспечить достаточную промывку. Добавляли 200 мкл/лунку блокирующего раствора и инкубировали при комнатной температуре в течение 2 часов. Планшет промывали промывочным раствором трижды по 250 мкл на лунку. При каждой промывке планшет встряхивали в течение 10 секунд, чтобы обеспечить достаточную промывку. В каждую лунку добавляли 100 мкл IL-2 и его варианта, разведенного раствором для разведения. Планшет инкубировали в течение 1 часа при комнатной температуре. Планшет промывали промывочным раствором трижды по 250 мкл на лунку. В каждую лунку добавляли 100 мкл меченного HRP поликлонального антитела против IL-2 (SinoBiological, кат. номер 11848-Т16), разведенного до 0,1 мкг/мл раствором для разведения. Планшет инкубировали в течение 1 часа при комнатной температуре. Планшет промывали промывочным раствором трижды по 250 мкл на лунку. В каждую лунку добавляли 100 мкл ТМВ, и реакцию проводили в течение 15 минут в темноте. В каждую лунку добавляли 50 мкл 0,16 М серной кислоты. Считывающее устройство для микропланшетов Thermo MultiSkanFc использовали для считывания значения OD при 450 нм, и рассчитывали значение ЕС50 для связывания IL-2 и его варианта с IL-2Rα.
Данные ELISA по связыванию вариантов из примера 4 с IL-2Rα показаны на Фигуре 2 и в Таблице 5. Результаты показывают, что первый тип мутации (а именно мутации N26Q, N30S, Q11C/L132C, L70C/P82C, G27C/F78C и N29S) не влияет на связывание IL-2 с IL-2Rα; тогда как второй тип мутации (а именно F42A/Y45A, F42A/L72G, Y45A/L72G, мутация до QSMHIDATL в положениях 29-44) значительно снижают связывание IL-2 с IL-2Rα; связывание IL-2 с IL-2Ra практически невозможно наблюдать в экспериментальных условиях. Связывание IL-2 с IL-2Rα также снижается из-за присутствия второго типа мутации, когда два типа мутации сочетаются.
>IL-2Rα (гистидиновая метка)

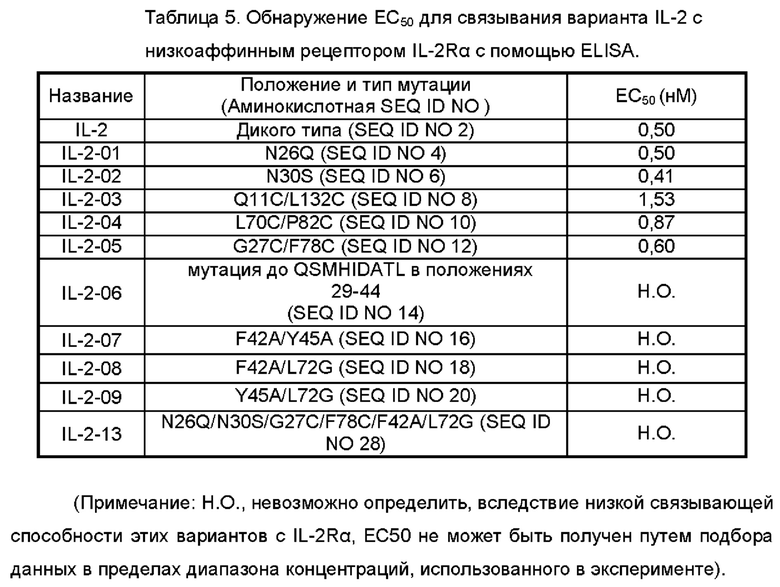
Octet RED96e (Fortebio) использовали для определения аффинности IL-2, ПЭГ-IL-2-10, ПЭГ-IL-2-22 и ПЭГ-IL-2-23 к IL-2Rα.
Биосенсор HIS1K (Fortebio, 18-5120) погружали в 200 мкл буфера (натрий-фосфатный буфер (PBS), рН 7,4, 0,02% твин-20, 0,1% BSA) на 10 минут для обработки смачиванием. Затем человеческий IL-2Rα с гистидиновой меткой (SinoBiological, кат. номер 10165-Н08Н) растворяли в PBS рН 7,4, 0,02% твин-20 и 0,1% BSA, и датчик помещали в 200 мкл такого раствора. Датчик помещали в 200 мкл буфера (PBS рН 7,4, 0,02% твин-20, 0,1% BSA) для смывания избытка IL-2Rα. Затем ПЭГ-IL-2-10, ПЭГ-IL-2-22 и ПЭГ-IL-2-23 разбавляли до 133,3 нМ буфером (PBS рН 7,4, 0,02% твин-20 и 0,1% BSA) соответственно. Датчик помещали в растворы IL-2 с разными концентрациями и выдерживали в течение 300 секунд для связывания. Затем датчик помещали в 200 мкл 1 × PBS, рН 7,4, 0,02% твин-20, 0,1% BSA, на 600 секунд для диссоциации IL-2. Результаты экспериментов в Таблице 6 показывают, что ни один из ПЭГ-IL-2-10, ПЭГ-IL-2-22 и ПЭГ-IL-2-23 не связывается с IL-2Rα.

Пример 5: Определение аффинности связывания IL-2 и его варианта с рецептором IL-2 бета/гамма (IL-2Rβ/γ)
Эксперимент Biacore использовали для определения способности связывания IL-2 и его варианта с IL-2Rβ/γ в Примере 1.
Сначала субъединицы IL-2Rβ и IL-2Rγ были клонированы и слиты с Fc впадиной и Fc выступом (SEQ ID NO 38 и 39), соответственно, для получения молекулы-инструмента гетеродимера IL-2Rβ/γ-Fc. IL-2Rβ-Fc-впадина и IL-2Ry-Fc-выступ совместно трансфицировали в клетки HEK293. Гетеродимер очищали с применением белка А, а затем молекулярного сита Superdex 200. Белок IL-2Rβ/γ был получали при тестировании.
>IL-2Rβ (Fc впадина)

>IL-2Rγ (Fc выступ)

Сенсорный чип белка A (GE, кат. номер 29127556) прибора Biacore (Biacore T200, GE) использовали для захвата IL-2Rβ/γ-Fc, при этом IL-2Rβ/γ-Fc разбавляли посредством 1 × HBS-EP до 1 мкг/мл и пропускали со скоростью 10 мкл/мин в течение 30 секунд. Затем серию градиентов концентрации IL-2 и его варианта пропускали через поверхность чипа со скоростью 30 мкл/мин, связывание сохранялось в течение 120 секунд, а диссоциация поддерживалась в течение 360 секунд. Прибор Biacore (Biacore Х100, GE) применяли для обнаружения реакции в реальном времени и получения кривых ассоциации и диссоциации. После завершения каждого цикла диссоциации чип промывали и регенерировали с применением 10 мМ Gly-HCl рН 1,5. Экспериментальные данные были адаптированы к модели связывания 1:1, и были получены значения, представляющие способность связывания IL-2 и его варианта с рецептором со средней аффинностью IL-2Rβ/γ, как показано в Таблице 7.
Результаты показывают, что все мутации N26Q, N30S, Q11C/L132C, L70C/P82C, G27C/F78C, F42A/Y45A, F42A/L72G, Y45A/L72G, N26Q/N30S/F42A/L72G, мутация до QSMHIDATL в положениях 29-44 и их комбинация мало влияют на связывание IL-2 с IL-2Rβ/γ.
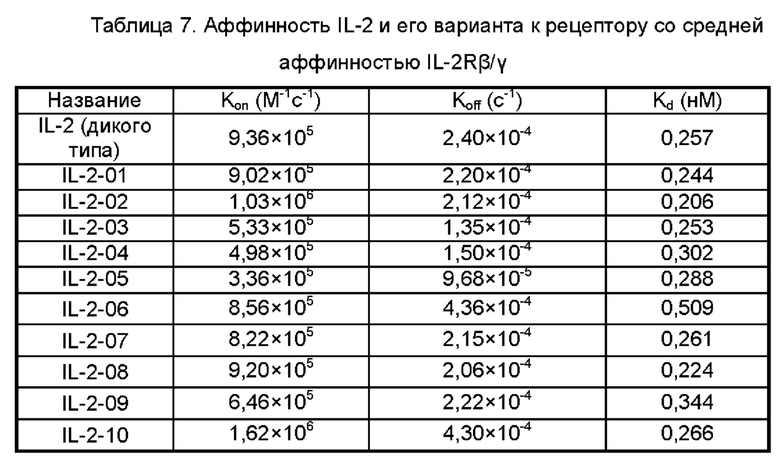
Аналогичный способ использовали для определения аффинности ПЭГ-IL-2-10, ПЭГ-1b-2-22 и ПЭГ-IL-2-23 к IL-2Rβ/γ с применением Biacore. Результаты показаны в Таблице 8. Результаты показывают, что вариант IL-2 при связывании с ПЭГ демонстрирует пониженное связывание с IL-2Rβ/γ до определенной степени, но все же сохраняет сильную аффинность. Результаты экспериментов показывают, что IL-2-24 редко связывается с IL-2R(3 по сравнению с IL-2 дикого типа, что указывает на то, что N26Q/N29S/N88R снижает связывание IL-2 с IL-2R0 (результаты не показаны в настоящем документе).

Пример 6: Жизнеспособность клеток, опосредованная рецептором с высокой аффинностью IL-2Rα/β/γ IL-2 и его вариантом
CTLL2 представляет собой клеточную линию, полученную от мыши, которая совместно экспрессирует IL-2Rα, β и γ, что может быть использовано для оценки жизнеспособности клеток, опосредованной рецептором с высокой аффинностью IL-2Rα/β/γ каждого варианта IL-2. При различных концентрациях IL-2 или его варианта была определена скорость пролиферации CTLL-2 для оценки биологической активности IL-2 или его варианта.
Полная культуральная среда: RPMI 1640 плюс 2 мМ L-глутамин плюс 1 мМ пируват натрия плюс 10% фетальной телячьей сыворотки плюс 10% T-STIM с добавлением конканавалина-А(содержащего IL-2); Основная среда: RPMI 1640 плюс 2 мМ L-глутамин плюс 1 мМ пируват натрия плюс 10% фетальная бычья сыворотка.
Эксперимент по пролиферации клеток CTLL-2: клетки CTLL-2 культивировали в полной культуральной среде при 37°C, 5% CO2 для достижения плотности 2,0×105 клеток/мл, клетки субкультивировали, и клетки CTLL-2 собирали центрифугированием через 3-4 дня. Клетки промывали 3 раза посредством PBS и повторно суспендировали в основной культуральной среде для получения клеточной суспензии, содержащей 2,0×105 клеток на мл, и инкубировали в 96-луночном планшете с 90 мкл клеток на лунку. Добавляли 10 мкл 10-кратного концентрированного раствора IL-2, приготовленного на основной культуральной среде, до соответствующей концентрации. Клетки инкубировали при температуре 37°C и 5% CO2. После инкубации в течение 24 часов в каждую лунку добавляли 100 мкл раствора для лизиса реагента CELLTITER-Glo (Promega) и смешивали с раствором в планшете для клеток. Планшет помещали в считывающее устройство для микропланшетов с длиной волны 630 нм, измеряли оптическую плотность на длине волны 570 нм и записывали результаты измерений.
Данные были адаптированы с использованием компьютерной программы или четырехпараметрического алгоритма регрессии, и результаты вычислений были рассчитаны следующим образом:
Относительная биологическая активность тестируемого образца (%) - ЕС50 эталонного образца/ЕС50 тестируемого образца (ЕС50: концентрация для 50% максимального эффекта).
Данные по активности IL-2 и его варианта показаны в Таблице 9, Таблице 10 и Фигурах 3А-3С. Результаты показывают, что первый тип мутации (а именно мутации N26Q, N29S, N30S, Q11C/L132C, L70C/P82C и G27C/F78C) не влияют или даже незначительно усиливают активность IL-2, способствуя пролиферации клеток CTLL2; тогда как второй тип мутации (т.е. F42A/Y45A, F42A/L72G, Y45A/L72G и мутация до QSMHIDATL в положениях 29-44) снижает связывание IL-2 с IL-2Rα, а также снижает активность IL-2, что способствует пролиферации клеток CTLL2.
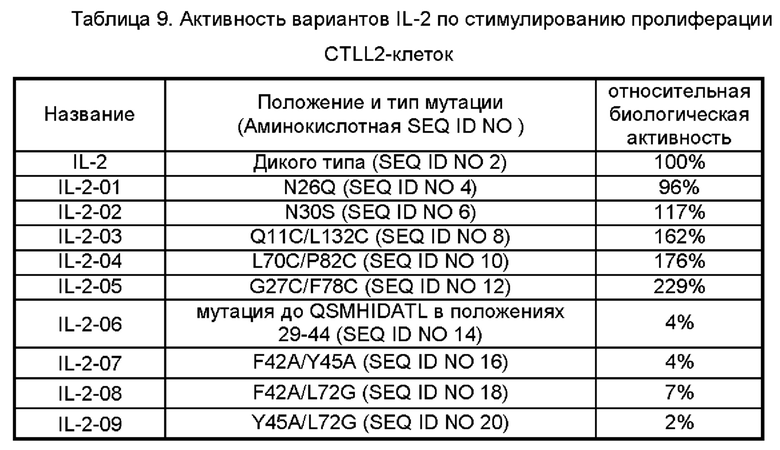
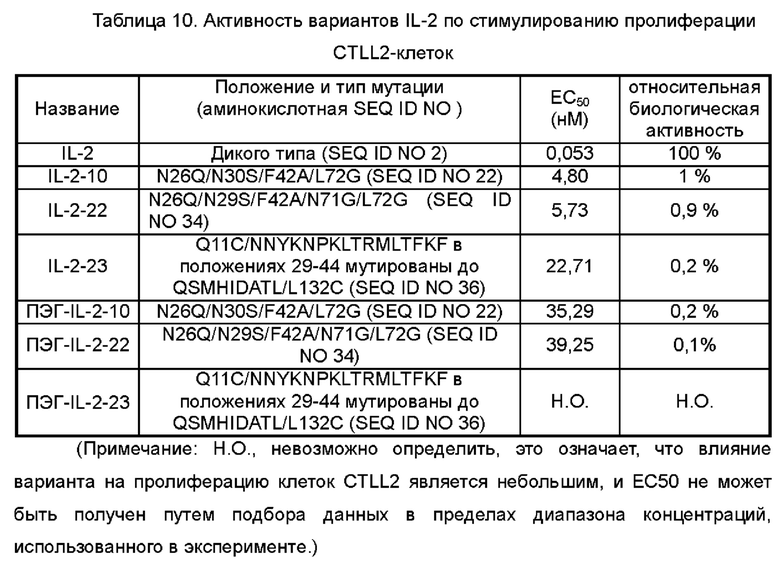
Пример 7: Жизнеспособность клеток, опосредованная рецептором со средней аффинностью IL-2Rβ/γ IL-2 и его вариантом
Мо7е представляет собой клеточную линию человеческого происхождения, которая экспрессирует только IL-2Rβ и γ, но не экспрессирует IL-2Rα. Мо7е можно применять для оценки жизнеспособности клеток, опосредованной рецептором со средней аффинностью IL-2Rβ/γ каждого варианта IL-2. При различных концентрациях IL-2 или его варианта определяли скорость пролиферации Мо7е, зависящую от клеточной линии, для оценки биологической активности IL-2 или его варианта.
Полная культуральная среда: RPMI 1640 плюс 2 мМ L-глутамин плюс 1 мМ пируват натрия плюс 10% фетальная телячья сыворотка плюс 15 нг/мл GM-CSF; основная среда: RPMI 1640 плюс 2 мМ L-глутамин плюс 1 мМ пируват натрия плюс 10% фетальная бычья сыворотка.
Эксперимент по пролиферации клеток Мо7е: Клетки Мо7е культивировали в полной культуральной среде при 37°C, 5% CO2 для достижения плотности 2,0×105 клеток/мл, клетки субкультивировали, и клетки Мо7е собирали центрифугированием через 3-4 дня. Клетки промывали 3 раза посредством PBS и повторно суспендировали в основной культуральной среде для получения клеточной суспензии, содержащей 2,0×105 клеток на мл, и инкубировали в 96-луночном планшете с 90 мкл клеток на лунку. Добавляли 10 мкл 10-кратного концентрированного раствора IL-2, приготовленного на основной культуральной среде, до соответствующей концентрации. Клетки инкубировали при температуре 37°C и 5% CO2. После инкубации в течение 72 часов в каждую лунку добавляли 100 мкл раствора для лизиса реагента CELLTITER-Glo (Promega) и смешивали с раствором в планшете для клеток. Планшет помещали в считывающее устройство для микропланшетов с длиной волны 630 нм, измеряли оптическую плотность на длине волны 570 нм и записывали результаты измерений. Тот же способ, что и в Примере 6, применяли для расчета относительной биологической активности.
Данные по активности пролиферации клеток Мо7е для IL-2 и его варианта показаны в Таблице 11 и на Фигурах 4А-4С. Результаты показывают, что ни первый тип мутации (а именно мутации N26Q, N29S, N30S, Q11C/L132C, L70C/P82C и G27C/F78C), ни второй тип мутации (a именно F42A/Y45A, F42A/L72G, Y45A/L72G и мутация до QSMHIDATL в положениях 29-44) не влияют на активность IL-2, чтобы способствовать пролиферации клеток Мо7е, что указывает на то, что они не влияют на аффинность IL-2 KlL-2Rβ/γ. Связывание IL-2 с ПЭГ снижает активность IL-2, чтобы способствовать пролиферации клеток Мо7е до определенной степени, но все же сохраняя желаемое связывание.
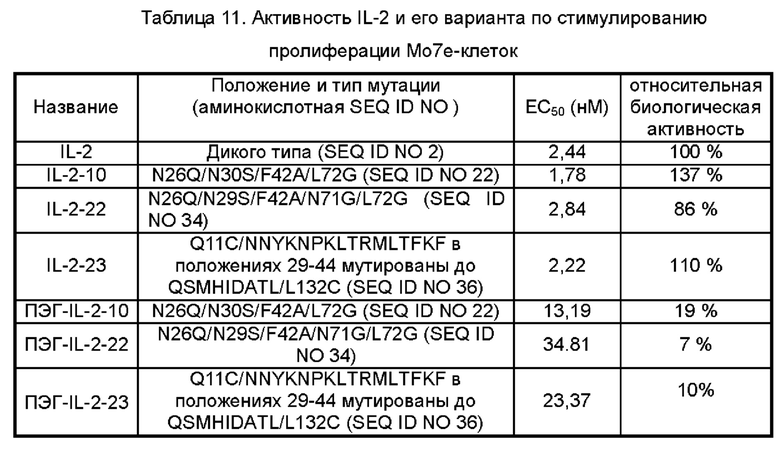
Пример 8: Определение активности IL-2 и его варианта в фосфорилировании STAT5 в клетках CTLL2
Биологическую активность IL-2 или его варианта определяли на основании уровня фосфорилирования STAT5 в клеточно-зависимом штамме CTLL-2 при различных концентрациях IL-2 или его варианта.
Полная культуральная среда: RPMI 1640 плюс 2 мМ L-глутамин плюс 1 мМ пируват натрия плюс 10% фетальной бычьей сыворотки плюс 10% T-STIM с добавлением конканавалина-А(содержащего IL-2); Основная среда: RPMI 1640 плюс 2 мМ L-глутамин плюс 1 мМ пируват натрия плюс 10% фетальная бычья сыворотка.
Эксперимент по фосфорилированию STAT5 в клетках CTLL-2: клетки CTLL-2 культивировали в полной культуральной среде при 37°C и 5% CO2 для достижения плотности 2,0×105 клеток на мл и промывали посредством PBSA (PBS, рН 7,2, 1% BSA) один раз, и плотность доводили до 1,0×106 клеток на мл, и клетки помещали в пробирки по 500 мкл на пробирку. Соответствующие концентрации концентрированного раствора IL-2, приготовленного с основной культуральной средой, инкубировали при комнатной температуре в течение 20 минут; немедленно добавляли параформальдегид до конечной концентрации 1,5%, перемешивали на вортексе и инкубировали при комнатной температуре в течение 10 минут. Добавляли 1 мл PBS и центрифугировали при 4°C, 1400 об/мин в течение 5 минут для удаления параформальдегида. Клетки ресуспенд провал и, добавляли 1 мл 100% предварительно охлажденного метанола при 4°C и перемешивали на вортексе, клетки инкубировали при 4°C в течение 20 минут. Добавляли 3 мл буфера PBSA и центрифугировали при 4°C, 1400 об/мин в течение 5 минут. Клетки дважды промывали. Антитело против STAT5-pY694, конъюгированное с Alexa Fluor 647 (BD, каталожный номер 612599), инкубировали в течение 30 минут при комнатной температуре в темноте. Клетки дважды промывали 3 мл PBSA и детектировали на проточном цитометре. Способ, описанный в Примере 6, использовали для расчета относительной биологической активности.
Данные об активности IL-2 и его варианта в фосфорилировании STAT5 в клетках CTLL2 показаны на Фигуре 5 и в Таблице 12. Результаты показывают, что мутации N26Q, N29S и N30S не влияют или даже незначительно усиливают активность IL-2 в фосфорилировании STAT5 в клетках CTLL2, тогда как F42A/Y45A, F42A/L72G и Y45A/L72G снижают активность IL-2 в фосфорилировании STAT5 в клетках CTLL2. Таким образом, можно доказать, что N26Q, N29S и N30S не влияют на связывание IL-2 с рецептором IL-2Rα/β/γ с высокой аффинностью, тогда как F42A/Y45A, F42A/L72G и Y45A/L72G снижают связывание IL-2 с рецептором IL-2Rα/β/γ c высокой аффинностью.
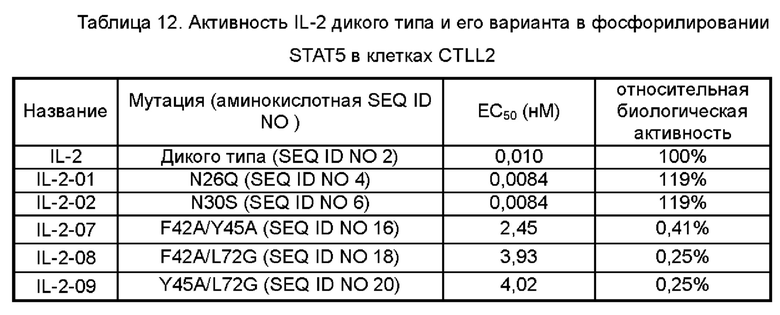
Пример 9: Определение активности IL-2 и его варианта в фосфорилировании STAT5 в периферической крови человека (РВМС)
Биологическую активность IL-2 определяли на основании уровня фосфорилирования STAT5 в различных популяциях клеток периферической крови человека (включая Treg, NK-клетки, CD4+Т-клетки и CD8+Т-клетки) при различных концентрациях IL-2 или его варианта.
Основная среда: RPMI 1640+10% фетальная бычья сыворотка.
Смесь антител: CD3 АРС-Су7 (BD 557832), CD4 ВВ515 (BD 564419), CD8 ВВ700 (BD 566452), CD25 BV421 (BD 564033), FOXP3 РЕ (BD 560852), CD56 BV650 (BD 564057), pSTATS AF647 (BD 562076).
Эксперимент по фосфорилированию STATS в PBMC человека: плотность свежевыделенных клеток PBMC человека доводили до плотности 6,0×106 клеток на мл с помощью основной среды, и 90 мкл добавляли в 96-луночный планшет.IL-2 и его вариант и его производное разбавляли основной средой до 1000 нМ, 100 нМ, 10 нМ, 1 нМ, 0,1 нМ, 0,01 нМ; 10 мкл из которых добавляли в 90 мкл РВМС и стимулировали при 37°C в течение 15 минут. Затем клетки немедленно фиксировали предварительно нагретым буфером BD Cytofix (BD, каталожный №554655) при 37°C в течение 10 минут. Клетки центрифугировали при 350 g в течение 7 минут при 4°C. Супернатант удаляли, добавляли 200 мкл буфера BD Phosflow Perm Buffer III (BD, каталожный №558050), предварительно охлажденного при -20°C на льду в течение 30 минут для расщепления клеточной мембраны. Клетки центрифугировали при 450 g в течение 7 минут при 4°C. Супернатант удаляли, добавляли 200 мкл PBS с рН 7,4 для двукратной промывки. Добавляли 100 мкл блокатора FcR, разведенного в соотношении 1:200, и инкубировали при 4°C в течение 20 минут. Образец центрифугировали при 450 g в течение 7 минут при 4°C. Супернатант удаляли, добавляли 100 мкл смеси антител, и клетки окрашивали при комнатной температуре в течение 40 минут. Образец центрифугировали при 450 g в течение 7 минут при 4°C. Супернатант удаляли, добавляли 200 мкл PBS с рН 7,4 для однократной промывки. Добавляли 200 мкл PBS с рН 7,4, чтобы повторно суспендировать РВМС для обнаружения с помощью проточного цитометра. NK-клетки были определены как CD3-CD56+ клетки, CD8+T клетки были определены как CD3+CD4-CD8+ клетки, а Treg были определены как CD3+CD4+CD25+Foxp3+ клетки.
Для трех популяций клеток, описанных выше, значения флуоресценции pSTATS (MFI) при различных концентрациях IL-2 были суммированы, подогнаны с использованием компьютерной программы или четырехпараметрического алгоритма регрессии, и относительная биологическая активность была рассчитана в соответствии со способом, аналогичным Примеру 6.
Результаты показывают, что F42A/L72G и мутация(и) в IL-2-10 и IL-2-23 только уменьшают связывание IL-2 с IL-2Rα, но не влияют на связывание IL-2 с IL-2Rβ/γ; поэтому снижение активности в Treg, вызванное этими мутациями, больше, чем снижение активности в CD8+T клетках и NK-клетках. Напротив, поскольку N88R не влияет на связывание IL-2 с IL-2Rα, но снижает связывание IL-2 с IL-2Rβ, следовательно, снижение активности в Treg, вызванное IL-2, меньше, чем в CD8+T клетках. IL-2, когда он соединен с ПЭГ, в определенной степени приводит к снижению воздействия IL-2 на активацию CD8+T клеток и NK-клеток.
Данные об активности варианта IL-2 в фосфорилировании STAT5 в клетках РВМС показаны в Таблице 13, Таблице 14, Таблице 15 и Фигурах 6А-6С.

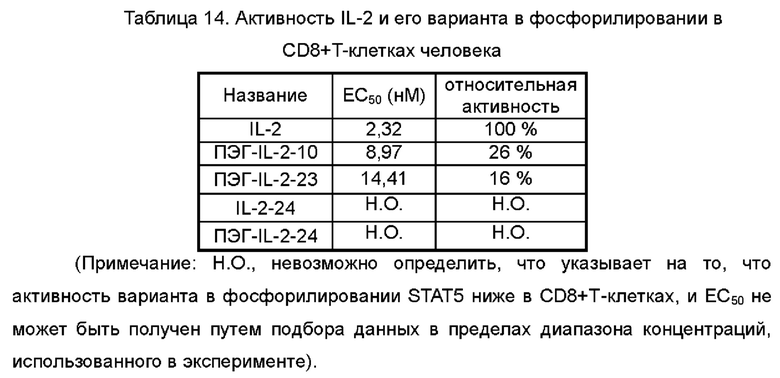
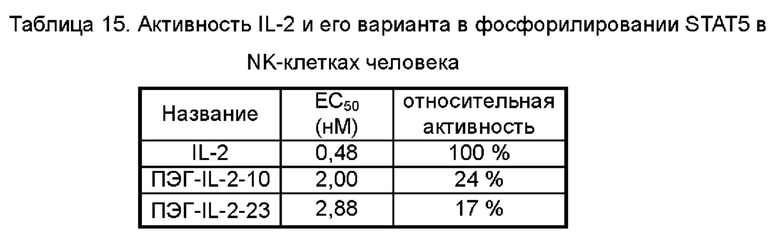
Пример 10: Определение действия IL-2 и его варианта на иммунные клетки периферической крови мышей Balb/c
Мышам BALB/c (приобретенным у Shanghai Lingchang Biotechnology Co., Ltd.), самкам в возрасте 4-8 недель, массой 18-20 г, позволяли акклиматизироваться в течение 5 дней перед формальным экспериментом. Всех мышей BALB/c выращивали в ИВК для животных класса SPF с системой постоянной температуры и давления, где температура составляла от 20 до 26°C, влажность от 40 до 70%, а световой цикл составлял 12 часов света/12 часов в темноты. В каждой клетке содержали не более 6 мышей BALB/c. Размер клетки составлял 325 мм × 210 мм × 180 мм. Подстилочный материал в клетках представлял собой стержни кукурузных початков, который обновляли дважды в неделю. В течение всего эксперимента все лабораторные мыши получали свободный доступ к пище и питью, а корм и воду автоклавировали и обновляли дважды в неделю. Весь персонал, входящий в виварий и выходящий из него, или операторы экспериментов носили стерильную лабораторную одежду, одноразовые медицинские маски и резиновые перчатки. Каждая клетка имела соответствующую четкую и подробную этикетку. На этикетке были указаны: регистрационный номер IACUC LDIACUC006, количество животных, пол, линия, дата включения, номер позиции, объединение в группы, текущая стадия эксперимента и ответственное лицо за эксперимент и т.д. На протяжении всего эксперимента работу и наблюдение за экспериментальными животными осуществляли в соответствии с правилами эксплуатации и содержания животных AAALAC. В соответствии с обычным процессом эксперимента отслеживали и регистрировали поведение, потребление корма и воды, изменение массы, блеск шерсти и другие аномальные состояния всех лабораторных животных.
Мышей группировали в соответствии с массой тела, и введение начинали после объединения в группы. Тип введения, доза и способ введения показаны в Таблице 16 и на Фигурах 7A-7D. День, в который мышей объединяли в группы, установлен как день 0.
Кровь собирали в каждый момент времени и измеряли объем крови, свежесобранную кровь с антикоагулянтом лизировали с применением лизата для эритроцитов для лизирования эритроцитов, и один раз промывали PBS. Смешанный окрашивающий раствор готовили с PBS, содержащим 1% FBS. Смешанный окрашивающий раствор содержал CD3 АРС-Су7 (Biolegend 100329), CD8 РЕ (Biolegend 100708), CD4 РЕ-Су7 (eBioscience 25-0042-82), CD25 PerCP-Cy5.5 (BD 561112) и CD49b-APC (Biolegend 108909). К каждому образцу добавляли 100 мкл смешанного окрашивающего раствора и инкубировали при 4°C в течение 30 минут. Образец дважды промывали PBS, содержащим 1% FBS. Набор буферов для факторов транскрипции True-Nuclear™ (Biolegend 424401) использовали для фиксации образцов в течение 60 минут для расщепления клеточной мембраны. 100 мкл антитела против антитела мыши Foxp3 (Biolegend 126405) инкубировали в течение 60 минут при комнатной температуре. Образцы дважды промывали промывочным раствором PBS с рН 7,4 и, наконец, ресуспендировали в 500 мкл промывочного раствора PBS с рН 7,4 для анализа на приборе. NK-клетки были определены как CD3-CD49b+ клетки, CD8+T клетки были определены как CD3+CD4-CD8+ клетки, a Treg были определены KaKCD3+CD4+CD25+Foxp3+ клетки. По объему забора крови рассчитывали плотность клеток каждой группы клеток в периферической крови.
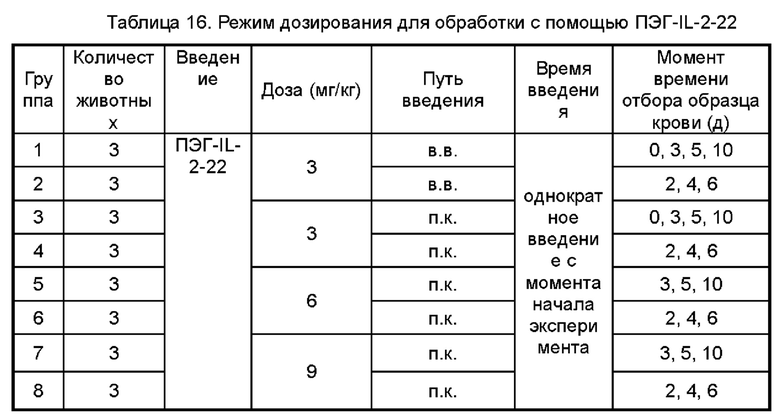
Во время эксперимента ПЭГ-IL-2-22 вводили посредством инъекции в хвостовую вену в день 0, кровь мышей собирали и анализировали с помощью проточной цитометрии в дни 0, 2, 3, 4, 5, 6 и 10 соответственно. Результаты определения плотности каждой популяции клеток в крови показывают, что плотность CD3-CD49b+ NK-клеток в клетках цельной крови мышей значительно увеличивается на 3-й день в зависимости от дозы по сравнению с таковой в 0-й день, и в 10-й день плотность в основном возвращается к уровню до начала дозирования. Плотность CD8+T клеток значительно увеличивается на 3-й день дозозависимым образом и в основном возвращается к уровню до начала дозирования на 5-й день. Плотность регуляторных Т-клеток (Treg) значительно увеличивается на 3-й день, плотность в основном возвращается к уровню до начала дозирования на 4-й день.
Во время эксперимента все группы мышей, которым вводили различные дозы ПЭГ-IL-2-22, которые должны быть протестированы, не проявляют потери массы тела или аномального поведения, что указывает на то, что мыши имеют благоприятную переносимость лекарственного средства в исследуемых дозах.
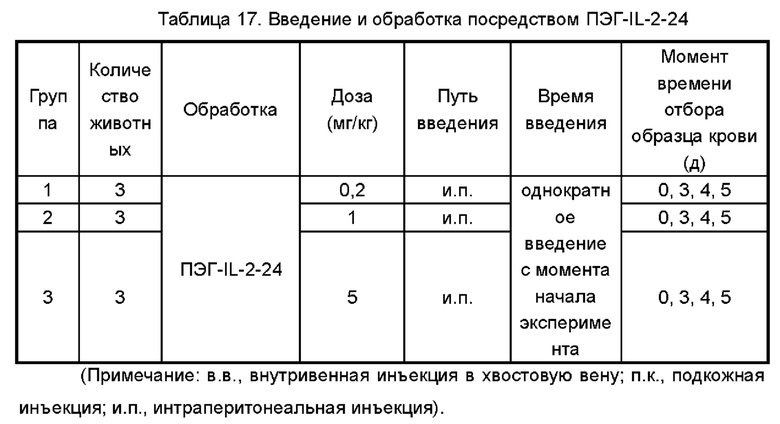
Результаты показывают, что ПЭГ-IL-2-24 может стимулировать пролиферацию Treg в высоких (5 мг/кг), средних (1 мг/кг) и низких (0,2 мг/кг) дозах после трех дней введения дозозависимым образом; процентное содержание CD4+T клеток и CD8+T клеток в CD3+T клетках не изменяется при трех дозах, что свидетельствует о преимущественной активации Treg посредством ПЭГ-11.-2-24. Результаты показаны на Фигурах 8A-8F.
Пример 11: Оценка эффективности IL-2 и его варианта на мышиных моделях опухоли рака толстой кишки, полученной у мышей
Мышиные клетки аденокарциномы толстой кишки CT26.WT (из банка клеток Китайской академии наук (SIBC), Шанхай) размножали после размораживания клеток поколения Р4+1 и культивировали в среде DMEM, содержащей 10% фетальной бычьей сыворотки (FBS). Клетки CT26.WT в фазе экспоненциального роста собирали, ресуспендировали в HBSS до 1×106/мл, трансплантировали подкожно мышам BALB/c в асептических условиях, и каждой мыши инокулировали 1*105 клеток. Когда объем опухоли достигал 80-100 мм3, животных разделили на группы. Первое введение начинали после распределения по группам. Подробный способ введения, доза и путь введения показаны в Таблице 18. День, в который мышей распределяли по группам, установлен как день 0.
Таблица 18. Режим дозирования ПЭГ-IL-2-22
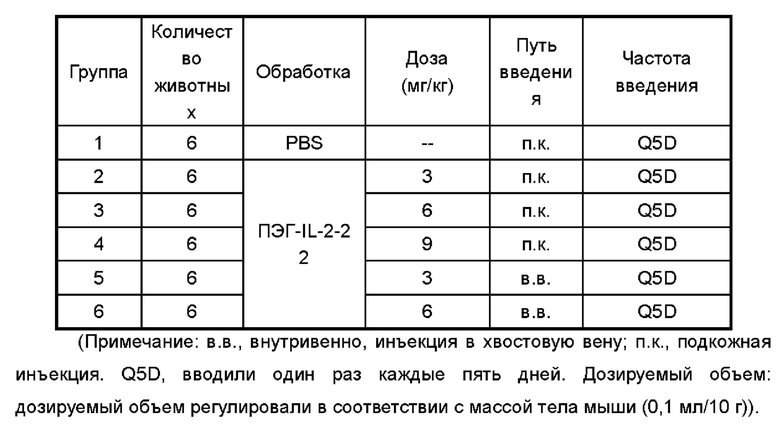
После начала введения массу тела и объем опухоли мышей измеряли 3 раза в неделю, и рассчитывали объем опухоли по формуле: объем опухоли (мм3)=0,5 × (длинный диаметр опухоли × короткий диаметр опухоли2). Относительную степень ингибирования опухоли TGI (%) рассчитывали как: TGI %=(1-Т/С)×100%. Т/С% представляет собой относительную скорость роста опухоли (т.е. относительная процентная величина объема опухоли или массы опухоли между группой обработки и контрольной группой в определенный момент времени). Т и С представляют собой объем опухоли (TV) или массу опухоли (TW) группы обработки и контрольной группы в определенный момент времени соответственно. Результаты экспериментов показаны в Таблице 19 и на Фигуре 9.
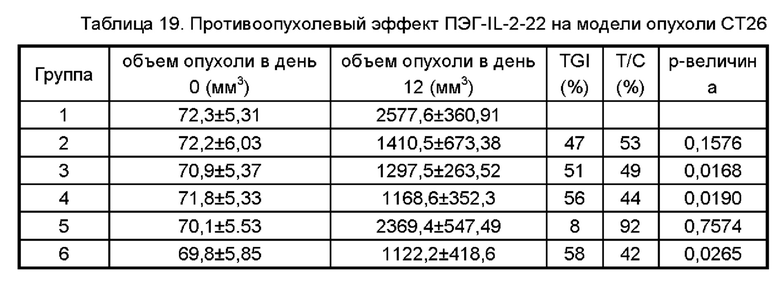
В данном эксперименте эффективность ПЭГ-IL-2-22 с различными дозами и разными способами введения исследовали на модели аллотрансплантата СТ26 клеток рака толстой кишки мышей. Результаты показывают, что: в группе с подкожным введением средней дозы (G3), ПЭГ-IL-2-22 6 мг/кг п.к. Q5D*5 показывает средний объем опухоли 1297,5 плюс/минус 263,52 мм3 на 12-й день после введения, что значительно ниже, чем в контрольной группе в тот же день (при объеме опухоли 2577,6 плюс/минус 360,91 мм3, TGI равен 51%, р равно 0,0168). В группе с подкожным введением высокой дозы (G4), ПЭГ-IL-2-22 9 мг/кг п.к. Q5D*5 показывает средний объем опухоли 1168,6 плюс/минус 352,3 мм3 на 12-й день после введения, что значительно ниже, чем в контрольной группе в тот же день (при объеме опухоли 2577,6 плюс/минус 360,91 мм3, TGI равен 56%, р равно 0,0190). В группе с внутривенным введением средней дозы (G6) ПЭГ-IL-2-22 6 мг/кг в.в. Q5D*5 показывает средний объем опухоли 1122,2 плюс/минус 418,6 мм3 на 12-й день после введения, что значительно ниже, чем в контрольной группе в тот же день (при объеме опухоли 2577,6 плюс/минус 360,91 мм3, TGI равен 58%, р равно 0,0265).
Пример 12: Оценка эффективности IL-2 и его варианта на мышиной модели опухоли меланомы человека
Мыши NCG, самки, возрастом 4-8 недель, массой примерно 18-22 г, были приобретены у Jiangsu GemPharmatech Biotechnology Co., Ltd. Всех мышей NCG выращивали в ИВК для животных класса SPF с системой постоянной температуры и давления.
Клетки А375 культивировали в среде DMEM, содержащей 10% фетальной бычьей сыворотки (FBS). Клетки А375 в фазе экспоненциального роста собирали, и HBSS ресуспендировали до подходящей концентрации для подкожной инокуляции опухоли мышам NCG. Клетки А375, используемые для совместного культивирования, следует обработать митомицином С в течение 2 часов, а затем трижды промыть PBS. Нормальную периферическую кровь человека собирали для отделения РВМС человека центрифугированием в градиенте плотности, и подсчитывали количество клеток. Затем РВМС ресуспендировали до концентрации 3×106 клеток/мл в среде RPMI1640 (содержащей IL-2 и 10% FBS) и совместно культивировали с клетками А375, обработанными митомицином С. После 8 дней совместного культивирования собирали РВМС, а также собирали только что расщепленные клетки А375. Каждой мыши инокулировали: РВМС 8×105, клетки А375 4×106; Объем инокуляции: 0,2 мл/мышь (включая 50% матригеля); подкожно инокулировали в правый бок самок мышей NCG, всего инокуляция была проведена 30 мышам. Мышей случайным образом делили на группы по массе тела. Подробный режим введения, доза и путь введения показаны в Таблице 20. День, в который мышей распределяли по группам для введения, установлен как день 0.
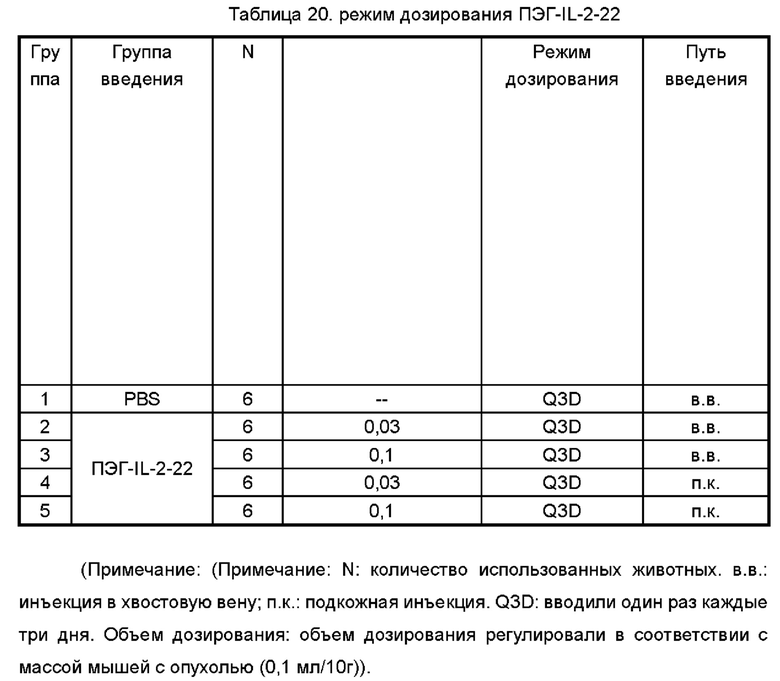
После начала введения массу и объем опухоли мышей измеряли дважды в неделю. Результаты экспериментов показаны в Таблице 21 и на Фигуре 10 соответственно.
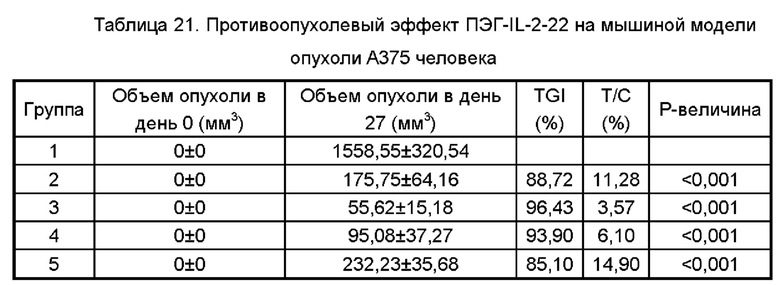
В конце эксперимента (27 день после введения) объем опухоли и масса опухоли в группе введения ПЭГ-IL-2-22 (0,03 мг/кг, инъекция в хвостовую вену), в группе введения ПЭГ-IL-2-22 (0,1 мг/кг, инъекция в хвостовую вену), в группе введения ПЭГ-IL-2-22 (0,03 мг/кг, подкожная инъекция), в группе введения ПЭГ-IL-2-22 (0,1 мг/кг, подкожная инъекция) значительно отличаются от таковых в группе PBS (Р-величина менее 0,001), что указывает на значительный ингибирующий эффект на рост опухоли.
Пример 13: Анализ иммуногенности IL-2 и его варианта
При компьютерном моделировании количество смоделированных Т-клеточных эпитопов (ТСЕ), рассчитанное с применением варианта IL-2, примерно равно или меньше, чем количество IL-2 дикого типа (см. Таблицу 22). Результаты показывают, что аминокислотная мутация(и) в каждом варианте IL-2 не вызывает неблагоприятного действия на иммуногенность IL-2 для терапевтических целей.
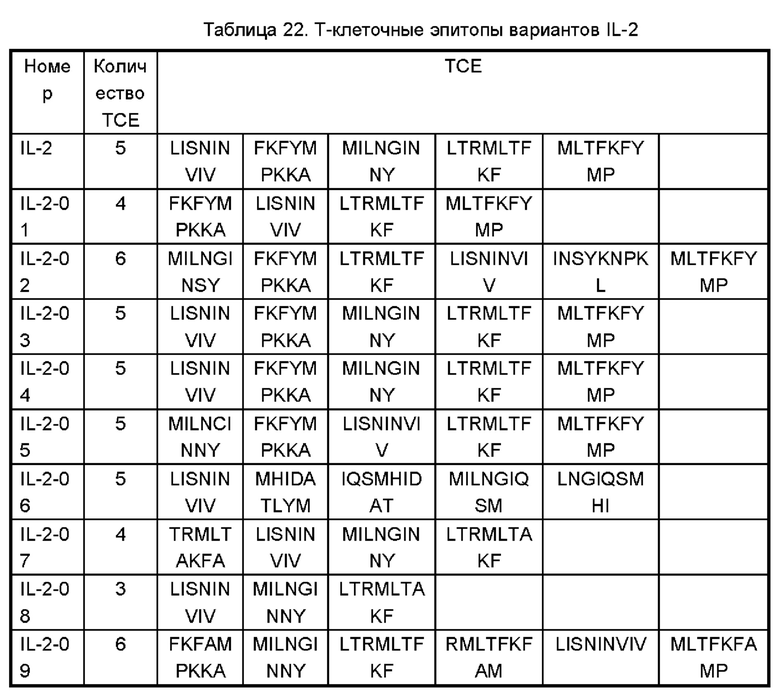
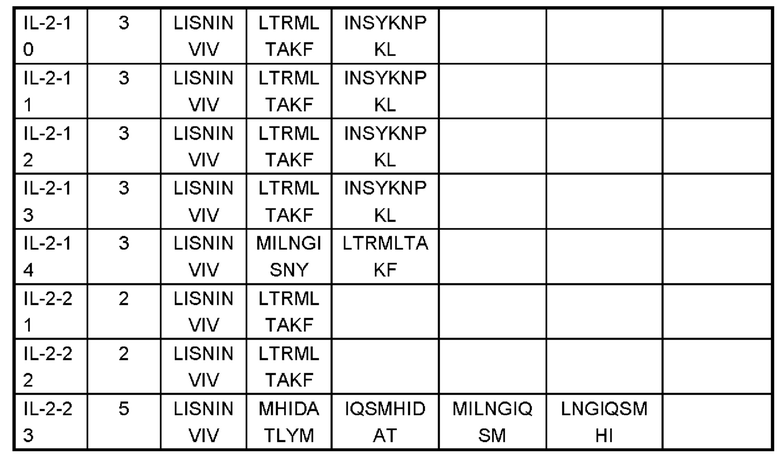
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> JIANGSU HENGRUI MEDICINE CO., LTD.
SHANGHAI HENGRUI PHARMACEUTICAL CO., LTD
SHANGHAI SHENGDI PHARMACEUTICAL CO., LTD
<120> ВАРИАНТ ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА-2 ИЛИ ЕГО ПРОИЗВОДНОЕ
<130> 719086CPCT
<160> 41
<170> SIPOSequenceListing 1.0
<210> 1
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2 дикого типа
<400> 1
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc aacaactaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatc tggcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttaccttttg tcagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 2
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2 дикого типа
<400> 2
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 3
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-01
<400> 3
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagggcatc aacaactaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatc tggcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 4
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-01
<400> 4
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Gly Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 5
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-02
<400> 5
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc aacagctaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatc tggcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 6
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-02
<400> 6
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Ser Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 7
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-03
<400> 7
catatggcac cgaccagcag cagcaccaaa aaaacctgtc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc aacaactaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatc tggcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcacct gtacctaatg aggatcc 417
<210> 8
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-03
<400> 8
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Cys Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Cys Thr
130
<210> 9
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Аллель
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-04
<400> 9
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc aacaactaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gtttgtaatc tggcacagag caaaaacttt 240
catctgcgtt gtcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 10
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-04
<400> 10
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Cys Asn Leu Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Cys Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 11
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-05
<400> 11
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaactgtatc aacaactaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatc tggcacagag caaaaactgt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 12
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-05
<400> 12
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Cys Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Cys His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 13
<211> 396
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(396)
<223> Последовательность нуклеиновой кислоты IL-2-06
<400> 13
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc cagagcatgc atattgatgc aaccctgtac 120
atgccgaaaa aagcaaccga gctgaaacat ctgcagtgtc tggaagaaga actgaaaccg 180
ctggaagagg ttctgaatct ggcacagagc aaaaactttc atctgcgtcc gcgtgatctg 240
attagcaata ttaacgttat tgtgctggaa ctgaaaggta gcgaaaccac ctttatgtgt 300
gaatatgccg atgaaaccgc aaccattgtg gaatttctga atcgttggat tacctttgca 360
cagagcatta ttagcaccct gacctaatga ggatcc 396
<210> 14
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(124)
<223> Аминокислотная последовательность IL-2-06
<400> 14
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Gln Ser Met
20 25 30
His Ile Asp Ala Thr Leu Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys
35 40 45
His Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val Leu
50 55 60
Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile
65 70 75 80
Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr
85 90 95
Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu
100 105 110
Asn Arg Trp Ile Thr Phe Ala Gln Ser Ile Ile Ser Thr Leu Thr
115 120 125
<210> 15
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-07
<400> 15
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc aacaactaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcgc aatgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatc tggcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 16
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-07
<400> 16
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Ala Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 17
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-08
<400> 17
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc aacaactaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatg gcgcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 18
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-08
<400> 18
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 19
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-09
<400> 19
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc aacaactaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcgc aatgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatg gcgcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 20
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-09
<400> 20
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Ala Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 21
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-10
<400> 21
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagggcatc aacagctaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatg gcgcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 22
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-10
<400> 22
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Gly Ile Asn Ser Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 23
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-11
<400> 23
catatggcac cgaccagcag cagcaccaaa aaaacctgtc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagggcatc aacagctaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatg gcgcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcacct gtacctaatg aggatcc 417
<210> 24
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-11
<400> 24
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Cys Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Gly Ile Asn Ser Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Cys Thr
130
<210> 25
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-12
<400> 25
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagggcatc aacagctaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gtttgtaatg gcgcacagag caaaaacttt 240
catctgcgtt gtcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 26
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-12
<400> 26
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Gly Ile Asn Ser Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Cys Asn Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Cys Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 27
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-13
<400> 27
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagtgtatc aacagctaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatg gcgcacagag caaaaactgt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 28
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-13
<400> 28
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Cys Ile Asn Ser Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Cys His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 29
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-14
<400> 29
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc agcaactaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatg gcgcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 30
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-14
<400> 30
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Ser Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 31
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-21
<400> 31
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagggcatc agcaactaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatg gcgcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 32
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-21
<400> 32
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Gly Ile Ser Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 33
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-22
<400> 33
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagggcatc agcaactaca aaaatccgaa actgacccgt 120
atgctgaccg caaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgcagg gcgcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagcaat attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 34
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-22
<400> 34
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Gly Ile Ser Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Ala Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Gln Gly Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<210> 35
<211> 396
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Аллель
<222> (1)..(396)
<223> Последовательность нуклеиновой кислоты IL-2-23
<400> 35
catatggcac cgaccagcag cagcaccaaa aaaacctgtc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gaacggcatc cagagcatgc atattgatgc aaccctgtac 120
atgccgaaaa aagcaaccga gctgaaacat ctgcagtgtc tggaagaaga actgaaaccg 180
ctggaagagg ttctgaatct ggcacagagc aaaaactttc atctgcgtcc gcgtgatctg 240
attagcaata ttaacgttat tgtgctggaa ctgaaaggta gcgaaaccac ctttatgtgt 300
gaatatgccg atgaaaccgc aaccattgtg gaatttctga atcgttggat tacctttgca 360
cagagcatta ttagcacctg tacctaatga ggatcc 396
<210> 36
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(127)
<223> Аминокислотная последовательность IL-2-23
<400> 36
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Cys Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Gln Ser Met
20 25 30
His Ile Asp Ala Thr Leu Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys
35 40 45
His Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val Leu
50 55 60
Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile
65 70 75 80
Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr
85 90 95
Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu
100 105 110
Asn Arg Trp Ile Thr Phe Ala Gln Ser Ile Ile Ser Thr Cys Thr
115 120 125
<210> 37
<211> 198
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<222> (1)..(198)
<223> IL-2R альфа (His метка)
<400> 37
Glu Leu Cys Asp Asp Asp Pro Pro Glu Ile Pro His Ala Thr Phe Lys
1 5 10 15
Ala Met Ala Tyr Lys Glu Gly Thr Met Leu Asn Cys Glu Cys Lys Arg
20 25 30
Gly Phe Arg Arg Ile Lys Ser Gly Ser Leu Tyr Met Leu Cys Thr Gly
35 40 45
Asn Ser Ser His Ser Ser Trp Asp Asn Gln Cys Gln Cys Thr Ser Ser
50 55 60
Ala Thr Arg Asn Thr Thr Lys Gln Val Thr Pro Gln Pro Glu Glu Gln
65 70 75 80
Lys Glu Arg Lys Thr Thr Glu Met Gln Ser Pro Met Gln Pro Val Asp
85 90 95
Gln Ala Ser Leu Pro Gly His Cys Arg Glu Pro Pro Pro Trp Glu Asn
100 105 110
Glu Ala Thr Glu Arg Ile Tyr His Phe Val Val Gly Gln Met Val Tyr
115 120 125
Tyr Gln Cys Val Gln Gly Tyr Arg Ala Leu His Arg Gly Pro Ala Glu
130 135 140
Ser Val Cys Lys Met Thr His Gly Lys Thr Arg Trp Thr Gln Pro Gln
145 150 155 160
Leu Ile Cys Thr Gly Glu Met Glu Thr Ser Gln Phe Pro Gly Glu Glu
165 170 175
Lys Pro Gln Ala Ser Pro Glu Gly Arg Pro Glu Ser Glu Thr Ser Cys
180 185 190
His His His His His His
195
<210> 38
<211> 466
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<222> (1)..(466)
<223> IL-2R бета (Fc впадина)
<400> 38
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Phe Pro Gly Ala Arg Cys Ala Val Asn Gly Thr Ser Gln Phe Thr Cys
20 25 30
Phe Tyr Asn Ser Arg Ala Asn Ile Ser Cys Val Trp Ser Gln Asp Gly
35 40 45
Ala Leu Gln Asp Thr Ser Cys Gln Val His Ala Trp Pro Asp Arg Arg
50 55 60
Arg Trp Asn Gln Thr Cys Glu Leu Leu Pro Val Ser Gln Ala Ser Trp
65 70 75 80
Ala Cys Asn Leu Ile Leu Gly Ala Pro Asp Ser Gln Lys Leu Thr Thr
85 90 95
Val Asp Ile Val Thr Leu Arg Val Leu Cys Arg Glu Gly Val Arg Trp
100 105 110
Arg Val Met Ala Ile Gln Asp Phe Lys Pro Phe Glu Asn Leu Arg Leu
115 120 125
Met Ala Pro Ile Ser Leu Gln Val Val His Val Glu Thr His Arg Cys
130 135 140
Asn Ile Ser Trp Glu Ile Ser Gln Ala Ser His Tyr Phe Glu Arg His
145 150 155 160
Leu Glu Phe Glu Ala Arg Thr Leu Ser Pro Gly His Thr Trp Glu Glu
165 170 175
Ala Pro Leu Leu Thr Leu Lys Gln Lys Gln Glu Trp Ile Cys Leu Glu
180 185 190
Thr Leu Thr Pro Asp Thr Gln Tyr Glu Phe Gln Val Arg Val Lys Pro
195 200 205
Leu Gln Gly Glu Phe Thr Thr Trp Ser Pro Trp Ser Gln Pro Leu Ala
210 215 220
Phe Arg Thr Lys Pro Ala Ala Leu Gly Lys Asp Thr Gly Ala Gln Asp
225 230 235 240
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
275 280 285
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
355 360 365
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
370 375 380
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
450 455 460
Gly Lys
465
<210> 39
<211> 492
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<222> (1)..(492)
<223> IL-2R гамма (Fc выступ)
<400> 39
Met Leu Lys Pro Ser Leu Pro Phe Thr Ser Leu Leu Phe Leu Gln Leu
1 5 10 15
Pro Leu Leu Gly Val Gly Leu Asn Thr Thr Ile Leu Thr Pro Asn Gly
20 25 30
Asn Glu Asp Thr Thr Ala Asp Phe Phe Leu Thr Thr Met Pro Thr Asp
35 40 45
Ser Leu Ser Val Ser Thr Leu Pro Leu Pro Glu Val Gln Cys Phe Val
50 55 60
Phe Asn Val Glu Tyr Met Asn Cys Thr Trp Asn Ser Ser Ser Glu Pro
65 70 75 80
Gln Pro Thr Asn Leu Thr Leu His Tyr Trp Tyr Lys Asn Ser Asp Asn
85 90 95
Asp Lys Val Gln Lys Cys Ser His Tyr Leu Phe Ser Glu Glu Ile Thr
100 105 110
Ser Gly Cys Gln Leu Gln Lys Lys Glu Ile His Leu Tyr Gln Thr Phe
115 120 125
Val Val Gln Leu Gln Asp Pro Arg Glu Pro Arg Arg Gln Ala Thr Gln
130 135 140
Met Leu Lys Leu Gln Asn Leu Val Ile Pro Trp Ala Pro Glu Asn Leu
145 150 155 160
Thr Leu His Lys Leu Ser Glu Ser Gln Leu Glu Leu Asn Trp Asn Asn
165 170 175
Arg Phe Leu Asn His Cys Leu Glu His Leu Val Gln Tyr Arg Thr Asp
180 185 190
Trp Asp His Ser Trp Thr Glu Gln Ser Val Asp Tyr Arg His Lys Phe
195 200 205
Ser Leu Pro Ser Val Asp Gly Gln Lys Arg Tyr Thr Phe Arg Val Arg
210 215 220
Ser Arg Phe Asn Pro Leu Cys Gly Ser Ala Gln His Trp Ser Glu Trp
225 230 235 240
Ser His Pro Ile His Trp Gly Ser Asn Thr Ser Lys Glu Asn Pro Phe
245 250 255
Leu Phe Ala Leu Glu Ala Gly Ala Gln Asp Lys Thr His Thr Cys Pro
260 265 270
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
275 280 285
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
290 295 300
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
305 310 315 320
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
325 330 335
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
340 345 350
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
355 360 365
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
370 375 380
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg
385 390 395 400
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly
405 410 415
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
420 425 430
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
435 440 445
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
450 455 460
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
465 470 475 480
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
485 490
<210> 40
<211> 417
<212> ДНК/РНК
<213> Искусственная последовательность
<220>
<221> Ген
<222> (1)..(417)
<223> Последовательность нуклеиновой кислоты IL-2-24
<400> 40
catatggcac cgaccagcag cagcaccaaa aaaacccagc tgcaactgga acatctgctg 60
ttagatctgc aaatgattct gcagggcatc agcaactaca aaaatccgaa actgacccgt 120
atgctgacct tcaaattcta catgccgaaa aaagcaaccg agctgaaaca tctgcagtgt 180
ctggaagaag aactgaaacc gctggaagag gttctgaatc tggcacagag caaaaacttt 240
catctgcgtc cgcgtgatct gattagccgt attaacgtta ttgtgctgga actgaaaggt 300
agcgaaacca cctttatgtg tgaatatgcc gatgaaaccg caaccattgt ggaatttctg 360
aatcgttgga ttacctttgc acagagcatt attagcaccc tgacctaatg aggatcc 417
<210> 41
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<222> (1)..(134)
<223> Аминокислотная последовательность IL-2-24
<400> 41
Met Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
1 5 10 15
His Leu Leu Leu Asp Leu Gln Met Ile Leu Gln Gly Ile Ser Asn Tyr
20 25 30
Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro
35 40 45
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu
50 55 60
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
65 70 75 80
Leu Arg Pro Arg Asp Leu Ile Ser Arg Ile Asn Val Ile Val Leu Glu
85 90 95
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
100 105 110
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Ala Gln Ser
115 120 125
Ile Ile Ser Thr Leu Thr
130
<---
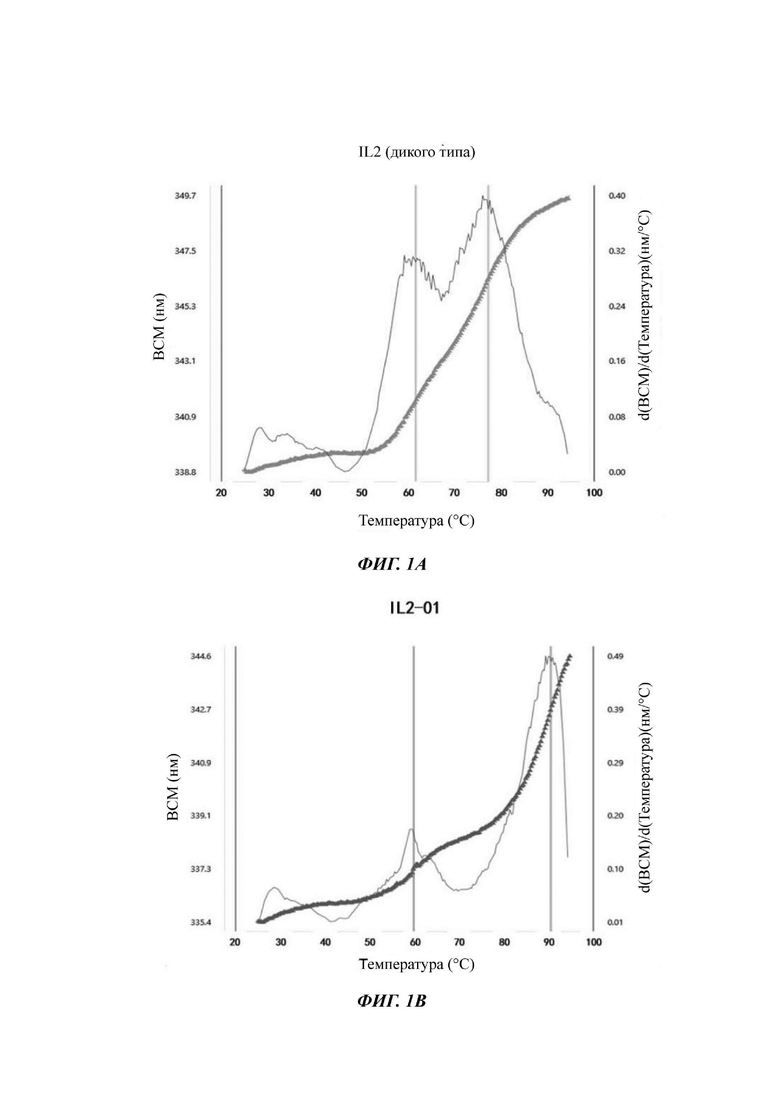
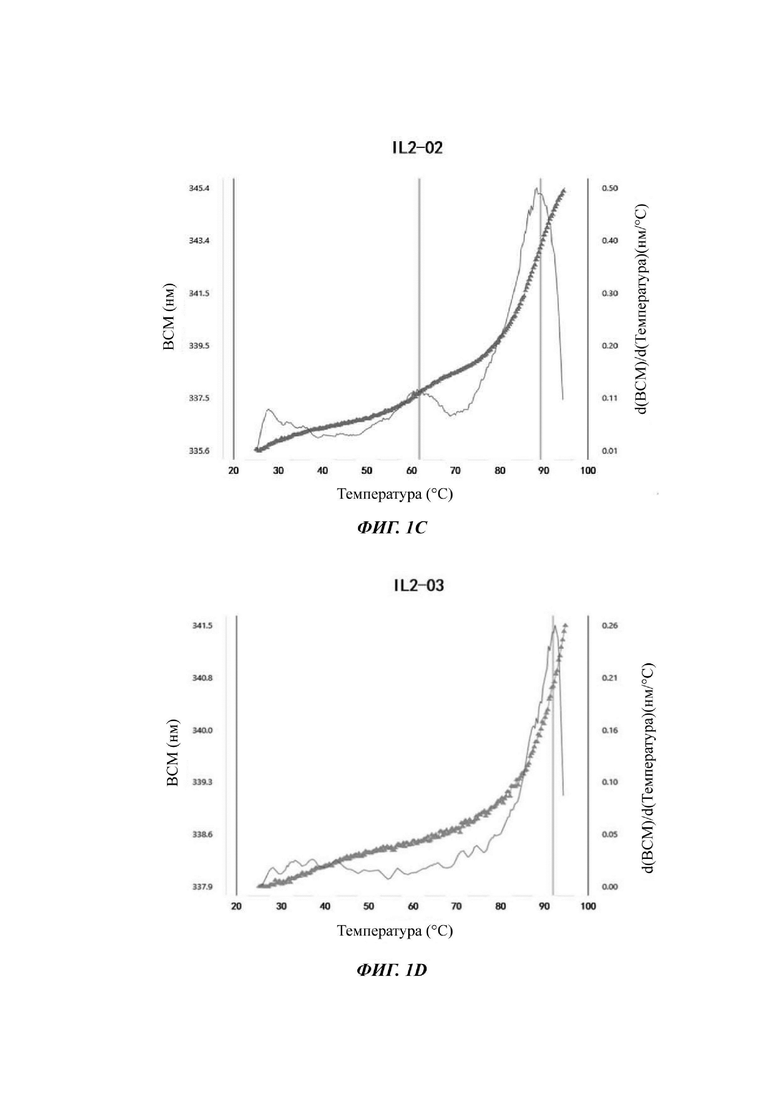
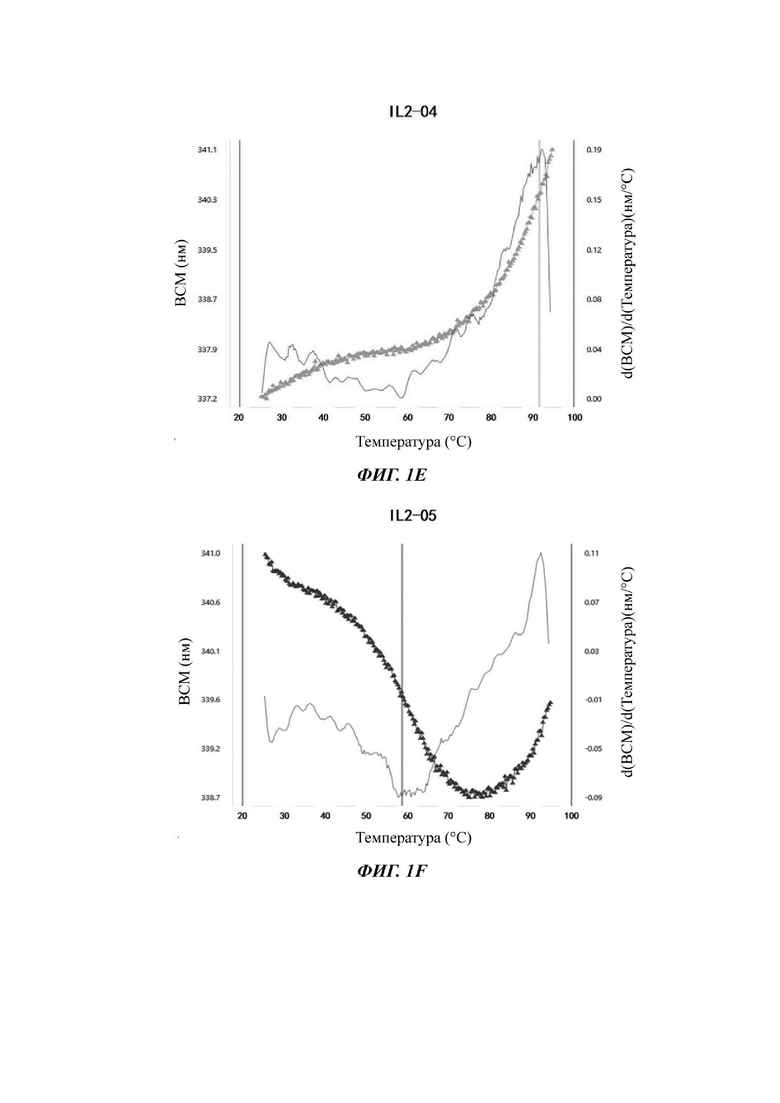
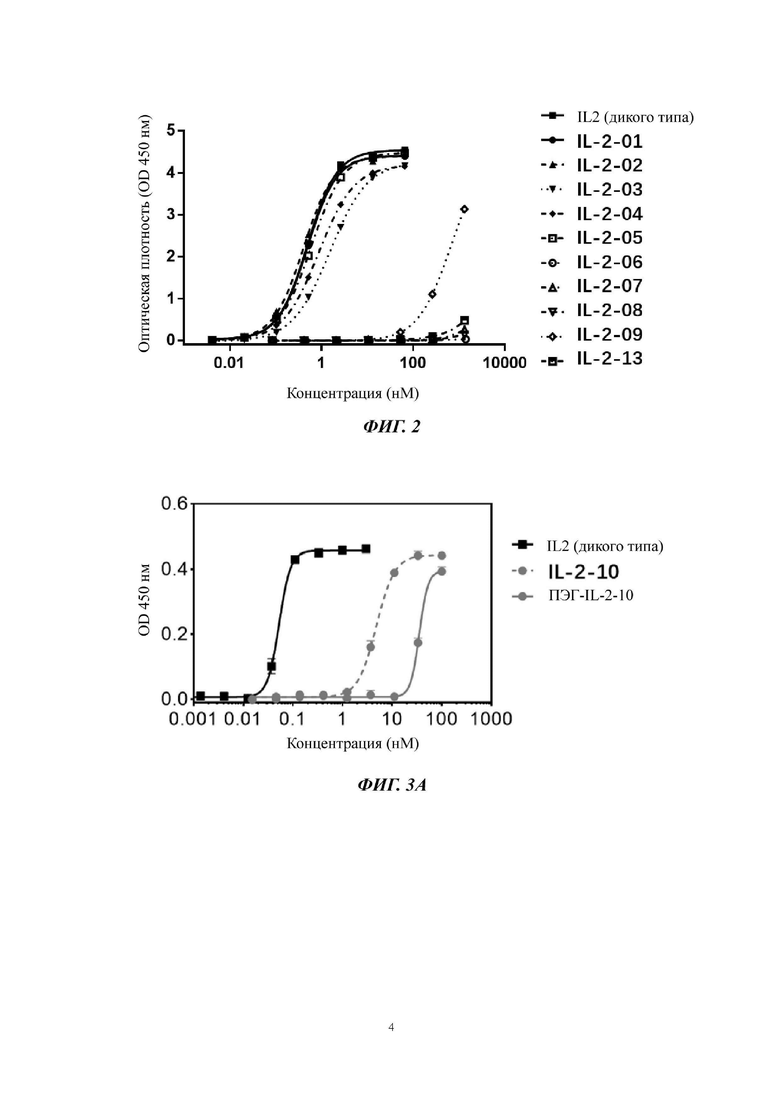
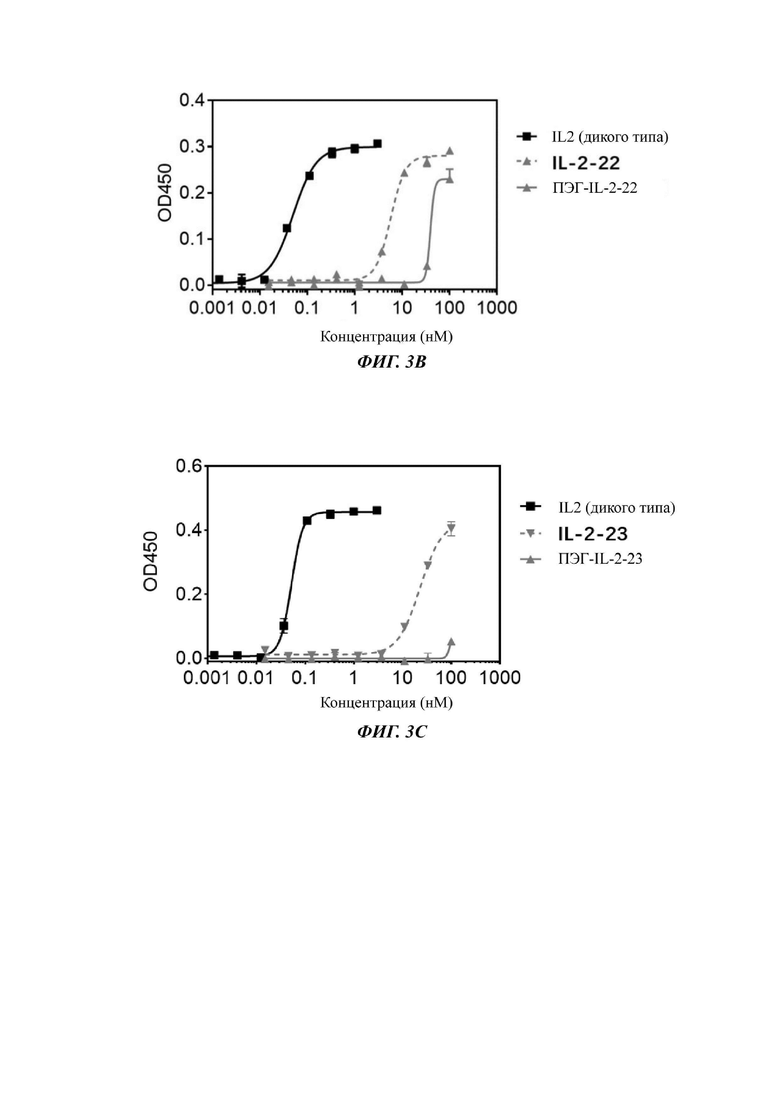
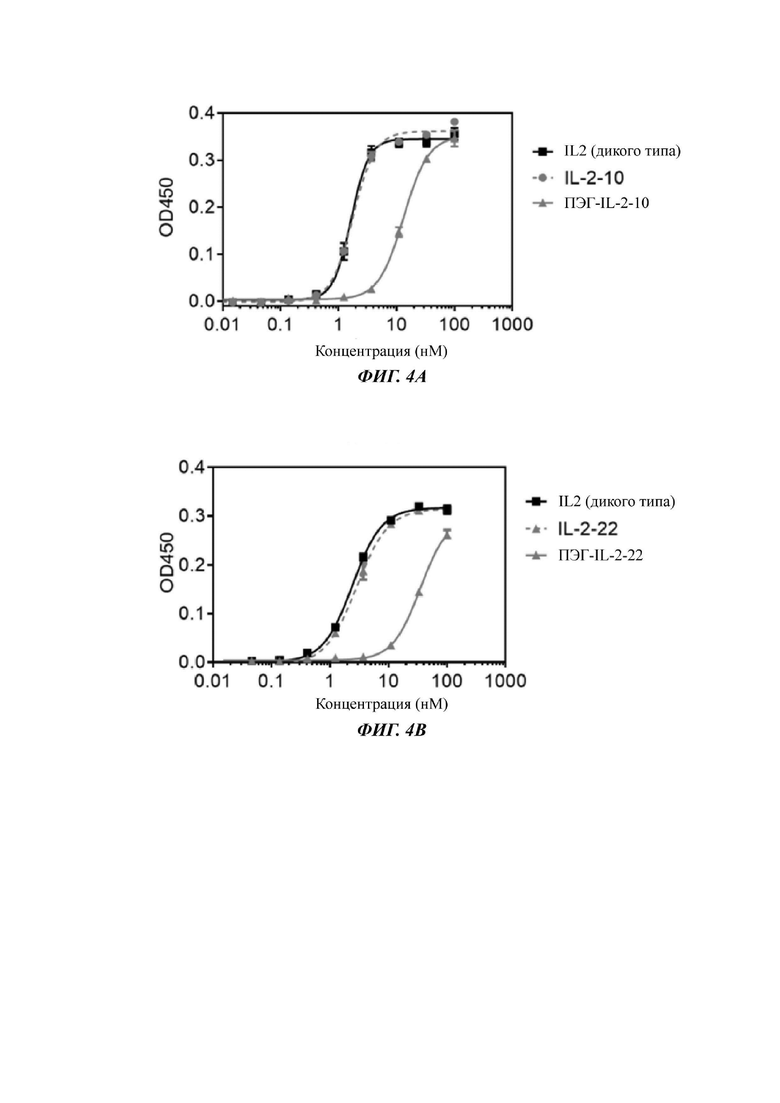
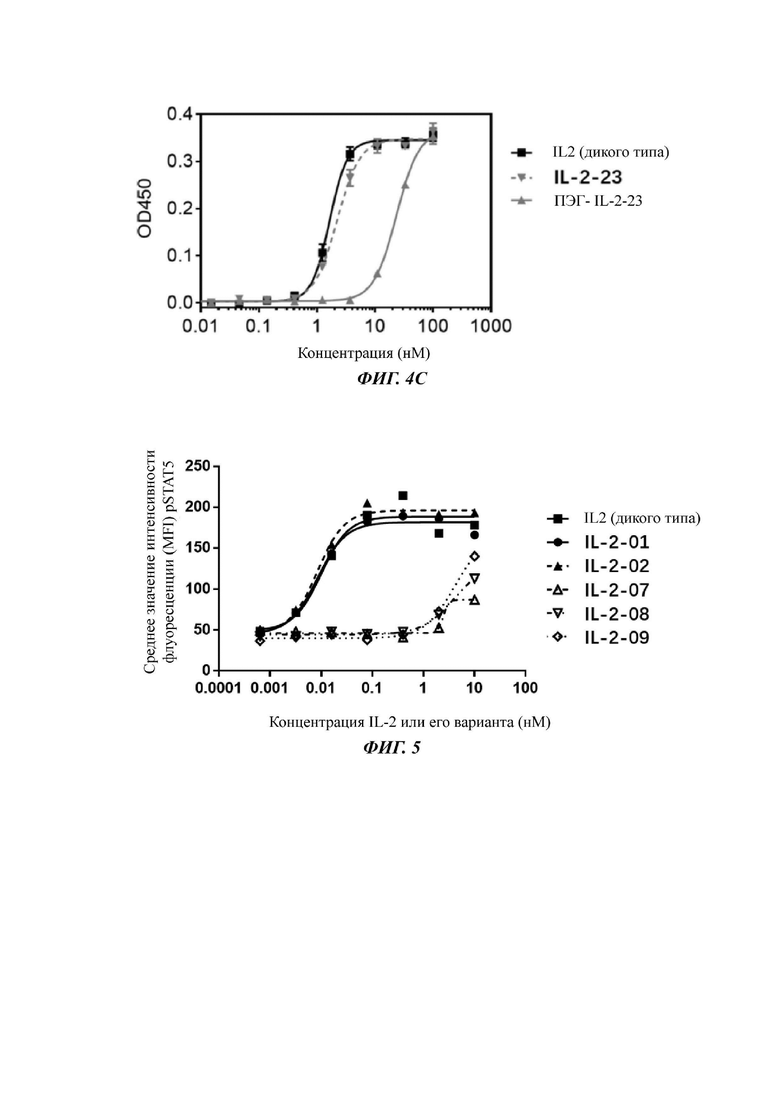
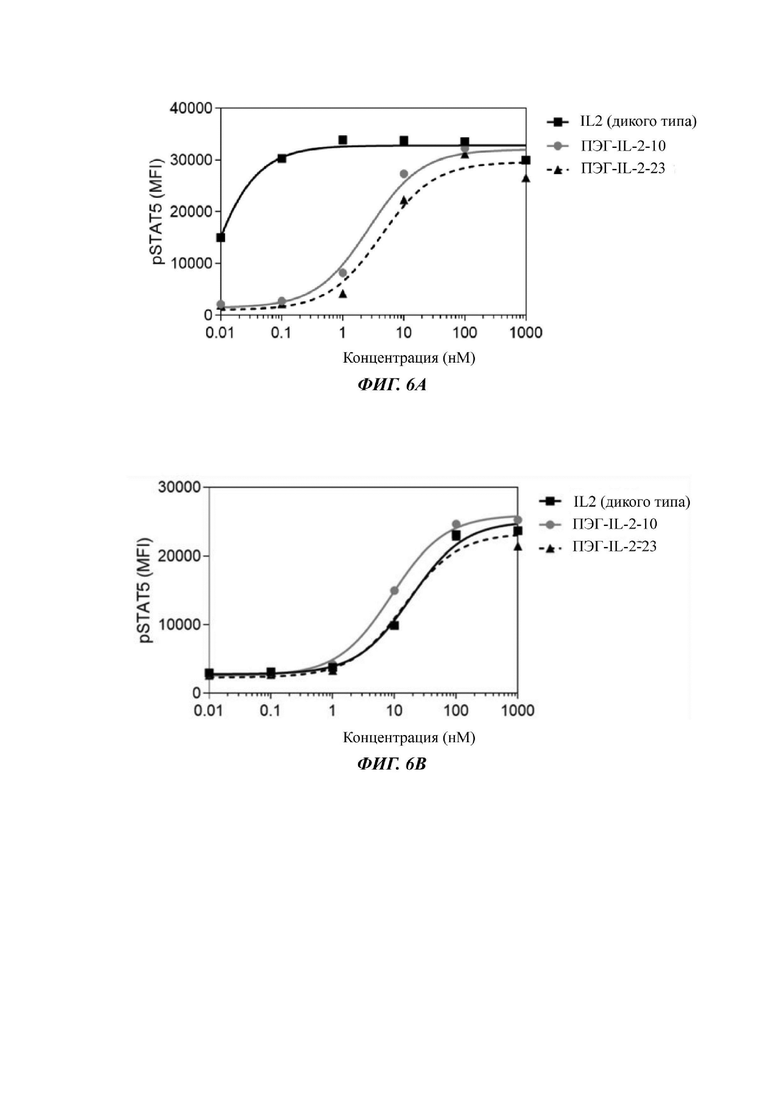
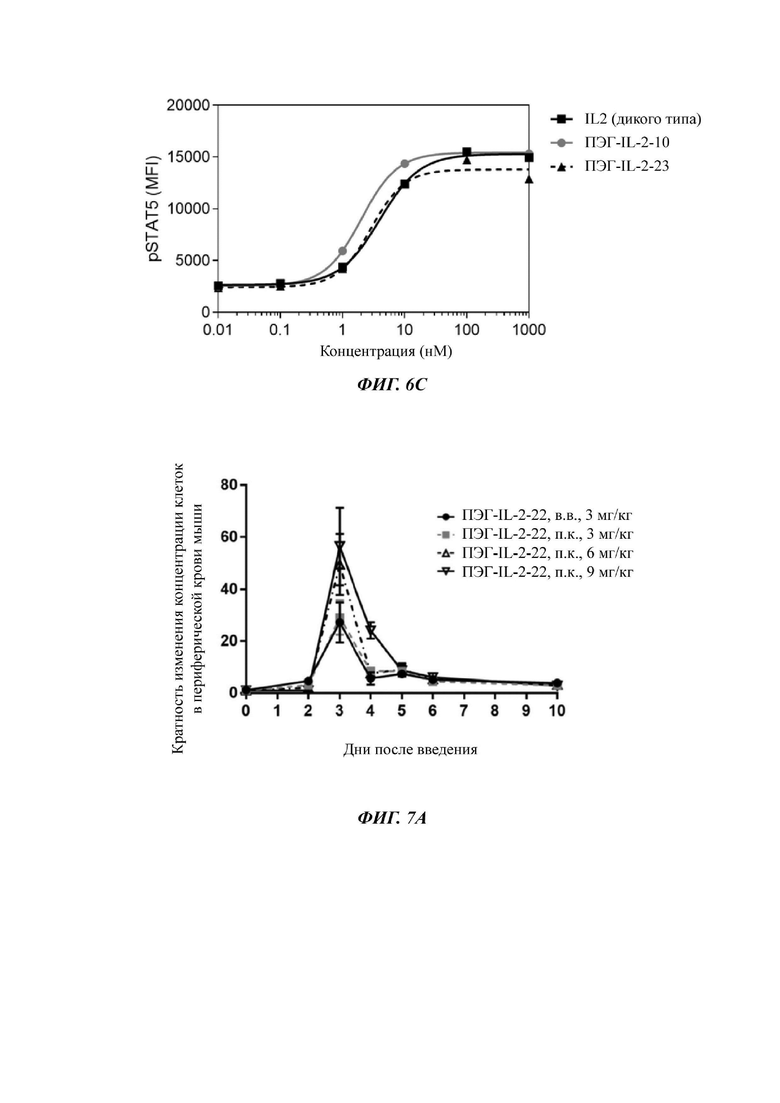
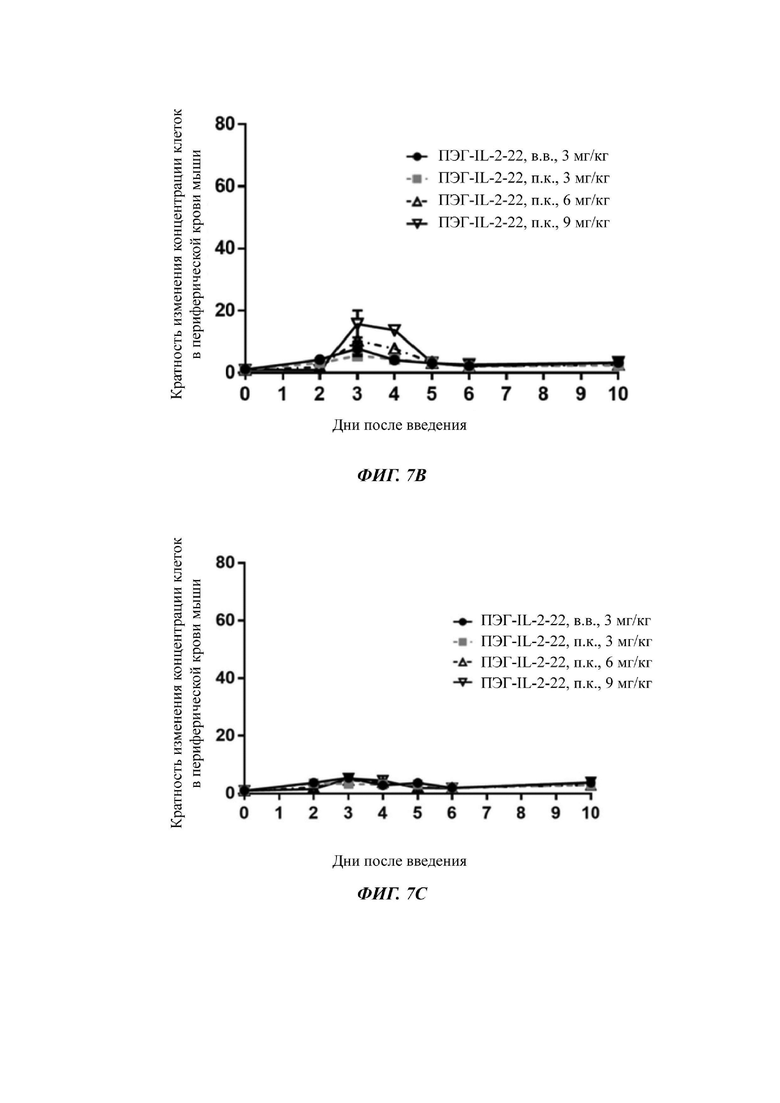
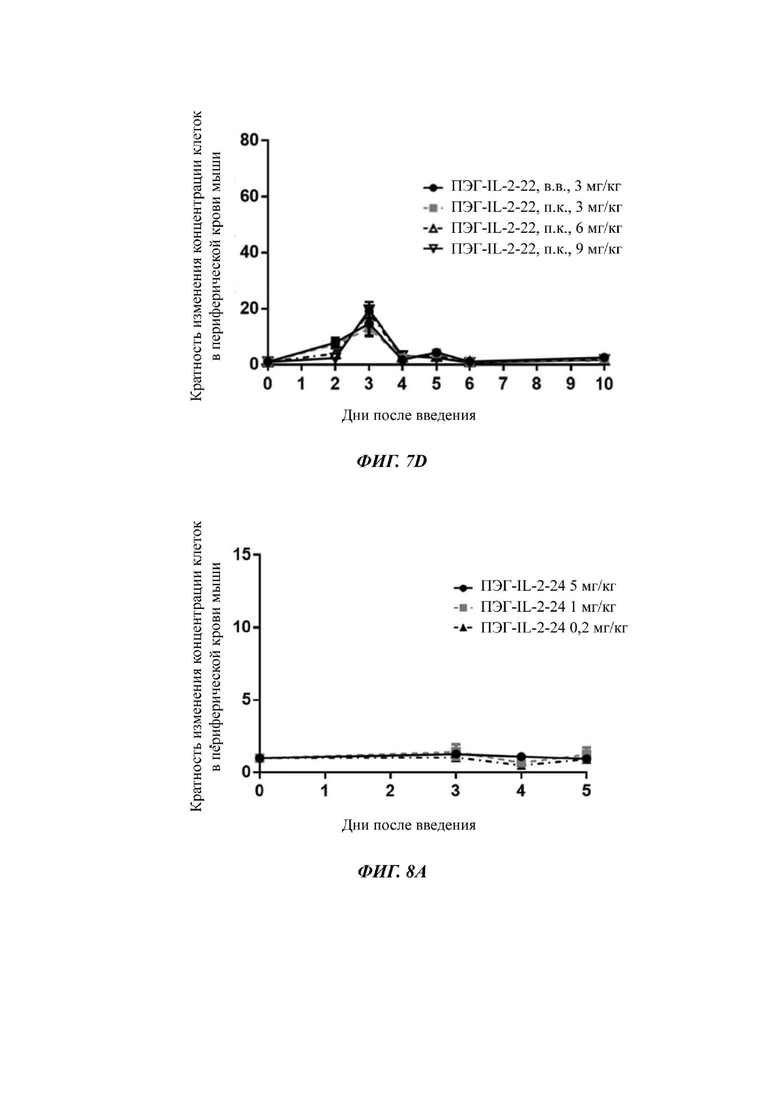
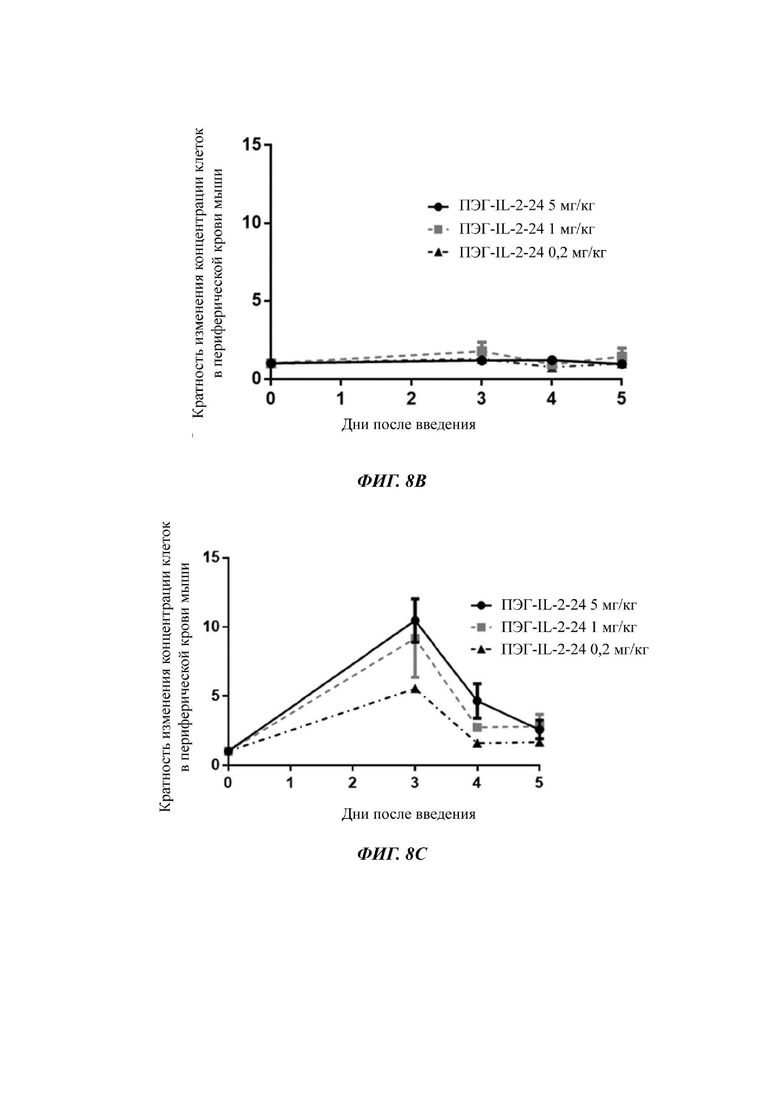
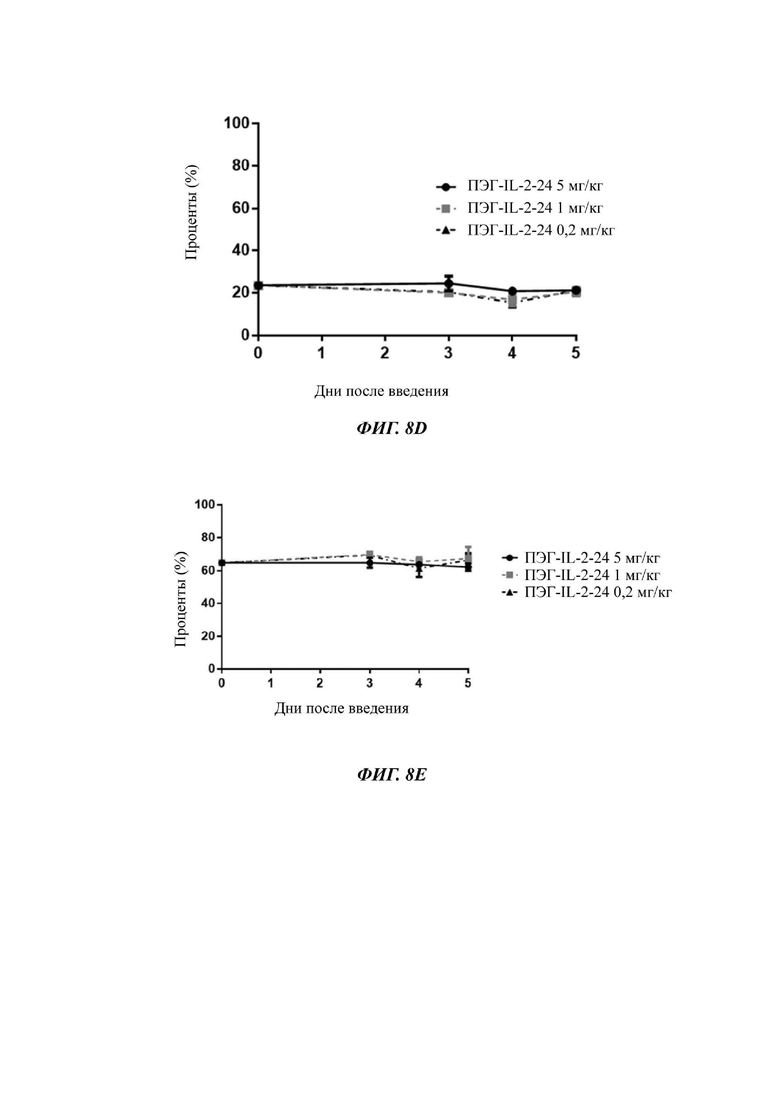
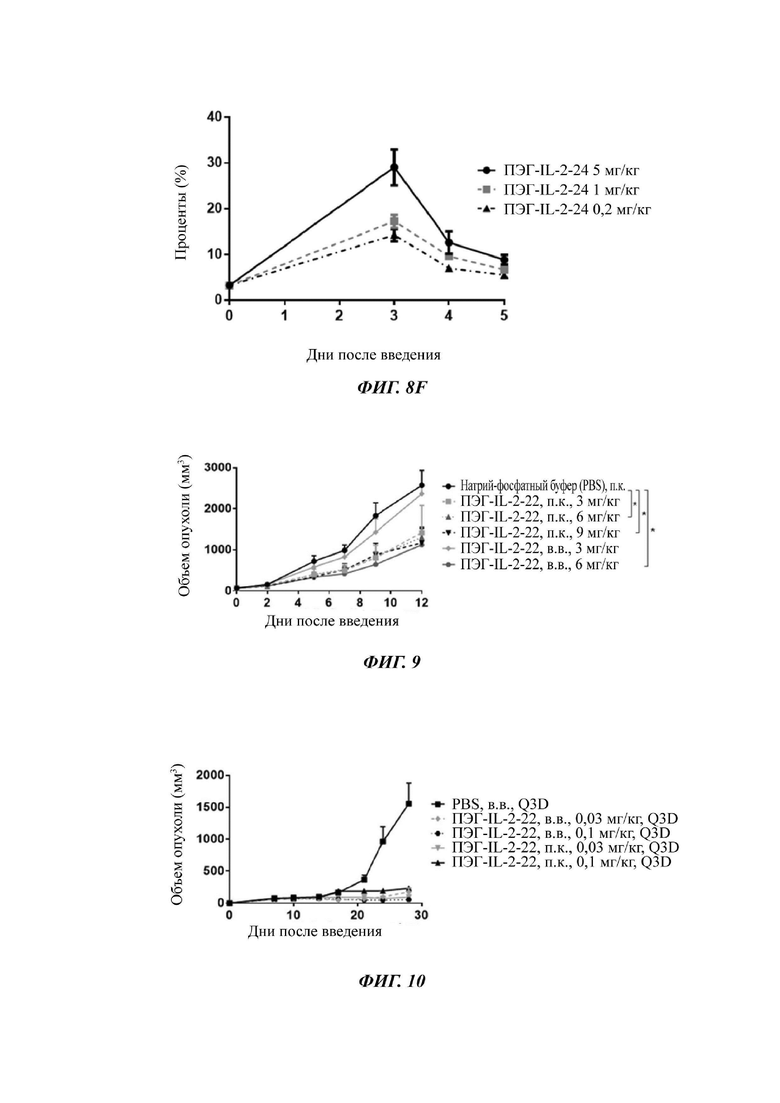
Изобретение относится к области биотехнологии, конкретно к получению мутантных вариантов и производных человеческого интерлейкина-2 (IL-2), и может быть использовано в медицине для лечения пролиферативного или аутоиммунного заболевания или диабета или лечения или предотвращения аутоиммунного ответа вследствие трансплантации органа. Предложенный мутеин содержит мутации, выбранные из группы, состоящей из 15)-17), или любую из 15)-17) в комбинации с любой из 5)-7): 15) N26Q и N29S, 16) N26Q, N29S и N71Q, и 17) N26Q и N30S, 5) Q11C и L132C, 6) L70C и Р82С, и 7) G27C и F78C, а также может содержать дополнительные мутации. Предложен конъюгат, в котором мутантный вариант IL-2 является ПЭГилированным, и/или гликозилированным, и/или конъюгированным с альбумином или слитым с альбумином, и/или слитым с Fc, и/или гидроксиэтилированным. Также мутантный вариант IL-2 может быть непосредственно связан с антигенсвязывающим модулем или косвенно связан с антигенсвязывающим модулем через пептидный линкер. Изобретение обеспечивает получение варианта IL-2 и его производного с повышенной стабильностью по сравнению с IL-2 дикого типа и улучшенными свойствами в качестве иммунотерапевтического агента. 20 н. и 19 з.п. ф-лы, 10 ил, 22 табл., 13 пр.
1. Вариант IL-2, где стабильность варианта IL-2 повышена по сравнению со стабильностью IL-2 дикого типа, и он содержит мутации, выбранные из группы, состоящей из 15)-17), или любую из 15)-17) в комбинации с любой из 5)-7):
15) N26Q и N29S,
16) N26Q, N29S и N71Q, и
17) N26Q и N30S,
5) Q11C и L132C,
6) L70C и Р82С, и
7) G27C и F78C;
мутации представляют собой мутации относительно IL-2 дикого типа, аминокислотная последовательность которого представляет собой такую, как показано в SEQ ID NO 2, и нумерация положения мутации отсчитывается от аминокислоты А во втором положении в соответствии с аминокислотной последовательностью, показанной в SEQ ID NO 2.
2. Вариант IL-2 по п. 1, который дополнительно содержит второй тип мутации или третий тип мутации, где:
второй тип мутации может устранять или уменьшать аффинность варианта IL-2 к рецептору с высокой аффинностью (IL-2Rα/β/γ), но сохранять аффинность к рецептору со средней аффинностью (IL-2Rβ/γ);
третий тип мутации может уменьшать аффинность варианта IL-2 как к рецептору с высокой аффинностью (IL-2Rα/β/γ), так и к рецептору со средней аффинностью (IL-2Rβ/γ), и аффинность к рецептору с высокой аффинностью уменьшается больше, чем к рецептору со средней аффинностью;
где второй тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 8)-11), или любой комбинации 8)-10):
8) F42A,
9) Y45A,
10) L72G, и
11) NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL;
третий тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L.
3. Вариант IL-2 по п. 2, где второй тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 18)-20) и 11):
18) F42A и Y45A,
19) F42A и L72G, и
20) Y45A и L72G;
третий тип мутации представляет собой N88R, или N88G, или N88I, или N88D.
4. Вариант IL-2 по п. 1, где вариант IL-2 содержит мутации, как показано в любом из пунктов 21)-29):
21) N26Q, N29S, F42A, N71Q и L72G,
22) N26Q, N29S и N88R,
23) N26Q, N29S, F42A и L72G,
24) N26Q, N30S, F42A и L72G,
25) Q11C, N26Q, N30S, F42A, L72G и L132C,
26) N26Q, N30S, F42A, L70C, L72G и Р82С,
27) N26Q, G27C, N30S, F42A, L72G и F78C,
28) N29S, F42A and L72G, и
29) Q11C, NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL, и L132C.
5. Вариант IL-2 по п. 1, где он дополнительно содержит аминокислотную мутацию С125А.
6. Вариант IL-2 по п. 1, который содержит или представляет собой аминокислоты, как показано в любой последовательности, выбранной из группы, состоящей из SEQ ID NO 4, SEQ ID NO 22, SEQ ID NO 24, SEQ ID NO 26, SEQ ID NO 28, SEQ ID NO 32, SEQ ID NO 34 и SEQ ID NO 41.
7. Вариант IL-2 по п. 1, который является мономерным.
8. Конъюгат для лечения заболевания, связанного с IL-2/IL-2R, содержащий вариант IL-2 по любому из пп. 1-7, где конъюгат является ПЭГилированным, и/или гликозилированным, и/или конъюгированным с альбумином или слитым с альбумином, и/или слитым с Fc, и/или гидроксиэтилированным.
9. Конъюгат по п. 8, где ПЭГ связан с N-концом варианта IL-2.
10. Конъюгат по п. 9, где молекулярная масса ПЭГ составляет от 5 до 50 кДа.
11. Конъюгат по п. 9, где молекулярная масса ПЭГ составляет 20 кДа.
12. Конъюгат для лечения заболевания, связанного с IL-2/IL-2R, содержащий вариант IL-2 по любому из пп. 1-7, где вариант IL-2 непосредственно связан с антигенсвязывающим модулем или косвенно связан с антигенсвязывающим модулем через пептидный линкер; вариант IL-2 имеет общую пептидную связь с антигенсвязывающим модулем на амино- или карбоксильном конце.
13. Конъюгат по п. 12, где антигенсвязывающий модуль представляет собой антитело или его антигенсвязывающий фрагмент.
14. Конъюгат по п. 13, где антитело или его антигенсвязывающий фрагмент нацелены на антиген, присутствующий на опухолевых клетках или в окружающей среде опухолевых клеток.
15. Фармацевтическая композиция для лечения заболевания, связанного с IL-2/IL-2R, содержащая терапевтически эффективное количество варианта IL-2 по любому из пп. 1-7 или конъюгата по любому из пп. 8-14.
16. Фармацевтическая композиция по п. 15, где указанная фармацевтическая композиция включает фармацевтически приемлемый(ые) разбавитель(и), носитель(и) или адъювант(ы).
17. Молекула нуклеиновой кислоты, кодирующая вариант IL-2 по любому из пп. 1-7.
18. Молекула нуклеиновой кислоты по п. 17, где молекула нуклеиновой кислоты содержит или представляет собой полинуклеотид, показанный в любой из SEQ ID NO 3, SEQ ID NO 5, SEQ ID NO 7, SEQ ID NO 9, SEQ ID NO 11, SEQ ID NO 13, SEQ ID NO 15, SEQ ID NO 17, SEQ ID NO 19, SEQ ID NO 21, SEQ ID NO 23, SEQ ID NO 25, SEQ ID NO 27, SEQ ID NO 29, SEQ ID NO 31, SEQ ID NO 33, SEQ ID NO 35 и SEQ ID NO 40.
19. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п. 17 или 18.
20. Клетка-хозяин для экспрессии варианта IL-2, которая содержит экспрессионный вектор по п. 19, где клетка-хозяин представляет собой Escherichia coli.
21. Применение варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 для получения лекарственного средства для лечения заболевания, связанного с IL-2/IL-2R.
22. Применение варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 для получения лекарственного средства,
когда вариант IL-2 содержит второй тип мутации, лекарственное средство применяют для лечения пролиферативного заболевания, связанного с IL-2/IL-2R; где второй тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 8)-11), или любой комбинации 8)-10):
8) F42A,
9) Y45A,
10) L72G, и
11) NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL.
23. Применение варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 для получения лекарственного средства,
когда вариант IL-2 содержит второй тип мутации, лекарственное средство применяют для лечения метастатического пролиферативного заболевания, связанного с IL-2/IL-2R; где второй тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 8)-11), или любой комбинации 8)-10):
8) F42A,
9) Y45A,
10) L72G, и
11) NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL.
24. Применение по п. 22, где пролиферативное заболевание представляет собой опухоль или рак.
25. Применение по п. 24, где опухоль или рак выбраны из группы, состоящей из эпителиально-клеточной карциномы, эндотелиально-клеточной карциномы, плоскоклеточной карциномы, рака, вызванного вирусом папилломы, аденокарциномы, карциномы, меланомы, саркомы, тератокарциномы, опухоли легкого, метастатического рака легкого, лимфомы и метастатической почечно-клеточной карциномы.
26. Применение варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 для получения лекарственного средства,
когда вариант IL-2 содержит мутацию третьего типа, лекарственное средство применяют для лечения диабета; где третий тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L.
27. Применение варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 для получения лекарственного средства,
когда вариант IL-2 содержит мутацию третьего типа, лекарственное средство применяют для лечения аутоиммунного заболевания, связанного с IL-2/IL-2R; где третий тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L.
28. Применение варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 для получения лекарственного средства,
когда вариант IL-2 содержит мутацию третьего типа, лекарственное средство применяют для лечения аутоиммунного ответа, вызванного трансплантацией органов, связанного с IL-2/IL-2R; где третий тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L.
29. Применение по п. 27, где аутоиммунное заболевание выбрано из группы, состоящей из диабета I типа, ревматоидного артрита, рассеянного склероза, системной красной волчанки (СКВ), экземы и астмы.
30. Способ лечения пролиферативного заболевания, который включает введение терапевтически эффективного количества варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 субъекту,
где вариант IL-2 содержит мутацию второго типа, и второй тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 8)-11), или любой комбинации 8)-10):
8) F42A,
9) Y45A,
10) L72G, и
11) NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL.
31. Способ лечения метастатического пролиферативного заболевания, который включает введение терапевтически эффективного количества варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 субъекту,
где вариант IL-2 содержит мутацию второго типа, второй тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 8)-11), или любой комбинации 8)-10):
8) F42A,
9) Y45A,
10) L72G, и
11) NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL.
32. Способ по п. 30, где пролиферативное заболевание представляет собой опухоль или рак.
33. Способ по п. 32, где опухоль или рак выбраны из группы, состоящей из эпителиально-клеточной карциномы, эндотелиально-клеточной карциномы, плоскоклеточной карциномы, рака, вызванного вирусом папилломы, аденокарциномы, карциномы, меланомы, саркомы, тератокарциномы, опухоли легкого, метастатического рака легкого, лимфомы и метастатической почечно-клеточной карциномы.
34. Способ лечения диабета, который включает введение терапевтически эффективного количества варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 субъекту,
где вариант IL-2 содержит мутацию третьего типа, и третий тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L.
35. Способ лечения или предотвращения аутоиммунного заболевания, при этом способ включает введение терапевтически эффективного количества варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 субъекту,
где вариант IL-2 содержит мутацию третьего типа, и третий тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L.
36. Способ по п. 35, где аутоиммунное заболевание выбрано из группы, состоящей из диабета I типа, ревматоидного артрита, рассеянного склероза, системной красной волчанки (СКВ), экземы и астмы.
37. Способ лечения или предотвращения аутоиммунного ответа вследствие трансплантации органа, при этом способ включает введение терапевтически эффективного количества варианта IL-2 по любому из пп. 1-7, конъюгата по любому из пп. 8-14 или фармацевтической композиции по любому из пп. 15, 16 субъекту,
где вариант IL-2 содержит мутацию третьего типа, и третий тип мутации представляет собой любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L.
38. Способ получения варианта IL-2 по любому из пп. 1-7, включающий:
введение мутаций в человеческий IL-2 дикого типа, или
осуществление рекомбинантной экспрессии с применением молекулы нуклеиновой кислоты по любому из пп. 17-18, или экспрессионного вектора по п. 19, или клетки-хозяина по п. 20,
где мутации выбраны из группы, состоящей из 15)-17), или любой из 15)-17) в комбинации с любой из 5)-7):
15) N26Q и N29S,
16) N26Q, N29S и N71Q, и
17) N26Q и N30S,
5) Q11C и L132C,
6) L70C и Р82С, и
7) G27C и F78C;
или мутации дополнительно содержат любую мутацию, выбранную из группы, состоящей из 8)-11), или любой комбинации 8)-10):
8) F42A,
9) Y45A,
10) L72G, и
11) NNYKNPKLTRMLTFKF в положениях 29-44 мутированы до QSMHIDATL;
или мутации дополнительно содержат любую мутацию, выбранную из группы, состоящей из 12)-14) или их комбинации:
12) N88R или N88G или N88I или N88D,
13) D20H или D20Y, и
14) Q126L;
где мутации представляют собой мутации относительно IL-2 дикого типа, аминокислотная последовательность которого представляет собой такую, как показано в SEQ ID NO 2, и нумерация положения мутации отсчитывается от аминокислоты А во втором положении в соответствии с аминокислотной последовательностью, показанной в SEQ ID NO 2.
39. Способ повышения стабильности IL-2, включающий введение мутаций в IL-2, при этом указанные мутации представляют собой любую мутацию, выбранную из группы, состоящей из 15)-17), или любую из 15)-17) в комбинации с любой из 5)-7):
15) N26Q и N29S,
16) N26Q, N29S и N71Q, и
17) N26Q и N30S;
5) Q11C и L132C,
6) L70C и Р82С, и
7) G27C и F78C;
мутации представляют собой мутации относительно IL-2 дикого типа, аминокислотная последовательность которого представляет собой такую, как показано в SEQ ID NO 2, и нумерация положения мутации отсчитывается от аминокислоты А во втором положении в соответствии с аминокислотной последовательностью, показанной в SEQ ID NO 2.
| WO 2005007121 A2, 27.01.2005 US 2012244112 A1, 27.09.2012 RU 2312677 C2, 20.12.2007 RU 2235729 C2, 10.09.2004 WO 8500817 A1, 28.02.1985 GB 2415904 A, 11.01.2006 ROWLEY J | |||
| et al., Inhibition of tumor growth by NK1 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Водяные лыжи | 1919 |
|
SU181A1 |
Авторы
Даты
2023-07-05—Публикация
2019-12-20—Подача