Настоящее изобретение относится к использованию комбинаций, содержащих 8-[(1R)-1-(3,5-дифторфениламино)этил]-N,N-диметил-2-морфолино-4-оксо-4Н-хромен-6-карбоксамид (далее "Соединение [1]") или его фармацевтически приемлемую соль и таксан, в лечении или профилактике рака. Таксаны включают признанные лекарственные средства против рака, такие как доцетаксел (Taxotere™) и паклитаксел (Taxol™). Другие таксаны включают кабазитаксел, ларотаксел, ортатаксел и тезетаксел. Также изобретение относится к фармацевтическим композициям, содержащим соединение [1] или его фармацевтически приемлемую соль и таксан, и к наборам, содержащим соединение [1] или его фармацевтически приемлемую соль и таксан, возможно с инструкциями по применению. Дополнительно изобретение относится к способам лечения, включающим одновременное, последовательное или раздельное введение соединения [I] или его фармацевтически приемлемой соли и таксана теплокровному животному, такому как человек.
Было обнаружено, что клетка может стать раковой вследствие трансформации части ее ДНК в онкоген, представляющий собой ген, активация которого приводит к формированию злокачественных опухолевых клеток (Bradshaw, Mutagenesis. 1986, 1, 91). Некоторые из таких онкогенов вызывают продуцирование пептидов, которые являются рецепторами для факторов роста. Активация комплекса рецептора фактора роста впоследствии приводит к усилению пролиферации клеток. Известно, например, что некоторые онкогены кодируют ферменты-тирозинкиназы и что определенные рецепторы факторов роста также представляют собой ферменты-тирозинкиназы (Yarden et al., Ann, Rev. Biochem. 1988, 57, 443; Larsen et al., Ann, Reports in Med. Chem., 1989, Chpt. 13). Первая группа тирозинкиназ для идентификации происходит от вирусных онкогенов, например тирозинкиназы pp60v-Src (также известной как v-Src), и соответствующих тирозинкиназ в нормальных клетках, например тирозинкиназы pp60c-Src (также известной как c-Src).
Тирозинкиназные рецепторы важны в передаче биохимических сигналов, которые запускают репликацию в клетке. Они представляют собой крупные ферменты, которые пронизывают клеточную мембрану и имеют внеклеточный связывающий домен для факторов роста, таких как эпидермальный фактор роста (EGF), и внутриклеточную часть, которая функционирует как киназа для фосфорилирования аминокислоты тирозин в белках и, следовательно, влияет на пролиферацию клеток. Известны различные классы тирозинкиназных рецепторов (Wilks, Advances in Cancer Research, 1993, 60, 43-73), включая липидкиназы, которые локализованы внутриклеточно и вовлечены в передачу биохимических сигналов, таких как те, которые влияют на рост и инвазионную способность опухолевых клеток. Известны различные классы липидкиназ, включая семейство PI3-киназ, которое также известно как семейство фосфатидилинозитол-3-киназ.
В настоящее время установлено, что нарушение регуляции онкогенов и генов-супрессоров опухоли вносит вклад в образование злокачественных опухолей, например путем увеличенной пролиферации клеток или увеличенной выживаемости клеток. Также в настоящее время известно, что сигнальные пути, опосредованные семейством PI3-киназ, играют центральную роль в ряде клеточных процессов, включая пролиферацию и выживаемость, и нарушение регуляции этих путей является причинным фактором для широкого спектра злокачественных и других заболеваний человека (Katso et al., Annual Rev. Cell Dev. Biol., 2001. 17: 615-617, и Foster et al., J. Cell Science, 2003, 116: 3037-3040).
PI3-Киназное семейство липидкиназ представляет собой группу ферментов, которые фосфорилируют положение 3 инозитольного кольца фосфатидилинозитола (PI). Известно три основные группы ферментов PI3-киназ, которые классифицируют в соответствии с их физиологической субстратной специфичностью (Vanhaesebroeck et al., Trends in Biol. Sci., 1997, 22, 267). Ферменты PI3-киназы класса III фосфорилируют только PI. Напротив, ферменты PI3-киназы класса II фосфорилируют как PI, так и PI-4-фосфат [далее сокращено как PI(4)Р]. Ферменты PI3-киназы класса I фосфорилируют PI, PI(4)P и PI-4,5-бисфосфат [далее сокращено как PI(4,5)P2], хотя, как полагают, только PI(4,5)P2 является физиологическим клеточным субстратом. Фосфорилирование PI(4,5)P2 приводит к образованию липидов вторичных мессенджеров PI-3,4,5-трифосфатов [далее сокращено как PI(3,4,5)P3]. Отдаленно родственные члены этого суперсемейства представляют собой киназы класса IV, такие как mTOR и ДНК-зависимые киназы, которые фосфорилируют остатки серина/треонина в белковых субстратах. Наиболее изученными и понятными из этих липидкиназ являются ферменты PI3-киназы класса I.
PI3-Киназа класса I представляет собой гетеродимер, состоящий из каталитической субъединицы р110 и регуляторной субъединицы, и это семейство дополнительно подразделяют на ферменты класса Ia и класса Ib на основании регуляторных партнеров и механизма регуляции. Ферменты класса Ia включают PI3-киназу β и состоят из трех отдельных каталитических единиц (р110α, р110β и р110δ), которые димеризуются с пятью различными регуляторными субъединицами (р85α, р55α, р50α, р85β и р55γ), при этом все каталитические субъединицы способны взаимодействовать со всеми регуляторными субъединицами с образованием разнообразных гетеродимеров. Ферменты PI3-киназы класса Ia обычно активируются в ответ на стимуляцию тирозинкиназных рецепторов факторами роста через взаимодействие SH2-доменов регуляторной субъединицы со специфическими остатками фосфотирозина активированного рецептора или адапторных белков, таких как IRS-1. Как р110α, так и р110β конститутивно экспрессируются во всех типах клеток, в то время как экспрессия р110δ более ограничена популяциями лейкоцитов и некоторыми эпителиальными клетками. Напротив, единичный фермент класса Ib состоит из каталитической субъединицы р110γ, которая взаимодействует с регуляторной субъединицей р101. Более того, ферменты класса Ib активируются в ответ на системы рецепторов, сопряженными с G-белками (GPCR), а также механизмами, описанными выше.
В настоящее время имеется множество фактов, показывающих, что ферменты PI3-киназы класса Ia, которые включают PI3-киназу β, участвуют в онкогенезе большого разнообразия злокачественных образований человека, либо прямо, либо опосредованно (Vivanco and Sawyers, Nature Reviews Cancer. 2002, 2, 489-501). Например, субъединица p110α амплифицирована в некоторых опухолях, таких как опухоли яичника (Shayesteh et al., Nature Genetics, 1999, 21: 99-102) и шейки матки (Ma et al., Oncogene, 2000, 19: 2739-2744). Была показана связь активирующих мутаций в каталитическом участке р110α с различными другими опухолями, такими как опухоли колоректальной области, молочной железы и легкого (Samuels et al., Science, 2004, 304, 554). Связанные с опухолью мутации в р85α также были идентифицированы при злокачественных образованиях, таких как рак яичника и желудка (Philp et al., Cancer Research, 2001, 61., 7426-7429). PI3-Киназа-β играет ключевую роль в функционировании В-клеток, и было показано, что она является посредником сигнала выживаемости в нескольких злокачественных образованиях В-клеток. Они включают хронический лимфоцитарный лейкоз (CLL), острый лимфобластный лейкоз (ALL), фолликулярную лимфому, диффузную крупноклеточную В-клеточную лимфому (DLBCL) и лимфому из клеток зоны мантии (Ikeda et al., Blood, 2010, 116, 1460-1468; Herman et al., Blood. 2010, 116, 2078-2088; Lannutti et al., Blood. 2011, 117, 591-594; Hoellenriegel et al., Blood, 2011, 118, 3603-3612), но не ограничены ими. Полагают, что, помимо прямых эффектов, активация PI3-киназ класса Ia вносит вклад в события, приводящие к образованию опухоли, которые происходят выше по ходу в сигнальных путях, например путем лиганд-зависимой или лиганд-независимой активации тирозинкиназных рецепторов, систем GPCR или интегринов (Vara er al., Cancer Treatment Reviews, 2004, 30, 193-204). Примеры таких сигнальных путей выше по ходу включают сверхэкспрессию тирозинкиназного рецептора Erb2 в разнообразных опухолях, приводящую к активации путей, опосредованных PI3-киназами (Harari et al., Oncogene, 2000, 19. 6102-6114), и сверхэкспрессию онкогена Ras (Kauffmann-Zeh et al., Nature, 1997, 385, 544-548). Дополнительно, PI3-киназы класса Ia могут опосредованно вносить вклад в онкогенез, вызванный различными сигнальными событиями ниже по ходу. Например, утрата действия фосфатазы-супрессора опухоли PTEN, которая катализирует превращение PI(3,4,5)P3 обратно в PI(4,5)P2 ассоциирована с очень широким спектром опухолей через отмену регуляции продуцирования PI(3,4,5)P3, опосредованного PI3-киназой (Simpson and Parsons, Exp.Cell Res., 2001, 264, 29-41). Более того, полагают, что усиление действия других сигнальных событий, опосредованных PI3-киназой, задействовано в ряде злокачественных образований, например путем активации АКТ (Nicholson and Anderson, Cellular Signalling. 2002, 14, 381-395).
Дополнительно к их роли в опосредовании пролиферативных сигналов и сигналов выживаемости в опухолевых клетках, также имеются достоверные доказательства того, что ферменты PI3-киназы класса Ia также вносят вклад в онкогенез через их функционирование в ассоциированных с опухолью стромальных клетках. Например, известно, что сигнальный путь PI3-киназ играет важную роль в передаче ангиогенных событий в эндотелиальных клетках в ответ на проангиогенные факторы, такие как VEGF (фактор роста эндотелия сосудов) (Abid et al., Arterioscler. Thromb. Vase. Biol., 2004, 24, 294-300). Поскольку ферменты PI3-киназы класса I также вовлечены в подвижность и миграцию (Sawyer, Expert Opinion Investig. Drugs, 2004, 13, 1-19), ингибиторы PI3-киназ должны обеспечивать терапевтические преимущества через ингибирование инвазии и метастазирования опухолевых клеток.
Дополнительно ферменты PI3-киназы класса I играют важную роль в регуляции иммунных клеток, при этом PI3-киназная активность вносит вклад в про-онкогенное действие клеток воспаления (Coussens and Werb, Nature, 2002, 420. 860-867).
Эти обнаружения подтверждают, что фармакологические ингибиторы ферментов PI3-киназ класса I должны обладать терапевтической ценностью для лечения различных форм ракового заболевания, включая солидные опухоли, такие как карциномы и саркомы, и лейкозы и лимфолейкозы. В частности, ингибиторы ферментов PI3-киназ класса I должны обладать терапевтической ценностью для лечения, например, рака молочной железы, ободочной и прямой кишки, легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого и бронхоальвеолярный рак) и предстательной железы, и рака желчного протока, кости, мочевого пузыря, мозга, головы и шеи, почки, печени, ткани желудочно-кишечного тракта, пищевода, яичника, поджелудочной железы, кожи, семенников, щитовидной железы, матки, шейки матки и вульвы, и лейкозов (включая острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз и хронический миелобластный лейкоз), множественной миеломы и лимфом (включая неходжкинские лимфомы, такие как диффузная крупноклеточная В-клеточная лимфома, фолликулярная лимфома и лимфома из клеток зоны мантии).
Обычно исследователи изучают физиологические и патологические роли ферментов семейства PI3-киназ с использованием вышеупомянутых ингибиторов PI3-киназ LY294002 и вортманнина. Хотя использование этих соединений может предполагать роль для PI3-киназы в событии в клетке, они не достаточно избирательны внутри семейства PI3-киназ для того, чтобы обеспечить разделение на индивидуальные роли для членов семейства. По этой причине более мощные и избирательные фармацевтические ингибиторы PI3-киназ будут полезны для того, чтобы дать более полное понимание функции PI3-киназ и обеспечить полезные терапевтические агенты.
Есть доказательства того, что в дополнение к онкогенезу ферменты PI3-киназы класса I играют роль в других заболеваниях (Wymann et al., Trends in Pharmacological Science, 2003, 24, 366-376). Как ферменты PI3-киназы класса Ia, так и единственный фермент класса lb играют важные роли в клетках иммунной системы (Koyasu, Nature Immunology, 2003, 4, 313-319) и, таким образом, они являются терапевтическими мишенями при воспалительных и аллергических показаниях. Ингибирование PI3-киназы также, как описано ранее, полезно для лечения сердечно-сосудистого заболевания через противовоспалительные эффекты или непосредственно путем воздействия на сердечные миоциты (Prasad et al., Trends in Cardiovascular Medicine, 2003, 13, 206-212). Также ингибирование PI3-киназы полезно при лечении тромбоза. В WO 2004016607 раскрыт способ нарушения агрегации и адгезии тромбоцитов, происходящих в условиях высокого напряжения сдвига, и способ ингибирования активации тромбоцитов, индуцированной сдвигом, где оба способа включают введение избирательного ингибитора PI3-киназы β. Также в WO 2004016607 раскрыт антитромботический способ, включающий введение эффективного количества избирательного ингибитора PI3-киназы β. Согласно этому способу можно достичь специфического ингибирования тромбоза без воздействия на нормальный гемостаз путем направленного воздействия на PI3-киназу β, что важно для активации тромбоцитов, индуцированной сдвигом. Следовательно, указанный антитромботический способ не вызывает побочных эффектов, вызванных нарушением нормального гемостаза, таких как увеличение времени кровотечения.
Соединение [I] представляет собой избирательный ингибитор фосфоинозитид (PI) 3-киназы β, который раскрыт среди множества других примеров в публикации международной заявки №WO 2011/051704. Соединение [I] имеет следующую структуру:
В WO 2011/051704 указано, что раскрытые там соединения "можно использовать в качестве монотерапии, или терапия может включать, дополнительно к соединению по изобретению, традиционные хирургию, или радиотерапию, или химиотерапию". Далее в WO 2011/051704 перечислено множество потенциальных противоопухолевых агентов для применения в такой химиотерапии.
В настоящее время было обнаружено, что использование соединения [I] в комбинации с таксаном обеспечивает неожиданный синергетический эффект, и следовательно может обеспечивать улучшенный способ лечения рака по сравнению с использованием либо только соединения [I], либо только таксана.
Можно считать, что комбинированное лечение обеспечивает синергетический эффект, если этот эффект является терапевтически превосходящим, как оценивают, например, по величине ответа, скорости ответа, времени развития заболевания или периоду выживаемости, относительно тех, что достигаются при дозировании одного или другого из компонентов комбинированного лечения в их стандартной дозе. Например, эффект комбинированного лечения является синергетическим, если эффект применения комбинации превосходит эффект, достигаемый соединением [I] или одним из указанных партнеров комбинации, когда их используют по отдельности. В частности, эффект комбинированного лечения является синергетическим, если эффективность можно поддерживать во время комбинированного лечения при более низкой дозе одного или более чем одного из партнеров комбинации, чем требуется для соответствующего монотерапевтического лечения. Далее, эффект комбинированного лечения является синергетическим, если положительный результат получают в группе пациентов, которые не отвечают (или плохо отвечают) на соединение [I] или один из указанных партнеров комбинации, когда их используют по отдельности.
Также можно считать, что комбинированное лечение обеспечивает синергетический эффект, если один или оба компонента можно дозировать менее часто, чем при режиме дозирования, используемом при стандартном дозировании каждого компонента при использовании отдельно, в то же время не оказывая неблагоприятного влияния на положительный результат, в других случаях достигаемый использованием стандартных количеств только одного применяемого агента. В частности, считают, что синергизм имеет место, если частота дозирования соединения [I] и/или указанного партнера комбинации может быть уменьшена относительно таковой, которая в другом случае является принятой/требуемой при использовании одного из партнеров по комбинации отдельно, без ущерба для одного или более факторов, таких как: степень ответа, скорость ответа, время развития заболевания и данных по выживаемости, и в частности, без ущерба для продолжительности ответа. Уменьшение количества и частоты дозирования для конкретного соединения может приводить к меньшему количеству и/или причиняющим меньше беспокойства побочным эффектам, чем те, которые имеют место при использовании традиционного режима/доз.
В первом аспекте изобретения предложена комбинация, содержащая соединение [I] или его фармацевтически приемлемую соль и таксан, для использования в лечении рака.
Фармацевтически приемлемая соль представляет собой, например, соль присоединения кислоты с неорганической или органической кислотой, например соляной кислотой, бромистоводородной кислотой, метансульфоновой кислотой, серной кислотой или трифторуксусной кислотой.
В данном описании, при использовании термина "таксан" следует понимать, что он может относиться к любому химическому аналогу, который оказывает свое противораковое действие путем стабилизирования тубулиновых микротрубочек, вовлеченных в деление клетки.
Примеры таксанов, которые можно объединять с соединением [I], включают: (2aR,3aR,4aR,6R,9S,11S,12S,12aR,12bS)-6,12b-диацетокси-9-[3(S)-(трет-бутоксикарбониламино)-2(R)-гидрокси-3фенилпропионилокси]-12-бензилокси-11-гидрокси-8,13,13-триметил-2а,3,3а,4,5,6,9,10,11,12,12а,12b-додекагидро-1Н-7,11-метаноциклодека[3,4]циклопропа[4,5]бенз[1,2-b]оксет-5-она дигидрат; паклитаксел (Таксол), BMS-184476 (7-метилтиометилпаклитаксел); BMS-188797; BMS-275183; BMS-188797; BMS-109881; CYC-3204 (конъюгат пенетратин-паклитаксел); таксопрексин; DJ-927; доцетаксел (Taxotere™); ларотаксел (XRP9881; RPR-109881A); XRP6258 (RPR112658); милатаксел (МАС-321); MST 997; МВТ-206; NBT-287; ортатаксел; Протакс-3; PG-TXL; PNU-166945; PNU-106258; оратаксел (BAY 59-8862; IDN 5109; полусинтетический таксан); TPI-287; протаксел и МАС-321 (Таксалог).
Примеры препаратов для таксанов включают:
- стандартные препараты паклитаксела или доцетаксела, например одобренные в настоящее время препараты Taxol™ и Taxotere™;
- препараты с биосовместимыми полимерами, в частности белками, такими как альбумин, более конкретно препаратами паклитаксела или доцетаксела с альбумином в виде наночастиц или микрочастиц, например Abraxane™ (описанный в US 5439686 и US 6749868) или NAB-доцетаксел (описанный, например, в US 20080161382, US 20070117744 и US 20070082838);
- полимерные конъюгаты, в частности полимерные конъюгаты паклитаксела или доцетаксела, более конкретно конъюгаты доцетаксела или паклитаксела с поли-L-глутаматом, например Opaxio (также известный как Xyotax, паклитаксел полиглюмекс, СТ-2103 и описанный, например, в Li С; Poly (L-glutamic acid) - anticancer drug conjugates; Adv. DrugDeliv. Rev. 2002; 54: 695-713);
- конъюгаты доцетаксела или паклитаксела с жирной кислотой, в частности конъюгаты паклитаксела или доцетаксела с докозагексаеновой кислотой (DHA), например, Taxoprexin (DHA-паклитаксел, описанный, например, в Bradley МО et al. Tumor targeting by covalent conjugation of a natural fatty acid to paclitaxel; Clin. Cancer Res. 2001; 7: 3229-38);
- композиции микрочастиц, такие как препараты пористых микрочастиц, описанные в US 6645528, например препарат микрочастиц паклитаксела Al-850, содержащий наночастицы паклитаксела в пористой гидрофильной матрице, состоящей главным образом из сахара; и
- эмульсии паклитаксела или доцетаксела в витамине Е, например Tocosol.
В одном воплощении таксан выбран из паклитаксела, доцетаксела и абраксана.
В одном воплощении таксан выбран из доцетаксела и паклитаксела.
В одном воплощении таксан представляет собой паклитаксел.
В одном воплощении таксан представляет собой доцетаксел.
В одном воплощении таксан представляет собой абраксан.
В одном воплощении таксан представляет собой кабазитаксел.
В одном воплощении таксан выбран из доцетаксела, паклитаксела, кабазитаксела, ларотаксела, ортатаксела и тезетаксела.
В данном описании при использовании термина "комбинация" следует понимать, что он может относиться к одновременному, раздельному или последовательному введению компонентов комбинации.
В одном воплощении "комбинация" относится к одновременному введению компонентов комбинации.
В одном воплощении "комбинация" относится к раздельному введению компонентов комбинации.
В одном воплощении "комбинация" относится к последовательному введению компонентов комбинации.
Как показано далее, есть преимущества в объединении соединения [I] с таксаном (таким как доцетаксел) в моделях ксенотрансплантатов РС3 и НСС70. Более того, здесь также показано, что эффективность в регулировании размера опухоли при прерывистом дозировании соединения [I] в комбинации с таксаном (таким как доцетаксел) сходна с таковой при непрерывном дозировании соединения [I] в комбинации с таксаном (таким как доцетаксел). В частности, эффективность в регулировании размера опухоли при прерывистом дозировании соединения [I], вслед за единственной дозой таксана (такого как доцетаксел), сходна с таковой при непрерывном дозировании соединения [I] в комбинации с таксаном (таким как доцетаксел).
Следовательно, в одном воплощении предложена комбинация, содержащая соединение [I] или его фармацевтически приемлемую соль и таксан, для использовании в лечении рака, где соединение [I] или его фармацевтически приемлемую соль дозируют прерывисто.
В одном воплощении цикл дозирования включает прерывистое дозирование соединения [I] или его фармацевтически приемлемой соли.
Во избежание сомнений прерывистое дозирование соединения [I] или его фармацевтически приемлемой соли означает, что данный цикл дозирования будет составлять одни или более чем одни сутки (например 1, 2, 3, 4, 5, 6 или 7 суток), когда не вводят соединение [I] или его фармацевтически приемлемую соль.
Может быть полезно в пределах данного цикла дозирования вводить один определенный компонент комбинации перед другим, то есть дозировать последовательно.
Следовательно, в одном воплощении цикл дозирования включает последовательное введение соединения [I] или его фармацевтически приемлемой соли до введения таксана (такого как доцетаксел).
В другом воплощении цикл дозирования включает последовательное введение таксана (такого как доцетаксел) до введения соединения [I] или его фармацевтически приемлемой соли.
В одном воплощении цикл дозирования включает только одну дозу таксана (такого как доцетаксел).
В одном воплощении цикл дозирования включает последовательное введение таксана (такого как доцетаксел) только в пределах 2 суток до первого введения соединения [I] или его фармацевтически приемлемой соли в пределах цикла дозирования.
В одном воплощении цикл дозирования включает последовательное введение таксана (такого как доцетаксел) только в пределах 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли в пределах цикла дозирования.
В одном воплощении цикл дозирования включает последовательное введение таксана (такого как доцетаксел) только в пределах 12 часов до первого введения соединения [I] или его фармацевтически приемлемой соли в пределах цикла дозирования.
В одном воплощении цикл дозирования включает последовательное введение таксана (такого как доцетаксел) только в пределах 6 часов до первого введения соединения [I] или его фармацевтически приемлемой соли в пределах цикла дозирования.
В одном воплощении цикл дозирования включает последовательное введение таксана (такого как доцетаксел) только в пределах 3 часов до первого введения соединения [I] или его фармацевтически приемлемой соли в пределах цикла дозирования.
В одном воплощении цикл дозирования включает последовательное введение таксана (такого как доцетаксел) только в пределах 1,5 часов до первого введения соединения [I] или его фармацевтически приемлемой соли в пределах цикла дозирования.
Во избежание сомнений "в пределах х часов до первого введения соединения" означает любое время вплоть до х часов перед первым дозированием соединения [I] или его фармацевтически приемлемой соли в пределах данного цикла дозирования и включает по существу одновременное дозирование таксана (такого как доцетаксел) с первым дозированием соединения [I] или его фармацевтически приемлемой соли в пределах цикла дозирования.
В одном воплощении продолжительность цикла дозирования составляет от 8 до 29 суток.
В одном воплощении продолжительность цикла дозирования составляет от 15 до 29 суток.
В одном воплощении продолжительность цикла дозирования составляет от 15 до 22 суток.
В одном воплощении продолжительность цикла дозирования составляет от 22 до 29 суток.
В одном воплощении продолжительность цикла дозирования составляет от 8 до 22 суток.
В одном воплощении продолжительность цикла дозирования составляет от 8 до 15 суток.
В одном воплощении продолжительность цикла дозирования составляет 29 суток.
В одном воплощении продолжительность цикла дозирования составляет 22 суток.
В одном воплощении продолжительность цикла дозирования составляет 15 суток.
В одном воплощении продолжительность цикла дозирования составляет 8 суток.
В одном воплощении цикл дозирования включает соединение [I] или его фармацевтически приемлемую соль, дозируемые в течение по меньшей мере одного периода (например 1, 2 или 3 периодов) продолжительностью 3-5 суток подряд (например 3, 4 или 5 суток), где за этим(и) периодом(ами) непосредственно следует дополнительный период продолжительностью по меньшей мере одни сутки (например 2, 3, 4 или 5 суток подряд), когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования включает по меньшей мере один период продолжительностью 7 суток, в котором соединение [I] или его фармацевтически приемлемую соль дозируют только в течение 3-5 суток подряд.
В одном воплощении цикл дозирования включает один период продолжительностью 7 суток, в котором соединение [I] или его фармацевтически приемлемую соль дозируют только в течение 3-5 суток подряд.
В одном воплощении цикл дозирования включает два периода по 7 суток, в которых соединение [I] или его фармацевтически приемлемую соль дозируют только в течение 3-5 суток подряд.
В одном воплощении цикл дозирования включает три периода по 7 суток, в которых соединение [I] или его фармацевтически приемлемую соль дозируют только в течение 3-5 суток подряд.
В одном воплощении цикл дозирования включает соединение [I] или его фармацевтически приемлемую соль, дозируемые в течение по меньшей мере одного периода продолжительностью 5 суток подряд, за которым сразу следует дополнительный период продолжительностью 2 суток подряд, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования включает соединение [I] или его фармацевтически приемлемую соль, дозируемые в течение по меньшей мере одного периода продолжительностью 4 суток подряд, за которым сразу следует дополнительный период продолжительностью 3 суток подряд, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования включает соединение [I] или его фармацевтически приемлемую соль, дозируемые в течение по меньшей мере одного периода продолжительностью 3 суток подряд, за которым сразу следует дополнительный период продолжительностью 4 суток подряд, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 29 суток и включает четыре периода по 7 суток, где каждый такой период состоит из 5 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 2 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 29 суток и включает четыре периода по 7 суток, где каждый такой период состоит из 4 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 3 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 29 суток и включает четыре периода по 7 суток, где каждый такой период состоит из 3 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 4 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 22 суток и включает три периода по 7 суток, где каждый такой период состоит из 5 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 2 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 22 суток и включает три периода по 7 суток, где каждый такой период состоит из 4 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 3 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 22 суток и включает три периода по 7 суток, где каждый такой период состоит из 3 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 4 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 15 суток и включает два периода по 7 суток, где каждый такой период состоит из 5 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 2 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 15 суток и включает два периода по 7 суток, где каждый такой период состоит из 4 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 3 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 15 суток и включает два периода по 7 суток, где каждый такой период состоит из 3 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 4 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 8 суток и включает один период продолжительностью 7 суток, состоящий из 5 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 2 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 8 суток и включает один период продолжительностью 7 суток, состоящий из 4 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 3 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 8 суток и включает один период продолжительностью 7 суток, состоящий из 3 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 4 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 8-29 суток и включает одно введение таксана (такого как доцетаксел) в пределах 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли с последующим прерывистым дозированием соединения [I] или его фармацевтически приемлемой соли.
В одном воплощении цикл дозирования составляет 15-29 суток и включает введение таксана (такого как доцетаксел) в течение 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли с последующим прерывистым введением соединения [I] или его фармацевтически приемлемой соли в течение периодов по 7 суток, состоящих из 5 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 2 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 15-29 суток и включает введение таксана (такого как доцетаксел) в течение 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли с последующим прерывистым введением соединения [I] или его фармацевтически приемлемой соли в течение периодов по 7 суток, состоящих из 4 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 3 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования составляет 15-29 суток и включает введение таксана (такого как доцетаксел) в течение 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли с последующим прерывистым введением соединения [I] или его фармацевтически приемлемой соли в течение периодов по 7 суток, состоящих из 3 суток, когда вводят соединение [I] или его фармацевтически приемлемую соль, за которыми следуют 4 суток, когда не вводят соединение [I] или его фармацевтически приемлемую соль.
В одном воплощении цикл дозирования включает следующие стадии:
а) Сутки 1: введение таксана (например доцетаксела);
б) Сутки 2-6: введение соединения [I] или его фармацевтически приемлемой соли;
в) Сутки 7-8: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана;
г) Сутки 9-13: введение соединения [I] или его фармацевтически приемлемой соли;
д) Сутки 14-15: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана;
е) Сутки 16-20: введение соединения [I] или его фармацевтически приемлемой соли;
ж) Сутки 21-22: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана.
В одном воплощении цикл дозирования включает следующие стадии:
а) Сутки 1: введение таксана (например доцетаксела);
б) Сутки 2-5: введение соединения [I] или его фармацевтически приемлемой соли;
в) Сутки 6-8: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана;
г) Сутки 9-12: введение соединения [I] или его фармацевтически приемлемой соли;
д) Сутки 13-15: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана;
е) Сутки 16-19: введение соединения [I] или его фармацевтически приемлемой соли;
ж) Сутки 20-22: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана.
В одном воплощении цикл дозирования включает следующие стадии:
а) Сутки 1: введение таксана (например доцетаксела);
б) Сутки 2-4: введение соединения [I] или его фармацевтически приемлемой соли;
в) Сутки 5-8: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана;
г) Сутки 9-11: введение соединения [I] или его фармацевтически приемлемой соли;
д) Сутки 12-15: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана;
е) Сутки 16-18: введение соединения [I] или его фармацевтически приемлемой соли;
ж) Сутки 19-22: нет введения ни соединения [I] или его фармацевтически приемлемой соли, ни таксана.
В одном воплощении изобретения соединение [I] или его фармацевтически приемлемую соль вводят ежесуточно в те сутки цикла дозирования, которые показаны для введения.
В одном воплощении изобретения соединение [I] или его фармацевтически приемлемую соль вводят два раза в сутки в те сутки цикла дозирования, которые показаны для введения.
Во избежание сомнений, циклы дозирования могут быть разделены несколькими сутками (например 1, 2, 3, 4, 5, 6 или 7 сутками), в которые не вводят ни один из активных компонентов комбинации.
В одном аспекте, где упомянуто соединение [I], соединение [I] представляет собой 8-[(1R)-1-(3,5-дифторфениламино)этил]-N,N-диметил-2-морфолино-4-оксо-4Н-хромен-6-карбоксамид.
В другом аспекте, где упоминается соединение [I], соединение [I] представляет собой фармацевтически приемлемую соль 8-[(1R)-1-(3,5-дифторфениламино)этил]-N,N-диметил-2-морфолино-4-оксо-4Н-хромен-6-карбоксамида.
В одном воплощении изобретения предложена комбинация, содержащая соединение [I] или его фармацевтически приемлемую соль и доцетаксел, для использования в лечении рака.
В одном воплощении изобретения предложена комбинация, содержащая соединение [I] или его фармацевтически приемлемую соль и доцетаксел, для использования в лечении рака.
В одном воплощении изобретения предложена комбинация, содержащая фармацевтически приемлемую соль соединения [I] и доцетаксел, для использования в лечении рака.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая соединение [I] или его фармацевтически приемлемую соль и таксан вместе с фармацевтически приемлемым разбавителем или носителем.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая соединение [I] или его фармацевтически приемлемую соль и доцетаксел вместе с фармацевтически приемлемым разбавителем или носителем.
В одном воплощении предложен фармацевтический продукт, содержащий:
(1) фармацевтическую композицию, содержащую соединение [I] или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем или носителем, и
(2) фармацевтическую композицию, содержащую таксан вместе с фармацевтически приемлемым разбавителем или носителем.
В одном воплощении предложен фармацевтический продукт, содержащий:
(1) фармацевтическую композицию, содержащую соединение [I] или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем или носителем, и
(2) фармацевтическую композицию, содержащую доцетаксел вместе с фармацевтически приемлемым разбавителем или носителем.
В одном аспекте предложен способ лечения рака у теплокровного животного, такого как человек, который включает введение указанному животному эффективного количества соединения [I] или его фармацевтически приемлемой соли в комбинации с эффективным количеством таксана.
В одном аспекте предложен способ лечения рака у теплокровного животного, такого как человек, который включает введение указанному животному эффективного количества соединения [I] или его фармацевтически приемлемой соли в комбинации с эффективным количеством доцетаксела.
Там, где указано лечение рака, следует понимать, что это может относиться к предупреждению метастазов и лечению метастазов, то есть к распространению рака. Следовательно, комбинацию по настоящему изобретению можно использовать для лечения пациента, у которого нет метастазов, для предотвращения их появления или для удлинения периода времени до их появления, и пациента, у которого уже есть метастазы, для лечения самих метастазов. Кроме того, лечение рака может относиться к лечению развившейся первичной опухоли(ей) и развивающейся первичной опухоли(ей).
Следовательно, в одном аспекте лечение рака относится к предупреждению метастазов.
В другом аспекте изобретения лечение рака относится к лечению метастазов.
В другом аспекте изобретения лечение рака относится к лечению развившейся первичной опухоли(ей) и развивающейся первичной опухоли(ей).
Здесь лечение рака может относиться к предупреждению рака как такового.
Согласно еще одному аспекту изобретения предложен набор, содержащий соединение [I] или его фармацевтически приемлемую соль и таксан, возможно с инструкциями по применению.
Согласно еще одному аспекту изобретения предложен набор, содержащий соединение [I] или его фармацевтически приемлемую соль и доцетаксел, возможно с инструкциями по применению.
Согласно еще одному аспекту изобретения предложен набор, содержащий:
а) Соединение [I] или его фармацевтически приемлемую соль в первой стандартной лекарственной форме;
б) таксан во второй стандартной лекарственной форме;
в) контейнерное средство для содержания указанных первой и второй лекарственных форм; и возможно
г) инструкции по применению.
Согласно еще одному аспекту изобретения предложен набор, содержащий:
а) Соединение [I] или его фармацевтически приемлемую соль в первой стандартной лекарственной форме;
б) доцетаксел во второй стандартной лекарственной форме;
в) контейнерное средство для содержания указанных первой и второй лекарственных форм; и возможно
г) инструкции по применению.
Пример стандартной лекарственной формы представляет собой таблетку для перорального введения.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая соединение [I] или его фармацевтически приемлемую соль и таксан вместе с фармацевтически приемлемым разбавителем или носителем, для использования в лечении рака.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая соединение [I] или его фармацевтически приемлемую соль и доцетаксел вместе с фармацевтически приемлемым разбавителем или носителем, для использования в лечении рака.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая соединение [I] или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем или носителем, в комбинации с фармацевтической композицией, содержащей таксан вместе с фармацевтически приемлемым разбавителем или носителем, для использования в лечении рака.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая соединение [I] или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем или носителем, в комбинации с фармацевтической композицией, содержащей доцетаксел вместе с фармацевтически приемлемым разбавителем или носителем, для использования в лечении рака.
Фармацевтические композиции могут быть в форме, подходящей для перорального введения, например в форме таблетки или капсулы, для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную, внутрисосудистую инъекции или инфузию) в форме стерильного раствора, суспензии или эмульсии, для местного введения в форме мази или крема или для ректального введения в форме суппозитория. Обычно вышеупомянутые композиции могут быть получены традиционным способом с использованием традиционных эксципиентов.
Согласно еще одному аспекту настоящего изобретения предложен набор, содержащий соединение [I] или его фармацевтически приемлемую соль и таксан, возможно с инструкциями по применению, для использования в лечении рака.
Согласно еще одному аспекту настоящего изобретения предложен набор, содержащий соединение [I] или его фармацевтически приемлемую соль и доцетаксел, возможно с инструкциями по применению, для использования в лечении рака.
Согласно еще одному аспекту настоящего изобретения предложен набор, содержащий:
а) Соединение [I] или его фармацевтически приемлемую соль в первой стандартной лекарственной форме,
б) таксан,
в) контейнерное средство для содержания указанных первой и второй лекарственных форм; и возможно
г) инструкции по применению,
для использования в лечении рака.
Согласно еще одному аспекту изобретения предложен набор, содержащий:
а) Соединение [I] или его фармацевтически приемлемую соль в первой стандартной лекарственной форме,
б) доцетаксел,
в) контейнерное средство для содержания указанных первой и второй лекарственных форм; и возможно
г) инструкции по применению,
для использования в лечении рака.
Согласно настоящему изобретению предложена комбинация, содержащая соединение [I] или его фармацевтически приемлемую соль и таксан, для использования в качестве лекарственного средства.
Согласно настоящему изобретению предложена комбинация, содержащая соединение [I] или его фармацевтически приемлемую соль и доцетаксел, для использования в качестве лекарственного средства.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном в изготовлении лекарственного средства для лечения рака.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с доцетакселом в изготовлении лекарственного средства для лечения рака.
Может быть удобно или оправдано с медицинской точки зрения для врача определить точную дозировку и режим введения для использования комбинированного продукта, так что активные компоненты комбинированного продукта не обязательно могут присутствовать вместе в одной лекарственной форме в фиксированной дозе. Следовательно, врач или фармацевт могут приготовить комбинированное лекарственное средство, содержащее активные комбинированные продукты, готовые для одновременного, раздельного или последовательного применения комбинации в медицине, например для лечения рака у теплокровного животного, такого как человек.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном (таким как доцетаксел) в изготовлении комбинированного лекарственного средства для использования в медицине.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном (таким как доцетаксел) в изготовлении комбинированного лекарственного средства для одновременного, раздельного или последовательного комбинированного использования в медицине.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном (таким как доцетаксел) в изготовлении комбинированного лекарственного средства для одновременного, раздельного или последовательного комбинированного использования для лечения рака.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном (таким как доцетаксел) в изготовлении комбинированного лекарственного средства для одновременного, раздельного или последовательного комбинированного использования для лечения рака у теплокровного животного, такого как человек.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном (таким как доцетаксел) в изготовлении комбинированного лекарственного средства для раздельного комбинированного использования в лечении рака у теплокровного животного, такого как человек.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном (таким как доцетаксел) в изготовлении комбинированного лекарственного средства для последовательного комбинированного использования в лечении рака у теплокровного животного, такого как человек.
Согласно другому аспекту изобретения предложено применение соединения [I] или его фармацевтически приемлемой соли в комбинации с таксаном (таким как доцетаксел) в изготовлении комбинированного лекарственного средства для лечения рака.
Согласно другому аспекту настоящего изобретения предложена комбинация, содержащая соединение [I] или его фармацевтически приемлемую соль и таксан (такой как доцетаксел), для использования в лечении рака.
В одном воплощении предложено соединение [I] или его фармацевтически приемлемая соль и таксан (такой как доцетаксел) для применения в лечении рака у теплокровного животного, такого как человек.
В одном воплощении предложено соединение [I] или его фармацевтически приемлемая соль и таксан (такой как доцетаксел) для применения в лечении рака у теплокровного животного, такого как человек, где соединение [I] или его фармацевтически приемлемую соль и таксан вводят одновременно, раздельно или последовательно теплокровному животному.
В одном воплощении предложен способ получения противоракового эффекта у теплокровного животного, такого как человек, который включает введение указанному животному эффективного количества соединения [I] или его фармацевтически приемлемой соли, возможно вместе с фармацевтически приемлемым разбавителем или носителем; до, после или одновременно с эффективным количеством таксана (такого как доцетаксел), возможно вместе с фармацевтически приемлемым разбавителем или носителем.
Там, где упоминается рак, это может относиться к раку пищевода, миеломе, гепатоцеллюлярному раку, раку поджелудочной железы, раку шейки матки, опухоли Юинга, нейробластоме, саркоме Капоши, раку яичника, раку молочной железы, раку ободочной и прямой кишки, раку предстательной железы, раку мочевого пузыря, меланоме, раку легкого - немелкоклеточному раку легкого и мелкоклеточному раку легкого, раку желудка, раковым образованиям головы и шеи, раку мозга, раку почки, лимфоме и лейкозу.
В одном воплощении рак представляет собой рак предстательной железы.
В одном воплощении рак представляет собой рак поджелудочной железы.
В одном воплощении рак представляет собой кастрационно-резистентный рак предстательной железы.
В одном воплощении рак представляет собой мелкоклеточный рак легкого.
В одном воплощении рак представляет собой немелкоклеточный рак легкого.
В одном воплощении рак представляет собой сквамозный немелкоклеточный рак легкого.
В одном воплощении рак представляет собой рак ободочной и прямой кишки.
В одном воплощении рак представляет собой рак яичника.
В одном воплощении рак представляет собой рак молочной железы.
В одном воплощении рак представляет собой рак молочной железы с тройным негативным фенотипом.
В одном воплощении рак представляет собой рак предстательной железы, немелкоклеточный рак легкого или рак молочной железы.
В одном воплощении рак представляет собой кастрационно-резистентный рак предстательной железы, сквамозный немелкоклеточный рак легкого, рак ободочной и прямой кишки, рак поджелудочной железы или рак молочной железы с тройным негативным фенотипом.
В одном воплощении рак представляет собой кастрационно-резистентный рак предстательной железы, сквамозный немелкоклеточный рак легкого или рак молочной железы с тройным негативным фенотипом.
В одном воплощении рак представляет собой рак мочевого пузыря, рак пищевода, рак желудка, меланому, рак шейки матки или рак почки.
В одном воплощении рак представляет собой рак эндометрия, печени, желудка, щитовидной железы, прямой кишки или мозга.
В одном воплощении рак представляет собой рак с недостаточностью по гену PTEN.
В другом воплощении рак находится в метастатическом состоянии, и более конкретно рак продуцирует метастазы в кость.
В одном воплощении изобретения, в частности, рак находится в метастатическом состоянии, и более конкретно рак продуцирует кожные метастазы.
В одном воплощении изобретения, в частности, рак находится в метастатическом состоянии, и более конкретно рак продуцирует лимфатические метастазы.
В одном воплощении изобретения, в частности, рак находится в неметастатическом состоянии.
Композиции по изобретению могут быть получены путем традиционных методов с использованием традиционных фармацевтических эксципиентов, хорошо известных в данной области техники. Таким образом, композиции, предназначенные для перорального применения, могут содержать, например, один или более чем один краситель, подсластитель, ароматизатор и/или консервант.
Соединение, такое как соединение I, обычно можно вводить теплокровному животному в стандартной дозе в диапазоне 5-5000 мг/м2 площади тела животного, то есть приблизительно 0,1-200 мг/кг, и это обычно обеспечивает терапевтически эффективную дозу. Стандартная лекарственная форма, такая как таблетка или капсула, обычно будет содержать, например, 1-250 мг активного компонента. Предпочтительно стандартная лекарственная форма, такая как таблетка или капсула, обычно будет содержать, например, 10-70 мг активного компонента. Предпочтительно применяют суточную дозу в диапазоне 10-150 мг/кг, например 10-50 мг/кг вводят два раза в сутки. Однако суточная доза обязательно будет варьировать в зависимости от субъекта, которого лечат, конкретного пути введения и тяжести заболевания, которое лечат. Соответственно, практикующий врач, который лечит какого-либо конкретного пациента, может определить оптимальную дозировку. Например, фармацевтическая композиция по настоящему изобретению, подходящая для перорального введения, может содержать 1-200 мг/мл соединения I в 0,5% гидроксипропилметилцеллюлозе (НРМС).
Таксан (такой как доксетацел) обычно будут вводить теплокровному животному в стандартной дозе, известной опытному практикующему врачу как терапевтически эффективная доза. Для однодозовой лекарственной формы активные компоненты можно комбинировать с подходящим и удобным количеством эксципиентов, которое может варьировать от примерно 5 до примерно 98 процентов по массе от общей массы композиции. Обычно стандартные лекарственные формы будут содержать примерно от 20 мг примерно до 500 мг активного компонента. Однако суточная доза обязательно будет варьировать в зависимости от субъекта, которого лечат, конкретного пути введения и тяжести заболевания, которое лечат.Соответственно, оптимальная дозировка может быть определена практикующим врачом, который лечит какого-либо конкретного пациента.
В любом воплощении, описанном здесь, таксан (например доцетаксел) можно вводить в дозе 50-140 мг/м2 площади тела животного в сутки при введении, например 60-120 мг/м2 площади тела животного или например 65-110 мг/м2 площади тела животного. В любом воплощении, описанном здесь, соединение [I] или фармацевтически приемлемую соль можно вводить 10-50 мг/кг два раза в сутки, в те дни когда его вводят. Специалист в данной области техники понимает, что если для дозирования используют фармацевтически приемлемую соль соединения [I], содержание соединения [I] в дозе составляет менее чем 100%, и реальная масса соли, которую вводят, будет выше, чем вышеупомянутые 10-50 мг/кг два раза в сутки в зависимости от массы противоиона, используемого для получения конкретной соли, и стехиометрии соли. Реальные дозы для применения у данного пациента должны определяться врачом соответствующей квалификации.
Дозировка каждого из лекарственных средств и их соотношения должны быть составлены таким образом, чтобы обеспечивать наилучшее возможное лечебное действие, как определено национальными и международными руководствами (которые периодически пересматривают и определения уточняют).
Экспериментальные данные
Соединение [I] может быть получено в соответствии с методиками, описанными в WO 2011/051704, значимые подробности которого включены в данное описание посредством ссылки.
Самкам бестимусных мышей Swiss nu/nu подкожно имплантировали в левый бок 0,1 мл клеток РС3 (1×106 клеток в среде Исков, не содержащей сыворотку, смешанной с матригелем 50:50) или клеток НСС70 (1×106 клеток в среде RPMI, не содержащей сыворотку, смешанной с матригелем 50:50). Как только опухоли достигали размера 200-500 мм3, животных случайным образом делили на контрольную группу и группы лечения.
Соединение [I] в форме свободного основания дозировали в присутствии или в отсутствие АВТ (аминобензотриазол). Для групп, которым вводили АВТ, один раз в неделю в состав композиции включали или только соединение [I] в 10% DMSO (диметилсульфоксид)/60% TEG/30% WFI(вода для инъекций), или соединение [I] в присутствии 10 мг/мл АВТ. Для дозирования два раза в сутки соединение [I] дозировали совместно с АВТ в час 0 и затем вводили только соединение [I] в форме единой композиции в час 6-8. Для групп, которым не вводили АВТ, соединение [I] в состав композиции включали один раз в неделю в форме суспензии в гидроксипропилметилцеллюлозе (НРМС)/Твин и дозировали один или два раза в сутки (0 и 6-8 часов).
1,5 мг/мл доцетаксел (Taxotere™) приготавливали свежим в физиологическом растворе и вводили в форме одного внутривенного (i.v.) болюса со скоростью 0,1 мл/10 г в сутки 0, за 24 часа до введения соединения [I].
га-Объем опухоли рассчитывали два раза в неделю по измерениям двусторонним штангенциркулем, используя формулу (длина×ширина×ширина)×π/6. Ингибирование роста от начала обработки оценивали путем сравнения изменения геометрического среднего объема опухоли в контрольной группе и группе лечения. Статистическую значимость оценивали с помощью одностороннего t-критерия.
Перечень графических материалов
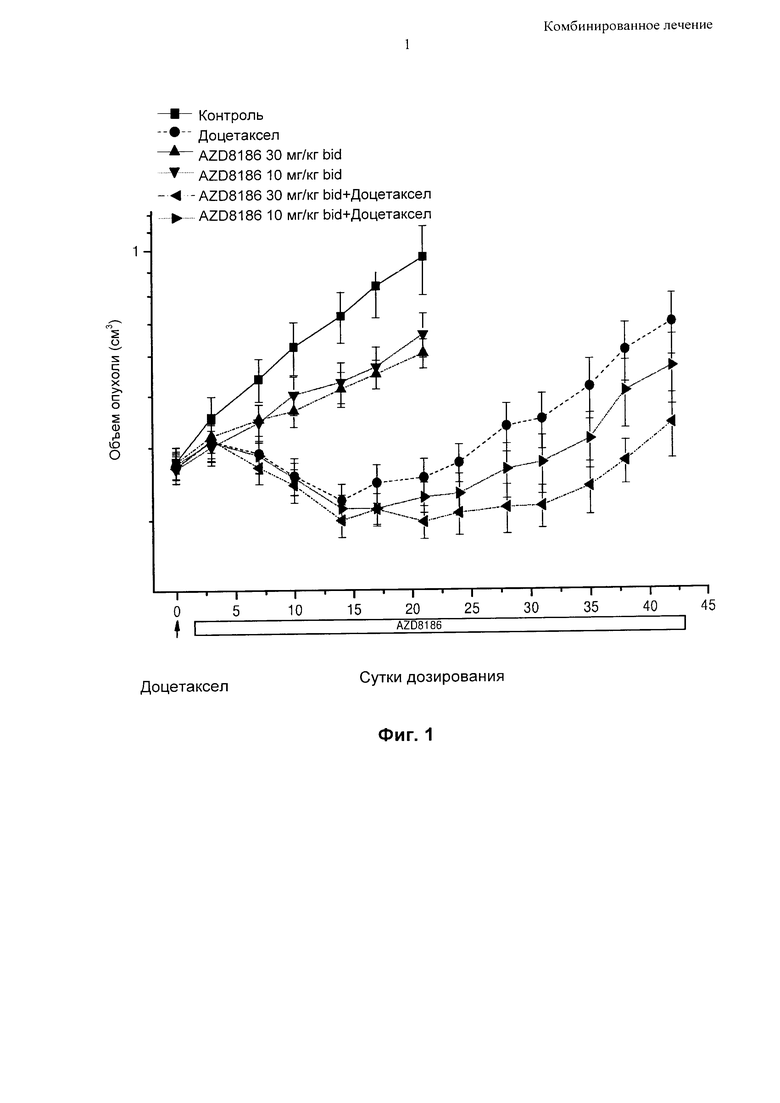
Фиг. 1 - Длительное непрерывное дозирование соединения [I], приготовленного в виде препарата с АВТ, в комбинации с доцетакселом в мышиной модели ксенотрансплантата РС3.
На Фиг. 1 показано изменение объема опухоли в мышиной модели ксенотрансплантата РС3 (линия клеток рака предстательной железы) на протяжении периода 42 суток при лечении:
1. только соединением [I] в дозе 10 мг/кг два раза в сутки (bid);
2. только соединением [I] в дозе 30 мг/кг два раза в сутки;
3. только таксаном (доцетакселом);
4. комбинацией соединения [I] в дозе 10 мг/кг два раза в сутки вместе с таксаном (доцетакселом); и
5. комбинацией соединения [I] в дозе 30 мг/кг два раза в сутки вместе с таксаном (доцетакселом).
На Фиг. 1 показано, что использование комбинации соединения [I] и доцетаксела очевидно приводит к достижению дополнительного уменьшения опухоли по сравнению с использованием соединения [I] или доцетаксела по отдельности.
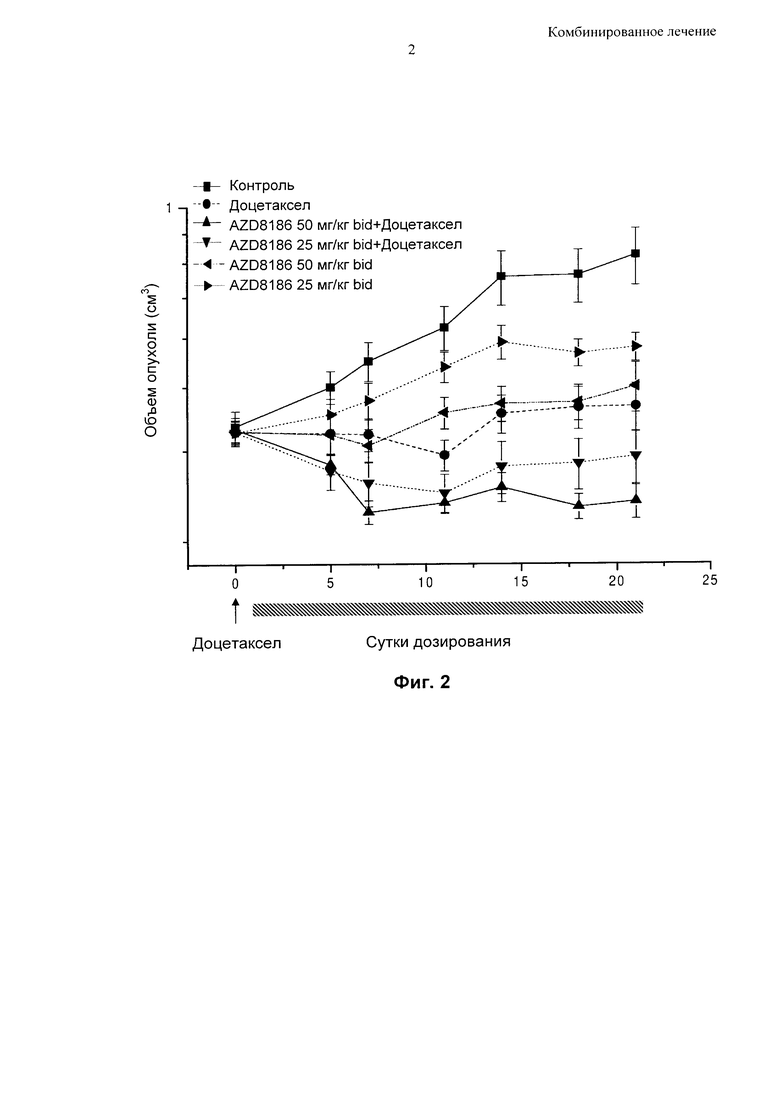
Фиг. 2 - Противоопухолевая активность соединения [I], приготовленного в виде препарата без АВТ, при непрерывном дозировании в комбинации с доцетакселом в мышиной модели ксенотрансплантата НСС70.
На Фиг. 2 показано изменение объема опухоли в мышиной модели ксенотрансплантата НСС70 (линия клеток рака молочной железы) на протяжении периода 21 сутки при лечении:
1. только соединением [I] в дозе 25 мг/кг два раза в сутки;
2. только соединением [I] в дозе 50 мг/кг два раза в сутки;
3. только таксаном (доцетакселом);
4. комбинацией соединения [I] в дозе 25 мг/кг два раза в сутки вместе с таксаном (доцетакселом); и
5. комбинацией соединения [I] в дозе 50 мг/кг два раза в сутки вместе с таксаном (доцетакселом).
На Фиг. 2 снова показано, что использование комбинированного лечения очевидно приводит к достижению дополнительного уменьшения опухоли по сравнению с использованием соединения [I] или доцетаксела по отдельности.
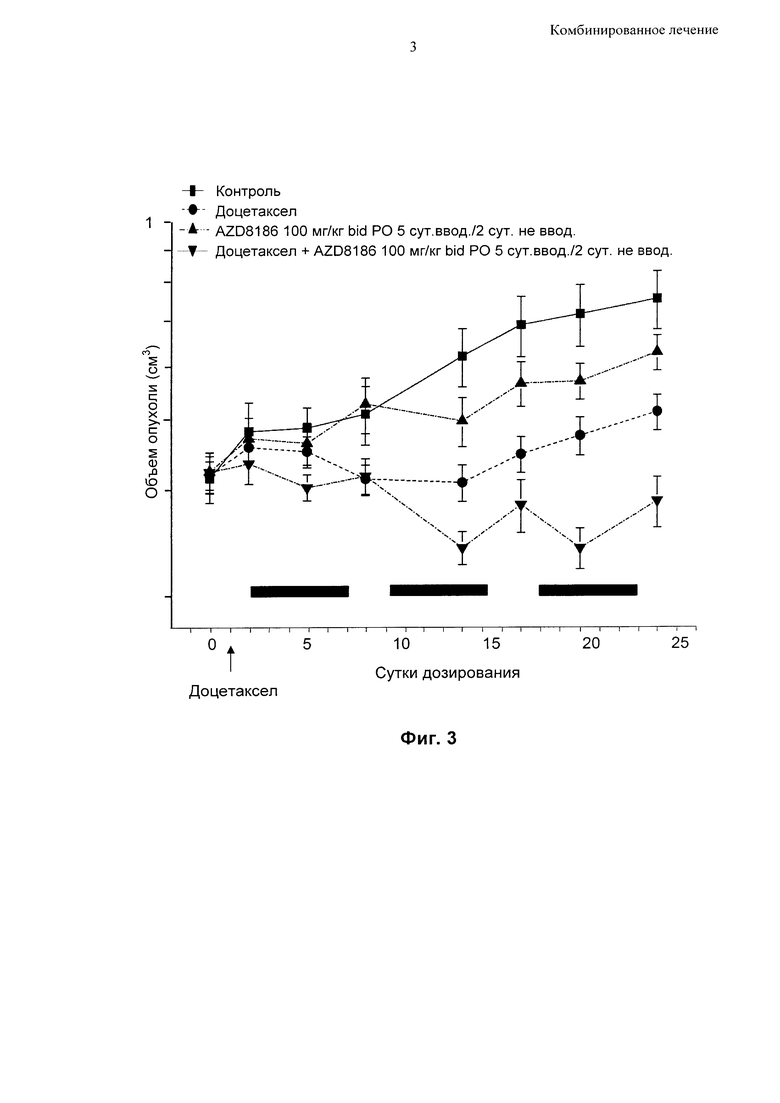
Фиг. 3 - Противоопухолевая активность прерывистого введения высоких доз соединения [I], приготовленного в виде препарата без АВТ, при дозировании в комбинации с доцетакселом в модели ксенотрансплантата НСС70.
На Фиг. 3 показано изменение объема опухоли в мышиной модели ксенотрансплантата НСС70 (линия клеток рака молочной железы) на протяжении периода 23 суток при лечении:
1. только таксаном (доцетакселом);
2. только соединением [I] в дозе 100 мг/кг два раза в сутки, где соединение [I] вводили только в течение 5 суток подряд на протяжении периода продолжительностью 7 суток, без введения какого-либо агента в оставшиеся 2 суток; и
3. комбинацией соединения [I] в дозе 100 мг/кг два раза в сутки вместе с доцетакселом, где соединение [I] вводили только в течение 5 суток подряд на протяжении периода продолжительностью 7 суток, без введения какого-либо агента в оставшиеся 2 суток.
На Фиг. 3 показано, что даже прерывистое дозирование соединения [I] в комбинации с одной дозой доцетаксела может приводить к устойчивой дополнительной противоопухолевой активности в сравнении с доцетакселом или соединением [I] по отдельности.
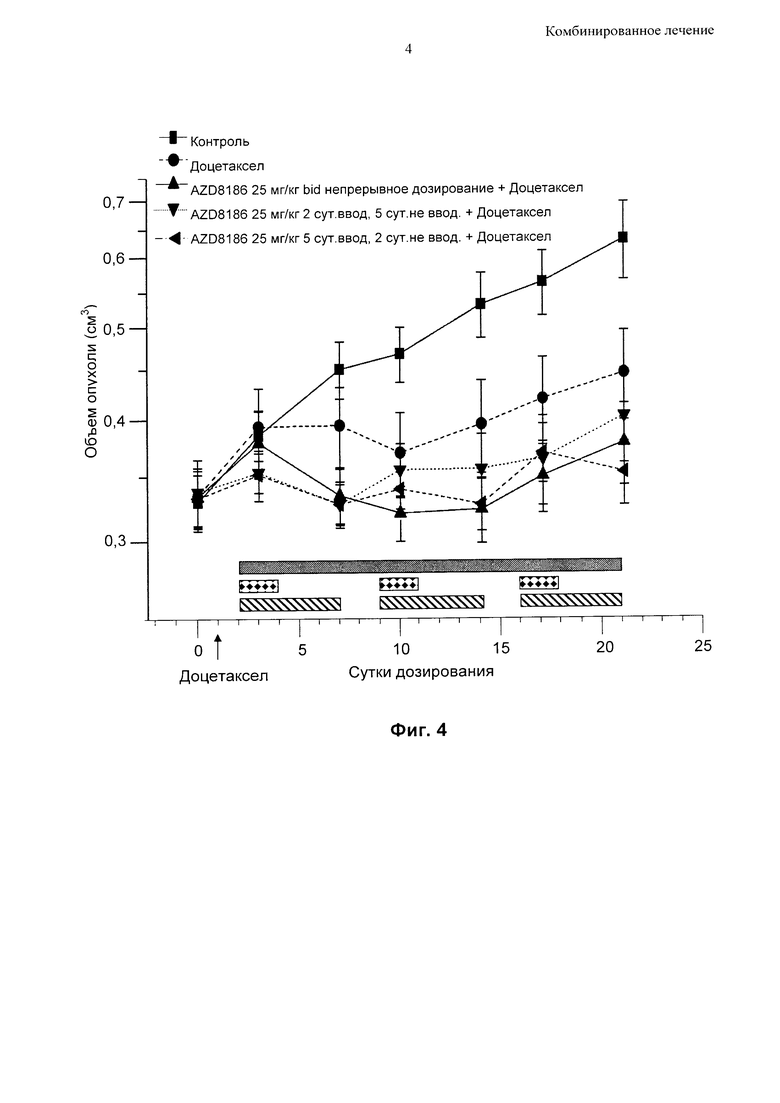
Фиг.4 - Противоопухолевая активность прерывистого введения низких доз соединения [I], приготовленного в виде препарата без АВТ, при дозировании в комбинации с доцетакселом в модели ксенотрансплантата НСС70.
На Фиг. 4 показано изменение объема опухоли на мышиной модели ксенотрансплантата НСС70 (линия клеток рака молочной железы) на протяжении периода 21 суток при лечении:
1. только таксаном (доцетакселом);
2. комбинацией соединения [I] в дозе 25 мг/кг два раза в сутки вместе с таксаном (доцетакселом) при непрерывном дозировании;
3. комбинацией соединения [I] в дозе 25 мг/кг два раза в сутки вместе с доцетакселом, где соединение [I] вводили только в течение 5 суток подряд на протяжении периода продолжительностью 7 суток, без введения какого-либо агента в оставшиеся 2 суток;
4. комбинацией соединения [I] в дозе 25 мг/кг два раза в сутки вместе с доцетакселом), где соединение [I] вводили только в течение 2 суток подряд на протяжении периода продолжительностью 7 суток, без введения какого-либо агента в оставшиеся 5 суток.
На Фиг. 4 показано, что даже прерывистое дозирование соединения [I] в относительно низкой дозе в комбинации с одной дозой доцетаксела может приводить к устойчивой дополнительной противоопухолевой активности в сравнении с доцетакселом или соединением [I] по отдельности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНЕРГИСТИЧЕСКИЕ КОМБИНАЦИИ АУРИСТАНА | 2015 |
|
RU2717570C2 |
| СЕЛЕКТИВНОСТЬ В ОТНОШЕНИИ МУТАНТНЫХ ФОРМ И КОМБИНАЦИИ СОЕДИНЕНИЯ, ПРЕДСТАВЛЯЮЩЕГО СОБОЙ ИНГИБИТОР ФОСФОИНОЗИТИД-3-КИНАЗЫ, И ХИМИОТЕРАПЕВТИЧЕСКИХ АГЕНТОВ ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2665949C2 |
| КОМБИНАЦИИ (СОСТАВЫ), ВКЛЮЧАЮЩИЕ DMXAA, ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2404764C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПИРИДИНАМИННОЕ СОЕДИНЕНИЕ, И ЕЕ ПРИМЕНЕНИЕ ПРИ ROS1-ПОЛОЖИТЕЛЬНОМ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО | 2020 |
|
RU2827402C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ | 2014 |
|
RU2644769C2 |
| КОМБИНАЦИИ ИНГИБИТОРОВ ФОСФОИНОЗИТИД 3-КИНАЗЫ И ХИМИОТЕРАПЕВТИЧЕСКИХ АГЕНТОВ И СПОСОБЫ ПРИМЕНЕНИЯ | 2008 |
|
RU2523890C2 |
| ЛЕЧЕНИЕ РАКА КОМБИНАЦИЕЙ ПЛИНАБУЛИНА И ТАКСАНА | 2013 |
|
RU2662298C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА | 2005 |
|
RU2361589C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ХИНОЛИНА ДЛЯ ЛЕЧЕНИЯ РАКА ПИЩЕВОДА, А ТАКЖЕ СПОСОБ ЛЕЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И НАБОР С ИХ ИСПОЛЬЗОВАНИЕМ | 2017 |
|
RU2734260C2 |
| КОМБИНАЦИЯ, СОДЕРЖАЩАЯ N-(3-МЕТОКСИ-5-МЕТИЛПИРАЗИН-2-ИЛ)-2-(4-[1,3,4-ОКСАДИАЗОЛ-2-ИЛ]ФЕНИЛ)ПИРИДИН-3-СУЛЬФОНАМИД И АНТИМИТОТИЧЕСКОЕ СРЕДСТВО, ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2005 |
|
RU2428188C2 |
Группа изобретений относится к медицине. Предложены: применение комбинации, содержащей 8-[(1R)-1-(3,5-дифторфениламино)этил]-N,N-диметил-2-морфолино-4-оксо-4Н-хромен-6-карбоксамид (соединение I) или его фармацевтически приемлемую соль и доцетаксел, для лечения кастрационно-резистентного рака предстательной железы, где соединение [I] или его фармацевтически приемлемую соль дозируют прерывисто; применение указанной комбинации для лечения рака молочной железы с тройным негативным фенотипом, где соединение [I] или его фармацевтически приемлемую соль дозируют прерывисто. Технический результат состоит в устойчивой дополнительной противоопухолевой активности комбинации даже при низкой дозе соединения [I] и его прерывистом введении для заявленных форм рака. 2 н. и 8 з.п. ф-лы, 4 ил.
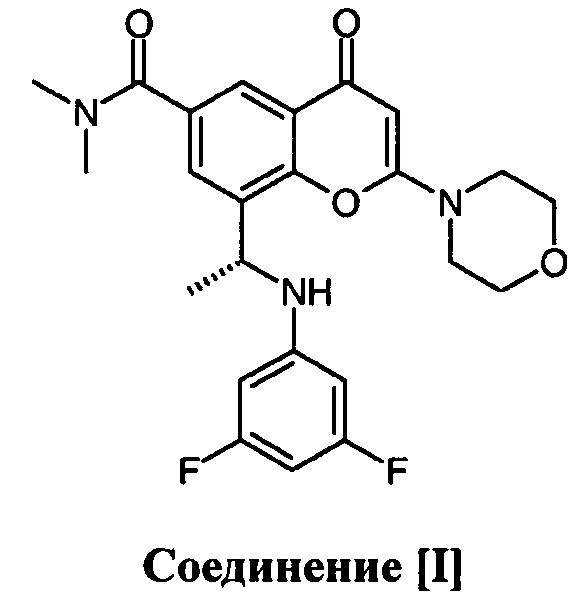
1. Применение комбинации соединения [I]
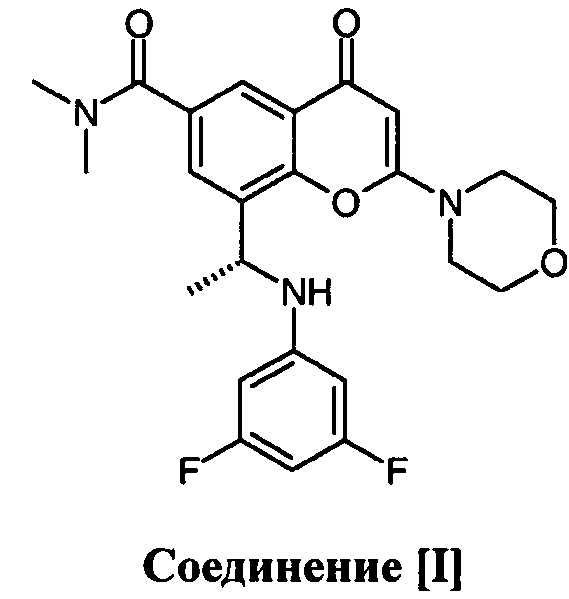
или его фармацевтически приемлемой соли и доцетаксела для лечения кастрационно-резистентного рака предстательной железы, где соединение [I] или его фармацевтически приемлемую соль дозируют прерывисто.
2. Применение по п. 1, где в пределах данного цикла дозирования соединение [I] или его фармацевтически приемлемую соль не вводят в течение 1, 2, 3, 4, 5, 6 или 7 суток.
3. Применение по п. 1 или 2, где соединение [I] или его фармацевтически приемлемую соль и доцетаксел вводят последовательно.
4. Применение по п. 1 или 2, где соединение [I] или его фармацевтически приемлемую соль и доцетаксел вводят в цикле дозирования продолжительностью 8-29 суток.
5. Применение комбинации соединения [I]
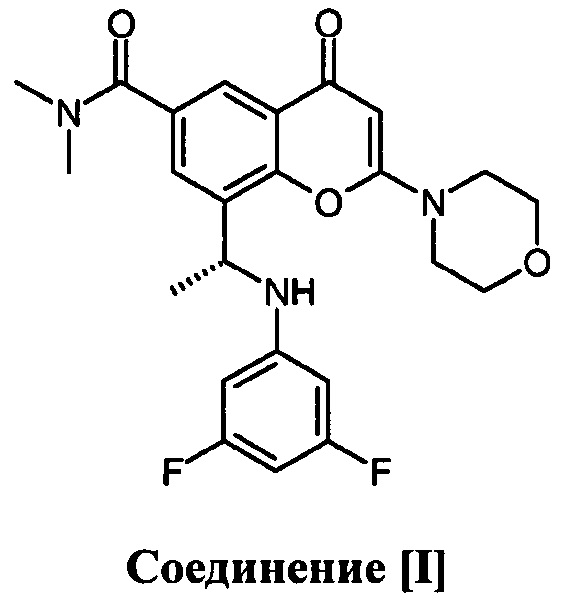
или его фармацевтически приемлемой соли и доцетаксела для лечения рака молочной железы с тройным негативным фенотипом, где соединение [I] или его фармацевтически приемлемую соль дозируют прерывисто в цикле дозирования продолжительностью 8-29 суток, причем соединение [I] или его фармацевтически приемлемую соль не вводят в течение 1, 2, 3, 4, 5, 6 или 7 суток, и где доцетаксел вводят только один раз в данном цикле дозирования.
6. Применение по п. 4, где доцетаксел вводят только один раз в данном цикле дозирования.
7. Применение по п. 5 или 6, где доцетаксел вводят в пределах 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли в данном цикле дозирования.
8. Применение по п. 1 или 5, где цикл дозирования составляет 15-29 суток и включает введение доцетаксела в пределах 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли с последующим прерывистым дозированием соединения [I] или его фармацевтически приемлемой соли периодами по 7 суток, состоящими из 5 суток, в которые дозируют соединение [I] или его фармацевтически приемлемую соль, с последующими 2 сутками, в которые не дозируют соединение [I] или его фармацевтически приемлемую соль.
9. Применение по п. 1 или 5, где цикл дозирования составляет 15-29 суток и включает введение доцетаксела в пределах 24 часов до первого введения соединения [I] или его фармацевтически приемлемой соли с последующим прерывистым дозированием соединения [I] или его фармацевтически приемлемой соли периодами по 7 суток, состоящими из 4 суток, в которые дозируют соединение [I] или его фармацевтически приемлемую соль, с последующими 3 сутками, в которые не дозируют соединение [I] или его фармацевтически приемлемую соль.
10. Применение по п. 1 или 5, где доцетаксел вводят в дозе 50-140 мг/м2 поверхности тела пациента в те сутки, когда его дозируют, и соединение [I] или его фармацевтически приемлемую соль вводят в дозе 10-50 мг/кг два раза в сутки в те сутки, когда его дозируют.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| СИНЕРГИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2438664C2 |
| BENDER A | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| М.Д.МАШКОВСКИЙ, Лекарственные средства | |||
| М., Новая волна, 2012, 16-е изд., с.998, статьи Паклитаксел, Доцетаксел | |||
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2001 |
|
RU2284818C2 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2018-09-13—Публикация
2014-03-03—Подача