Ссылка на родственную заявку
В соответствии с настоящей заявкой испрашивается приоритет согласно предварительной заявке на выдачу патента США №61/791953, поданной 15 марта 2013 года, полное содержание которой включено в настоящий документ посредством отсылки.
Перечень последовательностей
Настоящая заявка включает Перечень последовательностей, поданный в электронном виде в формате ASCII и, таким образом, включенный в настоящий документ при помощи ссылки в полном его объеме Указанная копия в формате ASCII, созданная 7 марта 2014 года, имеет название 44546-702.601_SL.txt и размер, составляющий 38025 байт.
Уровень техники
Железо является основным микроэлементом, необходимым для роста и развития живых организмов. У млекопитающих содержание железа регулируется путем контроля поглощения железа, кругооборота железа и высвобождения железа из клеток, в которых оно хранится. Железо преимущественно поглощается энтероцитами в двенадцатиперстной кишке и в верхнем отделе тонкой кишки. Железо поступает в оборот из эритроцитов, разрушенных посредством ретикулоэндотелиальных макрофагов в костном мозге, клетками Купфера в печени и в селезенке. Высвобождение железа контролируется ферропортином, основным белком выведения железа, расположенным на поверхности энтероцитов, макрофагов и гепатоцитов, основных клеток, способных высвобождать железо в плазму крови. Гепсидин связывается с ферропортином и понижает его функциональную активность путем того, что вызывает его поглощение с клеточной поверхности и расщепление. (Nemeth et al., Science, 306:2090-3, 2004).
Сущность изобретения
Изобретение относится к антителам и их антиген-связывающим фрагментам, которые связываются с гепсидином (Hep) или пептидом гепсидина. В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с N-концом гепсидина или пептида гепсидина и нейтрализует активность гепсидина in vitro и/или in vivo.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с гепсидином или пептидом гепсидина, содержащим вариабельный участок тяжелой цепи и вариабельный участок легкой цепи,
причем указанный вариабельный участок тяжелой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность с любой из SEQ ID NO: 55-57,
(ii) CDR2, имеющий аминокислотную последовательность с любой из SEQ ID NO: 58-60, и
(iii) CDR3, имеющий аминокислотную последовательность с любой из SEQ ID NO: 61-63;
а указанный вариабельный участок легкой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность с любой из SEQ ID NO: 64-66,
(ii) CDR2, имеющий аминокислотную последовательность с любой из SEQ ID NO: 67-69, и
(iii) CDR3, имеющий аминокислотную последовательность с любой из SEQ ID NO: 70-72.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с гепсидином или пептидом гепсидина, содержащим вариабельный участок тяжелой цепи и вариабельный участок легкой цепи,
причем указанный вариабельный участок тяжелой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 1-3,
(ii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 4-6, и
(iii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 7-9;
а указанный вариабельный участок легкой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 10-12,
(ii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 13-15, и
(iii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 16-18.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, содержащему вариабельную тяжелую цепь и вариабельную легкую цепь IgG1 или IgG4.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с гепсидином или пептидом гепсидина, которые получены путем введения грызуну (т.е. мыши, крысе или кролику) пептида с аминокислотной последовательностью с любой из SEQ ID NO: 19-27. В соответствии с другим вариантом осуществления пептид конъюгируют с носителем (например, гемоцианином лимфы улитки (KLH)) или вводят с адъювантом (полным адъювантом Фрейнда (CFA) или неполным адъювантом Фрейнда (IFA)). В соответствии с другим вариантом осуществления пептид конъюгируют с гаптеном (например, динитрофенолом [DNP]) и носителем.
Пептид гепсидина, с которым связывается антитело или его антиген-связывающий фрагмент, может иметь в некоторых случаях аминокислотную последовательность с SEQ ID NO: 19.
Настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которое специфично связывается с эпитопом, содержащим аминокислотную последовательность любого из Нер-5, Нер-9, Нер-20, Hep-22 и Нер-25.
В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с эпитопом, содержащим аминокислотную последовательность Нер-20 (SEQ ID NO: 22), Hep-22 (SEQ ID NO: 23) и Hep-25 (SEQ ID NO: 19).
В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с эпитопом, содержащим аминокислотную последовательность Нер-5 (SEQ ID NO: 25) или Нер-9 (SEQ ID NO: 24). В соответствии с другим вариантом осуществления настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с эпитопом, содержащим аминокислотные остатки 1-9 гепсидина. В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с 2, 3, 4, 5, 6, 7, 8, или 9 аминокислотными остатками эпитопа, содержащего аминокислотные остатки 1-9 гепсидина.
В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент представляет собой моноклональное антитело, содержащее CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 55, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 58, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 61, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 64, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 67, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 70.
В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент представляют собой моноклональное антитело, содержащее CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 56, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 59, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 61, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 65, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 68, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 71.
В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент представляют собой моноклональное антитело, содержащее CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 57, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 60, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 63, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 66, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 69, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 72.
Антитело может представлять собой, например, моноклональное антитело, химерное антитело, человеческое антитело или гуманизированное антитело. В соответствии с одним вариантом осуществления гуманизированная вариабельная тяжелая цепь содержит аминокислотную последовательность, изложенную под SEQ ID NO: 40. В соответствии с другим вариантом осуществления гуманизированная вариабельная легкая цепь содержит аминокислотную последовательность, изложенную под SEQ ID NO: 38.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, содержащему каркасный участок вариабельного участка тяжелой цепи и каркасный участок вариабельного участка легкой цепи, которые изложены в приведенном ниже Перечне последовательностей, где CDR, указанные в любой из SEQ ID NO: 1-18, вставлены в каркасный участок с использованием нумерации Кэбота.
Антиген-связывающий фрагмент может представлять собой, например, Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, Fv фрагмент, scFv фрагмент, одноцепочечный связывающий полипептид, Fd фрагмент, вариабельную тяжелую цепь, вариабельную легкую цепь или dAb фрагмент. Антиген-связывающий фрагмент может представлять собой, например, AVIMER, диатело или димер тяжелой цепи. Димер тяжелой цепи может представлять собой, например, конструкцию тяжелой цепи верблюда или акулы.
Антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе, могут иметь константу диссоциации (Kd), составляющую от приблизительно 1 до приблизительно 10 пМ, от приблизительно 10 до приблизительно 20 пМ, от приблизительно 1 до приблизительно 29 пМ, от приблизительно 30 до приблизительно 40 пМ, от приблизительно 10 до приблизительно 100 пМ или от приблизительно 20 до приблизительно 500 пМ.
Антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе, могут иметь константу диссоциации (Kd), составляющую менее приблизительно 500 пМ, менее приблизительно 400 пМ, менее приблизительно 300 пМ, менее приблизительно 200 пМ, менее приблизительно 100 пМ, менее приблизительно 75 пМ, менее приблизительно 50 пМ, менее приблизительно 30 пМ, менее приблизительно 25 пМ, менее приблизительно 20 пМ, менее приблизительно 18 пМ, менее приблизительно 15 пМ, менее приблизительно 10 пМ, менее приблизительно 7,5 пМ, менее приблизительно 5 пМ, менее приблизительно 2,5 пМ или менее приблизительно 1 пМ.
Антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе, могут иметь аффинность к гепсидину или пептиду гепсидина, составляющую от приблизительно 10-9 до приблизительно 10-14, от приблизительно 10-10 до приблизительно 10-14, от приблизительно 10-11 до приблизительно 10-14, от приблизительно 10-12 до приблизительно 10-14, от приблизительно 10-13 до приблизительно 10-14, от приблизительно 10-10 до приблизительно 10-11, от приблизительно 10-11 до приблизительно 10-12, от приблизительно 10-12 до приблизительно 10-13 или 10-13 до приблизительно 10-14.
Настоящее изобретение относится к композиции, содержащей антитело или антиген-связывающий фрагмент, описываемые в настоящем документе, и приемлемый носитель или вспомогательное средство.
Также настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе. Также настоящее изобретение относится к вектору экспрессии, содержащему молекулу нуклеиновой кислоты, функционально связанную с регуляторной управляющей последовательностью. Также настоящее изобретение относится к клетке-хозяину, содержащей приведенные в настоящем документе вектор или молекулу нуклеиновой кислоты. Также настоящее изобретение относится к способу применения клетки-хозяина для получения антитела, предусматривающему культивирование клетки-хозяина в таких подходящих условиях, чтобы экспрессировалась нуклеиновая кислота, с получением антитела.
Настоящее изобретение относится к терапевтическим способам с использованием описываемых в настоящем документе антитела или его антиген-связывающего фрагмента. В соответствии с одним аспектом настоящее изобретение относится к способу лечения нарушения гомеостаза железа у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с другим аспектом настоящее изобретение относится к способу модулирования активности гепсидина у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения нарушения гомеостаза железа у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения гемохроматоза у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения субъекта с патологически или несоответственно повышенными уровнями гепсидина (несоответственно повышенными по отношению к запасам железа в организме и плазме крови), предусматривающему введение указанному субъекту описываемой в настоящем документе фармацевтической композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения анемии у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения или уменьшения воспаления у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с одним вариантом осуществления воспаление, подлежащие лечению или уменьшению, является хроническим воспалением. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения воспалительного заболевания у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения инфекции у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. Инфекция может быть, например, бактериальной, грибковой или вирусной инфекцией. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения железорефрактерной алиментарной анемии (IRIDA). В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения анемии при воспалении (AI) и анемии при хроническом заболевании (ACD). В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения хронической почечной недостаточности (CKD). В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения злокачественной опухоли и индуцированной химиотерапией анемии (CCIA), которые ассоциированы с повышенным гепсидином. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения нейровоспалительных заболеваний, которые ассоциированы с повышенным гепсидином.
Любой из таких способов в некоторых случаях может дополнительно предусматривать введение указанному субъекту одного или нескольких стимуляторов эритропоэза. Стимуляторы эритропоэза включают без ограничения эритропоэтин, вариант эритропоэтина, стимулирующее эритропоэз средство (ESA; такое как, например, эпоэтин альфа [например, Procrit®, Epogen® и т.д.], эпоэтин бета [например, NeoRecormon и т.д.], дарбэпоэтин альфа [например, Aranesp® и т.д.], метоксиполиэтиленгликоль-эпоэтин бета [например, Mircera® и т.д.] и т.д.), ингибитор пролилгидроксилазы индуцируемого гипоксией фактора (HIF), эритроидный фактор из костного мозга (например, эритроферрон), пептид минигепсидина (см., например, патентную публикацию США №20120040894, Ganz et al., которая включена в настоящий документ при помощи ссылки), антисмысловой ингибитор гепсидина (см., например, патентную публикацию США №20100136015, Lin и Babitt., которая включена в настоящий документ при помощи ссылки), siRNA-ингибитор гепсидина (Id.), miRNA-ингибитор гепсидина (Id.), антитело к ВМР-2 (Id.), антитело к ВМР-4 (Id.), антитело к ВМР-6 (Id.), низкомолекулярный ингибитор (Id.), антитело к IL-6 (см., например, патентную публикацию США №20110059080, Cornfeld et al., которая включена в настоящий документ при помощи ссылки), антитело к TNF-альфа, метотрексат, противовоспалительное средство (например, стероид [например, кортикостероид и т.д.]; нестероидное противовоспалительное лекарственное средство [NSAID; например, аспирин, ибупрофен, напроксен, ингибитор фермента циклооксигеназа (СОХ) и т.д.], гормон (например, тестостерон) или иммунно-селективное противовоспалительное производное [ImSAID; например, трипептид FEG (Phe-Glu-Gly) и его D-изомер feG]), гемоювелин, антитело, которое связывает эритропоэтин, и их комбинации. В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент, которые специфично связывают гепсидин, и стимулятор эритропоэза вводят одновременно или последовательно.
Введение композиции по настоящему изобретению можно осуществлять любыми подходящими способами, включая без ограничения инъекцию. В соответствии с одним вариантом осуществления инъекция может быть, например, внутривенной, подкожной, внутримышечной инъекцией или спинальной инъекцией в спинномозговую жидкость (CSF).
Настоящее изобретение относится к контейнерному устройству, содержащему описываемую в настоящем документе композицию. Контейнерное устройство может представлять собой любой подходящий контейнер, который может заключать в себе жидкость или лиофилизированную композицию, включая без ограничения пузырек, шприц, флакон, пакет или ампулу для внутривенного (IV) вливания. Шприц может содержать любой объем жидкости, подходящей для инъекции субъекту, включая без ограничения 0,5 см3, 1 см3, 2 см3, 5 см3, 10 см3 или более.
Настоящее изобретение относится к наборам, содержащим композицию или композиции, описываемые в настоящем документе. В соответствии с одним аспектом настоящее изобретение относится к набору для лечения нарушения, ассоциированного с повышенными уровнями гепсидина, или нарушения гомеостаза железа, содержащий антитело или его антиген-связывающий фрагмент, которые описаны в настоящем документе, и стимулятор эритропоэза. Понятно, в некоторых случаях, что гепсидин может находится в нормальном диапазоне, но быть несоответственно повышенным по отношению к запасам железа.
В соответствии с другим аспектом настоящее изобретение относится к набору для лечения нарушения, ассоциированного с повышенными уровнями гепсидина, или нарушения гомеостаза железа, содержащий антитело или его антиген-связывающий фрагмент, которые описаны в настоящем документе, и этикетку, прикрепленную к контейнеру или поставляемую с ним, причем на этикетке описано применение антитела или его антиген-связывающего фрагмента со стимулятором эритропоэза.
В соответствии с другим аспектом настоящее изобретение относится к набору для лечения нарушения, ассоциированного с повышенными уровнями гепсидина, содержащий стимулятор эритропоэза и этикетку, прикрепленную к контейнеру или поставляемую с ним, причем на этикетке описано применение стимулятора эритропоэза с антителом или его антиген-связывающим фрагментом, которые описаны в настоящем документе.
Все упомянутые в настоящем описании публикации, патенты и заявки на выдачу патентов включены в настоящий документ при помощи ссылки в таком же объеме, как если бы каждая отдельная публикация, патент или заявка на выдачу патента была бы специально и отдельно указана как включенная при помощи ссылки.
Краткое описание чертежей
Новые признаки настоящего изобретения подробно изложены в прилагаемой формуле. Лучшее понимание признаков и преимуществ настоящего изобретения можно будет получить с учетом приведенного далее подробного описания, в котором изложены иллюстративные варианты осуществления, в которых задействованы принципы настоящего изобретения, и прилагаемых чертежей, описание которых приведено далее.
Фигура 1. Примеры антигенных последовательностей пептида гепсидина, применяемые для иммунизации BALB/c мышей для получения гибридомы и обнаружения MAb Н32, 583 и 1В1.
Фигура 2. Пример первого раунда скрининга выделенных гибридом с применением покрытых нейтравидином планшетов, которые покрывают K18-биотин-гепсидином-25 и детектируют антителом к мышиному IgG (H+L), конъюгированным с HRP. Изображены оптические плотности (OD) на 450 нм после проявления реакции с HRP и добавления стоп-реагента. Следует отметить, что положительные сигналы (>2,0 OD) в колонке 9, строки D-F. Лунками с положительным или отрицательным контролями, соответственно, являются G12 и Н12.
Фигура 3. Пример второго раунда скрининга выделенных гибридом после первого раунда скрининга, определенные как положительные (фигура 2), с применением планшетов с покрытием антителами кролика к мышиному Fc для захвата мышиного IgG из супернатантов гибридом. Связанные мышиные IgG затем подвергают скринингу в отношении связывания с K18-биотин-гепсидином-25 с применением конъюгированной со стрептавидином HRP. Изображены оптические плотности (OD) на 450 нм после проявления реакции с HRP и добавления стоп-реагента. Следует отметить, что положительные сигналы (>2,0 OD) в колонке 9, строка D. Лунками с положительным или отрицательным контролями, соответственно, являются G12 и Н12.
Фигура 4. Скрининг на функциональную активность гибридом, положительных по связыванию антитела к гепсидину. Лунки покрывали антителами к мышиному Fc и блокировали. В каждые две лунки каждый добавляли определяемый супернатант гибридомы к буферу для связывания, содержащему 1 нг меченного вещества, представляющего собой NT-биотин-гепсидин-25, с 100 нг синтетического гепсидина-25 или без них. Связывание NT-биотин-гепсидина-25 детектировали при помощи SA-HRP как OD на 450 нм после добавления стоп-реагента в лунки. У антитела 5А3 (как и в случае с 4В1 и 5A4) наблюдали отличное связывание в буфере без гепсидина-25, и оно полностью блокировалось посредством гепсидином-25 в буфере для связывания, что указывало на то, что гибридома 5А3 содержала антитело, которое связывалось как с NT-биотин-гепсидином-25, так и с синтетическим гепсидином-25 в растворе. Клон, в конечном итоге полученный от гибридомы 5А3, позже переименовывали в MAb 583; таким образом, данные для MAb 583 показаны в лунках 5A3. Клоны как 4В1, так и 5A4, несмотря на очевидно положительное значение в таком скрининге, не вырабатывали функциональные антитела к гепсидину при испытании после дополнительного скрининга на размножение, функциональность и изотип.
Фигура 5. Характеристики MAb 583, 1В1 и Н32, в том числе антигены, титры в сыворотке иммунизированных BALB/c мышей, участки инъекции, частоту инъекций, ткань (ткани), применяемые для получения гибридом, и показатели эффективности для каждого раунда скрининга, приводившего к получению выделенных, функциональных моноклональных антител к гепсидину.
Фигура 6. Все показатели эффективности для функциональных MAb к гепсидину-25 для мероприятий по разработке 8 MAb. Всего 11845 гибридом были подвергнуты скринингу для выявления MAb Н32, 583 и 1В1.
Фигура 7. SDS-PAGE-анализ в восстанавливающих условиях очистки MAb 583 на колонке с белком А. Неочищенные препараты разведенных супернатантов гибридомы, элюированные фракции, собранные в ходе промывания колонки, и высокоочищенное MAb 583 (лот очистки 003) и 1В1 (лот очистки 003), проанализированные посредством окрашивания кумасси. Справа от блота приведены описания дорожек.
Фигура 8. ELISA-анализ нейтрализации MAb 583 в растворе посредством гепсидина-25. С помощью такого скринингового исследования в растворе испытывали способность 0,0, и 0,1-8,0 нг синтетического гепсидина-25 (ось х) блокировать (нейтрализовать) связывание с 20 нг MAb 583 в растворе. Синтетический гепсидин (0,1-8,0 нг) добавляли к 20 нг MAb 583 на два часа в буфере для связывания. Обработанные гепсидином-25 растворы MAb 583 добавляли в каждые две лунки с гепсидином-25 (200 нг/лунку), ковалентно связанным с активированными малеиновым ангидридом микролуночными планшетами. Связывание с гепсидином-25 посредством MAb 583 детектировали при помощи антитела кролика к мышиному IgG (H+L), конъюгированному с HRP, при помощи ТМВ в качестве субстрата. Связывание MAb 583 со связанным гепсидином-25 количественно оценивали посредством спектрофотометрии после добавления стоп-реагента путем измерения OD (оптической плотности) на 450 нм.
Фигура 9. SDS-PAGE-гель в невосстанавливающих условиях с трицином (левая секция), окрашенный при помощи кумасси, и результаты вестерн-блоттинга (правая секция) гепсидина-25, гепсидина-22, гепсидина-20 и протегрина (1,5 мкг/дорожка) с обработкой MAb 583 в качестве зонда. Описания дорожек приведены в легенде под результатами блоттинга.
Фигура 10. Окрашенный кумасси SDS-PAGE в восстанавливающих условиях и результаты вестерн-блоттинга активности связывания MAb 583 и MAb 1В1 в отношении гепсидина-25, гепсидина-20, K18-биотин-гепсидина-25, K24-биотин-гепсидина-25 и NT-биотин-гепсидина-25. Описания дорожек приведены в легенде под результатами блоттинга.
Фигура 11. Анализ Biacore аффинностей связывания MAb 583 в количестве 24 мкг/мл к K18-биотин-гепсидину-25, NT-биотин-гепсидину-25 и K24-биотин-гепсидину-25, связанных с покрытым стрептавидином чипом Biacore. Из данных видна высокая аффинность и пикомолярные константы диссоциации у MAb 583 к NT-биотин-гепсидину 25 и сниженные примерно на один log константы аффинности к K18-биотин-гепсидину-25 и K24-биотин-гепсидину-25, соответственно.
Фигура 12. Анализ Biacore аффинностей связывания MAb 583 в количестве 5 мкг/мл к K18-биотин-гепсидину-25 и NT-биотин-гепсидину-25, связанных с покрытым стрептавидином чипом Biacore. Имело место небольшое изменение в крутизне для меченного вещества Biacore на протяжении 1200 секунд (20 минут), что указывало на низкие константы диссоциации связывания у MAb 583 к K18-биотин-гепсидину-25 и NT-биотин-гепсидину-25.
Фигура 13. Аффинность связывания, полученная в результате экспериментов Biacore, показана на фигуре 12. Из данных видна более высокая аффинность и пикомолярные константы ассоциации (KA) и более низкие константы диссоциации (KD) у MAb 583 к K18-биотин-гепсидину-25, нежели NT-биотин-гепсидину-25, при оценке в количестве 24 мкг/мл.
Фигура 14. Данные Biacore, указывающие на аффинность связывания MAb 1В1 в количестве 24 мкг/мл к K18-биотин-гепсидину-25, NT-биотин-гепсидину-25 и K24-биотин-гепсидину-25. Из этих данных видно, что MAb 1В1 имеют сильную аффинность связывания к K24-биотин-гепсидину-25, более низкую аффинность к K18-биотин-гепсидину-25 и отсутствие аффинности к NT-биотин-гепсидину-25. Такой эксперимент осуществляли на протяжении 500 секунд, и по результатам наблюдения или расчета посредством прибора Biacore диссоциация 1В1 отсутствовала после связывания с K24-биотин-гепсидином-25 и K18-биотин-гепсидином-25 на протяжении 500 секунд.
Фигура 15. Данные Biacore, указывающие на аффинность связывания MAb 1В1 в количестве 24 мкг/мл к K24-биотин-гепсидину-25. Из этих данных видна сильная аффинность 1В1 к K24-биотин-гепсидину-25 и отсутствие диссоциации MAb 1В1 от K24-биотин-гепсидина-25 на протяжении 500 секунд, что свидетельствует о том, что возможна низкая пикомолярно-фемтомолярная константа диссоциации для 1В1 от гепсидина-25.
Фигура 16. Анализ ELISA со стандартной кривой связывания гепсидина-25, гепсидина-22 и гепсидина-20 с антителом MAb 583, нанесенным покрытием в количестве 100 нг/мл на лунку. Посредством ELISA измеряли относительное связывание меченного вещества, представлявшего собой NT-биотин-гепсидин-25 (1 нг/лунка), по отношению к гепсидину-25, гепсидину-22 и гепсидину-20. Анализ четырех-параметрической логистической регрессии проводили при помощи программного обеспечения GraphPad Prism для получения показанных кривых. Сдвиг вправо кривой указывает на последовательно более низкую аффинность MAb 583 к гепсидину-22 и гепсидину-20, нежели MAb 583 имеет к гепсидину-25.
Фигура 17. Анализ ELISA связывания с мышиным гепсидином-1 (мышиным гепсидином-25), протегрином и пептидом гепсидина-(10-25) с MAb 583 по сравнению с NT-биотин-гепсидином-25. Из этих данных видно, что связывание MAb 583 с мышиным гепсидином-1, протегрином или окисленным и подвергнутым рефолдингу пептидом гепсидином-(10-25), содержащим соответствующие цистеиновые связи для такого участка гепсидина-25, отсутствует в концентрациях до 2000 нг/мл.
Фигура 18. Анализ ELISA связывания пептида гепсидина-(10-25) с MAb 1В1. Из результатов видно, что MAb 1В1 не имеет аффинности связывания к окисленному и подвергнутому рефолдингу пептиду гепсидина-(10-25), содержащему соответствующие цистеиновые связи для такого участка, по сравнению с гепсидином-25. Для детектирования применяли K18-биотин-гепсидин-25. Следует отметить, что связывание пептида гепсидина-(10-25) с MAb 1В1 отсутствует в концентрациях до 2000 нг/мл.
Фигура 19. Анализ ELISA связывания гепсидина-(10-25) с MAb 1В1. Из результатов видно, что MAb 1В1 не имеет аффинности связывания к окисленному и подвергнутому рефолдингу пептиду гепсидина-(10-25), содержащему соответствующие цистеиновые связи для такого участка, по сравнению с гепсидином-25. Для детектирования применяли NT-биотин-гепсидин-25. Следует отметить, что связывание гепсидина-(10-25) с MAb 1В1 отсутствует в концентрациях до 2000 нг/мл пептида гепсидин-(10-25).
Фигура 20. Проточная цитометрия клеток Fpn-GFP, обработанных при помощи MAb 583. Клетки индуцировали на протяжении ночи при помощи понастерона для индуцирования экспрессии мышиного Fpn-GFP. На следующий день понастерон удаляли посредством промывания и добавляли гепсидин-25 и антитела MAb 583 на 24 часа. Гепсидин-25 применяли в концентрации 100 нг/мл (37 нМ). MAb 583 добавляли в 10-кратной, 2-кратной или 1/3 концентрации гепсидина (370 нМ, 74 нМ и 10 нМ). Контрольное MAb представляло собой "неудачное" моноклональное антитело к гепсидину, при скрининге in vitro по результатам ELISA, и его применяли в наиболее высоких концентрациях (370 нМ). Следует отметить, что 10 нМ MAb 583 конкурентно нейтрализовали 37 нМ гепсидина-25 и его биологическую активность, что приводило к распаду FPN-GFP.
Фигура 21. Изменение процента (%) FPN-GFP флуоресценции у клеток HEK, обработанных при помощи MAb 583 в концентрациях 10-370 нМ в присутствии 37 нМ гепсидина-25.
Фигура 22. Проточная цитометрия Fpn-GFP клеток, обработанных при помощи MAb 583. Клетки индуцировали на протяжении ночи при помощи понастерона для индуцирования экспрессии мышиного Fpn-GFP. На следующий день понастерон удаляли посредством промывания и добавляли гепсидин-25 и антитела MAb 583 на 24 часа. Гепсидин-25 применяли в концентрации 100 нг/мл (37 нМ). В таких клеточных анализах биологической активности MAb 583 добавляли MAb 583 в 1/3, 1/6, 1/12 и 1/24 молярной концентрации гепсидина-25. Контрольное MAb представляло собой "неудачное" моноклональное антитело к гепсидину при скрининге in vitro посредством ELISA, и его применяли в наивысшей концентрации (370 нМ). Следует отметить, что 2,5 нМ MAb 583 значимо нейтрализовали (~23% понижение) 37 нМ гепсидина-25 и его биологическую активность, что приводило к распаду FPN-GFP в молярном соотношении in vitro 1/12.
Фигура 23. Изменение процента (%) FPN-GFP флуоресценции у клеток HEK, обработанных при помощи MAb 583 в концентрациях 0,62-10 нМ в присутствии 37 нМ гепсидина-25, как показано на фигуре 22.
Фигура 24. Ферритиновый анализ Fpn-GFP клеток, обработанных при помощи MAb 583. HEK клетки индуцировали на протяжении ночи при помощи понастерона для индуцирования экспрессии мышиного Fpn-GFP и транспорта железа в среду. На следующий день понастерон удаляли посредством промывания и добавляли гепсидин-25 и антитела MAb 583 на 24 часа. Гепсидин-25 применяли в концентрации 100 нг/мл (37 нМ). MAb 583 добавляли в 10-кратной, 2-кратной или 1/3 концентрации гепсидина (370 нМ, 74 нМ и 10 нМ). Контрольное MAb представляло собой "неудачное" моноклональное антитело к гепсидину при скрининге in vitro посредством ELISA, и его применяли в наивысшей концентрации (370 нМ). Следует отметить, что 10 нМ MAb 583 значимо нейтрализовали 37 нМ гепсидин-25 и его биологическую активность, что приводило к распаду FPN-GFP и удерживанию внутриклеточного связанного с ферритином железа. Белки экстрагировали при помощи буфера RIPA и концентрации внутриклеточного ферритина определяли при помощи ELISA ферритина (Ramco).
Фигура 25. Ферритиновый анализ Fpn-GFP клеток, обработанных при помощи MAb 583. HEK клетки индуцировали на протяжении ночи при помощи понастерона для индуцирования экспрессии мышиного Fpn-GFP и транспорта железа в среду. На следующий день понастерон удаляли посредством промывания и добавляли гепсидин-25 и антитела MAb 583 на 24 часа. В таком клеточном анализе биологической активности MAb 583 гепсидин-25 применяли в концентрации 100 нг/мл (37 нМ), а антитело MAb 583 в 1/3, 1/6, 1/12 и 1/24 молярной концентрации гепсидина-25. Контрольное MAb (имитационное MAb) представляло собой "неудачное" моноклональное антитело к гепсидину при скрининге in vitro посредством ELISA, и его применяли в наивысшей концентрации (370 нМ). Следует отметить, что 2,5-5 нМ MAb 583 значимо нейтрализовали 37 нМ гепсидин-25 и его биологическую активность, что приводило к распаду FPN-GFP и удерживанию внутриклеточного связанного с ферритином железа. Белки экстрагировали при помощи буфера RIPA и концентрации внутриклеточного ферритина определяли при помощи ELISA ферритина (Ramco).
Фигура 26. Изменение процента (%) концентрации внутриклеточного ферритина у клеток HEK, обработанных при помощи MAb 583 в концентрациях 0,62-10 нМ в присутствии 37 нМ гепсидина-25, как показано на фигуре 25.
Фигура 27. Влияние инъекции MAb 583 и человеческого гепсидина-25 in vivo на концентрацию железа в сыворотке крови у самцов мышей С57В1/6. Пяти группам мышей (n=8/группа) вводили инъекцией внутрибрюшинно либо PBS (группа 1, H-PBS и группа 5, PBS), 1 мг MAb 583 (группа 2, Н-Mab), 0,5 мг MAb 583 (группа 3, Н-2Mab), либо 0,5 мг контрольного Mab (группа 4, Η-имитационное Mab). На следующий день все мыши в группе 3 получали дополнительные 0,5 мг MAb 583 и спустя 24 часа группы 1-4 получали отдельную инъекцию 50 мкг человеческого гепсидина-25, а группа 5 получала PBS. Всех мышей умерщвляли через 2 часа и измеряли уровень железа в сыворотке крови. В ходе статистического анализа (для подробностей см. фигуру 28) было показано значимое различие между PBS и PBS плюс гепсидин-25 (H-PBS, Р=0,001) и между PBS плюс гепсидин-25 (H-PBS) и мышами, которые получали две дозы 0,5 мг MAb 583 и гепсидина-25 (Н-2Mab, Р=0,004).
Фигура 28. Описательная статистика (среднее, стандартное отклонение, SEM) и результаты однофакторного дисперсионного анализа концентраций железа в сыворотке крови пяти групп самцов мышей C57BL/6 из in vivo исследования MAb 583, показанного на фигуре 27. Множественные сравнения относительно контрольной группы (способ Холма-Сидака) с общим уровнем значимости Р=0,05 давало зависимые от сравнения нескорректированные Р-значения, варьирующие от 0,001 до 0,253.
Фигура 29. Сравнение химеры MAb 583 с мышиным MAb 583 в отношении связывания с покрытым гепсидином-25 планшетом для ELISA. 100 нг гепсидина-25 ковалентно связывали с лунками активированного малеиновым ангидридом 96-луночного микропланшета. Возрастающие количества химеры MAb 583 (ВАР070-01; 3650 нг/мл; незаштрихованные квадраты) и мышиного MAb 583 (положительный контроль MAb; незаштрихованные треугольники) добавляли в микролуночный планшет и позволяли связываться на протяжении одного часа. Связывание химеры MAb 583 детектировали посредством антитела кролика с HRP к человеческому IgG1 (H+L). Связанное мышиное антитело MAb 583 детектировали при помощи конъюгированного с HRP антитела к мышиному IgG1 (H+L). Реакции останавливали при помощи 1 H HCl через 5 минут после добавления ТМВ в лунки и немедленно считывали. Связывание количественно оценивали в виде OD на спектрофотометре на 450 нм после добавления стоп-реагента. Ось X: концентрация антитела в нг/мл; и ось Y: значения OD 450 нм.
Фигура 30. Связывание химеры MAb 583 с покрытым гепсидином-25 планшетом для ELISA. 100 нг гепсидина-25 ковалентно связывали с лунками активированного малеиновым ангидридом 96-луночного микропланшета. Возрастающие количества химеры MAb 583 (ВАР070-01; 3650 нг/мл; заштрихованные круги) и супернатант из клеток, трансфицированных пустым вектором (ВАР070; заштрихованные квадраты), добавляли в микролуночный планшет и позволяли связываться на протяжении 2 часов. Связывание химеры MAb 583 детектировали с помощью антитела кролика с HRP к человеческому IgG1 (H+L) с ТМВ в качестве субстрата. Связывание количественно оценивали на спектрофотометре на 450 нм после добавления стоп-реагента.
Фигура 31. Стандартная кривая для гепсидина-25, полученная при помощи химеры MAb 583 ВАР070-01. Лунки на микролуночном планшете покрывали при помощи 150 нг/мл белка G и блокировали. Химеру Mab 583 (ВАР070-01) добавляли в лунки в количестве 150 нг/лунка и позволяли связываться на протяжении одного часа. Известные концентрации синтетического гепсидина-25 добавляли в аналитическим буфер, содержащий NT-биотин-гепсидин-25 (1 нг/лунка), перемешивали и добавляли в 8 дублирующих лунок и позволяли протекать конкурентной реакции на протяжении двух часов. Промывали лунки и SA-HRP с субстратом ТМВ применяли для детектирования связывания меченного вещества, представлявшего собой NT-биотин-гепсидин-25. Связывание количественно оценивали на спектрофотометре на 450 нм после добавления стоп-реагента. Стандартную кривую строили при помощи программного обеспечения Graphpad Prism (Сан-Диего, Калифорния) с применением 4-параметрической логистической регрессии.
Фигура 32. Связывание химеры MAb 583 с NT-биотин-гепсидином-25 на покрытом нейтравидином микролуночном планшете. Лунки на микролуночном планшете покрывали при помощи 150 нг/мл нейтравидина и блокировали. Меченное вещество, представлявшее собой NT-биотин-гепсидин-25, добавляли в лунки в количестве 1 нг/лунка и позволяли связываться на протяжении одного часа. Химеру Mab 583 (ВАР070-01) добавляли в лунки в количестве 150 нг/лунка вместе с синтетическим гепсидином-25 в известных концентрациях и позволяли протекать конкурентной реакции за связывание с NT-биотин-гепсидином-25 на протяжении одного часа. Связывание химеры MAb 583 детектировали с помощью антитела кролика с HRP к человеческому IgG1 (H+L) с ТМВ в качестве субстрата. Связывание количественно оценивали с помощью спектроскопии на 450 нм после добавления стоп-реагента. Точки представляют собой две повторности (заштрихованные ромбы и квадраты) и среднее (заштрихованные треугольники).
Подробное описание изобретения
В соответствии с настоящей заявкой можно использовать традиционные методики молекулярной биологии, микробиологии и рекомбинантных ДНК, которые известны из уровня техники. Такие методики полностью описаны в литературе. См., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual" (1989); "Current Protocols in Molecular Biology" Volumes I-III [Ausubel, R. M., ed. (1994)]; "Cell Biology: A Laboratory Handbook" Volumes I-III [J. E. Celis, ed. (1994)]; "Current Protocols in Immunology" Volumes I-III [Coligan, J. E., ed. (1994)]; "Oligonucleotide Synthesis" (M.J. Gait ed. 1984); "Nucleic Acid Hybridization" [B.D. Hames & S.J. Higgins eds. (1985)]; "Transcription And Translation" [B.D. Hames & S.J. Higgins, eds. (1984)]; "Animal Cell Culture" [R.I. Freshney, ed. (1986)]; "Immobilized Cells And Enzymes" [IRL Press, (1986)]; B. Perbal, "A Practical Guide To Molecular Cloning" (1984), каждая из которых специально включена в настоящий документ при помощи ссылки в полном ее объеме.
Терминология антител
Применяемый в настоящем документе термин "антитело" относится к иммуноглобулину (Ig), либо природному, либо частично или полностью полученному синтетически. Термин также охватывает любой полипептид или белок, имеющий домен связывания, который является антиген-связывающим доменом или гомологичен ему. Термин дополнительно включает "антиген-связывающие фрагменты" и другие взаимозаменяемые термины для схожих связывающих фрагментов, таких как описанные ниже. Также этим термином предусмотрены антитела с привитыми определяющим комплементарность участком (CDR) и другие гуманизированные антитела (включающие модификации CDR и модификации каркасных участков).
Нативные антитела и нативные иммуноглобулины обычно являются гетеротетрамерными гликопротеинами, с массой приблизительно 150000 дальтон, содержащие в своем составе две идентичные легкие (L) цепи и две идентичные тяжелые (Н) цепи. Каждая легкая цепь обычно связывается с тяжелой цепью посредством одной ковалентной дисульфидной связи, при этом количестве дисульфидных соединений варьирует среди тяжелых цепей различных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также имеет расположенные с равными интервалами внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен ("VH"), за которым следует ряд константных доменов ("СН"). Каждая легкая цепь имеет вариабельный домен на одном конце ("VL") и константный домен ("CL") на другом ее конце; константный домен легкой цепи находится в соответствии с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи находится в соответствии с вариабельным доменом тяжелой цепи. Полагают, что отдельные аминокислотные остатки формируют участок взаимосвязи между вариабельными доменами легкой и тяжелой цепи.
Применяемые в настоящем документе термины "синтетический полинуклеотид", "синтетический ген" или "синтетический полипептид" означают, что соответствующая полинуклеотидная последовательность или ее часть, или аминокислотная последовательность или ее часть, является производной от последовательности, которая была сконструирована или синтезирована de novo или модифицирована по сравнению с эквивалентной встречающейся в природе последовательностью. Синтетические полинуклеотиды (антитела или антиген-связывающие фрагменты) или синтетические гены можно получить согласно способам, известных из уровня техники, включая без ограничения химический синтез последовательностей нуклеиновой кислоты или аминокислотных последовательностей. Синтетические гены обычно отличаются от встречающихся в природе генов, либо на аминокислотном, либо на полинуклеотидном уровне (или на обоих) и обычно расположены в окружении синтетических управляющих экспрессией последовательностей. Например, синтетические генные последовательности могут включать аминокислотные или полинуклеотидные последовательности, которые были изменены, например, посредством замены, делеции или добавления одной или нескольких аминокислот или нуклеотидов с получением, таким образом, аминокислотной последовательности антитела или полинуклеотидной кодирующей последовательности, которая отличается от исходной последовательности. Полинуклеотидные синтетические генные последовательности необязательно могут кодировать белки с отличными по сравнению с природным геном аминокислотами; например, они также могут охватывать синтетические полинуклеотидные последовательности, которые включают различные кодоны, но которые кодируют одинаковую аминокислоту (т.е. нуклеотидные изменения представляют собой молчащие мутации на аминокислотном уровне).
Что касается антител, термин "вариабельный домен" относится к вариабельным доменам антител, которые применяют при связывании и специфичности каждого конкретного антитела к его конкретному антигену. Однако, вариабельность не равномерно распределена по вариабельным доменам антител. Точнее, она сконцентрирована в трех сегментах, называемых гипервариабельными участками (также, известных как CDR) в вариабельных доменах как легкой цепи, так и в тяжелой цепи. Более высококонсервативные части вариабельных доменов называют "каркасными участками" или "FR". Каждый из вариабельных доменов немодифицированных тяжелой и легкой цепей содержит четыре FR (FR1, FR2, FR3 и FR4), как правило принимающих β-складчатую конфигурацию, чередующуюся с тремя CDR, которые формируют петли, соединяющие β-складчатую структуру, и в некоторых случаях формирующие ее часть. CDR в каждой цепи удерживаются друг с другом в непосредственной близости посредством FR и вместе с CDR из другой цепи вносят свой вклад в формирование антиген-связывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), pages 647-669).
Применяемые в настоящем документе термины "гипервариабельный участок" и "CDR" относятся к аминокислотным остаткам антитела, которые ответственны за связывание с антигеном. CDR содержат аминокислотные остатки из трех участков последовательности, которые связываются по принципу комплементарности с антигеном и известны как CDR1, CDR2 и CDR3 для каждой из цепей VH и VL. В вариабельном домене легкой цепи CDR обычно соответствуют примерно остаткам 24-34 (CDRL1), 50-56 (CDRL2) и 89-97 (CDRL3), a CDR в вариабельном домене тяжелой цепи обычно соответствуют примерно остаткам 31-35 (CDRH1), 50-65 (CDRH2) и 95-102 (CDRH3), в соответствии с Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991). Понятно, что CDR различных антител могут содержать вставки, поэтому нумерация аминокислот может отличаться. Система нумерации Кэбота предусматривает такие вставки со схемой нумерации, которая использует буквы, закрепляемые за конкретными остатками (например, 27А, 27В, 27С, 27D, 27Е и 27F CDRL1 в легкой цепи) для отображения любых вставок в нумерациях среди различных антител. В качестве альтернативы, в вариабельном домене легкой цепи CDR обычно соответствуют примерно остаткам 26-32 (CDRL1), 50-52 (CDRL2) и 91-96 (CDRL3), a CDR в вариабельном домене тяжелой цепи обычно соответствуют примерно остаткам 26-32 (CDRH1), 53-55 (CDRH2) и 96-101 (CDRH3), в соответствии с Chothia and Lesk, J. Mol. Biol., 196: 901-917 (1987).
Применяемый в настоящем документе "каркасный участок" или "FR" относится к аминокислотным остаткам каркасного участка, которые формируют часть антиген-связывающего кармана или бороздки. В соответствии с некоторыми вариантами осуществления остатки каркасного участка формируют петлю, которая является частью антиген-связывающего кармана или бороздки, и остатки аминокислот в петле могут либо контактировать, либо не контактировать с антигеном. Каркасные участки обычно содержат участки между CDR. В вариабельном домене легкой цепи FR обычно соответствуют примерно остаткам 0-23 (FRL1), 35-49 (FRL2) и 57-88 (FRL3) и 98-109, а FR в вариабельном домене тяжелой цепи обычно соответствуют примерно остаткам 0-30 (FRH1), 36-49 (FRH2) и 66-94 (FRH3) и 103-133, в соответствии с Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991). Как обсуждалось ранее в случае нумерации по Кэботу для легкой цепи, тяжелая цепь также предусматривает вставки аналогичным образом (например, 35А, 35В CDRH1 в тяжелой цепи). В качестве альтернативы, в вариабельном домене легкой цепи FR обычно соответствуют примерно остаткам 0-25 (FRL1), 33-49 (FRL2) 53-90 (FRL3) и 97-109 (FRL4), а в вариабельном домене тяжелой цепи FR обычно соответствуют примерно остаткам 0-25 (FRH1), 33-52 (FRH2), 56-95 (FRH3) и 102-113 (FRH4), в соответствии с Chothia and Lesk, J. Mol. Biol., 196: 901-917 (1987).
Формирующие петлю аминокислоты FR можно оценить и определить посредством проверки третичной структуры тяжелой цепи антитела и/или легкой цепи антитела. Третичную структуру можно проанализировать на доступные в растворителе аминокислотные положения, поскольку такие положения способны формировать петлю и/или обеспечивать контакт вариабельного домена антитела с антигеном. Некоторые из доступных в растворителе положения могут допускать разнообразие аминокислотных последовательностей, а другие (например, структурные положения) обычно являются менее разнообразными. Третичная структура вариабельного домена антитела может быть получена из кристаллической структуры или в результате моделирования белка.
Константные домены (Fc) антител не вовлекаются напрямую в связывание антитела с антигеном, а скорее проявляют различные эффекторные функции, такие как участие антитела в антителозависимой цитотоксичности посредством взаимодействия, например, с Fc рецепторами (FcR). Fc домены также могут повышать биодоступность антитела в системном кровотоке после введения субъекту.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, иммуноглобулины могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и несколько из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи (Fc), которые соответствуют различным классам иммуноглобулина, называют α, δ, ε, γ и μ, соответственно. Хорошо известны структуры субъединиц и третичные конфигурации различных классов иммуноглобулинов.
"Легкие цепи" антител (иммуноглобулинов) от любого вида позвоночных могут быть отнесена к одному из двух явно различающихся типов, называемых каппа или ("κ") и лямбда или ("λ"), на основании аминокислотных последовательностей их константных доменов.
Термины "антиген-связывающая часть антитела", "антиген-связывающий фрагмент", "антиген-связывающий домен", "фрагмент антитела" или "функциональный фрагмент антитела" в настоящем документе применяют взаимозаменяемо для обозначения одного или нескольких фрагментов антитела, которые сохраняют способность специфично связываться с антигеном. Неограничивающие примеры фрагментов антител, включенные в рамки таких терминов, включают без ограничения (i) Fab фрагмент, моновалентный фрагмент, состоящий из VL, VH, CL и CH1 доменов; (ii) F(ab')2 фрагмент, бивалентный фрагмент, содержащий два Fab фрагмента, соединенных посредством дисульфидного мостика в шарнирном участке; (iii) Fd фрагмент, состоящий из VH и CH1 доменов; (iv) Fv фрагмент, содержащий VL и VH домены отдельного плеча антитела, (v) dAb фрагмент (Ward et al., (1989) Nature 341:544 546), который содержит VH домен; и (vi) выделенный CDR. В настоящее определение дополнительно включены "половинные" антитела, содержащие одну тяжелую цепь и одну легкую цепь. В настоящем документе также охвачены другие формы одноцепочечных антител, таких как диатела.
"F(ab')2" и "Fab'" фрагменты можно получить посредством обработки Ig протеазой, такой как пепсин и папаин, и они включают фрагменты антител, полученные посредством расщепления иммуноглобулина возле дисульфидных связей, расположенных между шарнирными участками в каждой из двух тяжелых цепей. Например, папаин расщепляет IgG перед дисульфидными связями, расположенными между шарнирными участками в каждой из двух тяжелых цепей, с образованием двух гомологичных фрагментов антител, в которых легкая цепь, состоящая из VL и CL (константного участка легкой цепи), и фрагмент тяжелой цепи, состоящей из VH и СНγ1 (γ1) (участка в константном участке тяжелой цепи) соединены на их С-концевых участках посредством дисульфидной связи. Каждый из таких двух гомологичных фрагментов антител называют Fab'. Пепсин также расщепляет IgG после дисульфидных связей, расположенными между шарнирными участками в каждой из двух тяжелых цепей, с образованием фрагмента антитела, который слегка больше фрагмента, в котором два вышеупомянутых Fab' соединены в шарнирном участке. Такой фрагмент антитела называется F(ab')2.
Fab фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов добавлением нескольких остатков на карбоксильном конце СН1 домена тяжелой цепи, включая один цистеин или несколько цистеинов из шарнирного участка антитела. В настоящем документе Fab'-SH является обозначением Fab', в котором цистеиновый остаток(остатки) константных доменов несет свободную тиоловую группу. F(ab')2 фрагменты антител первоначально были получены в виде пар Fab' фрагментов, которые имеют шарнирные цистеины между ними. Также известны другие химические соединения фрагментов антител.
"Fv" относится к фрагменту антитела, который содержит полный участок распознания антигена и связывания антигена. Этот участок состоит из димера вариабельного вариабельного домена одной тяжелой цепи и одной легкой цепи в тесной, нековалентной или ковалетной ассоциации (Fv, соединенный дисульфидным мостиком, описан в уровне техники, Reiter et al. (1996) Nature Biotechnology 14:1239-1245). Он находится в такой конфигурации, что три CDR каждого вариабельного домена взаимодействуют с образованием антиген-связывающего сайта на поверхности димера VH-VL. В совокупности комбинация одного или нескольких CDR из каждой из VH и VL цепей придает антителу антиген-связывающую специфичность. Например, понятно, что, например, CDRH3 и CDRL3 могут быть достаточными для придания антиген-связывающей специфичности антителу при перенесении на VH и VL цепи антитела-реципиента или его антиген-связывающий фрагмент, и эту комбинацию CDR можно испытать на связывание, аффинность и т.д. при помощи любой из описываемых в настоящем документе методик. Даже отдельный вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя вероятно с более низкой аффинностью, чем при объединении со вторым вариабельным доменом. Кроме того, несмотря на то, что два домена Fv фрагмента (VL and VH) кодируются отдельными генами, они могут быть соединены при помощи рекомбинантных способов с помощью синтетического линкера, который позволяет получать их в виде одной белковой цепи, в которой VL и VH участки образуют пару с формированием моновалентных молекул (известных как одноцепочечный Fv (scFv); Bird et al (1988) Science 242:423-426; Huston et al (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; и Osbourn et al (1998) Nat. Biotechnol. 16:778). Подразумевают, что такие scFv охвачены в рамках термина "антиген-связывающая часть" антитела. Любые VH и VL последовательности конкретного scFv могут быть связаны с кДНК или геномными последовательностями Fc участка с образованием векторов экспрессии, кодирующих молекулы полного Ig (например, IgG) или другие изотипы. VH и VL также можно применять для получения Fab, Fv или других фрагментов Ig при помощи либо белковой химии, либо методики рекомбинантной ДНК.
"Одноцепочечные Fv" или "sFv" фрагменты антител содержат VH и VL домены антитела, причем эти домены присутствуют в одной полипептидной цепи. В соответствии с некоторыми вариантами осуществления Fv полипептид дополнительно содержит полипептидный линкер между VH и VL доменами, который позволяет sFv формировать требуемую структуру для связывания антигена. Для обзора sFv см., например, Pluckthun in The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994).
Термин "AVIMER™" относится к классу терапевтических белков человеческой природы, которые не относятся к антителам и фрагментам антител и состоят из нескольких модульных и повторно используемых доменов связывания, называемых А-доменами (также называемых модулем класса А, повтор комплементарного типа или домен класса А рецептора LDL). Их разрабатывали на основе человеческих внеклеточных рецепторных доменов путем in vitro шаффлинга экзонов и фагового дисплея (Silverman et al., 2005, Nat. Biotechnol. 23:1493-1494; Silverman et al., 2006, Nat. Biotechnol. 24:220). Полученные в результате белки могут содержать множество независимых доменов связывания, которые могут характеризоваться улучшенной аффинностью (в некоторых случаях, субмономолярной) и специфичностью по сравнению с одноэпитопными белками связывания. См., например, публикации заявок на выдачу патента США №№2005/0221384, 2005/0164301, 2005/0053973 и 2005/0089932, 2005/0048512 и 2004/0175756, каждая из которых, таким образом, включена в настоящий документ при помощи ссылки в полном ее объеме.
Каждый из известных 217 человеческих А-доменов содержит ~35 аминокислот (~4 кДа); и такие домены разделены линкерами, которые достигают пять аминокислот в длину. Нативные А-домены быстро и эффективно сворачиваются в однородную стабильную структуру, что главным образом опосредуется связыванием кальция и образованием дисульфидного мостика. Для такой общей структуры необходим консервативный мотив остова всего лишь из 12 аминокислот. Конечным результатом является отдельная белковая цепь, содержащая множественные домены, каждый из которых представляет собой отдельную функциональную единицу. Каждый домен белков связывается независимо, а энергетические вклады каждого домена являются аддитивными. Такие белки назвали "AVIMER™" от авидных мультимеров.
Термин "диатела" относится к малым фрагментам антитела с двумя антиген-связывающими сайтами, фрагменты которых содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной полипептидной цепи (VH-VL). С помощью линкера, который также является очень коротким для обеспечения возможности образования пары между двумя доменами на одной цепи, домены заставляют образовывать пару с комплементарными доменами другой цепи и создают два антиген-связывающих сайта. Диатела более полно описаны, например, в ЕР 404097; WO 93/11161; и в работе Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444 6448 (1993).
Антиген-связывающие полипептиды также включают димеры тяжелой цепи, такие как, например, антитела от верблюдов и акул. Верблюжьи и акульи антитела содержат гомодимерную пару из двух цепей V-подобных и С-подобных доменов (ни один из них не имеет легкую цепь). Так как VH участок димера тяжелой цепи IgG у верблюдов не должен создавать гидрофобные взаимодействия с легкой цепью, то участок в тяжелой цепи, который в норме контактирует с легкой цепью, изменяют у верблюда на гидрофильные аминокислотные остатки. VH домены у IgG с димером тяжелой цепи называют VHH доменами. Акульи Ig-NAR содержат гомодимер из одного вариабельного домена (называемого доменом V-NAR) и пять С-подобных константных доменов (домены С-NAR). У верблюдов многообразие репертуара антител определяют по CDR 1, 2 и 3 в VH или VHH участках. CDR3 в верблюжьем VHH участке характеризуется своей относительно большой длиной, составляющей 16 аминокислот (Muyldermans et al., 1994, Protein Engineering 7(9): 1129). Он отличается от CDR3 участков антител многих других видов. Например, CDR3 мышиного VH имеет среднюю длину 9 аминокислот. Библиотеки вариабельных участков верблюжьих антител, которые сохраняют in vivo разнообразие вариабельных участков верблюда, можно получить посредством, например, способов, раскрытых в заявке на выдачу патента США №20050037421.
"Гуманизированные" формы нечеловеческих (например, мышиных) антител включают химерные антитела, которые содержат минимальную последовательность, полученную от Ig, не относящегося к человеческому. В большинстве случаев гуманизированные антитела являются человеческими IgG (антитело-реципиент), в которых один или несколько из CDR реципиента заменяют на CDR из антитела от вида, не относящегося к человеку (донорное антитело), такого как мышь, крыса, кролик или примат за исключением человека, обладающих требуемой специфичностью, аффинностью и функцией связывания. В некоторых случаях, один или несколько FR аминокислотных остатков человеческого Ig заменяют на соответствующие аминокислотные остатки, отличные от человеческих. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в антителе-реципиенте или в донорном антителе. Такие модификации могут быть осуществлены для того, чтобы, при необходимости, скорректировать характеристики антитела. Гуманизированное антитело может содержать практически все из по меньшей мере одного и в некоторых случаях двух вариабельных доменов, в которых все или практически все из гипервариабельных участков соответствуют участкам из отличного от человеческого иммуноглобулина и все или практически все из FR являются последовательностями человеческого иммуноглобулина. Гуманизированное антитело необязательно также может включать по меньшей мере часть иммуноглобулинового константного участка (Fc), обычно участка из человеческого иммуноглобулина. Для получения более подробной информации см. работу Jones et al., Nature 321: 522-525 (1986); Reichmann et al., Nature 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992).
Гуманизированное антитело также включает антитела, у которых часть или все CDR тяжелой и легкой цепи получены из отличного от человеческого моноклонального антитела, практически все оставшиеся части вариабельных участков получены из человеческого вариабельного участка (как тяжелой, так и легкой цепи), а константные участки получены из человеческого константного участка. В соответствии с одним вариантом осуществления CDR1, CDR2 и CDR3 участки тяжелой и легкой цепей получены из отличного от человеческого антитела. В соответствии с еще одним вариантом осуществления по меньшей мере один CDR (например, CDR3) тяжелой и легкой цепей получен из отличного от человеческого антитела. Из отличного от человеческого антитела можно получить различные комбинации из CDR1, CDR2 и CDR3, и они предусмотрены настоящим документом. В соответствии с неограничивающим примером один или несколько из CDR1, CDR2 и CDR3 участков каждой из тяжелой и легкой цепей получены из приведенных в настоящем документе последовательностей.
Применяемый в настоящем документе термин "моноклональное антитело" относится к антителу, получаемому из группы практически однородных антител, т.е. отдельные антитела, составляющие группу, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, при этом они направлены на один сайт антигена. Кроме того, в отличие от традиционных (поликлональных) препаратов антител, которые могут включать различные антитела, направленные на различные детерминанты (эпитопы), каждое моноклональное антитело направлено на одну детерминанту на антигене. Модификатор "моноклональный" указывает на характер антитела как полученное из практически однородной группы антител, и его не следует рассматривать как предусматривающий получение антитела посредством какого-либо конкретного способа. Например, моноклональные антитела можно получать посредством способа гибридом, впервые описанного в работе Kohler et al., Nature 256:495 (1975), или можно получать с помощью способов рекомбинантной ДНК (см., например, патент США №4816567). В соответствии с конкретными вариантами осуществления моноклональные антитела можно выделить из фаговых библиотек антител при помощи методик, описанных, например, в работах Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol Biol. 222:581-597 (1991).
Антитела можно выделить и очистить из культурального супернатанта или асцитов, упомянутых выше, посредством фракционирования в насыщенном сульфатом аммония растворе, способа эуглобулинового высаливания, способа с применением капроновой кислоты, способа с применением каприловой кислоты, ионообменной хроматографии (DEAE или DE52) или аффинной хроматографии с применением колонки к Ig или колонки на основе белка A, G или L, такой как описанной более подробно ниже.
Иллюстративные антитела для применения в описываемых в настоящем документе композициях и способах являются интактными молекулами иммуноглобулина, такими как, например, гуманизированное антитело или части гуманизированной молекулы Ig, которые содержат сайт связывания антигена (т.е. паратоп) или отдельную тяжелую цепь и отдельную легкую цепь, включающую части, известные в настоящей области техники как Fab, Fab', F(ab)', F(ab')2, Fd, scFv, вариабельный тяжелый домен, вариабельный легкий домен, вариабельный домен NAR, биспецифичный scFv, биспецифичный Fab2, триспецифичный Fab3 и одноцепочечные связывающие полипептиды и другие, также называемые антиген-связывающими фрагментами. При построении иммуноглобулиновой молекулы или ее фрагментов вариабельные участки или их части можно сливать, соединять или иначе присоединять к одному или нескольким константным участкам или их частями с получением любого из описываемых в настоящем документе антител или их фрагментов. Это можно осуществлять различными способами, известными в настоящей области техники, включая без ограничения методики молекулярного клонирования или прямой синтез нуклеиновых кислот, кодирующих такие молекулы. Иллюстративные неограничивающие способы построения таких молекул также можно найти в описываемых в настоящем документе примерах.
Способы получения биспецифичных или других мультиспецифичных антител известны из уровня техники и включают химическое сшивание, применение лейциновой застежки (Kostelny et al., J. Immunol. 148:1547-1553, 1992); методику диател (Hollinger et al., Proc. Natl Acad. Sci USA 90:6444-48, 1993); димеры scFv [Gruber et al., J. Immunol. 152: 5368, 1994], линейные антитела (Zapata et al., Protein Eng. 8:1057-62, 1995); и хелатирующие рекомбинантные антитела (Neri et al., J Mol Biol. 246:367-73, 1995).
"Линейные антитела" содержат пару тандемных Fd сегментов (VH-CH1-VH-CH1), которые формируют пару антиген-связывающих участков. Линейные антитела могут быть биспецифичными или моноспецифичными (Zapata et al. Protein Eng. 8:1057-62 (1995)).
Дополнительно, раскрываемые в настоящем документе антитела к гепсидину также можно сконструировать для сворачивания в мультивалентные формы, что может улучшить аффинность связывания, специфичность и/или повысить период полужизни в крови. Мультивалентные формы антител к гепсидину можно получать посредством методик, известных из уровня техники.
Биспецифичные или мультиспецифичные антитела включают сшитые или "гетероконъюгатные" антитела. Например, одно из антитела в гетероконъюгате может быть соединено с авидином, а другое - с биотином. Гетероконъюгатные антитела можно получать при помощи любых традиционных способов сшивания. Подходящие сшивающие средства хорошо известны из уровня техники и раскрыты в патенте США №4676980, наряду с рядом методик сшивания. Другой способ предназначен для получения тетрамеров посредством добавления стрептавидин-кодирующей последовательности на С-конце scFv. Стрептавидин состоит из четырех субъединиц, поэтому при сворачивании scFv-стрептавидина четыре субъединицы ассоциируются с формированием тетрамера (Kipriyanov et al., Hum Antibodies Hybridomas 6(3): 93-101 (1995), раскрытие которого включено в настоящий документ при помощи ссылки в полном его объеме).
В соответствии с другим подходом для получения биспецифичных антител можно сконструировать участок взаимосвязи между парой молекул антитела для максимизации процента гетеродимеров, которые выделяются из культуры рекомбинантных клеток. Один участок взаимосвязь содержит по меньшей мере часть домена СН3 константного домена антитела. В соответствии с этим способом одна или несколько малых аминокислотных боковых цепей из участка взаимосвязи первой молекулы антитела заменяют на более длинные боковые цепи (например, тирозин или триптофан). Компенсаторные "полости" идентичного или сходного размера с большой боковой цепью (цепями) создают на участке взаимосвязи второй молекулы антитела посредством замены больших аминокислотных боковых цепей на более короткие (например, аланин или треонин). Это обеспечивает механизм для повышения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры. См. WO 96/27011, опубликованную 6 сентября 1996 года.
Методики получения биспецифичных или мультиспецифичных антител из фрагментов антител общеизвестны из уровня техники. Например, биспецифичные или триспецифичные антитела можно получать путем образования химической связи. В работе Brennan et al., Science 229:81 (1985) описана процедура, согласно которой интактные антитела протеолитически расщепляют с получением F(ab')2 фрагментов. Такие фрагменты восстанавливаются в присутствии образующего дитиоловый комплекс средства арсенита натрия для стабилизации соседних дитиолов и предотвращения образования межмолекулярный дисульфидных связей. Полученные Fab' фрагменты затем преобразуют до тионитробензоатных производных (TNB). Одно из производных Fab'-TNB затем преобразуют в Fab'-тиол посредством восстановления при помощи меркаптоэтиламина и смешивают с эквимолярным количеством другого производного Fab'-TNB с получением биспецифичного антитела. Полученные биспецифичные антитела можно применять в качестве средств для селективной иммобилизации ферментов. В работе Better et al., Science 240: 1041-1043 (1988) раскрыта секреция функциональных фрагментов антител из бактерий (см., например, работу Better et al., Skerra et al. Science 240: 1038-1041 (1988)). Например, Fab'-SH фрагменты можно напрямую выделять из Е. coli и химически связывать с получением биспецифичных антител (Carter et al., Bio/Technology 10:163-167 (1992); Shalaby et al., J. Exp. Med. 175:217-225 (1992)).
Различные методики получения и выделения биспецифичных или мультиспецифичных фрагментов антител непосредственно из рекомбинантной культуры клеток являются общеизвестными из уровня техники. Например, биспецифичные антитела были получены при помощи лейциновой застежки, например, GCN4. (В целом, см. работу Kostelny et al., J. Immunol. 148(5):1547-1553 (1992).) Пептиды с лейциновой застежкой из белков Fos и Jun связывали с Fab' частями двух различных антитела посредством генного слияния. Гомодимеры антитела уменьшали в шарнирном участке для формирования мономеров и затем повторно окисляли для формирования гетеродимеров антител. Этот способ также можно использовать для получения гомодимеров антитела.
Применяемое в настоящем документе "минитело" относится к scFv, слитому с СН3 с помощью пептидного линкера (бесшарнирного) или с помощью шарнира IgG, как было описано в работе Olafsen, et al., Protein Eng Des Sel. April 2004; 17(4):315-23.
Применяемое в настоящем документе "макситело" относится к бивалентному scFv, ковалентно прикрепленному к Fc участку иммуноглобулина, см., например, работу Fredericks et al., Protein Engineering, Design & Selection, 17:95-106 (2004) и работу Powers et al., Journal of Immunological Methods, 251:123-135 (2001).
Применяемое в настоящем документе "интратело" относится к одноцепочечному антителу, которое демонстрирует внутриклеточную экспрессию и может манипулировать внутриклеточной функцией белка (Biocca, et al., EMBO J. 9:101-108, 1990; Colby et al., Proc Natl Acad Sci USA. 101:17616-21, 2004). Интратела, которые содержат клеточные сигнальные последовательности, которые удерживают конструкцию антитела во внутриклеточных участках, можно получить как описано в работе Mhashilkar et al., (EMBO J 14:1542-51, 1995) и в работе Wheeler et al. (FASEB J. 17:1733-5. 2003). Транстела являются проникающими в клетку антителами, у которых белковые домены трансдукции (PTD) слиты с антителами с одноцепочечным вариабельным фрагментом (scFv), Heng et al., (Med Hypotheses. 64:1105-8, 2005).
Дополнительно настоящим документом предусмотрены антитела, которые представляют собой SMIP или белки слияния с иммуноглобулином с доменом связывания, специфичные к белку-мишени. Такие конструкции являются одноцепочечными полипептидами, содержащими домены связывания антигена, слитые с иммуноглобулиновыми доменами, необходимыми для реализации эффекторных функций антитела. См., например, WO 03/041600, патентную публикацию США 20030133939 и патентную публикацию США 20030118592, которые включены, таким образом, при помощи ссылки.
Гуманизацию антител и их антиген-связывающих фрагментов можно выполнять с помощью множества способов, известных в настоящей области техники и описываемых в настоящем документе. Аналогичным образом, получение гуманизированных антител также можно выполнить с помощью способов, известных в настоящей области техники и описываемых в настоящем документе.
В соответствии с иллюстративным вариантом осуществления заявка предусматривает одноцепочечный связывающий полипептид, имеющий вариабельный участок тяжелой цепи и/или вариабельный участок легкой цепи, который связывает описываемый в настоящем документе эпитоп и необязательно имеет иммуноглобулиновый Fc участок. Такая молекула представляет собой одноцепочечный вариабельный фрагмент (scFv), необязательно обладающий эффекторной функцией или повышенным периодом полужизни за счет наличия иммуноглобулинового Fc участка. Способы получения одноцепочечных связывающих полипептидов известны из уровня техники (например, заявка на выдачу патента США №2005/0238646).
Термины "генные сегменты зародышевой линии" или "последовательности зародышевой линии" относятся к генам из зародышевой линии (гаплоидных гамет и тех диплоидных клеток, из которых они формируются). ДНК зародышевой линии содержит множественные генные сегменты, которые кодируют тяжелую или легкую цепь отдельного Ig. Носителями таких генных сегментов являются зародышевые клетки, но эти сегменты не транскрибируются и не транслируются в тяжелые и легкие цепи, пока они будут перестроены в функциональные гены. В ходе В-клеточной дифференцировки в костном мозге такие генные сегменты случайным образом перетасовываются посредством динамической генетической системы, способной создавать более 108 специфичностей. Большинство таких генных сегментов опубликованы и собраны в базу данных зародышевой линии.
Аффинность связывания и/или авидность антител или их антиген-связывающих фрагментов можно улучшить посредством модификации каркасных участков. Способы модификации каркасных участков хорошо известны из уровня техники и предусмотрены настоящим документом. Выбор одного или нескольких соответствующих положений аминокислот в каркасном участке для замены зависит от множества критериев. Одним критерием для выбора соответствующих аминокислот каркасного участка для изменения могут быть относительные отличия аминокислотных остатков каркасного участка у донорных и акцепторных молекул. Выбор уместных положений каркасного участка для изменения при помощи настоящего подхода обладает преимуществом в том, что не допускает какой-либо существенной ошибки в определении остатка или какой-либо ошибки в определении вклада в аффинность связывания, вносимым таким остатком.
Применяемый в настоящем документе "иммунореактивный" относится к антителам или их антиген-связывающим фрагментам, которые являются специфичными к последовательности аминокислотных остатков ("сайт связывания" или "эпитоп"), при этом, если являются перекрестно-реактивными к другим пептидам/белкам, то не являются токсичными на уровнях, в которых их составляют в смесь для введения при применении на человеке. Термин "связывание" относится к непосредственной ассоциации между двумя молекулами, за счет, например, ковалентных, электростатических, гидрофобных и ионных и/или связанных с образованием водородной связи взаимодействий в физиологических условиях и в том числе таких взаимодействий, как солевые мостики и водные мостики и любые другие традиционные способы связывания. Термин "преимущественно связывает" означает, что связывающее средство связывается с сайтом связывания с большей аффинностью, чем оно связывает неродственные аминокислотные последовательности. Предпочтительно такая аффинность по меньшей мере в 1 раз больше, по меньшей мере в 2 раза больше, по меньшей мере в 3 раза больше, по меньшей мере в 4 раза больше, по меньшей мере в 5 раз больше, по меньшей мере в 6 раз больше, по меньшей мере в 7 раз больше, по меньшей мере в 8 раз больше, по меньшей мере в 9 раз больше, в 10 раз больше, по меньшей мере в 20 раз больше, по меньшей мере в 30 раз больше, по меньшей мере в 40 раз больше, по меньшей мере в 50 раз больше, по меньшей мере в 60 раз больше, по меньшей мере в 70 раз больше, по меньшей мере в 80 раз больше, по меньшей мере в 90 раз больше, по меньшей мере в 100 раз больше или по меньшей мере в 1000 раз больше аффинности связывающего средства для неродственных аминокислотных последовательностей. Термины "иммунореактивный" и "преимущественно связывает" в настоящем документе применяют взаимозаменяемо.
Применяемый в настоящем документе термин "аффинность" относится к равновесной константе для обратимого связывания двух средств и выражается как Kd. В соответствии с одним вариантом осуществления антитела или их антиген-связывающие фрагменты проявляют требуемые характеристики, такие как аффинность связывания, которую измеряют посредством KD (равновесной константы диссоциации) для гепсидина в диапазоне, составляющем 1×10-6 M или менее, или в диапазоне до 10-16 M или ниже, (например, приблизительно 10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14, 10-15, 10-16 M или менее). Равновесную константу диссоциации можно определить в анализе равновесия в растворе при помощи BIAcore и/или KinExA. Применяемый в настоящем документе термин "авидность" относится к устойчивости комплекса из двух или более средств к диссоциации после разведения. Кажущиеся аффинности можно определить посредством таких способов, как твердофазный иммуноферментный анализ (ELISA), или любой другой методики, знакомой специалисту в настоящей области техники. Авидности можно определить посредством таких способов, как анализ Скэтчарда или любой другой методики, знакомой специалисту в настоящей области техники.
"Эпитоп" относится к такой части антигена или другой макромолекулы, которая способна образовывать связывающее взаимодействие со связывающим карманом вариабельного участка антитела. Такие связывающие взаимодействия могут проявляться в виде межмолекулярного контакта с одним или несколькими аминокислотными остатками одного или нескольких CDR. Связывание антигена может вовлекать, например, CDR3 или пару CDR3 или, в некоторых случаях, взаимодействия вплоть до всех шести CDR VH и VL цепей. Эпитоп может представлять собой линейную пептидную последовательность (т.е. "непрерывную") или может состоять из несмежных аминокислотных последовательностей (т.е. "конформационных" или "дискретных"). Антитело может распознать одну или несколько аминокислотных последовательностей; поэтому эпитоп может определять более одной отличной аминокислотной последовательности. Эпитопы, распознаваемые антителами, можно определить посредством составления пептидных карт и методик анализа последовательностей, которые хорошо известны специалисту в настоящей области техники. Связывающие взаимодействия проявляются в виде межмолекулярных контактов с одним или несколькими аминокислотными остатками CDR.
Термин "специфичный" относится к ситуации, когда у антитело не будут наблюдать какое-либо значительное связывание с молекулами, отличными от антигена, содержащего распознаваемый антителом эпитоп. Термин также применим в случае, когда, например, антиген-связывающий домен является специфичным к конкретному эпитопу, который переносится рядом антигенов, в случае чего антитело или его антиген-связывающий фрагмент, несущие антиген-связывающий домен, будут способны связываться с различными антигенами, несущими такой эпитоп. Термины "преимущественно связывает" или "специфично связывает" означают, что антитела или ее фрагменты связываются с эпитопом с большей аффинностью, чем они связываются с неродственными аминокислотными последовательностями, и, если перекрестно-реактивны к другим полипептидам, содержащим такой эпитоп, то не являются токсичными на уровнях, в которых их составляют в смесь для введения при применении на человеке. В соответствии с одним аспектом такая аффинность по меньшей мере в 1 раз больше, по меньшей мере в 2 раза больше, по меньшей мере в 3 раза больше, по меньшей мере в 4 раза больше, по меньшей мере в 5 раз больше, по меньшей мере в 6 раз больше, по меньшей мере в 7 раз больше, по меньшей мере в 8 раз больше, по меньшей мере в 9 раз больше, в 10 раз больше, по меньшей мере в 20 раз больше, по меньшей мере в 30 раз больше, по меньшей мере в 40 раз больше, по меньшей мере в 50 раз больше, по меньшей мере в 60 раз больше, по меньшей мере в 70 раз больше, по меньшей мере в 80 раз больше, по меньшей мере в 90 раз больше, по меньшей мере в 100 раз больше или по меньшей мере в 1000 раз больше аффинности антитела или его фрагмента к неродственным аминокислотным последовательностям. Термины "иммунореактивный", "связывает", "преимущественно связывает" и "специфично связывает" в настоящем документе применяются взаимозаменяемо. Термин "связывание" относится к непосредственной ассоциации между двумя молекулами, за счет, например, ковалентных, электростатических, гидрофобных и ионных и/или связанных с образованием водородной связи взаимодействий в физиологических условиях, и включает такие взаимодействия, как солевые мостики и водные мостики, а также любые другие традиционные способы связывания.
Антитела можно подвергнуть скрининговому исследованию в отношении аффинности связывания посредством способов, известных из уровня техники, включая без ограничения анализы перемещения в геле, вестерн-блоттинг, конкурентный анализ с радиоактивной меткой, совместное фракционирование посредством хроматографии, совместную преципитацию, перекрестное связывание, ELISA и т.п., которые описаны, например, в Current Protocols in Molecular Biology (1999) John Wiley & Sons, NY, который включен в настоящий документ при помощи ссылки в полном его объеме.
Антитела, которые связываются с требуемым эпитопом на антигене-мишени, могут быть подвергнуты скрининговому исследованию, которое можно осуществить в традиционном эпитоп-перекрестном конкурентном анализе, таком как описанный в Antibodies, А Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Также можно применять традиционные анализы конкурентного связывания, в которых неизвестное антитело характеризуют по его способности ингибировать связывание мишени с мишень-специфичным антителом по настоящему изобретению. Можно применять интактный антиген, его фрагменты, такие как внеклеточный домен или линейные эпитопы. Составление карт эпитопа описано в работе Champe et al., J. Biol. Chem. 270: 1388-1394 (1995).
Антитела, которые ингибируют или нейтрализуют активность человеческого гепсидина, можно выявить посредством приведения в контакт гепсидина с антителом, сравнения активности гепсидина в присутствии и в отсутствии испытываемого антитела и определения того, понижает ли присутствие антитела активность гепсидина. Биологическую активность конкретного антитела или комбинации из антител можно оценить in vivo при помощи подходящей животной модели, включая любые из описываемых в настоящем документе.
В соответствии с одним вариантом осуществления настоящее изобретение относится к скрининговым анализам высокой производительности (HTS) для выявления антител, которые взаимодействуют с или ингибируют биологическую активность гепсидина-мишени. HTS-анализы позволяют эффективным образом проводить скрининг больших количеств соединений.
Фраза "консервативная аминокислотная замена" относится к группировке аминокислот на основе некоторых общих свойств. Эффективный способ определения общих свойств среди отдельных аминокислот заключается в анализе нормированных частот аминокислотных изменений между соответствующими белками гомологичных организмов (Schulz, G. Е. and R. Н. Schirmer, Principles of Protein Structure, Springer-Verlag). В соответствии с такими анализами можно определить группы аминокислот, причем аминокислоты в группе преимущественно заменяются друг другом и, таким образом, являются схожими друг с другом в основном по их влиянию на общую структуру белка (Schulz, G. Е. and R. Н. Schirmer, Principles of Protein Structure, Springer-Verlag). Примеры определяемых таким образом аминокислотных групп включают:
(i) заряженную группу, состоящую из Glu и Asp, Lys, Arg и His,
(ii) положительно заряженную группу, состоящую из Lys, Arg и His,
(iii) отрицательно заряженную группу, состоящую из Glu и Asp,
(iv) ароматическую группу, состоящую из Phe, Tyr и Trp,
(v) азот-содержащую кольцевую группу, состоящую из His и Trp,
(vi) большую алифатическую неполярную группу, состоящую из Val, Leu и Ile,
(vii) практически неполярную группу, состоящую из Met и Cys,
(viii) группу с малыми остатками, состоящую из Ser, Thr, Asp, Asn, Gly, Ala, Glu, Gln и Pro,
(ix) алифатическую группу, состоящую из Val, Leu, Ile, Met и Cys, и
(x) малую гидроксильную группу, состоящую из Ser и Thr.
В дополнение к представленным выше группам, каждый аминокислотный остаток может формировать свою собственную группу, и группа, сформированная индивидуальной аминокислотой может быть названа просто одно- и/или трех-буквенным сокращением для такой аминокислоты, широко применяемых в настоящей области техники, как описано выше.
"Консервативный остаток" представляет собой аминокислоту, которая является относительно неизменной по всему диапазону сходных белков. Часто консервативные остатки будут отличаться лишь при замене на сходную аминокислоту, как описано выше для "консервативной аминокислотной замены".
Буква "х" или "хаа", которую применяют в аминокислотных последовательностях в настоящем документе, предназначена для указания, что любые из двенадцати стандартных аминокислот можно расположить в этом положении, если специально не указанно иное.
"Гомология", или "идентичность", или "сходство" относится к сходству последовательностей у двух пептидов или у двух молекул нуклеиновой кислоты. Как гомологию, так и идентичность можно определить посредством сравнения положения в каждой последовательности, которое можно выравнивать с целью сравнения. Если эквивалентное положение в сравниваемых последовательностях занято одинаковым основанием или аминокислотном, то случае молекулы являются идентичными по такому положению; если эквивалентный сайт занят таким же или сходным аминокислотным остатком (например, сходным по пространственной и/или электронной природе), то молекулы можно назвать гомологичными (сходными) по такому положению. Выражение в виде процента гомологии/сходства или идентичности относится к функции какого-либо числа идентичных или сходных аминокислот в положениях, общих для сравниваемых последовательностей. Последовательность, которая является "неродственной" или "негомологичной", имеет менее 40% идентичности, хотя предпочтительно менее 25% идентичности с последовательностью по настоящему изобретению. При сравнении двух последовательностей отсутствие остатков (аминокислот или нуклеиновых кислот) или присутствие дополнительных остатков также понижает идентичность и гомологию/сходство.
Термин "гомология" описывает математическое сравнение сходств последовательностей, которое применяют для выявления генов или белков со сходными функциями или мотивами. Последовательности нуклеиновой кислоты (нуклеотидные, олигонуклеотидные) и аминокислотные (белковые) последовательности по настоящему изобретению можно применять в качестве "запрашиваемой последовательности" для осуществления поиска относительно общедоступных баз данных, например, для выявления других членов семейства, родственных последовательностей или гомологов. Такие поиски можно осуществлять при помощи программ NBLAST и XBLAST (версия 2.0) Altschul, et al. (1990) J. Mol. Biol. 215:403-10. Нуклеотидные поиски BLAST можно осуществлять при помощи программы NBLAST, вес = 100, длина слова = 12, для получения нуклеотидных последовательностей, гомологичных молекулам нуклеиновой кислоты по настоящему изобретению. Аминокислотные поиски BLAST можно осуществлять при помощи программы XBLAST, вес = 50, длина слова = 3, для получения аминокислотных последовательностей, гомологичных белковым молекулам по настоящему изобретению. Для получения выравниваний с введенными гэпами с целью сравнения можно использовать Gapped BLAST, которая описана в Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При использовании программ BLAST и Gapped BLAST можно применять параметры по умолчанию соответствующих программ (например, XBLAST и BLAST) (см. www.ncbi.nlm.nih.gov).
Применяемый в настоящем документе термин "идентичность" означает процент идентичных нуклеотидных или аминокислотных остатков в соответствующих положениях в двух или более последовательностях при выравнивании последовательностей для максимизации соответствия последовательностей, т.е. с учетом гэпов и вставок. Идентичность можно легко рассчитать посредством известных способов, включая без ограничения способов, которые описаны в (Computational Molecular Biology, Lesk, Α. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; и Carillo, H., and Lipman, D., SIAM J. Applied Math., 48: 1073 (1988). Способы определения идентичности предназначены для получения наибольшего совпадения между испытываемыми последовательностями. Кроме того, способы определения идентичности запрограммированы в общедоступных компьютерных программах. Способы определения идентичности с использованием компьютерных программ между двумя последовательностями включают без ограничения пакет программ GCG (Devereux, J., et al., Nucleic Acids Research 12(1): 387 (1984)), BLASTP, BLASTN и FASTA (Altschul, S. F. et al., J. Molec. Biol. 215: 403-410 (1990) и Altschul et al. Nuc. Acids Res. 25: 3389-3402 (1997)). Программа BLAST X является общедоступной на NCBI и других источниках (BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, Md. 20894; Altschul, S., et al., J. Mol. Biol. 215: 403-410 (1990). Также для определения идентичности можно применять хорошо известный алгоритм Смита-Ватермана.
"Выделенный" (применяемый взаимозаменяемо с "практически чистый" или "очищенный") применительно к полипептидам означает полипептид или его часть, который, в силу его происхождения или манипуляции: (i) присутствует в клетке-хозяине, как продукт экспрессии части вектора экспрессии; или (ii) связан с белком или другим химическим фрагментом, отличным от фрагмента, с которой он связан в природе; или (iii) не встречается в природе, например, белок, над которым проводят химические манипуляции посредством прикрепления или добавления по меньшей мере одного гидрофобного фрагмента к белку так, чтобы белок находился в не встречающейся в природе форме. Под "выделенным" дополнительно подразумевают белок, который: (i) синтезирован химическими методами; или (ii) экспрессирован в клетке-хозяине и очищен от ассоциированных и загрязняющих белков. Термин обычно означает полипептид, который был отделен от других белков и нуклеиновых кислот, с которыми он встречается в природе. Предпочтительно, полипептид также отделяют от веществ, таких как антитела или гелевые матрицы (полиакриламид), которые применяют для его очистки.
"Индуцирование иммунной реакции хозяина" означает, что субъект испытывает облегчение или уменьшение признаков или симптомов болезни, и, в частности, включает без ограничения пролонгирование продолжительности существования.
Гуманизированные иммуноглобулины, включая гуманизированные антитела, были сконструированы посредством способов генетической инженерии. Большинство гуманизированных иммуноглобулинов, которые ранее были описаны, содержали каркасный участок, который является идентичным каркасному участку конкретной иммуноглобулиновой цепи человека (т.е. акцепторной или реципиентной), и три CDR из иммуноглобулиновой цепи, не относящейся к человеческой (т.е. донорной). Гуманизация, которая описана в настоящем документе, также может включать критерии, посредством которых ограниченное число аминокислот в каркасном участке гуманизированной иммуноглобулиновой цепи выявляют и выбирают такими же, как и аминокислоты в таких положениях у донора, а не у акцептора, для повышения аффинности антитела, содержащего гуманизированную иммуноглобулиновую цепь.
При необходимости, повышенной аффинности гуманизированного антитела остатки в CDR преобразованного антитела можно дополнительно заменить на другие аминокислоты. Обычно, изменяют не более четырех аминокислотных остатков в CDR и наиболее обычно будут изменять не более двух остатков в CDR, за исключением CDR2 тяжелой цепи, где можно изменить примерно 10 остатков. Изменения аффинности можно измерить посредством традиционных способов, таких как описываемые в настоящем документе (например, Biacore).
Способы "супергуманизирования" антитела описаны более подробно в патенте США №6881557, который включен, таким образом, при помощи ссылки в полном его объеме.
Гуманизированные антитела и антиген-связывающие фрагменты можно сконструировать и получить при помощи традиционных методик, известных из уровня техники. В дополнение к этому, получаемые при помощи рекомбинантных способов антитела часто можно получить в больших количествах, особенно при использовании векторов векторов с высоким уровнем экспрессии.
Антитела можно секвенировать с помощью традиционных, известных из уровня техники методик. В соответствии с одним аспектом аминокислотные последовательности одного или нескольких CDR вставляют в синтетическую последовательность, например, каркасного участка человеческого антитела (или его антиген-связывающего фрагмента) для создания человеческого антитела, которое сможет ограничивать неблагоприятные побочные реакции на лечение субъекта-человека при помощи антитела, отличного от человеческого. Аминокислотные последовательности одного или нескольких CDR также можно вставить в синтетическую последовательность, например, в белок связывания, такой как AVIMER™, для создания конструкции для введения человеку. Такие методики можно модифицировать в зависимости от вида подлежащего лечению животного. Например, для ветеринарных применений антитело, антиген-связывающий фрагмент или белок связывания можно синтезировать для введения не относящемуся к человеку субъекту (например, примату, корове, лошади и т.д.).
В соответствии с другим аспектом, при помощи признанных в настоящей области методик, таких как приведенных и включенных в настоящее описание, можно вставить нуклеотиды, кодирующие аминокислотные последовательности одного или нескольких CDR, например, посредством рекомбинантных методик в сайты рестрикционной эндонуклеазы существующего полинуклеотида, который кодирует антитело, антиген-связывающий фрагмент или белок связывания.
Что касается экспрессии, системой экспрессии является система, в которой используется система GS (Lonza) с применением гена глутаминсинтетазы в качестве селектируемого маркера. Если кратко, трансфекцию осуществляют в клетках СНО посредством электропорации (250 В) при помощи системы GS (Lonza) с применением гена глутаминсинтетазы в качестве селектируемого маркера. Клетки СНО дикого типа выращивают в DMEM (Sigma), содержащей 10% диализированной фетальной телячьей сыворотки (FCS) с 2 мМ глутамина. 6×107 клеток СНО трансфицируют при помощи 300 мкг линеаризованной ДНК посредством электропорации. После электропорации клетки ресуспендируют в DMEM с глутамином, и высеивают в 36×96-луночных планшетах (50 мкл/лунка), и инкубируют при 37°С в 5% СО2. На следующий день добавляют 150 мкл/лунка селективной среды (DMEM без глутамина). Спустя примерно 3 недели колонии подвергают скринингу посредством ELISA (см. ниже) при помощи несоответствующего антитела в качестве отрицательного контроля. Все колонии, вырабатывающие >20 мкг/мл, размножают в 24-луночных планшетах, а затем в дублированных колбах Т25.
Для высокого уровня выработки наиболее широко применяемой системой экспрессии млекопитающих является система, которая использует процедуру амплификации гена, предлагаемую клетками яичника китайского хомяка с дефицитом по дегидрофолатредуктазе ("dhfr-"). Система хорошо известна хорошему специалисту в настоящей области техники. В основе системы лежит ген дегидрофолатредуктазы "dhfr", который кодирует фермент DHFR, который катализирует преобразование дегидрофолата в тетрагидрофолат. Для достижения высокой выработки dhfr- клетки СНО трансфицируют вектором экспрессии, содержащим функциональный ген DHFR, вместе с геном, который кодирует требуемый белок. В этом случае требуемый белок представляет собой тяжелую цепь и/или легкую цепь рекомбинантного антитела.
При повышении количества конкурентного ингибитора DHFR метотрексата (МТХ), у рекомбинантных клеток развивается устойчивость путем амплификации гена dhfr. В стандартных случаях используемая единица амплификации намного больше по размеру гена dhfr, и в результате совместно амплифицируется тяжелая цепь антитела.
При необходимости крупномасштабной выработки белка, такого как цепь антитела, учитывают как уровень экспрессии, так и стабильность используемых клеток. При долгосрочном культивировании популяции рекомбинантных клеток СНО теряют однородность в отношении их специфичной продуктивности антител при амплификации, несмотря на то, что они происходят от отдельного родительского клона.
Настоящая заявка относится к выделенному полинуклеотиду (нуклеиновой кислоте), кодирующему антитело или антиген-связывающий фрагмент, которые описаны в настоящем документе, векторам, содержащим такие полинуклеотиды, и клеткам-хозяевам и системам экспрессии для транскрибирования и трансляции таких полинуклеотидов в полипептиды.
Настоящая заявка также относится к конструкциям в форме плазмид, векторов, транскрипционных или экспрессионных кассет, которые содержат по меньшей мере один вышеупомянутый полинуклеотид.
Настоящая заявка также относится к рекомбинантной клетке-хозяину, которая содержит одну или несколько вышеупомянутых конструкций. Нуклеиновая кислота, кодирующая любое описываемые в настоящем документе антитело или его антиген-связывающие фрагменты по настоящему изобретению, сама по себе формирует аспект настоящей заявки, как и в случае описываемого в настоящем документе способа получения антитела или его антиген-связывающих фрагментов, причем способ предусматривает их экспрессию с кодирующей нуклеиновой кислоты. Экспрессию традиционно можно достичь посредством культивирования в соответствующих условиях рекомбинантных клеток-хозяев, содержащих нуклеиновую кислоту. После получения посредством экспрессии антитело или антиген-связывающий фрагмент можно выделить и/или очистить при помощи любой подходящей методики, а затем применять по необходимости.
Конкретные антитела, антиген-связывающие фрагменты и молекулы кодирующей нуклеиновой кислоты и векторы, описываемые в настоящем документе, могут быть представлены выделенными и/или очищенными, например, из их естественной среды, в практически чистой или гомогенной форме. В случае нуклеиновой кислоты беспримесная или практически беспримесная нуклеиновая кислота или гены имеют происхождение, отличное от последовательности, кодирующей полипептид с требуемой функцией. Нуклеиновая кислота может представлять собой ДНК или РНК и может быть полностью или частично синтетической. Способы очистки хорошо известны в настоящей области техники.
Хорошо известны системы для клонирования и экспрессии полипептида у ряда различных клеток-хозяев. Подходящие клетки-хозяева включают без ограничения бактериальные клетки, клетки млекопитающих, дрожжевые клетки и бакуловирусные системы. Линии клеток млекопитающих, доступные в настоящей области для экспрессии гетерогенного полипептида, включают клетки яичника китайского хомяка, клетки HeLa, клетки почек детеныша хомяка, клетки миеломы мыши NS0 и множество других. Распространенным бактериальным хозяином является Е. coli.
Экспрессия антител и фрагментов антител в прокариотических клетках, таких как Е. coli, хорошо известна в настоящей области техники. Для обзора см., например, работу  , A. Bio/Technology 9: 545-551 (1991). Экспрессия в эукариотических клетках в культуре также доступна специалистам в настоящей области техники в качестве варианта для получения описываемых в настоящем документе антител и антиген-связывающих фрагментов, см. недавние обзоры, например, работу Raff, М.Е. (1993) Curr. Opinion Biotech. 4: 573-576; Trill J.J. et al. (1995) Curr. Opinion Biotech 6: 553-560, каждая из которых включена в настоящий документ при помощи ссылки в полном его объеме.
, A. Bio/Technology 9: 545-551 (1991). Экспрессия в эукариотических клетках в культуре также доступна специалистам в настоящей области техники в качестве варианта для получения описываемых в настоящем документе антител и антиген-связывающих фрагментов, см. недавние обзоры, например, работу Raff, М.Е. (1993) Curr. Opinion Biotech. 4: 573-576; Trill J.J. et al. (1995) Curr. Opinion Biotech 6: 553-560, каждая из которых включена в настоящий документ при помощи ссылки в полном его объеме.
Могут быть выбраны или сконструированы подходящие векторы, содержащие соответствующие регуляторные последовательности, включая промоторные последовательности, терминаторные последовательности, последовательности полиаденилирования, энхансерные последовательности, маркерные гены и другие последовательности, в зависимости от ситуации. Векторы могут представлять собой плазмиды, вирусные, например, 'фаговые или фагмидные, в зависимости от ситуации. Для дополнительных подробностей см., например, работу Molecular Cloning: a Laboratory Manual: 2nd edition, Sambrook et al., 1989, Cold Spring Harbor Laboratory Press. Большое количество известных методик и протоколов для манипуляций с нуклеиновой кислотой, например, для получения конструкций нуклеиновой кислоты, мутагенеза, секвенирования, введения ДНК в клетки и экспрессии гена, и анализ белков подробно описаны в работе Short Protocols in Molecular Biology, Second Edition, Ausubel et al. eds., John Wiley & Sons, 1992. Раскрытия способов в Sambrook et al. и Ausubel et al. включены в настоящий документ при помощи ссылки в полном их объеме и хорошо известны из уровня техники.
Таким образом, в соответствии со следующим аспектом настоящее изобретение относится к клетке-хозяину, содержащей раскрываемую в настоящем документе нуклеиновую кислоту. В соответствии с еще одним следующим аспектом настоящее изобретение относится к способу, предусматривающему введение такой нуклеиновой кислоты в клетку-хозяина. Введение можно осуществлять посредством любой доступной методики. Для эукариотических клеток подходящие методики могут включать, например, трансфекцию с использованием фосфата кальция, DEAE декстран, электропорацию, опосредованную липосомами трансфекцию и трансдукцию при помощи ретровируса или другого вируса, например, коровьей оспы или, для клеток насекомых, бакуловируса. Для бактериальных клеток, подходящие методики могут включать, например, трансфекцию с использованием фосфата кальция, электропорацию и трансфекцию при помощи бактериофага.
Введение может сопровождаться индукцией или обеспечения возможности экспрессии с нуклеиновой кислоты, например, посредством культивирования клеток-хозяев в условиях, подходящих для экспрессии гена.
В соответствии с одним вариантом осуществления нуклеиновая кислота интегрируется в геном (например, хромосому) клетки-хозяина. Интеграцию можно стимулировать посредством включения последовательностей, которые способствуют рекомбинации с геномом, в соответствии со стандартными методиками. При необходимости для максимизации экспрессии можно инициализировать стимуляцию Ig.
Настоящая заявка также относится к способу, который предусматривает применение конструкции, которая указана выше, в системе экспрессии для экспрессии вышеупомянутых антител или их антиген-связывающих фрагментов.
Настоящая заявка также относится к выделенным нуклеиновым кислотам, таким как молекулы рекомбинантной ДНК или клонированным генам или вариантам продуктов их распада, мутантам, аналогам или их фрагментам, которые кодируют описываемые в настоящем документе антитело или антиген-связывающую последовательность.
В соответствии с одним аспектом настоящая заявка относится к нуклеиновой кислоте, которая кодирует антитело или его антиген-связывающий фрагмент, которые описаны в настоящем документе.
В соответствии с дополнительным вариантом осуществления полная последовательность ДНК молекулы рекомбинантной ДНК или клонированный ген антитела или антиген-связывающего фрагмента, описываемые в настоящем документе, можно функционально связать с управляющей экспрессией последовательностью, которую можно ввести в подходящего хозяина. Соответственно заявка распространяется на одноклеточных хозяев, трансформированных при помощи клонированного гена или молекулы рекомбинантной ДНК, содержащей последовательность ДНК, кодирующую VH и/или VL антитела или их части.
Другим признаком является экспрессия раскрываемых в настоящем документе последовательностей ДНК. Из уровня техники хорошо известно, что последовательности ДНК можно экспрессировать путем их функционального связывания с управляющей экспрессией последовательностью в подходящем векторе экспрессии и использования этого вектора экспрессии для трансформации подходящего одноклеточного хозяина.
Такое функциональное связывание последовательности ДНК с управляющей экспрессией последовательностью, конечно, включает, если еще не содержит в качестве части последовательности ДНК, обеспечение стартового кодона, ATG, в надлежащей рамке считывания до последовательности ДНК.
Полинуклеотиды и векторы могут быть представлены в выделенной и/или очищенной форме (например, беспримесные или практически беспримесные полинуклеотиды, имеющие отличное происхождение от полинуклеотида, кодирующего полипептид с требуемой функцией). Применяемый в настоящем документе "практически чистый" и "практически беспримесный" относятся к раствору или суспензии, содержащей менее, например, приблизительно 20% или менее примеси, приблизительно 10% или менее примеси, приблизительно 5% или менее примеси, приблизительно 4% или менее примеси, приблизительно 3% или менее примеси, приблизительно 2% или менее примеси или приблизительно 1% или менее примеси.
При экспрессии последовательностей ДНК по настоящему изобретению можно использовать широкий спектр комбинаций хозяин/вектор экспрессии. Подходящие векторы экспрессии, например, могут состоять из сегментов хромосомных, не хромосомных и синтетических последовательностей ДНК. Подходящие векторы включают без ограничения производные SV40 и известные бактериальные плазмиды, например, плазмиды E. coli col E1, Pcr1, Pbr322, Pmb9 и их производные, такие плазмиды, как RP4; фаговые ДНК, например, многочисленные производные фага λ, например, ΝΜ989, и другую фаговую ДНК, например, М13 и нитевидная одноцепочечная фаговая ДНК; дрожжевые плазмиды, такие как плазмида 2u или ее производные; векторы, подходящие для эукариотических клеток, такие как векторы, подходящие для клеток насекомых или млекопитающих; векторы, полученные от комбинаций плазмид и фаговых ДНК, такие как плазмиды, которые были модифицированы для использования фаговой ДНК или других контролирующих экспрессию последовательностей; и т.п.
Также настоящее изобретение относится к рекомбинантной клетке-хозяину, которая содержит одну или несколько полинуклеотидных конструкций. Полинуклеотид, кодирующий антитело или антиген-связывающие фрагмент, которые приведены в настоящем документе, формирует аспект настоящей заявки, как и в случае со способом получения антитела или антиген-связывающего фрагмента, причем способ предусматривает экспрессию с полинуклеотида. Экспрессию можно достичь, например, посредством культивирования в соответствующих условиях рекомбинантных клеток-хозяев, содержащих полинуклеотид. Антитело или антиген-связывающий фрагмент можно затем выделить и/или очистить при помощи любой подходящей методики, а затем применять по необходимости.
Любую из широкого разнообразия управляющих экспрессией последовательностей - последовательностей, которые управляют экспрессией последовательности ДНК, функционально связанную с ней, - можно применять в таких векторах для экспрессии последовательностей ДНК. Такие пригодные управляющие экспрессией последовательности включают, например, ранние или поздние промоторы SV40, CMV, вируса коровьей оспы, полиомы или аденовируса, lac системы, trp системы, TAC системы, TRC системы, LTR системы, основные операторные или промоторные участки фага λ, управляющие участки гена белка оболочки фага fd, промотор для 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы (например, Pho5), промоторы альфа-связывающих факторов дрожжей и другие известные последовательности для управления экспрессией генов прокариотических или эукариотических клеток или их вирусов и различные их комбинации.
Хорошо известны системы для клонирования и экспрессии полипептида у ряда различных клеток-хозяев. Подходящие клетки-хозяева включают бактерии, клетки млекопитающих, дрожжевые и бакуловирусные системы. Линии клеток млекопитающих, доступные в настоящей области для экспрессии гетерогенного полипептида, включают клетки яичника китайского хомяка (СНО), клетки HeLa, клетки почек детеныша хомяка, клетки миеломы мыши NS0 и множество других. Распространенным бактериальным хозяином может быть, например, Е. coli.
Экспрессия антител и антиген-связывающих фрагментов в прокариотических клетках, таких как Е. coli, является общеизвестной из уровня техники. Для обзора см., например,  , A. Bio/Technology 9: 545-551 (1991). Экспрессия в эукариотических клетках в культуре также доступна специалистам в настоящей области техники (Raff, М.Е. (1993) Curr. Opinion Biotech. 4: 573-576; Trill J.J. et al. (1995) Curr. Opinion Biotech 6: 553-560).
, A. Bio/Technology 9: 545-551 (1991). Экспрессия в эукариотических клетках в культуре также доступна специалистам в настоящей области техники (Raff, М.Е. (1993) Curr. Opinion Biotech. 4: 573-576; Trill J.J. et al. (1995) Curr. Opinion Biotech 6: 553-560).
При экспрессии последовательностей ДНК также пригоден широкий спектр одноклеточных клеток-хозяев. Такие хозяева включают хорошо известные эукариотические и прокариотические хозяева, такие как штаммы Е. coli, Pseudomonas, Bacillus, Streptomyces, грибы, такие как дрожжи, и клетки животных, такие как клетки СНО, YB/20, NS0, SP2/0, R1.1, B-W и L-M, клетки почек африканской зеленой мартышки (например, COS 1, COS 7, BSC1, BSC40, и ВМТ10), клетки насекомых (например, Sf9) и клетки людей или растительные клетки в культуре ткани.
Должно быть понятно, что не все векторы, управляющие экспрессией последовательности, и хозяева будут равноценно хорошо функционировать, экспрессируя последовательности ДНК. Равно как не все хозяева будут равноценно функционировать с одной и той же системой экспрессии. Тем не менее, специалист в настоящей области сможет выбрать соответствующие векторы, управляющие экспрессией последовательности, и хозяева без неоправданного эксперимента для осуществления требуемой экспрессии без отклонения от объема настоящей заявки. Например, при выборе вектора нужно учитывать хозяина, поскольку вектор должен в нем функционировать. Также будут рассматриваться число копий вектора, способность управлять таким числом копий и экспрессия любых других белков, кодируемых векторов, таких как маркеры, представляющие собой гены устойчивости к антибиотикам. Специалист в настоящей области может выбрать соответствующие векторы, управляющие экспрессией последовательности и хозяев для выполнения требуемой экспрессии без отклонения от объема настоящей заявки. Например, при выборе вектора берут в учет хозяина, поскольку вектор функционирует в нем. Также могут рассматриваться число копий вектора, способность управлять таким числом копий и экспрессия любых других белков, кодируемых векторов, таких как маркеры, представляющие собой гены устойчивости к антибиотикам.
Настоящая заявка также относится к конструкциям в форме плазмид, векторов, транскрипционных или экспрессионных кассет, рассматриваемые в других разделах настоящего документе, которые содержат по меньшей мере один вышеупомянутый полинуклеотид. Могут быть выбраны или сконструированы подходящие векторы, содержащие соответствующие регуляторные последовательности, включая промоторные последовательности, терминаторные последовательности, последовательности полиаденилирования, энхансерные последовательности, селектируемые маркеры и другие последовательности, в зависимости от ситуации. Векторы могут представлять собой плазмиды, вирусные, например, фаговые или фагмидные и т.д., в зависимости от ситуации. Для дополнительных подробностей см., например, работу Molecular Cloning: а Laboratory Manual: 2nd edition, Sambrook et al., 1989, Cold Spring Harbor Laboratory Press. Большое количество известных методик и протоколов для манипуляций с нуклеиновой кислотой, например, для получения конструкций нуклеиновой кислоты, мутагенеза, секвенирования, введения ДНК в клетки и экспрессии гена, и анализ белков подробно описаны в работе Short Protocols in Molecular Biology, Second Edition, Ausubel et al. eds., John Wiley & Sons, 1992. Раскрытия способов в Sambrook et al. и Ausubel et al. включены в настоящий документ при помощи ссылки.
При выборе контролирующей экспрессию последовательности в норме будут учитывать множество факторов. Таковые включают, например, относительную прочность системы, ее управляемость и ее совместимость с конкретной последовательностью ДНК или гена, которые подлежат экспрессии, особенно в отношении потенциальных вторичных структур. Подходящих одноклеточных хозяев будут выбирать путем рассмотрения, например, их совместимости с выбранным вектором, их характеристиками секреции, их способности правильно сворачивать белки и их ферментационных потребностей, а также токсичности для хозяина продукта, кодируемого посредством подлежащих экспрессии последовательностей ДНК и облегчения очистки продуктов экспрессии.
В соответствии со следующим аспектом настоящее изобретение относится к клетке-хозяину, содержащей один или несколько полипептидов, которые раскрыты в настоящем документе. В соответствии с еще одним следующим аспектом настоящее изобретение относится к способу введения такого одного или нескольких полинуклеотидов в клетку-хозяина, посредством любой доступной методики. Для эукариотических клеток подходящие методики могут включать, например, трансфекцию с использованием фосфата кальция, DEAE-декстран, электропорацию, опосредованную липосомами трансфекцию и трансдукцию при помощи ретровируса или другого вируса, например, коровьей оспы или, для клеток насекомых, бакуловируса. Для бактериальных клеток, подходящие методики могут включать, например, трансфекцию с использованием фосфата кальция, электропорацию и трансфекцию при помощи бактериофагов.
Введение может сопровождаться индукцией или обеспечения возможности экспрессии с одного или нескольких полинуклеотидов, например, посредством культивирования клеток-хозяев в условиях, подходящих для экспрессии одного или нескольких полипептидов с одного или нескольких полинуклеотидов. Можно применять индуцируемые системы и индуцировать экспрессию посредством добавления активатора.
В соответствии с одним вариантом осуществления полинуклеотиды можно интегрировать в геном (например, хромосому) клетки-хозяина. Интеграцию можно стимулировать посредством включения последовательностей, которые способствуют рекомбинации с геномом, в соответствии со стандартными методиками. В соответствии с другим вариантом осуществления нуклеиновую кислоту сохраняют на эписомальном векторе в клетке-хозяине.
В настоящем документе приведены способы, которые предусматривают применение вышеупомянутой конструкции в системе экспрессии для экспрессии конкретного полипептида.
При рассмотрении этих и других факторов специалист в настоящей области техники сможет сконструировать множество комбинаций вектор/управляющая экспрессией последовательность/хозяин, которые будут экспрессировать последовательности ДНК во время ферментации или в крупномасштабной животной культуре.
Помимо, или скорее вместо, клонирования полинуклеотид, кодирующий антитело, антиген-связывающий фрагмент или белок связывания, можно получить рекомбинантно/синтетически. Полинуклеотид можно сконструировать с соответствующими кодонами для антитела, антиген-связывающего фрагмента или белка связывания. В целом, если последовательность будут применять для экспрессии, то будут выбраны предпочтительные кодоны для предполагаемого хозяина. Полный полинуклеотид можно собрать из перекрывающихся олигонуклеотидов, полученных посредством стандартных способов, и собрать в полную кодирующую последовательность. См., например, Edge, Nature, 292:756 (1981); Nambair et al., Science, 223:1299 (1984); Jay et al., J. Biol. Chem., 259:6311 (1984), каждый из которых включен в настоящий документ при помощи ссылки в полном его объеме.
Общий способ для сайт-специфичного включения неприродных аминокислот в белки описан в работе Noren et al., Science, 244:182-188 (April 1989). Этот способ можно применять для создания аналогов с неприродными аминокислотами.
Как упомянуто выше, последовательность ДНК, кодирующую антитело или его антиген-связывающий фрагмент, можно получать синтетически, а не при помощи клонирования. Последовательность ДНК можно сконструировать с соответствующими кодонами для аминокислотной последовательности антитела или антиген-связывающего фрагмента. В целом, если последовательность будут применять для экспрессии, то будут выбраны предпочтительные кодоны для предполагаемого хозяина. Полную последовательность собирают из перекрывающихся олигонуклеотидов, полученных посредством стандартных способов, и собрать в полную кодирующую последовательность.
Антитела или их антиген-связывающие фрагменты можно модифицировать при помощи методик, известных из уровня техники для различных целей, таких как, например, посредством добавления полиэтиленгликоля (PEG). PEG модификация (пегилирование) может привести к одному или нескольким из улучшенного периода циркуляции в крови, улучшенной растворимости, улучшенной устойчивости к протеолизу, уменьшенной антигенности и иммуногенности, улучшенной биодоступности, уменьшенной токсичности, улучшенной стабильности и более легкого составления (для обзора см. Francis et al., International Journal of Hematology 68:1-18, 1998).
В случае антиген-связывающего фрагмента, который не содержит Fc часть, Fc часть можно добавлять (например, рекомбинантно) к фрагменту, например, для повышения периода полужизни антиген-связывающего фрагмента при циркуляции крови, при введении субъекту. Выбор соответствующего Fc участка и способы включения таких фрагментов известны из уровня техники. Включение Fc участка IgG в представляющий интерес полипептид с тем, чтобы увеличить его период полужизни в кровотоке, но так, чтобы не потерять его биологическую активность, можно выполнять при помощи традиционных методик, известных из уровня техники, таких как, например, которые описаны в патенте США №6096871, который включен, таким образом, при помощи ссылки в полном его объеме. Fc части антител можно дополнительно модифицировать для повышения периода полужизни антиген-связывающего фрагмента при циркуляции в крови при введении субъекту. Модификации можно определить при помощи традиционных способов, известных из уровня техники, таких как, например, которые описаны в патенте США №7217798, который включен, таким образом, при помощи ссылки в полном его объеме.
Также известны другие способы повышения периода полужизни слитых белков на основе антитела при циркуляции, такие как, например, которые описаны в патентах США №7091321 и №6737056, каждый из которых включен, таким образом, при помощи ссылки. Дополнительно, антитела и их антиген-связывающие фрагменты можно получить или экспрессировать так, чтобы они не содержали фукозу на своих комплексных N-гликозид-связанных сахарных цепях. Известно, что удаление фукозы с комплексных N-гликозид-связанных сахарных цепей повышает эффекторные функции антител и антиген-связывающих фрагментов, включая без ограничения антителозависимую клеточноопосредованную цитотоксичность (ADCC) и комплементзависимую цитотоксичность (CDC). Аналогичным образом, антитела или их антиген-связывающие фрагменты, которые могут связывать эпитоп, можно прикрепить на их С-конце к полной или части иммуноглобулиновой тяжелой цепи, полученной от любого изотипа антитела, например, IgG, IgA, IgE, IgD и IgM и любого подкласса изотипов, в частности IgG1, IgG2b, IgG2a, IgG3 и IgG4.
Дополнительно, описываемые в настоящем документе антитела или антиген-связывающие фрагменты также можно модифицировать так, чтобы они были способны пересекать гематоэнцефалический барьер. Такая модификация описываемых в настоящем документе антител или антиген-связывающих фрагментов делает возможным лечение заболеваний головного мозга, таких как мультиформная глиобластома (GBM). Иллюстративные модификации для того, чтобы сделать возможным пересечение белками, такими как антитела или антиген-связывающие фрагменты, гематоэнцефалического барьера, описаны в публикации заявки на выдачу патента США 2007/0082380, которая включена, таким образом, при помощи ссылки в полном ее объеме.
Было показано, что гликозилирование иммуноглобулинов оказывает значительные влияния на их эффекторные функции, структурную стабильность и скорость секреции из вырабатывающих антитела клеток (Leatherbarrow et al., Mol. Immunol. 22:407 (1985)). Углеводные группы, ответственные за такие свойства, обычно присоединены к константным (С) участкам антител. Например, гликозилирование IgG по аспарагину 297 в СН 2 домене необходимо для полной способности IgG активировать классический каскад реакций комплемент-зависимого цитолиза (Tao and Morrison, J. Immunol. 143:2595 (1989)).
Гликозилирование IgM по аспарагину 402 в СН 3 домене необходимо для правильной сборки и каталитической активности антитела (Muraoka and Shulman, J. Immunol. 142:695 (1989)). Удаление сайтов гликозилирования по положениям 162 и 419 в СН 1 и СН3 доменах антитела IgA приводило к внутриклеточной распаду и по меньшей мере 90% ингибированию секреции (Taylor and Wall, Mol. Cell. Biol. 8:4197 (1988)). Дополнительно, антитела и их антиген-связывающие фрагменты можно получить или экспрессировать так, чтобы они не содержали фукозу на своих сложных N-гликозид-связанных сахарных цепях. Известно, что удаление фукозы с комплексных N-гликозид-связанных сахарных цепей повышает эффекторные функции антител и антиген-связывающих фрагментов, включая без ограничения антителозависимую клеточноопосредованную цитотоксичность (ADCC) и комплементзависимую цитотоксичность (CDC). Такие "дефукозилированные" антитела и антиген-связывающие фрагменты можно получить с помощью множества систем, в которых использованы методики молекулярного клонирования, известные из уровня техники, включая без ограничения трансгенных животных, трансгенных растений или клеточных линий, которые были генетически сконструированы так, чтобы они больше не содержали ферменты и биохимические каскады, необходимые для включения фукозы в комплексные N-гликозидсвязанные сахарные цепи (также известные как нокаутные по фукозилтрансферазе животные, растения или клетки). Неограничивающие примеры клеток, которые могут быть сконструированы как нокаутные по фукозилтрансферазе клетки, включают клетки СНО, клетки SP2/0, клетки NS0 и клетки YB2/0.
Также наблюдали гликозилирование иммуноглобулинов в вариабельном (V) участке. Sox и Hood сообщали, что приблизительно 20% антител человека гликозилированы в V участке (Proc. Natl. Acad. Sci. USA 66:975 (1970)). Полагают, что гликозилирование V домена возникает в результате случайных появлений N-связанной-сигнальной последовательности гликозилирования Asn-Xaa-Ser/Thr в V участке, и его не признают в настоящей области техники как играющее какую-либо роль в функции иммуноглобулина.
Гликозилирование в каркасном участке вариабельного домена может изменять взаимодействие связывания антитела с антигеном. Настоящее изобретение относится к критериям, по которым ограниченное количество аминокислот в каркасном участке или CDR гуманизированной иммуноглобулиновой цепи выбирают для мутирования (например, путем замены, делеции или добавления остатков) с целью повышения аффинности антитела.
Цистеиновый остаток(остатки) можно удалить или внести в Fc участок антитела или Fc-содержащий полипептид, таким образом устраняя или повышая образование дисульфидных связей между цепями в таком участке. Гомодимерное специфичное средство связывания или антитело, созданное при помощи таких способов, может характеризоваться улучшенной интернализационной способностью и/или повышенным комплемент-опосредованным цитолизом и антителозависимой клеточноопосредованной цитотоксичностью (ADCC). См. Caron et al., J. Exp Med. 176: 1191-1195 (1992), и Shopes, B. J. Immunol. 148: 2918-2922 (1992).
Было показано, что последовательности в CDR могут заставлять антитело связываться с МНС II класса и запускать нежелательную реакцию с участием хелперных Т-клеток. Консервативная замена может сделать возможным сохранение антителом связывающей активности, с уменьшением его способности запускать нежелательную реакцию с участием Т-клеток. В соответствии с одним вариантом осуществления можно удалить одну или несколько из 20 N-концевых аминокислот тяжелой или легкой цепи.
В соответствии с некоторыми вариантами осуществления можно получить молекулы антитела с измененной углеводной структурой, что в результате приведет к изменению эффекторной активности, включая молекулы антитела с отсутствующим или уменьшенным фукозилированием, которые характеризуются улучшенной ADCC активностью. Из уровня техники известны различные способы для достижения этого. Например, ADCC эффекторная активность опосредуется связыванием молекулы антитела с рецептором FcγRIII, которое, как было показано, зависит от углеводной структуры N-связанного гликозилирования по Asn-297 СН2 домена. Нефукозилированные антитела связывают этот рецептор с повышенной аффинностью и запускают FcγRIII-опосредованные эффекторные функции более эффективно, чем нативные, фукозилированные антитела. Некоторые штаммы клеток-хозяев, например, Lec13 или линия клеток YB2/0 крысиной гибридомы, естественным образом вырабатывают антитела с более низкими уровнями фукозилирования. Shields et al., J Biol Chem. Jul. 26, 2002; 277(30):26733-40; Shinkawa et al., J Biol Chem. Jan. 31, 2003; 278(5):3466-73. Было определено, что повышение уровня двухантенного углевода, например, в результате рекомбинантной выработки антитела в клетках, которые сверхэкспрессируют фермент GnTIII, также повышает ADCC активность. Umana et al., Nat Biotechnol. February 1999; 17(2): 176-80. Было сделано предположение, что для повышения ADCC активности может быть достаточным отсутствие лишь одного из двух фукозных остатков. (Ferrara et al., J Biol Chem. Dec. 5, 2005).
Также настоящее изобретение относится к ковалентным модификациям антитела. Их можно получить при помощи химического синтеза или посредством ферментативного или химического расщепления антитела, если это необходимо. Другие типы ковалентных модификаций можно ввести посредством проведения реакции целевых аминокислотных остатков с органическим средством для получения производных, которое может вступать в реакцию с выбранными боковыми цепями или N- или С-концевыми остатками.
Цистеиниловые остатки чаще всего вступают в реакцию с альфа-галоацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетатамид, с образованием карбоксиметиловых или карбоксиамидометиловых производных. Цистеиниловые остатки также дериватизируют посредством реакции с бромтрифторацетоном, альфа-бром-бета-(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, п-хлорртутьбензоатом, 2-хлорртуть-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом.
Гистидиловые остатки можно дериватизировать посредством реакции с диэтилпирокарбонатом при рН 5,5-7,0, поскольку это средство является относительно специфичным для гистидиловой боковой цепи. Также пригоден пара-бромфенацилбромид; реакцию можно осуществлять в 0,1 M какодилате натрия при рН 6,0.
Лизиниловые и амино-концевые остатки можно ввести в реакцию с ангидридами янтарной или других карбоновых кислот. Дериватизация при помощи таких средств оказывает эффект обращения заряда лизиниловых остатков. Другие реактивы, пригодные для дериватизации альфа-амино-содержащих остатков, включают сложные имидоэфиры, такие как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлороборогидрид, тринитробензолсульфоновую кислоту, О-метилизомочевину, 2,4-пентандион и катализируемую трансаминазой реакцию с глиоксилатом.
Аргиниловые остатки можно модифицировать посредством реакции с одним или несколькими традиционными реактивами, такими как фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Дериватизация аргининовых остатков требует, чтобы реакцию осуществляли в щелочных условиях по причине высокой pKa гуанидиновой функциональной группы. Кроме того, такие реактивы могут вступать в реакцию с группами лизина, а также эпсилон-аминогруппой аргинина.
Можно осуществлять конкретные модификации тирозиловых остатков, причем особенный интерес представляет введение спектральных меток в тирозиловые остатки путем проведения реакции с ароматическими соединениями диазония или тетранитрометаном. Чаще всего N-ацетилимидизол и тетранитрометан можно применять для получения, соответственно О-ацетилтирозиловых соединений и 3-нитропроизводных. Тирозиловые остатки йодируют при помощи 125I или 131I с получением меченных белков для применения в радиоиммунном анализе.
Карбоксильные боковые группы (аспартил или глутамил) выборочно модифицируют посредством реакции с карбодиимидами (R-N=C=N-R'), где R и R' являются различными алкильными группами, такими как 1-циклогексил-3-(2-морфолинил-4-этил)-карбодиимидом или 1-этил-3-(4-азония-4,4-диметилпентил)карбодиимид. Кроме того, аспартиловые и глутамиловые остатки преобразовывают до аспарагиниловых и глутаминиловых остатков посредством реакции с ионами аммония.
Глутаминиловые и аспарагиниловые остатки можно дизамидировать до соответствующих глутамиловых и аспартиловых остатков, соответственно. Такие остатки дизамидируют в нейтральных или основных условиях.
Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треониловых остатков, метилирование альфа-аминогрупп лизиновых, аргининовых и гистидиновых боковых цепей (Т.Е. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевого амина и амидирование любой С-концевой карбоксильной группы.
Другой тип ковалентной модификации включает химическое или ферментативное связывание гликозидов со специфичным связывающимся средством или антителом. Такие процедуры являются преимущественными в том смысле, что они не требуют получения полипептида или антитела в клетке-хозяине, которая обладает гликозилирующей способностью для N- или О-сцепленного гликозилирования. В зависимости от применяемого способа связывания сахар(сахара) можно присоединить к (а) аргинину и гистидину, (b) свободным карбоксильным группам, (с) свободным сульфгидрильным группам, таким как группы цистеина, (d) свободным гидроксильным группам, таким как группы серина, треонина или гидроксипролина, (е) ароматическим остаткам, таким как остатки фенилаланина, тирозина или триптофана, или (f) амидной группе глутамина. Такие способы описаны в WO 87/05330, опубликованной 11 сентября 1987 года, и в работе Aplin and Wriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981).
Удаление любых углеводных фрагментов, присутствующих на полипептиде или антителе, можно осуществлять химически или ферментативно. Химическое дегликозилирование включает воздействие на антитело соединением трифторметансульфоновой кислоты или эквивалентным соединением. Эта обработка приводит в результате к расщеплению большинства или всех сахаров за исключением соединяющего сахара (N-ацетилглюкозамина или N-ацетилгалактозамина), в то же время оставляя антитело интактным. Химическое дегликозилирование описано в работе Hakimuddin, et al. Arch. Biochem. Biophys. 259: 52 (1987) и в работе Edge et al. Anal. Biochem., 118: 131 (1981). Ферментативное расщепление углеводных фрагментов на антителе можно осуществить посредством применения ряда эндо- и экзогликозидаз, которые описаны в работе Thotakura et al. Meth. Enzymol. 138: 350 (1987).
Другой тип ковалентной модификации активности гепсидина предусматривает соединение антитела с одним из ряда небелковых полимеров, например, полиэтиленгликолем, полипропиленгликолем, полиоксиэтилированными полиолами, полиоксиэтилированным сорбитом, полиоксиэтилированной глюкозой, полиокситилированным глицерином, полиоксиалкиленами или полисахаридными полимерами, такими как декстран. Такие способы известны из уровня техники, см., например, патенты США №№4640835, 4496689, 4301144, 4670417, 4791192, 4179337, 4766106, 4179337, 4495285, 4609546 или ЕР 315 456.
Аффинность связывания заранее определенного полипептидного антигена обычно можно модулировать путем введения одной или нескольких мутаций в каркасный V участок, обычно в областях, прилегающих к одному или нескольким CDR и/или в одном или нескольких каркасных участках. Обычно, такие мутации включают введение консервативных аминокислотных замен, которые либо разрушают, либо создают последовательности сайтов гликозилирования, но практически не влияют на гидропатические структурные свойства полипептида. Обычно избегают мутаций, которые вводят пролиновый остаток. Гликозилирование антител и их антиген-связывающих фрагментов дополнительно описано в патенте США №6350861, который включен в настоящий документ при помощи ссылки в том, что касается гликозилирования.
Антитела к гепсидину
Настоящее изобретение относится к гуманизированным антителам и их антиген-связывающим фрагментам, которые связываются с гепсидином.
Гепсидин вовлечен в регуляцию гомеостаза железа. Гепсидин связывается с ферропортином и понижает его функциональную активность путем того, что вызывает его поглощение с клеточной поверхности и расщепление.
Высокие уровни человеческого гепсидина могут в результате привести к уменьшенным уровням железа и наоборот. Мутации в гене гепсидина, которые в результате приводят к недостатку активности гепсидина, ассоциированы с ювенильным гемохроматозом, тяжелым заболеванием от переизбытка железа. Исследования на мышах показали роль гепсидина в контроле нормального гомеостаза железа.
Гепсидин также может быть вовлечен в секвестрацию железа при воспалении. Было отмечено, что экспрессия гена гепсидина подвергается сильной положительной регуляции после воспалительных стимулов, таких как инфекции, которые индуцируют реакцию острой фазы врожденного иммунитета позвоночных. Экспрессия гена гепсидина может подвергаться положительной регуляции липополисахаридом (LPS), турпентином, полным адъювантом, неполным адъювантом Фрейнда, аденовирусными инфекциями и воспалительным цитокином интерлейкин-6 (IL-6). Сильная корреляция между экспрессией гепсидина и анемией при воспалении также была обнаружена у больных с хроническими воспалительными заболеваниями, включая бактериальные, грибковые и вирусные инфекции.
Человеческий гепсидин представляет собой 25-аминокислотный пептид с противомикробной и регулирующей железо активностью. Также ему дали название LEAP-1 (liver-expressed antimicrobial peptide - экспрессируемый в печени противомикробный пептид). КДНК гепсидина, кодирующая 83-аминокислотный препропептид у мышей и 84-аминокислотный препропептид у крысы и человека, была выявлена позднее при поиске специфичных для печени генов, которые регулируются железом. Сначала отщепляется N-концевой сигнальный пептид из 24 остатков с образованием прогепсидина, который затем дополнительно процессируется с образованием зрелого гепсидина, обнаруживаемого как в крови, так и в моче. В моче человека преобладающая форма содержит 25 аминокислот, хотя при некоторых заболеваниях также присутствуют более короткие 22- и 20-аминокислотные пептиды в недетектируемых или в очень низких концентрациях.
К гепсидину вырабатываются моноклональные антитела (MAb), которые модулируют активность гепсидина и, таким образом, регулируют гомеостаз железа. В дальнейшем в этом документе отсылку к терминам "антитело" и "антитела" следует рассматривать как включающую любые описываемые в настоящем документе антиген-связывающие фрагменты, и эти термины, по возможности, должны быть взаимозаменяемыми.
Такие антитела и их антиген-связывающие фрагменты пригодны для диагностики и лечения различных состояний и заболеваний, а также для очистки и детекции гепсидина.
Связывание антитела или антиген-связывающего фрагмента с гепсидином может частично (например, на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99% или любые числа в этом диапазоне) или полностью модулировать гепсидин. Активность антитела или антиген-связывающего фрагмента можно определить при помощи анализа in vitro и/или in vivo с помощью общепринятых в настоящей области анализов, таких как анализы, описываемые в настоящем документе или другие известных из уровня техники.
В соответствии с одним аспектом антиген-связывающий фрагмент из любого из описанных выше антител представляет собой Fab, Fab', Fd, F(ab')2, Fv, scFv, одноцепочечный связывающий полипептид (например, scFv с Fc частью) или любой другой их функциональный фрагмент, которые описаны в настоящем документе.
Антитела или их антиген-связывающие фрагменты, описываемые в настоящем документе, можно дополнительно модифицировать для изменения конкретных свойств антитела, в то же время, при необходимости, сохраняя требуемую функциональность. Например, в соответствии с одним вариантом осуществления соединение можно модифицировать для изменения фармакокинетического свойства соединения, такого как in vivo стабильность, растворимость, биодоступность или период полужизни.
Антитела или их антиген-связывающие фрагменты можно составлять в смесь для любого подходящего пути введения субъекту, включая без ограничения инъекцию. Инъекция включает, например, подкожную, перитониальную или внутривенную инъекцию. Введение можно осуществлять в одно, два, три, четыре, пять, шесть, семь или более участков инъекции. В соответствии с одним вариантом осуществления введение осуществляют в шесть участков инъекции.
Полученные при помощи таких способов антитела, антиген-связывающие фрагменты и белки связывания, которые связывают гепсидин, можно испытать в отношении одного или нескольких из их свойств аффинности связывания, авидности и модулирования. Подходящие антитела и антиген-связывающие фрагменты можно вводить субъекту для предупреждения, ингибирования, контроля или лечения состояния, заболевания или нарушения, которые описаны более подробно ниже.
Традиционные способы можно использовать для выявления антител или их антиген-связывающих фрагментов, которые связываются с гепсидином. Антитела и антиген-связывающие фрагменты можно оценить в отношении одного или нескольких из аффинности связывания, скоростей ассоциации, скоростей диссоциации и авидности. В соответствии с одним аспектом антитела можно оценить на предмет их способности модулировать активность гепсидина или полипептида, в котором присутствует последовательность связывания гепсидин (эпитоп). Измерение аффинности связывания, скоростей ассоциации, скоростей диссоциации и авидности можно выполнять при помощи известных в настоящей области техники анализов, включая (поверхностный плазмонный резонанс) без ограничения твердофазных иммуноферментный анализ, (ELISA), анализ Скэтчарда, анализ BIACORE и т.д., а также другие анализы, широко применяемые и известные специалистам в настоящей области.
Измерение связывания антител с гепсидином и/или способности антител и их антиген-связывающих фрагментов можно определить при помощи, например, твердофазного иммуноферментного анализа (ELISA), анализа конкурентного связывания, анализа ELISPOT или любого другого подходящего анализа, известного из уровня техники. Эти анализы широко применяют, и они хорошо известны специалистам в настоящей области техники.
В соответствии с одним неограничивающим вариантом осуществления анализ ELISA можно применять для измерения связывающей способности специфичных антител или антиген-связывающих фрагментов, которые связываются с гепсидином.
Такие анализы, как ELISA, также можно применять для выявления антител или их антиген-связывающих фрагментов, которые характеризуются повышенной специфичностью к гепсидину по сравнению с другими антителами или их антиген-связывающими фрагментами. Такие анализы, как ELISA, также можно применять для выявления антител или их антиген-связывающих фрагментов со связыванием с эпитопами у одного или нескольких полипептидов и у одного или нескольких видов гепсидина. Анализ специфичности можно осуществлять посредством проведения параллельного ELISA, в которых испытываемые антитела или их антиген-связывающие фрагменты подвергают скринингу одновременно в раздельных камерах анализа на способность к связыванию одного или нескольких эпитопов на различных видах полипептида, содержащих гепсидиновые эпитопы для выявления антител или их антиген-связывающих фрагментов, которые связываются с гепсидином. Другой методикой для измерения кажущейся аффинности связывания, известной специалистам в настоящей области, является методика поверхностного плазмонного резонанса (проводимая на системе BIACORE 2000) (Liljeblad, et al., Glyco. J. 2000, 17:323-329). Стандартные измерения и традиционные анализы связывания описаны в работе Heeley, R. P., Endocr. Res. 2002, 28:217-229.
Антитела и их антиген-связывающие фрагменты можно испытать на ряд функций при помощи ряда способов in vitro и in vivo, включая без ограничения известные из уровня техники способы и описываемые в настоящем документе способы.
Настоящее изобретение относится к антителам и их антиген-связывающим фрагментам, которые связываются с гепсидином. В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с гепсидином, содержащим вариабельный участок тяжелой цепи и вариабельный участок легкой цепи,
причем указанный вариабельный участок тяжелой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность с любой из SEQ ID NO: 55-57,
(ii) CDR2, имеющий аминокислотную последовательность с любой из SEQ ID NO: 58-60, и
(iii) CDR3, имеющий аминокислотную последовательность с любой из SEQ ID NO: 61-63;
и указанный вариабельный участок легкой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность с любой из SEQ ID NO: 64-66,
(ii) CDR2, имеющий аминокислотную последовательность с любой из SEQ ID NO: 67-69, и
(iii) CDR3, имеющий аминокислотную последовательность с любой из SEQ ID NO: 70-72.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с гепсидином или пептидом гепсидина, содержащим вариабельный участок тяжелой цепи и вариабельный участок легкой цепи,
причем указанный вариабельный участок тяжелой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 1-3,
(ii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 4-6, и
(iii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 7-9;
и указанный вариабельный участок легкой цепи содержит:
(i) CDR1, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 10-12,
(ii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 13-15, и
(iii) CDR2, имеющий аминокислотную последовательность, кодируемую посредством любой из SEQ ID NO: 16-18. В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, содержащему каркасный участок вариабельного участка тяжелой цепи и каркасный участок вариабельного участка легкой цепи, которые изложены в приведенном ниже Перечне последовательностей, где CDR, указанные в любой из SEQ ID NO: 1-18 или 55-72 вставлены в каркасный участок с использованием нумерации Кэбота.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с гепсидином, которые получены путем введения грызуну (т.е. мыши, крысе или кролику) пептида с аминокислотной последовательностью с любой из SEQ ID NO: 19-27. В соответствии с другим вариантом осуществления пептид конъюгируют с носителем (например, гемоцианином лимфы улитки (KLH)) или адъювантом (полным адъювантом Фрейнда (CFA) или неполным адъювантом Фрейнда (IFA)). В соответствии с одним вариантом осуществления настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с аминокислотными остатками 1-9 гепсидина. В соответствии с другим вариантом осуществления настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с аминокислотными остатками 1-7 гепсидина.
Пептид гепсидина, с которым связывается антитело или его антиген-связывающий фрагмент, может иметь аминокислотную последовательность с SEQ ID NO: 19.
Настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с эпитопом, содержащим аминокислотную последовательность любого из Нер-5, Нер-9, Нер-20, Hep-22 и Нер-2, где последовательности пептидов приведены в перечне последовательностей.
В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с эпитопом, содержащим аминокислотную последовательность Нер-20 (SEQ ID NO: 22), Нер-22 (SEQ ID NO: 23) и Hep-25 (SEQ ID NO: 19).
В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с эпитопом, содержащим аминокислотную последовательность Нер-5 (SEQ ID NO: 25) или Нер-9 (SEQ ID NO: 24). В соответствии с другим вариантом осуществления настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, которые специфично связываются с эпитопом, содержащим аминокислотные остатки 1-9 гепсидина. В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с 2, 3, 4, 5, 6, 7, 8, или 9 аминокислотными остатками эпитопа, содержащего аминокислотные остатки 1-9 гепсидина.
В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент представляют собой моноклональное антитело, содержащее CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 55, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 58, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 61, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 64, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 67, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 70.
В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент представляют собой моноклональное антитело, содержащее CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 56, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 59, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 61, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 65, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 68, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 71.
В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент представляют собой моноклональное антитело, содержащее CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 57, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 60, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 63, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 66, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 69, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 72.
Антитело может представлять собой, например, моноклональное антитело, химерное антитело, человеческое антитело или гуманизированное антитело. В соответствии с одним вариантом осуществления гуманизированная вариабельная тяжелая цепь содержит аминокислотную последовательность, изложенную под SEQ ID NO: 40. В соответствии с другим вариантом осуществления гуманизированная вариабельная легкая цепь содержит аминокислотную последовательность, изложенную под SEQ ID NO: 38.
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антиген-связывающему фрагменту, содержащему каркасный участок вариабельного участка тяжелой цепи и каркасный участок вариабельного участка легкой цепи, которые изложены в приведенном ниже Перечне последовательностей, где CDR, указанные в любой из SEQ ID NO: 1-18 из 55-72 вставлены в каркасный участок с использованием нумерации Кэбота.
Антиген-связывающий фрагмент может представлять собой, например, Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, Fv фрагмент, scFv фрагмент, одноцепочечный связывающий полипептид, Fd фрагмент, вариабельную тяжелую цепь, вариабельную легкую цепь, dAb фрагмент или любой другой тип фрагмента, описанный в настоящем документе. Антиген-связывающий фрагмент может представлять собой, например, AVIMER, диатело или димер тяжелой цепи. Димер тяжелой цепи может представлять собой, например, конструкцию тяжелой цепи верблюда или акулы.
Антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе, могут иметь константу диссоциации (Kd) от приблизительно 1 до приблизительно 10 пМ, от приблизительно 10 до приблизительно 20 пМ, от приблизительно 1 до приблизительно 29 пМ, от приблизительно 30 до приблизительно 40 пМ, от приблизительно 10 до приблизительно 100 пМ или от приблизительно 20 до приблизительно 500 пМ.
Антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе, могут иметь константу диссоциации (Kd), составляющую менее приблизительно 500 пМ, менее приблизительно 400 пМ, менее приблизительно 300 пМ, менее приблизительно 200 пМ, менее приблизительно 100 пМ, менее приблизительно 75 пМ, менее приблизительно 50 пМ, менее приблизительно 30 пМ, менее приблизительно 25 пМ, менее приблизительно 20 пМ, менее приблизительно 18 пМ, менее приблизительно 15 пМ, менее приблизительно 10 пМ, менее приблизительно 75 пМ, менее приблизительно 5 пМ, менее приблизительно 2,5 пМ или менее приблизительно 1 пМ.
Антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе, могут иметь аффинность к гепсидину или пептиду гепсидина, составляющую от приблизительно 10-9 до приблизительно 10-14, от приблизительно 10-10 до приблизительно 10-14, от приблизительно 10-11 до приблизительно 10-14, от приблизительно 10-12 до приблизительно 10-14, от приблизительно 10-13 до приблизительно 10-14, от приблизительно 10-10 до приблизительно 10-11, от приблизительно 10-11 до приблизительно 10-12, от приблизительно 10-12 до приблизительно 10-13 или 10-13 до приблизительно 10-14.
Настоящее изобретение относится к композиции, содержащей антитело или антиген-связывающий фрагмент и приемлемый носитель или вспомогательное средство. Композиции описаны более подробно ниже.
Также настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует антитело или его антиген-связывающий фрагмент, описываемые в настоящем документе. Также настоящее изобретение относится к вектору экспрессии, содержащему молекулу нуклеиновой кислоты, функционально связанную с регуляторной управляющей последовательностью. Также настоящее изобретение относится к клетке-хозяину, содержащей приведенные в настоящем документе вектор или молекулу нуклеиновой кислоты. Также настоящее изобретение относится к способу применения клетки-хозяина для получения антитела, предусматривающему культивирование клетки-хозяина в таких подходящих условиях, чтобы экспрессировалась нуклеиновая кислота, с получением антитела.
Композиции
Каждое из описываемых в настоящем документе соединений можно применять в качестве композиции, при комбинировании с приемлемым носителем или вспомогательным средством. Такие композиции пригодны для анализа in vitro или in vivo или для введения субъекту in vivo или ex vivo для лечения субъекта при помощи раскрываемых соединений.
Таким образом, фармацевтические композиции могут включать, помимо активного ингредиента, фармацевтически приемлемое вспомогательное средство, носитель, буфер, стабилизатор или другие материалы, хорошо известные специалистам в настоящей области техники. Такие материалы не должны быть токсичными и не должны препятствовать эффективности активного ингредиента. Конкретная природа носителя или другого материала будет зависеть от пути введения.
Фармацевтические составы, содержащие представляющий интерес белок, например, антитело или антиген-связывающий фрагмент, выявленные посредством описываемых в настоящем документе способов, можно получить для хранения посредством смешивания белка, имеющего требуемую степень чистоты, с необязательными физиологически приемлемыми носителями, вспомогательными средствами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) для получением лиофилизированных составов или водных растворов. Приемлемые носители, вспомогательные средства или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и концентрациях и включают буферы, такие как фосфатный, цитратный и с другими органическими кислотами; антиоксиданты, в том числе аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметамония хлорид; бензалкония хлорид; бензетония хлорид; феноловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатообразующие средства, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексные соединения металлов (например, комплексное соединение Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN®, PLURONICS® или полиэтиленгликоль (PEG).
Приемлемые носители являются физиологически приемлемыми для введения субъекту и сохранения терапевтических свойств соединений, с/в которых их вводят. Приемлемые носители и их составы в целом описаны, например, в работе Remington's pharmaceutical Sciences (18th Edition, ed. A. Gennaro, Mack Publishing Co., Easton, PA 1990). Одним иллюстративным носителем является физиологический раствор. Применяемая в настоящем документе фраза "фармацевтически приемлемый носитель" означает фармацевтически приемлемый материал, композицию или наполнитель, такой как жидкое или твердое вещество-наполнитель, разбавитель, вспомогательное средство, растворитель или капсулирующий материал, участвующие в переносе или транспортировке субъекту соединений от места введения одного органа или части тела к другому органу или части тела или в аналитической системе in vitro. Каждый носитель является приемлемым в том смысле, что он совместим с другими ингредиентами состава и не вредит субъекту, которому его вводят. Также приемлемый носитель не должен изменять специфичную активность рассматриваемых соединений.
В соответствии с одним аспектом настоящее изобретение относится к фармацевтически приемлемыми или физиологически приемлемым композициям, включающим растворители (водные или безводные), растворы, эмульсии, дисперсионные среды, покрытия, изотонические и абсорбционные активирующие или замедляющие средства, совместимые с фармацевтическим введением. Фармацевтические композиции или фармацевтические составы, таким образом, относятся к композиции, подходящей для фармацевтического применения на субъекте. Фармацевтические композиции и составы включают некоторое количество описываемого в настоящем документе соединения и фармацевтически или физиологически приемлемый носитель.
Композиции могут быть составлены в такую смесь, чтобы она была совместима с конкретным путем введения (т.е. системным или локальным). Таким образом, композиции включают носители, разбавители или вспомогательные средства, подходящие для введения различными путями.
В соответствии с другим вариантом осуществления композиции могут дополнительно содержать, при необходимости, приемлемую добавку для улучшения стабильности соединений в композиции и/или контроля скорости высвобождения композиции. Приемлемые добавки не изменяют специфичную активность рассматриваемых соединений. Иллюстративные приемлемые добавки включают без ограничения сахар, такой как маннит, сорбит, глюкоза, ксилит, трегалоза, сорбоза, сахароза, галактоза, декстран, декстроза, фруктоза, лактоза и их смеси. Приемлемые добавки можно комбинировать с приемлемыми носителями и/или вспомогательными средствами, такими как декстроза. Альтернативно, иллюстративные приемлемые добавки включают без ограничения поверхностно-активное вещество, такой как полисорбат 20 или полисорбат 80 для повышения стабильности пептида и понижения гелеобразование раствора. Поверхностно-активное вещество можно добавлять к композиции в количестве от 0,01% до 5% раствора. Добавление таких приемлемых добавок увеличивает стабильность и половину ожидаемого срока хранения композиции при хранении.
В соответствии с одним вариантом осуществления композиция может содержать изотонический буфер, такой как фосфатный, ацетатный или TRIS буфер в комбинации с регулирующим тоничность средством, таким как полиол, сорбит, сахароза или хлорид натрия, которые регулируют тоничность и стабилизируют. Регулирующее тоничность средство может присутствовать в композиции в количестве, составляющем приблизительно 5%.
В соответствии с другим вариантом осуществления композиция может включать поверхностно-активное вещество, например, для предупреждения агрегации и для стабилизации, в количестве от 0,01 до 0,02% масс./объем.
В соответствии с другим вариантом осуществления рН композиции может варьировать 4,5-6,5 или 4,5-5,5.
Другие иллюстративные описания фармацевтических композиций для антитела можно обнаружить, например, в US 2003/0113316 и патенте США №6171586, каждый из которых включен в настоящий документ при помощи ссылки в полном их объеме.
Композиция по настоящему изобретению может также содержать более одного активного соединения, при необходимости для конкретного подвергаемого лечению признака, такого как соединения с дополняющими активностями, которые оказывают неблагоприятного действия друг на друга. Например, способ лечения может дополнительно предусматривать иммуносупрессирующее средство. Такие молекулы предпочтительно присутствуют в комбинации в количествах, которые являются эффективными для достижения поставленной цели.
Активные ингредиенты также могут быть заключены в микрокапсулу, полученную, например, с помощью методик коацервации или с помощью полимеризации на границе раздела фаз, например, гидроксиметилцеллюлозную или желатиновую микрокапсулу и поли-(метилметакрилатную) микрокапсулу, соответственно, в коллоидных системах для доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методики раскрыты в работе Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Также настоящим изобретением предусмотрены суспензии и кристаллические формы антител; способы получения суспензий и кристаллических форм известны специалисту в настоящей области техники.
Композиция, подлежащая применению для введения in vivo, должна быть стерильной. В соответствии с некоторыми вариантами осуществления композиции по настоящему изобретению можно стерилизовать посредством традиционных, хорошо известных методик стерилизации. Например, стерилизацию можно легко осуществить при помощи фильтрации через стерильные фильтрационные мембраны. Полученные в результате растворы можно упаковывать для применения или фильтровать в асептических условиях и лиофилизировать, при этом лиофилизированный препарат перед введением объединяют со стерильным раствором.
Сушку вымораживанием можно использовать для стабилизации полипептидов для длительного хранения, например, если полипептид является относительно нестабильным в жидких композициях. Цикл лиофилизации обычно состоит из трех этапов: заморозка, первичная сушка и вторичная сушка; Williams and Polli, Journal of Parenteral Science and Technology, Volume 38, Number 2, pages 48-59 (1984). На этапе заморозки раствор охлаждают до его надлежащего замерзания. На этом этапе объемная вода в растворе формирует лед. Лед сублимируется на этапе первичной сушки, которую осуществляют посредством уменьшения давления в камере ниже давления водяного пара льда при помощи вакуума. Наконец, сорбированную и связанную воду удаляют на этапе вторичной сушки под сниженным давлением в камере и повышенной температуры полки. В результате осуществления такого способа получают материал, известный как лиофилизированная таблетка. Впоследствии таблетку можно ресуспендировать перед применением. Стандартная практика восстановления для лиофилизированного материала заключается в обратном добавлении некоторого объема чистой воды (обычно эквивалентного объему, удаленному при лиофилизации), хотя иногда применяют разбавленные растворы противомикробных средств при получении фармацевтических препаратов для парентерального введения; Chen, Drug Development and Industrial Pharmacy, Volume 18, Numbers 11 and 12, pages 1311-1354 (1992).
Некоторые вспомогательные средства, такие как, например, полиолы (включая маннит, сорбит и глицерин), сахара (включая глюкозу и сахарозу) и аминокислоты (включая аланин, глицин и глутаминовую кислоту), могут играть роль стабилизаторов для лиофилизированных продуктов; см., например, Carpenter et al., Developments in Biological Standardization, Volume 74, pages 225-239 (1991). Полиолы и сахара также можно применять для защиты полипептидов от повреждения, индуцированного заморозкой и сушкой и для повышения стабильности при хранении в высушенном состоянии. Сахара могут быть эффективными как в процессе сушки вымораживанием, так и на протяжении хранения. В качестве стабилизаторов лиофилизированных продуктов были описаны другие классы молекул, включая моно- и дисахариды и полимеры, такие как ΡVP.
Для инъекции композиция и/или лекарственный препарат могут представлять собой порошок, подходящий для восстановления при помощи соответствующего раствора, как описано выше. Их примеры включают без ограничения высушенные заморозкой, высушенные в барабанной сушилке или высушенные распылением порошки, аморфные порошки, гранулы, осадки или твердые частицы. Для инъекции композиции необязательно могут содержать стабилизаторы, модификаторы рН, поверхностно-активные вещества, модификаторы биодоступности и их комбинации.
Можно получить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, причем такие матрицы имеют форму изделий с определенной формой, например, пленки или микрокапсула. Примеры матрицы с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (см., например, патент США №3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагающийся этиленвинилацетат, разлагающиеся сополимеры молочной кислоты и гликолевой кислоты, такие как Lupron Depot™ (вводимые инъекцией микросферы, состоящие из сополимеров молочной кислоты и гликолевой кислоты и лейпролидацетата), и поли-D-(-)-3-гидроксимасляной кислоты. Несмотря на то, что такие полимеры, как этиленвинилацетат и сополимер молочной кислоты и гликолевой кислоты, делают возможным высвобождение молекул на протяжении 100 дней, определенные гидрогели высвобождают белки за более короткие промежутки времени. Несмотря на то, что инкапсулированные антитела сохраняются в организме на протяжении длительного времени, они могут денатурировать и образовывать агрегаты в результате воздействия влаги при 37°С, что приводит в результате к утрате биологической активности и возможным изменениям иммуногенности. Можно разработать рациональные стратегии стабилизации в зависимости от задействуемого механизма. Например, если было обнаружено, что механизм агрегации заключается в образовании межмолекулярной связи S-S в результате тио-дисульфидного обмена, то стабилизацию можно осуществить посредством модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контроля содержания влаги, применения соответствующих добавок и разработки специальных полимерных матричных композиций.
Описываемую в настоящем документе композицию можно разработать как быстродействующую, с быстрым высвобождением, долгодействующую или с замедленным высвобождением, как описано в настоящем документе. В соответствии с одним вариантом осуществления композицию можно составить в смесь для контролируемого высвобождения или для медленного высвобождения.
Фармацевтическую композицию можно вводить, например, посредством инъекции, включая без ограничения подкожную, интравитреальную, внутрикожную, внутривенную, внутриартериальную, внутрибрюшинную, интрацереброспинальную или внутримышечную инъекцию. Настоящим изобретением предусмотрены вспомогательные средства и носители для применения в составе композиции для каждого типа инъекции. Приведенные далее описания предназначены лишь для примера и не предназначены для ограничения диапазона возможных вариантов композиций. Композиции для инъекции включают без ограничения водные растворы (в случае водорастворимых) или дисперсии, а также стерильные порошки для приготовленного для немедленного приема препарата стерильных вводимых инъекцией растворов или дисперсии. Для внутривенного введения подходящие носители включают физиологический раствор, бактериостатическую воду, Cremophor EL™ (BASF, Парсиппани, Нью-Джерси) или фосфатно-солевой буферный раствор (PBS). Носитель может представлять собой растворитель или диспергирующую среду, содержащие, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и пригодные с ними смеси. Текучесть можно сохранять, например, посредством применения покрытия, такого как лецитин, посредством сохранения требуемого размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ. Противобактериальные и противогрибковые средства включают, например, парабены, хлоробутанол, фенол, аскорбиновую кислоту и тимеросал. В композицию могут быть включены изотонические средства, например, сахара, полиспирты, такие как маннит, сорбит и хлорид натрия. Полученные в результате растворы можно упаковывать для применения как есть или в лиофилизированном виде; лиофилизированный препарат позже можно объединить со стерильным раствором перед введением. Для внутривенной инъекции или инъекции в место повреждения активный ингредиент будет находиться в форме парентерально приемлемого водного раствора, который является апирогенным и имеет подходящий рН, изотоничность и стабильность. Специалисты в настоящей области техники без труда смогут приготовить подходящие растворы при помощи, например, изотонических наполнителей, таких как инъекционный раствор хлорида натрия, инъекционный раствор Рингера, инъекционный раствор Рингера с лактатом. При необходимости могут быть включены консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки. Стерильные растворы для инъекций можно приготовить посредством включения активного ингредиента в требуемом количестве в соответствующем растворителе с одним или комбинацией ингредиентов, перечисленных выше, с последующей стерилизацией фильтрацией в случае необходимости. Обычно дисперсии готовят посредством включения активного ингредиента в стерильный наполнитель, который содержит основную диспергирующую среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций предпочтительными способами получения являются вакуумная сушка и сушка вымораживанием, которые на выходе дают порошок активного ингредиента плюс любой дополнительный требуемый ингредиент из предварительно простерилизованного фильтрацией раствора с ним.
Композиции традиционно можно вводить интравитреально, подкожно или с помощью интравитреального имплантата.
Композиции традиционно можно вводить внутривенно, как, например, посредством инъекции однократной дозы. Для инъекции активный ингредиент может находиться в форме парентерально приемлемого водного раствора, который является практически апирогенным и имеет подходящий рН, изотоничность и стабильность. Можно приготовить подходящие растворы при помощи, например, изотонических наполнителей, таких как инъекционный раствор хлорида натрия, инъекционный раствор Рингера, инъекционный раствор Рингера с лактатом. По желанию можно включить консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки. Дополнительно, композиции можно вводить путем распыления в виде аэрозоля. (Lahn et al., Aerosolized Anti-T-cell-Receptor Antibodies Are Effective against Airway Inflammation and Hyperreactivity, Int. Arch. Allergy Immuno., 134: 49-55 (2004)).
В соответствии с одним вариантом осуществления композицию лиофилизируют, например, для повышения длительности хранения на складе. При рассмотрении композиций для применения в лекарственных препаратах или любых способах, приведенных в настоящем документе, предполагают, что композиции могут быть практически апирогенными с тем, чтобы композиция не вызывала воспалительную реакцию или опасную аллергическую реакцию при введении человеку. Испытание композиций в отношении пирогенов и получение апирогенных практически композиций будут понятны любому специалисту в настоящей области, и это можно выполнить при помощи коммерчески доступных наборов.
Приемлемые носители могут содержать соединение, которое стабилизирует, повышает или задерживают поглощение или выведение. Такие соединения включают, например, углеводы, такие как глюкоза, сахароза или декстраны; низкомолекулярные белки; композиции, которые уменьшают выведение или гидролиз пептидов; или вспомогательные средства или другие стабилизаторы и/или буферы. Средства, которые задерживают поглощение, включают, например, моностеарат алюминия и желатин. Для стабилизации или повышения или понижения поглощения фармацевтической композиции также можно применять детергенты, включая липосомальные носители. Для защиты от расщепления соединение можно включить в комплекс с композицией для придания ему устойчивости к кислотному или ферментативному гидролизу или соединение можно включить в комплекс с соответствующим устойчивым носителем, таким как липосома. Способы защиты соединений от расщепления известны из уровня техники (см., например, Fix (1996) Pharm Res. 13:1760 1764; Samanen (1996) J. Pharm. Pharmacol. 48:119 135; и патент США №5391377, описывающий жидкие композиции для пероральной доставки терапевтических средств).
Фраза "фармацевтически приемлемый" относится к молекулярным объектам и композициям, которые являются физиологически допустимыми и обычно не инициируют аллергическую или подобного рода нежелательную реакцию, такую как расстройство желудка, головокружение и т.п., при введении человеку.
Термин "однократная доза" при применении в отношении терапевтической композиции относится к физически дискретным единицам, подходящим в качестве однократной дозировки для людей, причем каждая единица содержит заранее определенное количество активного вещества, рассчитанного для получения требуемого терапевтического эффекта в сочетании с требуемым разбавителем, т.е. носителем или наполнителем.
Композиции можно вводить способом, совместимым с дозированным составом, и в терапевтически эффективном количестве. Подлежащее введению количество зависит от подлежащего лечению субъекта, способности иммунной системы субъекта утилизировать активный ингредиент и необходимой степени связующей способности. Точные количества подлежащего введению активного ингредиента зависят от решения практикующего врача и являются специфичными для каждого индивидуума. Подходящие режимы для начального введения и бустер-дозы также могут изменяться, но характеризуются начальным введением с последующими повторными дозами через интервалы длительностью один или несколько часов посредством последующей инъекции или другого введения. Альтернативно, предусматривают непрерывное внутривенное вливание, которое является достаточным для поддержания концентраций в крови.
В соответствии с одним вариантом осуществления предусмотрено применение описываемых в настоящем документе композиций для получения лекарственного препарата для лечения описываемых в настоящем документе состояния, заболевания или нарушения. Лекарственные препараты можно составить в смесь на основе физических характеристик субъекта, нуждающегося в лечении, и можно составить в отдельный состав или множественные составы, основываясь на стадии состояния, заболевания или нарушения. Лекарственные препараты могут быть упакованы в подходящую упаковку с соответствующими этикетками для распространения в больницах и клиниках, причем этикетка служит для указания показаний к лечению субъекта, имеющего описываемое в настоящем документе заболевание. Лекарственные препараты могут быть упакованы в виде отдельной единицы или множественных единиц. С упаковками могут быть включены инструкции для дозировки и введения композиций, которые описаны ниже. Настоящее изобретение дополнительно относится к лекарственным средствам антитела к гепсидину или его связывание антиген-связывающего фрагмента, описываемым в настоящем документе выше, и фармацевтически приемлемому носителю.
Настоящее изобретение относится к композициям антител и их антиген-связывающих фрагментов, которые связывают гепсидин и включают такие, которые описаны в других разделах в настоящем документе. Антитела и их антиген-связывающие фрагменты, которые связывают гепсидин и которые описаны в настоящем документе, можно применять для лечения различных заболеваний и состояний, ассоциированных с гомеостазом железа.
Композицию (описываемые в настоящем документе антитело или антиген-связывающий фрагмент) можно вводить отдельно или в комбинации со второй композицией либо одновременно, либо последовательно, в зависимости от подлежащего лечению состояния. В соответствии с одним вариантом осуществления вторым терапевтическим средством лечения является стимулятор эритропоэза. При введении двух или более композиций композиции можно вводить в комбинации (либо последовательно, либо одновременно). Композицию можно вводить одной дозой или множественными дозами.
При составлении в смесь для введения людям композиции можно составлять в качестве апирогенных. Испытание композиций в отношении пирогенов и получение апирогенных фармацевтических композиций будут понятны любому специалисту в настоящей области.
Один вариант осуществления предусматривает применение любой из композиций по настоящему изобретению для получения лекарственного препарата для лечения нарушения по настоящему изобретению. Лекарственные препараты могут быть составлены на основе физических характеристик субъекта, нуждающегося в лечении, и можно составить в отдельный состав или множественные составы, основываясь на нарушении. Лекарственные препараты по настоящему изобретению могут быть упакованы в подходящую фармацевтическую упаковку с соответствующими этикетками для распространения в больницах и клиниках, причем этикетка служит для указания показаний к лечению описанного в настоящем документе нарушения у субъекта.
Лекарственные препараты могут быть упакованы в виде отдельной единицы или множественных единиц. С фармацевтическими упаковками могут быть включены инструкции для дозировок и введения фармацевтических композиций по настоящему изобретению.
Диагностика
Настоящее изобретение относится к способу диагностики гепсидин-опосредованного нарушения, предусматривающему: (а) приведение в контакт биологического образца от субъекта, предположительно имеющего указанное нарушение, с описываемыми в настоящем документе антителом или его антиген-связывающим фрагментом в условиях, которые делают возможным связывание антитела или его антиген-связывающего фрагмента с гепсидином; и (b) детектирование и/или количественную оценку гепсидина, связавшегося с антителом или его антиген-связывающим фрагментом, причем количество гепсидина в образце, которое количественно оценивают на (b), выше порогового значения указывает на наличие гепсидин-опосредованного нарушения и ниже порогового значения указывает на отсутствие гепсидин-опосредованного нарушения.
Способ дифференцирования воспалительного заболевания от невоспалительного заболевания, предусматривающий: (а) приведение в контакт биологического образца от человека, предположительно имеющего указанное нарушение, с описываемыми в настоящем документе антителом или его антиген-связывающим фрагментом в условиях, которые делают возможным связывание антитела или его антиген-связывающего фрагмента с гепсидином; и (b) детектирование и/или количественную оценку гепсидина, связавшегося с антителом или его антиген-связывающим фрагментом, причем количество гепсидина, которое количественно оценивают на (b), выше порогового значения указывает на наличие воспалительного заболевания и ниже порогового значения указывает на отсутствие воспалительного заболевания.
В соответствии с одним вариантом осуществления антитело или антиген-связывающий фрагмент дополнительно содержат детектируемый фрагмент. Детектирование может происходить in vitro, in vivo или ex vivo. In vitro анализы для детектирования и/или определения (количественного, качественного определения и т.д.) гепсидина с антителами или их антиген-связывающими фрагментами включают без ограничения, например, ELISA, RIA и вестерн-блоттинг. In vitro детектирование, диагностику или мониторинг гепсидина можно осуществлять посредством получения образца (например, образца крови) от субъекта и испытания образца, например, в стандартном анализе ELISA.
Например, 96-луночный титрационный микропланшет можно покрыть при помощи описываемого в настоящем документе антитела или его антиген-связывающего фрагмента, промыть и покрыть при помощи PBS-Tween/BSA для ингибирования неспецифичного связывания. Образец крови можно серийно развести и внести в отдельные или дублированные лунки в сравнении со стандартной кривой серийно разведенного гепсидина. После инкубирования и промывания лунок можно добавить антитело к гепсидину, меченное при помощи биотина, с последующим добавлением стрептавидин-щелочной фосфатазы. Лунки можно промыть и добавить субстрат (пероксидазы хрена) для проявления планшета. Планшет можно считывать при помощи стандартного планшет-ридера и программного обеспечения.
При осуществлении детекции in vivo приведение в контакт происходит с помощью введения антитела или антиген-связывающего фрагмента при помощи любых традиционных средств, таких как средства, описываемые в других разделах настоящего документа. В соответствии с такими способами детекцию гепсидина в образце или субъекте можно применять для диагностики заболевания или нарушения, ассоциированных ним или коррелирующих с его активностью, например, таких заболеваний и нарушений, которые описаны в настоящем документе.
При in vivo детекции, диагностике или мониторинге гепсидина субъекту вводят антитело или антиген-связывающий фрагмент, которые связываются с гепсидином, при этом антитело или антиген-связывающий фрагмент связаны с детектируемым фрагментом. Детектируемый фрагмент можно визуализировать при помощи известных в настоящей области техники способов, таких как без ограничения магнитно-резонансная томография (MRI), флуоресценция, радиоиммунная визуализация, источники освещения, подаваемые посредством эндоскопов, лапароскопов или сосудистых катетеров (т.е. путем детекции фотоактивных средств), фотосканирование, сканирование при помощи позитрон-эмиссионной томографии (PET), ядерный магнитный резонанс (NMR) всего тела, радиосцинтиграфия, однофотонная эмиссионная компьютерная томография (SPECT), целевое сканирование в ближнем ИК-диапазоне, рентгеновский анализ, ультразвук и т.д. такие как описанные, например, в патенте США №6096289, патенте США №7115716, патенте США №7112412, заявке на выдачу патента США №20030003048 и заявке на выдачу патента США №20060147379, каждый из которых включен в настоящий документ в полном их объеме при помощи ссылки. Метки для детектирования соединений при помощи таких способов также известны из уровня техники и описаны в таких патентах и заявках и включены в настоящий документ при помощи ссылки. Визуализация детектируемого фрагмента может предусматривать детектирование, диагностику и/или мониторинг ассоциированного с гепсидином состояния или заболевания.
Дополнительные диагностические анализы, в которых используют антитела, специфичные к требуемому белку-мишени, т.е. гепсидину, известны из уровня техники и также предусмотрены настоящим документом.
Для способов детектирования in vitro образцы, которые необходимо получить от субъекта, включают без ограничения образцы крови, биопсии ткани и жидкость из них.
Таким образом, настоящее изобретение относится к гуманизированным антителам и их антиген-связывающим фрагментам к гепсидину, которые пригодны для детектирования или диагностирования уровней гепсидина, ассоциированных с заболеванием или нарушением, потенциально указывающих на необходимость терапевтического лечения. В соответствии с некоторыми вариантами осуществления антитела представляют собой описываемое в настоящем документе гуманизированное антитело к гепсидину. В соответствии с другими вариантами осуществления антитело дополнительно содержит второе средство. Такое средство может представлять собой молекулу или фрагмент, такой как, например, репортерная группа или детектируемая метка. Детектируемые метки/фрагменты для таких способов детектирования известны из уровня техники и описаны более подробно ниже. Репортерные группы представляют собой любой фрагмент, которые можно детектировать при помощи анализа. Неограничивающие примеры репортерных групп, которые были конъюгированы с полипептидами, включают ферменты, радиоактивные метки, гаптены, флуоресцентные метки, фосфоресцентные молекулы, хемилюминесцентные молекулы, хромофоры, люминесцентные молекулы, фотоаффинные молекулы, окрашенные частицы или лиганды, такие как биотин. Детектируемые метки включают соединения и/или элементы, которые можно детектировать за счет их специфичных функциональных свойств и/или химических характеристик, применение которых делает возможным детектирование полипептида, к которому они прикреплены, и/или, при необходимости, дополнительную количественную оценку. Большое количество детектируемых (визуализируемых) средств известно из уровня техники, как и способы их прикрепления к полипептидам (см., например, патент США №№5021236, 4938948 и 4472509, каждый из которых включен, таким образом, при помощи ссылки).
Способы соединения полипептидов, таких как антитела с детектируемыми фрагментами, известны из уровня техники и предусматривают, например, методику рекомбинантной ДНК для формирования белков слияния и конъюгацию (например, химическую конъюгацию). Способы получения белков слияния посредством химической конъюгации или рекомбинантной инженерии хорошо известны из уровня техники. Способы ковалентного или нековалентного связывания компонентов также известны из уровня техники. См., например, Williams (1995) Biochemistry 34:1787 1797; Dobeli (1998) Protein Expr. Purif. 12:404-414; и Kroll (1993) DNA Cell. Biol. 12: 441-453.
В некоторых случаях может быть необходимо введение неструктурированного полипептидного линкерного участка между меткой или фрагментом и одной или несколькими частями антител, антиген-связывающих фрагментов или белков связывания, описываемых в настоящем документе. Линкер может способствовать усилению пластичности и/или уменьшать стерическое несоответствие между любыми двумя фрагментами. Линкер также может способствовать прохождению соответствующего сворачивания каждого фрагмента. Линкер может иметь природное происхождение, такое как последовательность, определяемая как существующая в случайной спирали между двумя доменами белка. Одна линкерная последовательность представляет собой линкер, обнаруживаемый между С-концевым и N-концевым доменами субъединицы РНК-полимеразы. Другие примеры встречающихся в природе линкеров включают линкеры, обнаруживаемые в белках 1CI и LexA.
В линкере аминокислотная последовательность может варьировать, исходя из характеристик линкера, что определяют эмпирически или что выявляют при моделировании. Факторы при выборе линкера включают гибкость линкера, заряд линкера и наличие некоторых аминокислот линкера во встречающихся в природе субъединицах. Линкер также можно сконструировать таким, чтобы остатки в линкере контактировали с дезоксирибонуклеиновой кислотой (ДНК), таким образом оказывая влияние на аффинность связывания или специфичность или на взаимодействие с другими белками. В некоторых случаях, таких как в случае необходимости перекрытия более длинного расстояния между субъединицами или в случае необходимости удерживания доменов в конкретной конформации, линкер необязательно может содержать дополнительный свернутый домен. В соответствии с некоторыми вариантами осуществления схема линкера может предусматривать расположение доменов, которое необходимо для того, чтобы линкер перекрывал относительно короткое расстояние, например, менее приблизительно 10 ангстремов ( ). Однако, в соответствии с конкретными вариантами осуществления линкеры перекрывают расстояние до приблизительно 50 ангстремов.
). Однако, в соответствии с конкретными вариантами осуществления линкеры перекрывают расстояние до приблизительно 50 ангстремов.
В линкере аминокислотная последовательность может варьировать, исходя из характеристик линкера, что определяют эмпирически или что выявляют при моделировании. Факторы при выборе линкера включают гибкость линкера, заряд линкера и наличие некоторых аминокислот линкера во встречающихся в природе субъединицах. Линкер также можно сконструировать таким, чтобы остатки в линкере контактировали с ДНК, таким образом оказывая влияние на аффинность связывания или специфичность или на взаимодействие с другими белками. В некоторых случаях, в случае необходимости перекрытия более длинного расстояния между субъединицами или в случае необходимости удерживания доменов в конкретной конформации, линкер необязательно может содержать дополнительный свернутый домен.
Способы соединения полипептидов (вне клеток или связанных к клеткой) с гранулами известны из уровня техники. Способы отбора соединенных полипептидов или клеток, несущих полипептиды, также известны из уровня техники. Если кратко, парамагнитные полистироловые микрочастицы являются коммерчески доступными (Spherotech, Inc., Либертивилл, Иллинойс; Invitrogen, Карлсбад, Калифорния), которые связывают пептиды с поверхностями микрочастиц, которые были модифицированы при помощи функциональных групп или покрыты различными антителами или лигандами, такими как, например, авидин, стрептавидин или биотин.
Парамагнитное свойство микрочастиц делает возможным их отделение от раствора при помощи магнита. Микрочастицы можно легко ресуспендировать при удалении с магнита. Полипептиды можно соединить в пробирке с парамагнитными полистироловыми микрочастицами, покрытыми полиуретановым слоем. Гидрокси-группы на поверхности микрочастиц активируют при помощи реакции с п-толуолсульфонилхлоридом (Nilsson K and Mosbach K. "p-Toluenesulfonyl chloride as an activating agent of agarose for the preparation of immobilized affinity ligands and proteins". Eur. J. Biochem. 1980:112: 397-402). Альтернативно, парамагнитные полистироловые микрочастицы, содержащие на поверхности карбоновую кислоту, можно активировать при помощи карбодиимида с последующим соединением с полипептидом, что приводит в результате к образованию устойчивой амидной связи между первичной аминогруппой полипептида и группами карбоновой кислоты на поверхности микрочастиц (Nakajima N and Ikade Y, Mechanism of amide formation by carbodiimide for bioconjugation in aqueous media, Bioconjugate Chem. 1995, 6(1): 123-130; Gilles MA, Hudson AQ and Borders CL Jr, Stability of water-soluble carbodiimides in aqueous solution, Anal Biochem. 1990 Feb 1; 184(2):244-248; Sehgal D and Vijay IK, a method for the high efficiency of water-soluble carbodiimide-mediated amidation, Anal Biochem. 1994 Apr; 218(1):87-91; Szajani В et al., Effects of carbodiimide structure on the immobilization of enzymes, Appl Biochem Biotechnol. 1991 Aug; 30(2): 225-231). Другой вариант заключается в соединении биотинилированных полипептидов с парамагнитными полистироловыми микрочастицами, поверхности которых были ковалентно связаны с монослоем стрептавидина. (Argarana CE, Kuntz ID, Birken S, Axel R, Cantor CR. Molecular cloning and nucleotide sequence of the streptavidin gene. Nucleic Acids Res. 1986; 14(4): 1871-82; Pahler A, Hendrickson WA, Gawinowicz Kolks MA, Aragana CE, Cantor CR. Characterization and crystallization of core streptavidin. J Biol Chem 1987:262(29): 13933-13937).
Полипептиды могут быть конъюгированы с широким спектром флуоресцентных красителей, гасителями люминесценции и гаптенами, такими как флуоресцеин, R-фикоэритрин и биотин. Конъюгация может происходить либо в ходе синтеза полипептида, либо после синтеза и очистки полипептида. Биотин представляет собой небольшой (244 килодальтона) витамин, который связывается с высокой аффинностью с авидиновыми и стрептавидиновыми белками и может быть конъюгирован с большинством пептидов без изменения их биологических активностей. Помеченные биотином полипептиды легко очищаются от немеченных полипептидов при помощи иммобилизированных аффинных гелей стрептавидина и авидина, зонды, конъюгированные со стрептавидином или авидином, можно применять для детектирования биотинилированных полипептидов, например, в ELISA, дот-блоттинге или вестерн-блоттинге. Сложные N-гидроксисукцинимидные эфиры биотина являются наиболее часто применяемым типом биотинилирующего средства. N-гидроксисукцинимид-активированные биотины эффективно вступают в реакцию с первичными аминогруппами в физиологических буферах с формированием устойчивых амидных связей. Полипептиды имеют первичные амины на N-конце и также могут иметь несколько первичных аминов в боковой цепи лизиновых остатков, которые доступны в качестве мишеней для мечения при помощи N-гидроксисукцинимид-активированных биотиновых реактивов. Доступно несколько различных сложных N-гидроксисукцинимидных эфиров биотина с различными свойствами и длиной спейсера (Pierce, Рокфорд, Иллинойс). Реактивы сложного сульфо-N-гидроксисукцинимидного эфира растворимы в воде, что делает возможным проведение реакции в отсутствии органических растворителей.
Молярное соотношение биотина к полипептиду можно рассчитать при помощи анализа с применением 2-(4'-гидроксиазобензол-2-карбоновой кислоты) при помощи методик, известных из уровня техники (Green, NM, (1975) "Avidin. In Advances in Protein Chemistry". Academic Press, New York. 29, 85-133; Green, NM, (1971) "The use of bifunctional biotinyl compounds to determine the arrangement of subunits in avidin". Biochem J. 125, 781-791; Green, NM., (1965) "A spectrophotometric assay for avidin and biotin based on binding of dyes by avidin". Biochem. J. 94: 23c-24c). С полипептидом могут быть конъюгированы несколько биотиновых молекул, и каждая биотиновая молекула может связывать одну молекулу авидина. Образование связи биотин-авидин является очень быстрым и стабильным в органических растворителях, крайних рН и денатурирующих реактивах. Для количественной оценки биотинилирования раствор, содержащий биотинилированный полипептид, добавляют к смеси из 2-(4'-гидроксиазобензол-2-карбоновой кислоты) и авидина. Поскольку биотин имеет более высокую аффинность к авидину он вытесняет 2-(4'-гидроксиазобензол-2-карбоновую кислоту) и пропорционально снижает поглощение на 500 нанометрах. Количество биотина в растворе можно количественно оценить в отдельной кювете посредством измерения поглощения у раствора 2-(4'-гидроксиазобензол-2-карбоновая кислота)-авидин до и после добавления биотин-содержащего пептида. Изменение поглощения связано с количеством биотина в образце коэффициентом ослабления комплекса 2-(4'-гидроксиазобензол-2-карбоновая кислота)-авидин.
Альтернативно, антитело, антиген-связывающий фрагмент или белок связывания можно конъюгировать с флуоресцентным фрагментом. Конъюгирование полипептидов с флуоресцентными фрагментами (например, R-фикоэритрином, флюоресцеинизотиоцианатом (FITC) и т.д.) можно выполнить при помощи методик, известных из уровня техники, описанных, например, в работе Glazer, AN and Stryer L. (1984). Trends Biochem. Sci. 9:423-7; Kronick, MN and Grossman, PD (1983) Clin. Chem. 29:1582-6; Lanier, LL and Loken, MR (1984) J. Immunol., 132:151-156; Parks, DR et al. (1984) Cytometry 5:159-68; Hardy, RR et al. (1983) Nature 306:270-2; Hardy RR et al (1984) J. Exp. Med. 159:1169-88; Kronick, MN (1986) J. Immuno. Meth. 92:1-13; Der-Balian G, Kameda, N and Rowley, G. (1988) Anal. Biochem. 173:59-63.
В соответствии с одним неограничивающим вариантом осуществления, антитело антиген-связывающий фрагмент может быть ассоциирован с (конъюгирован с) детектируемой меткой, такой как радионуклид, железосодержащее соединение, краситель, визуализирующее средство или флуоресцентное средство для иммунологической детекции гепсидина, которые можно применять для визуализации связывания антител с гепсидином in vitro и/или in vivo.
Неограничивающие примеры радиоактивных меток включают, например, 32Ρ, 33Р, 43K, 52Fe, 57Со, 64Cu, 67Ga, 67Cu, 68Ga, 71Ge, 75Br, 76Br, 77Br, 77As, 77Br, 81Rb/81MKr, 87MSr, 90Y, 97Ru, 99Tc, 100Pd, 101Rh, 103Pb, 105Rh, 109Pd, 111Ag, 111In, 113In, 119Sb, 121Sn, 123I, 125I, 127Cs, 128Ba, 129Cs, 131I, 131Cs, 143Pr, 153Sm, 161Tb, 166Ho, 169Eu, 177Lu, 186Re, 188Re, 189Re, 191Os, 193Pt, 194Ir, 197Hg, 199Au, 203Pb, 211At, 212Pb, 212Bi и 213Bi. Радиоактивные метки можно прикреплять к соединениям при помощи традиционного химического способа, известного из области визуализации антитела. Соединения с радиоактивными метками пригодны в методиках диагностики in vitro и в методиках радиоиммунной визуализации in vivo и в радиоиммунотерапии.
В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент могут быть конъюгированы как с терапевтическим фрагментом, так и с детектируемым фрагментом. Антитело или его антиген-связывающий фрагмент могут быть конъюгированы или рекомбинантно сконструированы с аффинной меткой (например, меткой для очистки). Аффинные метки, такие как, например, метки His6 (SEQ ID NO: 28), являются традиционными в настоящей области техники.
Антитела или их антиген-связывающие фрагменты по настоящему изобретению являются такими, чтобы их можно было конъюгировать или связывать с терапевтическим фрагментом, и/или визуализирующим или детектируемым фрагментом, и/или аффинной меткой. Способы конъюгирования или связывания полипептидов хорошо известны из уровня техники. Ассоциации (связывание) между соединениями и метками включают любые способы, известные в настоящей области техники, включая без ограничения ковалентные и нековалентные взаимодействия, химическую конъюгацию, а также рекомбинантные методики.
Способы лечения
Настоящее изобретение относится к способу индуцирования реакции у субъекта (человека или другого животного) посредством введения субъекту композиции антитела или его антиген-связывающего фрагмента, которые связываются с гепсидином. Сайт связывания, с которым связывается антитело, может быть секвенциальным или конформационным/прерывистого типа эпитопом. В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с эпитопом, содержащим аминокислотные остатки 1-9 гепсидина. В соответствии с другим вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с 2, 3, 4, 5, 6, 7, 8, или 9 аминокислотными остатками эпитопа, содержащего аминокислотные остатки 1-9 гепсидина. В соответствии с еще одним вариантом осуществления антитело или его антиген-связывающий фрагмент специфично связываются с Нер-20, Нер-22 и Нер-25.
Гепсидин может иметь аминокислотную последовательность, например, SEQ ID NO: 19. Пептид гепсидина может иметь аминокислотную последовательность, например, с любой из SEQ ID NO: 20-25. В соответствии с еще одним вариантом осуществления антитело или его антиген-связывающий фрагмент связываются с аминокислотной последовательностью, изложенной в любой из пептидных SEQ ID NO, описываемых в настоящем документе, включая, например, SEQ ID NO: 19-27.
Эффективная реакция по настоящему изобретению достигается тогда, когда субъект испытывает частичное или полное облегчение или уменьшение признаков или симптомов болезни, и, в частности, включает без ограничения пролонгирование продолжительности существования. Ожидаемые периоды времени выживаемости без прогрессирования могут измерятся от нескольких месяцев до нескольких лет, в зависимости от прогностических факторов, включающих число рецидивов, стадию заболевания и другие факторы. Пролонгирование продолжительности существования включает без ограничения периоды времени, составляющие по меньшей мере 1 месяц (мес.), приблизительно по меньшей мере 2 мес., приблизительно по меньшей мере 3 мес., приблизительно по меньшей мере 4 мес., приблизительно по меньшей мере 6 мес., приблизительно по меньшей мере 1 год, приблизительно по меньшей мере 2 года, приблизительно по меньшей мере 3 года, и т.д. Общая продолжительность существования также может измеряться от нескольких месяцев до нескольких лет. Альтернативно, эффективная реакция может быть такой, при которой симптомы субъекта остаются неизменными. Дополнительные показания к лечению признаков описаны более подробно ниже.
Композиции описываемых в настоящем документе антител и антиген-связывающих фрагментов можно применять в качестве нетерапевтических средств (например, в качестве средств для аффинной очистки). Обычно, в соответствии с одним таким вариантом осуществления представляющий интерес белок иммобилизируют на твердой фазе, такой как смола сефадекс или фильтровальная бумага, при помощи традиционных способов, известных в настоящей области техники. Иммобилизированный белок подвергают контакту с образцом, содержащим представляющую интерес мишень (или ее фрагмент) для очистки, а после этого подложку промывают при помощи подходящего растворителя, который будет удалять практически весь материал в образце за исключением белка-мишени, который связан с иммобилизированным антителом. Наконец, подложку промывают при помощи другого подходящего растворителя, такого как глициновый буфер, рН 5,0, который будет высвобождать белок-мишень. Помимо очистки, композиции можно применять для детектирования, диагностики и терапии описываемых в настоящем документе заболеваний и нарушений.
Применяемый в настоящем документе термин "приведение в контакт" относится к совместному добавлению раствора или композиции соединения к жидкой среде, содержащей полипептиды, клетки, ткань или орган из организма. Альтернативно, "приведение в контакт" относится к совместному смешиванию раствора или композиции соединения с такой жидкостью, как кровь, сыворотка крови или плазма крови, полученные из организма. Для применений in vitro композиция также может содержать другой компонент, такой как диметилсульфоксид (DMSO). DMSO способствует поглощению соединений или растворимости соединений. Раствор, содержащий испытываемое соединение, можно добавлять в среду, содержащую клетки, ткани или органы, или смешивать с другой жидкостью, такой как кровь, посредством использования механизма для доставки, такого как устройство по типу пипетки или устройство по типу шприца. Для применений in vivo приведение в контакт может происходить, например, посредством введения композиции субъекту любыми подходящими способами; композиции с фармацевтически приемлемыми вспомогательными средствами и носителями были описаны более подробно выше.
"Субъект" (например, млекопитающее, такое как человек или другое животное, такое как примат, грызун, корова, лошадь, свинья, овца и т.д.) в соответствии с одним вариантом осуществления настоящей заявки представляет собой млекопитающее, у которого наблюдают одно или несколько клинических проявлений и/или симптомов описываемых в настоящем документе заболевания или нарушения.
Описываемую в настоящем документе композицию можно вводить субъекту в терапевтически эффективном количестве, которое является эффективным для получения некоторого требуемого терапевтического эффекта посредством ингибирования заболевания или нарушения, такого как описанное в настоящем документе, которое может быть ассоциировано с гепсидином, в целесообразном соотношении польза/риск, применимым к любому терапевтическому лечению. Для введения настоящих композиций людям композиции можно составлять посредством методик, известных рядовому специалисту в настоящей области. Терапевтически эффективное количество является количеством, при котором по меньшей мере частично достигается требуемый терапевтический или профилактический эффект в органе или ткани. Количество антитела к гепсидину или его антиген-связывающего фрагмента, необходимое для осуществления предупреждения и/или терапевтического лечения заболевания или нарушения, не является фиксированным per se. Вводимое количество антитела к гепсидину или его антиген-связывающего фрагмента может варьировать в зависимости от типа заболевания, обширности заболевания и размера млекопитающего, страдающего от заболевания или нарушения. В соответствии с одним вариантом осуществления два или более описываемых в настоящем документе антител к гепсидину вводят субъекту в комбинации. Комбинация предусматривает одновременное или последовательное введение антител.
"Введение" определяют в настоящем документе как способы доставки композиции субъекту таким образом, который приводит в результате к тому, что композиция попадает внутрь организма субъекта. Такое введение можно осуществлять любым путем, включая без ограничения локально, регионально или системно посредством подкожного, интравитреального, внутрикожного, внутривенного, внутриартериального, внутрибрюшинного, интрацереброспинального или внутримышечного введения (например, инъекции). "Одновременное введение" означает введение за относительно короткий промежуток времени друг от друга; такой период может составлять менее 2 недель, менее 7 дней, менее 1 дня и даже может представлять собой синхронное введение.
Актуальные уровни дозировки активных ингредиентов в композициях могут варьировать так, чтобы получать количество активного ингредиент, которое является эффективным для достижения требуемой терапевтической реакции для конкретного субъекта, композиции и способа введения, при этом не являясь токсичным для субъекта. Выбранный уровень дозировки будет зависеть от множества факторов, включая активность конкретного используемого соединения, путь введения, время введения, скорость выведения конкретного используемого соединения, длительности лечения, другие лекарственные средства, соединения и/или материалы, применяемые в комбинации с конкретной используемой композицией, возраст, пол, массу, состояние, общее состояние здоровья и историю болезни подвергаемого лечению субъекта, и подобные факторы хорошо известны в области медицины.
Описываемые в настоящем документе антитела и антиген-связывающие фрагменты можно вводить субъекту различными количествами дозирования и через различные временные периоды. Неограничивающие дозы включают приблизительно 0,01 мг/кг, приблизительно 0,05 мг/кг, приблизительно 0,1 мг/кг, приблизительно 0,5 мг/кг, приблизительно 1 мг/кг, приблизительно 5 мг/кг, приблизительно 10 мг/кг, приблизительно 20 мг/кг, приблизительно 30 мг/кг, приблизительно 40 мг/кг, приблизительно 50 мг/кг, приблизительно 60 мг/кг, приблизительно 70 мг/кг, приблизительно 80 мг/кг, приблизительно 90 мг/кг, приблизительно 100 мг/кг, приблизительно 125 мг/кг, приблизительно 150 мг/кг, приблизительно 175 мг/кг, приблизительно 200 мг/кг или любое целое число в промежуточном интервале. Кроме того, дозу (дозы) антитела или антиген-связывающего фрагмента можно вводить два раза в неделю, каждую неделю, каждые две недели, каждые три недели, каждые 4 недели, каждые 6 недель, каждые 8 недель, каждые 12 недель или в любой комбинации недель среди них. Также предусмотрены циклы дозирования, такие как, например, введение антител или их антиген-связывающих фрагментов один раз или два раза в неделю на протяжении 4 недель с последующими двумя неделями без терапии. Также настоящим изобретением предусмотрены дополнительные циклы дозирования, включающие, например, различные комбинации доз и еженедельные циклы, описываемые в настоящем документе.
Терапевтически эффективные количества композиции могут варьировать и зависеть от тяжести заболевания и массы и общего состояния субъекта, подвергаемого лечению, но обычно варьирует от приблизительно 1,0 мкг/кг до приблизительно 100 мг/кг массы тела, или от приблизительно 10 мкг/кг до приблизительно 30 мг/кг, или от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг, или от приблизительно 1 мг/кг до приблизительно 10 мг/кг за применение. Введение может быть ежедневным, в чередующиеся дни, раз в неделю, два раза в месяц, каждый месяц или более или менее часто, по необходимости в зависимости от реакции на нарушение или состояния и переносимостью субъектом терапии. Сохранение дозировок на протяжении более длинный промежуток времени, такой как 4, 5, 6, 7, 8, 10 или 12 недель или длиннее, может требоваться до тех пор, пока не произойдет требуемая супрессия симптомов нарушения, и в случае необходимости дозировки можно корректировать. Прогресс от такой терапии легко подвергать мониторингу посредством традиционных методик и анализов.
Конкретные дозировки можно корректировать в зависимости от состояний заболевания, возраста, массы тела, общего состояния здоровья, пола и рациона субъекта, интервалов получения дозы, путей введения, скорости выведения и комбинаций лекарственных средств. Любые вышеупомянутые лекарственные формы, содержащие эффективные количества, вполне находятся в пределах типичного эксперимента и, поэтому, вполне подпадают в рамки объема настоящего изобретения.
В соответствии с некоторыми вариантами осуществления средство для специфичного связывания или антитело по настоящему изобретению вводят внутривенно в физиологическом растворе в дозе, варьирующей от 0,01 мг/кг до 100 мг/кг, с частотой, варьирующей от ежедневной до каждую неделю до каждый месяц (например, каждый день, через день день, каждый третий день или 2, 3, 4, 5 или 6 раз в неделю), предпочтительно в дозе, варьирующей от 0,1 до 45 мг/кг, от 0,1 до 15 мг/кг или от 0,1 до 10 мг/кг, с частотой 2 или 3 раза в неделю, или до 45 мг/кг один раз в месяц.
"Приведение в контакт" обозначает в настоящем документе способ доставки композиции, который приведен в настоящем документе, в физиологическую близость с клеткой, органом, тканью или жидкостью, которые описаны в настоящем документе. Приведение в контакт охватывает системное или локальное введение любой из приведенных в настоящем документе композиций и включает без ограничения in vitro, in vivo и/или ex vivo процедуры и способы. "Объединение" и "приведение в контакт" применяют в настоящем документе взаимозаменяемо и понимают как одинаковое определение.
Описываемое в настоящем документе антитело можно вводить посредством любых подходящих способов, либо системно, либо локально, включая парентеральным, подкожным, внутрибрюшинным, интрацереброспинальным, внутрилегочным и внутриназальным введением и, по желанию, для локального лечения, внутриочаговым введением. Парентеральные пути включают внутривенное, внутриартериальное, внутрибрюшинное, эпидуральное, подоболочечное введение. Кроме того, средство специфичного связывания или антитело предпочтительно вводят импульсным вливанием, особенно при уменьшающихся дозах средства специфичного связывания или антитела. В соответствии с одним вариантом осуществления композиции можно вводить посредством инъекции в зависимости, отчасти, от того является ли введение краткосрочным или длительным. Предусмотрены другие типы способов введения, включая местное, в частности трансдермальное, трансмукозальное, ректальное, пероральное или локальное введение, например, через катетер, расположенный вблизи требуемого участка.
Реакция достигается тогда, когда субъект испытывает частичное или полное облегчение или уменьшение признаков или симптомов болезни, и, в частности, включает без ограничения пролонгирование продолжительности существования. Ожидаемые периоды времени выживаемости без прогрессирования могут измерятся от нескольких месяцев до нескольких лет, в зависимости от прогностических факторов, включающих число рецидивов, стадию заболевания и другие факторы. Пролонгирование продолжительности существования включает без ограничения периоды времени, составляющие по меньшей мере 1 месяц (мес.), приблизительно по меньшей мере 2 месяцев, приблизительно по меньшей мере 3 мес., приблизительно по меньшей мере 4 мес., приблизительно по меньшей мере 6 мес., приблизительно по меньшей мере 1 год, приблизительно по меньшей мере 2 года, приблизительно по меньшей мере 3 года или дольше. Общая продолжительность существования также может измеряться от нескольких месяцев до нескольких лет. Симптомы субъекта могут оставаться неизменными или могут уменьшаться.
Лечащий врач или ветеринар с рядовой квалификацией в настоящей области сможет легко определить и назначить эффективное количество (ED50) необходимой композиции. Например, лечащий врач или ветеринар может начать дозы соединений, используемые в композиции, на уровнях, которые ниже необходимых для достижения требуемого терапевтического эффекта, и постепенно повышать дозировку до тех пор, пока не будет достигнут требуемый эффект. Альтернативно, дозу можно сохранять неизменной.
Композиции можно вводить субъекту посредством любого традиционного пути, такого как описанные выше. Независимо от выбранного пути введения, соединения по настоящему изобретению, которые можно применять в подходящей гидратной форме, и/или композиции составляют в приемлемые лекарственные формы, такие как описанные ниже, или согласно другим традиционным способам, известным специалистам в настоящей области техники.
Антитела и/или другие средства можно комбинировать в отдельные композиции для одновременного или последовательного введения. В соответствии с одним вариантом осуществления одновременное введение предусматривает одну или несколько композиций, которые вводят в одно и то же время или в пределах 30 минут друг от друга. Введение можно производить в один и тот же участок или различные участки.
Токсичность и терапевтическую эффективность такого ингредиента можно определить посредством стандартных фармацевтических процедур в культурах клеток или на подопытных животных, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Соотношение доз между токсичными и терапевтическими эффектами представляет собой терапевтический индекс, и его можно выразить как соотношение LD50/ED50. Несмотря на то, что можно применять соединения, у которых наблюдают токсичные побочные эффекты, нужно обращать внимание на конструкцию системы доставки, которая целенаправленно подает такие соединения в участок пораженной ткани, для минимизации потенциального повреждения, наносимого здоровым клеткам, и, таким образом, уменьшения побочных эффектов.
Данные, полученные из анализов культуры клеток и исследований на животных, можно применять при составлении диапазона дозировок для применения на людях. Дозировка таких соединений предпочтительно лежит в диапазоне концентраций в кровотоке, которые включают ED50 с небольшой или отсутствующей токсичностью. Дозировки могут варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, применяемого согласно способу по настоящему изобретению, терапевтически эффективную дозу можно оценить изначально по результатам анализов культуры клеток. Дозу можно составить на животных моделях для достижения порядка концентраций в плазме кровотока, который включает IC50 (т.е. концентрации испытываемого соединения, которая достигает половину максимального ингибирования), которую определяют в культуре клеток. Можно измерить уровни в плазме, например, посредством высокоэффективной жидкостной хроматографии. Такую информацию можно применять для более точного определения подходящих для людей доз.
Применяемое в настоящем документе антитело или его антиген-связывающий фрагмент может являться антагонистом активности гепсидина, что означает вещество, которое ингибирует регулирующую уровень железа активность гепсидина.
В соответствии с одним аспектом антагонист активности гепсидина может представлять собой вещество, которое ингибирует функцию гепсидина, например, посредством ингибирования связывание между гепсидином и ферропортином, посредством ингибирования удерживания контролируемого гепсидином внутриклеточного железа или посредством облегчения зависимого от ферропортина транспорта железа. Антагонисты активности гепсидина включают антитела или их антиген-связывающие фрагменты, которые связывают гепсидин и ингибируют его активность. Антитело или его антиген-связывающий фрагмент может в некоторых случаях, связываться с ферропортином, но не активировать транспорт железа ферропортином.
В соответствии с другими вариантами осуществления описываемые в настоящем документе антитело или его антиген-связывающий фрагмент могут ингибировать (или нейтрализовать) регулирующую уровень железа активность гепсидина in vitro и/или также in vivo. Такие гепсидин-нейтрализующие антитела являются терапевтически пригодными в отношении гепсидин-опосредованных нарушений или нарушений гомеостаза железа. Можно измерить гепсидин-нейтрализующую активность, например, с помощью ряда маркеров, таких как уровни ферритина/железа, подсчет эритроцитов, характеристики эритроцитов (содержание гемоглобина и/или объем клеток), характеристики эритроцитов на ранних стадиях (число ретикулоцитов, содержание гемоглобина или объем клеток), интернализация ферропортина или транспорт железа. В соответствии с одним неограничивающим вариантом осуществления описываемые в настоящем документе антитело или его антиген-связывающий фрагмент понижают концентрацию внутриклеточного железа при ЕС50, составляющей приблизительно 10-8 M или менее, и/или повышают концентрацию железа в кровотоке.
Описываемые в настоящем документе антитело или его антиген-связывающий фрагмент могут оказывать антагонистическое действие на человеческий гепсидина или ингибировать регулирующую уровень железо активность гепсидина. В соответствии с некоторыми вариантами осуществления описываемые в настоящем документе антитело или его антиген-связывающий фрагмент оказывают эффект при ЕС50, составляющей приблизительно 1×10-8 M или менее или приблизительно 1×10-7 M или менее. Например, антитело может уменьшать уровень внутриклеточного железа в клетке при ЕС50, составляющей приблизительно 1×10-8 M или менее, или может уменьшать экспрессию ферритина при ЕС50, составляющей приблизительно 1×10-8 M или менее, которую определяют посредством анализа ферритина. В соответствии с другими вариантами осуществления описываемое в настоящем документе антитело может уменьшать уровни бессывороточного гепсидина по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80% или по меньшей мере приблизительно на 90% по сравнению с контрольным антителом или по сравнению с плацебо. В соответствии с другими вариантами осуществления описываемое в настоящем документе антитело может увеличить количество (число) эритроцитов, средний объем клеток эритроцитов или содержание гемоглобина в эритроцитах, увеличивать гемоглобин, увеличивать гематокрит, увеличивать % Tsat, увеличивать уровни железа в кровотоке (или сыворотке) и/или увеличивать или нормализировать количество ретикулоцитов, средний объем клеток ретикулоцитов, содержание гемоглобина в ретикулоцитах или число ретикулоцитов.
Настоящее изобретение относится к диагностическим способам с использованием описываемых в настоящем документе антитела или его антиген-связывающего фрагмента. Описываемые в настоящем документе антитело или его антиген-связывающий фрагмент также можно применять в целях очистки.
Также настоящее изобретение относится к терапевтическим способам с использованием описываемого в настоящем документе антитела или его антиген-связывающего фрагмента. Такие антитела или их антиген-связывающие фрагменты можно применять для лечения гепсидин-опосредованного нарушения. Гепсидин-опосредованные нарушения, воспалительные заболевания и заболевания или нарушения гомеостаза железа, для которых можно применять способы, включают без ограничения африканскую перегрузку железом, альфа-талассемию, болезнь Альцгеймера, анемию, анемию при злокачественной опухоли, анемию при хроническом заболевании, анемию при воспалении, артериосклероз или атеросклероз (включая болезнь коронарных артерий, цереброваскулярную болезнь или периферическую окклюзивную болезнь артерий), атаксию, железо-зависимую атаксию, атрансферринемию, злокачественную опухоль, церулоплазминовый дефицит, индуцированную химиотерапией анемию, хроническое ренальное/почечное заболевание (стадия I, II, III, IV или V), включая конечную стадию ренального заболевания или хроническое ренальное/почечное нарушение, острое повреждение почек (AKI), цирроз печени, классический гемохроматоз, коллаген-индуцированный артрит (CIA), состояния при избытке гепсидина (повышенный гепсидин), врожденную дизэритропоэтическую анемию, острую сердечную недостаточность, болезнь Крона, глютеновую болезнь, воспалительную болезнь кишечника (IBD), сахарный диабет, нарушения биораспределения железа, нарушения гомеостаза железа, нарушения метаболизма железа, ферропортиновое заболевание, ферропортиновый мутационный гемохроматоз, фолатный дефицит, атаксию Фридрейха, фуникулярный миелоз, GRACILE-синдром, инфекцию Н. pylori или другие бактериальные инфекции, болезнь Галлервордена-Шпатца, гемохроматоз, гемохроматоз, полученный в результате мутации в трансферриновом рецепторе 2, гемоглобинопатии, гепатит, гепатит (Брока), гепатит С, гепатоклеточную карциному, дефицит гепсидина, наследственный гемохроматоз, ВИЧ или другие вирусные заболевания, болезнь Хантингтона, гиперферритинемию, микроцитарную гипохромную анемию, гипоферремию, инсулиновую резистентность, железодефицитную анемию, нарушения, связанные с железодефицитной анемией, нарушения, связанные с перегрузкой железом, состояния, связанные с дефицитом железа с избытком гепсидина, ювенильный гемохроматоз (HFE2), рассеянный склероз, мутацию в трансферриновом рецепторе 2, HFE, гемоювелине, ферропортине, TMPRSS6 (IRIDA) или других генах метаболизма железа, неонатальный гемохроматоз, нейродегенеративные болезни, связанные с железом, нарушение остеогенеза, остеопороз, панкреатит, нейродегенерацию, ассоциированную с пантотенаткиназой, болезнь Паркинсона, пеллагру, парорексию, порфирию, позднюю кожную порфирию, псевдоэнцефалит, гемосидероз легких, нарушения эритроцитов, ревматоидный артрит, сепсис, сидеробластную анемию, системную эритематозную волчанку, талассемию, промежуточную талассемию, трансфузиальная перегрузка железом, опухоли, васкулит, дефицит витамина В6, дефицит витамина В12 и/или болезнь Вильсона.
Применяемое в настоящем документе "лечение" или "лечить" относится как к профилактическому лечению субъекта, подверженного риску или имеющего предрасположенность к заболеванию или нарушению, так и к терапевтическому лечению субъекта, страдающего от заболевания или нарушения.
Введение терапевтического средства прафилактическим способ может происходить перед проявлением симптомов нежелательного заболевания или нарушения с тем, чтобы предупредить заболевание или нарушение или, альтернативно, замедлить его прогрессирование. Таким образом, при применении в сочетании с профилактическими способами термин "терапевтически эффективный" означает, что после лечения у меньшего количества субъектов (в среднем) развивается нежелательное заболевание или нарушение или прогрессирует по тяжести симптомов.
При применении в сочетании с терапевтическими способами, предусматривающими введение терапевтического средства после проявления у субъекта симптомов заболевания или нарушения термин "терапевтически эффективный" означает, что после лечения один или нескольких признаков или симптомов заболевания или нарушения ослабляются или устраняются.
Применяемое в настоящем документе "гепсидин-опосредованное нарушение" относится к состоянию, вызванному аномальным уровнем гепсидина (например, избытком гепсидина или дефицитом гепсидина относительно степени анемии или запасов железа), который нарушает гомеостаз железа, или ассоциированному с ним. Нарушение гомеостаза железа может, в свою очередь, привести в результате к развитию вторичных заболеваний, таких как анемия. Острые или хронические воспалительные состояния могут привести в результате к положительной регуляции экспрессии гепсидина, которая может привести в результате к понижению уровней циркулирующего железа, что может вызвать анемию или ухудшить существующую анемию. Иллюстративные гепсидин-опосредованные воспалительные заболевания включают анемию при злокачественной опухоли, анемию при хроническом заболевании, анемию при воспалении, индуцированную химиотерапией анемию, хроническое заболевание почек (стадия I, II, III, IV или V), конечную стадию ренального заболевания, хроническое ренальное нарушение, острую сердечную недостаточность, злокачественную опухоль, ревматоидный артрит, системную эритематозную волчанку, болезнь Крона, инфекцию Н. pylori или других бактериальных инфекций, гепатит С, ВИЧ и другие вирусные заболевания, артериосклероз, атеросклероз, цирроз печени, панкреатит, сепсис, васкулит, дефицит железа, микроцитарную гипохромную анемию и состояния при избытке гепсидина.
Применяемая в настоящем документе фраза "заболевание (или нарушение) гомеостаза железа" относится к состоянию, при котором необходима модуляция уровней железа у субъекта. Оно включает гепсидин-опосредованные нарушения, состояния, не ассоциированные с повышенными уровнями гепсидина, которые, тем не менее, будут излечиваться при ингибировании активности гепсидина, такие как нарушение гомеостаза железа, не обусловленное гепсидином, заболевания, при которых аномальное поглощение, рециркуляция, метаболизм или выделение железа обуславливает развитие нарушения нормальных уровней железа в крови или распределения в ткани; заболевания, при которых нарушенная регуляция железа является последствием другого заболевания или состояния, такого как воспаление, злокачественная опухоль или химиотерапия; заболевания или нарушения, являющиеся результатом аномальных уровней железа в крови или распределения в ткани; и заболевания или нарушения, которые можно лечить посредством модулирования уровней железа или его распределения. Неограничивающие примеры таких заболеваний или нарушений гомеостаза железа, гепсидин-опосредованных нарушений, воспалительных состояний, которые могут привести в результате к избытку гепсидина, включают африканскую перегрузку железом, железорефрактерную алиментарную анемию (IRIDA), альфа-талассемию, болезнь Альцгеймера, анемию, анемию при злокачественной опухоли, анемию при хроническом заболевании, анемию при воспалении, артериосклероз или атеросклероз (включая болезнь коронарных артерий, цереброваскулярную болезнь или периферическую окклюзивную болезнь артерий), атаксию, железо-зависимую атаксию, атрансферринемию, злокачественную опухоль, церулоплазминовый дефицит, индуцированную химиотерапией анемию, хроническое ренальное/почечное заболевание (стадия I, II, III, IV или V), включая конечную стадию ренального заболевания или хроническое ренальное/почечное нарушение, острое повреждение почек (AKI), AKI, ассоциированное с сердечно-легочным шунтированием, AKI, ассоциированное с лекарственным средством или токсином, цирроз печени, классический гемохроматоз, коллаген-индуцированный артрит (CIA), состояния при избытке гепсидина (повышенный гепсидин), врожденную дизэритропоэтическую анемию, острую сердечную недостаточность, болезнь Крона, глютеновую болезнь, воспалительную болезнь кишечника (IBD), сахарный диабет, нарушения биораспределения железа, нарушения гомеостаза железа, нарушения метаболизма железа, ферропортиновое заболевание, ферропортиновый мутационный гемохроматоз, фолатный дефицит, атаксию Фридрейха, фуникулярный миелоз, GRACILE-синдром, инфекцию Н. pylori или другие бактериальные инфекции, болезнь Галлервордена-Шпатца, врожденный гемохроматоз, приобретенный гемохроматоз, гемохроматоз, полученный в результате мутации в трансферриновом рецепторе 2, гемоглобинопатии, гепатит, гепатит (Брока), гепатит С, гепатоклеточную карциному, ВИЧ или другие вирусные заболевания, болезнь Хантингтона, гиперферритинемию, микроцитарную гипохромную анемию, гипоферремию, инсулиновую резистентность, железодефицитную анемию, нарушения, связанные с железодефицитной анемией, нарушения, связанные с перегрузкой железом, состояния, связанные с дефицитом железа с избытком гепсидина, ювенильный гемохроматоз (HFE2), рассеянный склероз, мутацию в трансферриновом рецепторе 2, HFE, гемоювелине, ферропортине или других генах метаболизма железа, неонатальный гемохроматоз, нейродегенеративные болезни, связанные с железом, нарушение остеогенеза, остеопороз, панкреатит, нейродегенерацию, ассоциированную с пантотенаткиназой, болезнь Паркинсона, пеллагру, парорексию, порфирию, позднюю кожную порфирию, псевдоэнцефалит, гемосидероз легких, нарушения эритроцитов, ревматоидный артрит, сепсис, сидеробластную анемию, системную эритематозную волчанку, талассемию, промежуточную талассемию, трансфузиальная перегрузка железом, опухоли, васкулит, дефицит витамина В6, дефицит витамина В12 и/или болезнь Вильсона.
Невоспалительные состояния, которые вовлечены в нарушение регуляции железа, включают без ограничения дефицит витамина В6, дефицит витамина В12, фолатный дефицит, пеллагру, фуникулярный миелоз, псевдоэнцефалит, болезнь Паркинсона (Fasano et al., J. Neurochem. 96:909 (2006), и Kaur et al., Ageing Res. Rev., 3:327 (2004)), болезнь Альцгеймера, коронарную болезнь сердца, нарушение остеогенеза и остеопороз (Guggenbuhl et al., Osteoporos. Int. 16:1809 (2005)), гемоглобинопатии и нарушения метаболизма эритроцитов (Papanikolaou et al., Blood 105:4103 (2005)) и периферическую окклюзивную болезнь артерий.
В соответствии с одним аспектом настоящее изобретение относится к способу лечения нарушения гомеостаза железа у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с другим аспектом настоящее изобретение относится к способу модулирования активности гепсидина у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения нарушения гомеостаза железа у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения гемохроматоза у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения субъекта с повышенным уровнем гепсидина, предусматривающему введение указанному субъекту описываемой в настоящем документе фармацевтической композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения анемии у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения воспалительного заболевания у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения инфекции у нуждающегося в этом субъекта, предусматривающему введение указанному субъекту описываемой в настоящем документе композиции. Инфекция может быть, например, бактериальной, грибковой или вирусной инфекцией.
Любой из таких способов в некоторых случаях может дополнительно предусматривать введение указанному субъекту стимулятора эритропоэза, причем указанный стимулятор эритропоэза выбирают из группы, состоящей из эритропоэтина, варианта эритропоэтина и антитела, которое связывает эритропоэтин. В соответствии с одним вариантом осуществления антитело или его антиген-связывающий фрагмент, которые специфично связывают гепсидин, и указанный стимулятор эритропоэза вводят одновременно или последовательно. Применяемый в настоящем документе термин "эритропоэтическая активность" означает активность, стимулирующую эритроцитопоэз, которую наблюдают в анализе in vivo, например, анализе постгипоксийных полицитемических мышей. См., например, работу Cotes and Bangham, Nature 191:1065 (1961).
В соответствии с одним вариантом осуществления описываемые в настоящем документе антитело или его антиген-связывающий фрагмент и стимулятор эритропоэза можно применять для улучшения лечения больного с анемией. В соответствии с другим вариантом осуществления больные, которые являются гипочувствительными, включая отсутствие чувствительности, к терапии стимулятором эритропоэза, таким как эритропоэтин или его аналоги (эпоэтин альфа, эпоэтин бета, дарбэпоэтин альфа), среди прочих, могут получать полезный эффект от совместного лечения при помощи антагониста активности гепсидина или ингибитора экспрессии гепсидина. В соответствии с другим вариантом осуществления описываемые в настоящем документе антитело или его антиген-связывающий фрагмент и стимулятор эритропоэза можно применять для улучшения лечения больного с нарушением нагрузки железом на фоне перегрузки железом, обусловленной переливанием крови, или который имеет нарушение равномерного распределения железа, такое как наследственная атаксия Фридрейха.
Применяемый в настоящем документе "стимулятор эритропоэза" относится к химическому соединению, которое напрямую или опосредовано вызывает активацию эритропоэтинового рецептора, например, посредством связывания и вызова димеризации рецептора или посредством стимуляции экспрессии эндогенного эритропоэтина. Стимуляторы эритропоэза включают эритропоэтин и его варианты, аналоги или производные, которые связываются и активируют эритропоэтиновый рецептор; антитела, которые связываются с эритропоэтиновым рецептором и активируют рецептор; или пептиды, которые связываются и активируют эритропоэтиновый рецептор; или малые органические химические соединения, необязательно с молекулярной массой менее приблизительно 1000 дальтон, которые связываются и активируют эритропоэтиновый рецептор. Стимуляторы эритропоэза включают без ограничения эпоэтин альфа, эпоэтин бета, эпоэтин дельта, эпоэтин омега, эпоэтин йота, эпоэтин дзета и его аналоги, пегилированный эритропоэтин, карбамилированный эритропоэтин, пептиды-миметики (включая EMP1/гематид), антитела-миметики и ингибиторы HIF (см. патентную публикацию США №2005/0020487, раскрытие, которой включено при помощи ссылки в полном ее объеме). Иллюстративные стимуляторы эритропоэза включают эритропоэтин, дарбэпоэтин, варианты агониста эритропоэтина и пептиды или антитела, которые связывают и активируют эритропоэтиновый рецептор (и включают соединения, описанные в публикациях заявок на выдачу патента США №№2003/0215444 и 2006/0040858, раскрытия каждой из которых включены в настоящий документ при помощи ссылки в полном их объеме), а также молекулы эритропоэтина или их варианты или аналоги, которые раскрыты в приведенных патентах или патентных заявках, каждый/каждая из которых включен/включена в настоящий документ при помощи ссылки в полном своем объеме: патент США. №№4703008, 5441868, 5547933, 5618698, 5621080, 5756349, 5767078, 5773569, 5955422, 5830851, 5856298, 5986047, 6030086, 6310078, 6391633, 6583272, 6586398, 6900292, 6750369, 7030226, 7084245, 7217689, публикации РСТ №№ WO 91/05867, WO 95/05465, WO 99/66054, WO 00/24893, WO 01/81405, WO 00/61637, WO 01/36489, WO 02/014356, WO 02/19963, WO 02/20034, WO 02/49673, WO 02/085940, WO 03/029291, WO 2003/055526, WO 2003/084477, WO 2003/094858, WO 2004/002417, WO 2004/002424, WO 2004/009627, WO 2004/024761, WO 2004/033651, WO 2004/035603, WO 2004/043382, WO 2004/101600, WO 2004/101606, WO 2004/101611, WO 2004/106373, WO 2004/018667, WO 2005/001025, WO 2005/001136, WO 2005/021579, WO 2005/025606, WO 2005/032460, WO 2005/051327, WO 2005/063808, WO 2005/063809, WO 2005/070451, WO 2005/081687, WO 2005/084711, WO 2005/103076, WO 2005/100403, WO 2005/092369, WO 2006/50959, WO 2006/02646, WO 2006/29094, и публикации США №№ US 2002/0155998, US 2003/0077753, US 2003/0082749, US 2003/0143202, US 2004/0009902, US 2004/0071694, US 2004/0091961, US 2004/0143857, US 2004/0157293, US 2004/0175379, US 2004/0175824, US 2004/0229318, US 2004/0248815, US 2004/0266690, US 2005/0019914, US 2005/0026834, US 2005/0096461, US 2005/0107297, US 2005/0107591, US 2005/0124045, US 2005/0124564, US 2005/0137329, US 2005/0142642, US 2005/0143292, US 2005/0153879, US 2005/0158822, US 2005/0158832, US 2005/0170457, US 2005/0181359, US 2005/0181482, US 2005/0192211, US 2005/0202538, US 2005/0227289, US 2005/0244409, US 2006/0088906, US 2006/0111279.
В соответствии с одним вариантом осуществления также предусмотрены описываемые в настоящем документе антитело или его антиген-связывающий фрагмент, а также хелатор железа для перераспределения запасов железа в организме. Хелатор железа является средством, способным связывать железо и удалять его из ткани или из кровотока. Примеры включают дефероксамин (Desferal®) и деферазирокс (Exjade®) и деферипрон (1,2-диметил-3-гидроксипиридин-4-он).
Введение композиции по настоящему изобретению можно осуществлять любыми подходящими способами, включая без ограничения инъекцию. В соответствии с одним вариантом осуществления инъекция может быть, например, внутривенной, подкожной или внутримышечной инъекцией.
Упаковки, наборы и предварительно заполненные контейнеры
Также настоящее изобретение относится к наборам, содержащим одно или несколько описываемых выше соединений. Набор может содержать антитело или его антиген-связывающий фрагмент, который связывает гепсидин в подходящих контейнерных устройствах.
Контейнерное устройство наборов обычно будет включать по меньшей мере один пузырек, пробирку для испытаний, колбу, флакон, ампулу, шприц, пакет для внутривенного (IV) вливания и/или другое контейнерное устройство, в котором может располагаться по меньшей мере один полипептид и/или предпочтительно в надлежащих аликвотах. Настоящее изобретение относится к контейнерному устройству, содержащему описываемую в настоящем документе композицию.
Наборы могут включать устройство для содержания по меньшей мере одного белка слияния, детектируемого фрагмента, репортерной молекулы и/или любые другие контейнеры для реактивов с плотной изоляцией для коммерческого применения. Такие контейнеры могут включать инъекционные и/или формованные раздувом пластиковые контейнеры, в которых хранятся требуемые пузырьки. Наборы также могут включать печатный материал по применению материалов в наборе.
Упаковки и наборы могут дополнительно включать буферизирующее средство, консервант и/или стабилизирующее средство в фармацевтическом составе. Каждый компонент набора может быть вложен в отдельный контейнер и все различные контейнеры могут находиться в одной упаковке. Наборы по настоящему изобретению могут быть предназначены для хранения в холоде или хранения при комнатной температуре.
Кроме того, препараты могут содержать стабилизаторы для увеличения периода хранения набора и включать, например, бычий сывороточный альбумин (BSA). Если композиции являются лиофилизированными, то набор может содержать дополнительные препараты растворов для ресуспендирования лиофилизированных препаратов. Приемлемые растворы для ресуспендирования хорошо известны в настоящей области техники и включают, например, фармацевтически приемлемый фосфатно-солевой буферный раствор (PBS).
Упаковки и наборы могу дополнительно включать один или несколько компонентов для анализа, такого как, например, анализ ELISA. Образцы для тестирования согласно настоящей заявке включают, например, кровь, плазму и срезы ткани и секреты, мочу, лимфу и их продукты. Упаковки и наборы могут дополнительно включать один или несколько компонентов для сбора образца (например, шприц, чашку Петри, тампон на стержне и т.д.).
Упаковки и наборы могут дополнительно включают этикетку, на которой указано, например, описание продукта, способ введения и/или показания для применения. Приведенные в настоящем документе упаковки могут включать любые композиции, которые описаны в настоящем документе. Заболевание (например, IBD), ревматоидный артрит, остеоартрит, формы злокачественной опухоли и их метастазы.
Термин "упаковочный материал" относится к физической структуре, в которой содержаться компоненты набора. Упаковочный материал может сохранять компоненты в стерильном состоянии и может быть выполнен из материала, традиционно применяемого для таких целей (например, бумаги, гофрированной фибры, стекла, пластика, фольги, ампул и т.д.). Этикетка или листок-вкладыш может включать соответствующую письменную инструкцию. Таким образом, наборы могут дополнительно включать этикетки или инструкции по применению компонентов набора для любого способа по настоящему изобретению. Набор может включать соединение в пакете или дозаторе вместе с инструкциями по применению соединения согласно описываемому в настоящем документе способу.
В соответствии с еще одними дополнительными вариантами осуществления набор может дополнительно содержать контейнерное устройство, предназначенное для стимулятора эритропоэза.
Инструкции могут включать инструкции по практическому применению любых описываемых в настоящем документе способов, включая способы лечения. Инструкции могут дополнительно включать определения удовлетворительного клинического результата или любые неблагоприятные симптомы, которые могут иметь место, или дополнительную информацию, запрашиваемую контролирующими органами, такими как Управление по контролю за продуктами питания и медицинскими изделиями для применения на людях.
Инструкции могут находиться на "полиграфическом изделии", например на бумаге или картоне, которые находятся в наборе или прикреплены к набору, или на этикетке, прикрепленной к набору или упаковочному материалу, или прикрепленном к пузырьку или пробирке, содержащей компонент набора. Инструкции дополнительно могут быть включены на читаемом компьютером носителе, таком как флеш/облачном носителе, диске (дискете или жестком диске), оптическом CD, такой как CD- или DVD-ROM/RAM, магнитная лента, электрическое запоминающее устройство, такое как RAM и ROM, IC игла и гибриды, такие как средства магнитного/оптического хранения информации.
Настоящее изобретение относится к контейнерному устройству, содержащему описываемую в настоящем документе композицию. Контейнерное устройство может представлять собой любой подходящий контейнер, который может заключать в себе жидкость или лиофилизированную композицию, включая без ограничения пузырек, шприц, флакон, пакет или ампулу для внутривенного (IV) вливания. Шприц может содержать любой объем жидкости, подходящей для инъекции субъекту, включая без ограничения 0,5 см3, 1 см3, 2 см3, 5 см3, 10 см3 или более.
Настоящее изобретение относится к наборам, содержащим описываемую в настоящем документе композицию. В соответствии с одним аспектом настоящее изобретение относится к набору для лечения нарушения, ассоциированного с повышенными уровнями гепсидина, или нарушения гомеостаза железа, содержащий антитело или его антиген-связывающий фрагмент, которые описаны в настоящем документе, и стимулятор эритропоэза.
В соответствии с другим аспектом настоящее изобретение относится к набору для лечения нарушения, ассоциированного с повышенными уровнями гепсидина, или нарушения гомеостаза железа, содержащий антитело или его антиген-связывающий фрагмент, которые описаны в настоящем документе, и этикетку, прикрепленную к контейнеру или поставляемую с ним, причем на этикетке описано применение антитела или его антиген-связывающего фрагмента со стимулятором эритропоэза.
В соответствии с другим аспектом настоящее изобретение относится к набору для лечения нарушения, ассоциированного с повышенными уровнями гепсидина, содержащий стимулятор эритропоэза и этикетку, прикрепленную к контейнеру или поставляемую с ним, причем на этикетке описано применение стимулятора эритропоэза с антителом или его антиген-связывающим фрагментом, которые описаны в настоящем документе.
Примеры
Настоящую заявку можно лучше понять на основании приведенных далее неограничивающих примеров, которые представлены в виде иллюстративных вариантов осуществления по настоящей заявке. Последующие примеры представлены для более полной иллюстрации вариантов осуществления и, тем не менее, не должны каким-либо образом истолковываться как ограничивающие широкий объем настоящей заявки.
Пример 1
Разработка моноклонального антитела и конструирование антигена к человеческому гепсидину
Предпосылки
Гепсидин представляет собой пептидный гормон длиной 25 аминокислот, который регулирует гомеостаз железа. Генетический или приобретенный дефицит или избыток гепсидина является основной или способствующей причиной развития большинства заболеваний, связанных с регуляцией обмена железа. При других заболеваниях, в случае которых гомеостаз железа нарушен в результате первичного дефицита или избытка запасов железа в организме, концентрации гепсидина отражают физиологические реакции на первичное нарушение. Несмотря на потенциальную важность ориентированных на гепсидина-25 терапевтических средств в клинической медицине, лишь одно гуманизированное моноклональное антитело вошло в раннюю фазу 1 клинических исследований.
Аминокислотная последовательность зрелых гепсидинов является высококонсервативной среди млекопитающих, особенно на N-конце. Мышиный и крысиный гепсидины, соответственно, на 76% и 64% идентичны с человеческим гепсидином. Характерная структура гепсидина является высококонсервативной с эволюционной точки зрения, и 5 N-концевых аминокислот исключительно необходимы для биологической активности in vitro, поскольку N-концевые аминокислоты непосредственно вовлечены в связывание Fpn и последующую интернализацию и расщепление в лизосомах (Nemeth et al., 2006).
На молекулярном уровне это происходит из-за того, что гепсидин обуславливает расщепление своего рецептора, ферропортина, единственного канала железа у человека, и приводит к тому, что железо попадает в клетки печени, макрофаги и клетки, выстилающие кишечник, в которых экспрессируется ферропортин. По мере снижения уровней железа в плазме крови снижаются уровни гепсидина, и вырабатывается и скапливается на клеточной мембране ферропортин. Это обеспечивает нормальное протекание поглощения и переработки железа и поставляет необходимое для кроветворения железо. Регулирующая количество железа ось гепсидин-ферропортин является мишенью в нескольких попытках разработать новые терапевтические лекарственные средства, которые в настоящий момент находятся на доклинической стадии и фазе I испытаний. Тем не менее, в настоящий момент лишь одно гуманизированное антитело MAb, направленное против гепсидина, апробируют на ранней фазе I клинических исследований.
Клетки мезонефроса человека (HEK 293) стабильно трансфицировали понестерон-индуцируемым промотором, который обеспечивает высокие уровни экспрессии гибридного белка мышиный ферропортин-GFP (обозначенного Ec:R50-GFP) для исследования биологии ферропортина in vitro с помощью клеточного анализа.
Хорошо известная сложность получения антител к гепсидину-25 связана с его сложной формой и высокой степенью эволюционного консерватизма, особенно в N-концевом участке пептида у млекопитающих, включая применяемые для попыток разработки MAb.
Другие компании направляли свои антитела против линейных пептидов из зрелого С-концевого участка гепсидина-25 (гепсидина (10-25)) [SEQ ID NO: 27], который не был пригодным для детекции с помощью ELISA биологически активного гепсидина-25 и не ожидали, что они будут эффективны в терапевтических применениях (см., например, Geacintov et al., US 2004/0096990 A1).
Антитела, разработанные авторами настоящего изобретения
Используя наши сведения о важности аминоконца гепсидина-25 и его плохой иммуногенности, нами был разработан набор антигенов и иммунизированных групп BALB/c мышей для получения моноклональных антител к биологически активному гепсидину-25.
Наша схема антигена была сфокусирована на получении MAb к N-концу гепсидина-25 и полноразмерного пептида окисленного гепсидина-25. Примеры антигенов, которые были разработаны и приводили к получению трех описываемых в настоящем документе функциональных MAb, показаны на фигурах 1 и 6.
У BALB/c мышей испытывали in vivo ряд пептидных антигенов в отношении иммуногенности и для получения MAb, специфичных к гепсидину-25, с применением ряда способов синтеза для добавления гаптенов (например, DNP, PamCys) и иммуногенных белков-носителей (например, KLH, mKLH, альбумина или белка-носителя), и было доказано, что некоторые являются подходящими антигенами (фигуры 5 и 6).
Пример 2
Протокол создания гибридомы
После расчета титра антител получали гибридомы с помощью коммерчески доступного набора для осуществления слияния (Ну-Clone) или с помощью традиционных способов, описанных у Kohler и Milstein (Id.).
Целью настоящего примера было описание получения моноклональных антител путем выделения лимфоцитов мышей из лимфатических узлов (LN) и/или селезенки (S) после иммунизации, получения гибридомных клеток и получения и отбора положительных клонов, которые секретировали антиген-специфичные антитела.
Процедура
Получение миеломных клеток
За две недели до инфузии линию миеломных клеток Sp2/0 размножали в среде DEME с 10% FCS, 8-азагуанином и пенициллином-стрептомицином. За одну неделю до слияния клеток клетки культивировали без 8-азагуанина и на каждый второй день разделяли клетки. Для слияния плотность клеток составляла 2×105/мл, и было необходимо 100 мл таких клеток. Клетки разделяли за день до слияния и определяли жизнеспособность клеток; согласно ожиданиям, жизнеспособность клеток должна была превышать 95%.
Клетки SP2/0 собирали путем центрифугирования при 300×g в течение 10 минут и промывали 3 раза путем добавления 30 мл среды В ClonaCell-HY-Fusion. Клеточные массы ресуспендировали в 25 мл среды В до содержания 2×107 жизнеспособных клеток. После ресуспендирования клетки хранили при комнатной температуре (RT). Такой этап можно осуществлять одновременно с получением лимфоцитов или после этого.
Выделение мышиных лимфатических узлов, селезенки и лимфоцитов
PEG и среды (среду А, В, С,) готовили для слияния путем предварительного нагревания до 37°С.
Для гибридомной технологии слияния отбирали только мышей, которые отвечали на иммунизацию по результатам определения с помощью стандартного анализа титра в сыворотке крови с применением гепсидина-25 в качестве антигена. Гибридомную технологию слияния осуществляли спустя 3 дня после последней стимуляции выбранным антигеном.
Каждую мышь умерщвляли с помощью асфиксии и смещения шейных позвонков и опрыскивали 75% этанолом. Мышь размещали вентральной поверхностью вверх на препаровальном столе и все конечности фиксировали относительно препаровального стола. Все методики препарирования проводили с применением методик асептики и для каждого этапа препарирования применяли различные наборы стерильных инструментов (ножниц, зажимов) для удаления селезенки и лимфатических узлов (LN).
LN (и/или селезенку) помещали в одну лунку 6-луночного планшета, содержавшего 2 мл среды А, и отрезали жировую и соединительную ткань. Устанавливали одно одноразовое клеточное сито на верхушке 50-мл конической центрифужной пробирки, и переносили LN (или селезенку) в сито, и разрезали LN (или селезенку) на мелкие кусочки при помощи стерильных ножниц, и измельчали ткань при помощи штока 3-мл стерильного шприца и пропускания 5-10 мл среды В через сито. Измельчали ткань один или более раз и промывали посредством 10 мл среды В (на сите должна была оставаться только мембрана). Лимфоциты осторожно пипетировали и перемешивали путем переворачивания и центрифугирования на скорости 400×g в течение 7 минут. Супернатант отбрасывали и клетки ресуспендировали в 10 мл среды В. Соответствующие разведения клеток затем количественно анализировали с помощью гемоцитометра.
Слияние
Лимфоциты и миеломные клетки смешивали в соотношении 4:1 (примерно 8×107 лимфоцитов с 2×107 миеломных клеток) в 50-мл пробирке. Соотношение лимфоцитов и миеломных клеток могло находиться в диапазоне от 10:1 до 1:1. Слитые клетки один раз центрифугировали в течение 10 минут на 400×g и клеточную смесь ресуспендировали в 30 мл среды В и центрифугировали на 800 g × 5 мин для получения хорошего сцепления и слияния клеток.
Среду полностью аспирировали из клеточной массы и осадок в пробирке осторожно обстукивали, поскольку для оптимального слияния массу нужно было раздробить. Один мл раствора PEG медленно по каплям добавляли к массе с помощью одномиллилитровой пипетки на протяжении периода, составлявшего одну минуту, без помешивания. Осадок в пробирке непрерывно осторожно обстукивали на протяжении следующей минуты.
4 мл среды В медленно добавляли к смеси для слияния при непрерывном обстукивании, как описано ранее, на протяжении периода, составлявшего 4 минуты.
К клеткам медленно добавляли 10 мл среды В, инкубировали в течение 15 минут в водяной бане, выставленной на 37°С.
Медленно добавляли 30 мл среды А и клетки центрифугировали при 400×g в течение 7 минут. Супернатант отбрасывали и клетки промывали посредством 40 мл среды А для того, чтобы удостовериться, что весь PEG был удален.
Клеточную массу медленно ресуспендировали в 10 мл среды для выделения гибридом Clonacell-HY (среды С) и переносили в Т-75 см2 колбу для культивирования ткани, содержавшую 20 мл среды С (общий объем = 30 мл). Клетки инкубировали на протяжении ночи во влажной камере при 37°С в атмосфере 5% СО2.
Отбор и клонирование
За день до слияния среду для отбора гибридом ClonaCell-Hy (среду D) помещали в 2-8°С и размораживали на протяжении ночи. В день слияния среду D энергично встряхивали для того, чтобы хорошо перемешать содержимое, и давали нагреться до комнатной температуры.
Суспензию слитых клеток затем переносили в 50-мл коническую пробирку и центрифугировали в течение 10 минут на 400×g при RT и удаляли и отбрасывали супернатант. Клетки ресуспендировали в среде С до общего объема, составлявшего 10 мл.
10 мл клеточной суспензии переносили в 90 мл среды D и тщательно перемешивали путем осторожного переворачивания емкости несколько раз. Затем суспензию гибридомных клеток переносили в одноразовый сосуд с реактивом и позволяли осаждаться в течение 15 минут при RT с тем, чтобы позволять всем пузырькам подняться вверх и рассеяться.
С помощью многоканальной пипетки и стерильных наконечников для пипетки среду D ClonaCell®-HY, содержавшую гибридомные клетки распределяли в 60-80 мкл объемах на лунку в 96-луночных планшетах. Это обычно давало от 10 до 16 планшетов, в зависимости от вносимого объема. Планшеты инкубировали при 37°С во влажной камере с 5% СО2. Спустя 8 дней спокойного инкубирования лунки исследовали на наличие колоний и осторожно наносили 150 мкл предварительно нагретой среды Ε ClonaCell®-HY на полужидкую среду каждой лунки, независимо от наличия колоний, и проводили анализ на всех лунках.
Планшеты инкубировали в течение дополнительных 2-4 дней при 37°С во влажной камере с 5% СО2. Общее время инкубирования можно было дополнительно повышать для обеспечения детекции гибридом с низким уровнем экспрессии.
100 мкл наслоенной среды Ε ClonaCell®-HY аккуратно удаляли, не тревожа колонии в полужидкой среде. Супернатанты испытывали в отношении специфичных антител с помощью аналитической системы, подходящей для рассматриваемого антигена, например, ELISA на нейтравидин, изотипирование мышиных Mab и т.д.
Содержимое лунок, которые согласно результатам испытания были положительны по антителам, осторожно ресуспендировали и переносили в лунки 24-луночного планшета, содержавшего один мл среды Ε ClonaCell®-HY, для размножения гибридом. Если положительная лунка содержала более одной колонии, то клоны собирали отдельно и переносили в отдельные лунки для размножения и повторного испытания с целью определения, какой из клонов вырабатывал представлявшее интерес антитело.
Замораживание гибридом
Клетки криоконсервировали в концентрации 2×106 клеток на флакон.
20% раствор DMSO в фетальной бычьей сыворотке (FBS) помещали в 50-мл коническую пробирку и позволяли ему охладиться на льду. Соответствующий объем DMSO медленно добавляли, и хорошо перемешивали, и стерилизовали фильтрацией с применением 0,2 мкм фильтра, и хранили на льду.
Собранные клетки ресуспендировали в холодной FBS в два раза превышавшей необходимую конечную концентрацию клеток (например, суспендировали в количестве 4×106 клеток/мл для клеток, которые криоконсервировали в количестве 2×106 клеток на криопробирку).
Для криоконсервации раствор FBS/20% DMSO медленно добавляли в соотношении 1:1 в пробирку, содержавшую клетки, с непрерывным перемешиванием в ходе добавления. В каждую криопробирку переносили один мл клеток в замораживающей среде. Согласно расчетам, конечная суспензия клеток была в 90% FBS, содержавшем 10% DMSO.
Криопробирки немедленно помещали в контейнеры для заморозки, а затем переносили в -80°С морозильную камеру на ночь. На следующий день удаляли замороженные флаконы из контейнеров для заморозки и хранили в жидком азоте.
Пример 3
Скрининг гибридом в отношении антител к гепсидину
Спустя восемь дней спокойного инкубирования после слияния все лунки подвергали скринингу для выявления мышиных гибридом, которые секретировали антитела к человеческому гепсидину. Если кратко, за один день до скрининга 100 мкл нейтравидина (200 нг/лунка), приготовленного в карбонатном буфере для сенсибилизации поверхностей (рН 9,6), вносили в каждую лунку планшета для иммуноферментного анализа (EIA) и инкубировали на протяжении ночи при 4°С. На следующий день планшет промывали, блокировали при помощи 1% BSA в буфере и в каждую лунку добавляли 1 нг K18-биотин-меченного вещества к гепсидину-25. После одночасовой инкубации планшет промывали 100 мкл супернатанта культуры гибридомной ткани объединяли с 50 мкл 1% BSA/TBST в каждой лунке и планшет инкубировали на ротационном шейкере (240 об/мин) в течение 1,5 часа. Планшет промывали, и добавляли HRP-меченное детекторное антитело козы (H+L) цепи IgG мыши, и продолжали инкубацию в течение еще одного часа. Планшет промывали, вносили субстрат, давали развиться реакции в течение 10 минут до остановки при помощи 1 H H2SO4 и считывали поглощение на 450 нм. Пример такого первого раунда скрининга давал матрицу 8×12 значений OD, которая изображена на фигуре 2. Гибридомы, которые давали OD>2,0, выявляли и дополнительно размножали перед вторым раундом скрининга.
Второй раунд скрининга предусматривал испытание специфичности каждой гибридомы к гепсидину-25. Если кратко, 96-луночные планшеты для EIA покрывали на протяжении ночи антителом козы, которое специфично к Fc IgG мыши (разведение 1/2500), а на следующий день планшет промывали, блокировали и 100 мкл супернатанта тканевой культуры вносили в каждую лунку и инкубировали в течение 1 часа при комнатной температуре. Способность мышиного антитела, присутствовавшего в супернатанте тканевой культуры, которое захватывалось Fc-участком, испытывали путем добавления 1 нг K18-биотин-меченного вещества к гепсидину-25 в каждую лунку и инкубирования в течение 1,5 часа на ротационном шейкере для планшетов. После промывания в лунки добавляли HRP-меченный стрептавидин (SA-HRP), инкубировали в течение одного часа, промывали и определяли наличие захваченного антителом меченного вещества путем добавления субстрата ТМВ на 10 минут. Реакцию останавливали путем добавления кислоты и считывали положение на 450 нм. Как показано на фигуре 3, гибридомы, которые давали OD>0,4, выявляли и субклонировали для последующего определения характеристики. Наш опыт подтверждал, что гибридомы, которые давали OD, превышавшее 2,0, в этом втором раунде скрининга были серьезными потенциальными кандидатами для последующего определения характеристики.
Для испытания на функциональную активность гибридом клоны, выявленные во втором раунде скрининга, субклонировали, выращивали до примерно 70% конфлюентности и подвергали скринингу как описано для второго раунда скрининга. Если кратко, 96-луночные планшеты покрывали антителом козы, которое специфично к Fc IgG мыши, а на следующий день планшеты промывали и блокировали и супернатант тканевой культуры вносили в каждую лунку и инкубировали в течение 1 часа.
Для получения исходного раствора гепсидина отвешивали примерно 1 мг лиофилизированного гепсидина и ресуспендировали в 0,5 мл 0,016% HCl (приготовленной в стерильной воде для культивирования тканей) с получением конечной концентрации 2 мг/мл.
Для точного определения концентрации гепсидина в растворе измеряли поглощение на 215 нм и 225 нм на спектрофотометре.
Для измерения образца получали 1:20 разведение раствора (10 мкл исходного раствора к 190 мкл стерильной воды). Получали значение холостой пробы спектрофотометра при помощи 10% 0,016% HCl. (10 мкл 0,016% HCl к 190 мкл стерильной воды). Измеряли поглощение на 215 нм и 225 нм и рассчитывали концентрацию гепсидина с помощью следующей формулы для концентрации пептида:
Расчет концентрации гепсидина-25 в мг/мл представляет собой [гепсидин-25 мг/мл] = (А215-А225)×0,144×20 (20 представляет собой фактор разведения).
Для хранения исходных растворов гепсидина-25 отбирали аликвоты раствора в 100 мкл объемах в стерильные 0,5 мл микроцентрифужные пробирки и хранили при -80°С. Для дополнительного разведения исходного раствора гепсидина до традиционного рабочего раствора разводили концентрированный исходный раствор до 500 мкг/мл (рабочий раствор) стерильной водой для культивирования тканей.
Для подтверждения концентрации пептида в полученном растворе измеряли поглощение на 215 нм и 225 нм. Для такого измерения готовили 1:10 разведение раствора. Отбирали аликвоты в 25-мкл объемах в 0,5-мл стерильных микроцентрифужных пробирках с завинчивающей крышкой.
Способность синтетического человеческого гепсидина-25 конкурировать с K18-биотин-меченным веществом к гепсидину-25 за сайты связывания MAb испытывали путем добавления 100 нг гепсидина-25, приготовленного как описано выше, к раствору с меченным веществом и 100 мкл его добавляли в каждую лунку и инкубировали в течение 1,5 часа. После промывания добавляли HRP-меченный стрептавидин, инкубировали в течение одного часа, промывали и наличие связанного меченного вещества определяли путем добавления субстрата ТМВ. Реакцию останавливали путем добавления кислоты и считывания поглощения на 450 нм. Пример скрининга функциональной активности супернатантов гибридом показан на фигуре 4. Гибридомы, которые проявляли функциональную активность, выявляли по уменьшению OD в лунках меченное вещество + гепсидин-25 по сравнению с OD, производимой только меченным веществом (например гибридома 5А3; обозначение 5А3 позже было изменено на "MAb 583").
Пример сложности получения мышиных MAb показан на фигуре 5. Ряд типичных антигенов и подходов иммунизации могли давать различающиеся количества мышей, которые отвечали на иммунизацию (исходя из титров в сыворотке), и тканей, которые давали успешные слияния. Независимо от использованного антигена процент функциональных специфичных к гепсидину-25 мышиных MAb был неизменно менее 0,06% (фигура 5). Аналогичным образом, в качестве примера попытки, необходимой для исследования 3 мышиных MAb, специфичных к гепсидину-25, нами были испытаны восемь антигенов и подвергнуты скринингу 11845 гибридом с процентом успеха, составлявшим 0,025% (фигура 6).
Пример 4
Очистка мышиных MAb
Большие количества MAb 583 и MAb 1В1 получали путем засеивания отдельных коммерчески доступных половолоконных биореакторов CellMax (площадь поверхности 10000 см2) (Spectrum Labs, Inc.), которые затем инкубировали при 37°С в атмосфере 5% СО2. Примерно 2-3 литра общего супернатанта клеточной культуры супернатант от каждого MAb собирали в примерно 100-мл партиях. Каждую партию центрифугировали и замораживали при -20°С до очистки.
Для очистки супернатант размораживали, повторно центрифугировали и очищали иммуноглобулин с помощью аффинной хроматографии с применением 5 мл колонки на основе белка G HiTrap (GE Healthcare, Уппсала, Швеция) согласно инструкциям производителя. Очистку осуществляли с применением системы для хроматографии среднего давления BioRad Biologic DuoFlow, оснащенной UV-VIS детектором BioLogic Maximizer, QuadTec и коллектором фракций BioFrac. Для SDS-PAGE анализа. Фракции элюата из двух предыдущих очисток MAb 583 и MAb 1В1, содержавших иммуноглобулин, объединяли и осуществляли замену буфера с помощью колонки для обессоливания HiPrep 26/10 (GE Healthcare). Концентрацию белка определяли с помощью бицинхониновой кислоты (ВСА, Thermo Scientific), а аликвоты хранили замороженными при -20°С.
Пример очистки MAb 581 и MAb 1В1 (лот 3) подтверждали с помощью окрашенных кумасси SDS-PAGE гелей (12% акриламил), прогнанных в стандартных восстанавливающих условиях (фигура 7). Как показано на фигуре 7, очищенные препараты MAb IgG 583 и 1В1 (дорожки 8, 9) получали из суперанатантов их соответствующих культур гибридом (дорожки 2-5), о чем свидетельствовало наличие белков как тяжелой, так и легкой цепей с правильной молекулярной массой (примерно 50 и 25 кДа, соответственно). Кроме того, очищенные мышиные MAb были электрофоретически эквивалентны мышиному IgG-контролю (дорожка 10). Бессывороточная среда для культивирования ткани (дорожка 6) служила в качестве отрицательного контроля. С помощью такого способа можно было систематически получать очищенный MAb, который подходил для дополнительных исследований аффинности связывания (например, Biacore) и специфичности.
Для оценки постоянства выхода после получения в биореакторе и очистки разрабатывали способ характеристики активности MAb для оценки активности связывания каждого лота успешной очистки антитела MAb 583, каждый из которых оценивали с помощью гель-электрофореза, который показан на фигуре 7. Точно такой же способ применяли для очистки MAb 1В1 (данные не показаны).
Для оценки активности антител применяли ELISA в микролуночном планшете. Серийные разведения очищенного MAb 583 из каждого лота успешной очистки из суперантантов биореактора (примерно 100 мл на лот) наносили на планшеты (0-100 нг) и блокировали. NT-биотин-меченное вещество к гепсидину-25 добавляли во все лунки планшета в количестве 1 нг/лунка в TBST, рН 8), содержавшей 0,25% реагента для проведения вестерн-блоттинга. Меченному веществу позволяли связываться в течение 2 часов и лунки промывали в TBST, рН 8 без реагента для проведения вестерн-блоттинга. SA-HRP добавляли в количестве 1:2500 на 30 минут, лунки промывали в TBST и на 10 минут добавляли субстрат ТМВ. Добавляли стоп-буфер, оценивали OD на спектрофотометре на 450 нм. OD, равная 4, указывала на то, что поглощение выходило за аналитический диапазон спектрофотометра.
Приведенная ниже таблица является примером общепринятого способа ELISA для определения характеристик связывающей активности для 5 успешных очисток MAb 583.
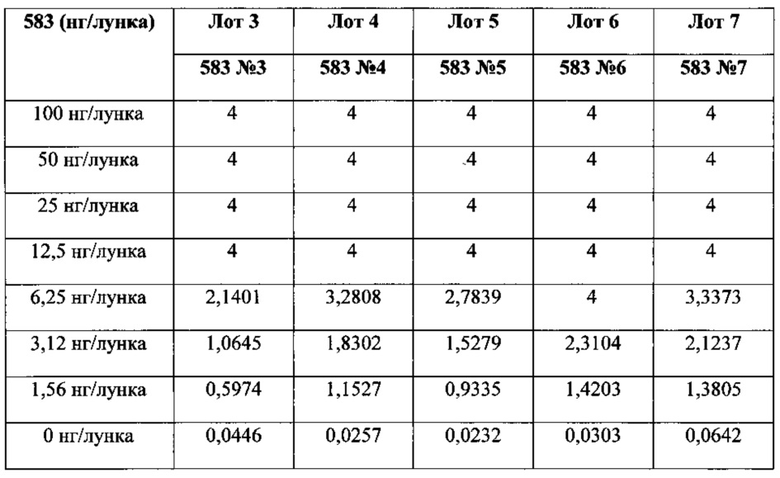
Из данных видно, что связывающая активность очищенного MAb 583 среди лотов возрастала после лота 3 и была постоянной у лотов 4-7 после оптимизации протокола очистки в ходе проведения первых четырех очисток. У лунок, покрытых 6,25 нг очищенного MAb 583, наблюдали, что оптическая плотность на 450 нм варьировала от 2,7 до 4 для лотов 4-7, а при следующем разведении (3,12 нг/лунка) значения OD варьировали от 1,5 до 2,3. Из этого примера видно, что общепринятый и утвержденный протокол очистки антитела MAb 583 из супернатантов биореактора был устоявшимся и, как было показано, подходящим для множества лотов очисток как MAb 583, так и 1В1.
Пример 5
Характеристика специфичности MAb к гепсидину-25 и гепсидиновым пептидам
У MAb 583 наблюдали сильную и отличную специфичность к гепсидину-25 в анализе на специфичность в растворе. Например, наносили гепсидин-25 на планшет с малеиновым ангидридом и незанятые сайты связывания подавляли при помощи стандартных способов. Параллельно 20 нг MAb 583 смешивали с возраставшими концентрациями гепсидина-25 (0-8 нг/лунка) в 96-луночном планшете с плохой связываемостью с белком и позволяли протекать реакции в течение одного часа. Затем такую смесь MAb переносили в планшет с малеиновым ангидридом и позволяли протекать реакции в течение 2 часов, после чего его промывали и определяли наличие MAb 583, связавшегося с гепсидином-25, который ковалентно связан с планшетом, с применением связанного с HRP вторичного антитела козы к IgG мыши. После дополнительной инкубации и промывания добавляли субстрат, останавливали развитие реакции с помощью кислоты и определяли OD 450 нм. На фигуре 8 показано, что гепсидин-25 мог блокировать сайты связывания на MAb 583 в растворе в зависимости от дозы.
Другой пример специфичности MAb 583 к гепсидину-20, гепсидину-22 и гепсидину-25 и протегрину был продемонстрирован с помощью мембранных анализов, таких как без ограничения невосстанавливающий SDS-PAGE (10-20% акриламид) анализ в трициновом буфере с применением стандартных электрофоретических условий и условий иммуноблоттинга (фигура 9). Как видно на окрашенном при помощи кумасси изображении, у каждого из гепсидина-20, -22 и -25 (дорожки 2, 3, 4) и протегрина (дорожка 5) были сходные молекулярные массы, равные примерно 3 кДа. Напротив, по результатам вестерн-блоттинга, зондированного при помощи MAb 583, наблюдали, что MAb 583 специфично распознавал гепсидин-20, гепсидин-22 и гепсидин-25, но не распознавал протегрин.
Для дополнительной иллюстрации специфичности MAb 583 и MAb 1В1 к гепсидину-22 и гепсидину-25 и меченному веществу NT-биотин-гепсидин-25, меченному веществу K18-биотин-гепсидин-25 и меченному веществу K24-биотин-гепсидин-25 проводили восстанавливающий SDS-PAGE анализ (12% акриламид) и вестерн-иммуноблоттинг согласно стандартным способам проведения электрофореза и иммуноблоттинга (фигура 10). Из результатов SDS-PAGE-анализа после окрашивания кумасси видно, что как гепсидин-20, так и гепсидин-25 (дорожки 2, 3) и три формы биотин-меченного вещества (дорожки 4, 5, 6) имели идентичную молекулярную массу. Из результатов вестерн-блоттинга, зондированного с помощью либо MAb 583, либо MAb 1В1, видно, что эти MAb специфично распознавали гепсидин-20, гепсидин-25 и три формы пептидов, представлявших собой биотин-меченный гепсидин-25. Все вместе, результаты наших исследований в растворе и мембранных исследований демонстрировали, что MAb 583 и MAb 1В1 обладали характерной специфичностью ко всем трем формам молекул меченного вещества, представлявшего собой биотинилированный гепсидин-25 человека.
Пример 6
Анализ с применением поверхностного плазмонного резонанса BIAcore (SPR) MAb 583 и 1В1
В этом примере описан анализ констант аффинности связывания и диссоциации для взаимодействия MAb 583 и 1В1 с гепсидином-25 при помощи SPR.
SPR проводили на системе Biacore 3000 (BIAcore, Пискатауэй, Нью-Джерси) с применением сенсорного чипа СМ5. Матрица чипа СМ5 состоит из карбоксиметилированного декстрана, ковалентно присоединенного к золотой поверхности. Все измерения проводили при 25°С.
Нейтравидин (Sigma, Сент-Луис, Миссури) иммобилизировали на сенсорном чипе СМ5 (проточные ячейки 1-4) согласно протоколу присоединения аминокислот на уровне 5000-10000 единиц ответа (RU). Протокол присоединения аминокислот предусматривал активацию декстрановой матрицы на поверхности сенсорного чипа при помощи 1:1 смеси 0,4 M 1-этил-3-(3-диметиламинопропилкарбодиимида (EDC) и 0,1 M N-гидроксисукцинимида (NHS) с последующим введением нейтравидина в 10 мМ буфере ацетата натрия, рН 4.
После иммобилизации нейтравидина последующие этапы проводили в HBS-EP буфере (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 3 мМ EDTA и 0,005% поверхностно-активного вещества Р20).
Биотинилированные гепсидиновые пептиды (NT-биотин-гепсидин-25, K18-биотин-гепсидин-25 и K24-биотин-гепсидин-25) иммобилизировали в проточных ячейках 2-4 (одно пептидное соединение на проточную ячейку) путем введения отдельных пептидов в концентрации, составлявшей 200 мкг/мл, со скоростью потока, составлявшей 5 мкл/мин, в течение 20 минут.
После захвата на чипе аналогов биотин-гепсидина-25 в проточные ячейки 1-4 вводили MAb 583 или 1В1 к гепсидину в концентрации, составлявшей 24 мкг/мл, в HBS-EP буфере со скоростью потока, составлявшей 50 мкл/мин, в течение 3 минут. Спустя 3 минуты, введение останавливали и продолжали диссоциацию в течение 6 минут. Регенерацию проводили путем введения 10 мМ глицин HCl, рН 1,5, со скоростью потока, составлявшей 10 мкл/мин в течение 1 минуты.
Резонансные сигналы корректировали в отношении неспецифичного связывания путем вычитания сигнала контрольной проточной ячейки (ячейка 1) и анализировали с помощью программного обеспечения BIAevaluation 4.1 (Biacore).
В первом SPR-эксперименте MAb 583 наносили на чип Biacore, подготовленный как описано выше, в концентрации, составлявшей 24 мкг/мл и наблюдали быстрое связывание и очень низкую скорость диссоциации MAb 583 с тремя аналогами биотин-гепсидина-25 (фигура 11). В приведенной ниже таблице показаны данные SPR-экспериментов, проиллюстрированных на фигуре 11. Отличные константы аффинности связывания (Ka) и диссоциации (Kd) наблюдали для MAb 583 с NT-биотин-гепсидином-25 и примерно на 1 log ниже констант аффинности и диссоциации для K18-биотин-гепсидина-25 и K24-биотин-гепсидина-25, соответственно.
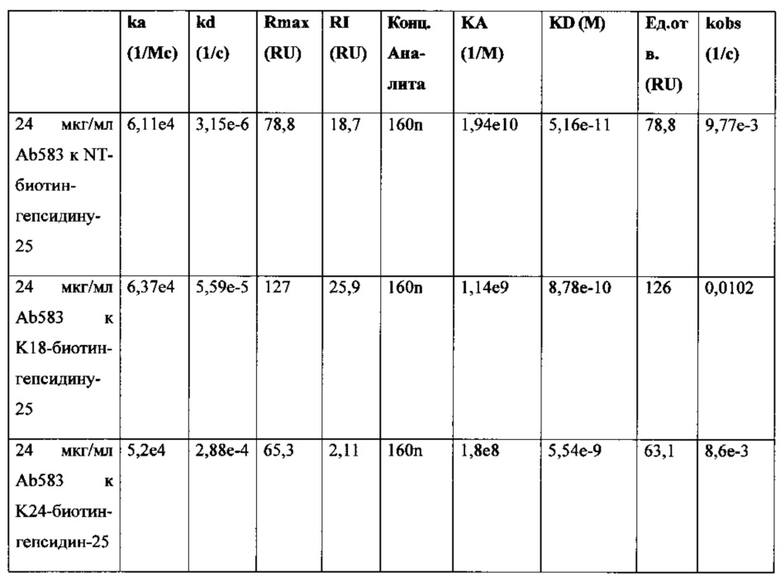
Мы повторяли эксперименты на Biacore, показанные на фигуре 11 с примерно в 5 раз более низкой концентрацией MAb 583 (5 мкг/мл) для оценки MAb 583 при намного более низком молярном соотношении антитела для двух наилучших антигенов биотинилированного гепсидина-25, NT-биотин-гепсидина-25 и K18-биотин-гепсидина-25 (фигура 12). На графиках Biacore видно, что MAb583 характеризовалось отличной аффинностью связывания и очень низкой диссоциацией как с пептидами K18-биотин-гепсидина-25, так и с пептидами NT-биотин-гепсидина-25, которые оценивали в этом эксперименте на Biacore. Результаты на Biacore с фигуры 12 показаны на фигуре 13.
Из данных Biacore видно, что MAb 583 связывалось с K18-биотин-гепсидином-25 с высокой аффинностью и низкой пикомолярной константой диссоциации (Kd) = примерно 7,5 пМ. MAb 583 характеризовалось высокой, но слегка более медленной аффинностью связывания и низкими пикомолярными константами диссоциации для NT-биотин-гепсидина-25, с Kd = примерно 18 пМ.
Эти эксперименты и результаты Biacore подтверждали, что MAb 583 связывало гепсидин-25 быстро и с высокой аффинностью и диссоциировали с гепсидином-25 медленно и с низкими пМ константами диссоциации. Эпитоп для MAb 583 представлял собой 9 N-концевых аминокислот, из которых первые 5 N-концевых аминокислот (SEQ 25) были существенны для связывания гепсидина-25 с транспортером и рецептором железа, ферропортином, и его способности интернализировать и разлагать ферропортин. Отличная специфичность, аффинность, авидность и пМ Kd у MAb 583 для N-концевого гепсидина-25 указывали на то, что оно будет нейтрализующим антителом in vitro и in vivo и будет подходящим для гуманизации для терапевтических целей. Примеры экспериментов Biacore с MAb 1В1 показаны на фигурах 14-15. Осуществляли две попытки с помощью тех же условий, которые описаны для MAb 583 для проведения SPR-анализа с MAb 1В1, и в каждом случае скорость диссоциации 1В1 от антигенов гепсидина-25 была настолько медленной, что прибор Biacore 3000, в котором используется программное обеспечение BIAevaluation 4.1, не мог детектировать никакой диссоциации 1В1 от антигенов гепсидина-25 на протяжении 20-минутного эксперимента. По этой причине эксперименты терпели неудачу в отношении получения статистической информации, которая показана для MAb 583 на фигуре 13 для экспериментов Biacore, показанных на фигурах 14-15.
SPR-анализ при таких экспериментальных условиях показывал, что мышиное MAb 1В1 характеризовалось экстраординарной аффинностью к пептидам гепсидина-25 и могло характеризоваться константой аффинности (KD) ≤ 10-12-10-13 М), и с такими характеристиками могло быть пригодным для гуманизации и доклинической оценки в качестве специфичного к гепсидину-25 MAb.
Эксперименты с MAb 583 и 1В1 по специфичности и связыванию с гепсидином
Специфичность и относительные аффинности связывания у 583 и 1В1 оценивали в ряде конкурентных экспериментов в титрационных микропланшетах. Анализы проводили в двух или трех повторностях с применением 96-луночных титрационных микропланшетов с покрытием MAb 583 или MAb 1В1.
MAb 583 разводили 1:4000 в Tris-забуференном солевом растворе (TBS), содержавшем 40 мМ Tris-HCl (рН 7,3), 100 мМ NaCl, пипетировали в титрационные микропланшеты.
Спустя 1 час инкубирования при комнатной температуре (RT) титрационные микропланшеты промывали при помощи TBST (TBS с 0,05% TWEEN® 20) и 100 мл стандартных образцов, содержавших различные количества синтетических пептидов и аналоги биотин-гепсидина-25 (1-2 нг/лунка) добавляли в каждую лунку и инкубировали в течение 1 часа при RT.
Конкуренцию определяли при помощи стрептавидина-HRP с субстратом тетраметилбензидин; цветную реакцию останавливали при помощи 0,5 H H2SO4 и считывали оптическую плотность раствора при длине волны 450 нм.
Проводили анализ связывания гепсидина-25, гепсидина-22 и гепсидина-20 с антителами MAb 583, нанесенными на титрационный микропланшет. Для детекции относительной степени связывания каждого из гепсидиновых пептидов относительно гепсидина-25 использовали связывание биотинилированных аналогов гепсидина-25 и детектирование связавшегося NT-биотин-гепсидина-25 (фигура 16). Конкурентные кривые с NT-биотин-гепсидином-25 с изомерами пептида гепсидина, гепсидином-22 и гепсидином-20, были сходными, что указывало на то, что изомеры гепсидина действительно связывались с MAb 583, но с уменьшением значений ЕС50 (аффинностью) при уменьшении размера изомера гепсидина, что видно по сдвигу вправо в кривой регрессии, идущему от гепсидина-25 к гепсидину-22 и к гепсидину-20.
Нами был использован тот же способ, что описан выше, для исследования относительной аффинности связывания MAb 583 и 1В1 к С-концевому окисленному пептиду для оценки эпитопов связывания на гепсидине для каждого MAb. Карбокси-концевые пептиды, такие как гепсидин (10-25), описаны в патентах США №7320894 и №7411048, каждый из этих патентов включен в настоящий документ с помощью ссылки в том, что касается пептидов.
Как показано на фигуре 17 и фигуре 18, отсутствовало связывание пептида гепсидина (10-25) либо с MAb 583, либо с 1В1, соответственно, при любой испытываемой концентрации до 2000 нг/мл с любым NT-биотин-гепсидином-25. Также отсутствовало связывание, которое наблюдали между MAb 583 и гепсидином-25 мыши (мышиным гепсидином-1) или протегрином по сравнению с отличным конкурентным связыванием синтетическим гепсидином-25 в таком ELISA-эксперименте (фигура 17). Эти эксперименты четко показывали, что MAb 583 и 1В1 не связывались со всеми эпитопами, обнаруживаемыми в 16 С-концевых аминокислотах гепсидина-25 (гепсидина (10-15)), и, таким образом, связывали N-концевые эпитопы.
Катионный противомикробный пептид, протегрин, и гепсидин-25 мыши (мышиный гепсидин-1) были структурно сходными, причем мышиный гепсидин-1 характеризовался 76% аминокислотной идентичностью с человеческим гепсидином-25. Нами были использованы эти пептиды для испытания перекрестной реактивности MAb 583 со сходными пептидами в аналогичном анализе с MAb 583. Как четко видно в ELISA-эксперименте, нами не было обнаружено очевидного связывания 583 с такими структурно сходными пептидами (фигура 17).
В сходном эксперименте, который показан на фигуре 18, не наблюдали связывание гепсидина (10-25) с MAb 1В1 в сходном эксперименте, который проводили с K18-биотин-гепсидином-25, применяемым в качестве меченного вещества в ELISA-эксперименте (фигура 19), дополнительно подтверждавшем 9 N-концевых аминокислот в качестве ключевого эпитопа для 1В1. Важно отметить, что из этих данных видно, что MAb как 583, так и 1В1 характеризовались отличной аффинностью и специфичностью к N-концу гепсидина-25. Согласно прогнозам, оба могли быть нейтрализующими антителами к молекулам, обладающим гепсидиновой биоактивностью в отношении ферропортинового рецептора и канала железа in vitro и in vivo, а после гуманизации - потенциальными кандидатами для разработки терапевтических средств.
Пример 8
Анализ MAb 583 в отношении нейтрализующей активности против гепсидина-25 в vitro in клеточных пробах с применение анализа флуоресценции ферропортин-GFP
In vitro клеточные испытания
Нами была оценена нейтрализующая активность MAb 583 in vitro в клеточной флуоресцентной пробе с применением протокола проточной цитометрии, который описан в Nemeth et al. (2006), для оценки нейтрализующей активности MAb 583 против человеческого гепсидина-25 (SEQ ID NO. 19). Пять N-концевых аминокислот [SEQ ID NO. 25] гепсидина взаимодействовали с ферропортином и были необходимы для биологической активности гепсидина, в результате чего делеция каждой отдельной аминокислоты с N-конца уменьшала гепсидиновую биологическую активность, по результатам определения активности разложения ферропортина (фигуры 20-23).
Человеческие HEK-клетки, содержавшие понастерон-индуцируемую конструкцию ферропортина мыши (Fpn-GFP), инкубировали с 10 мМ понастерона или без него в течение 24 часов. Через три промывания при помощи 1× PBS по Дульбекко клетки последовательно обрабатывали известными количествами очищенного антитела MAb 583 с аффинностью к белку А и известными концентрациями биологически активного синтетического человеческого гепсидина-25 или контрольным буфером в течение еще 24 часов.
Клетки отделяли при помощи TrypLE Express (Invitrogen) и ресуспендировали в среде в концентрации 1×106 клеток/мл. Интенсивность зеленой флуоресценции измеряли с помощью проточной цитометрии.
Клетки, которые не экспрессировали Fpn-GFP (без понастерона), применяли для построения гейта (исходного уровня) для исключения фоновой флуоресценции. Результаты представляли как долю GFP-интенсивности необработанных клеток согласно формуле (Fx - Fгeп)/(Fнеобработанные - Fгeп), где F представляет собой среднее гейтированной зеленой флуоресценции.
Проточная цитометрия Fpn-GFP клеток, обработанных при помощи MAb 583.
В первом эксперименте клетки индуцировали на протяжении ночи при помощи понастерона для индуцирования экспрессии мышиного Fpn-GFP. На следующий день понастерон удаляли посредством промывания и добавляли гепсидин-25 и 583 антитела на 24 часа (фигура 20 и фигура 21).
Гепсидин-25 применяли в концентрации 100 нг/мл (37 нМ). MAb 583 добавляли в 10-кратной, 2-кратной или 1/3 концентрации гепсидина (370 нМ, 74 нМ и 10 нМ).
Контрольное MAb представляло собой "неудачное" моноклональное антитело к гепсидину при скрининге in vitro посредством ELISA, и его применяли в наивысшей концентрации (370 нМ). В таком эксперименте 10 нМ MAb 583 полностью нейтрализовало 37 нМ гепсидина-25 и подавляло распад FPN-GFP при участии гепсидина-25.
Нами был повторен эксперимент с применением MAb 583, которое добавляли в 1/3-ей, 1/6-ой, 1/12-ой и 1/24-ой молярной концентрации гепсидина-25, в таких клеточных пробах биологической активности MAb 583 (фигура 22 и фигура 23).
В таком эксперименте 2,5 нМ MAb 583 значимо нейтрализовали (~23% снижение) 37 нМ гепсидина-25 и его биологическую активность в отношении FPN-GFP при 1/12-й от молярной концентрации биологически активного гепсидина-25 (фигура 22, 23).
Нами также была оценена нейтрализующая активность MAb 583 путем получения результатов измерения внутриклеточного ферритина от контрольных Fpn-GFP клеток и клеток, обработанных различными концентрациями MAb 583 и гепсидина в двух дополнительных экспериментах с применением идентичных протоколов, в том числе концентрации антитела MAb 583 и биотинилированных пептидов гепсидина-25, как в случае клеточных флуоресцентных анализов (фигуры 24-26).
Для получения концентраций внутриклеточного ферритина общий клеточный белок экстрагировали с применением буфера RIPA (Boston BioProducts, Ашленд, Массачусетс) с добавлением коктейля ингибиторов протеаз согласно инструкциям производителя (Roche, Индианаполис, Индиана).
Уровни ферритина определяли с помощью твердофазного иммуноферментного анализа (ELISA; Ramco Laboratories, Стаффорд, Техас) согласно инструкциям производителя с нормализованными концентрациями общего белка в каждом образце. Концентрацию общего белка определяли с помощью анализа с применением бицинхониновой кислоты (ВСА) (Pierce, Рокфорд, Иллинойс).
На фигурах 24-26 показаны результаты таких анализов, предназначенных для оценки способности MAb 583 нейтрализовать биологическую активность гепсидина-25 в отношении ферропортина.
Аналогично результатам, которые наблюдали при флуоресцентных анализах, описываемых в настоящем документе, 2,5-10 нМ MAb 583 значимо нейтрализовало 37 нМ гепсидина-25 и его биологическую активность in vitro, что приводило к понижению разложения FPN-GFP и удержания связанного внутриклеточным ферритином железа (фигуры 24-26).
Пример 9
In vivo нейтрализующая активность MAb 583 у C57BL/6 мышей
Для оценки in vivo нейтрализующих характеристик MAb 583 мы проводили простое, но робастное исследование на животных, в котором мы изучали два режима дозирования с аффинными очищенными антителами MAb 583 в отношении способности антител 583 блокировать биологически активный гепсидин-25 in vivo. Мы испытывали однократную дозу MAb 583 и две 50% дозы MAb 583, вводимых последовательно с интервалом 24 часа путем внутрибрюшинной инъекции.
Для начала in vivo эксперимента с MAb 583 сорок самцов C57BL/6 мышей (возрастом 6 недель) размещали в коммерческом виварии в нашем помещении и кормили рационом с низким содержанием железа (20 ppm общего железа, Teklad Custom Research Diet, Harlan Laboratories) в течение 17 дней. На день 1 сорок мышей рандомизировали на пять экспериментальных групп по 8 и каждую группу обрабатывали как описано ниже. Группа один получала только PBS, группы 2 и 3 получали 1,0 мг и 0,5 мг MAb 583, соответственно, группа 4 получала контрольное Mab (MAb к гепсидину, непригодное для ELISA), и группа 5 получала PBS. Двадцать четыре часа спустя каждая мышь в группе 3 получала дополнительные 0,5 мг MAb 583. После дополнительного 24-часового периода инкубации группы 1-4 получали 50 мкг гепсидина-25 в PBS, а мыши в группе 5 (контрольной группе) получали свою вторую дозу PBS (фигура 27).
У мышей отбирали кровь путем пункции в сердце через 2 часа после обработки, крови давали свернуться на протяжении 30 минут и оценили уровни железа в ее сыворотке с помощью коммерческого спектрофотометрического способа (Iron-SL Assay, Genzyme Diagnostics).
Статистический анализ данных показывал, что данные имели нормальное распределения согласно критерию нормальности Шапиро-Уилка (Р=0,216).
Критерий равных дисперсий данных показывал эквивалентные дисперсии в группах (Р=0,360).
Проводили дисперсионный анализ, и из его результатов было видно, что имело место статистически значимое отличие (Р=0,008), отличия в средних значениях концентраций железа в сыворотке среди групп обработки (фигура 28). На фигуре 27 эти результаты представлены графически и видны значимые отличия между PBS-контролями и мышами, обработанными либо гепсидином-25 в только PBS или в комбинации с двумя 0,5 мг дозами MAb 583 в PBS (фигура 28).
Статистическая мощность проведенного испытания с альфа = 0,050:0,748.
Множественные сравнения относительно контрольной группы (способ Холма-Сидака) давали общий уровень значимости = 0,05.
Значимые отличия наблюдали в концентрациях железа в плазме между PBS-контрольной группой и группой мышей, которым вводили либо 50 мкг гепсидина-25 в PBS, либо две 0,5 мг дозы MAb 583 с промежутком 24 часа. Группа, которой вводили 50 мкг гепсидина-25 в PBS с последующим 1,0 мг контрольного MAb к гепсидину (имитационного MAb), достигала значимого отличия с контрольной группой PBS плюс гепсидин-25 (Р=0,054; фигура 28).
Эти результаты были обнадеживающими и указывали на то, что MAb 583 обладал нейтрализующей активностью in vivo, которая подавляла биологическую активность гепсидина-25 в случае, когда оба последовательно IP вводили самцам C57BL/6 мышей. Ранее было показано, что 50 мкг доза человеческого гепсидина-25, применявшаяся в таком in vivo эксперименте, индуцировала сильное пониженное содержание железа в крови на период до 72 часов у C57BL\6 мышей, и поэтому такая доза представляла собой строгий критерий нейтрализующей активности MAb 583 (Rivera et al. 2005).
Пример 10
Мышино-человеческое химерное антитело
Вариабельные домены легкой и тяжелой цепей мышиного МАВ 583 к гепсидину синтезировали и клонировали в проприетарный вектор экспрессии у млекопитающих без каких-либо модификаций. Вариабельный домен легкой цепи клонировали в одной рамке считывания с сигналом секреции и константным доменом легкой каппа-цепи человека. Вариабельный домен тяжелой цепи клонировали в одной рамке считывания с сигналом секреции и константным доменом IgG1 человека. У полученного клона ВАР070-01 проверяли последовательность. Следует отметить, что приведенная ниже сигнальная последовательность выделена подчеркиванием.
Последовательность ДНК легкой цепи ВАР070-01

Аминокислотная последовательность белка легкой цепи ВАР070-01

Последовательность ДНК тяжелой цепи ВАР070-01


Аминокислотная последовательность белка тяжелой цепи ВАР070-01

Последовательность вариабельного участка тяжелой цепи мышиного mAb 583:

Последовательность вариабельного участка легкой цепи мышиного mAb 583:

СНО клетки высеивали в 6-луночные планшеты, трансфицировали посредством ВАР070-01 (рекомбинантной химеры) или только пустым вектором (ВАР070) с применением проприетарного протокола трансфекции и культивировали при 37°С в DMEM с 10% сывороткой. Супернатанты собирали через 48 часов после трансфекции. Концентрацию IgG в супернатанте определяли с помощью набора для количественного ELISA BioAtla. Концентрация рекомбинантного ВАР070-01 согласно результатам определения с помощью количественной ELISA составляла 3650 нг/мл.
Наш первый эксперимент с химерой MAb 583 ВАР070-01 был предназначен для сравнения химеры MAb 583 с мышиным MAb 583 в отношении связывающей активности к гепсидину-25. Серии двукратных, а затем трехкратных разведений супернатантов клеток СНО ВАР070-1 или мышиного MAb 583 (лот 10, 0,5 мг/мл), начиная с 600 нг/мл, инкубировали в микролуночных планшетах со 100 нг гепсидина-25, ковалентно связанного с лунками, активированными при помощи малеинового ангидрида. Связывание антитела определяли при помощи антитела к IgG человека (H+L), конъюгированного с HRP (1:2500), для супернатанта ВАР070-01. Связывание антитела контролем, представлявшим собой очищенное MAb 583, определяли с помощью антитела кролика к IgG мыши (H+L) при таком же разведении. Реакции останавливали при помощи 1 Н HCl через 5 минут, после этого в лунки добавляли ТМВ и немедленно считывали. Значение OD 450 нм у реакционных смесей измеряли при помощи Molecular Device SPECTRAmax Plus (фигура 29). Из результатов OD, показанных в приведенной ниже таблице и на фигуре 29, видно отличное связывание химерным MAb 583 ВАР070-01 и контролем, представлявшим собой очищенное MAb 583, что указывает на то, что клон химеры ВАР070-01 был построен правильно и что CDR мышиных тяжелой цепи и легкой цепи функционировали правильно в контексте каркаса IgG человека. Эти данные подтверждали, что клонирование, экспрессия ВАР070-01 в культуре клеток СНО и связывающая активность химеры были достаточно робастные для продолжения протокола гуманизации. Мы проводили дополнительные эксперименты для подтверждения результатов начального наблюдения.
Значения OD 450 нм были следующими:
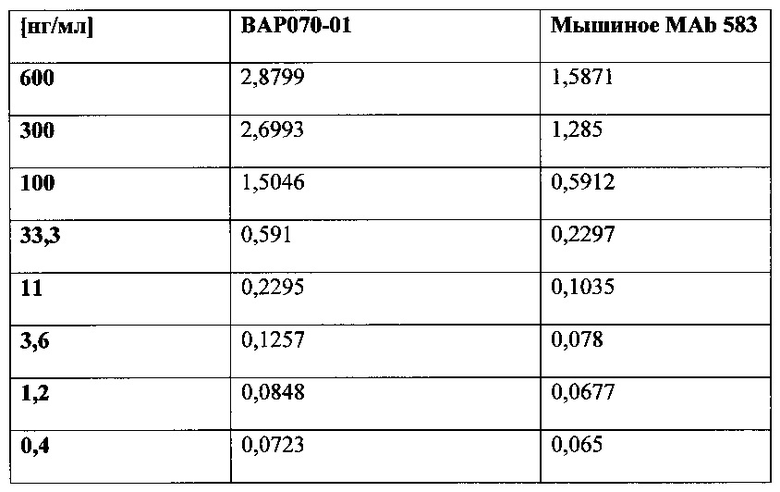
В этом эксперименте химера MAb 583, ВАР070-01, явно связывалась с гепсидином-25 с большей степенью, чем это делало серийно разведенное очищенное мышиное MAb 583, что подтверждало, что специфичность и функциональность химерных антител сравнима с исходным мышиным MAb 583 (фигура 29).
Анализ начального связывания представлял собой полуколичественную оценку химеры ВАР070-01, поскольку сравнение включало супернатант культуры клеток мышино-человеческого химерного MAb 583 с очищенным мышиным MAb 583. Количественное определение концентрации химерного антитела в супернатантах культуры клеток проводили с помощью проприетарного иммунологического способа и очищенного MAb 583 с применением ВСА. Другой анализ потенциально мог привести к возможности сравнения неравных количеств антитела, и, таким образом сигнала, при сравнении с помощью ELISA. Несмотря на подобные предостережения, у MAb 583 и химеры ВАР070-01 наблюдали возрастание сигнала при возрастании уровня антитела, как и прогнозировали для такого сравнения.
Титрование химеры 583 с помощью планшета с покрытием гепсидина-25
Для сравнения связывающей активности ВАР070-01 и пустого вектора определяли ВАР070 с помощью ELISA. Если кратко, человеческий гепсидин-25 (100 нг/лунка) ковалентно связывали с активированными при помощи малеинового ангидрида микролуночными планшетами на протяжении ночи, а оставшиеся несвязанные активированные сайты блокировали согласно инструкциям производителя. Серийно разведенные супернатанты культуры, содержавшие химеру MAb 583, ВАР070-01, или пустой вектор, ВАР070, добавляли в микролуночный планшет и инкубировали при комнатной температуре (RT) в течение 2 часов. Связавшееся химерное антитело MAb 583 определяли с помощью HRP-антитела к IgG человека с субстратом ТМВ. Результаты показаны на фигуре 30.
Из данных явно видно, что мышино-человеческое химерное MAb ВАР070-01 специфично распознавало человеческий гепсидин-25 с отличной аффинностью, в то время как в этом анализе отсутствовало связывание с гепсидином-25 у супернатанта СНО ВАР070 (фигура 30). Из данных, показанных на фигурах 29 и 30, видно весьма заметные результаты сравнения очищенного MAb 583 и химерного MAb 583 ВАР070-01 и специфичного связывания с гепсидином-25 у химеры ВАР070-01. Ожидаемые результаты ELISA сравнения химеры ВАР070-01 с отрицательным контролем, который представлял собой пустой вектор ВАР070, были продемонстрированы с помощью планшетов с покрытием гепсидином-25 для захвата функциональных IgG-антител человека и антител к IgG человека (H+L) для детекции (фигура 30).
Покрытие белком G C-ELISA для химеры ВАР070-01 583
Для оценки связывания химеры ВАР070-01 с белком G и степени нейтрализации ВАР070-01 MAb 583 синтетическим гепсидином-25 мы проводили анализ C-ELISA с применением NT-биотин-гепсидина-25 в качестве меченого вещества (фигура 31). Подобный формат C-ELISA также был пригоден для испытания связывания меченого вещества NT-биотин-гепсидин-25 с химерой ВАР070-01 и конкуренции с гепсидином-25 за связывание с химерным MAb 583. Для захвата химерных антител ВАР070-01 мы покрывали микролуночные планшеты белком G (150 нг/лунка) на протяжении ночи в карбонатном буфере для сенсибилизации поверхностей.
Планшет промывали при помощи TBST, и добавляли супернатант клеток СНО, содержавший химеру MAb 583 ВАР070-01 (150 нг/лунка), и позволяли связываться с белком G при RT в течение 1 часа.
Планшет промывали при помощи TBST и один (1) нг/лунка NT-биотин-гепсидина-25 смешивали с различными количествами (0-100 нг) стандарта, представлявшего собой синтетический гепсидин-25, в TBST, 0,25% BLOTTO (реагента для проведения вестерн-блоттинга) и вносили в планшет для конкурентного связывания. Планшет промывали при помощи TBST, и добавляли SA-HRP (1:2500), и позволяли связываться в течение 1 часа.
Планшет промывали при помощи TBST, и добавляли субстрат TBS, и через 10 минут останавливали реакцию при помощи стоп-реагента. Поглощение на 450 нм измеряли на спектрофотометре.
В приведенной ниже таблице показано поглощение (OD450) для C-ELISA ВАР070-01:
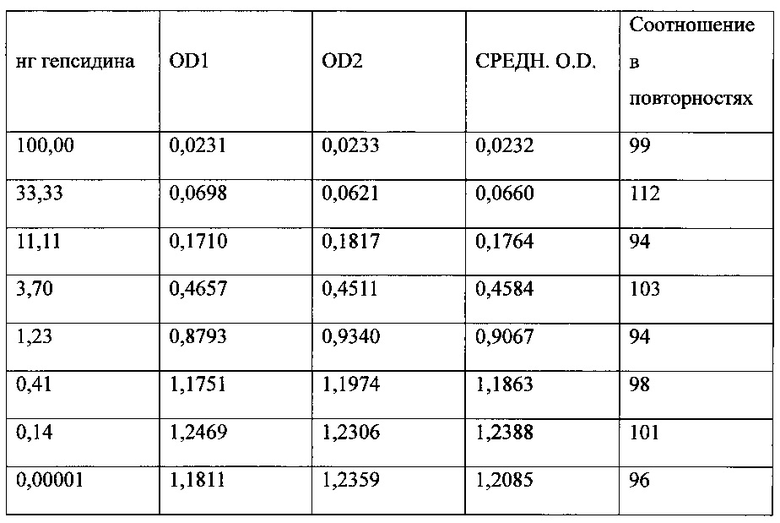
Из результатов в приведенной выше таблице и на фигуре 31 видно, что синтетический гепсидин-25 конкурировал за сайты связывания химеры ВАР070-10 и что химерные антитела MAb 583 были специфичны к гепсидину-25 и NT-биотин-гепсидину-25. Стандартную кривую, показанную на фигуре 31, строили при четырехпараметрической логистической регрессии (Graphpad Prism; Сан-Диего, Калифорния). Мы использовали Prism для расчета ЕС50 для связывания гепсидина-25 с ВАР070-01 и определяли ЕС50=54 нг/мл (фигура 31). Подобное значение ЕС50 является отличным с учетом того факта, что оно получено для неочищенного супернатанта и неочищенного MAb 583, для которого ЕС50≤5,0 нг/мл (фигура 16).
C-ELISA с нейтравидином для химеры 583 ВАР070-01
Другую оценку химерного MAb 583 ВАР070-01 проводили путем нанесения на микролуночные планшеты покрытия нейтравидина (150 нг/лунка) на протяжении ночи в карбонатном буфере для сенсибилизации поверхностей. Планшет промывали посредством TBST. Меченое вещество NT-биотин-гепсидин-25 добавляли в количестве 1 нг/лунка с различными концентрациями гепсидина-25 (0-100 нг/лунка) и позволяли связываться при RT в течение 1 часа. В таком C-ELISA анализе для детектирования связанной химеры MAb 583 ВАР070-01 применяли HRP-антитела к IgG человека (H+L).
В приведенной ниже таблице показаны как значения повторностей, так и среднее OD450 относительно концентраций гепсидина-25. Из результатов видно, что человеческий гепсидин-25 явно нейтрализовал сайты связывания на химере ВАР070-01 и что меченое вещество NT-биотин-гепсидин-25 (аналог гепсидина) эффективно связывалось.
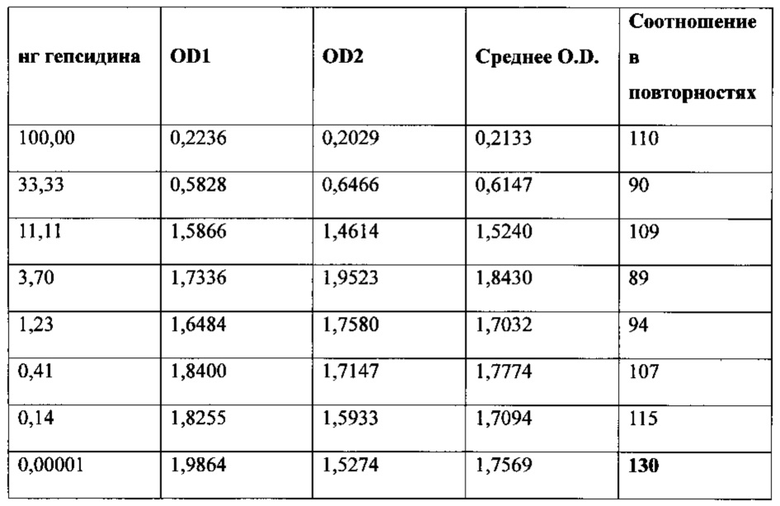
На фигуре 32 приведены данные в графическом виде, иллюстрирующие результаты, представленные в приведенной выше таблице, в отношении конкурентного связывания химеры ВАР070-01 с NT-биотин-гепсидином-25. Как и ожидали для любого конкурентного анализа, с повышением концентрации немеченого антигена (например, гепсидина-25) наблюдали более низкий сигнал. На фигуре 32 показаны две повторности OD450 и среднее значение OD450 для каждого повышения концентрации гепсидина-25.
В целом, из данных, которые были нами приведены в примере 10, видно, что химерное Mab 583 ВАР070-01 сохраняло высокие характеристики аффинности и специфичности, как и исходное мышиное антитело MAb 583, и что полная гуманизация нативного мышиного антитела MAb 583 будет давать потенциальное терапевтическое антитело, пригодная для доклинического и клинического испытания на людях.
Несмотря на то что в настоящем документе были показаны и описаны некоторые варианты осуществления настоящего изобретения, специалистам в настоящей области будет очевидно, что такие варианты осуществления приведены лишь для примера. Специалистам в настоящей области теперь будут очевидны различные вариации, изменения и замены без отступления от вариантов осуществления. Следует понимать, что при практическом осуществлении вариантов осуществления для описанных в настоящем документе вариантов осуществления можно реализовать различные альтернативы. Подразумевают, что приведенная далее формула изобретения определяет объем вариантов осуществления и, таким образом, ею охватываются способы и структуры в объеме, определяемые пунктами такой формулы изобретения и их эквивалентами.
ПОСЛЕДОВАТЕЛЬНОСТИ
Нуклеотидные выравнивания CDR-1, CDR-2 и CDR-3 участков вариабельной тяжелой и легкой цепей MAb Н32, 583 и 1В1 к гепсидину. CDR выделены подчеркиванием. Каркасные участки не выделены подчеркиванием.
Вариабельная тяжелая цепь

Вариабельная легкая цепь

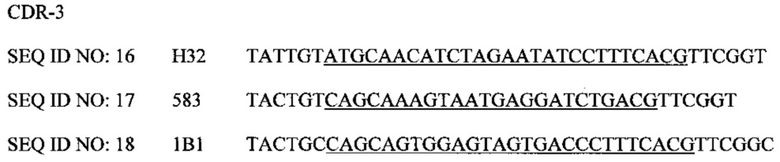
Пептид человеческого гепсидина (hepcidin-25, hep-25, Нер-25, hHepcidin-25): SEQ ID NO: 19 (25aa) DTHFPICIFCCGCCHRSKCGMCCKT
Пептид мышиного гепсидина-1 (mhepcidin-1, mhep-1, mHep-1, mHepcidin-1): SEQ ID NO: 20: (25aa) DTNFPICIFCCKCCNNSQCGICCKT
Пептид крысиного гепсидина (rhepcidin, rhep, rHep, rHepcidin): SEQ ID NO: 21: (25aa) DTNFPICLFCCKCCKNSSCGLCCIT
Пептид человеческого гепсидина-20 (hepcidin-20, hep-20, Hep-25, hHepcidin-20): SEQ ID NO: 22: (20aa) ICIFCCGCCHRSKCGMCCKT
Пептид человеческого гепсидина-22 (hepcidin-22, hep-22, Hep-22, hHepcidin-22): SEQ ID NO: 23: (23aa) HFPICIFCCGCCHRSKCGMCCKT
Пептид человеческого гепсидина-9 (hepcidin-9, hep-9, Hep-9, hHepcidin-9): SEQ ID NO: 24 (9aa) DTHFPICIF
Пептид человеческого гепсидина-5 (hepcidin-5, hep-5, Hep-5, hHepcidin-5): SEQ ID NO: 25 (5aa) DTHFP
Пептид человеческого гепсидина-10-25 (hepcidin-10-25, hep-10-25, Hep-10-25, hHepcidin-10-25): SEQ ID NO: 26 (16aa) CCGCCHRSKCGMCCKT
Пептид DNP-человеческий гепсидин-9-KLH (DNP-hepcidin-9-KLH, DNP-hep-9-KLH, DNP-Hep-9-KLH, DNP-hHepcidin-9-KLH): SEQ ID NO: 27 DNP-DTHFPIC(KLH-SMCC)-IF
Вариабельный участок тяжелой цепи IgG1 [Homo sapiens], GenBank: AAK62671.1
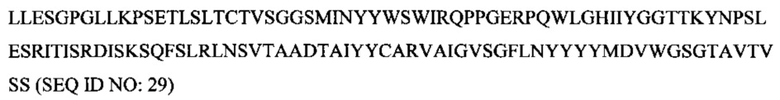
Вариабельный участок тяжелой цепи IgG1 [Homo sapiens], GenBank: AAK19936.1


Вариабельный участок легкой каппа-цепи иммуноглобулина [Mus musculus], GenBank:
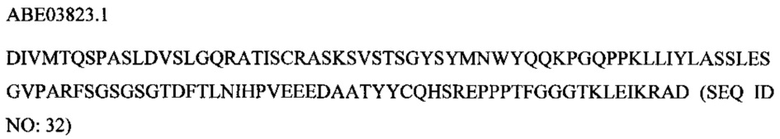
Вариабельный участок легкой каппа-цепи иммуноглобулина [Mus musculus], GenBank:
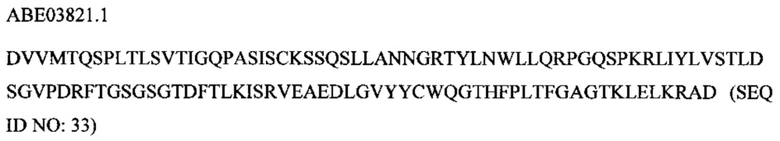
Вариабельный участок легкой цепи иммуноглобулина IgG1 [Homo sapiens], GenBank:
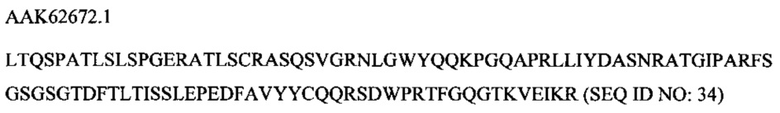
Мышиный_VK
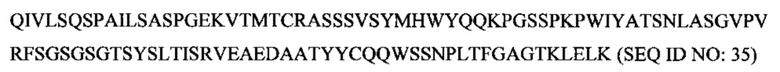
Мышиный_VH

Последовательности нуклеиновой кислоты и аминокислот вариабельной тяжелой и легкой цепей MAb Н32, 583 и 1В1 к гепсидину.


Полинуклеотидные последовательности CDR-1, CDR-2 и CDR вариабельной тяжелой и легкой цепей MAb Н32, 583 и 1В1 к гепсидину.
Вариабельная тяжелая цепь

Вариабельная легкая цепь


Ссылки
1. Hunter et al., J. Biol. Chem., 277:37597-37603 (2002).
2. Kemna et al., Blood, 106:1864-1866, 2005.
3. Kilpatrick KE, Wring SA, Walker DH, et al. 1997. Rapid Development of Monoclonal Antibodies Using Repetitive Immunization, Multiple Sites.
4. Krause et al., FEBS Lett. 480:147 (2000).
5. Lauth et al., J. Biol. Chem., 280:9272-9282 (2005).
6. Nemeth et al., J. Clin. Invest., 113:1271-1276, 2004.
7. Nemeth et al., Blood, 101:2461-2463, 2003.
8. Nicolas et al., Nat. Genet., 34:97-101, 2003.
9. Nicolas et al., Proc. Natl. Acad. Sci. USA, 99:4596-4601, 2002.
10. Nicolas et al., Proc. Natl. Acad. Sci. USA, 98:8780-8785, 2001.
11. Nicolas et al., J. Clin. Invest., 110:1037-1044, 2002.
12. Park et al., J. Biol. Chem. 276:7806 (2001).
13. Pigeon et al., J. Biol. Chem. 276:7811 (2001).
14. Rivera et al., Blood, 105:1797-1802, 2005.
15. Roetto et al., Nat. Genet., 33:21-22, 2003.
16. Weinstein et al., Blood, 100:3776-36781, 2002 The N-terminus of hepcidin is essential for its interaction with ferroportin.
17. Nemeth et al., Blood, 107(1):328-333, 2006.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИКИНОВЫЕ АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С НЕСКОЛЬКИМИ СС-ХЕМОКИНАМИ | 2010 |
|
RU2574786C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К ОНКОСТАТИНУ М И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2600444C2 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С БИАНТЕННАРНЫМИ АНТИГЕНАМИ ЛЬЮИСА B И ЛЬЮИСА Y | 2019 |
|
RU2803097C2 |
| АНТИТЕЛА, КОТОРЫЕ СПЕЦИФИЧНО СВЯЗЫВАЮТ АЛЬФА-ТОКСИН STAPHYLOCOCCUS AUREUS, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2620065C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕСЯ С PSL PSEUDOMONAS, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2708977C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2671481C2 |
| АНТИТЕЛА ПРОТИВ G-CSFR И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2605595C2 |
| СКОНСТРУИРОВАННОЕ АНТИТЕЛО ПРОТИВ TSLP | 2010 |
|
RU2575039C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ С ПРИМЕНЕНИЕМ ИНГИБИТОРОВ КОСТНОГО МОРФОГЕНЕТИЧЕСКОГО БЕЛКА 6 (ВМР6) | 2017 |
|
RU2790023C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К ТОКСИНАМ CLOSTRIDIUM DIFFICILE | 2013 |
|
RU2628305C2 |






















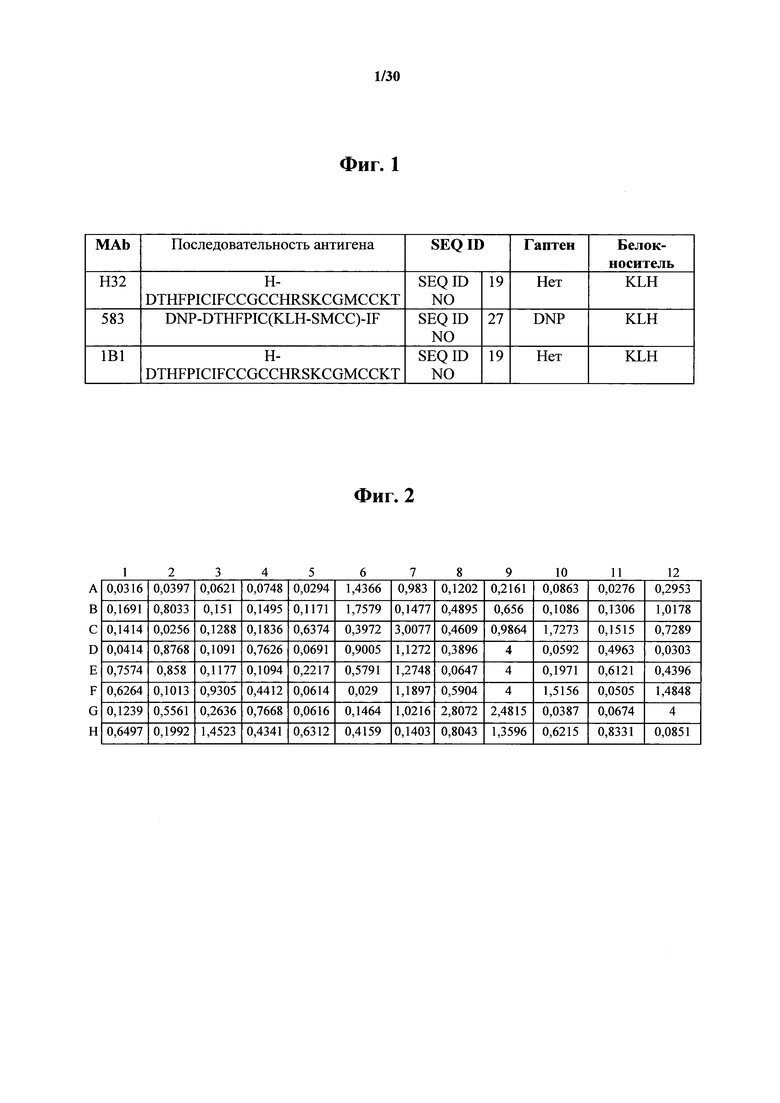

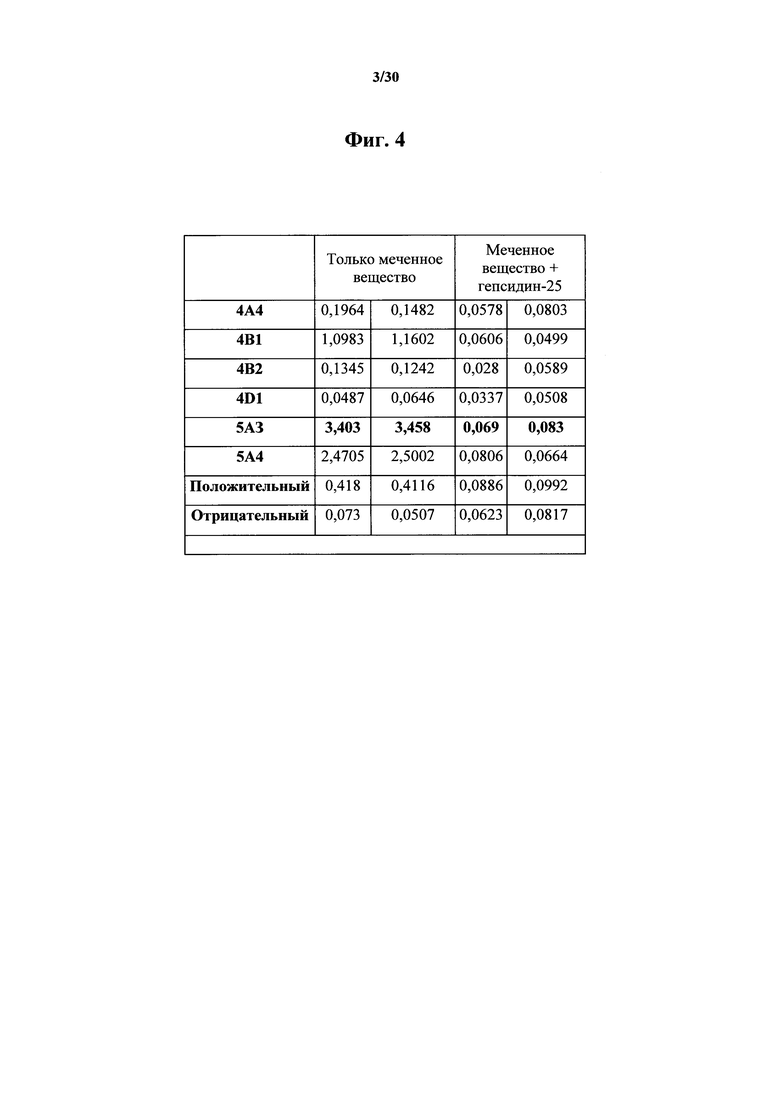
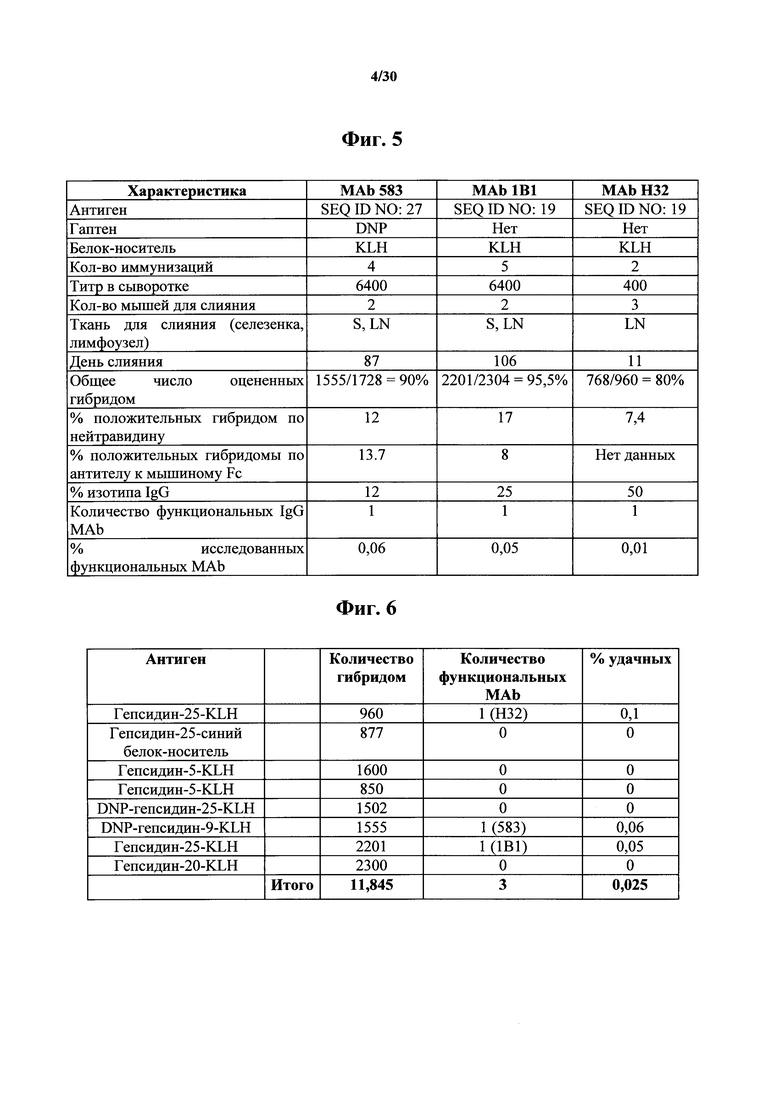
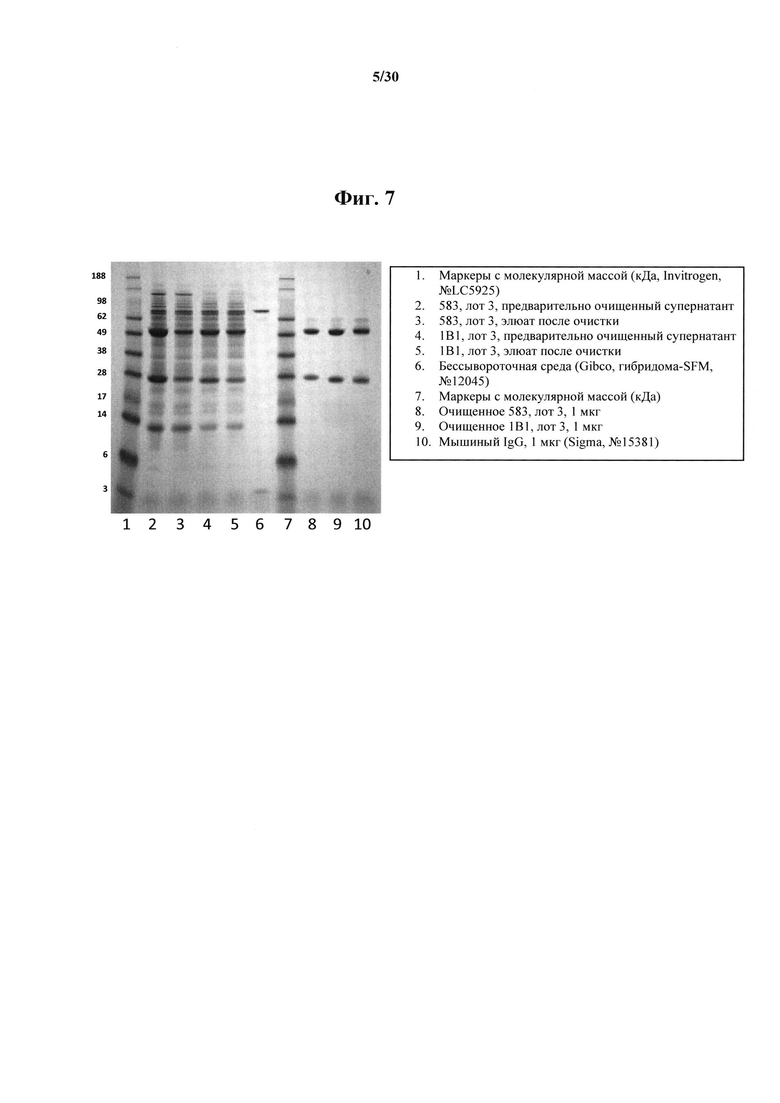
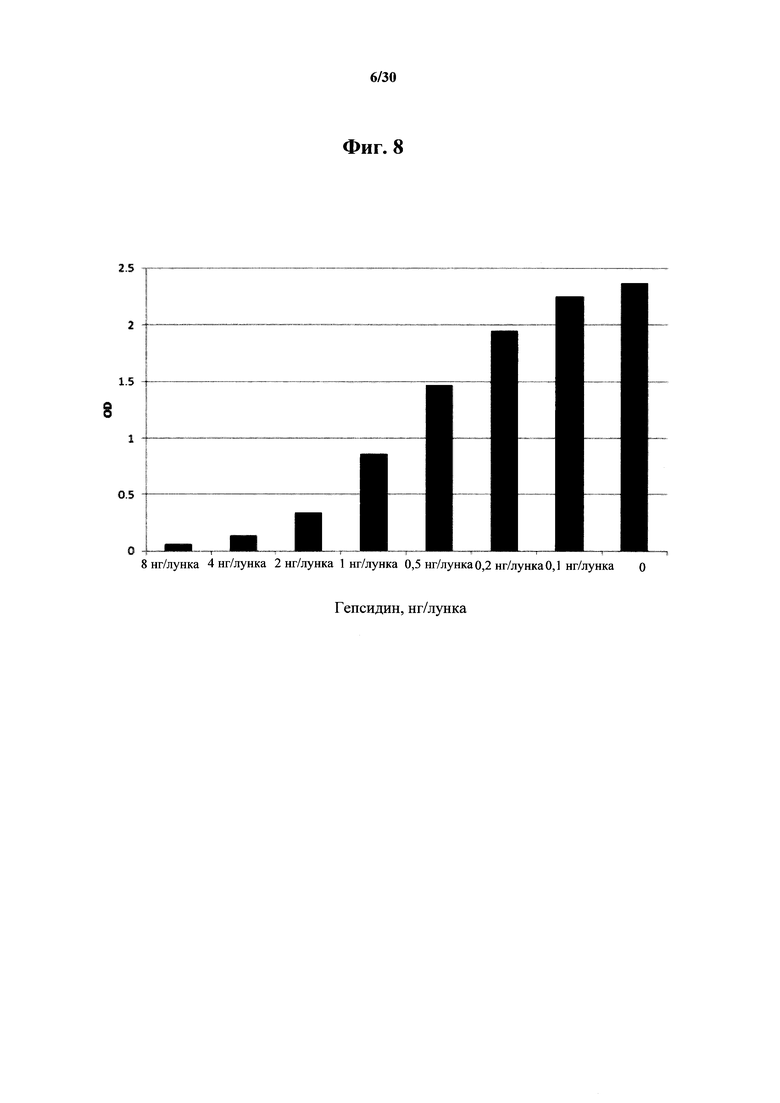
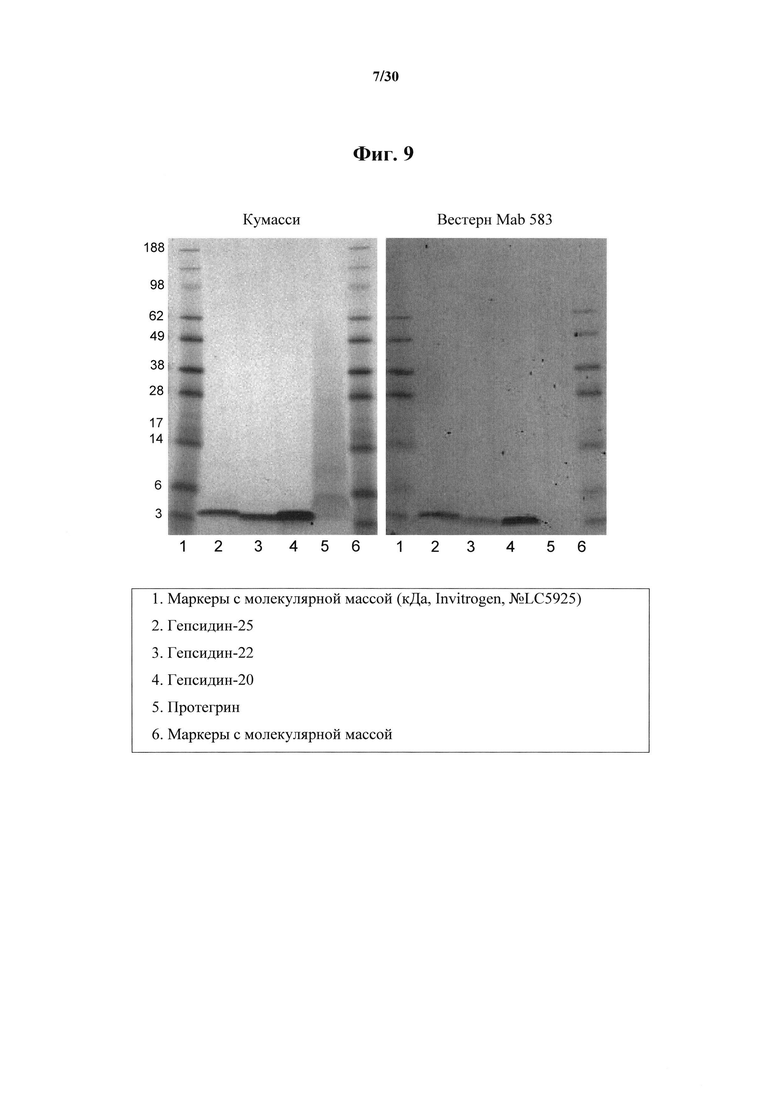
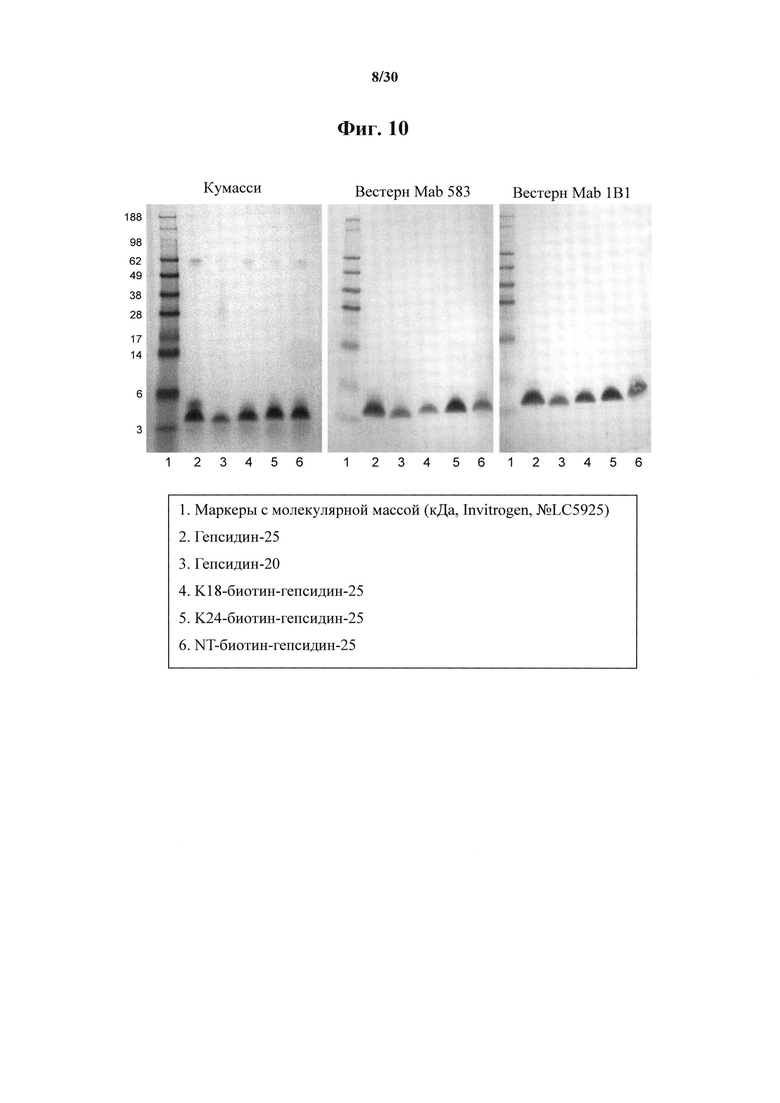
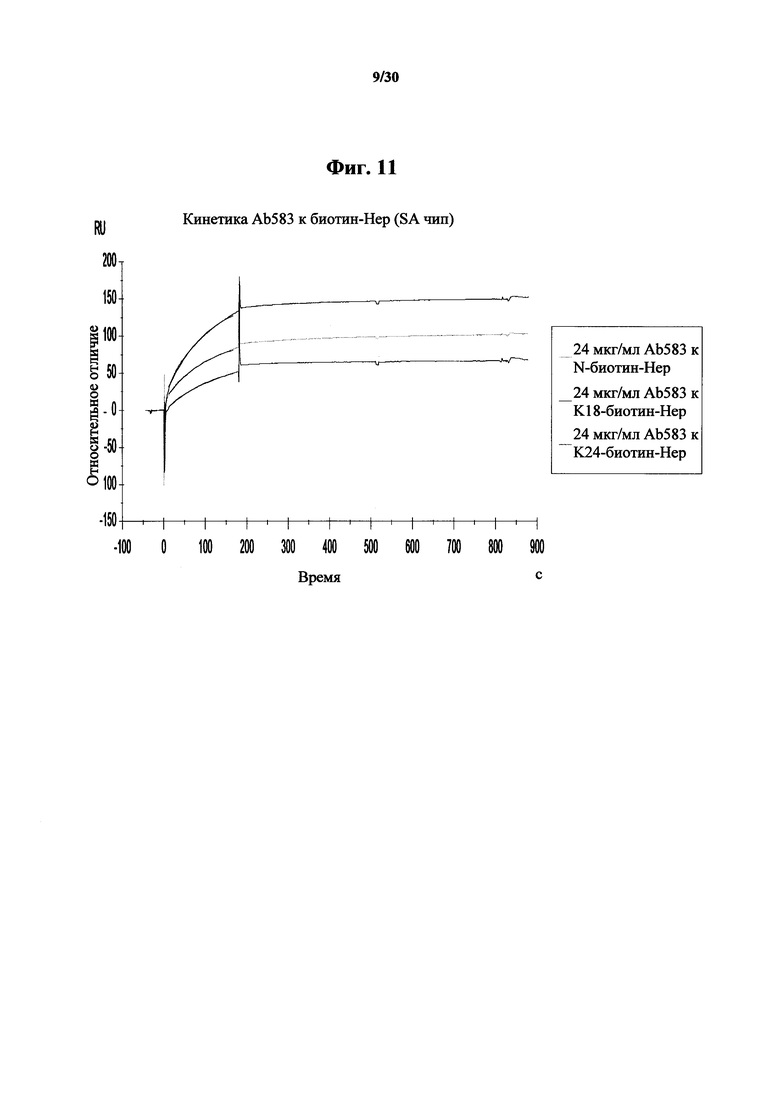
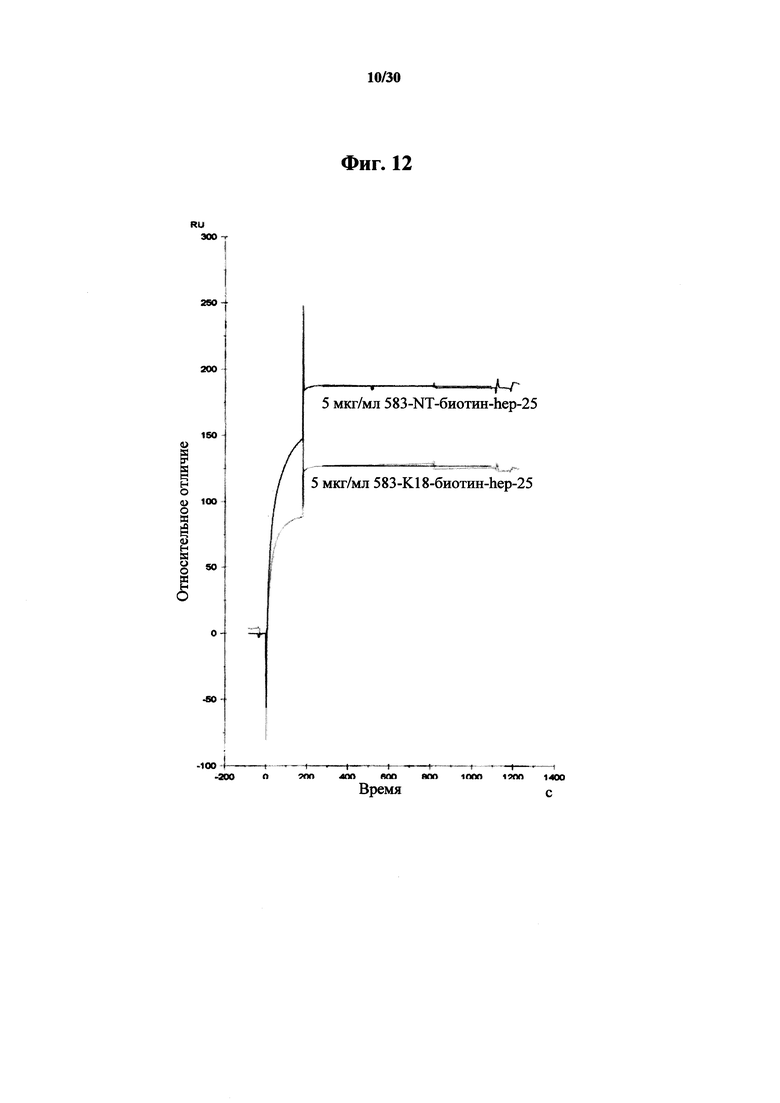
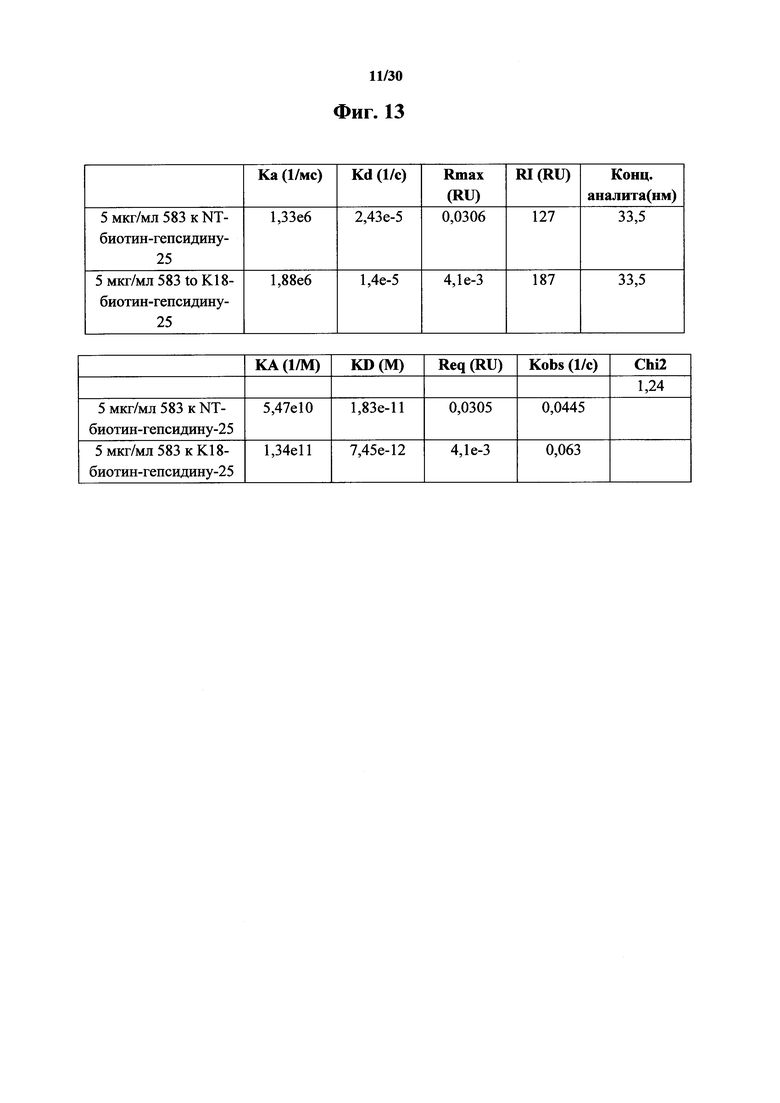
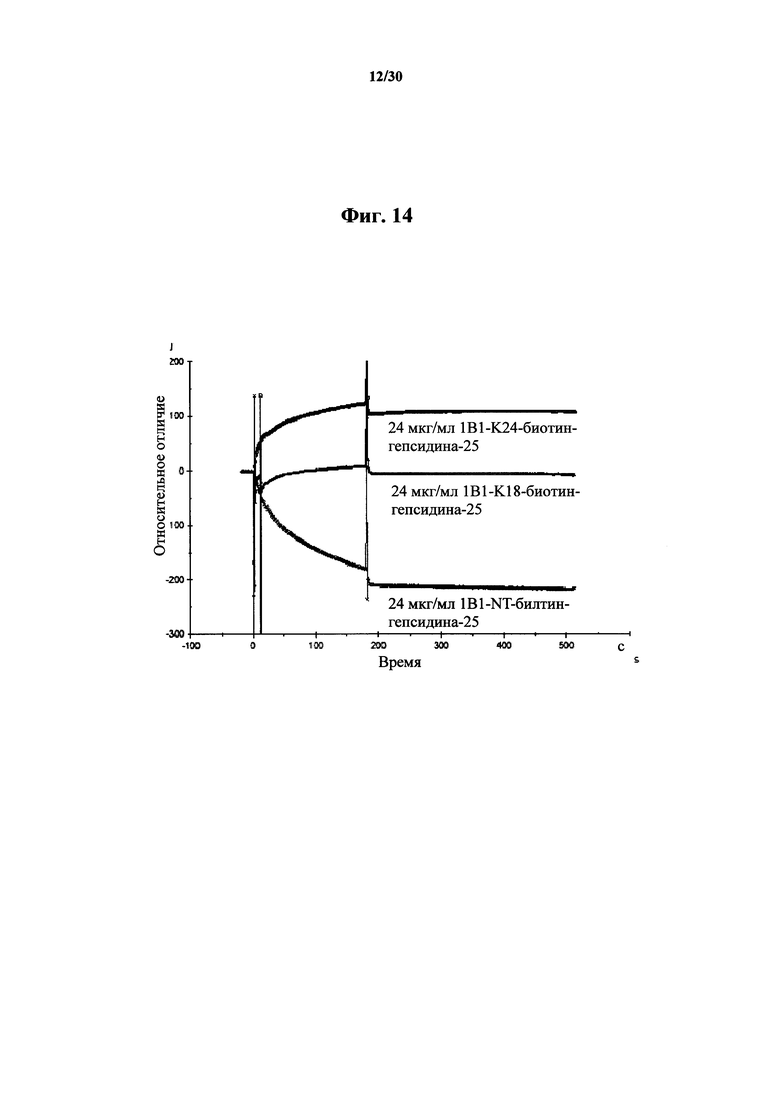
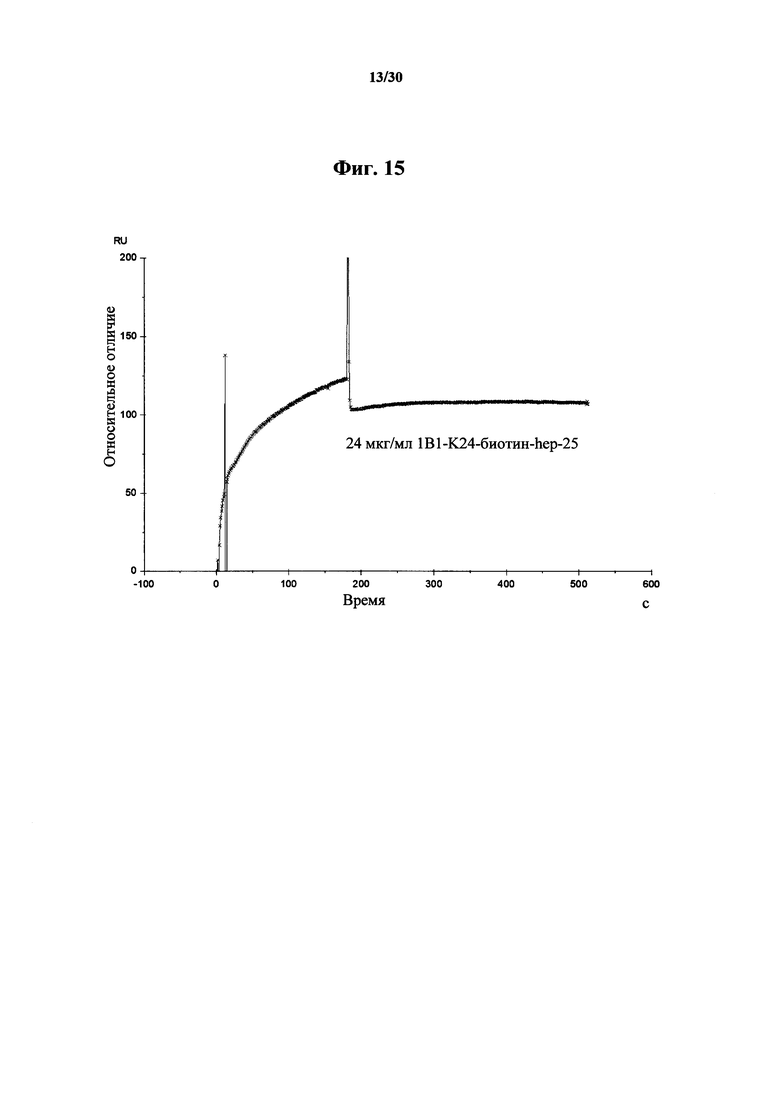
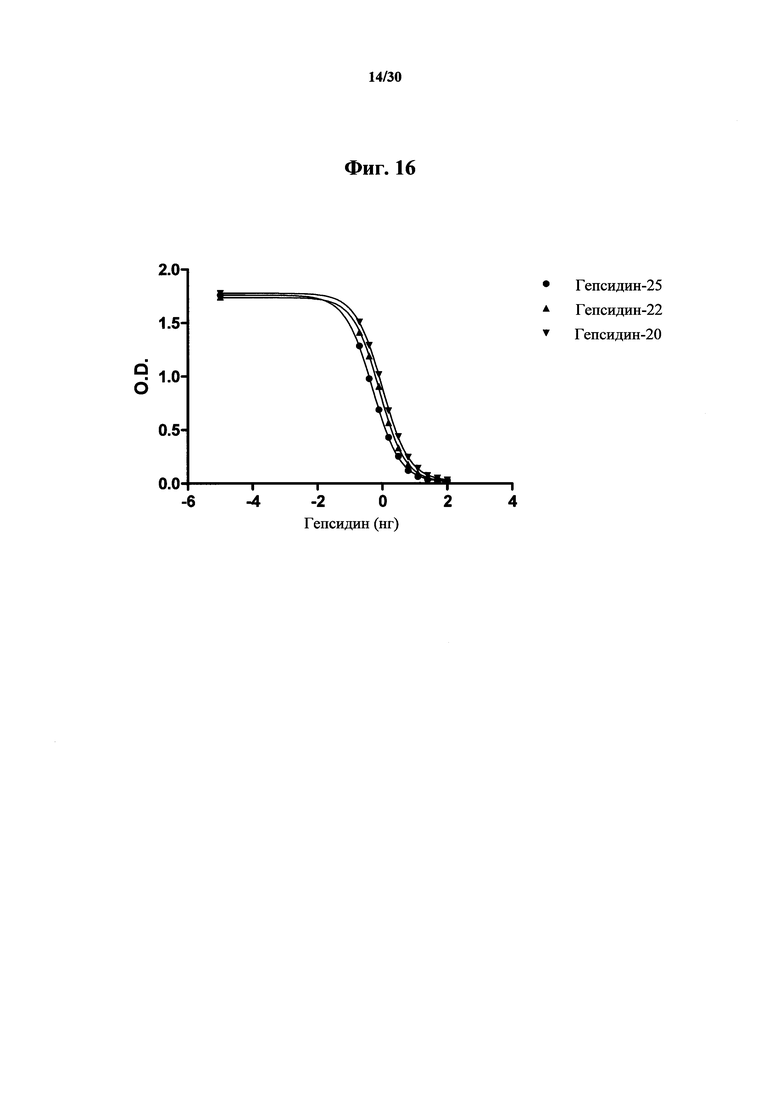
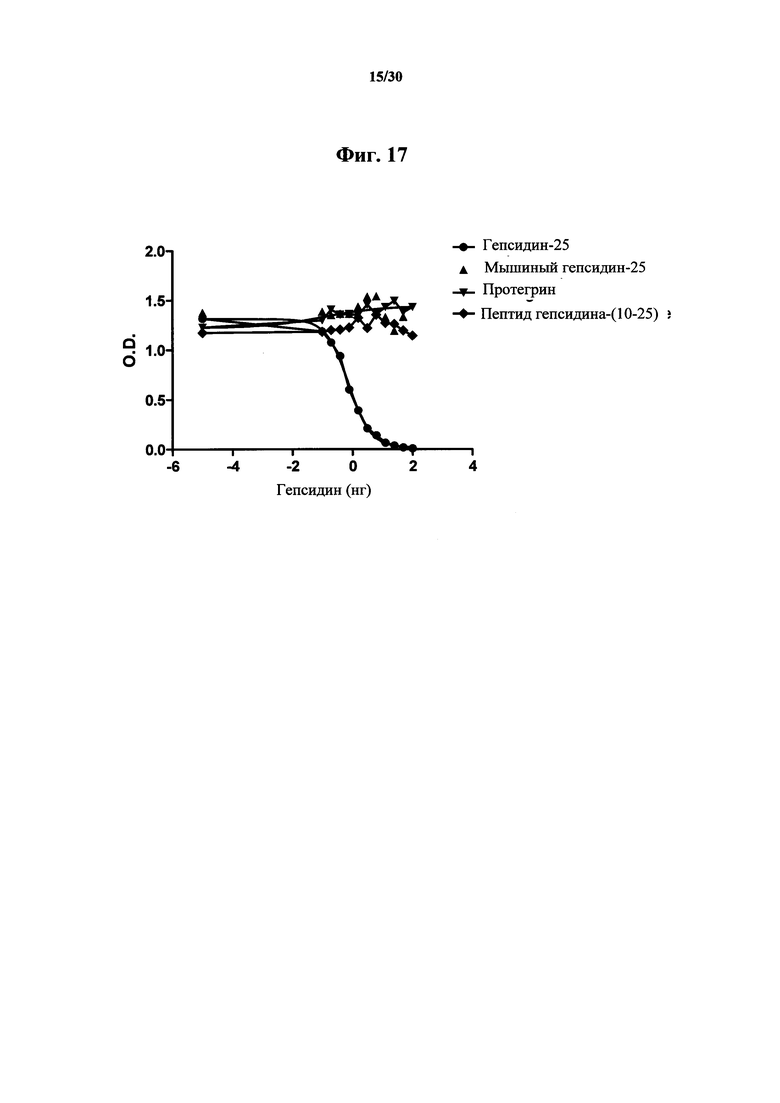
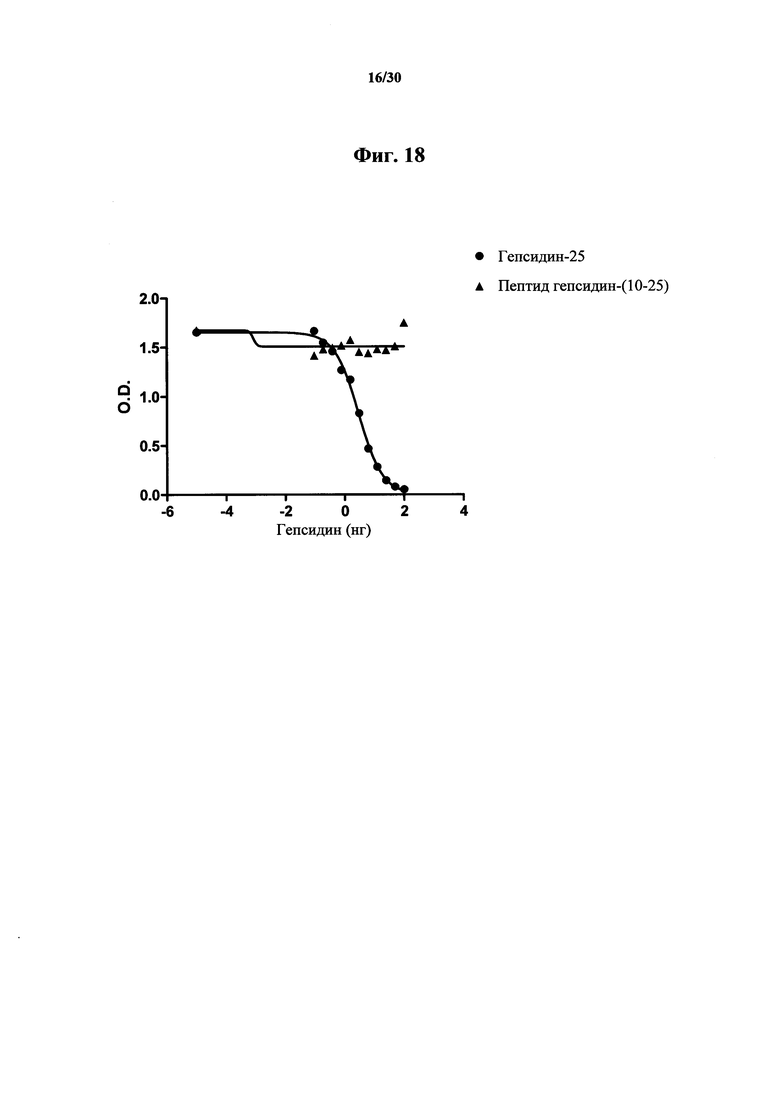
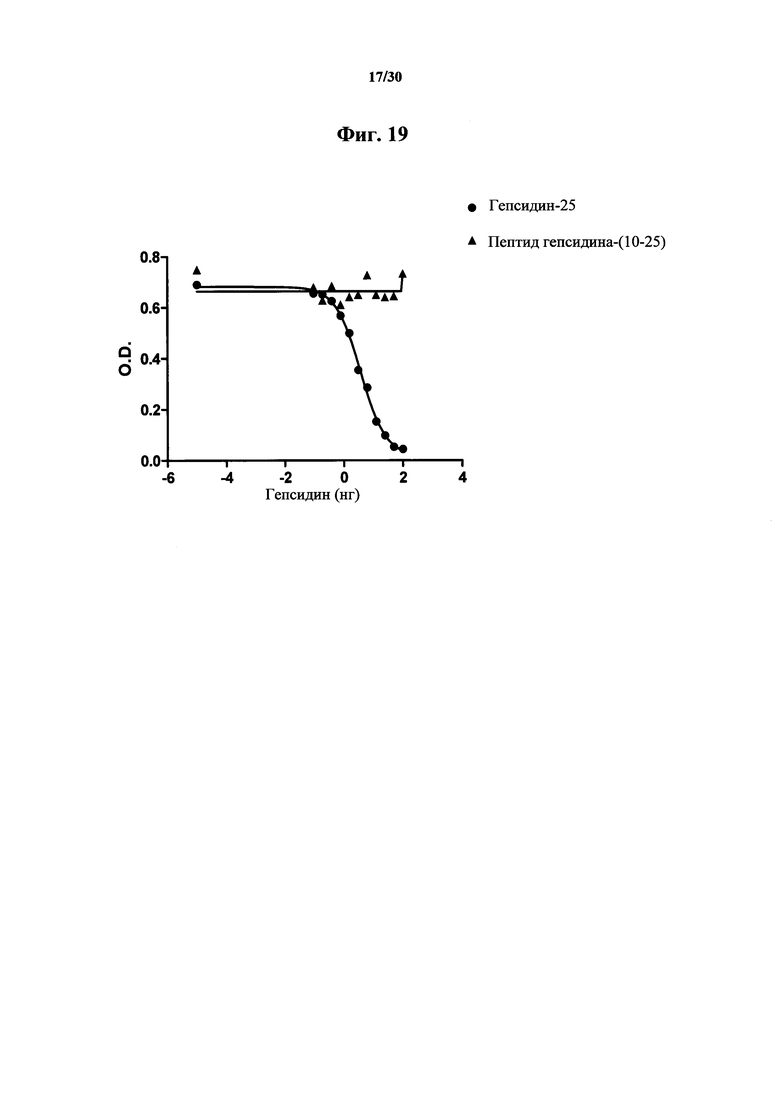
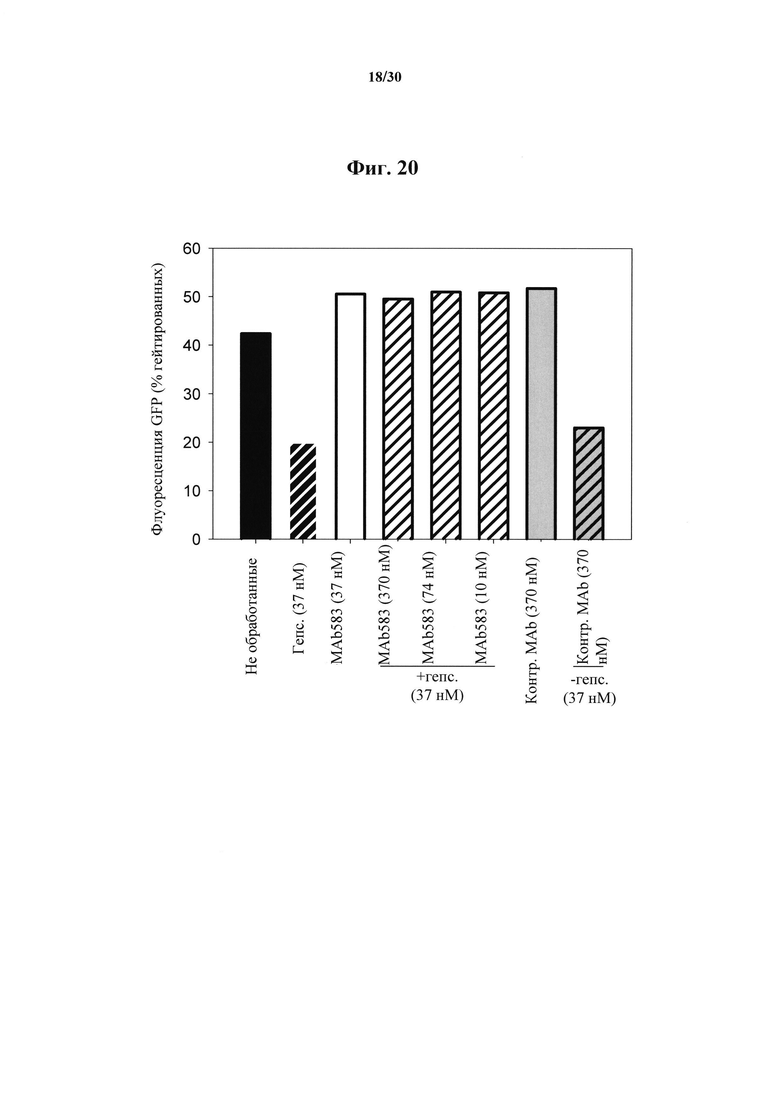
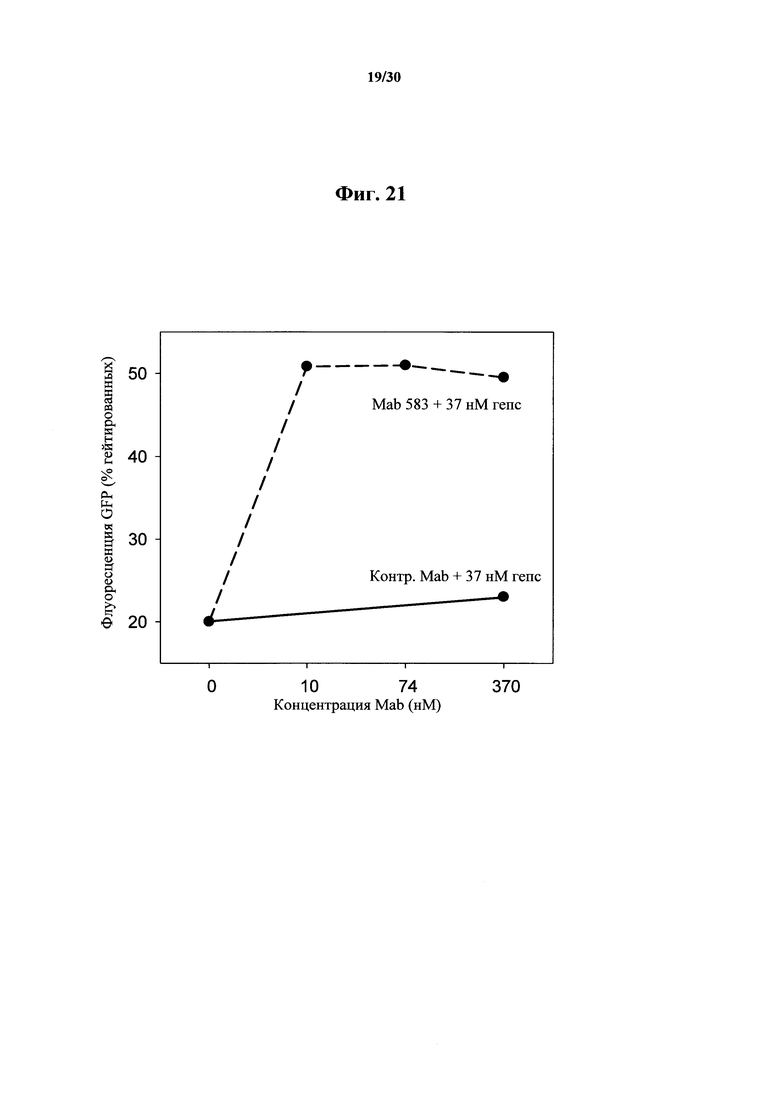
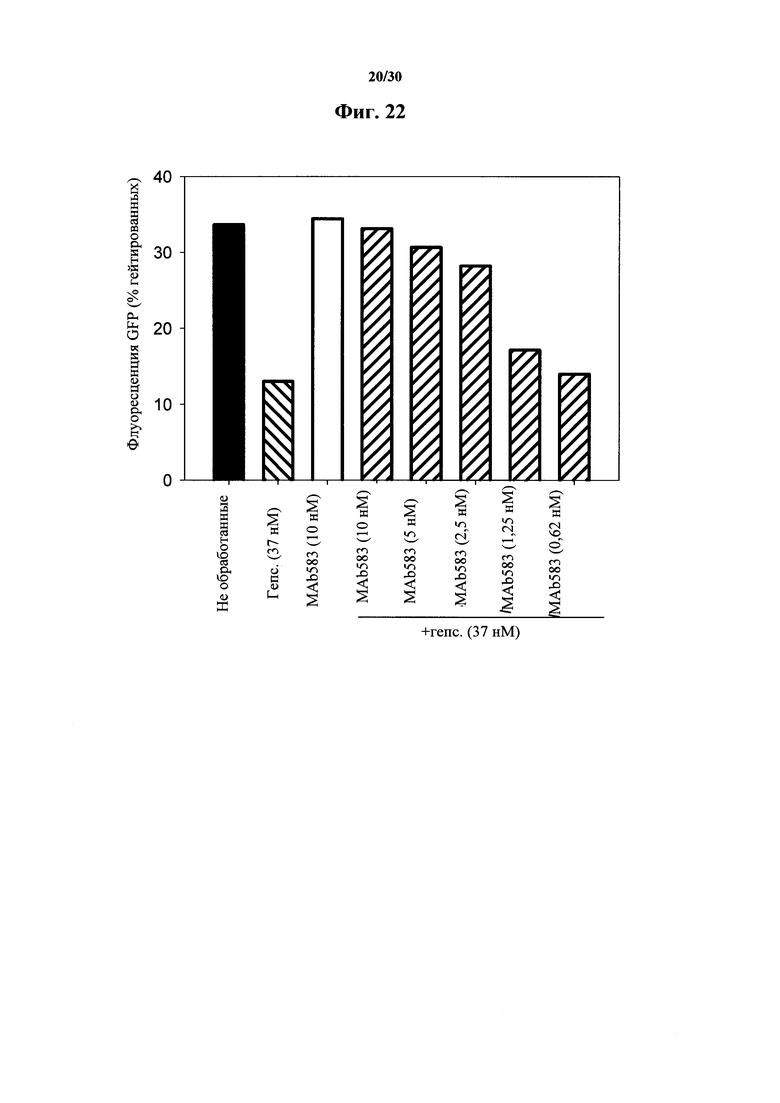
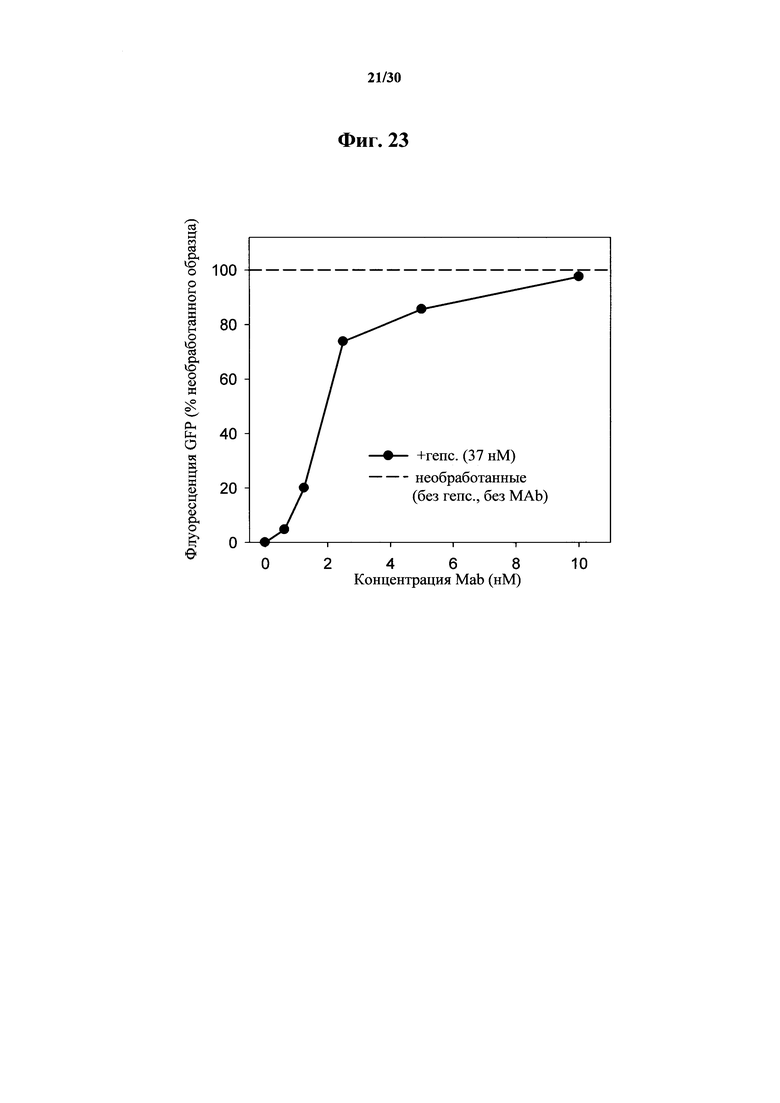
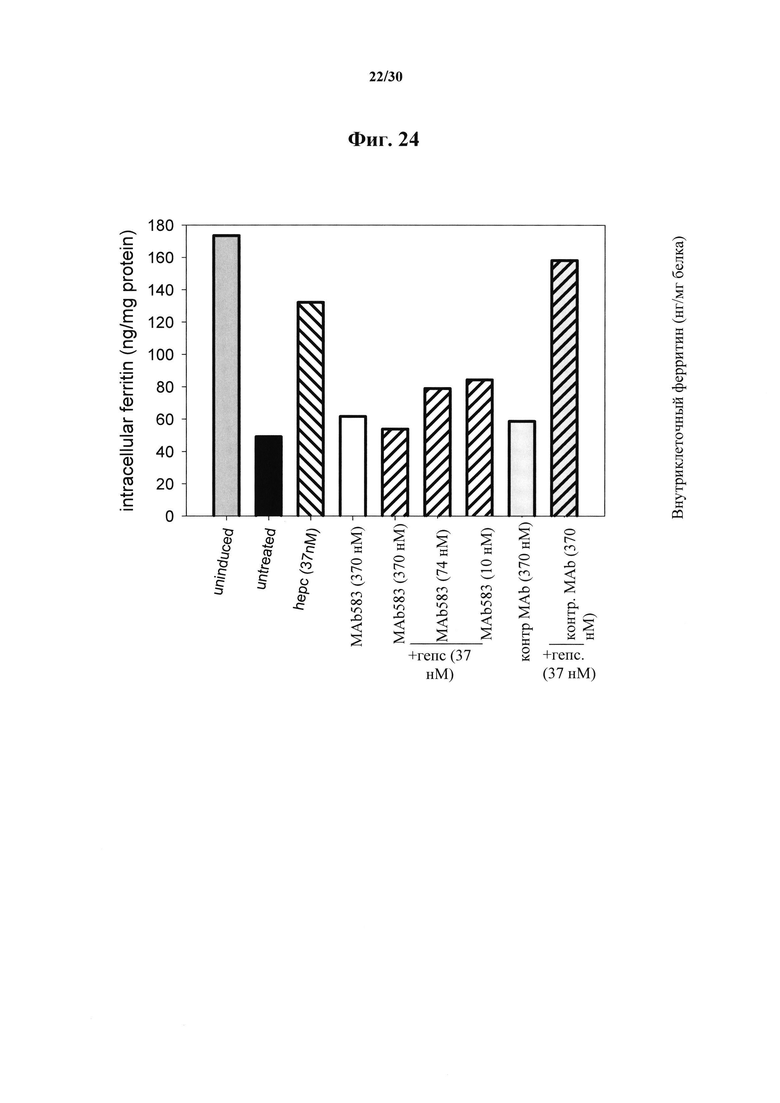
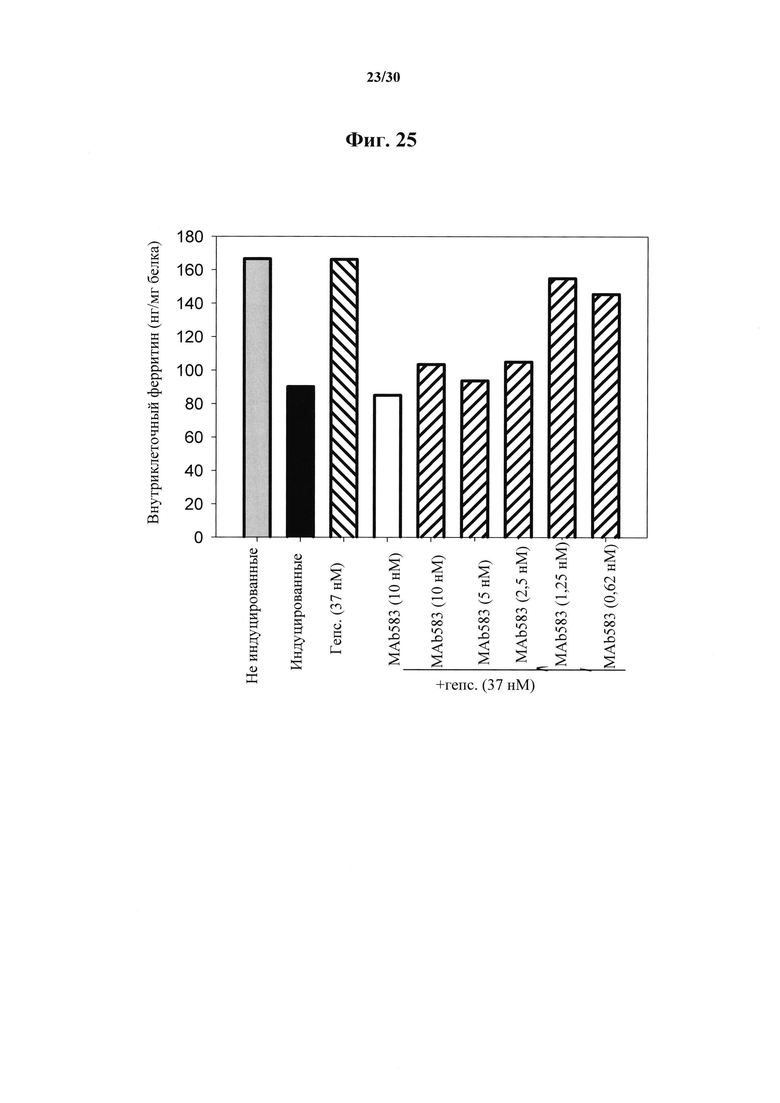
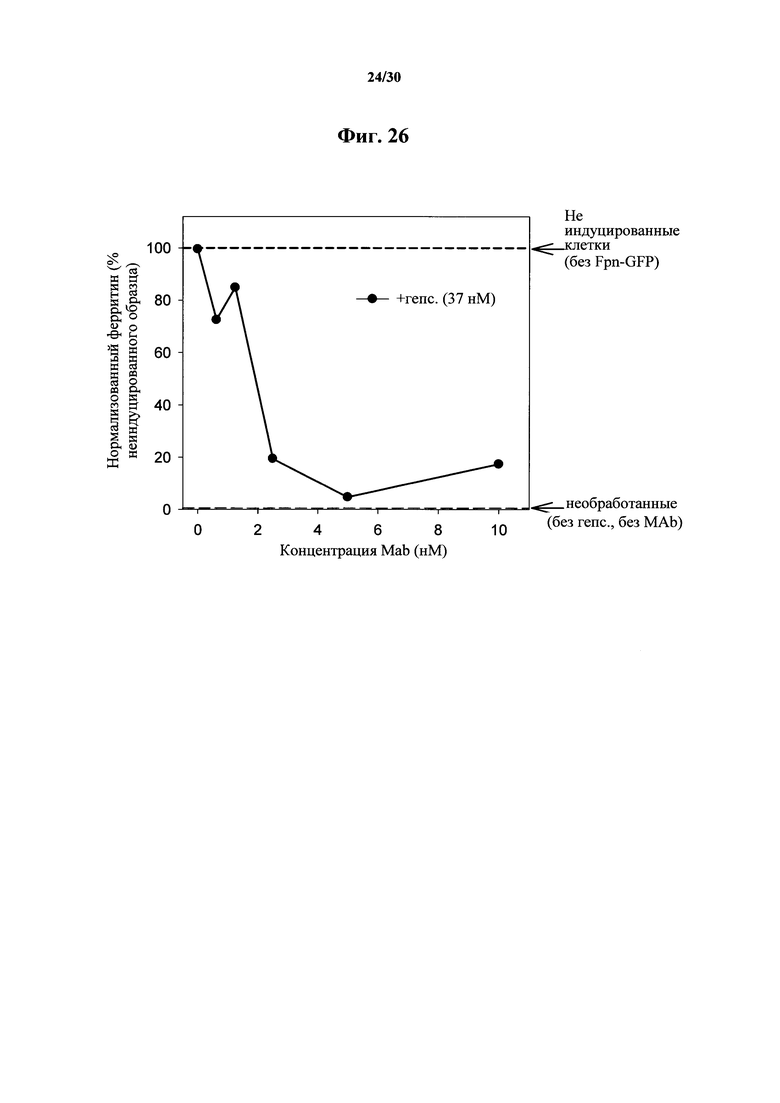
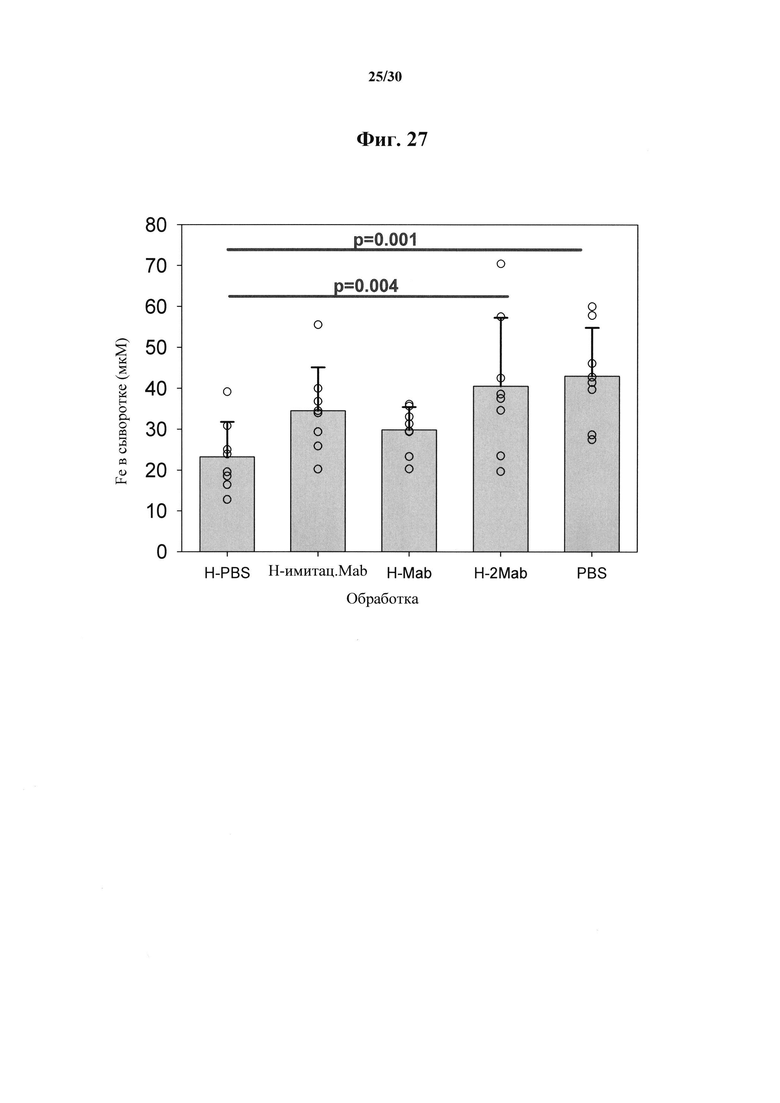
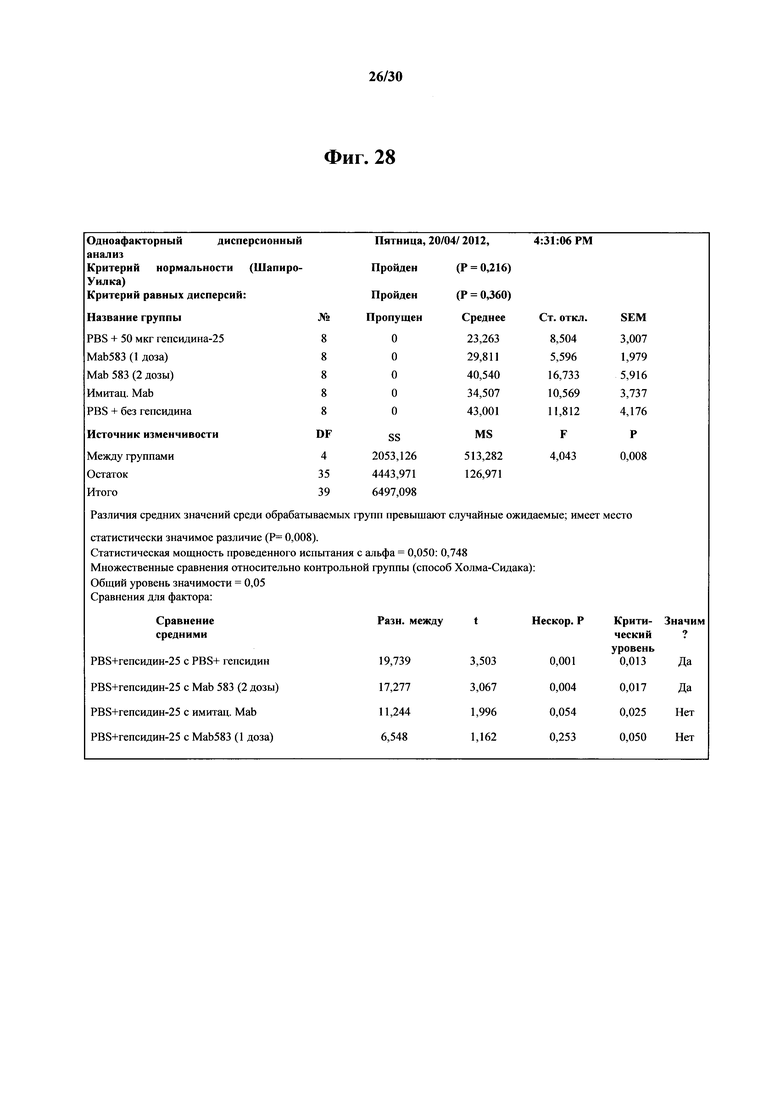
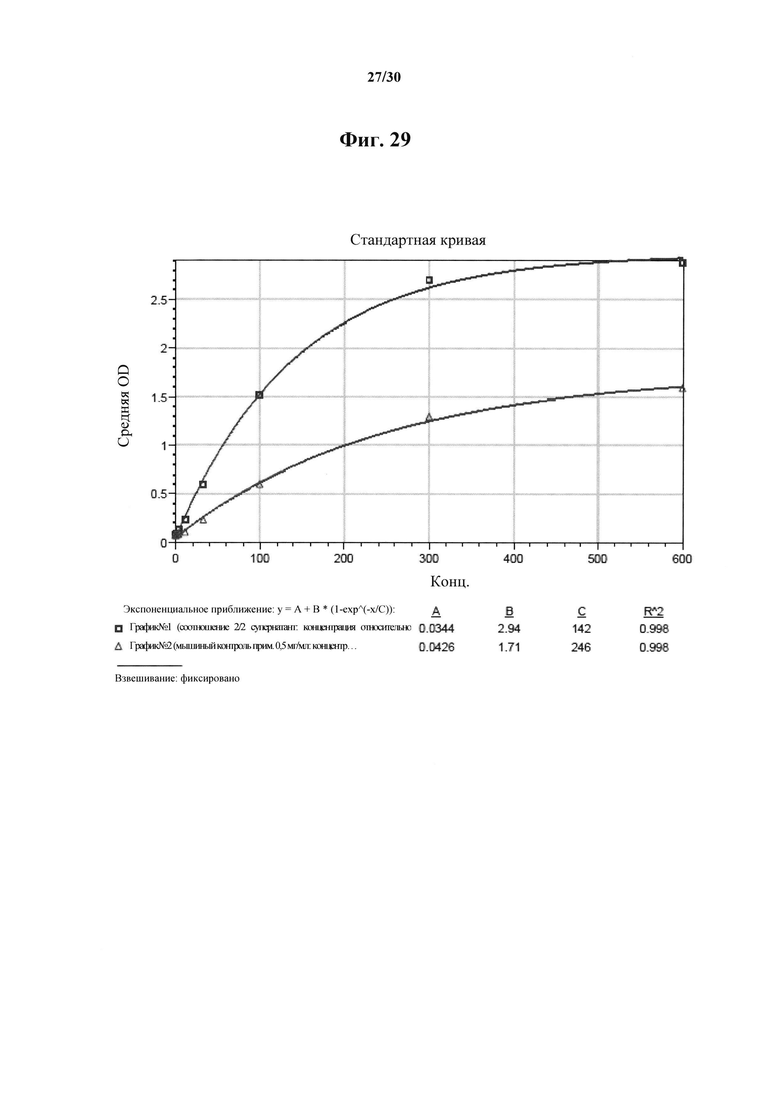
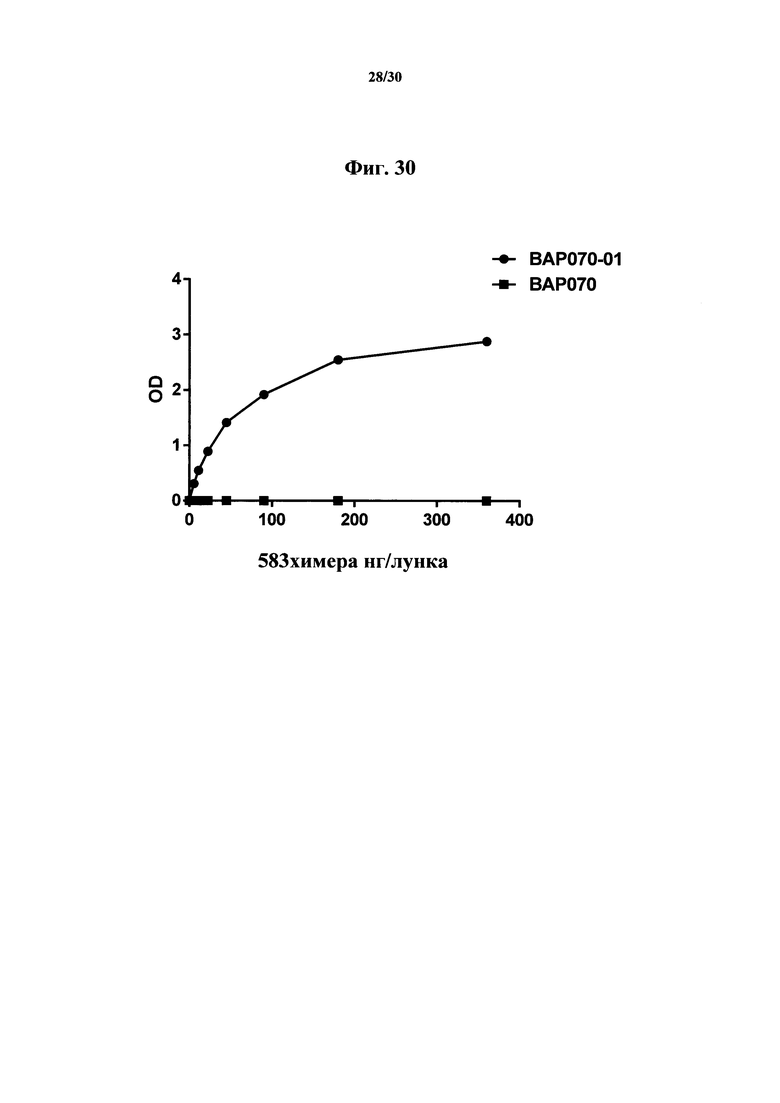
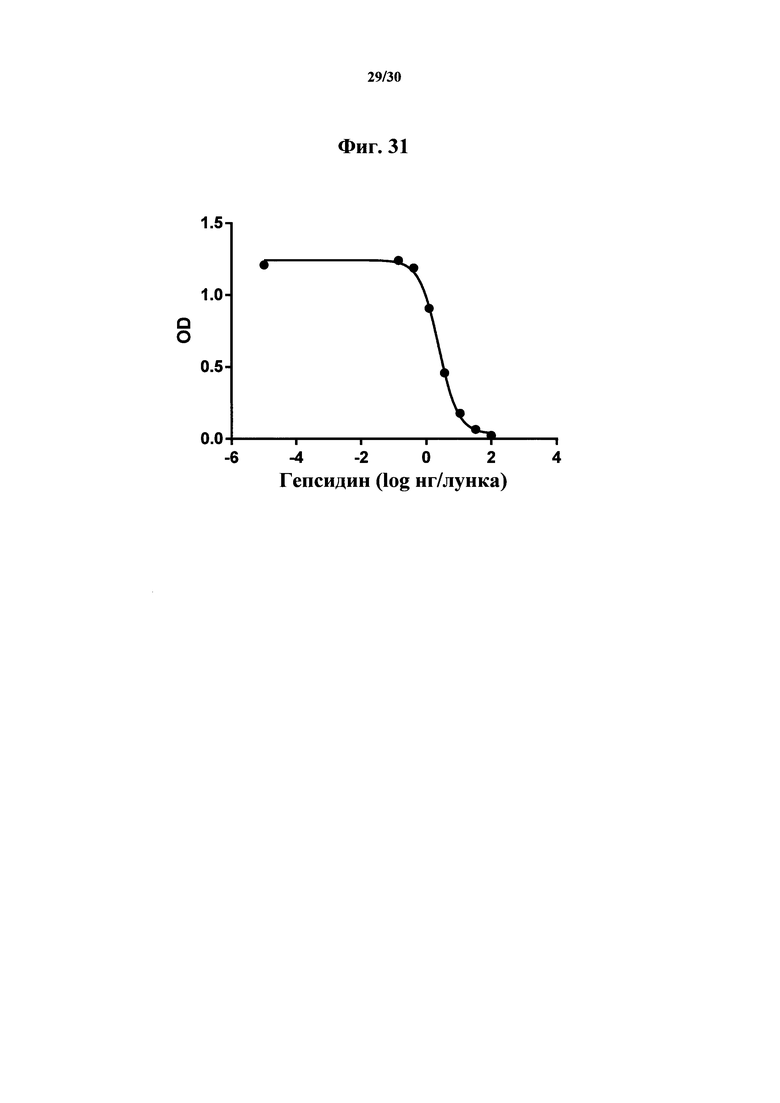
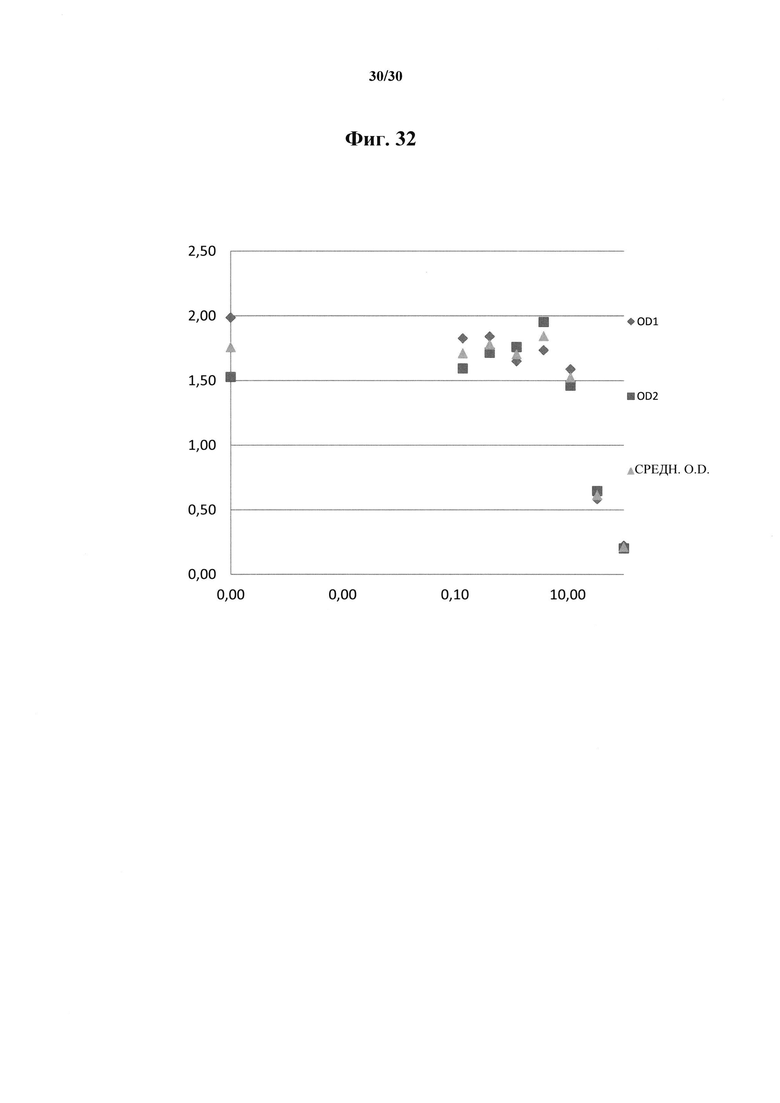
Изобретение относится к области биотехнологии, конкретно к антителам, которые специфично связываются с гепсидином, что может быть использовано в медицине. Получают моноклональные антитела к пептиду N-концевой части гепсидина, которые используют в составе композиции и применяют для лечения заболеваний, ассоциированных с повышенным уровнем гепсидина, или нарушений гомеостаза железа. Изобретение позволяет получить терапевтически пригодные антитела к гепсидину, обладающие высокой специфичностью и низкой константой диссоциации по сравнению с имеющимися в уровне техники аналогами. 6 н. и 21 з.п. ф-лы, 32 ил., 10 пр.
1. Антитело или его антиген-связывающий фрагмент, которые специфично связываются с пептидом гепсидина, который имеет аминокислотную последовательность SEQ ID NO: 19, причем указанные антитело или его антиген-связывающий фрагмент содержат CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 56, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 59, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 62, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 65, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 68, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 71.
2. Антитело или его антиген-связывающий фрагмент, которые специфично связываются с пептидом гепсидина, который имеет аминокислотную последовательность SEQ ID NO: 19, причем указанные антитело или его антиген-связывающий фрагмент содержат CDR1 тяжелой цепи, кодируемый посредством SEQ ID NO: 57, CDR2 тяжелой цепи, кодируемый посредством SEQ ID NO: 60, CDR3 тяжелой цепи, кодируемый посредством SEQ ID NO: 63, CDR1 легкой цепи, кодируемый посредством SEQ ID NO: 66, CDR2 легкой цепи, кодируемый посредством SEQ ID NO: 69, и CDR3 легкой цепи, кодируемый посредством SEQ ID NO: 72.
3. Антитело или его антиген-связывающий фрагмент по п. 1 или 2, характеризующее(ий)ся константой диссоциации (Kd) менее приблизительно 500 пМ, менее приблизительно 400 пМ, менее приблизительно 300 пМ, менее приблизительно 200 пМ, менее приблизительно 100 пМ, менее приблизительно 75 пМ, менее приблизительно 50 пМ, менее приблизительно 30 пМ, менее приблизительно 25 пМ, менее приблизительно 20 пМ, менее приблизительно 18 пМ, менее приблизительно 15 пМ, менее приблизительно 10 пМ, менее приблизительно 7.5 пМ, менее приблизительно 5 пМ, менее приблизительно 3 пМ или менее приблизительно 1 пМ.
4. Антитело или его антиген-связывающий фрагмент по п. 1 или 2, характеризующее(ий)ся константой диссоциации Kd от приблизительно 1 до приблизительно 10 пМ, от приблизительно 10 до приблизительно 20 пМ, от приблизительно 1 до приблизительно 29 пМ, от приблизительно 30 до приблизительно 40 пМ, от приблизительно 10 до приблизительно 100 пМ или от приблизительно 20 до приблизительно 500 пМ.
5. Антитело или его антиген-связывающий фрагмент по п. 1 или 2, где антитело представляет собой моноклональное антитело, химерное антитело, человеческое антитело, бивалентное антитело, мультиспецифическое антитело, макситело, нанотело или гуманизированное антитело.
6. Антитело или его антиген-связывающий фрагмент по п. 1 или 2, где антиген-связывающий фрагмент представляет собой Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, Fv фрагмент, scFv фрагмент или одноцепочечный связывающий полипептид.
7. Антитело или его антиген-связывающий фрагмент по п. 1, которое(ый) содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 44, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 50.
8. Антитело или его антиген-связывающий фрагмент по п. 2, которое(ый) содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 46, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 52.
9. Композиция для лечения заболевания или нарушения гомеостаза железа, ассоциированного с повышенным уровнем гепсидина у субъекта, нуждающегося в этом, содержащая антитело или антиген-связывающий фрагмент по любому из пп. 1-8 в эффективном количестве и приемлемый носитель или вспомогательное средство.
10. Применение антитела или его антиген-связывающего фрагмента по любому из пп. 1-8, заключающееся в получении лекарственного средства в эффективном количестве для лечения заболевания или нарушения гомеостаза железа, ассоциированного с повышенным уровнем гепсидина, у субъекта, нуждающегося в этом, причем лечение включает снижение активности гепсидина.
11. Применение по п. 10, в котором нарушение гомеостаза железа, ассоциированного с повышенным уровнем гепсидина, включает анемию.
12. Применение по п. 11, в котором анемия включает железорефракторную железодефицитную анемию (IRIDA).
13. Применение по п. 11, в котором анемия включает анемию при хроническом заболевании (ACD), анемию при раке, анемию при воспалении, врожденную дизэритропоэтическую анемию, микроцитарную гипохромную анемию или анемию, вызванную химиотерапией (CIA).
14. Применение по п. 10, в котором нарушение гомеостаза железа, ассоциированного с повышенным уровнем гепсидина, включает гемохроматоз.
15. Применение по п. 14, в котором гемохроматоз включает неонатальный гемохроматоз или ювенильный гемохроматоз.
16. Применение по п. 10, в котором нарушение гомеостаза железа, ассоциированное с повышенным уровнем гепсидина, включает талассемию.
17. Применение по п. 16, в котором талассемия включает промежуточную талассемию или альфа-талассемию.
18. Применение по п. 10, в котором указанный субъект, нуждающийся в этом, страдает от болезни Альцгеймера, болезни Паркинсона, бактериальной инфекции, грибковой инфекции или вирусной инфекции.
19. Применение по п. 10, в котором указанный субъект, нуждающийся в этом, страдает от заболевания или повреждения почек.
20. Применение по п. 19, в котором заболевание или повреждение почек включает хроническое почечное заболевание, ренальное заболевание в конечной стадии, хроническую почечную недостаточность или острое повреждение почек.
21. Применение по любому из пп. 10-20, в котором лекарственное средство должно вводиться субъекту со стимулятором эритропоэза, причем указанный стимулятор эритропоэза выбирают из группы, состоящей из эритропоэтина, ингибитора пролилгидроксилазы индуцируемого гипоксией фактора (HIF) или эритроферрона.
22. Применение по п. 21, в котором антитело или его антиген-связывающий фрагмент, которые специфично связываются с пептидом гепсидина, и стимулятор эритропоэза вводят одновременно или последовательно.
23. Применение по любому из пп. 10-20 или 22, в котором лекарственное средство должно вводиться субъекту путем инъекции.
24. Применение по п. 23, в котором инъекция включает внутривенную инъекцию, подкожную инъекцию, внутримышечную инъекцию или спинальную инъекцию в спинномозговую жидкость.
25. Контейнер для лечения заболевания или нарушения гомеостаза железа, ассоциированного с повышенным уровнем гепсидина, у субъекта, нуждающегося в этом, содержащий антитело или его антиген-связывающий фрагмент по любому из пп. 1-8 в эффективном количестве, причем контейнер включает пузырек, шприц, флакон или ампулу.
26. Набор для лечения заболевания или нарушения гомеостаза железа, ассоциированного с повышенными уровнями гепсидина, у субъекта, нуждающегося в этом, причем набор содержит (i) контейнер, содержащий антитело или его антиген-связывающий фрагмент по любому из пп. 1-8, и (ii) контейнер, содержащий стимулятор эритропоэза.
27. Набор по п. 26, в котором контейнер содержит пузырек, шприц, флакон или ампулу.
| US 20110150888 A1, 23.06.2011 | |||
| US 20120003696 A1, 05.01.2012 | |||
| WO 2010017070 A1, 11.02.2010 | |||
| WO 2009139822 A1, 19.11.2009 | |||
| СПОСОБ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ПУТЕМ СКРИНИНГА ТКАНЕЙ, КРОВИ ИЛИ ЖИДКОСТЕЙ ОРГАНИЗМА ЖИВОТНЫХ ИЛИ ЧЕЛОВЕКА НА ПРЕДМЕТ ОБНАРУЖЕНИЯ НЕФИЗИОЛОГИЧЕСКИХ УРОВНЕЙ ГЕПСИДИНА И ЕГО ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2003 |
|
RU2359268C2 |
Авторы
Даты
2018-09-28—Публикация
2014-03-13—Подача