Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к человеческим антителам и к антиген-связывающим фрагментам человеческих антител, которые специфично связываются с токсином А и/или токсином В Clostridium difficile, композициям, содержащим такие антитела, и терапевтическим способам применения таких антител.
Предшествующий уровень техники
Clostridium difficile (С. difficile) является грамположительной, анаэробной, спорообразующей бактерией, которая является основной причиной приобретаемого в стационарном лечебном заведении заболевания желудочно-кишечного тракта у людей, приводящее в результате к появлению симптомов, варьирующих до тяжелой диареи и колита. Полагают, что лечение антибиотиками широкого спектра действия, такими как ампициллин, амоксициллин, цефалоспорины, фторхинолоны и клиндамицин, может привести в результате к нарушению нормальной кишечной флоры, что затем обеспечит возможность колонизации С. difficile в кишечнике (Kelly and Lamont, (1998), Ann. Rev. Med. 49:375-90). Лечение инфекций С. difficile может включать прекращение или модификацию применения антибиотиков широкого спектра действия и нуждается в начале лечения при помощи конкретных противоклостридиальных антибиотиков, таких как, например, ванкомицин, метронидазол или фидаксомицин.
Диарея и воспаление, наблюдаемые у страдающих от инфекции С. difficile больных, считается последствием продуцирования бактерией двух токсинов, энтеротоксина (токсин А) и цитотоксина (токсин В). Токсины А и В С. difficile являются глюкозилтрансферазами с высокой молекулярной массой, которые ингибируют членов семейства Rho ГТФаз. Токсин А имеет молекулярную массу 308 кДа, а токсин В имеет молекулярную массу 270 кДа. Как токсин А, так и токсин В дезактивируют малые ГТФазы, такие как Rho, Rac и Cdc42, путем глюкозилирования треонинового остатка. Ингибирование таких ГТФаз обуславливает выключение каскадов передачи сигналов, приводящее к деполимеризации цитоскелета, транскрипции генов определенных стресс-зависимых протеинкиназ, понижению синтеза фосфатидилинозитолбисфосфата и возможно даже к потере клеточной полярности. Утрата цитоскелетной структуры в результате приводит к округлению стенок, и такая утрата структуры может обуславливать реакцию несовместимости с С. difficile. В анализах округления клеток токсин В является по меньшей мере в 1000 раз более токсичным, чем токсин А.
Токсины А и В С. difficile являются на 63% гомологичными по аминокислотному содержанию и имеют сходные третичные структуры (Davies, АН, (2011), Biochem. J., 436:517-526). C-концевая треть каждого токсина состоит из последовательностей, называемых «клостридиальные повторяющиеся олигопептиды» (CROP), которые в высокой степени антигенны. Оставшиеся N-концевые две трети токсинов А и В являются менее сходными друг с другом в отношении гомологии последовательностей, однако, именно эта часть каждого белка обладает глюкозилтрансферазной активностью.
Подтверждение о роли токсина А и/или токсина B в появлении диареи и воспаления после инфицирования С. difficile проистекают из результатов наблюдений в животных моделях. Например, введение пероральных доз токсинов симулирует заболевание (Kelly and Lamont, (1998), Ann. Rev. Med. 49:375-90). Мутантные штаммы с недостатком токсина А и В характеризуются уменьшенной или измененной вирулентностью (Lyras D, O'Connor JR, Howarth PK et al., Nature 458(7242), 1176-1179 (2009); Kuehne SA, Cartman ST, Heap JT, Kelly ML, Cockayne A, Minton NP, Nature 15, 467(7316), 711-713 (2010).). Кроме того, было показано, что применение поликлональных антител по отношению к токсинам защищало хомяков от заболевания (Gianasca et al., (1999), Infect. Immun. 66(2): 527-38). В клинических условиях исследования показали, что имеет место корреляция между наличием антител к токсину А или токсину В и защитой от ассоциированной с С. difficile диареи и рецидивов заболевания (Warny, M. et al., (1994), Inf. Immun. 62(2): 384-389; Kyne, L. et al. (2001), Lancet 357:189-193; Leav, B.A., (2010), Vaccine 28(4):965-969). Разработка антитела к токсину связана с асимптоматическими носителями (Kyne, L. et al. (2000), NEJM 342(6), 390-397). Вместе с тем клинические испытания с применением комбинации антител к токсину А и к токсину В С. difficile в сочетании с метронидазолом или ванкомицином приводили в результате к уменьшению частоты рецидивирующей инфекции С. difficile (Lowy, I. et al., (2010), NEJM 362(3):197-205).
Моноклональные антитела к токсину А С. difficile были описаны у Wilkins, et al. в патенте США №4879218. Кроме того, Rothman et al. описали мышиное моноклональное антитело, которое дает перекрестную реакцию с токсинами А и В С. difficile. Вместе с тем Coughlin et al. описали моноклональное антитело, специфичное к токсину В С. difficile, которое не давало перекрестную реакцию с токсином А. Были описаны другие антитела к токсинам С. difficile (см., например, US 7151159, US 7625559, US 8236311, US 8257709, патентные публикации США №№2009/0087478; US 2010/0233182, US 2010/0233181, US 2012/0288508, US 2012/012160, US 2011/0020356, US 2012/0121607, ЕР 1766093 В1, ЕР 1024826 В1, ЕР 1568378 А1, ЕР 2305303 А2, ЕР 2305293 А2, ЕР 2405940 А1, ЕР 2261253 А2, WO 2006/121422, WO 2011/130650, WO 2010/094970, WO 2009/108652, WO 2011/063346 и WO 2005/058353).
Краткое описание настоящего изобретения
Настоящее изобретение относится к полностью человеческим моноклональным антителам (mAb) и к их антиген-связывающим фрагментам, которые специфично связываются либо с токсином А, либо с токсином В, продуцируемыми Clostridium difficile (С. difficile), или которые связываются как с токсином А, так и с токсином В С. difficile (т.е. человеческим моноклональным антителам, которые дают перекрестную реакцию как с токсином А, так и с токсином В). Такие антитела могут быть пригодны для нейтрализации токсичности, ассоциированной либо с токсином А, либо с токсином В, либо с обоими, и фактически могут служить для уменьшения тяжести первичного ассоциированного с C. difficile состояния или заболевания, или уменьшения количества, продолжительности или тяжести рецидива заболевания, или ослабления по меньшей мере одного симптома, связанного с ассоциированным с C. difficile состоянием или заболеванием. Такие антитела можно применять отдельно или в сочетании со вторым средством, пригодным для лечения ассоциированного с C. difficile состояния или заболевания. В соответствии с определенными вариантами осуществления антитела, специфичные к токсину А, токсину В или обоим, можно давать в терапевтических целях в сочетании со вторым средством для уменьшения тяжести первичного ассоциированного с C. difficile состояния или заболевания, или для уменьшения количества, продолжительности или тяжести рецидива заболевания, или ослабления по меньшей мере одного симптома, связанного с ассоциированным с C. difficile состоянием или заболеванием. В соответствии с некоторыми вариантами осуществления антитела можно применять профилактически в качестве самостоятельного терапевтического средства для защиты пациентов, которые подвержены риску развития ассоциированного с C. difficile состояния или заболевания. Например, некоторые группы пациентов могут быть подвержены риску развития вызванного C. difficile состояния или заболевания, включая пожилых пациентов или пациентов, которые имеют хронические и/или сопутствующие первопричинные медицинские состояния, которые могут вызывать у них предрасположенность к возникновению инфекции С. difficile. Другие подверженные риску группы пациентов включают пациентов, которых госпитализировали на протяжении длительных периодов времени и которые принимают антибиотики широкого спектра действия, которые могут нарушить нормальную кишечную флору и которые могут вызывать у них предрасположенность к возникновению инфекции С. difficile. Недавно полученные данные указывают на то, что пациенты, принимающие ингибиторы протонного насоса (PPI), подвержены риску развития ассоциированной с C. difficile диареи (Yearsley, K. et al. (2006), Aliment. Pharmacol. Ther. 24(4):613-619; Lowe, DO, et al. Clin. Infect. Dis. (2006), 43(10):1272-1276). Другие группы пациентов, подверженных риску развития инфекции С. difficile, включают пациентов, которые проходят любой тип иммуносупрессивной терапии, такой как без ограничения противоопухолевое лекарственное средство, общая лучевая терапия для лечения определенных видов злокачественных опухолей или лекарственное средство или схема приема лекарственного средства для предупреждения отторжения ткани или органа после трансплантации. Пациенты, которые получают трансплатат гемопоэтических стволовых клеток (HSCT), могут быть подвержены особенно высокому риску развития инфекции С. difficile по причине длительных госпитализаций, приема антибиотиков широкого спектра действия и связанного с химиотерапией нарушения барьеров слизистых кишечника (Thibault, A. et al., ((1991), Infect. Control Hosp. Epidemiol. 12:345-8; Anand, A. et al. (1993), Clin. Infect. Dis. 17:109-13). Пациенты, которые получают трансплатат цельного органа, также могут подвергаться риску развития инфекции С. difficile. В группу риска включены страдающие от аутоиммунного заболевания пациенты или пациенты на диализе. Последние исследования показали, что пациенты, которые получали либо аутологические, либо аллогенные HSCT, подвергались не только большему риску развития инфекции С. difficile, но также такие пациенты подвергались более высокому риску развития желудочно-кишечной реакции "трансплантат против хозяина" (GI-GVHD) (Alonso, CD., et al. (2012), Clin Inf. Dis, 54:1053-1063). В то время как настоящее исследование четко показало, что инфекции С. difficile представляли собой частое раннее осложнение после HSCT, точное взаимоотношение или взаимосвязь между инфекциями С. difficile (CDI) и GVHD, вовлекающими в патологический процесс GI-тракт, необходимо исследовать более подробно. У любых таких групп пациентов может быть положительный результат от лечения при помощи антител по настоящему изобретению, при получении отдельно или в сочетании со вторым средством, таким как метронидазол, ванкомицин или фидаксомицин.
Антитела по настоящему изобретению могут иметь полную длину (например, антитело IgG1 или IgG4) или могут содержать только антиген-связывающую часть (например, фрагмент Fab, F(ab')2 или scFv) и могут быть модифицированы с затрагиванием функциональности, например, для устранения остаточных эффекторных функций (Reddy et al., (2000), J. Immunol. 164:1925-1933).
Соответственно, согласно первому аспекту настоящее изобретение относится к выделенному полностью человеческому моноклональному антителу или его антиген-связывающему фрагменту, которые связываются либо с токсином А, либо с токсином В, или которые связываются или вступают в перекрестную реакцию как с токсином А, так и с токсином В Clostridium difficile, причем:
a) выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в аминокислотной последовательности вариабельного участка тяжелой цепи (HCVR), выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162; и три определяющих комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в аминокислотной последовательности вариабельного участка легкой цепи (LCVR), выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170;
b) выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат HCDR1, HCDR2 и HCDR3, содержащиеся в аминокислотной последовательности HCVR, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и LCDR1, LCDR2 и LCDR3, содержащиеся в аминокислотной последовательности LCVR, выбранной из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362; и
c) выделенное антитело или антиген-связывающий фрагмент, которые связываются или вступают в перекрестную реакцию как с токсином А, так и с токсином В Clostridium difficile, содержат HCDR1, HCDR2 и HCDR3, содержащиеся в аминокислотной последовательности HCVR, выбранной из группы, состоящей из SEQ ID NO: 18, 34, 50, 66 и 82; и LCDR1, LCDR2 и LCDR3, содержащиеся в аминокислотной последовательности LCVR, выбранной из группы, состоящей из SEQ ID NO: 26, 42, 58, 74 и 90.
Согласно одному варианту осуществления человеческое моноклональное антитело, которое связывается/вступает в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, специфично связывается с карбоксиконцевым связывающимся с рецептором доменом (CBD) как токсина A (CBD-A: SEQ ID NO: 375), так и токсина В (CBD-B:SEQ ID NO: 376) С. difficile.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, связываются с токсином А и токсином В с KD, равной или меньше 10-7 М.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из последовательностей вариабельного участка тяжелой цепи (HCVR), выбранной из группы, состоящей из SEQ ID NO: 18, 34, 50, 66 и 82; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из последовательностей вариабельного участка легкой цепи (LCVR), выбранной из группы, состоящей из SEQ ID NO: 26, 42, 58, 74 и 90. Способы и методики определения CDR в аминокислотных последовательностях HCVR и LCVR хорошо известны из уровня техники и могут быть применены для определения CDR в раскрываемых в настоящем описании указанных аминокислотных последовательностях HCVR и/или LCVR. Иллюстративные условные обозначение, которые можно применять для определения границ CDR, включают, например, обозначение по Kabat, обозначение по Chothia и AbM-обозначение. В общих чертах, обозначение по Kabat основано на вариабельности последовательности, обозначение по Chothia основано на расположении структурных петельных участков, и AbM-обозначение является нечто средним между подходами Kabat и Chothia. См., например, Kabat, "Sequences of Proteins of Immunological Interest," National Institutes of Health, Bethesda, Md. (1991); A1-Lazikani et al., (1997), J. Mol. Biol. 275:927-948; and Martin et al., (1989), Proc. Natl. Acad. Sci. USA 56:9268-9272. Находящиеся в общем доступе базы данных также доступны для определения последовательностей CDR в антителе.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 18, 34, 50, 66 и 82.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, 42, 58, 74 и 90.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат (а) HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 18, 34, 50, 66 и 82; и (b) LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, 42, 58, 74 и 90.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат:
(a) домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, 36, 52, 68 и 84;
(b) домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 22, 38, 54, 70 и 86;
(c) домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 24, 40, 56, 72 и 88;
(d) домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28, 44, 60, 76 и 92;
(f) домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 30, 46, 62, 78 и 94; и
(g) домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 32, 48, 64, 80 и 96.
Согласно одному варианту осуществления человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 SEQ ID NO: 20, 22 и 24, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 SEQ ID NO: 28, 30 и 32, соответственно.
Согласно одному варианту осуществления человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 из SEQ ID NO: 36, 38 и 40, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 SEQ ID NO: 44, 46 и 48, соответственно.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26, 34/42, 50/58, 66/74 и 82/90.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат пару аминокислотных последовательностей HCVR/LCVR SEQ ID NO: 18/26 и 34/42.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В, связываются с:
эпитопом внутри карбоксиконцевого связывающегося с рецептором домена как токсина А, так и токсина В Clostridium difficile, причем антитело содержит пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26 и 34/42; или
эпитопом, находящимся за пределами карбоксиконцевого связывающегося с рецептором домена как токсина А, так и токсина В Clostridium difficile, причем антитело содержит пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 50/58, 66/74 и 82/90.
Согласно одному варианту осуществления настоящее изобретение относится к полностью человеческому моноклональному антителу или его антиген-связывающему фрагменту, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, причем у антитела или его фрагмента наблюдают одну или несколько из следующих характеристик: (i) содержит HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 18, 34, 50, 66 и 82, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (ii) содержит LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, 42, 58, 74 и 90, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iii) содержит домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 24, 40, 56, 72 и 88, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности и домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 32, 48, 64, 80 и 96, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iv) содержит домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, 36, 52, 68 и 84, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 22, 38, 54, 70 и 86, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28, 44, 60, 76 и 92, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 30, 46, 62, 78 и 94, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (v) связывается с токсином А и с токсином В с KD, равной или менее 10-9 М.
Согласно одному варианту осуществления полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В С. difficile, содержат последовательность HCDR1, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO: 381), где X1 представляет собой Gly, X2 представляет собой Phe, Val или Ile, X3 представляет собой Thr, Ala или Ser, Χ4 представляет собой Phe или Leu, X5 представляет собой Ser, Arg или Asn, Χ6 представляет собой Gly, Thr, Asp или Ser, X7 представляет собой His или Tyr и X8 представляет собой Gly, или Glu; последовательность HCDR2, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO: 382), где X1 представляет собой Ile, X2 представляет собой Leu, Ser или Asp, X3 представляет собой Tyr, Phe или Ser, X4 представляет собой Asp или Ser, X5 представляет собой Gly, X6 представляет собой Ser, Gly, Asp или Thr, X7 представляет собой Ser, His или Ile и X8 представляет собой Glu, Gin или Ile; последовательность HCDR3, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17 (SEQ ID NO: 383), где X1 представляет собой Ala или Val, X2 представляет собой Lys или Arg, X3 представляет собой Gly или Glu, X4 представляет собой Ser или Arg, Χ5 представляет собой Ile, Asp или Tyr, X6 представляет собой Leu, Ser или Asp, Χ7 представляет собой Asn, Ser, Gin или His, X8 представляет собой Arg, Tyr или Ser, X9 представляет собой Pro или Gly, X10 представляет собой Phe или Tyr, X11 представляет собой Asp, Gly или Tyr, X12 представляет собой Tyr, X13 представляет собой Phe, Leu или отсутствует, X14 представляет собой Gly или отсутствует, X15 представляет собой Met или отсутствует, X16 представляет собой Asp или отсутствует, X17 представляет собой Val или отсутствует; последовательность LCDR1, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12 (SEQ ID NO: 384), где X1, представляет собой Gln, X2 представляет собой Ser или Glu, X3 представляет собой Ile, Val или Thr, X4 представляет собой Leu или Asp, X5 представляет собой Phe, Lys или Asn и X6 представляет собой Ser или Trp, X7 представляет собой Ser или отсутствует, X8 представляет собой Asn, Asp или отсутствует, X9 представляет собой Asn или отсутствует, X10 представляет собой Lys или отсутствует, X11 Ile, Asn или отсутствует, X12 представляет собой Tyr или отсутствует; последовательность LCDR2, характеризующуюся формулой X1-X2-X3 (SEQ ID NO: 385), где X1 представляет собой Trp, Lys или Arg, X2 представляет собой Ala или Thr и X3 представляет собой Ser; и последовательность LCDR3, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO: 386), где X1 представляет собой Gln или His, X2 представляет собой Gln или Glu, X3 представляет собой Tyr, X4 представляет собой Tyr или Asn, X5 представляет собой Thr или Ser, X6 представляет собой Leu, Ala или Tyr, Χ7 представляет собой Pro, Phe или Ser, X8 представляет собой Leu, Phe или Arg и Χ9 представляет собой Thr или Ala.
Согласно одному варианту осуществления настоящее изобретение относится к выделенному человеческому моноклональному антителу или его антиген-связывающему фрагменту, которые специфично связываются с токсином A Clostridium difficile, причем антитело содержит три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей HCVR, выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей LCVR, выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат (a) HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162; и (b) LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат:
(a) домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 4, 100, 116, 132, 148 и 164;
(b) домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 6, 102, 118, 134, 150 и 166;
(c) домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 8, 104, 120, 136, 152 и 168;
(d) домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 12, 108, 124, 140, 156 и 172;
(e) домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ IDNO: 14, ПО, 126, 142, 158 и 174; и
(f) домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, 112, 128, 144, 160 и 176.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 SEQ ID NO: 148, 150 и 152, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 SEQ ID NO: 156, 158 и 160, соответственно.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 2/10, 98/106, 114/122, 130/138, 146/154 и 162/170.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 146/154.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, связываются с:
эпитопом внутри карбоксиконцевого связывающегося с рецептором домена токсина A Clostridium difficile, причем антитело содержит пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 2/10, 98/106, 130/138, 146/154 и 162/170; или
эпитопом, находящимся за пределами карбоксиконцевого связывающегося с рецептором домена токсина A Clostridium difficile, причем антитело содержит пару аминокислотных последовательностей HCVR/LCVR SEQ ID NO: 114/122.
Согласно одному варианту осуществления настоящее изобретение относится к полностью человеческому моноклональному антителу или его антиген-связывающему фрагменту, которые специфично связываются с токсином А С. difficile, причем у антитела или его фрагмента наблюдают одну или несколько из следующих характеристик: (i) содержит HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (ii) содержит LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iii) содержит домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 8, 104, 120, 136, 152 и 168, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, 112, 128, 144, 160 и 176, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iv) содержит домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 4, 100, 116, 132, 148 и 164, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 6, 102, 118, 134, 150 и 166, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 12, 108, 124, 140, 156 и 172, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 14, 110, 126, 142, 158 и 174, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (v) демонстрирует KD, равную или мене 10-9 М; (vi) демонстрирует нейтрализацию токсина А (при концентрации 32 пМ) с IC50, варьирующей в диапазоне от приблизительно 7 пМ до приблизительно 65 пМ в анализе жизнеспособности клеток.
Согласно одному варианту осуществления полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином А С. difficile, содержат последовательность HCDR1, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO: 387), где X1 представляет собой Gly или Arg, X2 представляет собой Phe, X3 представляет собой Asn или Thr, X4 представляет собой Phe, X5 представляет собой Gly, Ser, Asn или Thr, X6 представляет собой Thr, Ser, Asn или Asp, X7 представляет собой His, Tyr или Phe и X8 представляет собой Asp, Val, Ala или Tyr; последовательность HCDR2, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO: 388), где X1 представляет собой Leu или Ile, X2 представляет собой Thr, Gly, Ser или Trp, X3 представляет собой Ser, Thr, Gly, представляет собой Phe, X4 представляет собой Thr, Val, Tyr, Val, Asp или Gly, X5 представляет собой Gly, X6 представляет собой Gly, Asp, Ser или Ala, X7 представляет собой Ser, Thr, Asn или Ala и X8 представляет собой Ala, Thr, Glu, Lys или отсутствует; последовательность HCDR3, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-Χ17-X18-X19-X20-X21-X22-X23-X24 (SEQ ID NO: 389), где X1 представляет собой Ala, X2 представляет собой Lys или Arg, X3 представляет собой Thr, Asp или Ser, Χ4 представляет собой Phe, Arg, His, Ala или Leu, X5 представляет собой Asn, Gly или Lys, X6 представляет собой Trp, Gly, Asp или Ile, Χ7 представляет собой Asn, Ala или Phe, X8 представляет собой Ser, Asn, Tyr, Gly или Asp, X9 представляет собой Tyr, Ile, Ala, Thr, Glu или Leu, Χ10 представляет собой Phe, Tyr, Ser, Gly или отсутствует, X11 представляет собой Asp. Ser, Gly или отсутствует, Χ12 представляет собой Tyr, Phe, Ser, Pro или отсутствует, X13 представляет собой Tyr, Leu или отсутствует, X14 представляет собой Tyr, Phe или отсутствует, X15 представляет собой Gly, Asn, Asp или отсутствует, X16 представляет собой Met, Arg, Tyr или отсутствует, X17 представляет собой Asp или отсутствует, X18 представляет собой Tyr, Val или отсутствует, X19 представляет собой Tyr или отсутствует, X20 представляет собой Tyr или отсутствует, X21 представляет собой Gly или отсутствует, X22 представляет собой Met или отсутствует, X23 представляет собой Asp или отсутствует, X24 представляет собой Val или отсутствует; последовательность LCDR1, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 390), где X1 представляет собой Gln, X2 представляет собой Ser, Asp или Thr, X3 представляет собой Ile или Val, X4 представляет собой Ser, X5 представляет собой Thr, Asn или Ser, X6 представляет собой Tyr, Trp, Phe или Ser, и X7 представляет собой Tyr или отсутствует; последовательность LCDR2, характеризующуюся формулой X1-X2-X3 (SEQ ID NO: 391), где X1 представляет собой Gly, Ala, Lys или Thr, X2 представляет собой Ala, Thr или Val и X3 представляет собой Ser; и последовательность LCDR2, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9-X10 (SEQ ID NO: 392), где X1 представляет собой Gln или отсутствует, X2 представляет собой Gln, Lys или отсутствует, X3 представляет собой Tyr, Asn или отсутствует, X4 представляет собой Gly, Asn, Thr, Tyr, His или отсутствует, X5 представляет собой Asn, Ser или отсутствует, X6 представляет собой Ser, Ala, Tyr, Asp, Trp или отсутствует, Χ7 представляет собой Leu, Pro, Ser или отсутствует, X8 представляет собой Tyr, Phe, Arg, Pro или отсутствует, X9 представляет собой Thr, Tyr или отсутствует и X10 представляет собой Thr.
Согласно одному варианту осуществления настоящее изобретение относится к выделенному человеческому моноклональному антителу или его антиген-связывающему фрагменту, которые специфично связываются с токсином В Clostridium difficile, причем антитело содержит три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей HCVR, выбранных из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей LCVR, выбранных из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314,330, 346 и 362.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат (a) HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и (b) LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат:
(a) домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 180, 196, 212, 228, 244, 260, 276, 292, 308, 324, 340 и 356;
(b) домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 182, 198, 214, 230, 246, 262, 278, 294, 310, 326, 342 и 358;
(c) домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 184, 200, 216, 232, 248, 264, 280, 296, 312, 328, 344 и 360;
(d) домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 188, 204, 220, 236, 252, 268, 284, 300, 316, 332, 348 и 364;
(e) домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 190, 206, 222, 238, 254, 270, 286, 302, 318, 334, 350 и 366; и
(f) домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 192, 208, 224, 240, 256, 272, 288, 304, 320, 336, 352 и 368.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 SEQ ID NO: 276, 278 и 280, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 SEQ ID NO: 284, 286 и 288, соответственно.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 322/330, 338/346 и 354/362.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат пару аминокислотных последовательностей HCVR/LCVR SEQ ID NO: 274/282.
Согласно одному варианту осуществления выделенное человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, связываются с:
эпитопом внутри карбоксиконцевого связывающегося с рецептором домена токсина В Clostridium difficile, причем антитело содержит пару аминокислотных последовательностей HCVR/LCVR SEQ ID NO: 178/186; или
эпитопом, находящимся за пределами карбоксиконцевого связывающегося с рецептором домена токсина В Clostridium difficile, причем антитело содержит пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 194/202, 210/218, 226/234, 242/250, 258/266, 274/282 и 290/298.
Согласно одному варианту осуществления настоящее изобретение относится к полностью человеческому моноклональному антителу или его антиген-связывающему фрагменту, которые специфично связываются с токсином В С. difficile, причем у антитела или его фрагмента наблюдают одну или несколько из следующих характеристик: (i) содержит HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (ii) содержит LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iii) содержит домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 184, 200, 216, 232, 248, 264, 280, 296, 312, 328, 344 и 360, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 192, 208, 224, 240, 256, 272, 288, 304, 320, 336, 352 и 368, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iv) содержит домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 180,196, 212, 228, 244, 260, 276, 292, 308, 324, 340 и 356, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 182, 198, 214, 230, 246, 262, 278, 294, 310, 326, 342 и 358, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 188, 204, 220, 236, 252, 268, 284, 300, 316, 332, 348 и 364, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 190, 206, 222, 238, 254, 270, 286, 302, 318, 334, 350 и 366, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (v) демонстрирует KD, равную или менее 10-9 М; (vi) демонстрирует нейтрализацию токсина В (при концентрации 0,03 пМ) с IC50, варьирующей в диапазоне от приблизительно 25 пМ до приблизительно 320 пМ в анализе жизнеспособности клеток.
Согласно одному варианту осуществления полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В С. difficile, содержат последовательность HCDR1, характеризующуюся формулой Χ1-Χ2-Χ3-Χ4-Χ5-Χ6-Χ7-Χ8-Χ9-Χ10 (SEQ ID NO: 393), где Χ1 представляет собой Gly, X2 представляет собой Phe, Asp или Tyr, X3 представляет собой Thr, Asn, Ser или Val, X4 представляет собой Phe или Val, Χ5 представляет собой Ser, Arg, Lys, Glu или Thr, X6 представляет собой Ser, Ile, Asp или Arg, X7 представляет собой Phe, Tyr или Asn, X8 представляет собой Gly, Ala, Ser или Tyr; X9 представляет собой Ala или отсутствует, и X10 представляет собой Ala или отсутствует; последовательность HCDR2, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO: 394), где X1 представляет собой Ile или Thr, X2 представляет собой Ser, Gly, Tyr или Asn, X3 представляет собой Thr, Gly, Tyr, Tip, Pro или Ser, Χ4 представляет собой Asp, Ser, Asn, Arg, Lys или Asp, X5 представляет собой Gly, Ser или Thr, X6 представляет собой Ser, Asp, Gly, Lys или Asn, X7 представляет собой Lys, Arg, Asn, Ser, Trp или Gly, X8 представляет собой Lys, Thr, Ile или Tyr, Χ9 представляет собой His или отсутствует; последовательность HCDR3, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16 (SEQ ID NO: 395), где X1 представляет собой Ala или Val, X2 представляет собой Arg, Lys, Thr или Ser, X3 представляет собой Val, Gly, Asp, Arg или Tyr, X4 представляет собой Gly, Trp, Arg, Lys или Asn, X5 представляет собой Glu, Tyr, Arg, Ser или Trp, X6 представляет собой Leu, Tyr, Ser, Pro или Asn, X7 Leu, Asp, Tyr, Ser или Asp, X8 представляет собой Asn, Ser, Phe, Lys, Arg, Asp или Gly, X9 представляет собой Tyr, Gly, Phe, Asp, Tip или Val, X10 представляет собой Ser, Tyr, Asn, Asp или отсутствует, X11 представляет собой Tyr, Leu, Val, Gly или отсутствует, X12 представляет собой Tyr, Leu, Phe, Val или отсутствует, X13 представляет собой Asn, Gly, Asp, Phe или отсутствует, X14 представляет собой Tyr, Met, Asp или отсутствует, X15 Asp, Tyr или отсутствует, и X16 представляет собой Val или отсутствует; последовательность LCDR1, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 396), где X1 представляет собой Gln, Leu, or Arg, X2 представляет собой Gly, Asp или Ser, X3 представляет собой Ile или Val, X4 представляет собой Arg, Ser, Gly или Tyr, X5 представляет собой Ser или Asn, X6 представляет собой Trp, His, Asn, Phe, Ser или Asp, и X7 представляет собой Туr или отсутствует; последовательность LCDR2, характеризующуюся формулой X1-X2-X3 (SEQ ID NO: 397), где X1 представляет собой Ala, Ser, Asp или Gly, X2 представляет собой Ala или Thr, и X3 представляет собой Ser; и последовательность LCDR3, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO: 398), где X1 представляет собой Gln, His или Leu, X2 представляет собой Gln, X3 представляет собой Ala, Tyr, Arg, Asp, His или Val, X4 представляет собой Tyr, Gly, Asn, Ser, Ile или Lys, Χ5 представляет собой Ser, Leu, Pro, Ile, Asn, Thr или Gly, X6 представляет собой Phe, Tyr, Trp или Ser, X7 представляет собой Pro, X8 представляет собой Leu, Pro, Phe, Val или Tyr, и X9 представляет собой Thr.
Согласно одному варианту осуществления настоящее изобретение относится к выделенному антителу или его антиген-связывающему фрагменту, которые конкурируют за специфичное связывание с токсином А и/или токсином В С. difficile с антителом или антиген-связывающим фрагментом, содержащим определяющие комплементарность участки (CDR) вариабельного участка тяжелой цепи (HCVR), причем HCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и CDR вариабельного участка легкой цепи (LCVR), причем LCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
Согласно соответствующему варианту осуществления настоящее изобретение относится к выделенному антителу или его антиген-связывающий фрагменту, которые конкурируют за специфичное связывание с токсином А и/или токсином В С. difficile с антителом или антиген-связывающим фрагментом, содержащим CDR тяжелой и легкой цепи, которые содержатся в парах последовательностей тяжелой и легкой цепей, выбранных из группы, состоящей из SEQ ID NO: 18/26, 34/42, 146/154 и 274/282.
Согласно одному варианту осуществления настоящее изобретение относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с одним эпитопом на токсине А и/или токсине В С. difficile как антитело или антиген-связывающий фрагмент, содержащие определяющие комплементарность участки (CDR) вариабельного участка тяжелой цепи (HCVR), причем HCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и CDR вариабельного участка легкой цепи (LCVR), причем LCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
Согласно соответствующему варианту осуществления настоящее изобретение относится к выделенному антителу или его антиген-связывающий фрагменту, которые связываются с одним эпитопом на токсине А и/или токсине В С. difficile как антитело или антиген-связывающий фрагмент, содержащие CDR тяжелой и легкой цепи, которые содержатся в парах последовательностей тяжелой и легкой цепей, выбранных из группы, состоящей из SEQ ID NO: 18/26, 34/42, 146/154, 274/282.
В соответствии с некоторыми вариантами осуществления по настоящему изобретению антитела могут взаимодействовать или связываться с, аминокислотными остатками 468-863 карбоксиконцевого связывающегося с рецептором домена продуцируемого Clostridium difficile токсина А, последовательность которого показана в SEQ ID NO: 375. Этот участок соответствует аминокислотным остаткам, находящимся в диапазоне остатков 2315-2710 из SEQ ID NO: 378 (токсин А полной длины). В соответствии с некоторыми вариантами осуществления по настоящему изобретению антитела могут взаимодействовать или связываться с эпитопом на карбоксиконцевом связывающемся с рецептором домене, продуцируемого Clostridium difficile токсина А, причем эпитоп выбран из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375. Такие остатки соответствуют аминокислотным последовательностям, обнаруженным в последовательности полной длины токсина А, имеющей SEQ ID NO: 378, с определенными участками, выявленными как остатки 2315-2335 из SEQ ID NO: 378, остатков 2357-2377 из SEQ ID NO: 378, остатков 2449-2457 из SEQ ID NO: 378, остатков 2491-2550 из SEQ ID NO: 378, остатков 2571-2641 из SEQ ID NO: 378, остатков 2646-2661 из SEQ ID NO: 378 и остатков 2705-2710 из SEQ ID NO: 378. Согласно одному варианту осуществления антитело, которое связывается или взаимодействует с эпитопом в карбоксиконцевом связывающемся с рецептором домене продуцируемого Clostridium difficile токсина А, выбранным из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375, содержит пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 146/154. Согласно одному варианту осуществления антитело, которое связывается или взаимодействует с эпитопом в карбоксиконцевом связывающемся с рецептором домене продуцируемого Clostridium difficile токсина А, выбранным из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375, комбинировано со вторым антителом, которое специфично связывается с токсином В Clostridium difficile, в фармацевтической композиции. Согласно одному варианту осуществления второе антитело, которое взаимодействует или связывается с токсином В Clostridium difficile, содержит пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 274/282.
В соответствии со вторым аспектом настоящее изобретение относится к молекулам нуклеиновой кислоты, кодирующим антитела к токсину А и/или к токсину В или их фрагменты. Также настоящее изобретение относится к рекомбинантным векторам экспрессии, содержащим нуклеиновые кислоты по настоящему изобретению, и клеткам-хозяевам, в которые были введены такие векторы, в качестве способов получения антител посредством культивирования клеток хозяев в условиях, позволяющих происходить продукции антител, и выделения полученных антител.
Согласно одному варианту осуществления настоящее изобретение относится к антителу или его фрагменту, содержащему HCVR, кодируемый последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 1, 17, 33, 49, 65, 81, 97, 113, 129, 145, 161, 177, 193, 209, 225, 241, 257, 273, 289, 305, 321, 337 и 353, или практически идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% гомологию с ней.
Согласно одному варианту осуществления HCVR кодируется последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 17,33, 145 и 273.
Согласно одному варианту осуществления антитело или его фрагмент дополнительно содержит LCVR, кодируемый последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 9, 25, 41, 57, 73, 89, 105, 121, 137, 153, 169, 185, 201, 217, 233, 249, 265, 281, 297, 313, 329, 345 и 361, или практически идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% гомологию с ней.
Согласно одному варианту осуществления LCVR кодируется последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 25, 41, 153 и 281.
Согласно одному варианту осуществления настоящее изобретение также относится к антителу или антиген-связывающему фрагменту антитела, содержащему домен HCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 7, 23, 39, 55, 71, 87, 103, 119, 135, 151, 167, 183, 199, 215, 231, 247, 263, 279, 295, 311, 327, 343 и 359, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 15, 31, 47, 63, 79, 95, 111, 127, 143, 159, 175, 191, 207, 223, 239, 255, 271, 287, 303, 319, 335, 351 или 367, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности.
Согласно одному варианту осуществления настоящее изобретение относится к антителу или его фрагменту, дополнительно содержащему домен HCDR1, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 3, 19, 35, 51, 67, 83, 99, 115, 131, 147, 163, 179, 195, 211, 227, 243, 259, 275, 291, 307, 323, 339 и 355, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен HCDR2, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 5, 21, 37, 53, 69, 85, 101, 117, 133, 149, 165, 181, 197, 213, 229, 245, 261, 277, 293, 309, 325, 341 и 357, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR1, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 11, 27, 43, 59, 75, 91, 107, 123, 139, 155, 171, 187, 203, 219, 235, 251, 267, 283, 299, 315, 331, 347 и 363, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 13, 29, 45, 61, 77, 93, 109, 125, 141, 157, 173, 189, 205, 221, 237, 253, 269, 285, 301, 317, 333, 349 или 365, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности.
В соответствии с третьим аспектом настоящее изобретение относится к человеческому антителу или антиген-связывающему фрагменту, специфичному к токсину А и/или токсину В С. difficile, содержащему HCVR, кодируемый сегментами нуклеотидной последовательности, происходящими от VH, DH и JH последовательностей зародышевой линии, и LCVR, кодируемый сегментами нуклеотидной последовательности, происходящими от VK и JK последовательностей зародышевой линии, с комбинациями, которые показаны в Таблице 2.
Настоящее изобретение относится к антителам с модифицированными профилями гликозилирования. В некоторых областях применения может быть пригодна модификация, удаляющая нежелательные сайты гликозилирования, или, например, удаление фукозного фрагмента для повышения функции антителозависимой клеточноопосредованной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других областях применения для модификации комплементзависимой цитотоксичности (CDC) можно выполнить модификацию гликозилирования.
В соответствии с четвертым аспектом настоящее изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно выделенное полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые связываются либо с токсином А, либо с токсином В С. difficile, или которые связываются как с токсином А, так и с токсином В С. difficile, и фармацевтически приемлемый носитель или разбавитель. Согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей выделенное полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются только с токсином А С. difficile, и фармацевтически приемлемый носитель или разбавитель. Согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей выделенное полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, который специфично связывается только с токсином В С. difficile, и фармацевтически приемлемый носитель или разбавитель. Согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей два полностью человеческих моноклональных антитела или их антиген-связывающие фрагменты, одно из которых специфично связывается с токсином А, а другое специфично связывается с токсином В С. difficile, и фармацевтически приемлемый носитель или разбавитель. Согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей одно полностью человеческое моноклональное антитело с двойным связыванием (антитело, которое связывается как с токсином А, так и с токсином В) и фармацевтически приемлемый носитель или разбавитель. Согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей два полностью человеческих связывающих моноклональных антитела с двойным связыванием (антитело, которое связывается как с токсином А, так и с токсином В) и фармацевтически приемлемый носитель или разбавитель. Двойные антитела, применяемые в фармацевтической композиции, могут распознавать и/или связывать один эпитоп на токсине А или токсине В, могут распознавать и/или связывать различные эпитопы на токсине А или токсине В. Следует понимать, что для достижения необходимых результатов в группе нуждающихся в такой терапии пациентов в фармацевтической композиции можно применять любую описанную в настоящем документе комбинацию антител. Например, в композиции можно применять два антитела, которые распознают и/или связывают только токсин А. Альтернативно, в композиции можно применять два антитела, которые распознают и/или связывают только токсин В. Согласно одному варианту осуществления в композиции можно комбинировать одно антитело, которое распознает/связывает только токсин А или токсин В, с антителом с двойным связыванием. Согласно одному варианту осуществления одно антитело, которое распознает/связывает только токсин А можно комбинировать с одним антителом, которое распознает/связывает только токсин В, и эту комбинацию можно применять для композиции.
Согласно одному варианту осуществления фармацевтическая композиция содержит полностью человеческое моноклональное антитело, которое связывается с карбоксиконцевым связывающимся с рецептором доменом как токсина А, так и токсина В С. difficile, имеющее любую одну или несколько из описанных в настоящем документе характеристик. Антитело, которое связывается с карбоксиконцевым связывающимся с рецептором доменом как токсина А, так и токсина В С. difficile связывается как с токсином А, так и с токсином В с KD равной или менее 10-7 М.
Согласно одному варианту осуществления композиция содержит антитело, которое связывается как с токсином А, так и с токсином В С. difficile и имеет пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26, 34/42, 50/58, 66/74 и 82/90.
Согласно одному варианту осуществления композиция содержит антитело, которое связывается как с токсином А, так и с токсином В С. difficile и имеет пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26 и 34/42.
Согласно одному варианту осуществления фармацевтическая композиция содержит по меньшей мере одно антитело, которое связывается с токсином Clostridium difficile, причем антитело выбрано из следующих:
a) выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, причем антитело содержит три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей вариабельного участка тяжелой цепи (HCVR), выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162; и три определяющих комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей вариабельного участка легкой цепи (LCVR), выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170;
b) выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, причем антитело содержит три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей HCVR, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей LCVR, выбранных из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362; и
c) выделенное антитело или антиген-связывающий фрагмент, которые связываются/вступают в перекрестную реакцию как с токсином А, так и с токсином В Clostridium difficile, причем антитело содержит три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей HCVR, выбранной из группы, состоящей из SEQ ID NO: 18, 34, 50, 66 и 82; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей LCVR, выбранной из группы, состоящей из SEQ ID NO: 26, 42, 58, 74 и 90.
Согласно одному варианту осуществления фармацевтическая композиция содержит выделенное первое полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином А Clostridium difficile, как описано в настоящем документе, и выделенное второе полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, как описано в настоящем документе, и фармацевтически приемлемый носитель или разбавитель.
Согласно одному варианту осуществления композиция содержит по меньшей мере одно антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, и по меньшей мере одно антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, причем:
а) антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином А, содержат три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей вариабельного участка тяжелой цепи (HCVR), выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162; и три определяющих комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей вариабельного участка легкой цепи (LCVR), выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170; и причем
b) антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В, содержат три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей HCVR, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей LCVR, выбранных из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
Согласно одному варианту осуществления фармацевтическая композиция содержит:
а) выделенное первое полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином А Clostridium difficile, содержащие HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162; и LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170; и
b) выделенное второе полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержащие HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
Согласно одному варианту осуществления фармацевтическая композиция содержит выделенное первое полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином А С. difficile, содержащие пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 2/10, 98/106, 114/122, 130/138, 146/154 и 162/170; и выделенное второе полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В С. difficile, содержащие пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 322/330, 338/346 и 354/362.
Согласно другому варианту осуществления фармацевтическая композиция содержит выделенное первое полностью человеческое моноклональное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином А С. difficile, содержащие пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 146/154; и выделенное второе полностью человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В С. difficile, содержащие пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 274/282.
Согласно соответствующему варианту осуществления фармацевтическая композиция содержит:
а) выделенное первое человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержащие HCDR1 с аминокислотной последовательностью SEQ ID NO: 148, HCDR2 с аминокислотной последовательностью SEQ ID NO: 150, HCDR3 с аминокислотной последовательностью SEQ ID NO: 152, LCDR1 с аминокислотной последовательностью SEQ ID NO: 156, LCDR2 с аминокислотной последовательностью SEQ ID NO: 158, LCDR3 с аминокислотной последовательностью SEQ ID NO: 160;
b) выделенное второе человеческое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержащие HCDR1 с аминокислотной последовательностью SEQ ID NO: 276, HCDR2 с аминокислотной последовательностью SEQ ID NO: 278, HCDR3 с аминокислотной последовательностью SEQ ID NO: 280, LCDR1 с аминокислотной последовательностью SEQ ID NO: 284, LCDR2 с аминокислотной последовательностью SEQ ID NO: 286, LCDR3 с аминокислотной последовательностью SEQ ID NO: 288; и
c) фармацевтически приемлемый носитель или разбавитель.
Согласно одному варианту осуществления антитела по настоящему изобретению или композиции, содержащие одно или несколько антител по настоящему изобретению, можно применять для нейтрализации либо токсина А, либо токсина В, либо как токсина А, так и токсина В любого штамма Clostridium difficile.
Согласно одному варианту осуществления антитела по настоящему изобретению или композиции, содержащие одно или несколько антител по настоящему изобретению, можно применять для нейтрализации токсина А и/или В гипервирулетного штамма Clostridium difficile.
Согласно одному варианту осуществления антитела по настоящему изобретению или композиции, содержащие одно или несколько антител по настоящему изобретению, можно применять для нейтрализации токсина А и/или В штамма BI/NAP1/027.
Согласно одному варианту осуществления антитела по настоящему изобретению или композиции, содержащие одно или несколько антител по настоящему изобретению, можно применять для нейтрализации токсина А и/или В штамма BI/NAP1/027, причем штамм BI/NAP1/027 выбран из группы, состоящей из VA5, VA17, 6336 и 6443.
Согласно одному варианту осуществления композицию антител, содержащую первое антитело, которое специфично связывается с токсином А, можно вводить отдельно в виде отдельной композиции, и композицию антител, содержащую второе антитело, которое специфично связывается с токсином В, также можно вводить в виде отдельной композиции. Каждую композиция можно получить для введения пациенту в отдельных шприцах, или устройствах для введения, или ампулах. При раздельном составлении в виде двух композиций обе композиции можно доставлять раздельно, причем одну композицию антител вводят непосредственно перед другой композицией антител. Альтернативно, две композиции антител можно смешивать вместе незадолго до введения и вводить одновременно.
Согласно одному варианту осуществления настоящее изобретение относится к композиции, которая представляет собой комбинацию антитела или антиген-связывающего фрагмента антитела по настоящему изобретению и второго терапевтического средства.
Вторым терапевтическим средством может быть низкомолекулярное лекарственное средство, белок/полипептид, антитело, молекула нуклеиновой кислоты, такая как антисмысловая молекула, или siRNA. Второе терапевтическое средство может иметь искусственное или естественное происхождение.
Вторым терапевтическим средством может быть любое средство, которое преимущественно скомбинировано с антителом или его фрагментом по настоящему изобретению, например, пробиотик, антибиотик, анатоксин, вакцина от С. difficile или второе отличное антитело к токсину А и/или токсину В С. difficile.
В соответствии с некоторыми вариантами осуществления вторым терапевтическим средством может быть средство, которое способствует препятствованию возникновения или уменьшению любого возможного побочного эффекта(ов), связанного с антителом или антиген-связывающим фрагментом антитела по настоящему изобретению, при появлении такого побочного эффекта(ов).
Также будет понятно, что антитела и фармацевтически приемлемые композиции по настоящему изобретению можно использовать в разновидностях комбинированной терапии, иначе говоря, антитела и фармацевтически приемлемые композиции можно вводить одновременно, перед или после одного или нескольких других необходимых терапевтических средств или медицинских процедур. При конкретной комбинации терапий (терапевтических средств или процедур) для использования в комбинированной схеме будут учтены совместимость необходимых терапевтических средств и/или процедур и подлежащего достижению необходимого терапевтического эффекта. Также будет понятно, что при помощи используемых разновидностей терапии можно достичь необходимый эффект для одного нарушения (например, антитело можно вводить одновременно с другим средством, применяемым для лечения такого же заболевания) или можно достичь различные эффекты (например, контроль любых отрицательных действий). Применяемые в настоящем описании дополнительные терапевтические средства, которые в норме вводят для лечения или предупреждения конкретного заболевания или состояния, являются пригодными для лечения такого заболевания, или состояния.
При совместном введении множества терапевтических средств дозировки можно соответственным образом скорректировать, как известно из уровня техники.
Согласно пятому аспекту настоящее изобретение относится к способу лечения пациента, страдающего от ассоциированного с Clostridium difficile заболевания или состояния, или лечения по меньшей мере одного симптома или осложнения, связанных с указанным состоянием или заболеванием, или предупреждения развития ассоциированного с Clostridium difficile заболевания или состояния у пациента, подверженного такому риску, причем способ предусматривает введение пациенту эффективного количества антитела или его антиген-связывающего фрагмента, которые связываются с токсином А и/или токсином В С. difficile; или фармацевтической композиции, содержащей эффективное количество антитела или его антиген-связывающего фрагмента, которые связываются с токсином А и/или токсином В Clostridium difficile, с тем, чтобы ассоциированное с Clostridium difficile заболевание или состояние либо предупредить, либо уменьшить по тяжести и/или продолжительности, или предупредить или облегчить по меньшей мере один симптом или осложнение, связанные с указанным состоянием или заболеванием, или уменьшить его частоту и/или продолжительность или тяжесть рецидивов или обострений, вызванных Clostridium difficile.
Согласно одному варианту осуществления настоящее изобретение относится к применению одного или нескольких антител по настоящему изобретению или фармацевтических композиций, содержащих одно или несколько антител по настоящему изобретению, при производстве лекарственного препарата для применения при лечении пациента, страдающего от ассоциированного с Clostridium difficile заболевания или состояния, или лечения по меньшей мере одного симптома или осложнения, связанных с указанным состоянием или заболеванием, или предупреждения развития ассоциированного с Clostridium difficile заболевания или состояния у пациента, подверженного такому риску, причем ассоциированное с Clostridium difficile заболевание или состояние либо предупреждают, либо уменьшают по тяжести и/или продолжительности, или предупреждают или облегчают по меньшей мере один симптом или осложнение, связанные с указанным состоянием или заболеванием, или уменьшают его частоту и/или продолжительность или тяжесть рецидивов или обострений, вызванных Clostridium difficile. По меньшей мере один симптом или осложнение, связанные с ассоциированными с Clostridium difficile состоянием или заболеванием, могут быть выбраны из группы, состоящей из анорексии, боли в животе, вздутия живота, диареи с кровотечением или без него, обезвоживания, расстройства пищеварения, псевдомембранозного колита, полной или сегментной резекции толстого кишечника, сопровождающейся лихорадкой и системной инфекцией (сепсисом), смертельного исхода, обострения вызванного Clostridium difficile состояния или заболевания и отторжения трансплантированной ткани или органа.
Согласно одному варианту осуществления пациент, подлежащий лечению при помощи антител по настоящему изобретению или при помощи фармацевтических композиций, содержащих одно или несколько антител по настоящему изобретению, инфицирован гипервирулентным изолятом Clostridium difficile, таким как принадлежащий группе BI/NAP1/027, или может подвергаться риску развития инфекции, вызванной гипервирулентным штаммом, как описано в настоящем документе.
Согласно соответствующему варианту осуществления антитела по настоящему изобретению или фармацевтическую композицию, содержащую одно или несколько антител по настоящему изобретение, можно применять для нейтрализации токсинов, продуцируемых гипервирулентным штаммом Clostridium difficile, таким как без ограничения любой из принадлежащих группе штаммов BI/NAP1/027. В такие гипервирулентные штаммы включены клинические изоляты, обозначаемые в настоящем документе VA5, VA17, 6336 и 6443, которые описаны в настоящем документе в Примере 10.
Согласно одному варианту осуществления пациент, подверженный риску развития ассоциированного с Clostridium difficile заболевания или состояния, который может получить благоприятный эффект от лечения при помощи антител по настоящему изобретению или при помощи композиции, содержащей одно или несколько антител по настоящему изобретению, может быть выбран из пожилого пациента (возрастом ≥65), пациента, который имеет иммунную недостаточность в связи с первопричинной болезнью или в связи с введением иммуносупрессивных терапевтических средств, пациента, у которого есть некоторое первопричинное медицинское состояние, которое может вызывать у него предрасположенность к возникновению инфекции Clostridium difficile, пациента, госпитализированного на протяжении длительного периода времени (одна неделя или более), пациента, которого лечили на протяжении продолжительного периода времени (≥14 дней) антибиотиками широкого спектра действия, пациента со злокачественной опухолью, проходящего трансплантацию пациента и пациента, подвергаемого терапии средствами, такими как без ограничения ингибитор протонного насоса или ингибитор гистаминового рецептора Н2, которые применяют для лечения заболеваний или состояний желудочно-кишечного тракта для уменьшения или лечения кислотности желудочного сока, гастроэзофагеальной рефлюксной болезни (GERD), язв желудка или тонкой кишки или изжоги.
Согласно одному варианту осуществления пациентом, подверженным риску развития ассоциированного с Clostridium difficile заболевания или состояния, является пациент со злокачественной опухолью. Согласно соответствующему варианту осуществления пациент со злокачественной опухолью проходит лечение при помощи противоопухолевого лекарственного средства или проходит лучевую терапию для лечения злокачественной опухоли.
Согласно одному варианту осуществления пациентом, подверженным риску развития ассоциированного с Clostridium difficile заболевания или состояния, является проходящий трансплантацию пациент. Согласно соответствующему варианту осуществления проходящим трансплантацию пациентом является пациент, получающий тансплатат гемопоэтических стволовых клеток или трансплатат твердой ткани или цельного органа. В соответствии с определенными вариантами осуществления проходящий трансплантацию пациент подвергается лечению иммуносупрессивным лекарственным средством или любым лекарственным средством, препятствующим отторжению трансплантата, или он является пациентом, который проходит лечение согласно схеме приема лекарственного средства для предупреждения отторжения после трансплантации трансплантируемых ткани или органа.
Согласно одному варианту осуществления антитело вводят в терапевтических целях (вводят после того, как инфекция была установлена, и дают в течение всего курса лечения инфекции) пациенту, страдающему от ассоциированного с Clostridium difficile заболевания или состояния или страдающего по меньшей мере от одного симптома или осложнения, ассоциированного с таким состоянием или заболеванием. Согласно одному варианту осуществления антитело вводят в профилактических целях (вводят до развития инфекции) пациенту, подверженному риску развития ассоциированного с Clostridium difficile заболевания или состояния или подверженному риску развития по меньшей мере одного симптома или осложнения, ассоциированного с вызванным Clostridium difficile состоянием или заболеванием. Например, такие "пациенты, подверженные риску развития инфекции Clostridium difficile", включают пожилых (возрастом 65 лет или старше), или пациентов, которые имеют иммунную недостаточность в связи с болезнью или в связи с введением иммуносупрессивных терапевтических средств, или пациентов, у которых есть некоторое первопричинное медицинское состояние, которое может вызывать у них предрасположенность к возникновению инфекции Clostridium difficile, или пациентов, госпитализированных на протяжении длительных периодов времени (обычно одна неделя или дольше), или пациентов, которых лечили на протяжении длительного периода времени антибиотиками широкого спектра действия (обычно 14 дней или дольше), пациентов, подвергаемых терапии ингибиторами протонного насоса для лечения заболеваний и состояний желудочно-кишечного тракта. Другими пациентами, подверженными риску развития инфекции Clostridium difficile, являются такие пациенты, которым необходима трансплантация ткани или органа, которые могут проходить лечение при помощи иммунуспрессирующих лекарственных средств для предупреждения отторжения ткани или органа. Такая группа пациентов включает людей, которым необходима трансплантация либо аутологических, либо аллогенных гемопоэтических стволовых клеток. Необходимая для таких пациентов длительная госпитализация, помимо назначения высоких доз средств для антибиотикотерапии с целью предупреждения других типов инфекций, может вызывать у этих пациентов предрасположенность к возникновению первичной инфекции С. difficile. Альтернативно, если нуждающийся в такой трансплантации пациент уже страдает от инфекции С. difficile, или у него появились симптомы инфекции С. difficile, то такой пациент может быть склонен к рецидиву или обострению такой инфекции при назначении высокой дозы средств для антибиотикотерапии, с последующей иммуносупрессивной терапией для предупреждения отторжения трансплантата. Кроме того, такие проходящие трансплантацию пациенты могут подвергаться не только риску появления инфекции С. difficile, но также и риску отторжения трансплантата в связи со связанной с желудочно-кишечным трактом реакцией трансплантат против хозяина (GI-GVHD), которая, по видимому, усиливается у проходящих трансплантацию пациентов, страдающих от инфекции С. difficile (см., Alonso, C.D. et al., (2012), Clin. Infect. Dis. 54, 1053-1063. Взаимосвязь между инфекцией С. difficile и GVHD, вовлекающими GI-тракт, в настоящее время не ясна, но очевидно, что такая группа пациентов будет получать благоприятный эффект от терапии антителами к токсину А и/или к токсину В по настоящему изобретению. В то же время предусмотрено, что такую группу пациентов можно лечить терапевтически (после начала инфекции), также предполагают, что такие пациенты будут получать благоприятный эффект от профилактического (доинфекционного) введения любого из антител по настоящему изобретению. Пациентам, которые являются претендентами на лечение при помощи антител по настоящему изобретению, можно вводить композиции, содержащие одно или несколько антител, любым подходящим для введения путем доставки, включая без ограничения внутривенную инъекцию или подкожную инъекцию.
Согласно одному варианту осуществления фармацевтическую композицию, содержащую антитела по настоящему изобретению, вводят пациенту в комбинации с одним или несколькими терапевтическими средствами, пригодными для лечение инфекции С. difficile.
Согласно одному варианту осуществления одно или несколько терапевтических средств можно выбрать из группы, состоящей из анатоксина, пробиотика, вакцины против С. difficile (например, инактивированных токсинов А и В, таких как без ограничения ACAM-CDIFF™), антибиотика (например, метронидазола, ванкомицина или фидаксомицина), другого отличного антитела к токсину А и/или В С. difficile и любого другого паллиативного средства терапии, пригодного для уменьшения тяжести заболевания от С. difficile, или для уменьшения частоты рецидивов вызванного С. difficile заболевания, или для ослабления по меньшей мере одного симптома, связанного с ассоциированным с С. difficile состоянием или заболеванием.
Согласно другому варианту осуществления один симптом или одно осложнение, связанные с ассоциированным с С. difficile состоянием или заболеванием, выбраны из группы, состоящей из диареи, псевдомембранозного колита, обострения/рецидива вызванного Clostridium difficile состояния или заболевания и отторжения трансплантированной ткани или органа.
Другие варианты осуществления станут понятны при рассмотрении последующего подробного описания.
Краткое описание чертежей
На фигуре 1 показаны структуры доменов токсина А и токсина В Clostridium difficile (см. Davies АН, et al., Biochem. J. (2011), 436:517-526).
На фигуре 2 приведен график, показывающий результаты анализов обострения у хомяков как процент хомяков, выживших после лечения клиндамицином и ванкомицином после заражения С. difficile, и влияние лечения при помощи mAb к токсину А и токсину В. Все антитела давали подкожно один раз в день на дни 3-6. Антителами положительного контроля являются антитела сравнения, антитела к токсину А (контроль I) и антитела к токсину В (контроль II). Всем животным давали ванкомицин в виде пероральной дозы в количестве 10 мг/кг на дни 1-3. (• с пунктирной линией: контроль PBS; Δ с пунктирной линией: отрицательный изотипический контроль в количестве 10 мг/кг; □ со сплошной линией: контроль I/контроль II в количестве 5 мг/кг каждого (5/5): ♦ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 5 мг/кг каждого (5/5)).
На фигуре 3 приведен график, показывающий результаты анализов обострения у хомяков как процент хомяков, выживших после лечения клиндамицином и ванкомицином после заражения С. difficile, и влияние mAb к токсину А и токсину В. Все антитела давали подкожно один раз в день 3. Антителами положительного контроля являются антитела сравнения, антитела к токсину А (контроль I) и антитела к токсину В (контроль II). Всем животным давали ванкомицин в виде пероральной дозы в количестве 10 мг/кг на дни 1-3. (Δ с пунктирной линией: отрицательный изотипический контроль в количестве 10 мг/кг; □ со сплошной линией: контроль I/контроль II в количестве 5 мг/кг каждого (5/5); ♦ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 5 мг/кг каждого (5/5); ○ со сплошной линией: контроль I/контроль II в количестве 2 мг/кг каждого (2/2); □ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 2 мг/кг каждого (2/2)).
На фигуре 4 приведен график, на котором показаны результаты по выживаемости в модели острой инфекции С. difficile у хомяков. Результаты показаны в виде процента хомяков, выживших при заражении С. difficile (день 0) после лечения клиндамицином (день -1). Все антитела давали подкожно каждые 4 дня, начиная от дня -3, до дня 0. Антитела вводили в количестве 50 мг/кг каждого (50/50), 16,6 мг/кг каждого (16,6/16,6), 5,5 мг/кг каждого (5,5/5,5) и 1,85 мг/кг каждого (1,85/1,85). (∇ со сплошной линией: неинфицированные; • с пунктирной линией: контроль PBS; Δ с пунктирной линией: отрицательный изотипический контроль в количестве 100 мг/кг; ♦ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 50 мг/кг каждого (50/50); ○ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 16,6 мг/кг каждого (16,6/16,6); | со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 5,5 мг/кг каждого (5,5/5,5); ┼ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 1,85 мг/кг каждого (1,85/1,85).
На фигуре 5 приведен график, на котором показаны результаты по выживаемости в модели острой инфекции С. difficile у хомяков. Результаты показаны в виде процента хомяков, выживших при заражении С. difficile (день 0) после лечения клиндамицином (день -1). Все антитела давали подкожно каждые 4 дня, начиная от дня -3, до дня 0. Антитела вводили в количестве 20 мг/кг каждого (20/20) или в количестве 5 мг/кг каждого (5/5). (∇ со сплошной линией: неинфицированные; • с пунктирной линией: контроль PBS; Δ с пунктирной линией: отрицательный изотипический контроль в количестве 40 мг/кг; □ со сплошной линией: контроль I/контроль II в количестве 20 мг/кг каждого (20/20);  со сплошной линией: контроль I/контроль II в количестве 5 мг/кг каждого (5/5); ♦ со сплошной линией: Η1Η3330Ρ/H1Η3347Ρ в количестве 20 мг/кг каждого (20/20); ◊ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 5 мг/кг каждого (5/5)).
со сплошной линией: контроль I/контроль II в количестве 5 мг/кг каждого (5/5); ♦ со сплошной линией: Η1Η3330Ρ/H1Η3347Ρ в количестве 20 мг/кг каждого (20/20); ◊ со сплошной линией: Н1Н3330Р/Н1Н3347Р в количестве 5 мг/кг каждого (5/5)).
Подробное описание настоящего изобретения
Перед описанием настоящих способов необходимо понять, что настоящее изобретение не ограничено конкретными способами и описанными экспериментальными условиями, поскольку такие способы и условия могут изменяться. Также следует понять, что применяемая в настоящем описании терминология приведена только с целью описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
Если не указано иное, то все применяемые в настоящем документе технические и научные термины имеют такое же значение, которое обычно понимается рядовым специалистом в настоящей области техники, к которой относится настоящее изобретение. Несмотря на то, что при осуществлении на практике или испытании настоящего изобретения можно применять любые способы и материалы, сходные или эквивалентные описанным в настоящем документе, далее описаны предпочтительные способы и материалы.
Определения
Термин "токсин А" (также называемый как "tcdA") относится к белку токсина А, продуцируемому Clostridium difficile (также называемой в настоящем документе как "С. difficile"). Аминокислотная последовательность "токсина А" представлена в GenBank под номером доступа САА63564, а также называется в настоящем документе как SEQ ID NO: 378. Токсин А кодируется нуклеиновой кислотой, обозначенной в настоящем документе как SEQ ID NO: 377, а также находится в GenBank под номером доступа АМ180355.
Термин "токсин В" (также называемый как "tcdB") относится к белку токсина В, продуцируемому Clostridium difficile. Аминокислотная последовательность "токсина В" представлена в GenBank под номером доступа CAJ67492, а также называется в настоящем документе как SEQ ID NO: 380. Токсин В кодируется нуклеиновой кислотой, обозначенной в настоящем документе как SEQ ID NO: 379, а также находится в GenBank под номером доступа AMI 80355.
"Карбоксиконцевой связывающийся с рецептором домен токсина А и токсина В Clostridium difficile" относится к части токсина А и токсина В С. difficile, который является ответственным за связывание с клеткой-мишенью, таким образом обеспечивая последующий опосредованный рецептором эндоцитоз. Описанная в настоящем документе аминокислотная последовательность карбоксиконцевого связывающегося с рецептором домена токсина А показана в SEQ ID NO: 375. Аминокислотная последовательность карбоксиконцевого связывающегося с рецептором домена токсина В показана в SEQ ID NO: 376. Различные домены токсина А и токсина В С. difficile проиллюстрированы на фигуре 1 и дополнительно описаны в работе Davies et al. (Davies, AH, et al., Biochem. J. (2011), 436:517-526).
Обозначение "BI/NAP1/027" для Clostridium difficile относится к высоковирулетной группе изолятов Clostridium difficile, которых ассоциируют с повышением заболеваемости и смертности по всей территории Европы и Северной Америки (Loo, VG, et al., (2005), N Engl J Med, 353:2442-9; McDonald, LC et al. (2006), Emerg Infect Dis, 12:409-15; McDonald, LC, et al., (2005), N Engl J Med, 353:2433-41; Redelings, MD, et al., (2007), Emerg Infect Dis 13:1417-9). Обозначение "BI/NAP1/027" дополнительно относится к штамму North American pulsed-field type I (NAP1), риботипа 027 и группы BI по результатам анализа с применением рестрикционной эндонуклеазы. Изначально он был определен в 1980х годах, но изначально его не определяли как устойчивый к более новым фторхинолоновым средствам, и до 2000 года он не носил эпидемический характер (Warny, M. et al., (2005), Lancet 366:1079-84; Kelly, CP, et al., N Engl J Med 359:1932-40). Штамм "BI/NAP1/027" Clostridium difficile также характеризуется повышенной продукцией токсина А и токсина В, присутствием дополнительного токсина (бинарный токсин), и повышенной устойчивостью к фторхинолонам (McDonald, LC, et al., (2005), Ν Engl J Med, 353:2433-41; Warny, M. et al., (2005), Lancet 366:1079-84).
Применяемый в настоящем документе термин "антитело" предназначен для обозначения молекул иммуноглобулина, в состав которых входят четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями (т.е., "молекул целого антитела"), а также его мультимеров (например, IgM) или его антиген-связывающих фрагментов. В состав каждой тяжелой цепи входят вариабельный участок тяжелой цепи ("HCVR" или "VH") и константный участок тяжелой цепи (в его состав входят домены CH1, CH2 и CH3). В состав каждой легкой цепи входят вариабельный участок легкой цепи ("LCVR или "VL") и константный участок легкой цепи (CL). Участки VH и VL дополнительно можно подразделить на участки гипервариабельности, называемые определяющие комплементарность участки (CDR), чередующиеся с участками, которые являются более консервативными, называемыми каркасными участками (FR). В состав каждого VH и VL входят три CDR и четыре FR, располагающиеся от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В соответствии с определенными вариантами осуществления по настоящему изобретению FR антитела (или его антиген-связывающего фрагмента) могут быть идентичными с человеческими последовательностями зародышевой линии или могут быть модифицированы естественным или искусственным путем. Аминокислотную консенсусную последовательность можно определить на основе анализа расположенных параллельно последовательностей двух или более CDR.
Также возможна замена одного или нескольких остатков CDR или исключение одного или нескольких CDR. В научной литературе описаны антитела, для функции связывания у которых не важны один или два CDR. Padlan et al. (1995 FASEB J. 9:133-139) анализировали контактные участки между антителами и их антигенами на основе опубликованных кристаллических структур и пришли к выводу, что фактически приблизительно только от одной пятой до одной трети остатков CDR контактируют с антигеном. Padlan также обнаружил множество антител, в которых один или два CDR не имели аминокислот, контактирующих с антигеном (см. также Vajdos et al. 2002 J Mol Biol 320:415-428).
Остатки CDR, не контактирующие с антигеном, можно определить на основании результатов предыдущих исследований (например, остатки Н60-Н65 в CDRH2 часто не являются необходимыми), исходя из участков CDR по Kabat, лежащих за пределами CDR Chothia, посредством молекулярного моделирования и/или опытным путем. Если CDR или его остаток(остатки) исключены, то он обычно замещен на аминокислоту, занимающую соответствующее положение в другой последовательности человеческого антитела или консенсусной последовательности таких последовательностей. Положения для замены в CDR и аминокислотах для замены можно также подобрать опытным путем. Эмпирические замены могут быть консервативными или неконсервативными заменами.
Раскрываемые в настоящем документе полностью человеческие моноклональные антитела к токсину А и/или к токсину В могут содержать одну или несколько аминокислотных замен, вставок и/или делеций в каркасных и/или CDR участках вариабельных доменов тяжелых и легких цепей по сравнению с соответствующими последовательностями зародышевой линии. Такие мутации можно легко выявить путем сравнения раскрытых в настоящем документе аминокислотных последовательностей с последовательностями зародышевой линии, доступными, например, из находящихся в общем доступе баз данных последовательностей антител. Настоящее изобретение относится к антителам и к их антиген-связывающим фрагментам, которые получены из любой из раскрытых в настоящем документе аминокислотных последовательностей, причем одна или несколько аминокислот в одном или нескольких каркасных и/или CDR участках являются мутировавшими по соответствующему остатку(остаткам) последовательности зародышевой линии, из которой было получено антитело, или по соответствующему остатку(остаткам) другой последовательности человеческой зародышевой линии, или по консервативной аминокислотной замене соответствующего остатка(остатков) зародышевой линии (такие изменения последовательности собирательно называются в настоящем документе как "мутации зародышевой линии"). Рядовой специалист в настоящей области, исходя из раскрываемых в настоящем документе последовательностей вариабельных участков тяжелых и легких цепей, легко может получить многочисленные антитела и антиген-связывающие фрагменты, которые содержат одну или несколько отдельных мутаций зародышевой линии или их комбинации. В соответствии с определенными вариантами осуществления все каркасные и/или CDR остатки в доменах VH и/или VL являются мутировавшими обратно до остатков, обнаруживаемых в исходной последовательности зародышевой линии, из которой было получено антитело. Согласно другим вариантам осуществления только определенные остатки являются мутировавшими обратно до исходной последовательности зародышевой линии, например, только мутировавшие остатки, обнаруживаемые в первых 8 аминокислотах FR1 или в последних 8 аминокислотах FR4, или мутировавшие остатки, обнаруживаемые только в CDR1, CDR2 или CDR3. Согласно другим вариантам осуществления один или несколько каркасных и/или CDR остатков являются мутировавшими в соответствующие остатки отличной последовательности зародышевой линии (т.е. последовательности зародышевой линии, которая отличается от последовательности зародышевой линии, из которой исходно было получено антитело). Вместе с тем, антитела по настоящему изобретению могут содержать любую комбинацию из двух или более мутаций зародышевой линии в каркасных и/или CDR участках, в которой, например, некоторые отдельные остатки являются мутировавшими в соответствующий остаток конкретной последовательности зародышевой линии, в то время как некоторые другие остатки, которые отличаются от исходной последовательности зародышевой линии, сохранены или являются мутировавшими в соответствующий остаток отличной последовательности зародышевой линии. После получения антитела и антиген-связывающие фрагменты, которые содержат одну или несколько мутаций зародышевой линии, можно легко протестировать на предмет одного или нескольких необходимых свойств, таких как улучшенная специфичность связывания, повышенная аффинность связывания, улучшенные или увеличенные антагонистические или агонистические биологические свойства (при соответствующих обстоятельствах), уменьшенная иммуногенность и т.д. Настоящее изобретение относится к антителам и антиген-связывающим фрагментам, которые, в целом, получены таким способом.
Настоящее изобретение также относится к полностью человеческим моноклональным антителам к токсину А и/или к токсину В, содержащим варианты любой из раскрываемых в настоящем документе аминокислотных последовательностей HCVR, LCVR и/или CDR, имеющих одну или несколько консервативных замен. Например, настоящее изобретение относится к антителам к токсину А и к токсину В, имеющим аминокислотные последовательности HCVR, LCVR и/или CDR, например, с 10 или менее, 8 или менее, 6 или менее, 4 или менее и т.д. консервативными аминокислотными заменами относительно любой из раскрываемых в настоящем документе аминокислотных последовательностей HCVR, LCVR и/или CDR.
Применяемый в настоящем документе термин "человеческое антитело" подразумевают как включающий антитела, имеющие вариабельные и константные участки, полученные из иммуноглобулиновых последовательностей человеческой зародышевой линии. Человеческие mAb по настоящему изобретению могут включать аминокислотные остатки, не кодируемые иммуноглобулиновой последовательностью человеческой зародышевой линии (например, мутации, введенные в результате неспецифического или сайт-направленного мутагенеза in vitro или соматической мутации in vivo), например, в CDR и, в частности, в CDR3. Тем не менее, применяемый в настоящем документе термин "человеческое антитело" не подразумевают как включающий mAb, у которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих (например, мыши), были пришиты на человеческие последовательности FR.
Термин "специфично связывается с" или "связывается специфично с" или т.п. означает, что антитело или его антиген-связывающий фрагмент формирует с антигеном комплекс, который является относительно стабильным в физиологических условиях. Специфичное связывание можно охарактеризовать равновесной константой диссоциации, составляющей по меньшей мере приблизительно 1×10-6 M или менее (например, KD с меньшим значением указывает на более прочное связывание). Способы определения, специфично ли связываются две молекулы, хорошо известны в настоящей области техники и включают, например, равновесный диализ, поверхностный плазмонный резонанс и т.п. Как описано в настоящем документе, антитела были определены с помощью поверхностного плазмонного резонанса, например, BIACORE™, которые специфично связываются либо с токсином А, либо специфично с токсином В из С. difficile, в то время как было определено, что другие специфично связываются с карбоксиконцевым связывающимся с рецептором доменом как токсина А, так токсина и В. Кроме того, в контексте настоящего документа мультиспецифические антитела, которые связываются с токсином А или токсином В и одним или несколькими дополнительными антигенами, или биспецифическую молекулу, которая связывается с двумя различными участками токсина А или токсина В, тем не менее считают антителами, которые "специфично связывают".
Термин антитело с "высокой аффинностью"относится к mAb, имеющим аффинность связывания с токсином А или токсином В, выражаемую как KD, составляющую по меньшей мере 10-8 М; предпочтительно 10-9 М; более предпочтительно 10-10 М, еще более предпочтительно 10-11 М, еще более предпочтительно 10-12 М, которую измеряют с помощью поверхностного плазмонного резонанса, например, BIACORE™, или с помощью ELISA на аффинность в растворе.
Под термином "медленная скорость диссоциации", "Koff" или "kd" подразумевают антитело, которое диссоциирует от токсина А, или токсина В, или обоих с константой скорости реакции 1×10-3 с-1 или менее, предпочтительно 1×10-4 с-1 или менее, которую измеряют с помощью поверхностного плазмонного резонанса, например, BIACORE™.
Применяемые в настоящем документе термины "антиген-связывающая часть" антитела, "антиген-связывающий фрагмент" антитела и т.п. включают любой встречающийся в природе, получаемый ферментативно, синтетический или генетически сконструированный полипептид или гликопротеин, который специфично связывается с антигеном с формированием комплекса. Применяемые в настоящем документе термины "антиген-связывающая часть" антитела или "фрагмент антитела" относятся к одному или нескольким фрагментам антитела, которые сохраняют способность связываться с токсином А, или токсином В, или обоими.
Согласно конкретным вариантам осуществления, антитело или фрагменты антитела по настоящему изобретению могут быть конъюгированы с терапевтическим фрагментом ("иммуноконъюгат"), таким как антибиотик, второе антитело к токсину А или В, или вакцина от С. difficile, или анатоксин, или любым другим терапевтическим фрагментом, пригодным для лечения вызванного С. difficile заболевания или состояния.
Применяемый в настоящем документе термин "выделенное антитело" предназначен для обозначения антитела, которое практически не контактирует с другими антителами (Ab), имеющими отличные антигенные специфичности (например, выделенное антитело, которое специфично связывается с токсином А или токсином В, или его фрагмент, которые практически не контактируют с Ab, которые специфично связывают антигены, отличные от токсина А или токсина В).
Применяемые в настоящем документе термины "блокирующее антитело" или "нейтрализующее антитело", (или "антитело, которое нейтрализует активность токсина А и/или токсина В") предназначены для обозначения антитела, связывание которого с токсином А и/или токсином В приводит в результате к ингибированию по меньшей мере одной биологической активности токсина А и/или токсина В. Например, антитело по настоящему изобретению может способствовать предупреждению первичного заболевания, вызванного С. difficile. Альтернативно, у антитела по настоящему изобретению можно наблюдать способность предупреждать рецидив или обострение вызванного С. difficile заболевания или по меньшей мере один симптом, вызванный инфекцией С. difficile, включая диарею или псевдомембранный колит. Такое ингибирование биологической активности токсина А и/или токсина В можно оценить путем измерения одного или нескольких показателей биологической активности токсина А и/или токсина В при помощи одного или более из нескольких стандартных анализов in vitro (таких как описанный в настоящем документе анализ нейтрализации) или in vivo анализов, известных из уровня техники (например, животные модели для проверки защиты от заражения С. difficile после введения одного или нескольких описанных в настоящем документе антител).
Применяемый в настоящем документе термин "поверхностный плазмонный резонанс" относится к оптическому явлению, которое позволяет анализировать в реальном времени биомолекулярные взаимодействия путем определения изменений концентраций белка в матрице биосенсора, например при помощи системы BIACORE™ Pharmacia Biosensor АВ, Уппсала, Швеция и Пискатауэй, Нью-Джерси).
Применяемый в настоящем документе термин "KD" предназначен для обозначения равновесной константы диссоциации конкретного взаимодействия антитело-антиген.
Термин "эпитоп" относится к антигенной детерминанте, которая взаимодействует со специфичным антиген-связывающим сайтом в вариабельном участке молекулы антитела, известном как паратоп. Один антиген может иметь более одного эпитопа. Таким образом, различные антитела могут связываться с различными областями на антигене и могут оказывать различные биологические эффекты. Термин "эпитоп" также относится к сайту на антигене, на который реагируют В- и/или Т-клетки. Он также относится к участку антигена, который связывается антителом. Эпитопы можно определить как структурные или функциональные. Функциональные эпитопы обычно представляют собой подгруппу структурных эпитопов и имеют такие остатки, которые вносят непосредственный вклад в аффинность взаимодействия. Эпитопы также могут быть конформационными, т.е. состоящими из нелинейных аминокислот. В соответствии с определенными вариантами осуществления эпитопы могут включать детерминанты, которые являются химически активными поверхностными группировками таких молекул, как аминокислоты, сахарными боковыми цепями, фосфорильными группами или сульфонильными группами и, в соответствии с определенными вариантами осуществления, могут иметь характеристики, касающиеся трехмерной структуры, и/или характеристики удельного заряда.
Термин "существенная идентичность" или "по существу идентичный" в отношении нуклеиновой кислоты или ее фрагмента указывает на то, что при оптимальном выравнивании при помощи соответствующих нуклеотидных вставок или делеций с другой нуклеиновой кислотой (или комплементарной ей нитью) имеет место идентичность нуклеотидной последовательности по меньшей мере у приблизительно 90%, и более предпочтительно по меньшей мере приблизительно 95%, 96%, 97%, 98% или 99% нуклеотидных оснований согласно результатам измерения при помощи любого хорошо известного алгоритма определения идентичности последовательностей, такого как FASTA, BLAST или GAP, которые обсуждаются ниже. Молекула нуклеиновой кислоты, характеризующаяся существенной идентичностью с эталонной молекулой нуклеиновой кислоты, может в определенных случаях кодировать полипептид, имеющих такую же или по существу сходную аминокислотную последовательность, что и полипептид, кодируемый эталонной молекулой нуклеиновой кислоты.
Применительно к полипептидам термин "существенное сходство" или "по существу сходный" означает, что две пептидные последовательности при оптимальном выравнивании, таком как посредством программ GAP или BESTFIT, с применением штрафов за открытие гэпов по умолчанию, имеют по меньшей мере 90% идентичность последовательности, еще более предпочтительно по меньшей мере 95%, 98% или 99% идентичность последовательности. Предпочтительно, положения остатков, которые не являются идентичными, отличаются по консервативным аминокислотным заменам. "Консервативная аминокислотная замена" является заменой, при которой аминокислотный остаток заменен на другой аминокислотный остаток, имеющий боковую цепь (группа R) со сходными химическими свойствами (например, зарядом или гидрофобностью). В целом, консервативная аминокислотная замена практически не будет изменять функциональные свойства белка. В случаях, когда две или более аминокислотные последовательности отличаются друг от друга по консервативным заменам, процент или степень сходства можно скорректировать до надлежащей по консервативной природе замены. Способы осуществления такой корректировки хорошо известны специалистам в настоящей области техники. См., например, Pearson (1994) Methods Mol Biol. 24: 307-331. Примеры групп аминокислот, которые имеют боковые цепи со сходными химическими свойствами включают: 1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; 2) алифатически-гидроксильные боковые цепи: серии и треонин; 3) амидсодержащие боковые цепи: аспарагин и глутамин; 4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; 5) основные боковые цепи: лизин, аргинин и гистидин; 6) кислотные боковые цепи: аспартат и глутамат; и 7) серосодержащие боковые цепи: цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. Альтернативно, консервативным замещением является любое изменение, имеющее положительное значение в матрице логарифмического правдоподобия РАМ250, раскрытой в работе Gonnet et al. (1992) Science 256: 1443 45. "Умеренно консервативное" замещение представляет собой любое изменение, имеющее неотрицательное значение в матрице логарифмического правдоподобия РАМ250.
Сходство последовательностей для полипептидов обычно измеряют при помощи программного обеспечения для анализа последовательностей. Программное обеспечение для анализа белка сопоставляет сходные последовательности при помощи измерений сходства присвоенного различным заменам, делециям и другим модификациям, включая консервативные аминокислотные замены. Например, программное обеспечение GCG содержит программы, такие как GAP и BESTFIT, которые можно применять с параметрами по умолчанию для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды от различных видов организмов или между белком дикого типа и его мутеином. См., например, GCG Version 6.1. Полипептидные последовательности также можно сравнивать при помощи FASTA с параметрами по умолчанию или рекомендованными параметрами, программы в GCG Version 6.1. FASTA (например, FASTA2 и FASTA3) выводит результаты выравнивания и процентную идентичность последовательности для участков с наилучшим совпадением между запрашиваемой и поисковой последовательностями (Pearson (2000) supra). Другим предпочтительным алгоритмом при сравнении последовательности по настоящему изобретению с базой данных, содержащей большое количество последовательностей различных организмов, является компьютерная программа BLAST, в особенности BLASTP или TBLASTN, с применением параметров по молчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215: 403 410 и (1997) Nucleic Acids Res. 25:3389 402.
Согласно конкретным вариантам осуществления антитело или фрагмент антитела для применения согласно способу по настоящему изобретению может быть моноспецифическим, биспецифическим или мультиспецифическим. Мультиспецифические антитела могут быть специфичными к различным эпитопам одного целевого полипептида или могут содержать антиген-связывающие домены, специфичные к эпитопам более одного целевого полипептида. Иллюстративный формат биспецифического антитела, который можно применять в контексте настоящего изобретения, включает применение первого домена CH3 иммуноглобулина (Ig) и второго домена CH3 Ig, причем первый и второй домены CH3 Ig отличаются друг от друга по меньшей мере по одной аминокислоте, и причем по меньшей мере одно аминокислотное отличие уменьшает связывание биспецифического антитела с белком А по сравнению с биспецифическим антителом без аминокислотного отличия. Согласно одному варианту осуществления первый домен CH3 Ig связывается с белком А, а второй домен Ig CH3 содержит мутацию, которая уменьшает или ликвидирует связывание белка А, такую как модификация H95R (согласно нумерации экзонов IMGT; H435R согласно нумерации EU). Второй CH3 может дополнительно содержать модификацию Y96F (согласно IMGT; Y436F согласно EU). Дополнительные модификации, которые можно обнаружить во втором CH3, включают: D16E, L18M, N44S, K52N, V57M и V82I (согласно IMGT; D356E, L358M, N384S, K392N, V397M и V422I согласно EU) в случае mAb IgG1; N44S, K52N и V82I (IMGT; N384S, K392N и V422I согласно EU) в случае mAb IgG2; и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (согласно IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I согласно EU) в случае mAb IgG4. Описанные выше варианты формата биспецифических антител предусмотрены объемом настоящего изобретения.
Под фразой "терапевтически эффективное количество" подразумевают количество, которое производит необходимый эффект у того, кому его вводят. Точное количество будет зависеть от цели лечения и может быть установлено специалистом в настоящей области техники при помощи известных методик (см., например, Lloyd (1999) The Art, Science and Technology of Pharmaceutical Compounding).
Общее описание настоящего изобретения
Clostridium difficile является грамположительной, спорообразующей, продуцирующей токсины бактерией, которая является основной причиной нозокомиальной, ассоциированной с антибиотиками диареи и колита у людей (Bartlett, J.G. et al. (1978), N. Engl. J. Med. 298:531-534; Kyne, L., et al. (2001), Clin. N. Am. 30:753-777). Нарушение среды в толстом кишечнике, возникающее в результате введения антибиотиков широкого спектра действия, приводит к колонизации кишечника бактериями (Johnson, S.С. et al. (1990), Lancet 336:97-100). У большого процента такой группы пациентов, которые становятся колонизированными С. difficile, развивается диарея, которая в определенных случаях приводит к псевдомембранозному колиту, который, как полагают, является последствием продукции С. difficile двух экзотоксинов, токсина А и токсина В. Лечение состоит из прекращения употребления вызывающего реакцию антибиотика, или изменений дозировки вызывающего реакцию антибиотика, или отсутствие изменения вызывающего реакцию антибиотика с последующим введением метронидазола, ванкомицина или фидаксомицина. В то время как такая схема лечения обычно является успешной, у многих пациентов наблюдается обострение при прекращении терапии (Fekety, R., (1997), Am. J. Gastroenterology, 92:739-750). Вместе с тем, во многих случаях бактерия С. difficile становится устойчивой к применяемой терапии, таким образом приводя к неудачным исходам лечения и в некоторых случаях повышенным процентам смертности (Dworczynski, A. et al. (1991), Cytobios. 65:149-153; Fekety, R. et al. (1993), JAMA, 269:71-75). Поэтому, существует потребность в более эффективных терапиях для борьбы с этим заболеванием и/или для предупреждения рецидива этого заболевания у пациентов, колонизированных С. difficile. Кроме того, существует потребность лечения пациентов, которые подвержены риску развития инфекции С. difficile посредством профилактического введения эффективного средства. В группу подверженных риску пациентов включены пожилые, в частности, пациенты возрастом 65 лет и старше, несмотря на то, что пациенты моложе 65 лет могут подвергаться более серьезному риску в зависимости от наличия любого первопричинного заболевания, которое может вызывать у них предрасположенность к инфицированию С. difficile. Пациенты, которые были инфицированы С. difficile ранее, могут подвергаться более серьезному риску возникновения рецидивов. Другие подверженные риску пациенты включают пациентов, которые предрасположены к инфекции С. difficile в связи с первопричинным медицинским состояниям, или пациентов, которых госпитализировали на протяжении длительного периода времени (по меньшей мере одна неделя или дольше) и/или которые проходят долгосрочное лечение (≥14 дней) при помощи антибиотиков широкого спектра действия, а также пациентщв, которые принимают ингибиторы протонного насоса для лечения гастроэзофагеальной рефлюксной болезни (GERD), язв желудка и тонкой кишки и воспаления пищевода. Такие средства включают декслансопразол, эзомепразол, лансопразол, омепразол, натрия пантопразол или натрия рабепрозол. Другие средства, которые находятся на стадии исследовании для продажи пациенту, подверженному риску развития инфекции С. difficile, включают блокаторы Н2-гистаминовых рецепторов, такие как циметидин, фамотидин, низатидин и ранитидин. В других исследованиях отмечали возрастную заболеваемость ассоциированной с С. difficile диареей, более конкретно, увеличение пациентов возрастом старше 50 лет и повышение уровня смертности у пациентов возрастом старше 60 лет (Loo, VG, et al., (2005), N Engl J Med 353:2442-9). Фактически, это исследование было сопоставимо с результатами более раннего исследования, которое показало связанное с возрастом повышение встречаемости положительных анализов на токсин С. difficile (Karlström, О. et al. (1998), Clin Infect Dis 26:141-5).
Для удовлетворения потребности в более эффективной терапии против С. difficile было проведено множество исследований для определения того, можно ли антитела к токсину А и/или В, при применении отдельно или в качестве вспомогательной терапии, применять в качестве средства лечения такого заболевания или по меньшей мере в качестве средства предупреждения рецидива диареи или колита, ассоциированных с инфекцией С. difficile. (Corthier, et al. (1991), Infect. Immun. 59(3):1192-1195; Kink, J.A. and Willilams, J.A., (1998), Infect. Immun. 66(5):2018-2025; Lowy, I. et al. (2010), N. Engl. J. Med. 362(3):197-205; Babcock, G.J., et al.; (2006), Infection and Immunity, 74(11):6339-6347). Более конкретно, животные модели вызванной С. difficile инфекции применяли для исследования влияния антител к токсину А и/или токсину В С. difficile на первичную инфекции, а также на частоту обострения in vivo (Corthier, G. et al. (1991), Infect. Immun. 59(3):1192-1195; Kink, J.A. et al. (1998), Infect. Immun. 66(5):2018-2025; Babcock, G.J. et al. (2006), 74(11):6339-6347). Полученные результаты в животных моделях С. difficile показали значительный уровень защиты, таким образом побудив к дальнейшим клиническим испытаниям с применением антител к токсину А и к токсину В на больных заболеванием людях (Lowy, I., (2010), N. Engl. J. Med. 362(3):197-205).
У описанных в настоящем документе антител наблюдают специфичное связывание с токсином А и/или с токсином В С. difficile, и они могут быть пригодны для лечения пациентов, страдающих от вызванной С. difficile инфекции. Применение таких антител может представлять собой эффективное средство лечения пациентов, страдающих от первичной инфекции, вызванной С. difficile, или их можно применять для предупреждения обострения заболевания и сопутствующих симптомов, ассоциированных с заболеванием, или их можно применять для уменьшения тяжести диареи или колита, ассоциированных с первичной инфекцией или с рецидивом инфекции. Их можно применять отдельно или в качестве вспомогательной терапии с другими терапевтическими веществами или средствами, известными из уровня техники, для лечения инфекций С. difficile, такими как без ограничения антибиотикотерапия, например, при помощи метронидазола, ванкомицина или фидаксомицина. Их можно применять в сочетании с вакциной от С. difficile, или с применением анатоксина, или со вторым или третьим отличным антителом, специфичным к токсину А и/или В.
В соответствии с определенными вариантами осуществления по настоящему изобретению комбинации антител по настоящему изобретению можно применять для лечения инфекции, обусловленной гипервирулентным штаммом С. difficile. Наиболее заметной группой гипервирулентных эпидемиологических изолятов на сегодняшний день является группа по названием "BI/NAP1/027". Ее ассоциируют со вспышками инфекций С. difficile по всей Европе и Северной Америке. Изоляты, которые подпадают под это определение, характеризуются повышенной продукцией токсина А и токсина В, наличием дополнительного токсина (бинарного токсина) и повышенной устойчивостью к фторхинолонам (McDonald, LC, et al., (2005), N Engl J Med 353:2433-41; Warny, ME, et al., (2005), Lancet 366:1079-84). Эту группу изолятов также можно называть как штаммы North American pulsed-field type 1 (NAP1), риботипа 027, группы BI. Эта группа штаммов содержит делецию в 18 пар оснований гена tcdC, и бинарный токсин, который она продуцирует, кодируется генами cdtA и cdtB. Согласно сообщениям эта группа продуцирует токсин А и токсин B в количествах, которые в 16 и 23 раза, соответственно, превышают количества у контрольных штаммов (Warny, ME, et al., (2005), Lancet 366:1079-84). Поскольку было показано, что антитела по настоящему изобретению нейтрализуют токсин, продуцируемый четырьмя различными клинически выделенными штаммами BI/NAP 1/027 С. difficile (VA5, VA17, 6336 и 6443), предусмотрено, что композиции, содержащие антитела по настоящему изобретению, можно вводить в терапевтических целях пациентам, страдающим от инфекции, вызванной указанными выше гипервирулентными штаммами С. difficile, или можно вводить в профилактических целях пациентам, которые подвержены риску развития инфекции, вызванной указанными в настоящем документе гипервирулентными штаммами, а также любыми другими клинически релевантными гипервирулентными штаммами. Средства, посредством которых определяют эти штаммы, известны специалистам в настоящей области техники, и такие способы могут включать гель-электрофорез в пульсирующем поле (PFGE) изолятов С. difficile (см., например, Fawley, WN, et al., (2002), J. Clin Microbiol 40:3546-7), ПЦР-анализы генов бинарных токсинов и частичных делеций гена tcdC (см., например, Goncalves, С. et al. (2004), J Clin Microbiol 42:1933-9; и Cohen, SH et al., (2000), J Infect Dis 181:659-63) и анализы с применением рестрикционной эндонуклеазы (см., например, Clabots, CR, et al., (1993), J Clin Microbiol 31:1870-5).
В соответствии с некоторыми вариантами осуществления антитела по настоящему изобретению получают от мышей, иммунизированных первичным иммуногеном, таким как нативный, инактивированный токсин А (см. номер доступа в GenBank CAA63564 (SEQ ID NO: 378)) или токсин В (см. номер доступа в GenBank CAJ67492 (SEQ ID NO: 380)) С. difficile, или рекомбинантной, но инактивированной формой токсинов, или фрагментов токсинов, с последующей иммунизацией вторичным иммуногеном или иммуногенно активным фрагментом нативного токсина. Животных можно иммунизировать либо только инактивированным токсином А, либо только инактивированным токсином В, либо одновременно как инактивированным токсином А, так и инактивированным токсином В. Токсины можно инактивировать либо до применения в качестве иммуногена с применением стандартных процедур получения анатоксинов, в том числе путем обработки формальдегидом, глутаральдегидом, пероксидом или обработкой кислородом (Relyveld, et al. Methods in Enzymology, 93:24, 1983, Woodrow and Levine, eds. New Generation Vaccines, Marcel Dekker, Inc., New York, 1990). Другие средства инактивации заключаются в применении UDP-диальдегида (Genth et al., (2000), Infect. Immun. 68(3):1094-1101), который может содействовать сохранению нативной структуры токсина, по сравнению с другими способами инактивации, с повышением, таким образом, вероятности начала продуцирования антител, которые более реактивны по отношению к нативному токсину.
Альтернативно, мутантные токсины от С. difficile, у которых наблюдали сниженную токсичность, можно получить с помощью стандартных рекомбинантных методик и применять в качестве иммуногенов (см., например, US 5085862, 5221618, 5244657, 5332583, 5358868 и 5433945). Такие мутанты могут содержать делеции или точечные мутации в активном сайте токсина.
Иммуноген может быть биологически активным и/или иммуногенным фрагментом нативного токсина А или токсина В или ДНК, кодирующей его активный фрагмент. Фрагмент может быть получен из N-концевого или C-концевого домена либо токсина А, либо токсина В. Фрагмент может быть получен из любого из известных доменов токсина А или токсина В (см. фигуру 1), включая гликозилирующий ферментный домен (А), домен аутокаталитического процессинга (С), транслокационный домен (D) или связывающий домен (В). В соответствии с определенными вариантами осуществления по настоящему изобретению иммуногеном является карбоксиконцевой связывающийся с рецептором домен токсина А, который соответствует аминокислотным остаткам от приблизительно 1832 до 2710 из SEQ ID NO: 378. В соответствии с определенными вариантами осуществления по настоящему изобретению иммуногеном является карбоксиконцевой связывающийся с рецептором домен токсина А, который показан в SEQ ID NO: 375. В соответствии с определенными вариантами осуществления по настоящему изобретению иммуногеном является карбоксиконцевой связывающийся с рецептором домен токсина В, который соответствует аминокислотным остаткам от приблизительно 1834 до 2366 из SEQ ID NO: 380. В соответствии с определенными вариантами осуществления по настоящему изобретению иммуногеном является карбоксиконцевой связывающийся с рецептором домен токсина В, который показан в SEQ ID NO: 376.
Аминокислотная последовательность полной длины токсина А из С. difficile показана как SEQ ID NO: 378.
Аминокислотная последовательность полной длины токсина В из С. difficile показана как SEQ ID NO: 380.
В соответствии с определенными вариантами осуществления антитела, которые специфично связываются с токсином А или токсином В С. difficile можно получить с помощью фрагментов вышеупомянутых участков или пептидов, которые выходят за пределы обозначенных участков на от приблизительно 5 до приблизительно 20 аминокислотных остатков за любой из N или С концов описанных в настоящем документе участков или за оба конца. В соответствии с определенными вариантами осуществления при получении специфичных к токсину А или токсину В антител можно применять любую комбинацию вышеупомянутых участков или их фрагментов. В соответствии с определенными вариантами осуществления для получения моноспецифичных, биспецифичных или мультиспецифичных антител можно применять любой один или несколько из вышеупомянутых участков токсина А или токсина В или их фрагментов.
Антиген-связывающие фрагменты антител
Если специально не указано иное, применяемый в настоящем документе термин "антитело" необходимо понимать как охватывающий молекулы антител, содержащих две иммуноглобулиновые тяжелые цепи и две иммуноглобулиновые легкие цепи (т.е. "целые молекулы антител"), а также их антиген-связывающие фрагменты. Применяемые в настоящем документе термины "антиген-связывающая часть" антитела, "антиген-связывающий фрагмент" антитела и т.п. включают любой встречающийся в природе, получаемый ферментативно, синтетический или генетически сконструированный полипептид или гликопротеин, который специфично связывается с антигеном с формированием комплекса. Применяемые в настоящем документе термины "антиген-связывающая часть" антитела или "фрагмент антитела" относятся к одному или нескольким фрагментам антитела, которые сохраняют способность специфично связываться либо с токсином А и/или токсином В C. difficile. Фрагмент антитела может включать фрагмент Fab, фрагмент F(ab')2, фрагмент Fv, фрагмент dAb, фрагмент, содержащий CDR, или выделенный CDR. Антиген-связывающие фрагменты антитела могут быть получены, например, от целых молекул антител с применением любых подходящих стандартных методик, таких как протеолитическое расщепление или рекомбинантные методики генетической инженерии, предусматривающие манипуляцию и экспрессию ДНК, кодирующей вариабельные и (необязательно) константные домены антитела. Такая ДНК известна и/или легко доступна из, например, коммерческих источников, библиотек ДНК (включая, например, библиотеки фаг-антитело), или ее можно синтезировать. ДНК можно секвенировать и с ней можно проводить манипуляции химическими способами или при помощи методик молекулярной биологии, например, для организации одного или нескольких вариабельных и/или константных доменов в подходящую конфигурацию или введения кодонов, создания цистеиновых остатков, модификации, добавления или удаления аминокислот и т.д.
Неограничивающие примеры антиген-связывающих фрагментов включают: (i) фрагменты Fab; (ii) фрагменты F(ab')2; (iii) фрагменты Fd; (iv) фрагменты Fv; (v) одноцепочечные молекулы Fv (scFv); (vi) фрагменты dAb и (vii) минимальные единицы распознания, состоящие из аминокислотных остатков, которые имитируют гипервариабельный участок антитела (например, выделенный определяющий комплементарность участок (CDR), такой как пептид CDR3), или ограниченный пептид FR3-CDR3-FR4. Также применяемым в настоящем документе выражением "антиген-связывающий фрагмент" охвачены другие сконструированные молекулы, такие как домен-специфичные антитела, антитело с одним доменом, антитела с удаленным доменом, химерные антитела, антитела с пришитым CDR, диатела, триотела, тетратела, миниантитела, нанотела (например, моновалентные нанотела, бивалентные нанотела и т.д.), иммунопрепараты на основе модульного белка с малым размером молекул (SMIP) и вариабельные домены IgNAR акулы.
Антиген-связывающий фрагмент антитела, как правило, будет содержать по меньшей мере один вариабельный домен. Вариабельный домен может иметь любой размер или аминокислотный состав и, как правило, будет содержать по меньшей мере один CDR, который является смежным с одной или несколькими каркасными последовательностями или находится в их пределах. В антиген-связывающих фрагментах, имеющих домен VH, связанный с доменом VL, VH и VL, домены могут быть расположены относительно друг друга в любом подходящем порядке. Например, вариабельный участок может быть димерным и содержать димеры VH-VH, VH-VL или VL-VL. Альтернативно, антиген-связывающий фрагмент антитела может содержать мономерный домен VH или VL.
В соответствии с определенными вариантами осуществления антиген-связывающий фрагмент антитела может содержать по меньшей мере один вариабельный домен, ковалентно связанный по меньшей мере с одним константным доменом. Неограничивающие иллюстративные конфигурации вариабельных или константных доменов, которые можно обнаружить в антиген-связывающем фрагменте антитела по настоящему изобретению, включают: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; и (xiv) VL-CL. В любой конфигурации вариабельных и константных доменов, включая любые из перечисленных выше иллюстративных конфигураций, вариабельные и константные домены могут быть либо непосредственно соединены друг с другом, либо могут быть соединены при помощи полного или частичного шарнирного или линкерного участка. Шарнирный участок может состоять по меньшей мере из 2 (например, 5, 10, 15, 20, 40, 60 или более) аминокислот, что в результате дает гибкую или полугибкую связи между смежными вариабельными и/или константными доменами в отдельной полипептидной молекуле. Кроме того, антиген-связывающий фрагмент антитела по настоящему изобретению может содержать гомодимер или гетеродимер (или другой мультимер) в любой из перечисленных выше конфигураций вариабельных и константных доменов в нековалентной связи друг с другом и/или с одним или несколькими мономерными доменами VH или VL (например, посредством дисульфидной связи(связей)).
Как и в случае с целыми молекулами антител, антиген-связывающие фрагменты могут быть моноспецифическими или мультиспецифическими (например, биспецифическими). Мультиспецифический антиген-связывающий фрагмент антитела, как правило, будет содержат по меньшей мере два различных вариабельных домена, причем каждый вариабельный домен способен специфично связываться с отдельным антигеном или с различным эпитопом на одном антигене. Любой мультиспецифический формат антитела, включая раскрываемые в настоящем документе иллюстративные биспецифические форматы антител, можно адаптировать для применения в контексте антиген-связывающего фрагмента антитела по настоящему изобретению с помощью доступных в настоящей области техники стандартных методик.
Получение человеческих антител
Способы создания человеческих антител в трансгенных мышах известны из уровня техники. Для создания человеческих антител, которые специфично связываются с токсином А и/или токсином В С. difficile, в контексте настоящего изобретения можно применять любые такие известные способы.
Благодаря технологии VELOCIMMUNE® (см., например, патентный документ US 6596541, Regeneran Pharmaceuticals, VELOCIMMUNE®) или любого другого известного способа создания моноклональных антител, химерные антитела с высокой аффинностью к токсину А и/или токсину В С. difficile являются изначально выделенными с человеческим вариабельным участком и мышиным константным участком. Технология VELOCIMMUNE® предусматривает создание трансгенной мыши, имеющей геном, содержащий локусы человеческих вариабельных участков тяжелых и легких цепей, функционально связанные с эндогенными локусами мышиных константных участков так, чтобы мышь в ответ на стимуляцию антигеном продуцировала антитело, содержащее человеческий вариабельный участок и мышиный константный участок. ДНК, кодирующую вариабельные участки тяжелых и легких цепей антитела, выделяют и функционально связывают с ДНК, кодирующей человеческие константные участки тяжелых и легких цепей. Затем ДНК экспрессируют в клетке, способной экспрессировать полностью человеческое антитело.
Как правило, мышь VELOCIMMUNE® провоцируют представляющим интерес антигеном, а лимфатические клетки (такие как В-клетки) выделяют из мышей, которые экспрессируют антитела. Лимфатические клетки можно слить с линией миеломных клеток с получением бессмертных линий гибридомных клеток, и такие линии гибридомных клеток подвергают скринингу и отбирают для выявления линий гибридомных клеток, которые продуцируют антитела, специфичные к представляющему интерес антигену. ДНК, кодирующая вариабельные участки тяжелой цепи и легкой цепи, можно выделить и присоединить к необходимыми изотипическими константным участкам тяжелой цепи и легкой цепи. Такой белок антитела может продуцироваться в такой клетке, как клетка СНО. Альтернативно, ДНК, кодирующую антиген-специфические химерные антитела или вариабельные домены легких или тяжелых цепей, можно выделить непосредственно из антиген-специфических лимфоцитов.
Изначально химерные антитела с высокой аффинностью являются выделенными с человеческим вариабельным участком и мышиным константным участком. Так же, как и в приведенной ниже экспериментальной части, у антител определяют характеристики и их отбирают по необходимым характеристикам, включая аффинность, избирательность, эпитоп и т.д. Мышиные константные участки замещают необходимыми человеческими константными участками для создания полностью человеческого антитела по настоящему изобретению, например, дикого типа или модифицированного IgG1 или IgG4. Несмотря на то, что выбранный константный участок может варьировать в соответствии с конкретным применением, характеристики связывания антигена с высокой аффинностью и специфичности к мишени присущи вариабельному участку.
В целом, антитела по настоящему изобретению обладают очень высокоаффинными характеристиками, как правило, обладая KD, составляющей от приблизительно 10-12 до приблизительно 10-9 М, при измерении посредством связывания с антигеном, либо иммобилизированным на твердой фазе, либо в жидкой фазе. Мышиные константные участки замещают необходимыми человеческими константными участками для создания полностью человеческих антител по настоящему изобретению. Несмотря на то, что выбранный константный участок может варьировать в соответствии с конкретным применением, характеристики связывания антигена с высокой аффинностью и специфичности к мишени присущи вариабельному участку.
Биоэквиваленты
Антитела к токсину А и к токсину В и фрагменты антител по настоящему изобретению охватывают белки с аминокислотными последовательностями, которые отличаются от последовательностей описанных антител, но которые сохраняют способность связывать токсин А или токсин В. Такие вариантные антитела и фрагменты антител содержат одну или несколько присоединений, делеций или замен аминокислот по сравнению с исходной последовательностью, но характеризуются биологической активностью, которая фактически эквивалентна биологической активности описанных антител. Аналогичным образом, кодирующие антитела последовательности ДНК по настоящему изобретению охватывают последовательности, которые содержат одну или несколько присоединений, делеций или замен нуклеотидов по сравнению с раскрываемой последовательностью, но которые кодируют антитело или фрагмент антитела, которые фактически биоэквивалентны антителу или фрагменту антитела по настоящему изобретению.
Два антиген-связывающих белка, или антитела, считают биоэквивалентом, если, например, они являются фармацевтическими эквивалентами или фармацевтическими альтернативами, в скорости и степени абсорбции которых не наблюдают значительного различия при введении в одинаковой молярной дозе при сходных экспериментальных условиях, либо в однократной дозе, либо в многократной дозе. Некоторые антитела будут считать эквивалентами или фармацевтическими альтернативами, если они являются эквивалентными по степени их абсорбции, но не по скорости их абсорбции, и их все еще можно считать биоэквивалентными, так как такие различия в скорости абсорбции являются преднамеренными и учтены при введении меток, не являются существенным для достижения эффективных концентраций лекарственного средства в организме, например, при затяжном приеме, и их считают незначительными в медицинском плане для конкретной исследуемой готовой лекарственной формы.
Согласно одному варианту осуществления два антиген-связывающих белка являются биоэквивалентными, если они не имеют клинически существенных отличий по их безопасности, чистоте и активности.
Согласно одному варианту осуществления два антиген-связывающих белка являются биоэквивалентами, если пациент может менять один или несколько раз эталонный продукт и биологический продукт без предположительного повышения риска отрицательных эффектов, включая клинически значимое изменение иммуногенности или сниженную эффективность по сравнению с продолжительной терапией без такой замены.
Согласно одному варианту осуществления два антиген-связывающих белка являются биоэквивалентными, если они оба действуют по общему механизму или механизмам действия по отношению к состоянию или условиям применения, при условии, что такие механизмы известны.
Биоэквивалентность можно продемонстрировать посредством способов in vivo и/или in vitro. Измерения биоэквивалентности включают, например, (а) тестирование in vivo на людях или других животных, при котором концентрацию антитела или его метаболитов измеряют в крови, плазме крови, сыворотке крови или другой биологической жидкости в зависимости от времени; (b) тестирование in vitro, для которого установлена корреляция и оно является достаточно прогнозируемым по отношению к данным биологической доступности in vivo у человека; (с) тестирование in vivo на людях или других животных, при котором соответствующий быстрый фармакологический эффект антитела (или его мишени) измеряют в зависимости от времени; и (d) строго контролируемое клиническое испытание, при котором устанавливают безопасность, эффективность, или биологическую доступность, или биоэквивалентность антитела.
Биоэквивалентные варианты антител по настоящему изобретению можно сконструировать, например, посредством создания различных замен остатков или последовательностей или удаления концевых или внутренних остатков или последовательностей, которые не являются необходимыми для биологической активности. Например, цистеиновые остатки, несущественные для биологической активности, можно удалить или заменить на другие аминокислоты для предупреждения формирования нежелательных или неправильных внутримолекулярных дисульфидных мостиков при ренатурации. Согласно другому контексту, биоэквивалентные антитела могут включать варианты антител, содержащие аминокислотные изменения, которые модифицируют характеристики гликозилирования у антител, например, мутации, которые исключают или удаляют участки гликозилирования.
Биологические характеристики антител
Как правило, антитела по настоящему изобретению могут функционировать, связываясь либо с токсином А, либо с токсином В С. difficile, либо как с токсином А, так и с токсином В С. difficile (антитела с перекрестной реактивностью), либо с фрагментом либо А, либо В.
В соответствии с определенными вариантами осуществления антитела по настоящему изобретению могут связываться с эпитопом, расположенным по меньшей мере в C-концевом связывающемся с рецептором домене токсина А и/или токсина В С. difficile. Согласно одному варианту осуществления антитела могут связываться с C-концевым участком токсина А, располагающимся от аминокислотного основания 1832 до 2710 карбоксиконцевого связывающегося с рецептором домена токсина А, который охватывает аминокислотные остатки 1832-2710 из SEQ ID NO: 378. В соответствии с определенными вариантами осуществления по настоящему изобретению антитела могут связывать карбоксиконцевой связывающийся с рецептором домен токсина А, который показан в SEQ ID NO: 375. В соответствии с некоторыми вариантами осуществления по настоящему изобретению антитела могут взаимодействовать или связываться с, аминокислотными остатками 468-863 карбоксиконцевого связывающегося с рецептором домена продуцируемого Clostridium difficile токсина А, последовательность которого показана в SEQ ID NO: 375. В соответствии с некоторыми вариантами осуществления по настоящему изобретению антитела могут взаимодействовать или связываться с эпитопом на карбоксиконцевом связывающемся с рецептором домене, продуцируемого Clostridium difficile токсина А, причем эпитоп выбран из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375. Согласно одному варианту осуществления антитело, которое связывается или взаимодействует с эпитопом в карбоксиконцевом связывающемся с рецептором домене продуцируемого Clostridium difficile токсина А, выбранным из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375, содержит пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 146/154. Согласно одному варианту осуществления антитело, которое связывается или взаимодействует с эпитопом в карбоксиконцевом связывающемся с рецептором домене продуцируемого Clostridium difficile токсина А, выбранным из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375, комбинировано со вторым антителом, которое специфично связывается с токсином В Clostridium difficile, в фармацевтической композиции. Согласно одному варианту осуществления второе антитело, которое взаимодействует или связывается с токсином В Clostridium difficile, содержит пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 274/282.
В соответствии с определенными вариантами осуществления по настоящему изобретению антитела могут связываться с карбоксиконцевым связывающимся с рецептором доменом токсина В, который соответствует аминокислотным остаткам 1834-2366 из SEQ ID NO: 380. В соответствии с определенными вариантами осуществления по настоящему изобретению антитела могут связываться с карбоксиконцевым связывающимся с рецептором доменом токсина В, который показан в SEQ ID NO: 376.
В соответствии с определенными вариантами осуществления антитела по настоящему изобретению могут функционировать посредством блокировки или ингибирования токсичности, ассоциированной с токсином А С. difficile, связываясь с любым другим участком или фрагментом нативного белка полной длины токсина А, аминокислотная последовательность которого показана в SEQ ID NO: 378, которая кодируется последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 377.
В соответствии с определенными вариантами осуществления антитела по настоящему изобретению могут функционировать посредством блокировки или ингибирования токсичности, ассоциированной с токсином В С. difficile, связываясь с любым другим участком или фрагментом нативного белка полной длины токсина А, аминокислотная последовательность которого показана в SEQ ID NO: 380, которая кодируется последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 379.
В соответствии с определенными вариантами осуществления антитела по настоящему изобретению могут представлять собой биспецифические антитела. Биспецифические антитела по настоящему изобретению могут связывать один эпитоп в токсине А, а также могут связывать один эпитоп в токсине В. В соответствии с определенными вариантами осуществления биспецифические антитела по настоящему изобретению могут связывать два различных эпитопа в токсине А. В соответствии с определенными вариантами осуществления биспецифические антитела по настоящему изобретению могут связывать два различных эпитопа в токсине В. В соответствии с определенными вариантами осуществления биспецифические антитела по настоящему изобретению могут связываться с двумя различными сайтами в одном домене либо на одном из токсина А или токсина В, либо могут связываться с одним доменом как на токсине А, так и на токсине В.
Согласно одному варианту осуществления настоящее изобретение относится к полностью человеческому моноклональному антителу или его антиген-связывающему фрагменту, которые связываются с карбоксиконцевым связывающимся с рецептором доменом как токсина А, так и токсина В С. difficile, причем у антитела или его фрагмента наблюдают одну или несколько из следующих характеристик: (i) содержит HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 18, 34, 50, 66 и 82, или по существу сходную с ней последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (ii) содержит LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, 42, 58, 74 и 90, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iii) содержит домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 24, 40, 56, 72 и 88, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности и домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 32, 48, 64, 80 и 96, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iv) содержит домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, 36, 52, 68 и 84, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 22, 38, 54, 70 и 86, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28, 44, 60, 76 и 92, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 30, 46, 62, 78 и 94, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (v) связывается с токсином А и с токсином В с KD, равной или меньше 10-9 М.
Согласно одному варианту осуществления настоящее изобретение относится к полностью человеческому моноклональному антителу или его антиген-связывающий фрагменту, которые специфично связываются с токсином А (но не с токсином В) С. difficile, причем у антитела или его фрагмента наблюдают одну или несколько из следующих характеристик: (i) содержит HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 98, 114, 130, 146 и 162, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (ii) содержит LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 106, 122, 138, 154 и 170, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iii) содержит домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 8, 104, 120, 136, 152 и 168, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, 112, 128, 144, 160 и 176, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iv) содержит домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 4, 100, 116, 132, 148 и 164, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 6, 102, 118, 134, 150 и 166, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 12, 108, 124, 140, 156 и 172, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 14, 110, 126, 142, 158 и 174, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (v) демонстрирует KD, равную или мене 10-9 М; (vi) демонстрирует нейтрализацию токсина А (при концентрации 32 пМ) с IC50, варьирующей в диапазоне от приблизительно 7 пМ до приблизительно 65 пМ в анализе жизнеспособности клеток.
Согласно одному варианту осуществления настоящее изобретение относится к полностью человеческому моноклональному антителу или его антиген-связывающий фрагменту, которые специфично связываются с токсином В (но не с токсином А) С. difficile, причем у антитела или его фрагмента наблюдают одну или несколько из следующих характеристик: (i) содержит HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (ii) содержит LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iii) содержит домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID N0:184, 200, 216, 232, 248, 264, 280, 296, 312, 328, 344 и 360, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 192, 208, 224, 240, 256, 272, 288, 304, 320, 336, 352 и 368, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iv) содержит домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 180, 196, 212, 228, 244, 260, 276, 292, 308, 324, 340 и 356, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 182, 198, 214, 230, 246, 262, 278, 294, 310, 326, 342 и 358, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 188, 204, 220, 236, 252, 268, 284, 300, 316, 332, 348 и 364, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 190, 206, 222, 238, 254, 270, 286, 302, 318, 334, 350 и 366, или по существу сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (v) демонстрирует KD, равную или меньше 10-9 М; (vi) демонстрирует нейтрализацию токсина В (при концентрации 0,03 пМ) с IC50, варьирующей от приблизительно 25 пМ до приблизительно 320 пМ в анализе жизнеспособности клеток.
Определенные антитела к токсину А или к токсину В по настоящему изобретению способны связываться и нейтрализовать токсичность либо токсина А, либо токсина В, либо обоих С. difficile, по результатам определения посредством анализов in vitro или in vivo. Описанную в настоящем документе способность антител по настоящему изобретению связываться и нейтрализовать активность токсинов можно измерить при помощи любого стандартного способа, известного специалистам в настоящей области техники, включая анализы связывания или анализы нейтрализации токсичности (защита клеток от гибели).
Неограничивающими иллюстративными примерми анализов измерения in vitro связывающей активности являются анализы, проиллюстрированные в примерах 4, 5 и 6 из настоящего описания. В примерах 4 и 5 связывающие аффинности и константы скорости реакции человеческих антител к токсину А или к токсину В определяли с помощью поверхностного плазмонного резонанса, и измерения осуществляли на приборе Т200 Biacore. В примере 6 исследования связывания осуществляли при помощи эксклюзионной хроматографии. В примере 7 биоанализ нейтрализации разрабатывали на клетках Веро для определения жизнеспособности клеток после обработки токсином А или В и антителами либо к токсину А, либо к токсину В.
Настоящее изобретение также относится к антителам к токсинам А и В и их антиген-связывающим фрагментам, которые связываются по меньшей мере с одним биологически активным фрагментом любого из следующих белков или пептидов: SEQ ID NO: 378 (токсин А полной длины), остатки с номерами 1832-2710 из SEQ ID NO: 378 (C-концевой домен токсина A); SEQ ID NO: 380 (токсин В полной длины), остатки 1834-2366 из SEQ ID NO: 380; SEQ ID NO: 375 (карбоксиконцевой связывающийся с рецептором домен токсина А) или SEQ ID NO: 376. Настоящее изобретение также относится к антителам, которые взаимодействуют или связываются с эпитопом на карбоксиконцевом связывающемся с рецептором домене продуцируемого Clostridium difficile токсина А, или их антиген-связывающему фрагменту, причем эпитоп содержится в остатках, расположенных от приблизительно остатка 468 до приблизительно 863 из SEQ ID NO: 375. Согласно одному варианту осуществления, эпитоп для антитела, которое связывается с токсином А, выбран из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375. Любой из описанных в настоящем документе пептидов токсина А или токсина В или их фрагментов можно применять для создания антител к токсину А или токсину В.
Пептиды можно модифицировать с включением присоединений или замен определенных остатков для введения метки или с целью конъюгации с молекулами-носителями, такими как, KLH. Например, цистеин можно добавить либо в N-, либо в С-конец пептида, или можно добавить линкерную последовательность с получением пептида для конъюгации, например, с KLH для иммунизации. Антитела, специфичные к токсину А или токсину В, могут не содержать дополнительные метки или фрагменты, или они могут содержать N-концевую или C-концевую метку или фрагмент. Согласно одному варианту осуществления меткой или фрагментом является биотин. При анализе связывания по расположению метки (при наличии) можно определить ориентацию пептида относительно поверхности, с которой связан пептид. Например, если поверхность покрыта авидином, то содержащий N-концевой биотин пептид будет ориентирован так, что C-концевое положение будет удаленным по отношению к поверхности.
Картирование эпитопов и родственные методики
Для определения того, "взаимодействует ли с одной или несколькими аминокислотами" антитело в полипептиде или белке можно применять различные методики, известные рядовым специалистам в настоящей области. Иллюстративные методики включают, например, стандартный эпитоп перекрестный конкурентный анализ, который можно осуществить, как описано в Antibodies, Harlow and Lane (Cold Spring Harbor Press, Cold Spring Harb., NY). Другие способы включают анализ при помощи сканирующего аланином мутагенеза, пептидный блот-анализ (Reineke (2004) Methods Mol Biol 248:443-63), анализ расщепления пептидов, кристаллографические исследования и NMR-анализ. Кроме того, можно использовать такие способы, как вырезание эпитопов, экстракция эпитопов и химическая модификация антигенов (Tomer (2000) Protein Science 9: 487-496). Другим способом, который можно применять для определения аминокислот в полипептиде, с которым взаимодействует антитело, является водородно/дейтериевый обмен определяемый посредством масс-спектрометрии. В общих чертах, способ водород/дейтериевого обмена предусматривает мечение дейтерием представляющего интерес белка с последующим связыванием антитела с помеченным дейтерием белком. Затем, комплекс белок/антитело переносят в вводу и способные к обмену протоны в аминокислотах, которые защищены комплексом с антителом, подвергаются обратному обмену дейтерия-на-водород с более медленной скоростью, чем способные к обмену протоны в аминокислотах, которые не являются частью границы раздела. В результате, аминокислоты, которые формируют часть границы раздела белок/антитело, могут удерживать дейтерий и, таким образом, характеризуются относительно более высокой массой по сравнению с аминокислотами, не включенными в границу раздела. После диссоциации антитела белок-мишень подвергают протеазному расщеплению и масс-спектрометрическому анализу, таким образом выявляя меченные дейтерием остатки, которые соответствуют конкретным аминокислотам, с которыми взаимодействует антитело. См., например, Ehring (1999) Analytical Biochemistry 267(2):252-259; Engen and Smith (2001) Anal. Chem. 75:256A-265A.
Термин "эпитоп" относится к сайту на антигене, на который реагируют В- и/или Т-клетки. B-клеточные эпитопы могут быть сформированы как из заменимых аминокислот, так и из незаменимых аминокислот, приведенных в соприкосновение в результате образования третичной структуры белка. Эпитопы, сформированные из заменимых аминокислот, обычно остаются под воздействием денатурирующих растворителей, при этом эпитопы, сформированные в результате образования третичной структуры, обычно теряются при обработке денатурирующими растворителями. Эпитоп, как правило, включает по меньшей мере 3 или, более характерно, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
Анализ антител на основе модификаций (MAP), также известное как анализ антител на основе структуры антигена (ASAP), является способом, с помощью которого классифицируют большое число моноклональных антител (mAb) к одному антигену в соответствии со схожестью профиля связывания для каждого антитела с поверхностями химически или ферментативно модифицированных антигенов (US 2004/0101920). Каждая категория может отражать уникальный эпитоп, либо явно отличающийся от эпитопа, представленного в другой категории, либо практически совпадающий с ним. Такая методика позволяет быстро отфильтровывать генетически идентичные антитела так, чтобы характеристику можно было сфокусировать на генетически отличных антителах. Применительно к скринингу гибридом MAP может облегчить определение редких гибридомных клонов, которые продуцируют mAb с необходимыми характеристиками. MAP можно применять для разделения антител по настоящему изобретению на группы антител, связывающих различные эпитопы.
В соответствии с определенными вариантами осуществления антитело к токсину А или к токсину В или его антиген-связывающие фрагменты связываются с эпитопом в любом одном из участков, проиллюстрированных на фигуре 1 или в SEQ ID NO: 378 или 380, или по меньшей мере одном из карбоксиконцевых связывающихся с рецептором доменов токсина А или токсина В, или с их фрагментом, причем карбоксиконцевой связывающийся с рецептором домен токсина А показан в SEQ ID NO: 375, а карбоксиконцевый связывающийся с рецептором домен токсина В показан как SEQ ID NO: 376.
Настоящее изобретение относится к антителам к токсину А или к токсину В, которые связываются с тем же эпитопом, что и любое из конкретных иллюстративных антител, описанных в настоящем документе в таблице 1. Аналогичным образом, настоящее изобретение также относится к антителам к токсину А или к токсину В, которые конкурируют за связывания с токсином А или токсином В или фрагментом токсина А или В с любым из конкретных иллюстративных антител, описанных в настоящем документе в таблице 1.
Можно легко определить, связывается ли антитело с тем же эпитопом или конкурирует за связывание с эталонным антителом к токсину А или к токсину В антитело с помощью стандартных известных из уровня техники способов. Например, для определения того, связывается ли тестовое антитело с тем же эпитопом, что эталонное антитело к токсину А или к токсину В по настоящему изобретению, эталонному антителу позволяют связаться с белком или пептидом токсина А или B в насыщающих условиях. Затем оценивают способность тестового антитела связываться с молекулой токсина А или В. Если тестовое антитело способно связываются с токсином А или В после насыщающего связывания с эталонным антителом к токсину А или к токсину В, то можно прийти к заключению, что тестовое антитело связывается с отличным эпитопом, чем эталонное антитело к токсину А или к токсину В. С другой стороны, если тестовое антитело не способно связываться с молекулой токсина А или В после насыщающего связывания с эталонным антителом к токсину А или к токсину В, то тестовое антитело может связываться с тем же эпитопом, что и эпитоп, связываемый посредством эталонного антитела к токсину А или к токсину В по настоящему изобретению.
Для определения того, конкурирует ли антитело за связывание с эталонным антителом к токсину А или к токсину В, осуществляют описанные выше методики связывания в двух адаптациях: согласно первой адаптации эталонному антителу позволяют связаться с молекулой токсина А или B в насыщающих условиях с последующей оценкой связывания тестового антитела с молекулой токсина А или В; согласно второй адаптации тестовому антителу позволяют связаться с молекулой токсина А или B в насыщающих условиях с последующей оценкой связывания эталонного антитела с молекулой токсина А или В. Если в случае обоих адаптаций только первое (насыщающее) антитело способно связываться с молекулой токсина А или В, то можно прийти к заключению, что тестовое антитело и эталонное антитело конкурируют за связывание с токсином А или В. Рядовому специалисту в настоящей области техники будет понятно, что антитело, которое конкурирует за связывание с эталонным антителом, не обязательно может связываться с идентичным эпитопом, что и эталонное антитело, а может стерически блокировать связывание эталонного антитела посредством связывания совпадающего или смежного эпитопа.
Два антитела связываются с одинаковым или перекрывающимся эпитопом, если каждое конкурентно ингибирует (блокирует) связывание другого с антигеном. А именно, 1-, 5-, 10-, 20- или 100-кратный избыток одного антитела ингибирует связывание другого по меньшей мере на 50%, но предпочтительно на 75%, 90% или даже 99%, согласно результатам измерения в анализе конкурентного связывания (см., например, Junghans et al., Cancer Res. 1990 50:1495-1502). Альтернативно, два антитела характеризуются одинаковыми эпитопами, если фактически все аминокислотные мутации в антигене, которые уменьшают или исключают связывание одного антитела, уменьшают или исключают связывание другого. Два антитела характеризуются перекрывающимися эпитопами, если несколько аминокислотных мутаций, которые уменьшают или исключают связывание одного антитела, уменьшают или исключают связывание другого.
Затем, можно осуществить дополнительный стандартный эксперимент (например, анализы на мутации пептида и связывание) для подтверждения того, является ли наблюдаемое отсутствие связывания тестового антитела фактическим следствием связывания с тем же эпитопом, что и эталонное антитело, или является ли стерическое блокирование (или другое явление) ответственным за отсутствие наблюдаемого связывания. Эксперименты такого рода можно осуществить при помощи ELISA, RIA, поверхностного плазмонного резонанса, потоковой цитометрии или любого другого количественного или качественного анализа связывания антитела, который доступен в настоящей области техники.
Иммуноконъюгаты
Настоящее изобретение относится к человеческому моноклональному антителу к токсину А или к токсину В, конъюгированному с терапевтическим фрагментом ("иммуноконъюгат"), таким как средство, которое может уменьшить тяжесть первичной инфекции, вызванной С. difficile, или облегчить по меньшей мере один симптом, ассоциированный с инфекцией С. difficile, включая диарею или колит, или их тяжесть. Таким средством может быть второе отличное антитело либо к токсину А, либо к токсину В, либо к обоим С. difficile, или анатоксин, или вакцина против С. difficile. Тип терапевтического фрагмента, который может быть конъюгирован с антителом к токсину А или к токсину В, будет принимать в учет подлежащее лечению состояние и подлежащий достижению необходимый терапевтический эффект. Альтернативно, если необходимый терапевтический эффект предназначен для лечения последствия или симптомов, ассоциированных с инфекцией С. difficile или любым другим состоянием, полученным в результате такой инфекции, таким как без ограничения псевдомембранозный колит, то может быть предпочтительно конъюгирование средства, подходящего для лечения последствия или симптомов состояния или для ослабления любых побочных эффектов антител по настоящему изобретению. Примеры подходящих средств для формирования иммуноконъюгатов известны в настоящей области техники, см., например, WO 05/103081.
Мультиспецифические антитела
Антитела по настоящему изобретению могут быть моноспецифическими, биспецифическими или мультиспецифическими. Мультиспецифические антитела могут быть специфичными к различным эпитопам одного целевого полипептида или могут содержать антиген-связывающие домены, специфичные к более чем одному целевому полипептиду. См., например, Tutt et al, 1991, J. Immunol. 147:60-69; Kufer et al, 2004, Trends Biotechnol. 22:238-244. Антитела по настоящему изобретению могут быть связаны или совместно экспрессироваться с другой функциональной молекулой, например, другим пептидом или белком. Например, антитело или его фрагмент могут быть функционально связаны (например, посредством образования химической связи, генетическим слиянием, нековалентным связыванием или иначе) с одной или несколькими другими молекулярными структурами, такими как другое антитело или фрагмент антитела, с получением биспецифического или мультиспецифического антитела со второй специфичностью связывания. Например, настоящее изобретение относится к биспецифическим антителам, причем одно плечо иммуноглобулина является специфичным к токсину А С. difficile, или его фрагменту, а другое плечо иммуноглобулина является специфичным к токсину В С. difficile или второй терапевтической мишени, или конъюгировано с терапевтическим фрагментом. В соответствии с определенными вариантами осуществления по настоящему изобретению одно плечо иммуноглобулина является специфичным к эпитопу на C-концевом домене токсина А или его фрагменте, а другое плечо иммуноглобулина является специфичным к эпитопу на C-концевом домене токсина В или его фрагменте.
Иллюстративный формат биспецифического антитела, который можно применять в контексте настоящего изобретения, включает применение первого домена CH3 иммуноглобулина (Ig) и второго домена CH3 Ig, причем первый и второй домены СН3 Ig отличаются друг от друга по меньшей мере по одной аминокислоте, и причем по меньшей мере одно аминокислотное отличие уменьшает связывание биспецифического антитела с белком А по сравнению с биспецифическим антителом без аминокислотного отличия. Согласно одному варианту осуществления первый домен CH3 Ig связывается с белком А, а второй домен CH3 Ig содержит мутацию, которая уменьшает или делает невозможным связывание белка А, такую как модификация H95R (согласно нумерации экзонов IMGT; H435R согласно нумерации EU). Второй CH3 может дополнительно содержать модификацию Y96F (согласно IMGT; Y436F согласно EU). Дополнительные модификации, которые можно обнаружить во втором CH3, включают: D16E, L18M, N44S, K52N, V57M и V82I (согласно IMGT; D356E, L358M, N384S, K392N, V397M и V422I согласно EU) в случае антител IgG1; N44S, K52N и V82I (IMGT; N384S, K392N и V422I согласно EU) в случае антител IgG2; и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (согласно IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I согласно EU) в случае антител IgG4. Описанные выше варианты формата биспецифических антител предусмотрены объемом настоящего изобретения.
Терапевтическое введение и лекарственные формы
Настоящее изобретение относится к терапевтическим композициям, содержащим антитела к токсину А или к токсину В или к их антиген-связывающим фрагментам по настоящему изобретению. Введение терапевтических композиций в соответствии с настоящим изобретением будут производить с подходящими носителями, наполнителями и другими средствами, которые включены в лекарственные формы для обеспечения улучшенного переноса, доставки, стойкости и т.п. Большое количество соответствующих лекарственных форм можно найти в известном всем фармакологам фармакологическом справочнике: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Такие составы включают, например, порошки, пасты, мази, желе, воски, масла, липиды, жидкость (катионную или анионную), содержащую везикулы (такие как LIPOFECTIN™), ДНК-конъюгаты, безводные абсорбционные пасты, эмульсии по типу масло-в-воде и вода-в-масле, эмульсии карбовакса (полиэтиленгликоли с различными молекулярными массами), полужидкие гели и полужидкие смеси, содержащие карбовакс. См. также Powell et al. "Compendium of excipients for parenteral formulations" PDA (1998) J Pharm Sci Technol 52:238-311.
Доза каждого антитела по настоящему изобретению может варьировать в зависимости от возраста и размера субъекта, которому будут ее вводить, целевого заболевания, условий, пути введения и т.п. При применении антител по настоящему изобретению для лечения у пациента с инфекцией С. difficile, или для лечения у пациента одного или нескольких симптомов, ассоциированных с инфекцией С. difficile, таких как диарея или колит, ассоциированные с инфекцией С. difficile, или для предупреждения обострения заболевания, или для снижения тяжести заболевания, предпочтительно введение каждого из антител по настоящему изобретению внутривенно или подкожно в норме за однократную дозу, составляющую от приблизительно 0,01 до приблизительно 30 мг/кг массы тела, более предпочтительно от приблизительно 0,1 до приблизительно 20 мг/кг массы тела, или от приблизительно 0,1 до приблизительно 15 мг/кг массы тела, или от приблизительно 0,02 до приблизительно 7 мг/кг массы тела, или от приблизительно 0,03 до приблизительно 5 мг/кг массы тела, или от приблизительно 0,05 до приблизительно 3 мг/кг массы тела, или приблизительно 1 мг/кг массы тела, или приблизительно 3,0 мг/кг массы тела, или приблизительно 10 мг/кг массы тела, или приблизительно 20 мг/кг массы тела. В случае необходимости можно вводить многократные дозы. В зависимости от тяжести состояния частоту введения и длительность лечения можно откорректировать. В соответствии с определенными вариантами осуществления антитела или их антиген-связывающие фрагменты по настоящему изобретению можно вводить в качестве изначальной дозы, составляющей по меньшей мере от приблизительно 0,1 мг до приблизительно 800 мг, от приблизительно 1 до приблизительно 600 мг, от приблизительно 5 до приблизительно 300 мг, или от приблизительно 10 до приблизительно 150 мг, до приблизительно 100 мг или до приблизительно 50 мг. В соответствии с определенными вариантами осуществления после изначальной дозы может следовать введение второй или нескольких последующих доз антител или их антиген-связывающих фрагментов в количестве, которое может быть примерно таким же или меньше, чем в изначальной дозе, причем последующие дозы разделены по меньшей мере 1-3 днями, по меньшей мере одной неделей, по меньшей мере 2 неделями, по меньшей мере 3 неделями, по меньшей мере 4 неделями, по меньшей мере 5 неделями, по меньшей мере 6 неделями, по меньшей мере 7 неделями, по меньшей мере 8 неделями, по меньшей мере 9 неделями, по меньшей мере 10 неделями, по меньшей мере 12 неделями или по меньшей мере 14 неделями.
Известны различные системы доставки, и их можно применять для введения фармацевтической композиции по настоящему изобретению, например, инкапсуляция в липосомах, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать мутантные вирусы, опосредованный рецепторами эндоцитоз (см., например, Wu et al. (1987) J. Biol. Chem. 262:4429-4432). Способы введения включают без ограничения внутрикожный, чрезкожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный пути. Композицию можно вводить любым подходящим путем, например, при помощи инфузии или инъекции ударной дозы вещества, посредством всасывания через эпителиальные или слизистые оболочки (например, слизистую оболочку полости рта, слизистую оболочку прямой кишки или тонкого кишечника и т.д.) и можно вводить вместе с другими биологически активными средствами. Введение может быть системным или локальным.
Фармацевтическую композицию также можно доставлять в везикуле, в частности, липосоме (см., например, Langer (1990) Science 249:1527-1533).
В определенных ситуациях фармацевтическую композицию можно доставлять в системе с контролируемым высвобождением. Согласно одному варианту осуществления можно применять помпу. Согласно другому варианту осуществления можно применять полимерные материалы. В соответствии с еще одним вариантом осуществления систему с контролируемым высвобождением можно поместить вблизи мишени композиции, для чего, таким образом, необходима лишь доля системной дозы.
Инъекционные формы могут включать готовые лекарственные формы для внутривенных, подкожных, интракутанных и внутримышечных инъекций, капельных внутривенных вливаний и т.д. Такие инъекционные формы можно получить посредством общеизвестных способов. Например, инъекционные формы можно получить, например, растворением, суспендированием или эмульгированием описанных выше антитела или его соли в стерильной водной среде или масляной среде, обычно применяемых для инъекций. Водной средой для инъекций являются, например, физиологический раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные средства и т.д., которые можно применять в комбинации с соответствующим солюбилизирующим средством, таким как спирт (например, этанол), многоатомный спирт (например, пропиленгликоль, полиэтиленгликоль), неионное поверхностно-активное вещество [например, полисорбат 80, НСО-50 (аддукт полиоксиэтилена (50 моль) и гидрогенизованного касторового масла)] и т.д. Масляными средами являются, например, сезамовое масло, соевое масло и т.д., которые можно применять в комбинации с солюбилизирующим средством, таким как бензилбензоат, бензиловый спирт и т.п. Полученный таким образом инъекционный препарат предпочтительно заполняют в подходящую ампулу.
Фармацевтическую композицию по настоящему изобретению можно доставлять подкожно или внутривенно при помощи стандартной иглы и шпица. Кроме того, что касается подкожной доставки, то при доставке фармацевтической композиции по настоящему изобретению с легкостью можно применять устройство для доставки по типу шприц-ручка. Такое устройство для доставки по типу шприц-ручка может быть многоразовым или одноразовым. В многоразовом устройстве для доставки по типу шприц-ручка обычно используют сменный картридж, который содержит фармацевтическую композицию. После того как вся фармацевтическая композиция из картриджа была введена и картридж опустел, пустой картридж можно легко выбросить и поместить новый картридж, который содержит фармацевтическую композицию. Устройство для доставки по типу шприц-ручка затем можно повторно использовать. В случае одноразового устройства для доставки сменный картридж отсутствует. Вернее, одноразовое устройство для доставки по типу шприц-ручка заполнено фармацевтической композицией, удерживаемой в резервуаре устройства. После удаления из резервуара фармацевтической композиции пустое устройство выбрасывают.
Для подкожной доставки фармацевтической композиции по настоящему изобретению применяют разнообразные многоразовые шприц-ручки и автоинжекторные устройства для доставки. Примеры включают без ограничения AUTOPEN™ (Owen Mumford, Inc., Вудсток, Великобритания), шприц-ручка DISETRONIC™ (Disetronic Medical Systems, Бургдорф, Швейцария), шприц-ручка HUMALOG MIX 75/25™, шприц-ручка HUMALOG™, шприц-ручка HUMALIN 70/30™ (Eli Lilly and Co., Индианаполис, Индиана), NOVOPEN™ I, II и III (Novo Nordisk, Копенгаген, Дания), NOVOPEN JUNIOR™ (Novo Nordisk, Копенгаген, Дания), шприц-ручка BD™ (Becton Dickinson, Франклин-Лейке, Нью-Джерси), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ и OPTICLIK™ (sanofi-aventis, Франкфурт, Германия), не говоря уже о других. Примеры одноразовых устройств для доставки по типу шприц-ручка, применяемых для подкожной доставки фармацевтической композиции по настоящему изобретению, включают без ограничения шприц-ручку SOLOSTAR™ (sanofi-aventis), FLEXPEN™ (Novo Nordisk) и KWIKPEN™ (Eli Lilly), SURECLICK™ Autoinjector (Amgen, Таузенд-Оукс, Калифорния), PENLET™ (Haselmeier, Штутгарт, Германия), EPIPEN (Dey, L.P.) и шприц-ручку HUMIRA™ (Abbott Labs, Abbott Park, Иллинойс), не говоря уже о других.
Предпочтительно, описанные выше фармацевтические композиции для перорального или парентерального применения получают в готовых лекарственных формах в стандартной дозе, подобранной в соответствии с дозой активных ингредиентов. Такие готовые лекарственные формы в стандартной дозе включают, например, таблетки, пилюли, капсулы, инъекции (ампулы), суппозитории и т.п. Количество вышеизложенного включенного антитела обычно составляет от приблизительно 5 до приблизительно 500 мг на готовую лекарственную форму в стандартной дозе; особенно в форме инъекции, предпочтительно, чтобы вышеизложенное антитело содержалось в количестве от приблизительно 5 до приблизительно 100 мг и от приблизительно 10 до приблизительно 250 мг для каждой готовой лекарственной формы.
Схемы введения
В соответствии с определенными вариантами осуществления по настоящему изобретению многократные дозы антитела к токсину А и/или В Clostridium difficile можно вводить субъекту через определенный период времени. Способы в соответствии с аспектом по настоящему изобретению предусматривают последовательное введение субъекту многократных доз антитела к токсину А и/или В. Применяемый в настоящем документе термин "последовательное введение" означает, что каждую дозу антитела к токсину А и/или В вводят субъекту в различный момент времени, например, в различные дни, разделенные предварительно заданным интервалом (например, часами, днями, неделями или месяцами). Настоящее изобретение относится к способам, которые предусматривают последовательное введение пациенту однократной изначальной дозы антитела к токсину А и/или В с последующим введением одной или нескольких вторичных доз антитела к токсину А и/или В и необязательно с последующим введением одной или нескольких третичных доз антитела к токсину А и/или В.
Термины "изначальная доза," "вторичные дозы" и "третичные дозы" относятся к временной последовательности введения антитела к токсину А и/или В. Таким образом, "изначальной дозой" является доза, которую вводят в начале схемы лечения (также называемая как "исходная доза"), "вторичные дозы" являются дозами, которые вводят после изначальной дозы, и "третичные дозы" являются дозами, которые вводят после вторичных доз. Все из изначальной, вторичных и третичных доз могут содержать одинаковое количество антитела к токсину А и/или В, но в целом могут отличаться друг от друга касательно частоты введения. Тем не менее, в соответствии с определенными вариантами осуществления количество антитела к токсину А и/или В, содержащееся в изначальной, вторичной и/или третичной дозах отличается одно от другого (например, повышено или понижено, по необходимости) в течение курса лечения. В соответствии с определенными вариантами осуществления две или более (например, 2, 3, 4 или 5) дозы вводят в начале схемы лечения в качестве "ударных доз", за которыми следуют последующие дозы, которые вводят не так часто (например, "поддерживающие дозы").
Согласно одному иллюстративному варианту осуществления по настоящему изобретению каждую вторичную и/или третичную дозу вводят через 1-26 (например, 1, 11/2, 2, 21/2, 3, 31/2, 4, 41/2, 5, 51/2, 6, 61/2, 7, 71/2, 8, 81/2, 9, 91/2, 10, 101/2, 11, 111/2, 12, 121/2, 13, 131/2, 14, 141/2, 15, 151/2, 16, 161/2, 17, 171/2, 18, 181/2, 19, 191/2, 20, 201/2, 21, 211/2, 22, 221/2, 23, 231/2, 24, 241/2, 25, 251/2, 26, 261/2 или более) недель после непосредственно предшествующей дозы. Применяемая в настоящем документе фраза "непосредственно предшествующая доза" означает в последовательности многократных введений дозу антитела к токсину А и/или В, которую вводят пациенту перед введением непосредственно следующей дозы в последовательности при отсутствии промежуточных доз.
Способы в соответствии с этим аспектом по настоящему изобретению могут предусматривать введение пациенту любого числа вторичных или третичных доз антитела к токсину А и/или В. Например, в соответствии с определенными вариантами осуществления пациенту вводят только одну вторичную дозу. Согласно другим вариантам осуществления пациенту вводят две или более (например, 2, 3, 4, 5, 6, 7, 8 или более) вторичных доз. Аналогичным образом, в соответствии с определенными вариантами осуществления пациенту вводят только одну третичную дозу. Согласно другим вариантам осуществления пациенту вводят две или более (например, 2, 3, 4, 5, 6, 7, 8 или более) третичных доз.
Согласно вариантам осуществления, предусматривающим множественные вторичные дозы, каждую вторичную дозу можно вводить с такой же частотой, как и другие вторичные дозы. Например, каждую вторичную дозу можно вводить пациенту спустя 1-2 недели после непосредственно предшествующей дозы. Аналогичным образом, согласно вариантам осуществления, предусматривающим множественные третичные дозы, каждую третичную дозу можно вводить с такой же частотой, как и другие третичные дозы. Например, каждую третичную дозу можно вводить пациенту спустя 2-4 недели после непосредственно предшествующей дозы. Альтернативно, частота, с которой вводят пациенту вторичные и/или третичные дозы, может изменяться в ходе схемы лечения. Частота введения также может корректироваться в течение курса лечения лечащим врачом, в зависимости от индивидуальных потребностей пациента после клинического обследования.
Терапевтические применения антител
Благодаря их взаимодействию с токсином А и/или токсином В С. difficile антитела по настоящему изобретению пригодны для лечения первичного заболевания или состояния, вызванного С. difficile, или по меньшей мере одного симптома, ассоциированного с заболеванием или состоянием, такого как диарея или колит, или для предупреждения обострения заболевания, или для уменьшения тяжести, продолжительности и/или частоты рецидивов заболевания. Антитела по настоящему изобретению можно рассматривать для профилактического применения среди пациентов, подверженных риску развития или приобретения инфекции С. difficile. Такие пациенты включают пожилых (например, кого угодно в возрасте 65 лет или старше), или пациентов, которые имеют иммунную недостаточность в связи с болезнью или в связи с лечением иммуносупрессивными терапевтическими средствами, или пациентов, которые могут иметь определенное первопричинное медицинское состояние, которое может вызывать у них предрасположенность к возникновению инфекции С. difficile (например, пациентов со злокачественной опухолью, воспалительным заболеванием кишечника, пациентов перед трансплантацией печени с кумулятивным асцитом), или пациентов, которые госпитализированы на протяжении длительных периодов времени (например, в некоторых случаях этот период времени может варьировать всего лишь в пределах двух или трех дней, но в целом может составлять от одной недели до двух недель или дольше), делая их предрасположенными к приобретению нозокомиальных инфекций, или пациентов, которых лечат на протяжении длительного срока (≥14 дней) антибиотиками широкого спектра действия (в некоторых случаях больные могут приобрести инфекцию в течение 24 часов, если имеет место расстройство кишечника, но в других случаях это может занять намного больше времени, например, одну неделю или дольше), или пациентов, подвергаемых лечению ингибиторами протонного насоса для лечения расстройств желудочно-кишечного тракта. Полагают, что антитела по настоящему изобретению можно применять отдельно или в сочетании со вторым средством или третьим средством для лечения инфекции С. difficile или для облегчения по меньшей мере одного симптома или осложнения, ассоциированного с инфекцией С. difficile, такого как диарея или колит, ассоциированные с такой инфекцией или полученные в результате такой инфекции. Второе и третье средства можно доставлять одновременно с антителами по настоящему изобретению, или их можно вводить отдельно, либо до, либо после антител по настоящему изобретению.
Согласно еще одному варианту осуществление по настоящему изобретению настоящие антитела применяют для получения фармацевтической композиции для лечения пациентов, страдающих от инфекции С. difficile, включая такие инфекции, которые обусловлены клинически релевантным гипервирулентным штаммом Clostridium difficile, или диареи и колита, ассоциированных с инфекцией С. difficile. Согласно еще одному варианту осуществления по настоящему изобретению настоящие антитела применяют для получения фармацевтической композиции для уменьшения тяжести первичной инфекции, вызванной С. difficile, или для уменьшения тяжести, продолжительности и/или числа рецидивов от С. difficile. Согласно следующему варианту осуществления по настоящему изобретению настоящие антитела применяют в качестве средства вспомогательной терапии с любым другим средством, пригодным для лечения инфекций С. difficile, включая пробиотики, антибиотики, анатоксины, вакцины или любое другое паллиативное средство терапии, известное специалистам в настоящей области техники.
Комбинированная терапия
Способы по настоящему изобретению в соответствии с определенными вариантами осуществления предусматривают введение субъекту одного или нескольких дополнительных терапевтических средств в комбинации с антителом к токсину А и/или токсину B Clostridium difficile. Применяемое в настоящем документе выражение "в комбинации с" означает, что дополнительные терапевтические средства вводят до, после или одновременно с фармацевтической композицией, содержащей антитела к токсину А и/или В. Термин "в комбинации с" также включает последовательное или сопутствующее введение антител к токсину А и/или В и второго терапевтического средства.
Например, при введении "до" фармацевтической композиции, содержащей антитела к токсину А и/или В, дополнительное терапевтическое средство можно вводить приблизительно за 72 часа, приблизительно за 60 часов, приблизительно за 48 часов, приблизительно за 36 часов, приблизительно за 24 часа, приблизительно за 12 часов, приблизительно за 10 часов, приблизительно за 8 часов, приблизительно за 6 часов, приблизительно за 4 часа, приблизительно за 2 часа, приблизительно за 1 час, приблизительно за 30 минут, приблизительно за 15 минут или приблизительно за 10 минут до введения фармацевтической композиции, содержащей антитела к токсину А и/или В. При введении "после" фармацевтической композиции, содержащей антитела к токсину А и/или В, дополнительное терапевтическое средство можно вводить приблизительно через 10 минут, приблизительно через 15 минут, приблизительно через 30 минут, приблизительно через 1 час, приблизительно через 2 часа, приблизительно через 4 часа, приблизительно через 6 часов, приблизительно через 8 часов, приблизительно через 10 часов, приблизительно через 12 часов, приблизительно через 24 часа, приблизительно через 36 часов, приблизительно через 48 часов, приблизительно через 60 часов или приблизительно через 72 часа после введения фармацевтической композиции, содержащей антитела к токсину А и/или В. Введение "одновременное" или с фармацевтической композицией, содержащей антитела к токсину А и/или В, означает, что дополнительное терапевтическое средство вводят субъекту в виде отдельной готовой лекарственной формы в пределах менее 5 минут (до, после или в одно и то же время) от введения фармацевтической композиции, содержащей антитела к токсину А и/или В, или вводят субъекту в качестве однократной комбинированной дозированной лекарственной формы, содержащей как дополнительное терапевтическое средство, так и антитела к токсину А и/или В.
Средства комбинированной терапии могут включать антитело к токсину А или к токсину В по настоящему изобретению и любое дополнительное терапевтическое средство, которое можно успешно комбинировать с антителом по настоящему изобретению или с биологически активным фрагментом антитела по настоящему изобретению.
Например, второе или третье терапевтическое средство можно использовать для того, чтобы способствовать уменьшению бактериальной обсемененности в кишечнике, такое как антибиотик, который является бактериостатическим или бактерицидным по отношению к С. difficile. Иллюстративные антибиотики включают ванкомицин, метронидазол или фидаксомицин. Антитела также можно применять в сочетании с другими разновидностями терапии, такими как анатоксины, вакцины, специфичные к С. difficile, или пробиотические средства, такие как Saccharomyces boulardii.
Диагностические применения антител
Антитела к токсину А или к токсину В по настоящему изобретению также можно применять для обнаружения и/или измерения токсина А или В в образце, например, в диагностических целях. Предусмотрено, что подтверждение инфекции, которая, как полагают, обусловлена С. difficile, можно осуществить посредством измерения наличия либо токсина А, либо токсина В посредством применения любого одного или нескольких из антител по настоящему изобретению. Иллюстративные диагностические анализы на токсин А или токсин В могут предусматривать, например, приведение в контакт образца, полученного от пациента, с антителом к токсину А или к токсину В по настоящему изобретению, причем антитело к токсину А или к токсину В помечено поддающейся обнаружению меткой или репортерной группой, или его применяют в качестве захватывающего лиганда для избирательного выделения белка токсина А или токсина В из образцов пациента. Альтернативно, непомеченное антитело к токсину А или к токсину В можно применять для диагностических целей в комбинации со вторичным антителом, которое само по себе помечено для возможности обнаружения. Поддающаяся обнаружению метка или репортерная группа могут представлять собой радиоизотоп, такой как 3Н, 14С, 32Р, 35S или 125I; флуоресцентный или хемилюминесцентный фрагмент, такой как флуоресцеинизотиоцианат или родамин, или фермент, такой как щелочная фосфатаза, β-галактозидаза, пероксидаза хрена или люцифераза. Конкретные иллюстративные анализы, которые можно применять для обнаружения или измерения токсина А или токсина В в образце, включают твердофазный иммуноферментный анализ (ELISA), радиоиммунный анализ (RIA) и сортировку флуоресцентно-активированных клеток (FACS).
Образцы, которые можно применять в диагностических анализах на С. difficile, в соответствии с настоящим изобретением включают любой образец ткани или жидкости, получаемый от пациента, который содержит поддающиеся обнаружению количества белка либо токсина А или токсина В С. difficile, либо их фрагментов в нормальных или патологических условиях. Обычно уровни токсина А или токсина В в конкретном образце, полученном от здорового пациента (например, пациента, не пораженного заболеванием или состоянием, ассоциированным с наличием С. difficile), будут измерять, изначально устанавливая исходный или стандартный уровень токсина А или токсина В С. difficile. Такой базовый уровень токсина А или токсина В затем можно сравнить с уровнями токсина А или токсина В, измеренными в образцах, полученных от людей, у которых подозревают наличие связанного с С. difficile заболевания или состояния или симптомов, ассоциированных с таким заболеванием или состоянием.
Примеры
Следующие примеры приведены с целью предоставления специалистам в настоящей области техники полного раскрытия и описания того, как осуществлять и применять способы и композиции по настоящему изобретению, и не предназначены для ограничения рассматриваемого авторами объема настоящего изобретения. Были осуществлены попытки в обеспечении точности в отношении использованных цифр (например, количеств, температуры т.д.), но следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, части являются частями по массе, молекулярная масса является средней молекулярной массой, температура приведена в градусах Цельсия, а давление соответствует или близко к атмосферному.
Пример 1. Создание человеческих антител к токсину А и/или токсину В Clostridium difficile
Для создания антител к токсину А и/или токсину В С.difficile можно использовать иммуноген, содержащий одно из приведенного далее. В соответствии с определенными вариантами осуществления антитела по настоящему изобретению получали от мышей, иммунизированных первичным иммуногеном, таким как нативный, инактивированный токсин А (см. под номером доступа в GenBank САА63564 (SEQ ID NO: 378)) и/или токсин В полной длины (см. под номером доступа в GenBank CAJ67492 (SEQ ID NO: 380)) из С. difficile или рекомбинантной, но инактивированной формой токсинов, или фрагментов токсинов, или анатоксина, с последующей иммунизацией вторичным иммуногеном или иммуногенно активным фрагментом нативного токсина. Животных можно было иммунизировать либо только инактивированным токсином А, либо только инактивированным токсином В, либо одновременно как инактивированным токсином А, так и инактивированным токсином В. Токсины можно инактивировать до применения в качестве иммуногена с применением стандартных процедур получения анатоксинов, в том числе путем обработки формальдегидом, глутаральдегидом, пероксидом или обработкой кислородом (Relyveld, et al. Methods in Enzymology, 93:24, 1983, Woodrow and Levine, eds. New Generation Vaccines, Marcel Dekker, Inc., New York, 1990). Другие средства инактивации заключаются в применении UDP-диальдегида (Genth et al., (2000), Infect. Immun. 68(3):1094-1101), который может содействовать сохранению нативной структуры токсина, по сравнению с другими способами инактивации, с повышением, таким образом, вероятности начала продуцирования антител, которые более реактивны по отношению к нативному токсину. Альтернативно, мутантные токсины от С. difficile, у которых наблюдали сниженную токсичность, можно получить с помощью стандартных рекомбинантных методик и применять в качестве иммуногенов (см., например, US 5085862, 5221618, 5244657, 5332583, 5358868 и 5433945). Такие мутанты могут содержать делеции или точечные мутации в активном сайте токсина.
В соответствии с определенными вариантами осуществления антитела согласно настоящему изобретению получали от мышей, иммунизированных первичным иммуногеном, таким как биологически активный и/или иммуногенный фрагмент нативного токсина А или токсина В или ДНК, кодирующей его активных фрагмент. В соответствии с определенными вариантами осуществления иммуногеном может быть пептид от N-конца или С-конца токсина А и/или токсина В, или фрагмент, полученный от N- или С-концевого пептида токсина А и/или токсина В. В соответствии с определенными вариантами осуществления по настоящему изобретению иммуноген представлял собой связывающийся с рецептором карбоксиконцевой домен токсина А, который соответствовал аминокислотным остаткам от приблизительно 1832 до 2710 из SEQ ID NO: 378. В соответствии с определенными вариантами осуществления по настоящему изобретению иммуногеном был карбоксиконцевой связывающийся с рецептором домен токсина А, который показан в SEQ ID NO: 375. В соответствии с определенными вариантами осуществления по настоящему изобретению иммуногеном был карбоксиконцевой связывающийся с рецептором домен токсина В, который соответствовал аминокислотным остаткам от приблизительно 1834 до 2366 из SEQ ID NO: 380. В соответствии с определенными вариантами осуществления по настоящему изобретению иммуногеном был карбоксиконцевой связывающийся с рецептором домен токсина В, который показан в SEQ ID NO: 376.
Соответственно, согласно одному варианту осуществления антитела согласно настоящему изобретению получали от мышей, иммунизированных либо инактивированным токсином А полной длины (анатоксином), либо инактивированным токсином В полной длины (анатоксином), либо обоими анатоксинами. Вместе с тем, согласно одному варианту осуществления антитела получали от мышей, иммунизированных полипептидом, содержавшим аминокислотные последовательности из карбоксиконцевого связывающегося с рецептором доменом токсина А С. difficile, или полипептидом, содержавшим аминокислотные последовательности из карбоксиконцевого связывающегося с рецептором доменом токсина В С. difficile, или обоими одновременно.
В соответствии с определенными вариантами осуществления антитела, которые специфично связываются с токсином А или токсином В С. difficile можно получить с помощью фрагментов вышеупомянутых участков или пептидов, которые выходят за пределы обозначенных участков на от приблизительно 5 до приблизительно 20 аминокислотных остатков за любой из N или С концов описанных в настоящем документе участков или за оба конца. В соответствии с определенными вариантами осуществления при получении специфичных к токсину А или токсину В антител можно применять любую комбинацию вышеупомянутых участков или их фрагментов. В соответствии с определенными вариантами осуществления для получения моноспецифичных, биспецифичных или мультиспецифичньгх антител можно применять любой один или несколько из вышеупомянутых участков токсина А или токсина В или их фрагментов.
Белки полной длины или их карбокси-концевые фрагменты, которые применяли в качестве иммуногенов, как указано выше, вводили непосредственно с адьювантом для стимуляции иммунного ответа мыше VELOCIMMUNE®, содержащей ДНК, кодирующей вариабельные участки тяжелой и легкой каппа-цепи иммуноглобулина человека. Иммунный ответ с продуцированием антител отслеживали с помощью иммунологического анализа на токсин А и/или токсин В С. difficile. При достижении необходимого иммунного ответа собирали спленоциты и сливали их с клетками миеломы мыши для сохранения их жизнеспособности и получения линий гибридомных клеток. Линии гибридомных клеток подвергали скринингу и отбору для выявления линий клеток, которые продуцируют специфичные антитела к токсину А и/или токсину В С. difficile. С помощью данной методики и с применением различных описанных выше иммуногенов получали несколько антител к токсину А и токсину В С. difficile, а также химерные антитела с перекрестной реактивностью (т.е., антитела, обладающие человеческими вариабельными доменами и мышиными константными доменами); некоторые полученные таким образом иллюстративные антитела обозначали как H1H3067N, H1H3134N, H1H3117N, H1M3123N, H1M3121N и H1M3124N.
Также антитела к токсину А и токсину В С. difficile выделяли непосредственно из положительных к антигену В-клеток без слияния с клетками миеломы, как описано в патентном документе U.S. 2007/0280945A1. С помощью такого способа выделяли некоторые полностью человеческие антитела к токсину А и токсину В С. difficile (т.е., антитела, обладающие человеческими вариабельными доменами и человеческими константными доменами); полученные таким образом иллюстративные антитела обозначали следующим образом: Н1Н3328Р, Н1Н3324Р, Н1Н3325Р, Н1Н3330Р, Н1Н3350Р, Н1Н3347Р, Н1Н3335Р, Н1Н3344Р, Н1Н3339Р, Н1Н3337Р, Н1Н3343Р, H1H3411P, Н1Н3354Р, Н1Н3317Р, Н1Н3355Р, Н1Н3394Р и Н1Н3401Р.
Биологические свойства иллюстративных антител, полученных в соответствии со способами настоящего примера, подробно описаны в изложенных ниже примерах.
Пример 2. Аминокислотные последовательности вариабельных участков тяжелых и легких цепей
В таблице 1 изложены пары аминокислотных последовательностей вариабельных участков тяжелых и легких цепей выбранных антител, специфичных к токсину А и/или токсину В из С. difficile и их соответствующие идентификаторы антител. В настоящем документе антитела, как правило, обозначены согласно следующей номенклатуре: приставка Fe (например "Н4Н", "H1M, "Н2М"), с последующим числовым идентификатором (например "3117", как показано в таблице 1), с последующим суффиксом "Р" или "N". Таким образом, согласно настоящей номенклатуре антитело может быть обозначено, например, "Н1Н3117". Приставки Н4Н, H1M и Н2М в используемых в настоящем документе обозначениях антител указывают на конкретный Fe участок антитела. Например, антитело "Н2М" имеет Fe мышиного IgG2, в то время как антитело "Н4Н" имеет Fe человеческого IgG4. Рядовому специалисту в настоящей области будет понятно, что антитело H1M или Н2М можно преобразовать в антитело Н4Н, и наоборот, но в любом случае вариабельные домены (включающие CDR), которые указаны с помощью показанных в таблице 1 числовых идентификаторов, остаются теми же. Антитела с одинаковыми числовыми обозначениями антител, но различающиеся по буквенному суффиксу N, В или Р, относятся к антителам, имеющим тяжелые и легкие цепи с идентичными последовательностями CDR, но с вариациями последовательностей в участках, которые выходят за пределы последовательностей CDR (т.е. находятся в каркасных участках). Таким образом, варианты N, В и Ρ конкретного антитела имеют идентичные последовательности CDR в своих вариабельных участках тяжелых и легких цепей, но отличались друг от друга по своим каркасным участкам.
Антитела сравнения
Контрольные антитела к токсину А и антитела к токсину В включали в приведенные далее примеры с целью сравнения. В примерах также использовали отрицательные контроли, совпадающие по изотипам. Одно контрольное антитело к токсину А обозначено в настоящем документе как контроль I, и оно представляло собой антитело к токсину А с последовательностями вариабельных доменов тяжелых и легких цепей антитела "3D8", которые изложены в патентных документах US7625559 и US2005/0287150. Одно антитело к токсину В обозначено в настоящем документе как контроль II, и оно представляло собой антитело к токсину В с последовательностями вариабельных доменов тяжелых и легких цепей антитела "124-152", которые изложены в патентных документах US7625559 и US2005/0287150. Другое антитело к токсину А обозначено в настоящем документе как контроль III, и оно представляло собой антитело к токсину А с последовательностями вариабельных доменов тяжелых и легких цепей антитела "3358", которые изложены в патентном документе US2009/0087478.
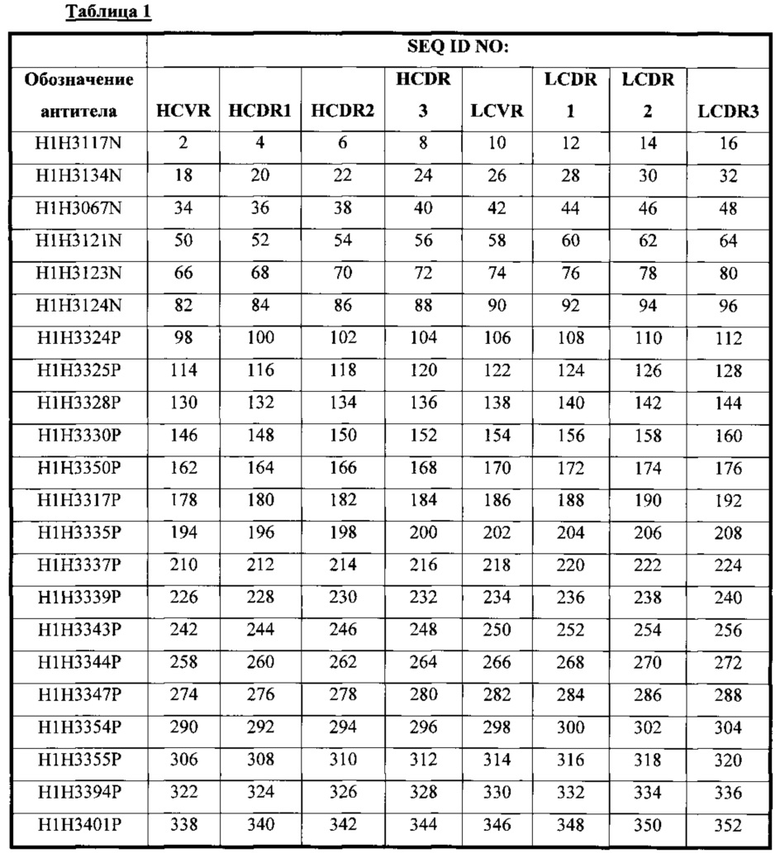

Пример 3. Анализ использования гена вариабельных участков
Для анализа структуры полученных антител клонировали и секвенировали нуклеиновые кислоты, кодирующие вариабельные участки антител. Из последовательности нуклеиновой кислоты и прогнозируемой аминокислотной последовательности антитела выявляли используемость гена для каждого вариабельного участка тяжелой цепи (HCVR) и вариабельного участка легкой цепи (LCVR). В таблице 2 изложена используемость гена для выбранных антител в соответствии с настоящим изобретением.
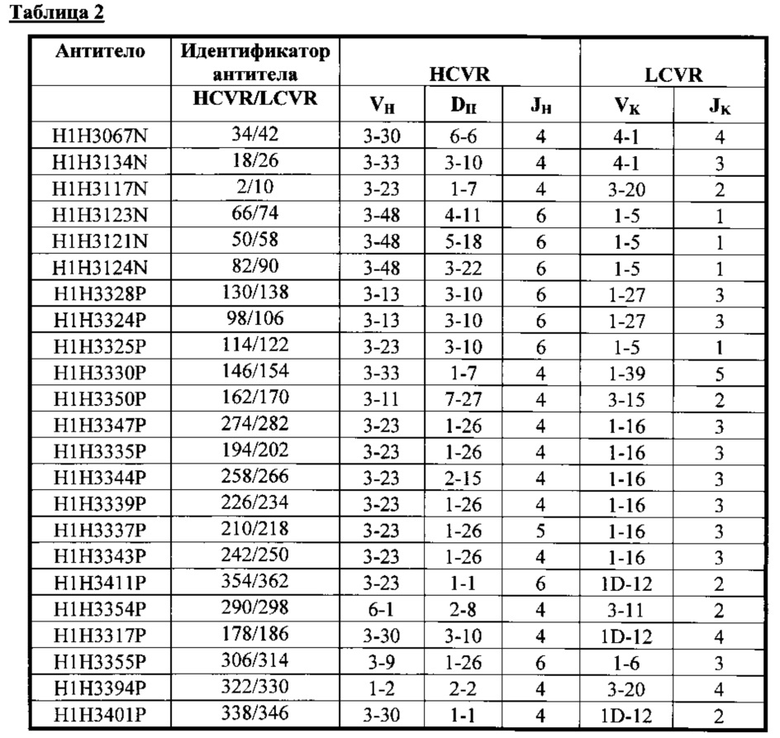
Пример 4. Связывание антитела с токсином А и/или токсином В из С. difficile по результатам определения с помощью поверхностного плазмонного резонанса
Аффинности связывания и константы скорости реакции человеческих моноклональных антител к токсину А и/или токсину В Clostridium difficile определяли с помощью поверхностного плазмонного резонанса при температуре 37°С (таблицы 3-5). Измерения проводили на приборе Т200 Biacore.
Антитела, экспрессируемые как человеческие Fe IgG1 (AbPID приставка H1H) или гибридомные (AbPID приставка НхМ), захватывали на поверхности датчика к человеческим или мышиным Fc, соответственно (формат для захвата Mab). Растворимый токсин А или В полной длины (TechLab), варьирующий от 5 до 10 нМ, вводили по поверхности с захваченным антителом. Ассоциацию антитело-антиген отслеживали в течение 150 секунд, в то время как диссоциацию в буфере отслеживали в течение 480 секунд. Кинетический анализ проводили для расчета KD и периода полудиссоциации комплекса антиген/антитело с помощью программного обеспечения для оценки на Biacore Т200 версии 1.0.
Как видно из таблиц 3-5, выделяли три типа антител: антитела, которые связывались как с токсином А, так и с токсином В ("молекулы с двойным связыванием", см. таблицу 3), антитела, которые связывались только с токсином А (таблица 4), и антитела, которые связывались только с токсином В (таблица 5). Выявляли некоторые антитела, которые связывались как с токсином А, так и с токсином В, в том числе обозначенные H2M3121N, H2M3123N, H2M3124N, H1H3067N и H1H3134N, и таким образом их классифицировали как молекулы с двойным связыванием. Выделенные антитела к токсину А связывались с токсином в субнаномолярном (нМ) диапазоне, аналогично подтипу, соответствующему Mab сравнения (контроль I; см. патент США US7625559 для последовательности сравнения клона 3D8 (Ab к токсину А) и клона 124-152 (Ab к токсину В)), в то время как лишь у нескольких молекул связывания токсина В наблюдали аффинности в диапазоне изотипа контроля II, соответствующего Mab сравнения (клон 124-152) (~200-300 пМ). Равновесные константы диссоциации связывания и периоды полудиссоциации рассчитывали из констант скорости реакции следующим образом: KD=kd/ka; Т1/2 (мин)=(ln2/kd)/60
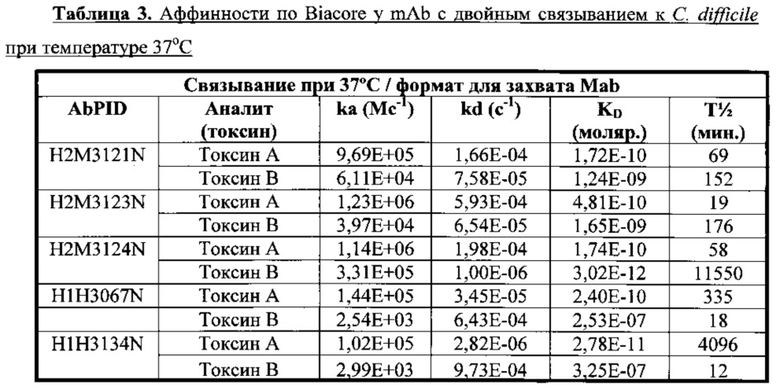
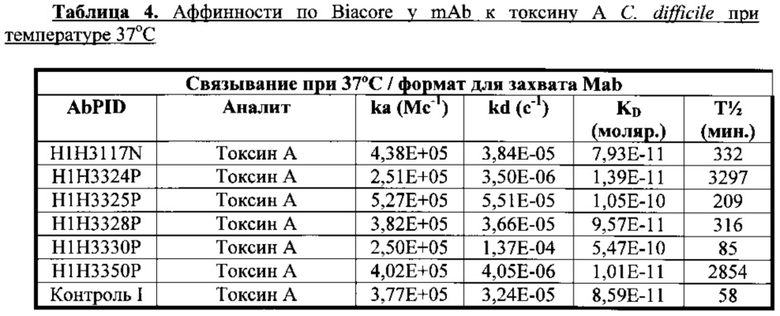
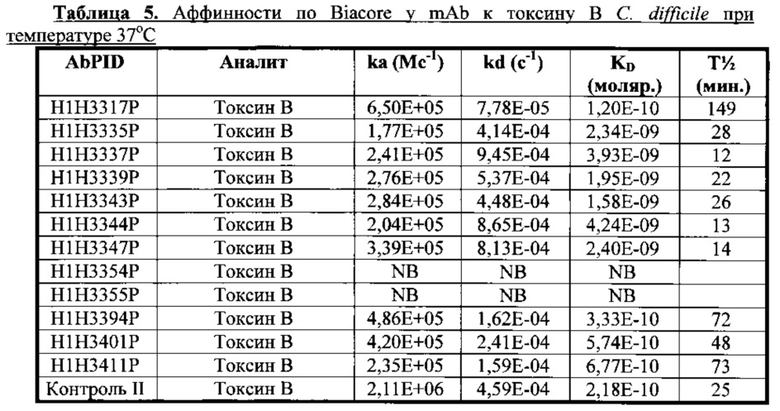
NB = в условиях тестирования связывание отсутствовало
Пример 5. Определение связывающего домена для антител к токсинам А и В Clostridium difficile с применением поверхностного плазменного резонанса
Проводили исследования для определения того, связываются ли антитела к токсину А и/или токсину В Clostridium difficile с С-концевым связывающимся с рецептором доменом (C-term receptor-Binding Domain - CBD) каждого токсина. В этих исследованиях использовали два экспериментальных формата чипа Biacore. В первом случае использовали поверхности с захваченными антителами к С. difficile, на которые заливали 100 нМ Fc CBD токсина A (SEQ ID NO: 375) или Fc CBD токсина В (SEQ ID NO: 376), и регистрировали ответные сигналы (RU). Реагенты токсина на основе CBD приводили в соответствие с форматом как человеческих, так и мышиных Fc для обеспечения возможности проведения анализа антител с подходящими для такого формата как гибридомными, так и человеческими Fc. В случае второго формата использовали поверхности с захваченными антигенами (CBD-Fc), на которые заливали 500 нМ mAb к С. difficile. В случае такого формата антитела с подходящими для такого формата гибридомными или человеческими Fc заливали, соответственно, на захваченные антигены с человеческими и мышиными Fc. У обоих форматов ответный сигнал, который значимо превышал фоновый (>50 RU), рассматривали как связывание с CBD токсина А или В (см. таблицу 6). Как для антител к токсину А, так и для антител к токсину В получали эпитопы, которые находились в и вне CBD. Как контроль I (антитело 3D8 из US7625559 и US 2005/0287150), так и контроль II (антитело 124-152 из US7625559 и US 2005/0287150) картировали по отношению к CBD их соответствующих токсинов согласно раннее приведенной информации (данные не показаны; см. US 2005/0287150 и US7625559).
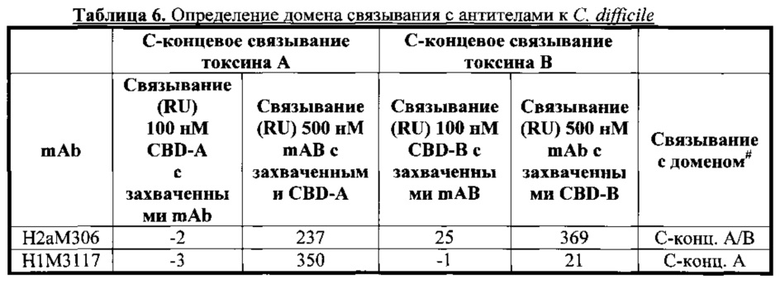
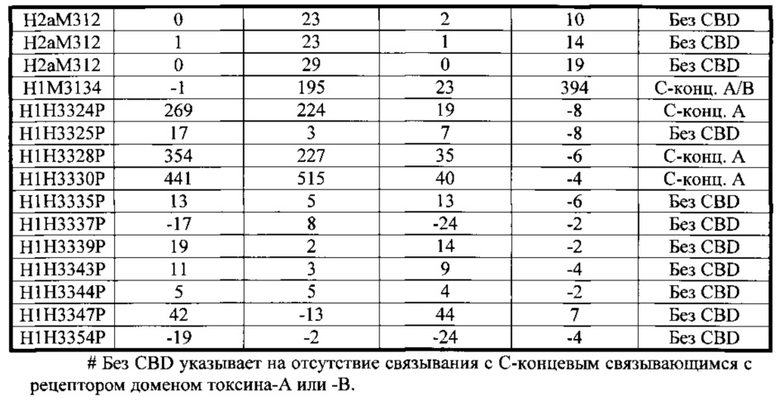
Пример 6. Определение домена связывания с антителами к токсину А и В Clostridium difficile с применением эксклюзионной хроматографии
В качестве дополнительного способа определения того, связываются ли антитела к токсину А и/или В Clostridium difficile с С-концевым связывающимся с рецептором доменом (CBD), использовали эксклюзионную хроматографию (SEC). В нескольких словах, CBD токсина A (SEQ ID NO: 375) или CBD токсина В (SEQ ID NO: 376), в количестве ~500 нМ смешивали с избытком антитела в указанных молярных соотношениях (1:5 и 1:20; CBD:Mab) в фосфатно-солевом буферном растворе, содержавшем 5% глицерин, pH 7,4 (PBS/G), и инкубировали при комнатной температуре в течение 1 часа.
Любое осаждение, которое можно было наблюдать спустя 1 час, регистрировали как +++ (сильное), ++ (умеренное), + (минимально) или - (не наблюдали). После центрифугирования (5 мин. при 16000×g) смесь антитела и CBD подвергали SEC-анализу с применением колонки с суперозой 6 (GE Healthcare) с PBS/G в качестве подвижной фазы. Пики белков, соответствовавшие комплексам, превышавшим отдельное антитело или CBD, интерпретировали как связывание с С-концевым доменом.
Из результатов видно, что связывание с CBD хорошо соответствовало связыванию, спрогнозированному для домена связывания, предполагаемому по результатам исследований с применением SPR (Biacore) и CBD (см. пример 5). Одним заметным исключением было H1H3134N, у которого связывание с CBD-A не наблюдали посредством SEC, но значения KD указывали на свойства двойного связывания у антитела.
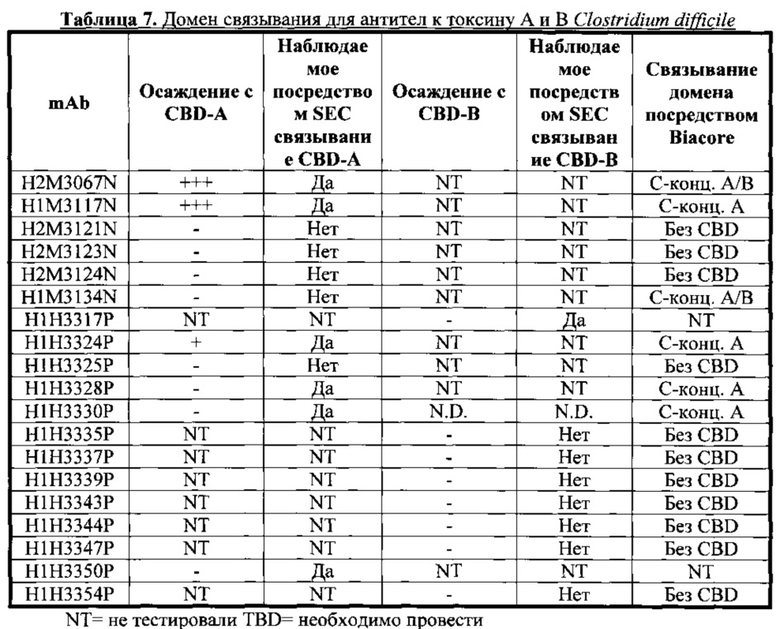
Без CBD указывает на отсутствие связывания с С-концевым связывающимся с рецептором доменом токсина -А или -В.
Пример 7. Определение нейтрализующей эффективности антител к токсину А и/или токсину В Clostridium difficile
Для определения нейтрализующей эффективности (IC50) антител к С. difficile in vitro, проводили анализ на оценку жизнеспособности клеток. В нескольких словах, клетки Веро (1,25×103), культивированные в среде альфа-MEM, дополненной 10% FBS, высеивали в 96-луночные микропланшеты и инкубировали в течение 16-18 часов при 37°С, в 5% СО2. Антитела к токсину С. difficile в различных концентрациях (0-66 нМ) добавляли к клеткам, а затем инкубировали с токсином А (32 или 25 пМ) или токсином В (0,03 пМ или 0,01 пМ) С. difficile в течение 48 часов. Использовали контроли, не содержавшие токсин (100% выживаемость), и контроли, содержавшие токсин, но без антитела (100% относительная смертность). Все разведения антитела проводили в трех повторах. После 2-дневной инкубации жизнеспособность клеток измеряли путем добавления соли тетразолия (WST-1; Roche Biochemicals), ожидания 4 часа для проявления цвета, а затем записи показаний поглощения света при 450 нм. Значения поглощения света анализировали с помощью 4-параметрического логистического уравнения по 11-точечной кривой реакции (GraphPad Prism).
Из результатов видно, что у десяти антител наблюдали нейтрализацию по отношению к токсину А со значениями IC50, варьирующими от 7 пМ до 65 пМ при 25-32 пМ постоянном токсине А (таблица 8А). Следует отметить, что у H1H330P наблюдали нейтрализующую эффективность, равную эффективности контроля III (изотип, соответствующий антителу сравнения, клону 3358, который изложен в US2009/0087478), и эффективность, примерно в 20 раз больше, чем у контроля I (см US2005/0287150 для клона 3D8). У нескольких нейтрализующих токсин-В антител наблюдали значимо большую эффективность, чем у контроля II (изотип, соответствующий антителу сравнения, см. клон 124-152 в патентном документе US2005/0287150), с IC50, варьирующими от 25-120 пМ при 0,03 пМ постоянном токсине В (таблица 8В). У антител H1M3067N и H1M3134N, несмотря на то, что могли связываться как с токсином А, так и с токсином В, наблюдали нейтрализующую активность в отношении токсина А. Несмотря на то, что причина этого пока еще не ясна, одним возможным объяснением этому результату может быть то, что несмотря на то, что антитела могут связываться со множеством сайтов в повторяющихся участках С-концевой части токсина, другие части домена этого же токсина все еще могут взаимодействовать с мембраной млекопитающих, таким образом делая возможным вхождение токсина в клетку.
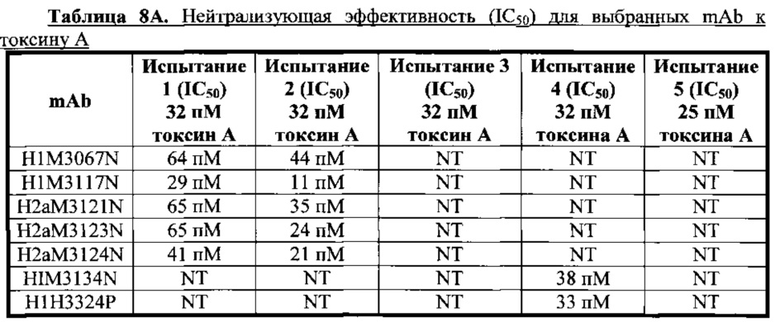
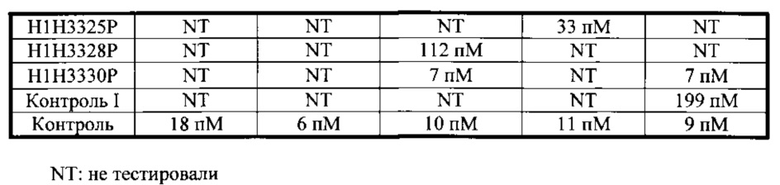
Пример 8. Создания биспецифического антитела
Создавали различные биспецифические антитела для применения при практическом осуществлении способов согласно настоящему изобретению. Например, специфичные к токсину А или токсину В С. difficile антитела создавали в формате биспецифической молекулы ("биспецифическая молекула"), в которой вариабельные участки, связывающиеся с различными доменами токсина А и/или В, соединяли вместе для придания специфичности к двум доменам и/или токсинам в одной связывающейся молекуле. Соответственно обозначенные биспецифические молекулы могли повышать общую эффективность нейтрализации токсина путем увеличения как специфичности, так и авидности связывания. Вариабельные участки со специфичностью к отдельным доменам, которые показаны на фигуре 1, (например, сегменты N-концевого домена, который представляет собой глюкозилирующий ферментный домен (обозначенный как домен 'A'), или домен автокаталитического процессинга (обозначенный как домен 'С'), или транслокационный домен (обозначенный как домен 'D'), или карбоксиконцевой связывающийся с рецептором домен (обозначенный как домен 'В'), или которые могли связываться с различными участками в одном домене, образовывали пары на структурном каркасе, что позволяло каждому участку одновременно связываться с отдельными эпитопами или с различными участками одного домена. В одном примере биспецифической молекулы вариабельные участки тяжелых цепей (VH) из молекулы связывания со специфичностью к одному домену рекомбинировали с вариабельными участками легких цепей (VL) из ряда молекул связывания со специфичностью ко второму домену для выявления неродственных VL-партнеров, которые могут образовывать пары с исходным VH без нарушения исходной специфичности у такого VH. Таким образом, отдельный VL-сегмент (например, VL1) можно комбинировать с двумя различными VH-доменами (например, VH1 и VH2) для создания биспецифической молекулы, состоящей из двух связывающих "плечей" (VH1- VL1 и VH2- VL1). Использование отдельного VLcerмeнтa уменьшало сложность системы и, таким образом, упрощало и повышало эффективность способов клонирования, экспрессии и очистки, использованных для создания биспецифической молекулы (см., например, USSN13/022759 и US2010/0331527).
Альтернативно, антитела, которые связываются как с токсином А так и/или с токсином В и второй мишенью, такой как без ограничения, например, второе отличное антитело к токсину А или токсину В, или анатоксин, или вакцина, можно получить в формате биспецифической молекулы с применением описываемых в настоящем документе методики или других, известных специалистам в настоящей области методик. Вариабельные участки антител, связывающиеся с различными участками токсина А, можно соединить с вариабельными участками, которые связываются с соответствующими сайтами, например, на токсине В, для придания специфичности к двум антигенам в одной связывающейся молекуле. Соответственно сконструированные биспецифические молекулы такой природы выполняют двойную функцию. Например, в случае биспецифического антитела, которое связывается как с токсином А, так и с токсином В, оно может лучше нейтрализовать одновременно как токсин А, так и токсин В без необходимости введения композиции, содержащей два отдельных антитела. Вариабельные участки со специфичностью к токсину А комбинировали с вариабельным участком со специфичностью к токсину В и образовывали пары на структурном каркасе, что позволяло каждому вариабельному участку связываться с отдельными антигенами.
Биспецифические молекулы связывания тестировали в отношении связывания и функциональной блокировки целевых антигенов, например, токсина А и токсина В, в любом из описанных выше для антител анализах. Например, для оценки биспецифического взаимодействия использовали стандартные способы измерения связывания растворимого белка, такие как Biacore, ELISA, эксклюзионная хроматография, многоугловое рассеивание лазерного света, прямая сканирующая калориметрия и другие способы. Связывание биспецифических антител как с токсином А, так и с токсином В определяли посредством ELISA-анализа связывания, при котором искусственные пептиды, представляющие собой различные токсины, наносили на лунки в титровальных миропланшетах, а связывание биспецифической молекулы определяли с помощью вторичного идентифицирующего антитела. Также проводили эксперименты по связыванию с применением экспериментов на основе поверхностного плазмонного резонанса, в которых взаимодействия при связывании пептида с антителом в реальном времени измеряли путем пропускания пептида или биспецифической молекулы по поверхности датчика, на котором были захвачены, соответственно, биспецифическая молекула или пептид. Функциональную блокировку in vitro как токсина А, так и токсина В биспецифической молекулой определяли с помощью любого биоанализа, такого как описываемый в настоящем документе анализ нейтрализации, или с помощью исследований иммунитета in vivo в соответствующих животных моделях, таких как описываемые в настоящем документе.
Пример 9. Оценка эффективности in vivo антител к токсину А и/или к токсину В против инфицирования С. difficile (CDI) в модели рецидива у хомяков (А) и в модели острого воспаления у хомяков (В)
Эффективность антител, специфичных к токсину А и/или токсину В из С. difficile, против инфицирования С. difficile оценивали у хомяков в двух различных описанных ниже моделях. Хомяки в присутствии клиндамицина восприимчивы к инфицированию С. difficile и обычно погибают в течение 2-4 дней после инфицирования.
(А) модель рецидива: Самцам сирийских золотых хомяков давали пероральную суспензию, содержавшую смесь спор и бесспоровых клеток С. difficile (всего 106), в день -1. Спустя двадцать четыре часа после инфицирования (день 0) животным делали однократную подкожную инъекцию клиндамицина (10 мг/кг). В дни 1-3 хомякам вводили перорально ванкомицин (10 мг/кг) один раз в день для ослабления инфекции. Антибиотик ванкомицин использовали с клинической точки зрения для лечения инфекции С. difficile. После последней дозы ванкомицина антитела ежедневно вводили подкожно в течение 4 дней (дни 3-6) или 1 дня (день 3) в соответствии с их группой лечения и дозировки (см. приведенные ниже таблицы 9А и 9В).
Проводили два различных испытания (см. фигуры 2 и 3) с применением модели рецидива в качестве замены оценки клинической эффективности. В обоих испытаниях сравнивали две комбинации антител:
1. антитела, обозначенные Н1Н3330РиН1Н3347Р;
2. антитела сравнения к токсину А (контроль I; см. патент США 7625559 для последовательности клона 3D8) и антитела сравнения к токсину В (контроль II; см. патент США 7625559 для последовательности клона 124-152).
В испытании 1 четыре дозы антитела вводили в количестве 5 мг/кг каждого антитела (общая доза 10 мг/кг). В испытании 2 одну дозу антитела давали в количестве либо 5 мг/кг, либо 2 мг/кг каждого антитела (всего либо 10 мг/кг, либо 4 мг/кг).
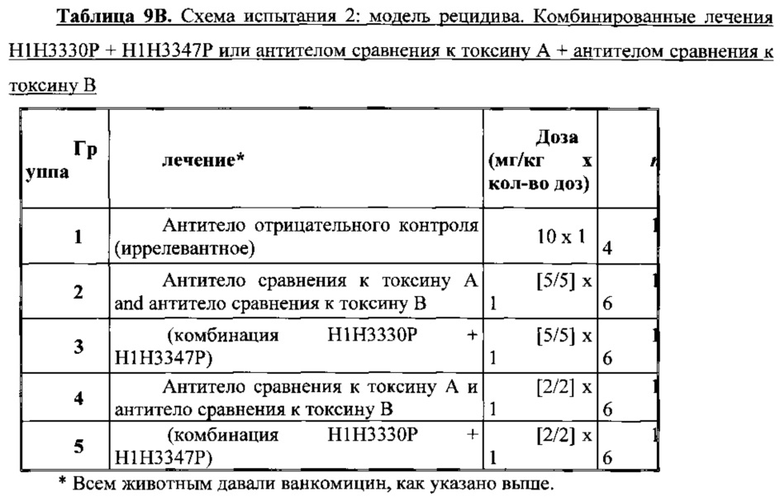
В ходе эксперимента животных осматривали два раза в день. Общие осмотры включали признаки смертельного исхода и заболеваемости, наличие диареи ("влажный хвост") и общий внешний вид (активность, общая реакция на взятие в руки, прикосновение, взлохмаченная шерсть). Животных, которые, согласно оценке, находились в предсмертном состоянии, умерщвляли. Используемыми критериями для оценки предсмертного состояния были продолжительные периоды (5 дней) потери массы, прогрессирование до истощенного состояния, продолжительная заторможенность (более 3 дней), признаки паралича, эрозии или травмы кожи, сгорбленная поза и вздутый живот. Наблюдения продолжали, при этом регистрировали смертельные случаи или умерщвление в течение периода до 18 дней после инифицирования для модели рецидива.
(В) модель острого воспаления: Самцам сирийских золотых хомяков внутривенно вводили клиндамицин с дозой 10 мг/кг на день -1. На день 0 споры С. difficile разбавляли стерильным PBS с получением 100 спор /300 мкл и вводили путем перорального принудительного кормления. Антитела вводили каждые день в течение 4 дней, начиная на день -3 и продолжая до дня 0 подкожным путем. Доза антител показана на условных обозначениях к фигуре. Для схемы исследования см. также приведенную ниже таблицу 9С.
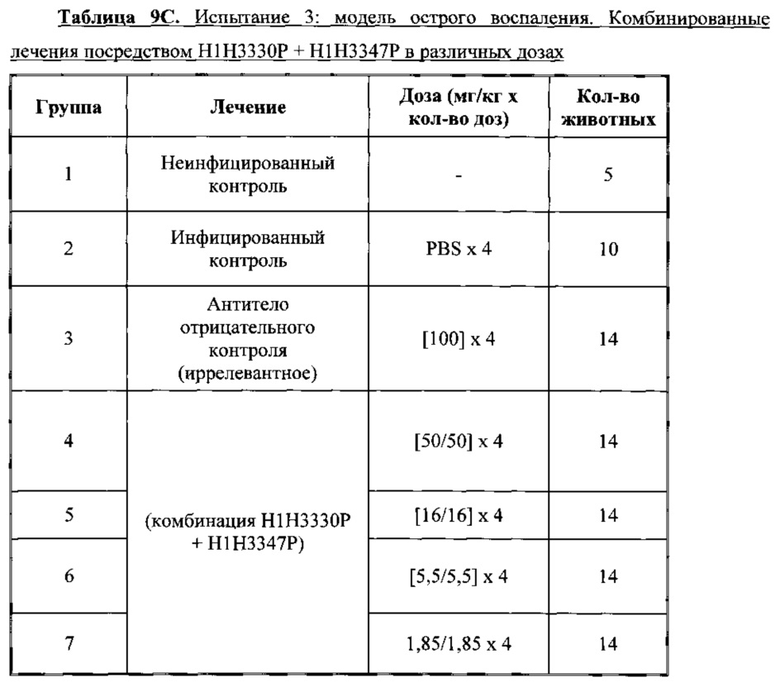


В ходе эксперимента животных осматривали два раза в день. Общие осмотры включали признаки смертельного исхода и заболеваемости, наличие диареи ("влажный хвост") и общий внешний вид (активность, общая реакция на взятие в руки, прикосновение, взлохмаченная шерсть). Животных, которые, согласно оценке, находились в предсмертном состоянии, умерщвляли. Используемыми критериями для оценки предсмертного состояния были продолжительные периоды (5 дней) потери массы, прогрессирование до истощенного состояния, продолжительная заторможенность (более 3 дней), признаки паралича, эрозии или травмы кожи, сгорбленная поза и вздутый живот. Наблюдения продолжали, при этом регистрировали смертельные случаи или умерщвление в течение периода до 10 дней для модели острого воспаления.
Результаты
Статистический анализ данных, полученных из моделей на хомяках, выполняли с применением логарифмического рангового критерия (критерия Кокса-Мантеля). Для парных сравнений для критичного значения Р применяли поправку по методу Бонферрони.
В первом испытании, которое представляло собой многодозовое исследование с помощью модели рецидива на хомяках, (см. фигуру 2), комбинированное лечение посредством Н1Н3330Р плюс Н1Н3347Р или комбинированное лечение посредством антитела сравнения, было видно повышение общей выживаемости по сравнению с изотопическим контролем или только ванкомицином (74-78% комбинация антител к токсину А и токсину В по сравнению с 27-43%) контрольными группами). В частности, ко дню 19 выживало 27% хомяков, получавших только PBS; выживало 43% получавших изотопический контроль; выживало 74% получавших комбинацию антител сравнения к токсину А плюс токсину В; и выживало 78% получавших комбинацию Н1Н3330Р (антитело к А) плюс Н1Н3347Р (антитело к В).
Во втором испытании, которое представляло собой однодозовое исследование с помощью модели рецидива на хомяках (см. фигуру 3), комбинированное лечение посредством либо Н1Н3330Р плюс Н1Н3347Р, либо антител сравнения повышало выживаемость по сравнению с изотипическим контролем (антитело отрицательного контроля), хотя различие между дозами 2 мг/кг и 5 мг/кг отсутствовало.
В первом исследовании на модели острого воспаления на хомяках (см. фигуру 4), при лечении посредством комбинации Н1Н3330Р плюс Н1Н3347Р наблюдали значимую защиту хомяков от смертельного исхода в зависимости от изменения титра по сравнению с отрицательными контролями (р<0,0001 для всех групп по сравнению с изотипическими контролями). Дозы изменялись от 50 мг/кг до 1,85 мг/кг (каждого антитела, которое давали в виде комбинации), причем высокая доза обеспечивала защиту для всех животных до дня 7 по сравнению с днем 1 для наиболее низкой дозы.
В последующих исследованиях с применением модели острого воспаления у хомяков (см. фигуру 5), комбинированное лечение либо H1H3330P плюс Н1Н3347Р, либо комбинацией антител сравнения значительно повышало выживаемость по сравнению с изотипическим контролем (фигура 5; изотопический контроль в количестве 40 мг/кг по сравнению с контроль I/контроль II в количестве 20 мг/кг каждого, р<0,0001; изотипический контроль в количестве 40 мг/кг по сравнению с контроль I/контроль II в количестве 5 мг/кг каждого, р=0,0003; изотипический контроль в количестве 40 мг/кг по сравнению с Н1Н3330Р/Н1Н3347Р в количестве 20 мг/кг каждого, р<0,0001; изотипический контроль в количестве 40 мг/кг по сравнению Н1Н3330Р/Н1Н3347Р в количестве 5 мг/кг каждого, p<0,0001). Тем не менее, лечение комбинацией H1H3330P плюс Н1Н3347Р защищало хомяков от смертельного исхода лучше контролей, представлявших собой антитело сравнения, при тестировании с низкой дозой, составлявшей 5 мг/кг каждого антитела (р<0,0001), в то время как значимое отличие между комбинацией H1H3330P плюс Н1Н3347Р и комбинацией антител сравнения с более высокой дозой, составлявшей 20 мг/кг каждого антитела (p=0,73), отсутствовало. Из результатов явно видно преимущество низкой дозы в модели острого воспаления у хомяков, и можно предположить, что дозы антител H1H3330P плюс Н1Н3347Р в клинической практике могут быть эффективны при более низких концентрациях по сравнению с антителами сравнения.
Пример 10. Влияние антител к токсину А и токсину В на блокировку цитотоксичности, вызванной культуральным супернатантом от нескольких гипервирулентных штаммов С. difficile группы BI: сравнение с mAb сравнения
Пациенты, инфицированные клинически гипервирулентными штаммами BI/NAP1/027, имеют более низкие показатели эффективности лечения, чем пациенты, инфицированные отличными от BI штаммами, при лечении либо фидаксомицином, либо ванкомицином (Petrella, LA, et al. (2012), Clinical Infectious Diseases, 55(3): 351-357). Вместе с тем штаммы BI/NAP 1/027 ассоциированы с более высокой частотой рецидивов CDI и более высоким ожидаемым процентом смертности по сравнению со штаммами-прототипами (Loo, VG, et al. (2005), N Engl J Med, 353:23; Petrella, LA, et al. (2012), Clinical Infectious Diseases, 55(3): 351-357. Эти гипервирулентные штаммы характеризуются повышением продукции токсинов А и В, наличием двухкомпонентного токсина и повышенной устойчивостью к фторхинолонам. Повышение продукции токсинов А и В наиболее вероятно вызвано приводящей к потере функции мутацией в tcdC, предполагаемый отрицательный регулятор экспрессии tcdA и tcdB, которая приводит к непрерывной продукции токсина на протяжении всего жизненного цикла.
Способность смеси H1H3330P и Н1Н3347Р с молярным соотношением 1:1 нейтрализовать токсин из четырех клинически выделенных штаммов BI/NAP1/027 С. difficile тестировали в ходе клеточного анализа нейтрализации. Клинически выделенные гипервирулентные штаммы VA5 и VA17 получали от Case Western Reserve University, Кливленд, Огайо. Клинически выделенные гипервирулентные штаммы 6336 и 6443 получали из Dept. of Veterans Affairs, Edward Hines, Jr. Hospital, Хайнз, Иллинойс. В анализах нейтрализации использовали клетки Веро, линии эпителиальных клеток обезьяньей почки, по причине их восприимчивости к обоим токсинам С. difficile. В течение 48 часов клетки инкубировали с различными количествами коктейля антител и фиксированным количеством культурального супернатанта, выделенного из нескольких штаммов С. difficile. Цитотоксичность определяли путем добавления реактива WST-1, химического индикатора окислительно-восстановительной реакции, который при восстановлении приводил к колориметрическому изменению; метаболическая активность во время роста клеток восстанавливала WST-1, что в результате давало повышенное поглощение при 450 нм.
Культуральный супернатант из нескольких клинически выделенных штаммов BI характеризовался широким спектром цитотоксической активности на клетках Веро, со значениями ЕС50 для индукции клеточной цитотоксичности, варьирующими в диапазоне от 3700-кратного разведения для штамма VA5 до 88200-кратного разведения для штамма 6443. Смесь Н1Н3330Р и Н1Н3347Р в молярном соотношении 1:1 блокировала цитотоксичность, индуцированную культуральными супернатантами из всех протестированных штаммов группы BI с более чем в 34 раза лучшей нейтрализующей эффективностью по сравнению со смесью антитела сравнения к токсину А (контроль I; см. патент США 7625559 для последовательности клона 3D8) и антитела сравнения к токсину В (контроль II; см. патент США 7625559 для последовательности клона 124-152) в молярном соотношении 1:1. Из этих данных видно, что пара антител Н1Н3330Р/Н1Н3347Р могла нейтрализовать цитотоксичность культуры со значениями IC50 в пикомолярном диапазоне (31-45 пМ) для тестированных гипервирулентных штаммов BI по сравнению с коктейлем mAb сравнения (диапазон IC50: 1200-1700 пМ; см. таблицу 10).
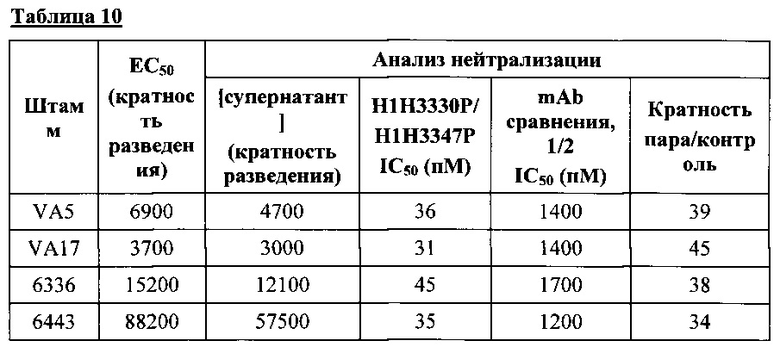
Пример 11. Картирование эпитопа антитела Н1Н3330Р к токсину А
Эпитоп С-концевого связывающегося с рецептором домена (CBD) токсина А (SEQ ID: 375), связываемый Н1Н3330Р, определяли с применением масс-спектрометрической методов протеомики. В нескольких словах, CBD токсина А подвергали расщеплению трипсином в течение 12-часового периода и образцы прогоняли на 10-14% градиентном SDS-PAGE с последующим переносом на нитроцеллюлозные мембраны и вестерн-блоттингом с применением либо антитела Н1Н3330Р, либо антитела контроля I (см. патент США 7625559 для последовательности антитела 3D8) в качестве первичных антител. Дополнительный анализ пептидных последовательностей, которые связывались с антителом Н1Н3330Р, проводили с применением 2D электрофореза с последующим MALDI-TOF MS-анализом. Ниже эти процедуры описаны более подробно.
Ограниченное расщепление трипсином токсина А
К рекомбинантному С-концевому связывающемуся с рецептором домену (CBD) токсина А (0,4 мкг/мкл в PBS) добавляли модифицированный по типу последовательности трипсин (Promega, кат. № V511C) в массовом соотношении 1:80 и инкубировали при 37°С в течение 0-12 часов. Фермент инактивировали путем добавления 2 объемов IX буфера для образца Laemmli и нагревали при 95°С в течение 5 минут. Образцы хранили при -20°С до проведения анализа.
Вестерн-блоттинг
Сначала исследовали степень протеолиза с помощью 10-14% градиентного SDS-PAGE. Количество каждого загружаемого образца было эквивалентно 1 мкг изначального CBD токсина А, а разделенные белки в геле визуализировали с помощью красителя кумасси SimplyBlue (Invitrogen, кат. № LC6065).
Образцы, расщепляемые на протяжении 0 часов и 12 часов, затем отбирали по разделению при 10-14% градиентном SDS-PAGE при помощи эквивалентного 50 нг изначального CBD токсина А, загруженного для каждого образца. Разделенные белки переносили на нитроцеллюлозную мембрану и зондировали при помощи первичного антитела Н1Н3330Р или антитела контроль I с концентрацией 1 мкг/мл в TBST (забуференный Tris солевой раствор, содержащий 0,05% Tween-20) в течение ночи при 4°C с последующим добавлением конъюгированного с HRP вторичного антитела к IgG человека (Pierce, кат. №31412; при 1:15000 разведении в TBST). Как антитела H1H3330P, так и антитела контроль 1 имели константный домен IgG1 человека. Мембрану инкубировали с хемилюминесцентным субстратом (Perkin Elmer, кат. № NEL103E001EA) и получали изображение на рентгеночувствительной пленке.
2D гель-электрофорез
Для определения того, какие аминокислоты представлены в бэнде белка, присущему в вестерн-блотах, полученных с применением антитела H1H3330P, проводили двухмерный (2D) гель-электрофорез с применением 12-часового расщепления трипсином CBD токсина А.
Расщепление трипсином в геле и пептидное картирование с помощью MALDI-TOF MS
2D-гель-анализ выявлял 4 белковых зоны, близко расположенных друг к другу в pH (значения pI ~ 9) направлении, которые составляли 50 кДа бэнд, который визуализировали с помощью вестерн-блоттинга с применением Н1Н3330Р. 4 белковых зоны с соответствующими молекулярными массами ~50 кДа из 20-геля с применением 12-часового расщепления трипсином извлекали, обесцвечивали с помощью 50% ацетонитрила, восстанавливали с помощью 65 мМ DTT и алкилировали с помощью 135 мМ йодацетамида. После обезвоживания с помощью ацетонитрила добавляли 20 мкл 2,5 нг/мкл модифицированного по типу последовательности трипсина (Promega, кат. № V5111) для покрытия всех бэндов геля и проводили расщепление в геле путем инкубации в течение ночи при 37°С.
Полученные пептиды обессоливали с помощью Ziptip C18 (Millipore, кат. № ZTC18S096) и анализировали с помощью MALDI-TOF-TOF MS Bruker UltrafleXtreme. Спектр обрабатывали с помощью программного обеспечения FlexAnalysis и производили внутреннюю калибровку по пикам аутолитических трипсиновых фрагментов. Производили поиск перечней калибровочных пиков относительно собственной базы данных, содержащей последовательность CBD токсина А, с погрешностью при измерении массы 10 ppm.
Результаты
Из результатов видно, что посредством блоттинга с помощью Н1Н3330Р выявляли основной бэнд белка с массой около 50 кДа через 12 часов после расщепления трипсином, в то время как не наблюдали бэнд белка с молекулярной массой около 50 кДа при проведении блоттинга с антителом контроль 1 через 12 часов после расщепления трипсином.
Для определения того, какие аминокислоты представлены в бэнде 50 кДа белка, присущие в вестерн-блотах, полученных с применением Н1Н3330Р, проводили двухмерный (2D) гель-электрофорез с применением описанного выше 12-часового расщепления трипсином. Как уже указано, 2D-гель-анализ выявлял 4 белковых зоны, близко расположенных друг к другу в рН (значения pI ~ 9) направлении, которые составляли 50 кДа бэнд, визуализированный с помощью вестерн-блоттинга с применением Н1Н3330Р. Масс-спектрометрия этих 4 белковых пятен показала 17 совпадающих пептидов, охватывающих аминокислотные остатки 468-863 CBD токсина A (SEQ ID: 375). Этот фрагмент токсина А (аминокислоты, охватывающие остатки 468-863) имел прогнозируемую молекулярную массу 45 кДа и прогнозируемую изоэлектрическую точку 9,01, вполне соответствующую значениям, полученным в результате 2-D гель-электрофоретического анализа.
Из этого примера видно, что антитело к токсину А Н1Н3330Р имело эпитоп, отличающийся от эпитопа контроля 1 (3D8 в US 7625559), и связывалось с CBD токсина А в пределах аминокислот 468-863. В пределах этого участка выявляли конкретные аминокислотные последовательности, которые взаимодействовали с антителом Н1Н3330Р, и такими аминокислотными последовательности были остатки 468-488 из SEQ ID NO: 375, остатки 510-530 из SEQ ID NO: 375, остатки 602-610 из SEQ ID NO: 375, остатки 644-703 из SEQ ID NO: 724-794 из SEQ ID NO: 375, остатки 799-814 из SEQ ID NO: 375 и остатки 858-863 из SEQ ID NO: 375.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К FEL D1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2658491C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕ RET, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2821548C2 |
| ВЫСОКОАФФИННЫЕ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ АНГИОПОЭТИНУ-2 | 2010 |
|
RU2545399C2 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ АССОЦИИРОВАННЫХ С CLOSTRIDIUM DIFFICILE ИНФЕКЦИИ И ЗАБОЛЕВАНИЙ | 2011 |
|
RU2630663C9 |
| ГУМАНИЗИРОВАННОЕ ТАУ-АНТИТЕЛО | 2013 |
|
RU2644242C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2007 |
|
RU2498999C2 |
| ВЫСОКОАФФИННЫЕ АНТИТЕЛА ЧЕЛОВЕКА К РЕЦЕПТОРУ IL-4 ЧЕЛОВЕКА | 2007 |
|
RU2445318C2 |
| Композиции и способы, имеющие отношение к мутантному токсину из Clostridium Difficile | 2013 |
|
RU2630671C2 |
| КОМПОЗИЦИИ, ОТНОСЯЩИЕСЯ К МУТАНТНОМУ ТОКСИНУ CLOSTRIDIUM DIFFICILE, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2592686C2 |
| АНТИТЕЛА ПРОТИВ GDF8 ЧЕЛОВЕКА | 2011 |
|
RU2567805C2 |


















































































































































































































































































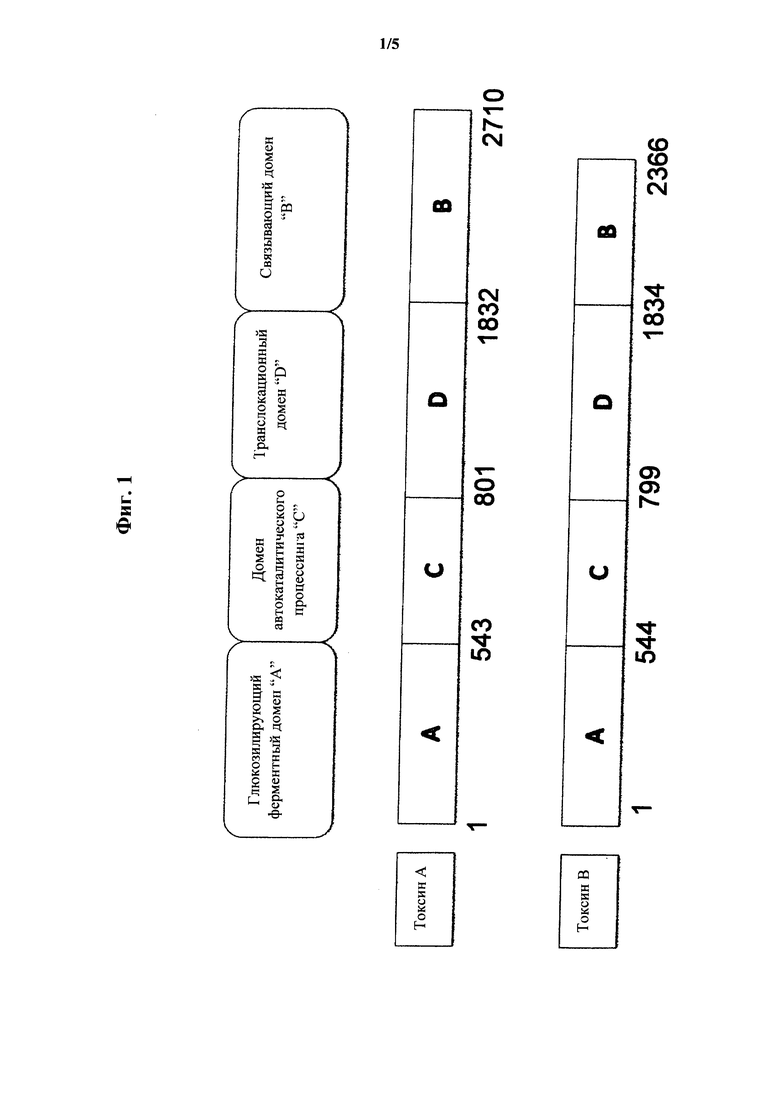
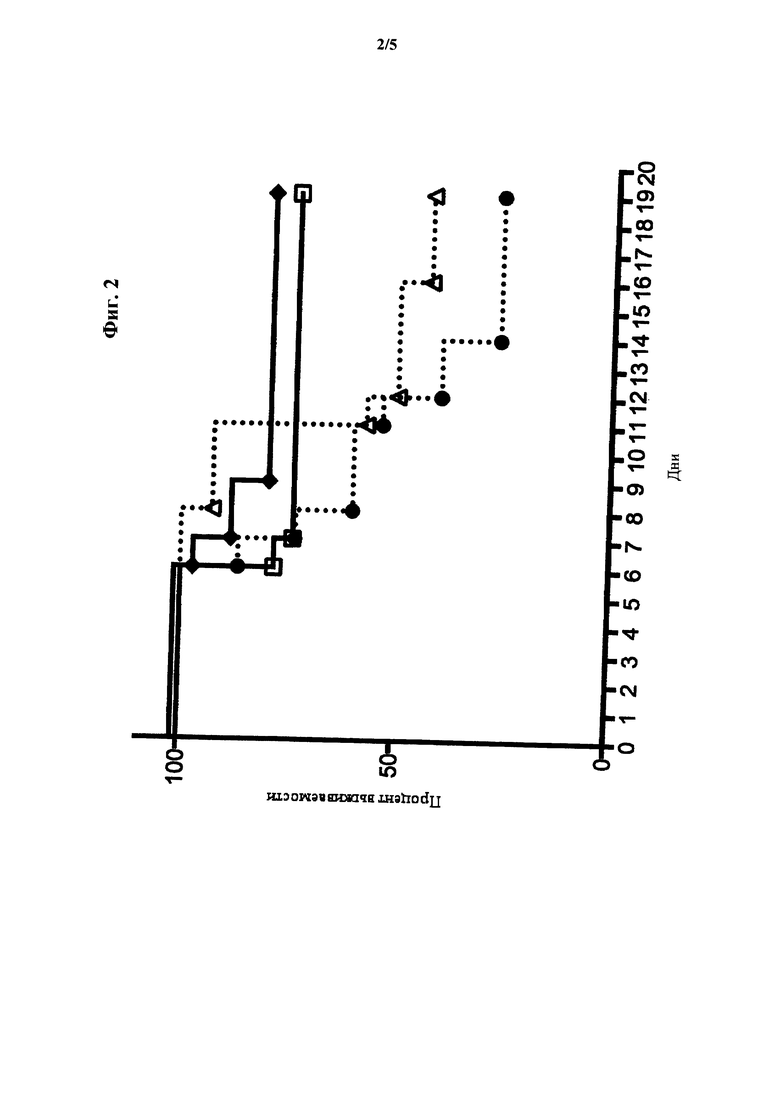
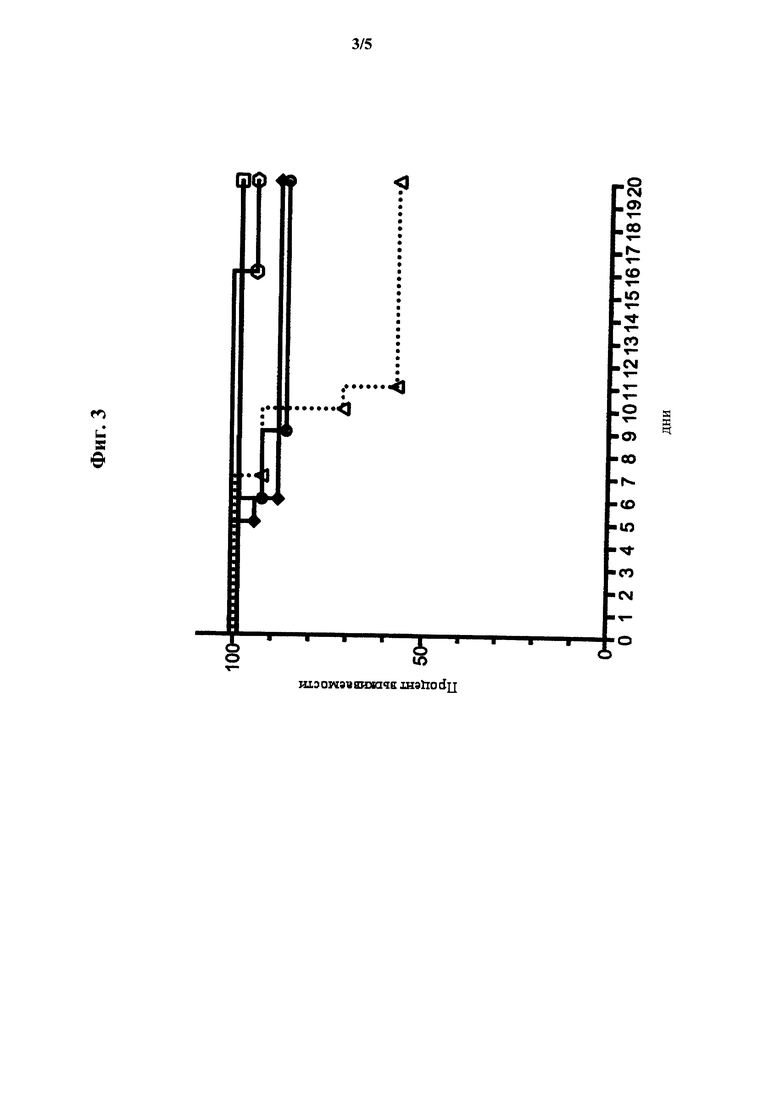
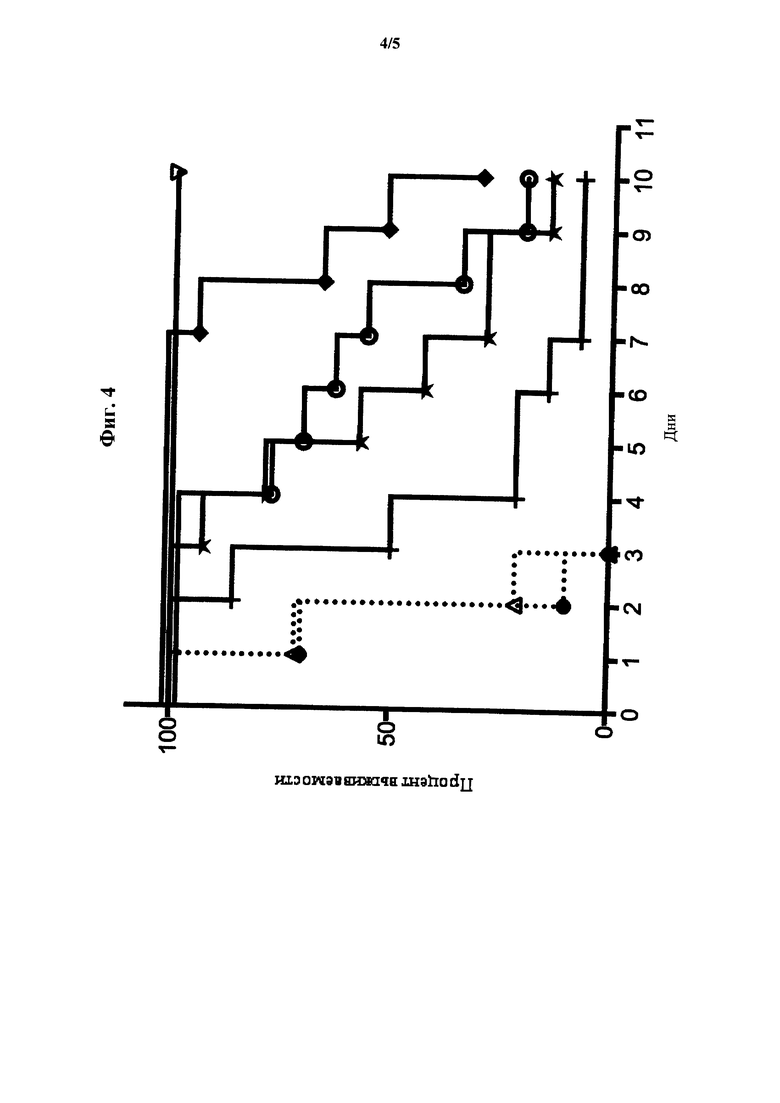
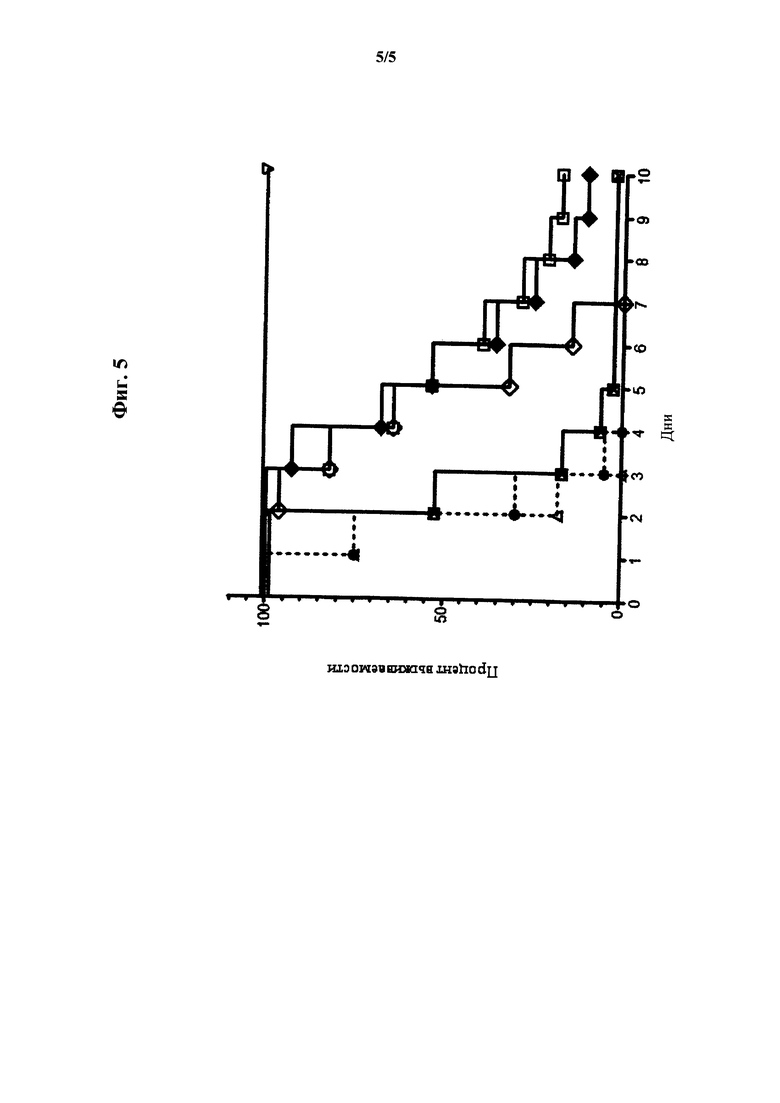
Изобретение относится к биохимии. Описаны полностью человеческие антитела, которые связываются либо с токсином А, либо с токсином В Clostridium difficile, или как с токсином А, так и с токсином В. Также описаны композиции, содержащие указанные антитела, и способам их применения. Антитела по настоящему изобретению пригодны для нейтрализации токсинов из С. difficile, таким образом, обеспечивая средства лечения заболевания и симптомов, связанных с инфекцией С. difficile, в том числе средство для лечения диареи или псевдомембранозного колита, вызванного С. difficile. Антитела также могут ограничивать тяжесть и/или продолжительность основного заболевания или могут ограничивать количество, продолжительность и/или тяжесть рецидивов или обострений заболевания, объясняемого присутствием С. difficile. Антитела по настоящему изобретению также могут быть пригодны для диагностики инфицирования С. difficile. 9 н. и 25 з.п. ф-лы, 5 ил., 10 табл., 11 пр.
1. Выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержащие три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в аминокислотной последовательности вариабельного участка тяжелой цепи (HCVR), выбранной из SEQ ID NO: 2, 98, 130, 146 и 162; и три определяющих комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в аминокислотной последовательности вариабельного участка легкой цепи (LCVR), выбранной из SEQ ID NO: 10, 106, 138, 154 и 170.
2. Выделенное антитело или его антиген-связывающий фрагмент по п. 1, которые специфично связываются с токсином A Clostridium difficile, причем антитело или его антиген-связывающий фрагмент содержат: (a) HCVR с аминокислотной последовательностью SEQ ID NO: 146; и (b) LCVR с аминокислотной последовательностью SEQ ID NO: 154.
3. Выделенное антитело или его антиген-связывающий фрагмент по п. 1, которые специфично связываются с токсином A Clostridium difficile, причем антитело или его антиген-связывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из SEQ ID NO: 2/10, 98/106, 130/138, 146/154 и 162/170.
4. Выделенное антитело по любому из пп. 1 или 3 или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, причем антитело содержит:
(a) домен HCDR1 с аминокислотной последовательностью, выбранной из SEQ ID NO: 4, 100, 132, 148 и 164;
(b) домен HCDR2 с аминокислотной последовательностью, выбранной из SEQ ID NO: 6, 102, 134, 150 и 166;
(c) домен HCDR3 с аминокислотной последовательностью, выбранной из SEQ ID NO: 8, 104, 136, 152 и 168;
(d) домен LCDR1 с аминокислотной последовательностью, выбранной из SEQ ID NO: 12, 108, 140, 156 и 172;
(e) домен LCDR2 с аминокислотной последовательностью, выбранной из SEQ ID NO: 14, 110, 142, 158 и 174; и
(f) домен LCDR3 с аминокислотной последовательностью, выбранной из SEQ ID NO: 16, 112, 144, 160 и 176.
5. Выделенное антитело по любому из пп. 1 или 3, или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, причем антитело содержит:
(a) домен HCDR1 с аминокислотной последовательностью SEQ ID NO: 148;
(b) домен HCDR2 с аминокислотной последовательностью SEQ ID NO: 150;
(c) домен HCDR3 с аминокислотной последовательностью SEQ ID NO: 152;
(d) домен LCDR1 с аминокислотной последовательностью SEQ ID NO: 156;
(e) домен LCDR2 с аминокислотной последовательностью SEQ ID NO: 158; и
(f) домен LCDR3 с аминокислотной последовательностью SEQ ID NO: 160.
6. Выделенное антитело по п. 2, которое взаимодействует или связывается с эпитопом внутри аминокислотных остатков 468-863 карбоксиконцевого связывающегося с рецептором домена продуцируемого Clostridium difficile токсина А, или его антиген-связывающий фрагмент, причем карбоксиконцевой связывающийся с рецептором домен токсина А содержит аминокислотную последовательность SEQ ID NO: 375.
7. Выделенное антитело по п. 2, которое взаимодействует или связывается с эпитопом внутри карбоксиконцевого связывающегося с рецептором домена продуцируемого Clostridium difficile токсина А, или его антиген-связывающий фрагмент, причем эпитоп выбран из группы, состоящей из остатков 468-488 из SEQ ID NO: 375, остатков 510-530 из SEQ ID NO: 375, остатков 602-610 из SEQ ID NO: 375, остатков 644-703 из SEQ ID NO: 375, остатков 724-794 из SEQ ID NO: 375, остатков 799-814 из SEQ ID NO: 375 и остатков 858-863 из SEQ ID NO: 375.
8. Фармацевтическая композиция для нейтрализации токсинов Clostridium difficile, содержащая эффективное количество одного или нескольких антител по любому из пп. 1-7 и фармацевтически приемлемый носитель или разбавитель.
9. Фармацевтическая композиция по п. 8, причем композиция содержит по меньшей мере одно антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, и по меньшей мере одно антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, причем:
a) антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином А, содержат три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей вариабельного участка тяжелой цепи (HCVR), выбранной из SEQ ID NO: 2, 98, 130, 146 и 162; и три определяющие комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей вариабельного участка легкой цепи (LCVR), выбранной из SEQ ID NO: 10, 106, 138, 154 и 170; и причем
b) антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В, содержат три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей HCVR, выбранной из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей LCVR, выбранной из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
10. Фармацевтическая композиция по любому из пп. 8 или 9, причем антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержат пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 146/154, и причем антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержат пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO: 274/282.
11. Фармацевтическая композиция по любому из пп. 8 или 9, содержащая:
a) выделенное первое антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержащие HCDR1 с аминокислотной последовательностью SEQ ID NO: 148, HCDR2 с аминокислотной последовательностью SEQ ID NO: 150, HCDR3 с аминокислотной последовательностью SEQ ID NO: 152, LCDR1 с аминокислотной последовательностью SEQ ID NO: 156, LCDR2 с аминокислотной последовательностью SEQ ID NO: 158, LCDR3 с аминокислотной последовательностью SEQ ID NO: 160;
b) выделенное второе антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, содержащие HCDR1 с аминокислотной последовательностью SEQ ID NO: 276, HCDR2 с аминокислотной последовательностью SEQ ID NO: 278, HCDR3 с аминокислотной последовательностью SEQ ID NO: 280, LCDR1 с аминокислотной последовательностью SEQ ID NO: 284, LCDR2 с аминокислотной последовательностью SEQ ID NO: 286, LCDR3 с аминокислотной последовательностью SEQ ID NO: 288; и
с) фармацевтически приемлемый носитель или разбавитель.
12. Фармацевтическая композиция по любому из пп. 8 или 9, причем содержащиеся в композиции антитела эффективны при нейтрализации токсинов А и В из гипервирулентного штамма Clostridium difficile.
13. Фармацевтическая композиция по п. 12, причем гипервирулентный штамм Clostridium difficile представляет собой штамм BI/NAP1/027.
14. Фармацевтическая композиция по п. 13, причем штамм BI/NAP1/027 выбран из VA5, VA17, 6336 и 6443.
15. Выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином A Clostridium difficile, содержащие три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в аминокислотной последовательности вариабельного участка тяжелой цепи (HCVR) SEQ ID NO: 114; и три определяющих комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в аминокислотной последовательности вариабельного участка легкой цепи (LCVR) SEQ ID NO: 122.
16. Фармацевтическая композиция для нейтрализации токсинов Clostridium difficile, содержащая эффективное количество одного или нескольких антител по п. 15 и фармацевтически приемлемый носитель или разбавитель.
17. Фармацевтическая композиция по п. 16, дополнительно содержащая антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile, при этом антитело содержит три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из аминокислотных последовательностей HCVR, выбранной из SEQ ID NO: 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338 и 354; и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из аминокислотных последовательностей LCVR, выбранной из SEQ ID NO: 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346 и 362.
18. Способ лечения пациента, страдающего от ассоциированного с Clostridium difficile состояния или заболевания, или лечения по меньшей мере одного симптома или осложнения, связанных с указанным состоянием или заболеванием, или предупреждения развития ассоциированного с Clostridium difficile заболевания или состояния у пациента, подверженного такому риску, причем способ предусматривает введение пациенту эффективного количества фармацевтической композиции по любому из пп. 8-14 или 16-17, причем ассоциированное с Clostridium difficile состояние или заболевание либо предупреждают, либо уменьшают по тяжести и/или продолжительности, или предупреждают или облегчают по меньшей мере один симптом или осложнение, связанные с указанным состоянием или заболеванием, или уменьшают его частоту и/или продолжительность или тяжесть рецидивов или обострений, вызванных Clostridium difficile.
19. Способ по п. 18, причем по меньшей мере один симптом или осложнение, связанные с ассоциированными с Clostridium difficile состоянием или заболеванием, выбраны из группы, состоящей из анорексии, боли в животе, вздутия живота, диареи с кровотечением или без него, обезвоживания, расстройства пищеварения, псевдомембранозного колита, полной или сегментной резекции толстого кишечника, сопровождающейся лихорадкой и системной инфекции (сепсиса), смертельного исхода, обострения вызванного Clostridium difficile состояния или заболевания и отторжения трансплантированной ткани или органа.
20. Способ по п. 18 или 19, причем пациент, подверженный риску развития ассоциированного с Clostridium difficile заболевания или состояния, выбран из группы, состоящей из пожилого пациента (возрастом ≥ 65), пациента, который имеет иммунную недостаточность в связи с первопричинной болезнью или в связи с введением иммуносупрессивных терапевтических средств, пациента, у которого есть некоторое первопричинное медицинское состояние, которое может вызывать у него предрасположенность к возникновению инфекции Clostridium difficile, пациента, госпитализированного на протяжении длительного периода времени (по меньшей мере одна неделя), пациента, которого лечили на протяжении продолжительного периода времени (≥14 дней) антибиотиками широкого спектра действия, пациента со злокачественной опухолью, проходящего трансплантацию пациента и пациента, подвергаемого терапии средствами, такими как без ограничения ингибитор протонного насоса или ингибитор гистаминового рецептора Н2, которые применяют для лечения заболеваний или состояний желудочно-кишечного тракта для уменьшения или лечения кислотности желудочного сока, гастроэзофагеальной рефлюксной болезни (GERD), язв желудка или тонкой кишки или изжоги.
21. Фармацевтическая композиция по любому из пп. 8 или 9 или 16-17 для применения при лечении пациента, страдающего от ассоциированного с Clostridium difficile заболевания или состояния, или лечения по меньшей мере одного симптома или осложнения, связанных с указанным состоянием или заболеванием, или предупреждения развития ассоциированного с Clostridium difficile заболевания или состояния у пациента, подверженного такому риску, причем ассоциированное с Clostridium difficile заболевание или состояние либо предупреждают, либо уменьшают по тяжести и/или продолжительности, или предупреждают или облегчают по меньшей мере один симптом или осложнение, связанные с указанным состоянием или заболеванием, или уменьшают его частоту и/или продолжительность или тяжесть рецидивов или обострений, вызванных Clostridium difficile.
22. Применение фармацевтической композиции по любому из пп. 8-14 или 16-17 при производстве лекарственного препарата для применения при лечении пациента, страдающего от ассоциированного с Clostridium difficile заболевания или состояния, или лечения по меньшей мере одного симптома или осложнения, связанных с указанным состоянием или заболеванием, или предупреждения развития ассоциированного с Clostridium difficile заболевания или состояния у пациента, подверженного такому риску, причем ассоциированное с Clostridium difficile заболевание или состояние либо предупреждают, либо уменьшают по тяжести и/или продолжительности, или предупреждают или облегчают по меньшей мере один симптом или осложнение, связанные с указанным состоянием или заболеванием, или уменьшают его частоту и/или продолжительность или тяжесть рецидивов или обострений, вызванных Clostridium difficile.
23. Применение по п. 22, причем пациент, подверженный риску развития ассоциированного с Clostridium difficile заболевания или состояния, выбран из пожилого пациента, пациента, который имеет иммунную недостаточность в связи с болезнью или в связи с введением иммуносупрессивных терапевтических средств, пациента, у которого есть некоторое первопричинное медицинское состояние, которое может вызывать у него предрасположенность к возникновению инфекции Clostridium difficile, пациента, госпитализированного на протяжении длительного периода времени, пациента, которого лечили на протяжении продолжительного периода времени антибиотиками широкого спектра действия, пациента, подвергаемого терапии ингибитором протонного насоса для лечения заболеваний или состояний желудочно-кишечного тракта, пациента со злокачественной опухолью и проходящего трансплантацию пациента.
24. Применение по п. 23, причем пациент со злокачественной опухолью проходит лечение при помощи противоопухолевого лекарственного средства или проходит лучевую терапию для лечения злокачественной опухоли.
25. Применение по п. 23, причем проходящим трансплантацию пациентом является пациент, получающий тансплатат гемопоэтических стволовых клеток или трансплатат твердой ткани или цельного органа.
26. Применение по п. 23 или 25, причем проходящий трансплантацию пациент подвергается лечению иммуносупрессивным лекарственным средством или любым лекарственным средством, препятствующим отторжению трансплантата, или он проходит лечение согласно схеме приема лекарственного средства для предупреждения отторжения после трансплантации трансплантируемых ткани или органа.
27. Применение по п. 22, причем фармацевтическая композиция вводится пациенту в комбинации со вторым терапевтическим средством.
28. Применение по п. 27, причем второе терапевтическое средство выбрано из анатоксина, вакцины против Clostridium difficile, антибиотика, другого отличного антитела к токсину А и/или В Clostridium difficile и любого другого паллиативного средства терапии, пригодного для ослабления по меньшей мере одного симптома, связанного с ассоциированным с Clostridium difficile заболеванием или состоянием.
29. Применение по п. 28, причем по меньшей мере один симптом или осложнение, связанные с ассоциированными с Clostridium difficile состоянием или заболеванием, выбраны из группы, состоящей из анорексии, боли в животе, вздутия живота, диареи с кровотечением или без него, обезвоживания, расстройства пищеварения, псевдомембранозного колита, полной или сегментной резекции толстого кишечника, сопровождающейся лихорадкой и системной инфекции (сепсиса), смертельного исхода, обострения вызванного Clostridium difficile состояния или заболевания и отторжения трансплантированной ткани или органа.
30. Выделенная нуклеиновая кислота, кодирующая антитело по любому из пп. 1-7.
31. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 30.
32. Выделенная клетка-хозяин для получения антитела или его антиген-связывающего фрагмента, которые специфично связываются с токсином A Clostridium difficile, содержащая вектор экспрессии по п. 31.
33. Фармацевтическая композиция по п. 8, дополнительно содержащая второе антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile.
34. Фармацевтическая композиция по п. 33, в которой второе антитело или его антиген-связывающий фрагмент, которые специфично связываются с токсином В Clostridium difficile содержат HCDR1 с аминокислотной последовательностью SEQ ID NO: 276, HCDR2 с аминокислотной последовательностью SEQ ID NO: 278, HCDR3 с аминокислотной последовательностью SEQ ID NO: 280, LCDR1 с аминокислотной последовательностью SEQ ID NO: 284, LCDR2 с аминокислотной последовательностью SEQ ID NO: 286, и LCDR3 с аминокислотной последовательностью SEQ ID NO: 288.
| WO 2008014733 A1, 07.02.2008 | |||
| RU 2008144913 A, 27.05.2010. |
Авторы
Даты
2017-08-15—Публикация
2013-03-01—Подача