Изобретение относится к области органической химии, а именно к способу получению 2-алкилзамещенных семикарбазидов формулы (I) или их гидрохлоридов формулы (II):
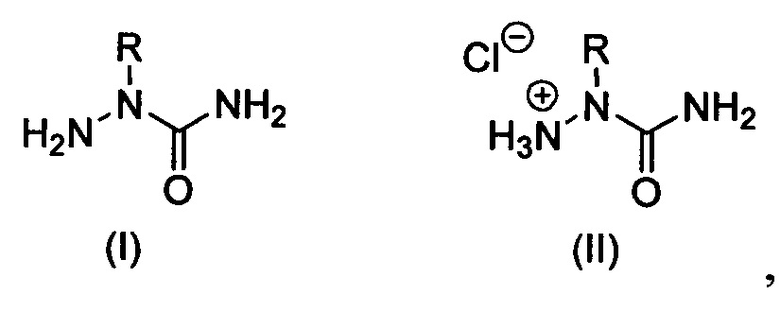 где R = алкил или замещенный алкил,
где R = алкил или замещенный алкил,
которые являются важными многоцелевыми реагентами и находят применение в качестве исходных веществ в органическом синтезе для получения разнообразных ациклических и гетероциклических азотсодержащих соединений, в частности, семикарбазонов, гидантоинов, пиразолов, 1,2,4-триазолов, 1,2,4-триазинов, 1,2,4-триазепинов, пиримидинов, 1,3,4-оксадиазолов, азамакроциклов и т.д. Кроме этого, указанные соединения используются в синтезах многих биологически активных веществ, содержащих семикарбазидный фрагмент, в том числе аналогов фурацилина и нитрофурантоина, обладающих выраженным противомикробным действием [Машковский М.Д. Лекарственные средства. 16-е изд. - М.: Новая волна, 2012. - 1216 с; Vass М. et al. Nitrofuran antibiotics: a review on the application, prohibition and residual analysis / Veterinarni Medicina, 2008, V. 53, N. 9, pp. 469-500], селективных агонистов пероксисомного пролифератор-активируемого рецептора PPARα [Хu Y. et al. Design and Synthesis of a Potent and Selective Triazolone-Based Peroxisome Proliferator-Activated Receptor α Agonist / Journal of Medicinal Chemistry, 2003, V. 46, N. 24, 5121-5124], ингибиторов MALT1 протеазы [заявка на патент WO 2014086478 A1, опубл. 12.06.2014] и т.д.
Одним из известных способов получения заявляемых соединений формулы (I) и (II) является нитрозирование N-алкилмочевин действием азотистой кислоты in situ или ее ангидрида с последующим восстановлением нитрозогруппы в синтезированных N-алкил-N-нитрозомочевинах под действием металлического цинка в водной уксусной кислоте, водорода над катализатором или электрохимически [Gabriel S. Uber einige Hydrazin-Derivate / EurJIC, 1914, V. 47, N. 3, pp. 3028-3033; Vogelesang C. Methylated semicarbazides / Rec. Trav. Chim., 1943, V. 62, N. 1, pp. 5-11; Smith P.A.S. et al. Preparation of Alkyl Azides from Hydrazine Derivatives / The Journal of Organic Chemistry, 1958, V. 23, N. 11, pp. 1595-1599; патент US 2959615 А, опубл. 08.11.1960; Young G. et al. Contribution to the chemistry of the triazoles. 1-Methyl-5-hydroxytriazoles / Journal of the Chemical Society, Transactions, 1901, V. 79, pp. 659-668; Backer H.J. 
 des nitrosamines /Rec. Trav. Chim., 1913, V. 32, N. 2, pp. 39-47; Backer H.J. Quelques
des nitrosamines /Rec. Trav. Chim., 1913, V. 32, N. 2, pp. 39-47; Backer H.J. Quelques 
 du 1,2,4-Triazol /Rec. Trav. Chim., 1925, V. 44, N. 12, pp. 1113-1117].
du 1,2,4-Triazol /Rec. Trav. Chim., 1925, V. 44, N. 12, pp. 1113-1117].
В уровне техники описан способ получения 2-(2-гидроксиэтил)семикарбазида реакцией (2-гидроксиэтил)гидразина с мочевиной [заявка на патент WO 9706250 А1, опубл. 20.02.1997].
Известны также способы получения некоторых 2-алкилсемикарбазидов, основанные на взаимодействии алкилгидразинов с триметилсилилизоцианатом [Szimhardt N. Methylsemicarbazide as a Ligand in Late 3d Transition Metal Complexes / Chemistry a European Journal, 2018, V. 24, N. 11, pp. 2687-2698; заявки на патент: WO 2014086478 Al (опубл. 12.06.2014), WO 2014154828 Al (опубл. 02.10.2014), WO 2012002096 Al (опубл. 05.01.2012), WO 2011036280 Al (опубл. 31.03.2011), US 20030119670 Al (опубл. 26.06.2003)] или с циановой кислотой, генерированной действием кислот Бренстеда на цианаты щелочных металлов [Ottersbach Р.А. et al. Induction of chirality: experimental evidence of atropisomerism in azapeptides / Chemical Communication, 2012, V. 48, pp. 5772-5774; Argentine M.D. et al. The role of new technologies in defining a manufacturing process for PRARI Agonoist LY518674 / Organic Process Research & Development, 2009, V. 13, pp. 131-143; Gever G. et al. Chemotherapeutic Nitrofurans. I. Some Derivatives of 3-Amino-2-oxazolidone / Journal of the American Chemical Society, 1955, V. 77, N. 8, pp. 2277-2281; Bruning G. Ann., 1889, V 253, pp. 10-11; Hale W.J. et al. Four-membered cyclic ureas. III. The condensation of isocyanic acid with alkyl schiff bases and related compounds / Journal of the American Chemical Society, 1920, V. 42, N. 1, pp. 107-116; заявки на патент: WO 2011018454 Al (опубл. 17.02.2011), WO 9847869 Al (опубл. 29.10.1998), US 20030119670 Al (опубл. 26.06.2003); патенты: DE 4416868 Al (опубл. 17.11.1994), GB 757822 А (опубл. 26.09.1956), US 2779786 Al (опубл. 29.01.1957)].
2-Метилсемикарбазид был синтезирован реакцией метилгидразона бензальдегида с фосгеном и далее с аммиаком с последующим удалением бензилиденовой защиты путем кислотного гидролиза [патент GB 898419 А, опубл. 06.06.1962].
Известен также способ получения одного производного 2-бензилсемикарбазида, основанный на алкилировании аминогруппы трет-бутоксикарбонилгидразина с последующей последовательной обработкой полученного продукта трифосгеном, аммиаком, раствором НСl в метаноле (для удаления Вос-защиты), водным раствором NaHCO3 [заявка на патент WO 2016096936 А1, опубл. 23.06.2016].
Описан также метод синтеза метансульфоната 2-(4-метилбензил)семикарбазида, включающий превращение трет-бутоксикарбонилгидразина реакцией с 4-метилбензальдегидом в соответствующий Вос-защищенный гидразон, который восстанавливают водородом над платиной в дизамещенный гидразин, обрабатывают триметилсилилизоцианатом и, наконец, удаляют Вос-защиту действием метансульфокислоты [Braden Т.М. et al. A Convergent Kilogram-Scale Synthesis of the PPARα Agonist LY518674: Discovery of a Novel Acid-Mediated Triazolone Synthesis / Organic Process Research & Development, 2007, V. 11, N. 3, pp. 431-440; заявка на патент WO 2002038553 A2, опубл. 16.05.2002].
Таким образом, все описанные выше способы получения 2-алкилсемикарбазидов включают формирование семикарбазидного фрагмента либо из алкилмочевин путем образования связи N-N, либо из алкилгидразинов или их производных путем образования связи C-N с использованием реакции ацилирования.
Наиболее близким аналогом к заявляемому способу, который выбран в качестве прототипа, является [патент BE 821084 R, опубл. 03.02.1975] способ получения 2-{3-[4-(3-хлорфенил)пиперазин-1-ил]проп-1-ил}семикарбазида - полупродукта синтеза фармакологически активного производного 1,2,4-триазолин-5-она. Способ заключается во введении соответствующей алкильной группы во второе положение семикарбазида. Согласно этому способу на первой стадии получают семикарбазид бензальдегида, который далее депротонируют под действием амида натрия в кипящем 1,4-диоксане в течение 1 часа и алкилируют с использованием 3-[4-(3-хлорфенил)пиперазин-1-ил]пропилхлорида (1,4-диоксан, кипячение, 18 часов). На последней стадии полученный N2-замещенный семикарбазон подвергают кислотному гидролизу (вода, щавелевая кислота, кипячение) с отгонкой образующегося бензальдегида с водяным паром.
Следует отметить, что в цитируемом патенте не приводится время реакции на последней стадии, а также условия выделения и очистки целевого семикарбазида. Кроме этого, отсутствует выход продукта алкилирования семикарбазона и выход конечного семикарбазида. Можно предположить, что эти выходы достаточно малы.
Действительно, известно, что кислотно-катализируемый гидролиз семикарбазонов ароматических альдегидов протекает с большим трудом и сопровождается образованием гидразинов - продуктов последующего гидролиза семикарбазидов. Так, в работе [Hale W.J. et al. Four-membered cyclic ureas. III. The condensation of isocyanic acid with alkyl schiff bases and related compounds / Journal of the American Chemical Society, 1920, V. 42, N. 1, pp. 107-116] не удалось получить 2-бензилсемикарбазид гидролизом 2-бензилсемикарбазона бензальдегида (вода, НСl, кипячение, отгонка банзальдегида с водяным паром). Вместо ожидаемого соединения из реакционной массы был выделен только гидрохлорид бензилгидразина.
Помимо неполноты и неопределенности описания, к недостаткам способа-прототипа следует также отнести жесткие условия реакций алкилирования и гидролиза, существенная времязатратность и трудоемкость процесса синтеза, использование токсичного амида натрия в качестве основания. Кроме того, этот метод был использован для синтеза лишь одного 2-алкилзамещенного семикарбазида, что оставляет открытым вопрос об его универсальности.
В настоящем изобретении заявляется подход к синтезу 2-алкилзамещенных семикарбазидов формулы (I) или их гидрохлоридов формулы (II), основанный на алкилировании семикарбазида по второму положению, со значительным положительным техническим результатом, заключающимся в универсальности этого подхода, простоте выполнения отдельных стадий процесса, низкой трудоемкости, мягких условиях реакций, достаточно высоких выходах продуктов на всех стадиях процесса, использовании в качестве основания гидрида натрия, являющегося более удобным в использовании и менее токсичным по сравнению с амидом натрия.
Указанный технический результат достигается способом, который включает следующие стадии:
а) реакцию коммерчески доступного гидрохлорида семикарбазида с ацетоном в присутствии ацетата натрия в воде при комнатной температуре с получением семикарбазона ацетона (III), который в ходе реакции выпадает в осадок и легко выделяется с выходом 83% операцией фильтрации в практически чистом виде;
б) проводят депротонирование группы N2-H семикарбазона ацетона (III) под действием оснований в различных растворителях при перемешивании при комнатной температуре. Среди опробованных оснований (DBU, К2СО3, EtONa, NaH и др.) и растворителей (EtOH, MeCN, ТГФ, толуол). Наиболее эффективным является использование эквивалентного количества гидрида натрия в сухом ацетонитриле. В оптимальных условиях депротонирование завершается в течение 1 часа при комнатной температуре с образованием натриевой соли семикарбазона ацетона (IV);
в) полученную натриевую соль семикарбазона ацетона (IV) без выделения и в том же растворителе (ацетонитриле) подвергают алкилированию по атому азота N2 под действием подходящих алкилирующих реагентов. Так, для введения метальной группы наилучший результат достигается при использовании эквивалентного количества диметилсульфата в качестве алкилирующего средства, при этом реакцию проводят в течение 17 часов при комнатной температуре. Для введения других алкильных групп (этильной, пропильной, бутильной и т.д.) следует использовать 5-10-ти кратный мольный избыток соответствующего алкилбромида, для введения замещенной алкильной группы (например, бензильной) целесообразно применять эквивалентное количество соответствующего бромида, при этом все реакции проводят при кипячении в ацетонитриле в течение 9 часов;
г) полученные 2-алкилзамещенные семикарбазоны (V) без промежуточного выделения и очистки подвергают кислотному гидролизу. С этой целью реакционные массы после окончания алкилирования фильтруют от осадков солей, растворитель удаляют в вакууме при температуре бани до 40°С, к остаткам добавляют 17-36% соляную кислоту в количестве 5-10 эквивалентов НСl на 1 эквивалент семикарбазона и полученные растворы сразу же упаривают в вакууме при температуре бани до 60°С. Твердые остатки, представляющие собой гидрохлориды 2-алкилзамещенных семикарбазидов формулы (II), растирают с изопропиловым спиртом, осадки отфильтровывают и высушивают;
д) для выделения свободных оснований формулы (I) гидрохлориды 2-алкилзамещенных семикарбазидов формулы (II), полученные на предыдущей стадии, обрабатывают небольшим избытком карбоната натрия (Na2CO3) в воде с последующей экстракцией продукта этилацетатом, отгонкой растворителя из объединенного экстракта, растиранием остатка с петролейным эфиром до кристаллизации.

Осуществление предлагаемого изобретения и достижение технического результата иллюстрируется примерами 1-6.
Пример 1. Гидрохлорид 2-метилсемикарбазида (II, R=СН3).
К суспензии NaH (0.319 г, 13.28 ммоль) в сухом MeCN (10 мл) добавляют (1.458 г, 12.67 ммоль) семикарбазона ацетона (III). Полученную суспензию перемешивают в течение 40 минут, добавляют раствор диметилсульфата (1.692 г, 13.41 ммоль) в сухом MeCN (10 мл) и перемешивают при комнатной температуре в течении 17 ч. Далее осадок отфильтровывают, маточный раствор упаривают, к остатку добавляют 8 мл 36% раствора соляной кислоты, образовавшийся раствор упаривают в вакууме при температуре бани до 60°С. Твердый остаток растирают с изопропиловым спиртом до образования суспензии, охлаждают до 0°С, осадок отфильтровывают, промывают охлажденным изопропиловым спиртом, петролейным эфиром, высушивают. Получают 1.150 г (72%) гидрохлорида 2-метилсемикарбазида. Аналитически чистый образец получен перекристаллизацией из смеси i-PrOH-EtOH (2:1). Т. пл. 135.5-136°С (с разлож.).
Вычислено, %: С 19.13, Н 6.42, N 33.47. C2H8ClN3O. Найдено, %: С 19.41, Н 6.69, N 33.72.
Спектр 1Н ЯМР (300.13 МГц, ДМСО-d6) δ, м.д.: 10.26 (3Н, уш.с, NH3+), 6.95 (2Н, с, NH2), 3.13 (3Н, с, СН3).
Спектр 13С ЯМР (75.48 МГц, ДМСО-d6) δ, м.д.: 158.7 (С=O), 36.6 (СН3).
ИК спектр (вазелиновое масло), ν, см-1: 3355 (уш.с), 3197 (уш.с), 3176 (уш.с), 2729 (уш.с), 2654 (уш.с), 2540 (уш.с), 1689 (с), 1613 (уш.с), 1592 (уш.с), 1573 (уш.с), 1533 (уш.с), 1515 (уш.с), 1293 (ср), 1245 (ср), 1097 (с), 1020 (с), 762 (ср), 610 (ср), 565 (уш.с), 537 (уш.с), 458 (с).
Пример 2. Гидрохлорид 2-этилсемикарбазида (II, R=С2Н5).
К суспензии NaH (0.092 г, 3.84 ммоль) в сухом MeCN (10 мл) добавляют (0.421 г, 3.66 ммоль) семикарбазона ацетона (III). Полученную суспензию перемешивают в течение 1 часа, добавляют раствор этилбромида (4.100 г, 37.63 ммоль) в MeCN (5 мл) и кипятят при перемешивании в течении 9 часов. Далее осадок отфильтровывают, маточный раствор упаривают, к остатку добавляют 3 мл 17% раствора соляной кислоты, образовавшийся раствор упаривают в вакууме при температуре бани до 60°С. Твердый остаток растирают в смеси изопропилового спирта и диэтилового эфира до образования суспензии, охлаждают до 0°С, осадок отфильтровывают, промывают холодным изопропиловым спиртом, холодным диэтиловым эфиром, петролейным эфиром, высушивают. Получают 0.326 г (71%) гидрохлорида 2-этилсемикарбазида. Аналитически чистый образец получен перекристаллизацией из смеси i-PrOH-EtOH (2:1). Т. пл. 127-127.5°С (с разлож.).
Вычислено, %: С 25.81, Н 7.22, N 30.10. C3H10ClN3O. Найдено, %: С 25.57, Н 7.25, N 30.12.
Спектр 1Н ЯМР (300.13 МГц, ДМСО-d6) δ, м.д.: 10.22 (3Н, уш.с, NH3+), 6.91 (2Н, с, NH2), 3.61 (2Н, кв., 3JCH2,CH3=7.0 Гц, СН2), 1.10 (3Н, т, 3JCH3,CH2=7.0 Гц, СН3).
Спектр 13С ЯМР (75.48 МГц, ДМСО-d6) δ, м.д.: 157.6 (С=O), 43.7 (СН2), 11.5 (СН3).
ИК спектр (вазелиновое масло), ν, см-1: 3357 (уш.с), 3198 (уш.с), 3176 (уш.с), 3045 (уш.с), 2679 (уш.с), 2620 (уш.с), 2357 (уш.ср), 1679 (с), 1620 (уш.с), 1592 (уш.с), 1530 (уш.с), 1197 (ср), 1091 (с), 1039 (с), 948 (ср), 799 (ср), 762 (ср), 605 (ср), 536 (уш.ср), 503 (уш.ср), 472 (уш.ср), 432 (уш.ср).
Пример 3. Гидрохлорид 2-пропилсемикарбазида (II, R=н-С3Н7).
К суспензии NaH (0.093 г, 3.88 ммоль) в сухом MeCN (10 мл) добавляют (0.407 г, 3.53 ммоль) семикарбазона ацетона (III). Полученную суспензию перемешивают в течение 1 часа, добавляют раствор пропилбромида (2.171 г, 17.65 ммоль) в MeCN (5 мл) и кипятят при перемешивании в течении 9 часов. Далее осадок отфильтровывают, маточный раствор упаривают, к остатку добавляют 2.9 мл 17% раствора соляной кислоты, образовавшийся раствор упаривают в вакууме при температуре бани до 60°С. Твердый остаток растирают в смеси изопропилового спирта и диэтилового эфира до образования суспензии, охлаждают до 0°С, осадок отфильтровывают, промывают холодным изопропиловым спиртом, холодным диэтиловым эфиром, петролейным эфиром, высушивают. Получают 0.382 г (71%) гидрохлорида 2-пропилсемикарбазида. Аналитически чистый образец получен перекристаллизацией из смеси i-PrOH-EtOH (2:1). Т. пл. 129-129.5°С (с разлож.).
Вычислено, %: С 31.28, Н 7.87, N 27.36. C4H12ClN3O. Найдено, %: С 31.34, Н 8.14, N 27.29.
Спектр 1Н ЯМР (300.13 МГц, ДМСО-d6) δ, м.д.: 10.24 (3Н, уш.с, NH3+), 6.89 (2Н, с, NH2), 3.49 (2Н, т, 3J=7.7 Гц, NCH2), 1.47-1.65 (2Н, м, СH2СН3), 0.82 (3Н, т, 3J=7.4 Гц, СН3).
Спектр 13С ЯМР (75.48 МГц, ДМСО-d6) δ, м.д.: 157.5 (С=O), 50.1 (NCH2), 19.4 (СН2), 10.5 (СН3).
ИК спектр (вазелиновое масло), ν, см-1: 3327 (уш.с), 3200 (уш.с), 3105 (уш.с), 2700 (уш.с), 2644 (уш.с), 2561 (уш.с), 1702 (с), 1613 (с), 1555 (уш.с), 1528 (уш.с), 1267 (ср), 1206 (с), 1082 (уш.с), 1065 (уш.с), 901 (ср), 767 (с), 748 (с), 567 (уш.с), 433 (ср).
Пример 4. Гидрохлорид 2-бутилсемикарбазида (II, R=н-C4H9).
К суспензии NaH (0.101 г, 4.21 ммоль) в сухом MeCN (13 мл) добавляют (0.463 г, 4.02 ммоль) семикарбазона ацетона (III). Полученную суспензию перемешивают в течение 1 часа, добавляют раствор бутилбромида (5.506 г, 40.18 ммоль) в MeCN (7 мл) и кипятят при перемешивании в течении 9 часов. Далее осадок отфильтровывают, маточный раствор упаривают, к остатку добавляют 3.2 мл 17% раствора соляной кислоты, образовавшийся раствор упаривают в вакууме при температуре бани до 60°С. Твердый остаток растирают в смеси изопропилового спирта и диэтилового эфира до образования суспензии, охлаждают до 0°С, осадок отфильтровывают, промывают холодным изопропиловым спиртом, холодным диэтиловым эфиром, петролейным эфиром, высушивают. Получают 0.398 г (59%) гидрохлорида 2-бутилсемикарбазида. Аналитически чистый образец получен перекристаллизацией из i-PrOH. Т. пл. 133.5-134°С (с разлож.).
Вычислено, %: С 35.82, Н 8.42, N 25.07. C5H14ClN3O. Найдено, %: С 35.84, Н 8.31, N 25.11.
Спектр 1H ЯМР (300.13 МГц, ДМСО-d6) δ, м.д.: 10.20 (3Н, уш.с, NH3+), 6.87 (2Н, с, NH2), 3.53 (2Н, т, 3J=7.7 Гц NCH2), 1.45-1.59 (2Н, м, 3J=7.7 Гц, С(2)Н2), 1.16-1.32 (2Н, м, 3J=7.3 Гц, С(3)Н2), 0.87 (3Н, т, 3J=7.3 Гц СН3).
Спектр 13С ЯМР (75.48 МГц, ДМСО-d6) δ, м.д.: 157.6 (С=O), 48.4 (C(1)H2), 28.1 (С(2)Н2), 19.0 (С(3)Н2), 13.7 (СН3).
ИК спектр (вазелиновое масло), ν, см-1: 3342 (уш.с), 3180 (уш.с), 2730 (уш.с), 2653 (уш.с), 2594 (уш.с), 2569 (уш.с), 1670 (с), 1626 (уш.с), 1597 (уш.с), 1560 (уш.с), 1191 (ср), 1108 (уш.ср), 1086 (уш.ср), 1061 (ср), 941 (ср), 759 (ср), 738 (ср), 609 (ср), 542 (уш.с), 462 (ср).
Пример 5.2-Октилсемикарбазид (I, R=С8Н17).
К суспензии NaH (0.098 г, 4.06 ммоль) в сухом MeCN (13 мл) добавляют (0.446 г, 3.87 ммоль) семикарбазона ацетона (III). Полученную суспензию перемешивают в течение 1 часа, добавляют раствор октилбромида (3.741 г, 19.37 ммоль) в MeCN (7 мл) и кипятят при перемешивании в течении 9 часов. Далее осадок отфильтровывают, маточный раствор упаривают, к остатку добавляют 3.2 мл 17% раствора соляной кислоты, образовавшийся раствор упаривают в вакууме при температуре бани до 60°С. К остатку приливают 5 мл Н2O и нейтрализуют Na2CO3 (1.789 г, 21.29 ммоль), образовавшуюся суспензию перемешивают до прекращения выделения газа. Далее экстрагируют этилацетатом (4×3 мл), экстракт упаривают до маслообразного остатка, который растирают в петролейном эфире в суспензию, смесь охлаждают до 0°С, осадок отфильтровывают, промывают петролейным эфиром, высушивают, промывают 2 раза Et2O. Получают 0.421 г (58%) 2-октилсемикарбазида. Аналитически чистый образец получен перекристаллизацией из смеси ЕtOH-Н2O (1:3). Т. пл. 72-72.5°С.
Вычислено, %: С 57.72, Н 11.30, N 22.44. C9H21N3O. Найдено, %: С 57.73, Н 11.47, N 22.55.
Спектр 1Н ЯМР (300.13 МГц, ДМСО-d6) δ, м.д.: 5.89 (2Н, уш.с, N(1)H2), 4.33 (2Н, с, N(2)H2), 3.29 (2Н, т, 3J=7.3 Гц, NCH2), 1.40-1.54 (2Н, т.т, 3J=7.3 Гц, 3J=7.0 Гц, С(2)Н2), 1.13-1.35 (10Н, м, С(3)Н2, С(4)Н2, С(5)Н2, С(6)Н2, С(7)Н2,), 0.86 (3Н, т, 3J=6.7 Гц, СН3).
Спектр 13С ЯМР (75.48 МГц, ДМСО-d6) δ, м.д.: 160.0 (С=O), 48.2 (C(1)H2), 31.2 (С(2)Н2), 28.8 (С(3)Н2), 28.7 (С(4)Н2), 26.2 (С(5)Н2), 22.1 (C(6)H2), 22.0 (С(7)Н2), 13.9 (СН3).
ИК спектр (вазелиновое масло), ν, см-1: 3472 (с), 3322 (с), 3210 (с), 1648 (уш.с), 1615 (уш.с), 1568 (уш.с), 1107 (с), 1072 (ср), 948 (уш.ср), 722 (ср), 494 (уш.ср).
Пример 6. Гидрохлорид 2-бензилсемикарбазида (II, R=СН2С6H5).
К суспензии NaH (0.380 г, 15.84 ммоль) в сухом MeCN (15 мл) добавляют (1.740 г, 15.11 ммоль) семикарбазона ацетона (III). Полученную суспензию перемешивают в течение 1 часа, добавляют раствор бензилбромида (2.730 г, 15.96 ммоль) в MeCN (10 мл) и кипятят при перемешивании в течении 6.5 часов. Далее осадок отфильтровывают, маточный раствор упаривают, к остатку добавляют 14.5 мл 36% раствора соляной кислоты, образовавшийся раствор упаривают в вакууме при температуре 60°С. Твердый остаток растирают с изопропиловым спиртом до образования суспензии, охлаждают до 0°С, осадок отфильтровывают, промывают холодным изопропиловым спиртом, холодным диэтиловым эфиром, петролейным эфиром, высушивают. Получают 1.816 г (60%) гидрохлорида 2-бензилсемикарбазида. Аналитически чистый образец получен перекристаллизацией из ЕtOH. Т. пл. 139-139.5°С (с разлож.).
Вычислено, %: С 47.63, Н 6.00, N 20.84. C8H12ClN3O. Найдено, %: С 47.41, Н 6.18, N 20.87.
Спектр 1H ЯМР (300.13 МГц, ДМСО-d6) δ, м.д.: 9.88 (3Н, уш.с, NH3+), 7.29-7.43 (5Н, м, СН(аром)), 7.05 (2Н, уш.с, NH2), 4.84 (2Н, с, СН2).
Спектр 13С ЯМР (75.48 МГц, ДМСО-d6) δ, м.д.: 157.6 (С=O), 135.4 (С(аром)), 128.6 (2 С(аром)), 128.1 (2 С(аром)), 127.9 (С(аром)), 51.7 (СН2).
ИК спектр (вазелиновое масло), ν, см-1: 3330 (уш.с), 3302 (уш.с), 3161 (уш.с), 2765 (уш.с), 2683 (уш.с), 2573 (уш.с), 1674 (с), 1616 (уш.с), 1587 (уш.с), 1551 (уш.с), 1234 (уш.с), 1201 (уш.с), 1153 (уш.с), 1085 (с), 1038 (с), 930 (ср), 770 (ср), 747 (с), 700 (с), 633 (с), 593 (уш.с), 528 (с), 470 (с).
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные 1,4-диоксида хиноксалин-2-карбонитрила, ингибирующие рост опухолевых клеток | 2016 |
|
RU2640304C1 |
| СПОСОБ ИНГИБИРОВАНИЯ ОПУХОЛЕВЫХ КЛЕТОК НОВЫМИ ПРОИЗВОДНЫМИ 3-ТРИФТОРМЕТИЛХИНОКСАЛИН 1,4-ДИОКСИДА | 2020 |
|
RU2746395C1 |
| Флуоресцентно-меченые дезоксиуридинтрифосфаты | 2016 |
|
RU2637310C1 |
| ГИДРОГАЛОГЕНИДЫ 11-[(4-ТРЕТ-БУТИЛФЕНОКСИ)ЭТИЛ]- И 11-БЕНЗИЛЗАМЕЩЁННЫХ 2,3,4,5-ТЕТРАГИДРО[1,3]ДИАЗЕПИНО[1,2-A]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АЛЬФА-ГЛЮКОЗИДАЗА ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2015 |
|
RU2602504C1 |
| Новые производные гелиомицина и фармацевтические композиции на их основе, ингибирующие опухолевый рост | 2018 |
|
RU2670763C1 |
| Применение 3-ароил-4-[2-(гидроксиметил)-фениламино]-6',6'-диметил-1'-(3-фторфенил)-6',7'-дигидро-5Н-спиро[фуран-2,3'-индол]-2',4',5(1'Н,5'Н)-трионов в качестве средства, обладающего антиоксидантной активностью | 2023 |
|
RU2806189C1 |
| Гидроксамовые кислоты, производные 4-аминохиназолина, обладающие противоопухолевой активностью | 2022 |
|
RU2802463C1 |
| 8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения | 2017 |
|
RU2643363C1 |
| 5-(4'-ГИДРОКСИФЕНИЛ)- И 5-(2',5'-ДИГИДРОКСИФЕНИЛ)-6Н-1,3,4-ТИАДИАЗИН-2-АМИНЫ, ГИДРОГАЛАГЕНИДЫ, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ ПРИ ВНУТРИВЕННОМ ВВЕДЕНИИ | 2009 |
|
RU2458060C2 |
| 1,3-ДИЗАМЕЩЕННЫЕ 2-ИМИНОБЕНЗИМИДАЗОЛИНА, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2423355C2 |
Изобретение относится к области органической химии, а именно к способу получения 2-алкилзамещенных семикарбазидов формулы (I) или их гидрохлоридов формулы (II), где R = алкил или замещенный алкил. Способ заключается в непрямом алкилировании незамещенного семикарбазида по атому азота N2 и включает стадии а)-д). На стадии а) проводят реакцию гидрохлорида семикарбазида с ацетоном в присутствии ацетата натрия в воде с получением семикарбазона ацетона, который в ходе реакции выпадает в осадок и выделяется операцией фильтрации. На стадии б) семикарбазон ацетона депротонируют действием эквивалентного количества гидрида натрия при перемешивании в сухом ацетонитриле в течение 1 ч при комнатной температуре. На стадии в) полученную натриевую соль семикарбазона ацетона без выделения и в том же растворителе - ацетонитриле - подвергают алкилированию по атому азота N2 под действием подходящих алкилирующих реагентов, при этом: (i) для введения метильной группы используют эквивалентное количество диметилсульфата и реакцию проводят в течение 17 ч при комнатной температуре; (ii) для введения других алкильных групп, кроме метильной, используют 5-10-кратный мольный избыток соответствующего алкилбромида и реакцию проводят при кипячении в ацетонитриле в течение 9 ч; (iii) для введения замещенной алкильной группы применяют эквивалентное количество соответствующего бромида и реакцию проводят при кипячении в ацетонитриле в течение 9 ч. На стадии г) полученные 2-алкилзамещенные семикарбазоны без промежуточного выделения и очистки подвергают кислотному гидролизу, для чего реакционные массы после окончания алкилирования фильтруют от осадков солей, растворитель удаляют в вакууме при температуре бани до 40°С, к остаткам добавляют 17-36%-ную соляную кислоту в количестве 5-10 эквивалентов HCl на 1 эквивалент семикарбазона и полученные растворы сразу же упаривают в вакууме при температуре бани до 60°С. При этом твердые остатки, представляющие собой гидрохлориды 2-алкилзамещенных семикарбазидов формулы (II), растирают с изопропиловым спиртом, осадки отфильтровывают и высушивают. На стадии д) для получения 2-алкилзамещенных семикарбазидов формулы (I) обрабатывают гидрохлориды 2-алкилзамещенных семикарбазидов формулы (II), полученные на предыдущей стадии, небольшим избытком карбоната натрия в воде с последующей экстракцией продукта этилацетатом, отгонкой растворителя из объединенного экстракта, растиранием остатка с петролейным эфиром до кристаллизации. Предлагаемый способ является универсальным, простым и позволяет в мягких условиях получать целевые продукты с высоким выходом. 6 пр.
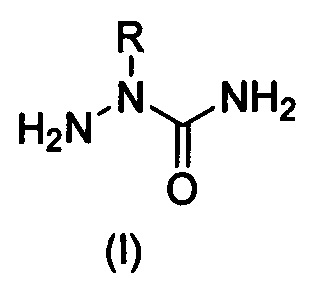
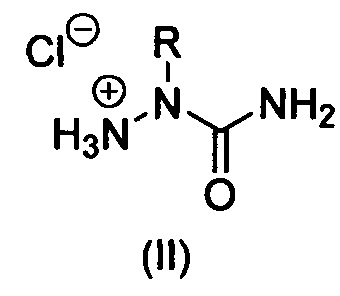
Способ получения 2-алкилзамещенных семикарбазидов формулы (I) или их гидрохлоридов формулы (II)
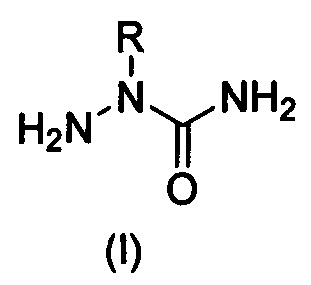
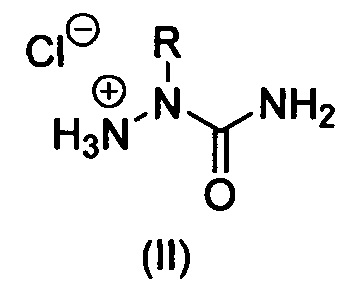 , где R = алкил или замещенный алкил, заключающийся в непрямом алкилировании незамещенного семикарбазида по атому азота N2, отличающийся тем, что включает следующие стадии:
, где R = алкил или замещенный алкил, заключающийся в непрямом алкилировании незамещенного семикарбазида по атому азота N2, отличающийся тем, что включает следующие стадии:
а) проводят реакцию гидрохлорида семикарбазида с ацетоном в присутствии ацетата натрия в воде с получением семикарбазона ацетона, который в ходе реакции выпадает в осадок и выделяется операцией фильтрации;
б) полученный семикарбазон ацетона депротонируют действием эквивалентного количества гидрида натрия при перемешивании в сухом ацетонитриле в течение 1 ч при комнатной температуре;
в) полученную натриевую соль семикарбазона ацетона без выделения и в том же растворителе - ацетонитриле - подвергают алкилированию по атому азота N2 под действием подходящих алкилирующих реагентов, при этом: (i) для введения метильной группы используют эквивалентное количество диметилсульфата и реакцию проводят в течение 17 ч при комнатной температуре; (ii) для введения других алкильных групп, кроме метильной, используют 5-10-кратный мольный избыток соответствующего алкилбромида и реакцию проводят при кипячении в ацетонитриле в течение 9 ч; (iii) для введения замещенной алкильной группы применяют эквивалентное количество соответствующего бромида и реакцию проводят при кипячении в ацетонитриле в течение 9 ч;
г) полученные 2-алкилзамещенные семикарбазоны без промежуточного выделения и очистки подвергают кислотному гидролизу, для чего реакционные массы после окончания алкилирования фильтруют от осадков солей, растворитель удаляют в вакууме при температуре бани до 40°С, к остаткам добавляют 17-36%-ную соляную кислоту в количестве 5-10 эквивалентов HCl на 1 эквивалент семикарбазона и полученные растворы сразу же упаривают в вакууме при температуре бани до 60°С, при этом твердые остатки, представляющие собой гидрохлориды 2-алкилзамещенных семикарбазидов формулы (II), растирают с изопропиловым спиртом, осадки отфильтровывают и высушивают;
д) для получения 2-алкилзамещенных семикарбазидов формулы (I) обрабатывают гидрохлориды 2-алкилзамещенных семикарбазидов формулы (II), полученные на предыдущей стадии, небольшим избытком карбоната натрия в воде с последующей экстракцией продукта этилацетатом, отгонкой растворителя из объединенного экстракта, растиранием остатка с петролейным эфиром до кристаллизации.
| Система отбраковки листов | 1978 |
|
SU821084A1 |
| ФОНД ЭНСПЕРТв! | 0 |
|
SU395363A1 |
Авторы
Даты
2018-10-24—Публикация
2018-07-19—Подача