Область техники, к которой относится изобретение
Изобретение относится к области химии нуклеиновых кислот, а именно к новым модифицированным нуклеотидам - флуоресцентно-меченым дезоксиуридинтрифосфатам. Изобретение включает в себя синтез нуклеотидов, модифицированных по С5-положению пиримидинового цикла, а также их использование для анализа нуклеиновых кислот (ДНК).
Уровень техники
Анализ нуклеиновых кислот используется как для проведения широкого круга исследований в разных областях науки, так и для клинической диагностики, фармакологии, медицины, биотехнологии и др. Введение маркеров, визуализирующих синтезируемую ДНК, позволяет изучать процессы взаимодействия исследуемой ДНК с различными мишенями: ДНК, РНК, белками, низкомолекулярными соединениями. Флуоресцентное маркирование нуклеиновых кислот является одним из способов выявления результатов гибридизационного анализа, в частности, в технологии биологических микрочипов, в микроскопической цитометрии, в проточном цитометрическом сортинге и т.д. Во всех этих методах анализируемую ДНК первоначально выявляют с помощью комплементарной ей нуклеиновой кислоты. Затем количество образовавшихся дуплексов измеряют по интенсивности флуоресценции метки, связанной с одним из компонентов дуплекса.
Введение флуоресцентно-меченых нуклеотидов при помощи ДНК-полимераз нашло широкое применение для маркирования генов и ДНК. Пробы с высокой плотностью меток позволяют повысить чувствительность анализа. Полимеразная цепная реакция является удобным методом для маркирования и амплификации ДНК с высокой плотностью флуорофоров с образованием флуоресцентно-меченых нуклеотидов, являющихся субстратами для ДНК-полимераз в ходе ПЦР. Однако использование флуоресцентно-меченых нуклеотидов имеет некоторые ограничения, поскольку большинство ферментов плохо распознают модифицированные нуклеотиды. Эффективность маркирования также сильно зависит от типа красителя в модифицированных нуклеотидах.
Известно, что С5-положение пиримидинового цикла лучше всего подходит для модификации нуклеотидов, поскольку ориентировано в широкую бороздку двунитевых ДНК и не ингибирует взаимодействие А-Т оснований. Функциональные маркеры, такие как флуорофоры, ферменты, лиганды, например биотин, присоединяют к С5-положению пиримидинового основания через линкер с аминогруппой (Tester J.К. et al., Synthesis and characterization of DNA oligomers and duplexes containing covalently attached molecular labels: comparison of biotin, fluorescein, and pyrene labels by thermodynamic and optical spectroscopic measurements, J. Am. Chem. Soc, 1989, vol. 111, pp. 6966-6976). Зачастую модифицированные ДНК получают, используя ДНК-синтезаторы (Ketomaki К. et al., Hybridization properties of support-bound oligonucleotides: the effect of the site of immobilization on the stability and selectivity of duplex formation, Bioconjugate Chem., 2003, vol. 14, pp. 811-816).
Однако если ДНК-полимеразы могут воспринять модифицированные нуклеотиды в качестве субстратов, то модифицированные ДНК получают энзиматически. Энзиматическое получение модифицированных ДНК, а именно меченых флуорофорами, представляет особый интерес. Сочетание полимеразной цепной реакции (ПЦР), позволяющей получить множество копий с исследуемой ДНК, с одновременным флуоресцентным маркированием представляется чрезвычайно важным.
Для проведения ПЦР используют смесь дезоксинуклеозидтрифосфатов, которая содержит dATP, dGTP, dCTP и dTTP, причем вместо dTTP может использоваться dUTP или смесь dTTP/dUTP в любой молярной пропорции. Любой из указанных дезоксинуклеозидтрифосфатов может нести флуоресцентную метку (патент США №6589737, Compositions and methods for labeling of nucleic acid molecules, 08.07.2003). Наиболее предпочтительно использование флуоресцентно-меченого дезоксиуридинтрифосфата, что, с одной стороны, обусловливает эффективное включение данного субстрата во вновь синтезированную цепь ДНК в процессе ПЦР, с другой - обеспечивает возможность предотвращать получение ложных результатов за счет перекрестной кросс-контаминации ампликонами путем использования на первой стадии фермента урацил-ДНК-гликозилазы.
Эффективность включения в ДНК производных, несущих заместители в С5-положении пиримидинового цикла, зависит от нуклеотида, природы заместителя и вида ДНК-полимеразы (Kuwahara М. et al., Systematic characterization of 2'-deoxynucleoside-5'-triphosphate analogs as substrates for DNA polymerases by polymerase chain reaction and kinetic studies on enzymatic production of modified DNA, Nucleic Acids Res., 2006, vol. 34, №19, pp. 5383-5394).
Производные 2'-дезоксиуридина с пропинильной группой в С5-положении хорошие субстраты для Vent- и Taq-ДНК полимераз (Giller G. et al., Incorporation of reporter molecule-labeled nucleotides by DNA polymerases. I. Chemical synthesis of various reporter group-labeled 2'-deoxyribonucleoside-5'-triphosphates, Nucleic Acids Res. 2003, vol. 31, №10, pp. 2630-2635). Производные с пропенильной группой хорошие субстраты для Taq-ДНК полимеразы, но плохие для Vent- и Pfu-ДНК полимераз, а с пропильной группой очень плохие субстраты для Taq-ДНК полимеразы (Godovikova T.S. et al., 5-[3-(E)-(4-azido-2,3,5,6-tetrafluorobenzamido)propenyl-1]-2'-deoxyuridine-5'-triphosphate substitutes for thymidine-5'-triphosphate in the polymerase chain reaction, Bioconjugate Chem., 1999, vol. 10, pp. 529-537; Gourlain T. et al, Enhancing the catalytic repertoire of nucleic acids. II. Simultaneous incorporation of amino and imidazolyl functionalities by two modified triphosphates during PCR, Nucleic Acids Res., 2001, vol. 29, №9, pp. 1898-1905). Иными словами, для 2'-дезоксиуридина хорошими субстратами являются производные с жесткими линкерами, линкерами на основе этина (ацетилена) и Е-этена (этилена, трансизомеры), а плохими с гибкими линкерами, линкерами на основе этана и Z-этена (цис-изомеры). Для 2'-дезоксицитидина пропинильные С5-производные хорошие субстраты для Vent- и Taq-ДНК полимеразы.
Даже незначительная химическая модификация аминогруппы 5-аминоаллил-2'-дезоксиуридин-5'-трифосфата приводит к существенному различию включения ДНК-полимеразами в ПЦР продукт. Однако эффективность энзиматического включения зависит не только от заместителя, находящегося в непосредственной близости от Соположения пиримидинового цикла, но и от более отдаленного окружения. В публикации (Giller G. et al., Incorporation of reporter molecule-labeled nucleotides by DNA polymerases. I. Chemical synthesis of various reporter group-labeled 2'-deoxyribonucleoside-5'-triphosphates, Nucleic Acids Res. 2003, vol. 31, №10, pp. 2630-2635) показано, что эффективность включения флуоресцентно-меченых производных 5-аминоаллил-2'-дезоксиуридина-5'-трифосфата Vent(exo)-HHK полимеразой существенно зависит от природы флуорофора, присоединенного к аминогруппе линкера.
В качестве флуоресцентной метки может быть использован любой флуоресцентный краситель, который можно химически ввести в молекулу дезоксинуклеозидтрифосфата таким образом, чтобы не препятствовать в существенной степени прохождению полимеразной цепной реакции. В случае флуоресцентно-меченого дезоксиуридинтрифосфата, например, флуоресцентный краситель может быть присоединен к 5'-концу аминопропаргильного производного dUTP (Ranasinghe R.T. et al, Fluorescence based strategies for genetic analysis, Chem. Commun, 2005, pp. 5487-5502). Используют красители флуоресцеинового (TAMRA®, ROX®, JOE®), родаминового (Texas Red®), индоцианинового (Cy3®, Cy5®, Cy5.5®, Cy7®) рядов. Наиболее предпочтительными являются красители, спектр возбуждения которых лежит в длинноволновой (красной) области спектра с меньшей фоновой флуоресценцией, области «диагностического окна биологической ткани», что позволяет увеличить чувствительность анализа.
Индоцианиновые красители широко используются для получения флуоресцентно-меченых ДНК. Природа заместителей и места их связывания с флуорофорным ядром красителя влияют на яркость флуоресценции, растворимость, образование молекулярных агрегатов, как самого красителя, так и маркированных им нуклеиновых кислот. Ориентация флуорофорного ядра красителя относительно маркированного нуклеотида, длина и химическая природа линкера, отдаляющего флуорофор от маркированной ДНК, существенно сказываются на эффективности образования совершенных дуплексов с комплементарной ДНК, и в итоге сказываются на чувствительности биоанализа в целом. Индоцианины, содержащие различные заместители - алкильные-, сульфо-, сульфоалкильные, конденсированные арильные, известны давно. Каждый новый ряд индоцианиновых красителей служит основой для получения нового ряда флуоресцентно-меченных биологически-активных соединений и полупродуктов для их получения.
В публикации (Европейский патент №1152008, Fluorescent nucleotides containing а cyanine, merocyanine or styryl dye for the detection of nucleic acid, 07.11.2001) предложены флуоресцентно-меченые 5-аминоаллилдезоксиуридинтрифосфаты, содержащие в качестве маркеров индокарбо- и индодикарбоцианиновые красители с различными заместителями (сульфамид, хлор, гидроксил).
В публикации (Yu Н. et al., Cyanine dye dUTP analogs for enzymatic labeling of DNA probes, Nucleic Acids Res., 1994, vol. 22, №15, pp. 3226-3232) представлен синтез Cy5-dUTP и Cy3-dUTP, которые использовали для получения флуоресцентно-меченых фрагментов нуклеиновых кислот, используя методы ник-трансляции, «рандом-прайм» маркирование и ПЦР.
В публикации (Lacenere C.J. et al, Effects of a modified dye-labeled nucleotide spacer arm on incorporation by thermophilic DNA polymerases, Nucleosides, Nucleotides and Nucleic Acids, 2006, vol. 25, pp. 9-15) выявлено влияние длины линкера, соединяющего флуорофор и AAdUTP, на эффективность роста цепи синтетических праймеров в зависимости от используемых ДНК-полимераз. Показано, что длинный линкер приводит к более эффективной элонгации, и образуются продукты длиннее исходного праймера на 30-52 пар оснований, тогда как короткий линкер способствует образованию продуктов длиннее на 5-10 пар оснований.
В публикации (Европейский патент №1211294, Improved process and method for the preparation of asymmetric monofunctionalised indocyanine labelling reagents and obtained compounds, 05.06.2002) представлен синтез флуоресцентно-меченых сульфобензиндоцианиновыми красителями трифосфатов дезоксиуридина. В публикации (Европейский патент №1801165, Modified carbocyanine dyes and their conjugates, 27.06.2007) фирмой Molecular Probes предложены флуоресцентно-меченые 5-аминоаллил-и 5-аминопропаргилдезоксиуридинтрифосфаты, содержащие в качестве маркеров полисульфированные индоцианиновые красители с карбоксипентильным заместителем в положении 3 индоленинового фрагмента. Синтезированные соединения рекомендованы для ник-трансляции и метода in-vitro транскрипции.
В публикации (Европейский патент №1491591, New fluorescence cyanine labels containing a sulfamido linker arm, 29.12.2004) предложена общая методика получения флуоресцентно-меченых 5-аминопропаргилдезоксиуридин- и дезоксицитидинтрифосфатов на основе гидроксисукцинимидных эфиров цианиновых красителей с карбоксильной группой, присоединенной через сульфамидоалкильную цепь в положении 5, с различным числом метиленовых звеньев от 1 до 6. Авторы утверждают, что такого рода красители имеют явное преимущество перед их аналогами - с карбоксиалкильной группой в положениях 1 и 5. Присоединение карбоксильной функции через сульфамидную связь привело к увеличению жесткости молекулы, а вследствие этого и к улучшению флуоресцентных характеристик красителя.
В публикации (патент США №2004186278, Cyanine dye labelling reagents with meso-substitution, 23.09.2004) для получения флуоресцентно-меченого дезоксиуридинтрифосфата использовали цианиновый краситель с нитрильным заместителем в мезо-положении полиметиновой цепи.
Подход оценки эффективности энзиматического включения флуоресцентно-меченых производных нуклеотидов с помощью олигонуклеотидных биочипов в литературе не описан и представляется очень эффективным. Возможность одновременного наблюдения нескольких десятков сигналов в условиях кинетического и термодинамического контроля позволяет получать одновременно большой объем количественной информации, с большей достоверностью. Наличие большого числа примеров флуоресцентно-меченых производных 2'-дезоксиуридин-5'-трифосфата и количественная оценка на отработанных моделях биочипов позволят четко определить влияние различных структурных факторов на эффективность включения в ПЦР продукт.
Раскрытие изобретения
Целью изобретения явился синтез производных нуклеотидов, содержащих цианиновый краситель в положении С5, а также их применение для маркирования ДНК в ходе ПЦР. Получаемая при этом модифицированная ДНК приобретает новые свойства, обусловленные введенными модификациями, но должна специфично взаимодействовать с ДНК и белками. Наш подход основывается на синтезе индоцианиновых красителей, содержащих две гетероциклические кольцевые системы, связанные полиметиновой линкерной связью и содержащие карбоксильную группу в положении 3 или 5 индоленинового гетероцикла, присоединенную через полиметиленовую цепочку. Такими соединениями, предлагаемыми в данном изобретении, являются соединения общей формулы (I).
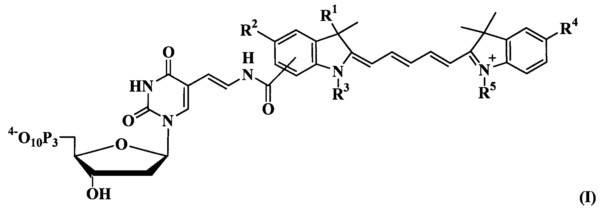
где R1 представляет собой -CH3; -(CH2)4СООН;
R2 представляет собой -(СН2)2СООН; -Н; -SO3-;
R3 представляет собой -С2Н5; -(CH2)4SO3-;
R4 представляет собой -Н; -SO 3-;
R5 представляет собой -С2Н5; -(CH2)4SO3-.
В частности, соединения, условно отнесенные к соединениям группы ТА, соответствующие общей формуле (ТА)
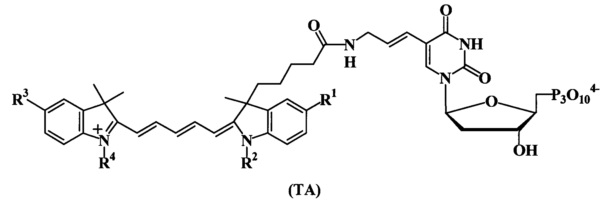
где R1 представляет собой -Н; -SO3-;
R2 представляет собой -C2H5;-(CH2)4SO3-;
R3 представляет собой -Н; -SO3-;
R4 представляет собой -С2Н5; -(CH2)4SO3-.
а также соединения, условно отнесенные к соединениям группы ТВ, соответствующие общей формуле (ТВ)
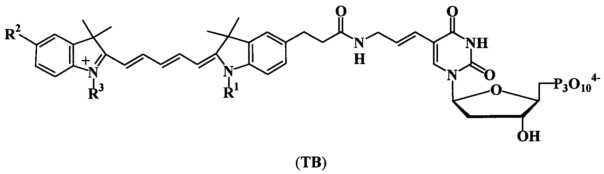
где R1 представляет собой -С2Н5; -(CH2)4SO3-;
R2 представляет собой -Н; -SO3-;
R3 представляет собой -С2Н5; -(CH2)4SO3-.
Предлагаемые флуоресцентно-меченые трифосфаты общей формулы (ТА) характеризуются тем, что реактивная карбоксильная группа индоцианиновых красителей общей формулы (А), входящих в их состав, присоединена в 3 положении индоленинового фрагмента через тетраметиленовую цепочку атомов (где R1, R2, R3, R4 - алкильные-, сульфо- и сульфоалкильные заместители).
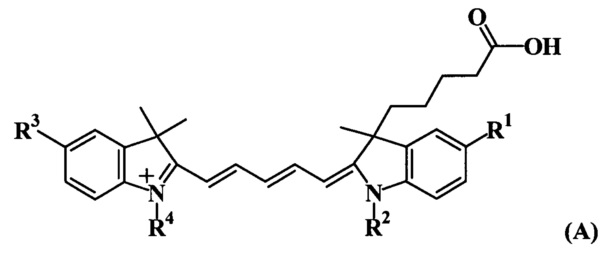
Предлагаемые флуоресцентно-меченые трифосфаты общей формулы (ТВ) характеризуются тем, что реактивная карбоксильная группа индоцианиновых красителей общей формулы (В), входящих в их состав, присоединена в 5 положении индоленинового фрагмента через диметиленовую цепочку атомов (где R1, R2, R3 - алкильные-, сульфо- и сульфоалкильные заместители).
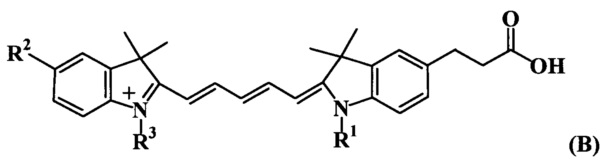
Указанные структурные отличия индоцианиновых красителей общих формул (А) и (В), входящих в состав нуклеозидтрифосфатов (ТА) и (ТВ), приводят к ряду отличительных свойств, а именно к повышенной светостойкости, повышенной химической устойчивости и термостойкости при использовании в качестве флуоресцентных меток.
Показано, что при непрерывном облучении на флуоресцентном микроскопе на длине волны 655 нм время полураспада красителей формул (А) и (В) различается: для красителя (А2) время полураспада составляет 7 ч, для красителей (Al), (В1) - 5,3 ч, для красителя (A3), (В2) - 6 ч, для красителя (А4) - 6,9 ч, в то время как для красителя, входящего в состав трифосфата общей формулы (I) (R1=-CH3; R2=R4=-H; R3=-(СН2)5СООН, R5=-C2H5) составляет 5,5 ч (Фиг. 1 линия №4), для красителя формулы (I) (R1=-CH3; R2=R5=-H, R3=-(СН2)5СООН, R4=-(CH2)4SO3-) составляет 1,5 ч (Фиг. 1 линия №6), для красителя формулы (I) (R1=-CH3; R2=-SO3-, R3=-(СН2)5СООН, R4=-(CH2)4SO3-) составляет 2,5 ч (Фиг. 1 линия №7).
Значения молярного коэффициента экстинкции красителей (А1) и (А2) превышают 240000, (В1) - около 200000 (таблица 1, Фиг. 2). Квантовый выход флуоресценции красителей (А1)-(А4) в метаноле превышает 25% (таблица 1, Фиг. 3).
Была определена относительная эффективность флуоресценции красителей общей формулы (А) и (В), при этом наибольшее значение эффективности получено для красителя (А2) при возбуждении и регистрации в максимумах поглощения и флуоресценции и принято за единицу (таблица 1, Фиг. 4). Были получены следующие данные:
- при возбуждении и регистрации в максимумах поглощения и флуоресценции значение относительной эффективности флуоресценции превышает 0.6 для красителей (А1)-(А4) в метаноле и для красителя (А2) в PBS;
- при возбуждении на длине волны 655 нм и регистрации на 690 нм значение относительной эффективности флуоресценции превышает 0.2 для красителя (А2) в метаноле и больше 0.1 в PBS.
Предлагаемые красители структур (А) и (В) в зависимости от заместителей в гетероциклическом фрагменте различаются спектральным диапазонам возбуждения и флуоресценции, суммарным электрическим зарядом и растворимостью в воде (таблица 1). Благодаря спектральным характеристикам в ближнем ИК-диапазоне, индодикарбоцианиновые красители формул (А) и (В) являются оптимальными для маркирования биомолекул, так как биоматериал в диапазоне длин волн между 600-800 нм имеет низкую собственную флуоресценцию. Введение меток в ДНК в виде флуоресцентно-меченых нуклеозидтрифосфатов общей формулы I на стадии наработки кДНК методом ПЦР позволяет добиться более высокой чувствительности, так как маркер вводится не в единственном числе, а в большем количестве вместе с нуклеотидами (Yu H. et al., Cyanine dye dUTP analogs for enzymatic labeling of DNA probes, Nucleic Acids Res., 1994, vol. 22, №15, pp. 3226-3232).
Далее представлены результаты использования красителей для получения флуоресцентно-меченых нуклеозидтрифосфатов с последующим их применением для маркирования ДНК в ходе ПЦР. Все красители общих формул (A1)-(А5) и (В1)-(B3) в виде их N-гидроксисукцинимидных эфиров (для (A) R1=-(CH2)4COOSu; для (В) R2=-(CH2)2COOSu) и пара-нитрофениловых эфиров (для (A) R1=-(CH2)4COOpNP; для (В) R2=-(CH2)2COOpNP) с хорошим выходом маркируют нуклеотиды, содержащие в С5-положении аминоаллильный заместитель.
Спектральные свойства флуоресцентно-меченых нуклеотидов общей формулы I представлены в таблице 2. Модифицированные нуклеотиды характеризуются интенсивными полосами поглощения и флуоресценции (Фиг. 5) и значениями квантового выхода флуоресценции 15-20% в фосфатно-солевом буферном растворе (Фиг. 6). По сравнению с красителями (А) и (В) наблюдается батохромный сдвиг максимумов поглощения и флуоресценции на несколько нм, а также увеличение квантового на 1-7% в зависимости от структуры соединения. Максимумы поглощения и флуоресценции модифицированных нуклеотидов I располагаются в области 645 нм и 663 нм соответственно. Мы наблюдали батохромный сдвиг максимума поглощения уридин-5'-трифосфата с 262 нм до ~300 нм при его модификации посредством присоединения аминоалкильного заместителя, несущего флуоресцентную метку.
Установлено, что результаты полимеразной цепной реакции с использованием флуоресцентно-меченых нуклеозидтрифосфатов общей формулы I (ТА1)-(ТА5) и (ТВ1)-(TB3) зависят от структуры модифицированных нуклеотидов, используемых в качестве субстратов в ПЦР. Для сравнительной оценки степени встраивания модифицированных нуклеотидов вычисляют средний флуоресцентный сигнал совершенных дуплексов в ячейках биочипа и затем нормируют его на значение, полученное для коммерчески-доступного продукта производства фирмы Amersham (CY5-DUTP, Amersham РА55022). Установлено, что образование полноразмерного ПЦР продукта зависит не только от химической структуры заместителей, но также от расположения заместителя в молекуле флуорофора. Флуоресцентный сигнал выше для нуклеотидов (ТА1), (TA3)-(ТА5) и (ТВ1)-(TB3), содержащих цианиновый краситель с одной сульфогруппой (Фиг. 7, Фиг. 11). Флуоресцентные сигналы, полученные для нуклеотида (ТА2) и коммерчески-доступного Cy5-dUTP, оказались ниже и приблизительно равными. Было обнаружено, что расположение сульфогруппы в молекуле красителя влияет на эффективность встраивания модифицированных нуклеотидов в продукт ПЦР.
Установлено, что все красители формул (A1)-(А5) и (В1)-(B3) в составе конъюгатов с нуклеотидами не ингибируют полимеразную цепную реакцию (Фиг. 9, Фиг. 10, Фиг. 12). Модифицированные нуклеотиды общей формулы (I) не влияют на стабильность всех остальных компонентов анализа. Установлено, что все соединения формулы (I) (ТА1)-(ТА5) и (ТВ1)-(TB3) обладают стабильностью, достаточной для проведения полного цикла анализа без заметного разложения красителя. По совокупности всех свойств соединения формулы (I) (ТА1)-(ТА5) и (ТВ1)-(TB3) могут быть использованы в качестве флуоресцентных меток при разработке диагностических тест-систем, основанных на проведении ПЦР.
Краткое описание чертежей
Фиг. 1. Зависимость интенсивности флуоресценции от времени при облучении красителей на биочипе полупроводниковым лазерным источником света (655 нм/690 нм, 40 мВт): 1 - краситель (А2); 2 - краситель (А4); 3 - красители (A3, В2); 4 - краситель формулы (I) (R1=-CH3; R2=R4=-H; R3=-(СН2)5СООН, R5=-C2H5); 5 - красители (A1, B1); 6 - краситель формулы (I) (R1=-CH3; R2=R5=-H, R3=-(СН2)5СООН, R4=-(CH2)4SO3-); 7 - краситель формулы (I) (R1=-CH3; R2=-SO3-, R3=-(СН2)5СООН, R4=-(CH2)4SO3-).
Фиг. 2. Коэффициенты молярной экстинкции красителей в метаноле и PBS.
Фиг. 3. Квантовый выход флуоресценции красителей в метаноле и PBS.
Фиг. 4. Относительная эффективность флуоресценции красителей: возбуждение - в максимуме поглощения и на длине волны 655 нм, регистрация - в максимуме флуоресценции и на длине волны 690 нм соответственно.
Фиг. 5. Нормированные спектры поглощения и флуоресценции флуоресцентно-меченного дезоксиуридинтрифосфата.
Фиг. 6. Квантовый выход флуоресценции модифицированных дезоксиуридинтрифосфатов в PBS.
Фиг. 7. Гибридизация ДНК образца дикого типа на ТБ-биочипе.
Фиг. 8. Электрофоретический анализ в 2% агарозном геле результатов мультиплексной амплификации генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110 с различными флуоресцентно-мечеными трифосфатами дезоксиуридина в реакционной смеси в концентрации 8 мкМ: (а) проявление этидийбромидом, (b) проявление в свете флуоресценции цианинового красителя. Полоса 1 - маркер молекулярного веса pUC19/MspI (67-501 bp); полоса 2 - положительный контроль, не содержит меченого нуклеозидтрифосфата; полоса 3 - нуклеотид ТА2; полоса 4 - нуклеотид ТА1; полоса 5 - нуклеотид TA3; полоса 6 - нуклеотид ТА4; полоса 7 - нуклеотид ТА5; полоса 8 - нуклеотид TBI; полоса 9 - нуклеотид ТВ2; полоса 10 - нуклеотид TB3; полоса 11 - отрицательный контроль амплификации.
Фиг. 9. Зависимость нормированного сигнала флуоресценции от концентрации флуоресцентно-меченного нуклеозидтрифосфата ТА2 и ТА4.
Фиг. 10. Нормированный сигнал флуоресценции для различных модифицированных нуклеотидов при использовании диагностической тест-системы «ТБ-биочип».
Фиг. 11. Гибридизация, нормированный сигнал и генотип маркированных фрагментов ДНК образцов на Тромбо-биочипе на примере флуоресцентно-меченного нуклеотида ТА1 (wt - дикий тип, mut - мутация).
Фиг. 12. Электрофоретический анализ в 2% агарозном геле результатов мультиплексной амплификации генов системы фибринолиза: (а) проявление этидийбромидом, (b) проявление в свете флуоресценции цианинового красителя. А - FGB ген, В - F7 ген, С -MTHFR ген, D - PAI-1 ген, Е - GPIIIa ген. Полоса 1 - нуклеотид ТА2; полоса 2 - нуклеотид ТА1; полоса 3 - нуклеотид TA3; полоса 4 - нуклеотид ТА4; полоса 5 - нуклеотид ТА5; полоса 6 - нуклеотид TBI; полоса 7 - нуклеотид ТВ2; полоса 8 - нуклеотид TB3; полоса 9 - положительный контроль, не содержит меченого нуклеозидтрифосфата; полоса 10 - отрицательный контроль амплификации; полоса 11 - маркер молекулярного веса pUC19/MspI (67-501 bp).
Фиг. 13. Нормированный сигнал флуоресценции для различных модифицированных нуклеотидов при использовании диагностической тест-системы «ПФ-биочип Тромбо».
Осуществление изобретения
Соединения по изобретению общих формул ТА и ТВ синтезировали согласно схеме 1.
Схема 1
Синтез несимметричных индодикарбоцианиновых красителей формул (А, В), входящих в состав нуклеозидтрифосфатов ТА и ТВ, основан на реакции конденсации солей индолениния, содержащих активную метиленовую группу, и гидрохлорида дианила малонового диальдегида (схема 2, таблица 3, 4) (В.Е. Кузнецова и др. Изв. АН, Сер. хим., 2007, №11, с. 2186-2190; В.Е. Кузнецова и др. Изв. АН, Сер. хим., 2007, №12, с. 2355-2359; V.E. Kuznetsova et al., Mend. Comm, 2008, №3, pp. 138-140). Синтез промежуточных соединений, необходимых для получения красителей формул (А, В), представлен на схемах 3-9 (В.Е. Кузнецова и др. Изв. АН, Сер. хим. - 2008. - №3. - С. 595-598; В.Е. Кузнецова и др. Изв. АН, Сер. хим., 2007, №11, с. 2186-2190).
Схема 2
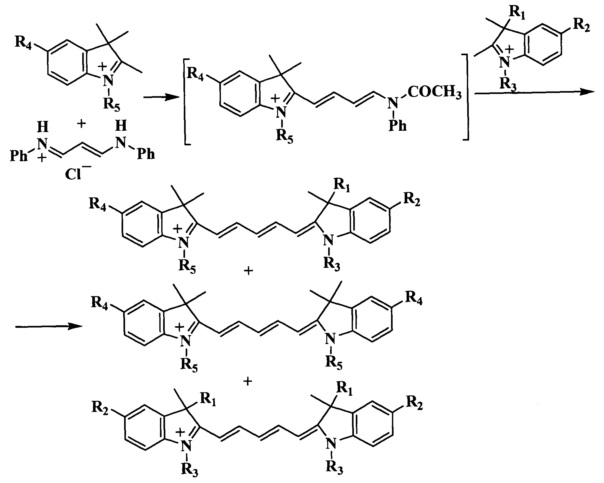
Схема 3
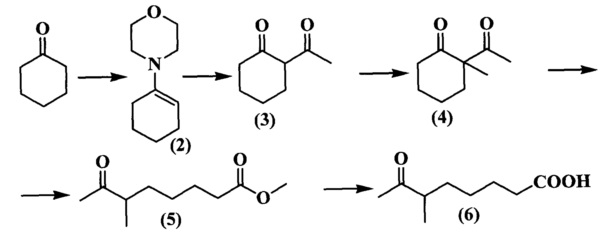
Схема 4
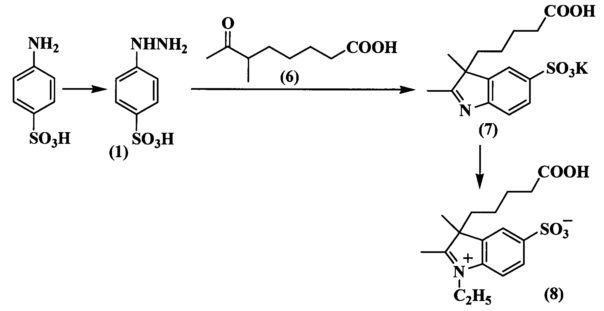
Схема 5
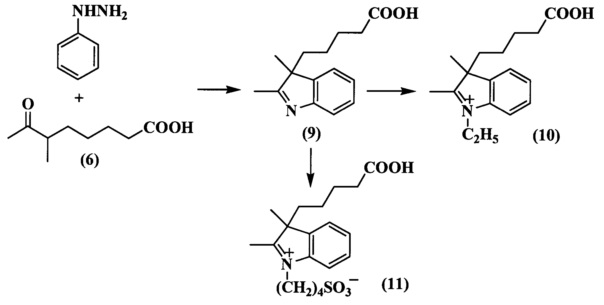
Схема 6
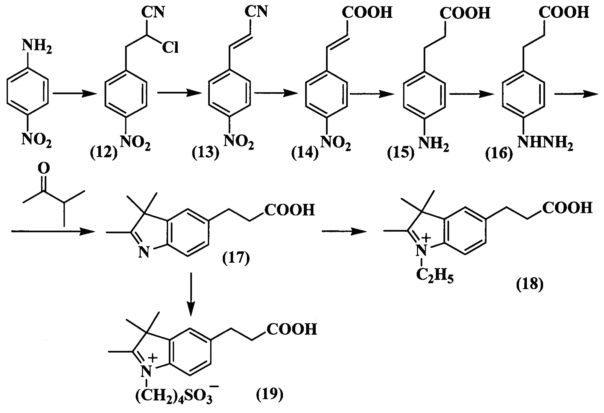
Схема 7
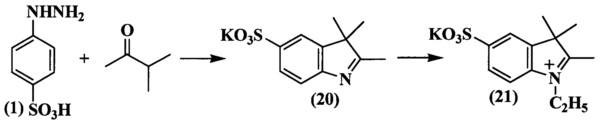
Схема 8
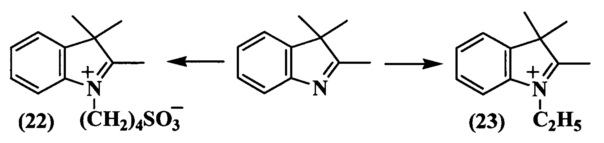
Схема 9
Исходным соединением для синтеза индоленинов (7) (схема 4) и (9) (схема 5), содержащих функциональную группу в положении 3, является 6-метил-7-оксооктановая кислота (6), синтез которой представлен на схеме 3. Ацетилирование циклогексанона проводили двумя способами: комплексом BF3⋅2AcOH и действием ацетилхлорида в хлороформе на морфолиновое производное циклогексена (2) в присутствии Et3N. 2-Ацетил-2-метилциклогексанон (4) получали действием метил иодида на раствор 2-ацетилциклогексанона (3) в метиловом спирте. Затем при помощи метилата лития синтезировали метиловый эфир кетокислоты (5). Гидролиз которого проводили разбавленной соляной кислотой, получая при этом кетокислоту (6). Конденсацией фенилгидразинов и 6-метил-7-оксо-октановой кислоты (6) (схема 3) получали соответствующие индолениновые основания (7, 9) (схема 4, 5).
Исходным соединением для синтеза индоленина (17), содержащего функциональную группу в положении 5, является гидрохлорид 4-(2-карбоксиэтил)фенилгидразина (16) (схема 6). Нитрил (12) получали из 4-нитроанилина действием раствора акрилонитрила в ацетоне на образующуюся в ходе реакции диазониевую соль. 3-(4-Нитрофенил)-акрилонитрил (13) получали кипячением водно-этанольного раствора 2-хлор-3-(4-нитрофенил)-пропионитрила (12) в присутствии ацетата натрия. 3-(4-Нитрофенил)-2-пропеновую кислоту (14) получали кислотным гидролизом нитрила (13). Дальнейшее восстановление кислоты (14) приводило к получению 3-(4-аминофенил)-пропионовой кислоты (15). Гидрохлорид 4-(2-карбоксиэтил)фенилгидразина (16) получали восстановлением в кислой среде диазониевой соли, которая образовывалась в ходе реакции. Карбоксиэтильное производное индоленина (17) синтезировали из гидразина (16) и метилизопропилкетона в ледяной уксусной кислоте в присутствии ацетата калия без выделения образующегося в ходе реакции гидразона.
Конденсацией фенилгидразина (1) с метилизопропилкетоном получали соответствующий индоленин (20) (схема 7).
N-Сульфоалкилирование всех индолениновых оснований проводили в 1,2-дихлорбензоле или бутиронитириле при действии 1,4-бутансультона (соединение (11) схема 5, соединение (19) схема 6, соединение (22) схема 8). N-Алкильные производные получали действием этилиодида или этилового эфира n-толуолсульфокислоты на раствор индоленина в ацетонириле или бутиронитриле (соединение (8) схема 4, соединение (10) схема 5, соединение (18) схема 6, соединение (21) схема 7, соединение (23) схема 8).
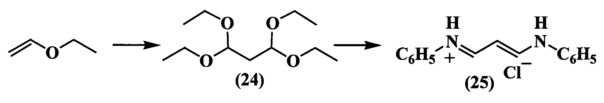
Полиметиновый мостик получали следующим образом (схема 9). Реакцией этилвинилового эфира и триэтилортоформиата в присутствии эфирата трехфтористого бора получали тетраэтилацеталь малонового альдегида (24). Далее при действии анилин гидрохлорида получен гидрохлорид дианила малонового диальдегида (25).
Несимметричные индодикарбоцианиновые красители формул (А, В) синтезируют конденсацией солей индолениния и гидрохлорида дианила малонового диальдегида (схема 2, таблицы 3, 4). В ходе реакции кроме целевого соединения образуются еще два побочных симметричных продукта. На первой стадии в реакцию конденсации вводили один индоленин. Ход реакции контролировали спектрофотометрически, при этом происходило исчезновение пиков λmax 237 и 280 нм, характерных для индоленинов, и появление нового сигнала λmax 440 нм, характерного для промежуточного соединения. Для полного протекания реакции достаточно нагревания при 118°C в течение 1-3 ч. Вторую стадию получения индодикарбоцианинового красителя осуществляют при использовании диизопропилэтиламина или безводного ацетата калия в качестве конденсирующих агентов. Все синтезированные индодикарбоцианиновые красители выделяли обращенно-фазовой хроматографией в системе ацетонитрил-0.01М триэтиламмонийацетатный буферный раствор градиентным элюированием от 0 до 50% ацетонитрила. Далее получали их натриевые соли.
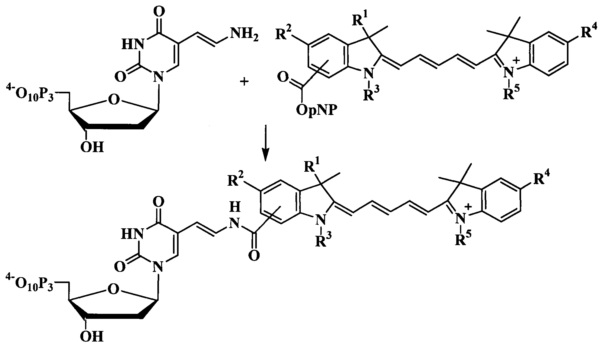
p-Нитрофениловые эфиры красителей получали действием бис p-нитрофенил карбоната в ДМФ. Активные эфиры выделяли обращенно-фазовой хроматографией. Реакцией аминогруппы AAdUTP с 1.25 эквивалентом р-нитрофенилового эфира красителя общей формулы (А) или (В) в 0.1 М NaHCO3/Na2CO3 (рН 8.5) в ДМФ получали флуоресцентно-меченые нуклеозид трифосфаты общей формулы (I) с выходом примерно 40% в зависимости от структуры используемого красителя (схема 1). Флуоресцентно-меченые нуклеотиды очищали в 2 этапа - анионная ионообменная хроматография на сорбенте DEAE-целлюлоза и обращенно-фазовая (C18-RP) хроматография.
Еще одним объектом изобретения является применение соединений по изобретению общей формулы (I) для маркирования ДНК. Ферментативное введение соединений формул (ТА) и (ТВ) представлено на примере диагностической тест-системы «ТБ-биочип» для определения мутаций, ассоциированных с лекарственной устойчивостью М. Tuberculosis.
Процедура молекулярной идентификации мутаций состоит из трех последовательных стадий: (1) мультиплексная ПЦР с амплификацией 5 ДНК фрагментов; (2) асимметричная мультиплексная ПЦР с образованием 5 флуоресцентно-меченых одно нитевых фрагментов ДНК; (3) гибридизация маркированных фрагментов с олигонуклеотидным микрочипом (биочип). Флуоресцентно-меченые нуклеозид трифосфаты общей формулы (I) добавляли в смесь природных dNTP, используемых в ПЦР. При проведении ПЦР получали ампликон, который содержал флуоресцентную метку. Флуоресцентно-меченный ампликон гибридизовали на биочипе.
Микрочип (Фиг. 7) представляет собой расположенные на подложке ячейки из гидрогеля с иммобилизованными внутри ячеек олигонуклеотидными зондами. Диаметр ячеек приблизительно 100 микрон. В разных ячейках находятся олигонуклеотидные зонды различного строения. В ячейках, в которых строение зонда соответствует строению ампликона, происходит связывание ампликона в прочный комплекс, дуплекс. В тех ячейках в которых строение зонда не соответствует строению ампликона не происходит связывания ампликона. Результаты анализа оценивают по интенсивности флуоресцентных сигналов в ячейках биочипа. В ячейках, в которых произошло связывание флуоресцентно-меченого ампликона с зондом, наблюдается интенсивный сигнал флуоресценции. Для регистрации сигналов используют флуоресцентный микроскоп, снабженный компьютером со специальным программным обеспечением.
Образование полноразмерных ПЦР продуктов подтверждено при помощи горизонтального электрофореза в агарозном геле в присутствии бромистого этидия и при помощи флуоресцентного анализатора (Фиг. 8). Электрофоретические полосы ПЦР продуктов (3-10), полученные обоими методами - идентичны. Все модифицированные нуклеотиды общей формулы (I) не ингибируют ПЦР для участка гена rpoB Mycobacterium tuberculosis и встраиваются в амплифицированные продукты.
Гибридизация дикого типа М. tuberculosis с биочипом представлена на Фиг. 7. Интенсивности гибридизационных сигналов на биологическом микрочипе для продуктов ПЦР, полученных с разными флуоресцентно-мечеными трифосфатами дезоксиуридина, различаются. На величину сигналов влияют различные факторы: эффективность встраивания ДНК-полимеразой модифицированных нуклеотидов в амплифицированный продукт, специфическое связывание с образованием совершенных дуплексов с олигонуклеотидными зондами, находящимися в ячейках биочипа, неспецифическое связывание с компонентами ячейки биочипа, яркость флуоресценции флуоресцентной метки, связанной с амплифицированнм продуктом.
Определена оптимальная концентрация флуоресцентно-меченых трифосфатов дезоксиуридина для проведения ПЦР при использовании Taq ДНК-полимеразы (Фиг. 9), которая соответствует 8 мкМ. На Фиг. 10 представлены уровни флуоресцентных сигналов на чипе с различными флуоресцентно-мечеными трифосфатами дезоксиуридина в концентрации 8 мкМ. Был вычислен средний флуоресцентный сигнал совершенных дуплексов в ячейках биочипа и затем нормирован на значение, полученное для коммерчески-доступного Cy5-dUTP.
Образование полноразмерного ПЦР продукта зависит не только от химической структуры заместителей, но также от расположения заместителя в молекуле флуорофора. В ряду соединений общей формулы (ТА) наиболее эффективен препарат с сульфогруппой жестко связанной с индолениновым фрагментом красителя и наиболее удаленной от пиримидинового основания нуклеозида (ТА4) - 6.75, тогда как эффективность соединения (TA3) с сульфонатобутильным заместителем равна 5.25. При приближении сульфогруппы к пиримидиновому основанию трифосфата эффективность конъюгата общей формулы (ТА) снижается: (ТА1) - 4.25, (ТА5) - 3.9. Также было показано, что количество сульфогрупп в структуре красителя сильно влияет на эффективность конъюгата - вне зависимости от расположения карбоксильной группы. Флуоресцентные сигналы, полученные для нуклеотида (ТА2) и коммерчески-доступного Cy5-dUTP, оказались ниже и приблизительно равными. В ряду соединений общей формулы ТВ наиболее эффективны препараты с сульфонатобутильным заместителем: (TB1) - 7.42, (ТВ2) - 7.11, тогда как соединение (TB3) с сульфогруппой, жестко связанной с индолениновым фрагментом красителя и наиболее удаленной от пиримидинового основания нуклеозида, оказался менее эффективным - 5.17.
Также эффективность встраивания модифицированных нуклеотидов (ТА) и (ТВ) в условиях ПЦР представлена при использовании тест-системы «ПФ-биочип Тромбо» для определения генетической предрасположенности к тромбозам. С использованием флуоресцентно-меченых нуклеотидов (ТА) и (ТВ) проведен анализ полиморфизма генов системы фибринолиза (FGB, F7, GPIIIa, PAI-1, MTHFR) (Фиг. 11). Процедура включает амплификацию последовательности выбранных генов с последующей гибридизацией маркированных фрагментов с олигонуклеотидами, иммобилизованными в гелиевые ячейки биочипа.
Степень ингибирования ферментативной активности определена проведением симметричной ПЦР при использовании стандартного протокола, в котором используемые праймеры применялись в равном количестве. Для определения образования и размера ПЦР продуктов генов FGB, F7, GPIIIa, PAI-1, MTHFR использован агарозный гель электрофорез. Как видно из Фиг. 12, продукты ПЦР FGB гена расположены между полосами 242 bp и 100 bp маркера pUC19/MspI. Амплификация при использовании только нативных нуклеотидов (полоса 9) и в присутствии модифицированных субстратов (полосы 1-8) привела к образованию полноразмерного продукта. Электрофореграммы ПЦР продуктов, проявленные при помощи этидий бромида и при регистрации сигнала флуоресценции красителя были одинаковыми для генов F7, GPIIIa, PAI-1 and MTHFR.
Гибридизация на биологическом микрочипе проведена после двух-раундной мультиплексной ПЦР с образованием одноцепочечных флуоресцентно-меченых фрагментов ДНК. Результаты гибридизации продемонстрированы на Фиг. 11.2 верхних ячейки (перфект матч) и две нижних (мисматч) продублированы. Флуоресцентный сигнал продублированных ячеек был усреднен и нормализован.
Эффективность встраивания модифицированных нуклеотидов в ПЦР определена измерением флуоресценции перфектных дуплексов для каждой анализируемой олигонуклеотидной пробы. Полученные данные скорректированы относительно сигнала фона и нормированы на значение Cy5-dUTP (Фиг. 13). Обнаружено, что эффективность встраивания модифицированных нуклеотидов в ПЦР аналогична в обеих тест-системах («ТБ-биочип» и «ПФ-биочип Тромбо»). Флуоресцентный сигнал выше для нуклеотида (TA3), содержащего в своей структуре цианиновый краситель с сульфогруппой удаленной от пиримидинового основания. Однако в случае тест-системы «ПФ-биочип Тромбо» наиболее эффективными оказались соединения общей формулы (ТА) - по эффективности, примерно в 12 раз, превышающие сигнал, полученный для Cy5-dUTP.
Использование флуоресцентно-меченых нуклеотидов общей формулы (I) в ПЦР позволяет получить флуоресцентный сигнал в 7 и 12 раз выше по сравнению с коммерчески-доступным продуктом Cy5-dUTP при определении мутаций Mycobacterium tuberculosis и для детекции генетической предрасположенности к тромбозам при использовании тест систем «ТБ-биочип» и «ПФ-биочип Тромбо». Исходя из вышеизложенного следует, что заявляемые флуоресцентно-меченые дезоксиуридинтрифосфаты общей формулы (I) (ТА1-ТА5, ТВ1-TB3) могут успешно использоваться для маркирования ДНК в ходе ПЦР.
Примеры соединений и их применение
Пример 1. Получение фенилгидразин-n-сульфокислоты (соединение 1)
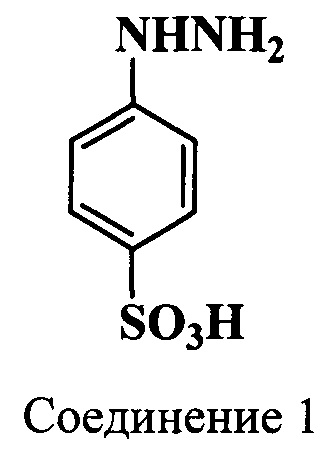
Сульфаниловую кислоту (52.0 г, 0.3 моль) и углекислый натрий (16.5 г, 0.06 моль) растворяют при нагревании в воде (200 мл). Полученный раствор отфильтровывают и к нему добавляют по каплям концентрированную серную кислоту (35.0 г, 19.1 мл, 0.36 моль), при этом выпадает белый осадок. К суспензии при охлаждении на льду и перемешивании добавляют раствор нитрита натрия (21.0 г, 0.3 моль) в воде (50 мл) с такой скоростью, чтобы температура реакционной массы не поднималась выше 12°C. Дополнительное перемешивание продолжают еще в течение 15 мин. Выделившийся осадок диазосоединения собирают фильтрацией и промывают небольшим количеством ледяной воды.
К раствору сульфита натрия (85 г, 0.67 моль) в воде (250 мл) при перемешивании и охлаждении на льду с солью добавляют влажное диазосоединение порциями с такой скоростью, чтобы температура реакционной массы была ниже +5°C. Дополнительно перемешивают 1 ч. Затем смесь нагревают до кипения и добавляют по каплям концентрированную соляную кислоту (200 мл), при этом выпадает осадок. Для полного обесцвечивания смеси добавляют цинковую пыль (2.0 г). Реакционную массу выдерживают 12 ч при комнатной температуре. Осадок собирают фильтрацией, промывают холодной водой и сушат на воздухе. Получают фенилгидразин-n-сульфокислоту (соединение 1) с выходом 42 г (74%).
Получение 6-метил-7-оксооктановой кислоты
Пример 2. Получение 1-морфолиноциклогексена (соединение 2)

Смесь морфолина (100.0 мл, 1.15 моль), циклогексанона (100.0 мл, 0.96 моль), толуола (190 мл) и n-толуолсульфокислоты (1.0 г) кипятят в круглодонной колбе, снабженной обратным холодильником и насадкой Дина-Старка до прекращения отделения воды (~6 ч). Затем толуол удаляют, а остаток фракционируют в вакууме, т.кип. 114°C (8 Торр). Получают 111 г (69%) 1-морфолиноциклогексена (соединение 2).
ЯМР 1H (CDCl3, δ, м.д., J/Гц): 1.55 [м, 2Н, СН2(4)], 1.67 [м, 2Н, СН2(3)], 2.05 [м, 4Н, СН2(5), СН2(6)], 2.77 (т, 4Н, СН2(2'), СН2(6'), J=5), 3.72 (т, 4Н, СН2(3'), СН2(5'), J=5), 4.66 (т, 1H, CH(2), J=4)
Пример 3. Получение 2-ацетилциклогексанона (соединение 3)
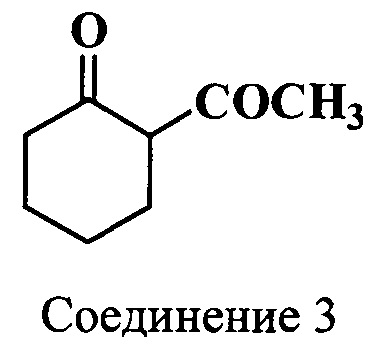
Метод А. В трехгорлую колбу, снабженную обратным холодильником, механической мешалкой, термометром и капельной воронкой, помещают безводный хлороформ (475 мл), 1-морфолиноциклогексен (соединение 2) (63.0 г, 0.38 моль) и перегнанный над натрием триэтиламин (56.7 мл, 0.41 моль). К охлажденной до 0°C реакционной массе по каплям добавляют раствор ацетилхлорида (27.7 мл, 0.39 моль) в безводном хлороформе (140 мл) с такой скоростью, чтобы температура смеси не поднималась выше 0°C. Дополнительно перемешивают при охлаждении на льду 1 ч, затем реакционную массу выдерживают 12 ч при 20°C. Далее в реакционную массу добавляют раствор концентрированной соляной кислоты (50.4 мл) в воде (126 мл) и кипятят 5 ч при непрерывном перемешивании. После охлаждения хлороформный слой отделяют, промывают водой порциями по 200 мл (до рН 5-6), насыщенным раствором хлорида натрия и сушат сульфатом натрия. Хлороформ удаляют, а остаток фракционируют в вакууме, т.кип. 102-104°C (10 Торр). Получают 29.0 г (55%) 2-ацетилциклогексанон (соединение 3).
ЯМР 1Н (CDCl3, δ, м.д.): 1.67 [м, 4Н, СН2(4), СН2(5)], 2.10 (с, 3H, COCH3), 2.31 [м, 4Н, СН2(3), СН2(6)], 15.90 [с, 1H, СН(2)]
Метод Б. К охлажденной до 0°C смеси циклогексанона (5.2 мл, 0.05 моль) и уксусного ангидрида (9.5 мл, 0.1 моль) в один прием вводили BF3⋅2AcOH комплекс (13.9 мл, 0.1 моль) и перемешивали сутки при ~20°C. Затем реакционную массу добавляли к раствору CH3COONa⋅3H2O (27.2 г, 0.2 моль) в воде (150 мл) и кипятили 3 ч при интенсивном перемешивании. После охлаждения экстрагировали Et2O (3*80 мл). Эфирные экстракты объединяли, промывали насыщенным раствором NaHCO3 до тех пор, пока не переставал выделяться газ, и сушили MgSO4. Эфир удаляли, а остаток фракционировали в вакууме в токе азота, т.кип. 105-108°C (17 Торр). Получали 3.8 г (55%) 2-ацетилциклогексанона (соединение 3).
ЯМР 1Н (CDCl3, δ, м.д.): 1.67 [м, 4Н, СН2(4), СН2(5)], 2.10 (с, 3H, COCH3), 2.31 [м, 4Н, СН2(3), СН2(6)], 15.90 [с, 1H, СН(2)]
Пример 4. Получение 2-ацетил-2-метилциклогексанона (соединение 4)
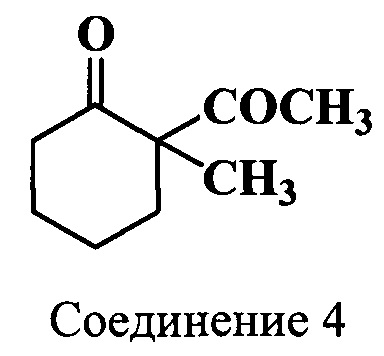
В трехгорлую круглодонную колбу, снабженную обратным холодильником, механической мешалкой и термометром, при охлаждении на льду помещают метиловый спирт (83 мл), 2-ацетилциклогексанон (соединение 3) (29.0 г, 0.21 моль) и метил иодид (19.3 мл, 0.31 моль). К реакционной массе при перемешивании и охлаждении до 0°C добавляют по каплям раствор гидроксида натрия (8.3 г, 0.21 моль) в воде (41.4 мл). Смесь перемешивают 20 ч при 20°C, а затем кипятят дополнительно 2 ч. Далее к охлажденной реакционной массе добавляют воду (85 мл) и экстрагируют хлороформом (2*85 мл). Хлороформные экстракты объединяют, промывают 2М гидроксидом натрия (200 мл), насыщенным раствором хлорида натрия (100 мл) и сушат MgSO4. Растворитель удаляют, а остаток фракционируют в вакууме в токе азота, т.кип. 127-128°C (32 Торр). Получают 24 г (75%) 2-ацетил-2-метилциклогексанона (соединение 4).
ЯМР 1Н (CDCl3, δ, м.д.): 1.23 (с, 3H, С(2)СН3), 1.41-1.48 [м, 1H, СН(4)], 1.61-1.69 [м, 3H, СН(4), СН2(5)], 1.93-1.99 [м, 1Н, СН(3)], 2.09 (с, 3H, COCH3), 2.25-2.34 [м, 1H, СН(3)], 2.42-2.48 [м, 2Н, СН2(6)]
Пример 5. Получение метилового эфира 6-метил-7-оксооктановой кислоты (соединение 5)

Смесь безводного МеОН (52.4 мл), Li (0.5 г, 0.071 моль) и 2-ацетил-2-метилциклогексанона (соединение 4) (10.0 г, 0.065 моль) кипятили 1 ч при перемешивании, а затем 12 ч выдерживали при ~20°C. Далее реакционную массу подкисляли концентрированной H2SO4 до рН 4-5. К суспензии добавляли воду (55 мл) и экстрагировали Et2O до обесцвечивания водной фазы. Эфирные экстракты объединяли, промывали насыщенным раствором NaCl и сушили MgSO4. Растворитель удаляли, а остаток фракционировали в вакууме, т.кип. 139-143°C (20 Торр). Получали 6.2 г (52%) метилового эфира 6-метил-7-оксооктановой кислоты (соединение 5).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1.06 (д, 3H, С(6)СН3, J=7), 1.23-1.35 [м, 3H, СН2(5), СН(4)], 1.56-1.69 [м, 3 Н, СН2(3), СН(4)], 2.11 [с, 3H, CH3(8)], 2.28 (т, 2 Н, СН2(2), J=7.5), 2.49 [м, 1 Н, СН(6)], 3.63 (с, 3H, COOCH3)
Пример 6. Получение 6-метил-7-оксооктановой кислоты (соединение 6)
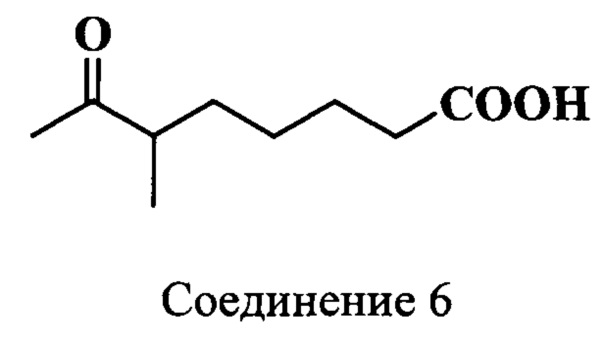
Смесь 12%-ной HCl (37 мл) и метилового эфира 6-метил-7-оксооктановой кислоты (соединение 5) (9.1 г, 0.049 моль) кипятили 6 ч при перемешивании. Реакционную массу экстрагировали эфиром (50 мл). Растворитель удаляли, а остаток фракционировали в вакууме, т.кип. 122°C (0.1-0.01 Торр). Получали 5.9 г (75%) соединения 6.
ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1.06 (д, 3H, С(6)СН3, J=7), 1.25-1.39 [м, 3H, СН2(5), СН(4)], 1.58-1.69 [м, 3H, СН2(3), СН(4)], 2.12 [с, 3H, СН3(8)], 2.33 (т, 2Н, CH2(2), J=7.5), 2.50 [м, 1H, СН(6)]
Гидрохлорид 4-(2-карбоксиэтил)фенилгидразина
Пример 7. Получение 2-хлор-3-(4-нитрофенил)-пропионитрила (соединение 12)
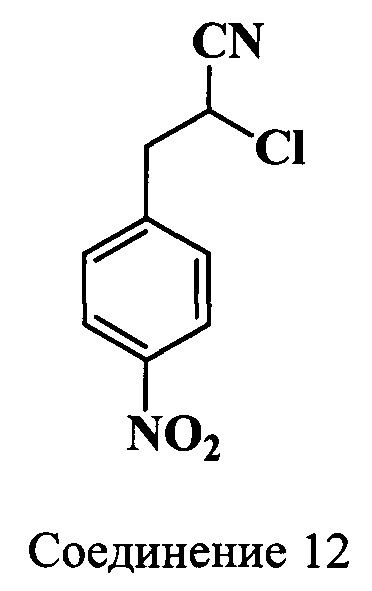
Смесь 4-нитроанилина (11.5 г, 0.083 моль), воды (60 мл) и концентрированной HCl (62 мл) нагревают до полного растворения выделяющегося гидрохлорида 4-нитроанилина. Затем реакционную массу охлаждают до начала кристаллизации, добавляют мелко колотый лед (50 г) и к полученной суспензии при сильном перемешивании вводят по каплям раствор NaNO2 (5.9 г, 0.083 моль) в воде (13.8 мл). Ход реакции контролируют по иодкрахмальной бумажке. К полученному раствору при перемешивании добавляют раствор акрилонитрила (4.4 г, 0.083 моль) в ацетоне (37.5 мл), кристаллический CuSO4⋅5H2O (2.5 г, 0.01 моль) и смесь выдерживают 24 ч при ~20°C. Затем выделившийся осадок отфильтровывают, промывают водой, переносят в колбу с водой (250 мл) и примеси удаляют перегонкой с водяным паром. После сбора 500 мл конденсата перегонку прекращают. Кубовый остаток охлаждают на льду и водный слой удаляют обратной фильтрацией. Твердый остаток растворяют в метаноле (100 мл), обрабатывают активированным углем (1 г), раствор фильтруют горячим и добавляют воду (300 мл). Выпавший осадок отфильтровывают и сушат при 80°C. Получают 14.3 г (82%) нитрила (соединение 12), т.пл. 110-111°C.
1Н (DMSO-d6, δ, м.д., J/Гц): 3.55 (м, 2Н, CH2CH(Cl)CN), 5.64 (т, 1H, CH2CH(Cl)CN, J=7.0), 7.65-8.26 (д, 4Н, ArH, J=9.0)
Пример 8. Получение 3-(4-нитрофенил)-акрилонитрила (соединение 13)
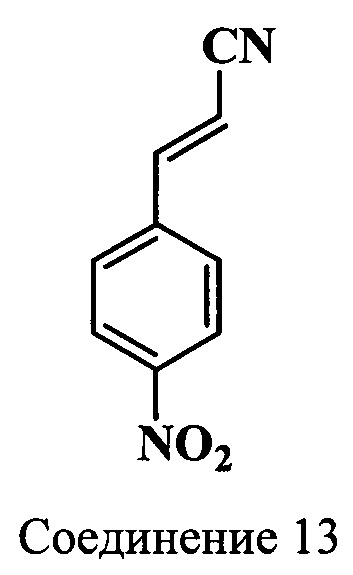
Смесь 2-хлор-3-(4-нитрофенил)-пропионитрила (соединение 12) (10.5 г, 0.05 моль), ацетата натрия (15.0 г, 0.18 моль), воды (40 мл) и этилового спирта (90 мл) кипятят в течение 4 ч. Затем в реакционную массу добавляют воду (150 мл) и выдерживают при +5°C до полной кристаллизации. Полученный осадок собирают фильтрацией, растворяют в этаноле (200 мл), обрабатывают активированным углем (1.5 г), раствор фильтруют горячим. К фильтрату добавляют воду (400 мл), выдерживают 24 ч при +5°C и отфильтровывают выпавший осадок. Получают 8.2 г технического соединения 13. После дополнительной перекристаллизации из спирта (200 мл) получают 4.1 г (47%) 3-(4-нитрофенил)-акрилонитрила (соединение 13) в виде игл желтого цвета, т.пл. 201°C (из этанола).
ЯМР 1H (DMSO-d6, δ, м.д., J/Гц): 6.72 (д, 1Н, CHCHCN, J=16.5), 7.81 (д, 1H, CHCHCN, J=16.5), 7.79-8.29 (д, 4Н, ArH, J=9.0)
Пример 9. Получение 3-(4-нитрофенил)-2-пропеновой кислоты (соединение 14)
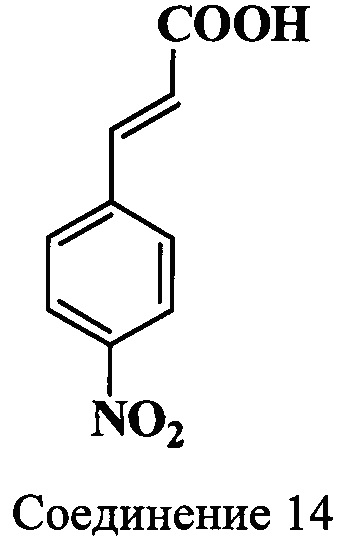
Смесь 3-(4-нитрофенил)-акрилонитрила (соединение 13) (17.4 г, 0.1 моль) и концентрированной фосфорной кислоты (350 мл) нагревают 2 ч при 150°C. После охлаждения до 20°C смесь переносят в ледяную воду (4 л). Полученный осадок отфильтровывают. Получают 18.3 г неочищенного продукта, который растворяют в 1 л 0.12М раствора NaOH и обрабатывают углем (3.5 г). Полученный раствор отфильтровывают и к фильтрату добавляют по каплям концентрированную HCl до рН~2. Выделившийся осадок отфильтровывают, промывают водой и сушат при 90°C. Получают 17.7 г (92%) кислоты (соединение 14) в виде игл желтого цвета, т.пл. >250°C.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 6.74 (д, 1Н, CHCHCOOH, J=16.5), 7.69 (д, 1Н, CHCHCOOH, J=16.5), 7.96-8.25 (д, 4Н, ArH, J=9)
Пример 10. Получение гидрохлорида 3-(4-аминофенил)-пропионовой кислоты (соединение 15)

Смесь катализатора 5% Pd/C (400 мг), уксусной кислоты (80 мл) и 3-(4-нитрофенил)-2-пропеновой кислоты (соединение 14) (3.9 г, 20 ммоль) гидрируют 2.5 ч при интенсивном перемешивании в токе водорода при ~1 атм и ~20°C. Реакционную массу отфильтровывают и фильтрат упаривают. Маслянистый остаток растворяют в смеси 5М раствора HCl (7 мл) и воды (30 мл), обрабатывают активированным углем при нагревании. Получают 3.9 г (96%) гидрохлорида (соединение 15), т.пл. 186-187°C.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 2.53 (т, 2Н, СН2СН2СООН, J=7.5), 2.83 (т, 2Н, СН2СН2СООН, J=7.5), 7.28-7.35 (д, 4Н, ArH, J=8.5), 10.31 (с, 2Н, NH2)
Пример 11. Получение гидрохлорида 4-(2-карбоксиэтил)фенилгидразина (соединение 16)
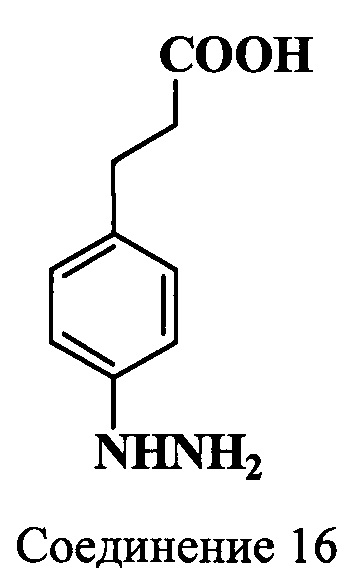
В трехгорлую колбу, снабженную механической мешалкой и термометром, помещают гидрохлорид 3-(4-аминофенил)пропионовой кислоты (соединение 15) (2.0 г, 10 ммоль), концентрированную соляную кислоту (35 мл) и при охлаждении добавляют по каплям под слой жидкости раствор нитрита натрия (0.69 г, 10 ммоль) в воде (0.9 мл) с такой скоростью, чтобы температура реакционной массы не поднималась выше -5°C. Затем в течение 30 мин температуру повышают до 0°C. Смесь вновь охлаждают до -5°C и добавляют охлажденный до -18°C раствор SnCl2⋅2H2O (10.0 г, 44 ммоль) в концентрированной соляной кислоте (15 мл) с такой скоростью, чтобы температура реакционной массы не поднималась выше -5°C. Смесь дополнительно перемешивают 30 мин при -5°C и выдерживают -24 ч при +5°C. Выпавшие кристаллы отфильтровывают и промывают охлажденной до -18°C концентрированной соляной кислотой (6 мл). Получают 1.6 г (75%) гидрохлорида (соединение 16).
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 2.47 (т, 2Н, СН2СН2СООН, J=7.5), 2.73 (т, 2Н, СН2СН2СООН, J=7.5), 6.91-7.13 (д, 4Н, ArH, J=8.5), 10.27 (с, 3H, NHNH2)
Синтез индоленинов
Пример 12. Получение 3-(4-карбоксибутил)-2,3-диметилиндоленина (соединение 9)
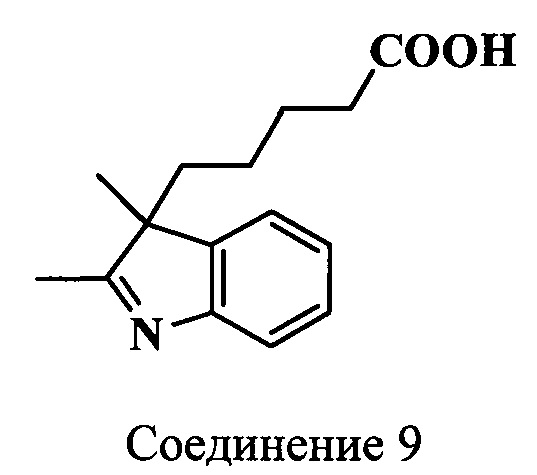
Смесь 6-метил-7-оксооктановой кислоты (соединение 6) (723 мг, 4.2 ммоль), фенилгидразина (454 мг, 4.2 ммоль) и ледяной уксусной кислоты (4.2 мл) нагревают 3.5 ч при 118°C. Растворитель удаляют, маслянистый остаток растворяют в хлороформе. Хлороформный раствор промывают водой, насыщенным раствором хлорида натрия, сушат MgSO4. Растворитель удаляют, а остаток перекристаллизовывают из смеси этилацетат - гексан, 0.6:2. Получают 0.8 г (78%) индоленина (соединение 9) в виде порошка желто-оранжевого цвета. Масс-спектр (MALDI) (C15H19NO2): найдено m/z 246.3, рассчитано m/z 245.32.
ЯМР 1Н (CDCl3, δ, м.д.): 0.56-0.81 (м, 2Н, СН2СН2СН2СН2СООН), 1.28 [с, 3H, CH3(3)], 1.43-1.51 (м, 2Н, СН2СН2СН2СН2СООН), 1.76-1.92 (м, 2Н, СН2СН2СН2СН2СООН), 2.13-2.21 (м, 2Н, СН2СН2СН2СН2СООН), 2.24 [с, 3H, СН3(2)], 7.18-7.54 (м, 4Н, ArH)
Пример 13. Получение калиевой соли 3-(4-карбоксибутил)-2,3-диметил-5-сульфоиндоленина (соединение 7)
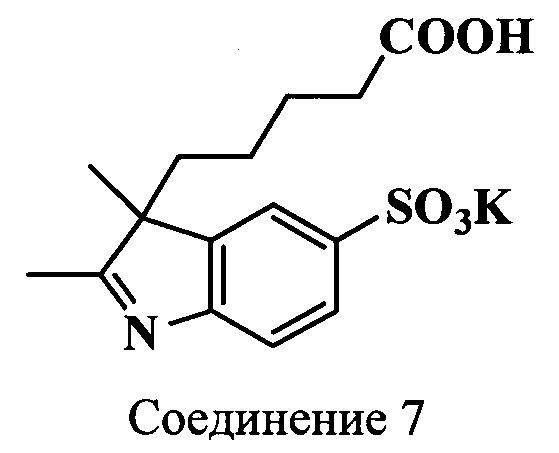
Смесь фенилгидразин-и-сульфокислоты (соединение 1) (1.8 г, 9.7 ммоль), 6-метил-7-оксооктановой кислоты (соединение 6) (2.0 г, 11.6 ммоль) и ледяной уксусной кислоты (15 мл) кипятят при перемешивании в течение 8 ч, затем добавляют дополнительное количество уксусной кислоты и обрабатывают активированным углем. Растворитель удаляют, а остаток растворяют в метаноле (10 мл). К полученному раствору добавляют по каплям раствор гидроксида калия (600 мг, 10.6 ммоль) в метаноле (7 мл), изопропиловый спирт (15 мл) и диэтиловый эфир (2 мл). Образовавшийся осадок отфильтровывают и сушат в вакуум-эксикаторе над Р2О5. Получают 3.5 г (83%) индоленина (соединение 7). λmax 258 нм. Масс-спектр (MALDI) (C15H19NO5S): найдено m/z 327.2, рассчитано m/z 325.38.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 0.45-0.70 (м, 2Н, СН2СН2СН2СН2СООН), 1.31 [с, 3H, CH3(3)], 1.36 (м, 2Н, СН2СН2СН2СН2СООН), 1.88-2.14 (м, 4Н, СН2СН2СН2СН2СООН), 7.53 (д, 1H, ArH, J=9), 7.80 (м, 2Н, ArH)
Пример 14. Получение 5-(2-карбоксиэтил)-2,3,3-триметилиндоленина (соединение 17)
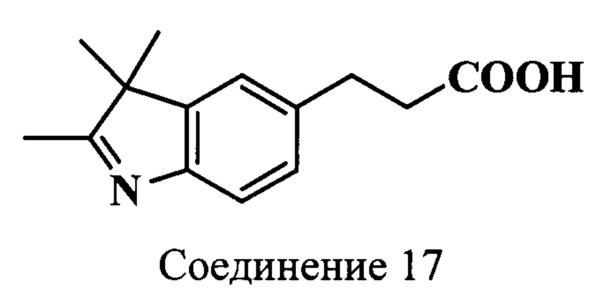
Смесь гидрохлорида 4-(2-карбоксиэтил)-фенилгидразина (соединение 16) (216 мг, 1 ммоль), безводного ацетата калия (196 мг, 2.0 ммоль), 3-метил-2-бутанона (147 мкл, 1.4 ммоль), уксусной кислоты (1 мл) нагревают 1 ч при 118°C. Затем растворители удаляют, остаток растворяют в хлороформе, промывают водой, насыщенным раствором хлорида натрия и сушат сульфатом натрия. Хлороформ удаляют, а маслянистый остаток перекристаллизовывают из смеси этилацетат : гексан, 1:10. Осадок собирают фильтрацией и сушат в вакуум-эксикаторе над Р2О5 и КОН. Получают 118 мг (55%) индоленина (соединение 17). λmax 262 нм. Масс-спектр (MALDI) (C14H17NO2): найдено m/z 232.3, рассчитано m/z 231.29.
ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1.27 (с, 6Н, 2С(3)Н3); 2.27 (с, 3H, С(2)Н3), 2.68 (т, 2Н, СН2СН2СООН, J=8), 3.00 (т, 2Н, CH2CH2COOH, J=8), 7.12-7.46 (д, 3H, Ar, J=8.5)
Пример 15. Получение калиевой соли 2,3,3-триметил-5-сульфоиндоленина (соединение 20)
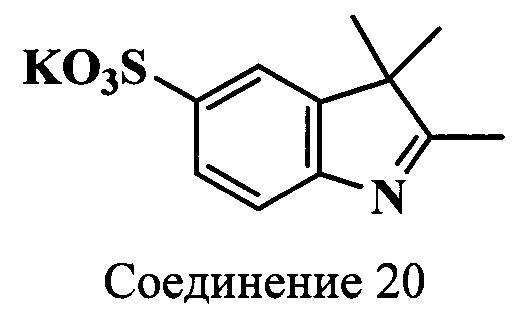
Смесь фенилгидразин-n-сульфокислоты (соединение 1) (11.0 г, 0.06 моль), 3-метил-2-бутанона (7.7 мл, 0.072 моль) и ледяной уксусной кислоты (34 мл) кипятят в течение 3 ч, а затем выдерживают 12 ч при 0°C. Выпавший осадок отделяют фильтрацией, промывают ацетоном и сушат в вакуум-эксикаторе над Р2О5. Получают 5.1 г (71%) индоленина.
ЯМР 1Н (D2O, δ, м.д.): 1.28 (с, 6Н, 2С(3)Н3), 7.47-7.79 (3H, м, ArH)
5-Сульфо-2,3,3-триметилиндоленин (4.8 г, 0.02 моль) растворяют при нагревании в метаноле (25 мл). К полученному раствору добавляют по каплям раствор гидроксида калия (1.4 г, 0.024 моль) в метаноле (16 мл). Затем добавляют изопропиловый спирт (50 мл). Осадок отфильтровывают, сушат в вакуум-эксикаторе над Р2О5. Получают 4.7 г (85%) индоленина (соединение 20) в виде блестящих пластинок светло-бежевого цвета. λmax 260 нм. Масс-спектр (MALDI) (C11H12NO3S-): найдено m/z 239.0, рассчитано m/z 238.28.
ЯМР 1H (D2O, δ, м.д.): 1.19 (6Н, с, 2С(3)Н3), 2.19 (3H, с, С(2)Н3), 7.41-7.7 (3H, м, ArH)
N-Алкилирование индоленинов
Пример 16. Получение 3-(4-карбоксибутил)-2,3-диметил-N-этилиндолениний иодида (соединение 10)
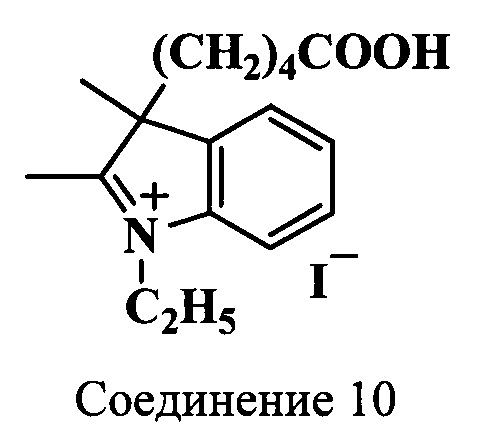
Смесь 2,3-диметил-3-(4-карбоксибутил)-индоленина (соединение 9) (49 мг, 0.2 ммоль), этилиодида (1 мл) и ацетонитрила (0.4 мл) нагревают 20 ч при 70°C. По окончанию нагревания растворитель удаляют в вакууме, а остаток промывают диэтиловым эфиром и сушат в вакуум-эксикаторе над Р2О5. Получают 76 мг (95%) 3-(4-карбоксибутил)-2,3-диметил-N-этилиндолениний иодида (соединение 10). λmax 279 нм. Масс-спектр (MALDI) (C17H24NO2+): найдено m/z 274.4, рассчитано m/z 274.38.
ЯМР 1H (CDCl3, δ, м.д., J/Гц): 0.52-0.78 (м, 2Н, СН2СН2СН2СН2СООН), 1.25 (с, 3H, С(3)Н3), 1.38-1.49 (м, 2Н, СН2СН2СН2СН2СООН), 1.62 (т, 3H, CH2CH3, J=7.0), 1.70-1.81 (м, 2Н, СН2СН2СН2СН2СООН), 2.18 (м, 2Н, СН2СН2СН2СН2СООН), 2.28 (с, 3H, С(2)H3), 4.73 (м, 2Н, СН2СН3), 7.5-7.68 (м, 4Н, ArH)
Пример 17. Получение 2,3-диметил-3-(4-карбоксибутил)-5-сульфо-N-этилиндолениния (соединение 8)
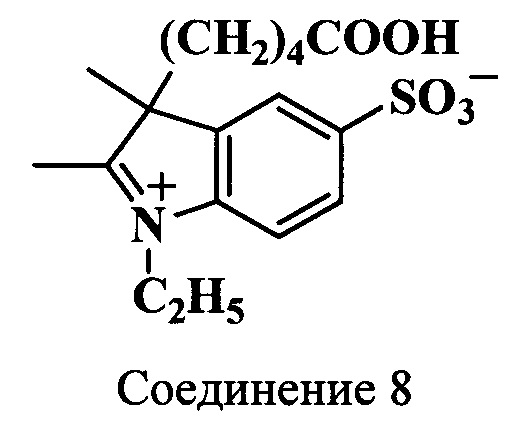
Смесь калиевой соли 3-(4-карбоксибутил)-2,3-диметил-5-сульфоиндоленина (соединение 7) (0.5 г, 1.4 ммоль), этилиодида (550 мкл, 6.9 ммоль) и 1,2-дихлорбензола (25 мкл) нагревают 50 ч при 72°C. По окончанию нагревания растворитель декантируют, осадок промывают ацетоном, собирают на фильтр и сушат в вакуум-эксикаторе над Р2О5. Получают 0.47 г (96%) 3-(4-карбоксибутил)-2,3-диметил-5-сульфо-N-этилиндолениния (соединение 8). λmax 266 нм. Масс-спектр (MALDI) (C17H23NO5S): найдено m/z 354.2, рассчитано m/z 353.43.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 0.58-0.72 (м, 2Н, СН2СН2СН2СН2СООН), 1.49 (т, 3H, CH2CH3, J=7), 1.56 (с, 3H, С(3)Н3), 1.61 (м, 2Н, СН2СН2СН2СН2СООН), 2.14 (уш.м, 4Н, СН2СН2СН2СН2СООН), 4.5 (м, 2Н, СН2СН3), 7.9 (д, 1H, ArH, J=9), 8.06 (м, 2Н, ArH)
Пример 18. Получение 2,3,3-триметил-N-этилиндолениний иодида (соединение 23)
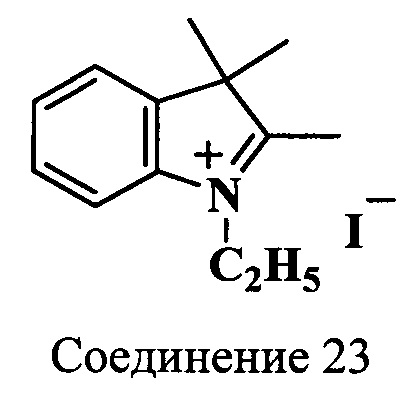
Смесь 2,3,3-триметилиндоленина (1.4 г, 8.5 ммоль), этилиодида (5.5 мл) и ацетонитрила (5 мл) кипятят 18 ч при перемешивании токе азота. По окончанию нагревания в охлажденную до комнатной температуры реакционную массу добавляют безводный диэтиловый эфир (30 мл). Выпавшие кристаллы собирают на фильтр и перекристаллизовывают из изопропанола (5 мл). Получают 2.5 г (92%) 2,3,3-триметил-N-этилиндолениний иодида (соединение 23). λmax 278 нм. Масс-спектр (MALDI) (C13H18N+): найдено m/z 189.3, рассчитано m/z 188.29.
ЯМР 1Н (CDCl3, δ, м.д.): 1.64 (уш.с, 9Н, СН2СН3, 2С(3)Н3), 3.14 (с, 3H, С(2)Н3), 4.75 (м, 2Н, СН2СН3), 7.56-7.72 (м, 4Н, ArH)
Пример 19. Получение 2,3,3-триметил-5-сульфо-N-этилиндолениния (соединение 21)
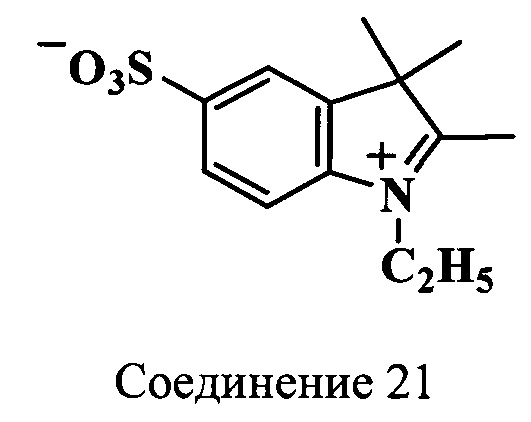
Смесь калиевой соли 2,3,3-триметил-5-сульфоиндоленина (соединение 20) (2.4 г, 10 ммоль), триэтиламина (1.7 мл, 12 ммоль), этилового эфира n-толуолсульфокислоты (5.0 г, 25 ммоль) и бутиронитрила (10 мл) нагревают 20 ч при 118°C. По окончанию нагревания добавляют ацетон (30 мл). Образовавшиеся кристаллы отфильтровывают и сушат в вакуум-эксикаторе над P2O5. Получают 2.32 г (86%) индолениниевой соли (соединение 21), т.пл. 240-242°C. λmax 228 нм. Масс-спектр (MALDI) (C13H17NO3S): найдено m/z 268.4, рассчитано m/z 267.35.
ЯМР 1H (D2O, δ, м.д., J/Гц): 1.43 (уш.с, 9Н, СН2СН3, 2С(3)Н3), 4.36 (м, 2Н, СН2СН3), 7.63 (д, 1Н, ArH, J=8.5), 7.75 (д, 1H, ArH, J=8.5), 7.97 (с, 1Н, ArH)
Пример 20. Получение 5-(2-карбоксиэтил)-2,3,3-триметил-N-этилиндолениний иодида (соединение 18)
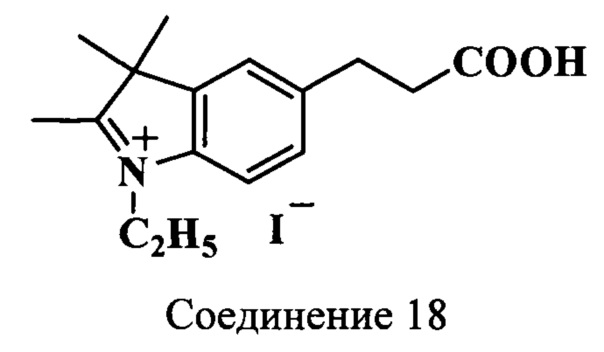
Смесь 5-(2-карбоксиэтил)-2,3,3-триметилиндоленина (соединение 17) (230 мг, 1 ммоль), этилиодида (500 мкл, 5.5 ммоль), ацетонитрила (2.2 мл) нагревают 20 ч при 70°C. Затем охлаждают до комнатной температуры, добавляют абсолютный диэтиловый эфир (2 мл) и выдерживают ~24 ч при -18°C. Полученные кристаллы отфильтровывают и сушат в вакуум-эксикаторе над Р2О5 и КОН. Получают 377 мг (97%) иодида индолениния (соединение 18). λmax 284 нм. Масс-спектр (MALDI) (C16H21NO2): найдено m/z 259.8, рассчитано m/z 259.34.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 1.44 (т, 3H, СН2СН3, J=7.0), 1.52 (с, 6Н, 2С(3)Н3), 2.62 (т, 2Н, СН2СН2СООН, J=7.5), 2.80 (с, 3H, С(2)Н3), 2.96 (т, 2Н, СН2СН2СООН, J=7.5), 4.47 (к, 2Н, СН2СН3, J=7.0), 7.47-7.86 (м, 3H, ArH)
N-Сульфоалкилирование индоленинов
Пример 21. Получение 5-(2-карбоксиэтил)-2,3,3-триметил-N-(4-сульфонатобутил)индолениния (соединение 19)
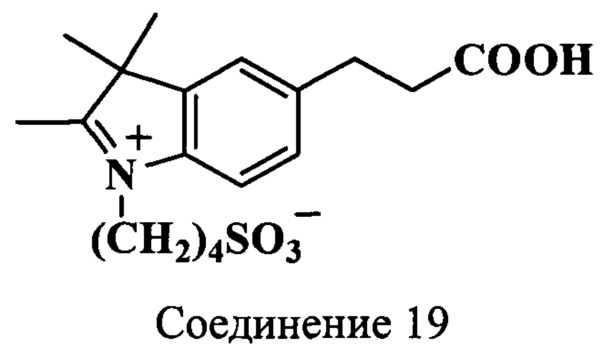
Смесь 5-(2-карбоксиэтил)-2,3,3-триметилиндоленина (соединение 17) (230 мг, 1 ммоль), 1,4-бутансультона (216 мг 1.6 ммоль) и бутиронитрила (2.2 мл) нагревают 22 ч при 118°C. Охлажденную до комнатной температуры реакционную массу затирают с абсолютным диэтиловым эфиром. Образовавшийся осадок отфильтровывают и сушат в вакуум-эксикаторе над Р2О5 и КОН. Получают 300 мг (86%) индолениния (соединение 19). λmax 284 нм. Масс-спектр (MALDI) (C18H25NO5S): найдено m/z 368.2, рассчитано m/z 367.46.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 1.51 (с, 6Н, 2С(3)Н3), 1.73 (м, 2Н, CH2CH2CH2CH2SO3), 1.96 (м, 2Н, CH2CH2CH2CH2SO3), 2.61 (т, 2Н, СН2СН2СООН, J=7.5), 2.81 (с, 3H, С(2)Н3), 2.85 (м, 2Н, CH2CH2CH2CH2SO3), 2.95 (т, 2Н, СН2СН2СООН, J=7.5), 4.46 (м, 2Н, CH2CH2CH2CH2SO3), 7.47-7.93 (м, 3H, ArH)
Пример 22. Получение 2,3,3-триметил-N-(4-сульфонатобутил)индолениния (соединение 22)
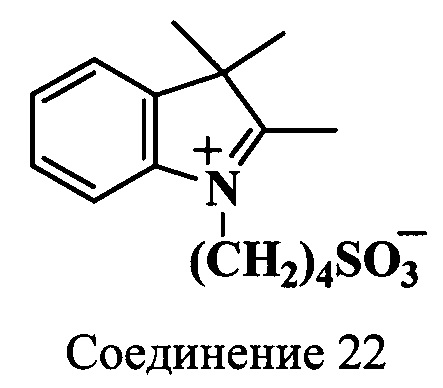
Смесь 2,3,3-триметилиндоленина (414 мг, 2.6 ммоль), 1,4-бутансультона (708 мг, 5.2 ммоль) и 1,2-дихлорбензола (4.2 мл) нагревают 25 ч при 118°C. Растворитель декантируют, а остаток затирают с диэтиловым эфиром. Образовавшийся осадок собирают на фильтр, промывают диэтиловым эфиром и сушат в вакуум-эксикаторе над Р2О5. Получают 0.75 г (97%) индолениния (соединение 22) в виде порошка темно-вишневого цвета. λmax 278 нм. Масс-спектр (MALDI) (C15H21NO3S): найдено m/z 296.0, рассчитано m/z 295.40.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 1.44 (с, 6Н, 2С(3)Н3), 1.77 (м, 2Н, CH2CH2CH2CH2SO3), 2.02 (м, 2Н, CH2CH2CH2CH2SO3), 2.84 (т, 2Н, CH2CH2CH2CH2SO3, J=7.5), 4.39 (т, 2Н, CH2CH2CH2CH2SO3, J=7.5), 7.49-7.68 (м, 4Н, ArH)
Пример 23. Получение 3-(4-карбоксибутил)-2,3-диметил-N-(4-сульфонатобутил)-индолениния (соединение 11)

Смесь 3-(4-карбоксибутил)-2,3-диметилиндоленина (соединение 9) (638 мг, 2.6 ммоль), 1,4-бутансультона (708 мг, 5.2 ммоль) и 1,2-дихлорбензола (4.2 мл) нагревают 25 ч при 118°C. Растворитель декантируют, а маслянистый остаток затирают с диэтиловым эфиром. Образовавшийся осадок собирают фильтрацией, промывают диэтиловым эфиром и сушат в вакуум-эксикаторе над Р2О5. Получают 0.98 г (99%) индолениния (соединение 11) в виде порошка темно-вишневого цвета. λmax 280 нм. Масс-спектр (MALDI) (C19H27NO5S): найдено m/z 382.0, рассчитано m/z 381.49.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 0.38-0.68 (м, 2Н, СН2СН2СН2СН2СООН), 1.23-1.35 (м, 2Н, СН2СН2СН2СН2СООН), 1.43 (с, 3H, С(3)Н3), 1.71-1.81 (м, 2Н, CH2CH2CH2CH2SO3), 1.92-2.2 (уш.м., 6Н, СН2СН2СН2СН2СООН, CH2CH2CH2CH2SO3), 2.84 (т, 2Н, CH2CH2CH2CH2SO3, J=7.5), 4.41 (т, 2H, CH2CH2CH2CH2SO3, J=7.5), 7.18-7.7 (уш.м., 4Н, ArH)
Синтез гидрохлорида дифенилимина малонового альдегида
Пример 24. Получение бис-(диэтилацеталь) малонового диальдегида (соединение 24)
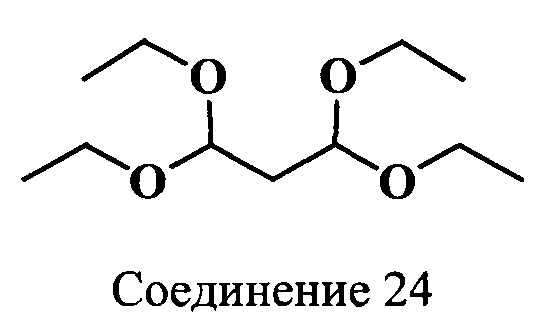
В трехгорлую колбу, снабженную обратным холодильником, механической мешалкой, термометром и капельной воронкой, помещают этилортоформиат (50,0 мл, 0.3 моль) и эфират трехфтористого бора (0.5 мл) и по каплям добавляют винилэтиловый эфир (27 мл, 0.28 моль) с такой скоростью, чтобы температура смеси не поднималась выше 38°C. Дополнительно перемешивают 1 ч при 20°C. Затем в реакционную массу добавляют безводный карбонат калия (3 г, 0.02 моль) и перемешивают 2 ч при 20°C. Образовавшийся осадок отфильтровывают, а фильтрат фракционируют в вакууме в токе азота, т.кип. 101-102°C (12 Торр). Получают бис-(диэтилацеталь) малонового диальдегида (соединение 24) с выходом 43 г (69%). Масс-спектр (MALDI) (С11Н24О4): найдено m/z 221.5, рассчитано m/z 220.31.
ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1.20 (т, 12Н, ОСН2СН3, J=7); 1.96 (т, 2Н, СН2, J=6); 3.46-3.71 (м, 8Н, ОСН2СН3); 4.62 (т, 2Н, 2СН, J=6)
Пример 25. Получение гидрохлорида дианила малонового диальдегида (соединение 25)
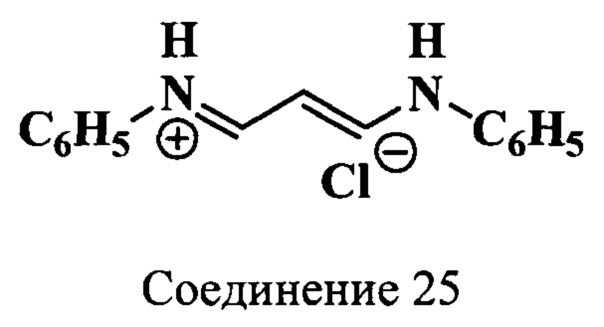
Смесь гидрохлорида анилина (4.,7 г, 36.4 ммоль) и метанола (6 мл) нагревают до образования гомогенного раствора, к которому добавляют по каплям диэтилацеталь малонового диальдегида (соединение 24) (4.0 г, 18.2 ммоль). Затем суспензию кипятят 10 мин, охлаждают до ~20°C, добавляют воду (500 мл) и выдерживают 24 ч при +5°C. Образовавшийся осадок отфильтровывают, промывают ледяной водой и сушат в вакуум-эксикаторе над Р2О5 и КОН. Получают 4.2 г (89%) гидрохлорида (соединение 25) в виде мелких кристаллов оранжево-желтого цвета. Масс-спектр (MALDI) (C15H15N2+): найдено m/z 224.5, рассчитано m/z 223.29
ЯМР 1H (DMSO-d6, δ, м.д., J/Гц): 6.48 (т, 2Н, β-СН, J=11.5); 7.4 (с, 10Н, ArH); 8.9 (т, 2Н, α,α’-СН, J=12.0); 12.49 (д, 2Н, NH, J=13.0)
Синтез красителей
Пример 26. Получение 3-(4-карбоксибутил)-3,3',3'-триметил-N-(4-сульфонатобутил)-N’-этилиндодикарбоцианинового красителя (соединение А1)
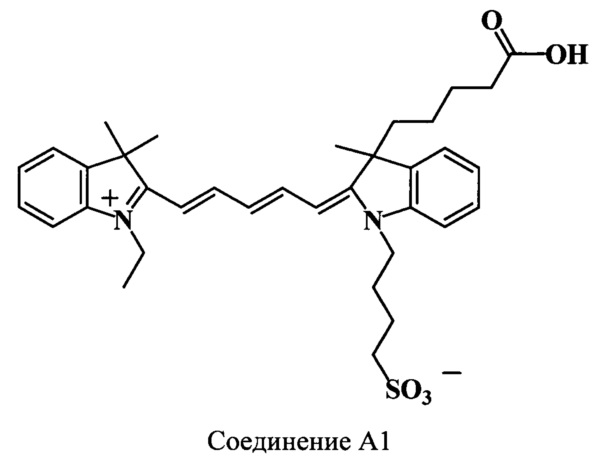
Смесь 2,3,3-триметил-N-этилиндолениний иодида (соединение 23) (63 мг, 0.2 ммоль), гидрохлорида дианила малонового диальдегида (соединение 25) (52 мг, 0.2 ммоль), уксусного ангидрида (700 мкл) и уксусной кислоты (300 мкл) нагревают 2 ч при 118°C. По окончанию нагревания растворитель удаляют в вакууме. Остаток растворяют в уксусном ангидриде (1.7 мл) и добавляют раствор 3-(4-карбоксибутил)-2,3-диметил-N-(4-сульфонатобутил)-индолениния (соединение 11) (80 мг, 0.21 ммоль) в смеси диизопропилэтиламина (200 мкл, 2.1 ммоль) и уксусного ангидрида (800 мкл). Реакционную массу нагревают 3 ч при 60°C. Растворители удаляют, к остатку добавляют 3 мл 0.5 М HCl и нагревают 4 ч при 90°C. По окончанию нагревания добавляют воду (50 мл) и реакционную массу нейтрализуют раствором NaHCO3 до рН 7. Продукты реакции выделяют обращенно-фазовой хроматографией на колонке RP-18 в системе MeCN-0.05 М триэтиламмоний-ацетатный буферный раствор градиентным элюированием от 0 до 50% MeCN. Растворители удаляют, а остаток разбавляют водой, вновь наносят на колонку RP-18, промывают 0.1М раствором NaCl, водой, затем выделяют обращенно-фазовой хроматографией в системе ацетонитрил-вода. Растворитель удаляют в вакууме, остаток сушат в вакуум-эксикаторе над Р2О5. Получают 46 мг (38%) соединения А1, т.пл. 175-176°C. Найдено: m/z 605.7 [М]+. C35H44N2O5S. Вычислено: М=604.80.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 0.43 (м, 1Н, СН2СН2СН2СН2СООН), 0.78 (м, 1Н, СН2СН2СН2СН2СООН), 1.24 (м, 3H, СН2СН3), 1.29 (м, 2Н, СН2СН2СН2СН2СООН), 1.64 (с, 9Н, С(3)Н3, С(3',3')Н3), 1.73 (м, 4Н, CH2CH2CH2CH2SO3), 1.89 (м, 2Н, СН2СН2СН2СН2СООН), 2.18 (м, 1Н, СН2СН2СН2СН2СООН), 2.41 (м, 3H, СН2СН2СН2СН2СООН, CH2CH2CH2CH2SO3), 4.12 (м, 4Н, СН2СН3, CH2CH2CH2CH2SO3), 6.26 (д, 1H, α’-СН, J=13.5), 6.41 (д, 1H, α-СН, J=13.5), 6.57 (т, 1Н, γ-СН, J=12.0), 7.21-7.61 (уш.м, 8Н, ArH), 8.32 (м, 2Н, β,β’-СН)
Пример 27. Получение натриевой соли 3-(4-карбоксибутил)-3,3',3'-триметил-N,N’-ди(4-сульфонатобутил)-индодикарбоцианинового красителя (соединение А2).
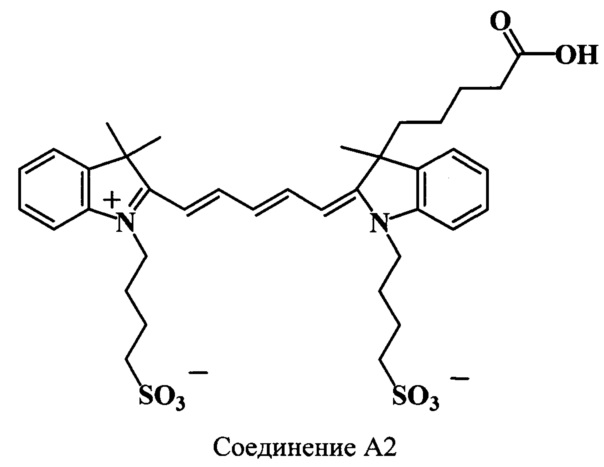
Смесь 2,3,3-триметил-N-(4-сульфонатобутил)-индолениний (соединение 22) (59 мг, 0.2 ммоль), гидрохлорида дианила малонового диальдегида (соединение 25) (52 мг, 0.2 ммоль), уксусного ангидрида (700 мкл) и уксусной кислоты (160 мкл) нагревают 2 ч при 118°C. В реакционную массу добавляют 3-(4-карбоксибутил)-2,3-диметил-N-(4-сульфонатобутил)-индолениний (соединение 11) (80 мг, 0.21 ммоль), безводный ацетат калия (117 мг, 1.2 ммоль), уксусный ангидрид (700 мкл), уксусную кислоту (350 мкл) и нагревают дополнительно 2 ч при 118°C. Продукт реакции выделяют аналогично соединению А1. Получают 71 мг (48%) соединения А2. Масс-спектр (MALDI) (C37H47N2O8S-): найдено m/z 712.1, рассчитано m/z 711.91.
ЯМР 1H (DMSO-d6, δ, м.д., J/Гц): 0.45 (м, 1Н, СН2СН2СН2СН2СООН), 0.77 (м, 1Н, СН2СН2СН2СН2СООН), 1.32 (м, 2Н, СН2СН2СН2СН2СООН), 1.65-1.8 (м, 17Н, С(3)Н3, С(3',3')Н3, CH2CH2CH2CH2SO3), 1.91 (м, 2Н, СН2СН2СН2СН2СООН), 2.17 (м, 1Н, СН2СН2СН2СН2СООН), 2.42 (м, 5Н, СН2СН2СН2СН2СООН, CH2CH2CH2CH2SO3), 4.09 (м, 4Н, CH2CH2CH2CH2SO3), 6.37 (м, 2Н, α,α’-СН), 6.57 (т, 1Н, γ-СН, J=12.0), 7.21-7.6 (м, 8Н, ArH), 8.3 (м, 2Н, β,β’-СН)
Пример 28. Получение 3-(4-карбоксибутил)-3,3',3'-триметил-N’-(4-сульфонатобутил)-N-этилиндодикарбоцианинового красителя (соединение A3)
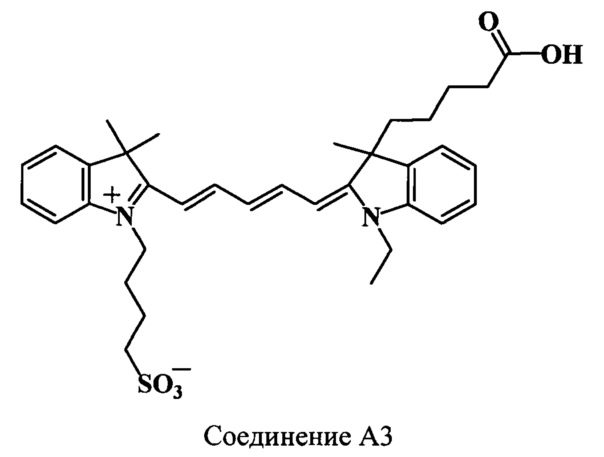
3-(4-Карбоксибутил)-3,3',3'-триметил-N’-(4-сульфонатобутил)-N-этилиндодикарбоцианиновый краситель (соединение A3) получают аналогично соединению А1 при следующих соотношениях реагентов: (1 стадия) 3-(4-карбоксибутил)-2,3-диметил-N-этилиндолениний иодид (соединение 10) (80 мг, 0.2 ммоль), гидрохлорид дианила малонового диальдегида (соединение 25) (73 мг, 0.28 ммоль), уксусный ангидрид (3 мл), ацетилхлорид (65 мкл); (2 стадия) 2,3,3-триметил-N-(4-сульфонатобутил)-индолениний (соединение 22) (149 мг, 0,5 ммоль), уксусный ангидрид (3 мл), диизопропилэтиламин (120 мкл, 1.25 ммоль). Получают 34 мг (28%) соединения A3. Масс-спектр (MALDI) (C35H44N2O5S): найдено m/z 605.7, рассчитано m/z 604.80.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 0.48 (м, 1Н, СН2СН2СН2СН2СООН), 0.79 (м, 1Н, СН2СН2СН2СН2СООН), 1.2-1.35 (м, 5Н, CH2CH3, CH2CH2CH2CH2COOH), 1.65-1.81 (м, 13Н, С(3)Н3, С(3',3')Н3, CH2CH2CH2CH2SO3), 2.02 (м, 2Н, СН2СН2СН2СН2СООН), 2.17 (м, 1Н, СН2СН2СН2СН2СООН), 2.34 (м, 3H, СН2СН2СН2СН2СООН, CH2CH2CH2CH2SO3), 4.12 (м, 4Н, CH2CH3, CH2CH2CH2CH2SO3), 6.35 (м, 2Н, α,α’-СН), 6.58 (м, 1H, γ-СН), 7.22-7.61 (м, 8Н, ArH), 8.3 (м, 2Н, β,β’-СН)
Пример 29. Получение 3-(4-карбоксибутил)-3,3',3'-триметил-5'-сульфо-N,N’-диэтилиндодикарбоцианинового красителя (соединение А4).
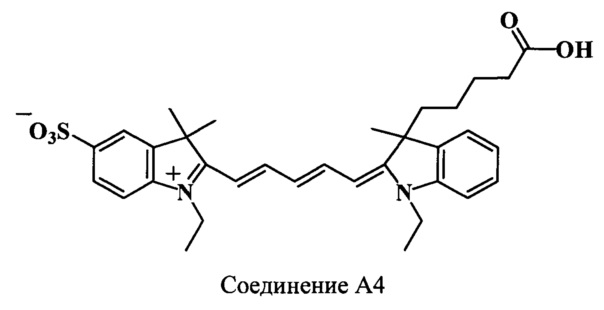
3-(4-Карбоксибутил)-3,3',3'-триметил-5'-сульфо-N,N’-диэтилиндодикарбоцианиновый краситель (соединение А4) получают аналогично соединению А1 при следующих соотношениях реагентов: (1 стадия) 3-(4-карбоксибутил)-2,3-диметил-N-этилиндолениний иодид (соединение 10) (80 мг, 0.2 ммоль), гидрохлорид дианила малонового диальдегида (соединение 25) (73 мг, 0.28 ммоль), уксусный ангидрид (3 мл), ацетилхлорид (65 мкл); (2 стадия) 2,3,3-триметил-5-сульфо-N-этилиндолениний (соединение 21) (134 мг, 0.5 ммоль), уксусный ангидрид (3 мл), диизопропилэтиламин (120 мкл, 1.25 ммоль). Получают 31 мг (27%) соединения А4. Масс-спектр (MALDI) (C33H40N2O5S): найдено m/z 577.0, рассчитано m/z 576.75.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 0.46 (м, 1H, СН2СН2СН2СН2СООН), 0.75 (м, 1Н, СН2СН2СН2СН2СООН), 1.23-1.33 (м, 8Н, СН2СН3, CH2CH2CH2CH2COOH), 1.68 (с, 9Н, С(3)Н3, С(3',3')Н3), 1.89 (м, 2Н, СН2СН2СН2СН2СООН), 2.16 (м, 1H, СН2СН2СН2СН2СООН), 2.4 (м, 1H, СН2СН2СН2СН2СООН), 4.13 (м, 4Н, СН2СН3), 6.26 (д, 1H, α’-СН, J=13.5), 6.34 (д, 1H, α-СН, J=13.5), 6.56 (т, 1Н, γ-СН, J=12.0), 7.2-7.8 (м, 7Н, ArH), 8.35 (т, 2Н, β,β’-СН, J=13.0)
Пример 30. Получение 3-(4-карбоксибутил)-3,3',3'-триметил-5-сульфо-N,N’-диэтил-индодикарбоцианинового красителя (соединение А5).
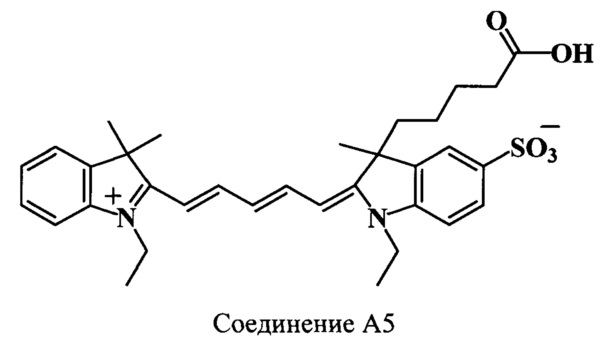
3-(4-карбоксибутил)-3,3',3'-триметил-5-сульфо-N,N’-диэтил-индодикарбоцианинового краситель (соединение А5) получают аналогично соединению А2 при следующих соотношениях реагентов: (1 стадия) 3-(4-карбоксибутил)-2,3-диметил-5-сульфо-N-этилиндолениний (соединение 8) (71 мг, 0.2 ммоль), гидрохлорид дианила малонового диальдегида (соединение 25) (52 мг, 0.2 ммоль), уксусный ангидрид (700 мкл), уксусная кислота (350 мкл); (2 стадия) 2,3,3-триметил-N-этилиндолениний иодид (соединение 23) (66 мг, 0.21 ммоль), безводный ацетат калия (98 мг, 1 ммоль), уксусный ангидрид (700 мкл), уксусная кислота (350 мкл). Продукт реакции выделяют аналогично соединению А1. Получают 20 мг (18%) соединения А5. Масс-спектр (MALDI) (C33H40N2O5S): найдено m/z 577.3, рассчитано m/z 576.75.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 0.47 (м, 1Н, СН2СН2СН2СН2СООН), 0.77 (м, 1H, СН2СН2СН2СН2СООН), 1.24-1.36 (м, 8Н, СН2СН3, СН2СН2СН2СН2СООН), 1.7 (с, 9Н, С(3)Н3, С(3',3')Н3), 1.9 (м, 2Н, СН2СН2СН2СН2СООН), 2.16 (м, 1H, СН2СН2СН2СН2СООН), 2.42 (м, 1Н, СН2СН2СН2СН2СООН), 4.13 (м, 4Н, CH2CH3), 6.27 (д, 1Н, α’-СН, J=13.5), 6.35 (д, 1Н, α-СН, J=13.5), 6.57 (т, 1Н, γ-СН, J=12.0), 7.21-7.75 (м, 7Н, ArH), 8.34 (т, 2Н, β,β’-СН, J=13)
Пример 31. Получение 5-(2-карбоксиэтил)-3,3,3',3'-тетраметил-N-(4-сульфонатобутил)-N’-этилиндодикарбоцианинового красителя (соединение В1)
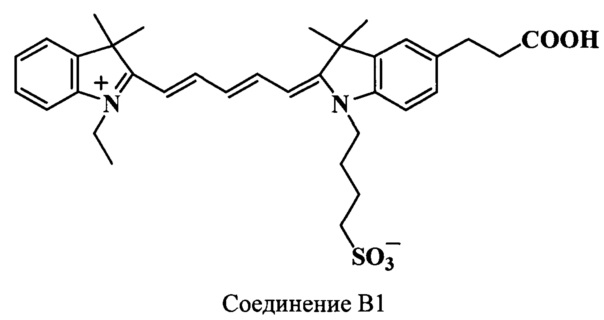
5-(2-Карбоксиэтил)-3,3,3',3'-тетраметил-N-(4-сульфонатобутил)-N’-этилиндодикарбоцианиновый краситель (соединение В1) получают аналогично соединению А1 при следующих соотношениях реагентов: (1 стадия) 2,3,3-триметил-N-этилиндолениний иодид (соединение 23) (54 мг, 0.2 ммоль), гидрохлорид дианила малонового диальдегида (соединение 25) (59 мг, 0.23 ммоль), уксусный ангидрид (1 мл), ацетилхлорид (64 мкл); (2 стадия) 5-(2-карбоксиэтил)-2,3,3-триметил-N-(4-сульфонатобутил)-индолениний (соединение 19) (81 мг, 0.22 ммоль), диизопропилэтиламин (200 мкл, 2.1 ммоль), уксусный ангидрид (2.8 мл). Получают 57 мг (48%) соединения В1. Масс-спектр (MALDI) (C34H42N2O5S): найдено m/z 591.0, рассчитано m/z 590.77.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 1.26 (т, 3H, J 7.0, СН2СН3), 1.63 (с, 12Н, С(3,3)Н3, С(3',3')Н3), 1.73 (м, 4Н, CH2CH2CH2CH2SO3), 2.48 (м, 2Н, CH2CH2CH2CH2SO3), 2.58 (т, 2Н, J 7.5, СН2СН2СООН, J=7.5), 2.88 (т, 2Н, СН2СН2СООН, J=7.5), 4.10 (м, 4Н, СН2СН3, CH2CH2CH2CH2SO3), 6.37 (д, 2Н, α,α’-СН, J=13.5), 6.56 (т, 1Н, γ-СН, J=12.0), 7.19-7.63 (уш.м., 7Н, ArH), 8.31 (м, 2Н, β,β’-СН)
Пример 32. Получение 5-(2-карбоксиэтил)-3,3,3',3'-тетраметил-N’-(4-сульфонатобутил)-N-этилиндодикарбоцианинового красителя (соединение В2)
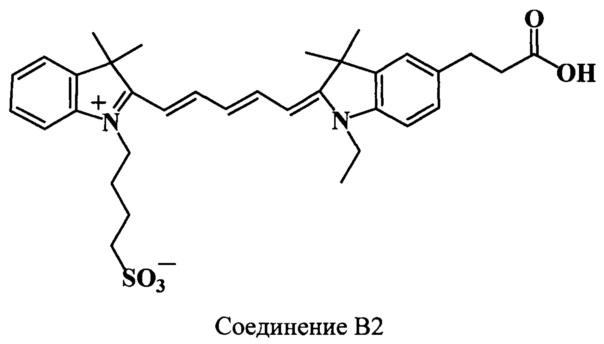
5-(2-Карбоксиэтил)-3,3,3',3'-тетраметил-N’-(4-сульфонатобутил)-N-этилиндодикарбоцианиновый краситель (соединение В2) получают аналогично соединению А2 при следующих соотношениях реагентов: (1 стадия) 2,3,3-триметил-N-(4-сульфонатобутил)-индолениний (соединение 22) (59 мг, 0.2 ммоль), гидрохлорид дианила малонового диальдегида (соединение 25) (59 мг, 0.23 ммоль), уксусный ангидрид (1.5 мл), уксусная кислота (0.5 мл); (2 стадия) 5-(2-карбоксиэтил)-2,3,3-триметил-N-этилиндолениний иодид (соединение 18) (85 мг, 0.22 ммоль), безводный ацетат калия (120 мг, 1.2 ммоль), уксусный ангидрид (1.5 мл), уксусная кислота (0.5 мл). Получают 59 мг (50%) соединения В2. Масс-спектр (MALDI) (C34H42N2O5S): найдено m/z 592.8, рассчитано m/z 590.77.
ЯМР 1Н (DMSO-d6, δ, м.д., J/Гц): 1.28 (т, 3H, J 7.0, СН2СН3), 1.67 (с, 12Н, С(3,3)Н3, С(3',3')Н3), 1.74 (м, 4Н, CH2CH2CH2CH2SO3), 2.48 (м, 2Н, CH2CH2CH2CH2SO3), 2.58 (т, 2Н, J 7.5, СН2СН2СООН, J=7.5), 2.88 (т, 2Н, СН2СН2СООН, J=7.5), 4.13 (м, 4Н, СН2СН3, CH2CH2CH2CH2SO3), 6.30 (д, 2Н, α,α’-СН, J=13.5), 6.56 (т, 1Н, γ-СН, J=12.0), 7.24-7.58 (м, 6Н, ArH), 8.28 (м, 2Н, β,β’-СН)
Пример 33. Получение 5-(2-карбоксиэтил)-3,3,3',3'-тетраметил-5'-сульфо-N,N’-диэтилиндодикарбоцианинового красителя (соединение B3)
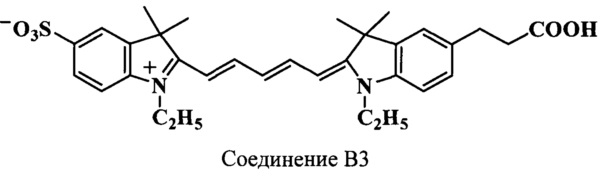
5-(2-Карбоксиэтил)-3,3,3',3'-тетраметил-5'-сульфо-N,N’-диэтилиндодикарбоцианиновый краситель (соединение B3) получают аналогично соединению А2 при следующих соотношениях реагентов: (1 стадия) 2,3,3-триметил-5-сульфо-N-этилиндолениний (соединение 19) (53 мг, 0.2 ммоль), гидрохлорид дианила малонового диальдегида (соединение 25) (59 мг, 0.23 ммоль), уксусный ангидрид (1.5 мл), уксусная кислота (0.5 мл); (2 стадия) 5-(2-карбоксиэтил)-2,3,3-триметил-N-этилиндолениний иодид (соединение 18) (85 мг, 0.22 ммоль), безводный ацетат калия (120 мг, 1,2 ммоль), уксусный ангидрид (1.5 мл), уксусная кислота (0.5 мл). Получают 60 мг (53%) соединения B3. Масс-спектр (MALDI) (C32H38N2O5S): найдено m/z 563.2, рассчитано m/z 562.72.
ЯМР 1H (DMSO-d6, δ, м.д., J/Гц): 1.25 (т, 6Н, СН2СН3, J=7.0), 1.69 (с, 12Н, С(3,3)Н3, С(3',3')Н3), 2.32 (т, 2Н, СН2СН2СООН, J=7.5), 2.86 (т, 2Н, СН2СН2СООН, J=7.5), 4.95 (м, 4Н, СН2СН3), 6.30 (д, 2Н, α,α’-СН, J=13.5), 6.58 (т, 1H, γ-СН, J=12.0), 7.21-7.63 (м, 6Н, ArH), 8.31 (м, 2Н, β,β’-СН)
Пример 34. p-Нитрофениловые эфиры красителей общих формул (А) и (В).
Смесь красителя (0.044 ммоль) и бис(р-нитрофенил)карбоната (26 мг, 0.087 ммоль) растворяли в DMF (1 мл) и перемешивали 2 ч при комнатной температуре. Затем реакционную массу разбавляли водой (10 мл) и выделившийся осадок удаляли фильтрацией. Фильтрат очищали при помощи обращенно-фазовой хроматографии (С18-RP) с использованием в качестве элюента смеси ацетонитрил - вода. Получали активированные эфиры красителей с количественным выходом (около 90%).
Пример 35. Синтез флуоресцентно-меченых 5-(3-аминоаллил)-2'-деоксиуридин-5'-трифосфатов.
К раствору AAdUTP (1 мг, 1.6 мкмоль) в NaHCO3/Na2CO3 буферном растворе (0.2 мл, 0.1 М, рН 8.5) добавили p-нитрофениловый эфир красителя общей формулы А или В (2 мкмоль) в DMF (0.2 мл) и смесь перемешивали 12 ч при +5°C. Конъюгаты общей формулы I очищали от избытка красителя А или В осаждением при помощи 2% раствора NaClO4 в ацетоне (1.6 мл). Осадок собирали центрифугированием при 13000 rpm в течение 1 мин, промывали ацетоном (0.2 мл) и растворяли в 1 мл смеси 30% ацетонитрила в воде.
Раствор модифицированного нуклеотида в 1 мл смеси 30% ацетонитрила в воде наносили на колонку (2×8 см), заполненную DEAE-целлюлозой (DE-52, Whatman), и элюировали в линейном градиенте концентраций от 0.025М до 0.3М ТЕАНС (рН 8.5) в 30% ацетонитриле со скоростью 58 мл/ч. Целевое вещество собирали с колонки в диапазоне концентраций NH4HCO3 от 0.2 до 0.3М.
Фракцию, содержащую модифицированный нуклеотид собирали, разбавляли до объема 50 мл 0.1М ТЕАНС буферным раствором (рН 8.5) и наносили на хроматографическую колонку (2×8 cm) (Analtech, Newark, DE), заполненную C18-RP (40-63 мкм), промывали 0.1М NaClO4, 0.1М EDTA (рН 8.0) и деионизованной водой, и элюировали смесью ацетонитрил - вода.
Фракции, содержащие целевое соединение, объединяли и разбавляли до объема 50 мл деионизованной водой. Концентрацию модифицированного нуклеотида общей формулы I определяли, исходя из молярного коэффициента экстинкции цианиновых красителей. Поглощение определяли в трех повторах путем разбавления стокового раствора в MQ, таким образом, чтобы оптическая плотность не превышала значение 0.1.
Растворители удаляли в вакууме, полученный осадок растворяли в ТЕ-буфере (рН 8.0), получая раствор флуоресцентно-меченого нуклеотида с концентрацией 1 мкмоль/мл. Полученный раствор хранили при температуре -20°C.
Пример 36. Получение 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1-(4-сульфонатобутил)-1'-этилиндо дикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение ТА1).

Получают 0.56 μмоль (35%) соединения ТА1. Найдено: m/z 1111.6 [М]+. C47H58N5O18P3S4-. Вычислено: М=1105.97.
ЯМР 1H (D2O, δ, м.д., J/Гц): 0.47, 0.76 (2 м, 2Н, краситель С(8)Н2), 1.22 (т, 3H, СН2СН3, J=7.0), 1.31 (м, 2Н, краситель С(9)Н2), 1.64 (с, краситель 9Н, С(3)Н3, С(3',3')Н3), 1.77 (м, 4Н, CH2CH2CH2CH2SO3), 1.92 (м, 2Н, краситель С(7)H2), 2.21 (м, 6Н, С(2')Н2, краситель С(6)Н2, CH2CH2CH2CH2SO3), 3.80 (м, 2Н, краситель С(3)H2), 4.08 (уш.м., 8Н, С(3')Н, С(4')Н, С(5')Н2, СН2СН3, CH2CH2CH2CH2SO3), 6.19 (м, 3H, краситель α,α’-СН, С(1')Н), 6.34 (м, 2Н, краситель С(1)Н, С(2)Н), 6.41 (м, 1H, краситель γ-СН), 7.15, 7.21, 7.38, 7.61, 7.71 (5 м., 9Н, С(6)Н, ArH), 7.95 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -21.16 (т, βP), -11.06 (д, αР), -7.98 (д, γР)
Пример 37. Получение 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-ди-(4-сульфонатобутил))индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение ТА2).
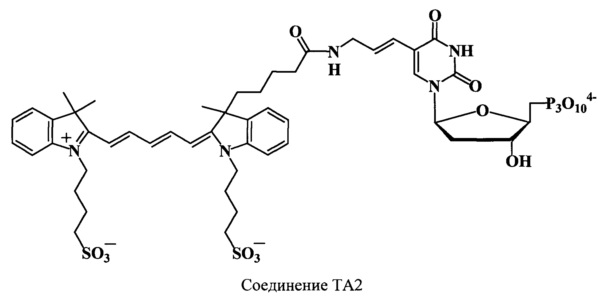
Получают 0.72 μмоль (46%) соединения ТА2. Найдено: m/z 1219.3 [М]+. C49H61N5O21P3S25-. Вычислено: М=1213.08.
ЯМР 1H (D2O, δ, м.д., J/Гц): 0.45, 0.77 (2 м, 2Н, краситель С(8)Н2), 1.35 (м, 2Н, краситель С(9)Н2), 1-62 (с, краситель 9Н, С(3)Н3, С(3',3')Н3), 1.75 (м, 4Н, CH2CH2CH2CH2SO3), 1.9 (м, 2Н, краситель С(7)Н2), 2.25 (м, 6Н, С(2')Н2, краситель С(6)Н2, CH2CH2CH2CH2SO3), 3.85 (м, 2Н, краситель С(3)Н2), 4.12 (уш.м, 8Н, С(3')Н, С(4')Н, С(5')Н2, CH2CH2CH2CH2SO3), 6.15 (м, 3H, краситель α,α’-СН, С(1')Н), 6.31 (м, 2Н, краситель С(1)Н, С(2)Н), 6.39 (м, 1H, краситель γ-СН), 7.11, 7.25, 7.41, 7.59, 7.64 (5 м., 9Н, С(6)Н, ArH), 8.08 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -22.86 (т, βР), -11.94 (д, αР), -7.05 (д, γP)
Пример 38. Получение 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1'-(4-сульфонатобутил)-1-этилиндодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение TA3).
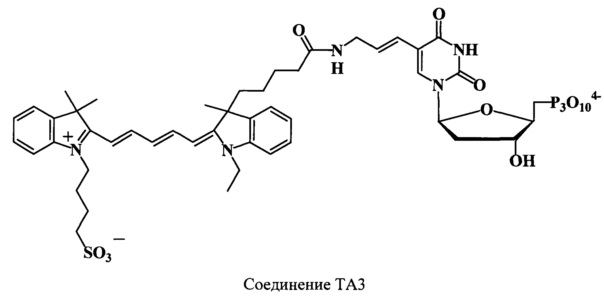
Получают 0.62 μмоль (39%) соединения TA3. Найдено: m/z 1111.2 [М]+. C47H58N5O18P3S4-. Вычислено: М=1105.97.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 0.45, 0.78 (2 м, 2Н, краситель С(8)Н2), 1.21 (т, 3H, СН2СН3, J=7.0), 1.34 (м, 2Н, краситель С(9)Н2), 1.62 (с, краситель 9Н, С(3)Н3, С(3',3')Н3), 1.72 (м, 4Н, CH2CH2CH2CH2SO3), 1.91 (м, 2Н, краситель С(7)H2), 2.24 (м, 6Н, С(2')Н2, краситель С(6)Н2, CH2CH2CH2CH2SO3), 3.81 (м, 2Н, краситель С(3)Н2), 4.12 (уш.м, 8Н, С(3')Н, С(4')Н, С(5')Н2, СН2СН3, CH2CH2CH2CH2SO3), 6.12 (м, 3H, краситель α,α’-СН, С(1')Н), 6.32 (м, 2Н, краситель С(1)Н, С(2)Н), 6.45 (м, 1H, краситель γ-СН), 7.12, 7.25, 7.38, 7.65, 7.75 (5 м., 9Н, С(6)Н, ArH), 7.99 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -21.56 (т, βP), -11.26 (д, αР), -7.13 (д, γP)
Пример 39. Получение 5-[4-аза-5-оксо-9-(3,3',3'-триметил-5'-сульфо-1,1'-диэтил-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение ТА4).
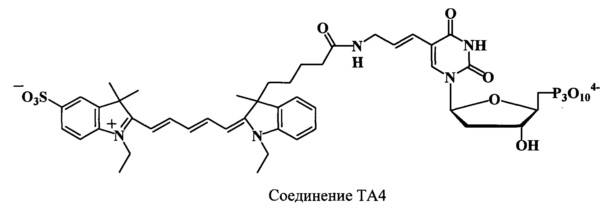
Получают 0.78 μмоль (49%) соединения ТА4. Найдено: m/z 1083.1 [М]+. C45H54N5O18P3S4-. Вычислено: М=1077.92.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 0.43, 0.72 (2 м, 2Н, краситель С(8)Н2), 1-28 (м, 6Н, СН2СН3), 1.35 (м, 2Н, краситель С(9)Н2), 1.58 (с, краситель 9Н, С(3)Н3, С(3',3')Н3), 1.88 (м, 2Н, краситель С(7)Н2), 2.24 (м, 4Н, С(2')Н2, краситель С(6)Н2), 3.85 (м, 2Н, краситель С(3)Н2), 4.13 (уш.м, 8Н, С(3')Н, С(4')Н, С(5')Н2, СН2СН3), 6.21 (м, 3H, краситель α,α’-СН, С(1')H), 6.31 (м, 2Н, краситель С(1)Н, С(2)Н), 6.45 (м, 1H, краситель γ-СН), 7.14, 7.19, 7.31, 7.58, 7.68 (5 м., 8Н, С(6)Н, ArH), 7.98 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -22.35 (т, βР), -12.64 (д, αР), -8.68 (д, γР)
Пример 40. Получение 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-диэтил-5-сульфо-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение ТА5).

Получают 0.67 μмоль (42%) соединения ТА5. Найдено: m/z 1083.4 [М]+. C45H54N5O18P3S4-. Вычислено: М=1077.92.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 0.44, 0.71 (2 м, 2Н, краситель С(8)Н2), 1.25 (м, 6Н, CH2CH3), 1.37 (м, 2Н, краситель С(9)Н2), 1.59 (с, краситель 9Н, С(3)Н3, С(3',3')Н3), 1.89 (м, 2Н, краситель С(7)H2), 2.26 (м, 4Н, С(2')Н2, краситель С(6)Н2), 3.83 (м, 2Н, краситель С(3)Н2), 4.08 (уш.м, 8Н, С(3')Н, С(4')Н, С(5')Н2, СН2СН3), 6.23 (м, 3H, краситель α,α’-СН, С(1')Н), 6.33 (м, 2Н, краситель С(1)Н, С(2)Н), 6.43 (м, 1H, краситель γ-СН), 7.15, 7.17, 7.3, 7.56, 7.66 (5 м., 8Н, С(6)Н, ArH), 7.99 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -22.15 (т, βР), -12.54 (д, αР), -8.24 (д, γР)
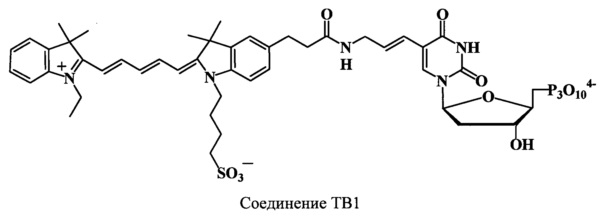
Пример 41. Получение 5-[4-аза-5-оксо-7-(1-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1'-этилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение TB1).
Получают 1 μмоль (63%) соединения TB1. Найдено: m/z 1092.4 [М]+. C46H56N5O18P3S24-. Вычислено: М=1091.95.
ЯМР 1H (D2O, δ, м.д., J/Гц): 1.24 (т, 3H, СН2СН3, J=7.0), 1.59 (с, краситель 12Н, С(3,3)Н3, С(3',3')Н3), 1.73 (м, 4Н, CH2CH2CH2CH2SO3), 2.21 (м, 4Н, С(2')Н2, CH2CH2CH2CH2SO3), 2.52 (т, 2Н, краситель С(6)Н2, J=7.5), 2.91 (т, 2Н, краситель С(7)H2, J=7.5), 3.82 (м, 2Н, краситель С(3)Н2), 4.08 (уш.м, 8Н, С(3')Н, С(4')Н, С(5')Н2, СН2СН3, CH2CH2CH2CH2SO3), 6.21 (м, 3H, краситель α,α’-СН, С(1')H), 6.29 (м, 2Н, краситель С(1)Н, С(2)Н), 6.42 (м, 1H, краситель γ-СН), 7.25, 7.32, 7.39, 7.62, 7.71 (5 м., 8Н, С(6)Н, ArH), 8.07 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -21.45 (т, βР), -11.03 (д, αР), -7.97 (д, γP)
Пример 42. Получение 5-[4-аза-5-оксо-7-(1'-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1-этилин до дикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение ТВ2).

Получают 0.93 μмоль (58%) соединения ТВ2. Найдено: m/z 1093.6 [М]+. C46H56N5O18P3S24-. Вычислено: М=1091.95.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 1.22 (т, 3H, СН2СН3, J=7.0), 1.62 (с, краситель 12Н, С(3,3)Н3, С(3',3')Н3), 1.76 (м, 4Н, CH2CH2CH2CH2SO3), 2.25 (м, 4Н, С(2')Н2, CH2CH2CH2CH2SO3), 2.56 (т, 2Н, краситель С(6)Н2, J=7.5), 2.92 (т, 2Н, краситель С(7)Н2, J=7.5), 3.80 (м, 2Н, краситель С(3)Н2), 4.12 (уш.м, 8Н, С(3')Н, С(4')Н, С(5')Н2, СН2СН3, CH2CH2CH2CH2SO3), 6.17 (м, 3H, краситель α,α’-СН, С(1')Н), 6.32 (м, 2Н, краситель С(1)Н, С(2)Н), 6.42 (м, 1Н, краситель γ-СН), 7.23, 7.29, 7.41, 7.69, 7.74 (5 м., 8Н, С(6)Н, ArH), 7.98 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -22.84 (т, βР), -11.47 (д, αР), -7.13 (д, γP)
Пример 43. Получение 5-[4-аза-5-оксо-7-(3,3,3',3'-тетраметил-5'-сульфо-1,1'-диэтилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил]-2'-дезоксиуридин-5'-трифосфата (соединение TB3).
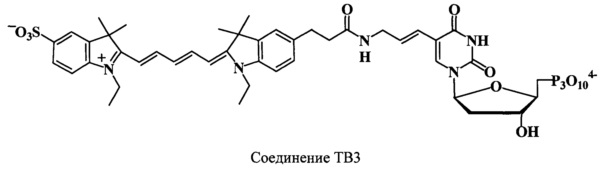
Получают 1.2 μмоль (77%) соединения TB3. Найдено: m/z 1064.58 [М]+. C44H52N5O18P3S4-. Вычислено: М=1063.89.
ЯМР 1Н (D2O, δ, м.д., J/Гц): 1.25 (т, 3H, СН2СН3, J=7.0), 1.68 (с, краситель 12Н, С(3,3)Н3, С(3',3')Н3), 2.21 (м, 2Н, С(2')Н2), 2.53 (т, 2Н, краситель С(6)Н2, J=7.5), 2.78 (т, 2Н, краситель С(7)Н2, J=7.5), 3.82 (м, 2Н, краситель С(3)Н2), 4.08 (уш.м, 8Н, С(3')Н, С(4')Н, С(5')Н2, СН2СН3), 6.19 (м, 3H, краситель α,α’-СН, С(1')Н), 6.35 (м, 2Н, краситель С(1)Н, С(2)Н), 6.45 (м, 1H, краситель γ-СН), 7.15, 7.21, 7.36, 7.61, 7.72 (5 м., 7Н, С(6)Н, ArH), 7.95 (м, 2Н, краситель β,β’-СН)
ЯМР 31Р (D2O, δ, м.д.): -23.15 (т, βР), -10.85 (д, αР), -7.89 (д, γР)
Пример 44. Использование флуоресцентно-меченых нуклеозидтрифосфатов общей формулы (I) на примере тест-системы «ТБ-биочип».
ДНК образцы анализировали в соответствии с рекомендациями производителя (Биочип-ИМБ, Москва, Россия). Амплификацию ДНК образца осуществляли методом мультиплексной двухраундовой ПЦР. Обнаружение продуктов ПЦР после каждой стадии подтверждали при помощи агарозного гель электрофореза. На первой стадии мультиплексной ПЦР проводили амплификацию геномной ДНК (3 μl) в конечном объеме 30 мкл. Реакционная смесь (конечный объем 30 мкл) содержала 3 мкл Taq буфера, 2.5 ед. Taq полимеразы, по 0.2 мкМ каждого дезоксинуклеозид трифосфата, праймеры, и 3 мкл ДНК образца. Температурный режим был следующим: денатурация 95°C - 4 мин, затем 36 циклов амплификации (95°C - 30 сек, 67°C - 30 сек, 72°C - 30 сек), заключительная стадия инкубации 72°C - 5 мин. В качестве матрицы для проведения 2 стадии использовали 1 мкл реакционной смеси, полученной на 1 стадии. Вторую стадию проводили методом асимметричной мультиплексной ПЦР для получения преимущественного флуоресцентно-меченого продукта, необходимого для гибридизации с олигонуклеотидными зондами. Реакционная смесь 2-й стадии содержала 8 мкмоль флуоресцентно-меченого нуклеотида и избыток одного праймера. Температурный режим был следующим: денатурация 95°C - 5 мин, затем 37 циклов амплификации (95°C - 20 сек, 65°C - 30 сек, 72°C - 30 сек), заключительная стадия инкубации 72°C - 5 мин. К 12 мкл реакционной смеси, полученной на 2 стадии мультиплексной ПЦР и содержащей преимущественно одноцепочечную флуоресцентно-меченую ДНК, добавляли 24 мкл концентрированного раствора гибридизационного буфера. Полученную смесь помещали в гибридизационную камеру биочипа. Гибридизацию проводили при 37°C в течение 18 ч. По окончании гибридизации микрочип отмывали дистиллированной водой и высушивали на воздухе. Регистрацию результатов гибридизации выполняли на портативном анализаторе флуоресценции «Чипдетектор» (Биочип-ИМБ, Россия) с использованием специализированного программного обеспечения Imageware.
Пример 45. Использование флуоресцентно-меченых нуклеозидтрифосфатов общей формулы (I) на примере тест-системы «ПФ-биочип Тромбо».
ДНК образцы анализировали в соответствии с рекомендациями производителя (Биочип-ИМБ, Москва, Россия). Амплификацию ДНК образца осуществляли методом мультиплексной двухраундовой ПЦР. Обнаружение продуктов ПЦР после каждой стадии подтверждали при помощи агарозного гель электрофореза. Реакционная смесь (конечный объем 25 мкл) содержала 10х буфер для ПЦР, 2.5 ед. Taq полимеразы, по 0.2 мкМ каждого дезоксинуклеозид трифосфата, 0.4 пикамоль праймеров, и 10 нг ДНК образца. Температурный режим был следующим: денатурация 94°C - 4 мин, затем 35 циклов амплификации (94°C - 30 сек, 62°C - 30 сек, 72°C - 30 сек), заключительная стадия инкубации 72°C - 5 мин. В качестве матрицы для проведения 2 стадии использовали 2 мкл реакционной смеси, полученной на 1 стадии. Вторую стадию проводили методом асимметричной мультиплексной ПЦР для получения преимущественного флуоресцентно-меченого продукта, необходимого для гибридизации с олигонуклеотидными зондами. Реакционная смесь 2-ой стадии содержала 8 мкмоль флуоресцентно-меченого нуклеотида и избыток одного праймера. Температурный режим был следующим: денатурация 94°C - 4 мин, затем 35 циклов амплификации (94°C - 30 сек, 62°C - 30 сек, 72°C - 30 сек), заключительная стадия инкубации 72°C - 5 мин. Гибридизацию флуоресцентно-меченого продукта проводили в соответствии с рекомендациями производителя (Биочип-ИМБ, Москва, Россия).
Флуоресцентно-меченые нуклеозидтрифосфаты общей формулы (I) могут быть использованы во всех диагностических тест-системах, основанных на ПЦР с последующим гибридизационным анализом на олигонуклеотидных биочипах и флуоресцентной регистрацией результатов анализа.
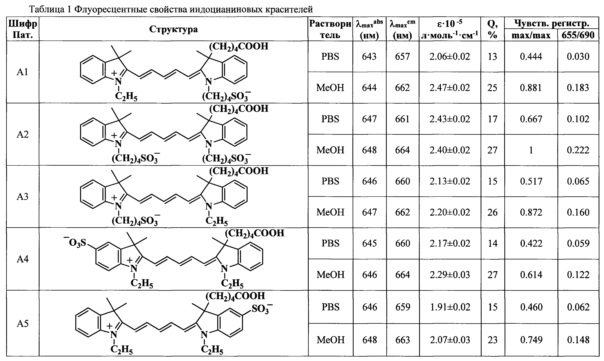
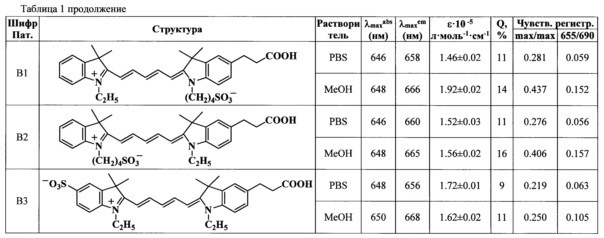
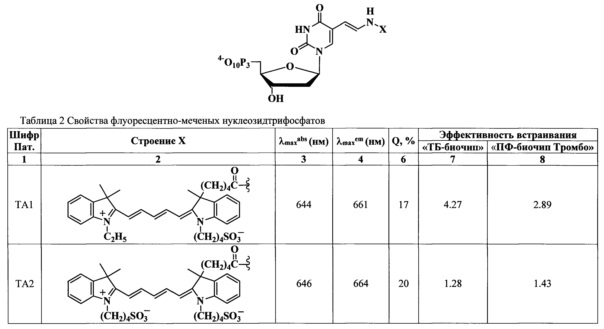
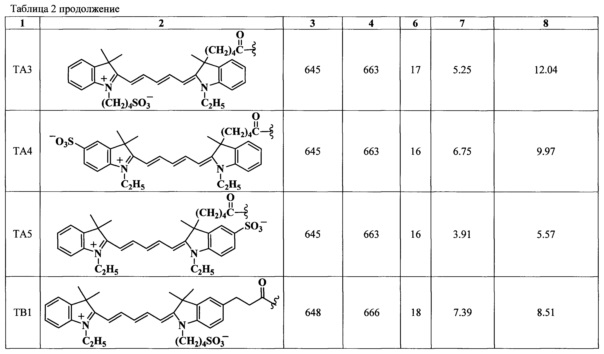

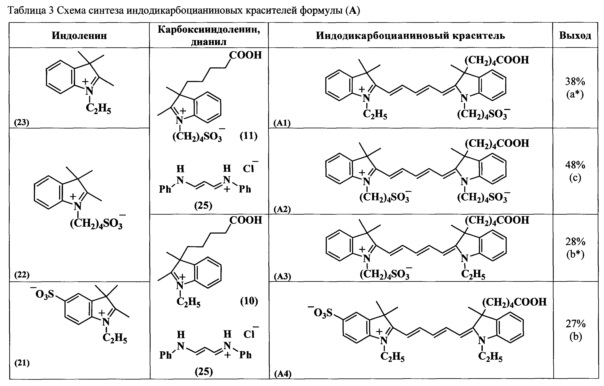
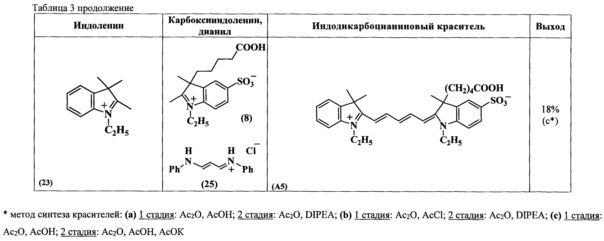
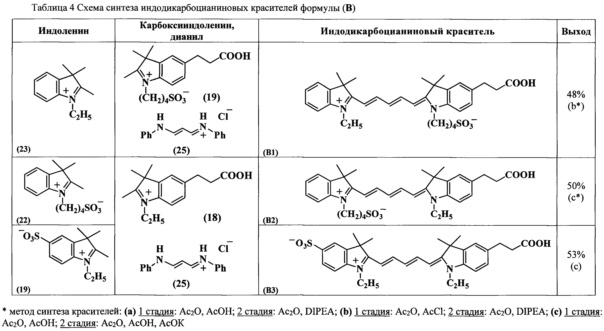
| название | год | авторы | номер документа |
|---|---|---|---|
| Дезоксиуридинтрифосфаты, связанные с цианиновыми красителями сульфамидоалкильными линкерами, для использования в ПЦР | 2017 |
|
RU2667070C1 |
| Дезоксиуридинтрифосфаты, маркированные цвитерионными индоцианиновыми красителями | 2017 |
|
RU2725884C2 |
| Способ ферментативного получения модифицированных ДНК для создания реагентов, специфично связывающихся с гидрофобными участками высокомолекулярных органических соединений | 2017 |
|
RU2699522C2 |
| ФОСФОРОАМИДАТНЫЕ ПРОИЗВОДНЫЕ 5-ФТОР-2'-ДЕЗОКСИУРИДИНА ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2614406C2 |
| 6-ГИДРОКСИНАФТОХИНОНЫ ЛАБДАНОВОГО ТИПА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2012 |
|
RU2479582C1 |
| ПОЛИМЕТИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРЕСЦЕНТНЫХ МЕТОК | 2016 |
|
RU2696562C1 |
| Способ определения субстратной эффективности производных трифосфатов дезоксиуридина для ДНК-полимераз методом реакции достраивания праймера | 2019 |
|
RU2731739C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУБСТРАТНОЙ СОВМЕСТИМОСТИ МОДИФИЦИРОВАННЫХ ТРИФОСФАТОВ ДЕЗОКСИУРИДИНА И ДНК-ПОЛИМЕРАЗ СОЧЕТАНИЕМ МЕТОДОВ КОЛИЧЕСТВЕННОЙ ПЦР И ЭЛЕКТРОФОРЕЗА | 2019 |
|
RU2736969C1 |
| АНАЛОГИ ПРИРОДНЫХ ДЕЗОКСИРИБОНУКЛЕОЗИДТРИФОСФАТОВ И РИБОНУКЛЕОЗИДТРИФОСФАТОВ, СОДЕРЖАЩИЕ РЕПОРТЁРНЫЕ ФЛУОРЕСЦЕНТНЫЕ ГРУППЫ, ДЛЯ ИСПОЛЬЗОВАНИЯ В АНАЛИТИЧЕСКОЙ БИООРГАНИЧЕСКОЙ ХИМИИ | 2014 |
|
RU2582198C1 |
| КОНЪЮГАТ ФЛУОРЕСЦЕНТНОГО КРАСИТЕЛЯ С ВЕЩЕСТВОМ ПЕПТИДНОЙ ПРИРОДЫ, ВКЛЮЧАЮЩИМ ПСМА-СВЯЗЫВАЮЩИЙ ЛИГАНД НА ОСНОВЕ ПРОИЗВОДНОГО МОЧЕВИНЫ ДЛЯ ВИЗУАЛИЗАЦИИ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ ПСМА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2713151C1 |
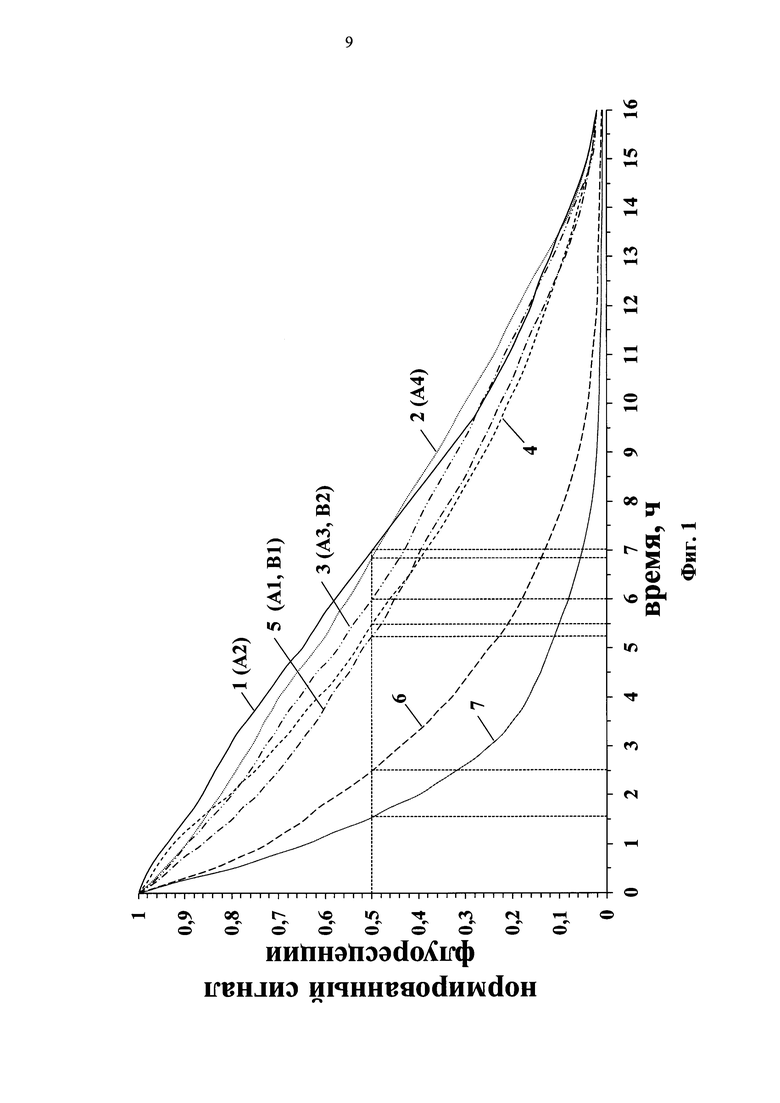
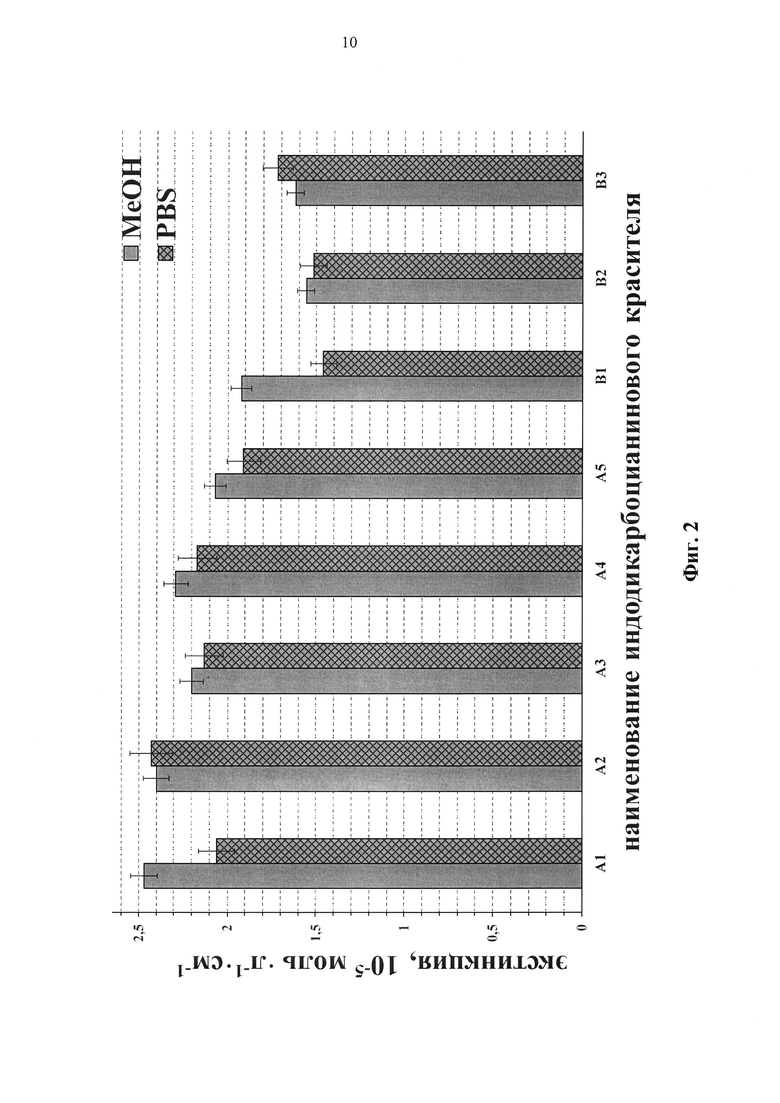
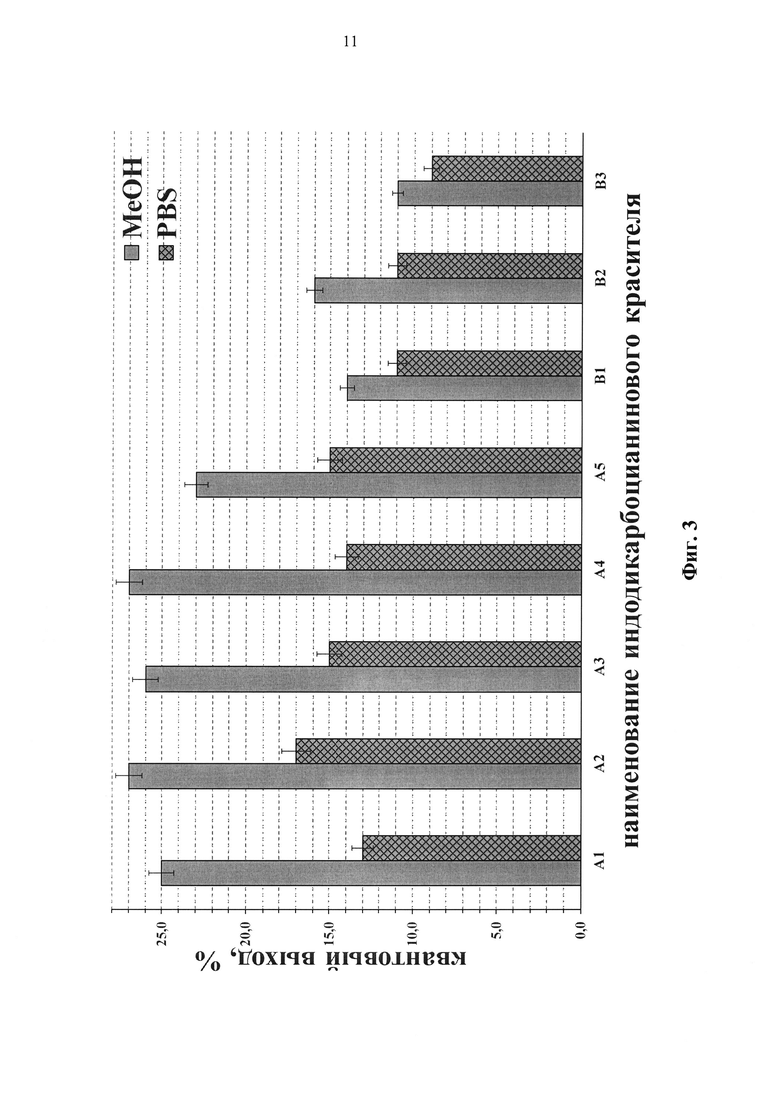
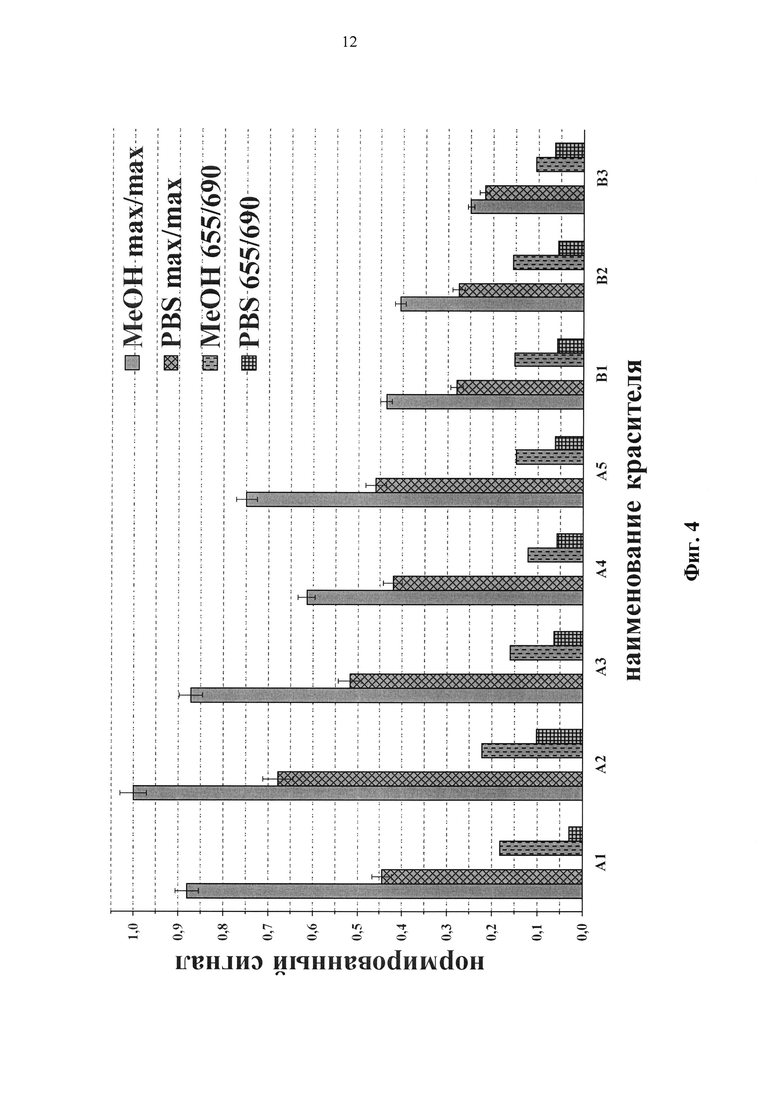
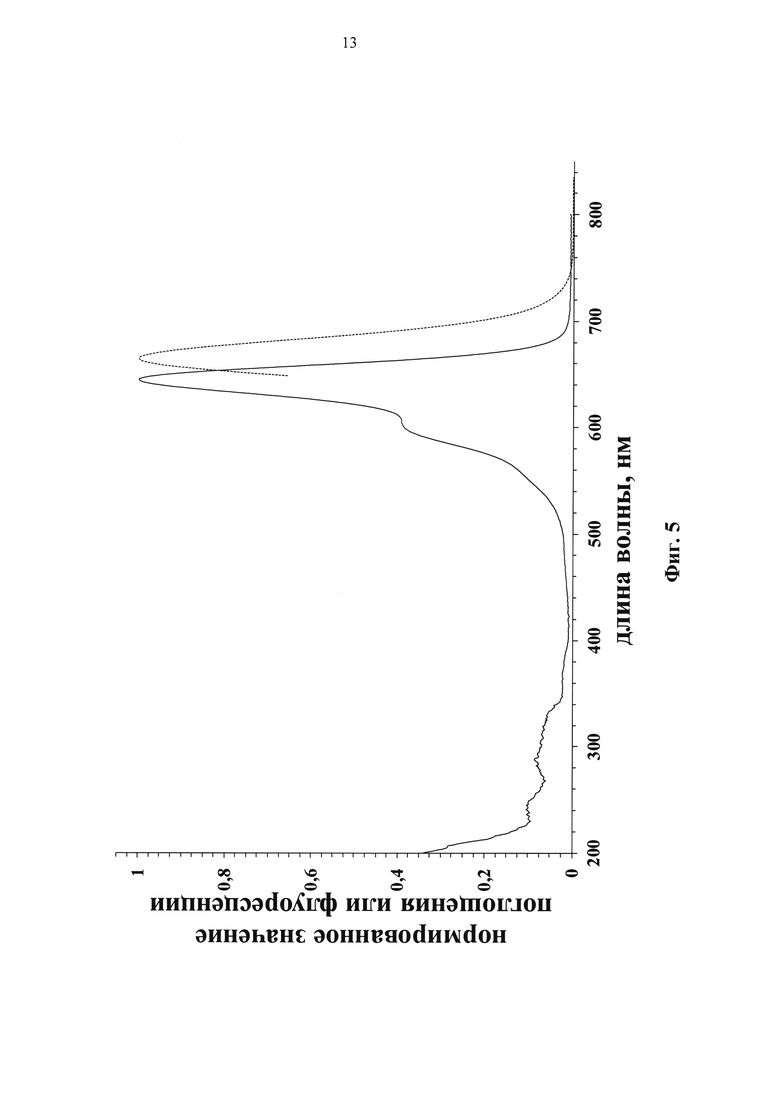
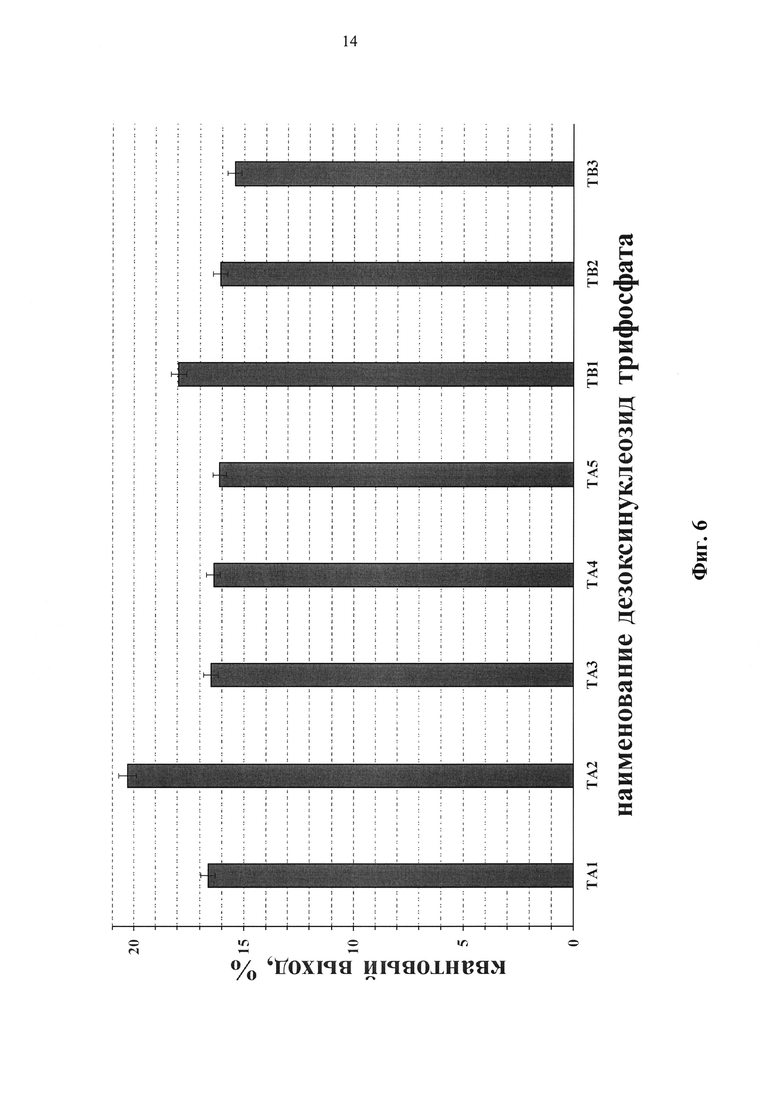

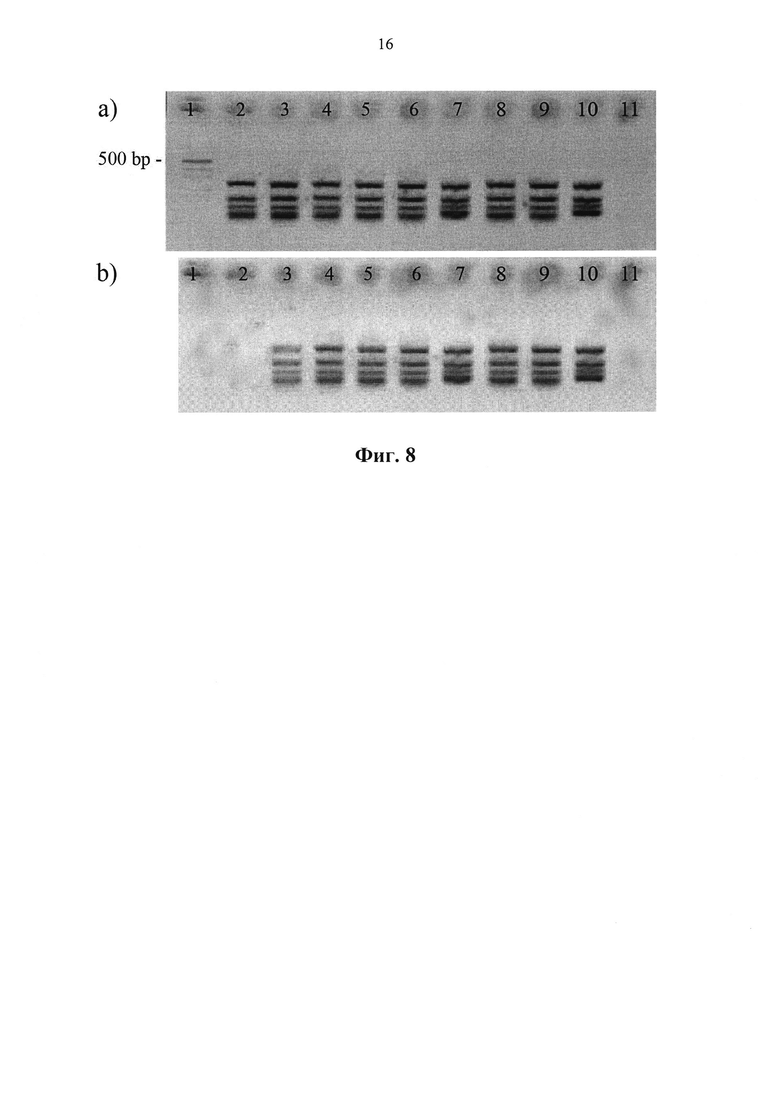
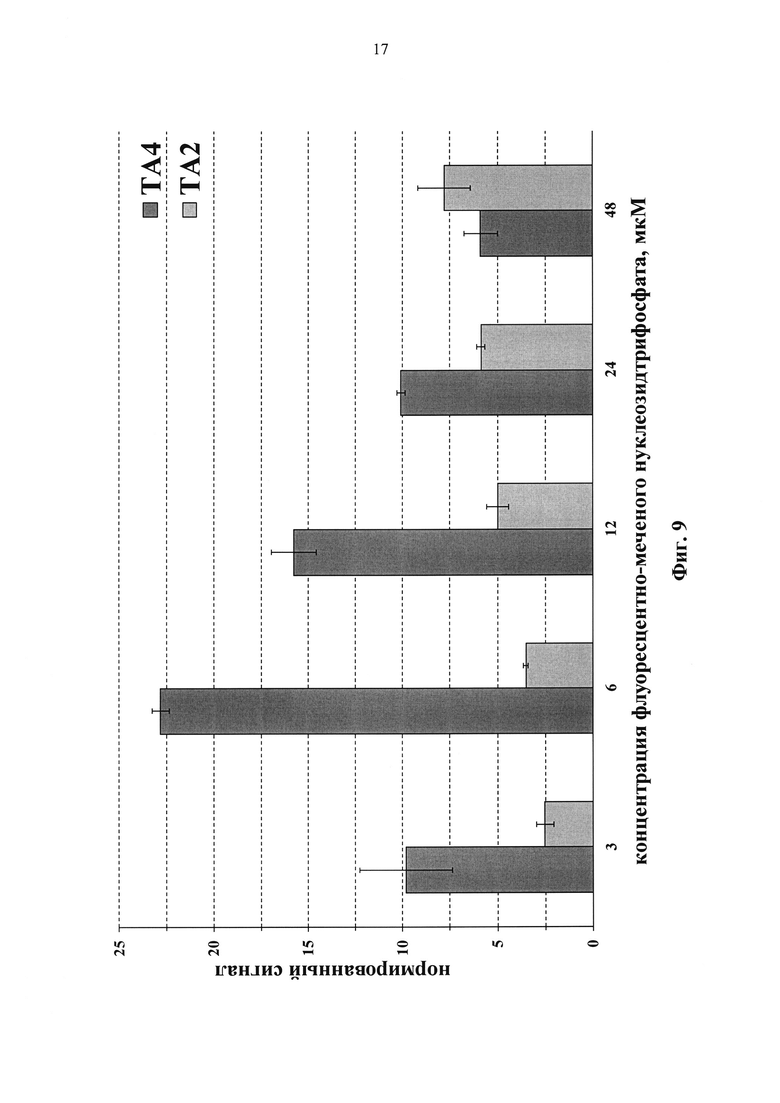
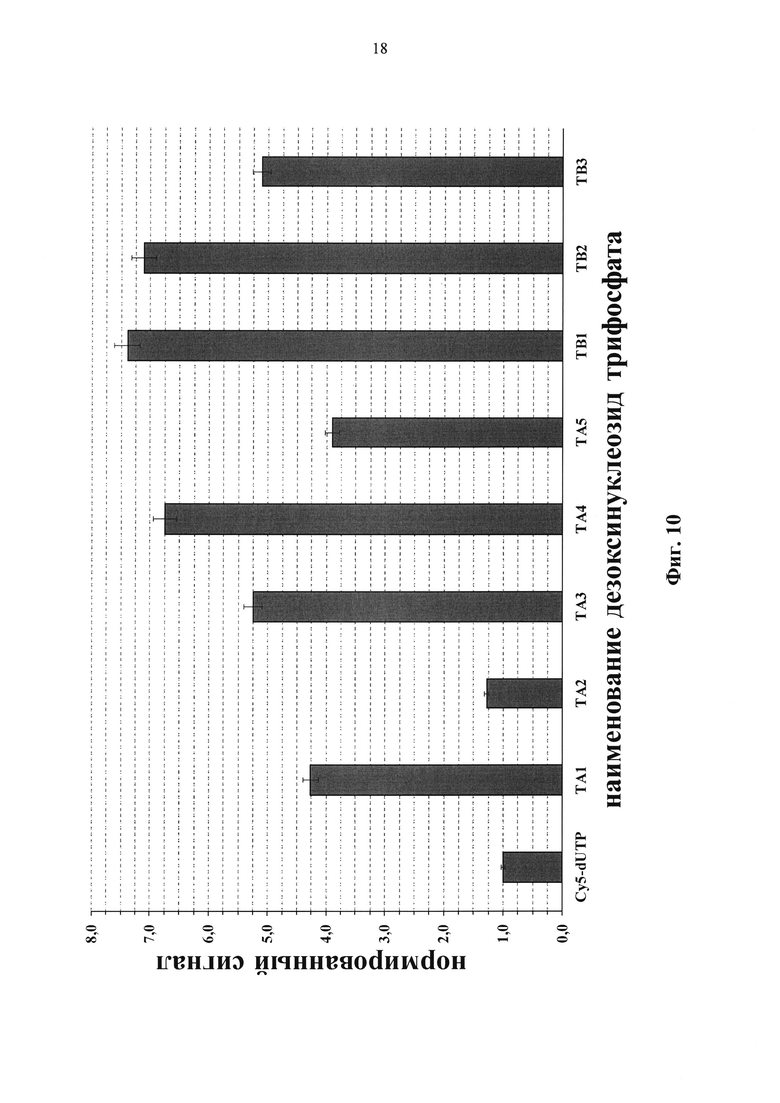
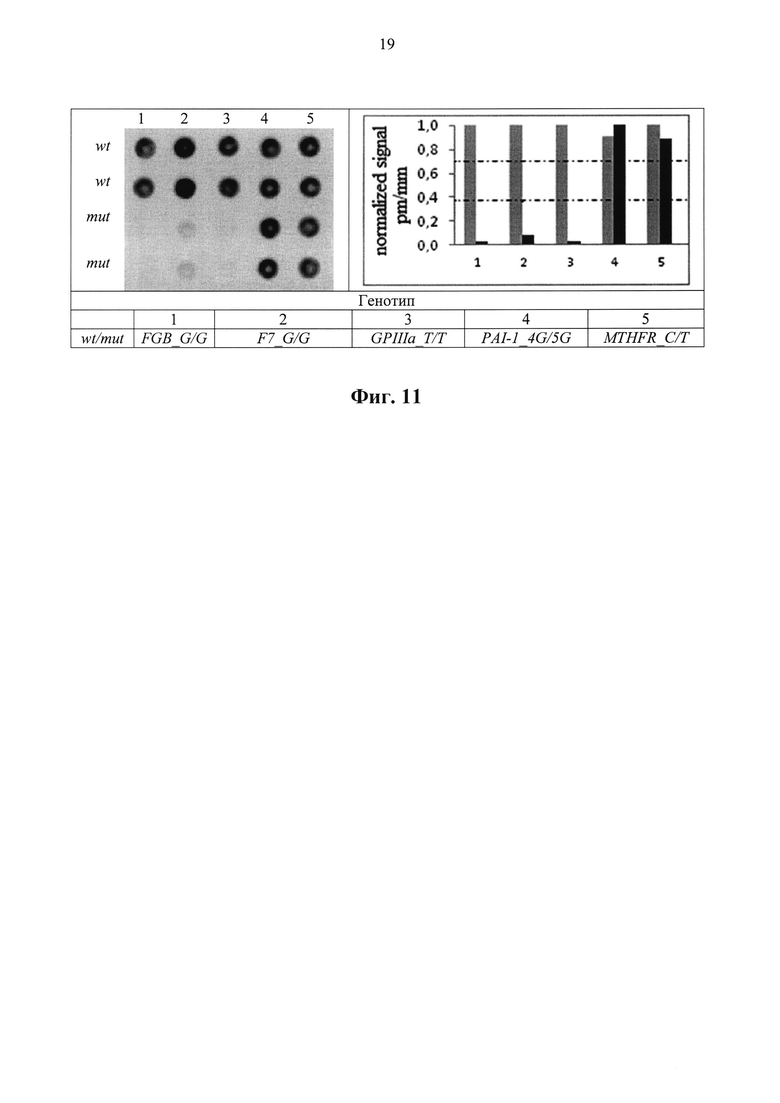

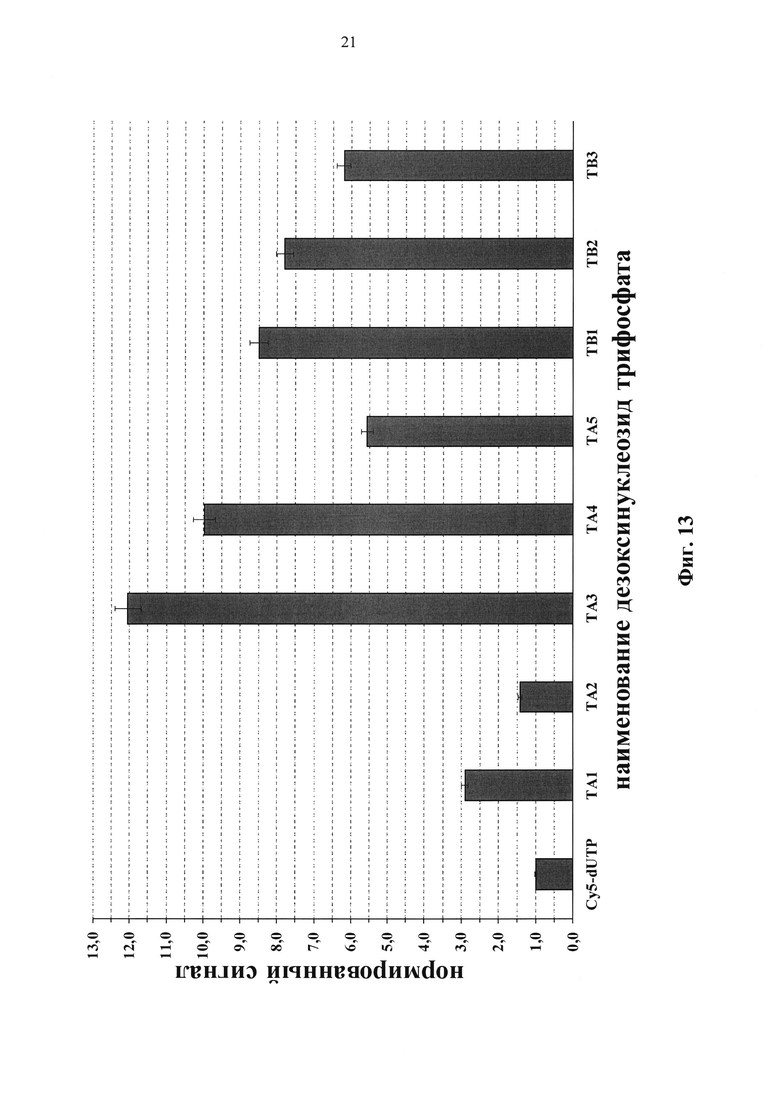
Изобретение относится к флуоресцентно-меченым дезоксиуридин трифосфатам, которые могут найти применение в качестве меток для маркирования ДНК в ходе ПЦР. Предложенные соединения включают в себя 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1-(4-сульфонатобутил)-1'-этилиндодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-ди-(4-сульфонатобутил))индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1'-(4-сульфонатобутил)-1-этилиндодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-5'-сульфо-1,1'-диэтил-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-диэтил-5-сульфо-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-7-(1-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1'-этилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-7-(1'-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1-этилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-7-(3,3,3',3'-тетраметил-5'-сульфо-1,1'-диэтилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил]-2'-дезоксиуридин-5'-трифосфат или их соли. Предложены новые флуоресцентно-меченые нуклеотиды, эффективные в качестве флуоресцентных меток для маркирования ДНК в ходе ПЦР, в том числе с использованием известных тест-систем для определения мутаций, ассоциированных с лекарственной устойчивостью к М. Tuberculosis и с генетической предрасположенностью к тромбозам. 3 н.п. ф-лы, 13 ил., 4 табл., 45 пр.
1. Соединения, представляющие собой
5-[4-аза-5-оксо-9-(3,3',3'-триметил-1-(4-сульфонатобутил)-1'-этилиндодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат,
5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-ди-(4-сульфонатобутил))индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат,
5-[4-аза-5-оксо-9-(3,3',3'-триметил-1'-(4-сульфонатобутил)-1-этилиндодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат,
5-[4-аза-5-оксо-9-(3,3',3'-триметил-5'-сульфо-1,1'-диэтил-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат,
5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-диэтил-5-сульфо-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат или их соли.
2. Соединения, представляющие собой
5-[4-аза-5-оксо-7-(1-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1'-этилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат,
5-[4-аза-5-оксо-7-(1'-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1-этилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат,
5-[4-аза-5-оксо-7-(3,3,3',3'-тетраметил-5'-сульфо-1,1'-диэтилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил]-2 '-дезоксиуридин-5'-трифосфат или их соли.
3. Применение соединений по п.п. 1 и 2 в качестве флуоресцентных меток для маркирования ДНК в ходе ПЦР.
| Устройство для очистки цилиндрических поверхностей | 1987 |
|
SU1491591A1 |
| Воздухонагреватель доменной печи | 1983 |
|
SU1211294A1 |
| Устройство для контроля перемещения объекта | 1983 |
|
SU1152008A1 |
| Водоразборная колонка | 1990 |
|
SU1801165A3 |
| ГЕНОМНЫЙ АНАЛИЗ | 2005 |
|
RU2464320C2 |
| ГЕНОМНЫЙ АНАЛИЗ | 2005 |
|
RU2464320C2 |
Авторы
Даты
2017-12-04—Публикация
2016-06-08—Подача