Изобретение относится к области биологически активных соединений и касается разработки новых производных класса 1,3,4-тиадиазинов, обладающих антиагрегантным действием и способных эффективно влиять на гемостаз - ингибировать агрегацию тромбоцитов.
Агрегация тромбоцитов играет важную роль в физиологии и патологии человека, так как является важным этиологическим моментом в патогенезе нарушений кровообращения (в частности, капиллярного). Агрегированные тромбоциты (склеенные между собой) и тромбоциты, адгезированные к сосудистой стенке, служат основой для формирования тромба, что приводит к возникновению сердечно-сосудистых заболеваний (нарушению коронарного и мозгового кровообращения, патологии сосудов конечностей, брюшной полости и др.), к развитию тромбозов после хирургических операций, нарушению кровообращения при ранении человека и животных.
Разработка эффективных антиагрегантов, тормозящих агрегацию тромбоцитов, является важной проблемой современной медицины, решение которой позволит значительно улучшить лечение инфаркта миокарда, тромботического инсульта (данные заболевания являются ведущей причиной смертности в развитых странах). Поэтому модуляция агрегационной способности тромбоцитов - одно из главных направлений в коррекции нарушений системы гемостаза. В настоящее время в мире активно разрабатываются способы целенаправленного химического синтеза антиагрегантов нового поколения, обладающих высокой эффективностью и избирательностью действия.
В последние годы разработаны и внедрены в медицинскую практику эффективные ингибиторы агрегации тромбоцитов из группы производных тиенопиперидина (тиклопидин, клопидогрель). Они являются на сегодняшний день оптимальными из имеющихся препаратов. Однако их терапевтический эффект развивается лишь на второй день и достигает максимума лишь на 4-7-й день лечения. Тиклопидин часто вызывает осложнения в виде диареи, сыпи и лейкопении. Как тиклопидин, так и клопидогрель не предназначены для внутривенного введения, т.е. не могут быть средствами скорой помощи.
Настоящий проект патентной заявки предполагает разработку синтеза средства, способного эффективно ингибировать агрегацию тромбоцитов, в том числе при внутривенном введении.
Предшествующий уровень техники
Известны различные представители класса тиадиазина, отличающиеся положением гетероатомов в тиадиазиновом кольце, которые обладают влиянием на свертывающую систему крови. Так, в работе [N.Campillo] с соавторами [1] констатировал уменьшение агрегации тромбоцитов, индуцированной аденазиндифосфатом (АДФ), арахидоновой кислотой (АК) и коллагеном как in vitro, так и ex vivo при воздействии гетероарилпиразино[2,3-с][1,2,6]тиадиазин-2,2-диоксидов. Однако антиагрегацинные свойства данных соединений в несколько раз ниже, чем у заявляемых соединений как при агрегации тромбоцитов АК, так и АДФ.
В работе [Rehse К] показано, что 2-нитрозоимино-3,6-дигидро-2Н-1,3,4-тиадиазины также снижают агрегацию тромбоцитов, индуцированную коллагеном [2].
В других исследованиях [Ozcelic A.B.] [3] установлена антифибринолитическая активность и некоторое ингибирование тромбоцитарной агрегации 3-замещенных-5-(4-карбокси-циклогексилметил)-тетрагидро-2Н-1,3,5-тиадиазин-2-тионом.
В патенте [Чупахин О.Н и др.] приведены убедительные доказательства антиагрегантного и антикоагулянтного действия 5-арил-1,3,4-тиадиазин-2 аминов [4].
Таким образом, тиадиазины представляют собой класс соединений, на основе которых возможно создание эффективных антиагрегантов, действующих на различные пути активации и агрегации тромбоцитов.
Целью настоящей работы была разработка синтеза и изучение антиагрегационных свойств новых групп класса 1,3,4-тиадиазина: 5-(4′-гидроксифенил)- и 5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин-2-аминов, которые могли бы удовлетворять современным требованиям медицины к препаратам такого рода. Препараты должны быть устойчивыми, способными эффективно ингибировать агрегацию тромбоцитов, в том числе в условиях внутривенного введения и, таким образом, могли бы быть средствами скорой помощи.
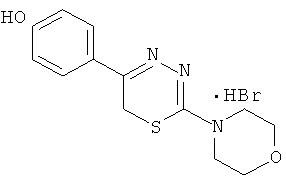
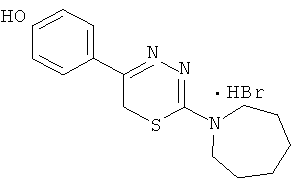
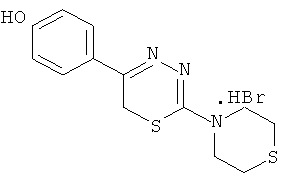
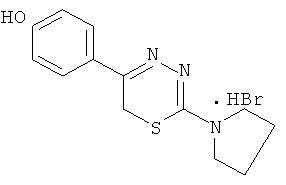
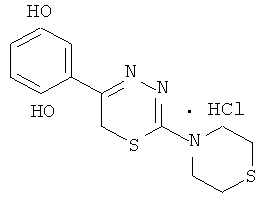
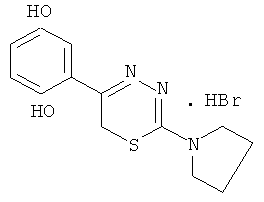
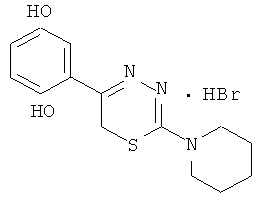
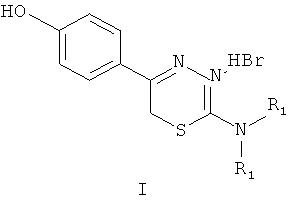
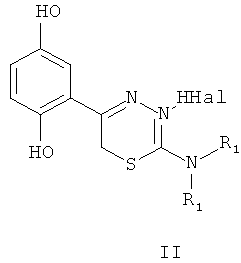
Указанный технический результат достигается тем, что согласно изобретению предложены гидробромиды 5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин-2 аминов, общей формулы (I) и гидрохлориды 5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин-2 аминов общей формулы (II), обладающие антиагрегантной активностью в условиях внутривенного введения.
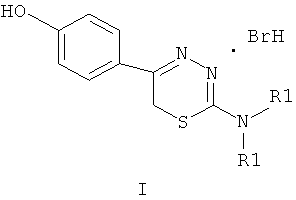
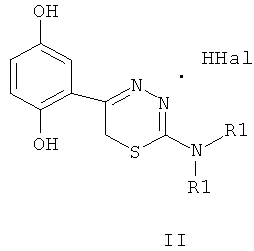
NR1R1 = морфолино-; тиоморфолино-; пирролидино-; пиперидино-; гексаметиленимино-
HHal=HCl
Данные соединения могут быть использованы в кардиологии и позволят значительно улучшить лечение различных сердечно-сосудистых заболеваний, в том числе инфаркта миокарда и тромботического инсульта.
Близкими по структуре (прототип), по отношению к заявляемым « 5-(4′-гидроксифенил)- и 5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин-2 амины, гидрогалогениды, ингибирующие агрегацию тромбоцитов при внутривенном введении» являются 5-арил-1,3,4-тиадиазин-2 амины [4] общей формулы III:
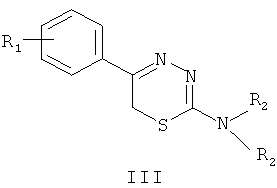
где R1=Н; Cl; Br; C1-С4-алкокси; С1-С4 алкильные группы
NR2R2 = циклоалкиламины
От прототипа заявляемые соединения отличаются тем, что в положение-5 1,3,4-тиадиазинового кольца вместо арильного остатка введены остатки фенола и гидрохинона. Наличие в положение-5 тиадиазинового цикла таких заместителей привело к новым положительным свойствам данных препаратов: качественному улучшению растворимости соединений, повышению их как гидрофильности, так и липофильности, а также наличия, благодаря фенолам, вероятных антиоксидантных свойств.
Все исследованные соединения ингибировали агрегацию тромбоцитов, индуцированную АК и АДФ (таблицы 1-4) в диапазоне концентраций 0,001-0,1 mM.
Примеры синтеза и физико-химические характеристики заявляемых соединений
Все соединения получены с выходом 50-80% путем конденсации соответствующих α-бром-2-ацетилтиофенов и 4,4-циклоалкиламиноосемикарбазидами при нагревании в абсолютном этаноле и последующим высаживанием продуктов реакций эфиром из охлажденных растворов. Строение соединений доказано спектральными данными 1Н ЯМР. Чистота соединений подтверждена элементным анализом, тонкослойной хроматографией.
Экспериментальная часть
Синтез исходных соединений: α-бром-2,5-дигидроксиацетофенон
2′,5′-Диоксиацетофенон - синтон для получения α-бром-2,5-дигидроксиацетофенона, получен нагреванием смеси 25 г (13 ммоль) диацетата гидрохинона с 58 г (20 ммоль) безводного AlBr3 при температуре 110-120°С до прекращения бурного выделения HBr, затем реакционную массу выдерживали при температуре 160-165°С 3 ч. Остаток AlBr3 разлагали добавлением измельченного льда, а затем - добавлением 125 мл конц. HCl. Сушили на воздухе, кристаллизовали из большого объема воды. Выход 15 г (75%).
Суспензию 14,8 г (66 ммоль) безводного CuBr2 в 60 мл сухого этилацетата нагревали до полного растворения осадка и добавляли раствор 5 г (33 моль) 2,5-диоксиацетофенона в 80 мл этилацетата и 80 мл хлороформа. Нагревали при перемешивании до перехода темно-зеленой окраски раствора в желтую. Горячую реакционную массу фильтровали, осадок на фильтре промывали горячей смесью этилацетата и хлороформа. Растворитель отгоняли, остаток перекристаллизовывали из бензола. Выход 5,0 г (66%). Т.пл. 113-115°С. Лит. т.пл. 112-113°С.
α-Бром-4-гидроксиацетофенон
К 15,6 г (70 ммоль) безводного CuBr2 в 80 мл безводного этилацетата добавляли 5 г (40 мммоль) 4-гидроксиацетофенона в смеси безводных, нагретых до кипения 40 мл этилацетата и 40 мл хлороформа. Суспензию кипятили при перемешивании 1 ч до изменения цвета осадка от черного до бесцветного CuBr. Осадок CuBr отфильтровывали, растворитель отгоняли, остаток - кристаллический осадок слегка желтого цвета, при стоянии темнеет. Выход 5,2 г (68%). Т.пл. 127-128°С (кристаллизовали из сухого бензола).
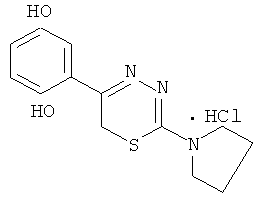
Пример 1
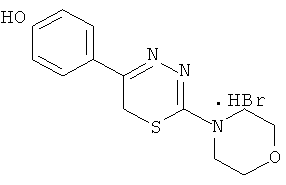
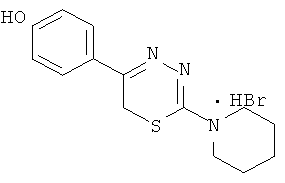
2-Морфолино-5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (1)
К раствору 1,08 г (5 ммоль) α′-бром-4-гидроксиацетофенона в 40 мл абсолютного этанола добавляли 0,81 г (5 ммоль) морфолинида тиокарбазиновой кислоты и 0,5 мл концентрированной HBr, кипятили 40 мин, отфильтровывали выпавший осадок слегка желтого цвета. К фильтрату при охлаждении добавляли сухой диэтиловый эфир, образовавшийся осадок слегка желтого цвета отфильтровывали, сушили, объединяли с основным продуктом и кристаллизовали из абсолютного этанола с добавлением нескольких капель HBr конц. Выход 1,40 г (78%). Т.пл. 228-229°С. Rf=0,32 (элюент, бутанол:уксусная кислота:вода 4:1:5). Найдено, %: С 43,54; Н 4,44; N 11,71. C13H16BrN3O2S. Вычислено,%: С 43,58; Н 4,47; N 11,73, ЯМР1Н (ДМСО-d6), δ, м.д.: 3,81 (м, 4Н, морфолино), 3,90 (м, 4Н, морфолино); 4,37 (с, 2Н, CH2S), 6,91 и 7,85 (д.д., 4Н, C6H4); 10,05 (уш.с., 1Н, ОН).
Пример 2
2-Гексаметиленимин-1-ил-5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (2).
К раствору 8,4 г (40 ммоль) α-бром-4-гидроксиацетофенона в 100 мл абсолютного этанола добавляли раствор 7 г (40 ммоль) 4-гексаметилениминотиосемикарбазида в 150 мл абсолютного этанола и 1,5 мл конц. HBr, кипятили 50 мин. После горячего фильтрования к фильтрату темно-коричневого цвета добавляли при охлаждении 350 мл сухого диэтилового эфира, образовавшийся осадок слегка желтого цвета отфильтровывали, сушили и перекристаллизовывали из абсолютного этанола. Выход 6,5 г (44,8%). Т.пл. 221-222°С. Найдено, %: С 48,57; Н 5,48: N 11, 28. C15H20BrN3OS. Вычислено, %: С 48,65; Н 5,41; N 11,35. ЯМР 1Н (ДМСО-d6), δ м.д.:
1,76 (6Н, с, гексаметиленимин-1-ил), 2,50 (2Н, с, гексаметиленимин-1-ил), 3,88 (4Н, с, гексаметиленимин-1-ил), 4,29 (2Н, с, CH2S), 7,35 (4Н, д.д., С6Н4), 10,02 (1Н, уш.с., NH), 13,32 (1H, уш.с., ОН).
Пример 3
2-Тиоморфолино-5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (3)
К раствору 2,16 г (10 ммоль) α-бром-4-гидроксиацетофенона в 60 мл абсолютного этанола добавляли 1,77 г (10 ммоль) тиоморфолида тиокарбазиновой кислоты и 1 мл конц. HBr, кипятили 40 мин, отфильтровывали выпавший осадок слегка желтого цвета. К фильтрату при охлаждении льдом добавляли 100 мл сухого диэтилового эфира, образовавшийся осадок отфильтровывали, сушили, объединяли с основным продуктом и перекристаллизовывали из абсолютного этанола. Выход 2,51 г (73%). Т.пл. 217-218°С. Найдено, %: С 41,62; Н 4,22; N 11,34. C13H16BrN3OS2. Вычислено, %: С 41,71; Н 4,28; N 11,23. ЯМР 1Н (ДМСО-d6), δ, м.д.: 2,85 (4Н, м, тиоморфолино), 4,14 (4Н, м, тиоморфолино), 4,31 (2Н, с, CH2S), 7,41 (4Н, д.д., С6Н4), 10,23 (1H, уш.с., NH), 13,25 (1H, уш.с., ОН).
Пример 4
2-Пирролидин-1-ил-5-(4-гидроксифенил)-6Н-1,3,4тиадиазин, гидробромид (4)
К раствору 2,16 г (10 ммоль) α-бром-4-гидроксиацетофенона в 60 мл абсолютного этанола добавляли 1,45 г (10 ммоль) 4-тетраметилениминотиосемикарбазида в 50 мл абсолютного этанола и 0,5 мл концентрированной HBr, кипятили 45 мин. Выпавший после горячего фильтрования и последующего охлаждения осадок слегка желтого цвета отфильтровывали, сушили и кристаллизовали из абсолютного этанола. Выход 1,65 г (48,4%). Т.пл. 223-224°С. Rf=0,61 (бутанол:уксусная кислота:вода 3:1:3). Найдено, %: С 45,42; Н 4,94; N 12,31. C13H16BrN3OS. Вычислено, %: С 45,64; Н 4,72; N 12,36. ЯМР 1Н (ДМСО-d6), δ, м.д.: 2,04 (4Н, м, пирролидин-1-ил), 3,76 (4Н, м, пирролидин-1-ил), 4,14 (2Н, с, CH2S), 7,39 (4Н, д.д., С6Н4). 10,18 (1Н, уш.с., NH), 13,10 (1Н, уш.с., NH).
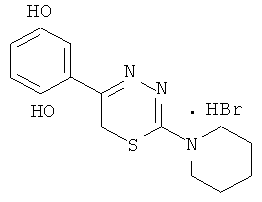
Пример 5
2-Пиперидино-5-(4-гидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (5)
При слабом нагревании растворяли 1,59 г (10 ммоль) 4-пентаметилениминотиосемикарбазида в 40 мл абсолютного этанола и добавляли 2,16 г (10 ммоль) α-бром-4-гидроксиацетофенона и 0,5 мл концентрированной HBr, кипятили 40 мин, отфильтровывали выпавший осадок слегка желтого цвета, сушили и кристаллизовали из абсолютного этанола. Выход 1,81 г (50,6%). Т.пл. 253-255°С. Rf=0,52 (бутанол:уксусная кислота:вода 4:1:5). Найдено, %: С 47,44; Н 5,04; N 12,02. C14H18BrN3OS. Вычислено, %: С 47,24; Н 5,12; N 11,84. ЯМР 1Н (ДМСО-d6), δ, м.д.: 1,81 (6Н, м, пиперидино), 3,92 (4Н, м, пиперидино), 4,27 (2Н, с, CH2S), 7.18 (4Н, д.д., С6Н4), 10,15 (1Н, уш.с., NH), 13,11 (1H, уш.с., ОН).
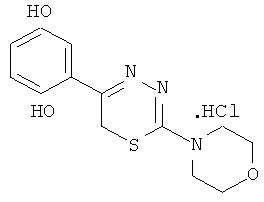
Пример 6
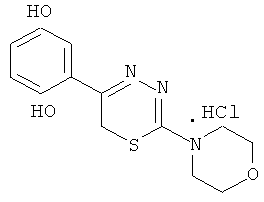
2-Морфолино-5-(2′,5′-дигидроксифенил)-1,3,4-тиадиазин, гидрохлорид (6)
К раствору 1,62 г (7 ммоль) α′-бромхинацетофенона в 30 мл этанола добавляли 1,13 г (7 ммоль) морфолида тиокарбазиновой кислоты, кипятили 1 час. Выпавший ярко-желтый осадок - 2-морфолино-5-(2′,5′-дигидроксифенил)-1,3,4-тиадиазин, гидробромид отфильтровывали, промывали этанолом. Выход 1,3 г (47%). Т.пл. °С (с разлож.). Для получения А-38 гидрохлорида, 0,4 г А-38 гидробромида растворяли в 15 мл горячей воды, охлаждали до 25°С и добавляли 7% водный раствор аммиака до рН 5-6. Выпавшее основание тиадиазина растворяли в минимальном количестве конц. HCl. После охлаждения льдом выделяли гидрохлорид 2-морфолино-5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазина. Т.пл. 242°С (из воды). Найдено, % С 46,80; Н 4,76; N 12,75. C13H16ClN3SO3. Вычислено, %: С 47,34; Н 4,85; N 12,74. ЯМР 1Н (ДМСО-d6), δ, м.д.: 4.2 (с, 2Н, SCH2), 3,9 (м, 4Н, морфолино), 3,7 (м, 4Н, морфолино), 5,2-6,6 (уш.с., 2Н, ОН), 6,8-7,8 (м, 3Н, С6Н3).
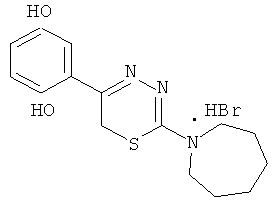
Пример 7
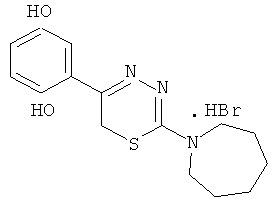
2-Гексаметиленимин-1-ил-5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (7)
К 100 мл концентрированной HBr добавляли 6,9 г (30 ммоль) α-бром-2,5-диоксиацетофенона и 5,1 г (30 ммоль) 4-гексаметилениминотиосемикарбазида, нагревали 1 ч при 80°С. Выпавший кристаллический продукт отфильтровывали и кристаллизовали из воды. Выход 8,0 г (80%). Т.пл. 232°С. Найдено,%: С 45,61; Н 4,90; N 11,41. C15H20BrN3O2S. Вычислено, %: С 46,63; Н 5,22; N 10,87. ЯМР 1Н (ДМСО-d6), δ, м.д.: 1,81 (6Н, с, гексаметиленимин-1-ил), 2,5 (2Н, с, гексаметиленимин-1-ил), 3,88 (4Н, с, гексаметиленимин-1-ил), 4,24 (2Н, с, CH2S), 6,80-6,95 (3Н, м, С6Н3), 9,0-10,2 (2Н, уш,с., ОН).
Пример 8
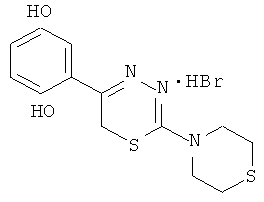
2-Тиоморфолино-5-(2′,5′-дигвдроксифенил)-6Н,-1,3,4-тиадиазин, гидробромид (8)
К 100 мл конц. HBr добавляли 6,9 г (30 ммоль) α-бром-2,5-диоксиацетофенона и 5,3 г (30 ммоль) тиоморфолида тиокарбазиновой кислоты, нагревали при 80°С в течение часа. Выпавший при нагревании кристаллический осадок отфильтровывали и кристаллизовали с углем из воды, подкисленной HBr до рН 4. Выход 7,0 г (64%). Т.пл. 214-215°С. Найдено, %: С 40,15; Н 4,40; N 10,77. C13H16BrN3O2S2. Вычислено: С 40,0; Н 4,13; N 10,76. ЯМР 1Н (ДМСО-d6), δ, м.д.: 2,85 (4Н, м, тиоморфолино), 4,15 (4Н, м, тиоморфолино), 4,3 (2Н, с. CH2S), 6,70-7,05 (3Н, м, С6Н3), 8,50-9,40 (2Н, уш.с., ОН).
Пример 9
2-Пирролидин-1-ил-5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадазин, гидрохлорид (9)
При слабом нагревании растворяли 2,9 г (20 ммоль) 4-тетраметилениминотиосемикарбазида в 100 мл конц. HCl и к бесцветному раствору добавляли 4,6 г (20 ммоль) α-бром-2,5-диоксиацетофенона, нагревали 30 мин при 80°С. Охлаждали и отфильтровывали желтый осадок и кристаллизовали из воды, подкисленной до рН 5. Выход 5,0 г (80%). Т.пл. 228-229°С. Найдено, %: С 49,44; Н 4,98; N 13,16. C13H16ClN3O2S. Вычислено, %: С 49,75; Н 5,14; N 13,49. ЯМР 1Н (ДМСО-d6), δ, м.д.: 2,08 (4Н, уш.с., пирролидино), 3,82 (4Н, с, пирролидино), 4,18 (2Н, с, CH2S), 6,80-6,81 (3Н, м, С6Н3), 9,06 (1H, уш.с., ОН), 10,6 (1H, уш.с., ОН).
Пример 10
2-Пиперидино-5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (10)
К раствору 2,4 г (15 ммоль) 4-пентаметилениминотиосемикарбазида в 50 мл изопропилового спирта добавляли 3,4 г (15 ммоль) α-бром-2,5-диоксиацетофенона в 50 мл изопропилового спирта, кипятили 1 ч. Выпавший при нагревании осадок желтого цвета отфильтровывали и промывали охлажденным изопропиловым спиртом, сушили и перекристаллизовывали из подкисленной HBr воды (рН 4), сушили при 100°С. Выход 4,5 г (80%). Найдено, %: С 45,23; Н 5,02; N 11,32. C14H18BrN3O2S. Вычислено, %: С 45,16; Н 4,87; N 11,29. ЯМР 1Н (ДМСО-d6), δ, м.д.; 1,76 (6Н, с, пиперидино), 3,87 (4Н, с, пиперидино), 4,24 (2Н, с, CH2S), 6,80-6,94 (3Н, м, С6Н3), 8,90 (1Н, уш.с., ОН), 11,18 (1H, уш.с., ОН).
2. Исследование антиагрегационной активности in vitro
Материалы и методы:
Рабочие растворы исследуемых соединений готовили путем их разведения в дистиллированной воде при комнатной температуре или при нагреве до 50-70°С до достижения необходимой концентрации.
Эксперименты по исследованию антиагрегационной способности соединений были выполнены с использованием венозной крови здоровых доноров (n=50), которую получали путем пункции кубитальной вены и стабилизировали 3,8%-ным раствором цитрата натрия в соотношении 9:1. Для приготовления богатой тромбоцитами плазмы кровь центрифугировали в течение 10 минут при 1000 об/мин, после чего верхний слой плазмы переносили в другую пробирку, а остаток повторно центрифугировали в течение 20 минут при 3000 об/мин для получения плазмы, бедной тромбоцитами. Агрегацию тромбоцитов исследовали на агрегометре фирмы "Chrono-Log Corporation" (США) по методу G. Born [5]. С этой целью в кювету прибора помещали 250 мкл богатой тромбоцитами плазмы. Оптическим контролем служил такой же объем плазмы, не содержащей тромбоцитов. О степени агрегации судили по максимальной величине падения оптической плотности после окончания реакции (Аmах) по сравнению с исходной величиной. Эксперименты проводили следующим образом: в кювету, содержащую 250 мкл богатой тромбоцитами плазмы, добавляли 28 мкл изучаемого препарата и инкубировали полученную смесь в течение 5 мин при температуре 37°С и индуцировали процесс тромбоцитарной агрегации. В контрольных опытах к богатой тромбоцитами плазме добавляли только проагрегант. В качестве проагрегантов в работе использовали арахидоновую кислоту (АК) в конечной концентрации 1×10-3 M и АДФ (Boehringer Mannheim, Германия) в конечной концентрации 1×10-5 М. Арахидоновая кислота (АК), свободная от продуктов окисления, была предоставлена сотрудниками лаборатории оксилипидов Института биоорганической химии им. М.М.Шемякина и Ю.А.Овчинникова РАН.
Влияние 5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин-2 аминов (1-5) на агрегацию тромбоцитов человека in vitro
- Было изучено влияние на АК-индуцированную агрегацию тромбоцитов 1,3,4-тиадиазинов (1-5), содержащих в качестве заместителя в положении-5 тиадиазинового кольца, - гидроксифенил (таблица 1).
Как видно из таблицы, антиагрегационной активностью обладают все изученные 1,3,4-тиадиазины, но активность их различна и зависит от заместителя в положении-2 тиадиазинового кольца.
Так, наличие в структуре вещества пирролидинового приводит к резкому снижению антиагрегационной активности. Соединение 4 ингибировало АК-индуцированную агрегацию тромбоцитов только в максимальных исследованных концентрациях (0,25-0,1 mM). Замена атома кислорода на атом серы в морфолиновом цикле также ухудшала антиагрегационную активность: вещество Н-75 достоверно снижало тромбоцитарное взаимодействие в концентрациях 0,25-0,1 mM. При этом в минимальной эффективной концентрации (0,25 тМ) Н-75 ингибировало агрегацию тромбоцитов в 2 раза по сравнению с контрольным экспериментом.
Вещества 1, 2 и 5 ингибировали агрегацию тромбоцитов наиболее эффективно. Соединения 1 и 2 снижали агрегацию в два раза по сравнению с контролем в концентрациях менее 0,1 mM и менее 0,025 mM соответственно. Антиагрегационное действие соединения 5 продолжалось и при его использовании в более низких концентрациях (вплоть до 0,001 mM).
Таким образом, наиболее эффективным в случае АК-индуцированной агрегации оказалось вещество, содержащее в своей структуре пиперидин: 2-пиперидино-5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (5)
Соединения 3 и 4 ингибировали АК-индуцированную агрегацию тромбоцитов только в максимальных исследованных концентрациях (0,25-0,1 mM).
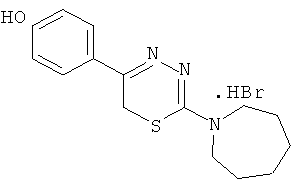
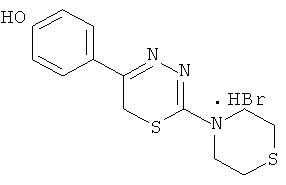
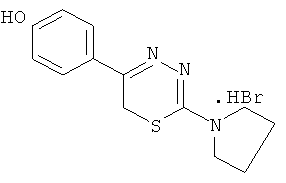
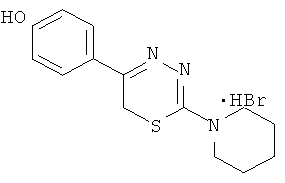
- Было изучено влияние на АДФ-индуцированную агрегацию тромбоцитов 1,3,4-тиадиазинов (1-5), содержащих в качестве заместителя в тиадиазиновом кольце гидроксифенил (таблица 2).
Соединение 5 показало себя наиболее эффективным и в случае индуцирования тромбоцитарной агрегации АДФ (таблица 2). В максимальной исследованной концентрации (1 mM) оно ингибировало тромбоцитарное взаимодействие более, чем в два раза по сравнению с контрольной величиной. Достоверное снижение АДФ-индуцированной агрегации наблюдалось во всем диапазоне концентраций соединения 5 (0,001-1 mM), при этом даже в минимальных дозах данное соединение уменьшало активность тромбоцитов на 20-22%.
Другим соединением, оказывающим выраженное антиагрегационное действие на АДФ-индуцированную агрегацию, оказалось соединение 4, которое проявило активность, сопоставимую с соединением 5.
Тиадиазины, содержащие в своей структуре: морфолин, тиоморфолин, гексаметиленимин, были менее эффективны и достоверно ингибировали АДФ-индуцированную агрегацию в концентрациях 0,1-1 тМ и 0,5-1 mM соответственно.
Таким образом, среди всех изученных соединений, содержащих в своей структуре гидроксифенил, наиболее эффективными, в случае АДФ-индуцированной агрегации, являются соединения-лидеры:
2-пирролидино-5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (4) и
2-пиперидино-5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазин, гидробромид (5).
Влияние 5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин-2 аминов (6-10) на агрегацию тромбоцитов человека in vitro
- Было изучено влияние на АК-индуцированную агрегацию тромбоцитов 1,3,4-тиадиазинов (6-10), содержащих в качестве заместителя в положении-5 тиадиазинового кольца дигидроксифенил (таблица 3).
- Было изучено влияние на АДФ-индуцированную агрегацию тромбоцитов 1,3,4-тиадиазинов(6-10), содержащих в качестве заместителя в положении-5 тиадиазинового кольца дигидроксифенил (таблица 4).
Все исследованные 1,3,4-тиадиазины (6-10), содержащие в своей структуре дигидроксифенил, оказывали близкий по величине эффективный антиагрегационный эффект, как в случае АК-, так и в случае АДФ-индуцированной агрегации. Все соединения ингибировали АК-индуцированную агрегацию в концентрациях 0,01-0,25 mM и АДФ-индуцированную агрегацию в концентрациях 0,001-1 mM. Максимальный антиагрегационный эффект (снижение агрегации в 2 раза) наблюдалось у соединения-лидера 6 в концентрации 0,5 mM и в 1,7 раза - у всех остальных соединений в концентрации 1-0,5 mM.
Таким образом, в случае АК- и АДФ-индуцированной агрегации тромбоцитов, наличие в химической структуре морфолинового, пирролидинового, гексаметилениминового, тиоморфолинового или пиперидинового циклов не оказывает существенного влияния на антиагрегационную активность 5-(2′,5′-гидроксифенил)-6Н-1,3,4-тиадиазин-2 аминов (6-10).
- Были изучены интегральные параметры плазменного гемостаза крови кроликов для двух представителей (1 и 6) разных групп изученных соединений.
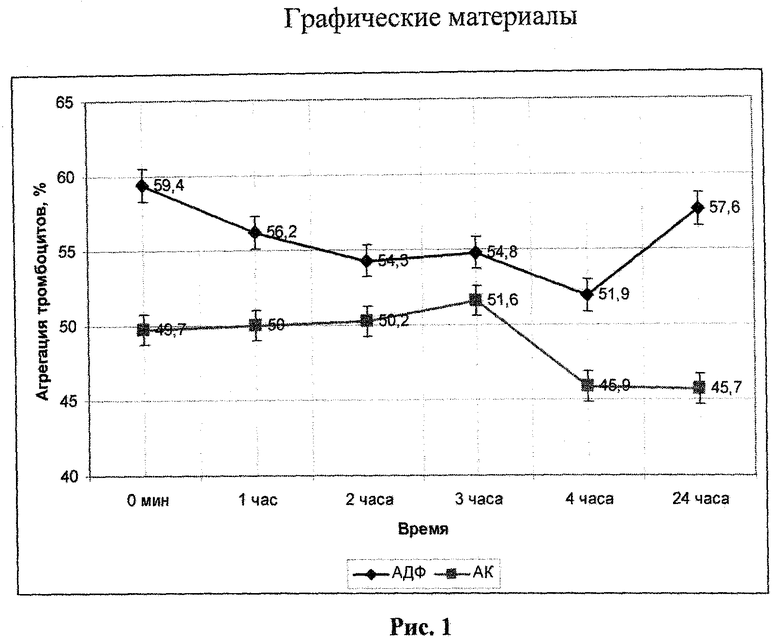
Достоверное снижение АДФ-индуцированной агрегации наблюдалось через 4 часа после инъекции соединения 1. При этом тромбоцитарная агрегация снижалась на 7,5% по отношению к исходному уровню. Через сутки после введения, показатель агрегации восстановился (таблица 5, рис.1).
При болюсном внутривенном введение кроликам соединения 1 в дозе 20 мг/кг была установлена тенденция к укорочению протромбинового времени (таблица 4). Отмечалось достоверное уменьшение тромбинового времени с 14,35±1,99 с в контроле до 13,86±2,31 с спустя 4 часа после инъекции. Далее тромбиновое время продолжало укорачиваться, через сутки после введения данный показатель составил 12,25±0,92 с.
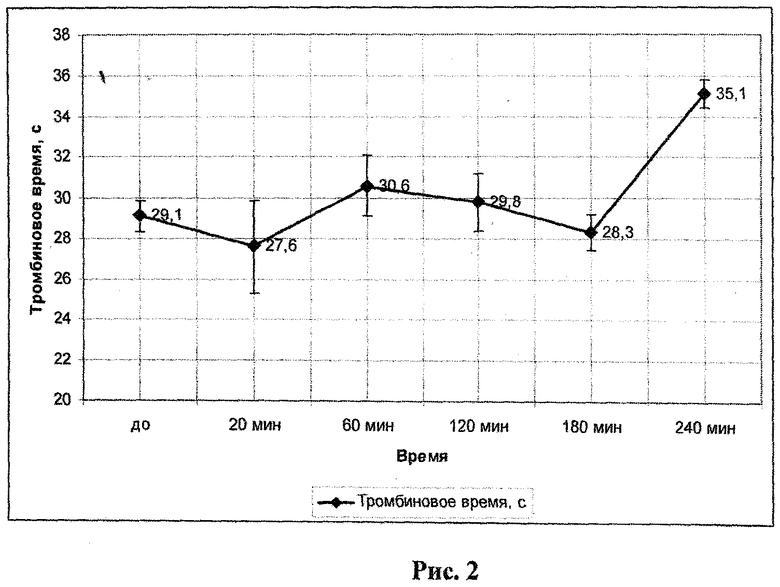
При болюсном внутривенном введении кроликам соединения 6 в дозе 20 мг/кг, в противоположность соединению 1, было отмечено достоверное удлинение тромбинового времени на 20% по сравнению с исходным уровнем спустя 4 часа после инъекции (таблица 6, рис.2)
Промышленная применимость изобретения
Данные соединения могут быть использованы в качестве фармакологически активных веществ в производстве лекарств, позволяющих эффективно и достаточно быстро ингибировать тромбоообразование, что крайне важно при лечении сердечно-сосудистых заболеваний. Как лекарственные препараты, они могут быть использованы для внутривенного введения и могут быть лекарствами скорой помощи.
Краткое описание чертежей
Рис.1 - влияние 2-морфолино-5-(4′-гидроксифенил)-6Н-1,3,4-тиадиазина, гидробромида (1) на АДФ- и АК-индуцированную агрегацию тромбоцитов кролика в дозе 20 мг/кг, ex vivo (проагреганты: АДФ в конечной концентрации 1×10-5 М; АК в конечной концентрации 1×10-3 М).
Рис.2 - влияние 2-морфолино-5-(2′,5′-гидроксифенил)-6Н-1,3,4-тиадиазина, гидробромида (6) (20 мг/кг, в/в) на тромбиновое время «ex vivo».
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-ЦИКЛОАЛКИЛАМИНО-5-ТИЕНИЛ-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2008 |
|
RU2379306C1 |
| 2-АМИНОПРОПИЛМОРФОЛИНО-5-АРИЛ-6Н-1,3,4-ТИАДИАЗИНЫ, ДИГИДРОБРОМИДЫ И 2-АМИНОПРОПИЛМОРФОЛИНО-4-АРИЛТИАЗОЛЫ, ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2011 |
|
RU2456284C1 |
| 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-2)- И 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-3)-6Н-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2445310C2 |
| ЗАМЕЩЕННЫЕ 5R,6R 1,3,4-ТИАДИАЗИН-2 АМИНЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ В КАЧЕСТВЕ ФАРМАКОЛОГИЧЕСКИ АКТИВНЫХ СРЕДСТВ, ОБЛАДАЮЩИХ АНТИКОАГУЛЯНТНЫМ И АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2259371C2 |
| 2-ЦИКЛОАЛКИЛИМИНО-5-(4-НИТРОФЕНИЛ)-1,3,4-ТИАДИАЗИНЫ, ОБЛАДАЮЩИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ ПРОТИВ ВИРУСОВ ОСПЫ | 2005 |
|
RU2281946C1 |
| ЗАМЕЩЕННЫЕ 6H-1,3,4-ТИАДИАЗИН-2-АМИНЫ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНЕСТЕЗИРУЮЩИХ, СЕРДЕЧНО-СОСУДИСТЫХ И ГИПОМЕТАБОЛИЧЕСКИХ СРЕДСТВ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1995 |
|
RU2157210C2 |
| ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ЗАМЕЩЕННЫХ 6H-1,3,4-ТИАДИАЗИН-2-АМИНОВ И ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1995 |
|
RU2152943C1 |
| ДИГИДРОХЛОРИД 1-(3-МОРФОЛИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО[1,2-a]-БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТАГОНИСТА ПУРИНОВЫХ P2Y-РЕЦЕПТОРОВ, АНТИАГРЕГАНТНУЮ И АНТИТРОМБОТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2391345C2 |
| 2-(1S,2R,5S)-6,6-ДИМЕТИЛБИЦИКЛО[3.1.1]ГЕПТ-2ИЛ]МЕТИЛ}СУЛЬФИНИЛ)ЭТАНОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ АНТИАГРЕГАЦИОННЫМ ДЕЙСТВИЕМ | 2013 |
|
RU2522198C2 |
| Применение пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({ [(1S, 2R, 5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил} тио)ацетата, обладающий ингибирующим действием на активацию тромбоцитов | 2015 |
|
RU2671567C2 |
Изобретение относится к 5-(4′-гидроксифенил)- и 5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин-2-аминам, гидрогалогенидам общей формул (I) и (II), ингибирующим агрегацию тромбоцитов при внутривенном введении
NR1R1=морфолино-; тиоморфолино-; пирролидино-; пиперидино-; гексаметиленимино-, HHal-HCl; HBr. Данные соединения могут быть использованы при создании лекарственных препаратов для кардиологии и позволят значительно улучшить лечение различных сердечно-сосудистых заболеваний, в том числе инфаркта миокарда и тромботического инсульта. 6 табл., 2 ил., 10 пр.
5-(4′-гидроксифенил)- и 5-(2′,5′-дигидроксифенил)-6Н-1,3,4-тиадиазин-2-амины, гидрогалогениды, ингибирующие агрегацию тромбоцитов при внутривенном введении


NR1R1=морфолино-; тиоморфолино-; пирролидино-; пиперидино-; гексаметиленимино-
HHal=HCl; HBr.
| ЗАМЕЩЕННЫЕ 5R,6R 1,3,4-ТИАДИАЗИН-2 АМИНЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ В КАЧЕСТВЕ ФАРМАКОЛОГИЧЕСКИ АКТИВНЫХ СРЕДСТВ, ОБЛАДАЮЩИХ АНТИКОАГУЛЯНТНЫМ И АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2259371C2 |
| WO 2007057092 А1, 24.05.2007. | |||
Авторы
Даты
2012-08-10—Публикация
2009-05-22—Подача