Изобретение относится к медицине, а именно к кардиологии, кардиохирургии, ангиологии, реабилитологии и может быть использовано для прогнозирования сердечно-сосудистых осложнений (ССО) у больных ишемической болезнью сердца (ИБС).
Известен способ прогнозирования ССО у пациентов с ИБС, заключающийся в определении генетических маркеров полиморфизма гена белка р53, в котором при наличии у носителя аллеля Arg и генотипа Arg/Arg полиморфного локуса Arg72Pro экзона 4 прогнозируют неблагоприятное течение заболевания (RU 2545899, опубл. 10.04.2015).
Недостатком способа является отсутствие комплексного подхода к прогнозированию ССО у больных ИБС: не учитываются традиционные факторы риска ИБС, полиморфные варианты генов, ответственные за интегральную регуляцию липидного и углеводного обменов, активность иммунного воспаления.
Известен способ прогнозирования ССО у пациентов с ИБС, основанный на выявлении традиционных факторов риска ИБС, таких, как: дислипидемия, курение, артериальная гипертензия, абдоминальное ожирение, сахарный диабет (СД), психоэмоциональный стресс.(Бритов А.Н., Поздняков Ю.М., Волкова Э.Г. и др. Кардиоваскулярная профилактика. Национальные рекомендации. Кардиоваск. тер. и проф. 2011;6: Приложение 2:1-64).
Недостатком способа является отсутствие комплексного подхода к прогнозированию с выявлением наиболее значимых клинико-анамнестических и генетических маркеров.
Техническим результатом изобретения является повышение точности прогнозирования ССО у больных ИБС за счет комплексного подхода к прогнозированию.
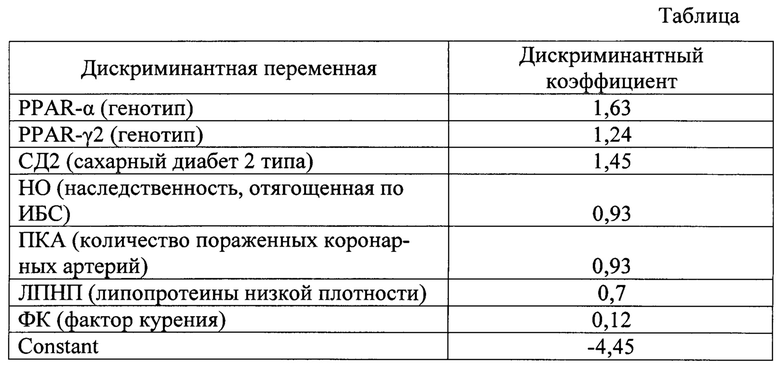
Указанный технический результат достигается в способе прогнозирования ССО у больных ИБС, включающем определение наличия сахарного диабета 2 типа, наследственности, отягощенной по ИБС, уровня холестерина ЛПНП, фактора курения, в котором дополнительно определяют наличие полиморфизмов гена рецепторов активатора пролиферации пероксисом PPAR-γ2 и PPAR-α и количество пораженных коронарных артерий на момент манифестации заболевания, рассчитывают дискриминантную функцию по формуле
D=1,24×PPAR-γ2+l,63×PPAR-α+1,45×СД2+0,93×ОН+0,93×ПКА+0,7×ЛПНП+0,12×ФК-4,45,
где:
PPAR-γ2 - полиморфизм гена PPAR-γ2: Pro12Pro генотип - 0, Pro 12Ala, Ala 12Ala генотипы - 1;
PPAR-α -полиморфизм гена PPAR-α: L162L генотип - 0, L162V генотип - 1; СД2 - сахарный диабет 2 типа: 0 - отсутствие сахарного диабета, 1 - наличие сахарного диабета;
ОН - наследственность, отягощенная по ИБС: 0 - наследственность не отягощена, 1 - наследственность отягощена;
ПКА - пораженные коронарные артерии, количество пораженных
коронарных артерий на момент манифестации ИБС;
ЛПНП - уровень холестерина, липопротеиды низкой плотности, ммоль/л;
ФК - фактор курения, 0 - отсутствие курения в анамнезе, 1 - наличие
курения
и при D >0 прогнозируют ССО ИБС, а при D <0 отсутствие.
В последние годы выявлены новые сети генов, которые отвечают за ремоделирование сердца и сосудов, активность иммунного воспаления, липидный углеводный метаболизм. Среди них особую роль играют рецепторы PPAR, широко представленные в сердечно-сосудистой системе. Выявление полиморфизмов PPAR-γ2 и PPAR-α наряду с наиболее значимыми традиционными факторами риска позволяет повысить точность прогнозирования ССО у больных ИБС.
Способ основан на исследовании 567 больных ИБС (481 мужчина и 86 женщин), жителей Северо-Западного региона России. Все женщины на момент включения в исследование находились в постменопаузе более 9 лет.
Среди больных ИБС в анамнезе имелись сведения о перенесенном инфаркте миокарда (ИМ) - у 394 (69%) обследованных. ИБС дебютировала в форме ИМ у 324 (57,1%) из всех обследованных пациентов, при этом у пациентов с дебютом в возрасте 45 лет и менее - у 39 (45,3%) человек, в возрасте от 46 до 59 лет - у 154 (57,7%), в возрасте 60 лет и старше - у 130 (62,2%) больных ИБС (р =0,002). Таким образом, манифестация ИБС в форме ИМ преобладала в группе пациентов с ранним дебютом заболевания, в то время как ИБС чаще дебютировала со стенокардии у пациентов с возрастом развития заболевания 60 лет и старше.
Выполнена статистическая обработка с использованием пакетов специализированных компьютерных программ Statistica 10.0 (StatSoft Inc.) и SPSS 11.5 for Windows (SPSS Inc.).
Анализ различия частот в двух и более независимых группах проводился при помощи метода таблиц сопряженности с использованием точного двухстороннего критерия Фишера или критерия ХИ-квадрат с поправкой Бонферрони. Для определения рисков вычислялось отношение шансов (OR).
Для проверки однородности количественных признаков в различных группах использовался однофакторный дисперсионный анализ (ANOVA) и тест Шеффе для множественных сравнений. Для оценки влияния качественных признаков на зависимую переменную проводился однофакторный дисперсионный анализ.
У всех обследованных больных были проанализированы следующие традиционные факторы риска ИБС:
1. Артериальная гипертензия отмечалась у 519 (91,5%) обследованных;
2. Ожирение и избыточная масса тела - у 67%, при этом средний индекс массы тела (ИМТ) составлял 28,32±0,21 кг/м2;
3. Курение в анамнезе - у 342 человек (60,3%);
4. Дислипидемия (коэффициент атерогенности >3) - у 181 (32%) человека.
5. Отягощенная наследственность по ИБС - у 201 больного (35%), причем только у 47 (8,3%) обследованных наследственность была отягощена по линии обоих родителей;
6. Сахарный диабет 2 типа - у 102 (17%) человек.
При этом не выявлено статистически значимых различий встречаемости этих шести факторов риска у пациентов с дебютом заболевания в различном возрасте (р >0,017).
Анализ распределения генотипов L162L, L162V гена PPAR-α у больных ИБС в группах с наличием конечных точек и без них выявил следующие статистически значимые различия. L162V генотип гена PPAR-a статистически значимо чаще встречался у больных ИБС с наличием комбинированной конечной точки, чем в группе без конечных точек (16 (25%) и 13(14%), соответственно, р =0,041). Встречаемость аллеля V162 была выше в группе больных ИБС с наличием конечных точек, чем у больных ИБС без конечных точек (р=0,045). При этом L162V полиморфизм гена PPAR-a не ассоциировался с увеличением риска неблагоприятного течения ИБС (OR=2; CI: 0,88÷4,52).
Выявлена тенденция к увеличению встречаемости Рго12А1а и Ala12Ala генотипов у больных ИБС с наличием комбинированной конечной точки по сравнению с их встречаемостью у больных без конечных точек (17 (32,7%) и 17 (23%), соответственно, р =0,078). Ala12 аллель выявлялся чаще у больных ИБС с наличием комбинированной конечной точки, чем в группе больных ИБС без конечных точек (0,81 и 0,88 соответственно, р=0,033) без повышения риска (OR=1,43; CI: 0,72÷2,84).
Для выявления переменных, максимально влияющих на неблагоприятное течение ИБС, и построения прогнозирующей функции проводилась процедура пошагового дискриминантного анализа.
В качестве группирующей (результирующей) переменной использовалась качественная переменная - комбинированная конечная точка (0 - ее отсутствие, 1 - наличие конечной точки).
В качестве конечной точки ИБС рассматривались: возобновление стенокардии после реваскуляризации миокарда при помощи стентирования или шунтирования, прогрессирование сердечной недостаточности, развитие жизнеугрожающих аритмий, острое нарушение мозгового кровообращения (ОНМК) или транзиторная ишемическая атака (ТИА), ИМ, летальный исход.
В качестве дискриминантных переменных, способных оказать влияние на риск развития заболевания, использовались следующие переменные: возраст дебюта ИБС; ИМТ; пол; фактор курения в анамнезе; наследственность, отягощенная по ИБС; гипертоническая болезнь; сахарный диабет 2 типа; Pro12Pro, Pro12Ala, Ala12Ala генотипы Pro12Ala полиморфизма гена PPAR-γ; L162L, L162V генотипы L162V полиморфизма гена PPAR-α; уровни общего холестерина, холестерина ЛИНИ, ЛПВП, глюкозы, фибриногена СРБ.
В результате проведенного дискриминантного анализа получены наиболее значимые дискриминантные переменные и константа (Constant), представленные в табл.
Дискриминантные переменные и соответствующие коэффициенты в табл.могут быть проинтерпретированы следующим образом: чем больше коэффициент, тем больше вклад соответствующей переменной в дискриминацию совокупностей.
6
Способ имеет точность 93,4%, чувствительность - 98,9%, специфичность - 85,2%.
Способ поясняется фиг. 1, 2, где на фиг. 1 представлены результаты генотипирования полиморфных аллелей Pro12Ala гена PPAR-γ2, на фиг. 2 - результаты рестрикционного анализа полиморфных вариантов гена PPAR-α.
Способ осуществляют, например, следующим образом.
У больного ИБС осуществляют забор венозной крови в пробирки, содержащие в качестве антикоагулянта динатриевую соль этилендигидротетрауксусной кислоты (Nа2ЭДТА). Для выделения дезоксирибонуклеиновой кислоты (ДНК) из лейкоцитов венозной крови используют колонки «К-СОРБ-100» фирмы «Синтол», Россия и прилагаемую к ним методику.
Затем для идентификации полиморфных вариантов Pro12Ala полиморфизма гена PPAR-γ2 используют метод на основе полимеразной цепной реакции (ПЦР) с последующим рестрикционным анализом. Амплификацию исследуемого фрагмента гена проводят при помощи следующей последовательности олигонуклеотидов:
прямой праймер: 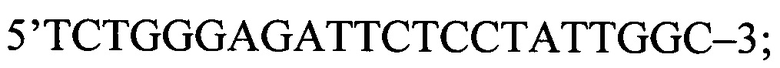
обратный праймер: 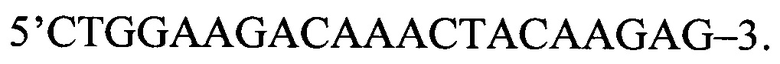
Реакционная смесь для амплификации содержит:
10 нг геномной ДНК, по 0,5 пмоль прямого и обратного праймеров, 7 мкл амплификационной смеси Master Mix (Thermo Sientific, Латвия), 5 мкл дистиллированной воды и 10 мкл вазелинового масла для предотвращения испарения реакционной смеси в ходе ПНР.
Амплификацию производят на термоциклере Терцик (ДНК-Технология, Москва) через следующие этапы:
1. Первоначальная денатурация при 95°С в течение 5 мин.
2. 30 циклов амплификации проводят в следующем температурно-временном режиме: плавление 92°С - 1 мин, отжиг 58°С - 1 мин, синтез 72°С - 1 мин.
3. Заключительный синтез при 72°С в течение 7 мин.
После завершения всех этапов амплификации получают продукт ПНР -площадка длиной 154 пар нуклеотидов (п.н.).
4. Производят рестрикционный анализ: полученный продукт ПЦР инкубируют с 1 ЕД рестриктазы Hin6I (Hhal) (Thermo Sientific, Латвия) при температуре 37°С в течение 8 часов.
В случае аллеля Ala 12 ПНР-продукт расщепляется на фрагменты длиной 133 и 24 п. н. В случае аллеля Pro 12 сохраняется нерасщепленный ПНР-продукт длиной 154 п. н. (фиг. 1).
Продукты рестрикции подвергают электрофоретическому разделению в 8% полиакриламидном геле (ПААГ) с последующей окраской этидием бромидом и визуализацией в ультрафиолете. Результаты генотипирования полиморфных аллелей Pro 12Ala гена PPAR-γ2 представлены на фиг. 1.
Для определения полиморфных вариантов L162V полиморфизма гена PPAR-α проводят ПНР на термоциклере "Терцик" (ДНК-Технология, Москва).
Амплификацию данного фрагмента производят с использованием следующей последовательности синтетических олигонуклеотидов фирмы ООО Beagle, Россия.
прямой праймер: 5'GACTCAAGCTGGTGTATGACAAGT-3;
обратный праймер: 5'CGTTGTGTGACATCCCGACAGAAT-3.
Реакционная смесь для амплификации содержит: 2 мкл полногеномной ДНК, 0,3 мкл tag-полимеразы (Silex), 5 мкл реакционного буфера (Silex), 1 мкл десятикратного раствора нуклеотидов, по 2 мкл раствора прямого и обратного праймеров, 4 мкл 2,5 мМ раствора магния. Реакционную смесь доводят до 50 мкл дистиллированной водой.
Амплификацию производят через следующие этапы:
1. Первоначальная денатурация при 95°С в течение 5 мин.
2. 35 циклов амплификации проводят в следующем температурно-временном режиме: плавление на 95°С - 30 сек., отжиг на 59°С - 30 сек., синтез на 72°С - 1 мин.
3. Заключительный синтез при 72°С в течение 10 мин. Реакционная смесь для осуществления рестрикционного анализа
включает: 18 мкл ПЦР-продукта, 1 мкл рестриктазы Hinf I (ООО "СибЭнзим", Россия), буфер О. Производят инкубацию полученной смеси при температуре 37°С в течение 12 часов.
Проводят рестрикционный анализ с применением вертикального электрофореза в 8% ПААГ с последующим окрашиванием этидием бромидом и визуализацией в ультрафиолете.
Примеры рестрикционного анализа полиморфных вариантов гена PPAR-a представлены на фиг. 2.
Количество пораженных коронарных артерий на момент манифестации заболевания, фактор курения, наличие сахарного диабета, наличие наследственности, отягощенной по ИБС, уровень холестерина ЛПНП определяют из анамнеза больного и известными аппаратными и лабораторными методами.
Рассчитывают дискриминантную функцию по формуле: D=l,24×PPAR-γ2 + l,63×PPAR-α + 1,45×СД2+0,93×ОН + 0,93×ПКА + 0,7×ЛПНП+ 0,12×ФК - 4,45
и при D >0 прогнозируют ССО ИБС, а при D <0 - отсутствие.
Способ подтверждается следующими клиническими примерами.
Пример 1. Больная Н, 56 лет, госпитализирована в октябре 2014 года по поводу острого коронарного синдрома, прогрессирующей стенокардии напряжения. У больной дебют ИБС в возрасте 52 лет с ИМ. Многолетний анамнез артериальной гипертензии, наследственность, отягощенная по ИБС, дислипидемия. Фактор курения отсутствует. При эхокардиографическом исследовании выявлена систолическая дисфункция левого желудочка с зонами гипокинезии, фракция выброса 49%. При коронарографии выявлено трехсосудистое поражение коронарных артерий. При молекулярно-генетическом исследовании установлены полиморфизмы гена рецепторов активатора пролиферации пероксисом PPAR-γ2 и PPAR-α соответственно: Ala12Ala генотип - 1, L162V генотип - 1. Уровень ЛПНП -2,7 ммоль/л.
Больная получала статины, бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, дезагреганты. Через 2 года динамического наблюдения перенесла ОНМК.
Таким образом, для расчета прогноза ССО заявляемым способом получены следующие данные: PPAR-α -1; PPAR-γ2 - 1; СД2 - 0; НО - 1; ПКА - 3; ЛПНП- 2,7 ммоль/л; ФК - 0. Дискриминантная модель прогноза для больной Н.:
D=l,24×PPAR-γ2 + l,63×PPAR-α+1,45×СД2 + 0,93×ОН + 0,93×ПКА + 0,7×ЛПНП + 0,12×ФК - 4,45=1,24+1,63+0+0,93×3+0,7×2,7 - 4,45=3,10
Таким образом, D >0 - высокий индекс прогноза ССО, что и подтвердилось в процессе динамического наблюдения.
Пример 2. Больной В., госпитализирован в апреле 2011 года по поводу острого коронарного синдрома, нестабильной стенокардии.
Из факторов риска: артериальная гипертензия, фактор курения, отягощенная наследственность, дислипидемия. Дебют ИБС- в возрасте 55 лет. В анамнезе инфаркт миокарда. При коронарографии выявлено функционально значимое однососудистое поражение правой коронарной артерии, в которую установлен стент. Сахарного диабета нет, гликемический контроль в норме. При молекулярно-генетическом исследовании установлены генотип L162L гена PPAR-α и Рго12Рго генотип гена PPAR-γ2. Уровень ЛПНП - 2,8 ммоль/л.
В качестве постоянной терапии больной получал бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, дезагреганты, статины.
Таким образом, для расчета прогноза ССО заявляемым способом получены следующие данные: PPAR-α-0; PPAR-γ2 - 0; СД2 - 0; ОН - 1; ПКА - 1; ЛПНП- 2,8 ммоль/л; ФК - 1.
Дискриминантная модель прогноза для больного В.:
D=1,24×PPAR-γ2+l,63×PPAR-α+1,45×СД2+0,93×ОН+0,93×ПКА+0,7×ЛПНП+0,12×ФК-4,45=0+0+0+0,93+0,93×1+0,7×2,8+0,12-4,45=-0,51
Согласно дискриминантной модели, у пациента В. установлен низкий риск ССО. В течение пятилетнего периода динамического наблюдения у больного не было ССО.
Заявленный способ применен при динамическом наблюдении в течение 1-5 лет за 199 больными ИБС. Среди них мужчины и женщины в возрасте от 33 до 80 лет, средний возраст составил 61,6±0,48 лет. Артериальная гипертензия отмечалась у 189 (95%) обследованных человек. Ожирение и избыточная масса тела - у 68,1% пациентов, при этом средний ИМТ составлял 29,46±0,22 кг/м. Курение в анамнезе отмечалось у 170 человек (64%). Отягощенная наследственность по ИБС имела место у 83 больных (42%), причем только у 20 пациентов (10%) наследственность была отягощена по линии обоих родителей. Сахарный диабет 2 типа отмечался у 37 больных (19,1%).
С помощью заявляемого способа был произведен прогноз ССО у этих больных, который показал, что у 84 пациентов прогнозировали ССО, у 115 пациентов - отсутствие ССО. Через 1-5 лет у этих пациентов была произведена оценка таких конечных точек, как возобновление стенокардии после реваскуляризации миокарда при помощи стентирования или шунтирования, прогрессирование сердечной недостаточности, развитие жизнеугрожающих аритмий, острое нарушение мозгового кровообращения (ОМК) или транзиторная ишемическая атака (ТИА), инфаркт миокарда, летальный исход. Сделанный ранее прогноз подтвердился во всех случаях.
Заявляемый способ позволяет с высокой точностью прогнозировать ССО у больных ИБС с различным характером поражения коронарных артерий, что позволяет выделить приоритетную группу пациентов для проведения персонализированной вторичной профилактики неблагоприятных ССО.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования неблагоприятных сердечно-сосудистых событий в течение одного года после перенесенного инфаркта миокарда на основании молекулярно-генетического анализа | 2021 |
|
RU2767269C1 |
| Способ прогнозирования риска неконтролируемого течения бронхиальной астмы у детей с ожирением | 2022 |
|
RU2805825C1 |
| Способ прогнозирования неблагоприятных сердечно-сосудистых событий в течение года после операции коронарного шунтирования | 2020 |
|
RU2731305C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА У БОЛЬНЫХ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНЬЮ ЛЕГКИХ | 2015 |
|
RU2620545C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА РАЗВИТИЯ АТЕРОСКЛЕРОЗА КОРОНАРНЫХ АРТЕРИЙ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ С СЕРДЕЧНО-СОСУДИСТЫМИ НАРУШЕНИЯМИ | 2013 |
|
RU2532521C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕБЛАГОПРИЯТНЫХ СЕРДЕЧНО-СОСУДИСТЫХ СОБЫТИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2017 |
|
RU2682811C1 |
| Способ прогнозирования риска развития сахарного диабета 2 типа у жителей Центральной России на основе генотипирования полиморфизма rs11073891 гена ANPEP | 2023 |
|
RU2803636C1 |
| Способ прогнозирования кардиоваскулярных осложнений в течение 12 месяцев после плановой эндоваскулярной реваскуляризации миокарда у больных ишемической болезнью сердца | 2020 |
|
RU2749485C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ | 2014 |
|
RU2571715C1 |
| Способ определения риска развития инфаркта миокарда с подъемом сегмента ST с использованием генетических маркеров | 2019 |
|
RU2711623C1 |

Изобретение относится к медицине, а именно к кардиологии, кардиохирургии, ангиологии и реабилитологии. Определяют наличие сахарного диабета 2 типа, наследственности, отягощенной по ИБС, уровня холестерина ЛПНП, фактора курения и дополнительно - наличие полиморфизмов гена рецепторов активатора пролиферации пероксисом PPAR-γ2 и PPAR-α и количество пораженных коронарных артерий на момент манифестации заболевания. Затем рассчитывают дискриминантную функцию по оригинальной формуле и при ее положительных значениях прогнозируют ССО у больных ИБС, при ее отрицательных значениях - отсутствие ССО. Способ позволяет с высокой точностью прогнозировать ССО у больных ИБС с различным характером поражения коронарных артерий, что позволяет выделить приоритетную группу пациентов для проведения персонализированной вторичной профилактики неблагоприятных ССО. 2 ил., 1 табл., 2 пр.
Способ прогнозирования сердечно-сосудистых осложнений у больных ишемической болезнью сердца (ИБС), включающий определение наличия сахарного диабета 2 типа, наследственности, отягощенной по ИБС, уровня холестерина ЛПНП, фактора курения, отличающийся тем, что дополнительно определяют наличие полиморфизмов гена рецепторов активатора пролиферации пероксисом PPAR--γ2 и PPAR-α и количество пораженных коронарных артерий на момент манифестации заболевания, рассчитывают дискриминантную функцию по формуле
D=1,24×PPAR-γ2+l,63×PPAR-α+1,45×СД2+0,93×ОН+0,93×ПКА+0,7×ЛПНП+0,12×фК-4,45,
где:
PPAR-γ2 - полиморфизм гена PPAR-γ2: Pro12Pro генотип - 0, Pro12Ala, Ala12Ala генотипы - 1;
PPAR-α - полиморфизм гена PPAR-α: L162L генотип - 0, L162V генотип - 1;
СД2 - сахарный диабет 2 типа: 0 - отсутствие сахарного диабета, 1 - наличие сахарного диабета;
ОН - наследственность, отягощенная по ИБС: 0 - наследственность не отягощена, 1 - наследственность отягощена;
ПКА - пораженные коронарные артерии, количество пораженных коронарных артерий на момент манифестации ИБС;
ЛПНП - уровень холестерина, липопротеиды низкой плотности, ммоль/л;
ФК - фактор курения, 0 - отсутствие курения в анамнезе, 1 - наличие курения
и при D>0 прогнозируют сердечно-сосудистые осложнения ИБС, а при D<0 их отсутствие.
| Бритов А.Н., Поздняков Ю.М., Волкова Э.Г | |||
| и др | |||
| Кардиоваскулярная профилактика | |||
| Национальные рекомендации | |||
| Кардиоваск | |||
| тер | |||
| и проф | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА ПОСЛЕ АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ | 2011 |
|
RU2466395C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ НЕБЛАГОПРИЯТНЫХ СЕРДЕЧНО-СОСУДИСТЫХ СОБЫТИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА С ИШЕМИЧЕСКОЙ И/ИЛИ ПОСТИНФАРКТНОЙ ДИСФУНКЦИЕЙ МИОКАРДА НА ФОНЕ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ | 2014 |
|
RU2568577C1 |
| GLORIA-BOTTINI F | |||
| et al | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| Am J Med Sci | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2018-10-24—Публикация
2017-12-28—Подача