Область техники
Настоящее изобретение относится к новому способу производства липоплекса, используемого для местного введения, и противоопухолевому средству, в котором используется такой липоплекс.
Область техники
Липосомы состоят из фосфолипидов, которые образуют мембраны клеток живых организмов, они обладают высокой степенью биосовместимости, и они могут доставлять лекарственные средства и активные ингредиенты, защищая их от осуществляющих деградирование ферментов in vivo. Соответственно, липосомы привлекли к себе внимание как полезное средство для систем доставки лекарственных средств.
Между тем, молекулы РНКи, которые индуцируют РНК-интерференцию (в дальнейшем именуемые «РНКи», привлекли внимание как полезное средство для лечения опухолей и других целей, и был разработан широкий ряд молекул РНКи, которые способны к подавлению роста опухолей. Кроме того, был разработан способ использования комплексов, состоящих из молекул РНКи и смесей липидов, (т.е. липоплексов) для доставки молекул РНКи в качестве активных ингредиентов в опухолевые клетки (Qixin Leng et al., Drug Future, September 2009; 34 (9): 721; Sherry Y., Wu et al., The AAPS Journal, Vol. 11, No. 4, December 2009; и B. Ozpolat et al., Journal of Internal Medicine 267; 44-53, 2009).
Прежде, авторы настоящего изобретения разработали молекулы РНКи, таргетирующие, т.е. мишенью которых являются, тимидилатсинтазы (в дальнейшем именуемые «TS»), которые участвуют в росте опухолей (WO 2010/113844). Они сообщили, что доставка таких молекул РНКи в опухоли с помощью, например, внутривенного введения с использованием комплексов (липоплексов), включенных в смесь катионных липидов определенного состава, может обеспечивать возможность подавления роста опухолей, демонстрирующих экспрессию TS. Они также сообщили, что использование таких липоплексов в комбинации с химиотерапевтическими средствами может привести к увеличению эффективности нацеленности на опухоли, а также увеличению противоопухолевых эффектов молекул РНКи в значительной мере (WO 2012/161196).
Краткое изложение сущности изобретения
Задачи, которые должны быть достигнуты настоящим изобретением.
В соответствии с традиционным способом получения липоплекса, способ приготовления смеси липидов включал стадию предварительного растворения составной части, такой как фосфолипид, в органическом растворителе, таком как хлороформ или циклогексан. Однако в случае промышленного способа производства, включающего использование органического растворителя, такого как хлороформ или циклогексан, требовалось обеспечение крупномасштабного оборудования, такого как оборудование для транспортировки взрыво- и огнеопасных материалов или взрывобезопасные аппараты. Прежде, для образования липоплекса также требовался сложный процесс, включающий приготовление водного раствора молекул РНКи, отдельное приготовление смеси липидов и затем смешивание водного раствора со смесью липидов перед введением больному раком в рецептурном отделе больницы, при этом такой способ требует приложения немалых усилий.
Принимая во внимание вышеизложенные обстоятельства, задачей настоящего изобретения является обеспечение промышленного способа производства липоплекса, который делает возможным легкое, единовременное производство порошков для образования липоплекса, которые позволяют получать липоплекс просто путем суспендирования его в растворителе, таком как вода. Это избавило бы от необходимости использования сложного способа образования липоплекса, в котором смесь липидов образовывалась путем использования большого количестве органического растворителя, такого как хлороформ или циклогексан, и подвергания лиофилизации, и получаемую в результате смесь липидов диспергировали в растворителе, таком как вода, после чего получаемую дисперсию затем смешивали с водным раствором молекул РНКи.
Другой целью настоящего изобретения является устранение необходимости в сложном способе приготовления липоплекса, который требует приложения немалых усилий в рецептурном отделе больницы.
Средства достижения задач
Авторы настоящего изобретения провели интенсивные исследования для достижения вышеизложенных задач. В результате они сумели получить лиофилизированный продукт липоплеса путем растворения диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида в очень хорошо переносимом и невзрывоопасном спирте, добавления спиртового раствора по каплям к раствору молекул РНКи при перемешивании и лиофилизации раствора и удаления из него растворителя, такого как спирт. Таким образом, они обнаружили, что эффективное лечение больного раком можно осуществлять путем смешивания получаемого в результате лиофилизированного продукта липоплекса, полученного в соответствующем буфере, и местного введения его в орган-мишень, пораженный раком. Настоящее изобретение основано на таких обнаружениях.
Настоящее изобретение представляет собой изобретение, описанное ниже.
[1] Способ производства липоплекса, содержащего диолеилфосфатидилэтаноламин (DOPE), фосфатидилхолин, катионный липид и молекулы РНКи, включающий стадии:
(a) растворения диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида в спирте;
(b) добавления спиртового раствора, полученного на стадии (a), по каплям к раствору молекул РНКи при перемешивании; и
(c) лиофилизации раствора, полученного на стадии (b),
причем фосфатидилхолин имеет один или несколько признаков, выбираемых из (i)-(iii), изложенных ниже:
(i) фосфатидилхолин включает по меньшей мере одну цепь ненасыщенной жирной кислоты, содержащую двойную углерод-углеродную связь;
(ii) фосфатидилхолин включает по меньшей мере одну цепь ненасыщенной жирной кислоты, содержащую двойную углерод-углеродную связь в цис-форме; и
(iii) фосфатидилхолин характеризуется температурой фазового перехода ниже 0οC.
[2] Способ в соответствии с [1], в котором катионным липидом является O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина хлорид (DC-6-14).
[3] Способ в соответствии с [1] или [2], в котором фосфатидилхолином является 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), пальмитоилолеоилфосфатидилхолин (POPC) или 1,2-диэйкозеноил-sn-глицеро-3-фосфохолин (DEPC).
[4] Способ в соответствии с [3], в котором фосфатидилхолином является DOPC.
[5] Способ в соответствии с [1], в котором стадия (a) включает растворение и смешивание DOPE, DOPC и DC-6-14 в спирте.
[6] Способ в соответствии с любым из [1]-[5], который, кроме того, включает стадию (d) приготовления смеси лиофилизированного продукта, полученного на стадии (c), в буфере.
[7] Фармацевтическая композиция, используемая для местного введения с целью лечения метастазов в брюшину рака желудка, рака яичников и рака поджелудочной железы, которая содержит смесь липидов, включающую диолеилфосфатидилэтаноламин (DOPE), фосфатидилхолин и катионный липид, причем фосфатидилхолин имеет один или несколько признаков, выбираемых из (i)-(iii), изложенных ниже:
(i) фосфатидилхолин включает по меньшей мере одну цепь ненасыщенной жирной кислоты, содержащую двойную углерод-углеродную связь;
(ii) фосфатидилхолин включает по меньшей мере одну цепь ненасыщенной жирной кислоты, содержащую двойную углерод-углеродную связь в цис-форме; и
(iii) фосфатидилхолин характеризуется температурой фазового перехода ниже 0οC, и
короткую, образующую шпильки РНК (кшРНК), способную ингибировать экспрессию тимидилатсинтазы посредством РНК-интерференции (ТС-кшРНК).
[8] Фармацевтическая композиция в соответствии с [7], в которой катионным липидом является O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина хлорид (DC-6-14).
[9] Фармацевтическая композиция в соответствии с [7], в которой фосфатидилхолином является DOPC.
[10] Фармацевтическая композиция в соответствии с [7], в которой смесь липидов состоит из DOPE, DOPC и DC-6-14.
[11] Фармацевтическая композиция в соответствии с [10], которая включает DOPE, DOPC и DC-6-14 в молярном соотношении 3:2:5.
[12] Фармацевтическая композиция в соответствии с любым из [7]-[11], в которой кшРНК состоит из нуклеотидной последовательности, представленной в SEQ ID NO: 8.
[13] Фармацевтическая композиция в соответствии с любым из [7]-[12], которая используется в комбинации с противораковым химиотерапевтическим средством.
[14] Комбинированный продукт, включающий фармацевтическую композицию в соответствии с любым из [7]-[13] и противораковое химиотерапевтическое средство.
[15] Комбинированный продукт в соответствии с [14], в случае которого противораковое химиотерапевтическое средство выбирают из группы, состоящей из противоопухолевого средства с ингибирующим деполимеризацию микротрубочек механизмом действия, производного дезоксицитидина и противоопухолевого средства с ингибирующим тимидилатсинтазу механизмом действия.
Это описание включает полное содержание или его часть, которое раскрывается в заявке на патент Японии с № 2014-221062, которая представляет собой приоритетный документ для настоящей заявки.
Эффекты настоящего изобретения
Благодаря настоящему изобретению может обеспечиваться промышленный способ производства липоплекса, который делает возможным легкое, единовременное получение порошков для образования липоплекса, которые позволяют получать липоплекс просто путем суспендирования его в растворителе, таком как вода. Это избавит от необходимости использования сложного способа образования липоплекса, включающего образование смеси липидов, используя большое количество органического растворителя, такого как хлороформ или циклогексан, подвергание лиофилизации, диспергирование получаемой в результате смеси липидов в растворителе, таком как вода, а затем смешивание получаемой дисперсии с водным раствором молекул РНКи.
В соответствии с настоящим изобретением также может устраняться необходимость в сложном способе приготовления липоплекса, который требует приложения немалых усилий в рецептурном отделе больницы.
Используя липоплекс настоящего изобретения, молекулы РНКи, способные к подавлению роста опухолей, могут также эффективно доставляться в опухолевые клетки.
Краткое описание чертежей
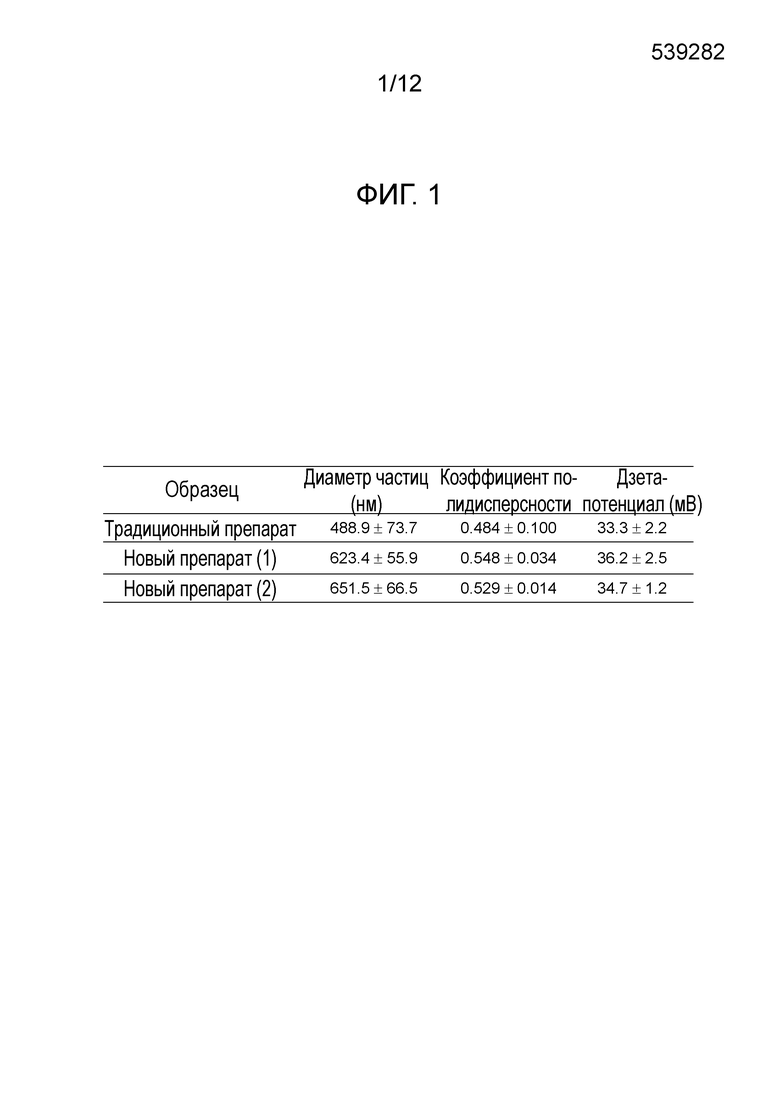
На фиг. 1 представлены результаты сравнения физических свойств (т.е. диаметра частиц, коэффициента полидисперсности и дзета-потенциала) традиционного препарата, нового препарата (1) и нового препарата (2): традиционный препарат был приготовлен путем растворения смеси липидов, состоящей из DOPC, DOPE и DC-6-14, полученной известным способом, в органическом растворителе (смеси циклогексан/этанол (95/5 (в объемном отношении)), лиофилизации получаемого в результате раствора, диспергирования получаемого в результате лиофилизированного продукта в воде для приготовления раствора и смешивания с ним водного раствора молекул РНКи; а новый препарат (1) и новый препарат (2) были получены способом в соответствии с настоящим изобретением: новый препарат (1) был приготовлен путем растворения смеси липидов, состоящей из DOPC, DOPE и DC-6-14, в органическом растворите (смеси циклогексан/этанол (95/5 (в объемном отношении)), лиофилизации получаемого в результате раствора и растворения до гомогенного состояния получаемого в результате лиофилизированного продукта для приготовления раствора, добавления по каплям получаемого в результате раствора к гомогенному раствору молекул РНКи при перемешивании, лиофилизации получаемого в результате раствора и диспергирования получаемого в результате лиофилизированного продукта в воде; а новый препарат (2) был приготовлен путем растворения до гомогенного состояния липидов (т.е. DOPC, DOPE, и DC-6-14) в этаноле для приготовления гомогенного раствора, растворения получаемого в результате гомогенного раствора по каплям в гомогенном водном растворе молекул РНКи при перемешивании для приготовления водно-этального раствора, лиофилизации получаемого в результате водно-этального раствора и диспергирования получаемого в результате лиофилизированного продукта в воде.
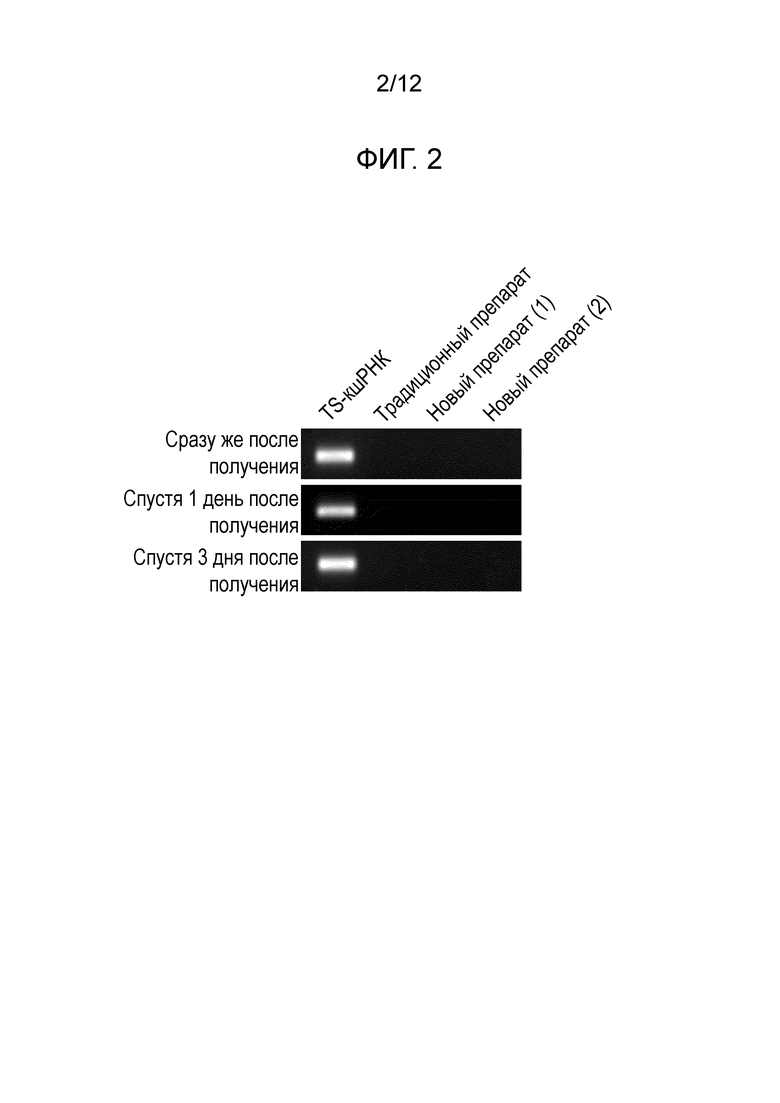
На фиг. 2 представлены фотографии, демонстрирующие результаты сравнения способности к удерживанию TS-кшРНК традиционного препарата, полученного известным способом, нового препарата (1), полученного способом настоящего изобретения, и нового препарата (2), полученного способом настоящего изобретения.
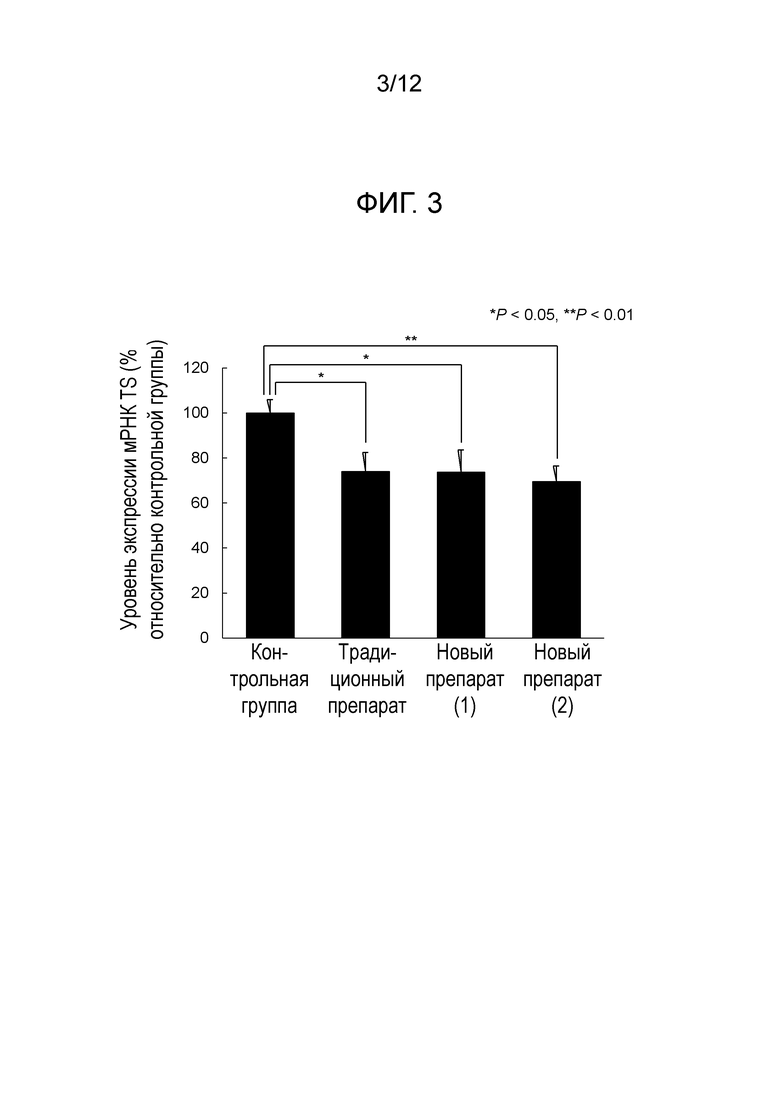
На фиг. 3 представлена диаграммы, демонстрирующая результаты сравнения и анализа ингибиторных эффектов на ген-мишень опухоли (мРНК TS) с помощью ОТ-ПЦР в масштабе реального времени, достигаемых с помощью внутрибрюшинного введения традиционного препарата, полученного известным способом, нового препарата (1), полученного способом настоящего изобретения, и нового препарата (2), полученного способом настоящего изобретения, моделям на мышах метастазов рака желудка в брюшину (*: P<0,05; **: P<0,01).
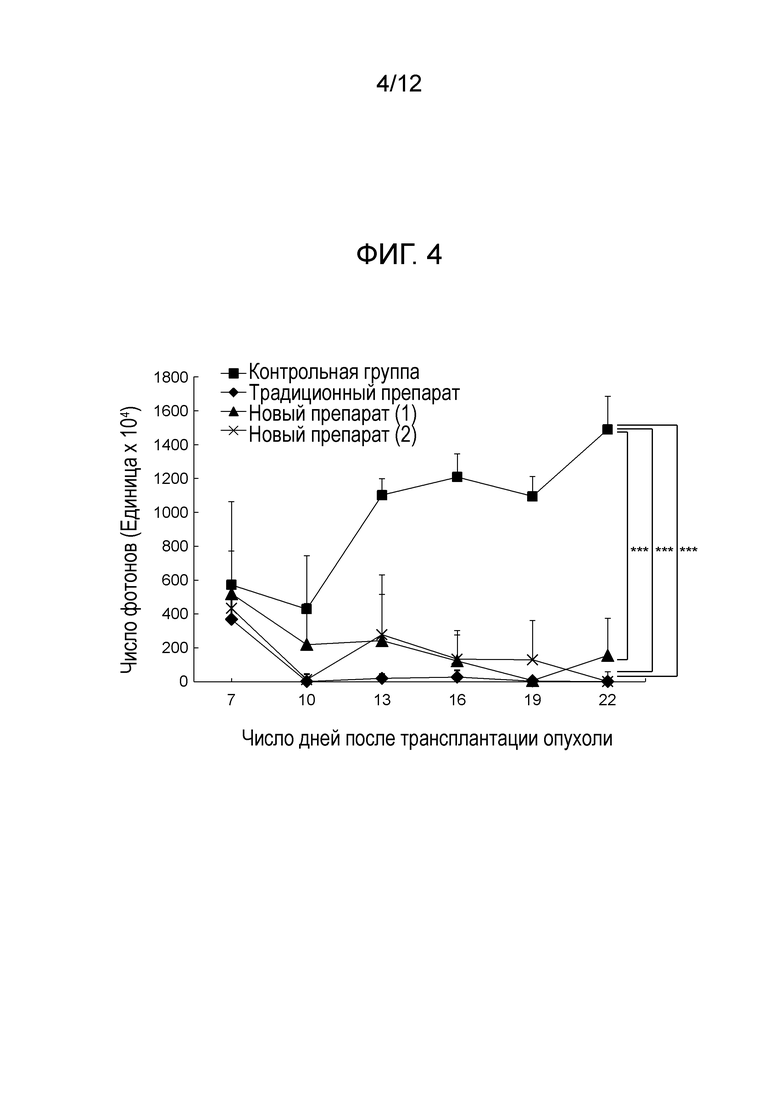
На фиг. 4 представлен график, демонстрирующий результаты количественного анализа люциферазной активности у группы моделей на мышах метастазов рака желудка в брюшину, подвергнутой внутрибрюшинному введению традиционного препарата, нового препарата (1) и нового препарата (2), соответственно, а также у контрольной группы (т.е. эффекты подавления роста опухоли) (***: P < 0,005).
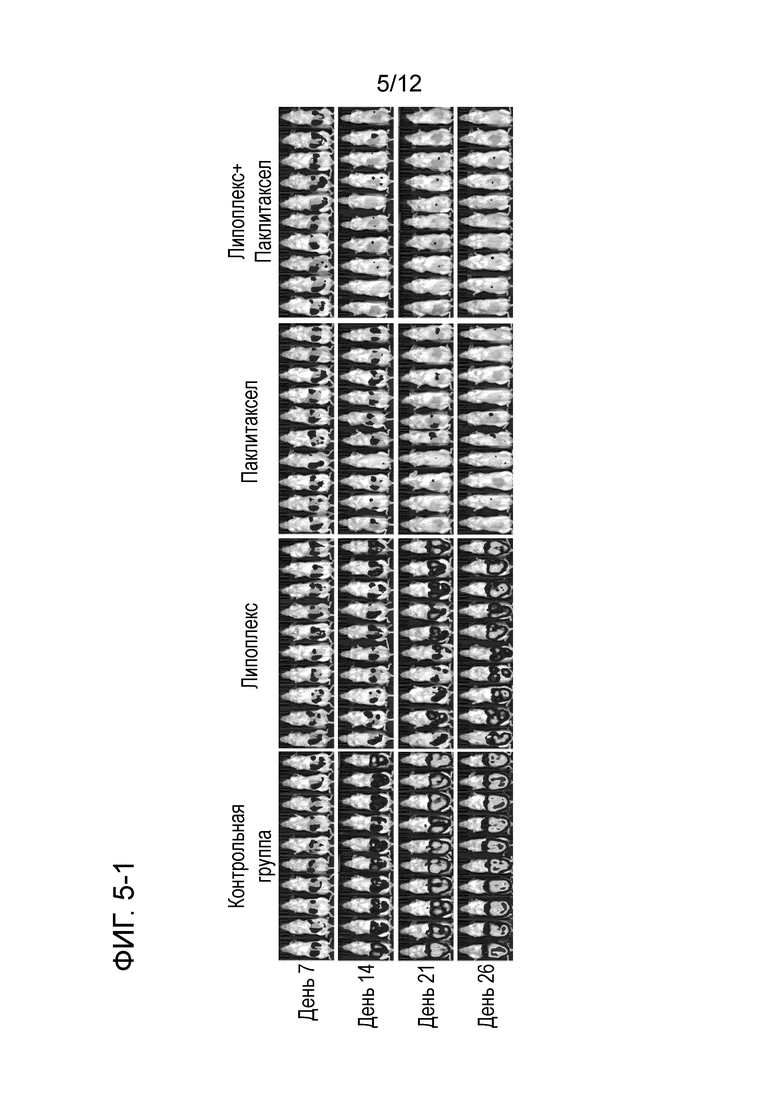
На фиг. 5-1 представлены фотографии, демонстрирующие результаты анализа с использованием IVIS ингибиторных эффектов на рост опухоли введения содержащего TS-кшРНК липоплекса (т.е. только нового препарата (2)), только паклитаксела и содержащего TS-кшРНК липоплекса (т.е. только нового препарата (2)) в комбинации с паклитакселом на моделях на мышах метастазов в брюшину рака яичника.
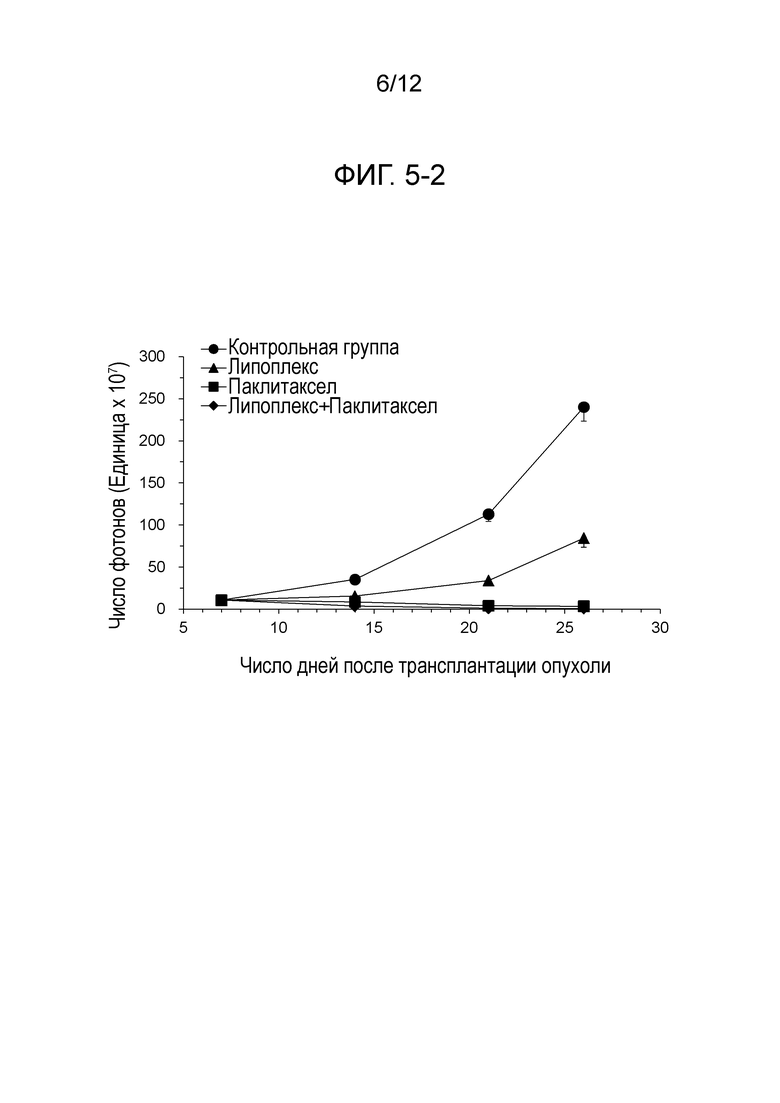
На фиг. 5-2 представлен график, демонстрирующий результаты количественного анализа роста опухоли в брюшной полости на основе данных изображений, представленных на фиг. 5-1.
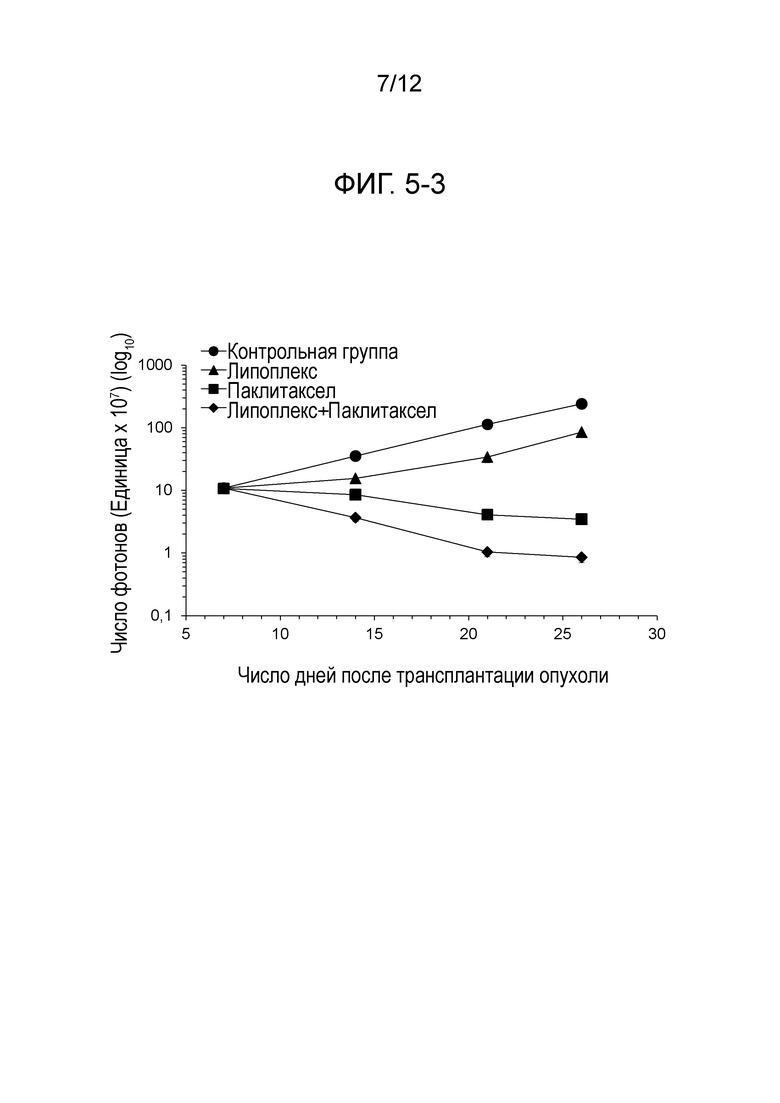
На фиг. 5-3 представлены результаты, продемонстрированные на фиг. 5-2, в виде графика логарифмической функции.
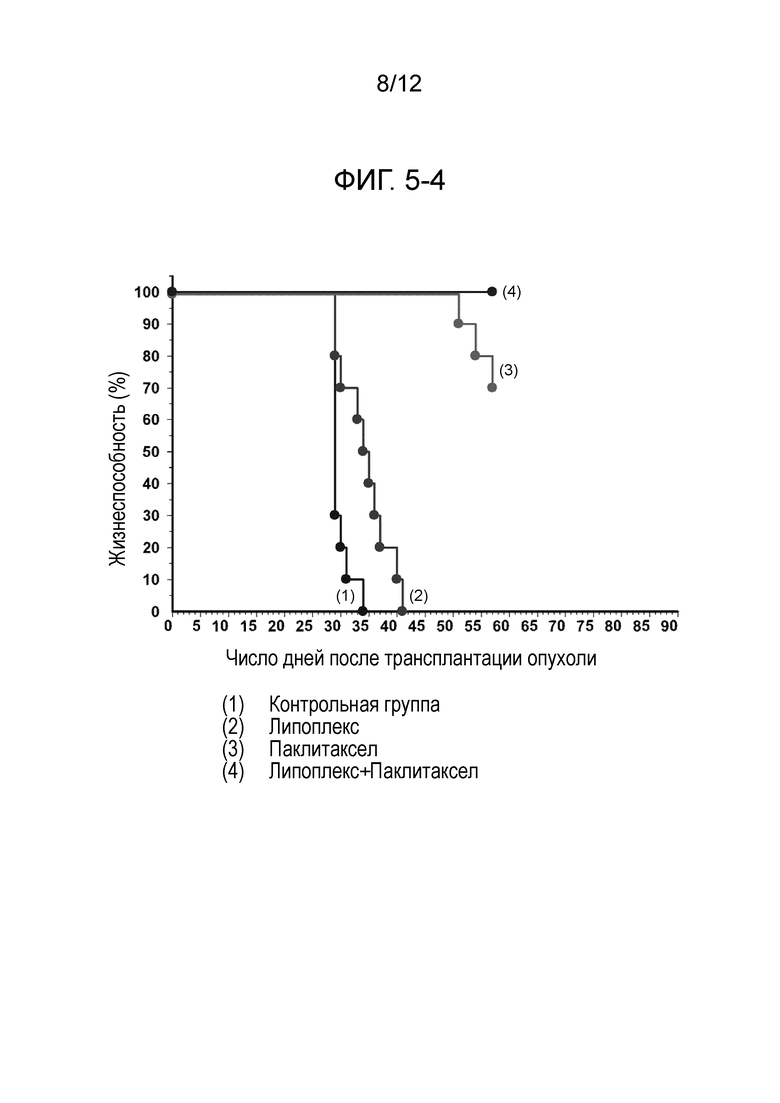
На фиг. 5-4 представлен график, демонстрирующий эффекты увеличения продолжительности жизни, отмечаемые в контрольной группе, группе, подвергнутой введению только содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)), группе, подвергнутой введению только паклитаксела, и группе, подвергнутой введению пакситаксела в комбинации с содержащим TS-кшРНК липоплексом (т.е. новым препаратом (2)), в экспериментах на животных, представленных на фиг. 5-1.
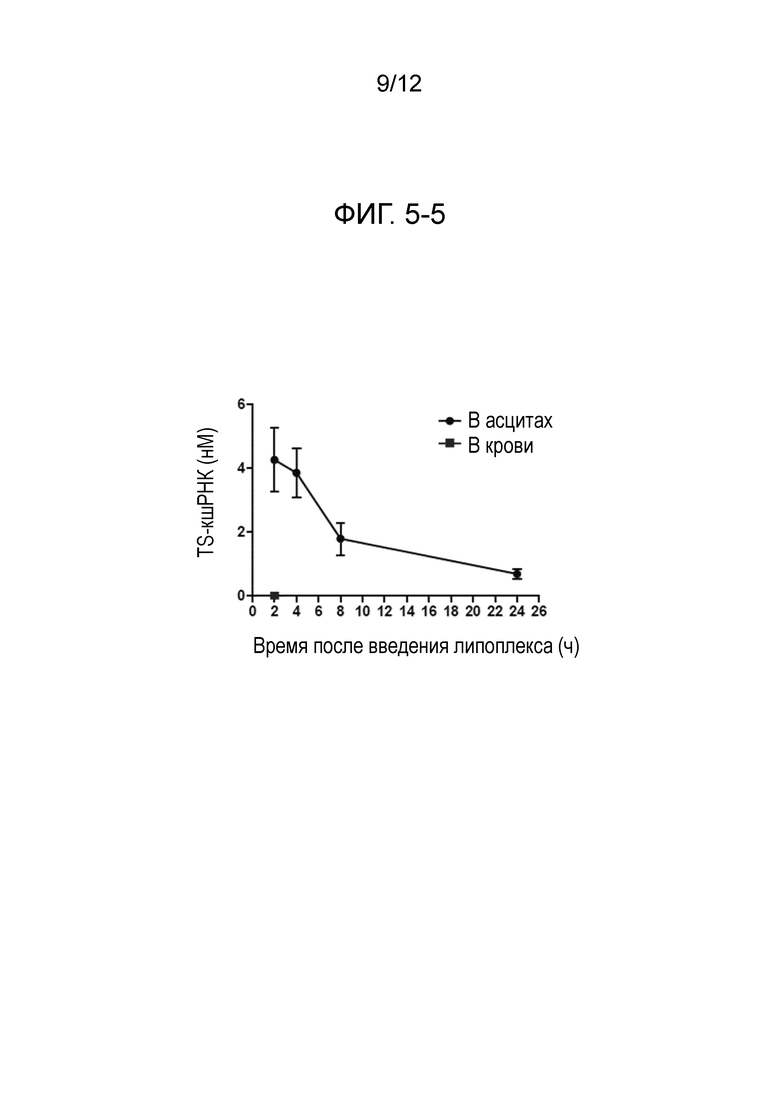
На фиг. 5-5 представлен график, демонстрирующий изменение концентрации TS-кшРНК в асцитах и в крови, подвергнутых анализу с помощью ОТ-ПЦР после внутрибрюшинного введения содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)) модели на мыши метастазов в брюшину рака яичника.
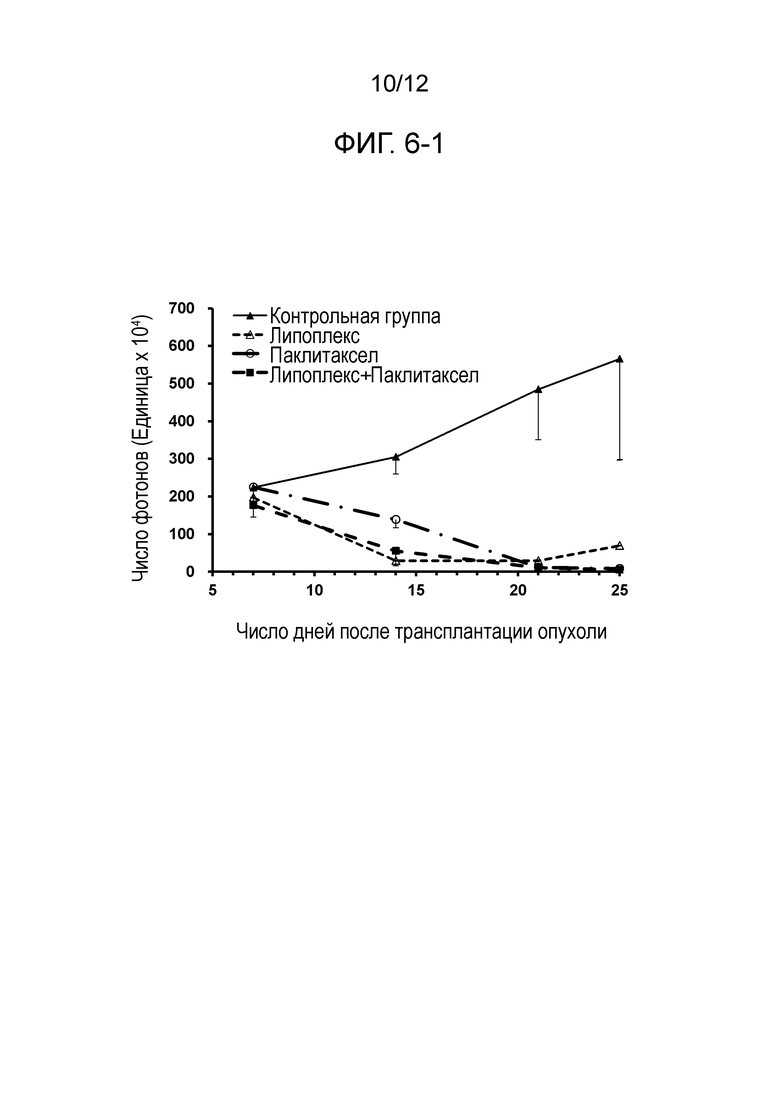
На фиг. 6-1 представлен график, демонстрирующий результаты количественного анализа, используя IVIS, роста опухоли, проанализированного на основе данных изображений от моделей на мышах метастазов в брюшину рака поджелудочной железы, подвергнутых введению только содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)), только паклитаксела и содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)) в комбинации с паклитакселом.
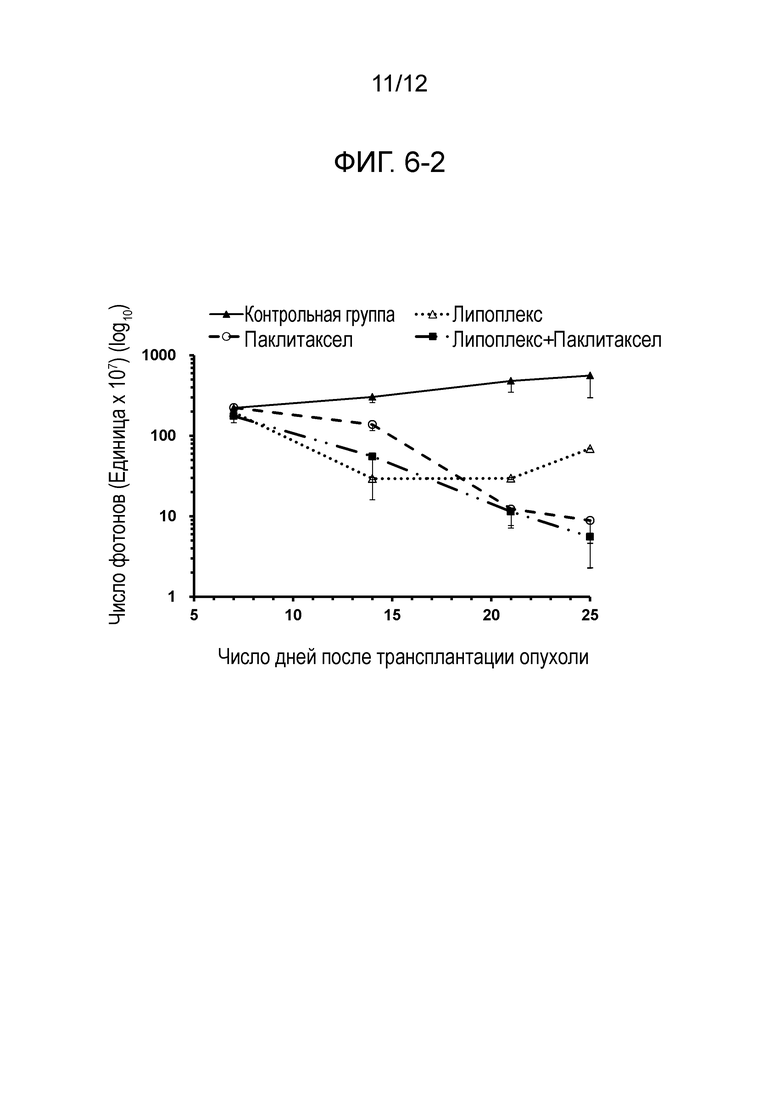
На фиг. 6-2 представлены результаты, продемонстрированные на фиг. 6-1, в виде графика логарифмической функции.
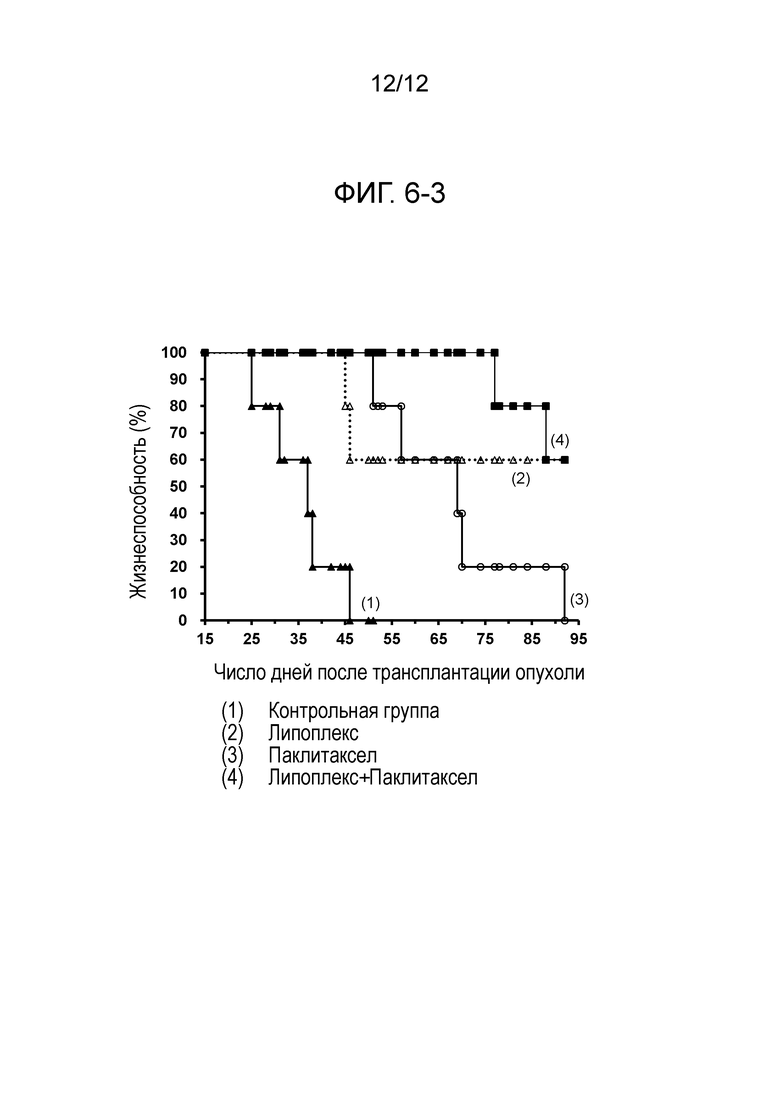
На фиг. 6-3 представлен график, демонстрирующий эффекты увеличения продолжительности жизни, отмечаемые в моделях на мышах метастазов в брюшину рака поджелудочной железы, в результате введения только содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)), введения только паклитаксела и введения содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)) в комбинации с паклитакселом.
Варианты осуществления настоящего изобретения
Липоплекс настоящего изобретения содержит смесь липидов, состоящую из диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида, и молекулу РНКи, или он представляет собой состоящий из них комплекс.
«Фосфатидилхолин», который может использоваться в настоящем изобретении, имеет один или несколько признаков, выбираемых из (i)-(iii), изложенных ниже:
(i) фосфатидилхолин включает по меньшей мере одну цепь ненасыщенной жирной кислоты, содержащую двойную углерод-углеродную связь;
(ii) фосфатидилхолин включает по меньшей мере одну цепь ненасыщенной жирной кислоты, содержащую двойную углерод-углеродную связь в цис-форме; и
(iii) фосфатидилхолин характеризуется низкой температурой фазового перехода (например, ниже 0οC, ниже -10οC или ниже -20οC).
Примеры такого «фосфатидилхолина» включают 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), пальмитоилолеоилфосфатидилхолин (POPC) или 1,2-диэйкозеноил-sn-глицеро-3-фосфохолин (DEPC), при этом DOPC является предпочтительным.
«Катионный липид», который может использоваться в настоящем изобретении, может представлять собой любое вещество, выбираемое из числа O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина хлорида (DC-6-14), N,N-диолеоил-N,N-диметиламмония хлорида (DODAC), N,N-дистеарил-N,N- диметиламмония бромида (DDAB), N-(1-(2,3-диолеоилокси)пропил)-N,N,N-триметиламмония хлорида (DOTAP), N-(1-(2,3-диолеоилокси)пропил)-N,N,N-триметиламмония хлорида (DOTMA), N,N-диметил-(2,3-диолеоилокси)пропиламина (DODMA) и производного любого из них. Предпочтительно катионным липидом является DC-6-14.
Липоплекс настоящего изобретения предпочтительно содержит смесь липидов, состоящую из DOPE, DOPC и DC-6-14.
Соотношение DOPE, фосфатидилхолина (DOPC) и катионного липида (DC-6-14) в липоплексе может быть установлены в диапазоне молярного соотношения (2-4):(1-3):(4-6). Предпочтительно соотношение DOPE:DOPC:DC-6-14 составляет 3:2:5.
Размер частиц липоплекса настоящего изобретения составляет от 200 нм до 2000 нм и предпочтительно составляет приблизительно от 400 нм до 700 нм. Дзета-потенциал липоплекса настоящего изобретения составляет от 30 до 60 мВ и предпочтительно составляет приблизительно от 30 до 40 мВ.
Липоплекс настоящего изобретения может быть получен способом, включающим следующие стадии.
А именно, лиофилизированный продукт смеси фосфатидилэтаноламина, фосфатидилхолина и катионного липида или каждый ее ингредиент растворяют в спирте.
Примеры спиртов, которые могут использоваться, включают этанол и метанол, при этом этанол, являющийся очень хорошо переносящемся, является особенно предпочтительным. Фосфатидилэтаноламин, фосфатидилхолин и катионный липид могут использоваться в любой форме. Например, такое вещество может использоваться в форме порошка.
Предварительно фосфатидилэтаноламин, фосфатидилхолин и катионный липид могут быть растворены по отдельности в этаноле, и такие вещества по отдельности разделяют на фракции и смешивают с доведением количества получаемой в результате смеси до определенного уровня. Альтернативно, лиофилизированный продукт смеси липидов, состоящей из фосфатидилэтаноламина, фосфатидилхолина и катионного липида в определенном количестве, описанном выше, может быть растворен в этаноле.
Количество каждого из фосфатидилэтаноламина, фосфатидилхолина и катионного липида в спиртовой смеси может составлять от 1 до 100 мМ и предпочтительно от 10 до 80 мМ.
Фосфатидилэтаноламин, фосфатидилхолин и катионный липид могут быть растворены в спирте при нагревании. Например, нагревание может проводиться при температуре от 35οC до 60οC и предпочтительно от 40οC до 50οC.
Затем получаемый в результате спиртовой раствор добавляют по каплям к раствору молекул РНКи (например, водному раствору молекул РНКи в воде) при перемешивании, и затем получаемый в результате раствор подвергают лиофилизации с получением лиофилизированного продукта липоплекса. Предпочтительно, когда спиртовой раствор смешивают с раствором молекул РНКи в соотношении (1-3):(7-9).
Лиофилизированный продукт может быть, кроме того, смешан с водным раствором, таким как буфер, чтобы получить суспензию липоплекса, и получаемая в результате суспензия может быть введена в живой организм. Буфер может быть в виде водного раствора, который можно вводит в живой организм. Например, физиологический раствор или текучая среда с углеводами могут использоваться. Предпочтительно смешивание осуществляют в течение от 1 до 15 минут, а более предпочтительно приблизительно 5 минут, посредством перемешивания с применением вортекса или другого средства. При выполнении таким образом перемешивания размер частиц липоплекса можно установить на представляющем интерес уровне, описанном выше.
В способе производства липоплекса в соответствии с настоящим изобретением нет необходимости в использовании хлороформа или циклогексана с высокой степенью токсичности и взрывчатости. Соответственно, нет необходимости в обеспечении высокозащищенного взрывобезопасного оборудования на промышленном предприятии. Поскольку по выбору используется этанол, являющийся очень хорошо переносящимся, его введение пациенту, к тому же, не будет ставить какие-либо проблемы даже в присутствии очень незначительного количества остающегося растворителя.
В соответствии с настоящим изобретением, кроме того, липоплекс можно легко приготовить в медицинской зоне, например, в рецептурном отделе больницы. Конкретно, инъекционный флакон или т.п., наполненный лиофилизированным продуктом липоплекса, может быть предоставлен в медицинскую зону, например, в рецептурный отдел больницы, с тем, чтобы раствор липоплекса, который должен быть введен, (т.е. дисперсия в воде) мог быть приготовлен в момент применения просто путем добавления к нему буфера в рецептурном отделе больницы до введения пациенту.
Липоплекс настоящего изобретения может использоваться для местного введения пациенту. В настоящем изобретении под «местным введением» не подразумевается системное введение посредством внутривенной инъекции или другого способа. Примеры местного введения включают, но без ограничения ими, внутрибрюшинное, интраторакальное, внутримышечное, подкожное, эндодермальное, внутриглазное, внутримозговое, интратекальное, интравагинальное, ректальное, внутриорганное введение и нанесение на эпидермис. Термин «местное введение» предпочтительно относится к внутриполостному введению, а более предпочтительно интраторакальному или внутрибрюшинному введению.
Липоплекс настоящего изобретения включает, в качестве активного ингредиента, молекулу РНКи, такую как киРНК или кшРНК, способную к ингибированию экспрессии генов, кодирующих факторы, экспрессируемые в опухолевых клетках и причастные к росту опухолевых клеток, посредством РНК-интерференции. Примеры «генов, кодирующих факторы, экспрессируемые в опухолевых клетках и причастные к росту опухолевых клеток», включают, но без ограничения ими, гены, кодирующие регулирующие рост факторы, такие как тимидилатсинтаза, VEGF, EGFR, PDGF, HGF, Wint, Bcl-2 и сурвивин, и ферменты, вовлеченные в синтез нуклеиновых кислот, такие как рибонуклеотидредуктаза и ДНК-полимераза. Информация об этих генах раскрыта в известных базах данных GenBank и т.п., и киРНК и кшРНК могут быть разработаны и синтезированы на основе такой информации о генах. кшРНК, которая подробно описана ниже, может использоваться в качестве кшРНК, которая может ингибировать экспрессию тимидилатсинтазы посредством РНК-интерференции. Альтернативно, противораковое химиотерапевтическое средство может использоваться в качестве активного ингредиента.
В липоплексе настоящего изобретения молекула РНКи может содержаться в полой части, окруженной липидным бислоем из смеси липидов, или она может быть связана с поверхностью наружной мембраны липидного бислоя. Предпочтительно, когда молекула РНКи связана с поверхностью наружной мембраны липидного бислоя. Молекула РНКи может быть связана с поверхностью наружной мембраны липидного бислоя способом, описанным выше.
Липоплекс настоящего изобретения может использоваться в качестве противоопухолевого средства.
Липоплекс в соответствии с вариантом осуществления настоящего изобретения включает кшРНК, которая может ингибировать экспрессию тимидилатсинтазы (в дальнейшем именуемой «TS») посредством РНК-интерференции.
кшРНК, которая может ингибировать экспрессию TS, в соответствии с настоящим изобретением проявляет TS-специфическую РНКи-индуцирующую активность при таргетировании мРНК для TS, и она, таким образом, может значительно ингибировать экспрессию TS. Используемый здесь термин «таргетирование мРНК» относится к ситуации, в которой антисмысловая цепь кшРНК, описанной подробно ниже, может гибридизоваться в жестких условиях с мРНК-мишенью.
Жесткие условия могут быть определены на основе температуры плавления (Tm) для нуклеиновой кислоты, на которой образуется гибрид, в соответствии с традиционным методом. В жестких условиях, например, условия промывки, которые позволяют сохранить гибридизацию, включают, как правило, «1хSSC, 0,1% SDS, 37οC», более жестко «0,5хSSC, 0,1% SDS, 42οC» и еще жестче «0,1хSSC, 0,1% SDS, 65οC».
В соответствии с настоящим изобретением кшРНК включает смысловую цепь, включающую нуклеотидную последовательность, идентичную нуклеотидной последовательности ORF (открытой рамки считывания), кодирующей TS, или ее части, и антисмысловую цепь, гибридизующуюся в жестких условиях со смысловой цепью. Термин «нуклеотидная последовательность, идентичная нуклеотидной последовательности ORF или ее части», относится к нуклеотидной последовательности, которая идентична нуклеотидной последовательности, полученной путем замены тимина урацилом в нуклеотидной последовательности ORF или ее части.
Смысловая цепь состоит из 15-25 нуклеотидов и предпочтительно 19 нуклеотидов. Хотя нуклеотидная последовательность смысловой цепи предпочтительно является такой же, что и нуклеотидная последовательность ORF, кодирующей TS, она может представлять собой по существу одну и ту же последовательность; то есть, гомологичную последовательность. В частности, нуклеотидная последовательность смысловой цепи может отличаться от нуклеотидной последовательности ORF заменой, делецией, вставкой и/или добавлением одного или более; то есть, 1-3 нуклеотидов, предпочтительно 1 или 2 нуклеотидов и более предпочтительно 1 нуклеотида.
Антисмысловая цепь включает нуклеотидную последовательность, которая может гибридизоваться в жестких условиях со смысловой цепью. При условии, что она может гибридизоваться в жестких условиях, антисмысловая цепь может иметь несоответствие, в том числе замену, делецию, вставку и/или добавление 1-3 нуклеотидов, предпочтительно 1 или 2 нуклеотидов и более предпочтительно 1 нуклеотида. Предпочтительно, когда антисмысловая цепь состоит из нуклеотидной последовательности, полностью комплементарной смысловой цепи.
Нуклеотидные последовательности смысловой цепи и антисмысловой цепи могут быть выбраны на основе известной TS-кодирующей нуклеотидной последовательности (GenBank: CR601528.1). Известны различные способы отбора таких нуклеотидных последовательностей. Например, Design Support System для киРНК (Takara Bio Inc.) может использоваться
В настоящем изобретении примеры смысловой цепи включают те, которые состоят из нуклеотидных последовательностей, указанных ниже, хотя смысловые цепи не ограничиваются ими: 5'-GUAACACCAUCGAUCAUGA-3' (SEQ ID NO: 1); 5'-GAAUACAGAGAUAUGGAAU-3' (SEQ ID NO: 3) и 5'-CGAUCAUGAUGUAGAGUGU-3' (SEQ ID NO: 5).
В настоящем изобретении кшРНК предпочтительно включает: смысловую цепь 5'-GUAACACCAUCGAUCAUGA-3' (SEQ ID NO: 1) и антисмысловую цепь 5'-UCAUGAUCGAUGGUGUUAC-3' (SEQ ID NO: 2); антисмысловую цепь 5'-GAAUACAGAGAUAUGGAAU-3' (SEQ ID NO: 3) и антисмысловую цепь 5'-AUUCCAUAUCUCUGUAUUC-3' (SEQ ID NO: 4); или смысловую цепь 5'-CGAUCAUGAUGUAGAGUGU-3' (SEQ ID NO: 5) и антисмысловую цепь 5'-ACACUCUACAUCAUGAUCG-3' (SEQ ID NO: 6).
В настоящем изобретении более предпочтительно, когда кшРНК включает смысловую цепь, состоящую из нуклеотидной последовательности, представленной в SEQ ID NO: 1, и антисмысловую цепь, состоящую из нуклеотидной последовательности, представленной в SEQ ID NO: 2.
Смысловая цепь и антисмысловая цепь соединены друг с другом через линкер, они сложены, когда линкер образует петлю, и антисмысловая цепь и смысловая цепь гибридизуются друг с другом с образованием двухцепочечной части. При условии, что линкер, включенный в состав молекулы кшРНК, может соединять смысловую цепь с антисмысловой цепью и образовывать структуру «петля-на-стебле», он может представлять собой полинуклеотидный или неполинуклеотидный линкер. Предпочтительно линкер представляет собой, но особенно не ограничивается им, полинуклеотидный линкер, состоящий из 2-22 нуклеотидов, известный в данной области техники. Его конкретные примеры включают UAGUGCUCCUGGUUG (SEQ ID NO: 7), UUCAAGAGA, CCACC, CUCGAG, CCACACC, UUCAAGAGA, AUG, CCC и UUCG, при этом UAGUGCUCCUGGUUG (SEQ ID NO: 7) является предпочтительным.
В настоящем изобретении кшРНК содержит выступ, состоящий из двух или более нуклеотидов на 3'-конце.
В настоящем изобретении термин «выступ» относится к нуклеотиду, добавленному к 3'-концу антисмысловой цепи, который не имеет нуклеотида, способного к комплементарному связыванию с соответствующим положением смысловой цепи. Если антисмысловая цепь не имеет выступ на 3'-конце, степень ингибирования экспрессии TS, вызванного молекулой кшРНК, уменьшается на приблизительно 40%-60%, по сравнению со случаем, когда антисмысловая цепь имеет выступ. Типы и количество нуклеотидов, образующих выступ, особенно не ограничиваются. Могут использоваться, например, последовательности, состоящие из 1-5, предпочтительно 1-3 и более предпочтительно 1 или 2 нуклеотидов. Конкретные примеры включают TTT, UU и TT, при этом UU является предпочтительной.
В настоящем изобретении предпочтительно, когда кшРНК представляет собой одноцепочечную РНК, состоящую из нуклеотидной последовательности, представленной в SEQ ID NO: 8.
Смысловая или антисмысловая цепь может иметь фосфорилированный 5'-конец, и она может иметь трифосфатную (ppp) связь с 5'-концом, в случае необходимости.
Липоплекс, содержащий кшРНК настоящего изобретения, может включать киРНК или кшРНК, которая может ингибировать экспрессию «генов, кодирующих факторы, экспрессируемые в опухолевых клетках и причастные к росту опухолевых клеток» посредством РНК-интерференции, наряду с кшРНК, которая может ингибировать экспрессию TS. Могут использоваться киРНК или кшРНК, описанные выше. кшРНК может ингибировать экспрессию TS, и другая киРНК или кшРНК может присутствовать в одном и том же липоплексе или в отдельных липоплексах.
Как подробно описано в примерах, представленных ниже, содержащий кшРНК липоплекс способен к подавлению роста опухолевых клеток в результате его местного введения, и он может соответственно использоваться для лечения рака.
Раками, лечение которых может осуществляться с применением противоопухолевого средства настоящего изобретения, являются те, которые демонстрируют высокие уровни экспрессии TS. Их примеры включают, но без особенного ограничениями ими, колоректальный рак, рак печени, рак почки, рак головы и шеи, рак пищевода, рак желудка, рак желчных протоков, рак желчного пузыря и желчного протока, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, рак шейки матки, рак тела матки, рак мочевого пузыря, рак предстательной железы, злокачественную мезотелиому плевры, опухоль яичек, рак яичника, остеосаркому или остеосаркому мягких тканей, рак кожи и опухоль головного мозга. Лечение карциноматозного плеврита и карциноматозного перитонита может осуществляться с применением противоопухолевого средства настоящего изобретения. Предпочтительно кандидатами на лечение являются, например, рак желудка, рак легкого, рак желчных протоков, рак печени, злокачественная мезотелиома плевры, рак яичника, карциноматозный плеврит и карциноматозный перитонит, и особенно предпочтительно метастазы в брюшину рака желудка, рака яичников и рака поджелудочной железы, злокачественная мезотелиома плевры, и рак легкого и карциноматозная пневмония с первичными очагами поражения в полости грудной клетки.
Противоопухолевое средство настоящего изобретения может, кроме того, включать, наряду с липоплексом, наполнитель, связующее вещество, вызывающий дезинтеграцию агент, смазывающее вещество, разбавитель, солюбилизатор, суспендирующий агент, средство для придания изотоничночти, регулятор pH, буфер, стабилизатор, краситель, корригент, средство для улучшения запаха, гистидин или другие вещества, которые обычно используются при производстве фармацевтических продуктов.
Примеры наполнителей включают лактозу, сахарозу, хлорид натрия, глюкозу, мальтозу, маннит, эритрит, ксилит, мальтит, инозит, декстран, сорбит, альбумин, мочевину, крахмал, кальция карбонат, каолин, кристаллическую целлюлозу, кремниевую кислоту, метилцеллюлозу, глицерин, натрия альгинат, аравийскую камедь и их смесь. Примеры смазывающих веществ включают очищенный тальк, стеарат, натрия борат, полиэтиленгликоль и их смесь. Примеры связующих веществ включают сахарный сироп, раствор глюкозы, раствор крахмала, раствор желатина, поливиниловый спирт, поливиниловый эфир, поливинилпирролидон, карбоксиметилцеллюлозу, шеллак, метилцеллюлозу, этилцеллюлозу, воду, этанол, калия фосфат и их смесь. Примеры вызывающих дезинтеграцию агентов включают сухой крахмал, натрия альгинат, измельченный в порошок агар, измельченный в порошок ламинаран, натрия бикарбонат, кальция карбонат, полиоксиэтиленовые эфиры сорбита и жирной кислоты, натрия лаурилсульфат, моноглицерид стеариновой кислоты, крахмал, лактозу и их смесь. Примеры разбавителей включают воду, этиловый спирт, макрогол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт, полиоксиэтиленовые эфиры сорбита и жирной кислоты и их смесь. Примеры стабилизаторов включают натрия пиросульфит, этилендиаминтетрауксусную кислоту, тиогликолевую кислоту, тиомолочную кислоту и их смесь. Примеры средств для придания изотоничночти включают натрия хлорид, борную кислоту, глюкозу, глицерин и их смесь. Примеры регуляторов pH и буферов включают натрия ацетат, лимонную кислоту, натрия ацетат, натрия фосфат и их смесь.
Противоопухолевое средство настоящего изобретения можно вводить с помощью местного введения. Формами местного введения являются такие, которые описаны выше. Композиция настоящего изобретения может быть приготовлена в любой из различных лекарственных форм, подходящих для местного введения, такой как инъекционная форма, суспензия, эмульсия или аэрозоль. Противоопухолевое средство настоящего изобретения может предоставляться в лиофилизированной форме, и соответствующий буфер (например, физиологический раствор) может быть добавлен в момент его применения.
Эффекты противоопухолевого средства настоящего изобретения могут быть оценены посредством введения противоопухолевого средства в клетки или ткани, происходящие из любого из описанных выше раков, и индивидууму, страдающему любым из раков, описанных выше, сравнения размера результирующей опухоли с размером опухоли в клетках или тканях и у индивидуума, которому (в которые) противоопухолевое средство было введено (или до введения), и использования уменьшения или исчезновения опухоли в качестве показателя. Альтернативно, эффекты противоопухолевого средства настоящего изобретения могут быть оценены посредством введения противоопухолевого средства в клетки или ткани, происходящие из любого из описанных выше раков, и индивидууму, страдающему любым из раков, описанных выше, и определения улучшенного коэффициента выживаемости (т.е. эффектов увеличения продолжительности жизни) и уменьшения или исчезновения плеврального выпота или асцитов, по сравнению с индивидуумом, которому противоопухолевое средство не вводилось.
Противоопухолевое средство настоящего изобретения может использоваться в комбинации с имеющейся противораковой химиотерапией или противораковым химиотерапевтическим средством. Противораковая химиотерапия или противораковое химиотерапевтическое средство, которая(ое) может использоваться в комбинации с противоопухолевым средством настоящего изобретения, особенно не ограничивается, с условием, что оно может изменять условия в опухоли, так что липоплекс настоящего изобретения может легко проникать в опухолевую ткань. Примеры имеющихся противораковых химиотерапевтических средств включают противоопухолевые средства с ингибирующим деполимеризацию микротрубочек действием, такие как Taxol® (Bristol-Myers Squibb) и Taxotere® (Sanofi-Aventis), которые являются эффективными для пациентов с метастазами в брюшину рака желудка и рака яичников, и противоопухолевые средства, содержащие производные дезоксицитидина, такие как Gemcitabine® (Eli Lilly), который эффективен для лечения рака поджелудочной железы и метастазов в брюшину рака поджелудочной железы.
Противоопухолевое средство настоящего изобретения может использоваться в комбинации с другими традиционными противораковыми химиотерапевтическими средствами, помимо или вместо противораковых химиотерапевтических средств, описанных выше. Примеры таких противораковых химиотерапевтических средств включают циклофосфамид, N-оксид хлорметина, ифосфамид, мелфалан, бусульфан, митобронитол, карбоквон, тиотепу, ранимустин, нимустин, темозоломид, кармустин, пеметрексед динатрия, метотрексат, 6-меркаптопуринрибозид, меркаптопурин, доксифлуридин, кармофур, цитарабин, цитарабина окфосфат, эноцитабин, флударабин, пеметрексед, цисплатин, карбоплатин, оксалиплатин, доцетаксел, иринотекана гидрохлорид и капецитабин. Может использоваться одно или множество противораковых химиотерапевтических средств, выбираемых из них. Как и в случае противоракового химиотерапевтического средства, описанного выше, кшРНК может эффективно доставляться в опухолевые клетки, когда противораковое химиотерапевтическое средство используется в комбинации с противоопухолевым средством настоящего изобретения. Противоопухолевые эффекты, достигаемые таким образом, могут быть заметно выше таковых, достигаемых с применением только противоракового химиотерапевтического средства или противоопухолевого средства настоящего изобретения.
При условии, что противоопухолевое средство настоящего изобретения вводят в комбинации с имеющимся противораковым химиотерапевтическим средством, эти средства могут предоставляться в виде «комбинированного продукта».
Противоопухолевое средство настоящего изобретения может быть приготовлено в виде «комбинированного продукта» в комбинации с имеющимся противораковым химиотерапевтическим средством. Такой «комбинированный продукт» может представлять собой сложное лекарственное средство, содержащее противоопухолевое средство настоящего изобретения и имеющееся противораковое химиотерапевтическое средство в качестве активных ингредиентов. Кроме того, одна упаковка (набор препаратов), содержащая противоопухолевое средство настоящего изобретения и имеющееся противораковое химиотерапевтическое средство, подходящее для совместного введения, может изготовляться, упаковываться и распространяться.
Термин «совместное введение» может относиться не только к одновременному введению противоопухолевого средства настоящего изобретения и имеющегося противоракового химиотерапевтического средства, но также к введению противоопухолевого средства настоящего изобретения и имеющегося противоракового химиотерапевтического средства с определенными интервалами. Путь введения и способ введения противоопухолевого средства настоящего изобретения может быть одинаковым с или отличным от таковых для имеющегося противоракового химиотерапевтического средства.
Доза и частота введения противоопухолевого средства настоящего изобретения могут меняться в зависимости от таких факторов, как возраст и вес тела пациента и тяжесть заболевания. Противоопухолевое средство может вводиться в однократной дозе, соответственно выбираемой из диапазона от 0,0001 мг до 100 мг в пересчете на количество кшРНК на кг веса тела, от 1 до 3 раз каждый день или каждые 1-21 день.
Доза имеющегося противоракового химиотерапевтического средства может меняться в зависимости от таких факторов, как тип химического вещества в качестве активного ингредиента, возраст и вес тела пациента, и тяжесть заболевания. Имеющееся противораковое химиотерапевтическое средство может вводиться в однократной дозе, соответственно выбираемой из диапазона от 0,0001 мг до 1000 мг на кг веса тела, от 1 до 3 раз каждый день или каждые 1-14 дней. Когда имеющимся противораковым химиотерапевтическим средством является, например, паклитаксел, оно может вводиться в суточной дозе, составляющей от 500 до 1000 мг, внутрибрюшинно или внутривенно каждые 1-21 день. Когда имеющимся противораковым химиотерапевтическим средством является пеметрекседа натрия гидрат, оно может вводиться в суточной дозе, составляющей от 500 до 1000 мг, внутривенно каждые 1-21 день. Когда имеющимся противораковым химиотерапевтическим средством является TS-1, которое представляет собой противоопухолевое средство для перорального применения 5-FU, оно может вводиться 1-3 раза в день, каждый день или каждые 2 или 3 дня. Имеющееся противораковое химиотерапевтическое средство может вводиться в более низких дозах и с меньшей частотой при использовании в комбинации с противоопухолевым средством настоящего изобретения по сравнению со случаем, когда осуществляют введение только его. Оно может подавить или отсрочить развитие побочных эффектов, которые могут быть вызваны введением имеющихся противораковых химиотерапевтических средств. Примеры побочных эффектов включают, но без ограничения ими, подавление деятельности костного мозга, гемолитическую анемию, генерализованный тромбогеморрагический синдром, молниеносную печеночную недостаточность, дегидратацию, энтерит, интерстициальную пневмонию, стоматит, язву желудочно-кишечного тракта, кровотечение из желудочно-кишечного тракта, перфорацию желудочно-кишечного тракта, острую почечную недостаточность, слизисто-кожно-глазной синдром, токсический эпидермальный некролизис, психоневротическое расстройство, острый панкреатит, острый некроз скелетных мышц и отсутствие обоняния.
Настоящее изобретение также относится к способу лечения рака, используя противоопухолевое средство настоящего изобретения. Примеры раков, лечение которых может осуществляться этим способом, включают раки, определенные выше. В способе настоящего изобретения пути введения и дозы противоопухолевого средства настоящего изобретения и имеющихся противораковых химиотерапевтических средств являются такими, которые описаны выше.
Примеры
В дальнейшем настоящее изобретение описано более подробно со ссылкой на примеры, представленные ниже, хотя настоящее изобретение не ограничивается этими примерами.
Пример 1: Приготовление липоплекса
В примере 1 использовались реагенты, описанные ниже.
Диолеилфосфатидилэтаноламин (DOPE): Nippon Fine Chemical Co., Ltd.
1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC): Nippon Fine Chemical Co., Ltd.
O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина хлорид (DC-6-14): Pharmaron
Этанол: Wako Pure Chemical Industries, Ltd.
Натрия хлорид: Wako Pure Chemical Industries, Ltd.
(TS-таргетирующая кшРНК)
TS-таргетирующая кшРНК (в дальнейшем именуемая «TS-кшРНК»), имеющая последовательность, приведенную ниже, была синтезирована на основе известной кшРНК, способной к ингибированию экспрессии TS, которая, как было доказано, вызывает противоопухолевые эффекты (смотрите WO 2012/161196).
TS-кшРНК: 5'-GUAACACCAUCGAUCAUGAUAGUGCUCCUGGUUGUCAUGAUCGAUGGUGUUACUU-3' (SEQ ID NO: 8)
(1) Приготовление липоплекса (нового препарата) способом настоящего изобретения
(1-1) Приготовление липоплекса (т.е. нового препарата (1)) из лиофилизированного продукта смеси липидов
Presome DF1 (смесь липидов, включающую DOPE, DOPC и DC-6-14 в молярном соотношении 3:2:5, производства Nippon Fine Chemical Co., 100 мг) отвешивали и растворяли в 1,842 мл этанола при комнатной температуре с получением раствора смеси липидов в этаноле.
К 66,2 мкл не содержащей РНКазу воды добавляли 3,8 мкл 300 мкМ TS-кшРНК с получением водного раствора TS-кшРНК.
Затем 30 мкл раствора смеси липидов в этаноле постепенно добавляли по каплям к 70 мкл водного раствора TS-кшРНК при медленном перемешивании, для получения раствора липоплекса в этаноле/воде.
Получаемый в результате раствор липоплекса в этаноле/воде замораживали при -40οC или ниже, а затем подвергали лиофилизации, используя сублимационную сушку (LABCONCO FZ-4.5, Asahi Life Science Co., Ltd.).
К получаемому в результате лиофилизированному продукту добавляли 100 мкл физиологического раствора, приготовленного с использованием не содержащей РНКазы воды, (0,9% (в отношении веса к объему) водного раствора хлорида натрия), и смесь перемешивали, используя PresentMixer2013, в течение 10 секунд для получения липоплекса (с количеством TS-кшРНК: 20 мкг/100 мкл).
В дальнейшем полученный таким липоплекс приводится как «новый препарат (1)».
(1-2) Приготовление липоплекса (нового препарата (2)) из измельченных в порошок липидов DOPE, DOPC и DC-6-14
Отвешивали порошки DOPE (55,8 мг), DOPC (78,6 мг) и DC-6-14 (66,0 мг), к каждому из них добавляли 1 мл этанола, и смеси затем нагревали до 40οC с получением растворов, содержащих 75 мМ DOPE, 100 мМ DOPC и 100 мМ DC-6-14, соответственно.
К 4,777 мкл этанола добавляли 9,172 мкл 75 мМ раствора DOPE, 4,586 мкл 100 мМ раствора DOPC и 11,465 мкл 100 мМ раствора DC-6-14 с получением раствора смеси липидов в этаноле, содержащего DOPE, DOPC и DC-6-14 в молярном соотношении 3:2:5.
Затем 30 мкл раствора смеси липидов в этаноле постепенно добавляли по каплям к 70 мкл водного раствора TS-кшРНК при медленном перемешивании для получения раствора липоплекса в этаноле/воде.
Получаемый в результате раствор липоплекса в этаноле/воде подвергали лиофилизации так же, как и в (1-1), к нему добавляли физиологический раствор, приготовленный с использованием не содержащей РНКазы воды, и смесь затем перемешивали с получением липоплекса (с количеством TS-кшРНК: 20 мкг/100 мкл).
В дальнейшем полученный таким липоплекс приводится как «новый препарат (2)».
(2) Приготовление липоплекса известным способом
Отвешивали порошки DOPE (0,51 мг), DOPC (0,36 мг) и DC-6-14 (0,76 мг), и такие порошки смешивали и растворяли в 1,0 мл смеси циклогексан/этанол (95%/5% (в объемном отношении)). Затем получаемый в результате раствор подвергали лиофилизации, из него удаляли циклогексан и этанол, добавляли 50 мкл физиологического раствора, смесь энергично перемешивали, используя вортекс, в течение 10 минут для приготовления суспензии, и в нее вносили 50 мкл водного раствора, содержащего TS-кшРНК (0,4 мкг/мкл), для получения липоплекса (с количеством TS-кшРНК: 20 мкг/100 мкл).
В дальнейшем полученный таким липоплекс приводится как «традиционный препарат».
Пример 2: Сравнение эквивалентности физических свойств липоплексов
Используя Zetasizer Nano ZS (Malvern), измеряли диаметр частиц (d, нм), коэффициент полидисперсности (PdI) и дзета-потенциал (мВ) нового препарата (1) и нового препарата (2), полученного в примере 1, а также традиционного препарата.
Результаты представлены на фиг. 1.
Результаты показывают, что нет значительных различий в плане физических свойств между традиционным препаратом, полученным известным способом, новым препаратом (1) или новым препаратом (2), полученными способом настоящего изобретения, и что преплекс, полученный известным способом, не отличается от преплекса, полученного способом настоящего изобретения, в плане физических свойств.
Пример 3: Оценка способности липоплекса к удерживанию TS-кшРНК
В примере 3 использовались реагенты, описанные ниже.
Tris: Wako Pure Chemical Industries, Ltd.
Борная кислота: Wako Pure Chemical Industries, Ltd.
EDTA×2Na: Sigma-Aldrich
Агароза: Sigma-Aldrich
Этидия бромид (EtBr): Wako Pure Chemical Industries, Ltd.
Новый препарат (1), новый препарат (2) и традиционный препарат, приготовленные в примере 1, были оценены в плане способности к удерживанию кшРНК.
Отвешивали Tris (5,4 г), борную кислоту (2,75 г) и EDTA×2Na (0,185 г), и добавляли дистиллированную воду для доведения количества раствора до 1 литра. Таким образом, был приготовлен буфер TBE. Буфер TBE (40 мл) добавляли к 0,4 г агарозы, агарозу полностью растворяли с помощью кипячения, к ней добавляли 4 мкл 1 мг/мл EtBr, результирующий продукт помещали на пластину для геля, и температуру возвращали к комнатной температуре для приготовления 1% агарозного геля.
Пластину с гелем устанавливали в аппарат для электрофореза (PLUS-2, CIMA Biotech), каждый из традиционного препарата, нового препарата (1) и нового препарата (2) разбавляли в 10 раз и наносили на агарозный гель, в электрофоретический резервуар добавляли буфер TBE, и затем электрофорез проводили при 100 В в течение 15 минут. После этого отмечали соответствующую TS-кшРНК полосу, используя AE-9000N E-Graph (ATTO Corporation). Оценку проводили таким же образом через 1 день и 3 дня после приготовления липоплексов.
Результаты представлены на фиг. 2.
Сразу после получения традиционного препарата, нового препарата (1) и нового препарата (2) никакой полосы не отмечали в геле в положении, одинаковым с таковым в случае свободной TS-кшРНК. Т.е. в содержащих липоплекс образцах по существу не было свободной TS-кшРНК. Кроме того, никакой полосы не отмечали в положении, одинаковым с таковым в случае свободной TS-кшРНК, через 3 дня после получения. Таким образом, было подтверждено, что традиционный препарат, новый препарат (1) и новый препарат (2) могли удерживать TS-кшРНК спустя 3 дня после их получения.
Результаты показывают, что нет значительного различия в плане способности к удерживанию кшРНК между липоплексом, полученным традиционным способом, и липоплексом, полученным способом настоящего изобретения.
Пример 4: Оценка ингибиторных эффектов липоплекса на ген-мишень опухоли с помощью внутрибрюшинного введения
(ОТ-ПЦР в режиме реального времени)
В примере 4 использовались реагенты, описанные ниже.
TaqMan® реагенты для обратной транскрипции: Life Technologies
Мастер-микс FastStart Universal Probe Master (ROX): Roche
Универсальная библиотека зондов #64: Roche
Универсальная библиотека зондов #60: Roche
Прямой праймер для мРНК TS: Life Technologies
Нуклеотидная последовательность: 5'-CCC CTT CTT CTC TGG TGG A-3' (SEQ ID NO: 9)
Обратный праймер для мРНК TS: Life Technologies
Нуклеотидная последовательность: 5'-AGG AGT TGC TGT GGT TTA TCA AG-3' (SEQ ID NO: 10)
Обратный праймер для мРНК GAPDH: Life Technologies
Нуклеотидная последовательность: 5'-CTC TGC TCC TCC TGT TCG AC-3' (SEQ ID NO: 11)
Обратный праймер для мРНК GAPDH: Life Technologies
Нуклеотидная последовательность: 5'-ACG ACC AAA TCC GTT GAC TC-3' (SEQ ID NO: 12)
Новый препарат (1), новый препарат (2) и традиционный препарат, приготовленные в примере 1, были оценены с помощью ОТ-ПЦР в режиме реального времени в плане ингибиторных эффектов на ген-мишень опухоли.
Клетки рака желудка человека MKN-45 (RIKEN, Япония) культивировали и трансплантировали внутрибрюшинно «голым» мышам BALB/c (возрастом 5 недель, самцам) в количестве 5×106 клеток/мышь. Вес тела мышей определяли в день трансплантации и спустя 6 дней после этого, и мышей, вес тела которых уменьшался, (т.е. мышей, у которых трансплантированные клетки, как полагают, привились) подвергали эксперименту в качестве моделей распространения на брюшину клеток MKN45 на мышах.
Традиционный препарат, новый препарат (1) или новый препарат (2) вводили внутрибрюшинно различным моделям на мышах таким образом, чтобы 20 мкг TS-кшРНК вводилось бы каждой мыши в день, и такое введение выполняли три раза в сумме (т.е. через 7, 9 и 11 дней после трансплантации клеток). Опухоли удаляли из моделей на мышах через 13 дней после трансплантации клеток, опухоли гомогенизировали с применением Multi-beads shocker® (Yasui Kikai Corporation), и затем РНК экстрагировали, используя RNeasy® Mini Kit (QIAGEN).
Концентрацию РНК в получаемом в результате экстракте РНК измеряли, используя NanoDrop 8000 (Thermo Fisher Scientific), экстракт разбавляли не содержащей РНКазу водой для доведения концентрации РНК до 1 мкг/7,7 мкл, и затем выполняли обратную транскрипцию с применением TaqMan® реагентов для обратной транскрипции (при 16οC в течение 30 минут, 42οC в течение 30 минут и 85οC в течение 5 минут).
К 5 мкл получаемого в результате раствора кДНК добавляли 15 мкл смеси для TS-специфической ПЦР или смеси для GAPDH-специфической ПЦР, описанной ниже, и выполняли ОТ-ПЦР в режиме реального времени (с одним циклом, состоящим из 50οC в течение 2 минут и 95οC в течение 10 минут, с повторением 40 раз, 95οC в течение 15 секунд и 60οC в течение 1 минуты) с применением StepOnePlusTM (Life Technologies). Затем определяли уровень мРНК для mRNA и уровень мРНК для GAPDH.
Результаты представлены на фиг. 3. На фиг. 3 уровень мРНК для TS, определенный с помощью ОТ-ПЦР в режиме реального времени с учетом поправки на уровень мРНК для GAPDH, указан как «уровень экспрессии мРНК TS» относительно уровня (т.е. 100%), определяемого для контрольной группы моделей на мышах, которым вводили 9% раствор сахарозы без липоплекса.
Во всех группах, подвергнутых введению традиционного препарата, нового препарата (1) и нового препарата (2), уровни экспрессии мРНК TS уменьшались значительно на приблизительно 30%, по сравнению с контрольной группой. Таким образом, было установлено, что липоплекс, полученный традиционным способом, и липоплекс, полученный способом настоящего изобретения, способны к подавлению экспрессии гена-мишени опухоли, которая распространилась на брюшину в значительной степени. Было также установлено, что нет значительного различия в таких эффектах между липоплексом, полученным традиционным способом, и липоплексом, полученным способом настоящего изобретения.
Пример 5: Оценка ингибиторных эффектов липоплекса на ген-мишень опухоли с помощью внутрибрюшинного введения
(Системы in vivo визуализации: IVIS)
В примере 5 использовались реагенты, описанные ниже.
Люциферин: Wako Pure Chemical Industries, Ltd.
PBS: Nissui Pharmaceutical Co., Ltd.
(Таргетирующая люциферазу (Luc) кшРНК)
Luc-таргетирующая кшРНК (в дальнейшем именуемая «Luc-кшРНК») имеет последователь, представленную ниже.
Luc-кшРНК: 5'-CUUACGCUGAGUACUUCGAUAGUGCUCCUGGUUGUCGAAGUACUCAGCGUAAGUU-3' (SEQ ID NO: 13)
В примере 5 содержащие Luc-кшРНК липоплексы были приготовлены с применением таргетирующей люциферазу кшРНК (Luc-кшРНК) таким же образом, как и в примере 1, за исключением того, что Luc-кшРНК использовали вместо кшРНК, и ингибиторные эффекты нового препарата (1), нового препарата (2) и традиционного препарата на ген-мишень опухоли оценивали, используя IVIS.
Экспрессирующие люциферазу клетки рака желудка человека NCI-N87 (NCI-N87-Luc, Summit Pharmaceuticals International Corporation) культивировали и трансплантировали внутрибрюшинно «голым» мышам BALB/c (возрастом 5 недель, самцам, Japan SLC, Inc.) в количестве 4×106 клеток/мышь для создания моделей распространения на брюшину клеток NCI-N87-Luc на мышах.
Традиционный препарат, новый препарат (1) или новый препарат (2) вводили внутрибрюшинно различным моделям на мышах таким образом, чтобы 20 мкг Luc-кшРНК вводилось бы каждой мыши в день, и такое введение выполняли пять раз в сумме (т.е. через 8, 11, 14, 17 и 20 дней после трансплантации клеток). Люциферин растворяли с использованием PBS до концентрации, составляющей 7,5 мг/мл, 10 мкл люциферина вводили внутрибрюшинно через 7, 10, 13, 16, 19 и 22 дня после трансплантации клеток, и за люциферазной активности опухоли вели наблюдение, используя IVIS (Xenogen, Alameda, CA, США). Модели на мышах, которым липоплексы не вводились, но которым вводили 9% раствор сахарозы, использовали в качестве контрольной группы.
Используя демонстрирующие результаты данные изображений, представлен график, демонстрирующий результаты количественного анализа люциферазной активности в брюшной полости (фиг. 4).
В контрольной группе отмечали увеличение люциферазной активности с течением времени. Это указывает на рост опухоли в брюшной полости. В группах, подвергнутых внутрибрюшинному введению традиционного препарата, нового препарата (1) и нового препарата (2), содержащих Luc-кшРНК, отмечалось значительное уменьшение люциферазной активности после первого введения. Во время эксперимента (вплоть до 22 дней после трансплантации клеток), люциферазная активность не увеличивалась снова (фиг. 4).
В то время как таргетирующую люциферазу Luc-кшРНК использовали в примере 5, вряд ли бы такая Luc-кшРНК оказывала бы влияние на рост опухоли. В самом деле, вес опухолей в группах мышей определяли через 24 дня после трансплантации клеток, и между группами не отмечались значительные различия. Таким образом, было установлено, что введение содержащего Luc-кшРНК липоплекса избирательно ингибирует люциферазную активность опухоли. Результаты показывают, что обусловленная TS-кшРНК активность липоплекса, полученного традиционным способом, является одинаковой с таковой нового липоплекса в соответствии со способом настоящего изобретения.
Пример 6: Оценка терапевтических эффектов липоплекса (нового препарата (2)) на распространения рака яичника на брюшину с помощью внутрибрюшинного введения
Были оценены терапевтические эффекты содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)), приготовленного таким же образом, как и в примере 1, на распространение рака яичника на брюшину.
Экспрессирующие люциферазу клетки рака яичника OVCAR-3 (OVCAR-3-luc, Pharmaron) культивировали и трансплантировали внутрибрюшинно «голым» мышам BALB/c (возрастом 6-8 недель, самкам, Beijing HFK Bio-Technology Co., Ltd.) в количестве 1,5×107 клеток/мышь для создания моделей распространения на брюшину клеток OVCAR-3-luc на мышах.
В примере 6 липоплекс (новый препарат (2)), паклитаксел (таксол, Pharmaron), или липоплекс (новый препарат (2)) в комбинации с паклитакселом вводили различным моделям на мышах. 9% раствор сахарозы вводили контрольной группе.
Липоплекс (новый препарат (2)) вводили внутрибрюшинно моделям на мышах таким образом, чтобы 20 мкг TS-кшРНК вводилось бы каждой мыши в день, и такое введение выполняли четыре раза в сумме (т.е. через 8, 11, 14 и 17 дней после трансплантации клеток). Паклитаксел вводили внутрибрюшинно соответствующей группе моделей на мышах четыре раза в сумме (т.е. через 8, 11, 14 и 17 дней после трансплантации клеток) в дозе, составляющей 15 мг/кг.
Люциферин растворяли с использованием PBS до концентрации, составляющей 7,5 мг/мл, 10 мкл люциферина вводили внутрибрюшинно через 7, 14, 21 и 26 дней после трансплантации клеток, и за люциферазной активности опухоли вели наблюдение, используя IVIS.
Результаты представлены на фиг. 5-1. Используя представленные на фиг. 5-1 данные изображений, представлен график, демонстрирующий результаты количественного анализа люциферазной активности в брюшной полости, (фиг. 5-2) и график ее логарифмической функции (фиг. 5-3).
В контрольной группе отмечали увеличение люциферазной активности с течением времени. Это указывает на рост опухоли в брюшной полости. В группах, подвергнутых внутрибрюшинному введению содержащего TS-кшРНК липоплекса, увеличение люциферазной активности было уменьшенным по сравнению с контрольной группой. Это означает, что рост опухоли подавлялся в брюшной полости. Кроме того, наибольшие ингибиторные эффекты на рост опухоли отмечались в группе, подвергнутой введению липоплекса в комбинации с паклитакселом.
На фиг. 5-4 представлены периоды времени выживания моделей на мышах.
По сравнению с контрольной группой, значительно большие эффекты увеличения продолжительности жизни отмечались в группе, подвергнутой введению липоплекса в комбинации с паклитакселом.
На фиг. 5-5 представлены результаты определения с помощью ОТ-ПЦР изменения концентрации TS-кшРНК в крови и асцитах моделей на мышах, подвергнутых введению липоплекса.
Результаты демонстрируют длительный полупериод существования, составляющий приблизительно 8 часов, в асцитах, в то время как TS-кшРНК не проникала в кровь.
Пример 7: Оценка терапевтических эффектов липоплекса (нового препарата (2)) на распространения рака поджелудочной железы на брюшину с помощью внутрибрюшинного введения
Были оценены терапевтические эффекты содержащего TS-кшРНК липоплекса (т.е. нового препарата (2)), приготовленного таким же образом, как и в примере 1, на распространение рака поджелудочной железы на брюшину.
Экспрессирующие люциферазу клетки рака поджелудочной железы PANC-1 (PANC-1-luc, Pharmaron) культивировали и трансплантировали внутрибрюшинно «голым» мышам BALB/c (возрастом 6-8 недель, самкам, Beijing HFK Bio-Technology Co., Ltd.) в количестве 1×107 клеток/мышь, для создания моделей распространения на брюшину клеток PANC-1-luc на мышах.
В примере 7 липоплекс (новый препарат (2)), паклитаксел (таксол, Pharmaron) или липоплекс (новый препарат (2)) в комбинации с паклитакселом вводили различным моделям на мышах. 9% раствор сахарозы вводили контрольной группе.
Липоплекс (новый препарат (2)) вводили внутрибрюшинно моделям на мышах таким образом, чтобы 20 мкг TS-кшРНК вводилось бы каждой мыши в день, и такое введение выполняли четыре раза в сумме (т.е. через 8, 11, 14 и 17 дней после трансплантации клеток). Паклитаксел вводили внутрибрюшинно соответствующей группе моделей на мышах четыре раза в сумме (т.е. через 8, 11, 14 и 17 дней после трансплантации клеток) в дозе, составляющей 10 мг/кг.
Люциферин растворяли с использованием PBS до концентрации, составляющей 7,5 мг/мл, 10 мкл люциферина вводили внутрибрюшинно через 7, 14, 21 и 26 дней после трансплантации клеток, и за люциферазной активности опухоли вели наблюдение, используя IVIS.
Представлен график, демонстрирующий люциферазную активность в брюшной полости, количественно определенную на основе данных изображений, полученных с использованием IVIS, (фиг. 6-1) и график ее логарифмической функции (фиг. 6-2).
В контрольной группе отмечали увеличение люциферазной активности с течением времени. Это указывает на рост опухоли в брюшной полости. В группах, подвергнутых введению липоплекса (нового препарата (2)), паклитаксела (таксола, Pharmaron) или липоплекса (нового препарата (2)) в комбинации с паклитакселом, увеличение люциферазной активности было уменьшенным по сравнению с контрольной группой. Это означает, что рост опухоли подавлялся в брюшной полости. В частности, сильные эффекты подавления опухоли отмечались в группе, подвергнутой введению паклитаксела, и в группе, подвергнутой введению липоплекса в комбинации с паклитакселом.
На фиг. 6-3 представлены периоды времени выживания моделей на мышах.
По сравнению с контрольной группой, значительно большие эффекты увеличения продолжительности жизни отмечались в группе, подвергнутой введению липоплекса в комбинации с паклитакселом.
Промышленная применимость
В соответствии с настоящим изобретением липоплексы могут быть образованы с использованием только растворителя, являющегося очень хорошо переносящимся, без использования органического растворителя с высокой степенью токсичности и взрывчатости, такого как хлороформ или циклогексан. Соответственно, настоящее изобретение является оптимальным для промышленных способов производства фармацевтических препаратов. В медицинских учреждениях, например, в рецептурном отделе больницы, можно избежать сложных процессов приготовления лекарственных средств, включающих приготовление отдельно дисперсий в воде смесей липидов и водных растворов молекул РНКи, а затем смешивание их вместе. Кроме того, текучая среда, вводимая пациенту, может быть приготовлена путем добавления физиологического раствора или текучей среды с углеводами к измельченному в порошок липоплексу и мягкого перемешивания смеси. Соответственно, усилия и затраты, требуемые для приготовления лекарственных средств в рецептурном отделе больницы, могут быть в значительной степени уменьшены.
Кроме того, может быть выполнено местное введение, являющееся подходящим для определенной цели введения, например, внутрибрюшинное введение для пациентов с метастазами в брюшину рака желудка, рака яичника или рака поджелудочной железы (т.е. в состоянии, близком к конечной стадии соответствующего рака) или интраторакальное введение для пациентов с злокачественной мезотелиомой плевры, раком легкого или карциноматозной пневмонией с первичным очагом поражения, отмечаемом в полости грудной клетки. Таким образом, молекулы РНКи могут быть эффективно доставлены в опухолевую клетку-мишень, и рост опухоли может быть эффективно подавлен. Ожидается, что настоящее изобретение внесет значительный вклад в область доставки лекарственных средств и лечения рака.
Все публикации, патенты и заявки на патенты, приведенные здесь, включены сюда посредством ссылки во всей их полноте.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОСНОВАННАЯ НА НАНОЧАСТИЦАХ, НАЦЕЛЕННАЯ НА ОПУХОЛИ ДОСТАВКА ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2011 |
|
RU2593367C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ TUSC2-ИММУНОТЕРАПИИ | 2017 |
|
RU2755903C2 |
| Композиция для ингибирования роста и стимуляции апоптоза клеток колоректального рака | 2016 |
|
RU2644675C1 |
| НОВЫЕ КОМПОЗИЦИИ ЛИПОСОМ | 2006 |
|
RU2454229C2 |
| ЛИПИДНЫЕ НАНОЧАСТИЦЫ | 2021 |
|
RU2837542C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВЫХ АГЕНТОВ | 2000 |
|
RU2271829C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ХОЛЕСТАНОЛА | 2009 |
|
RU2492865C2 |
| ПОЛУЧЕНИЕ И ХРАНЕНИЕ ЛИПОСОМНЫХ ПРЕПАРАТОВ РНК, ПРИГОДНЫХ ДЛЯ ТЕРАПИИ | 2020 |
|
RU2807543C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ ЛИПИДОВ И ЛИПОСОМ | 2015 |
|
RU2738060C2 |
| СРЕДСТВО, УЛУЧШАЮЩЕЕ ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ОКСАЛИПЛАТИН, И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО | 2009 |
|
RU2492863C2 |
Группа изобретений относится к химико-фармацевтической промышленности и представляет собой способ производства липоплекса, содержащего смесь липидов, состоящую из диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида, и молекулы РНКи, включающий стадии растворения диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида в этаноле, где фосфатидилхолин представляет собой 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), пальмитоилолеоилфосфатидилхолин (POPC) или 1,2-диэйкозеноил-sn-глицеро-3-фосфохолин (DEPC), и где катионный липид представляет собой O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина хлорид (DC-6-14); добавления раствора этанола, полученного на предыдущей стадии, по каплям к раствору молекул РНКи в воде при перемешивании; и лиофилизации раствора. Также изобретение включает фармацевтическую композицию, которая содержит липоплекс и короткую, образующую шпильки РНК (кшРНК), способную ингибировать экспрессию тимидилатсинтазы посредством РНК-и (ТС-кшРНК). Группа изобретений также включает комбинированный продукт для лечения метастазов в брюшину рака желудка, рака яичников и рака поджелудочной железы, включающий фармацевтическую композицию и противораковое химиотерапевтическое средство, которое имеет ингибирующий деполимеризацию микротрубочек механизм действия. Группа изобретений позволяет создать комбинированный препарат, проявляющий аддитивный или синергетический эффект при сочетании липоплекса и противоракового химиотерапевтического средства. 3 н. и 8 з.п. ф-лы, 12 ил., 7 пр.
1. Способ производства липоплекса, содержащего смесь липидов, состоящую из диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида, и молекулы РНКи, включающий стадии:
(a) растворения диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида в этаноле, где фосфатидилхолин представляет собой 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), пальмитоилолеоилфосфатидилхолин (POPC) или 1,2-диэйкозеноил-sn-глицеро-3-фосфохолин (DEPC), и где катионный липид представляет собой O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина хлорид (DC-6-14);
(b) добавления раствора этанола, полученного на стадии (a), по каплям к раствору молекул РНКи в воде при перемешивании; и
(c) лиофилизации раствора, полученного на стадии (b).
2. Способ по п. 1, в котором фосфатидилхолин представляет собой DOPC.
3. Способ по п. 1, в котором стадия (a) включает растворение и смешивание DOPE, DOPC и DC-6-14 в этаноле.
4. Способ по любому из пп.1-3, который, кроме того, включает стадию (d) приготовления смеси лиофилизированного продукта, полученного на стадии (c), в буфере.
5. Фармацевтическая композиция, используемая для местного введения с целью лечения метастазов в брюшину рака желудка, рака яичников и рака поджелудочной железы, которая содержит:
смесь липидов, полученную способом по п. 1 и состоящую из диолеилфосфатидилэтаноламина (DOPE), фосфатидилхолина и катионного липида, где фосфатидилхолин представляет собой 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), пальмитоилолеоилфосфатидилхолин (POPC) или 1,2-диэйкозеноил-sn-глицеро-3-фосфохолин (DEPC), и где катионный липид представляет собой O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина хлорид (DC-6-14), и
короткую, образующую шпильки РНК (кшРНК), способную ингибировать экспрессию тимидилатсинтазы посредством РНК-и (ТС-кшРНК).
6. Фармацевтическая композиция по п. 5, в которой фосфатидилхолин представляет собой DOPC.
7. Фармацевтическая композиция по п. 5, в которой смесь липидов состоит из DOPE, DOPC и DC-6-14.
8. Фармацевтическая композиция по п. 7, которая включает DOPE, DOPC и DC-6-14 в молярном соотношении 3:2:5.
9. Фармацевтическая композиция по любому из пп. 5-8, в которой кшРНК состоит из нуклеотидной последовательности, представленной в SEQ ID NO: 8.
10. Фармацевтическая композиция по любому из пп. 5-9, которая используется в комбинации с противораковым химиотерапевтическим средством.
11. Комбинированный продукт для лечения метастазов в брюшину рака желудка, рака яичников и рака поджелудочной железы, включающий фармацевтическую композицию по любому из пп. 5-10 и противораковое химиотерапевтическое средство, которое имеет ингибирующий деполимеризацию микротрубочек механизм действия.
| WO 2012161196 A1, 31.07.2014 | |||
| WO 2013177419 A1, 28.11.2013 | |||
| WO 2013149140 A1, 03.10.2013 | |||
| Yi Wen and Wilson S | |||
| Meng, Recent In Vivo Evidences of Particle-Based Delivery of Small-Interfering RNA (siRNA) into Solid Tumors// J Pharm Innov (2014) 9 | |||
| ГЕНЕТИЧЕСКИЙ ТЕСТ НА НАКОПЛЕНИЕ МЕДИ В ПЕЧЕНИ СОБАК И КОРМ ДЛЯ ДОМАШНИХ ЖИВОТНЫХ С НИЗКИМ СОДЕРЖАНИЕМ МЕДИ | 2010 |
|
RU2564129C2 |
| СИНЕРГИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2438664C2 |
| И.Н | |||
| Шакирова, М.Б | |||
| Стенина, Н.С | |||
| Бесова | |||
| Нейротоксичность паклитаксела.// Вестник РОНЦ им | |||
| Н | |||
| Н | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 6287590 B1, 11.09.2001 | |||
| WO 2005067632 A2, 28.07.2005. | |||
Авторы
Даты
2018-11-07—Публикация
2015-10-28—Подача