Изобретение относится к фармацевтической биотехнологии. Предложен способ перфузионного культивирования клеток, позволяющий в промышленных объемах продуцировать антитела со сниженным уровнем варьирования критических гликанов, в частности, терапевтические антитела, аффинные к С5-компоненту комплемента, и анти-IgE антитела.
Термипы и определения
Фед-батч - культивирование микроорганизмов или культур клеток в периодическом режиме с подпиткой.
Перфузия - разновидность непрерывного культивирования с частичным или полным отделением клеток от выходящего потока культуральной жидкости и возвращением их в биореактор.
Скорость перфузии - объем потока культуральной жидкости, может быть выражена в литрах в сутки (л/сутки, л*сутки-1).
Относительная скорость перфузии - количество объемов реактора (N), сменяемых за сутки, Размерность определяется в относительных единицах как N/сутки или N*сутки-1
Ускорение перфузии - изменение скорости перфузии за единицу времени, достигаемое путем увеличения скорости протока среды на начальном этапе перфузионного культивирования. Определяется как первая производная скорости перфузии, т.е. скорость перфузии, деленная на время, N/сутки2, или N*сутки-2.
Удельная скорость перфузии (УСП) - отношение скорости протока питательной среды к концентрации клеток, измеряется в пиколитрах на клетку в сутки, пл/кл/сутки. Стационарная фаза перфузионного культивирования - фаза перфузионного процесса, в которой рост клеток в биореакторе скомпенсирован их отбором, так что концентрация клеток в течение длительного времени поддерживается на определенном уровне с незначительными отклонениями.
Блидинг - непрерывный или дискретный отбор суспензии клеток из биореактора в стационарной фазе перфузионного культивирования для предотвращения перерастания культуры и недостатка питательных веществ, размерность определяется в относительных единицах - количество объемов реактора, отбираемых за сутки, N*сутки-1.
Непрерывное культивирование клеток с применением перфузионных процессов - перспективный метод, используемый в промышленной биотехнологии при наработке в клетках различных белков, в том числе терапевтического назначения. В то же время короткий период применения перфузионных процессов в мире и, соответственно, недостаточная экспериментальная проверка особенностей способа, одновременно с появлением новых питательных сред, привели к появлению новой технической проблемы, обнаруженной авторами изобретения. Питательные среды более ранних поколений не оказывали большого влияния на процесс культивирования в широком диапазоне применяемых ускорений перфузии. Однако среды нового поколения, появившиеся относительно недавно, проявляют себя совсем по-другому. Различные ускорения перфузии вызывают различную реакцию культур клеток, довольно часто крайне негативную. Поэтому проблема оптимизации ускорения перфузии требует аккуратного обращения и тщательного исследования.
В настоящее время известно много различных модификаций процесса, и до сих пор неизвестен процесс, которой с одинаковой эффективностью позволял бы продуцировать любой необходимый белок в любой культуре клеток, то есть выбор конечных условий способа продукции белка каждый раз является нетривиальной задачей, требующей синтеза различных методов и экспериментальной проверки новых способов.
Описание чертежей.
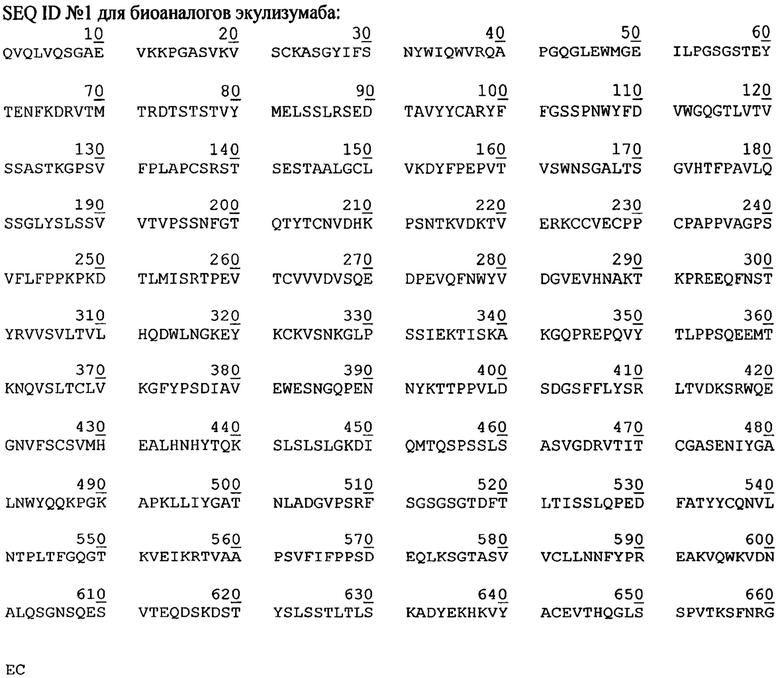
Фиг. 1. Графики изменения скорости протока среды при различных ускорениях перфузии
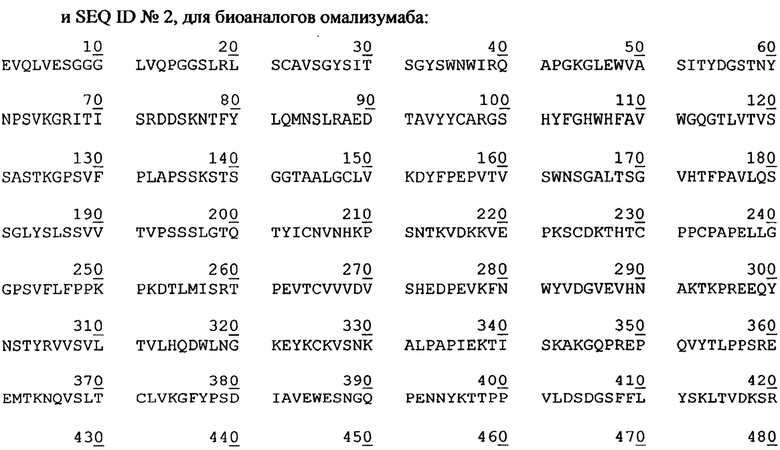
Фиг. 2. Кривые роста культуры клеток СНО, экспрессирующей антитело, имеющее аминокислотную последовательность экулизумаба, при различных ускорениях перфузии
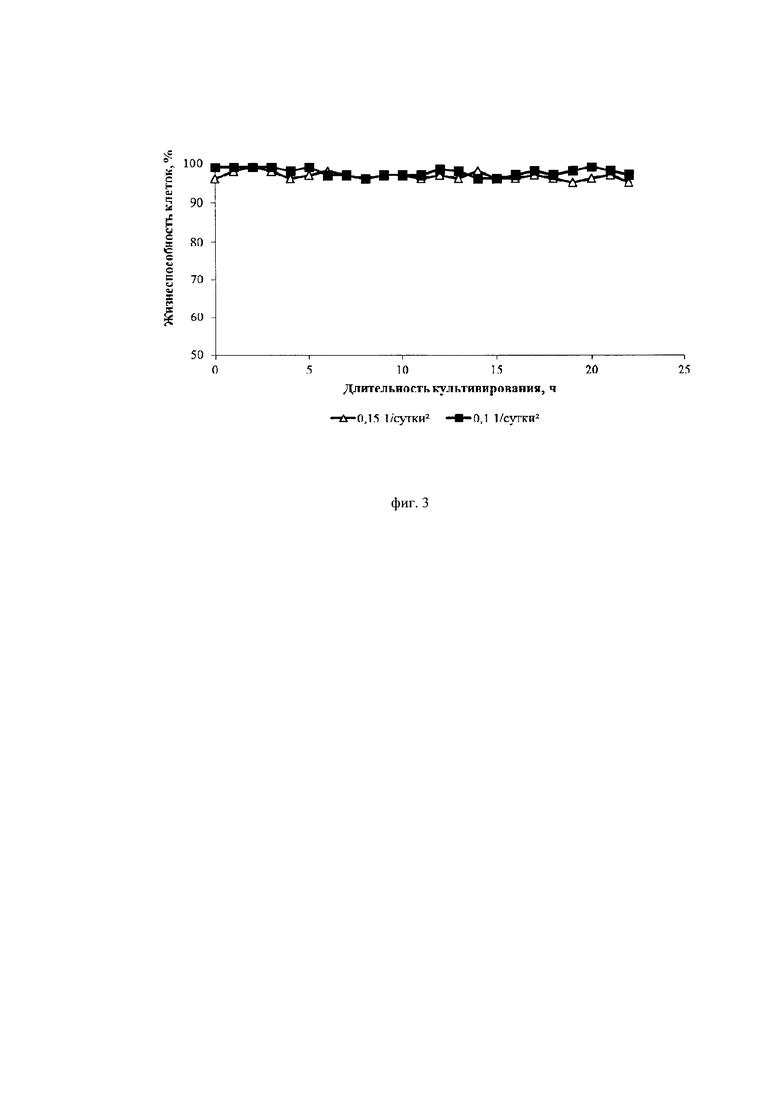
Фиг. 3. Динамика изменения жизнеспособности культуры клеток СНО, экспрессирующей антитело, имеющее аминокислотную последовательность экулизумаба, при различных ускорениях перфузии
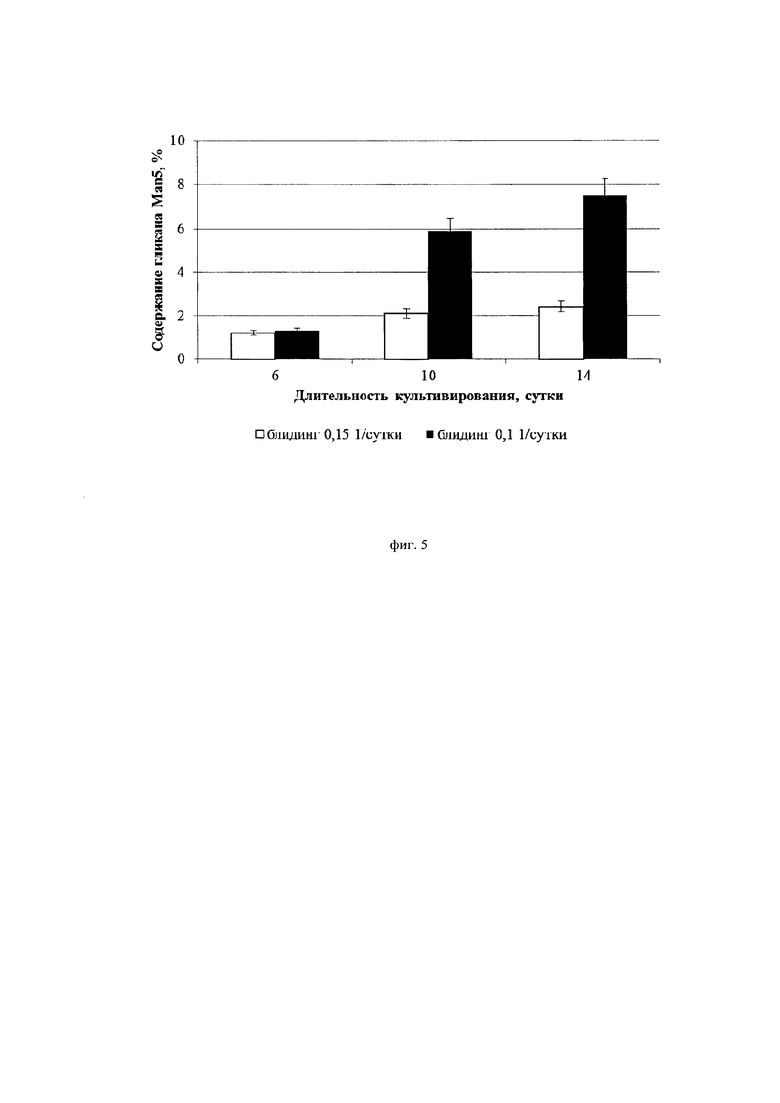
Фиг. 5. Влияние скорости блидинга на содержание гликана Man5 в целевом белке ( - 0,1* сутки-1,
- 0,1* сутки-1,  - 0,15* сутки-1)
- 0,15* сутки-1)
Фиг. 6. Влияние скорости блидинга на содержание гликана G0 в целевом белке ( - 0,1* сутки-1,
- 0,1* сутки-1,  - 0,15 *сутки-1)
- 0,15 *сутки-1)
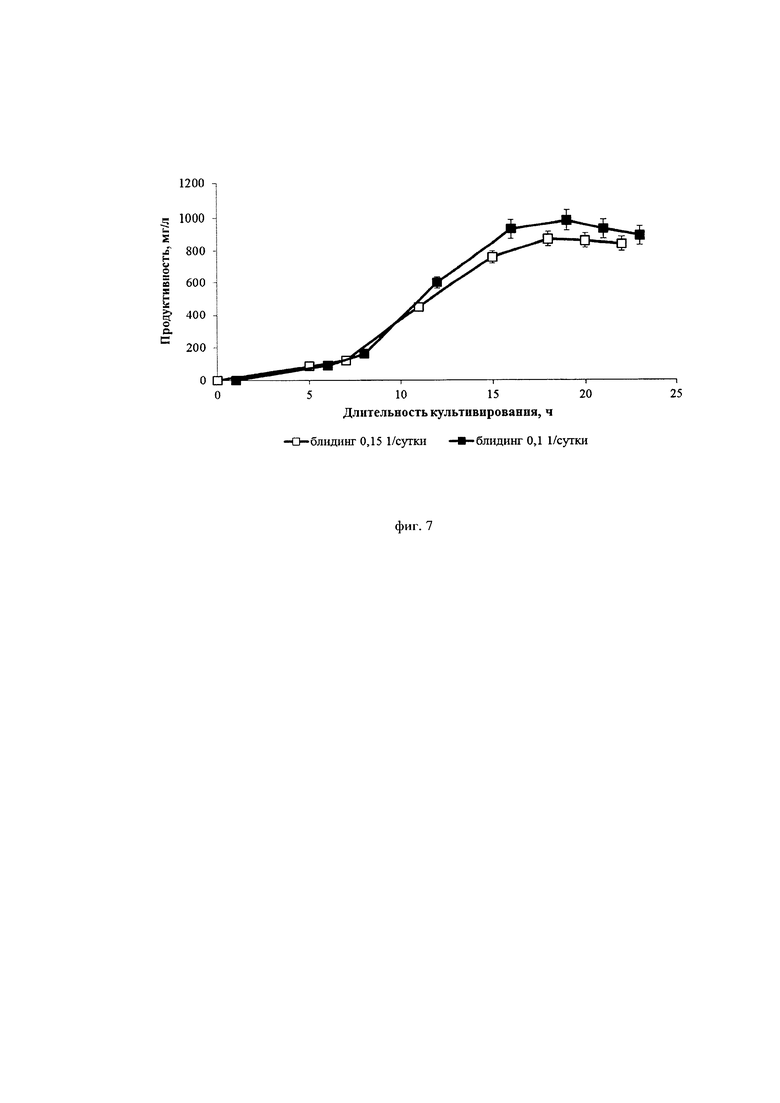
Фиг. 7. Влияние скорости блидинга на продуктивность процесса перфузионного культивирования ( - 0,1* сутки-1,
- 0,1* сутки-1,  - 0,15* сутки--1)
- 0,15* сутки--1)
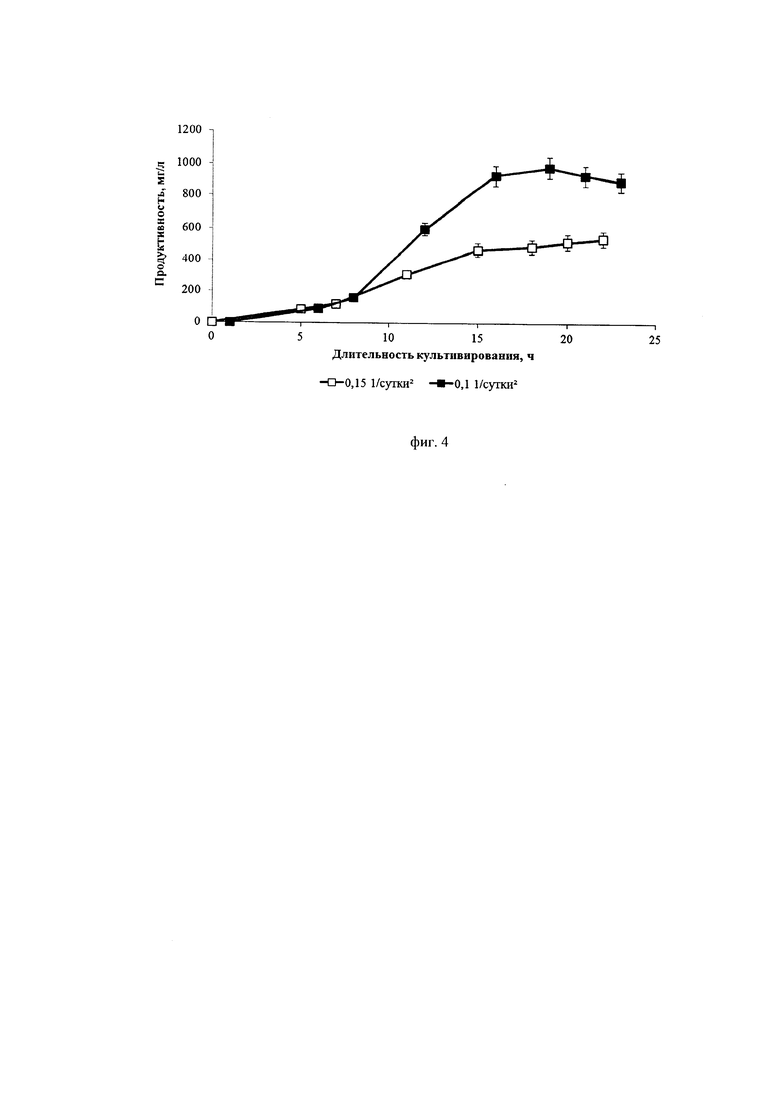
Фиг. 4. Динамика продуктивности культуры клеток СНО, экспрессирующей антитело, имеющее аминокислотную последовательность экулизумаба, при различных ускорениях перфузии ( - 0,1*сутки-2,
- 0,1*сутки-2,  - 0,15 *сутки-2)
- 0,15 *сутки-2)
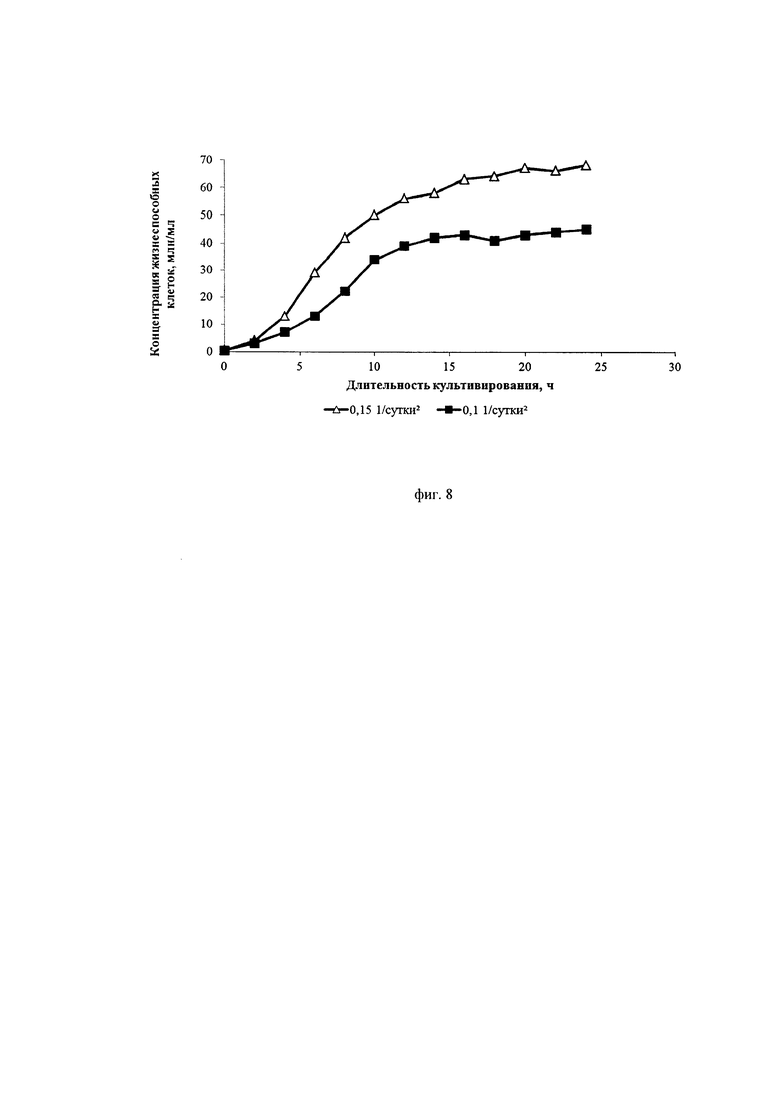
Фиг. 8. Кривые роста культуры клеток СНО, экспрессирующей антитело, имеющее аминокислотную последовательность омализумаба, при различных ускорениях перфузии
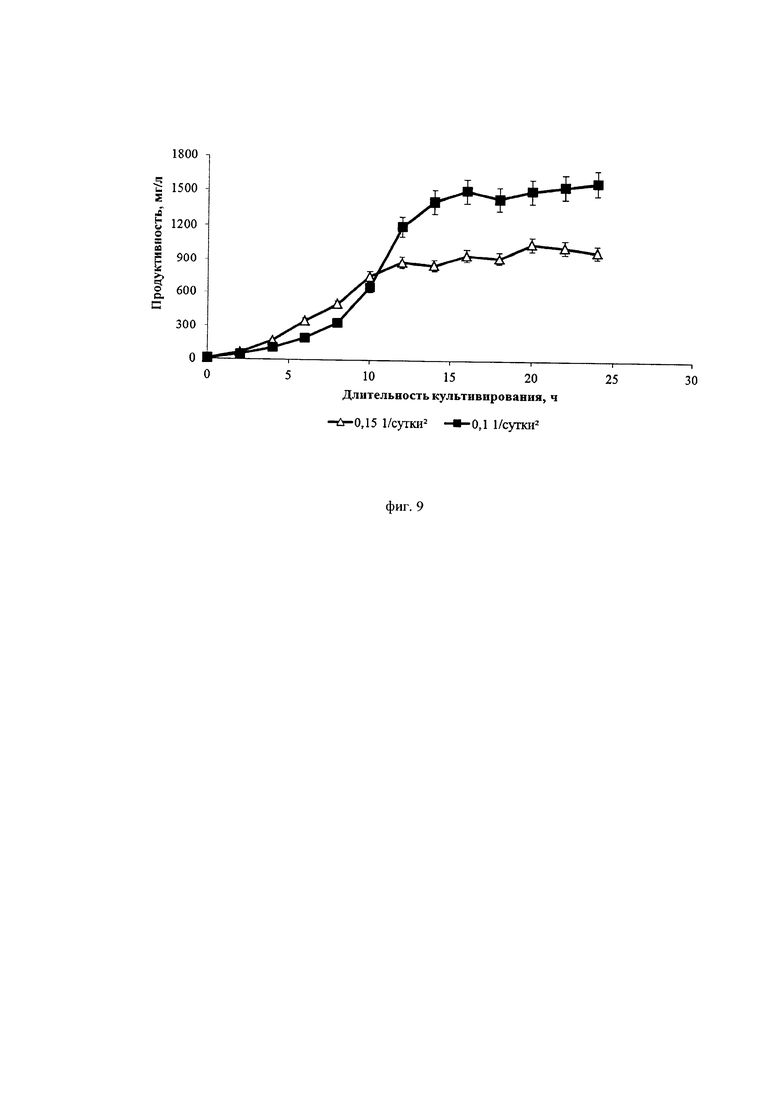
Фиг. 9. Динамика продуктивности культуры клеток СНО, экспрессирующей антитело, имеющее аминокислотную последовательность омализумаба, при различных ускорениях перфузии
Задачей авторов изобретения являлась разработка высокопродуктивного способа производства в культуре животных клеток некоторых видов терапевтических антител, направленных к С5-компоненту комплемента, а также анти-lgE антител. В частности, таким способом могут быть получены экулизумаб, омализумаб и их биоаналоги, содержащие аминокислотные последовательности, соответственно,

Из уровня техники известны следующие решения, раскрывающие перфузионное культивирование клеток для продукции в них терапевтических антител.
Документ CN 104845880 А раскрывает устройство и способ получения анти-IgE антител с помощью непрерывного перфузионного культивирования клеток СНО. Для стабилизации физиологического состояния культуры, и, как следствие, стабилизации всего процесса культивирования, используется контролируемый отбор суспензии клеток из биореактора. Недостатком способа является относительно низкая продуктивность процесса, обусловленная высокой удельной скоростью роста клеток (μ=0,34 сут-1), при которой их специфическая продуктивность далека от максимальной. Таким образом, при высоком расходе питательной среды, продуктивность процесса относительно низкая.
Публикация «Оптимизация ускорения перфузии - ключевой этап разработки высокопроизводительного перфузионного культивирования клеток СНО. (Морозов А.Н. и др. Биотехнология, 2016: 60-67)» раскрывает способ оптимизации непрерывного культивирования клеток СНО, экспрессирующих моноклональные антитела нейтрализующего действия, к которым относятся, в частности, омализумаб, экулизумаб и адалимумаб. В эксперименте показано, что медленное ускорение перфузии (0,1*сутки-2) приводит к существенному подавлению пролиферации клеток, увеличению их объема (гипертрофии клеток), увеличению специфической продуктивности и, одновременно, изменение профиля гликозилирования антитела таким образом, что может увеличиваться его антителозависимая клеточная цитотоксичность (ADCC), а фармакокинетические свойства целевой молекулы могут изменяться в сторону снижения времени полувыведения. Эти изменения являются нежелательными и могут сделать процесс культивирования непригодным для промышленного использования.
Документ US 20140255993 A1 раскрывает режимы перфузионного культивирования клеток СНО, при которых в определенный момент (перед или во время продукционной фазы) происходит арест клеточного цикла и подавление пролиферации клеток, влекущие за собой повышение специфической продуктивности клеток и увеличение тотального выхода целевого белка. Арест клеточного цикла достигается за счет ограничения содержания в питательной среде аминокислоты аспарагин (не более 5 ммоль/л).
К недостаткам способа можно отнести необходимость индивидуального подбора оптимальной концентрации аспарагина для каждой клеточной линии-продуцента; потенциальную нечувствительность некоторых клеточных линий к данному техническому решению снижение жизнеспособности культуры клеток, полученной таким способом, в ходе процесса культивирования, что может негативным образом сказываться на технологии и качестве продукта. Возможны проблемы с осветляющей фильтрацией вследствие большого количества клеточного дебриса; высокий уровень примесей белков клетки-хозяина и необходимость введения дополнительных этапов хроматографической очистки; усиленный протеолиз целевого белка.
Различные варианты перфузионного культивирования раскрыты также в документах WO 2004097006 A1, WO 2005095578 A1, WO 2009023562 A2, US 2016/0281044 А1, WO 2014059035 A1.
Наиболее близкими аналогами заявленного изобретения можно считать решение CN 104845880 A, раскрывающее получение анти-IgE антител в перфузионном режиме культивирования, способ получения моноклональных антител с помощью непрерывного культивирования в клетках СНО (линия иммортализованных клеток яичника китайского хомячка) с повышенной специфической продуктивностью при существенном подавлении их пролиферации (Морозов А.Н, и др., Биотехнология, 2016: 60-67.), а также способ, раскрытый в US 20140255993 A1, где в ходе перфузии клетки СНО, экспрессирующие рекомбинантные белки, перестают пролиферировать вследствие низкой концентрации аспарагина в питательной среде, что влечет за собой увеличение удельной продуктивности клеток и общего выхода продукта.
Недостатки способа, раскрытого в документе CN 104845880 A, связаны с более низкой концентрацией целевого белка в культуральной жидкости при культивировании клеток СНО в режиме перфузии по сравнению с периодическими (фед-батч) процессами. Как следствие, больше ресурсов требуется для приготовления, использования, хранения и утилизации питательных сред, особенно, при осуществлении длительного перфузионного процесса. Расходы на среды и подпитки существенно выше, чем для фед-батч процессов. Для решения этой проблемы необходимо увеличивать концентрацию целевого белка в культуральной жидкости. Одним из способов это сделать является увеличение специфической продуктивности клеток СНО, которое достигается, в частности, подавлением клеточной пролиферации и поддержанием культуры в таком состоянии в течение длительного времени при сохранении высокой жизнеспособности.
В предложенном решении подавление пролиферации и увеличение специфической продуктивности клеток достигается за счет использования малых значений ускорения перфузии на этапе накопления биомассы. Стабильность состояния клеток обеспечивается непрерывным отводом из биореактора суспензии клеток со скоростью от 0,1*сутки-1 до 0,15*сутки-1. В данном случае не требуется использования специальных дефицитных сред, не требуется мониторинг отдельных компонентов, таких как аминокислоты. Низкие скорости протока питательной среды с самого начала процесса культивирования обеспечивают низкую удельную скорость роста и существенное подавление пролиферации клеток в продукционной фазе процесса (удельная скорость роста не превышает 0,15/сутки). При этом достигается новый технический результат - повышение жизнеспособности клеток до 95% и выше на всем протяжении процесса культивирования, в противоположность примерам из патента Amgen (US 20140255993 A1).
В публикации Морозова и др. раскрыт сходный метод культивирования, однако применение данного метода приводит к существенному отклонению биологической активности экспрессируемого целевого белка от заданных за счет изменения его гликозилирования. Данный недостаток устранен в предложенном техническом решении за счет внесения ряда изменений в процесс культивирования. В частности, изменена скорость отбора клеточной суспензии из биореактора, что привело к стабилизации профиля гликозилирования целевого белка. Отбор клеточной суспензии из биореактора - т.н. блидинг - позволяет предотвратить недостаток питательных веществ и увеличить стабильность ростовых и продукционных характеристик культуры клеток.
Авторы изобретения нашли оптимальные режимы ускорения перфузии, позволяющие достигнуть максимальной продуктивности клеток. Ускорение перфузии регулируется за счет изменения скорости подачи свежей питательной среды в биореактор и скорости отбора отработанной среды из биореактора от минимального до максимального в ходе начального этапа перфузионного культивирования. Ускорение перфузии играет важную роль в установлении эффективного, высокопродуктивного процесса перфузионного культивирования. Было установлено, что ускорение перфузии более 0,1*сут-2 приводит к интенсивному росту культуры, малому времени удвоения и быстрому достижению пиковых концентраций клеток. Специфическая продуктивность таких клеток находилась на среднем уровне (около 10 пкг/кл/сут). Жизнеспособность при ускорении выше 0,25*сут-2 после достижения пиковой концентрации снижалась до 80-85%.
Ускорение перфузии менее 0,12*сут-2 не вызывало падения жизнеспособности клеток, которая оставалась высокой в течение всего процесса (выше 95%). Кроме того, при данных режимах существенно снижалась скорость пролиферации и увеличивалась специфическая продуктивность клеток (до 20 пкг/кл/сут).
Варьирование ускорения перфузии для достижения эффективного, высокопродуктивного процесса культивирования ранее не было раскрыто в уровне техники.
Материалы и методы
В качестве модели для изучения использовались варианты клеточной линии СНО, экспрессирующие моноклональные антитела, являющиеся биоаналогами терапевтических антител - омализумаба, экулизумаба и адалимумаба.
Клетки выращивали в шейкере-инкубаторе Climo-Shaker ISF1-XC (Kuhner, Швейцария) в колбах Эрленмейера на коммерческой питательной среде BalanCD СНО Growth A (Irvine Scientific, США), содержащей 6 мМ L-глутамина (Applichem, Германия) при 37°С, 5% СО2, 90 об/мин. Полученный инокулят вносили в биореактор, содержащий питательную среду того же состава. Состав питательной среды для перфузии: 90% BalanCD СНО Growth А, 10% BalanCD СНО Feed 3 (Irvine Scientific), 6 мМ L-глутамина.
Перфузионное культивирование клеток осуществляли в одноразовых биореакторах волнового типа Sartorius Flexsafe 10L perfusion (Sartorius, Германия) со встроенной перфузионной мембраной. Рабочий объем суспензии составлял 3,0 л. Посевная концентрация клеток - 0,5±0,1 млн/мл.
Концентрацию растворенного кислорода в биореакторах поддерживали на уровне 50% от насыщения. Расход газовой смеси составлял 0,3 л/мин. Также осуществляли рН-статирование на уровне 6,9 в течение всего процесса культивирования с помощью подачи СО2 или 5%-го раствора гидроксида натрия. Частота качания платформы с биореактором находилась в диапазоне 22-28 кач/мин. Угол наклона платформы составлял 6°. Температура культивирования в фазе роста - 37°С. При достижении скорости перфузии 0,5*сутки-1 осуществляли снижение температуры до 34°С. Максимальная скорость перфузии составляла 1,0*сутки-1. Перфузия начиналась с третьих суток культивирования.
Исследовали два разных режима ускорения перфузии: 0,1*сут-2 и 0,15*сут-2. Скорость блидинга составляла 0,1*сутки-1 и 0,15*сутки-1.
Определение концентрации антител в культуральной жидкости проводили путем выделения целевого белка на аффинном сорбенте MabSelect (GE Healthcare, Швеция) и измерения его количества на спектрофотометре BioPhotometer Plus (Eppendorf, Германия) при длине волны 280 нм с использованием расчетного коэффициента экстинкции. Анализ профиля гликозилирования целевого белка проводили с использованием системы ВЭЖХ Alliance е2695 (Waters, США) с детектором Multi λ Fluorecsence Detector 2475 (Waters) на колонке TSKgel Amide-80 (Tosoh Corporation, Япония).
Авторы изобретения обнаружили, что культуры клеток, экспрессирующие аффинные к С5 компоненту комплемента моноклональные антитела или анти-IgE антитела при ускорении перфузии, равном 0,1*сут-2, отводом из биореактора суспензии клеток со скоростью от 0,1*сутки-1 до 0,15*сутки-1, достигли в 1,5 - 2 раза более высокой специфической продуктивности, чем в контроле при 0,15*сут-2, вкупе с высокой жизнеспособностью (более 95%), а также показали способность к длительному нахождению в продукционной фазе перфузионного культивирования. Высокая специфическая продуктивность достигается за счет подавления пролиферативной активности клеток. За счет изменения блидинга значительно снижено варьирование критических гликанов и экспрессируемый клетками целевой белок обладает стабильным профилем гликозирования в течение всего процесса культивирования. Данный технический результат позволяет обеспечить высокую специфичность и биологическую активность получаемых антител, необходимую для включения их в состав терапевтических препаратов.
Приведенные примеры демонстрируют возможности применения способа для продукции различных видов антител в различных режимах. Пользуясь раскрытыми в описании данными и закономерностями, найденными авторами, квалифицированный специалист легко
может применять данный способ для наработки различных видов терапевтических антител в культуре эукариотических клеток.
Пример 1
В качестве примера 1 приведены два режима ускорения перфузии - 0,1*сут-2 и 0,15*сут-2 для продуцента антитела, содержащего аминокислотную последовательность SEQ ID #1 (последовательность экулизумаба), и аффинного к С5-компоненту комплемента.
Клетки СНО, экспрессирующие данное моноклональное антитело, выращивали в шейкере-инкубаторе Climo-Shaker ISF1-XC (Kuhner, Швейцария) в колбах Эрленмейера на коммерческой питательной среде BalanCD СНО Growth A (Irvine Scientific, США), содержащей 6 мМ L-глутамина (Applichem, Германия) при 37°С, 5% СО2, 90 об/мин. Полученный инокулят вносили в биореактор, содержащий питательную среду того же состава. Состав питательной среды для перфузии: 90% BalanCD СНО Growth А, 10% BalanCD СНО Feed 3 (Irvine Scientific), 6 мМ L-глутамина.
Перфузионное культивирование клеток осуществляли в одноразовых биореакторах волнового типа Sartorius Flexsafe RM 10L perfusion pro 1,2 my (Sartorius, Германия) со встроенной перфузионной мембраной. Рабочий объем суспензии составлял 3,0 л. Посевная концентрация клеток - 0,5±0,1 млн/мл.
Концентрацию растворенного кислорода в биореакторах поддерживали на уровне 50% от насыщения. Расход газовой смеси составлял 0,3 л/мин. Также осуществляли рН-статирование на уровне 6,9 в течение всего процесса культивирования с помощью подачи СО2 или 5%-го раствора гидроксида натрия. Частота качания платформы с биореактором находилась в диапазоне 22-28 кач/мин. Угол наклона платформы составлял 6°. Температура культивирования в фазе роста - 37°С. При достижении скорости перфузии 0,5*сутки-1 осуществляли снижение температуры до 34°С. Максимальная скорость перфузии составляла 1,0*сутки-1. Перфузия начиналась с третьих суток культивирования.
Использовано два режима ускорения перфузии: 0,1*сут-2 и 0,15*сут-2. Скорость блидинга составляла 0,1*сутки-1 и 0,15*сутки-1.
Из фиг. 2 и фиг. 4 видно, что меньшее значение ускорения замедляет пролиферацию клеток и увеличивает их продуктивность. Из фиг. 3 видно, что замедление пролиферации сопровождается сохранением высокой жизнеспособности клеток.
Пример 2
В рамках следующего эксперимента были проведены два культивирования. Условия эксперимента те же, что в примере 1, за исключением ускорения перфузии и скорости блидинга. В обоих вариантах ускорение перфузии имело одинаковое значение - 0,1*сут-2; скорость блидинга составляла в первом варианте 0,1*сутки-1, во втором - 0,15*сутки-1.
На фиг. 5 и фиг. 6 приведены данные по динамике изменения доли пиков Маn5 и G0 в профиле гликозилирования целевого белка в зависимости от применяемой скорости блидинга. Можно заметить, что при скорости блидинга 0,15*сут-1 доля пиков Man5 и G0 меняется в ходе процесса культивирования не более чем в 2 раза. В то же время при скорости блидинга 0,1*сут-1 наблюдается негативная динамика в профиле гликозилирования антитела: доля гликана G0 выросла по ходу культивирования более чем в 6 раз, Man5 - более чем в 5 раз.
На фиг. 7 приведены данные по продуктивности двух процессов культивирования, из которых видно, что при увеличении скорости блидинга с 0,1*сут-1 до 0,15*сут-1 не происходит существенного падения выхода целевого белка.
Пример 3
В рамках следующего эксперимента были проведены два культивирования. Условия эксперимента те же, что в примере 1, за исключением используемой линии клеток. В данном примере использовалась линия клеток СНО, экспрессирующая моноклональное антитело к IgE, содержащее аминокислотную последовательность SEQ ID№2 (последовательность омализумаба).
На фиг. 8 можно видеть, что при ускорении перфузии 0,1*сут-2 на 10-12-ые сутки происходит значительное подавление пролиферации клеток, и удельная скорость их роста падает до значений, сопоставимых со скоростью блидинга (около 0,1*сут-1-0,15*сут-1). При ускорении перфузии 0,15*сут-2 пролиферация клеток более интенсивная, а максимальная их концентрация достигает значения 67 млн./мл, что в 1,5 раза превосходит максимальную концентрацию в процессе с ускорением перфузии 0,1*сут-2 (43 млн./мл). Специфическая продуктивность клеток в процессе с ускорением перфузии 0,1*сут-2 в продукционной фазе в 2,2 раза превышает специфическую продуктивность, наблюдаемую в процессе с ускорением перфузии 0,15*сут-2 (фиг. 9).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРАЛЬНОЙ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА БЕШЕНСТВА | 2023 |
|
RU2816765C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРОТИВ CD3*CD19 ФОРМАТА ФЛЕКСИБОДИ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ | 2014 |
|
RU2577226C2 |
| СПОСОБЫ СОЗДАНИЯ БАНКОВ КЛЕТОК СО СВЕРХВЫСОКОЙ ПЛОТНОСТЬЮ | 2015 |
|
RU2826038C2 |
| СПОСОБЫ СОЗДАНИЯ БАНКОВ КЛЕТОК СО СВЕРХВЫСОКОЙ ПЛОТНОСТЬЮ | 2015 |
|
RU2723129C2 |
| СПОСОБ ПЕРФУЗИОННОЙ ФИЛЬТРАЦИИ ДЛЯ НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ КУЛЬТУР КЛЕТОК | 2022 |
|
RU2794425C1 |
| СИСТЕМА ПЕРФУЗИОННОЙ ФИЛЬТРАЦИИ ДЛЯ НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ КУЛЬТУР КЛЕТОК | 2022 |
|
RU2800874C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦЕЛЕВОГО АНТИТЕЛА С МОДУЛИРОВАННЫМ ГАЛАКТОЗИЛИРОВАНИЕМ (ВАРИАНТЫ) И СПОСОБ МОДУЛИРОВАНИЯ ГАЛАКТОЗИЛИРОВАНИЯ ЦЕЛЕВОГО АНТИТЕЛА (ВАРИАНТЫ) ПУТЕМ ОПТИМИЗАЦИИ КУЛЬТУРАЛЬНОЙ СРЕДЫ | 2015 |
|
RU2642285C1 |
| НЕ СОДЕРЖАЩАЯ ЖИВОТНЫХ БЕЛКОВ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2005 |
|
RU2383616C2 |
| МАЛОМАСШТАБНЫЙ СПОСОБ КУЛЬТИВИРОВАНИЯ СУСПЕНДИРОВАННЫХ КЛЕТОК | 2016 |
|
RU2730656C2 |
| СПОСОБЫ ФОРМИРОВАНИЯ БАНКА КЛЕТОК ВЫСОКОЙ ПЛОТНОСТИ (ВАРИАНТЫ) | 2014 |
|
RU2668796C2 |

Изобретение относится к области биотехнологии, в частности к способу непрерывного культивирования линии клеток яичника китайского хомячка CHO, являющейся продуцентом антител, и применению указанного способа. Способ включает непрерывное культивирование линии клеток яичника китайского хомячка CHO в биореакторе, ускорение перфузии, находящееся в диапазоне от 0,1*сутки-2 до 0,12*сутки-2, и отвод суспензии клеток из биореактора, осуществляемый со скоростью 0,15*сутки-1. Далее указанный способ применяется для продукции терапевтических антител в линии клеток яичника китайского хомячка CHO. Изобретение позволяет достичь высокую специфичную продуктивность и высокую жизнеспособность (более 95%) клеток, а также выравнить степень гликозилирования белка на протяжении всего культивирования. 2 н. и 15 з.п. ф-лы, 9 ил., 3 пр.
1. Способ непрерывного культивирования линии клеток яичника китайского хомячка СНО, являющейся продуцентом антител, отличающийся тем, что ускорение перфузии находится в диапазоне от 0,1*сутки-2 до 0,12*сутки-2, и отвод суспензии клеток из биореактора осуществляют со скоростью 0,15*сутки-1.
2. Способ по п. 1, где ускорение перфузии происходит со скоростью 0,1*сутки-2.
3. Способ по п. 1, где посевная концентрация клеток составляет 0,5±0,1 млн/мл.
4. Способ по любому из пп. 1-3, где линия клеток продуцирует антитело, содержащее последовательность аминокислот, которая представляет собой последовательность SEQ ID №1.
5. Способ по любому из пп. 1-3, где линия клеток продуцирует антитело, содержащее последовательность аминокислот, которая представляет собой последовательность SEQ ID №2.
6. Способ по любому из пп. 1-3, где линия клеток продуцирует экулизумаб.
7. Способ по любому из пп. 1-3, где линия клеток продуцирует омализумаб.
8. Способ по любому из пп. 1-3, где линия клеток продуцирует антитело, специфичное к С5 компоненту комплемента.
9. Способ по любому из пп. 1-3, где линия клеток продуцирует антитело, специфичное к IgE.
10. Применение способа по п. 1 для продукции терапевтических антител в линии клеток яичника китайского хомячка СНО.
11. Применение по п. 10, где терапевтическим антителом явяется экулизумаб.
12. Применение по п. 10, где терапевтическим антителом является омализумаб.
13. Применение по п. 10, где терапевтическое антитело специфично к С5 компоненту комплемента.
14. Применение по п. 10, где терапевтическое антитело специфично к IgE.
15. Применение по п. 10, где терапевтическое антитело содержит последовательность аминокислот, которая представляет собой последовательность SEQ ID №1.
16. Применение по п. 10, где терапевтическое антитело содержит последовательность аминокислот, которая представляет собой последовательность SEQ ID №2.
17. Применение по п. 10, где достигается специфическая продуктивность клеток до 20 пкг/кл/сут.
| МОРОЗОВ А.Н | |||
| и др | |||
| "Оптимизация ускорения перфузии - ключевой этап разработки высокопроизводительного перфузионного культивирования клеток CHO", Биотехнология | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Запор для крышки койлера кардочесальной машины | 1927 |
|
SU8670A1 |
| ВЫРАЩЕННЫЕ В ПРИКРЕПЛЕННОЙ К СУБСТРАТУ КУЛЬТУРЕ КЛЕТКИ ИЗ ТКАНИ ПЛАЦЕНТЫ И ИХ ИСПОЛЬЗОВАНИЕ ПРИ ЛЕЧЕНИИ | 2009 |
|
RU2539786C2 |
| RU 2015143439 A, 26.04.2017 | |||
| ВЕЧКАНОВ Е.М | |||
| и др | |||
| Основы клеточной инженерии: Учебное пособие | |||
| - Ростов-на-Дону, 2012 | |||
| Регулятор для ветряного двигателя в ветроэлектрических установках | 1921 |
|
SU136A1 |
Авторы
Даты
2018-11-13—Публикация
2017-09-19—Подача